Область техники, к которой относится изобретение
[0001]
Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет на основании японской патентной заявки № 2019-115496, поданной 21 июня 2019 года, полное содержание которой включено в настоящую заявку посредством ссылки.
Настоящее изобретение относится к способу лечения злокачественной опухоли с использованием имидазооксазинового соединения, обладающего AKT-ингибирующей активностью и противоопухолевой активностью.
Предпосылки создания изобретения
[0002]
AKT представляет собой серин/треонинкиназу, действующую в нисходящем направлении от фосфатидилинозит 3-киназы (PI3 киназа), которая активируется сигналом рецепторной тирозинкиназы. Что касается ее функции, сообщалось о том, что AKT играет важную роль в онкогенезе, таком как клеточная пролиферация, резистентность к апоптозу, ангиогенез, метастазы и инвазия, а также в метаболизме глюкозы и метаболизме липидов (Непатентная литература (NPL) 1). Часто наблюдается активация и высокая экспрессия AKT при многих раковых заболеваниях (почечно-клеточный рак, рак желудка, рак молочной железы, рак легкого, колоректальный рак, рак поджелудочной железы, рак яичников, гепатоцеллюлярная карцинома, множественная миелома, лимфома, лейкоз, рак головы и шеи, меланома и т.п.), и сообщалось о генетической амплификации или активирующей мутации при некоторых раковых заболеваниях (NPL 2).
[0003]
Транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол (далее также указан как “Соединение 1”) или его соль, который представляет собой имидазооксазиновое соединение, известен как высокоактивный и высокоселективный пероральный аллостерический ингибитор AKT (Патентная литература (PTL) 1).
[0004]
Хотя бело разработано большое количество ингибиторов AKT для применения в качестве лекарственных средств, на данный момент никакие соединения не были одобрены в качестве лекарственных средств. Причиной этого являются побочные эффекты 3 или более высокой степени, например, в клинических испытаниях наблюдали сыпь, зуд, гипергликемию и стоматит, а в качестве других основных побочных эффектов возникали диарея, тошнота, рвота, слабость, потеря аппетита и сухость кожи. Также существует потенциальный риск желудочно-кишечных расстройств, расстройств метаболизма и кожных расстройств (NPL 3 и NPL 4).
[0005]
Что касается исследования схем введения для снижения побочных эффектов ингибиторов AKT, было сообщение о способе введения для AZD5363, включающем предусматриваемый период отмены препарата. В этом сообщении рекомендуемые дозы (RD) были определены для следующих схем: схема, в которой один курс состоит из 7 дней и в которой AZD5363 вводят два раза в день в течение 7 последовательных дней, т.е. в общей сложности 14 раз; схема, в которой один курс состоит из 7 дней и в которой AZD5363 вводят два раза в день в течение 2 последовательных дней, т.е. в общей сложности 4 раза, с последующим предусмотренным периодом отмены препарата в течение 5 дней; и схема, в которой один курс состоит из 7 дней и в которой AZD5363 вводят два раза в день в течение 4 последовательных дней, т.е. в общей сложности 8 раз, с последующим предусмотренным периодом отмены препарата в течение 3 дней (NPL 5).
[0006]
Период полужизни AZD5363, который действует как конкурентный ингибитор, у человека составляет около 6 часов. Период полужизни аллостерического Соединения 1, которое осуществляет ингибирование другим образом, у мышей составляет около 2,3 часа; однако, его фармакокинетика у человека остается неясной (NPL 6). При исследовании оптимальных схем введения Соединения 1 у человека доклинические свойства не всегда применимы для человека; и даже если целевые ферменты являются такими же, фармакокинетические свойства могут существенно отличаться. Таким образом, фармакокинетические свойства даже ингибиторов AKT, таких как AZD5363, не всегда можно использовать без модификации в качестве эталона.
[0007]
Поэтому крайне желателен способ лечения злокачественной опухоли с использованием ингибитора AKT, способного подавлять возникновение побочных эффектов, проявляя при этом отличные противоопухолевые эффекты.
[0008]
Известно, что Соединение 1 или его соль вводят в течение 7 последовательных дней в комбинации с Соединением 2 или его солью (PTL 3). Однако комбинированное введение Соединения 1 или его соли в течение 4 дней с последующим предусматриваемым периодом отмены препарата в течение 3 дней и введением Соединения 2 или его соли в течение 21 последовательных дней не раскрывается.
Перечень ссылочных документов
Патентная литература
[0009]
PTL 1: WO2012/137870
PTL 2: WO2013/108809
PTL 3: Публикация патентной заявки США № 20190350932
Непатентная литература
[0010]
NPL 1: Cell 2007, 129, p1261-1274
NPL 2: Ann Oncol 2010, 21, p683-691
NPL 3: J Clin Oncol. 2011, 29:4688-4695.
NPL 4: Cancer Res. 2013, 73 (Suppl 8): Abstract LB-197
NPL 5: Clin Cancer Res 2018, May 1, 24(9): 2050-2059, (doi: 10,1158/1078-0432.CCR-17-2260)
NPL 6: Poster presentation material for the conference “EORTC-NCI-AACR 2017,” “Characterization of TAS-117, a novel, highly potent and selective inhibitor of AKT”
Сущность изобретения
Техническая задача
[0011]
Целью настоящего изобретения является обеспечение способа для лечения злокачественной опухоли с использованием имидазооксазинового соединения, обладающего AKT-ингибирующей активностью, с уменьшением при этом побочных эффектов.
Решение задачи
[0012]
Авторы настоящего изобретения обнаружили, что введение Соединения 1 или его соли, которое проявляет высокоэффективную и высокоселективную AKT-ингибирующую активность, в соответствии с определенным способом введения обеспечивает возможность высокоэффективного лечения злокачественных опухолей с уменьшением при этом побочных эффектов.
[0013]
Более конкретно, в настоящей заявке представлены изобретения в соответствии с пунктами 1-58, представленными ниже.
1. Способ лечения злокачественной опухоли у пациента-человека, включающий
введение транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанола (Соединение 1) или его соли пациенту, нуждающемуся в лечении, в соответствии со схемой введения, где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0014]
2. Терапевтическое средство для лечения злокачественной опухоли у пациента-человека, включающее Соединение 1 или его соль,
где Соединение 1 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения,
где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0015]
3. Фармацевтическая композиция для лечения злокачественной опухоли у пациента-человека, включающая Соединение 1 или его соль,
где Соединение 1 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения,
где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0016]
4. Применение Соединения 1 или его соли для получения терапевтического средства для лечения злокачественной опухоли у пациента-человека,
где Соединение 1 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения,
где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0017]
5. Соединение 1 или его соль для применения в лечении злокачественной опухоли у пациента-человека,
где Соединение 1 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения,
где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0018]
6. Применение Соединения 1 или его соли для лечения злокачественной опухоли у пациента-человека,
где Соединение 1 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения,
где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0019]
7. Набор для лечения злокачественной опухоли у пациента-человека, включающий Соединение 1 или его соль,
где Соединение 1 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения,
где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0020]
8. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-7, где Соединение 1 или его соль вводят отдельно.
[0021]
9. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-8, где Соединение 1 или его соль вводят один раз в сутки в день введения.
[0022]
10. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-9, где схема введения включает три курса общей продолжительностью 21 день, где один курс составляет 7 дней, где в ходе каждого курса Соединение 1 или его соль вводят в течение 4 последовательных дней с дня 1 по день 4, с дня 8 по день 11 и с дня 15 по день 18, и период отмены препарата предусмотрен с дня 5 по день 7, с дня 12 по день 14 и с дня 19 по день 21.
[0023]
11. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-10, где доза Соединения 1 или его соли составляет от 4 мг/человек/день до 44 мг/человек/день.
[0024]
12. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-11, где доза Соединения 1 или его соли составляет от 16 мг/человек/день до 32 мг/человек/день.
[0025]
13. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-12, где доза Соединения 1 или его соли составляет 24 мг/человек/день.
[0026]
14. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-13, где злокачественная опухоль представляет собой рак легкого, рак молочной железы, рак почки, саркому, гематопоэтическую опухоль, опухоль центральной нервной системы, рак печени, рак яичников, рак желудка, рабдомиосаркому, рак эндометрия, рак мочевыводящих путей, рак предстательной железы, колоректальный рак, рак поджелудочной железы, рак вульвы, рак щитовидной железы, рак кожи или рак желчных протоков.
[0027]
15. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-14, где злокачественная опухоль представляет собой рак легкого, рак эндометрия, рак мочевыводящих путей, рак молочной железы, рак предстательной железы, колоректальный рак, рак желчных протоков, рак яичников, или множественную миелому.
[0028]
16. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-15, где злокачественная опухоль представляет собой рак легкого, рак молочной железы, рак мочевого пузыря, рак толстой кишки, рак прямой кишки, рак желчного пузыря или рак анального канала.
[0029]
17. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с любым из пунктов 1-16, где побочный эффект, вызываемый Соединением 1 или его солью, уменьшается.
[0030]
18. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с пунктом 17, где уменьшенный побочный эффект представляет собой макулопапулезную сыпь.
[0031]
19. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, или набор в соответствии с пунктом 17, где уменьшенный побочный эффект представляет собой гипергликемию.
[0032]
20. Способ в соответствии с пунктом 1, дополнительно включающий
введение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она (Соединение 2) или его соли в соответствии со схемой введения,
где схема введения включает введение Соединения 2 или его соли в комбинации в течение 7 последовательных дней.
[0033]
21. Способ в соответствии с пунктом 20, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0034]
22. Терапевтическое средство в соответствии с пунктом 2, которое предназначено для комбинированного применения Соединения 1 или его соли с Соединением 2 или его солью,
где Соединение 2 или его соль вводят в соответствии со схемой введения,
где схема введения включает введение Соединения 2 или его соли в комбинации в течение 7 последовательных дней.
[0035]
23. Терапевтическое средство в соответствии с пунктом 22, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0036]
24. Терапевтическое средство в соответствии с пунктом 22 или 23, включающее Соединение 2 или его соль.
[0037]
25. Фармацевтическая композиция в соответствии с пунктом 3, которая предназначена для комбинированного применения Соединения 1 или его соли с Соединением 2 или его солью,
где Соединение 2 или его соль вводят в соответствии со схемой введения,
где схема введения включает введение Соединения 2 или его соли в комбинации в течение 7 последовательных дней.
[0038]
26. Фармацевтическая композиция в соответствии с пунктом 25, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0039]
27. Фармацевтическая композиция в соответствии с пунктом 25 или 26, включающая Соединение 2 или его соль.
[0040]
28. Применение в соответствии с пунктом 4, где терапевтическое средство предназначено для комбинированного применения Соединения 1 или его соли с Соединением 2 или его солью, и
Соединение 2 или его соль вводят в соответствии со схемой введения,
где схема введения включает введение Соединения 2 или его соли в комбинации в течение 7 последовательных дней.
[0041]
29. Применение в соответствии с пунктом 28, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0042]
30. Соединение или его соль в соответствии с пунктом 5, где Соединение 1 или его соль предназначены для применения в комбинации с Соединением 2 или его солью, и Соединение 2 или его соль вводят в соответствии со схемой введения,
где схема введения включает введение Соединения 2 или его соли в комбинации в течение 7 последовательных дней.
[0043]
31. Соединение или его соль в соответствии с пунктом 30, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0044]
32. Применение в соответствии с пунктом 6, где Соединение 1 или его соль предназначены для применения в комбинации с Соединением 2 или его солью, и Соединение 2 или его соль вводят в соответствии со схемой введения,
где схема введения включает введение Соединения 2 или его соли в комбинации в течение 7 последовательных дней.
[0045]
33. Применение в соответствии с пунктом 32, где схема введения включает введение Соединения 2 или его соли в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0046]
34. Набор в соответствии с пунктом 7, который предназначен для комбинированного применения Соединения 1 или его соли с Соединением 2 или его солью, где
Соединение 2 или его соль вводят в соответствии со схемой введения,
где схема введения включает введение Соединения 2 или его соли в комбинации в течение 7 последовательных дней.
[0047]
35. Набор в соответствии с пунктом 34, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0048]
36. Набор в соответствии с пунктом 34 или 35, включающий Соединение 2 или его соль.
[0049]
37. Комбинация Соединения 1 или его соли и Соединения 2 или его соли для применения в лечении злокачественной опухоли у пациента-человека,
где Соединение 1 или его соль и Соединение 2 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения,
где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней, и в течение которого Соединение 2 или его соль вводят в комбинации в течение 7 последовательных дней.
[0050]
38. Комбинация в соответствии с пунктом 37, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0051]
39. Применение Соединения 1 или его соли и Соединения 2 или его соли для получения терапевтического средства для лечения злокачественной опухоли у пациента-человека,
где Соединение 1 или его соль и Соединение 2 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения, где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней, и в течение которого Соединение 2 или его соль вводят в комбинации в течение 7 последовательных дней.
[0052]
40. Применение в соответствии с пунктом 39, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0053]
41. Применение Соединения 1 или его соли и Соединения 2 или его соли для лечения злокачественной опухоли у пациента-человека,
где Соединение 1 или его соль и Соединение 2 или его соль предназначены для применения для введения пациенту, нуждающемуся в лечении, в соответствии со схемой введения, где схема введения включает один курс продолжительностью 7 дней, в течение которого Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на Соединение 1, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней, и в течение которого Соединение 2 или его соль вводят в комбинации в течение 7 последовательных дней.
[0054]
42. Применение в соответствии с пунктом 41, где Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0055]
43. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-42, где Соединение 1 или его соль вводят один раз в сутки в день введения.
[0056]
44. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-43, где схема введения включает три курса общей продолжительностью 21 день, где один курс составляет 7 дней, где в ходе каждого курса Соединение 1 или его соль вводят в течение 4 последовательных дней с дня 1 по день 4, с дня 8 по день 11 и с дня 15 по день 18, и период отмены препарата предусмотрен с дня 5 по день 7, с дня 12 по день 14 и с дня 19 по день 21.
[0057]
45. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-44, где доза Соединения 1 или его соли составляет от 4 мг/человек/день до 44 мг/человек/день.
[0058]
46. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-45, где доза Соединения 1 или его соли составляет от 16 мг/человек/день до 32 мг/человек/день.
[0059]
47. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-46, где доза Соединения 1 или его соли составляет 24 мг/человек/день.
[0060]
48. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-47, где злокачественная опухоль представляет собой солидный рак.
[0061]
49. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-48, где злокачественная опухоль представляет собой рак легкого, рак молочной железы, рак почки, саркому, опухоль центральной нервной системы, рак печени, рак яичников, рак желудка, рабдомиосаркому, рак эндометрия, рак мочевыводящих путей, рак предстательной железы, колоректальный рак, рак поджелудочной железы, рак вульвы, рак щитовидной железы, рак кожи или рак желчных протоков.
[0062]
50. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-49, где злокачественная опухоль представляет собой рак легкого, рак эндометрия, рак мочевыводящих путей, рак молочной железы, рак предстательной железы, колоректальный рак, рак желчных протоков, или рак яичников.
[0063]
51. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-50, где злокачественная опухоль представляет собой рак легкого, рак молочной железы, рак мочевого пузыря, рак толстой кишки, рак прямой кишки, рак желчного пузыря или рак анального канала.
[0064]
52. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-51, где побочный эффект, вызываемый Соединением 1 или его солью, уменьшается.
[0065]
53. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с пунктом 52, где уменьшенный побочный эффект представляет собой макулопапулезную сыпь.
[0066]
54. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с пунктом 52, где уменьшенный побочный эффект представляет собой гипергликемию.
[0067]
55. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 20-54, где злокачественная опухоль представляет собой солидный рак, который подтвержден как положительный на генетические аберрации в факторе роста фибробластов (FGF), рецептор фактора роста фибробластов (FGFR), PTEN, PIK3CA или AKT, для которого стандартные варианты лечения недоступны.
[0068]
56. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с пунктом 55, где злокачественная опухоль представляет собой солидный рак, который подтвержден как положительный на генетические аберрации в FGFR.
[0069]
57. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с пунктом 55 или 56, где злокачественная опухоль представляет собой немелкоклеточный рак легкого, который подтвержден как положительный на амплификацию гена FGFR1.
[0070]
58. Способ, терапевтическое средство, фармацевтическая композиция, применение, соединение или его соль, комбинация или набор в соответствии с любым из пунктов 55-57, где злокачественная опухоль представляет собой плоскоклеточный рак легкого, который подтвержден как положительный на амплификацию гена FGFR1.
Полезные эффекты изобретения
[0071]
Способ в соответствии с настоящим изобретением обеспечивает лечение злокачественной опухоли с достижением при этом отличных противоопухолевых эффектов и уменьшения побочных эффектов.
Краткое описание чертежей
[0072]
Фиг. 1 показывает результаты испытаний Примера 1.
Фиг. 2 показывает результаты испытаний Примера 2.
Фиг. 3 показывает фармакокинетику Соединения 1 в Примере 4.
Фиг. 4 показывает противоопухолевый эффект для каждого пациента в Примере 5 как процентное изменение от исходного уровня.
Описание вариантов осуществления
[0073]
Имидазооксазиновое соединение (химическое название: транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол (Соединение 1)), используемое в качестве активного ингредиента в настоящем изобретении, представлено следующей структурной формулой (I).
[0074]
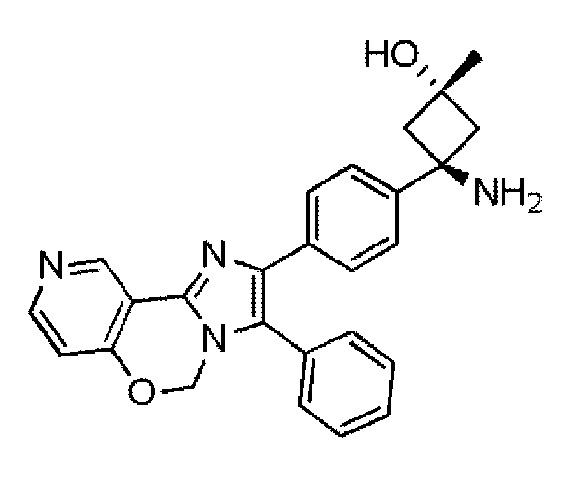 (I)
(I)
[0075]
Соединение 1 или его соль является известным соединением, и его можно синтезировать, например, в соответствии с способами, раскрытыми в PTL 1 (WO 2012/137870).
[0076]
В настоящем изобретении соли Соединения 1 представляют собой фармацевтически приемлемые соли.
[0077]
В настоящем изобретении Соединение 1 или его соль вводят пациенту, нуждающемуся в лечении злокачественной опухоли, в соответствии со схемой его введения.
[0078]
В настоящем изобретении термин “схема введения” относится к плану, который показывает тип лекарственного средства, количество, продолжительность, процедуру и т.д. при лечении лекарственным средством в хронологическом порядке, и показывает вводимое количество, способ введения, порядок введения, день введения и т.д. каждого лекарственного средства. Дату, когда предусматривается введение, и дату, когда не следует осуществлять введение, определяют до начала введения лекарственного средства. Также один цикл схемы введения определяется как “курс”, и введение продолжают путем повторения курса. Схема введения, в которой повторяется один курс, который включает введение лекарственного средства и предусматриваемый период отмены препарата, указана как два курса (схема введения, в которой один курс повторяют два раза), три курса (схема введения, в которой один курс повторяют 3 раза) и т.п.
[0079]
В настоящем изобретении термин “введение” означает введение лекарственного средства, а “отмена” означает, что введение лекарственного средства не осуществляют. Термин “день введения” означает день, в который осуществляют введение, а термин “день отмены препарата” означает день, в который введение не осуществляют.
[0080]
Термин “предусмотренная отмена” или “предусмотренный период отмены препарата” в контексте настоящего изобретения означает, что введение лекарственного средства не осуществляют, в соответствии с предварительно определенной схемой введения, или период, когда введение не осуществляют.
[0081]
В настоящем изобретении термин “непредусмотренная отмена” или “непредусмотренный период отмены препарата” означает, что введение лекарственного средства не осуществляют, или что невозможно осуществлять введение лекарственного средства из-за побочных эффектов и т.п. в результате последнего введения лекарственного средства, хотя это и является заранее предусмотренным днем или периодом для осуществления введения лекарственного средства.
[0082]
Что касается схемы введения в соответствии с настоящим изобретением, термин “последовательный” означает, что введение осуществляют каждый день без прерывания. Введение в течение “A последовательных дней” означает, что соединение вводят последовательно в течение A дней.
[0083]
В настоящем изобретении выражение, такое как “введение в течение N дней, с последующим предусмотренным периодом отмены препарата в течение X дней” означает, что введение лекарственного средства осуществляют с дня 1 по день (N), а затем следует предусмотренный период отмены препарата с дня (N+1) по день (N+X). Этот способ введения также может быть указан как “N-введение с X-отменой введения”. Например, когда один курс принимается равным 7 дням, “введение в течение 4 последовательных дней с последующим предусматриваемым периодом отмены в течение 3 дней” означает, что введение последовательно осуществляют с дня 1 по день 4, а период отмены введения предусмотрен с дня 5 по день 7; после этого введение возобновляют с дня 8 в последующем курсе. Этот режим введения указан как “4-введение плюс 3-отмена введения”. Например, когда осуществляют три курса “введения в течение 4 последовательных дней с последующим предусмотренным периодом отмены в течение 3 дней” общей продолжительностью 21 день, Соединение 1 или его соль вводят в течение 4 последовательных дней в ходе каждого курса с дня 1 по день 4, с дня 8 по день 11 и с дня 15 по день 18, и период отмены препарата предусмотрен с дня 5 по день 7, с дня 12 по день 14 и с дня 19 по день 21.
[0084]
Термин “нежелательное явление” в контексте настоящего изобретения относится к любому нежелательному или непредусмотренному заболеванию или признаку такого заболевания, развившемуся у пациента, которому вводили лекарственное средство. Случайная связь с препаратом не подвергается сомнению. Термин “побочный эффект” в контексте настоящего изобретения включает любые побочные реакции после введения лекарственного средства независимо от вводимого количества (включая отклонения в лабораторных данных). Более конкретно, этот термин относится к реакциям, для которых может быть обоснованно установлена причинно-следственная связь между лекарственным средством и нежелательными явлениями, и для которых нельзя отрицать причинно-следственную связь.
[0085]
Термин “контроль побочных эффектов” в контексте настоящего изобретения означает уменьшение развившихся побочных эффектов до степени 1 или ниже или до исходного уровня, или означает осуществление соответствующего лечения для предотвращения возникновения дальнейших обострений даже при продолжении введения лекарственного средства. Для гипергликемии этот термин означает облегчение до степени 1 или степени 0.
[0086]
В настоящем изобретении термин “рекомендуемая доза (RD)” относится к количеству для введения, которое можно вводить, не вызывая неприемлемых побочных эффектов, и которое считается наиболее предпочтительным с точки зрения исследований безопасности, эффективности, фармакокинетики и фармакодинамики. Рекомендуемая доза определяется на основании клинических испытаний на людях. Конкретные примеры рекомендуемой дозы включают вводимые количества, которые одобрены, рекомендованы или предложены государственными учреждениями или организациями, такими как Japan Pharmaceuticals and Medical Devices Agency (PMDA), U.S. Food and Drug Administration (FDA) и European Medicines Agency (EMA), и они описаны во вкладышах в упаковки, формах типа “интервью”, протоколах лечения и т.д. Вводимые количества предпочтительно утверждаются государственным учреждением PMDA, FDA или EMA.
[0087]
При анализе настоящего изобретения недавно было обнаружено, что Соединение 1 или его соль остается в организме в течение чрезвычайно длительного периода времени при введении людям, как показано в Примерах, описанных ниже, которые подтверждают, что период полужизни в кровотоке составляет около 49 часов, хотя при введении мышам он составлял около 2,3 часов. Эти результаты показывают, что у людей и мышей лекарственные средства имеют определенные характерные различия, а также разные фармакокинетические характеристики, в зависимости от каждого соединения. Кроме того, в настоящем изобретении было обнаружено, что Соединение 1 или его соль при последовательном введении в течение 4-7 дней недостаточно метаболизируется, выводится и т.п. из кровотока и обладает свойствами аккумуляции. Поскольку трудно предсказать, какая фармакокинетика будет получена, какие побочные эффекты возникнут и как они будут возникать при последовательном введении таких лекарственных средств с длительным периодом полужизни и свойствами аккумуляции, введение в течение нескольких дней следует осуществлять с осторожностью.
[0088]
В настоящем изобретении, тем не менее, авторы настоящего изобретения осуществляли введение в течение 7 дней подряд или введение в течение 4 дней с последующей предусмотренной отменой в течение 3 дней, используя способ введения, основанный на ежедневном введении. Результаты показали, что введение на основе схемы 4-введение плюс 3-отмена с использованием определенного вводимого количества может уменьшить побочные эффекты, демонстрируя при этом отличный противоопухолевый эффект. В настоящем изобретении уменьшение побочных эффектов означает уменьшение побочных эффектов по сравнению с побочными эффектами, вызываемыми введением в течение 7 последовательных дней, если не указано иное.
[0089]
Более конкретно, в настоящем изобретении Соединение 1 или его соль можно повторно вводить с использованием двух-четырех курсов. При использовании двух курсов введение осуществляют в соответствии со схемой введения, которая включает два курса общей продолжительностью 14 дней, где один курс составляет 7 дней, при этом в ходе каждого курса Соединение 1 или его соль вводят в течение 4 последовательных дней с дня 1 по день 4 и с дня 8 по день 11, а период отмены препарата предусмотрен с дня 5 по день 7 и с дня 12 по день 14. При использовании трех курсов введение осуществляют в соответствии со схемой введения, которая включает три курса общей продолжительностью 21 день, где один курс составляет 7 дней, при этом в ходе каждого курса Соединение 1 или его соль вводят в течение 4 последовательных дней с дня 1 по день 4, с дня 8 по день 11 и с дня 15 по день 18, а период отмены препарата предусмотрен с дня 5 по день 7, с дня 12 по день 14 и с дня 19 по день 21. При использовании четырех курсов введение осуществляют в соответствии со схемой введения, которая включает четыре курса общей продолжительностью 28 дней, где один курс составляет 7 дней, при этом в ходе каждого курса Соединение 1 или его соль вводят в течение 4 последовательных дней с дня 1 по день 4, с дня 8 по день 11, с дня 15 по день 18 и с дня 22 по день 25, а период отмены препарата предусмотрен с дня 5 по день 7, с дня 12 по день 14, с дня 19 по день 21 и с дня 26 по день 28. Повторное введение с использованием трех курсов является более предпочтительным.
[0090]
В настоящем изобретении суточная доза для человека Соединения 1 или его соли в день введения составляет от 4 мг/человек/день до 160 мг/человек/день как количество первого введения Соединения 1. Доза предпочтительно составляет от 4 мг/человек/день до 44 мг/человек/день, более предпочтительно от 16 мг/человек/день до 32 мг/человек/день, еще более предпочтительно 16 мг/человек/день или 24 мг/человек/день, и наиболее предпочтительно 24 мг/человек/день. Суточную дозу можно вводить дробными дозами; однако, предпочтительно введение указанной выше дозы один раз в день. (Например, когда введение осуществляют в течение 4 последовательных дней в 7-дневном курсе, указанную выше дозу предпочтительно вводят 4 раза в течение последовательных дней в 7-дневном курсе).
[0091]
В настоящем изобретении Соединение 1 или его соль вводят предпочтительно в соответствии со схемой введения, которая включает один курс продолжительностью 7 дней, в котором дозу от 4 мг до 160 мг вводят в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней, более предпочтительно в соответствии со схемой введения, которая включает один курс продолжительностью 7 дней, в котором дозу от 4 мг до 44 мг вводят в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней, еще более предпочтительно в соответствии со схемой введения, которая включает один курс продолжительностью 7 дней, в котором дозу от 16 мг до 32 мг вводят в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней, и еще более предпочтительно в соответствии со схемой введения, которая включает один курс продолжительностью 7 дней, в котором дозу 16 мг или 24 мг вводят в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней. Особенно предпочтительно, когда введение осуществляют в соответствии со схемой введения, которая включает один курс продолжительностью 7 дней, в котором Соединение 1 или его соль вводят при дозе, в расчете на человека в день, 24 мг/человек/день в каждый день введения в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней. Наиболее предпочтительно, введение осуществляют в течение трех курсов общей продолжительностью 21 день, повторяя три раза один курс, который включает введение Соединения 1 или его соли при дозе, в расчете на человека в день, 24 мг/человек/день в каждый день введения в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата в течение 3 дней.
[0092]
Когда введение осуществляют по схеме 4-введение плюс 3-отмена введения, Соединение 1 или его соль можно вводить отдельно без использования других противоопухолевых средств в комбинации. В настоящем описании введение Соединения 1 или его соли без совместного использования других активных ингредиентов, таких как другие противоопухолевые средства, указано как “отдельное введение”. При условии, что другие активные ингредиенты не используются в комбинации, термин “отдельное введение” также охватывает, например, варианты осуществления введения препарата, включающего комбинацию Соединения 1 или его соли с эксципиентом или другими компонентами. В другом варианте осуществления настоящего изобретения Соединение 1 или его соль также можно вводить по схеме 4-введение плюс 3-отмена введения в комбинации с другими лекарственными средствами. Примеры таких лекарственных средств, которые можно использовать в комбинации, включают (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он. В настоящем изобретении это соединение просто указано как “Соединение 2”. Соединение 2 представляет собой дизамещенное бензолалкинильное соединение, имеющее следующую структуру. Соединение 2 описано как Соединение Примера 2 в PTL 2 (WO 2013/108809). Было описано, что Соединение 2 или его соль обладает отличной FGFR-ингибирующей активностью и ингибирует способность рецепторных протеинтирозинкиназ (FGFR1, FGFR3 и FGFR4) фосфорилировать тирозин в последовательности пептидного субстрата (PTL 2).
[0093]
Факторы роста фибробластов (FGF) экспрессируются в различных тканях и являются одним из факторов роста, регулирующих пролиферацию и дифференцировку клеток. Физиологическая активность FGF опосредуется рецепторами фактора роста фибробластов (FGFR), которые являются специфическими рецепторами клеточной поверхности. FGFR принадлежат к семейству рецепторных протеинтирозинкиназ и включают внеклеточный лиганд-связывающий домен, единственный трансмембранный домен и внутриклеточный тирозинкиназный домен. До настоящего времени были идентифицированы четыре типа FGFR (FGFR1, FGFR2, FGFR3 и FGFR4). FGFR связываются с FGF с образованием димеров и активируются путем фосфорилирования. Активация рецепторов индуцирует мобилизацию и активацию специфических молекул, передающих нисходящие сигналы, тем самым развивая физиологические функции. Было несколько сообщений о взаимосвязи между аберрантной передачей сигналов FGF/FGFR и различными опухолями человека. Считается, что аберрантная активация передачи сигналов FGF/FGFR в опухолях человека может быть связана со сверхэкспрессией FGFR и/или генной амплификацией, генной мутацией, хромосомной транслокацией, инсерцией и инверсией, слиянием генов или аутокринным или паракринным механизмом за счет сверхпродукции FGF (лигандов).
[0094]
В предпочтительном варианте осуществления настоящее изобретение можно использовать для опухолей, которые имеют аберрацию в генах FGFR, PTEN, PIK3CA или AKT. Генетические аберрации включают генную амплификацию, генную мутацию, хромосомную транслокацию, инсерцию и инверсию, слияние генов, генетическую перестройку и т.д. О некоторых генетических аберрациях в опухолях уже сообщалось в документах, доступных специалистам в данной области. Генетические аберрации могут быть обнаружены методами, известными специалистам в данной области, например, такими как пиросеквенирование, ДНК-секвенирование, включая секвенирование следующего поколения (NGS), методы на основе ПЦР, включая аллель-специфические ПЦР цепные реакции, сравнительная геномная гибридизация на основе микрочипов. (aCGH), флуоресцентная гибридизация in situ (FISH) и хромогенная гибридизация in situ (CISH)
[0095]
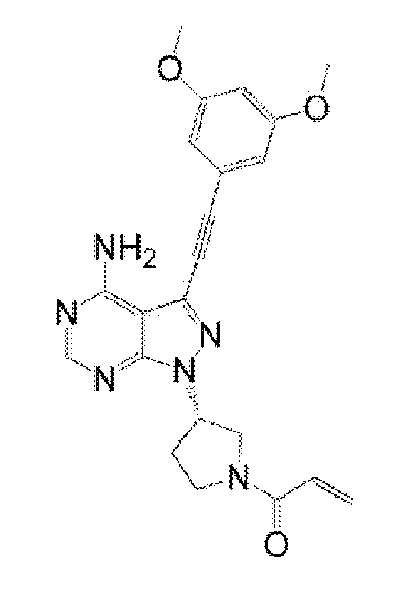
[0096]
В настоящем изобретении Соединение 2 или его соль, описанные выше, можно синтезировать любым способом, и их можно синтезировать, например, в соответствии со способом получения, описанным в PTL 2.
[0097]
В настоящем изобретении соли Соединения 2 являются фармацевтически приемлемыми солями.
[0098]
В предпочтительном варианте осуществления настоящего изобретения Соединение 1 или его соль можно использовать в комбинации с Соединением 2 или его солью.
[0099]
В контексте настоящего изобретения выражения, такие как “комбинированное применение” или “используемые в комбинации”, используются для определения терапии, в которой используют комбинацию двух или более соединений или лекарственных средств. Поэтому применение соединений или лекарственных средств “в комбинации” и “комбинированное применение” соединений или лекарственных средств в настоящем изобретении может относиться к введению соединений или лекарственных средств в соответствии с частью одной и той же общей схемы введения. Дозы двух или более соединений или лекарственных средств могут отличаться друг от друга; их можно вводить одновременно или в разное время. Таким образом, подразумевается, что соединения или лекарственные средства, используемые в комбинации, можно вводить последовательно (например, одно после другого), или одновременно в одном и том же лекарственном препарате (т.е. вместе), или в разных лекарственных препаратах (т.е. раздельно). При одновременном введении один и тот же препарат вводят в виде единого препарата, а разные препараты вводят в виде не объединенных препаратов.
[0100]
Примеры комбинаций суточной дозы Соединения 1 или его соли в день введения с суточной дозой Соединения 2 в соответствии с настоящим изобретением включают следующие:
от 4 мг/человек/день до 160 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
от 4 мг/человек/день до 44 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
от 16 мг до 32 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
16 мг или 24 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
4 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
8 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
12 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
16 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
20 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
24 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
32 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
44 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
60 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
80 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
100 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
120 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
160 мг/человек/день Соединения 1 по настоящему изобретению или его соли и от 12 мг/человек/день до 20 мг/человек/день Соединения 2,
4 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
8 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
12 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
16 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
20 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
24 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
32 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
44 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
60 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
80 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
100 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
120 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
160 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 12 мг/человек/день Соединения 2,
4 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
8 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
12 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
16 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
20 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
24 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
32 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
44 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
60 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
80 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
100 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
120 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
160 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 16 мг/человек/день Соединения 2,
4 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
8 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
12 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
16 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
20 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
24 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
32 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
44 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
60 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
80 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
100 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2,
120 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2, and
160 мг/человек/день Соединения 1 по настоящему изобретению или его соли и 20 мг/человек/день Соединения 2.
[0101]
В этом варианте осуществления Соединение 2 или его соль можно вводить параллельно в соответствии со следующими схемами введения, тогда как Соединение 1 или его соль вводят в соответствии со схемами введения, описанными выше. Схема введения конкретно не ограничивается. Например, Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, предпочтительно 20 мг/человек/день, в расчете на Соединение 2, в течение 7 последовательных дней.
[0102]
В типичном варианте осуществления Соединение 1 или его соль вводят в соответствии со схемой введения, которая включает три курса общей продолжительностью 21 день, где один курс составляет 7 дней, в ходе которого Соединение 1 или его соль вводят один раз в день в дозе от 4 мг/человек/день до 160 мг/человек/день (предпочтительно от 4 мг/человек/день до 44 мг/человек/день, более предпочтительно от 16 мг/человек/день до 32 мг/человек/день, еще более предпочтительно 16 мг/человек/день или 24 мг/человек/день, и еще более предпочтительно 24 мг/человек/день), в расчете на Соединение 1, в течение 4 последовательных дней в ходе каждого курса с дня 1 по день 4, с дня 8 по день 11 и с дня 15 по день 18, и период отмены препарата предусмотрен с дня 5 по день 7, с дня 12 по день 14 и с дня 19 по день 21. Параллельно этому, например, Соединение 2 или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, предпочтительно 20 мг/человек/день, в расчете на Соединение 2, последовательно в течение 21 дня.
[0103]
Схема введения для противоопухолевого средства по настоящему изобретению может быть подходящим образом выбрана в соответствии с типом рака, стадией заболевания и т.п.
[0104]
В другом варианте осуществления продукты, включающие Соединение 1 или его соль и Соединение 2 или его соль (например, терапевтические средства, фармацевтические композиции и наборы), представлены как комбинированные препараты, которые используют одновременно, последовательно или с интервалом.
[0105]
Каждый из активных ингредиентов Соединения 1 или его соли и Соединения 2 или его соли по настоящему изобретению может быть сформулирован в виде нескольких лекарственных форм, или они могут быть вместе сформулированы в единую лекарственную форму в соответствии с формой введения и/или схемой введения каждого активного ингредиента. Кроме того, препараты могут быть получены и могут продаваться в одной упаковке, подходящей для комбинированного введения, или препараты могут быть получены и могут продаваться в отдельных упаковках. Поэтому терапевтическое средство, фармацевтическая композиция, набор и т.д. по настоящему изобретению, «включающие Соединение 1 или его соль и Соединение 2 или его соль», охватывают не только те, которые получены путем формулирования этих соединений или их солей в виде единой лекарственной формы, но также те, которые получены путем их формулирования в виде нескольких лекарственных форм.
[0106]
В настоящем изобретении «рак» или «опухоль» относится к физиологическим состояниям млекопитающего, характеризующимся тем, что нормальный контроль не приемлем из-за генной мутации в клетках, приводящей к нерегулируемому росту клеток. «Рак» и «опухоль» имеют одинаковое значение в настоящем изобретении и используются взаимозаменяемо.
[0107]
Примеры опухолей, на которые нацелено настоящее изобретение, включают, но не ограничиваются этим, эпителиальный рак (например, рак дыхательных путей, рак пищеварительного органа, урогенитальный рак, рак секреторной системы, рак кожи и плоскоклеточный рак), мезотелиому, рак молочной железы, саркому, гематопоэтическую опухоль, опухоль центральной нервной системы и опухоль периферической нервной системы. Солидный рак означает злокачественные опухоли, которые развиваются в любом органе и ткани, за исключением гематопоэтических опухолей. Конкретные примеры включают эпителиальный рак, мезотелиому, рак молочной железы, саркому, опухоль центральной нервной системы и опухоль периферической нервной системы.
Конкретные примеры рака дыхательных путей включают рак легких (например, немелкоклеточный рак легкого (например, аденокарциному, крупноклеточный рак и плоскоклеточный рак легкого) и мелкоклеточный рак легкого). Конкретные примеры рака органа пищеварения включают рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных путей (например, рак желчного пузыря и рак желчных протоков), рак поджелудочной железы и рак толстой кишки (например, рак толстой кишки, рак прямой кишки и рак анального канала). Конкретные примеры урогенитального рака включают рак яичников, рак матки (например, рак шейки матки, рак тела матки и рак эндометрия), рак мочевыводящих путей (например, рак почечной лоханки, рак мочевого пузыря и рак уретры), рак предстательной железы, рак почек (почечно-клеточный рак), тестикулярную опухоль и рак вульвы. Конкретные примеры рака секреторной системы включают нейроэндокринную опухоль и рак щитовидной железы. Конкретные примеры мезотелиомы включают мезотелиому плевры, мезотелиому брюшины, мезотелиому перикарда и тестикулярную мезотелиому. Конкретные примеры саркомы включают опухоль костей и мягких тканей и рабдомиосаркому. Конкретные примеры гематопоэтических опухолей включают лейкоз, злокачественную лимфому и множественную миелому. Конкретные примеры опухоли центральной нервной системы включают опухоль головного мозга. Конкретные примеры опухолей периферической нервной системы включают злокачественную шванному.
Из них эпителиальный рак, рак молочной железы, саркома, гематопоэтическая опухоль и опухоль центральной нервной системы являются предпочтительными; рак дыхательных путей, рак органа пищеварения, рак мочеполовой системы, рак секреторной системы, рак кожи, рак молочной железы, саркома, гематопоэтическую опухоль и опухоль центральной нервной системы являются более предпочтительными; рак легких, рак молочной железы, рак почек, саркома, гематопоэтическая опухоль, опухоль центральной нервной системы, рак печени, рак яичников, рак желудка, рабдомиосаркома, рак эндометрия, рак мочевыводящих путей, рак предстательной железы, колоректальный рак, рак поджелудочной железы, рак вульвы, рак щитовидной железы, рак кожи, рак желчных путей и т.п. являются еще более предпочтительными; рак легких, рак эндометрия, рак мочевыводящих путей, рак молочной железы, рак предстательной железы, колоректальный рак, рак желчных путей, рак яичников, множественная миелома и т.п. являются еще более предпочтительными; и еще более предпочтительными являются рак легких, рак молочной железы, рак мочевого пузыря, рак толстой кишки, рак прямой кишки, рак желчного пузыря, рак анального канала и т.п. Еще более предпочтительным является рак легкого. Особенно предпочтителен немелкоклеточный рак легкого. Наиболее предпочтителен плоскоклеточный рак легкого.
[0108]
В настоящем изобретении, когда Соединение 1 или его соль используют в комбинации с Соединением 2 или его солью, опухоль представляет собой солидный рак, предпочтительно солидный рак с генетической мутацией, и более предпочтительно солидный рак, который подтвержден как положительный на генетические аберрации фактора роста фибробластов (FGF), рецептора фактора роста фибробластов (FGFR), PTEN, PIK3CA или AKT.
Конкретные примеры солидного рака включают перечисленные выше, такие как эпителиальный рак (например, рак дыхательных путей, рак органов пищеварения, урогенитальный рак, рак секреторной системы, рак кожи и плоскоклеточный рак), рак молочной железы, саркома и опухоль центральной нервной системы. Конкретные примеры рака дыхательных путей включают рак легких. Конкретные примеры рака органа пищеварения включают рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных путей, рак поджелудочной железы и рак толстой кишки. Конкретные примеры урогенитального рака включают рак яичников, рак матки, рак мочевыводящих путей, рак предстательной железы, рак почек и рак вульвы. Конкретные примеры рака секреторной системы включают нейроэндокринную опухоль и рак щитовидной железы. Конкретные примеры саркомы включают опухоль костей и мягких тканей и рабдомиосаркому. Конкретные примеры опухоли центральной нервной системы включают опухоль головного мозга.
Из них солидный рак предпочтительно представляет собой рак эпителия, рак молочной железы, саркому или опухоль центральной нервной системы, более предпочтительно рак дыхательных путей, рак органа пищеварения, рак мочеполовой системы, рак секреторной системы, рак кожи, рак молочной железы, саркому или опухоль центральной нервной системы, еще более предпочтительно рак легких, рак молочной железы, рак почек, саркому, опухоль центральной нервной системы, рак печени, рак яичников, рак желудка, рабдомиосаркому, рак эндометрия, рак мочевыводящих путей, рак предстательной железы, колоректальный рак, рак поджелудочной железы, рак вульвы, рак щитовидной железы, рак кожи, рак желчных путей и т.п., даже более предпочтительно рак легких, рак эндометрия, рак мочевыводящих путей, рак молочной железы, рак предстательной железы, колоректальный рак, рак желчевыводящих путей, рак яичников и т.п., и еще более предпочтительно рак легких, рак молочной железы, рак мочевого пузыря, рак толстой кишки, рак прямой кишки, рак желчного пузыря, рак анального канала и т.п. Рак легких является даже более предпочтительным. Особенно предпочтителен немелкоклеточный рак легкого. Плоскоклеточный рак легкого является наиболее предпочтительным.
[0109]
«Лечение» злокачественной опухоли в соответствии с настоящим изобретением включает послеоперационную адъювантную химиотерапию, осуществляемую для предотвращения рецидива после хирургического удаления опухоли, и предоперационную адъювантную химиотерапию, осуществляемую заранее для хирургического удаления опухоли.
[0110]
Лечение в соответствии с настоящим изобретением включает процедуры, осуществляемые с целью излечения или облегчения заболеваний, или с целью подавления прогрессирования или рецидива заболевания, или облегчения симптомов. Лечение включает введение лекарственных средств до или после хирургической процедуры, или введение лекарственных средств во время, до или после лучевой терапии.
[0111]
При использовании в качестве лекарственного средства Соединение 1 или его соль может быть в любой вводимой форме в зависимости от терапевтической цели. Примеры формы включают пероральные препараты (например, таблетки, таблетки с покрытием, порошки, гранулы, капсулы и растворы), инъекции, суппозитории, пластыри и мази. Соединение 1 или его соль предпочтительно находятся в форме перорального препарата. Эти препараты могут быть получены путем формулирования в соответствии с обычным методом формулирования, широко известным в данной области, с использованием фармацевтически приемлемого носителя или т.п.
[0112]
Примеры фармацевтически приемлемых носителей включают носители, которые широко используются в типичных лекарственных средствах, такие как эксципиенты, связующие, разрыхлители, смазывающие вещества, разбавители, солюбилизирующие агенты, суспендирующие агенты, регуляторы тоничности, регуляторы pH, буферы, стабилизаторы, красители, ароматизаторы и маскирующие запах агенты.
[0113]
Препарат по настоящему изобретению, включающий Соединение 1 или его соль, может быть представлен в виде набора, содержащего инструкции, в которых указано, что Соединение 1 или его соль вводят в соответствии со схемой введения, в которой Соединение 1 или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата, составляющим 3 дня. Конкретные примеры «инструкций по применению» включают вкладыши в упаковку и брошюры. Препарат в виде набора, содержащего инструкции по применению, может представлять собой такой, в котором инструкции по применению напечатаны на упаковке набора или прилагается к нему, или может представлять собой такой, в котором инструкции по применению включены вместе с Соединением 1 или его солью в упаковку препарата в виде набора.
[0114]
Тяжесть нежелательных явлений в настоящем изобретении может быть оценена в соответствии с Общими терминологическими критериями оценки нежелательных явлений (CTCAE), версии 4.03 или 5.0, Национального института онкологии (NCI).
[0115]
В настоящем изобретении противоопухолевый эффект может быть определен в соответствии с RECIST, версия 1.1 (European Journal of Cancer 45 (2009), 228-247) и путем комплексной оценки уменьшения опухоли между целевыми поражениями (поражения, имеющие размер, равный или больше, чем размер, который может быть измерен в соответствии с толщиной среза диагностическим методом (например, МРТ, КТ или рентген), используемой во время регистрации, и нецелевыми поражениями (все поражения, кроме целевых).
[0116]
Противоопухолевый агент в соответствии с настоящим изобретением можно использовать для лечения рака. «Противоопухолевый эффект» у онкологических пациентов, принимающих лечение в соответствии со схемами лечения, например, комбинированную терапию, описанную в настоящем описании, оценивают, например, на основании, по меньшей мере, одного из следующих: PFS (выживаемость без прогрессирования заболевания), DCR (частота контроля заболевания), DOR (продолжительность ответа), OS (общая выживаемость), ORR (частота объективного ответа), DCR (частота контроля заболевания), TTR (время до ответа) и PRO (результаты, сообщаемые пациентом). В одном варианте осуществления, когда мишенью является солидный рак, эффект комбинированной терапии, описанной в настоящем описании, на опухоли оценивают в соответствии со стандартом RECIST 1.1 (критерии эффекта на солидный рак), и противоопухолевый эффект представлен на основании SD (стабильное заболевание), PR (частичный ответ), CR (полный ответ) и PD (прогрессирующее заболевание).
Примеры
[0117]
Настоящее настоящее описано более подробно ниже при помощи Примеров; однако, настоящее настоящее не ограничивается этими Примерами, и обычный специалист в данной области сможет осуществить различные модификации без отступления от технического замысла настоящего изобретения.
[0118]
Пример 1: Исследование схемы введения Соединения 1 С использованием модели бестимусных мышей с подкожно транспланстированными OVCAR-3
Человескую клеточную линию рака яичников OVCAR-3 (American Type Culture Collection (ATCC)), которая была подкожно субкультивирована у мышей, разрезали на квадраты примерно 2 мм и подкожно транспланстировали 5-недельным самцам мышей BALB/cAJcl-nu/nu (CLEA Japan, Inc.) с использованием иглы для трансплантации.
[0119]
Когда опухоль достигала объема около 100-200 мм3, животных разделяли на группы таким образом, чтобы группы имели одинаковый объем опухоли. День распределения по группам определяли как День 1.
Объем опухоли (TV) рассчитывали с использованием следующей формулы.
[0120]
TV=(большая ось × малая ось × малая ось) × 1/2
Группы введения были установлены как показано в таблице ниже. Отвешивали необходимые количества Соединения 1 и каждое отдельно суспендировали в 0,5% (масс/об) водном растворе гидроксипропилметилцеллюлозы (HPMC) с получением жидкости для введения, имеющей соответствующие концентрации. Для контрольной группы в качестве жидкости для введения использовали 0,5% (масс/об) водный раствор HPMC.
[0121]
Вводимое количество составляло 10 мл/кг массы тела, и каждую жидкость для введения отдельно вводили в желудок мышей через питающую иглу.
[0122]
n
[0123]
Противоопухолевый эффект
Два раза в неделю большую ось и малую ось каждой опухоли измеряли от кожи электронным циркулем, затем рассчитывали следующие показатели. Результаты использовали в качестве показателей для подтверждения присутствия или отсутствия противоопухолевого эффекта.
[0124]
Объем опухоли (TVn)=(большая ось × малая ось × малая ось) × 1/2
Относительный объем опухоли (RTVn)=TVn/TV1
T/C(%)=(средний RTVn группы введения)/(средний RTVn контрольной группы) × 100
(n обозначает каждый день измерений).
Изменение массы тела
В те же дни, когда измеряли объем опухоли, измеряли массу тела (BW) мышей на электронных весах и затем рассчитывали изменение массы тела (BWC).
[0125]
BWCn(%)=(BWn-BW1)/BW1 × 100
(n обозначает каждый день измерений).
Фиг. 1 показывает результаты. Как ясно видно из Фиг. 1, отличный противоопухолевый эффект был продемонстрирован без серьезной потери массы тела в каждой из групп введения Соединения 1 в испытании in vivo. Не было никакой существенной разницы в противоопухолевых эффектах и побочных эффектах между введением Соединения 1 в течение 7 последовательных дней и введением Соединения 1 по схеме 4-введение плюс 3-отмена введения.
[0126]
Пример 2: Исследование схемы введения Соединения 1, используемого в комбинации с Соединением 2, с использованием модели бестимусных мышей, которым подкожно транспланстировали AN3CA опухоль человека
Клеточную линию AN3CA, полученную из рака эндометрия человека (American Type Culture Collection (ATCC)), которая была подкожно субкультивирована у мышей, разрезали на квадраты примерно 2 мм и транспланстировали вблизи последнего правого ребра 6-недельным самцам BALB/cAJcl-nu/nu мышей (CLEA Japan, Inc.) с использованием иглы для трансплантации.
[0127]
Когда опухоль достигала объема около 50-200 мм3, животных разделяли на группы таким образом, чтобы группы имели одинаковый объем опухоли. День распределения по группам определяли как День 0.
Объем опухоли (TV) рассчитывали с использованием следующей формулы.
[0128]
TV=(большая ось × малая ось × малая ось) × 1/2
Группы введения были установлены как показано в таблице ниже. Отвешивали необходимые количества Соединения 1 и Соединения 2 и каждое отдельно суспендировали в 0,5% (масс/об) водном растворе гидроксипропилметилцеллюлоза (HPMC) с получением жидкости для введения, имеющей соответствующие концентрации. Для контрольной группы в качестве жидкости для введения использовали 0,5% (масс/об) водный раствор HPMC.
[0129]
n
[0130]
Два раза в неделю большую ось и малую ось каждой опухоли измеряли от кожи электронным циркулем, затем рассчитывали следующие показатели. Результаты использовали в качестве показателей для подтверждения присутствия или отсутствия противоопухолевого эффекта.
[0131]
Объем опухоли (TVn)=(большая ось × малая ось × малая ось) × 1/2
Относительный объем опухоли (RTVn)=TVn/TV0
T/C(%)=(средний RTVn группы введения)/(средний RTVn контрольной группы) × 100
(n обозначает каждый день измерений).
Изменение массы тела
В те же жни, когда измеряли объем опухоли, измеряли массу тела (BW) мышей на электронных весах, а затем рассчитывали изменение массы тела (BWC).
[0132]
BWCn (%)=(BWn-BW1)/BW1 × 100
(n обозначает каждый день измерений).
Фиг. 2 показывает результаты. Как ясно видно из Фиг. 2, отличный противоопухолевый эффект был продемонстрирован без серьезной потери массы тела в каждой из групп введения Соединение 1+Соединение 2 в испытании in vivo. Не было никакой существенной разницы в противоопухолевых эффектах и побочных эффектах между введением Соединения 1 в течение 7 последовательных дней и введением Соединения 1 по схеме 4-введение плюс 3-отмена введения.
[0133]
Пример 3: Исследование схемы введения Соединения 1 у человека
Это испытание осуществляли для определения рекомендуемой дозы и схемы введения Соединения 1 и исследования профиля безопасности Соединения 1 для пациентов с прогрессирующим солидным раком, для которых стандартные варианты лечения недоступны.
[0134]
В этом Примере, сначала определяли рекомендуемые дозы для схемы введения в течение 7 последовательных дней и схемы 4-введение плюс 3-отмена введения. В схеме введения Соединения 1 в течение 7 последовательных дней Соединение 1 перорально вводили последовательно один раз в день в течение трех курсов общей продолжительностью 21 день, где один курс составляет 7 дней. В схеме 4-введение плюс 3-отмена Соединение 1 перорально вводили один раз в день с дня 1 по день 4, с дня 8 по день 11 и с дня 15 по день 18 в течение трех курсов общей продолжительностью 21 день, где один курс составляет 7 дней.
[0135]
В схеме введения в течение 7 последовательных дней вводимое количество, принимаемое за один раз, начиналось при 4 мг/человек/день. В схеме 4-введение плюс 3-отмена введения вводимое количество, принимаемое за один раз, начиналось при 32 мг/человек/день. Для испытания использовали вариант 3+3. Уровни доз были следующими: уровень 1=4 мг/человек/день, уровень 2=8 мг/человек/день, уровень 3=16 мг/человек/день, уровень 4=24 мг/человек/день, уровень 5=32 мг/человек/день, уровень 6=44 мг/человек/день, уровень 7=60 мг/человек/день, уровень 8=80 мг/человек/день, уровень 9=100 мг/человек/день, уровень 10=120 мг/человек/день и уровень 11=160 мг/человек/день.
[0136]
В настоящем изобретении вариант испытания 3+3 осуществляли следующим образом. Введение осуществляют трем или более пациентам при каждом уровне дозы. При каждом уровне дозы, если ни один из первых трех пациентов не испытал DLT в течение трех курсов общей продолжительностью 21 день, уровень дозы переходит к следующему более высокому уровню дозы, который на один уровень выше. Если один из первых трех пациентов испытывает DLT, трех дополнительных пациентов лечат при том же уровне дозы. Если ни один из трех дополнительных пациентов не испытывает DLT во время завершения трех курсов общей продолжительностью 21 день, уровень дозы переходит на уровень дозы на один уровень выше. Если один или более из трех дополнительных пациентов испытывают DLT, по меньшей мере шесть пациентов включаются в число пациентов для оценки DLT при уровне дозы на один уровень ниже, чтобы определить рекомендуемую дозу. Если два или более из первых трех пациентов испытывают DLT, уровень дозы не изменяется, и по меньшей мере шесть пациентов включаются в число пациентов для оценки DLT при уровне дозы на один уровень ниже, чтобы определить рекомендуемую дозу. Переход на следующий уровень определяется исследователем и спонсором на основе всестороннего рассмотрения не только информации о DLT, но и всех соответствующих токсичностей, независимо от того, являются ли они DLT, а также лекарственных средств, используемых в комбинации/комбинированной терапии, с клинической точки зрения.
[0137]
В этом Примере, тяжесть нежелательных явлений классифицировали с использованием CTCAE Ver. 4,03.
[0138]
Определение дозолимитирующей токсичности (DLT)
DLT представляет собой токсичность, которая является причиной, по которой дозу нельзя больше увеличивать, когда пациенту вводят новое противораковое средство.
Для определения DLT использовали только побочные эффекты, которые возникли во время первых трех курсов общей продолжительностью 21 день при каждом способе введения.
Более конкретно, DLT определяются следующим образом.
[0139]
Гематологические токсичности
a) Нейтропения 4 степени, продолжающаяся более 7 дней
b) Тромбоцитопения 4 степени или тромбоцитопения 3 степени с кровотечением, требующим переливания крови
c) Фебрильная нейтропения (с абсолютным числом нейтрофилов (ANC) меньше чем 1000/мм3, и температурой выше 38,3°C (101°F) даже разово или устойчивой температурой 38°C (100,4°F) или выше в течение более 1 часа
Негематологические токсичности
a) Симптоматическая гипергликемия 4 степени (уровень глюкозы натощак: больше чем 500 мг/дл)
b) гипергликемия 3 степени (уровень глюкозы натощак: больше чем 250 мг/дл), которая продолжается более 7 дней и которая не лечится интенсивным лечением диабета с использованием инсулина, пероральным лекарственным средством от диабета или т.п.; или aсимптоматическая гипергликемия 4 степени
c) Кожная токсичность 3 или более высокой степени, которая не лечится интенсивным лечением кожи с использованием топического стероида, перорального кортикостероида или т.п.
d) Тошнота/рвота 3 или более высокой степени, которая продолжается более 48 часов и которая не лечится интенсивной противорвотной терапией с использованием антагониста серотонинового (5-гидрокситриптамин-3 (5-HT3)) рецептора (например, ондансетрона) или т.п.
e) Диарея 3 или более высокой степени, которая продолжается более 48 часов и при которой противодиарейное средство неэффективно
f) Другие негематологические токсичности 3 или более высокой степени
Другие
a) Побочный эффект 2 или более высокой степени, требующий предусматриваемого периода отмены препарата 20% или более от запланированного периода введения во время трех курсов общей продолжительностью 21 день
b) Случай, когда введение нельзя начинать в течение 2 недель от запланированного дня начала введения четвертого курса из-за побочного эффекта выше 2 степени
c) Что касается отклонений в лабораторных данных (за исключением вышеуказанных гематологических токсичностей и негематологических токсичностей) и транзиентных признаков и симптомов, исследователь и спонсор определяют, соответствуют ли они DLT.
[0140]
Рекомендуемые дозы определяли на основании случая DLT в каждой схеме, профиля безопасности, профиля эффективности и мнения комитета врачей, которые были экспертами, независимыми от спонсора и исследователя.
[0141]
Пациенты с раком молочной железы, раком мочевого пузыря, колоректальным раком, панкреатическими нейроэндокринными опухолями, раком желчного пузыря, раком анального канала и т.п. были зачислены в это испытание.
[0142]
Как результат, максимальные переносимые вводимые количества для введения в течение 7 последовательных дней и по схеме 4-введение плюс 3-отмена введения составили соответственно 16 мг/человек/день и 24 мг/человек/день, которые были определены как рекомендуемые дозы.
[0143]
Пример 4: Исследование фармакокинетики Соединения 1 у человека
Фармакокинетика рекомендуемых доз Соединения 1 при введении в течение 7 последовательных дней и по схеме 4-введение плюс 3-отмена введения измеряли у пациентов с прогрессирующим солидным раком, для которых стандартные варианты лечения были недоступны.
Что касается введения в течение 7 последовательных дней, Соединение 1 перорально вводили один раз в день при дозе 16 мг/человек/день в течение трех курсов общей продолжительностью 21 день, где один курс составляет 7 дней. Образцы крови брали через некоторое время в день 1 и день 21, который был последним днем введения для трех курсов, для измерения фармакокинетики.
Что касается схемы 4-введение плюс 3-отмена введения, Соединение 1 перорально вводили один раз в день при дозе 24 мг/человек/день в течение трех курсов общей продолжительностью 21 день, где один курс составляет 7 дней. Образцы крови брали через некоторое время в день 1 и день 18, который был последним днем введения для трех курсов, для измерения фармакокинетики. Образцы крови также брали непосредственно перед введением в день 3, день 4 и день 8.
Фиг. 3 показывает концентрации Соединения 1 в крови в день 1 (Фиг. 3, вверху) и день 21 или 18 (Фиг. 3, внизу), который был последним днем введения для трех курсов.
[0144]
Период полужизни Соединения 1 в кровотоке был около 49 часов. Сравнение между концентрациями лекарственного средства в крови в день 1 и день 21 в схеме введения в течение 7 последовательных дней, и сравнение между концентрациями лекарственного средства в крови в день 1 и день 18 в схеме 4-введение плюс 3-отмена введения показало, что концентрации лекарственного средства в крови были определенно выше в день 21 при введении в течение 7 последовательных дней и в день 18 при введении по схеме 4-введение плюс 3-отмена введения, чем концентрации в день 1. При введении Соединения 1 по схеме 4-введение плюс 3-отмена введения, концентрации в крови остающегося лекарственного средства перед введением в день 3 и день 4 составляли 25,7 нг/мл и 35,7 нг/мл, соответственно. Концентрации лекарственного средства в крови в день 21 при введении в течение 7 последовательных дней и в день 18 при введении по схеме 4-введение плюс 3-отмена введения показали, что Соединение 1 обладает свойствами аккумулирования.
[0145]
Пример 5: Исследование оптимальной схемы введения Соединения 1 у человека
Принимая во внимание Пример 3, исследовали оптимальную схему введения Соединения 1. Профили безопасности и профили эффективности при введении рекомендуемых доз в схеме введения в течение 7 последовательных дней и схеме 4-введение плюс 3-отмена введения сравнивали у пациентов с прогрессирующим солидным раком, для которых стандартные варианты лечения были недоступны.
[0146]
Что касается профилей безопасности, сравнивали непредусмотренные периоды отмены препарата. Непредусмотренный период отмены препарата является универсальным показателем профилей безопасности.
В этом Примере показаны критерии модификации дозы в случае возникновения токсичности, для которой нельзя отрицать причинно-следственную связь с лекарственным средством. Были установлены критерии модификации дозы для негематологических токсичностей, критерии модификации дозы для гематологических токсичностей и критерии модификации дозы для других токсичностей. В случае соответствия каким-либо из этих критериев предусмотренный день для осуществления введения лекарственного средства изменяли на день, в который лекарственное средство не вводят, т.е. непредусмотренный период отмены препарата.
[0147]
Критерии модификации дозы для негематологических токсичностей
Критерии модификации дозы для негематологических токсичностей, для которых нельзя отрицать причинно-следственную связь с лекарственным средством, были установлены следующим образом.
Что касается уровня глюкозы натощак, если симптоматическая гипергликемия 4 степени или гипергликемия 3 или более высокой степени проявляется в течение более чем 7 дней, введение прерывают (непредусмотренная отмена). Если состояние восстанавливается до степени 1 или степени 0, введение может быть возобновлено. Когда введение возобновляют, вводимое количество уменьшают на один уровень от исходного вводимого количества. Однако, что касается нежелательных явлений (например, слабость и сухость кожи), которые, как считается, с меньшей вероятностью перерастут в серьезные или усугубятся до угрожающих жизни явлений, введение лекарственного средства может быть продолжено при том же вводимом количестве без снижения дозы или приостановки введения, независимо от степени явлений.
[0148]
В случае DLT или негематологических токсичностей 3 или более высокой степени или других токсичностей, введение прерывают (непредусмотренная отмена). Если состояние восстанавливается до степени 1 или ниже или до исходного уровня, введение может быть возобновлено. В качестве негематологических токсичностей 3 или более высокой степени, тошнота и/или рвота 3 степени, которую можно лечить интенсивной противорвотной терапией, диарея 3 степени, при которой антидиарейное средство было эффективным, и кожная токсичность 3 степени, которую можно лечить с применением интенсивного средства для лечения кожи, например, топического стероида и/или перорального кортикостероида, исключаются. Когда введение возобновляют, вводимое количество уменьшают на один уровень от исходного вводимого количества. Однако, что касается нежелательных явлений (например, слабость и сухость кожи), которые, как считается, с меньшей вероятностью перерастут в серьезные или усугубятся до угрожающих жизни явлений, введение лекарственного средства может быть продолжено при том же вводимом количестве без снижения дозы или приостановки введения, независимо от степени явлений.
[0149]
Критерии модификации дозы для гематологических токсичностей
Критерии модификации дозы для гематологических токсичностей, для которой нельзя отрицать причинно-следственную связь с лекарственным средством, были установлены следующим образом.
Если число нейтрофилов меньше чем 500/мм3, введение прерывают (непредусмотренная отмена). Если число нейтрофилов восстанавливается до 1500/мм3 или более, введение может быть возобновлено. Когда введение возобновляют, вводимое количество не нуждается в изменении в случае aсимптоматической нейтропении, продолжающейся 7 дней или меньше. В случае aсимптоматической нейтропении, продолжающейся более 7 дней, или нейтропении с симптомом (нейтропения с инфекционным заболеванием или лихорадкой) вводимое количество уменьшают на один уровень от исходного вводимого количества.
Если количество тромбоцитов меньше чем 25000/мм3, введение прерывают (непредусмотренная отмена). Если количество тромбоцитов восстанавливается до 75000/мм3 или более, введение может быть возобновлено. Когда введение возобновляют, вводимое количество уменьшают на один уровень от исходного вводимого количества.
[0150]
Критерии модификации дозы для других токсичностей
Критерии модификации дозы для других токсичностей, для которых нельзя отрицать причинно-следственную связь с лекарственным средством и к которым не относится ни один из описанных выше случаев, были установлены следующим образом.
Что касается других токсичностей, которые по мнению исследователя требуют прерывания введения, введение прерывают (непредусмотренная отмена). Если состояние восстанавливается до степени 1 или ниже или до исходного уровня, введение может быть возобновлено. Когда введение возобновляют, вводимое количество не нуждается в изменении.
[0151]
Таблица 3 показывает результаты профилей безопасности. Сравнение между двумя группами введения рекомендуемых доз показало следующее: при введении в течение 7 последовательных дней трем из шести пациентов требовалась непредусмотренная отмена из-за побочных эффектов, и средний непредусмотренный период отмены препарата составил 3,7 дня; тогда как при введении по схеме 4-введение плюс 3-отмена введения одному из шести пациентов требовалась непредусмотренная отмена, и непредусмотренный период отмены составил 2 дня. Для Соединения 1 эти результаты показали, что введение по схеме 4-введение плюс 3-отмена введения имело преимущество по сравнению с введением в течение 7 последовательных дней, что касается контроля побочных эффектов.
[0152]
[0153]
Профили эффективности рекомендуемых доз для индивидуальных схем сравнивали путем построения каскадных диаграмм противоопухолевого эффекта у каждого пациента (Фиг. 4). Кроме того, результаты противоопухолевого эффекта сравнивали на основании оценки в соответствии с RECIST.
Как показано на каскадных диаграммах на Фиг. 4, результаты показали, что введение по схеме 4-введение плюс 3-отмена введения имеет преимущество по сравнению с введением в течение 7 последовательных дней, что касается эффекта уменьшения размера опухоли. Кроме того, результаты RECIST оценки показали, что два из шести пациентов имели стабильное заболевание (SD) при введении по схеме 4-введение плюс 3-отмена введения, тогда как все из этих пациентов имели прогрессирующее заболевание (PD) при введении в течение 7 последовательных дней. Как ясно видно из этих результатов, для Соединения 1 введение по схеме 4-введение плюс 3-отмена введения имеет преимущество по сравнению с введением в течение 7 последовательных дней в том, что касается противоопухолевого эффекта.
[0154]
На основании вышеизложенного очевидно, что введение Соединения 1 по схеме 4-введение плюс 3-отмена введения имеет преимущество в том, что касается получения отличного противоопухолевого эффекта и контроля побочных эффектов у людей, являющихся пациентами с опухолями. Это удивительный результат, который является неожиданным, исходя из экспериментов на мышах и результатов для других соединений.
[0155]
Пример 6: Фаза I/II клинического испытания комбинации 4-введение плюс 3-отмена введения Соединения 1 и введения Соединения 2 в течение 7 последовательных дней.
Целью этого испытания является изучение безопасности и переносимости комбинации 4-введение плюс 3-отмена введения Соединения 1 и введения Соединения 2 в течение 7 последовательных дней и определение рекомендуемых доз для людей с солидным раком. Это открытое нерандомизированное многоцентровое исследование фазы I/II с эскалацией дозы для оценки безопасности, переносимости, эффективности, фармакокинетики, фармакодинамики и прогнозирующих биомаркеров комбинированного применения Соединения 1 и Соединения 2 у пациентов с прогрессирующим или метастатическим солидным раком, для которых стандартные варианты лечения недоступны. Режим дозирования Соединения 2 является фиксированным, и дозу Соединения 1 увеличивают с использованием схемы 3+3 для определения рекомендуемого режима дозирования. Затем эффективность и безопасность исследуют с использованием установленной схемы введения.
[0156]
В этом испытании введение осуществляют тремя курсами общей продолжительностью 21 день, при этом один курс составляет 7 дней. В частности, Соединение 1 вводят перорально один раз в день в диапазоне от 4 мг до 160 мг/человек/день в течение 21 дня подряд, начиная с 8 мг/человек/день, согласно схеме 3+3. Соединение 2 вводят один раз в день в диапазоне от 12 мг до 20 мг в течение 21 дня подряд, начиная с 20 мг/человек/день. Курс повторяют до тех пор, пока пациент не будет соответствовать установленным критериям отмены. Когда введение по схеме 4-введение плюс 3-отмена или введение один раз в неделю считается желательным в качестве схемы введения Соединения 1, исходя из профилей безопасности, переносимости, эффективности, фармакокинетики, фармакодинамических биомаркеров и т.д., схему введения Соединения 1 можно изменять.
[0157]
Когда способ введения для Соединения 1 изменяют с введения в течение 7 последовательных дней на 4-введение плюс 3-отмена введения, Соединение 1 вводят перорально один раз в день в дозе от 4 мг до 160 мг/человек/день по схеме 4-введение плюс 3-отмена введения в течение трех курсов общей продолжительностью 21 день, где один курс составляет 7 дней, в соответствии с вариантом 3+3. Соединение 2 вводят один раз в день в дозе от 12 мг до 20 мг/человек/день последовательно в течение 21 дня.
[0158]
В схеме введения в течение 7 последовательных дней вводимое количество, принимаемое за один раз, начинается с 8 мг/человек/день. В схеме 4-введение плюс 3-отмена введение начинают с вводимого количества, считающегося предпочтительным на основании результатов введения в течение 7 дней. В испытании используют вариант 3+3. Уровни доз являются следующими: уровень -1 соответствует 4 мг/человек/день, уровень 1 соответствует 8 мг/человек/день, уровень 2 соответствует 12 мг/человек/день, уровень 3 соответствует 16 мг/человек/день, уровень 4 соответствует 20 мг/человек/день, уровень 5 соответствует 24 мг/человек/день, уровень 6 соответствует 32 мг/человек/день и уровень 7 соответствует 44 мг/человек/день. На основании профилей безопасности, переносимости, эффективности, фармакокинетики, фармакодинамических биомаркеров и т.д., вводимое количество можно еще больше увеличить. В этом случае вводимое количество составляет, например, 60 мг/человек/день, 80 мг/человек/день, 100 мг/человек/день, 12 мг/человек/день или 160 мг/человек/день.
[0159]
Введение Соединения 2 или его соли начинается с введения при 20 мг/человек/день один раз в день в течение 21 последовательных дней. Вводимое количество Соединения 2 или его соли можно уменьшить в зависимости от возникновения нежелательных явлений. Вводимое количество Соединения 2 или его соли можно уменьшить до 16 мг/человек/день или 12 мг/человек/день.
[0160]
В настоящем изобретении вариант испытания 3+3 осуществляют следующим образом. Введение осуществляют трем или более пациентам при каждом уровне дозы. При каждом уровне дозы, если ни один из первых трех пациентов не испытал DLT в течение трех курсов общей продолжительностью 21 день, уровень дозы переходит к следующему более высокому уровню дозы, который на один уровень выше. Если один из первых трех пациентов испытывает DLT, трех дополнительных пациентов лечат при том же уровне дозы. Если ни один из трех дополнительных пациентов не испытывает DLT во время завершения трех курсов общей продолжительностью 21 день, уровень дозы переходит на уровень дозы на один уровень выше. Если один или более из трех дополнительных пациентов испытывают DLT, по меньшей мере шесть пациентов включаются в число пациентов для оценки DLT при уровне дозы на один уровень ниже, чтобы определить рекомендуемую дозу. Если два или более из первых трех пациентов испытывают DLT, уровень дозы не изменяется, и по меньшей мере шесть пациентов включаются в число пациентов для оценки DLT при уровне дозы на один уровень ниже, чтобы определить рекомендуемую дозу. Переход на следующий уровень определяется исследователем и спонсором на основе всестороннего рассмотрения не только информации о DLT, но и всех соответствующих токсичностей, независимо от того, являются ли они DLT, а также лекарственных средств, используемых в комбинации/комбинированной терапии, с клинической точки зрения.
[0161]
Определение дозолимитирующей токсичности (DLT)
DLT представляет собой токсичность, которая является причиной, по которой дозу нельзя больше увеличивать, когда пациенту вводят новое противораковое средство.
Для определения DLT используют только побочные эффекты, которые возникли во время первых трех курсов общей продолжительностью 21 день каждого способа введения.
Более конкретно, DLT определяют следующим образом.
[0162]
Гематологические токсичности
1) Нейтропения 4 степени, продолжающаяся более 7 дней
2) Тромбоцитопения 4 степени или тромбоцитопения 3 степени с кровотечением, требующим переливания крови
3) Фебрильная нейтропения (с абсолютным числом нейтрофилов (ANC) меньше чем 1000/мм3 и температурой выше 38,3°C (101°F) даже разово или устойчивой температурой 38°C (100,4°F) или выше в течение более 1 часа
Негематологические токсичности
1) Гипергликемия 4 степени
2) Гипергликемия 3 степени, которая продолжается более 7 дней и которая не лечится интенсивным лечением диабета с использованием инсулина или т.п.
3) Кожная токсичность 3 или более высокой степени, которая не лечится интенсивным лечением кожи с использованием топического стероида, перорального кортикостероида или т.п.
4) Гиперфосфатемия с значением неогранического фосфата (Pi) >10 мг/дл и/или Pi значением >7 мг/дл в течение 7 дней или более, хотя лечение для снижения Pi значения осуществляют в течение 7 дней
5) Корнеальное расстройство степени 1 или более высокой степени, связанное с кальцификацией
6) Повышение креатинина, Pi, кальция
Креатинин > 1,5 × верхний предел нормы (ULN) продолжается в течение 7 дней или более, и Pi>5,5 мг/дл, хотя лечение для снижения Pi осуществляют в течение 7 дней, и/или скорректированный кальций × Pi>55 мг/дл, хотя лечение для снижения Pi осуществляют в течение 7 дней
7) Гиперкальциемия 2 степени, продолжающаяся более 7 дней, или гиперкальциемия 3 или более высокой степени
8) Новая эктопическая кальцификация в мягкой ткани по мнению исследователя
9) Тошнота/рвота 3 или более высокой степени, которая продолжается более 48 часов и которая не лечится интенсивной противорвотной терапией с использованием антагониста серотонинового (5-гидрокситриптамин-3 (5-HT3)) рецептора (например, ондансетрона) или т.п.
e) Диарея 3 или более высокой степени, которая продолжается более 48 часов и при которой противодиарейное средство неэффективно
f) Другие негематологические токсичности 3 или более высокой степени
Другие
a) Побочный эффект 2 или более высокой степени, который препятствует завершению трех курсов общей продолжительностью 21 день
b) Случай, когда введение нельзя начинать в течение 2 недель от запланированного дня начала введения четвертого курса из-за побочного эффекта выше 2 степени
[0163]
Рекомендуемые дозы определяют на основании случая DLT в каждой схеме, профиля безопасности, профиля эффективности и мнения комитета врачей, которые являются экспертами, независимыми от спонсора и исследователя.
[0164]
В этом испытании тяжесть нежелательных явлений классифицируют с использованием CTCAE Ver. 5.0.
[0165]
Комбинация Соединения 1 или его соли по схеме 4-введение плюс 3-отмена и введения Соединения 2 или его соли последовательно в течение 21 дня может обеспечить противоопухолевые эффекты, которые нельзя ожидать от монотерапий с использованием каждого из них по отдельности. Например, в варианте осуществления настоящего изобретения может быть обнаружено, что это комбинированное применение имеет более высокую степень эффектов, чем по меньшей мере один из результатов измерений лечения с использованием любого из них. Кроме того, например, в варианте осуществления настоящего изобретения можно получить синергетический эффект с использованием комбинации введения Соединения 1 или его соли по схеме 4-введение плюс 3-отмена и введения Соединения 2 или его соли последовательно в течение 21 дня.
[0166]
Противоопухолевые эффекты оценивают в соответствии с рекомендациями RECIST, версии 1.1. Комбинация Соединения 1 или его соли по схеме 4-введение плюс 3-отмена и введения Соединения 2 или его соли в течение 7 последовательных дней может быть более эффективной, чем использование каждого из них по отдельности, в соответствии с по меньшей мере одним из следующих результатов измерений: частота объективного ответа (ORR), частота контроля заболевания (DCR), продолжительность ответа (DOR), выживаемость без прогрессирования заболевания (PFS), общая выживаемость (OS) и время до ответа (TTR).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ЭКТЕИНАСЦИДИНА-743 И СОДЕРЖАЩИХ ПЛАТИНУ ПРОТИВООПУХОЛЕВЫХ СОЕДИНЕНИЙ | 2004 |
|
RU2391101C2 |
| КОМБИНАЦИЯ ТРИФЛУРИДИНА/ТИПИРАЦИЛ ГИДРОХЛОРИДА, ПРОТИВООПУХОЛЕВОГО ПЛАТИНОВОГО КОМПЛЕКСА И МОДУЛЯТОРА КОНТРОЛЬНЫХ ТОЧЕК ИММУННОГО ОТВЕТА | 2018 |
|
RU2778887C2 |
| ПРОТИВООПУХОЛЕВОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО | 2016 |
|
RU2718048C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2010 |
|
RU2587013C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2006 |
|
RU2429838C2 |
| ДОЗА И РЕЖИМ ВВЕДЕНИЯ ДЛЯ ИНГИБИТОРОВ ВЗАИМОДЕЙСТВИЯ HDM2 С P53 | 2017 |
|
RU2762573C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2001 |
|
RU2284818C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S, 4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2592231C2 |
| ЛЕЧЕНИЕ РАКА ЖЕЛУДКА С ПРИМЕНЕНИЕМ КОМБИНАЦИОННЫХ ВИДОВ ТЕРАПИИ, СОДЕРЖАЩИХ ЛИПОСОМАЛЬНЫЙ ИРИНОТЕКАН, ОКСАЛИПЛАТИН, 5-ФТОРУРАЦИЛ (И ЛЕЙКОВОРИН) | 2017 |
|
RU2761953C2 |
| СПОСОБ, ВКЛЮЧАЮЩИЙ ФИКСИРОВАННОЕ ДРОБНОЕ ДОЗИРОВАНИЕ ЦЕДИРАНИБА | 2017 |
|
RU2740849C2 |
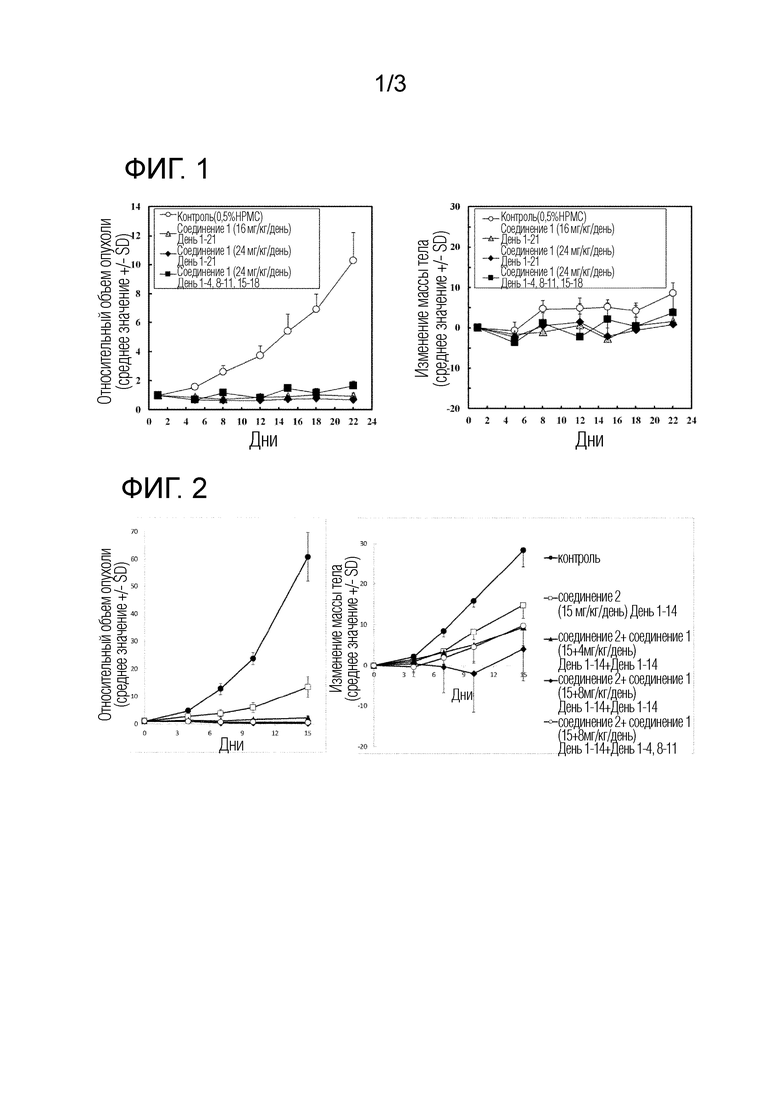
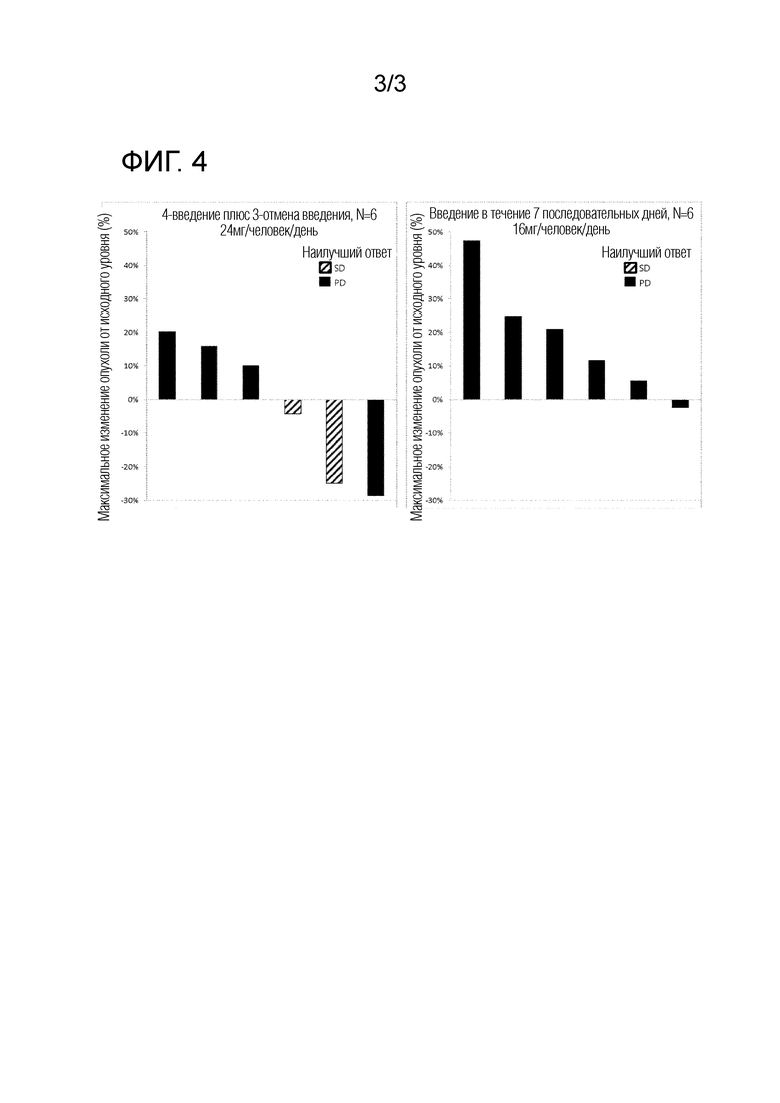
Изобретение относится к области фармацевтической промышленности, а именно к способу лечения злокачественной опухоли у пациента-человека. Способ для лечения злокачественной опухоли у пациента-человека, включающий введение транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанола или его соли пациенту, нуждающемуся в лечении, в соответствии со схемой введения, где схема введения включает один курс продолжительностью 7 дней, в течение которого транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день в расчете на транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата, составляющим 3 дня. Использование изобретения обеспечивает лечение злокачественной опухоли с использованием имидазооксазинового соединения, обладающего AKT-ингибирующей активностью, с уменьшением при этом побочных эффектов. 13 з.п. ф-лы, 4 ил., 3 табл., 6 пр.
1. Способ для лечения злокачественной опухоли у пациента-человека,
включающий введение транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанола или его соли пациенту, нуждающемуся в лечении, в соответствии со схемой введения, где схема введения включает один курс продолжительностью 7 дней, в течение которого транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол или его соль вводят в дозе от 4 мг/человек/день до 160 мг/человек/день, в расчете на транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол, в течение 4 последовательных дней с последующим предусмотренным периодом отмены препарата, составляющим 3 дня.
2. Способ по п. 1, где транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол или его соль вводят один раз в сутки в день введения.
3. Способ по п. 1 или 2, где схема введения включает три курса общей продолжительностью 21 день, где один курс составляет 7 дней, в которой транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанол или его соль каждый раз вводят в течение 4 последовательных дней, с дня 1 по день 4, с дня 8 по день 11 и с дня 15 по день 18, а предусмотренную отмену препарата осуществляют с дня 5 по день 7, с дня 12 по день 14 и с дня 19 по день 21.
4. Способ по п. 1 или 2, где доза транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанола или его соли составляет от 4 мг/человек/день до 44 мг/человек/день.
5. Способ по п. 1 или 2, где доза транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанола или его соли составляет от 16 мг/человек/день до 32 мг/человек/день.
6. Способ по п. 1 или 2, где доза транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанола или его соли составляет 24 мг/человек/день.
7. Способ по п. 1 или 2, где злокачественная опухоль представляет собой рак легкого, рак молочной железы, рак почки, саркому, гематопоэтическую опухоль, опухоль центральной нервной системы, рак печени, рак яичника, рак желудка, рабдомиосаркому, рак эндометрия, рак мочевыводящих путей, рак предстательной железы, колоректальный рак, рак поджелудочной железы, рак вульвы, рак щитовидной железы, рак кожи или рак желчных протоков.
8. Способ по п. 1 или 2, где злокачественная опухоль представляет собой рак легкого, рак эндометрия, рак мочевыводящих путей, рак молочной железы, рак предстательной железы, колоректальный рак, рак желчных протоков, рак яичника или множественную миелому.
9. Способ по п. 1 или 2, где злокачественная опухоль представляет собой рак легкого, рак молочной железы, рак мочевого пузыря, рак толстой кишки, рак прямой кишки, рак желчного пузыря или рак анального канала.
10. Способ по п. 1 или 2, где побочный эффект, вызываемый транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанолом или его солью, уменьшается.
11. Способ по п. 1 или 2, где побочный эффект, такой как макулопапулезная сыпь, вызываемый транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанолом или его солью, уменьшается.
12. Способ по п. 1 или 2, где побочный эффект, такой как гипергликемия, вызываемый транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанолом или его солью, уменьшается.
13. Способ по п. 1 или 2, который предназначен для комбинированного применения транс-3-амино-1-метил-3-(4-(3-фенил-5H-имидазо[1,2-c]пиридо[3,4-e][1,3]оксазин-2-ил)фенил)циклобутанола или его соли с (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-оном или его солью,
где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль вводят в соответствии со схемой введения, где схема введения включает введение (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-она или его соли в комбинации в течение 7 последовательных дней.
14. Способ по п. 13, где (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он или его соль вводят в комбинации в дозе от 12 мг/человек/день до 20 мг/человек/день, в расчете на (S)-1-(3-(4-амино-3-((3,5-диметоксифенил)этинил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-ил)проп-2-ен-1-он, в течение 7 последовательных дней.
| EP 3424505 A1, 09.01.2019 | |||
| СПОСОБ ЛЕЧЕНИЯ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 1998 |
|
RU2173157C2 |
| AU 2013284570 A1, 22.01.2015 | |||
| Вакуумный взрывотехнический комплекс | 2018 |
|
RU2698372C1 |
| US 2012004240 A1, 05.01.2012. | |||
Авторы
Даты
2024-03-26—Публикация
2020-06-19—Подача