Настоящее изобретение относится к области медицины, в частности к клинической лабораторной диагностике в области репродуктивной медицины, и может быть использовано для прогнозирования исхода переноса эмбриона высокого качества при экстракорпоральном оплодотворении.
Бесплодие определяется как невозможность зачатия в течение 1 года регулярных половых незащищенных актов (или в течение 6 месяцев в том случае, если женщина моложе 35 лет). По всему миру с данной проблемой сталкивается около 15% пар репродуктивного возраста; мужской фактор является наиболее значимым примерно в половине случаев [Sun, H. Global, Regional, and National Prevalence and Disability-Adjusted Life-Years for Infertility in 195 Countries and Territories, - 1990-2017: Results from a Global Burden of Disease Study, - 2017 / H. Sun [et al.] // Aging. - 2019. - Vol. 11, N 23. - P. 10952-10991]. Бесплодие, как и сам процесс его лечения, неизбежно оказывают влияние на качество жизни, вызывая финансовые трудности, депрессию, социальный дискомфорт.
В настоящее время для борьбы с бесплодием доступны вспомогательные репродуктивные технологии, в частности экстракорпоральное оплодотворение. Ежегодно совершается около 2 миллионов подобных процедур по всему миру, из которых лишь ~25% приводят к успешному исходу беременности [Mouzon, J. de International committee for monitoring assisted reproductive technologies world report: Assisted reproductive technology - 2012 / J. de Mouzon [et al.] // Human Reproduction. - 2020. - Vol. 35, N 8. - P. 1900-1913]. Учитывая их высокую стоимость процедур, а также возможные нежелательные явления, связанные с высокой экзогенной гормональной нагрузкой, разработка подходов к предсказанию исходов подобных циклов представляется крайне актуальной.
Известно, что низкое качество эмбриона ответственно за ~30% неудачных имплантаций [Oron, G. The association between embryo quality and perinatal outcome of singletons born after single embryo transfers: A pilot study / G. Oron [et al.] // Human Reproduction. - 2014. - Vol. 29, N 7. - P. 1444-1451]. Введение в клиническую практику морфологического и преимплантационного генетического тестирования эмбрионов позволило в некоторой степени повысить шансы на успешную имплантацию при ЭКО, однако частота успешных исходов данных процедур все равно остается субоптимальной, именно поэтому необходимо обратить внимание на вторую, более значимую, причину нарушения имплантации - пониженную рецептивность эндометрия [Baltaci, V. Relationship between embryo quality and aneuploidies / V. Baltaci [et al.] // Reproductive BioMedicine Online. - 2006. - Vol. 12, N 1. - P. 77-82]. Другими словами, рецептивный эндометрий является обязательным условием наступления беременности в результате экстракорпорального оплодотворения.
Рецептивность эндометрия (РЭ) - это способность эндометрия принять эмбрион и обеспечить для него оптимальные трофический статус и микроокружение. Другими словами, РЭ это величина эмбрионально-эндометриального взаимодействия. Однако в настоящее время не существует общепризнанного подхода к оценке рецептивности эндометрия вне констатации факта наступления/ненаступления беременности.
Из уровня техники известны подходы к оценке рецептивности эндометрия, основанные на ультразвуковых методах исследования [Jinno, M. Measurement of endometrial tissue blood flow: A novel way to assess uterine receptivity for implantation / M. Jinno [et al.] // Fertility and Sterility. - 2001. - Vol. 76, N 6. - P. 1168-1174; Довгань, А. А., Зиганшина, М. М., Долгушина, Н. В. Современные тренды в поиске маркеров рецептивности эндометрия - от отдельных параметров к комплексному подходу / А. А. Довгань, М. М. Зиганшина, Н. В. Долгушина // Акушерство и Гинекология. - 2020. - N 11. - C. 26-32], подразумевающие определение таких пространственных параметров эндометрия, как толщина, объем и паттерн. Сравнительная простота изучения ультразвуковых характеристик эндометрия позволила получить подобным подходам к оценке рецептивности эндометрия широкое распространение в научных исследованиях. Однако стоит отметить, что данные параметры являются суррогатными по отношению к молекулярному состоянию эндометрия и соответственно его способности принять имплантируемый эмбрион. Таким образом, в недавнем мета-анализе L. Craciunas и соавт. было продемонстрировано, что хоть и все обсужденные выше ультразвуковые параметры эндометрия в определенных подгруппах пациентов с бесплодием оказываются статистически значимо ассоциированы с исходом экстракорпорального оплодотворения, их прогностический потенциал оказывается предельно низок (площадь под ROC-кривой - 0,6), что существенно ограничивает оправданность принятия клинических решений, основываясь на данных ультразвукового исследования [Craciunas, L. Conventional and modern markers of endometrial receptivity: A systematic review and meta-analysis / L. Craciunas [et al.] // Human Reproduction Update. - 2019. - Vol. 25, N 2. - P. - 202-223].
Из уровня техники также известны способы оценки рецептивности эндометрия, основанные на анализе экспрессии ряда генов, связанных с процессом имплантации [Патент WO2010010213, Gene expression profile as an endometrial receptivity marker; Enciso, M. Development of a new comprehensive and reliable endometrial receptivity map (ER Map/ER Grade) based on RT-qPCR gene expression analysis / M. Enciso [et al.] // Human Reproduction. - 2018. - Vol. 33, N 2. - P. 220-228] и подразумевающие исследование биопсийного материала эндометрия. Для оценки уровней экспрессии предлагается использование полимеразной цепной реакции в реальном времени с обратной транскрипцией или секвенирования нового поколения. Ключевым недостатком данных способов является тот факт, что сбор биоматериала (с помощью биопсии эндометрия), необходимого для проведения анализа, возможен лишь вне цикла переноса эмбриона. Считается, что эндометрий женщин, проходящих цикл ВРТ, является крайне хрупкой системой, поэтому какой-либо инвазивный сбор биоматериала (особенно в момент близкий к имплантации) представляется недопустимым [Sar-Shalom Nahshon, C. The impact of intentional endometrial injury on reproductive outcomes: A systematic review and meta-analysis / C. Sar-Shalom Nahshon [et al.] // Human Reproduction Update. - 2019. - Vol. 25, N 1. - P. 95-113]. Таким образом, в соответствии с данными способами результаты анализа экспрессии генов в биопсийном материале эндометрия в нецелевом цикле экстраполируются на непосредственный цикл переноса эмбриона, тогда как нет доказательств сохранности как параметров экспрессии тех или иных связанных с процессом имплантации генов, так и рецептивности эндометрия в целом от цикла к циклу. Также для данных способов неизвестен реальный прогностический потенциал в связи с прекращением основного клинического исследования (NCT01954758).
Из уровня техники также известен способ оценки рецептивности эндометрия, основанный на анализе экспрессии нескольких генов, связанных с процессом имплантации, методом количественной полимеразной цепной реакции с обратной транскрипцией [Camargo-Díaz, F. Colony stimulating factor-1 and leukemia inhibitor factor expression from current-cycle cannula isolated endometrial cells are associated with increased endometrial receptivity and pregnancy / F. Camargo-Díaz [et al.] // BMC Women’s Health. - 2017. - Vol. 17, N 1. - 63], подразумевающий анализ остаточных клеток на катетере для переноса эмбриона. В соответствии с данным способом сбор биоматериала выполняется в потенциально самый информативный момент менструального цикла, а именно в момент переноса эмбриона. Однако это же и является основным недостатком данного способа. С клинической точки зрения получение прогностических данных в отношении исхода экстракорпорального оплодотворения после проведения данной процедуры является бессмысленным, так как после данного этапа принятие каких-либо клинических решений, в частности возможности отложить процедуру имплантации до наступления цикла с оптимальной рецептивностью (что позволит избежать выполнения заведомо неудачной имплантации, тем самым сохранив эмбрион высокого качества, уменьшив финансовую нагрузку, устранив необходимость в избыточной гормональной стимуляции при подготовке к имплантации), невозможно.
Из уровня техники также известен способ оценки рецептивности эндометрия, основанный на анализе уровня гликоделина на второй день после овуляции в смывах, полученных из полости матки [Bentin-Ley, U. Glycodelin in endometrial flushing fluid and endometrial biopsies from infertile and fertile women / U. Bentin-Ley [et al.] // European Journal of Obstetrics and Gynecology and Reproductive Biology. - 2011. - Vol. 156, N 1. - P. 60-66]. Основным недостатком данного способа является тот факт, что сбор смывов из полости матки путем орошения ее физиологическим раствором является неоднородной и маловоспроизводимой процедурой, так как могут происходить потери жидкости, в том числе через фаллопиевы трубы, что может затруднять сравнение результатов между разными пациентами. Данный факт нашел отражение в низком прогностическом потенциале данного способа (площадь под ROC-кривой - 0,58).
Таким образом, в настоящее время существует необходимость в разработке способа определения вероятности наступления беременности на основании неинвазивной оценки рецептивности эндометрия у пациенток в цикле экстракорпорального оплодотворения, лишенного всех вышеперечисленных недостатков.
Раскрытие изобретения
Техническая проблема, решаемая посредством заявляемого изобретения, заключается в необходимости разработки способа определения вероятности наступления беременности на основании неинвазивной оценки рецептивности эндометрия при экстракорпоральном оплодотворении, учитывающим ограниченную воспроизводимость забора биоматериала из матки и обладающим высоким прогностическим потенциалом в отношении наступления беременности в результате переноса эмбриона.
Техническим результатом заявляемого изобретения является разработка способа определения вероятности наступления беременности на основании неинвазивной оценки рецептивности эндометрия при экстракорпоральном оплодотворении, обладающего высоким прогностическим потенциалом в отношении наступления беременности в результате переноса эмбриона, осуществляемого в первые дни менструального цикла, в котором производится имплантация зародыша, тем самым обеспечивая возможность своевременного принятия клинических решений, в частности отмены переноса эмбриона до наступления цикла с оптимальной рецептивностью эндометрия, что позволит сохранить эмбрионы высокого качества (бластоцисты качества 2ВВ по Гарднеру или выше), избежать проведения гормональной стимуляции в заведомо неблагоприятном для имплантации цикле, а также снизить финансовую нагрузку. Также техническим результатом является отнесение пациентки с бесплодием, проходящей цикл экстракорпорального оплодотворения, к группе высокой или низкой рецептивности эндометрия с определением вероятности успешного исхода переноса эмбриона высокого качества, основанное на анализе уровней сигнальных молекул в менструальной крови, собранной из полости матки, и характеризующееся неинвазивностью, возможностью нормализации значений молекулярных биомаркеров в биоматериале для нивелирования неоднородности процедуры забора биоматериала из полости матки, осуществимостью непосредственно в начале целевого цикла переноса эмбриона и высокой прогностической ценностью при чувствительности 90% и специфичности 67% (площадь под ROC-кривой 0,822).
Техническая проблема решается способом определения вероятности наступления беременности у пациенток с бесплодием при экстракорпоральном оплодотворении, включающим:
- проведение забора менструальной крови (не менее 0,1 мл) из полости матки в любой день менструации в начале цикла переноса эмбриона, предпочтительно на второй или третий ввиду наибольшей обильности выделений в эти дни, с использованием любого известного из уровня техники катетера диаметром от 2 до 10 по Французской шкале диаметров катетеров (Fr), предпочтительно с диаметром 6,6 Fr для обеспечения отсутствия закупорки катетера и безболезненности процедуры (например, с использованием катетера для переноса эмбрионов Guardia Access Transfer Catheter K-JETS-7019, Cook Medical Inc., Блумингтон, Индиана, США);
- центрифугирование менструальной крови с последующем отделением надосадочной жидкости на любом известном из уровня техники оборудовании при скорости центрифугирования от 2000 об./мин до 14000 об./мин в течение от 1 до 30 минут, предпочтительно при 5500 об./мин в течение 10 мин для достижения оптимальной сепарации клеточного и неклеточного компонентов биоматериала (например, с использованием центрифуги Pico 21 Microcentrifuge, Thermo Fisher Scientific, Уолтэм, Массачусетс, США);
- измерение уровня общего белка в надосадочной жидкости менструальной крови любом известным из уровня техники способом (например, с использованием автоматизированного биохимического анализатора AU480, Beckman Coulter, Бреа, Калифорния, США);
- измерение уровней цитокинов интерферон-γ-индуцируемого белка 10 (англ. - Interferon-γ induced protein IP-10) и монокина, индуцируемого интерфероном-γ (англ. - Monokine induced by Interferon-γ, MIG), в надосадочной жидкости менструальной крови любым известным из уровня техники способом (например, с использованием набора реактивов для мультиплексного иммунофлуоресцентного анализа с магнитными частицами Bio-Plex Custom Assay IP-10, MIG на приборе Bio-Plex 200 (Bio-Rad Laboratories Inc., Геркулес, Калифорния, США);
- нормализацию измеренных в надосадочной жидкости менструальной крови уровней цитокинов IP-10 и MIG по уровню общего белка путем деления значений их измерения на значения измерений уровня общего белка в соответствующем образце биоматериала;
- расчет значения индекса рецептивности эндометрия (IER) в соответствии со следующей формулой:
IER = 0,054 × СIP-10 + 0,018 × СMIG - 0,005,
где IER - индекс рецептивности эндометрия; СIP-10 - нормализованная по уровню общего белка концентрация цитокина IP-10; СMIG - нормализованная по уровню общего белка концентрация цитокина MIG; 0,054, 0,018 и 0,005 - константы;
- расчет вероятности (Pp) наступления беременности в данном менструальном цикле в результате переноса эмбриона высокого качества в соответствии со следующей формулой:
Pp = ((e^IER / (1 + e^IER)) - 0,5) × 2× 100%,
где Pp - вероятность наступления беременности; IER - индекс рецептивности эндометрия; 1, е, 0,5, 2 и 100% - константы.
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
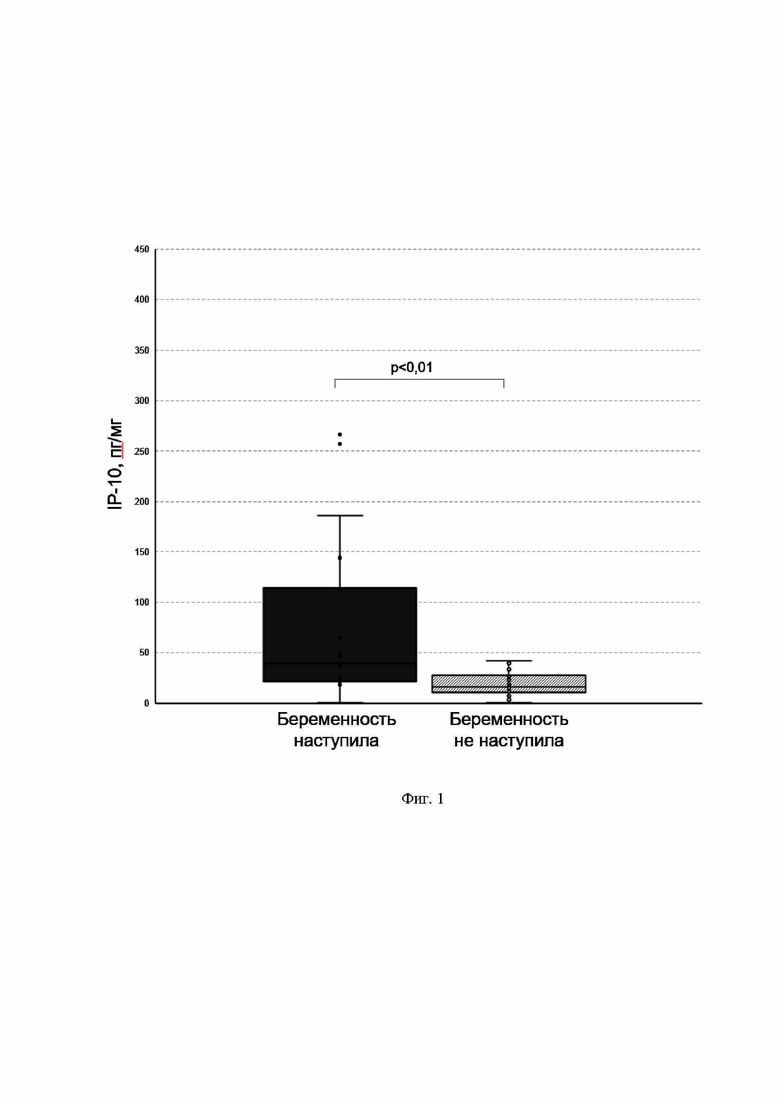
На фиг. 1 представлена диаграмма «ящики с усами» для сравнения уровней цитокина IP-10 в надосадочной жидкости менструальной крови пациенток, достигших и не достигших беременности в результате переноса эмбриона высокого качества (бластоцисты качества 2ВВ по Гарднеру или выше) при экстракорпоральном оплодотворении. По оси Х отложена принадлежность данных к группе. По оси Y отложена концентрация цитокина, представленная в виде пг цитокина на мг общего белка. Показано наличие статистически значимых различий; р-значение было рассчитано с использованием U-критерия Манна-Уитни.
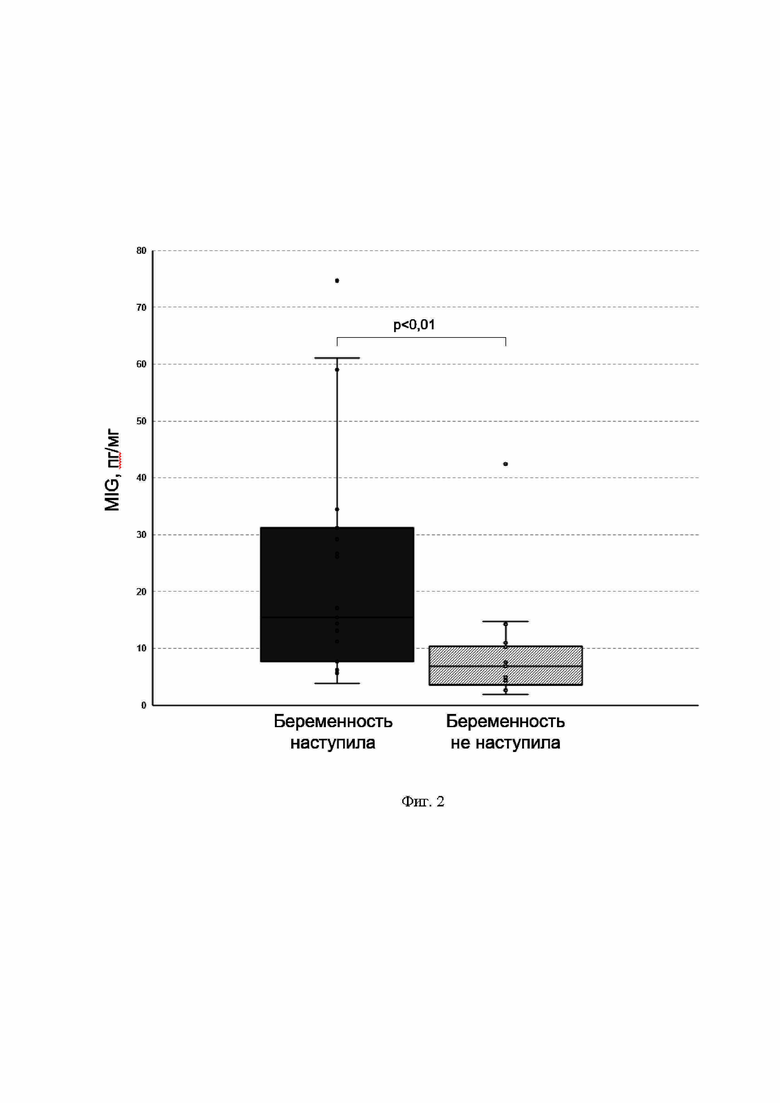
На фиг. 2 представлена диаграмма «ящики с усами» для сравнения уровней цитокина MIG в надосадочной жидкости менструальной крови пациенток, достигших и не достигших беременности в результате переноса эмбриона высокого качества (бластоцисты качества 2ВВ по Гарднеру или выше) при экстракорпоральном оплодотворении. По оси Х отложена принадлежность данных к группе. По оси Y отложена концентрация цитокина, представленная в виде пг цитокина на мг общего белка. Показано наличие статистически значимых различий; р-значение было рассчитано с использованием U-критерия Манна-Уитни.
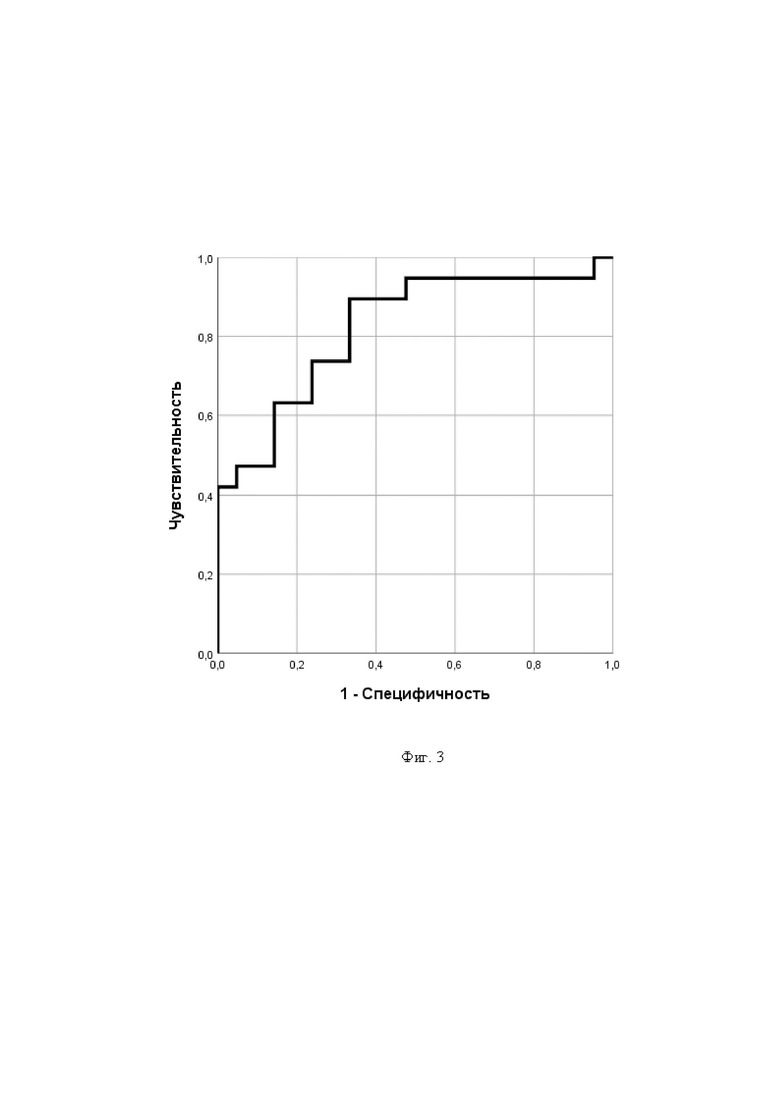
На фиг. 3 представлена ROC-кривая для индекса рецептивности эндометрия. По оси Х отложена разность единицы и специфичности для прогнозирования наступления или ненаступления беременности в результате переноса эмбриона высокого качества (бластоцисты качества 2ВВ по Гарднеру или выше) при экстракорпоральном оплодотворении. По оси Y отложена чувствительность для прогнозирования наступления или ненаступления беременности в результате процедуры. Каждая точка на кривой соответствует определенному пороговому значению индекса рецептивности эндометрия. Площадь под ROC-кривой составляет 0,822.
Осуществление изобретения
С целью разработки способа неинвазивной оценки рецептивности эндометрия у пациенток с бесплодием при экстракорпоральном оплодотворении было проведено клиническое исследование, в которое было включено 40 пациенток, которым был запланирован криоперенос эмбриона (как часть программы экстракорпорального оплодотворения). Критериями исключения пациенток из исследования были прием антибиотиков или диагностированные инфекции, передающиеся половым путем за 3 месяца до включения в исследование, а также наличие онкологических заболеваний. Все процедуры в рамках вспомогательных репродуктивных технологий были выполнены в строгом соответствии с национальными клиническими рекомендациями (№ 15-4/И/2-1908 от 05.03.2019 утв. МЗ РФ). Перенос эмбрионов проводился только для бластоцист качества 2ВВ по Гарднеру или выше. Пациентки были разделены на две группы в зависимости от исхода переноса эмбриона. Таким образом, 19 пациенток составили группу «беременность наступила», тогда как 21 - группу «беременность не наступила». Клиническая беременность устанавливалась по уровню человеческого хорионического гонадотропина с последующим ультразвуковым подтверждением наличия одного или более плодных яиц. Также производился контроль пролонгирования беременности до 12 недель. Впрочем, оно было достигнуто абсолютно у всех пациенток из группы «беременность наступила», поэтому данный параметр не учитывался при последующей обработке данных. Клинико-демографические характеристики участниц исследования представлены в Таблице 1. При применении поправки на множественные сравнения группы не различались по представленным параметрам (p>0,05).
Клинико-демографическая характеристика участниц исследования
Примечание:
* Данные представлены как среднее (разброс). ** Данные состояния устанавливались при наличии 3 и в анамнезе. ЭКО - экстракорпоральное оплодотворение; ИКСИ - интрацитоплазматическая инъекция смерматозоида в яйцеклетку; ПЭ - перенос эмбриона.
В рамках исследования менструальная кровь собиралась на 2-3-й дни цикла криопереноса эмбриона непосредственно из полости матки с использованием катетера для переноса эмбриона Guardia Access Transfer Catheter K-JETS-7019 (Cook Medical Inc., Блумингтон, Индиана, США), соединенного со шприцем. Данная процедура была полностью безболезненна. Объем аспирируемой менструальной крови было весьма гетерогенным и большинстве случаев составлял не более 0,5 мл. Из-за высокой вязкости биоматериала катетер зачастую забивался и нуждался в промывке стерильным физиологическим раствором (0,2 мл). Образцы менструальной крови центрифугировались при 5500 об./мин в течение 10 мин. Супернатант переносился в отдельные пробирки. И супернатант, и осадок менструальной крови хранились при температуре минус 80°С.
После размораживания менструальный супернатант доводился стерильным физиологическим раствором до объема 0,4 мл при необходимости, а затем разбавлялся 1:1 тем же раствором. Анализ цитокинов, хемокинов и факторов роста в супернатанте менструальной крови проводился с использованием набора реактивов для мультиплексного иммунофлуоресцентного анализа с магнитными частицами Bio-Plex Pro™ Human Cytokine Screening 48-Plex на приборе Bio-Plex 200 (Bio-Rad Laboratories Inc., Геркулес, Калифорния, США). Данная панель включала следующие аналиты: FGF; Eotaxin; G-CSF; GM-CSF; M-CSF; IFN-γ; IFN-α2; IL-1β; IL-1ra; IL-1α; IL-2Rα; IL-3; IL-12 (p40); IL-16; IL-2; IL-4; IL-5; IL-6; IL-7; IL-8; IL-9; IL-10; IL-12 (p70); IL-13; IL-15; IL-17A; IL-18; GRO-α; HGF; LIF; MCP-1; MCP-3; IP-10; MIG; NGF-β; SCF; SCGF-β; SDF-1α; MIP-1α; MIP-1β; PDGF-BB; RANTES; TNF-α; TNF-β; VEGF; CTACK; TRAIL.
Из-за высокой вариабельности исхода забора менструальной крови (в первую очередь, неизвестное соотношение крови к эндометриальному секрету) уровни всех анализируемых иммунных факторов нормализовались по общему белку и представлялись как пг аналита на мг общего белка. Уровень общего белка анализировался на автоматизированном биохимическом анализаторе AU480 (Beckman Coulter, Бреа, Калифорния, США). В части образцов менструального супернатанта были видимые признаки гемолиза разной степени, уровни гемоглобина в каждом образце определялись спектрофотометрически на приборе Multiskan GO (Thermo Fisher Scientific Inc., Уолтем, Массачусетс, США), чтобы оценить его влияние на результаты анализа сигнальных молекул.
Статистический анализ был осуществлен в компьютерной программе IBM SPSS Statistics 26.0 (IBM, Армонк, Нью-Йорк, США). Нормальность распределения была оценена с использованием критерия Шапиро-Уилка. После установления отсутствия нормального распределения во всех выборках сравнение переменных было осуществлено с помощью непараметрических критериев. U-критерий Манна-Уитни был использован для сравнения независимых количественных данных. Корреляционный анализ проводился с использованием рангового коэффициента Спирмена (rS), который интерпретировался по шкале Чеддока. Поправка на множественные сравнения проводилась по методу Бенджамини-Хохберга. Построение прогностической модели выполнялось с использованием бинарной логистической регрессии. Для оценки классифицирующей способности переменных применялся ROC-анализ.
Все 48 иммунных медиаторов, входящих в заявленную аналитическую панель, оказались детектируемы в менструальном супернатанте. После нормализации по общему белку уровней проанализированных сигнальных молекул статистически значимая разница между группами «беременность наступила» и «беременность не наступила» была обнаружена для G-CSF, GRO-α, IL-6, IL-9, MCP-1, SDF-1α, TNF-β, M-CSF, TRAIL, SCF, IP-10 и MIG (p<0,05). После применения поправки на множественные сравнения статистическая значимость сохранилась для цитокинов M-CSF, TRAIL, SCF, IP-10 и MIG (p<0,05). Наибольшие различия были продемонстрированы для уровней IP-10 (фиг. 1) и MIG (фиг. 2) (p<0,01), которые и были использованы для построения прогностической модели при помощи бинарной логистической регрессии. Важно отметить, что степень гемолиза (оцененная посредством изучения уровня гемоглобина в менструальной супернатанте) не была связана с уровнями IP-10 и MIG (rS -0,103 и 0,126, p>0,05, соответственно)
Построенная модель описывается следующей формулой:
IER = 0,054 × СIP-10 + 0,018 × СMIG - 0,005,
где IER - индекс рецептивности эндометрия; СIP-10 - нормализованная по уровню общего белка концентрация цитокина IP-10; СMIG - нормализованная по уровню общего белка концентрация цитокина MIG; 0,054, 0,018 и 0,005 - константы.
При пороговом значении индекса рецептивности эндометрия, равном 1,1, данная модель характеризуется чувствительностью 90% и специфичностью 67% (площадь под ROC-кривой 0,822) (фиг. 3), что превосходит прогностический потенциал отдельно взятых цитокинов IP-10 (площадь под ROC-кривой 0,820) и MIG (площадь под ROC-кривой 0,815).
Для оценки вероятности успешного исхода экстракорпорального оплодотворения была использована формула модифицированной относительной вероятности с целью преобразования полученных значений в более доступную для пациента форму:
Pp = ((e^IER / (1 + e^IER)) - 0,5) × 2× 100%,
где Pp - вероятность наступления беременности; IER - индекс рецептивности эндометрия; 1, е, 0,5, 2 и 100% - константы.
Ниже представлено более детальное описание заявляемого способа, которое не ограничивает объем притязаний заявляемого изобретения, а демонстрирует возможность осуществления изобретения с достижением заявляемого технического результата.
1) Проводят забор менструальной крови из полости матки в любой день менструации, предпочтительно на второй или третий дни. Избыток влагалищного секрета удаляют при помощи ватного тампона. Аспирацию биоматериала проводят таким образом, чтобы биоматериал представлял молекулярный профиль матки, а не проходил через шейку матки и влагалище. Предпочтительно аспирацию биоматериала проводить с использованием любого известного из уровня техники катетера диаметром от 2 до 10 по Французской шкале диаметров катетеров (Fr), предпочтительно с диаметром 6,6 Fr (например, с использованием катетера для переноса эмбрионов Guardia Access Transfer Catheter K-JETS-7019, Cook Medical Inc., Блумингтон, Индиана, США), который подсоединяют к шприцу объемом до 5 мл (предпочтительно 0,5 мл). Аспирацию выполняют при достижении конца катетера устья матки. При закупорке катетера компонентами менструальной крови его промывают изотоническим раствором (например, 0,9% раствор хлорида натрия или натрий-фосфатный буфер) в объеме до 1 мл (предпочтительно 0,2 мл). Собранный биоматериал помещают в пробирку любого объема (предпочтительно 1,5 мл).
2) Проводят отделение надосадочной жидкости менструальной крови с использованием центрифугирования. Центрифугирование выполняют при скорости от 2000 об./мин до 14000 об./мин в течение от 1 до 30 минут, предпочтительно при 5500 об./мин в течение 10 мин на любом известном из уровня техники оборудовании (например, с использованием центрифуги Pico 21 Microcentrifuge, Thermo Fisher Scientific, Уолтэм, Массачусетс, США). После центрифугирования надосадочную жидкость переносят в отдельную пробирку любого объема (предпочтительно 1,5 мл). В случае если объем надосадочной жидкости составляет менее 0,4 мл, то его доводят до этого объема изотоническим раствором (например, 0,9% раствор хлорида натрия или натрий-фосфатный буфер). Надосадочную жидкость менструальной крови при невозможности дальнейшего анализа в течение 4 часов с момента сбора биоматериала допускается хранить при температуре от минус 20°С до минус 80°С (предпочтительно минус 80°С). Последующие циклы перезаморозки недопустимы.
3) Проводят измерение уровня общего белка в надосадочной жидкости менструальной крови любом известным из уровня техники способом (например, с использованием автоматизированного биохимического анализатора AU480, Beckman Coulter, Бреа, Калифорния, США).
4) Выполняют измерение уровней цитокинов IP-10 и MIG, в надосадочной жидкости менструальной крови любым известным из уровня техники способом (например, с использованием набора реактивов для мультиплексного иммунофлуоресцентного анализа с магнитными частицами Bio-Plex Custom Assay IP10, MIG на приборе Bio-Plex 200 (Bio-Rad Laboratories Inc., Геркулес, Калифорния, США).
5) Проводят нормализацию измеренных в надосадочной жидкости менструальной крови уровней цитокинов IP-10 и MIG по уровню общего белка путем деления значений их измерения на значения измерений уровня общего белка в соответствующем образце биоматериала. Полученные значения представляют в виде пикограммов цитокина на мг общего белка (пг/мг).
6) Выполняют расчет значения индекса рецептивности эндометрия (IER) в соответствии со следующей формулой:
IER = 0,054 × СIP-10 + 0,018 × СMIG - 0,005,
где IER - индекс рецептивности эндометрия; СIP-10 - нормализованная по уровню общего белка концентрация цитокина IP-10; СMIG - нормализованная по уровню общего белка концентрация цитокина MIG; 0,054, 0,018 и 0,005 - константы;
7) Проводят расчет вероятности (Pp) наступления беременности в данном менструальном цикле в результате переноса эмбриона высокого качества (бластоцисты качества 2ВВ по Гарднеру или выше) в соответствии со следующей формулой:
Pp = ((e^IER / (1 + e^IER)) - 0,5) × 2× 100%,
где Pp - вероятность наступления беременности; IER - индекс рецептивности эндометрия; 1, е, 0,5, 2 и 100% - константы.
Пример 1
Пациентка С., женщина, 35 лет. Пациентке был запланирован перенос замороженного эмбриона в рамках программы экстракорпорального оплодотворения в цикле с заместительной гормональной терапией. На второй день менструального цикла у пациентки был выполнен забор менструальной крови в соответствии с заявляемым способом. В надосадочной жидкости менструальной крови были измерены уровни общего белка (13,5 мг/мл), IP-10 (7,6 пг/мл) и MIG (38,8 пг/мл).
Были рассчитаны нормализованные по уровню общего белка концентрации цитокинов IP-10 и MIG в надосадочной жидкости менструальной крови, которые составили 0,56 пг/мг и 2,87 пг/мг соответственно. Данные значения были подставлены в формулу расчета индекса рецептивности эндометрия (IER) по заявляемому способу:
IER = 0,054 × 0,56 + 0,018 × 2,87 - 0,005 = 0,077
Затем значение индекса рецептивности эндометрия было использовано для расчета вероятности (Pp) наступления беременности в данном менструальном цикле в результате переноса эмбриона в соответствии со следующей формулой:
Pp = ((e^0,077 / (1 + e^0,077)) - 0,5) × 2× 100% = 3,8%
На 18-й день менструального цикла пациентке был выполнен перенос замороженного эмбриона высокого качества (бластоцисты качества 2ВВ по Гарднеру или выше). Позже было подтверждено отсутствие клинической беременности по уровню человеческого хорионического гонадотропина с последующим ультразвуковым подтверждением отсутствия плодного яйца.
Таким образом, заявляемое изобретение позволило точно предсказать отрицательный исход переноса эмбриона. Отсрочка переноса эмбриона до наступления менструального цикла с высокой рецептивностью эндометрия позволила бы не проводить заведомо неудачную вспомогательную репродуктивную процедуру, что, в свою очередь, способствовало бы сохранению эмбриона высокого качества, снижению финансовых затрат пациентки, а также обеспечило бы отсутствие повышенной гормональной нагрузки и связанных с ней потенциальных побочных реакций.
Пример 2
Пациентка И., женщина, 28 лет. Пациентке был запланирован перенос замороженного эмбриона в рамках программы экстракорпорального оплодотворения в цикле с заместительной гормональной терапией. На второй день менструального цикла у пациентки был выполнен забор менструальной крови в соответствии с заявляемым способом. В надосадочной жидкости менструальной крови были измерены уровни общего белка (23,2 мг/мл), IP-10 (907,1 пг/мл) и MIG (396,9 пг/мл).
Были рассчитаны нормализованные по уровню общего белка концентрации цитокинов IP-10 и MIG в надосадочной жидкости менструальной крови, которые составили 39,1 пг/мг и 17,1 пг/мг соответственно. Данные значения были подставлены в формулу расчета индекса рецептивности эндометрия (IER):
IER = 0,054 × 39,1+ 0,018 × 17,1 - 0,005 = 2,414
Затем значение индекса рецептивности эндометрия было использовано для расчета вероятности (Pp) наступления беременности в данном менструальном цикле в результате переноса эмбриона в соответствии со следующей формулой:
Pp = ((e^2,414 / (1 + e^2,414)) - 0,5) × 2× 100% = 84%
На 18-й день менструального цикла пациентке был выполнен перенос замороженного эмбриона высокого качества (бластоцисты качества 2ВВ по Гарднеру или выше). Позже было подтверждено наступление клинической беременности по уровню человеческого хорионического гонадотропина с последующим ультразвуковым подтверждением наличия плодного яйца.
Таким образом, заявляемое изобретение позволило точно предсказать положительный исход переноса эмбриона.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ НЕИНВАЗИВНОЙ ОЦЕНКИ РЕЦЕПТИВНОСТИ ЭНДОМЕТРИЯ ПРИ ЭКСТРАКОРПОРАЛЬНОМ ОПЛОДОТВОРЕНИИ | 2023 |
|
RU2817061C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РЕЦЕПТИВНОСТИ ЭНДОМЕТРИЯ В ЦИКЛАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ | 2014 |
|
RU2562559C1 |
| Способ внутриматочной инфузии аутологичной плазмы женщины для повышения эффективности программ вспомогательных репродуктивных технологий | 2021 |
|
RU2762159C1 |
| Способ лечения повторяющихся неудач имплантации эмбриона при вспомогательных репродуктивных технологиях | 2024 |
|
RU2838873C1 |
| Способ оценки имплантационной состоятельности эндометрия при повторных неудачах имплантации, ассоциированных с хроническим эндометритом | 2021 |
|
RU2746644C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ РЕЦЕПТИВНОСТИ ЭНДОМЕТРИЯ У ЖЕНЩИН С МАТОЧНОЙ ФОРМОЙ БЕСПЛОДИЯ С ИСПОЛЬЗОВАНИЕМ КАВИТИРОВАННОГО РАСТВОРА ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА РОСТА | 2017 |
|
RU2667611C1 |
| Способ определения персонального "окна имплантации" у женщин на основе анализа транскрипционного профиля генов | 2016 |
|
RU2636527C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ УСПЕХА ИМПЛАНТАЦИИ В СТАНДАРТНОМ ДЛИННОМ ПРОТОКОЛЕ СТИМУЛЯЦИИ СУПЕРОВУЛЯЦИИ | 2017 |
|
RU2670450C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИМПЛАНТАЦИИ В ПРОГРАММАХ ВРТ У ЖЕНЩИН СТАРШЕГО РЕПРОДУКТИВНОГО ВОЗРАСТА С ТРУБНО-ПЕРИТОНЕАЛЬНЫМ ФАКТОРОМ БЕСПЛОДИЯ | 2020 |
|
RU2735218C1 |
| Способ прогнозирования наступления беременности у женщин с маточной формой бесплодия, обусловленной гиперплазией эндометрия | 2020 |
|
RU2732431C1 |
Изобретение относится к медицине, а именно к клинической лабораторной диагностике и репродуктивной медицине, и может быть использовано для определения вероятности наступления беременности в текущем менструальном цикле при экстракорпоральном оплодотворении (ЭКО). Осуществляют забор менструальной крови, определение уровней общего белка, интерферон-γ-индуцируемого белка 10 (IP-10) и монокина, индуцируемого интерфероном-γ (MIG), и подсчет индекса рецептивности эндометрия и вероятности наступления беременности в результате переноса эмбриона высокого качества. Способ обеспечивает отнесение пациентки с бесплодием, проходящей цикл ЭКО, к группе высокой или низкой рецептивности эндометрия с определением вероятности успешного исхода переноса эмбриона высокого качества за счет оценки рецептивности эндометрия в первые дни менструального цикла. 2 з.п. ф-лы, 3 ил., 1 табл., 2 пр.
1. Способ определения вероятности наступления беременности в текущем менструальном цикле при экстракорпоральном оплодотворении, включающий забор менструальной крови, определение в ее надосадочной жидкости уровней общего белка, интерферон-γ-индуцируемого белка 10 (IP-10) и монокина, индуцируемого интерфероном-γ (MIG), проводят определение индекса рецептивности эндометрия по формуле
IER = 0,054 × СIP-10 + 0,018 × СMIG – 0,005,
где IER – индекс рецептивности эндометрия; СIP-10 – нормализованная по уровню общего белка концентрация интерферон-γ-индуцируемого белка 10 (IP-10); СMIG – нормализованная по уровню общего белка концентрация монокина, индуцируемого интерфероном-γ (MIG); 0,054, 0,018 и 0,005 – константы, а определение вероятности наступления беременности проводят по формуле
Pp = ((e^IER / (1 + e^IER)) – 0,5) × 2 × 100%,
где Pp – вероятность наступления беременности; IER – индекс рецептивности эндометрия; 1, е, 0,5, 2 и 100% – константы.
2. Способ по п.1, характеризующийся тем, что менструальную кровь получают непосредственно из полости матки на 2-3-й день цикла.
3. Способ по п.1, характеризующийся тем, что значения уровней интерферон-γ-индуцируемого белка 10 (IP-10) и монокина, индуцируемого интерфероном-γ (MIG), нормализуют путем деления их концентрации на концентрацию общего белка в образце.
| СПОСОБ ПРОГНОЗА РЕЗУЛЬТАТА ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ И ПЕРЕНОСА ЭМБРИОНОВ (ЭКО И ПЭ) | 2011 |
|
RU2476142C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАСТУПЛЕНИЯ БЕРЕМЕННОСТИ В ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ И ПЕРЕНОСА ЭМБРИОНОВ | 2014 |
|
RU2587333C1 |
| WO 2019152625 A1, 08.08.2019 | |||
| LI M.Q | |||
| et al | |||
| Ovarian stimulation for in vitro fertilization alters the protein profile expression in endometrial secretion | |||
| Int J Clin Exp Pathol | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
Авторы
Даты
2024-04-09—Публикация
2023-10-23—Подача