ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее раскрытие относится к новому варианту аденинфосфорибозилтрансферазы, штамму Corynebacterium stationis, содержащему данный вариант, и к способу получения ИМФ (5'-инозилмонофосфат) с использованием данного штамма.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Проводятся разные исследования для разработки высокоэффективных микроорганизмов и технологий способов ферментации для производства ИМФ и других полезных веществ. Например, главным образом, используется специфичный подход в отношении целевого вещества, при котором увеличивается экспрессия гена, кодирующего фермент, участвующий в биосинтезе ИМФ, или при котором удаляются гены, не являющиеся необходимыми для биосинтеза (ЕР 3722430 A1, US 2020-0347346 A1). В качестве фермента, участвующего в биосинтезе ИМФ, имеется, например, аденинфосфорибозилтрансфераза (https://www.uniprot.org/uniprot/A0A1Q8DG31).
Однако все еще необходимо проводить исследования для эффективного увеличения способности к продуцированию ИМФ, так как возрастает спрос на ИМФ.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Авторы настоящего изобретения разработали новый вариант аденинфосфорибозилтрансферазы, штамм Corynebacterium stationis , содержащий данный вариант, и способ получения ИМФ с использованием данного штамма, посредством этого осуществляя настоящее раскрытие.
Техническое решение
Целью настоящего раскрытия является предоставление варианта аденинфосфорибозилтрансферазы, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 1, в которой аланин, представляющий собой аминокислоту, соответствующую положению 122 в аминокислотной последовательности SEQ ID NO: 3, заменен треонином.
Другой целью настоящего раскрытия является предоставление полинуклеотида, кодирующего вариант по настоящему раскрытию.
Еще одной другой целью настоящего раскрытия является предоставление штамма Corynebacterium stationis, который содержит вариант по настоящему раскрытию, или полинуклеотид, кодирующий данный вариант, и имеет способность к продуцированию ИМФ.
Еще одной другой целью настоящего раскрытия является предоставление способа получения ИМФ, который включает культивирование штамма Corynebacterium stationis, который содержит вариант по настоящему раскрытию, или полинуклеотид, кодирующий данный вариант, и имеет способность к продуцированию ИМФ в среде.
Полезные эффекты
В случае культивирования штамма Corynebacterium stationis, содержащего вариант аденинфосфорибозилтрансферазы по настоящему раскрытию, возможно получать ИМФ с более высоким выходом по сравнению со случаем существующих микроорганизмов, имеющих немодифицированные полипептиды.
Наилучший способ воплощения изобретения
Настоящее раскрытие будет подробно описано следующим образом. Тем временем, каждое из описаний и воплощений, раскрытых в настоящем раскрытии, можно применять к другим описаниям и воплощениям. Другими словами, все комбинации разных элементов, раскрытых в настоящем раскрытии, принадлежат к объему настоящего раскрытия. Кроме того, нельзя считать, что объем настоящего раскрытия ограничивается конкретным описанием, приведенным ниже. Кроме того, во всем настоящем описании изобретения приводятся ссылки целого ряда статей и патентных документов, и указываются их цитирования. Вся полнота содержания, раскрытого в процитированных статьях и патентных документах, включается в настоящее описание изобретения посредством ссылки для того, чтобы более ясно описать уровень технической области, к которой принадлежит настоящее изобретение, и содержание настоящего изобретения.
Согласно одному аспекту настоящего раскрытия предложен вариант аденинфосфорибозилтрансферазы, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 1, в которой аланин, представляющий собой аминокислоту, соответствующую положению 122 в аминокислотной последовательности SEQ ID NO: 3, заменен треонином.
Вариант по настоящему раскрытию может иметь, содержать, состоять или по существу состоять из аминокислотной последовательности, представленной SEQ ID NO: 1.
В варианте по настоящему раскрытию аминокислота, соответствующая положению 122 на основе аминокислотной последовательности SEQ ID NO: 3 в аминокислотной последовательности, представленной SEQ ID NO: 1, представляет собой треонин и может содержать аминокислотную последовательность, имеющую по меньшей мере 70%-ную, 75%-ную, 80%-ную, 85%-ную, 90%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную, 99%-ную, 99,5%-ную, 99,7%-ную или 99,9%-ную или большую гомологию или идентичность с аминокислотной последовательностью, представленной SEQ ID NO: 1. Очевидно то, что варианты, имеющие аминокислотные последовательности, в которых некоторые последовательности удалены, модифицированы, заменены, консервативно заменены или добавлены, также включаются в объем настоящего раскрытия, при условии, что аминокислотные последовательности имеют такую гомологию или идентичность и демонстрируют эффективность, соответствующую эффективности варианта по настоящему раскрытию.
Его примеры включают варианты, имеющие присоединение или делецию последовательности, которые не изменяют функцию варианта по настоящему раскрытию, на N-конце, С-конце аминокислотной последовательности и/или внутри данной аминокислотной последовательности, встречающуюся в природе мутацию, молчащую мутацию или консервативную замену.
Термин «консервативная замена» означает замену одной аминокислоты другой аминокислотой, имеющей аналогичные структурные и/или химические свойства. Такая аминокислотная замена обычно может существовать на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков. Обычно консервативная замена может слегка влиять или не влиять на активность белков или полипептидов.
В настоящем раскрытии термин «вариант» относится к полипептиду, который имеет аминокислотную последовательность отличную от аминокислотной последовательности данного варианта перед изменением посредством консервативной замены и/или модификации одной или более чем одной аминокислоты, но сохраняет функции или свойства. Такой вариант обычно может быть идентифицирован посредством модифицирования одной или более чем одной аминокислоты аминокислотной последовательности данного полипептида и осуществления оценки свойств данного модифицированного полипептида. Другими словами, способность данного варианта может быть увеличена, оставлена неизменной или снижена по сравнению со способностью полипептида перед изменением. Некоторые варианты могут включать варианты, в которых одна или более чем одна часть, такая как N-концевая лидерная последовательность или трансмембранный домен, были удалены. Другие варианты могут включать варианты, в которых была удалена часть N- и/или С-конца от зрелого белка. Термин «вариант» можно использовать взаимозаменяемо с такими терминами, как модификация, модифицированный полипептид, модифицированный белок, мутант, мутеин и дивергент, и не ограничивается ими, при условии, что он представляет собой термин, используемый со значением вариации. В целях настоящего раскрытия данный вариант может представлять собой полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 1, в которой аланин, представляющий собой аминокислоту, соответствующую положению 122 в аминокислотной последовательности SEQ ID NO: 3, заменен треонином.
Данный вариант может содержать делеции или присоединения аминокислот, которые имеют минимальное влияние на свойства и вторичную структуру полипептида. Например, с N-концом данного варианта может быть конъюгирована сигнальная (или лидерная) последовательность, которая котрансляционно или посттрансляционно участвует в транслокации белка. Данный вариант может быть конъюгирован с другими последовательностями или линкерами таким образом, чтобы его идентифицировать, очищать или синтезировать.
В настоящем раскрытии термин «гомология» или «идентичность» означает степень сходства между двумя данными аминокислотными последовательностями или последовательностями оснований и может выражаться в виде процентной доли. Термины «гомология» и «идентичность» часто могут использоваться взаимозаменяемо.
Гомологию или идентичность последовательности консервативного полинуклеотида или полипептида определяют стандартными алгоритмами выравнивания, и можно совместно использовать штраф за пропуск по умолчанию, установленный применяемой программой. По существу гомологичные или идентичные последовательности обычно способны к гибридизации со всей или с частью последовательности при условиях умеренной или высокой жесткости. Очевидно, что гибридизация также включает гибридизацию полинуклеотида с полинуклеотидом, содержащим кодон общего типа или вырожденный кодон.
Имеют ли любые две последовательности полинуклеотида или полипептида гомологию, сходство или идентичность, можно определять с использованием известных компьютерных алгоритмов, таких как программа «FASTA», например, с использованием параметров по умолчанию как в Pearson et al, (1988) Proc. Natl. Acad Sci USA;. 85:2444. В качестве альтернативы, гомология, сходство или идентичность могут быть определены с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-153), как осуществляется в программе Нидлмана пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al, 2000, Trends Genet. 16:276-277) (версия 5.0.0 или более поздняя) (включая программный пакет GCG (Devereux, J., et al., Nucleic Acids Research 12:387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S. F., et al, J MOLEC BIOL 215:403 (1990); Guide to Huge Computers , Martin J. Bishop, ed., Academic Press, San Diego, 1994; и CARILLO et al, (1988) SIAM J Applited Math 48:1073). Например, для определения гомологии, сходства или идентичности можно использовать BLAST Национального центра биотехнологической информации или ClustalW.
Гомологию, сходство или идентичность полинуклеотидов или полипептидов можно определять посредством сравнения информации по последовательности с использованием, например, компьютерной программы GAP, как, например, Needleman et al. (1970), J Mol Biol. 48:443, как анонсировано, например, в Smith and Waterman, Adv. Appl Math (1981) 2:482. В заключение, результат программы GAP может быть определен как значение, полученное делением числа аналогичных выровненных символов (а именно: нуклеотидов или аминокислот) на общее число символов в более короткой из двух последовательностей. Параметры по умолчанию программы GAP могут включать (1) матрицу двоичных сравнений (включающую значения 1 для идентичности и 0 для неидентичности) и матрицу взвешенных сравнений Gribskov et al., (1986) Nucl .Acids Res. 14:6745 (или матрицу замен EDNAFULL (EMBOSS версии NCBI NUC4.4)), как раскрыто в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp.353-358 (1979); (2) штраф 3,0 для каждого пропуска и дополнительный штраф 0,10 для каждого символа в каждом пропуске (или штраф 10 за открытие пропуска, штраф 0,5 за удлинение пропуска); и (3) отсутствие штрафа за концевые пропуски.
В качестве примера по настоящему раскрытию, вариант по настоящему раскрытию может демонстрировать аденинфосфорибозилтрансферазную активность. Вариант по настоящему раскрытию может демонстрировать активность таким образом, чтобы иметь повышенную способность к образованию ИМФ по сравнению с полипептидом дикого типа, демонстрирующим аденинфосфорибозилтрансферазную активность.
В настоящем раскрытии термин «аденинфосфорибозилтрансфераза» относится к ферменту, который катализирует реакцию реутилизации с образованием АМФ, которая требует меньше энергии, чем синтез de novo. В частности, термин «аденинфосфорибозилтрансфераза» по настоящему раскрытию может использоваться взаимозаменяемо с «Apt». В настоящем раскрытии последовательность аденинфосфорибозилтрансферазы может быть получена из GenBank NCBI - известной базы данных. В частности, аденинфосфорибозилтрансфераза может представлять собой полипептид, имеющий активность аденинфосфорибозилтрансферазы, кодируемой геном apt, но не ограничивается им.
В настоящем раскрытии термин «соответствующий» относится к аминокислотным остаткам в положениях, перечисленных в полипептиде, или к аминокислотным остаткам, которые являются аналогичными, идентичными или гомологичными остаткам, перечисленным в данном полипептиде. Идентификация аминокислоты в соответствующем положении может определяться специфической аминокислотой в последовательности, которая относится к специфической последовательности. Термин «соответствующая область» в том виде, в котором он здесь используется, обычно относится к аналогичному или соответствующему положению в родственном белке или эталонном белке.
Например, произвольная аминокислотная последовательность выравнивается с SEQ ID NO: 3, и, на основе этого, каждый аминокислотный остаток данной аминокислотной последовательности может быть пронумерован по отношению к аминокислотному остатку SEQ ID NO: 3 и числовому положению соответствующего аминокислотного остатка. Например, алгоритм выравнивания последовательности, как описано в настоящем раскрытии, может определять положение аминокислоты или положение, в котором происходит модификация, такая как замена, вставка или делеция, посредством сравнения с положением в запрашиваемой последовательности (также именуемой «эталонная последовательность»).
Для таких выравниваний, например, можно использовать алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), программу Нидлмана пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al, 2000, Trends Genet. 16:276-277) и тому подобные, но программа и алгоритм не ограничиваются ими, и подходящим образом можно использовать программу выравнивания последовательностей, алгоритм попарного сравнения последовательностей и тому подобное, известные в данной области.
Другим аспектом настоящего раскрытия является предоставление полинуклеотида, кодирующего вариант по настоящему раскрытию.
В настоящем раскрытии термин «полинуклеотид» представляет собой цепочку ДНК или РНК, имеющую определенную или большую длину, в качестве полимера нуклеотидов, в котором нуклеотидные мономеры соединяются в длинную цепь ковалентными связями, и, более конкретно, означает фрагмент полинуклеотида, кодирующий данный вариант.
Полинуклеотид, кодирующий вариант по настоящему раскрытию, может содержать последовательность оснований, кодирующую аминокислотную последовательность, представленную SEQ ID NO: 1. В качестве примера по настоящему раскрытию полинуклеотид по настоящему раскрытию может иметь или содержать последовательность SEQ ID NO: 2. Полинуклеотид по настоящему раскрытию может состоять или по существу состоять из последовательности SEQ ID NO: 2.
В полинуклеотиде по настоящему раскрытию могут быть сделаны разные модификации в кодирующей области при условии, что аминокислотная последовательность варианта по настоящему раскрытию не изменяется при рассмотрении вырожденности предпочтительных кодонов в организмах, которые предназначены для экспрессии варианта по настоящему раскрытию. В частности, полинуклеотид по настоящему раскрытию имеет или содержит последовательность оснований, имеющую 70%-ную или большую, 75%-ную или большую, 80%-ную или большую, 85%-ную или большую, 90%-ную или большую, 95%-ную или большую, 96%-ную или большую, 97%-ную или большую, 98%-ную или большую, но менее, чем 100%-ную гомологию или идентичность с последовательностью SEQ ID NO: 2 или может состоять или по существу состоять из последовательности оснований, имеющей 70%-ную или большую, 75%-ную или большую, 80%-ную или большую, 85%-ную или большую, 90%-ную или большую, 95%-ную или большую, 96%-ную или большую, 97%-ную или большую, 98%-ную или большую, но менее, чем 100%-ную гомологию или идентичность с последовательностью SEQ ID NO: 2, но не ограничиваясь ей. Здесь в последовательности, имеющей гомологию или идентичность, кодон, кодирующий аминокислоту, соответствующую положению 122 в SEQ ID NO: 1, может представлять собой один из кодонов, кодирующих треонин.
Полинуклеотид по настоящему раскрытию может содержать зонд, который может быть получен из последовательности известного гена, например, последовательности без ограничения при условии, что она представляет собой последовательность, которая может гибридизоваться с комплементарной последовательностью всей или части последовательности полинуклеотида по настоящему раскрытию в жестких условиях. «Жесткие условия» означают условия, которые обеспечивают специфичную гибридизацию между полинуклеотидами. Данные условия конкретно описаны в документах (см. J. Sambrook et al, Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al, Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York, 9.50-9.51, 11.7-11.8). Их примеры включают условия, при которых полинуклеотиды, имеющие более высокую гомологию или идентичность, а именно: полинуклеотиды, имеющие 70%-ную или большую, 75%-ную или большую, 80%-ную или большую, 85%-ную или большую, 90%-ную или большую, 95%-ную или большую, 96%-ную или большую, 97%-ную или большую, 98%-ную или большую, или 99%-ную или большую гомологию или идентичность, гибридизуются друг с другом, тогда как полинуклеотиды, имеющие меньшую гомологию или идентичность, не гибридизуются друг с другом, или условия, при которых промывка осуществляется один раз, в частности, от двух до трех раз при концентрации соли и температуре, эквивалентных 60°С, 1×SSC (раствор цитрата и хлорида натрия), 0,1% SDS (додецилсульфат натрия), в частности, при 60°С, 0,1×SSC, 0,1% SDS, более конкретно, при 68°С, 0,1×SSC, 0,1% SDS, которые представляют собой условия промывки для обычной гибридизации по Саузерну.
Для гибридизации требуется то, чтобы две нуклеиновые кислоты имели комплементарные последовательности, хотя и допускаются несоответствия между основаниями, в зависимости от жесткости гибридизации. Термин «комплементарный» используется для описания связи между нуклеотидными основаниями, способными к гибридизации друг с другом. Например, в отношении ДНК, аденин является комплементарным тимину, а цитозин является комплементарным гуанину. Следовательно, полинуклеотид по настоящему раскрытию также может содержать по существу аналогичные последовательности нуклеиновой кислоты, а также фрагменты выделенной нуклеиновой кислоты, которые являются комплементарными всей последовательности.
В частности, полинуклеотид, имеющий гомологию или идентичность с полинуклеотидом по настоящему раскрытию, может быть выявлен с использованием условий гибридизации, включая стадию гибридизации при значении Tm 55°С и вышеописанных условиях. Значение Tm может составлять 60°С, 63°С или 65°С, но не ограничивается ими, и может подходящим образом корректироваться специалистами в данной области согласно цели.
Подходящая жесткость для гибридизации полинуклеотида зависит от длины и степени комплементарности данного полинуклеотида, и переменные хорошо известны в данной области (например, J. Sambrook et al, Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989).
Другим аспектом настоящего раскрытия является предложение вектора, содержащего полинуклеотид по настоящему раскрытию. Данный вектор может представлять собой экспрессионный вектор для осуществления экспрессии полинуклеотида в клетке-хозяине, но не ограничивается им.
Вектор по настоящему раскрытию может включать ДНК-конструкцию, содержащую последовательность полинуклеотида, кодирующую интересующий полипептид, связанный функциональным образом с подходящей регуляторной областью экспрессии (или последовательностью контроля экспрессии) таким образом, что интересующий полипептид может экспрессироваться в подходящем хозяине. Регуляторная область экспрессии может содержать промотор, способный инициировать транскрипцию, любую последовательность оператора для осуществления контроля транскрипции, последовательность, кодирующую подходящий сайт связывания мРНК с рибосомой, и последовательность, контролирующую терминацию транскрипции и трансляции. Данный вектор можно трансформировать в подходящую клетку-хозяина, и затем он может реплицироваться или функционировать независимо от генома хозяина, или может сам интегрироваться в геном.
Вектор, используемый в настоящем раскрытии, конкретно не ограничивается, но можно использовать любой вектор, известный в данной области. Примеры обычно используемых векторов включают природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора можно использовать pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A, Charon21A и тому подобные, и в качестве плазмидного вектора можно использовать систему pDZ, систему pBR, систему pUC, систему pBluescript II, систему pGEM, систему pTZ, систему pCL, систему рЕТ и тому подобные. В частности, можно использовать векторы pDZ, pDC, pDCM2, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 и pCC1BAC, и тому подобные.
Например, полинуклеотид, кодирующий интересующий полипептид, можно вставлять в хромосому посредством вектора для внутриклеточной хромосомной вставки. Вставку данного полинуклеотида в хромосому можно осуществлять любым способом, известным в данной области, например, гомологичной рекомбинацией, но не ограничиваясь ей. Данный вектор может дополнительно содержать селективный маркер для подтверждения вставки в хромосому. Данный селективный маркер служит для отбора клеток, трансформированных векторами, то есть, для подтверждения вставки интересующей молекулы нуклеиновой кислоты, и можно использовать маркеры, которые придают селектируемые фенотипы, такие как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к цитотоксическим агентам или экспрессия поверхностных полипептидов. В среде при обработке селективным агентом выживают или демонстрируют другие фенотипические признаки только клетки, экспрессирующие селективный маркер, и, таким образом, могут быть отобраны трансформированные клетки.
В настоящем раскрытии термин «трансформация» означает то, что вектор, содержащий полинуклеотид, кодирующий целевой полипептид, вводится в клетку-хозяина или микроорганизм таким образом, что полипептид, кодируемый данным полинуклеотидом, может экспрессироваться в клетке-хозяине. Трансформированный полинуклеотид может локализоваться посредством вставки в хромосому клетки-хозяина или локализоваться вне хромосомы, при условии, что он может экспрессироваться в данной клетке-хозяине. Данный полинуклеотид содержит ДНК и/или РНК, кодирующую интересующий полипептид. Данный полинуклеотид может быть введен в любой форме, при условии, что он может быть введен в клетку-хозяина и может экспрессироваться. Например, данный полинуклеотид может быть введен в клетку-хозяина в виде экспрессионной кассеты, которая представляет собой генетическую конструкцию, содержащую все элементы, требующиеся для автономной экспрессии. Данная экспрессионная кассета обычно может содержать промотор, связанный функциональным образом с полинуклеотидом, сигнал терминации транскрипции, сайт связывания рибосомы и сигнал терминации трансляции. Данная экспрессионная кассета может находиться в виде экспрессионного вектора, способного к автономной репликации. Полинуклеотид может быть введен в клетку-хозяина сам по себе и связан функциональным образом с последовательностью, требующейся для экспрессии в клетке-хозяине, но не ограничиваясь ей.
В приведенном выше термин «связанный функциональным образом» означает то, что последовательность полинуклеотида функционально связана с последовательностью промотора, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего интересующий вариант по настоящему раскрытию.
Еще одним другим аспектом настоящего раскрытия является предложение штамма Corynebacterium stationis, который содержит вариант по настоящему раскрытию или полинуклеотид по настоящему раскрытию.
Штамм по настоящему раскрытию может содержать модифицированный полипептид по настоящему раскрытию, полинуклеотид, кодирующий данный полипептид, или вектор, содержащий полинуклеотид по настоящему раскрытию.
В настоящем раскрытии «штамм (или микроорганизм)» включает все микроорганизмы дикого типа или естественно или искусственно генетически модифицированные микроорганизмы, и он может представлять собой микроорганизм, в котором ослаблен или усилен специфический механизм из-за вставки внешнего гена или усиления активности, или инактивации эндогенного гена, и он может представлять собой микроорганизм, содержащий генетическую модификацию для продуцирования интересующего полипептида, белка или продукта.
Штамм по настоящему раскрытию может представлять собой штамм, содержащий любой один или более чем один вариант по настоящему раскрытию, полинуклеотид по настоящему раскрытию или вектор, содержащий полинуклеотид по настоящему раскрытию; штамм, модифицированный для экспрессии варианта по настоящему раскрытию или полинуклеотида по настоящему раскрытию; штамм (например, рекомбинантный штамм), экспрессирующий вариант по настоящему раскрытию или полинуклеотид по настоящему раскрытию; или штамм (например, рекомбинантный штамм), демонстрирующий активность варианта по настоящему раскрытию, но не ограничивается ими.
Штамм по настоящему раскрытию может представлять собой штамм, имеющий способность к продуцированию 5'-инозинмонофосфата (ИМФ).
Штамм по настоящему раскрытию может представлять собой микроорганизм, имеющий в природе аденинфосфорибозилтрансферазу или способность к продуцированию ИМФ, или микроорганизм, в котором вариант по настоящему раскрытию или полинуклеотид, кодирующий данный вариант (или вектор, содержащий данный полинуклеотид), вводят в родительский штамм, который не имеет аденинфосфорибозилтрансферазы или способности к продуцированию ИМФ, и/или в котором способность к продуцированию ИМФ придается родительскому штамму, но не ограничивается им.
Например, штамм по настоящему раскрытию представляет собой клетку или микроорганизм, который трансформирован вектором, содержащим полинуклеотид по настоящему раскрытию, или полинуклеотидом, кодирующим вариант по настоящему раскрытию, и экспрессирует вариант по настоящему раскрытию. В целях настоящего раскрытия штамм по настоящему раскрытию может включать все микроорганизмы, которые содержат вариант по настоящему раскрытию и могут продуцировать ИМФ. Например, штамм по настоящему раскрытию может представлять собой рекомбинантный штамм, в котором полинуклеотид, кодирующий вариант по настоящему раскрытию, вводят в природный микроорганизм дикого типа или микроорганизм, продуцирующий ИМФ, для того, чтобы, таким образом, экспрессировать вариант аденинфосфорибозилтрансферазы и иметь повышенную способность к продуцированию ИМФ. Рекомбинантный штамм, имеющий повышенную способность к продуцированию ИМФ, может представлять собой микроорганизм, имеющий повышенную способность к продуцированию ИМФ по сравнению с природным микроорганизмом дикого типа или микроорганизмом, не модифицированным аденинфосфорибозилтрансферазой (а именно: микроорганизмом, экспрессирующим аденинфосфорибозилтрансферазу дикого типа (SEQ ID NO: 3), или микроорганизмом, который не экспрессирует модифицированный белок (SEQ ID NO: 1), но не ограничивается им. Например, штамм по настоящему раскрытию, имеющий повышенную способность к продуцированию ИМФ, может представлять собой микроорганизм, имеющий повышенную способность к продуцированию ИМФ по сравнению с Corynebacterium stationis, которая содержит полипептид SEQ ID NO: 3 или полинуклеотид, кодирующий данный полипептид, но не ограничивается им. В качестве примера, микроорганизм, не модифицированный аденинфосфорибозилтрансферазой, который представляет собой целевой штамм для сравнения увеличения способности к продуцированию ИМФ, может представлять собой штамм СЛ2332 (KCCM12277P, KR 10-1950141 В1), но не ограничивается им.
Например, рекомбинантный штамм, имеющий повышенную способность к продуцированию, может иметь способность к продуцированию ИМФ, повышенную примерно на 1% или более, в частности, примерно на 1% или более, примерно на 2,5% или более, примерно на 5% или более, примерно на 6% или более, примерно на 7% или более, примерно на 8% или более, примерно на 9% или более, примерно на 10% или более, примерно на 11% или более, примерно на 11,5% или более, примерно на 12% или более, примерно на 12,5% или более, примерно на 13% или более, примерно на 13,5% или более, примерно на 14% или более, примерно на 14,5% или более, примерно на 15% или более, примерно на 15,5% или более, примерно на 16% или более, примерно на 16,5% или более, примерно на 17% или более, примерно на 17,5% или более, примерно на 18% или более, примерно на 18,5% или более, примерно на 19% или более, примерно на 19,5% или более, примерно на 20% или более, примерно на 20,5% или более, примерно на 21% или более, примерно на 21,5% или более, примерно на 22% или более, примерно на 22,5% или более, примерно на 23% или более, примерно на 23,5% или более, примерно на 24% или более, примерно на 24,5% или более, примерно на 24,6% или более, примерно на 24,7% или более, примерно на 24,8% или более, или примерно на 24,9% или более (верхняя граница конкретно не ограничивается и может составлять, например, примерно 200% или менее, примерно 150% или менее, примерно 100% или менее, примерно 50% или менее, примерно 40% или менее, или примерно 30% или менее) по сравнению со способностью к продуцированию ИМФ родительского штамма перед изменением или с немодифицированным микроорганизмом, но повышенное значение не ограничивается им, при условии, что способность к продуцированию имеет повышенное значение плюс значения по сравнению со способностью к продуцированию родительского штамма перед изменением или с немодифицированным микроорганизмом. В другом примере рекомбинантный штамм, имеющий повышенную способность к продуцированию, может иметь способность к продуцированию ИМФ, увеличенную примерно в 1,01 раза или более, примерно в 1,02 раза или более, примерно в 1,03 раза или более, примерно в 1,05 раза или более, примерно в 1,06 раза или более, примерно в 1,07 раза или более, примерно в 1,08 раза или более, примерно в 1,09 раза или более, примерно в 1,10 раза или более, примерно в 1,11 раза или более, примерно в 1,12 раза или более, примерно в 1,13 раза или более, примерно в 1,14 раза или более, примерно в 1,15 раза или более, примерно в 1,16 раза или более, примерно в 1,17 раза или более, примерно в 1,18 раза или более, примерно в 1,19 раза или более, примерно в 1,20 раза или более, примерно в 1,21 раза или более, примерно в 1,22 раза или более, примерно в 1,23 раза или более, примерно в 1,24 раза или более, или примерно в 1,25 раза или более (верхняя граница конкретно не ограничивается и может, например, быть примерно в 10 раз или менее, примерно в 5 раз или менее, примерно в 3 раза или менее, или примерно в 2 раза или менее) по сравнению со способностью к продуцированию ИМФ родительского штамма перед изменением или с немодифицированным микроорганизмом, но данный показатель увеличения не ограничивается ими. Термин «примерно» представляет собой интервал, включающий все из плюс/минус 0,5; плюс/минус 0,4; плюс/минус 0,3; плюс/минус 0,2; плюс/минус 0,1 и тому подобных, и включает все значения в интервале, равные или аналогичные значению после термина «примерно», но не ограничивается ими.
В настоящем раскрытии «немодифицированный микроорганизм» не исключает штаммы, содержащие мутацию, которая может случаться у микроорганизмов в природе, и может представлять собой штамм дикого типа или сам природный штамм, или может представлять собой штамм перед изменением признака посредством генетической вариации из-за природных или искусственных факторов. Например, данный немодифицированный микроорганизм может представлять собой штамм, в который не вводится или еще не был введен вариант аденинфосфорибозилтрансферазы, описанный в настоящем описании изобретения. Термин «немодифицированный микроорганизм» можно использовать взаимозаменяемо с фразами «штамм перед модификацией», «микроорганизм перед модификацией», «неизмененный штамм», «немодифицированный штамм», «неизмененный микроорганизм» или «эталонный микроорганизм».
В другом примере настоящего раскрытия микроорганизм по настоящему раскрытию может представлять собой Corynebacterium stationis; Corynebacterium glutamicum,;Corynebacterium crudilactis, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium ammoniagenes, Corynebacterium pollutisoli, Corynebacterium imitans, Corynebacterium testudinoris или Corynebacterium flavescens..
В настоящем раскрытии «ослабление» активности полипептида включает оба случая, где активность снижена по сравнению с эндогенной активностью или отсутствует. Термин «ослабление» можно использовать взаимозаменяемо с такими терминами, как инактивация, недостаточность, понижающая регуляция, снижение, уменьшение и аттенуация.
Ослабление также может включать случай, когда активность самого полипептида снижена или устранена по сравнению с активностью полипептида, которым исходно обладал микроорганизм, посредством изменения полинуклеотида, кодирующего данный полипептид, и тому подобного, случай, где общие уровень активности и/или концентрация (уровень экспрессии) полипептида в клетке ниже по сравнению с уровнем активности или концентрацией природного штамма посредством ингибирования экспрессии гена полинуклеотида, кодирующего полипептид, или ингибирования трансляции в полипептид, случай, где данный полинуклеотид совсем не экспрессируется, и/или случай, где активность полипептида не проявляется даже при экспрессии полинуклеотида. Термин «эндогенная активность» означает активность конкретного полипептида, которой исходно обладает родительский штамм перед изменением признака, или микроорганизм дикого типа или немодифицированный микроорганизм при изменении признака генетической вариацией из-за природных или искусственных факторов. Фразу «эндогенная активность» можно использовать взаимозаменяемо с фразой «активность перед модификацией». Тот факт, что активность полипептида является «инактивированной, недостаточной, пониженной, подвергнувшейся понижающей регуляции, сниженной или ослабленной» по сравнению с эндогенной активностью означает то, что активность полипептида снижается по сравнению с активностью конкретного полипептида, которой исходно обладал родительский штамм перед изменением признака или микроорганизм дикого типа, или немодифицированный микроорганизм.
Такое ослабление активности полипептида можно осуществлять любым способом, известным в данной области, но данный способ не ограничивается им, и ослабления можно достигнуть применением разных способов, хорошо известных в данной области (например, Nakashima N. et al., Bacterial cellular engineering by genome editing and gene silencing. Int J Mol Sci.. 2014; 15(2):2773-2793, Sambrook et al, Molecular Cloning 2012, и тому подобные).
В частности, ослабление активности полипептида в настоящем раскрытии может представлять собой:
1) делецию всего гена, кодирующего полипептид, ч или его части;
2) модификацию экспрессии регуляторной области (или экспрессии контрольной последовательности) для уменьшения экспрессии гена, кодирующего полипептид;
3) модификацию аминокислотной последовательности, составляющей полипептид, для устранения или ослабления активности полипептида (например, делеции/замены/присоединения одной или более чем одной аминокислоты в аминокислотной последовательности);
4) модификацию последовательности гена, кодирующей полипептид, для устранения или ослабления активности данного полипептида (например, делеция/замена/присоединение одного или более чем одного основания нуклеиновой кислоты в последовательности оснований нуклеиновой кислоты гена полинуклеотида для кодирования полипептида, который был модифицирован для устранения или ослабления активности данного полипептида);
5) модификацию инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей 5'-UTR (5'-нетранслируемая область) область;
6) введение антисмыслового олигонуклеотида (например, антисмысловой РНК), который комплементарно связывается с транскриптом гена, кодирующего полипептид;
7) добавление последовательности, комплементарной последовательности Шайна-Дальгарно, перед последовательностью Шайна-Дальгарно гена, кодирующего полипептид, для того, чтобы образовать вторичную структуру, к которой не может присоединяться рибосома;
8) добавление промотора, подлежащего транскрипции в противоположном направлении относительно 3'-конца открытой рамки считывания (ORF) последовательности гена, кодирующей полипептид (инженерия обратной транскрипции, RTE); или
9) комбинацию двух или более чем двух, выбранных из (1) - (8), но, в частности, не ограничивается ими.
Например:
1) Делецией части или всего гена, кодирующего полипептид, может быть удаление всего полинуклеотида, кодирующего интересующий эндогенный полипептид в хромосоме, замена полинуклеотидом, в котором некоторые нуклеотиды делетированы, или замена маркерным геном.
2) Модификацией регуляторной области экспрессии (или последовательности контроля экспрессии) может быть делеция, вставка, неконсервативная или консервативная замена, или появление изменения в регуляторной области экспрессии (или последовательности контроля экспрессии) из-за их комбинации, или замена последовательностью, демонстрирующей более слабую активность. Регуляторная область экспрессии содержит промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность, контролирующую терминацию транскрипции и трансляции, но не ограничивается ими.
3) и 4) Модификацией аминокислотной последовательности или последовательности полинуклеотида может быть делеция, вставка или неконсервативная, или консервативная замена аминокислотной последовательности полипептида или последовательности полинуклеотида, кодирующего данный полипептид, или появление изменения в последовательности из-за их комбинации, или замена аминокислотной последовательностью или последовательностью полинуклеотида, модифицированной для демонстрации более слабой активности, или аминокислотной последовательностью или последовательностью полинуклеотида, модифицированной для того, чтобы быть неактивной, таким образом, что активность полипептида ослабевает, но не ограничивается ими. Например, экспрессия гена может ингибироваться или быть ослаблена посредством введения в последовательность полинуклеотида изменения и образования терминирующего кодона, но модификация не ограничивается им.
5) Модификацией инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей 5'-UTR область, может быть, например, замена последовательностью оснований, кодирующей другой инициирующий кодон, имеющий меньшую скорость экспрессии полипептида по сравнению с эндогенным инициирующим кодоном, но не ограничивается ей.
6) Для введения антисмыслового олигонуклеотида (например, антисмысловой РНК), который комплементарно связывается с транскриптом гена, кодирующего полипептид, можно сделать ссылку на документы, например, Weintraub, Н. et al, Antisense-RNA as a molecular tool for genetic analysis, Peviews-Trends in Genetics, Vol. 1(1) 1986.
7) Добавление последовательности, комплементарной последовательности Шайна-Дальгарно, перед последовательностью Шайна-Дальгарно, гена, кодирующего полипептид, для того, чтобы образовать вторичную структуру, к которой не может присоединиться рибосома, для того, чтобы сделать невозможной трансляцию мРНК или для замедления скорости трансляции мРНК.
8) Добавление промотора, подлежащего транскрипции в противоположном направлении относительно 3'-конца открытой рамки считывания (ORF) последовательности гена, кодирующего полипептид (инженерия обратной транскрипции, RTE), может служить для ослабления активности посредством получения антисмыслового нуклеотида, комплементарного транскрипту гена, кодирующего полипептид.
В настоящем раскрытии термин «усиление» активности полипептида означает то, что активность полипептида увеличивается по сравнению с эндогенной активностью. Термин «усиление» может использоваться взаимозаменяемо с такими терминами, как активация, повышающая регуляция, сверхэкспрессия и увеличение. Здесь активация, усиление, повышающая регуляция, сверхэкспрессия и увеличение могут включать как демонстрирование активности, которой исходно не обладали, так и демонстрирование улучшенной активности по сравнению с эндогенной активностью или активностью перед модификацией. Термин «эндогенная активность» означает активность конкретного полипептида, которой исходно обладал родительский штамм, перед изменением признака или немодифицированный микроорганизм при изменении признака посредством генетической вариации из-за природных или искусственных факторов. Это можно использовать взаимозаменяемо с «активностью перед модификацией». Тот факт, что активность полипептида «усиливается», «подвергается повышающей регуляции», «сверхэкспрессируется» или «увеличивается» по сравнению с эндогенной активностью означает то, что активность полипептида улучшается по сравнению с активностью и/или концентрацией (уровнем экспрессии) конкретного полипептида, которой исходно обладает родительский штамм перед изменением признака или немодифицированный микроорганизм.
Данное усиление может достигаться посредством введения чужеродного полипептида или усиления эндогенной активности и/или концентрации (уровня экспрессии) данного полипептида. Усиление активности полипептида может быть подтверждено увеличением степени активности и уровня экспрессии полипептида или количества продукта, продуцируемого из данного полипептида.
Для усиления активности полипептида можно применять разные способы, хорошо известные в данной области, и данный способ не ограничивается, при условии, что активность интересующего полипептида может быть усилена по сравнению с активностью микроорганизма до модификации. В частности, можно использовать генную инженерию и/или белковую инженерию, хорошо известные специалистам в данной области, которые представляют собой традиционные способы молекулярной биологии, но данный способ не ограничивается ими (например, Sitnicka et al, Functional Analysis of Genes. Advances in Cell Biology 2010, Vol. 2. 1-16; Sambrook et al, Molecular Cloning 2012; и тому подобные).
В частности, усиление активности полипептида по настоящему раскрытию может представлять собой:
1) увеличение числа внутриклеточных копий полинуклеотида, кодирующего полипептид;
2) замену регуляторной области экспрессии гена на хромосоме, кодирующей полипептид, последовательностью, демонстрирующей сильную активность;
3) модификацию инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей 5'-UTR область;
4) модификацию аминокислотной последовательности полипептида для увеличения активности данного полипептида;
5) модификацию последовательности полинуклеотида, кодирующей полипептид, для усиления активности данного полипептида (например, модификацию последовательности полинуклеотида гена полипептида для кодирования полипептида, который был модифицирован для усиления активности данного полипептида);
6) введение чужеродного полипептида, демонстрирующего активность данного полипептида, или чужеродного полинуклеотида, кодирующего данный полипептид;
7) оптимизацию кодонов полинуклеотида, кодирующего полипептид;
8) анализ третичной структуры полипептида для отбора и модификации или химической модификации экспонированного сайта; или
9) комбинацию двух или более чем двух, выбранных из 1) - 8), но конкретно не ограничиваясь ими.
Более конкретно:
1) Увеличение числа внутриклеточных копий полинуклеотида, кодирующего полипептид, может быть достигнуто посредством введения в клетку-хозяина вектора, который может реплицироваться и функционировать независимо от хозяина, и с которым полинуклеотид, кодирующий данный полипептид, связан функциональным образом. В качестве альтернативы, увеличение может быть достигнуто введением одной копии или двух или более чем двух копий полинуклеотида, кодирующего данный полипептид, в хромосому клетки-хозяина. Введение в хромосому может осуществляться введением вектора, способного вставлять полинуклеотид в хромосому клетки-хозяина, в клетку-хозяина, но не ограничивается им. Данный вектор является таким, как описано выше.
2) Замена регуляторной области экспрессии гена (или контрольной последовательности экспрессии) на хромосоме, кодирующей полипептид, последовательностью, демонстрирующей более сильную активность, может представлять собой, например, делецию, вставку, неконсервативную или консервативную замену или появление изменения в последовательности из-за их комбинации, или замена последовательности, демонстрирующей более сильную активность, таким образом, что активность регуляторной области экспрессии дополнительно усиливается. Регуляторная область экспрессии конкретно не ограничивается ими, но может содержать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, последовательность, контролирующую терминацию транскрипции и трансляции и тому подобные. Например, замена может представлять собой замену исходного промотора сильным промотором, но не ограничивается ей.
Примеры известных сильных промоторов включают промоторы CJ1-CJ7 (US 7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL, промотор tet, промотор gapA, промотор SPL7, промотор SPL13 (sm3) (US 10584338 В2), промотор O2 (US 10273491 В2), промотор tkt и промотор уссА, но не ограничиваются ими.
3) Модификация инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей область 5'-UTR, может представлять собой, например, замену последовательностью оснований, кодирующей другой инициирующий кодон, имеющий более высокую скорость экспрессии полипептида по сравнению с эндогенным инициирующим кодоном, но не ограничивается ей.
4) и 5) Модификация аминокислотной последовательности или последовательности полинуклеотида может представлять собой делецию, вставку, неконсервативную или консервативную замену аминокислотной последовательности полипептида или последовательности полинуклеотида, кодирующей данный полипептид, или появление изменения в данной последовательности из-за их комбинации или замены аминокислотной последовательности или последовательности полинуклеотида, модифицированной для демонстрации более сильной активности, или аминокислотной последовательности или последовательности полинуклеотида, модифицированной для того, чтобы быть более активной, таким образом, что активность данного полипептида усиливается, но не ограничивается ими. Данная замена может конкретно осуществляться посредством вставки полинуклеотида в хромосому гомологичной рекомбинацией, но не ограничивается ей. Используемый здесь вектор может дополнительно содержать селективный маркер для подтверждения вставки в хромосому. Селективный маркер является таким, как описано выше.
6) Введение чужеродного полипептида, демонстрирующего активность полипептида, может представлять собой введение в клетку-хозяина чужеродного полинуклеотида, кодирующего полипептид, демонстрирующий такую же или аналогичную данному полипептиду активность. Данный чужеродный полинуклеотид не ограничивается по его происхождению или последовательности при условии, что он демонстрирует такую же или аналогичную данному полипептиду активность. Введение может осуществляться посредством подходящего выбора способа трансформации, известного специалистам в данной области. Поскольку введенный полинуклеотид экспрессируется в клетке-хозяине, может продуцироваться полипептид и может увеличиваться его активность.
7) Оптимизация кодонов полинуклеотида, кодирующего полипептид, может представлять собой оптимизацию кодонов эндогенного полинуклеотида таким образом, чтобы увеличивать транскрипцию или трансляцию в клетке-хозяине, или оптимизацию кодонов чужеродного полинуклеотида таким образом, чтобы осуществлять оптимизированную транскрипцию и трансляцию в клетке-хозяине.
8) Анализ третичной структуры полипептида для выбора и модификации или химическая модификация экспонированного сайта могут осуществляться, например, для определения шаблонного белка-кандидата согласно степени сходства последовательности посредством сравнения информации по последовательности полипептида, подлежащего анализу, с хранилищем информации по последовательностям известных белков базы данных для подтверждения структуры на основе этого и для выбора и модификации или химической модификации экспонированной части, подлежащей модификации или химической модификации.
Такое усиление активности полипептида может представлять собой увеличение активности или концентрации, или уровня экспрессии соответствующего полипептида на основе активности или концентрации полипептида, экспрессируемого в микробном штамме дикого типа или в микробном штамме перед модификацией, или увеличение количества продукта, продуцируемого из полипептида, но не ограничивается ими.
В микроорганизме по настоящему раскрытию частичная или полная модификация полинуклеотида может индуцироваться (а) гомологичной рекомбинацией с использованием вектора для вставки в хромосому в микроорганизме или геноме, редактируя с использованием генетически модифицированной нуклеазы (например, CRISPR-Cas9), и/или (б) обработкой светом, таким как ультрафиолетовые лучи и излучение, и/или химическими агентами, но не ограничиваясь ими. Способ осуществления модификации части или всего гена может включать способ с использованием технологии рекомбинантной ДНК. Например, посредством введения в микроорганизм нуклеотидной последовательности или вектора, содержащего нуклеотидную последовательность, гомологичную интересующему гену, для вызова гомологичной рекомбинации можно удалить часть гена или весь данный ген. Введенная нуклеотидная последовательность или вектор может содержать доминантный селективный маркер, но не ограничиваясь им.
В микроорганизме по настоящему раскрытию вариант, полинуклеотид, ИМФ и тому подобные являются такими, как описано в других аспектах.
Согласно еще одному другому аспекту настоящего раскрытия предложен способ получения ИМФ, который включает культивирование штамма Corynebacterium stationis, содержащего вариант по настоящему раскрытию или полинуклеотид по настоящему раскрытию в среде.
Способ получения ИМФ по настоящему раскрытию может включать культивирование штамма Corynebacterium stationis, содержащего вариант по настоящему раскрытию или полинуклеотид по настоящему раскрытию, или вектор по настоящему раскрытию, в среде.
В настоящем раскрытии термин «культивирование» означает выращивание штамма Corynebacterium stationis по настоящему раскрытию в условиях среды, контролируемых подходящим образом. Способ культивирования по настоящему раскрытию можно осуществлять в соответствии с подходящей средой и условиями культивирования, известными в данной области. Такой способ культивирования можно легко корректировать и использовать специалистами в данной области согласно выбранному штамму. В частности культивирование может быть периодическим, непрерывным и/или с подпиткой, но не ограничивается ими.
В настоящем раскрытии термин «среда» означает смешанное вещество, содержащее питательные вещества, требующиеся для культивирования штамма Corynebacterium stationis по настоящему раскрытию в качестве главного компонента, и данная среда поставляет питательные вещества, факторы роста и тому подобное, включая воду, которые являются незаменимыми для выживания и развития. В частности, в качестве среды и других условий культивирования, используемых для культивирования штамма Corynebacterium stationis по настоящему раскрытию, можно использовать любые без конкретного ограничения, при условии, что она представляет собой среду, используемую для обычного культивирования микроорганизмов. Штамм Corynebacterium stationis по настоящему раскрытию можно культивировать в обычной среде, содержащей правильные источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины, и тому подобное, при одновременном осуществлении контроля температуры, рН и тому подобного при аэробных условиях.
В частности, культуральную среду для штамма рода Corynebacterium можно найти в документе "Manual of Methods for General Bacteriology" by the American Society for Bacteriology (Washington, D.C., USA, 1981).
В настоящем раскрытии источники углерода включают углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, сахароза и мальтоза; сахароспирты, такие как маннит и сорбит; органические кислоты, такие как пировиноградная кислота, молочная кислота и лимонная кислота; аминокислоты, такие как глутаминовая кислота, метионин и лизин; и тому подобное. Можно использовать природные органические питательные вещества, такие как гидролизат крахмала, мелассу, сырую мелассу, рисовые отруби, маниок, остаток сахарного тростника и жидкий кукурузный экстракт. В частности, можно использовать углеводы, такие как глюкоза и стерилизованные предобработанные мелассы (а именно: мелассы, превращенные в восстанавливающий сахар), и можно использовать подходящие количества других источников углерода разными способами без ограничения. Данные источники углерода можно использовать одиночно или в комбинации с двумя или более чем двумя, но не ограничиваясь ими.
В качестве источников азота можно использовать неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония и нитрат аммония; и органические источники азота, такие как аминокислоты, такие как глутаминовая кислота, метионин и глутамин, пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыба или продукты ее разложения и обезжиренный соевый жмых или продукты его разложения. Данные источники азота можно использовать одиночно или в комбинации двух или более чем двух, но не ограничиваясь ими.
Источники фосфора могут включать монокалия фосфат, дикалия фосфат или натрийсодержащие соли, соответствующие им. В качестве неорганических соединений можно использовать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и тому подобное. Помимо них могут содержаться аминокислоты, витамины и/или подходящие предшественники, и тому подобное. Данные компоненты или предшественники можно добавлять в среду порционно или непрерывно, но способ добавления не ограничивается ими.
Во время культивирования штамма Corynebacterium stationis по настоящему раскрытию рН среды можно корректировать добавлением в данную среду надлежащим образом таких соединений, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Во время культивирования пенообразование можно подавлять посредством применения пеногасителя, такого как сложный полигликолевый эфир жирной кислоты. В среду можно инъецировать кислород или кислородсодержащий газ для поддержания аэробного состояния данной среды, или газ можно не инъецировать, или можно инъецировать газообразный азот, водород или диоксид углерода для того, чтобы поддерживать анаэробное и микроаэробное состояния, но способ поддержания данного состояния не ограничивается ими.
При культивировании по настоящему раскрытию можно поддерживать температуру культивирования от 20°С до 45°С, в частности, от 25°С до 40°С, и данный штамм можно культивировать в течение примерно от 10 до 160 часов, но условия культивирования не ограничиваются ими.
ИМФ, продуцируемый посредством культивирования по настоящему раскрытию, может секретироваться в среду или может оставаться в клетках.
Способ получения ИМФ по настоящему раскрытию может дополнительно включать стадию получения штамма Corynebacterium stationis по настоящему раскрытию, стадию приготовления среды для культивирования данного штамма или их комбинацию (в любом порядке), например, перед стадией культивирования.
Способ получения ИМФ по настоящему раскрытию может дополнительно включать стадию выделения ИМФ из среды в соответствии с культивированием (среда, подвергнувшаяся воздействию культуры) или из штамма Corynebacterium stationis по настоящему раскрытию. Стадия выделения может быть дополнительно включена после стадии культивирования.
Выделение может служить для сбора интересующего ИМФ посредством подходящего способа, известного в данной области, согласно способу культивирования микроорганизма по настоящему раскрытию, например, способу периодического, непрерывного культивирования или культивирования с подпиткой. Например, можно использовать центрифугирование, фильтрование, обработку осадителем кристаллизованного белка (высаливание), экстракцию, ультразвуковое разрушение, ультрафильтрацию, диализ, разные виды хроматографии, такие как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография и аффинная хроматография, ВЭЖХ (высокоэффективная жидкостная хроматография) или их комбинацию. Интересующий ИМФ можно выделять из среды или микроорганизма посредством подходящего способа, известного в данной области.
Способ получения ИМФ по настоящему раскрытию может дополнительно включать стадию очистки. Очистку можно осуществлять посредством подходящего способа, известного в данной области. В одном примере, когда способ получения ИМФ по настоящему раскрытию включает и стадию выделения, и стадию очистки, данные стадии выделения и очистки можно осуществлять непрерывно или прерывисто, независимо от порядка, или можно осуществлять одновременно, или посредством объединения в одну стадию, но способ осуществления данных стадий не ограничивается ими.
В способе по настоящему раскрытию вариант, полинуклеотид, вектор, штамм, ИМФ и тому подобное являются такими, как описано в других аспектах.
Еще одним другим аспектом настоящего раскрытия является предложение композиции для получения ИМФ, которая содержит штамм Corynebacterium stationis, содержащий вариант по настоящему раскрытию, полинуклеотид, кодирующий данный вариант, вектор, содержащий данный полинуклеотид, или полинуклеотид по настоящему раскрытию; среды, в которой культивировали данный штамм Corynebacterium stationis; или комбинации двух или более чем двух из них.
Композиция по настоящему раскрытию может дополнительно содержать произвольные подходящие эксципиенты, подлежащие обычному применению в композициях для получения ИМФ. Такие эксципиенты могут представлять собой, например, консервант, увлажнитель, диспергирующий агент, суспендирующий агент, буферизующий агент, стабилизатор или изотоничный агент, но не ограничиваются ими.
В композиции по настоящему раскрытию вариант, полинуклеотид, вектор, штамм, среда, ИМФ и тому подобные являются такими, как описано в других аспектах.
Способ осуществления изобретения
Ниже настоящее раскрытие будет более подробно описано посредством Примеров. Однако следующие Примеры являются лишь предпочтительными воплощениями для иллюстрации настоящего раскрытия и, таким образом, не предназначены для ограничения объема настоящего раскрытия ими. Тем не менее, технические вопросы, не описанные в настоящем описании изобретения, могут быть в достаточной степени поняты и легко воплощены специалистами в технической области настоящего раскрытия или в аналогичных технических областях.
Пример 1. Конструирование вектора для осуществления экспрессии варианта аденинфософрибозилтрансферазы в микроорганизме
Для того чтобы исследовать влияние на продукцию ИМФ варианта (А122Т, SEQ ID NO: 1), в котором аланин в положении 122 в аминокислотной последовательности аденинфософрибозилтрансферазы (SEQ ID NO: 3) заменен треонином, конструировали вектор для конструирования штамма, экспрессирующего данный вариант, следующим образом с использованием плазмиды pDCM2 (Корейская публикация №10-2020-0136813) для вставки и замены генов в хромосоме Corynebacterium.
ПЦР (полимеразная цепная реакция) проводили с использованием гДНК (геномная ДНК) Corynebacterium stationis АТСС6872 дикого типа в качестве матрицы и пары праймеров, имеющих последовательности SEQ ID NO: 5 и 6, и пары праймеров, имеющих последовательности SEQ ID NO: 7 и 8. Вновь проводили ПЦР с перекрывающимися праймерами с использованием смеси двух фрагментов, полученных выше, в качестве матрицы и пары праймеров, имеющих последовательности SEQ ID NO: 5 и 8, для получения фрагмента. ПЦР проводили следующим образом: денатурация при 94°С в течение 5 минут; 30 циклов при 94°С в течение 30 секунд, 55°С в течение 30 секунд, 72°С в течение 1 минуты 30 секунд; и 72°С в течение 5 минут. Вектор pDCM2 обрабатывали SmaI, и ПЦР-продукт, полученный выше, клонировали в него слиянием. Клонирование слиянием проводили с использованием набора для клонирования In-Fusion® HD (Clontech). Полученную плазмиду называли pDCM2-apt(A122T).
Пример 2. Оценка способности к продуцированию ИМФ микроорганизма, экспрессирующего вариант аденинфосфорибозилтрансферазы
2-1. Конструирование штамма для осуществления экспрессии варианта аденинфосфорибозилтрансферазы
Вектор, сконструированный в Примере 1, трансформировали в штамм Corynebacterium stationis СЛ2332 (KCCM12277P, KR 10-1950141 В1).
Штамм, в который был введен данный вариант, отбирали из штаммов, в которых происходила гомологичная рекомбинация с использованием SEQ ID NO: 9 и 10. Отобранный штамм называли CJI2332_apt_A122T.
2-2. Сравнение способности к продуцированию ИМФ штаммов, экспрессирующих вариант аденинфосфорибозилтрансферазы
Способность к продуцированию ИМФ анализировали посредством оценки титра ферментации в колбе каждого штамма, сконструированного в Примере 2-1, и контрольного родительского штамма.
Во-первых, каждый штамм инокулировали в пробирке с диаметром 18 мм, содержащей 2 мл среды для посева, и культивировали со встряхиванием в течение 24 часов при 30°С для применения в качестве раствора среды для посева. В 250 мл колбу с угловыми перегородками, содержащую 29 мл следующей продукционной среды (24 мл главной среды плюс 5 мл отдельной стерилизационной среды) инокулировали 2 мл раствора посевной культуры и культивировали при 170 об/мин в течение 72 часов при 30°С. После завершения культивирования способность к продуцированию ИМФ измеряли посредством ВЭЖХ (высокоэффективная жидкостная хроматография). Концентрация ИМФ в культуральном растворе для каждого из проанализированных штаммов и скорость увеличения концентрации ИМФ являются такими, как представлено в Таблице 1 ниже.
Среда для посева (рН 7,5)
Глюкоза 1%, пептон 1%, мясной экстракт 1%, дрожжевой экстракт 1%, хлорид натрия 0,25%, аденин 100 мг/л и гуанин 100 мг/л (на основе 1 литра дистиллированной воды).
Продукционная среда - основная среда (рН 7,5)
Дрожжевой экстракт 0,2%, глутамат натрия 0,1%, сульфат магния 1,2%, хлорид кальция 0,01%, сульфат железа 20 мг/л, сульфат марганца 20 мг/л, сульфат цинка 20 мг/л, сульфат меди 5 мг/л, L-цистеин 23 мг/л, бета-аланин 24 мг/л, никотиновая кислота 8 мг/л, биотин 45 мкг/л, тиамина гидрохлорид 5 мг/л, аденин 30 мг/л, глюкоза 2,55% и фруктоза 1,45% (на основе 1 литра дистиллированной воды).
Продукционная среда - отдельная стерилизационная среда (рН 7,5)
Фосфорная кислота (85%) 2,3%, гидроксид калия (45%) 2,55% (на основе 1 литра дистиллированной воды)
Данный эксперимент повторяли 3 раза, и средние значения его результатов анализа представлены в Таблице 1 ниже.
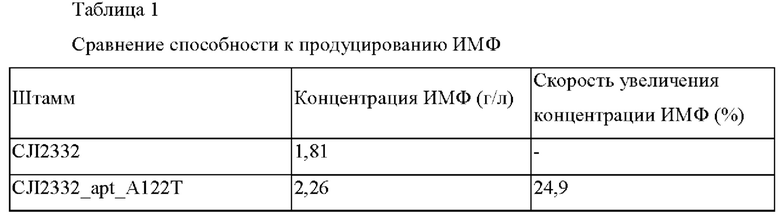
Как представлено в Таблице 1, штамм CJI2332_apt_A122T демонстрировал способность к продуцированию ИМФ, увеличенную на 24,9% по сравнению со способностью контрольной группы.
Из приведенного выше описания специалистам в технической области, к которой принадлежит настоящее раскрытие, будет понятно то, что настоящее раскрытие можно осуществлять в других конкретных формах без изменения его технической сущности и важных характеристик. В данном отношении следует понимать то, что воплощения, описанные выше, являются во всех отношениях иллюстративными и не ограничивающими. Объем настоящего раскрытия следует истолковывать как включающий все изменения или модифицированные формы, происходящие из значения и объема формулы изобретения, подлежащей описанию ниже, а не из приведенного выше подробного описания и эквивалентных ему идей.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> НОВЫЙ ВАРИАНТ АДЕНИНФОСФОРИБОЗИЛТРАНСФЕРАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ИМФ
С ЕГО ПРИМЕНЕНИЕМ
<130> OPA21259
<150> KR 10-2021-0055713
<151> 2021-04-29
<160> 10
<170> KoPatentIn 3.0
<210> 1
<211> 182
<212> PRT
<213> Artificial Sequence
<220>
<223> Apt_VT
<400> 1
Met Asn Ser Lys Tyr Ser Asn Ala Arg Glu Ala Ile Lys Asp Lys Ile
1 5 10 15
Arg Tyr Val Gln Asp Phe Pro Glu Asp Gly Val Leu Phe Glu Asp Leu
20 25 30
Thr Pro Val Leu Ala Asp Ala Asp Ala Phe Ser Val Val Ile Asp Gly
35 40 45
Leu Ala Asp Glu Cys Glu Lys Leu Gly Ala Asp Leu Ile Ala Gly Leu
50 55 60
Asp Ala Arg Gly Phe Leu Leu Gly Ser Ala Ala Ala Tyr Lys Leu Gly
65 70 75 80
Thr Gly Val Leu Ala Val Arg Lys Ala Gly Lys Leu Pro Pro Pro Val
85 90 95
Leu His Gln Glu Tyr Ser Leu Glu Tyr Gly Ser Ala Ala Leu Glu Ile
100 105 110
Pro Ala Asp Gly Ala Val Ile Thr Gly Thr Lys Ile Ala Leu Val Asp
115 120 125
Asp Val Leu Ala Thr Gly Gly Thr Leu Ala Gly Ala Arg Gln Leu Leu
130 135 140
Glu Ser Ala Gly Ala Glu Val Val Gly Ala Val Val Val Leu Glu Val
145 150 155 160
Glu Gly Leu Gly Gly Arg Glu Lys Phe Gly Asn Leu Pro Ile Ser Val
165 170 175
Leu Asn Ala Thr Thr Glu
180
<210> 2
<211> 549
<212> DNA
<213> Artificial Sequence
<220>
<223> apt_VT
<400> 2
gtgaactcaa agtattccaa tgcccgcgaa gccatcaagg ataaaatccg ctatgtacag 60
gattttccag aagacggtgt gctttttgaa gacctgactc cggtattagc tgatgccgat 120
gccttttcgg ttgtcatcga tggacttgct gatgaatgtg aaaagctggg cgcggatctt 180
atcgcaggtc tggatgcacg tggctttttg cttggctcag ccgcagcgta caagctgggc 240
accggtgtcc tagctgtgcg caaggctggc aagcttcctc ctccagtgct gcaccaggag 300
tactcgctgg aatacggctc cgcggcgttg gagattcctg cggatggggc agtgattaca 360
ggcaccaaga ttgcgcttgt cgatgacgtc cttgccaccg gcggtaccct tgccggtgct 420
cgtcagctac tggagtctgc tggcgcagaa gtcgttggtg ctgttgtggt tttggaagtt 480
gaaggtttag ggggacgtga aaaatttgga aatctcccta ttagtgtgct gaatgccaca 540
actgaataa 549
<210> 3
<211> 182
<212> PRT
<213> Artificial Sequence
<220>
<223> Apt_WT
<400> 3
Met Asn Ser Lys Tyr Ser Asn Ala Arg Glu Ala Ile Lys Asp Lys Ile
1 5 10 15
Arg Tyr Val Gln Asp Phe Pro Glu Asp Gly Val Leu Phe Glu Asp Leu
20 25 30
Thr Pro Val Leu Ala Asp Ala Asp Ala Phe Ser Val Val Ile Asp Gly
35 40 45
Leu Ala Asp Glu Cys Glu Lys Leu Gly Ala Asp Leu Ile Ala Gly Leu
50 55 60
Asp Ala Arg Gly Phe Leu Leu Gly Ser Ala Ala Ala Tyr Lys Leu Gly
65 70 75 80
Thr Gly Val Leu Ala Val Arg Lys Ala Gly Lys Leu Pro Pro Pro Val
85 90 95
Leu His Gln Glu Tyr Ser Leu Glu Tyr Gly Ser Ala Ala Leu Glu Ile
100 105 110
Pro Ala Asp Gly Ala Val Ile Thr Gly Ala Lys Ile Ala Leu Val Asp
115 120 125
Asp Val Leu Ala Thr Gly Gly Thr Leu Ala Gly Ala Arg Gln Leu Leu
130 135 140
Glu Ser Ala Gly Ala Glu Val Val Gly Ala Val Val Val Leu Glu Val
145 150 155 160
Glu Gly Leu Gly Gly Arg Glu Lys Phe Gly Asn Leu Pro Ile Ser Val
165 170 175
Leu Asn Ala Thr Thr Glu
180
<210> 4
<211> 549
<212> DNA
<213> Artificial Sequence
<220>
<223> apt_WT
<400> 4
gtgaactcaa agtattccaa tgcccgcgaa gccatcaagg ataaaatccg ctatgtacag 60
gattttccag aagacggtgt gctttttgaa gacctgactc cggtattagc tgatgccgat 120
gccttttcgg ttgtcatcga tggacttgct gatgaatgtg aaaagctggg cgcggatctt 180
atcgcaggtc tggatgcacg tggctttttg cttggctcag ccgcagcgta caagctgggc 240
accggtgtcc tagctgtgcg caaggctggc aagcttcctc ctccagtgct gcaccaggag 300
tactcgctgg aatacggctc cgcggcgttg gagattcctg cggatggggc agtgattaca 360
ggcgccaaga ttgcgcttgt cgatgacgtc cttgccaccg gcggtaccct tgccggtgct 420
cgtcagctac tggagtctgc tggcgcagaa gtcgttggtg ctgttgtggt tttggaagtt 480
gaaggtttag ggggacgtga aaaatttgga aatctcccta ttagtgtgct gaatgccaca 540
actgaataa 549
<210> 5
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер_1F
<400> 5
gtgaattcga gctcggtacc cccaatgccc gcgaagcc 38
<210> 6
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер_2R
<400> 6
acaagcgcaa tcttggtgcc tgtaatcact gcc 33
<210> 7
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер_3F
<400> 7
ggcagtgatt acaggcacca agattgcgct tgt 33
<210> 8
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер_4R
<400> 8
ggtcgactct agaggatccc ccaattccac gtcagcgcg 39
<210> 9
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер_5F
<400> 9
ggagacaatc cacgaggc 18
<210> 10
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер_6R
<400> 10
cccgacttgc gaaatacc 18
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ ВАРИАНТ БИФУНКЦИОНАЛЬНОГО ТРАНСКРИПЦИОННОГО РЕГУЛЯТОРА ОПЕРОНА PYR/УРАЦИЛФОСФОРИБОЗИЛТРАНСФЕРАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ИМФ С ЕГО ПРИМЕНЕНИЕМ | 2021 |
|
RU2819925C1 |
| Новый вариант гидролизующей глутамин GMP-синтазы и способ получения пуринового нуклеотида с его использованием | 2021 |
|
RU2804010C1 |
| НОВЫЙ ВАРИАНТ ПЕПТИДМЕТИОНИНСУЛЬФОКСИДРЕДУКТАЗЫ И СПОСОБ ПОЛУЧЕНИЯ IMP С ЕГО ИСПОЛЬЗОВАНИЕМ | 2021 |
|
RU2826036C1 |
| НОВЫЙ ВАРИАНТ DAHP СИНТАЗЫ И СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА С ЕГО ПРИМЕНЕНИЕМ | 2021 |
|
RU2794484C1 |
| Новая дегидрогеназа 5'-инозиновой кислоты и способ получения 5'-инозиновой кислоты с ее использованием | 2018 |
|
RU2728334C1 |
| Новый вариант 2-изопропилмалатсинтазы и способ получения L-валина с его применением | 2021 |
|
RU2794279C1 |
| НОВЫЙ ВАРИАНТ МИКОТИОНРЕДУКТАЗЫ И СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА С ЕГО ПРИМЕНЕНИЕМ | 2021 |
|
RU2793438C1 |
| НОВЫЙ ВАРИАНТ ТРАНСПОРТЕРА ИЗ СЕМЕЙСТВА MFS САХАРНЫХ ПОРТЕРОВ И СПОСОБ ПОЛУЧЕНИЯ L-ВАЛИНА С ЕГО ПРИМЕНЕНИЕМ | 2021 |
|
RU2796590C1 |
| Новый вариант белка и способ получения L-лизина с его применением | 2021 |
|
RU2793405C1 |
| НОВЫЙ ВАРИАНТ ЦИТРАТСИНТАЗЫ II ТИПА И СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2021 |
|
RU2793434C1 |
Изобретение относится к биотехнологии. Предложен полипептид, участвующий в продуцировании ИМФ (5'-инозилмонофосфат), состоящий из аминокислотной последовательности, представленной SEQ ID NO: 1, в которой аланин, представляющий собой аминокислоту, соответствующую положению 122 в SEQ ID NO: 3, заменен треонином. Также предложены полинуклеотид, кодирующий указанный полипептид, микроорганизм Corynebacterium stationis, продуцирующий ИМФ и содержащий указанные полипептид или полинуклеотид, а также способ получения ИМФ с использованием указанного микроорганизма. Изобретение обеспечивает получение ИМФ с высоким выходом. 4 н. и 1 з.п. ф-лы, 1 табл., 2 пр.
1. Полипептид, участвующий в продуцировании ИМФ (5'-инозилмонофосфат), состоящий из аминокислотной последовательности, представленной SEQ ID NO: 1, в которой аланин, представляющий собой аминокислоту, соответствующую положению 122 в SEQ ID NO: 3, заменен треонином.
2. Полинуклеотид, кодирующий полипептид по п. 1.
3. Микроорганизм Corynebacterium stationis, продуцирующий ИМФ, содержащий полипептид по п. 1 или полинуклеотид, кодирующий данный полипептид.
4. Микроорганизм по п. 3, продуцирующий повышенное количество ИМФ по сравнению с Corynebacterium stationis, содержащей полипептид SEQ ID NO: 3 или полинуклеотид, кодирующий данный полипептид.
5. Способ получения ИМФ, включающий культивирование в среде микроорганизма Corynebacterium stationis, содержащего полипептид по п. 1 или полинуклеотид, кодирующий данный полипептид.
| База данных UniProtKB, A0A0X8VER7_9CORY, Adenine phosphoribosyltransferase, 13.04.2016 | |||
| Найдено онлайн: https://www.uniprot.org/uniprotkb/A0A0X8VER7/entry Дата обращения 30.11.2023 | |||
| US 20200377917 A1, 03.12.2020 | |||
| US 20200347346 A1, 05.11.2020 | |||
| Новая дегидрогеназа 5'-инозиновой кислоты и способ получения 5'-инозиновой кислоты с ее использованием | 2018 |
|
RU2728334C1 |
Авторы
Даты
2024-04-22—Публикация
2021-07-12—Подача