Изобретение относится к способу культивирования микроводорослей и может быть использовано в нефтеперерабатывающей промышленности с целью получения биотоплив.
В условиях непрерывного уменьшения запасов ископаемого топлива задача поиска новых энергетических источников остается актуальной. Согласно современной классификации видов биотоплива, топливо, полученное с использованием микроводорослей, называется биотопливом третьего поколения. Основные преимущества использования микроводорослей для получения биотоплива являются их высокая скорость роста, высокая продуктивность по липидам, для их выращивания не требуется высокачественных сельскохозяйственных земель. Таким образом, Биотопливо третьего поколения имеет достаточный потенциал как альтернативный источник энергии.
Выбор условий культивирования микроводорослей определяется задачами по культивированию биомассы и качеству получаемого продукта.
Известен способ получения биомассы (патент РФ №2541446, опубл. 10.02.12015), включающий культивирование одноклеточной зеленой микроводоросли Dunaliella salina с использованием квазинепрерывного режима культивирования, при этом культуру, выращенную на модифицированной питательной среде Тренкеншу методом накопительных культур до плотности 1,5-3 г ОВ⋅л-1, переводят в квазинепрерывный режим культивирования и осуществляют дальнейшее выращивание при удельной скорости протока среды около 0,3 сут-1 при круглосуточном освещении с поверхностной освещенностью 80 Вт⋅м-2, непрерывной продувке газовоздушной смесью со скоростью 1 л смеси⋅мин-1⋅л-1 культуры, содержащей 3% СО2 и температуре 26-28°С, на модифицированной питательной среде Тренкеншу.
Описанный способ позволяет культивировать биомассу, являющуюся источником биоактивных веществ, обладающих антиоксидантными свойствами, таких как липиды (полиненасыщенные жирные кислоты), каротиноиды (β-каротин, лютеин, зеаксантин и др.), витамины (токоферол) и др. В отличие от других водорослей, клетки D. salina лишены целлюлозной или пектиновой оболочки и окружены лишь тонкой эластичной протоплазматической мембраной (плазмалеммой), что существенно облегчает усвоение биомассы водоросли.
Однако способ культивирования при выращивании штамма Dunaliella salina не позволяет поглощать газы с высоким содержанием CO2.
Известно изобретение (патент CN 103952314) из области техники биологических источников энергии, относящееся к выращиванию водоемного сцендесмуса Desmodesmus коммун GS05 с номером консервации ССТСС М2013609. Штамм может эффективно фиксировать 0,03%-30% СО2, имеет эффективность фиксации СО2 90-370 мг/л/сутки, концентрацию биомассы (сухого веса) 700-3800 мг/л, содержание масла 20%-43%, и состав жирных кислот, в основном состоящий из короткоцепочечных жирных кислот С16 и C18, и подходит для производства биодизельного топлива. Штамм scenedesmus, предложенный в изобретении, может быть использован для снижения выбросов дымовых газов и глубокой очистки промышленных и коммунальных сточных вод путем сопряжения; скорость удаления азота и фосфора из сточных вод может достигать 95%, и можно получить высокий выход масла из микроводорослей, что значительно снижает стоимость производства масла из микроводорослей. Изобретение обеспечивает хороший производственный штамм водорослей для эффективного выброса СО2 из источника с высоким уровнем загрязнения, очистки сточных вод и получения чистой энергии.
Однако в описанном способе речь о водоемном штамме, эффективно выращиваемом в основном в открытых водоемах.
Известен способ (патент KR 20020074029) биологической фиксации углекислого газа хлореллой sp.НА-1 с использованием полунепрерывного метода культивирования в фотобиореакторе, предназначенный для удаления большого количества углекислого газа из дымовых газов. Метод фиксации углекислого газа включает этапы подачи фотосинтетического штамма в трубчатый фотобиореактор с внутренним освещением; введение в фотобиореактор диоксида углерода и облучение его светом для культивирования фотосинтетического штамма при постоянных температурных условиях; и замену соответствующего объема суспензии клеток свежей средой для культивирования, когда рост микроводорослей находится в стационарной фазе после фазы экспоненциального роста. Однако для осуществления предложенного способа требуется высокий расход воздуха при использовании трубчатого реактора, что делает данный способ энергетически затратным.
Известен способ по патенту РФ №2508398, опубл. 27.02.2014, в котором культивирование штамма микроводоросли Chlorella vulgaris А1 123 проводят в лабораторных условиях при температуре 25°С на среде ВВМ рН 6.8 в лимитированных по азоту условиях в течение 7 дней, в объеме среды 200 мл в колбах на 500 мл, при непрерывном барботировании суспензии стерильным воздухом со скоростью 200 мл/мин, при освещенности 120 Вт/м2 с фотопериодом 16 ч. Недостатком данного способа является низкий прирост биомассы.
Известен способ культивирования микроводоросли Chlorella, который предусматривает культивирование микроводоросли на жидкой питательной среде в условиях перемешивания и освещения при воздействии импульсного низкочастотного электромагнитного поля с магнитной индукцией 2000 Гс при частоте импульсов 10 Гц и длительностью 10 мкс (авт. св. №1711734, опубл. 15.02.1992). К недостаткам данного способа можно отнести низкую производительность и высокую энергозатратность.
Известен способ искусственного культивирования микроводорослей и установка для его осуществления по патенту РФ №2175013, опубл. 10.06.2001. Культивирование микроводорослей осуществляется путем фотосинтеза при воздействии на них радиолюминесцентного излучения и тепла, возбуждаемого проникающими ядерными излучениями, при этом спектр радиолюминесцентного излучения может быть выбран резонансно совпадающим со спектром действия фотосинтеза. Искусственным источником энергии служит источник проникающих ядерных излучений, источником люминесцентного оптического излучения - радиолюминофор, тепло генерируется в среде источника ядерных излучений. В качестве источника ядерных излучений используется ядерный реактор, в том числе, реактор-размножитель с уран-ториевым циклом, в том числе, в виде решетки из ядерных радиолюминесцентных ламп, которые со всех сторон окружены светоприемными кюветами с суспензией культивируемых микроводорослей. Недостатками являются высокие энергозатраты, использование ядерного излучения, применение дорогостоящего компонента, являющегося прекурсором, - радиолюминофора.
Известен способ, описанный в патенте JPH 10248553, где показана возможность получения водоросли рода Chlorella, состоящей из определенного штамма, размножающегося в СО2-содержащей газовой смеси при определенной температуре, полезной для фиксации СО2 в выхлопных газах сжигания теплоэлектростанции и эффективен для предотвращения явления глобального потепления. Описанный способ позволяет культивировать микроводоросли хлореллы, состоящие из штамма Chlorella sorokiniana HAK, штамма Chlorella sorokiniana HFK, штамма Chlorella sorokiniana YSK или штамма Chlorella sorokiniana HHK и способные к пролиферации в смешанном газе, содержащем 0,03-40% СО2, при 25-40°С можно получить, культивируя хлореллу при медленной подаче СО2 и отделяя выживший штамм.
Однако, несмотря на то что в рассмотренном способе акцент сделан на разновидностях штамма Chlorella sorokiniana, наиболее активным и отличающимся высокой скоростью поглощения СО2 является Chlorella vulgaris, а Chlorella kessleri содержит большее количество липидов, чем остальные виды.
Наиболее близким к заявляемому способу по технической сущности и достигаемому результату является способ, описанный в патенте RU 2668162, опубл. 26.09.2018 «Способ культивирования микроводоросли Chlorella», выбранный в качестве прототипа.
Известный способ заключается в том, что суспензию микроводоросли помещают в фотобиореактор, в котором суспензию микроводоросли перемешивают в течение 13-17 минут с частотой вращения 500 об/мин через каждые 120 минут, при этом культивирование проводят при непрерывной продувке воздухом с помощью барботирующего устройства с расходом 1,2-1,8 л/мин при температуре 26-30°С, непрерывном воздействии инфракрасного излучения 10900-11300 Лк и при поверхностной освещенности 2200-2800 Лк с фотопериодом 12 часов. Способ обеспечивает увеличение прироста биомассы при минимальных энергетических затратах.
Однако указанный способ не позволяет получить максимально возможное содержание липидов в биомассе, достигаемое дефицитом азота, вовлеченного в процесс культивирования. К тому же предложенный способ осуществляется при непрерывном воздействии ИК излучения, что влечет дополнительные энергозатраты.
Задачей данного изобретения является разработка эффективного способа культивирования микроводорослей, сочетающих повышенное содержание липидов и высокую динамику поглощения CO2 и пригодных для использования в качестве биокомпонента топлива.
Новым техническим результатом предлагаемого способа является повышение содержания липидов в микроводорослях, высокий прирост биомассы и динамика поглощения СО2 при минимальных энергетических затратах.
Заявленный технический результат достигается предлагаемым способом культивирования микроводоросли Chlorella для использования в качестве биокомпонента топлива, включающий перемешивание суспензии микроводоросли в биореакторе в течение 13-17 минут с частотой вращения 500 об/мин через каждые 120 минут, при этом культивирование проводят при непрерывной продувке воздухом с помощью барботирующего устройства с расходом 1,2-1,8 л/мин при температуре 26-30°С при поверхностном освещении 2700±200 Лк, при этом культивированию подлежит штамм микроводоросли Chlorella kessleri, продолжительность культивирования составляет 12-13 суток, культивирование проводят в питательной среде с концентрацией KNO3 0,2 г/л при рН питательной среды 7,5-8,5.
Технический результат, достигаемый предлагаемым способом, обусловлен его новыми свойствами, обнаруженными при проведении исследований.
В ходе проведенных исследований поставленная задача была решена путем выявления оптимальных условий культивирования микроводоросли Chlorella kessleri (далее C. kessleri), обладающей высоким потенциалом в фиксации углекислого газа от различных источников с максимальным потенциалом по получению липидного масла, являющегося биокомпонентом для биотоплив.
Результаты экспериментов показали, что оптимальными условиями, необходимыми для максимального прироста биомассы микроводоросли C. kessleri и, следовательно, и максимального поглощения СО2, являются:
- рН=8,0±0,5;
- интенсивность освещения - 2700±200 Лк;
- температура 28±2°С;
- аэрация не менее 1,2-1,8 л/мин;
- питательная среда с концентрацией KNO3 - 0,2 г/л. Максимальная скорость поглощения СО2 - 0,156 г/л в день. Продолжительность культивирования - 12-13 суток.
Максимальный объем СО2, утилизированный за 1 сутки - 5,17 л при Т=26-30°С и освещенности 2700±200 Лк.
В период культивирования микроводоросли C. kessleri по предложенному способу максимальное поглощения CO2 происходит в период фазы экспоненциального роста (12-13 сутки).
В период культивирования микроводоросли С. kessleri по предложенному способу максимальное поглощения CO2 происходит в период фазы экспоненциального роста (12-13 сутки).
Изученный вид микроводоросли С. kessleri, полученный по предложенному способу, способен поглощать газы с высоким содержанием CO2 (более 25%).
Продолжительность культивирования
В ходе проведения экспериментов была изучена зависимость фазы роста С. kessleri при постоянной аэрации 1,2-1,8 л/мин, освещенности 2700±200 Лк и температуре (26-30)°С. Установлено, что кривую роста биомассы микроводорослей (Фиг. 1) можно разделить на три стадии: лаг-фаза (0-2 суток); экспоненциальная фаза роста (3-9 суток) и стационарная фаза (начиная с 10 суток), образующие S-образную кривую.
Установлено, что наиболее оптимальное время сбора биомассы С. kessleri приходится на 12-13 сутки культивирования, т.е. в начале стационарной фазы. В это же время происходит максимальное поглощение CO2.
Количество клеток микроводорослей определяли по оптической плотности, измеренной на спектрофотометре КФК-3 КМ при длине волны λ=750 нм.
Температура культивирования
В данном исследовании определили температурный интервал, оптимальный для роста С. kessleri. Культивирование С. kessleri осуществлялось в течение 12 суток в фото биореакторах (ФБР), где поддерживалась определенная температура питательной среды (22°С, 24°С, 26°С, 28°С, 30°С, 32°С). Суспензию барботировали атмосферным воздухом со скоростью 1,2-1,8 л/мин при непрерывном освещении лампами дневного света при интенсивности 2700±200 Лк. Результаты исследования влияния температуры на скорость роста биомассы представлены на Фиг. 2.
Наиболее высокая скорость роста биомассы была достигнута при температуре (30±1)°С. Принимая во внимание устойчивость микроводоросли С. kessleri к различным температурным условиям, характеризуемую способностью расти в температурном диапазоне (25±5)°С, рекомендованными значениями температуры для культивирования является температурный интервал 26-30°С. При данных температурах происходит максимальное поглощение CO2.
Этот результат был подтвержден и при проведении экспериментов при условии скорости барботирования (1,2; 1,4; 1,7; 1,8) л/мин и с различными условиями интенсивности освещения (2500, 2600, 2800, 2900) Лк.
Состав питательной среды для культивирования
В ходе проведения экспериментов для культивирования микроводорослей С. kessleri использовалась питательная среда, взятая из прототипа (табл. 1).
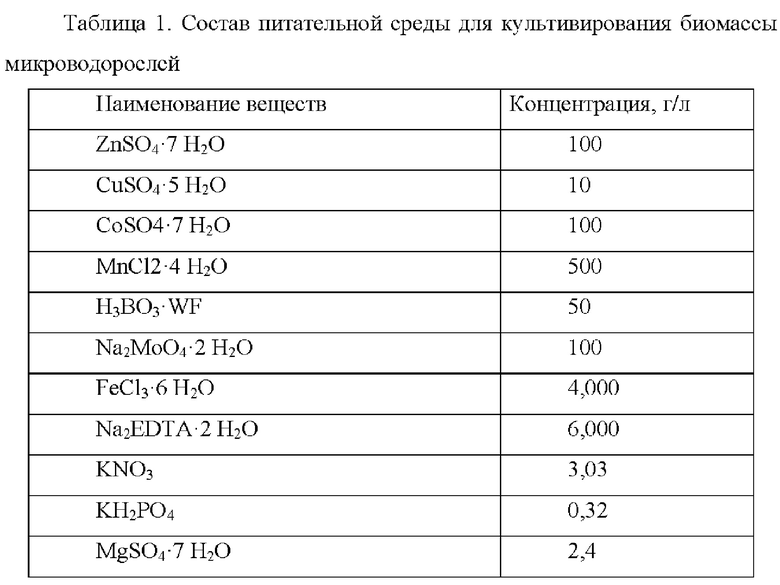
Однако при использовании данный среды не были получены положительные результаты по содержанию липидов.
Одним из наиболее важных питательных веществ, влияющих на рост микроводорослей, является содержание азота. Недостаток азота вызывает уменьшение прироста биомассы. При этом увеличивается средний сухой вес клетки, а в органическом веществе уменьшается содержание хлорофилла и белка, но увеличивается количество углеводов и липидов, относящихся к безазотистым соединениям.
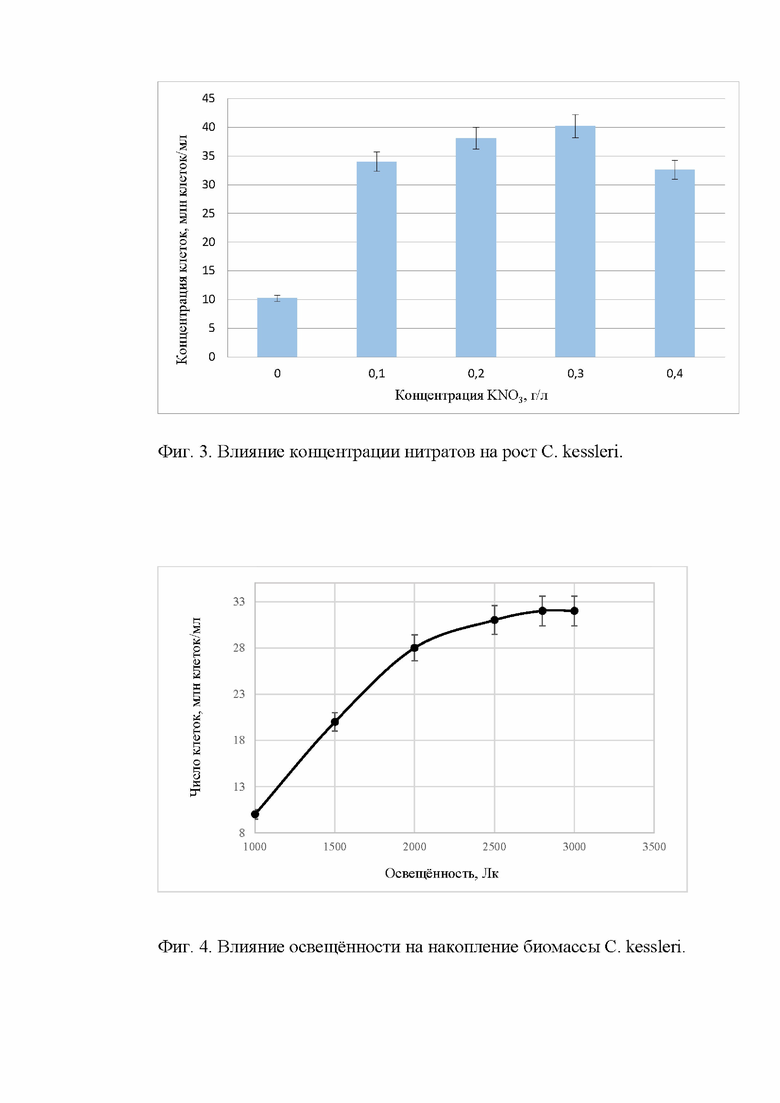
В ходе экспериментов было изучено влияние уменьшения концентрации KNO3 в питательной среде на накопление липидов. Для этого микроводоросли культивировали в 5 ФБР, содержащих следующие концентрации KNO3 (0; 0,1; 0,2; 0,3; 0,4) г/л при постоянной аэрации 1,2-1,8 л/мин и температуре 26-30°С. Рост биомассы оценивали ежедневно в течение продолжительности периода культивирования (12-13) суток. Обнаружено, что стрессовые условия дефицита азота способствуют накоплению липидов. Эксперимент проводился в трехкратной повторности. Результаты влияния концентрации нитрата калия на рост С. kessleri представлены на Фиг. 3.
Наибольший выход биомассы был получен при концентрации KNO3 0,3 г/л. В отсутствии нитратов прирост биомассы С. kessleri был наименьшим. В таблице 2 приведено влияние концентрации KNO3 на выход липидов, полученных из биомассы С. kessleri.
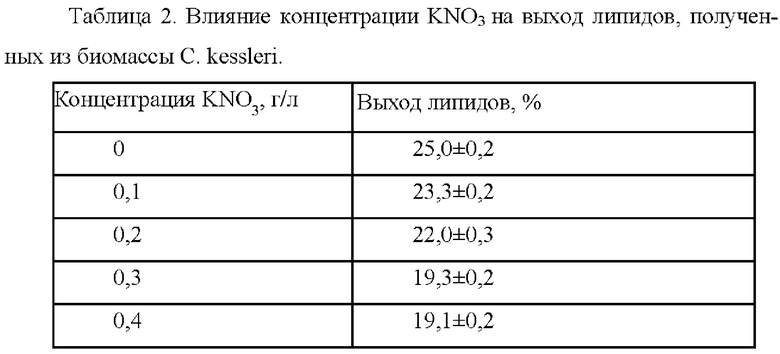
Согласно полученным результатам, концентрация 0 г/л KNO3 позволила получить выход липидов до 25%, но с минимальным приростом биомассы (Фиг. 3). Максимальный выход биомассы был отмечен с использованием концентрации KNO3 0,3 г/л, а максимальное содержание липидов обеспечила концентрация 0,2 г/л KNO3 наряду с небольшим снижение скорости роста микроводорослей. На основании этого в предлагаемом способе используется концентрация KNO3 равная 0,2 г/л.
Уровень освещенности при культивировании
Известно, что освещенность играет важную роль в росте и усвоении питательных веществ микроводорослями. В исследовании изучалось влияние различной интенсивности света на рост С. kessleri. Для реализации данной цели применяли ФБР объемом 1000 мл, содержащих 500 мл суспендированной микроводоросли С. kessleri в питательной среде при начальной концентрации клеток 2 млн клеток/мл. ФБР располагали на разных расстояниях от источника света - ламп дневного света (ЛДС) до достижения эффективной интенсивности света. С. kessleri культивировали в течение 12 суток при постоянной аэрации со скоростью 1,2-1,8 л/мин и температуре 26-30°С. Результаты исследования представлены на Фиг. 4.
Согласно результатам, прирост биомассы микроводоросли был наибольшим при освещенности 2700±200 Лк.
При культивировании в течение 13 суток указанный результат повторился.
рН питательной среды, используемой при культивировании
Значение рН среды культивирования микроводорослей оказывает большое влияние на накопление биомассы. С целью определения рН, оптимального для роста микроводоросли С. kessleri, штамм культивировали в шести параллельных ФБР, содержащих по 500 мл питательной среды с различными значениями рН (7,0; 7,5; 8,0; 8,5; 9,0). Величина рН в каждом ФБР поддерживали добавлением растворами гидроксида натрия NaOH 0,1 М (для повышения рН) и соляной кислоты HCl 1М (для снижения рН). Культуры непрерывно аэрировали и перемешивали барботированием с разными скоростями (1,2; 1,4; 1,5; 1,7; 1,8) л/мин при температуре 26°С. Количество клеток на 12-13 сутки культивирования в каждой среде представлено на Фиг. 5.
Показано, что рН=8,0±0,5 является наиболее подходящим для культивирования С. kessleri с максимальным поглощением CO2. Сдвиг рН в сторону более кислых или щелочных значений отрицательно влияет на рост микроводорослей.
Повторение эксперимента при температурах 27°С и 30°С показало аналогичный результат.
Динамика поглощения СО2 микроводорослью С. kessleri
Оценка динамики поглощения CO2 биомассой микроводорослей в исследовании проводилась в герметичных фотобиореакторах-биофильтрах (ФБРБ), вместимостью 100 л, оснащенных системой аэрирования, освещения, подачи углекислого газа, системой измерения состава газовой смеси, системой удаления суспензии биомассы микроводорослей и температурными датчиками.
Отдельно была изучена динамика поглощения CO2 суспензией микроводорослей С. kessleri при культивировании в стрессовых условиях дефицита азота (концентрация KNO3 - 0,2 г/л). Выявлено, что поглощение CO2 суспензией микроводорослей С. kessleri в стрессовых условиях, наиболее активно происходит в период до 13 суток. Фаза привыкания клеток к среде (лаг-фаза) в стрессовых условиях протекает в течение первых часов. Оптическая плотность суспензии увеличивалась на протяжении всего эксперимента, однако, отмечалась быстрая седиментация биомассы.
В таблице 3 представлена сравнительная характеристика образцов микроводоросли С. kessleri по различным факторам ее культивирования.

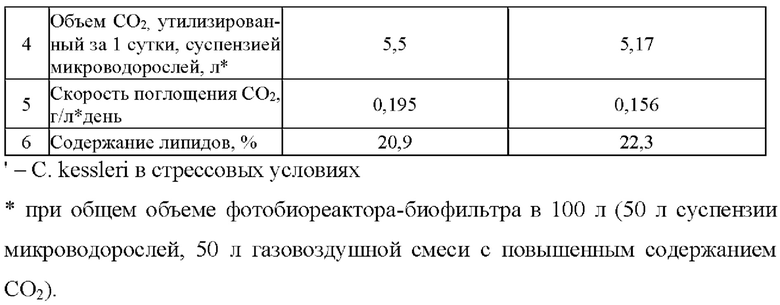
В ходе эксперимента был изучен период от максимальной подачи CO2 32% до полного его поглощения, что заняло 2,8 суток. При последующей подаче СО2 в максимальной концентрации 32% полное поглощение произошло в течение времени до 13 суток от момента начала эксперимента, далее скорость поглощения снизилась, что соответствовало снижению роста массы микроводорослей.
Таким образом, заявляемый способ культивирования позволяет получить микроводоросль С. kessleri с максимальной скоростью поглощения CO2 - 0,156 г/л в день, при Т=30°С и освещенности 2900 Лк. Предпочтительно ведение процесса культивирования в стрессовых условиях для получения биомассы С. kessleri с большим содержанием липидов, рекомендованной для получения биодизеля. Подтверждено, что максимальное поглощение CO2 происходит в период фазы экспоненциального роста (12-13 сутки). Микроводоросли С. kessleri способны поглощать газы с высоким содержанием CO2 содержащим 32%.
Способ культивирования микроводоросли С. kessleri реализуется следующим образом.
Суспензию микроводорослей, представляющую раствор микроводоросли в питательной среде, помещают в фотобиореактор необходимых объемов. Перемешивание суспензии во время культивирования производят в течение 13-17 минут через каждые 120 минут. Перемешивание осуществляют с помощью магнитной мешалки, частота вращения которой составляет 500 об/мин. Культивирование биомассы проводят при непрерывной продувке воздухом с помощью барботирующего устройства при поверхностной освещенности в диапазоне от 2500 до 2900 Лк. Для освещения используются искусственные источники света, например ламп дневного света, создающие большую облученность. Температуру раствора суспензии поддерживают в диапазоне от 26 до 30°С за счет терморегуляторов. Процесс культивирование проводят при значении рН=8,0±0,5.
Интенсивное барботирование газами с высоким содержанием CO2 (15-39%) суспензии микроводоросли С. kessleri позволило интенсифицировать процессы поглощения CO2 биомассой микроводорослей, рН раствора поддерживался в пределах от 7,5 до 8,5.
Таким образом, заявляемый способ культивирования микроводоросли Chlorella kessleri позволяет получить биомассу с высоким содержанием липидов до 22,3% в стрессовых условиях дефицита азота в питательной среде и скоростью поглощения CO2 в процессе культивирования до 0,156 г/л в день.
Микроводоросль С. kessleri, культивированная предложенным способом, содержит большее количество липидов, чем остальные виды штаммов микроводорослей Chlorella и рекомендуется для использования при получении биодизеля.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ утилизации углекислого газа с применением микроводоросли рода Chlorella | 2022 |
|
RU2797838C1 |
| Способ культивирования микроводорослей Chlorella vulgaris Beijer. f. globosa V. Andr. IIPAS C-2024 в природных условиях с использованием воды из пруда | 2021 |
|
RU2774314C1 |
| Способ культивирования микроводоросли Chlorella | 2017 |
|
RU2668162C1 |
| Способ направленного культивирования биомассы микроводоросли Chlorella sorokiniana | 2021 |
|
RU2758355C1 |
| ШТАММ МИКРОВОДОРОСЛИ Chlorella vulgaris, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ОЧИСТКИ СТОЧНЫХ ВОД СЕЛЬСКОХОЗЯЙСТВЕННЫХ И СПИРТОВЫХ ПРОИЗВОДСТВ | 2013 |
|
RU2555519C2 |
| Способ культивирования микроводоросли Chlorella vulgaris | 2021 |
|
RU2769152C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ CHROMOCHLORIS ZOFINGIENSIS ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ И КАРОТИНОИДОВ | 2019 |
|
RU2715039C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ БИОМАССЫ С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ЛИПИДОВ | 2014 |
|
RU2569149C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ФОТОСИНТЕЗИРУЮЩИХ МИКРООРГАНИЗМОВ | 2013 |
|
RU2550266C2 |
| ШТАММ ЗЕЛЁНОЙ МИКРОВОДОРОСЛИ DUNALIELLA SALINA ДЛЯ ПОЛУЧЕНИЯ ЕЁ БИОМАССЫ В ПРОМЫШЛЕННЫХ УСЛОВИЯХ | 2021 |
|
RU2788527C2 |

Изобретение относится к области биотехнологии. Изобретение представляет собой способ, включающий перемешивание суспензии микроводоросли в биореакторе в течение 13-17 минут с частотой вращения 500 об/мин через каждые 120 минут, при этом культивирование проводят при непрерывной продувке воздухом с помощью барботирующего устройства с расходом 1,2-1,8 л/мин при температуре 26-30°С при поверхностном освещении 2700±200 Лк, при этом культивированию подлежит штамм микроводоросли Chlorella kessleri, продолжительность культивирования составляет 12-13 суток, культивирование проводят в питательной среде с концентрацией KNO3 0,2 г/л при рН питательной среды 7,5-8,5. Способ культивирования микроводоросли Chlorella kessleri позволяет получить биомассу с высоким содержанием липидов до 22,3% в стрессовых условиях дефицита азота в питательной среде и скоростью поглощения СО2 в процессе культивирования до 0,156 г/л в день. 5 ил.
Способ культивирования микроводоросли Chlorella для использования в качестве биокомпонента топлива, включающий перемешивание суспензии микроводоросли в биореакторе в течение 13-17 минут с частотой вращения 500 об/мин через каждые 120 минут, при этом культивирование проводят при непрерывной продувке воздухом с помощью барботирующего устройства с расходом 1,2-1,8 л/мин при температуре 26-30°С при поверхностном освещении 2700±200 Лк, отличающийся тем, что культивированию подлежит микроводоросль Chlorella kessleri, продолжительность культивирования составляет 12-13 суток, культивирование проводят в питательной среде с концентрацией KNO3 0,2 г/л при рН питательной среды 7,5-8,5.
| Способ культивирования микроводоросли Chlorella | 2017 |
|
RU2668162C1 |
| ПЛАНКТОННЫЙ ШТАММ PARACHLORELLA KESSLERI, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПОЛУЧЕНИЯ ПИЩЕВОЙ ПРОДУКЦИИ | 2019 |
|
RU2726111C1 |
| WONG Y.K | |||
| et al | |||
| Cultivation of Chlorella vulgaris in column photobioreactor for biomass production and lipid accumulation, Water Environment Research., 2016, vol | |||
| Шланговое соединение | 0 |
|
SU88A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Рр | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2024-05-21—Публикация
2023-12-08—Подача