Предлагаемое изобретение относится к области регенеративной медицины, а именно к хирургии тонкого кишечника путем имплантации биоматериала, который может быть использован для восстановления дефекта (хирургического, травматического и т.д.) тонкой кишки.
Синдром короткой кишки (СКК) представляет собой тяжелое состояние, характеризующееся уменьшением всасывательной поверхности тонкого кишечника, возникающее вследствие врожденного недостатка его длины или в результате обширных резекций, приводящих к хронической кишечной недостаточности, что неизбежно приводит к значительному снижению качества жизни, так как больные вынуждены находиться на полном парентеральном питании, влекущем такие многочисленные осложнения, как печеночная недостаточность, катетер-ассоциированный сепсис. Такие пациенты вынуждены находиться на полном парентеральном питании. Среди больных сохраняется высокая смертность вследствие печеночной недостаточности (ПН) и катетер-ассоциированного сепсиса.
Среди хирургических вмешательств по поводу СКК наиболее востребованы операции, позволяющие непосредственно удлинить кишечник сегментом, полностью идентичным по анатомо-гистологической архитектуре резидуальной кишке, трансплантацию инвертированных сегментов, трансплантацию донорского кишечника, создание кишечных клапанов, с целью замедления пассажа химуса, а также различные методы, влияющие на перистальтику. Однако выполнение операций ограничивается уже имеющимися у больных осложнениями, такими как сепсис, ПН, Болезнь Крона. Также у больных с СКК сохраняется низкая выживаемость после проведенных операций. Трансплантация кишечника предполагает непосредственное замещение полноценной, гистологически идентичной кишкой, но влечет за собой определенные технические сложности, высокую частоту отторжений, а также осложнения, вызванные иммуносупрессией, длительным листом ожидания т.д. Такой метод, как трансплантация тонкой кишки, является многообещающей терапией, однако подразумевает подбор донора с соответствующим типом ткани, длительную иммуносупрессию и все еще сопровождается высокой заболеваемостью и смертностью [Abu-Elmagd K. M. Intestinal transplantation for short bowel syndrome and gastrointestinal failure: Current consensus, rewarding outcomes, and practical guidelines // Gastroenterology. 2006. Vol. 130. S132 – S137].
Все перечисленное диктует необходимость разработки новых инновационных подходов к лечению СКК. Одним из перспективных направлений является создание биосовместимых биомиметиков на основе экстрацеллюлярного матрикса. В настоящее время в тканевой инженерии исследуется множество разных каркасов: бесклеточный дермальный матрикс [Pahari M. P., Raman A., Bloomenthal A. et al. A novel approach for intestinal elongation using acellular dermal matrix: an experimental study in rats // Transpl. Proc. 2006. Vol. 38. Р. 1849-1850], подслизистая основа тонкого кишечника [Wang Z. Q., Watanabe Y., Toki A. Experimental assessment of small intestinal submucosa as a small bowel graft in a rat model // J. Pediatr. Surgery. 2003. Vol. 38. Р. 1596–1601], коллагеновая губка [Nakase Y., Nakamura T., Kin S. et al. Endocrine cell and nerve regeneration in autologous in situ tissue-engineered small intestine // J. Surg. Res. 2007. Vol. 137. Р. 61-68], каркасы на основе гиалуроновой [Collins M. N., Birkinshaw C. Hyaluronic acid based scaffolds for tissue engineering: a review // Carbohydrate polymers. 2013. Vol. 92. Р. 1262-1279] или полигликолевой кислоты [Grikscheit T. C., Siddique A., Ochoa E. R. et al. Tissue-engineered small intestine improves recovery after massive small bowel resection // Ann. Surg. 2004. Vol. 240. Р. 748–754], каркасы на основе хитозана, фиброина шелка, спидроина паука. В данных работах матрикс/каркас рассматривается в качестве клеточного скаффолда. Нами предлагается метод имплантации в организм аллогенного децеллюляризированного биоматериала, который может служить полноценным биомиметиком для удлинения кишки, что ранее исследовано не было. Известно, что аллогенный биоматериал способен стимулировать процессы регенерации, постепенно биодеградирует, утилизируется макрофагами с определенными фенотипическими свойствами, обеспечивает селективный рост тканей на месте имплантации без признаков рубцевания или инкапсуляции, а также обратного развития поствоспалительных фиброзных и дегенеративно-дистрофических изменений в тканях [Мулдашев Э.Р., Муслимов С.А., Вялков В.А., Галимова В.У., Нигматуллин Р.Т., Салихов А.Ю., Сельский Н.Е., Кийко Ю.И., Шангина О.Р., Булатов Р.Т., Мусина Л.А., Хасанов Р.А., Кийко М.Ю. Биоматериал аллоплант для регенеративной хирургии. Патент на изобретение RU 2189257 C1, 20.09.2002. Заявка № 2001127296/14 от 10.10.2001.].
В качестве матрицы ранее использовали хитозан, который хоть и обладает бактериостатическими и гемостатическими свойствами, позволяющими успешно применять его в качестве биологической матрицы, регенераторными свойствами не обладает. Используется в качестве скаффолда для клеток [Kumar M.N., Muzzarelli R.A., Muzzarelli С., Sashiwa Н., Domb A.J. Chitosan chemistry and pharmaceutical perspectives (Химические особенности хитозана и его применение в фармацевтике). Chemical Reviews, 2004. - V. 104. - P. 6017-6084].
Однако хитозан, как носитель оказался не способен удерживать клетки на своей поверхности, так как вследствие особенностей химического строения не обладает достаточной биологической инертностью для прикрепления к ним клеток, а не прикрепившиеся клетки погибают, т.к. они не способны жить без прикрепления к поверхности и погибают вследствие анойкиса. Этот существенный недостаток ограничивает область применения хитозана [Wang Y.-C., Kao S.-H., Hsieh H.-J. A chemical surface modification of chitosan by glycoconjugates to enhance the cell-biomaterial interaction (Химическая модификация поверхности хитозана гликоконъюгатами для усиления взаимодействия клеток и биоматериалов). Biomacromolecules, 2003. - V. 4. - Р. 224-231].
Некоторые авторы используют методику 3D принтерных биоинженерных каркасов для восстановления сложных тканевых конструкций ex vivo [Jianmin Xue, Chen Qin, Chengtie Wu, 3D printing of cell-delivery scaffolds for tissue regeneration, Regenerative Biomaterials, Volume 10, 2023, rbad032, https://doi.org/10.1093/rb/rbad032]. Основными недостатками методики создания подобных конструкций являются очевидные ограничения, связанные с неспособностью точно распределить слои клеток. Процесс создания матрикса также является сложным, имеет ограничение по размерам создаваемых биопринтером 3D-моделей, которые вряд ли могут сравниться с размерами хозяина. Их применение в исследовании ограничивается костными, хрящевыми, мышечными каркасами и не предполагает 3D-модель кишечного циркулярного трансплантата.
Синтетические биодеградируемые носители на основе полимолочной и полигликолевой кислот также можно использовать в качестве матрикса. Тем не менее, их применение сопровождается быстрой и непредсказуемой деградацией с локальным снижением рН, что снижает эффективность их применения и ограничивает применение синтетических носителей [Prokop A., Jubel A., Helling H.J., Eibach Т., Peters С., Baldusc S.E., Rehm K.Е. Soft tissue reactions of different biodegradable polylactide implants (Реакция мягких тканей на введение биоразлагаемых имплантов из полилактида). Biomaterials, 2004. - V. 25. - Р. 259-267].
Известен способ получения васкуляризованного бесклеточного матрикса на основе сегментов тонкого кишечника крыс, при котором в дальнейшем была возможна рецеллюляризация первичными эндотелиальными клетками просвета селективно выделяемых сосудов питающей ножки [HOFMANN AD, HILFIKER A, HAVERICH A, ANDREE B, KUEBLER J, URE B. BioVaM in the rat model: a new approach of vascularized 3D tissue for esophageal replacement. Eur J Pediatr Surg. 2015 Apr;25(2):181-8. doi: 10.1055/s-0034-1370778. Epub 2014 May 2. PMID: 24792863]. Методика предполагает создание бесклеточного матрикса посредством соответствующей обработки выделенного сегмента 3-5см с сохранением просвета кишки и сосудов и последующей колонизацией первичными эндотелиальными клетками стенки артерии и вен. Как предполагают авторы, это позволит создать адекватную перфузию трансплантированного лоскута и резидуальный просвет кишки.
Однако стоит упомянуть существенные недостатки биоматериала, полученного по данной методике:
1. Экспериментальная работа по трансплантации лабораторным животным с демонстрацией обоснованности сохранения просвета кишки при всей сложности ее обработки (авторы заявляют о проблемах полной децеллюляризации ворсинок слизистой оболочки) не предоставлена.
2. Аналогично не продемонстрирована состоятельность сосудистой перфузии, васкулогенеза пересаженного сегмента in vivo, как наиболее важного критерия жизнеспособности биокаркаса (не приведена экспериментальная верификация ассимиляции трансплантата in vivo). Стоит подчеркнуть, что именно этот этап сопряжен со сложностями процессов рецеллюляризации аутологичными эндотелиоцитами и элиминации ДНК, упоминаемых самими авторами.
3. Сложность децеллюляризации сосудов в использовании ДНКазы I, а также их канюляции.
Известна тканеинженерная конструкция кишечника, где каркасом являются нановолокна поли(гликолевой кислоты) (PGA), поли(ε-капролактона) (PCL), поли(-капролактон-сомолочная кислота) (PLC), полимолочных кислот (PLGA), полиуретана (PU), полидиоксанона (PDO) и их комбинаций [US20210030924A1]. Изобретение предполагает использование различных матриц, выбранных авторами, с дальнейшей имплантацией на них нейрональных и гладкомышечных стволовых клеток. К недостаткам относится представление результатов трансплантации образованных матриц на стенку брюшной полости, а не непосредственно анастомозированием тонкой кишки с включением ее в кишечный транзит.
Наиболее близким аналогом (прототипом) изобретения является способ восстановления стенки тонкой кишки путем имплантации биорезорбируемой трубки на основе метакрилированного желатина и фиброина [патент RU 2714200, 2020]. Децеллюляризованный внеклеточный матрикс представляет собой трубку, состоящую из армированных при помощи шелковой некрученой нити 8/0-4/0 и неармированных участков. Как заявляют авторы разработки, трубка легко подготавливается согласно требуемой длине и диаметру резидуальной кишки. Трубка подшивается к проксимальному и дистальному краю резецированного участка кишки длиной до 10 мм. Нельзя не упомянуть существенные недостатки прототипа:
1. Предполагает использование армировочной шелковой некрученой нити 8/0-4/0, так как это препятствует прорезыванию имплантата при пришивании и обеспечивает тем самым герметичность кишечника, что подразумевает недостаточные прочностные характеристики используемого материала. Помимо этого, методика укладывания витков нити с чередованием участков трубки может вносить дополнительные сложности и определенно удорожает производство биорезорбируемой трубки.
2. Перед каждым применением биодеградируемого имплантата на основе метакрилированного желатина и метакрилированного фиброина шелка необходимо проводить предварительную подготовку, заключающуюся в его инкубации в стерильном физиологическом растворе в течение 15-30 минут с многократной заменой физиологического раствора, что может вызывать определенные трудности и ограничения при его практическом применении.
3. Осуществляемая обработка имплантата перед применением не позволяет предсказать сохранность фиброархитектоники и пластических свойств материала. Помимо этого, предлагаемая обработка не исключает недостаточную элиминацию достаточно токсичных консервирующих веществ, так как внутренняя поверхность сформированной трубки экспонируется хлороформом.
4. В представленной модели циркулярного дефекта стенки тонкой кишки резецировали недостаточно протяженный участок кишки – длиной 3-10 мм, преимущественно 3 или 10 мм. Соответственно аналогичная длина восстанавливаемого участка кишки 3-10 мм не позволяет утверждать о полноценном увеличении длины кишечной трубки в рамках лечения СКК.
Задачей изобретения является разработка способа восстановления дефекта тонкой кишки, обеспечивающего удлинение тонкой кишки, достижение адекватного заживления циркулярного дефекта со стимуляцией репаративной регенерации всех слоев стенки тонкой кишки.
Технический результат при использовании изобретения – регенерация всех слоев стенки тонкой кишки без явлений фиброза, восстановление физиологической целостности тонкой кишки с наличием адекватной сосудистой перфузии и иннервации.
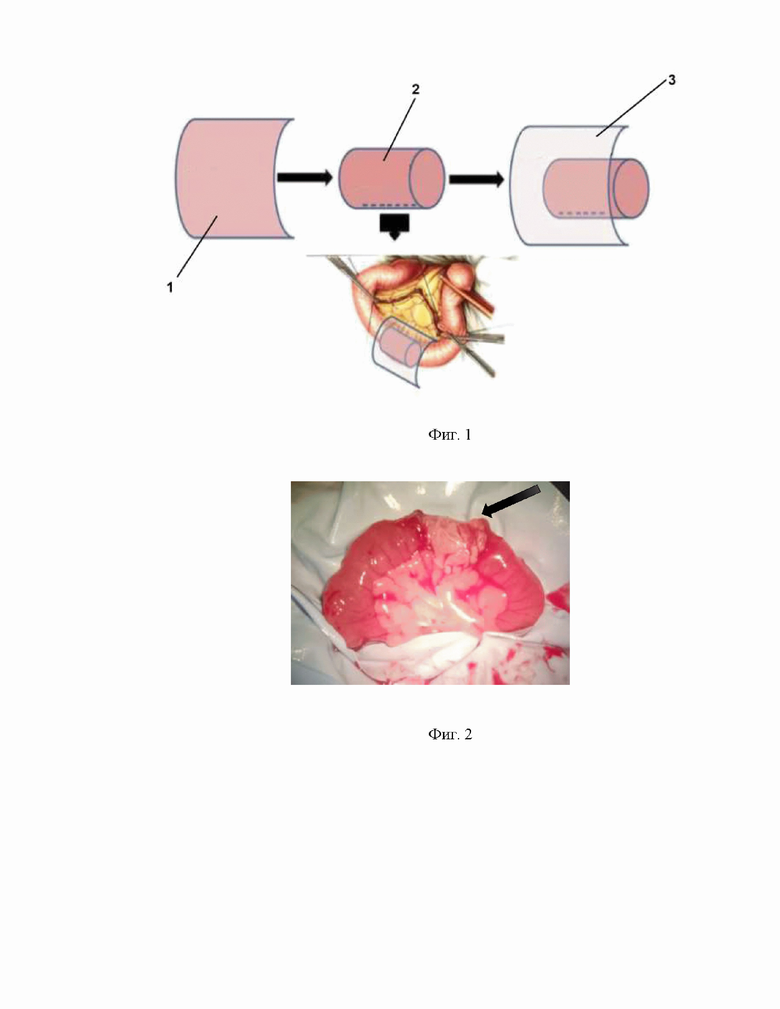
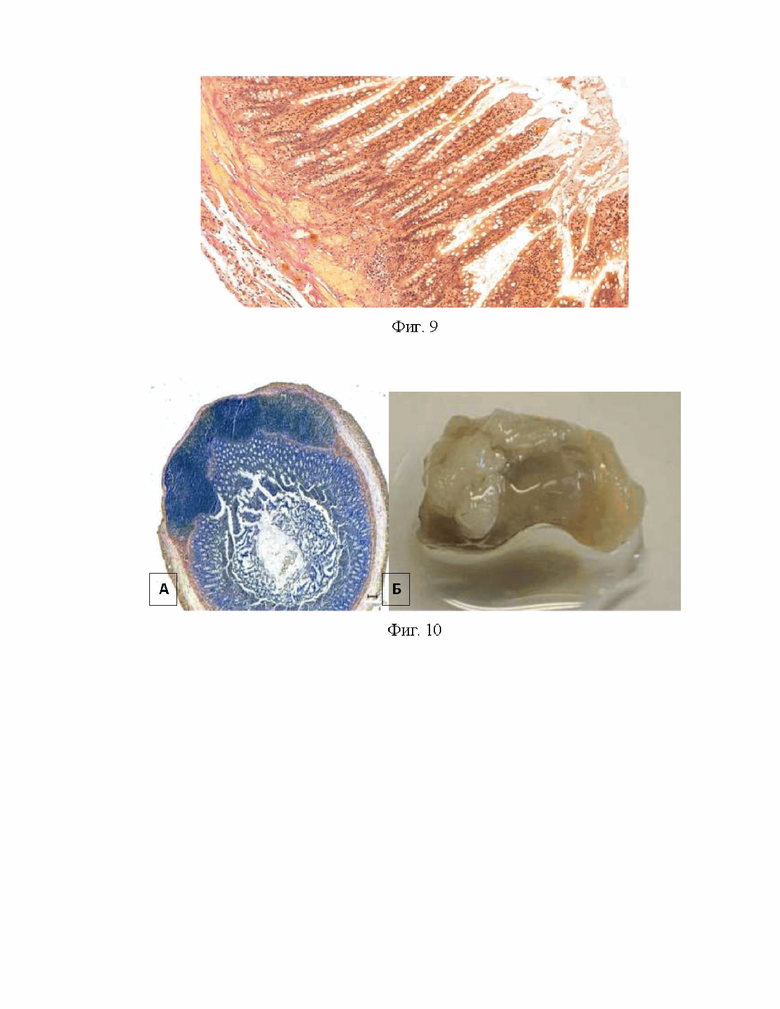
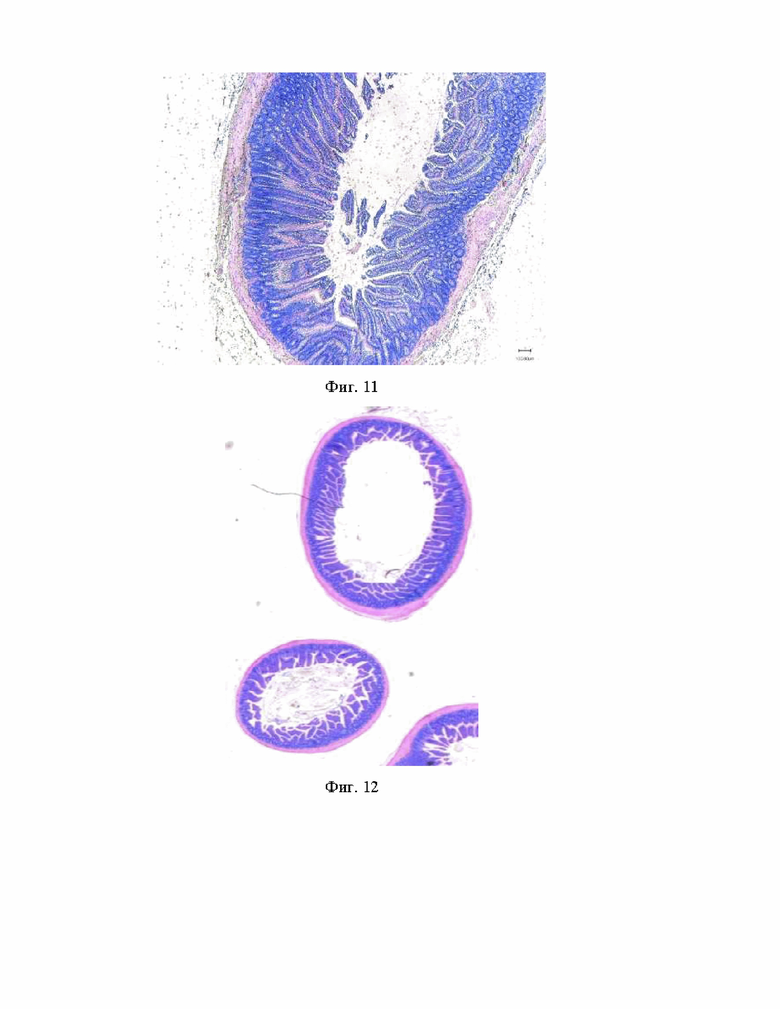
Изобретение иллюстрируется следующими фигурами: на фиг. 1 – схематически изображен предлагаемый способ, где 1 - децеллюляризированный матрикс, 2 – муфта, 3 – мембранный децеллюляризированный матрикс; на фиг. 2 – интраоперационная фотография АДМ из кишки крысы после имплантации; на фиг. 3 - 7 дней после трансплантации АДМ в дефект тонкой кишки. Окраска гематоксилином и эозином, где 4 - АДМ; на фиг. 4 - 7 дней после трансплантации АДМ в дефект тонкой кишки. Окраска гематоксилином и эозином, где 5 - монослой эпителиоцитов на границе с грануляционной тканью; на фиг. 5-14 суток после трансплантации АДМ в дефект тонкой кишки. Окраска гематоксилином и эозином; на фиг. 6 - поперечный разрез просвета кишки через 1 месяц после трансплантации АДМ. Окраска по Ван Гизону, где: 6 - грануляционная ткань на месте пересаженного аллогенного биоматериала; на фиг. 7 - новообразованная грануляционная ткань через 1 месяц после трансплантации АДМ. Окраска гематоксилином и эозином, где: А - коллагеновые волокна 7 имеют упорядоченную архитектонику. Б - гладкомышечные клетки 8 вдоль параллельно ориентированных новообразованных коллагеновых волокон. Окраска по Ван Гизону; на фиг. 8 - структура стенки тонкой кишки через 1 месяц после трансплантации АДМ: показан ангиогенез. Развитая сеть недифференцированных анастомозирующих кровеносных сосудов. Окраска по Ван Гизону. Нервные клетки в ганглии (стрелки). Окраска гематоксилином и эозином; на фиг. 9 - формирование стенки подвздошной кишки через 2 месяца после трансплантации АДМ в дефект кишки. Окраска по Ван Гизону; на фиг. 10 - состояние тонкой кишки крысы после трансплантации АДМ через 3 месяца, где: А - поперечный срез подвздошной кишки крысы через 3 месяца после операции. Окраска гематоксилином и эозином. Б – Макропрепарат илиоцекального угла; на фиг. 11 - формирование кишки крысы через 5 месяцев после трансплантации АДМ в дефект стенки кишки; на фиг. 12 - формирование стенки подвздошной кишки через 3 месяца после трансплантации АДМ в дефект кишки. Окраска гематоксилином и эозином.
Предлагаемый способ восстановления дефекта тонкой кишки в эксперименте осуществляется следующим образом. Крысе линии Wistar массой 200 - 240 г под эфирным наркозом выполняют срединную лапаротомию, в рану выводят петлю - дистальный отдел подвздошной кишки на брыжейке с питающими артериями и дренирующими венами. Далее удаляют часть кишки в виде циркулярного дефекта длиной от 2 до 3 см (преимущественно 3 см), между проксимальным и дистальным концами кишки имплантируют аллогенный децеллюляризированный матрикс (АДМ) 1 ткани кишечника крысы конец-в-конец в виде циркулярно уложенного лоскута через все слои стенки кишки с использованием нитей Vicryl 10-0, образующего муфту 2 (фиг. 1). Далее укрывают имплантат мембранным АДМ 3, изготовленным из аллогенной фиброзной капсулы почки, и петлей большого сальника, которую фиксируют серозно-мышечными швами для закрытия дефекта брыжейки (фиг. 2). Рану передней брюшной стенки ушивают послойно Vicryl 5-0.
Использование предлагаемого способа показало успешные результаты трансплантации АДМ in vivo с регенерацией всех слоев кишечной стенки с васкулогенезом и сохранением резидуального просвета и длины любой требуемой величины. Помимо этого, получение и техника имплантации АДМ менее сложны в реализации и достижении регенерации всех слоев стенки тонкой кишки и ее соединительнотканной оболочки без явлений фиброза.
Для апробации заявляемого способа было проведено восстановление циркулярного дефекта тонкой кишки крысы по предлагаемому способу с помощью трансплантации аллогенного АДМ. Проведен сравнительный анализ патоморфологических изменений тонкого кишечника после трансплантации АДМ на 7, 14, 21, 30, 60, 90 сутки после операции.
АДМ для экспериментальных животных был произведен на базе лаборатории консервации тканей Всероссийского Центра глазной и пластической хирургии Башкирского Государственного Медицинского Университета (далее ВЦГПХ БГМУ).
Для изготовления аллогенного децеллюляризированного матрикса ткани кишечника крысы подвергают механической очистке от остатков прилегающих тканей, промывают в проточной воде и помещают в 3% раствор перекиси водорода для удаления кровяных элементов (соотношение объема раствора к массе образца 10:1). Колбы с образцами ткани в растворе помещают на орбитальный шейкер «PSU-20i» (SIA BIOSAN, Латвия), (при 150 об/мин) на 30 мин. Затем образцы трижды последовательно отмывают в 0,9% растворе натрия хлорида. Далее ткани помещают в раствор 95 % этилового спирта и диэтилового эфира в соотношении 3:1 на 3 часа (на шейкере при оборотах 50 об/мин), после чего промывают дистиллированной водой в течение 3 часов, каждые 30 минут проводят замену раствора. Обработанные ткани помещают в стеклянные флаконы с консервирующим раствором 70% этилового спирта и глицерина в соотношении 3:1 и герметично укупоривают. Стерилизацию проводят ионизирующим излучением потоком быстрых электронов в дозе 1,5 Мрад. Сроки хранения при этом составляют 5 лет при комнатной температуре [патент RU 2189257, 2002]. Далее получают АДМ из фиброзной капсулы почки крысы. Для этого висцеральную ткань почки подвергают механической очистке от остатков прилегающих тканей и посторонних загрязнений, промывают в проточной воде, помещают в 3% раствор перекиси водорода на непродолжительное время (не более 15 минут) для удаления кровяных элементов и отполаскивают в изотоническом растворе натрия хлорида. Затем, для обезжиривания ткани помещают в раствор 95 % этилового спирта и диэтилового эфира в соотношении 3:1, после чего несколько раз промывают в изотоническом растворе натрия хлорида. Полученный АДМ из фиброзной капсулы почки крысы помещают в стеклянные флаконы с консервирующим раствором этилового спирта и герметично укупоривают. Стерилизацию проводят ионизирующим излучением потоком быстрых электронов в дозе не более 15 кГр (1,5 Мрад) [патент RU 2780831, 2022].
Осуществляемая физико-химическая обработка позволяет элиминировать клеточные компоненты тканей и максимально сохранить их исходную фиброархитектонику и пластические свойства.
Преимущества экспериментального аллогенного децеллюляризированного биоматерала, полученного из ткани тонкой кишки лабораторного животного (крысы), включают:
1. Длительное время хранения (консервации).
2. Позволяет заготовить заранее необходимый объем и количество.
3. Является иммунноинертными материалом.
4. Допускает возможность изготовления необходимого объема биоматериала, включая диаметр и длину для замещения сегментов кишки различного размера.
Для проведения экспериментальных исследований в работе использовались половозрелые крысы - самцы линии Wistar (n= 30) массой 200-240 г. Крыс содержат в пластиковых клетках при естественном освещении и температуре 22-24°С, кормят брикетированными комбикормами. Воду подают без ограничений. Все манипуляции с животным проводят в соответствии с этическими принципами, утвержденными этическим комитетом при ФГБОУ ВО БГМУ Минздрава России, протокол № 45. (Уфа, Россия) и установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях ETS N 123 (Страсбург, 18 марта 1986 г.)).
Группе крыс (n= 30) было проведено восстановление циркулярного дефекта тонкой кишки крыс по предлагаемому способу с помощью трансплантации аллогенного АДМ.
В ходе эксперимента крысам под эфирным наркозом выполняли срединную лапаротомию, в рану выводили петлю - дистальный отдел подвздошной кишки на брыжейке с питающими артериями и дренирующими венами. Далее удаляли часть кишки в виде циркулярного дефекта длиной от 2 до 3 см (преимущественно 3 см), между проксимальным и дистальным отделами кишки имплантировали АДМ кишечника крысы конец-в-конец в виде циркулярно уложенного лоскута через все слои стенки кишки с использованием нитей Vicryl 10-0, образующего муфту. Далее укрывали имплантат мембранным АДМ, изготовленным из аллогенной фиброзной капсулы почки, и петлей большого сальника, которую фиксировали серозно-мышечными швами для закрытия дефекта брыжейки. Рану передней брюшной стенки ушили послойно Vicryl 5-0. В послеоперационном периоде животных содержали в течение 48 часов на жидкой диете (глюкоза-5%), а затем возвращают на полноценный корм.
Животных выводили из эксперимента на 7, 14, 21, 30, 60, 90 сутки, иссекали место операции с окружающими тканями для проведения морфологического исследования.
Для проведения гистологического исследования кусочки ткани фиксировали в 10%-ном растворе нейтрального формалина, обезвоживали в серии спиртов возрастающей концентрации и заливали в парафин по общепринятой методике. Гистологические срезы готовили на микротоме LEICA RM 2145 (Германия), которые окрашивали гематоксилином и эозином, по Ван Гизону. Исследование и визуализацию препаратов проводили с использованием микроскопа Leica DMD 108 (Германия) со специализированным программным обеспечением.
Сравнительный анализ гистоморфологических изменений тонкой кишки после применения аллогенного трансплантата
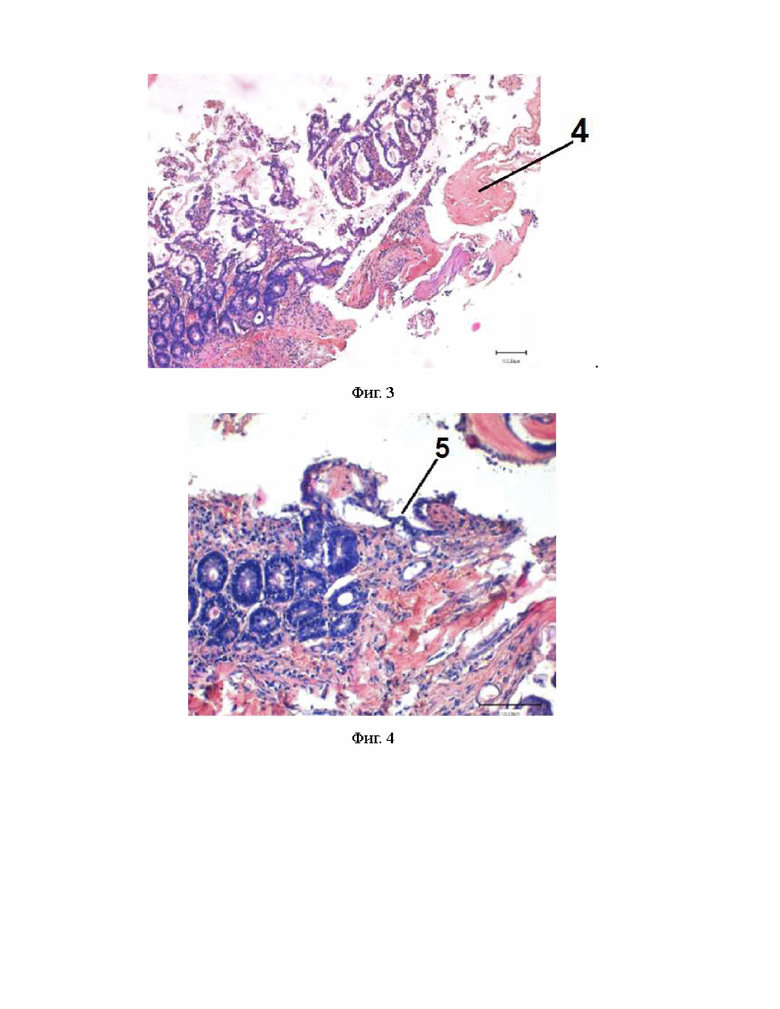
Через 7 дней после проведенной операции АДМ подвергался постепенной биодеградации и резорбции макрофагами. Параллельно он замещался грануляционной тканью, представленной рыхлой волокнистой соединительной тканью, инфильтрированной воспалительно-соединительнотканными клетками – макрофагально-фибробластическими с наличием лейкоцитов (фиг. 3).
На месте трансплантата формировалась незрелая грануляционная ткань. Со стороны просвета кишки определялись признаки наползания однослойного эпителия со стороны окружающих тканей на новообразованную грануляционную ткань (фиг. 4). Спустя 14 суток аллогенного биоматериала не было обнаружено и в центральной зоне. Он замещался грануляционной тканью, состоящей из разнонаправленных коллагеновых волокон, инфильтрированных макрофагально-фибробластическими клетками. Также выявлялась сеть новообразованных недифференцированных разнонаправленных гемокапилляров. Встречались наряду с макрофагами немногочисленные лимфоциты, нейтрофилы. В перифокальной зоне определялись признаки дифференциации эпителиальных клеток, появлялись единичные бокаловидные клетки, ворсинки удлинялись, формировалась собственная пластинка слизистой оболочки кишки (фиг. 5).
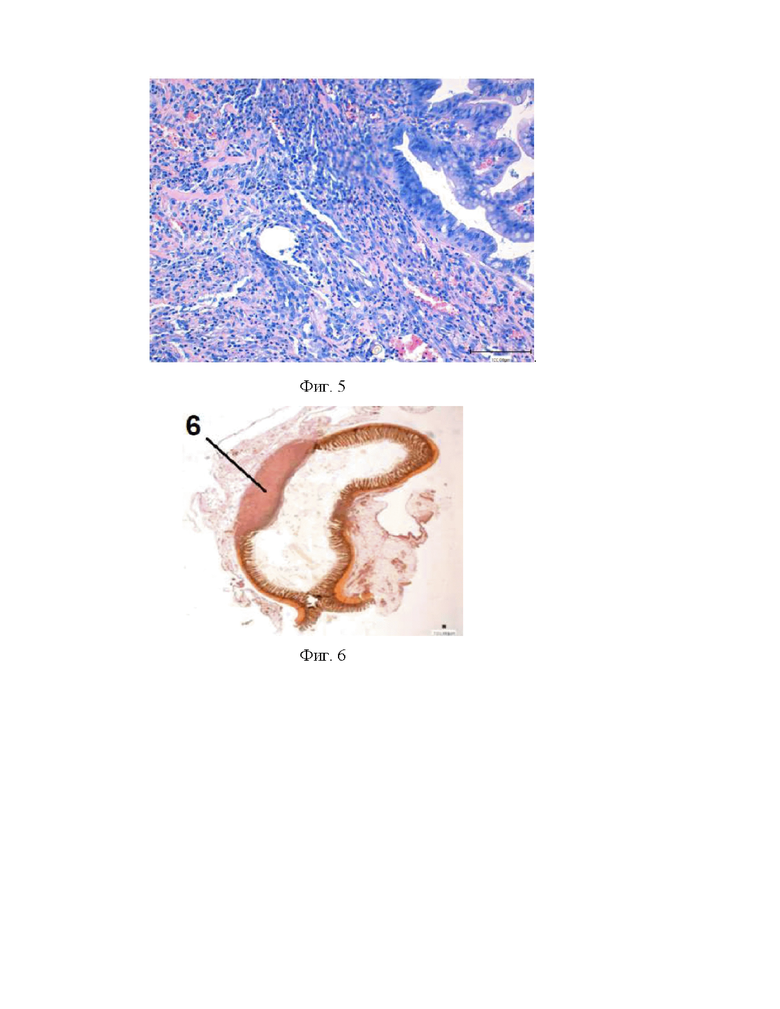
Спустя 1 месяц комплекс АДМ был полностью на всем протяжении замещен грануляционной тканью, в которой проявлялись признаки дифференциации.
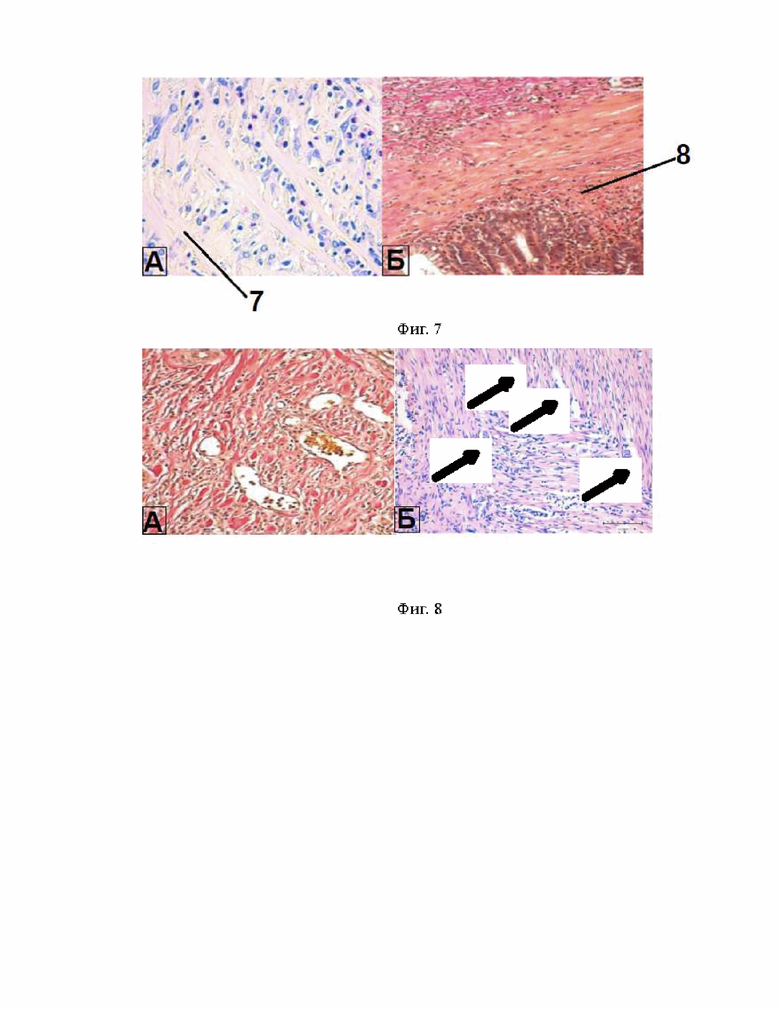
Пучки коллагеновых волокон приобретали одновекторное направление, параллельную ориентацию вдоль длины кишки. Между ними определялись соединительнотканные клетки: макрофаги в преобладающем количестве, фибробластические клетки (фиг. 6, 7). Наблюдались признаки миграции гладкомышечных клеток со стороны резецированной кишки из его мышечного слоя (как внутреннего циркулярного, так и наружного-продольного) в межволоконные промежутки новообразованной волокнистой соединительной ткани (фиг. 7).
Гемокапилляры дифференцировались в кровеносные сосуды венозного и артериального русла. В новообразованном мышечном слое наблюдались скопления нервных клеток ганглий мышечно-кишечного сплетения (фиг. 8).
Через 2 месяца после проведенного эксперимента наблюдались признаки восстановления практически всех слоев стенки, характерных для тонкой кишки. Отчетливо определялись ворсинки слизистой оболочки. Они были укорочены, в строме еще сохранялись признаки воспалительно-клеточной инфильтрации. В данном сроке обнаруживался утонченный слой лейомиоцитов. Наружный слой был представлен слоем рыхлой волокнистой соединительной ткани – адвентицией (фиг. 9).
Через 3 месяца обнаруживались признаки замещения дефекта с формированием мышечного слоя, представленного как внутренней пластинкой циркулярно расположенных гладких мышечных клеток, так и наружной, состоящих из продольно ориентированных клеток. Отмечалась вариабельность высоты ворсинок. Высота ворсинок составляла 57-69 мкм (в норме 500-700 мкм). Основу клеток ворсинок составляли призматические клетки, однако, среди них встречались многочисленные бокаловидные и клетки Панета. Собственная пластинка слизистой оболочки кишки состояла из рыхлой волокнистой соединительной ткани и содержала кровеносные сосуды и лимфатические капилляры. В слизистой оболочке выявлялись скопления лимфоидной ткани - Пейеровы бляшки, что соответствует нормальной структуре стенки тонкой кишки. Спаечный процесс не обнаружен (фиг. 10).
Следовательно, в начальные сроки эксперимента весь комплекс аллогенных биоматериалов резорбировался макрофагами. На его месте формировалась грануляционная ткань, которая со временем постепенно замещалась органоспецифичными тканями со стороны интактной зоны тонкого кишечника со всеми ее структурными элементами. На основе новообразованной волокнистой соединительной ткани дефект тонкой кишки зарастал мышечно-соединительнотканным регенератом. Мышечный слой тонкой кишки состоял из продольно и поперечно ориентированных гладких мышечных клеток. Слизистая оболочка с характерными многочисленными удлиненными ворсинками и подслизистая оболочки присутствовали, были обращены в просвет кишки. Снаружи мышечного слоя определялась фиброзная тонкая пластинка – адвентиция. Таким образом, в результате использования предлагаемого способа произошло восстановление архитектоники всех слоев стенки тонкой кишки со всеми структурными элементами.
Сущность изобретения поясняется следующими примерами.
Пример 1. Операцию проводят на крысе линии Wistar. Животное находится в пластиковой клетке при естественном освещении и температуре 22-24 °С с соблюдением 12-часового цикла день/ночь. В день операции осуществляют доступ только к воде. Под эфирным наркозом выполняют срединную лапаротомию, в рану выводят петлю (дистальный отдел) подвздошной кишки на брыжейке с питающими артериями и дренирующими венами. Далее удаляют часть кишки в виде циркулярного дефекта 2 см, между проксимальным и дистальным концами кишки имплантируют АДМ из кишки крысы конец-в-конец в виде муфты циркулярно уложенного лоскута через все слои стенки кишки с использованием нитей Vicryl 10-0. Далее укрывают имплантат мембранным АДМ, изготовленным из аллогенной фиброзной капсулы почки, и петлей большого сальника, которую фиксировали серозно-мышечными швами для закрытия дефекта брыжейки. Рану передней брюшной стенки ушивают послойно Vicryl 5-0.
В послеоперационном периоде животное содержат в течение 48 часов на жидкой диете (глюкоза-5%), а затем возвращают на полноценный корм. Лабораторное животное было выведено из эксперимента в срок 5 месяцев после операции. Спустя 5 месяцев в стенке подвздошной кишки в месте операции обнаруживались все характерные для нее слои. Слизистая оболочка состояла из ворсинок, покрытых однослойным призматическим эпителием. Они располагались на подложке из волокнистой соединительной ткани, содержащей кровеносные сосуды и лимфатические капилляры. Подслизистый слой состоял из рыхлой волокнистой соединительной ткани. В подслизистом слое определялись пейеровы бляшки (фиг. 11).
Пример 2. Через верхнесрединный доступ крысе линии Wistar под эфирным наркозом выводили тонкую кишку, резецировали участок кишки длиной 3 см, между проксимальным и дистальным концами кишки имплантировали АДМ кишечника крысы конец-в-конец в виде циркулярно уложенного лоскута через все слои стенки кишки с использованием нитей пролена 10/0, образующего муфту. Далее имплантат укрывали мембранным АДМ, изготовленным из аллогенной фиброзной капсулы почки, и петлей большого сальника, фиксируя их 4-мя серозно-мышечными швами. Рану брюшной стенки ушивали послойно проленом 4\0. Все операционные швы обрабатывали 2% раствором йодом. Содержание и уход за животными производились в соответствии с международными правилами и нормами. Животные находились по одному в клетке в стандартных лабораторных условиях с соблюдением 12-часового цикла день/ночь. В первый день после операции осуществлялось питание жидким сбалансированным питанием. Со второго и последующего дня допускался свободным доступом к стандартному твердому корму и воде.
Спустя 3 месяца после операции лабораторное животное было выведено из эксперимента. Был проведен анализ гистоморфологических изменений тонкой кишки после применения аллогенного трансплантата (фиг. 12). Собственная пластинка слизистой оболочки кишки в месте операции состояла из рыхлой волокнистой соединительной ткани и содержала кровеносные сосуды и лимфатические капилляры. Мышечный слой состоял из внутренней пластинки циркулярно расположенных гладких мышечных клеток, а наружный - из продольно-ориентированных. Некоторые зоны в области операции имели только циркулярный слой гладких мышечных клеток, представленный 3-4 рядами клеток. Также отчетливо определялись ворсинки слизистой оболочки. Спаечный процесс отсутствовал. Таким образом, наблюдались признаки восстановления всех слоев стенки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ ПОСТСПЛЕНЭКТОМИЧЕСКОГО СИНДРОМА В ЭКСПЕРИМЕНТЕ | 2003 |
|
RU2247567C2 |
| ТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ СОЕДИНИТЕЛЬНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2330675C2 |
| Способ восстановления функциональных свойств тканеинженерной конструкции диафрагмы | 2017 |
|
RU2654686C1 |
| Способ лечения печеночной недостаточности | 2016 |
|
RU2618989C1 |
| БИОСОВМЕСТИМАЯ КОМПОЗИЦИЯ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ И СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОЙ КОМПОЗИЦИИ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ | 2008 |
|
RU2385727C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ СОЗДАНИЯ ВЫСОКОРЕГЕНЕРАТИВНОГО РАНЕВОГО ПОКРЫТИЯ | 2022 |
|
RU2795904C1 |
| КОМПОЗИЦИЯ - ОСТЕОИНДУКТОР И ОСТЕОКОНДУКТОР, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ, И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ - ОСТЕОИНДУКТОРА И ОСТЕОКОНДУКТОРА, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ | 2008 |
|
RU2383564C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425647C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАХЕОБРОНХИАЛЬНОГО БИОИМПЛАНТА | 2011 |
|
RU2458635C1 |
| МНОГОМЕРНЫЙ БИОМАТЕРИАЛ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2010 |
|
RU2542430C2 |
Изобретение относится к экспериментальной медицине, а именно к тканевой инженерии, абдоминальной хирургии, гастроэнтерологии. Удаляют часть кишки в виде циркулярного дефекта длиной 2-3 см. В качестве биорезорбируемого кишечного трансплантата кишки имплантируют аллогенный децеллюляризированный матрикс (АДМ) ткани кишечника крысы конец-в-конец в виде циркулярно уложенного лоскута через все слои стенки кишки, образующего муфту. Укрывают имплантат мембранным АДМ, изготовленным из аллогенной фиброзной капсулы почки, и петлей большого сальника, которую фиксируют серозно-мышечными швами. Способ обеспечивает регенерацию всех слоев стенки тонкой кишки без явлений фиброза, восстановление физиологической целостности тонкой кишки с наличием адекватной сосудистой перфузии и иннервации. 12 ил., 2 пр.
Способ восстановления дефекта тонкой кишки в эксперименте, включающий удаление части кишки в виде циркулярного дефекта, имплантацию крысе между проксимальным и дистальным концами кишки биорезорбируемого кишечного трансплантата, отличающийся тем, что формируют циркулярный дефект размером от 2 до 3 см, в качестве биорезорбируемого кишечного трансплантата кишки имплантируют аллогенный децеллюляризированный матрикс (АДМ) ткани кишечника крысы конец-в-конец в виде циркулярно уложенного лоскута через все слои стенки кишки, образующего муфту, затем укрывают имплантат мембранным АДМ, изготовленным из аллогенной фиброзной капсулы почки, и петлей большого сальника, которую фиксируют серозно-мышечными швами.
| СПОСОБ ВОССТАНОВЛЕНИЯ ЦЕЛОСТНОСТИ ТОНКОЙ КИШКИ | 2013 |
|
RU2559921C2 |
| Летательный аппарат с реактивным движителем | 1921 |
|
SU4818A1 |
| WO 2017185853 A1, 02.11.2017 | |||
| CN 109602956 A, 12.04.2019 | |||
| КОСУЛИН А.В | |||
| и др | |||
| Тканеинженерные конструкции для компенсации синдрома короткой кишки //Вестник российской военно-медицинской академии, 2018, no | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Арматура для железобетонных свай и стоек | 1916 |
|
SU259A1 |
| HAN HOHYEON et al | |||
| "A Bioprinted Tubular Intestine Model Using a | |||
Авторы
Даты
2024-06-18—Публикация
2024-04-17—Подача