Область техники
Изобретение относится к области мезенхимальных стволовых клеток и их дифференцировке для образования многомерных тканей или биоматериалов или матриксов. Продукты изобретения могут применяться в ревматологии, восстановлении тканей и/или в хирургии, особенно в травматологии, ортопедии, пластической и челюстно-лицевой хирургии. Особенно полезными могут быть продукты изобретения при репарации или замещении костей или хрящей.
Уровень техники
Техника формирования тканей - развивающаяся область, в которой разрабатываются новые материалы для имплантации в организм. Одна из важных областей включает костные материалы для трансплантатов с целью замещения участков кости, утраченных при травме или заболевании (например, при удалении опухоли). Обычно материал для трансплантата может быть выделен из кости того же индивидуума, который получает трансплантируемый материал. Однако это требует дополнительной хирургической операции и дополнительного восстановления. Кость может быть взята также у других лиц или даже у трупов, но при этом возникают проблемы биосовместимости, а также риск переноса заболевания.
Были проведены исследования в области дифференцировки стволовых клеток для формирования тканей. Например, WO 2007/103442 описывает композицию, содержащую шелковую подложку и зрелую стволовую клетку, которая происходит из адипозной ткани.
Техническая проблема
Однако образование многомерных тканей для применения в качестве костного трансплантата или усиления кости или для реконструкции кости составляет реальную техническую проблему. Та же проблема остается в случае реконструкции хряща или исправления дефектов хряща.
Кроме того, имеется необходимость опыта в формировании тканевых материалов, которые должны быть полностью биосовместимыми и должны обеспечивать механические свойства, соответствующие поставленным задачам.
Сущность изобретения
Данное изобретение относится к природному человеческому остеоиндуктивному биоматериалу, имеющему многомерную структуру и содержащему ткань из дифференцированных мезенхимальных стволовых клеток (MSCs) и деминерализованного костного матрикса (DBM), который диспергирован в ткани из дифференцированных MSCs.
MSC, используемая для формирования ткани из дифференцированных MSCs, может быть человеческого или животного происхождения.
По первому воплощению, MSCs выделяли из адипозной ткани и поэтому они относились к мезенхимальным стволовым клеткам адипозной ткани (AMSCs).
По другому воплощению, MSCs выделяли из костного мозга и поэтому они относились к стволовым клеткам костного мозга (BMSCs). Соответственно MSCs, включенные в биоматериал по данному изобретению, - это стволовые клетки позднего пассажа, происходящие из адипозной ткани.
Биоматериал по данному изобретению предназначен для имплантирования в организм человека или животного. Имплантированный биоматериал может быть аутологичным или аллогенным. Биоматериал по данному изобретению может быть имплантирован в область кости или хряща. Биоматериал по данному изобретению может быть имплантирован в несимметричные области организма человека или животного.
Биоматериал по данному изобретению биосовместим.
Как правило, биоматериал по данному изобретению гомогенный, что означает, что структура и/или состав биоматериала одинаков по всей ткани. Как правило, биоматериал по данному изобретению имеет желаемую обработку и механические свойства, нужные для имплантации в естественную пораженную область.
По особому воплощению, биоматериал по данному изобретению можно удерживать хирургическим инструментом, не отрывая от него.
В одном воплощении изобретения биоматериал не должен включать никаких склеивающих или связывающих агентов.
В предпочтительном воплощении биоматериал по данному изобретению является трехмерным. В этом воплощении биоматериал по данному изобретению может образовывать толстую пленку толщиной по меньшей мере 1 мм. Размер биоматериала может быть подобран так, чтобы быть удобным для использования. В другом воплощении биоматериал образует подложку, так что биоматериал по данному изобретению не требует применения никакой другой синтетической подложки.
В другом воплощении биоматериал по данному изобретению может образовывать тонкую пленку менее 1 мм толщиной. В этом воплощении биоматериал считается двумерным.
По первому воплощению биоматериал по данному изобретению имеет те же свойства, что и настоящая кость с экспрессией остеокальцина и свойствами минерализации, то есть он содержит костные клетки и соединительную ткань. По особому воплощению биоматериал по данному изобретению содержит костные клетки (называемые также остеоцитоподобными клетками) и коллаген, предпочтительно кальцифицированный и минерализованный коллаген, костный матрикс и минеральную оболочку на костных клетках, причем оболочка образована из фосфокальциевых кристаллов. Как правило, биоматериал по данному изобретению имеет пористость, близкую к пористости настоящей кости.
По второму воплощению биоматериал по данному изобретению имеет те же свойства, что и натуральный хрящ, то есть содержит хондриоциты, внеклеточный матрикс, содержащий коллаген и протеогликаны.
Свойства реколонизации биоматериалов по данному изобретению могут зависеть от среды, окружающей имплант: биоматериал по данному изобретению может быть способен к реколонизации при помещении в костное окружение и может не быть способен к реколонизации в отсутствие костного окружения.
Биоматериал изобретения таков, что дифференцировка клеток биоматериала достигала конечной точки, а фенотип биоматериала останется неизменным после имплантирования. Имплант по изобретению может быть многослойным, т.е. он содержит по меньшей мере два слоя биоматериала, возможно, сшитых или прикрепленных друг к другу любым подходящим способом, например хирургическим клеем или любыми подходящими способами фиксации.
Как правило, биоматериал по данному изобретению включает деминерализованный костный матрикс в форме частиц со средним диаметром 50-2500 мкм; в первом воплощении частицы имеют средний диаметр 50-125 мкм, во втором воплощении частицы имеют средний диаметр 125-200 мкм, в третьем воплощении частицы имеют средний диаметр 500-1000 мкм. Как правило, деминерализованный костный матрикс получают от доноров младше 40 лет. По одному воплощению, скорость деминерализации костного матрикса составляет 90-99%, предпочтительно 95-98% и еще более предпочтительно около 97%. Такая скорость деминерализации преимущественно возникает при действии 0,6 N HCl в течение трех часов. По специфическому воплощению, деминерализованный костный матрикс стерилизуют.
По особому воплощению, деминерализованный костный матрикс предоставлен университетским банком тканей (Cliniques universitaires Saint-Lue, Bmssels, Belgium).
Данное изобретение относится также к способу формирования многомерного биоматериала, включающего инкубацию MSCs в остеобластной и/или хондрогенной среде в течение 15-25 дней и последующее добавление деминерализованного костного матрикса в упомянутую среду и дополнительное поддержание инкубации еще в течение 15-30 дней, предпочтительно 15-25 дней, более предпочтительно 20 дней; в течение дополнительного периода предпочтительно замещение среды каждые 2 дня без удаления деминерализованного костного матрикса.
Инкубация MSCs перед добавлением костного матрикса - это ключевой этап способа данного изобретения. Такой этап необходим для того, чтобы разрешить дифференциацию MSCs и превращение их в хондрогенные клетки и/или остеобластные клетки. Кроме того, этот этап необходим для получения трехмерной (3D) костноподобной структуры.
Согласно предпочтительному воплощению, MSCs представляют собой мезенхимальные стволовые клетки адипозной ткани позднего пассажа.
По одному воплощению, добавляют от 1 до 20 мг деминерализованного костного матрикса на 1 мл среды. Согласно предпочтительному воплощению, добавляют от 1 до 10 мг деминерализованного костного матрикса на 1 мл среды.
Наиболее предпочтительно, добавляют от 5 до 10 мг деминерализованного костного матрикса на 1 мл среды. Упомянутое количество деминерализованного костного матрикса - это оптимальная концентрация для создания трехмерной (3D) костноподобной структуры биоматериала.
По одному воплощению, все среды свободны от животных белков.
По второму воплощению, среда для дифференцировки содержит человеческую сыворотку. Желательно, чтобы среда для дифференцировки не содержала животной сыворотки, преимущественно, чтобы, она не сдержала никакой сыворотки, кроме человеческой.
Изобретение относится также к многомерному биоматериалу, получаемому по способу настоящего изобретения. Биоматериал, получаемый по способу настоящего изобретения, предназначен для имплантации в организм человека или животного. Имплантированный биоматериал может быть аутологичного или аллогенного происхождения. Биоматериал по настоящему изобретению можно имплантировать в область кости или хряща. Этот биоматериал может быть имплантирован в несимметричные области организма человека или животного. Предпочтительно, этот биоматериал имеет желаемую обработку и механические характеристики, требуемые для имплантации в естественную поврежденную область. Как правило, биоматериал, получаемый по способу данного изобретения, можно удерживать хирургическим инструментом, не отрывая от него.
В одном воплощении изобретения биоматериал не включает никаких склеивающих или скрепляющих агентов.
В другом воплощении, биоматериал, получаемый по способу данного изобретения, является трехмерным. В этом воплощении биоматериал может образовывать толстую пленку толщиной не менее 1 мм. Размер биоматериала может быть подобран как удобно для применения. В другом воплощении, биоматериал образует подложку: таким образом, биоматериал, получаемый по способу данного изобретения, не требует применения дополнительной синтетической подложки.
В еще одном воплощении, биоматериал, получаемый по способу данного изобретения, может образовывать тонкую пленку менее 1 мм. В этом воплощении биоматериал является двумерным.
По первому воплощению, биоматериал, получаемый по способу данного изобретения, имеет те же свойства, что и реальная кость, по отношению к экспрессии остеокальцина и свойствам минерализации, т.е. он содержит костные клетки и соединительную ткань. В одном воплощении, биоматериал содержит костные клетки (называемые также остеоцитоподобными клетками) и коллаген, предпочтительно кальцифицированный и минерализованный коллаген, костный матрикс и минеральную оболочку костных клеток, причем оболочка образована из фосфокальциевых кристаллов. Как правило, биоматериал по настоящему изобретению имеет пористость, близкую к пористости настоящей кости.
По второму воплощению, биоматериал, получаемый по способу данного изобретения, имеет те же свойства, что и реальный хрящ, т.е. он содержит хондриоциты, внеклеточный матрикс, содержащий коллаген и протеогликаны.
Биоматериал, получаемый по способу данного изобретения, таков, что дифференцировка клеток биоматериала достигла конечной точки, и фенотип биоматериала останется неизменным при имплантации. Имплант по данному изобретению может быть многослойным, т.е. он содержит по меньшей мере два слоя биоматериала, возможно, сшитых или скрепленных между собой любыми подходящими средствами, например хирургическим клеем или подходящими средствами фиксации.
Биоматериал, получаемый по способу данного изобретения, включает деминерализованный костный матрикс в форме частиц, имеющих диаметр 50-2500 мкм; в первом воплощении частицы имеют средний диаметр 50-125 мкм; во втором воплощении частицы имеют средний диаметр 125-200 мкм; в третьем воплощении частицы имеют средний диаметр от 500 до 1000 мкм. Как правило, деминерализованный костный матрикс получают от доноров младше 40 лет. По одному воплощению, скорость деминерализации костного матрикса составляет 90-99%, предпочтительно 95-98% и еще более предпочтительно около 97%. Такая скорость деминерализации преимущественно происходит в результате взаимодействия с HCl 0,6 N в течение трех часов. По специфическому воплощению, деминерализованный костный матрикс стерилизован.
Как правило, деминерализованный костный матрикс предоставлен университетским банком тканей (Cliniques universitaires Saint-Lue, Brussels, Belgium).
Изобретение относится к любому применению биоматериала по настоящему изобретению в качестве медицинского устройства или части медицинского устройства или в качестве фармацевтической композиции.
Изобретение относится также к набору, содержащему медицинское устройство, содержащее биоматериал по настоящему изобретению и подходящие средства фиксации, например хирургический клей или любую адгезивную композицию, которая является биосовместимой, не токсичной для хирургического применения и, возможно, саморассасывающейся и, в частности, для соединения биологических тканей друг с другом или с имплантируемым биоматериалом.
В другом аспекте изобретение относится к биоматериалу по настоящему изобретению для применения в способе облегчения состояния или лечения дефекта кости или хряща.
Это изобретение также относится к способу облегчения состояния или лечения дефекта кости или хряща у млекопитающих, причем упомянутый способ включает введение упомянутому млеконитающему, имеющему дефект кости или хряща, терапевтически эффективного количества описанного в заявке биоматериала.
Биоматериал применяют в терапевтически эффективном количестве для облегчения состояния или лечения дефекта кости или хряща у млекопитающих.
Не ограничивающие примеры дефекта кости или хряща - это перелом кости, хрупкость кости, потеря минеральной плотности кости, артриты, остеопороз, остеомаляция, остеопения, рак кости, болезнь Педжета, склеротические повреждения, инфильтрирующие заболевания кости, метаболическая потеря кости.
Изобретение относится также к применению биоматериала в ортопедии, особенно в челюстно-лицевой и пластической хирургии. Биоматериал по настоящему изобретению может применяться также в ревматологии.
Кроме того, изобретение относится к способу применения биоматериала по настоящему изобретению для поддержки или коррекции врожденных или приобретенных аномалий суставов, челюстно-лицевых костей черепа, ортодонтических процедур, послеоперационного замещения кости или костного сустава, травмы или других врожденных или приобретенных аномалий и для поддержания других скелетно-мышечных имплантов, особенно искусственных и синтетических имплантов.
В другом аспекте, данное изобретение относится к биоматериалу по настоящему изобретению для применения в качестве наполнителя полости в кости человека или животного.
Еще в одном аспекте изобретение относится к биоматериалу по настоящему изобретению для применения в реконструктивной или эстетической хирургии. Биоматериал по настоящему изобретению может быть аутологичным или аллогенным. Его можно применять при трансплантации ткани.
Изобретение далее относится к способу заполнения пустоты в кости человека или животного, причем упомянутый способ содержит этап введения биоматериала по настоящему изобретению.
Биоматериал по настоящему изобретению может применяться в качестве аллогенного импланта или в качестве аутологичного импланта.
Преимущество биоматериала заключается также в том, что он не иммуногенен и обладает иммуномодулирующим эффектом: удивительно, что в биоматериале по настоящему изобретению иммуномодулирующие свойства недифференцированных MSC сохраняются, приводя к тому, что имплантация биоматериала по настоящему изобретению в организм человека или животного не вызывает никакой воспалительной реакции: напротив, присутствие биоматериала ослабляет воспаление в месте имплантации.
Биоматериал по настоящему изобретению, таким образом, особенно подходит для лечения артрита, особенно воспалительного артрита, действуя как альтернатива противовоспалительным лекарственным препаратам или как средство уменьшить количество противовоспалительных препаратов, необходимых пациенту, страдающему от последствий упомянутого воспаления.
Преимущество биоматериала по настоящему изобретению заключается также в стимуляции ангиогенеза. Действительно, MSCs биоматериала высвобождают фактор роста сосудистого эндотелия (VEGF), который стимулирует рост новых кровеносных сосудов. Этот аспект изобретения является многообещающим, поскольку он создает оптимальные условия для образования кости или хряща.
Определения
В значении, употребляемом в данном изобретении, термин «ткань» относится к совокупности взаимосвязанных клеток, выполняющих сходную функцию в естественной ткани человека.
В значении, употребляемом в данном изобретении, термин «мезенхимальные стволовые клетки», или MSCs, - это мультипотентные стволовые клетки, которые могут дифференцироваться с превращением в различные типы клеток.
«Адипозный» относится к любой жировой ткани. Адипозная ткань может быть коричневой, желтой или белой адипозной тканью. Предпочтительно, адипозная ткань - подкожная белая адипозная ткань. Адипозная ткань включает адипоциты и строму. Адипозная ткань может быть найдена по всему телу животного. Например, у млекопитающих адипозная ткань присутствует в сальнике, костном мозге, подкожном пространстве, жировых телах (например, лопаточное или инфрапателлярное жировое тело) и в большинстве окружающих органов. Клетки, полученные из адипозной ткани, могут содержать первичную клеточную культуру или линию клеток-предшественников. Адипозная ткань может происходить из любого организма, имеющего жировую ткань.
Термин «клетка, происходящая из адипозной ткани» относится к клетке, которая образуется из адипозной ткани. Исходная клеточная популяция, выделенная из адипозной ткани, является гетерогенной клеточной популяцией, включающей клетки стромальной сосудистой фракции (SVF), но не ограничивающейся ими.
Используемый в данной заявке термин «мезенхимные стволовые клетки адипозной ткани» (AMSCs) относится к стромальным клеткам, которые образуются из адипозной ткани, могущей служить предшественником для ряда различных типов клеток, таких как адипоциты, остеоциты, хондроциты, но не ограничивается ими.
Используемый в данной заявке термин «мезенхимные стволовые клетки адипозной ткани позднего пассажа» относится к клеткам, демонстрирующим менее иммуногенные свойства по сравнению с клетками более раннего пассажа. Иммуногенность стромальных клеток, происходящих из адипозной ткани, соответствует числу пассажей. Предпочтительно, клетка должна пройти по меньшей мере до четвертого пассажа, более предпочтительно по меньшей мере до шестого пассажа и наиболее предпочтительно по меньшей мере до восьмого пассажа.
Используемый в данной заявке термин «биосовместимый» относится к любому материалу, который, будучи имплантирован в организм млекопитающего, не вызывает у млекопитающего неблагоприятной реакции. Биосовместимый материал при введении в организм не является токсичным или повреждающим для этого организма и не вызывает у млекопитающего иммунологического отторжения материала.
Используемый в данной заявке термин «аутологичный» относится к биологическому материалу, происходящему из того же организма, которому этот материал будет позднее вновь введен.
Используемый в данной заявке термин «аллогенный» относится к биологическому материалу, происходящему из генетически отличающегося индивидуума того же вида, что и индивидуум, которому этот материал будет введен.
Используемый в данной заявке термин «трансплантат» относится к клетке, ткани или органу, имплантированным в организм, как правило, для замещения, корректировки или же преодоления дефекта. Ткань или орган может состоять из клеток, происходящих из того же индивидуума; этот трансплантат относится к используемым в данной заявке взаимозаменяемым терминам: «аутографт», «аутологичный трансплантат», «аутологичный имплант» и «аутологичный графт». Трансплантат, содержащий клетки из генетически отличающегося индивидуума того же вида, относится к используемым в данной заявке взаимозаменяемым терминам: «аллографт», «аллогенный трансплантат», «аллогенный имплант» и «аллогенный графт». Трансплантат из индивидуума к его идентичному близнецу относится к используемым в данной заявке терминам: «изографт», «сингенный трансплантат» или «сингенный графт». Термины «ксенографт», «ксеногенный трансплантат» или «ксеногенный имплант» относятся к трансплантату от одного индивидуума к другому другого вида.
Используемые в данной заявке термины «трансплантация ткани» и «реконструкция ткани» относятся к имплантации графта индивидууму для лечения или облегчения дефекта ткани, например дефекта кости иди дефекта хряща.
Используемый в данной заявке термин «облегчить» заболевание, дефект, нарушение или состояние означает уменьшение тяжести одного или большего количества симптомов заболевания, дефекта, нарушения или состояния.
Используемый в данной заявке термин «лечить» означает уменьшение частоты, с которой пациент испытывает симптомы заболевания, дефекта, нарушения или неблагоприятного состояния и т.д.
Используемый в данной заявке термин «терапевтически эффективное
количество» означает количество композиции по данному изобретению, достаточное, чтобы обеспечить благоприятный эффект для индивидуума, которому эта композиция введена.
Используемый в данной заявке термин «дефект кости» относится к перелому, трещине, отсутствию части кости или подобным повреждениям. Такое повреждение может быть вызвано врожденной аномалией, заболеванием, лечением заболевания, травмой или костной инфекцией и может быть острой или хронической. Например, утрата кости может произойти в результате удаления опухоли, приводя, таким образом, к дефекту кости. Не ограничивающие примеры дефектов кости включают: переломы, костную или костнопозвоночную деформацию, остеосаркому, миелому, костную дисплазию, сколиоз, остеопороз, остеомаляцию, фиброзный остит, фиброзную дисплазию, почечную костную дистрофию и костную болезнь Педжета.
Используемый в данной заявке термин «дефект хряща» относится к хрящевой ткани, если она отсутствует, уменьшено ее количество или она иначе повреждена. Дефект хрящевой ткани может быть результатом врожденной аномалии, заболевания, лечения заболевания или травмы и может быть острой или хронической (остеоартрит).
Используемый в данной заявке термин «остеобластная и/или хондрогенная среда» означает отношение к культуральной среде, которая способствует росту и дифференцировке остеобластных и/или хондрогенных клеток.
Остеогененез хорошо индуцируется при добавлении к стандартной среде человеческой или животной сыворотки (обычно фетальной сыворотки теленка или быка (FCS, FBS), дексаметазона, аскорбата натрия, дигидрофосфата натрия, пенициллина и стрептомицина. Клетки поддерживают в остеогенной культуре, замещая среду каждые 2 дня.
В предпочтительном воплощении остеобластная среда - это стандартная среда, предпочтительно DMEM с добавлением 10% объемных долей (v/v) человеческой сыворотки, 1 мкМ дексаметазона, 50 мкг/мл аскорбата натрия, 36 мг/мл дигидрофосфата натрия, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина.
Хондрогенез хорошо индуцируется добавлением к стандартной среде человеческой или животной сыворотки (обычно фетальной сыворотки теленка или быка (FCS, FBS), дексаметазона, TGF-B3, L-пролина, аскорбата натрия, дигидрофосфата натрия, пирвувата натрия, ITS (инсулин-трансферрин-селена, например, из лиофилизованного порошка инсулин-трансферин-натрий селенитной добавки к среде, поставляемого Sigma), пенициллина и стрептомицина.
Предпочтительная хондрогенная среда - это стандартная среда, предпочтительно DMEM с добавлением 10% объемных долей (v/v) человеческой сыворотки, 1 мкМ дексаметазона, 10 нг TGF-B3, 40 мкг/мл L-пролина, 50 мкг/мл аскорбата натрия, 36 мг/мл дигидрофосфата натрия, 100 мкг/мл пирвувата натрия, 100 мкл/мл ITS (инсулин-трансферрин-селена, например, из лиофилизованного порошка инсулин-трансферин-натрий селенитной добавки к среде, поставляемого Sigma), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина.
Подходящие стандартные среды как для остеогенных, так и хондрогенных сред включают DMEM, ЕМЕМ, RPMI и GMEM, но не ограничиваются ими, причем DMEM - предпочтительная стандартная среда.
Используемый в данной заявке термин «подложка» относится к структуре различной формы, включающей пленки (например, в форме, где размеры по двум измерениям существенно больше, чем по третьему), ленты, шнуры, листы, плоские диски, цилиндры, сферы, 3-мерные аморфные тела и т.д., но не ограничиваются ими.
Краткое описание чертежей
Фиг.1. Фигура 1 демонстрирует дифференцировку AMSCs человека в остеогенной среде с добавлением человеческой сыворотки и DBM. Многослойная структура (А) с ретракцией ткани и соединительная ткань (В) были обнаружены с помощью окрашивания Trichrom Massons (С).
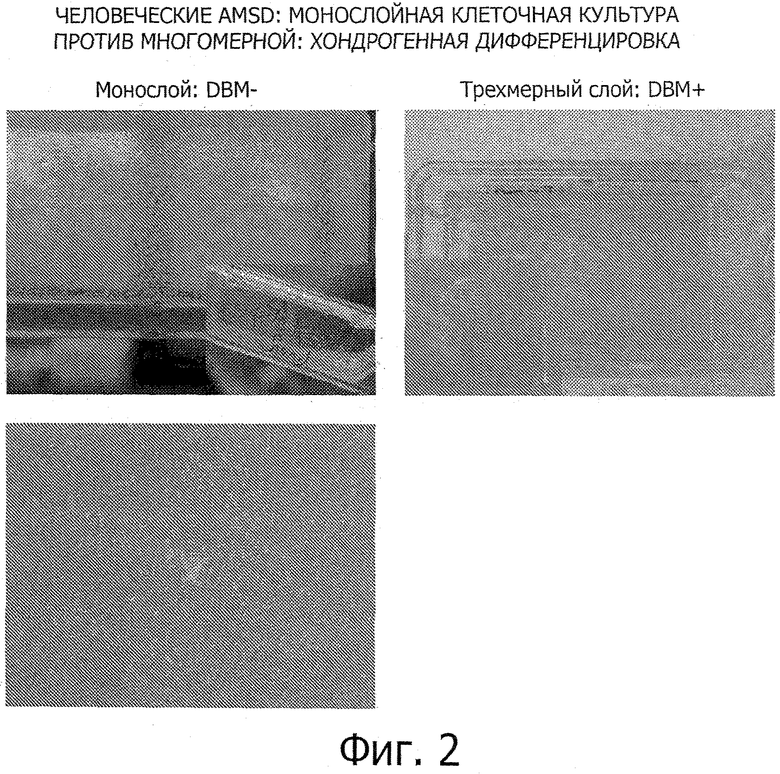
Фиг.2. Фигура 2 демонстрирует дифференцировку AMSCs человека в хондрогенной среде без (А, В) и с (С, D, Е) DBM. В хондрогенной среде без DBM монослойная структура (А) с конфлуентными клетками формировалась в хондрогенной среде без DBM (В). Напротив, многослойная структура (С), полученная при ретракции клеточной ткани (D), формировалась на хондрогенноподобном матриксе, окрашенном альциановым синим (Е и прямоугольник, с окраской по Гимза).
Фиг.3. Фигура 3 демонстрирует дифференцировку AMSCs человека в остеогенной среде без (А, В, С) и в присутствии (D, Е, F) DBM. Монослойная структура (А), составленная из индивидуальных костных узлов (окрашивание Ализарином красным. В) и внутриузловой коллагеновой тканью (С), формировалась на остеогенной среде без DBM. Напротив, ретракция клеточной ткани (D) с соединительной тканью (Е), образованная из минерализованного коллагена (F, Von Kossa окрашивание черным: левый прямоугольник) с остеокальцин-экспрессирующими клетками (F, правый прямоугольник), наблюдалась в присутствии DBM.
Фиг.4. Фигура 4 демонстрирует выживаемость BM-MSCs и AMSCs через 60 дней после имплантации в паравертебральные мышцы голых крыс. Мезенхимные стволовые клетки определяли иммуногистохимически с помощью антител к GFP и остеокальцину. Если имплантировали только кость, не было обнаружено экспрессии GFP и остеокальцин-окрашенных клеток. В случае композитных трансплантатов, состоящих из «MSC - человеческого костного графта», были обнаружены GFP и клетки с остеокальцином.
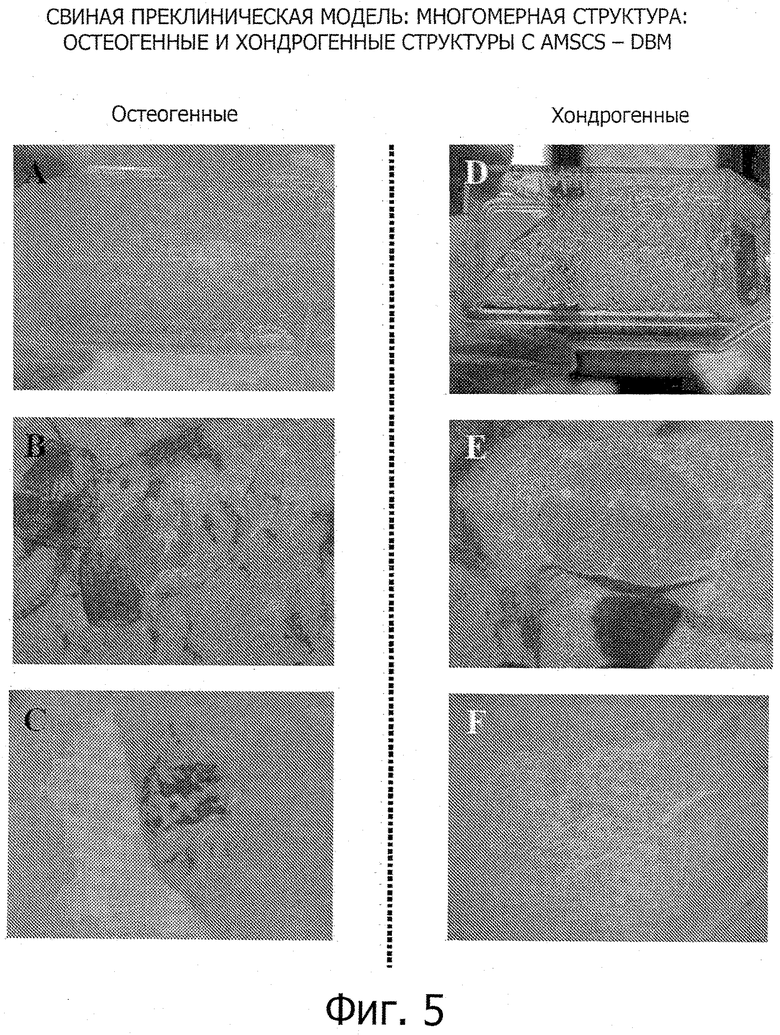
Фиг.5. Фигура 5 демонстрирует развитие многомерных структур для AMSCs, инкубированных в остеогенной (А-С) и хондрогенной (E-F) средах с добавлением DBM. Видны ретракция ткани (A, D), взаимосвязь с DBM (В, Е) и экспрессия белков остеокальцина (С) и протеогликана (F).
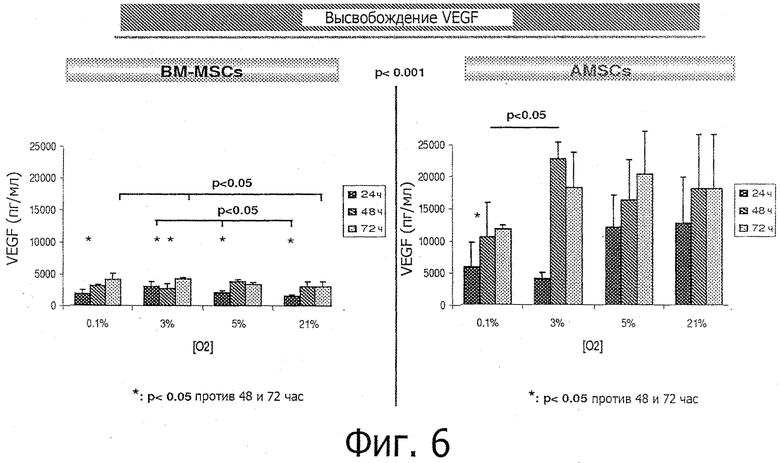
Фиг.6. Фигура 6 демонстрирует ангиогенный потенциал AMSCs, в сравнении с BM-MSCs. Потенциал in vitro определяли, инкубируя оба типа клеток при разных концентрациях кислорода (0,1, 3, 5 и 21% O2). AMSCs при всех концентрациях O2 демонстрировали значительно более высокое высвобождение VEGF, чем BM-MSCs.
Примеры
Пример 1
Приготовление многомерного материала по настоящему изобретению
Животные источники для AMSCs в преклинической модели
В качестве доноров костного мозга и адипозных стволовых клеток использовали зеленых флуоресцентных трансгенных свиней (Brunetti D, donning Stem Cells. Eupb 2008). Животных содержали согласно руководству Бельгийского министерства сельского хозяйства и ухода за животными. Все процедуры были утверждены местным комитетом по этике ухода за животными католического университета Louvain.
Источник AMSCs животного происхождения
Коллагеназу (0,075 г) растворяли в сбалансированном солевом растворе Хенкса (с ионами кальция) и хранили при 2-8°С перед расщеплением. Жировые ткани (в среднем 15 г) отмывали трижды 0,009% NaCl и нарезали в чашках Петри для удаления сосудов и фиброзной соединительной ткани. Жир взвешивали перед расщеплением и переносили в 50 мл флаконы, содержащие фермент. Ткань помещали на встряхивающуюся водяную баню при 37°С при постоянном покачивании в течение 60 минут. После расщепления коллагеназу инактивировали в DMEM (500 мл) с добавлением 50 мл человеческой сыворотки, L-глутамина (5 мл) и 5 мл антибиотиков (пенициллин/стрептомицин). Собранную ткань центрифугировали в течение 10 минут со скоростью 1500 оборотов в минуту при комнатной температуре (20-25°С). Супернатант, содержащий зрелые адипоциты, отсасывали. Осадок ресуспендировали в 20 мл среды для пролиферации (МР), образованной из DMEM с добавлением 10% человеческой сыворотки и антибиотиков (100 ед./мл пенициллина и 100 мкг/мл стрептомицина) и фильтровали через 500 мкм сетчатый фильтр. Собранную ткань (после фильтрации) центрифугировали 10 минут со скоростью 1500 оборотов в минуту при комнатной температуре (20-25°С), и осадок ресуспендировали в МР и идентифицировали его как клетки стромальной сосудистой фракции (SVF). Этот исходный пассаж первичных клеток обозначали как пассаж 0 (РО).
После 24-48 часов инкубации при 37°С и в присутствии 5% CO2 культуры отмывали PBS и сохраняли в МР до Р4 (четвертого пассажа) и затем подвергали дифференцировке в специфической среде (см. ниже).
Источник AMSCs человеческого происхождения
Человеческую жировую ткань (маленькие кусочки подкожной жировой ткани, 1-2 г, n=4) получали в процессе рутинных хирургических операций (абдоминальная и ортопедическая хирургия), сохраняли в холодном физиологическом растворе при 4°С для дальнейшей обработки. Расщепление человеческой жировой ткани выполняли, как было ранее описано, для обработки жировой ткани свиньи. После расщепления человеческие AMSCs культивировали в МР и подвергали дифференцировке в специфической среде (точный состав описан ниже), дополненной (i) фетальной бычьей сывороткой (10% объемных частей) или (ii) человеческой сывороткой (10% объемных частей).
Было показано, что AMSC подвергались дифференцировке в обеих дифференцирующих средах, как в среде, содержащей FBS, так и в среде, содержащей человеческую сыворотку.
Источник деминерализованного костного матрикса
Человеческий деминерализованный костный матрикс, получали от мультиорганных доноров из университетского банка тканей (Cliniques universitaires Saint-Luc, Brussels, Belgium). Диафизальный, бедренный или тибиальный участки кости вырезали и дробили на частицы размером меньше 1000 мкм для обработки с целью деминерализации (см. далее).
Человеческий деминерализованный костный матрикс получали путем измельчения кортикальных костей отобранных доноров. Сначала человеческую костную ткань обезжиривали в ацетоновой бане (99%) в течение суток и затем отмывали их деминерализованной водой в течение 2 часов. Декальцификацию осуществляли иммерсией в HCl 0,6 N в течение 3 часов (20 мл раствора на грамм кости) при покачивании при комнатной температуре. Затем деминерализованный костный порошок промывали деминерализованной водой в течение 2 часов и контролировали рН. Если рН оказывался слишком кислым, DBM забуферивали 0,1 М фосфатным раствором при встряхивании. Наконец, DBM высушивали и взвешивали. DBM стерилизовали гамма-облучением 25 kgray при замораживании.
Дифференцировка и характеристика стволовых клеток
Адипогенез
Конфлюэнтные культуры AMSCs индуцировали, чтобы вызвать адипогенез, замещая МР средой для индукции адипоцитов, состоящей из Iscove модифицированной среды Duibecco (IMDM) с добавлением 20% человеческой сыворотки, L-глутамина (5 мл) бычьего инсулина(5 мкг/мл), индометацина (50 мкМ), 3-изобутил-1-метил-ксантина (IBMX, 0,5 мМ), дексаметазона (1 мкМ) и пенициллина 100 ед/мл и стрептомицина 100 мкг/мл (Mauney JR, Biomaterials 2005, vol 26:6167). Клетки поддерживали в адипогенной культуре, заменяя среду каждые 2 дня. Культуры промывали PBS, фиксировали раствором формалина и определяли адипозную дифференцировку, окрашивая нейтральные липиды масляным красным.
Остеогенез
Конфлюэнтные культуры AMSCs индуцировали, чтобы вызвать остеогенез, используя среду для остеогенеза, полученную добавлением к DMEM человеческой сыворотки (10% весовых частей), дексаметазона (1 мкМ), аскорбата натрия (50 мкг/мл), дигидрофосфата натрия (36 мг/мл), пенициллина (100 ед/мл) и стрептомицина (100 мкг/мл) (См. фиг.3 - А, В, С). Клетки поддерживали в остеогенной культуре, заменяя среду каждые 2 дня. Культуры промывали PBS, фиксировали 70% этанолом и определяли остеогенную дифференцировку, окрашивая фосфат кальция ализариновым красным. Кроме того, для подтверждения «костного» фенотипа выполняли иммуногистохимическое определение остеокальцина и окрашивание по von Kossa.
Хондрогенез
Конфлюэнтные культуры AMSCs индуцировали, чтобы вызвать хондрогенез, используя среду для хондрогенеза, полученную добавлением к DMEM человеческой сыворотки (10% весовых частей), дексаметазона (1 мкМ), TGF-B3 (10 мг), L-пролина (40 мкг/мл), аскорбата натрия (50 мкг/мл), дигидрофосфата натрия (36 мг/мл), пирувата натрия (100 мкг/мл), ITS (инсулин-трансферрин-селен, например, из лиофилизованного порошка инсулин-трансферин-натрий селенитной добавки к среде, поставляемого Sigma), (100 мкг/мл), пенициллина (100 ед./мл) и стрептомицина (100 мкг/мл) (Taipaleenmaki Н, Experimental Cell Research 2008 vol 314; 2400). Клетки поддерживали в хондрогенной культуре, заменяя среду каждые 2 дня.
Влияние дифференцирующей среды (остеогенной и хондрогенной на AMSCs)
Рост
Состояние клетки и культуры
AMSCs выращивали в среде для пролиферации (МР) и поддерживали их при 37°С (95% воздуха и 5% CO2), пока 85-90% клеток не становились конфлюэнтными. Среду заменяли каждые 2 дня. Чтобы суспендировать клетки для цитотоксических исследований, клетки отделяли от культуральной колбы, обрабатывая их смесью 0 25% трипсин-ЭДТА в течение 10 минут при 37°С, и ресуспендировали в культуральной среде. Клетки высевали в 96-ячеечные микроплашки для MTS (3-[4,5диметилтиазол-2у1]-5-[3-карбоксиметоксифенил]-2-[4-сульфофенил]-2Н-тетразолиум бромид) с плотностью 1×104 клеток/ячейку. Их культивировали почти до слияния в течение 96 часов при 37°С перед экспозицией в различных исследованных средах: (i) MP, (ii) остеогенной среде и (iii) хондрогенной среде в течение 5 дней.
MTS исследование
После 24 часов контакта экстракта с клеткой добавляли непосредственно в каждую ячейку, содержащую 100 мкл экстрагированной среды, по 20 мкл «Cell titer 96® AQueous One Solution Cell Proliferation Assay» (Promega, Madison, WI). Клетки инкубировали 3 часа при 37°С, используя микротитровальный плашечный спектрофотометр (Multiscan Ex, Labsystems, Brussels, Belgium). Реперная длина волны равнялась 690 нм. Определяли разность значений оптической плотности OD=OD492 нм - OD690 нм.
Было показано, что дифференцировка происходила, только если использовали специфическую дифференцирующую среду.
Формирование многомерной структуры
После 15-20 дней инкубации AMSC (субкультура, пассаж 4) в специфической среде (остеогенной или хондрогенной) добавляли деминерализованный костный матрикс (DBM) к остеогенной и хондрогенной средам, получая многомерную структуру (1 мг DBM/мл дифференцирующей среды) еще на дополнительный период 20 дней. Среду заменяли каждые 2 дня, не удаляя DBM.
В конце дифференцировки промывали культуры PBS и фиксировали их в растворе формалина для гистологической оценки на остеокальцин с помощью окрашивания апьциановым синим и Гимза (фиг.2 - С, В, Е, фиг.3 - D, Е, Р).
Осажденные клетки фиксировали в 4% параформальдегиде в течение ночи. Последовательные срезы (толщиной 5 мкм) помещали на предметные стекла с помощью деминерализованной воды, высушивали 12 часов при 37°С и подвергали иммунно-классическому определению гистохимии. Эндогенную пероксидазную активность блокировали, помещая срезы в перекись водорода (0,3% H2O2) на 30 минут. После промывания в солевом растворе, забуференном трис-тритоном (TBS-0.05M, 0,05%, рН=7,4), стекла инкубировали 30 минут при комнатной температуре с нормальной козьей сывороткой (1: 10; BIOSYS, Boussens, France) и в течение ночи с первичными антителами для окрашивания остеокальцина (антиостеокальцин моноклональные мышиные антитела-АВСАМ, Cambridge, UK) при разбавлении 1:100. После отмывания трис-TBS стекла инкубировали в течение 1 часа с вторичными антимышиными иммуноглобулинами IG для определения иммунопероксидазы.
Структуру коллагена исследовали с помощью Masson's Trichrom на каждом образце всех типов недифференцированных/дифференцированных клеток. Фибробластные клетки, инкубированные в средах для пролиферации и дифференцировки (остеогенной, хондрогенной и адипогенной), служили отрицательным контролем.
Хондроциты, секретирующие протеогликан, окрашивали альциановым синим и красителем Гимза.
AMSCs окрашивали насыщающим количеством моноклональных CD90 антител, конъюгированных с фикоэритрином (РЕ). По меньшей мере 15000 событий анализировали с помощью флоуцитометра (FACScan, BD Biosciences) с программным обеспечением Celiquest.
Как в остеогенной, так и в хондрогенной дифференцирующих средах с добавлением DBM наблюдалось формирование трехмерной структуры из клеточных конструкций, благодаря синтезу коллагена и перегруппировке частиц деминерализованного костного матрикса (см фиг.5 А-Е). Под микроскопом наблюдались экспрессия остеокальцина и секреция протеогликана в остеогенных (фиг.5С) и хондрогенных (фиг.5Р) условиях соответственно.
Имплантация in vivo и гистологический анализ
Дифференцированные до остеобластов GFP-свиней AMSCs высевали на человеческий обработанный/освобожденный от клеток костный матрикс (Dufrane D, Eur Cell Mater, vol 1; 52, 2001), поставляемый университетским банком тканей (University clinical hospital Saint-Luc, Brussels<Belgium). Композитный графт имплантировали подкожно в паравертебральную область голым крысам (2 импланта/реципиент и п=10) (6-8 недельные самцы). После 60 дней животных забивали, и импланты эксплантировали для иммунохимического исследования. Затем импланты декальцифицировали в НС1, подготавливали и заливали в парафин, после чего готовили срезы (5 мкм). Затем выполняли иммуногистохимические исследования, определяя остеокальцин (Masson's Trichrom) и «зеленый флуоресцентный белок» (моноклональные антитела).
Пример 2
Потенциал многомерного костноподобного графта из адипозных мезенхимных стволовых клеток
Материалы и методы
Выделение свиных и человеческих AMSCs
Для этих экспериментов выделяли свиные и человеческие AMSC, как описано в примере 1.
Способность к ангиогенезу AMSCs invitro
Для оценки in vitro проангиогенной способности стволовых клеток в условиях нормоксии и гипоксии свиные MSC из костного мозга и MSC из адипозной ткани помещали в гипоксическую камеру на 24, 48 и 72 часа при 0,1, 3, 5 и 21% О2 и определяли высвобождение VEGF с помощью ELISA.
Оптимизация многомерной структуры деминерализованным костным матриксом.
Индуцировали AMSCs для стимуляции остеогенеза путем добавления к МР фетальной бычьей сыворотки (FBS, 10% объемных частей), дексаметазона (1 мкМ), аскорбата натрия (50 мкг/мл), дигидрофосфата натрия и пенициллина 100 ед./мл и стрептомицина 100 мкг/мл. Клетки поддерживали в остеогенной культуре, заменяя среду каждые 2 дня (Post et al. Bone 2008, 43, 1; 32-39, Qu et al. in vitro cell. Dev. Biol. Anim. 2007; 43; 95-100). Культуры промывали PBS и фиксировали в 70-процентном этаноле, и остеогенную дифференцировку определяли с помощью окрашивания фосфата кальция ализариновым красным. Кроме того, для подтверждения «костного» фенотипа выполняли иммуногистохимическое окрашивание на остеокальцин и окрашивание по von Kossa.
Многомернаая структура с AMSC была получена путем коинкубации в присутствии «деминерализованного костного матрикса (DBM), полученного из университетского банка тканей (University clinical hospital St-Luc, Brussels, Belgium). Образование деминерализованного костного матрикса описано в примере 1) Источник деминерализованной кости.
Матрикс
Эффективность DBM оценивали путем: (i) измерения остаточной концентрации кальция после процесса деминерализации (>97% снижения уровня кальция) и (ii) определения in vivo (у голых крыс) остеогенного потенциала через 1 месяц после имплантации.
После инкубации AMSC (субкультура Пассаж 4) в остеобластной среде в течение в среднем 15-18 дней добавляли в специфическую дифференционную среду разные концентрации (0/1/5/10 и 20 мг/мл) DBM. Среду заменяли каждые 2 дня, не удаляя DBM. Степень 3-D структуры, клеточную структуру, экспрессию остеокальцина и окрашивание по Von Kossa (для отложений кальция) оценивали, чтобы выбрать соответствующую концентрацию DBM для 3-D костноподобной структуры.
Процедура имплантации и наблюдение за многомерной структурой с деминерализованным костным матриксом и AMSCs
AMSCs, полученные из остеогенной культуры (после пассажа 4) с оптимальной концентрацией DBM (для многомерной структуры), собирали для имплантации.
Голых крыс (Charles River Laboratories International, Inc., Wilmington, Massachusetts, USA) использовали в качестве реципиентов. Клетки имплантировали в параспинальные мышцы. Делали продольный разрез в центре позвоночника и рассекали кожные ткани, чтобы обнажить фасции. Многомерную структуру непосредственно (Университетский банк тканей, Universite Catholique de Louvain, Brussels, Belgium) имплантировали в паравертебральную мускулатуру. Контроль обеспечивали, имплантируя лиофилизованную губчатую кость в контрольные латеральные параспинальные мышцы той же крысы. Фасции закрывали, используя нерассасывающийся шов, чтобы обеспечить легкое восстановление места имплантации. Животных забивали и выполняли эксплантацию на 30-й день трансплантации с помощью внутрисердечных инъекций Т61 (Intervent Int. GmbH-D, Germany) под общей анестезией. Импланты затем собирали и исследовали гистологию и микро компьютерную томографию.
Реципиенты-свиньи
Графты тестировали на двух разных хирургических моделях. Авторы изобретения анализируют: (i) их способность реконструировать кортикальный дефект бедренной кости и (ii) их способность к сращиванию (межпозвонковому спондилодезу) в передней поясничной области (ALIF).
(i) Модель кортикального дефекта кости хорошо известна в экспериментальной ортопедической хирургии и в лаборатории авторов, главным образом, благодаря работе профессора Delloye. Свиней использовали в аналогичных моделях, где создавали сегментный диафизарный дефект длинной кости, который затем заполняли графтовым материалом или оставляли пустым. В экспериментах авторов изобретения оперировали оба бедра. Создавали 1,5 см кортикальный дефект кости, стабилизировали его стандартной 4,5 мм титановой давящей ограничительной пластинкой. Дефект одного бедра оставляли пустым, а в противоположную ногу имплантировали AMSC графт.
(ii) ALIF модель хорошо разработана в экспериментальной хирургии на свиньях. Применяемая техника состоит из четырехуровневой ALIF процедуры с заднелатеральным приближением. Срастание достигалось с помощью межпозвонковой камеры из полиэтилэтилкетона (PEEK). Открывали межпозвонковый диск и удаляли студенистое ядро, рассверливали хрящ, обнажая субхондральную кость, после чего вставляли PEEK камеру. Эти камеры исходно пустые, но могут быть заполнены различными экспериментальными материалами. В этом случае каждый уровень получит свою трансплантируемую ткань, образуя четыре разных группы: одну камеру оставляют пустой в качестве отрицательного контроля, одну заполняют лиофильно высушенной облученной губчатой костью (что часто используют в клинической практике), одна камера содержит аутологичный пористый костный графт (рассматриваемый как золотой стандарт в процедуре сращивания и являющийся поэтому положительным контролем) и последняя камера содержит AMSC графт. Животных забивали и осуществляли эксплантацию через 7 недель после трансплантации с помощью внутрисердечных инъекций Т61 (Intervent Int.GmbH-D, Germany) под общей анестезией. Импланты затем собирали и исследовали гистологию и микрокомпьютерную томографию.
Дальнейшее исследование
Голые крысы
Эксплантированные импланты декальцифицировали в HCl, обрабатывали, заливали в парафин и готовили срезы (5 мкм). Для гистологического окрашивания использовали стандартное окрашивание эозином, Masson's Green Trichrom, окрашивание остеокальцина и окрашивание по Van Kossa. Окрашивание остеокальцина осуществляли с помощью моноклональных антител (ОС4-30, Abeam, Cambridge), обнаруживаемых с помощью Envision Rsystem monoclonal antibody (Dako, Denmark). Микроструктуру собранных имплантов анализировали, используя pQCT (периферическое количественное устройство для компьютерной томографии, model XCT Research SA, Stratec, Pforzheim, Germany). Кортикальную и общую плотность кости измеряли на многократных срезах каждого импланта. Количественную оценку неоангиогенеза in vivo выполняли путем количественного определения вновь образованных сосудов после окрашивания von Willebrandi (см. выше).
Свиньи
Свиней содержали индивидуально со свободным доступом к пище и воде. Послеоперационный уход и анальгезию осуществляли согласно стандартным протоколам ухода за экспериментальными животными. В модели с аутотрансплантатом биологическое завершение будет включать оценку воспаления по образцам крови.
Дальнейшее радиологическое исследование позволяет сравнить in vivo образование кости с помощью компьютерной томографии (СТ), причем сканирование осуществляли через 1, 5 и 7 недель после имплантации. Высокое разрешение и многоплоскостные реконструкции клинических СТ срезов настолько точны, что авторы изобретения могли анализировать содержимое камер PEEK in vivo, оценивая таким образом процесс реконструкции.
Ту же процедуру применяли на бедренной кости, причем всю информацию получали с одной сканирующей развертки. Еще лучшее разрешение получали после эвтаназии животного, исследуя эксплантированные графты с помощью микро-СТ. В настоящее время все шире применяются гистологические и иммуногистохимические исследования на эксплантированных графтах для оценки образования новой кости и реваскулизации графта (фактор роста сосудистого эндотелия, CD51, фактор Виллебрандта), консолидации (остеокальцин) и минерализации (von Kossa) по сравнению с естественным кортикальным срастанием и способностью к реконструкции.
Процесс декальцификации позволяет осуществлять гистологические и иммуногистохимические исследования трансплантированного материала. Гистология, гистоморфометрия и микрорадиография требуют поддержания ткани в кальцифицированном состоянии, поэтому обязательным является отсутствие декальцификации.
Статистика
Статистическую значимость различий между группами оценивали с помощью однофакторного дисперсионного анализа с тестом Bonferroni post hoc. Статистические тесты выполняли с использованием Systat, версия 8. Различия считали достоверными при р<0,05.
Результаты
Проверка концепции многомерной структуры с оптимальной концентрацией DBM: костноподобная структура in vitro
Чтобы избежать использования биологической подложки при трансплантации клеток AMSC, была разработана многомерная структура в комбинации с DBM. Деминерализованный костный матрикс (со средним диаметром 700 мкм), обладающий способностью стимулировать in vivo остеогенную дифференцировку у голых крыс (Контроль качества, необходимый перед применением в контакте с AMSCs), требуется для достижения клеточной реконструкции in vitro при коинкубировании с AMSCs.
В обеих остеогенных дифференцирующих средах добавленный DBM индуцировал формирование трехмерной структуры, благодаря сокращению клеток, синтезу коллагена и перегруппировке частиц DBM по сравнению с AMSC без DBM. Чтобы оптимизировать развитие многомерной структуры тестировали добавление разных доз DBM. Показано, что самые высокие концентрации (более 20 мг/мл) не подходили. Концентрация 1 мг/мл не способствовала образованию оптимальной 3-D структуры для графта, пригодного для хирургического применения. Напротив, оказалось, что 5 и 10 мг/мл обеспечивают оптимальную ретракцию ткани для удаления графта и для хирургического применения. При этих последних концентрациях DBM были показаны микроскопически экспрессия остеокальцина и процесс минерализации (окрашивание по von Kossa). Для получения трехмерной структуры с AMSCs в остеогенных условиях требуется в среднем 20±3 дня коинкубирования с DBM.
Проверка концепции многомерной структуры с оптимальной концентрацией DBM: остеогенез in vivo
Голые крысы
Через 30 дней после имплантации голым крысам одних клеток AMSCs без DBM не происходило образования новой костноподобной структуры. При окраске по Von Kossa только небольшие костные узлы (остеокальцин+) были негусто распределены в мускулатуре голых крыс. Напротив, имплантация многомерной структуры легко выполнялась с хорошей локализацией в месте имплантации. Через 30 дней после имплантации в мышце находили компактную/крепкую структуру с микроскопическими плотными участками соединительной ткани внутри частиц DBM.
Была обнаружена костноподобная структура с окрашивающейся остеокальцином соединительной тканью и процессом минерализации.
Реципиенты-свиньи
Через 5 недель после имплантации у свиней не наблюдалось спонтанного зарастания костного дефекта бедра (без лечения) по результатам СТ-сканирования. Легко включить многомерную структуру в дефект кости без какой-либо подложки. Этот последний графт значительно улучшает зарастание кости в ранний период после имплантации (5 недель после трансплантации) с образованием костноподобной структуры, восстанавливающей кортикальный дефект кости.
Проверка концепции многомерной структуры с оптимальной концентрацией DBM: ангиогенез in vivo
Для оценки in vitro проангиогенных свойств стволовых клеток в условиях нормоксии и гипоксии помещали преклинические свиные MSC из костного мозга и из адипозной ткани в гипоксические камеры на 24, 48 и 72 часа при 0,1, 3, 5 и 21% О2 и количественно определяли высвобождение VEGF с помощью ELISA. BM-MSC высвобождали больше VEGF в гипоксических, чем в нормоксических условиях и сохраняли секрецию во времени с более высоким уровнем VEGF при 48 и 72 часах инкубации, чем при 24 часах (р<0,05). Напротив, высвобождение VEGF из AMSC было одинаковым в разных условиях культивирования, но AMSC высвобождали значительно больше VEGF, чем BM-MSC (11274±679 по сравнению с 2364±94 пг/мл соответственно; р<0,05) (фиг.6).
Эти результаты были подтверждены in vivo после трансплантации BM-MSC и AMSC. В случае трансплантации остеогенных AMSCs наблюдался значительно более высокий ангиогенез, чем при трансплантации BM-MSC (р<0,05).



Группа изобретений относится к медицине. Описан биоматериал, имеющий многомерную структуру и содержащий дифференцированную MSCs ткань и деминерализованный костный матрикс, который диспергирован в дифференцированной MSCs ткани, способ его приготовления и применение. Биоматериал имеет желаемую обработку и механические свойства, нужные для имплантации в естественную пораженную область. 6 н. и 11 з.п. ф-лы, 6 ил., 2 пр.
1. Биоматериал, имеющий многомерную структуру и содержащий дифференцированную ткань из мезенхимальных стволовых клеток и деминерализованный костный матрикс для восстановления или замещения хряща или кости, где деминерализованный костный матрикс диспергирован внутри дифференцированной ткани из мезенхимальных стволовых клеток, и мезенхимальные стволовые клетки представляют адипозные мезенхимальные стволовые клетки.
2. Биоматериал по п.1, в котором мезенхимальные стволовые клетки, применяемые для формирования указанной дифференцированной ткани, имеют человеческое или животное происхождение.
3. Биоматериал по п.1, в котором мезенхимальные стволовые клетки представляют адипозные мезенхимальные стволовые клетки позднего пассажа.
4. Биоматериал по п.1, который является трехмерным.
5. Биоматериал по п.1, который содержит остеоциты, покрытые минеральной
оболочкой, и соединительную ткань, включающую коллаген.
6. Биоматериал по п.1, который содержит хондроциты и внеклеточный матрикс, содержащий коллаген и протеогликаны.
7. Биоматериал по п.1, в котором деминерализованный костный матрикс находится в форме частиц, имеющих средний диаметр 50-2500 мкм.
8. Имплант для восстановления или замещения хряща или кости, содержащий биоматериал по любому из пп.1-7.
9. Способ получения многомерного биоматериала для восстановления или замещения хряща или кости, включающий инкубирование мезенхимальных стволовых клеток в остеобластной и/или хондрогенной среде в течение 15-25 дней, последующее добавление деминерализованного костного матрикса в указанную среду и продолжение инкубации еще в течение 15-30 дней, причем мезенхимальные стволовые клетки представляют адипозные мезенхимальные стволовые клетки.
10. Способ по п.9, в котором остеобластная среда представляет цобой стандартную среду, дополненную челочеческой сывороткой, дексаметазоном, аскорбатом натрия, дигидрофосфатом натрия, пенициллином и стрептомицином.
11. Способ по п.9, в котором хондрогенная среда представляет цобой стандартную среду, дополненную челочеческой сывороткой, дексаметазоном, TGF-B3, L-пролином, аскорбатом натрия, дигидрофосфатом натрия, пируватом натрия, инсулин-трансферрин-селениумом, пенициллином и стрептомицином.
12. Способ по п.9, в котором деминерализованный костный матрикс добавляют в указанную среду в количестве от 5 до 10 мг/мл.
13. Многомерный биоматериал для восстановления или замещения хряща или кости, полученный способом по любому из пп.9-12.
14. Медицинское устройство для восстановления или замещения хряща или кости, содержащее биоматериал по п.1.
15. Набор для восстановления или замещения хряща или кости, содержащий биоматериал по п. 1 и подходящие средства фиксации.
16. Биоматериал по п.1 для улучшения состояния или лечения дефектной кости или хряща.
17. Биоматериал по п.1 для поддержки или коррекции врожденных или приобретенных аномалий суставов, челюстно-лицевых костей черепа, ортодонтических процедур, после хирургических замещений костей или костных суставов, травматических или других врожденных или приобретенных аномалий или для поддержания других скелетно-мышечных имплантов, в частности искусственных и синтетических имплантов.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Ippokratis Pountos, Peter V | |||
| Giannoudis, Injury, Int | |||
| J | |||
| Care injured, Biology of mesenchymal stem cells, 2005, 365, S8-S12 [найдено 2014.01.28] | |||
| Найдено из Интернет: | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| МАТЕРИАЛ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА ДЛЯ ПРИМЕНЕНИЯ В ФОРМИРОВАНИИ КРОВЕНОСНЫХ СОСУДОВ И ВЫРАБОТКИ ФАКТОРОВ АНГИОГЕНЕЗА И ТРОФИЧЕСКИХ ФАКТОРОВ | 2003 |
|
RU2332223C2 |
| . | |||
Авторы
Даты
2015-02-20—Публикация
2010-06-04—Подача