Изобретение относится к медицине, а именно к способам дифференциальной диагностике очаговой патологии печени в онкологии, и может быть использовано для дифференциальной диагностики очагового стеатоза печени и солидных образований печени у пациентов с отягощенным онкоанамнезом.
Онкологические заболевания занимают одну из лидирующих позиций по заболеваемости и смертности во всем мире. По данным мировой статистики в 2020 году число новых случаев превысило 19 миллионов, а летальность от онкологических заболеваний составила более 1.0 миллионов человек ([1] - Sung Н., 2021).
Благодаря анатомическому строению и особенностям кровоснабжения, печень является высокотропным органом для метастазирования, по данным литературы, у каждого третьего онкологического больного независимо от локализации первичной опухоли встречаются метастазы в гепатобилиарной зоне ([2] - Рыков О.В., 2017).
По данным литературы, доброкачественные новообразования обнаруживаются с той же частотой (5-20%) в пораженной метастазами печени, что и у здоровых лиц ([3] - Катрич А.Н. 2019), поэтому крайне важно иметь точный метод визуализации для определения дальнейшей тактики ведения больного. Более того, для непрерывного наблюдения за онкологическими больными требуется легкодоступный, надежный, экономичный и главное бездозовый диагностический инструмент для обнаружения и характеристики поражения печени ([4] - Battaglia V., 2017).
В настоящее время наиболее часто выполняют такие методы неинвазивной диагностики, как нативное ультразвуковое исследование (УЗИ) и контрастно-усиленное ультразвуковое исследование (КУУЗИ), компьютерную томографию с контрастированием (КТ с КУ), магнитно-резонансную томографию с контрастным усилением (МРТ с КУ).
Серошкальное УЗИ является скрининговым методом и первой линией в выявлении изменений в печени. Наличие очагового поражения на УЗИ считается показанием к использованию других диагностических методов с контрастированием, таких как КУУЗИ, КТ или МРТ с КУ. Тем не менее, данные методики требуют использования контрастного вещества, что несет в себе потенциальный риск аллергической реакции, увеличивает стоимость исследования и требует больше времени ([8] - Akdogan E., 2018).
Попытки повысить информативность нативного ультразвукового исследования привели к использованию сдвиговой точечной эластографии для дифференциальной диагностики очагов ([5] - Борсуков А.В., 2022).
Ранее данная методика применялась только для оценки диффузных поражений печени, в частности у больных с вирусными гепатитами ([7] - Пиманов С.И., 2021).
Техническим результатом изобретения является неинвазивное определение типа поражения (очагового стеатоза печени или солидное образование), сокращение времени оценки очагового образования печени, за счет отсутствия необходимости выполнения иных методов лучевой визуализаций, возможность проведения дифференциальной диагностики на первичном этапе и снижение затрат на дальнейшие исследования.
Указанный технический результат достигается B способе дифференциальной диагностики очагового стеатоза печени и солидных образований печени y пациентов с отягошенным онкоанамнезом, включающем ультразвуковое исследование очагового образования в В-режиме, отличающемся тем, что после визуализации зоны интереса активируют режим точечной эластографии сдвиговых волн и при размерах очагового образования от 10 до 15 мм измерения проводят в центральной части очагового образования, а при его размерах более 16 мм в периферической части очагового образования, далее осуществляют количественную оценку жесткости ткани печени в 10 точках в зоне интереса, и при среднем значении жесткости ткани в зоне интереса выше диапазона референсных показателей жесткости ткани печени диагностируют солидное образование, а если, полученное значение не выходит из диапазона референсных показателей жесткости ткани печени диагностируют очаговый стеатоз.
Способ иллюстрируется фиг.1-4, где:
на фиг.1 - графическое изображение распределения количественных показателей жёсткости (м/с) в соответствии с окончательным диагнозом;
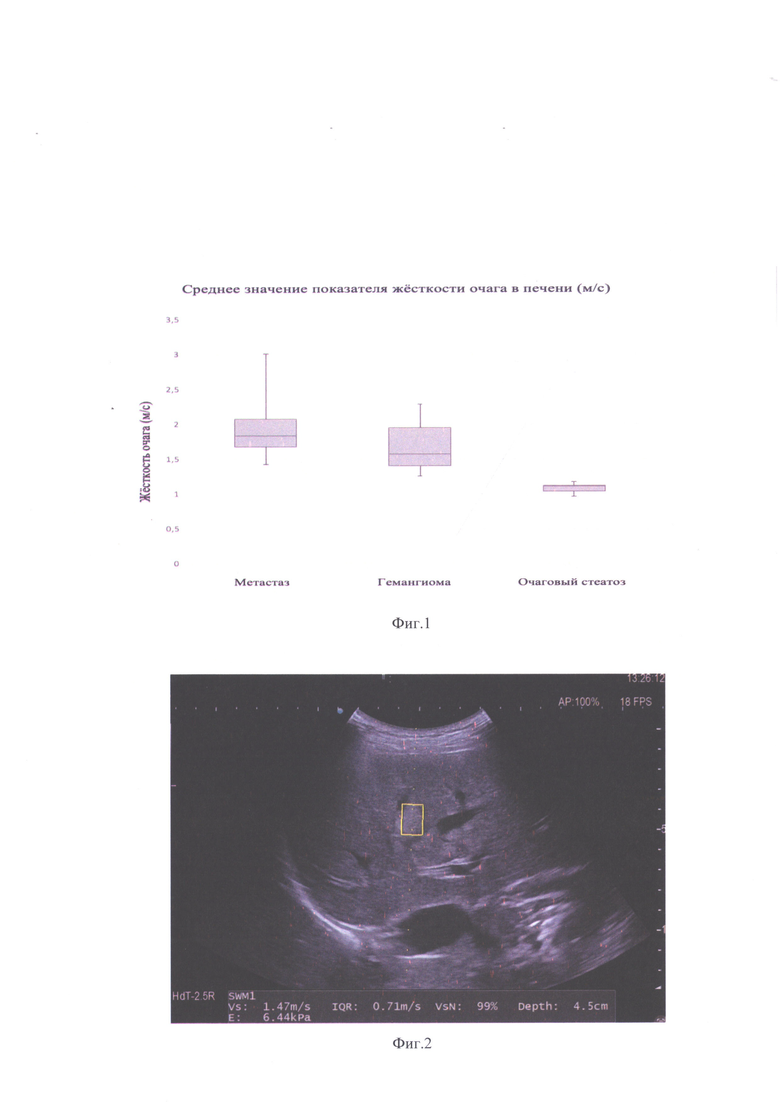
на фиг.2 (пример 1) - проведение количественного измерения жёсткости очага в режиме эластографии сдвиговых волн. Значение выше нормальных показателей для жёсткости паренхимы печени и составляет 1,47 м/с (6,44 кПа);
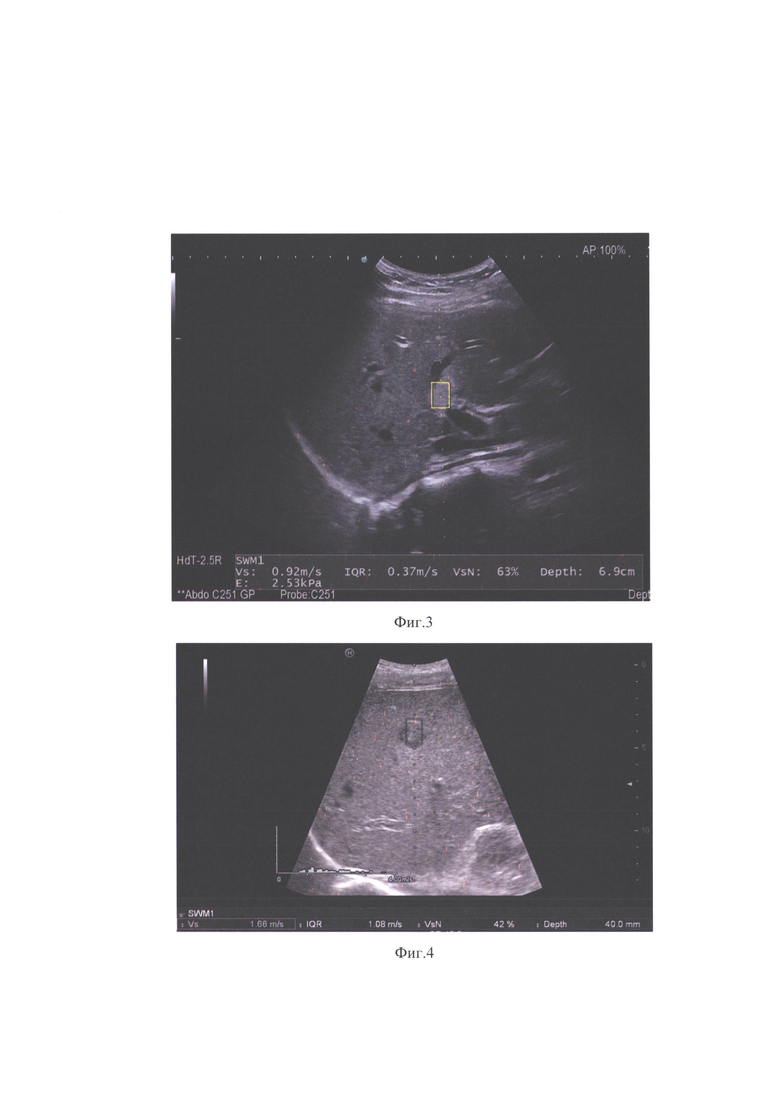
на фиг.3 (пример 2) - количественные измерения жёсткости в очаге соответствуют нормальным показателям жёсткости в паренхиме печени;
на фиг.4 (пример 3) - повышенные показатели жёсткости ткани в солидном очаге.
Определение параметров жёсткости очага было осуществлено у 64 пациентов с отягощённым онкологическим анамнезом, у которых при серошкальном УЗИ визуализировалось очаговое поражение печени.
Всем пациентам из данной группы выполнялось ультразвуковое исследование на аппаратах экспертного класса с наличием пакета программ для активации режима точечной эластографии сдвиговой волны.
Исследование проводилось с применением конвексного датчика с частотой 2-8 МГц. Перед исследованием для нормализации гемодинамики пациент находился в горизонтальном положении на кушетке в состоянии покоя 10 минут. Далее исследование проводилось в положении пациента лёжа на спине с запрокинутой за голову правой рукой.
Для расширения ультразвукового «окна» визуализации ноги пациента отводились в левую сторону. После визуализации в серошкальном режиме, активировался режим точечной эластографии сдвиговой волны. Интересующий участок должен быть отчётливо визуализирован на эхограмме, без артефактов от ткани лёгкого петель кишечника, желудка. Значение контрольного окна ставилось минимальное (1 см × 0,5 см), зона интереса располагалась в центральной части очагового образования при размерах от 10 мм до 15 мм и в периферической части при размерах очага более 16 мм. Проводилось не менее 10 измерений в различных контрольных точках в зоне интереса, затем проводилось 10 измерений в здоровой паренхиме печени для исключения диффузных изменений по типу фиброза. Исследование проводилось с кратковременной задержкой дыхания на обычном вдохе для статичности изображения и минимизации дыхательных артефактов. Далее все исследования для удобства заносились в таблицу Excel 2018 для дальнейшего анализа с применением специального пакета программ статистики Jamovi [10]. С целью нивелирования ложных значений в очаге, в данную группы не вошли пациенты, имеющих фиброзные знания печени, полученные при оценке методом сдвиговой эластографии печени (F2 и выше в соответствии со шкалой METAVIR), а также пациенты, у которых по результатам биохимического анализа крови уровень печёночных трансаминаз в 5 и более раз превышал пороговые значения. Окончательный клинический диагноз природы очага ставился на основании анамнестических данных, а также в совокупности с компьютерной томографией с контрастным усилением, выполненной по стандартному протоколу сканирования.
При подозрении на злокачественный процесс выполнялась морфологическая верификация образования, при определении доброкачественных признаков по данным лучевых методов исследования пациент находился на динамическом наблюдении каждые 3 месяца в первые полгода наблюдения, далее контроль осуществлялся каждые 6 месяцев. По результатам окончательного клинического диагноза были получены следующие данные: метастазы были выявлены у 29 пациентов, в 16 случаях-гемангиома, также у 19 человек очаговые изменения в печени интерпретировались как участок фокального стеатоза.
При статистическом анализе и построении графиков было получено, что все очаги, интерпретируемые как участки очагового стеатоза печени имели значения жесткости, сопоставимые с жесткостью нормальной паренхимы печени, а среднее значение жесткости гемангиом и метастазов было значительно выше. При анализе полученных данных для трех типов очагов рассчитывали медиану минимального, максимального и среднего значения жесткости в очаге по результатам 10 измерений с определением стандартного отклонения, а также межквартильного размаха (M±STD (min; max). Полученные данные представлены в табл. 1.
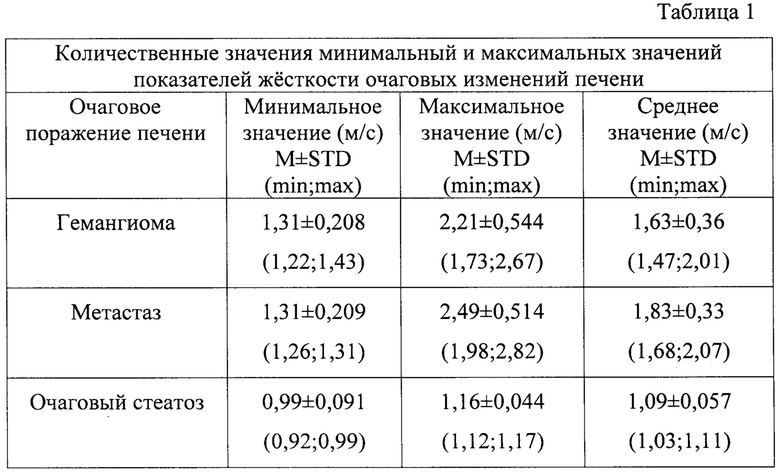
В нашем исследовании за референсные показатели жесткости нормальной паренхимы печени были взяты количественные значения, рекомендованные Европейской федерацией общества ультразвука и медицине в биологии (EFSUMB) ([9] - Dietrich C.F., 2017, [6] - Борсуков А.В., 2017), где количественные показатели нормальной жесткости паренхимы печени (норма или клинически незначимый фиброз печени- F0/F1) соответствовали значениям менее 1,2 м/с (4,32 кПа), показатели клинически значимого фиброза печени (F2) укладывались в интервал от 1,24 до 1,34 м/с (4,32-5,4 кПа), для выраженного фиброза (F3) определялся диапазон значений 1,34-1,55 м/с (5,4-7,2 кПа), для цирроза (F4) 1,55-2,0 м/с (7,2-12 кПа).
Таким образом, при сопоставлении количественных значений показателей жесткости в очагах и рекомендованных значениях жесткости в соответствии с наличием диффузных изменений в печени участок очагового жирового гепатоза по количественным значениям жесткости не отличается от здоровой паренхимы печени, солидные очаги, такие как гемангиомы и метастаз, по количественным значениям имеют значимо выраженное превышение показателя жесткости в сопоставлении с нормальной паренхимой печени.
Способ осуществляют, например, следующим образом.
Перед началом дифференциальной диагностики проводят обзорное сканирование всех сегментов печени для предмета патологических изменений. Далее при наличии патологической зоны в серошкальном режиме на экран монитора выводят печень с очаговым образованием, проводят измерения данной зоны в миллиметрах в двух плоскостях. При получении устойчивой У3-картины очагового поражения активируют режим точечной сдвиговой эластографии, на зону интереса наводят окно измерения ультразвуковой точечной эластографии сдвиговых волн с последующей активацией данного режима на задержке дыхания во избежание артефактов и получения ложных значений. При размерах очага от 10 до 15 мм рамку измерений в очаге наводят в центральную часть, при размерах очага более 16 мм проводят оценку очага по периферии без захвата визуально здоровых тканей. После получения 10 измерений в очаге дополнительно проводят 10 измерений в интактной паренхиме печени для исключения диффузных изменений по типу фиброза и, таким образом, возможного избежания ложных значений жесткости в очаге. Нормальные значения жесткости печени для большинства ультразвуковых аппаратов стратифицированы и количественно соответствуют стадии фиброза по системе METAVIR, применяемой для оценки фиброзных изменений в печени ([9] - Dietrich C.F., 2017, [6] - Борсуков А.В. 2017).
Способ подтверждается следующими клиническими примерами.
Пример 1. Пациентка Б., 46 лет. Основное заболевание: СА правой молочной железы (pT2N1M0), состояние после комплексного лечения от 2019 года, на фоне гормонотерапии (Тамоксифен) по настоящее время. Пациентка находится на динамическом наблюдении в онкологическом центре. При УЗИ в правой доле печени визуализируется гиперэхогенное очаговое образование, размерами до 17 мм, с четкими неровными контурами. По результатам эластографии сдвиговых волн жесткость нормальной ткани печени без очаговых изменений в соответствии с клиническими рекомендации равна нормальным показателям (F0/F1), что соответствует отсутствию фиброзных изменений. По результатам эластографии сдвиговых волн все значения измерений в очаге (n=10) значимо превышали нормальные показатели жесткости ткани печени (фиг. 2), среднее значение жесткости очага при 10 измерениях составило 1,66 м/с (8,27 кПа) - данные значения выходят из референсного интервала нормальных показателей жесткости печени, соответственно, данное образование было расценено как солидное новообразование печени, было высказано предположение о гемангиоме. Была проведена компьютерная томография с контрастным усилением, где паттерны контрастирования очага соответствовали гемангиоме печени. По результатам наблюдения в динамике размеры очага в печени без изменений. Следовательно, с учетом мультимодальной визуализации, очаговое образование в печени расценивается как гемангиома.
Пример 2. Пациентка К., 69 лет. Основное заболевание: Рак молочной железы. Состояние после органосохраняющей операции, лучевой терапии от 2012 года. Гормонотерапия Тамоксифеном 5 лет. По результатам контрольной компьютерной томографии органов брюшной полости с внутривенным контрастным усилением 6 месяцев назад данных за метастазы не получено, ультразвуковое исследование не проводилось. Настоящая цель обращения: плановое наблюдение в соответствии с рекомендациями онколога.
При контрольном УЗИ в В-режиме в правой доли печени, вблизи воротной вены, визуализируется гиперэхогенное очаговое образование, размерами 15×10 мм, с четкими неровными контурами. По результатам эластографии сдвиговых волн жесткость интактной ткани печени в соответствии с клиническими рекомендации равна нормальным показателям (1,12 м/с; 3,79 кПа), то есть диффузные изменения по типу фиброза отсутствуют. При оценке визуализируемого очага в печени, количественные показатели в очаге также соответствуют нормальным показателям жесткости (0,92 м/с; 2,53 кПа) (фиг. 3), среднее значение жесткости очага при 10 измерениях составило 1,07 м/с (3,44 кПа), данные значения не выходят из референсного интервала нормальных показателей жесткости печени, соответственно, данное образование было расценено как очаговый стеатоз печени. При контрольном исследовании через 3 месяца данные изменения без динамики, соответственно, очаг в печени не является вторичным и не требует инвазивных вмешательств.
Пример 3. Пациент Ф., 28 лет. Жалобы на боли в правой ноге в течение 6 месяцев, усиление болей после физических нагрузок, нарастание интенсивности и протяженности в динамике. По КТ по месту жительства обнаружена опухоль забрюшинного пространства справа, гепатомегалия, простые кисты почек. Для дальнейшего дообследования обратился в онкологический центр. Выполнена трепанбиопсия образования, по результатам гистологии был получен диагноз: эпителиоидная саркома проксимального типа, Ki67-30%.
Также было выполнено повторное КТ грудной клетки и брюшной полости (проводилось спустя 3 месяца от первоначального исследования), по результатам которой было диагностировано увеличение основной опухоли с инвазией в прилежащие мышцы и сосуды, дополнительно определялись метастазы в легких, а также появились метастазы в печени. По УЗИ органов брюшной полости в печени визуализируется гипоэхогенный очаг с нечеткими неровными контурами, размерами до 15 мм в диаметре. При оценке жесткости непораженной паренхимы печени данных за наличие фиброзных изменений получено не было. При исследовании параметров жесткости очага при применении методики сдвиговой эластографии были получены значения, жесткость которых значимо выше, чем жесткость нормальной паренхимы печени (фиг. 4), среднее значение жесткости очага при 10 измерениях составило 3 м/с (18 кПа)-данные значения выходят из референсного интервала нормальных показателей жесткости печени, соответственно, данное образование было расценено как солидное новообразование печени, более вероятно, метастатической природы. По результатам комплексного обследования очаг в печени являлся метастазом, на фоне лечения данный очаг имел тенденцию к уменьшению в размерах.
Таким образом, заявляемый способ позволяет выявлять изменения в печени на этапе скрининга, вести постоянное неинвазивное наблюдение за онкологическими больными, позволяет определять дальнейшую тактику ведения больного, является легкодоступным, надежным, экономичным и главное бездозовым диагностическим инструментом для обнаружения и характеристики поражения печени. Достоинствами способа является сокращение времени оценки очагового образования печени, возможность проведения дифференциальной диагностики на первичном этапе и снижение затрат на дальнейшие исследования.
Источники информации
1. Sung Н., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May; 71(3): 209-249. doi: 10.3322/caac.21660.
2. Рыков O.B., Паршин Д.В., Цховребов A.T., Мирзоян О.С., Федоров Д.Н., Тарасова И.А., Шестаков А.Л. Результаты лечения рака желудка и метахромных метастазов в печени и легких. Хирургия. Журнал им. Н.И. Пирогова. 2017; (6): 69-71. https://doi.org/10.17116/hirurgia2017669-71
3. Катрич А.Н. Ультразвуковое исследование с контрастным усилением в дифференциальной диагностике очаговых новообразований печени / А.Н. Катрич, В.А. Порханов // Хирургия. Журнал им. Н.И. Пирогова. - 2019. - №6. - С. 49-59. - DOI: 10.17116/hirurgia201906149.
4. Battaglia V., Cervelli R. Liver investigations: Updating on US technique and contrast-enhanced ultrasound (CEUS). Eur J Radiol. 2017 Nov; 96: 65-73. DOI: 10.1016/j.ejrad.2017.08.029.
5. А.В. Борсуков, Ю.К. Александров, М.И. Арабачян и др. Эластография сдвиговых волн. Анализ клинических примеров: Практическое руководство для последипломной профессиональной переподготовки врачей / А. Борсуков, Ю.К. Александров, М.И. Арабачян и др. - 2-е издание, переработанное и дополненное. - Москва: СИМК, 2022. - 468 с. - ISBN 978-5-91894-102-7.
6. Борсуков А.В. Адаптация мировых и европейских рекомендаций по эластографии печени для отечественной лучевой диагностики / A.В. Борсуков // Медицинская визуализация. - 2017. - Т. 21, №6. - С. 63-71. - DOI: 10.24835/1607-0763-2017-6-63-71.
7. Пиманов С.И. Факторы, оказывающие влияние на результаты ультразвуковой эластометрии печени / С.И. Пиманов, М.Д. Митькова, B.В. Митьков // Ультразвуковая и функциональная диагностика. - 2021. - №4. - С. 9-29. - DOI: 10.24835/1607-0771-2021-4-9-29.
8. Akdoğan Е, Yilmaz FG. The role of acoustic radiation force impulse elastography in the differentiation of benign and malignant focal liver masses. Turk J Gastroenterol. 2018 Jul; 29(4): 456-463. DOI: 10.5152/tjg.2018.11710. Erratum in: Turk J Gastroenterol. 2018 Oct; 29(6): 722.
9. Dietrich C.F., Bamber J., Berzigotti A., Bota S., Cantisani V., Castera L., Cosgrove D., Ferraioli G., Friedrich-Rust M., Gilja O.H., Goertz R.S., Karlas T., de Knegt R., de Ledinghen V., Piscaglia F., Procopet B., Saftoiu A., Sidhu P.S., Sporea I., Thiele M. EFSUMB Guidelines and Recommendations on the Clinical Use of Liver Ultrasound Elastography, Update 2017 (Long Version). Ultraschall Med. 2017 Aug; 38(4): e16-e47. English. DOI: 10.1055/s-0043-103952. Epub 2017 Apr 13. Erratum in: Ultraschall Med. 2017 Aug; 38(4): e48.
10. The jamovi project (2022). jamovi. (Version 2.3) [Computer Software]. Retrieved from https://www.jamovi.org.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ПЕРЕХОДА СТЕАТОЗА ПЕЧЕНИ В СТЕАТОГЕПАТИТ | 2023 |
|
RU2816305C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ КИСТОЗНЫХ ОБРАЗОВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2017 |
|
RU2681515C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ХАРАКТЕРА ОЧАГОВЫХ ИЗМЕНЕНИЙ В ПАРЕНХИМЕ ПЕЧЕНИ | 2014 |
|
RU2571335C1 |
| Способ дифференциальной диагностики диффузных и очаговых заболеваний печени | 2020 |
|
RU2771257C1 |
| Способ дифференциальной диагностики очаговых заболеваний селезенки | 2016 |
|
RU2631560C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2009 |
|
RU2406434C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО РАКА ПЕЧЕНИ | 2009 |
|
RU2400130C1 |
| Способ диагностики злокачественных кистозных образований поджелудочной железы | 2020 |
|
RU2747032C1 |
| Способ оценки вероятности развития постлучевого гипотиреоза на основе компрессионной соноэластографии | 2024 |
|
RU2839011C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ГЕПАТИТА В ЦИРРОЗ | 2019 |
|
RU2702145C1 |
Изобретение относится к медицине, а именно к гепатологии и онкологии, и может быть использовано для дифференциальной диагностики очагового стеатоза печени и солидных образований печени у пациентов с отягощенным онкоанамнезом. Проводят ультразвуковое исследование очагового образования в В-режиме и после визуализации зоны интереса активируют режим точечной эластографии сдвиговых волн. При размерах очагового образования от 10 до 15 мм измерения проводят в центральной части очагового образования, а при его размерах более 16 мм - в периферической части очагового образования. Осуществляют количественную оценку жесткости ткани печени в 10 точках в зоне интереса, и при среднем значении жесткости ткани в зоне интереса выше диапазона референсных показателей жесткости ткани печени диагностируют солидное образование, а если полученное значение не выходит из диапазона референсных показателей жесткости ткани печени, диагностируют очаговый стеатоз. Способ позволяет выявлять изменения в печени на этапе скрининга, вести постоянное неинвазивное наблюдение за онкологическими больными, определять тактику ведения больного за счет идентификации наиболее значимой зоны сканирования очагового образования и совокупности применения ультразвукового сканирования в В-режиме и точечной эластографии сдвиговых волн. 4 ил., 3 пр.
Способ дифференциальной диагностики очагового стеатоза печени и солидных образований печени у пациентов с отягощенным онкоанамнезом, включающий ультразвуковое исследование очагового образования в В-режиме, отличающийся тем, что после визуализации зоны интереса активируют режим точечной эластографии сдвиговых волн и при размерах очагового образования от 10 до 15 мм измерения проводят в центральной части очагового образования, а при его размерах более 16 мм - в периферической части очагового образования, далее осуществляют количественную оценку жесткости ткани печени в 10 точках в зоне интереса, и при среднем значении жесткости ткани в зоне интереса выше диапазона референсных показателей жесткости ткани печени диагностируют солидное образование, а если полученное значение не выходит из диапазона референсных показателей жесткости ткани печени, диагностируют очаговый стеатоз.
| СПОСОБ ПРОГНОЗИРОВАНИЯ И ПРОФИЛАКТИКИ ПОСТРЕЗЕКЦИОННОЙ ОСТРОЙ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ У БОЛЬНЫХ ПЕРВИЧНЫМ И МЕТАСТАТИЧЕСКИМ РАКОМ ПЕЧЕНИ | 2017 |
|
RU2673667C2 |
| Способ диагностики неалкогольного стеатоза печени | 2021 |
|
RU2755974C1 |
| СПОСОБ ДИАГНОСТИКИ СТЕАТОЗА ПЕЧЕНИ | 2004 |
|
RU2292043C2 |
| ПОСТНОВА Н.А | |||
| и др | |||
| Эластография сдвиговой волны: возможности дифференциальной диагностики очаговых и диффузных изменений различных органов и тканей | |||
| Вестник рентгенологии и радиологии | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Солесос | 1922 |
|
SU29A1 |
| FERRAIOLI G | |||
| et al | |||
| Ultrasound-based techniques for the | |||
Авторы
Даты
2024-07-16—Публикация
2023-08-08—Подача