Перекрестная ссылка на родственную заявку
[0001] В настоящей заявке испрашивается приоритет предварительной заявки на патент США с порядковым № 62/780602, поданной 17 декабря 2018 г., содержание которой полностью включено сюда посредством ссылки.
Предпосылки изобретения
[0002] Разнообразные протоколы биологических или химических исследований предусматривают проведение большого количества контролируемых реакций на локальных опорных поверхностях или в заранее заданных реакционных камерах. Затем можно наблюдать или обнаруживать указанные реакции, а последующий анализ может помочь идентифицировать или выявить свойства химических веществ, участвующих в реакции. Например, в некоторых мультиплексных анализах неизвестный аналит, имеющий идентифицируемую метку (например, флуоресцентную метку), может подвергаться воздействию тысяч известных зондов в контролируемых условиях. Каждый известный зонд можно поместить в соответствующую лунку микропланшета. Наблюдение за какими-либо химическими реакциями, протекающими между известными зондами и неизвестным аналитом в лунках, может помочь идентифицировать или выявить свойства аналита. Другие примеры таких протоколов включают известные способы секвенирования ДНК, такие как секвенирование путем синтеза (SBS) или параллельное циклическое секвенирование. С методами секвенирования полинуклеотидов анализ может помочь идентифицировать или выявить свойства участвующего в реакциях полинуклеотида.
Введение
[0003] В раскрытом здесь первом аспекте представлена первая проточная ячейка, содержащая подложку; электрод, расположенный на подложке; расположенный на электроде структурированный материал, включающий углубления, разделенные промежуточными областями; функционализированную поверхность электрода, открытую на каждом из углублений; и праймер, привитый к функционализированной поверхности в каждом из углублений.
[0004] В примере первого аспекта электрод содержит золото, а функционализированная поверхность содержит тиоловые линкеры или аминные линкеры; или электрод содержит оксид индия-олова, а функционализированная поверхность содержит силановый линкер.
[0005] В примере первого аспекта электрод является прозрачным; подложка является прозрачной; а проточная ячейка дополнительно содержит устройство обнаружения, находящееся в контакте с подложкой, причем устройство обнаружения содержит соответствующий фотодиод, функционально связанный с каждым из углублений, и цепь устройства, электрически соединенную с соответствующим фотодиодом.
[0006] Следует понимать, что любые раскрытые здесь признаки первой проточной ячейки можно скомбинировать вместе любым желательным образом и/или с любой нужной конфигурацией.
[0007] В раскрытом здесь втором аспекте представлен набор для секвенирования, содержащий проточную ячейку согласно первому аспекту и меченые нуклеотиды, подлежащие введению в проточную ячейку, причем каждый меченый нуклеотид содержит нуклеотид, имеющий блокирующую 3’ OH группу, связывающую молекулу, присоединенную к основанию или сахару нуклеотида, и электрохемилюминесцентную метку, присоединенную к связывающей молекуле.
[0008] В примере второго аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный спектр излучения.
[0009] В примере второго аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный окислительный или восстановительный потенциал.
[0010] В примере второго аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разное время жизни электрохемилюминесцентного излучения.
[0011] В примере второго аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разную интенсивность электрохемилюминесцентного излучения.
[0012] Следует понимать, что любые признаки этого набора для секвенирования можно скомбинировать вместе любым желательным образом. Кроме того, следует понимать, что любую комбинацию признаков этого набора для секвенирования и/или проточной ячейки можно использовать совместно и/или скомбинировать с любым из раскрытых здесь примеров.
[0013] В раскрытом здесь третьем аспекте представлена другая проточная ячейка, содержащая подложку, расположенный на подложке структурированный электрод, включающий углубления, разделенные промежуточными областями, функционализированную поверхность подложки, открытую на каждом из углублений, и праймер, привитый к функционализированной поверхности в каждом из углублений.
[0014] В примере третьего аспекта функционализированная поверхность подложки содержит слой полимера, присоединенный к силановым группам, присоединенным к подложке.
[0015] В примере третьего аспекта функционализированная поверхность подложки содержит гидроксильные группы, присоединенные к подложке.
[0016] В примере третьего аспекта подложка является прозрачной; а проточная ячейка дополнительно содержит устройство обнаружения, находящееся в контакте с подложкой, причем устройство обнаружения содержит соответствующий фотодиод, функционально связанный с каждым из углублений; и цепь устройства, электрически соединенную с соответствующим фотодиодом.
[0017] Следует понимать, что любые признаки этой проточной ячейки можно скомбинировать вместе любым желательным образом. Кроме того, следует понимать, что любую комбинацию признаков этой проточной ячейки и/или набора для секвенирования и/или другой проточной ячейки можно использовать совместно и/или скомбинировать с любым из раскрытых здесь примеров.
[0018] В раскрытом здесь четвертом аспекте представлен набор для секвенирования, содержащий проточную ячейку согласно третьему аспекту и меченые нуклеотиды, подлежащие введению в проточную ячейку, причем каждый меченый нуклеотид содержит нуклеотид, имеющий блокирующую 3’ OH группу, связывающую молекулу, присоединенную к основанию или сахару нуклеотида, и электрохемилюминесцентную метку, присоединенную к связывающей молекуле.
[0019] В примере четвертого аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный спектр излучения.
[0020] В примере четвертого аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный окислительный или восстановительный потенциал.
[0021] В примере четвертого аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разное время жизни электрохемилюминесцентного излучения.
[0022] В примере четвертого аспекта меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разную интенсивность электрохемилюминесцентного излучения.
[0023] Следует понимать, что любые признаки этого набора для секвенирования можно скомбинировать вместе любым желательным образом. Кроме того, следует понимать, что любую комбинацию признаков этого набора для секвенирования и/или любой из проточных ячеек и/или другого набора для секвенирования можно использовать совместно и/или скомбинировать с любым из раскрытых здесь примеров.
[0024] В раскрытом здесь пятом аспекте представлен способ, включающий: введение текучей среды, содержащей полимеразу и нуклеотиды, в проточную ячейку, содержащую электрод, который частично образует углубление, содержащее матричную полинуклеотидную цепь, прикрепленную в углублении, причем по меньшей мере некоторые из нуклеотидов являются мечеными нуклеотидами, каждый из упомянутых по меньшей мере некоторых меченых нуклеотидов содержит нуклеотид, имеющий блокирующую 3’ OH группу, связывающую молекулу, присоединенную к основанию или сахару нуклеотида, и электрохемилюминесцентную метку, присоединенную к связывающей молекуле, посредством чего один из нуклеотидов встраивается в образующуюся цепь, комплементарную матричной полинуклеотидной цепи; приложение потенциала к электроду; и обнаружение оптического излучения в ответ на приложенный потенциал.
[0025] В примере пятого аспекта встроенным одним из нуклеотидов является один из меченых нуклеотидов, и при этом приложение потенциала инициирует путь реакции окисления-восстановления с участием электрохемилюминесцентной метки встроенного одного из меченых нуклеотидов. В одном примере текучая среда содержит по меньшей мере три различных меченых нуклеотида, соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный спектр излучения, а способ дополнительно включает идентификацию встроенного одного из меченых нуклеотидов по его оптическому излучению. В другом примере текучая среда содержит по меньшей мере три различных меченых нуклеотида, соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный окислительный или восстановительный потенциал, а способ дополнительно включает идентификацию встроенного одного из меченых нуклеотидов по приложенному потенциалу. В еще одном примере перед приложением потенциала способ дополнительно включает введение в проточную ячейку кореагента. В еще одном примере связывающую молекулу и электрохемилюминесцентную метку встроенного одного из меченых нуклеотидов присоединяют во время встраивания, приложения потенциала и оптического обнаружения, и при этом после оптического обнаружения способ дополнительно включает введение деблокирующего средства для отщепления связывающей молекулы и электрохемилюминесцентной метки от встроенного одного из меченых нуклеотидов и для удаления блокирующей 3’ OH группы из встроенного одного из меченых нуклеотидов, тем самым обеспечивая встраивание еще одного нуклеотида или еще одного меченого нуклеотида в образующуюся цепь. В этом конкретном примере способ может дополнительно включать введение еще одной текучей среды, приложение к электроду еще одного потенциала и обнаружение еще одного оптического излучения.
[0026] В примере пятого аспекта фотодиод обнаруживает оптическое излучение, а способ дополнительно включает обнаружение электрического сигнала, который соответствует оптическому излучению.
[0027] В примере пятого аспекта встроенным одним из нуклеотидов является один из: первого меченого нуклеотида, в котором связывающая молекула является отщепляемой; второго меченого нуклеотида, в котором связывающая молекула является неотщепляемой; третьего немеченого нуклеотида, имеющего блокирующую 3’ OH группу и содержащего связывающую молекулу, подлежащую присоединению к электрохемилюминесцентной метке; или четвертого немеченого нуклеотида, имеющего блокирующую 3’ OH группу; а способ дополнительно включает введение реагента, который может отщеплять электрохемилюминесцентную метку от первого меченого нуклеотида и может добавлять электрохемилюминесцентную метку к третьему немеченому нуклеотиду, приложение к электроду еще одного потенциала, обнаружение еще одного оптического излучения в ответ на приложенный потенциал и использование обнаруженного оптического излучения и обнаруженного другого оптического излучения для идентификации встроенного одного из нуклеотидов.
[0028] В примере пятого аспекта проточная ячейка содержит множество углублений, каждое из которых содержит множество матричных полинуклеотидных цепей, прикрепленных в углублении, соответствующий один из нуклеотидов встраивается в соответствующую образующуюся цепь, комплементарную соответствующей матричной полинуклеотидной цепи, а способ дополнительно включает одновременное обнаружение соответствующего оптического излучения из каждого из множества углублений.
[0029] Следует понимать, что любые признаки способа можно скомбинировать вместе любым желательным образом. Кроме того, следует понимать, что любую комбинацию признаков способа и/или первого набора для секвенирования и/или второго набора для секвенирования можно использовать совместно и/или скомбинировать с любым из раскрытых здесь примеров.
[0030] Кроме того, следует понимать, что любые признаки любого из способов и/или любого из наборов для секвенирования можно скомбинировать вместе любым желательным образом и/или можно скомбинировать с любым из раскрытых здесь примеров.
Краткое описание чертежей
[0031] Признаки примеров настоящего раскрытия станут очевидными при обращении к следующему подробному описанию и чертежам, на которых одинаковые ссылочные номера соответствуют аналогичным, хотя возможно и не идентичным, компонентам. Для краткости ссылочные номера или признаки, имеющие ранее описанную функцию, могут быть или не быть описаны в связи с другими чертежами, на которых они появляются.
[0032] На фиг. 1A представлен вид сверху примера проточной ячейки;
[0033] на фиг. 1B представлен увеличенный вид в перспективе примера части одной из дорожек проточной ячейки по фиг. 1A, иллюстрирующий углубления, образованные на поверхности электрода, и праймеры, прикрепленные к поверхности электрода в углублении;
[0034] на фиг. 1C представлен увеличенный вид в перспективе другого примера части одной из дорожек проточной ячейки по фиг. 1A, иллюстрирующий углубления, образованные структурированным электродом на поверхности подложки, и праймеры, прикрепленные к поверхности подложки в углублениях;
[0035] на фиг. 2 схематично представлены разные примеры меченого нуклеотида;
[0036] на фиг. 3 представлен полусхематичный вид в перспективе одного примера массива углублений проточной ячейки для набора для секвенирования;
[0037] на фиг. 4A-4C представлен вид в поперечном разрезе одного углубления из массива по фиг. 3 при проведении цикла секвенирования;
[0038] на фиг. 5 представлен полусхематичный вид в перспективе другого примера массива углублений проточной ячейки для набора для секвенирования;
[0039] на фиг. 6A-6C представлен вид в поперечном разрезе одного углубления из массива по фиг. 5 при проведении цикла секвенирования;
[0040] на фиг. 7 представлен вид в поперечном разрезе примера проточной ячейки для набора для секвенирования, где в проточную ячейку встроено устройство обнаружения с комплементарной структурой металл-оксид-полупроводник (КМОП); а
[0041] на фиг. 8 представлен вид в поперечном разрезе другого примера проточной ячейки для набора для секвенирования, где в проточную ячейку встроено КМОП-устройство обнаружения.
Подробное описание изобретения
[0042] В раскрытых здесь примерах распознавание нуклеотидных оснований во время секвенирования проводят посредством обнаружения сигналов флюоресценции, которые генерируются электрохимически. Электрохимическое генерирование сигналов флюоресценции не предусматривает возбуждения меченых красителем оснований посредством освещения лазером, светоизлучающим диодом или другим источником освещения. Без необходимости в источнике возбуждения оптическая система раскрытых здесь примеров упрощается.
[0043] Процесс электрохемилюминесценции (ЭХЛ) начинается с окисления или восстановления молекулы на поверхности электрода с образованием катион- или анион-радикала. В некоторых примерах катион- или анион-радикал затем претерпевает перенос электрона кореагентом с образованием излучающего возбужденного состояния. В других примерах потенциал электрода меняют с положительного на отрицательный, что может напрямую создавать излучающее возбужденное состояние. В любом примере раскрытый здесь процесс дает свет без фонового шума от источника возбуждения. В связи с этим в раскрытых здесь примерах отсутствует шум из-за источника возбуждения, и, таким образом, повышается соотношение сигнал-шум. Повышенное соотношение сигнал-шум улучшает точность секвенирования, а также позволяет использовать меньший шаг из-за более высокой плотности данных.
[0044] Кроме того, в раскрытых здесь примерах возбужденные состояния образуются исключительно на поверхности электрода или в углублении, которое образовано стенками электрода, что способствует активным областям ЭХЛ с пространственным разрешением.
[0045] Кроме того, число испускаемых фотонов зависит от эффективности реакции ЭХЛ и длительности приложенного потенциала. Теоретически, активная в ЭХЛ молекула может претерпевать многочисленные циклы окисления-восстановления/реакции/излучения и может излучать фотоны в течение длительности приложенного потенциала. Это позволяет регулировать временные рамки генерирования сигнала, что может приводить к более точным результатам обнаружения.
[0046] В раскрытых здесь примерах сигналы генерируют электрохимически с использованием наборов для секвенирования. Примером описанного здесь набора для секвенирования является электрохемилюминесцентный набор для секвенирования. Хотя электрохемилюминесцентные наборы для секвенирования использованы здесь в качестве типового примера набора для секвенирования, набор для секвенирования по изобретению не обязательно должен быть электрохемилюминесцентным набором. Каждый электрохемилюминесцентный набор для секвенирования содержит конкретную проточную ячейку, которая содержит электрод, подлежащий использованию в процессе ЭХЛ. В некоторых примерах проточные ячейки можно использовать с устройством оптического обнаружения. В других примерах проточные ячейки интегрированы с устройством обнаружения с комплементарной структурой металл-оксид-полупроводник (КМОП) и поэтому используются для оптоэлектронного обнаружения.
[0047] Пример проточной ячейки 10 представлен на фиг. 1A. В этом примере проточная ячейка 10 содержит проточные каналы 12. Хотя показано несколько проточных каналов 12, следует понимать, что в проточной ячейке 10 может иметься любое число каналов 12 (например, один канал 12, четыре канала 12 и т.д.). Каждый проточный канал 12 является областью, образованной между двумя связанными компонентами (например, подложкой и крышкой или двумя подложками), которая может иметь вводимые в нее и удаляемые из нее жидкости. Каждый проточный канал 12 может быть изолирован от любого другого проточного канала 12, так что жидкость, вводимая в любой конкретный проточный канал 12, не перетекает в любой смежный проточный канал. Как будет обсуждаться здесь дальше, с жидкостями, вводимыми в проточные каналы 12, можно вводить реакционные компоненты (например, меченые и/или немеченые нуклеотиды), промывочные растворы, деблокирующие средства и т.д.
[0048] На фиг. 1B и 1C показаны разные примеры архитектуры проточных каналов 12 проточной ячейки 10.
[0049] В примере, показанном на фиг. 1B, проточная ячейка 10 содержит подложку 14, электрод 16, расположенный на подложке 14, и структурированный материал 18, расположенный на электроде 16. Структурированный материал 18 образует углубления 20, разделенные промежуточными областями 22. В этом примере функционализированная поверхность S16 электрода 16 открыта в каждом из углублений 20, а к функционализированной поверхности S16 привит праймер 24.
[0050] Подложка 14 на фиг. 1B обеспечивает опору для других компонентов проточной ячейки 10. Обычно подложка 14 является жесткой и нерастворимой в водной жидкости. Примеры подходящих подложек 14 включают в себя эпоксидный силоксан, стекло, модифицированное стекло, пластмассы, нейлон, керамику/керамические оксиды, кремнезем (диоксид кремния (SiO2)), плавленный кварц, материалы на основе диоксида кремния, силикат алюминия, кремний, модифицированный кремний (например, легированный бором p+ кремний), нитрид кремния (Si3N4), пентоксид тантала (TaO5) или другой(ие) оксид(ы) тантала (TaOx), оксид гафния (HfO2), неорганические стекла или тому подобное. Некоторые примеры подходящих пластмасс для подложки 14 включают акриловые соединения, полистирол, сополимеры стирола и других материалов, полипропилен, полиэтилен, полибутилен, полиуретаны, политетрафторэтилен (такой как TEFLON® от Chemours), циклические олефины/циклоолефиновые полимеры (COP) (такие как ZEONOR® от Zeon), полиимиды и т.д. Подложкой также может быть стекло или кремний со слоем покрытия из оксида тантала или другого керамического оксида на поверхности.
[0051] Подложка 14 может иметь форму пластины, панели, прямоугольного листа, кристалла или любую другую подходящую конфигурацию. В одном примере подложка 14 может быть круглой пластиной или панелью, имеющей диаметр от примерно 2 мм до примерно 300 мм. В качестве более конкретного примера подложка 14 представляет собой пластину, имеющую диаметр от примерно 200 мм до примерно 300 мм. В другом примере подложка 14 может представлять собой прямоугольный лист или панель с их наибольшим размером вплоть до примерно 10 футов (~ 3 метра). В качестве конкретного примера, подложка 14 представляет собой кристалл, имеющий ширину, составляющую от примерно 0,1 мм до примерно 10 мм. Хотя были приведены примерные размеры, следует понимать, что можно использовать подложку 14 с любыми подходящими размерами.
[0052] На фиг. 1B электрод 16 расположен на подложке 14. Электрод 16 может содержать любой подходящий электродный материал, такой как золото (Au), серебро (Ag), хлорид серебра (AgCl), платина (Pt), титан (Ti), молибден (Mo), оксид индия-олова (ITO), оксид индия-цинка (IZO), углерод (например, графен, листы углеродных нанотрубок), проводящие полимеры и т.д. В одном примере электрод 16 выполнен из золота. Электрод 16 может иметь любую подходящую толщину, которая делает электрод 16 механически и химически стабильным. Например, толщина может составлять 200 нм или более.
[0053] Электродом 16 может быть предварительно сформованный лист, который прикреплен к подложке 14, например, с использованием клея, или может быть нанесен на подложку 14 с использованием подходящего метода осаждения.
[0054] В примере, показанном на фиг. 1B, на электроде 16 расположен структурированный материал 18. Следует понимать, что для структурированного материала 18 можно использовать любой материал, который может быть выборочно осажден или осажден и структурирован с образованием углублений 20 и промежуточных областей 22. Структурированный материал 18 может быть проводящим или непроводящим и выбран так, чтобы он не прививал праймеры 24.
[0055] В качестве одного примера, на электрод 16 можно выборочно нанести неорганический оксид посредством осаждения из паровой фазы, аэрозольной печати или струйной печати. Примеры подходящих неорганических оксидов включают оксид тантала, оксид алюминия, оксид кремния, оксид гафния и т.д.
[0056] В качестве другого примера, на электрод 16 можно нанести смолу, а затем структурировать. Подходящие способы осаждения включают химическое осаждение из паровой фазы, нанесение покрытия методом погружения, нанесение покрытия методом окунания, нанесение покрытия методом центрифугирования, нанесение покрытия методом распыления, дозирование методом наплыва, ультразвуковое нанесение покрытия методом распыления, нанесение покрытия ножевым устройством, аэрозольную печать, трафаретную печать, микроконтактную печать и т.д. Подходящие методы структурирования включают в себя фотолитографию, нанопечатную литографию (NIL), методы штамповки, методы тиснения, методы формования, методы микротравления, методы печати и т.д. Некоторые примеры подходящих смол включают в себя смолу на основе смолы полиэдрического олигомерного силсесквиоксана (POSS), не являющуюся POSS эпоксидную смолу, поли(этиленгликолевую) смолу, полиэфирную смолу (например, эпоксидные смолы с разомкнутым кольцом), акриловую смолу, акрилатную смолу, метакрилатную смолу, аморфную фторполимерную смолу (например, CYTOP® от Bellex) и их комбинации.
[0057] Употребляемый в настоящем изобретении термин «полиэдрический олигомерный силсесквиоксан» (POSS) относится к химическому составу, который представляет собой гибридный промежуточный продукт (например, RSiO1,5) между диоксидом кремния (SiO2) и силиконом (R2SiO). Примером POSS может быть описанный в статье Kehagias et al., Microelectronic Engineering 86 (2009), pp. 776-778, которая полностью включена посредством ссылки. В одном примере этот состав представляет собой кремнийорганическое соединение с химической формулой [RSiO3/2]n, в котором группы R могут быть одинаковыми или разными. Иллюстративные группы R для POSS включают эпокси, азид/азидо, тиол, поли(этиленгликоль), норборнен, тетразин, акрилаты и/или метакрилаты, или, кроме того, например, алкильные, арильные, алкокси и/или галоалкильные группы. В состав раскрытой здесь смолы может входить одна или более разных каркасных или сердцевинных структур в качестве мономерных звеньев. Полиэдрическая структура может представлять собой структуру T8, такую как:
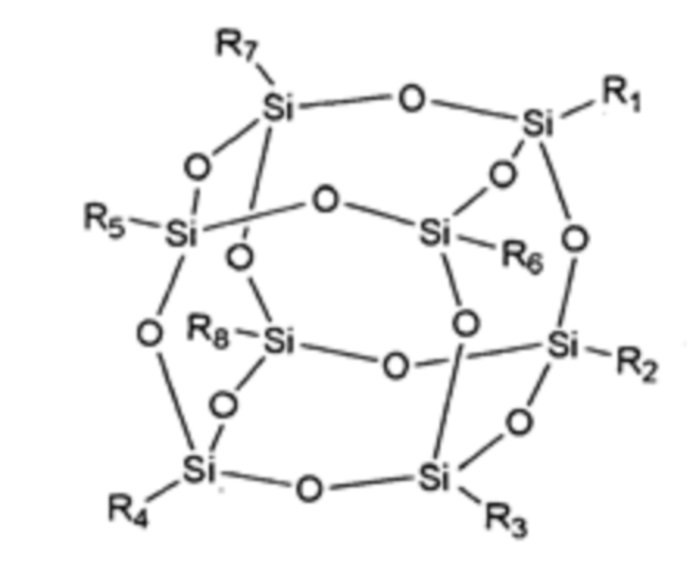
и представленную как: 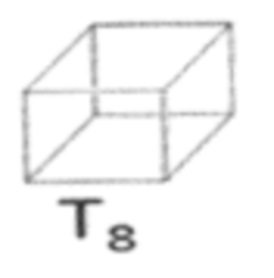 . Это мономерное звено обычно имеет восемь ветвей функциональных групп R1-R8.
. Это мономерное звено обычно имеет восемь ветвей функциональных групп R1-R8.
[0058] Мономерное звено может иметь каркасную структуру с 10 атомами кремния и 10 R группами, обозначаемую T10, такую как, например: 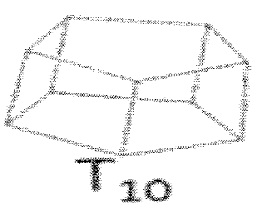 , или может иметь каркасную структуру с 12 атомами кремния и 12 R группами, обозначаемую T12, такую как, например:
, или может иметь каркасную структуру с 12 атомами кремния и 12 R группами, обозначаемую T12, такую как, например: 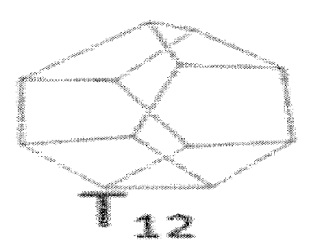 . Альтернативно, материал на основе POSS может содержать каркасные структуры T6, T14 или T16. Среднее содержание каркасной структуры можно корректировать во время синтеза и/или регулировать с помощью методов очистки, и распределение размеров каркаса мономерного(ых) звена (звеньев) можно использовать в раскрытых здесь примерах.
. Альтернативно, материал на основе POSS может содержать каркасные структуры T6, T14 или T16. Среднее содержание каркасной структуры можно корректировать во время синтеза и/или регулировать с помощью методов очистки, и распределение размеров каркаса мономерного(ых) звена (звеньев) можно использовать в раскрытых здесь примерах.
[0059] Как показано на фиг. 1B, структурированный материал 18 содержит образованные в нем углубления 20 и промежуточные области 22, разделяющие смежные углубления 20. Можно предусмотреть много различных схем размещения углублений 20, включая правильные, повторяющиеся и неправильные структуры (узоры). В одном примере углубления 20 расположены в виде шестиугольной решетки для плотной упаковки и повышенной плотности. Другие схемы размещения могут включать, например, прямолинейные (т.е. прямоугольные) схемы размещения, треугольные схемы размещения и так далее. В некоторых примерах схемой размещения или структурой может быть x-y формат углублений 20, которые упорядочены в ряды и столбцы. В некоторых других примерах схемой размещения или структурой может быть повторяющееся расположение углублений 20 и/или промежуточных областей 22. В других примерах схемой размещения или структурой может быть случайное расположение углублений 20 и/или промежуточных областей 22. Структура может включать в себя пятна, бугорки, лунки, столбики, полосы, завитки, линии, треугольники, прямоугольники, круги, дуги, галочки, клетки, диагонали, стрелки, квадраты и/или штриховки.
[0060] Схему размещения или структуру углублений 20 можно охарактеризовать в зависимости от плотности углублений 20 (т.е. числа углублений 20) на определенной площади. Например, углубления 20 могут присутствовать с плотностью приблизительно 2 миллиона на мм2. Плотность может быть настроена на разные плотности, включая, например, плотность примерно 100 на мм2, примерно 1000 на мм2, примерно 0,1 миллиона на мм2, примерно 1 миллион на мм2, примерно 2 миллиона на мм2, примерно 5 миллионов на мм2, примерно 10 миллионов на мм2, примерно 50 миллионов на мм2 или больше, или меньше. Кроме того, должно быть понятно, что плотность углублений 20 в структурированном материале 18 может быть между одним из нижних значений и одним из верхних значений, выбранных из указанных выше диапазонов. В качестве примеров, массив с высокой плотностью можно охарактеризовать как имеющий углубления 20, разделенные менее чем примерно 100 нм, массив со средней плотностью можно охарактеризовать как имеющий углубления 20, разделенные на от примерно 400 нм до примерно 1 мкм, а массив с низкой плотностью можно охарактеризовать как имеющий углубления 20, разделенные более чем примерно 1 мкм. Хотя приведены примерные плотности, следует понимать, что можно использовать любые подходящие плотности.
[0061] Схема размещения или структура углублений 20 может быть также или альтернативно охарактеризована с точки зрения среднего шага, то есть расстояния от центра углубления 20 до центра смежного углубления 20 (межцентрового расстояния) или от края одного углубления 20 до края смежного углубления 20 (межкраевого расстояния). Структура может быть правильной, так что коэффициент отклонения от среднего шага является небольшим, или структура может быть неправильной, и в этом случае коэффициент отклонения может быть относительно большим. В любом случае, средний шаг может быть, например, примерно 50 нм, примерно 0,1 мкм, примерно 0,5 мкм, примерно 1 мкм, примерно 5 мкм, примерно 10 мкм, примерно 100 мкм или более или менее. Средний шаг для конкретной структуры углублений 20 может быть между одним из нижних значений и одним из верхних значений, выбранных из указанных выше диапазонов. В одном примере углубления 20 имеют шаг (межцентровое расстояние) примерно 1,5 мкм. Хотя были предоставлены примерные средние значения шага, следует понимать, что можно использовать другие средние значения шага.
[0062] Размер каждого углубления 20 можно охарактеризовать по его объему, площади отверстия, глубине и/или диаметру.
[0063] Каждое углубление 20 может иметь любой объем, способный удерживать жидкость. Можно выбрать минимальный или максимальный объем, например, для приспосабливания к пропускной способности (например, мультиплексности), разрешению, составу аналита или реакционной способности аналита, ожидаемым для последующих применений проточной ячейки 10. Например, объем может составлять по меньшей мере примерно 1×10−3 мкм3, примерно 1×10−2 мкм3, примерно 0,1 мкм3, примерно 1 мкм3, примерно 10 мкм3, примерно 100 мкм3 или более. Альтернативно или дополнительно, объем может составлять не более примерно 1×104 мкм3, примерно 1×103 мкм3, примерно 100 мкм3, примерно 10 мкм3, примерно 1 мкм3, примерно 0,1 мкм3 или менее.
[0064] Площадь, занимаемую отверстием каждого углубления, можно выбрать на основе критериев, аналогичных изложенным выше для объема. Например, площадь отверстия каждого углубления может составлять по меньшей мере примерно 1×10−3 мкм2, примерно 1×10−2 мкм2, примерно 0,1 мкм2, примерно 1 мкм2, примерно 10 мкм2, примерно 100 мкм2 или более. Альтернативно или дополнительно, площадь может составлять не более примерно 1×103 мкм2, примерно 100 мкм2, примерно 10 мкм2, примерно 1 мкм2, примерно 0,1 мкм2, примерно 1×10−2 мкм2 или менее. Площадь, занимаемая отверстием каждого углубления, может быть больше, меньше или между указанными выше значениями.
[0065] Глубина каждого углубления 20 может составлять по меньшей мере примерно 0,1 мкм, по меньшей мере примерно 0,5 мкм, по меньшей мере примерно 1 мкм, по меньшей мере примерно 10 мкм, по меньшей мере примерно 100 мкм или более. Альтернативно или дополнительно, глубина может составлять не более примерно 1×103 мкм, не более примерно 100 мкм, не более примерно 10 мкм, не более примерно 1 мкм, не более примерно 0,1 мкм или менее. В некоторых примерах глубина составляет примерно 0,4 мкм. Глубина каждого углубления 20 может быть больше, меньше или между указанными выше значениями.
[0066] В некоторых случаях диаметр или длина и ширина каждого углубления 20 может составлять по меньшей мере примерно 50 нм, примерно 0,1 мкм, примерно 0,5 мкм, примерно 1 мкм, примерно 10 мкм, примерно 100 мкм или более. Альтернативно или дополнительно, диаметр или длина и ширина может составлять не более примерно 1×103 мкм, примерно 100 мкм, примерно 10 мкм, примерно 1 мкм, примерно 0,5 мкм, примерно 0,1 мкм или менее (например, примерно 50 нм). Диаметр или длина и ширина также могут изменяться по глубине (например, как показано на фиг. 4A-4C и 6A-6C). Диаметр или длина и ширина каждого углубления 20 может быть больше, меньше или между указанными выше значениями.
[0067] В примере, показанном на фиг. 1B, поверхность S16 электрода 16, открытая в углублениях 20, функционализирована так, что праймеры 24 могут прикрепляться к поверхности S16, а не к промежуточным областям 22. Функционализация поверхности S16 электрода будет зависеть от материала электрода и праймера 24, который подлежит прикреплению к ней.
[0068] В некоторых примерах электродный материал может быть функционализированной по своей природе, поскольку праймер 24 содержит концевую функциональную группу, которая может присоединяться непосредственно к немодифицированному электродному материалу. Например, праймер с концевым тиолом может химически связываться с поверхностью S16 золотого электрода.
[0069] В других примерах поверхность S16 электрода можно модифицировать, вводя функциональную группу (т.е. связывающую молекулу), которая может связываться с праймером 24. Функциональная группа способна химически присоединяться на одном конце к поверхности S16 электрода, а на другом конце - к праймеру 24. В качестве примеров, тиоловые или тиолатные линкеры или аминные линкеры могут присоединяться к золотым электродам, а силановые линкеры (например, азидосилановые) могут присоединяться к электродам из ITO. Хотя представлены некоторые примеры, следует понимать, что можно использовать другие химические функциональные группы.
[0070] Будь то прямое или непрямое (например, через линкер), присоединение праймера 24 к поверхности S16 электрода может происходить посредством ковалентного связывания, координационного связывания или другой химической или физической связи (такой как двойной пи-стэкинг), в зависимости от праймера 24, любого используемого линкера и электродного материала.
[0071] Поскольку поверхность S16 модифицирована функциональными группами или является функционализированной по своей природе, а промежуточные области 22 не содержат реагирующих с праймером функциональных групп, праймеры 24 будут прикрепляться к поверхности S16 и не будут прикрепляться к промежуточным областям 22.
[0072] Следует понимать, что функционализацию электрода можно осуществлять до или после нанесения на него структурированного материала 18.
[0073] В других примерах поверхность S16 электрода может быть функционализирована слоем полимера, описанным здесь со ссылкой на фиг. 1C.
[0074] Как показано на фиг. 1B, праймер(ы) 24 прикрепляют к функционализированной поверхности S16 электрода. Праймером 24 может быть любой прямой праймер амплификации или обратный праймер амплификации, который содержит функциональную группу, которая может прикрепляться к поверхности S16, либо непосредственно к электродному материалу, либо к присоединенной к нему функциональной группе, либо к присоединенному к нему слою полимера. Примеры праймеров с подходящей концевой функциональной группой включают праймер с концевым алкином, праймер с концевым тетразином, праймер с концевым азидо, праймер с концевым амино, праймер с концевым эпокси или глицидилом, праймер с концевым тиофосфатом, праймер с концевым тиолом, праймер с концевым альдегидом, праймер с концевым гидразином и праймер с концевым триазолиндионом. Также можно использовать смесь праймеров. Конкретные примеры подходящих праймеры включают праймеры P5 и/или P7, которые использованы на поверхности коммерческих проточных ячеек, продаваемых компанией Illumina Inc., для секвенирования на HiSeq™, HiSeqX™, MiSeq™, MiSeqDX™, MiNISeq™, NextSeq™, NextSeqDX™, NovaSeq™, Genome Analyzer™ и других приборных платформах.
[0075] В одном примере праймеры 24 можно присоединять с использованием метода прививки, такого как осаждение из потока (например, когда проточная ячейка 10 имеет соединенную с ней крышку), нанесение покрытия методом окунания, нанесение покрытия методом распыления, дозирование методом наплыва или с использованием другого подходящего способа, который прикрепит праймер(ы) 24. В каждом из этих иллюстративных методов можно использовать раствор или смесь праймера(ов), который(ая) может содержать праймер(ы), воду, буфер (например, солевой раствор) и катализатор.
[0076] Обращаясь теперь к фиг. 1C, проточная ячейка 10 содержит подложку 14 и структурированный электрод 26, расположенный на подложке 14. В этом примере структурированный электрод 26 образует углубления 20, разделенные промежуточными областями 22. В этом примере функционализированная поверхность S14 подложки 14 открыта на каждом из углублений 20, и праймер 24 привит к функционализированной поверхности S14.
[0077] Подложка 14 на фиг. 1C обеспечивает опору для других компонентов проточной ячейки 10. Подложка 14 может быть любой из описанных здесь примеров.
[0078] На фиг. 1C структурированный электрод 26 расположен на подложке 14. Структурированный электрод 26 может представлять собой любой из электродных материалов, упоминавшихся для электрода 16. В этом примере структурированный электрод 26 может представлять собой заранее сформированную решетку, которая присоединена к подложке 14, например, с использованием клея, или может быть осажден на подложке 14 с нужной структурой (узором) с использованием подходящего метода осаждения.
[0079] В примере, показанном на фиг. 1C, структурированный электрод 26 содержит образованные в нем углубления 20 и промежуточные области 22, разделяющие смежные углубления 20. Для показанных на фиг. 1C углублений 20 можно использовать любые структуры, схемы размещения и размеры, приведенные здесь для углублений 20 по фиг. 1B.
[0080] Также в примере, показанном на фиг. 1C, поверхность S14 подложки 14, открытая в углублениях 20, функционализирована так, что праймеры 24 могут присоединяться к поверхности S14, а не к промежуточным областям 22 структурированного электрода 26.
[0081] В некоторых примерах функционализация поверхности S14 подложки предусматривает силанизацию поверхности S14, открытой в углублениях 20, и образование слоя полимера на силанизированной поверхности. Силанизацию можно осуществлять с использованием любого силана или производного силана. Иллюстративный силан или производные силана включают норборненсилан, производное норборнена (например, [(5-бицикло[2.2.1]гепт-2-энил)этил]триметоксисилан), циклооктин, производное циклооктина или другой подходящий силан. Способ, используемый для присоединения силана или производного силана, может меняться в зависимости от используемого силана или производного силана. Примеры подходящих способов силанизации включают в себя осаждение из паровой фазы (например, способ YES), нанесение покрытия методом центрифугирования или другие способы осаждения.
[0082] Затем на силанизированную поверхность может быть нанесен полимер (не показан). Полимер может представлять собой полужесткий полимерный материал, проницаемый для жидкостей и газов. Пример полимера включает сополимер акриламида, такой как поли(N-(5-азидоацетамидилпентил)акриламид-ко-акриламид, PAZAM. PAZAM и некоторые другие формы сополимера акриламида представлены следующей структурой (I):
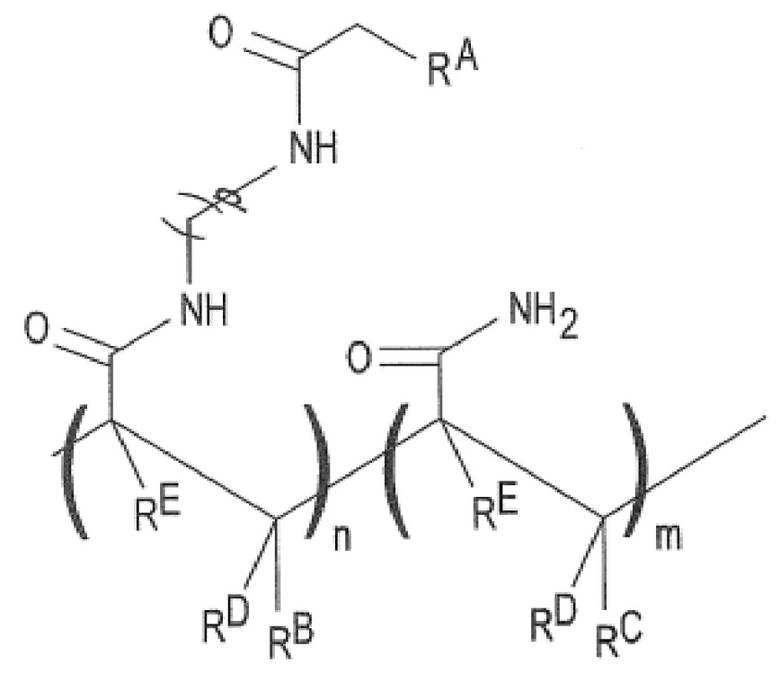
в которой:
RA выбран из группы, состоящей из азидо, необязательно замещенного амино, необязательно замещенного алкенила, необязательно замещенного гидразона, необязательно замещенного гидразина, карбоксила, гидрокси, необязательно замещенного тетразола, необязательно замещенного тетразина, оксида нитрила, нитрона и тиола;
RB представляет собой H или необязательно замещенный алкил;
RC, RD и RE, каждый независимо, выбран из группы, состоящей из H и необязательно замещенного алкила;
каждый из -(CH2)p- может быть необязательно замещен;
p представляет собой целое число в диапазоне 1-50;
n представляет собой целое число в диапазоне 1-50000; а
m представляет собой целое число в диапазоне 1-100000.
Среднему специалисту в данной области техники будет ясно, что расположение повторяющихся признаков «n» и «m» в структуре (I) является репрезентативным, и мономерные субзвенья могут располагаться в полимерной структуре в любом порядке (например, случайном, блоками, структурированно или их комбинации).
[0083] Молекулярная масса PAZAM может составлять в диапазоне от примерно 10 кДа до примерно 1500 кДа или, в конкретном примере, может составлять примерно 312 кДа. В некоторых примерах PAZAM представляет собой линейный полимер. В некоторых других примерах PAZAM представляет собой редкосшитый полимер.
[0084] В других примерах полимер может быть разновидностью структуры (I). В одном примере акриламидное звено может быть заменено N,N-диметилакриламидом (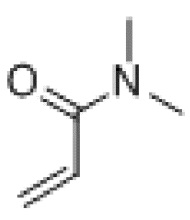 ). В этом примере акриламидное звено в структуре (I) может быть заменено на
). В этом примере акриламидное звено в структуре (I) может быть заменено на 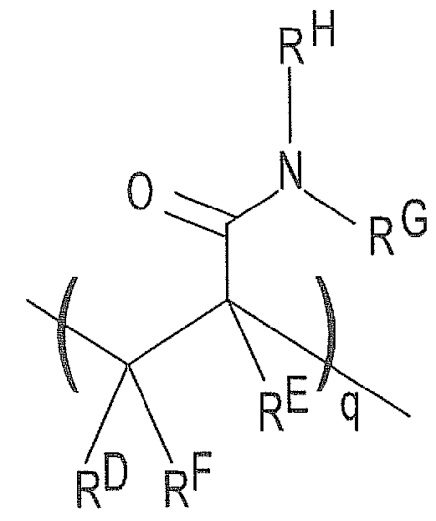 , где каждый из RD, RE и RF представляет собой H или C1-C6 алкил, а каждый RG и RH представляет собой C1-C6 алкил (вместо H, как в случае с акриламидом). В этом примере q может быть целым числом в диапазоне 1-100000. В другом примере N,N-диметилакриламид можно использовать в дополнение к акриламидному звену. В этом примере структура (I) может содержать
, где каждый из RD, RE и RF представляет собой H или C1-C6 алкил, а каждый RG и RH представляет собой C1-C6 алкил (вместо H, как в случае с акриламидом). В этом примере q может быть целым числом в диапазоне 1-100000. В другом примере N,N-диметилакриламид можно использовать в дополнение к акриламидному звену. В этом примере структура (I) может содержать 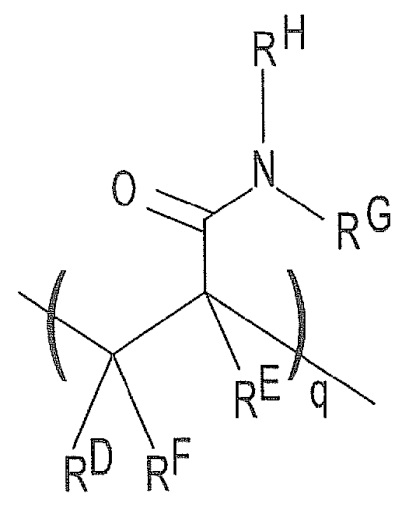 в дополнение к повторяющимся признакам «n» и «m», где каждый RD, RE и RF представляет собой H или C1-C6 алкил, а каждый RG и RH представляет собой C1-C6 алкил. В этом примере q может быть целым числом в диапазоне 1-100000.
в дополнение к повторяющимся признакам «n» и «m», где каждый RD, RE и RF представляет собой H или C1-C6 алкил, а каждый RG и RH представляет собой C1-C6 алкил. В этом примере q может быть целым числом в диапазоне 1-100000.
[0085] Следует понимать, что для образования полимера можно использовать другие молекулы, при условии, что они функционализированы для взаимодействия с активированной поверхностью S14 и нанесенным(и) впоследствии праймером (праймерами) 24. Другие примеры подходящих полимеров включают в себя полимеры, имеющие коллоидную структуру, такие как агароза; или полимерную сетчатую структуру, такие как желатин; или сшитую полимерную структуру, такую как полиакриламидные полимеры и сополимеры, безсилановый акриламид (SFA) или азидолизированный вариант SFA. Иллюстративные подходящие полиакриламидные полимеры можно синтезировать из акриламида и акриловой кислоты или акриловой кислоты, содержащей винильную группу, или из мономеров, которые вызывают реакции фотоциклоприсоединения [2+2]. Другие примеры подходящих полимеров включают смешанные сополимеры акриламидов и акрилатов.
[0086] Полимер (например, PAZAM) можно наносить с использованием нанесения покрытия методом центрифугирования или нанесения покрытия методом окунания или погружения, или из потока функционализированных молекул при положительном или отрицательном давлении, или другим подходящим методом. Полимер может находиться в смеси. В одном примере смесь содержит PAZAM в воде или в смеси этанола и воды.
[0087] После нанесения покрытия смесь, содержащую полимер, также можно подвергать процессу отверждения с образованием полимера по промежуточным областям 22 структурированного электрода 26 и в углублениях 20. В одном примере отверждение может происходить при температуре в диапазоне от комнатной температуры (например, примерно 25°C) до примерно 95°C в течение времени от примерно 1 миллисекунды до примерно нескольких дней. В другом примере это время может составлять от 10 секунд до по меньшей мере 24 часов. В еще одном примере это время может составлять от примерно 5 минут до примерно 2 часов.
[0088] Присоединение полимера к силанизированным поверхностям S14 может происходить посредством ковалентного связывания. Ковалентное связывание полезно для сохранения по меньшей мере праймера(ов) 24 в углублениях на протяжении всего срока службы образованной в итоге проточной ячейки 10 в ходе множества разнообразных применений. Ниже приведены некоторые примеры реакций, которые могут происходить между активированными (например, силанизированными) поверхностями и полимером.
[0089] Когда силан или производное силана содержит норборнен или производное норборнена в качестве ненасыщенного фрагмента, норборнен или производное норборнена могут: i) вступать в реакцию 1,3-диполярного циклоприсоединения с азид/азидо группой PAZAM; ii) вступать в реакцию связывания с тетразиновой группой, присоединенной к PAZAM; вступать в реакцию циклоприсоединения с гидразоновой группой, присоединенной к PAZAM; вступать в фотоклик-реакцию с тетразоловой группой, присоединенной к PAZAM; или вступать в реакцию циклоприсоединения с группой оксида нитрила, присоединенной к PAZAM.
[0090] Когда силан или производное силана содержит циклооктин или производное циклооктина в качестве ненасыщенного фрагмента, циклооктин или производное циклооктина может: i) вступать в реакцию облегченного напряжением азид-алкинового 1,3-циклоприсоединения (SPAAC) с азид/азидо группой PAZAM или ii) вступать в реакцию облегченного напряжением циклоприсоединения алкин-оксида нитрила с группой оксида нитрила, присоединенной к PAZAM.
[0091] Когда силан или производное силана содержит бициклононин в качестве ненасыщенного фрагмента, бициклононин может подвергаться аналогичному SPAAC циклоприсоединению алкина с азидами или оксидами нитрила, присоединенными к PAZAM вследствие напряжения в бициклической кольцевой системе.
[0092] В других примерах вместо силанизации можно использовать плазменное озоление для функционализации открытых поверхностей S14 подложки 14 в углублениях 20. После плазменного озоления смесь, содержащую полимер, можно наносить методом центрифугирования (или осаждать иным методом) непосредственно на подвергнутые плазменному озолению поверхности, а затем отверждать с образованием полимера. В этом примере при плазменном озолении может образовываться активирующее(ие) поверхность средство (средства) (например, группы -OH), которые могут приклеивать полимер к промежуточным областям 22 и открытым поверхностям S14 подложки 14 в углублениях 20. В этих примерах полимер выбран так, чтобы он реагировал с поверхностными группами, образованными плазменным озолением.
[0093] При использовании силанизации или плазменного озоления затем можно выполнить полировку с целью удаления полимера из промежуточных областей 22 структурированного электрода 26. В некоторых примерах полировка также может удалять или не удалять силан или производное силана, прилегающие к промежуточным областям 22. Следует понимать, что при полном удалении этих силанизированных частей открывается нижележащий структурированный электрод 26.
[0094] Процесс полировки можно выполнять с помощью слабой химической суспензии (содержащей, например, абразив, буфер, хелатирующее средство, поверхностно-активное вещество и/или диспергатор), которая может удалять тонкий полимер, а в некоторых случаях и по меньшей мере часть силана или производного силана, из промежуточных областей 22 без вредного воздействия на нижележащий структурированный электрод 26 в этих областях. Альтернативно, полировку можно выполнять раствором, не содержащим абразивных частиц.
[0095] Химическую суспензию можно использовать в системе химико-механического полирования для полировки поверхности промежуточных областей 22. Полировальная(ые) головка(и)/подушечка(и) или другой(ие) полировальный(е) инструмент(ы) способны сполировать полимер из промежуточных областей 22, оставляя полимер в углублениях 20. В качестве примера, полировальной головкой может быть полировальная головка Strasbaugh ViPRR II.
[0096] Процессы очистки и сушки можно проводить после полировки. В процессе очистки можно использовать водяную баню и обработку ультразвуком. В водяной бане можно поддерживать относительно низкую температуру в диапазоне от примерно 22°C до примерно 30°C. Процесс сушки может включать центрифугирование или сушку другим подходящим методом.
[0097] Следует понимать, что для функционализации поверхности S14 подложки при подготовке к присоединению праймера 24 также можно использовать другие химические вещества и/или процессы.
[0098] Как показано на фиг. 1C, праймер(ы) 24 присоединяют к функционализированной поверхности S14 подложки. В примере, показанном на фиг. 1C, можно использовать любые из раскрытых здесь праймеров 24 и способов прививки праймеров 24, при условии, что праймер(ы) 24 может/могут быть присоединен(ы) к функциональным группам (например, функциональным группам полимера) на поверхности S14 подложки.
[0099] Проточная ячейка 10 содержит массив углублений 20, либо в соответствии с архитектурой, описанной на фиг. 1B, либо в соответствии с архитектурой, описанной на фиг. 1C. Массив 52, соответствующий архитектуре, показанной на фиг. 1B, представлен на фиг. 3, а массив 52’, соответствующий архитектуре, показанной на фиг. 1C, представлен на фиг. 5. Проточную ячейку 10, содержащую массив 52 или 52’, можно использовать в рабочем процессе секвенирования, который генерирует посредством электрохемилюминесценции сигналы флуоресценции, которые обнаруживаются оптически. Примеры этих рабочих процессов будут описаны со ссылкой на фиг. 4A-4C и фиг. 6A-6C.
[0100] Перед секвенированием на поверхности проточной ячейки с использованием праймеров 24 может быть сформирована матричная полинуклеотидная цепь 40, которую необходимо секвенировать. В начале образования матричной полинуклеотидной цепи могут быть приготовлены матрицы библиотеки из любого образца нуклеиновой кислоты (например, образца ДНК или образца РНК). Образец нуклеиновой кислоты можно фрагментировать на одноцепочечные фрагменты ДНК или РНК с аналогичными размерами (например, <1000 п.о.). При подготовке к концам этих фрагментов можно добавить адаптеры. Посредством сокращенного цикла амплификации в адаптеры можно вводить различные мотивы, такие как сайты связывания для секвенирования, индексы и области, комплементарные праймерам 24 в углублениях 20. Конечные матрицы библиотеки содержат фрагмент ДНК или РНК и адаптеры на обоих концах. В некоторых примерах фрагменты из одного образца нуклеиновой кислоты имеют добавленные к ним такие же адаптеры.
[0101] В проточную ячейку 10 можно ввести множество матриц библиотеки. Поскольку проточная ячейка 10 содержит массив 52 или 52’ углублений 20, множественные матрицы библиотеки гибридизуют, например, с одним из двух типов праймеров 24, иммобилизованных на поверхности S16 электрода или поверхности S14 подложки в каждом из углублений 20.
[0102] Затем можно выполнить создание кластера. В одном примере создания кластеров матрицы библиотеки копируют из гибридизированных праймеров 24 с помощью 3' расширения с использованием высококачественного воспроизведения ДНК-полимеразы. Исходные матрицы библиотеки денатурируют, оставляя копии иммобилизованными в углублениях 20. Для амплификации иммобилизованных копий можно использовать изотермическую мостиковую амплификацию или какую-либо другую форму амплификации. Например, охватывают скопированные матрицы для гибридизации с соседним комплементарным праймером 24, а полимераза копирует скопированные матрицы с образованием двухцепочечных мостиков, которые денатурируют с образованием двух одноцепочечных нитей. Эти две нити охватывают и гибридизуют с соседними комплементарными праймерами 24 и снова удлиняют с образованием двух новых двухцепочечных петель. Процесс повторяют с каждой копией матрицы с помощью циклов изотермической денатурации и амплификации для создания плотных клоновых кластеров. Денатурируют каждый кластер двухцепочечных мостиков. В одном примере обратную цепь удаляют путем отщепления определенного основания, оставляя прямые матричные полинуклеотидные цепи. Хотя на фиг. 4A-4C и фиг. 6A-6C в углублении 20 показана одна матричная полинуклеотидная цепь 40, следует понимать, что кластеризация приводит к образованию нескольких матричных полинуклеотидных цепей 40 в каждом углублении 20. Этот пример кластеризации представляет собой мостовую амплификацию и является одним из примеров амплификации, которую можно выполнять. Следует понимать, что можно использовать другие методы амплификации, такие как рабочий процесс амплификации исключения (Examp) (Illumina Inc.).
[0103] Во время секвенирования сигналы флуоресценции генерируются с помощью электрохемилюминесценции. По сути, по меньшей мере некоторые из нуклеотидов, которые вводят в проточную ячейку 10 во время секвенирования, являются мечеными нуклеотидами, которые содержат электрохемилюминесцентную метку. Примеры меченых нуклеотидов 28A, 28B, 28C показаны на фиг. 2. Каждый из меченых нуклеотидов 28A, 28B, 28C содержит нуклеотид 30, имеющий блокирующую 3’ OH группу 32A, 32B, 32C, связывающую молекулу 34, присоединенную к основанию или сахару нуклеотида 30, и электрохемилюминесцентную (ЭХЛ) метку 36, присоединенную к связывающей молекуле 34.
[0104] Нуклеотид 30 содержит азотсодержащее гетероциклическое основание, сахар и одну или более фосфатных групп. Нуклеотиды 30 представляют собой мономерные звенья последовательности нуклеиновой кислоты. В РНК сахаром является рибоза, а в ДНК сахаром является дезоксирибоза, то есть сахар с отсутствующей гидроксильной группой, которая присутствует в положении 2' в рибозе. Азотсодержащее гетероциклическое основание (т.е. азотистое основание) может быть пуриновым основанием или пиримидиновым основанием. Пуриновые основания включают аденин (A) и гуанин (G), а также их модифицированные производные или аналоги. Пиримидиновые основания включают цитозин (C), тимин (T) и урацил (U), а также их модифицированные производные или аналоги. Атом C-1 рибозы или дезоксирибозы связан с N-1 пиримидина или N-9 пурина. Нуклеотид 30 может быть монофосфатной или полифосфатной формой, содержащей несколько фосфатных групп (например, трифосфат (т.е. гамма-фосфат), тетрафосфат, пентафосфат, гексафосфат и т.д.). Аналог нуклеиновой кислоты может иметь любые из фосфатного остова, сахара или измененного нуклеинового основания. Примеры аналогов нуклеиновых кислот включают, например, универсальные основания или аналоги фосфатно-сахарного остова, такие как пептидо-нуклеиновая кислота (ПНК). На фиг. 2 основанием нуклеотида 30 является цитозин, сахаром является дезоксирибоза, а фосфатом является три- или гамма-фосфат.
[0105] В раскрытых здесь примерах нуклеотид 30 имеет присоединенную к нему группу 32A, 32B, 32C, блокирующую 3’ OH. Эта блокирующая 3’ OH группа 32A, 32B, 32C может быть связана с атомом кислорода молекулы сахара в нуклеотиде 30. Блокирующая 3’ OH группа 32A, 32B, 32C может быть обратимым терминатором, который обеспечивает встраивание только одного единственного основания в каждом цикле секвенирования (как будет обсуждаться дальше со ссылкой на фиг. 4A-4C и фиг. 6A-6C). Обратимый терминатор останавливает встраивание дополнительных оснований в образующуюся цепь, комплементарную матричной полинуклеотидной цепи 40. Это обеспечивает возможность обнаружения и идентификации единственного встроенного основания. Блокирующую 3’ OH группу 32A, 32B, 32C можно впоследствии удалить, позволяя происходить дополнительным циклам секвенирования на каждой матричной полинуклеотидной цепи 40. На фиг. 2 показаны примеры разных блокирующих 3’ OH групп 32A, 32B, 32C, включая обратимый терминатор 3′-ONH2 (показан как 32A), 3′-O-аллиловый обратимый терминатор (т.е. -CH=CHCH2, показанный как 32B) и 3′-O-азидометиловый обратимый терминатор (т.е. -CH2N3, показанный как 32C). Другие подходящие обратимые терминаторы включают o-нитробензиловые простые эфиры, алкил o-нитробензилкарбонат, фрагменты сложных эфиров, другие аллильные фрагменты, ацетали (например, трет-бутокси-этокси), фрагменты MOM (-CH2OCH3), 2,4-динитробензолсульфенил, тетрагидрофураниловый простой эфир, 3' фосфат, простые эфиры, -F, - H2, -OCH3, -N3, -HCOCH3 и 2-нитробензолкарбонат.
[0106] Связывающая молекула 34 присоединена к пуриновому основанию или пиримидиновому основанию нуклеотида 30. В некоторых примерах связывающая молекула 34 содержит сайт расщепления, обозначенный стрелками (например, стрелкой 38) на фиг. 2. Некоторые примеры подходящих связывающих молекул 34 показаны на фиг. 2, хотя следует понимать, что можно использовать любой подходящий отщепляемый линкер, который может прикреплять электрохемилюминесцентную метку 36 к основанию или сахару нуклеотида. В других примерах связывающая молекула 34 является неотщепляемой. Этот тип связывающей молекулы 34 может быть желательным, когда для различения встроенных нуклеотидных оснований используют одноканальное детектирование и используют химизм отщепления ЭХЛ-метки 36.
[0107] К связывающей молекуле 34 присоединена обладающая электрохемилюминесценцией (ЭХЛ) метка 36. В качестве ЭХЛ-метки 36 можно использовать любое соединение, которое может быть присоединено к связывающей молекуле 34 и которое может проявлять электрохемилюминесценцию в текучей среде (например, водном растворе).
[0108] Некоторые ЭХЛ-метки 36 претерпевают самоаннигиляцию, в результате чего метка 36 непосредственно генерирует возбужденное состояние в ответ на электрический потенциал, который меняется с положительного на отрицательный. Одним из примеров такого типа меток является хлорпромазин. Для этого типа метки 36 не требуется кореагент для создания излучения ЭХЛ.
[0109] Другие ЭХЛ-метки 36 можно классифицировать как анодные ЭХЛ-соединения или катодные ЭХЛ-соединения, в зависимости от того, активируют ли их с помощью окисления или восстановления соответственно.
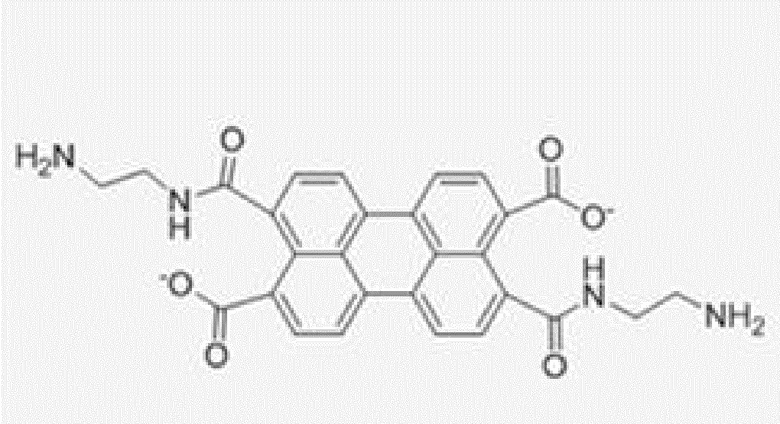
[0110] Анодный ЭХЛ-меченый нуклеотид окисляется при приложенном положительном потенциале, что генерирует катион-радикал, который может затем вступить в реакцию переноса электронов с кореагентом (в данном примере - восстановителем) с образованием нейтрального возбужденного состояния, которое является эмиссионным. Примеры анодных ЭХЛ-меток 36 включают трис(2,2'-бипиридин)рутений(II), 2-тиантренкарбоновую кислоту, 9,10-дифенилантрацен-2-сульфонат натрия (DPAS), структуры которых соответственно показаны ниже:
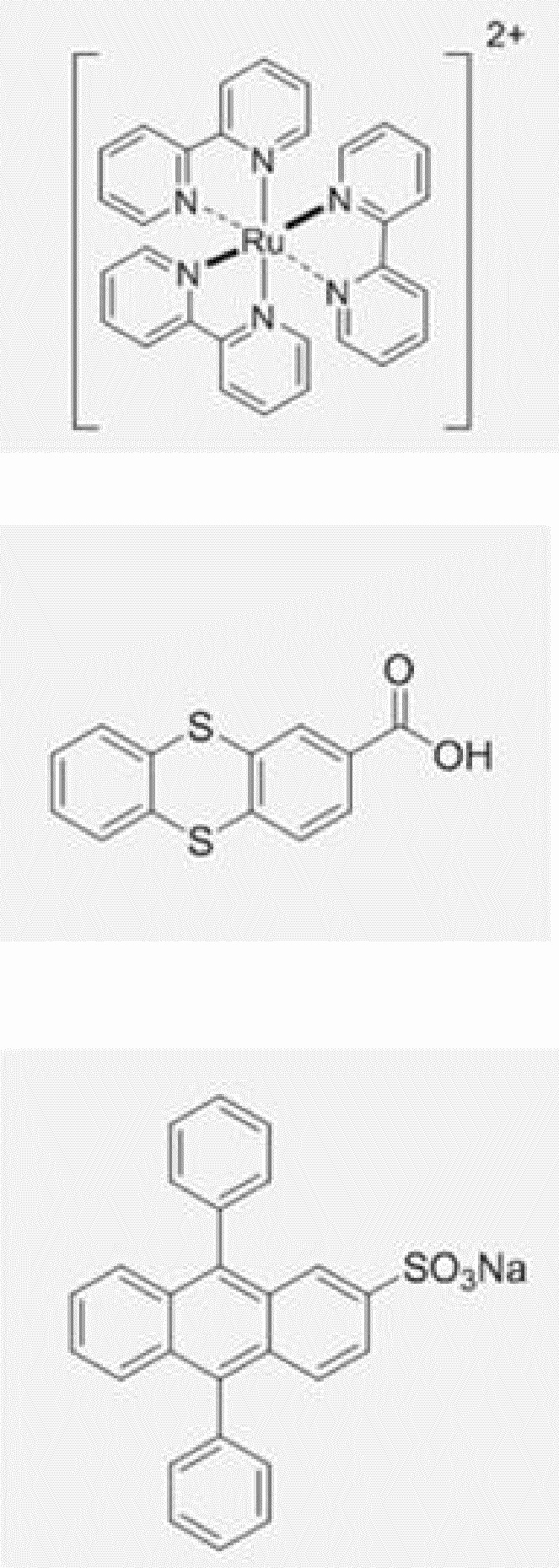
Подходящие кореагенты-восстановители для анодных ЭХЛ-меток включают алифатические амины, такие как триалкиламины (например, три-n-пропиламин), и оксалат.
[0111] Катодный ЭХЛ-меченый нуклеотид восстанавливается при приложенном отрицательном потенциале, что генерирует анион-радикал, который может затем вступать в реакцию переноса электрона с кореагентом (в этом примере - окислителем) с образованием нейтрального возбужденного состояния, которое является эмиссионным. Примеры катодных ЭХЛ-меток 36 включают диангидрид 3,4,9,10-перилентетракарбоновой кислоты и мезо-тетра(4-сульфонатофенил)порфирин, структуры которых соответственно показаны ниже:
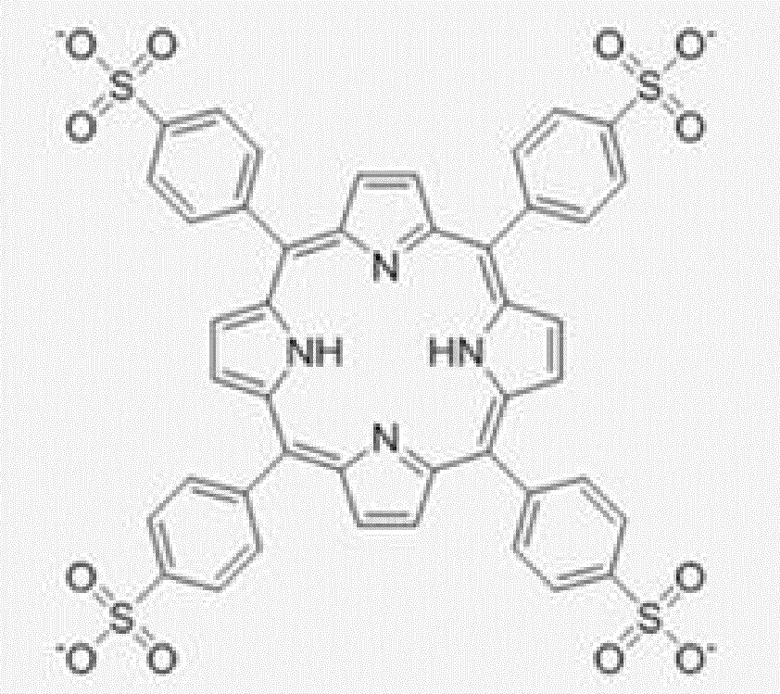
Подходящий кореагент для катодных ЭХЛ-меток включает пероксидисульфат (S2O82-) (например, пероксидисульфат калия). 9,10-дифенилантрацен-2-сульфонат натрия (DPAS) (показанный выше в качестве анодной ЭХЛ-метки) может также функционировать в качестве катодной ЭХЛ-метки 36 при приложении подходящего отрицательного потенциала с пероксидисульфатом калия в качестве кореагента.
[0112] Хотя было представлено несколько примеров ЭХЛ-меток 36 и кореагентов, следует понимать, что можно использовать другие ЭХЛ-метки 36 и кореагенты.
[0113] Далее способы секвенирования с использованием меченых нуклеотидов 28A, 28B, 28C и оптического обнаружения будут описаны со ссылкой на фиг. 4A-4C и фиг. 6A-6C. На фиг. 4A-4C представлен такой способ с использованием архитектуры проточной ячейки по фиг. 1B и массива 52 по фиг. 3, а на фиг. 6A-6C представлен такой способ с использованием архитектуры проточной ячейки по фиг. 1C и массива 52’ по фиг. 5.
[0114] Перед циклом секвенирования можно блокировать 3’-концы матричных полинуклеотидных цепей/нитей 40 и любые связанные с проточной ячейкой праймеры 24 (не присоединенные к матричным полинуклеотидным цепям/нитям 40) для предотвращения помех реакции секвенирования и, в частности, для предотвращения ненужного прайминга.
[0115] Как показано на фиг. 4A и фиг. 6A, праймер 53 для секвенирования может быть введен в проточную ячейку 10, где он будет гибридизоваться с комплементарной последовательностью на адаптере матричной полинуклеотидной цепи 40. Это делает матричную полинуклеотидную цепь 40 готовой к секвенированию.
[0116] Способ секвенирования включает введение текучей среды (например, водного раствора), содержащего полимеразу 42 и нуклеотиды (например, меченый нуклеотид 28) в проточную ячейку 10, содержащую электрод 16 или 26, который частично образует углубление 20, содержащее матричную полинуклеотидную цепь 40, прикрепленную в углублении 20, причем по меньшей мере некоторые из этих нуклеотидов являются описанными здесь мечеными нуклеотидами 28. Можно использовать любую полимеразу 42 с высокой или низкой процессивностью. Некоторые примеры включают Phi29, Bacillus stearothermophilus (Bst) и фрагмент Кленова (KF), хотя можно использовать и другие. В дополнение к полимеразе(ам) 42 и меченому(ым) нуклеотиду(ам) 28, текучая среда также может содержать воду, буфер, немеченые нуклеотиды и т.д. Иллюстративные буферы включают в себя Трис-буфер, буферный солевой раствор цитрата натрия (SSC), сульфатно-аммониевый буфер, фосфатный буфер и т.д. В некоторых примерах буфер может представлять собой другой катион соли, такой как калий, магний, марганец или другие.
[0117] Один из нуклеотидов встраивают с помощью соответствующей полимеразы 42 в образующуюся цепь, которая удлиняет праймер 53 для секвенирования и которая комплементарна матричной полинуклеотидной цепи 40. Другими словами, на каждой матричной полинуклеотидной цепи 40 по проточной ячейке 10 соответствующие полимеразы 42 удлиняют гибридизованный праймер 53 для секвенирования на один из нуклеотидов (меченый или нет) в растворе. Нуклеотиды в растворе находятся в виде одиночных, отдельных молекул, а значит, естественная конкуренция минимизирует сдвиг встраивания. На фиг. 4B и 6B встроенным нуклеотидом является ЭХЛ-меченый нуклеотид 28.
[0118] В раскрытых здесь примерах как меченые нуклеотиды 28, так и любые немеченые нуклеотиды включают обратимый терминатор. По сути, встраивание меченого нуклеотида 28 или немеченого нуклеотида в образующуюся цепь служит терминатором для полимеризации. Это позволяет происходить генерированию и обнаружению электрохимических сигналов.
[0119] После встраивания текучую среду, которая содержит какие-то невстроенные нуклеотиды, можно удалить из проточной ячейки 10. Это можно осуществить с использованием промывочного раствора (например, воды).
[0120] После встраивания и удаления каких-либо невстроенных нуклеотидов способ включает приложение потенциала к электроду 16 (фиг. 4B-4C) или к структурированному электроду 26 (фиг. 6B-6C) и обнаружение оптического излучения 54 в ответ на приложенный потенциал (фиг. 4C и фиг. 6C). Потенциал, который прикладывают к электроду 16 или к структурированному электроду 26, является достаточным для запуска реакции ЭХЛ любого меченого нуклеотида 28, основание которого встроено в образующуюся цепь. В некоторых примерах можно последовательно прикладывать серию различных потенциалов для запуска реакций ЭХЛ разных ЭХЛ-меток 36.
[0121] В некоторых примерах потенциал меняют с положительного на отрицательный, что непосредственно генерирует возбужденное состояние ЭХЛ-меток 36, приводящее в результате к оптическому излучению 54.
[0122] В других примерах кореагент вводят в текучую среду с полимеразой 42 и нуклеотидами. В этих примерах приложенный потенциал инициирует путь реакции окисления-восстановления, в котором задействованы метка 36 и кореагент. В качестве примера, приложенный потенциал может инициировать электрохимическое окисление или восстановление ЭХЛ-метки 36 с образованием иона-радикала, который затем восстанавливается или окисляется кореагентом с образованием возбужденного состояния. Возбужденное состояние приводит к оптическому излучению 54.
[0123] В еще других примерах с кореагентом можно добавить окислительно-восстановительный челнок. Окислительно-восстановительный челнок может переносить заряд через текучую среду к активному веществу или от него. Окислительно-восстановительный челнок может диффундировать к поверхности S16 электрода или к стенкам углубления, которые образованы структурированным электродом 26, и окисляться или восстанавливаться. Затем окисленный или восстановленный окислительно-восстановительный челнок может диффундировать к и реагировать с ЭХЛ-меткой 36 с образованием окисленной или восстановленной ЭХЛ-метки. Затем окисленная или восстановленная ЭХЛ-метка должна вступить в реакцию с кореагентом с образованием эмиссионного состояния. Окислительно-восстановительный челнок может обеспечивать участие ЭХЛ-метки 36 в событии окисления-восстановления, когда метка 36 не находится в непосредственном физическом контакте с электродом 16 или 26.
[0124] В примерах, показанных на фиг. 4C и фиг. 6C, получают изображение оптического излучения 54 с помощью камеры для захвата цвета излучения.
[0125] Затем в проточную ячейку 10 можно ввести деблокирующее средство. Деблокирующее средство может быть способно i) отщеплять любые отщепляемые связывающие молекулы 34 от встроенного меченого нуклеотида 28 (что также удаляет ЭХЛ-метку 36) и ii) удалять блокирующую 3’ OH группу 32A, 32B, 32C (см. фиг. 2) из встроенного меченого нуклеотида 28. Следует понимать, что, когда немеченый нуклеотид (который не содержит присоединенной к нему ЭХЛ-метки 36) встраивается в образующуюся цепь, деблокирующее средство удаляет блокирующую 3’ OH группу 32A, 32B, 32C из немеченого нуклеотида. В любом примере удаление блокирующей 3’ OH группы 32A, 32B, 32C позволяет выполнять последующий цикл секвенирования. Примеры блокирующих 3’ OH групп и подходящих деблокирующих средств включают: o-нитробензиловые простые эфиры и алкил o-нитробензилкарбонат, который может быть удален фотолитически; фрагменты сложных эфиров, которые можно удалять путем гидролиза оснований; аллиловые фрагменты, которые можно удалять с помощью Nal, хлортриметилсилана и Na2S2O3 или с помощью Hg(II) в ацетоне/воде; азидометил, который можно отщеплять фосфинами, такими как трис(2-карбоксиэтил)фосфин (TCEP) или три(гидроксипропил)фосфин (THP); ацетали, такие как трет-бутокси-этокси, которые можно отщеплять при кислых условиях; фрагменты MOM (-CH2OCH3), которые можно отщеплять с помощью LiBF4 и CH3CN/H2O; 2,4-динитробензолсульфенил, который можно отщеплять нуклеофилами, такими как тиофенол и тиосульфат; тетрагидрофураниловый простой эфир, который можно отщеплять с помощью Ag(I) или Hg(II); и 3' фосфат, который можно отщеплять с помощью ферментов фосфатазы (например, полинуклеотидкиназы). Другие полезные обратимые фрагменты включают простые эфиры, -F, -H2, -OCH3, -N3, -HCOCH3 и 2-нитробензолкарбонат, а полезные деблокирующие обработки включают в себя облучение светом (например, чтобы вызвать фоторасщепление), нагревание, воздействие химическими реагентами, воздействие катализаторами, воздействие электрическим током (например, чтобы вызвать электролиз), или тому подобное.
[0126] Для простоты объяснения и понимания на фиг. 4А-4C и фиг. 6А-6C проиллюстрирован один цикл секвенирования с участием одной матричной полинуклеотидной цепи 40 и встраиванием одного меченого нуклеотида 28 в образующуюся цепь, формируемую комплементарно матричной полинуклеотидной цепи 40. Однако следует понимать, что каждое углубление 20 содержит несколько (например, до нескольких миллионов) матричных полинуклеотидных цепей 40 (ампликонов), и встраивание одного основания может одновременно происходить на каждой матричной полинуклеотидной цепи 40 в каждом углублении 20. При получении изображения будут захватываться излучения 54, появляющиеся в результате разнообразных событий встраивания и приложенного(ых) потенциала(ов), и соответственно встроенные основания можно идентифицировать по этому изображению. Полученные изображения можно обрабатывать с помощью программного обеспечения анализа изображений для определения того, какие нуклеотиды были встроены в каждом положении кластера по проточной ячейке.
[0127] В раскрытых здесь примерах ЭХЛ-метка 36 может иметь конкретный спектр излучения, конкретный потенциал окисления или восстановления, конкретное время жизни излучения (свечения), конкретную интенсивность излучения и/или конкретный химизм отщепления. Эти уникальные характеристики позволяют идентифицировать разные ЭХЛ-метки 36, например, по их соответствующим (и разным) излучениям (свечениям), по соответствующим (и разным) потенциалам, используемым для запуска окисления или восстановления, по их соответствующим (и разным) временам жизни излучения и/или по наличию или отсутствию конкретной активности отщепления. В одном примере соответствующие и разные излучение, потенциал, время жизни излучения и/или активность отщепления любой ЭХЛ-метки 36 отличается от излучения, потенциала, времени жизни излучения и/или активности расщепления любой другой ЭХЛ-метки 36, используемой во множестве меченых нуклеотидов 28. По сути, особую ЭХЛ-метку 36, имеющую одну или более из этих уникальных характеристик, можно соединить с конкретным нуклеотидным основанием (например, A, T, C и G). Когда меченый нуклеотид 28A, 28B, 28C встраивается в образующуюся цепь во время секвенирования, эта уникальная характеристика ЭХЛ-метки 36 может быть обнаружена, а затем использована для идентификации встроенного основания.
[0128] В качестве одного примера, четыре различные ЭХЛ-метки с четырьмя различными спектрами излучения (т.е. с излучением в четырех различных диапазонах длин волн) могут быть соответственно присоединены к четырем нуклеотидным основаниям: A, T, C и G. В ходе получения изображения в цикле секвенирования четыре разных изображения с использованием этих четырех различных диапазонов длин волн могут быть захвачены и обработаны для выявления того, какие нуклеотиды были встроены.
[0129] В качестве другого примера, три различные ЭХЛ-метки с тремя различными спектрами излучения (т.е. с излучением в трех различных диапазонах длин волн) могут быть соответственно присоединены к трем нуклеотидным основаниям, A, T и C, а нуклеотидное основание G может оставаться натуральным (т.е. немеченым). В ходе получения изображения в цикле секвенирования три разных изображения с использованием этих трех различных диапазонов длин волн могут быть захвачены и обработаны для выявления того, какие нуклеотиды были встроены. На этих изображениях отсутствие излучения (т.е. темный отклик) позволяет идентифицировать четвертое нуклеотидное основание.
[0130] В качестве еще одного примера, четыре различные ЭХЛ-метки 36 с четырьмя различными потенциалами окисления или восстановления могут быть соответственно присоединены к четырем нуклеотидным основаниям, A, T, C и G. Во время цикла секвенирования потенциал окисления или восстановления, используемый для инициирования конкретного излучения, может быть зарегистрирован (записан) с конкретным изображением. Идентификации четырех оснований можно добиться путем сопоставления излучений с приложенными потенциалами окисления или восстановления, инициировавшими эти излучения. В этом примере излучение может быть в одном и том же оптическом канале, потому что для проведения различия между сигналами будет использован потенциал окисления или восстановления, вызывающий излучение.
[0131] В дополнительном примере четыре различные ЭХЛ-метки с четырьмя различными временами жизни излучения могут быть соответственно присоединены к четырем нуклеотидным основаниям, A, T, C и G. В ходе получения изображения эти различные времена жизни излучения могут быть зарегистрированы. Эти данные обеспечивают идентификацию любого одного или нескольких из четырех различных нуклеотидных оснований.
[0132] В еще одном примере четыре различные ЭХЛ-метки с четырьмя различными интенсивностями излучения могут быть соответственно присоединены к четырем нуклеотидным основаниям, A, T, C и G. В ходе получения изображения эти различные интенсивности излучения могут быть зарегистрированы. Эти данные обеспечивают идентификацию любого одного или нескольких из четырех различных нуклеотидных оснований. В другом примере три различные ЭХЛ-метки с тремя различными интенсивностями излучения могут быть соответственно присоединены к трем нуклеотидным основаниям, A, T и C, а нуклеотидное основание G может оставаться натуральным (например, немеченым).
[0133] В качестве дополнительного примера, тот же самый тип ЭХЛ-метки 36 можно соединить со связывающими молекулами 34, имеющими различные химизмы отщепления. В этом примере в текучей среде можно использовать четыре различных нуклеотида. В одном примере текучая среда содержит: первый меченый нуклеотид 28A, 28B, 28C, содержащий отщепляемую связывающую молекулу 34, присоединенную к ЭХЛ-метке 36; второй меченый нуклеотид 28A, 28B, 28C, содержащий неотщепляемую связывающую молекулу 34, присоединенную к ЭХЛ-метке 36; третий немеченый нуклеотид, имеющий блокирующую 3’ OH группу и содержащий связывающую молекулу 34, которая способна присоединяться к ЭХЛ-метке 36; и четвертый немеченый нуклеотид, имеющий блокирующую 3’ OH группу. Из-за того, что одна ЭХЛ-метка 36 (которая активируется при том же самом потенциале и излучает в одном канале) присоединяется или способна присоединяться к нескольким из нуклеотидов в растворе, в цикле секвенирования используют две химических стадии, два приложения электродного потенциала и две стадии получения изображения. В этом примере на первой химической стадии добавляют различные нуклеотиды с первого по четвертый, прикладывают потенциал окисления или восстановления ЭХЛ-метки 36 и снимают изображение; а затем на второй химической стадии добавляют новый реагент, который удаляет ЭХЛ-метку 36 из первого меченого нуклеотида и добавляет ЭХЛ-метку 36 третьему немеченому нуклеотиду, снова прикладывают потенциал окисления или восстановления ЭХЛ-метки 36 и снимают другое изображение. В этом примере первый меченый нуклеотид визуализируют только на первом изображении, потому что его ЭХЛ-метку 36 удаляют перед съемкой второго изображения; второй меченый нуклеотид визуализируют как на первом, так и на втором изображениях, потому что его ЭХЛ-метка 36 присоединена постоянно; третий немеченый нуклеотид визуализируют только на втором изображении, потому что его ЭХЛ-метку 36 вводят и присоединяют после съемки первого изображения; и четвертый немеченый нуклеотид является постоянно «темным», потому что он не содержит ЭХЛ-метку 36 или не имеет введенной в него ЭХЛ-метки 36. В этом примере различные нуклеотиды идентифицируют путем анализа различных картин излучения для каждого основания на двух изображениях.
[0134] Циклы секвенирования можно повторять для определения последовательности оснований в матричной полинуклеотидной цепи 40, по одному основанию за один раз.
[0135] Хотя было описано оптическое обнаружение электрохимически генерируемых сигналов, следует понимать, что примеры архитектуры проточной ячейки, показанной на фиг. 1B и фиг. 1C, также можно объединить с комплементарной структурой металл-оксид-полупроводник (КМОП) таким образом, чтобы электрически обнаруживать созданные ЭХЛ сигналы флюоресценции (оптические излучения 54). На фиг. 7 проиллюстрирована архитектура проточной ячейки, показанной на фиг. 1B, объединенная с КМОП (устройством 44 обнаружения), а на фиг. 8 - архитектура проточной ячейки, показанной на фиг. 1C, объединенная с КМОП (устройством 44 обнаружения).
[0136] В иллюстративной проточной ячейке 10’, показанной на фиг. 7, электрод 16 является прозрачным; подложка 14 является прозрачной; а устройство 44 обнаружения (например, КМОП) находится в контакте с подложкой 14. Устройство 44 обнаружения содержит соответствующий фотодиод 50, функционально связанный с каждым из углублений 20; и цепь устройства, электрически соединенную с соответствующим фотодиодом 50.
[0137] В иллюстративной проточной ячейке 10’, показанной на фиг. 8, подложка 14 является прозрачной; а устройство 44 обнаружения (например, КМОП) находится в контакте с подложкой 14. Устройство 44 обнаружения содержит соответствующий фотодиод 50, функционально связанный с каждым из углублений 20; и цепь устройства, электрически соединенную с соответствующим фотодиодом 50.
[0138] В примерах, показанных на фиг. 7 и фиг. 8, термин «прозрачный» означает, что прозрачный электрод и/или прозрачная подложка позволяет(ют) проходить сквозь себя световым излучениям 54. Кроме того, прозрачная подложка может быть похожа на пассивирующий слой в КМОП-устройстве.
[0139] Устройства 44 обнаружения в этих примерах представляют собой КМОП-устройства, которые содержат множество расположенных стопкой друг на друге слоев, включая, например, слой (слои) кремния, слой (слои) диэлектрика, слой (слои) металла-диэлектрика, слой (слои) металла и т.д.). Эти расположенные стопкой друг на друге слои составляют цепь обнаружения. Цепь 44 обнаружения может содержать соединенные между собой проводящие элементы (например, проводники, дорожки, перемычки, межсоединения и т.д.), которые могут проводить электрический ток. Эта цепь может быть выполнена с возможностью выборочной передачи сигналов данных, которые основаны на обнаруживаемых фотонах. Цепь может также быть выполнена с возможностью усиления, оцифровки, хранения и/или обработки сигналов. Цепь может собирать и анализировать обнаруженные световые излучения 54 и генерировать сигналы данных для передачи данных обнаружения. Цепь может также выполнять дополнительную обработку аналогового и/или цифрового сигнала в устройстве 44 обнаружения.
[0140] Устройство 44 обнаружения также содержит оптические компоненты, такие как фотодиод 50 (или другой(ие) оптический(е) датчик(и)) и оптический(е) волновод(ы) 48. В примерах, показанных на фиг. 7 и 8, оптические компоненты расположены так, что каждый фотодиод 50 по меньшей мере по существу совмещен с, а значит, и функционально связан с одним оптическим волноводом 48 и одним углублением 20.
[0141] Используемым здесь фотодиодом 50 может быть световой датчик, который содержит один пиксель или более чем один пиксель. В качестве примера, каждый фотодиод 50 может иметь площадь обнаружения, которая составляет менее примерно 50 мкм2. В качестве другого примера, площадь обнаружения может составлять менее примерно 10 мкм2. В качестве еще одного примера, площадь обнаружения может составлять менее примерно 2 мкм2. В последнем примере фотодиод 50 может составлять один пиксель. Средний считываемый шум каждого пикселя фотодиода 50 может быть, например, менее примерно 150 электронов. В других примерах считываемый шум может быть менее примерно 5 электронов. Разрешение оптического(их) датчика(ов) может составлять более примерно 0,5 мегапикселей (Mпикселей). В других примерах разрешение может составлять более примерно 5 Mпикселей или более примерно 10 Mпикселей.
[0142] Также используемый здесь единственный оптический волновод 48 может представлять собой световод, содержащий материал, который позволяет световым излучениям 54 распространяться по нему к соответствующим фотодиодам 50. Поскольку в раскрытых здесь способах оптические излучения 54 генерируются электрохимически, материал в оптическом волноводе 48 не должен быть фильтром для света возбуждения. Примером подходящего материала световода является оксид. Материал световода может быть окружен диэлектрическим или металлическим материалом, который помогает образовать светонаправляющую структуру.
[0143] В случае проточных ячеек 10’, показанных на фиг. 7 и фиг. 8, способы секвенирования могут быть осуществлены так, как описано здесь со ссылкой на фиг. 4А-4C и фиг. 6А-6B. Устройство 44 обнаружения также является твердотельным формирователем изображения и поэтому может получать изображение оптического излучения 54 в соответствии с раскрытыми здесь примерами. Кроме того, световые излучения 54 обнаруживают фотодиодами 50 устройства 44 обнаружения. Фотодиоды 50 могут обнаруживать фотоны светового излучения 54 и преобразовывать эти сигналы в электрические сигналы (например, электрические ток или напряжение). Электрические сигналы коррелируют с оптическим излучением разнообразных ЭХЛ-меток 36, а значит, могут быть использованы для идентификации событий встраивания одного основания.
[0144] Хотя это не показано на фиг. 7 и фиг. 8, следует понимать, что проточные ячейки 10’ могут содержать два контроллера, так что электрохимическое генерирование оптического излучения 54 не зависит от восприятия оптического излучения 54. Другими словами, потенциалом(ами), прикладываемым(и) к электроду 16 или структурированному электроду 26, можно управлять отдельно от цепи устройства 44 обнаружения.
[0145] Также следует отметить, что на фиг. 7 и фиг. 8 показана крышка 46. Крышку 46 можно использовать в любом из раскрытых здесь примеров для создания проточного(ых) канала (каналов) 12 проточных ячеек 10, 10’. В примерах, показанных на фиг. 1A и фиг. 3-6C, крышка 46 может быть из прозрачного материала, так что оптическое излучение 54 может приниматься детектором. На фиг. 7 и фиг. 8 крышка 46 может быть изготовлена из любого материала, поскольку нет источника возбуждения, а оптическое излучение 54 направляют через устройство 44 обнаружения на фотодиод 50.
[0146] В раскрытых здесь примерах создают уникальные и различимые сигналы электрохимически и таким образом устраняют необходимость в источнике возбуждения. Это упрощает общие системы секвенирования, которые можно использовать с раскрытыми здесь проточными ячейками 10, 10’.
[0147] Ссылка по всему описанию на «один пример», «другой пример», «пример» и так далее означает, что конкретный элемент (например, признак, структура и/или характеристика), описанный в связи с этим примером, включен в по меньшей мере один описанный здесь пример и может присутствовать или не присутствовать в других примерах. Кроме того, следует понимать, что описанные для любого примера элементы можно скомбинировать любым подходящим образом в разнообразных примерах, если из контекста явно не следует иное.
[0148] Термины «по существу» и «примерно», используемые по всему этому раскрытию, включая формулу изобретения, использованы для описания и учета небольших отклонений, таких как флуктуации из-за изменений в обработке. Например, они могут относиться к отклонениям, меньшим или равным ±5%, таким как меньшие или равные ±2%, таким как меньшие или равные ±1%, таким как меньшие или равные ±0,5%, таким как меньшие или равные ±0,2%, таким как меньшие или равные ±0,1%, таким как меньшие или равные ±0,05%.
[0149] Кроме того, следует понимать, что представленные здесь диапазоны включают указанный диапазон и любое значение или поддиапазон в пределах указанного диапазона, как если бы они были явно указаны. Например, представленный диапазон от примерно 2 мм до примерно 300 мм следует интерпретировать как включающий не только явно перечисленные пределы от примерно 2 мм до примерно 300 мм, но и как включающий в себя отдельные значения, такие как примерно 5 мм, 222,5 мм, 275 мм и т.д., и поддиапазоны, такие как от примерно 150 мм до примерно 180 мм и т.д.
[0150] Хотя было подробно описано несколько примеров, следует понимать, что раскрытые примеры могут быть изменены. Следовательно, приведенное выше описание следует рассматривать как неограничивающее.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТОЧНЫЕ ЯЧЕЙКИ С ПОКРЫТИЕМ ИЗ ГИДРОГЕЛЯ | 2018 |
|
RU2751517C2 |
| ЗАЩИТНОЕ ПОВЕРХНОСТНОЕ ПОКРЫТИЕ ДЛЯ ПРОТОЧНЫХ ЯЧЕЕК | 2018 |
|
RU2729688C1 |
| ПРОТОЧНЫЕ ЯЧЕЙКИ | 2019 |
|
RU2785680C2 |
| СЕНСОРНЫЕ СИСТЕМЫ | 2019 |
|
RU2772924C1 |
| СМОЛЯНАЯ КОМПОЗИЦИЯ И ПРОТОЧНЫЕ ЯЧЕЙКИ, ВКЛЮЧАЮЩИЕ ДАННУЮ СМОЛЯНУЮ КОМПОЗИЦИЮ | 2019 |
|
RU2778014C1 |
| КАТАЛИТИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА | 2018 |
|
RU2741805C1 |
| СМОЛЯНАЯ КОМПОЗИЦИЯ И ПРОТОЧНЫЕ ЯЧЕЙКИ, ВКЛЮЧАЮЩИЕ ДАННУЮ СМОЛЯНУЮ КОМПОЗИЦИЮ | 2019 |
|
RU2773387C1 |
| МОДУЛЬ ПРОТОЧНОЙ ЯЧЕЙКИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2754808C2 |
| СЧИТЫВАЮЩИЕ СИСТЕМЫ | 2020 |
|
RU2791444C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ХИМИЧЕСКОГО РАСЩЕПЛЕНИЯ И СНЯТИЯ ЗАЩИТЫ ДЛЯ СВЯЗАННЫХ С ПОВЕРХНОСТЬЮ ОЛИГОНУКЛЕОТИДОВ | 2019 |
|
RU2766688C2 |
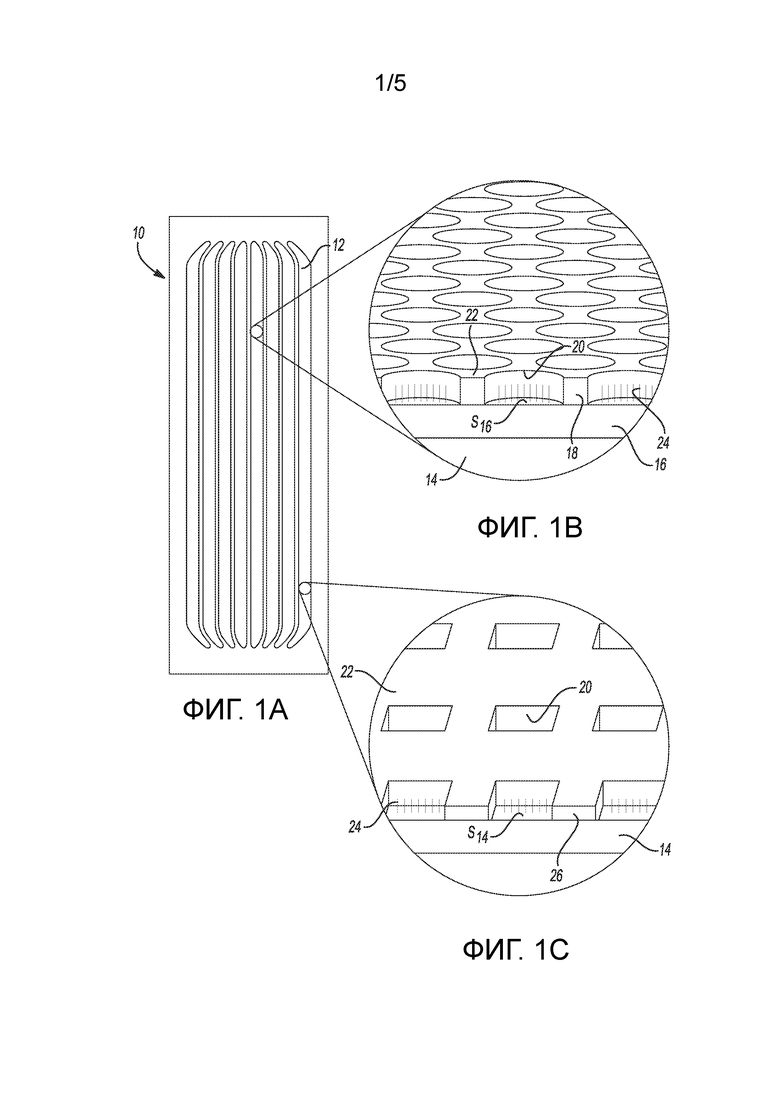
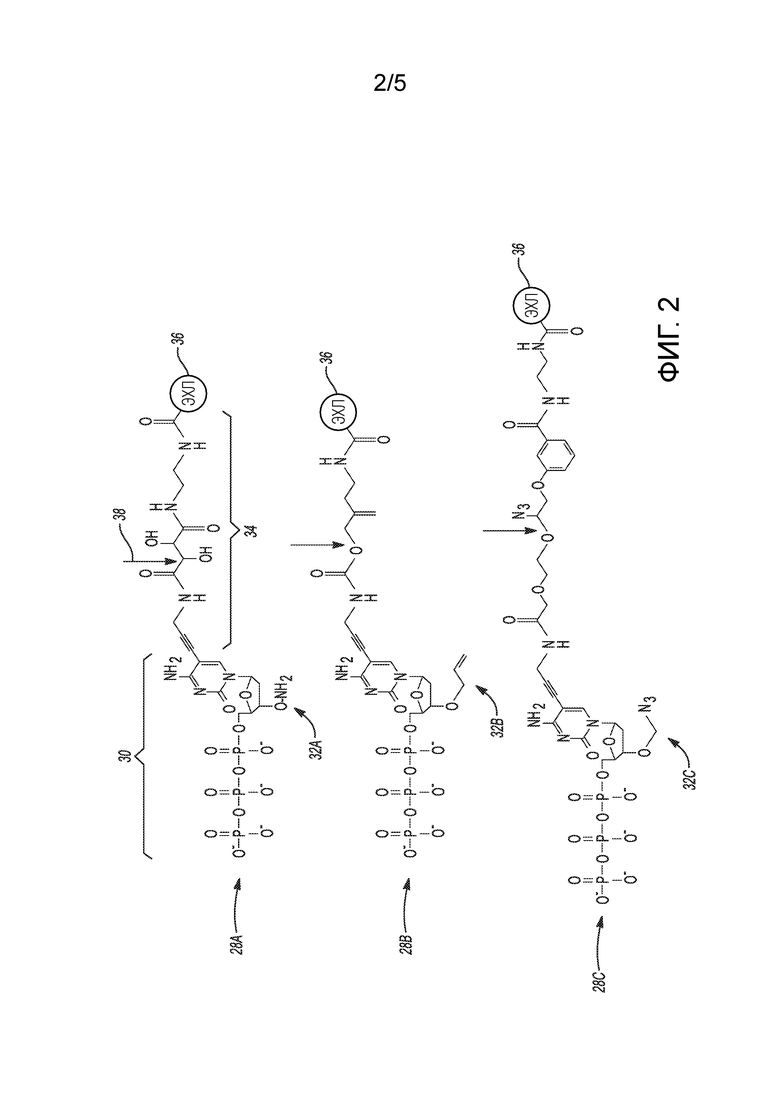
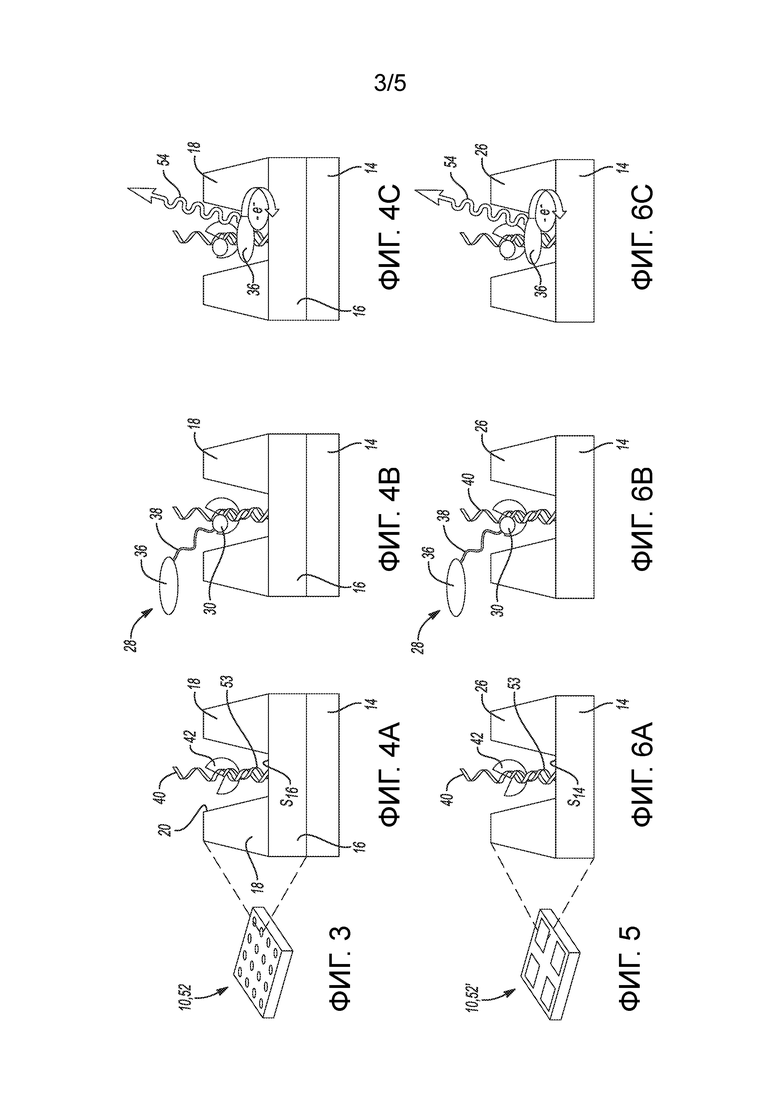
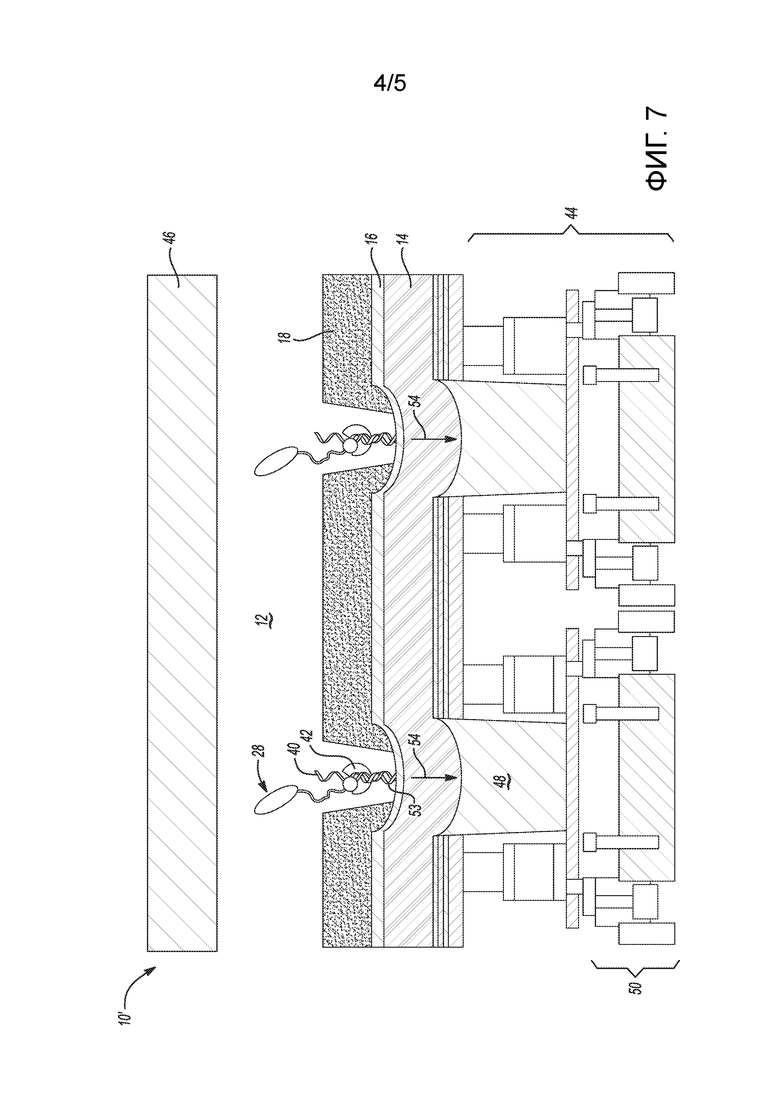
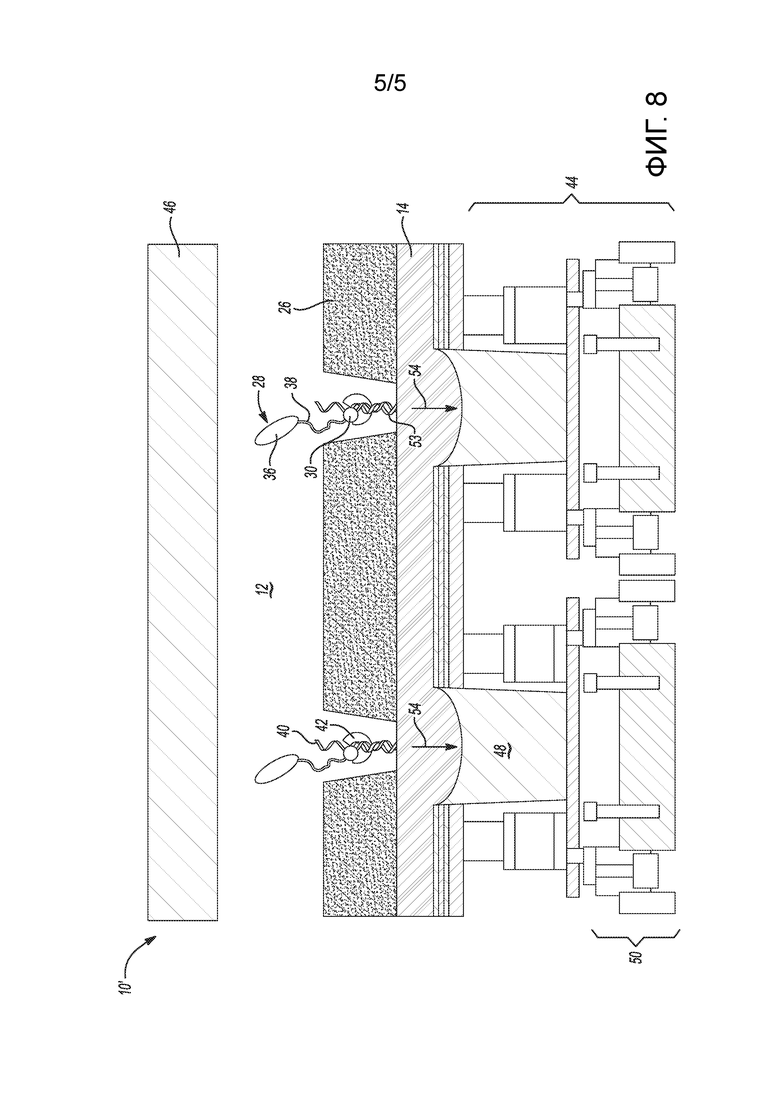
Группа изобретений относится к области секвенирования нуклеиновых кислот, а именно к проточной ячейке, набору и способу секвенирования. Проточная ячейка содержит подложку, крышку, соединенную с подложкой, проточный канал, электрод, расположенный непосредственно на подложке и в проточном канале. На электроде расположен структурированный материал, включающий в себя углубления, которые образованы стенками структурированного материала и которые разделены промежуточными областями. Промежуточные области на электроде образованы поверхностью структурированного материала, которая открыта в проточный канал. Функционализированная поверхность электрода открыта на каждом из углублений. К функционализированной поверхности в каждом из углублений привит праймер. Набор для секвенирования содержит проточную ячейку и меченые нуклеотиды. Группа изобретений обеспечивает повышение точности секвенирования за счет устранения шума, обусловленного источником возбуждения. 5 н. и 25 з.п. ф-лы, 12 ил.
1. Проточная ячейка для набора для секвенирования, содержащая:
подложку;
крышку, соединенную с подложкой;
проточный канал, образованный между крышкой и подложкой;
электрод, расположенный непосредственно на подложке и в проточном канале;
структурированный материал, расположенный на электроде и включающий в себя углубления, которые образованы стенками структурированного материала на электроде и которые разделены промежуточными областями, при этом промежуточные области образованы поверхностью структурированного материала на электроде, которая открыта в проточный канал;
функционализированную поверхность электрода, открытую на каждом из углублений; и
праймер, привитый к функционализированной поверхности в каждом из углублений.
2. Проточная ячейка по п. 1, при этом:
электрод содержит золото, а функционализированная поверхность содержит тиоловые линкеры или аминные линкеры; или
электрод содержит оксид индия-олова, а функционализированная поверхность содержит силановый линкер.
3. Проточная ячейка по п. 1, при этом:
электрод является прозрачным;
подложка является прозрачной; и
проточная ячейка дополнительно содержит:
устройство обнаружения, находящееся в контакте с подложкой, причем устройство обнаружения содержит:
соответствующий фотодиод, функционально связанный с каждым из углублений; и
цепь устройства, электрически соединенную с соответствующим фотодиодом.
4. Набор для секвенирования, содержащий:
проточную ячейку по п. 1; и
меченые нуклеотиды, подлежащие введению в проточную ячейку, причем каждый меченый нуклеотид содержит:
нуклеотид, имеющий блокирующую 3’ OH группу;
связывающую молекулу, присоединенную к основанию или сахару нуклеотида; и
электрохемилюминесцентную метку, присоединенную к связывающей молекуле.
5. Набор для секвенирования по п. 4, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный спектр излучения.
6. Набор для секвенирования по п. 4, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный окислительный или восстановительный потенциал.
7. Набор для секвенирования по п. 4, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разное время жизни электрохемилюминесцентного излучения.
8. Набор для секвенирования по п. 4, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разную интенсивность электрохемилюминесцентного излучения.
9. Проточная ячейка для набора для секвенирования, содержащая:
подложку;
крышку, соединенную с подложкой;
проточный канал, образованный между крышкой и подложкой;
структурированный электрод, расположенный непосредственно на подложке и в проточном канале и включающий в себя углубления, которые образованы стенками структурированного электрода и которые разделены промежуточными областями;
функционализированную поверхность подложки, открытую на каждом из углублений; и
праймер, привитый к функционализированной поверхности в каждом из углублений.
10. Проточная ячейка по п. 9, в которой функционализированная поверхность подложки содержит слой полимера, присоединенный к силановым группам, присоединенным к подложке.
11. Проточная ячейка по п. 9, в которой функционализированная поверхность подложки содержит гидроксильные группы, присоединенные к подложке, и слой полимера, присоединенный к гидроксильным группам, и при этом праймер присоединен к функциональным группам слоя полимера.
12. Проточная ячейка по п. 9, в которой:
подложка является прозрачной; и
проточная ячейка дополнительно содержит:
устройство обнаружения, находящееся в контакте с подложкой, причем устройство обнаружения содержит:
соответствующий фотодиод, функционально связанный с каждым из углублений; и
цепь устройства, электрически соединенную с соответствующим фотодиодом.
13. Проточная ячейка по п. 10, причем слой полимера имеет следующую структуру:
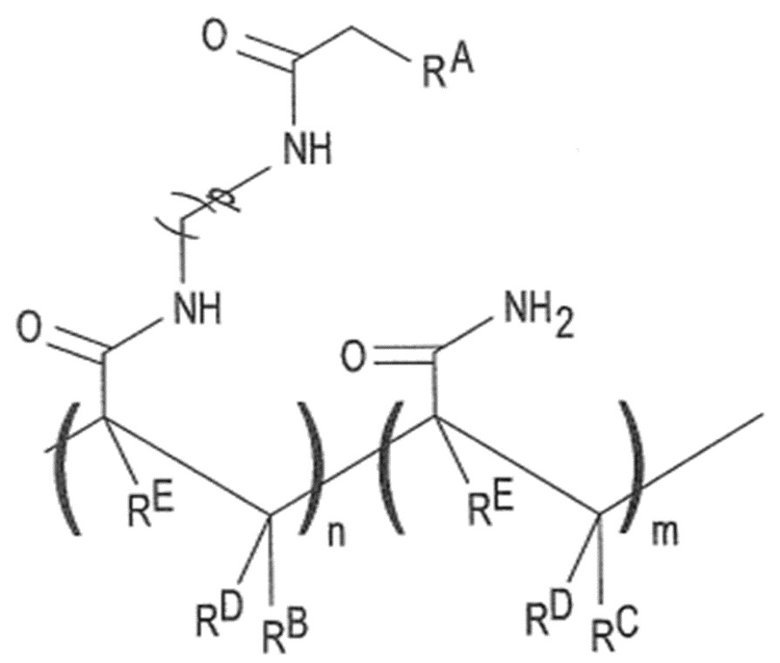 ,
,
в которой:
RA выбран из группы, состоящей из азидо, необязательно замещенного амино, необязательно замещенного алкенила, необязательно замещенного гидразона, необязательно замещенного гидразина, карбоксила, гидрокси, необязательно замещенного тетразола, необязательно замещенного тетразина, оксида нитрила, нитрона и тиола;
RB представляет собой H или необязательно замещенный алкил;
RC, RD и RE, каждый независимо, выбраны из группы, состоящей из H и необязательно замещенного алкила;
каждый из -(CH2)p- может быть необязательно замещен;
p представляет собой целое число в диапазоне 1-50;
n представляет собой целое число в диапазоне 1-50000; а
m представляет собой целое число в диапазоне 1-100000.
14. Проточная ячейка по любому из пп. 1-3 или 9-12, причем праймер включает два типа праймеров амплификации, и причем упомянутые два типа праймеров амплификации предназначены для амплификации соответствующей матрицы библиотеки в каждом из углублений посредством мостиковой амплификации.
15. Набор для секвенирования, содержащий:
проточную ячейку по п. 9; и
меченые нуклеотиды, подлежащие введению в проточную ячейку, причем каждый меченый нуклеотид содержит:
нуклеотид, имеющий блокирующую 3’ OH группу;
связывающую молекулу, присоединенную к основанию или сахару нуклеотида; и
электрохемилюминесцентную метку, присоединенную к связывающей молекуле.
16. Набор для секвенирования по п. 15, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный спектр излучения.
17. Набор для секвенирования по п. 15, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный окислительный или восстановительный потенциал.
18. Набор для секвенирования по п. 15, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разное время жизни электрохемилюминесцентного излучения.
19. Набор для секвенирования по п. 15, в котором меченые нуклеотиды включают по меньшей мере три различных меченых нуклеотида, и при этом соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разную интенсивность электрохемилюминесцентного излучения.
20. Набор для секвенирования по любому из пп. 4-8 или 15-19, в котором электрохемилюминесцентная метка выбрана из группы, состоящей из хлорпромазина, трис(2,2'-бипиридин)рутения(II), 2-тиантренкарбоновой кислоты, 9,10-дифенилантрацен-2-сульфоната натрия, диангидрида 3,4,9,10-перилентетракарбоновой кислоты и мезо-тетра(4-сульфонатофенил)порфирина.
21. Способ секвенирования, включающий:
обеспечение проточной ячейки по любому из пп. 1-3 или 9-12;
введение текучей среды, содержащей полимеразу и нуклеотиды, в проточную ячейку, содержащую электрод, который частично образует углубление, содержащее матричную полинуклеотидную цепь, прикрепленную в углублении, причем по меньшей мере некоторые из нуклеотидов являются мечеными нуклеотидами, причем каждый из упомянутых по меньшей мере некоторых меченых нуклеотидов содержит:
нуклеотид, имеющий блокирующую 3’ OH группу;
связывающую молекулу, присоединенную к основанию или сахару нуклеотида; и
электрохемилюминесцентную метку, присоединенную к связывающей молекуле;
посредством чего один из нуклеотидов встраивается в образующуюся цепь, комплементарную матричной полинуклеотидной цепи;
приложение потенциала к электроду; и
обнаружение оптического излучения в ответ на приложенный потенциал.
22. Способ по п. 21, в котором встроенным одним из нуклеотидов является один из меченых нуклеотидов, и при этом приложение потенциала инициирует путь реакции окисления-восстановления с участием электрохемилюминесцентной метки встроенного одного из меченых нуклеотидов.
23. Способ по п. 22, в котором:
текучая среда содержит по меньшей мере три различных меченых нуклеотида;
соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный спектр излучения; и
способ дополнительно включает идентификацию встроенного одного из меченых нуклеотидов по его оптическому излучению.
24. Способ по п. 22, в котором:
текучая среда содержит по меньшей мере три различных меченых нуклеотида;
соответствующая электрохемилюминесцентная метка каждого из упомянутых по меньшей мере трех различных меченых нуклеотидов имеет разный окислительный или восстановительный потенциал; и
способ дополнительно включает идентификацию встроенного одного из меченых нуклеотидов по приложенному потенциалу.
25. Способ по п. 22, в котором перед приложением потенциала способ дополнительно включает введение кореагента в проточную ячейку.
26. Способ по п. 22, в котором связывающую молекулу и электрохемилюминесцентную метку встроенного одного из меченых нуклеотидов присоединяют во время встраивания, приложения потенциала и оптического обнаружения, и при этом после оптического обнаружения способ дополнительно включает:
введение деблокирующего средства для отщепления связывающей молекулы и электрохемилюминесцентной метки от встроенного одного из меченых нуклеотидов и для удаления блокирующей 3’ OH группы из встроенного одного из меченых нуклеотидов, тем самым обеспечивая возможность встраивания другого нуклеотида или другого меченого нуклеотида в образующуюся цепь.
27. Способ по п. 26, дополнительно включающий:
введение другой текучей среды;
приложение другого потенциала к электроду; и
обнаружение другого оптического излучения.
28. Способ по п. 21, в котором:
фотодиод обнаруживает оптическое излучение; и
способ дополнительно включает обнаружение электрического сигнала, который соответствует оптическому излучению.
29. Способ по п. 21, в котором:
встроенным одним из нуклеотидов является один из:
первого меченого нуклеотида, в котором связывающая молекула является отщепляемой;
второго меченого нуклеотида, в котором связывающая молекула является неотщепляемой;
третьего немеченого нуклеотида, имеющего блокирующую 3’ OH группу и содержащего связывающую молекулу, подлежащую присоединению к электрохемилюминесцентной метке; или
четвертого немеченого нуклеотида, имеющего блокирующую 3’ OH группу; и
способ дополнительно включает:
введение реагента, который может отщеплять электрохемилюминесцентную метку от первого меченого нуклеотида и может присоединять электрохемилюминесцентную метку к третьему немеченому нуклеотиду;
приложение другого потенциала к электроду;
обнаружение другого оптического излучения в ответ на приложенный потенциал; и
использование обнаруженного оптического излучения и обнаруженного другого оптического излучения для идентификации встроенного одного из нуклеотидов.
30. Способ по п. 21, в котором:
проточная ячейка содержит множество углублений, каждое из которых содержит множество матричных полинуклеотидных цепей, прикрепленных в углублении;
соответствующий один из нуклеотидов встраивается в соответствующую образующуюся цепь, комплементарную соответствующей матричной полинуклеотидной цепи; и
способ дополнительно включает одновременное обнаружение соответствующего оптического излучения из каждого из множества углублений.
| US 20160318016 A1, 03.11.2016 | |||
| US 20180195950 A1, 12.07.2018 | |||
| US 9891221 B2, 13.02.2018 | |||
| US 20050019803 A1, 27.01.2005 | |||
| WO 1998028320 A2, 02.07.1998 | |||
| Приспособление для перемещения нижней крышки в загрузочной коробке генератора | 1923 |
|
SU1198A1 |
Авторы
Даты
2024-07-18—Публикация
2019-12-03—Подача