Карельская береза (Betula pendula Roth var. carelica (Mercklin) Hämet-Ahti) - особая разновидность березы повислой, образующая небольшие популяции, в пределах северо-западной части ареала B. pendula: Финляндия, Россия (Карелия), страны Балтии, Беларусь, Польша, юг Швеции и Норвегия.
Главная отличительная особенность карельской березы заключается в наличии оригинальной узорчатой текстуры древесины, которая по рисунку и прочности напоминает мрамор. Древесина карельской березы используется для изготовления декоративной мебели, архитектурных панно и иных изделий. Из-за своих декоративных свойств узорчатая древесина карельской березы оплачивается по весу (3-5 € за кг), а не по объему, как древесина других лесных пород (Hynynen et al., 2010). В связи с высокой коммерческой ценностью интерес к размножению карельской березы на плантациях значительно возрос с 1980-х годов. В России общая площадь лесных насаждений карельской березы к 1986 г. достигла 5500 га. К сожалению, в 90-е годы из-за незаконных рубок на территории Карелии было вырублено около 1,5 тысяч деревьев карельской березы. Однако в Финляндии было создано 6500 га насаждений карельской березы, которые в настоящее время достигли возраста рубки (37 лет) (Viherä-Aarnio, Hagqvist, 2017).
Наличие узорчатой текстуры в древесине лучше всего фиксируется на поперечных спилах, но ее также можно установить и на неповрежденном дереве по косвенным признакам, к которым относятся утолщения или выпуклости, визуально различимые на поверхности ствола. Основной проблемой плантационного выращивания карельской березы является то, что первые косвенные признаки «узорчатости» среди деревьев появляются в возрасте от 8 до 15 лет (Ермаков, 1986). При этом во всех насаждениях, искусственно созданных из семян карельской березы, всегда встречается примесь березы обыкновенной (с безузорчатой древесиной). Доля «узорчатых» деревьев среди потомства карельской березы от свободного опыления колеблется от 2-3% (Johnsson, 1951) до 25 % (реже 50 %) (Larsen, 1940; Heikinheimo, 1951). При контролируемом скрещивании двух карельских берез признаки “узорчатости” проявляются у 60-70% потомства (Kärkkäinen et al., 2017). Таким образом, до достижения деревьями возраста 8-10 лет необходимо содержать обширные плантации деревьев с непредсказуемым экономическим эффектом, так как часть нецелевых деревьев подвергнется выбраковке.
“Безузорчатые” растения обычно удаляют из насаждений карельской березы в возрасте около 10-13 лет (Viherä-Aarnio, Hagqvist, 2017), чтобы обеспечить целевые деревья с “узорчатым” фенотипом достаточным пространством и освещением. Для такого прореживания обычно используют неинвазивную визуальную оценку деревьев на «узорчатость» (Vetchinnikova, Titov, 2023). Однако и в этом возрасте прореживание является проблемным, так как выявление «узорчатости» по косвенным морфологическим признакам деревьев довольно затруднительно даже для специалиста. Таким образом, понимание генетического механизма, лежащего в основе феномена узорчатой древесины карельской березы, идентификация генов, отвечающих за этот признак, и разработка соответствующих молекулярных маркеров может предоставить лесоводам возможность распознавать деревья карельской березы с узорчатой древесиной на самых ранних стадиях развития дерева, не дожидаясь пока оно достигнет 8-10 летнего возраста.
Сутью данного изобретения является создание ДНК-маркера, способного на ранней стадии выявить будущий «узорчатый» фенотип у растений в потомстве карельской березы, и как следствие, снизить чрезмерные затраты и усилия по содержанию плантаций карельской березы в промышленных целях.
Использование молекулярных маркеров облегчает селекцию особенно древесных пород, так как в этом случае проявление хозяйственно-ценного признака в фенотипе можно ожидать через несколько десятилетий.
Разработка молекулярных маркеров требует обнаружения ассоциации между изменчивостью хозяйственно-ценного признака и полиморфизмом в цепи ДНК, маркируемым молекулярным маркером. Для разработки ДНК-маркера, сцепленным с признаком узорчатой древесины у карельской березы, использовался анализ полногеномных ассоциаций (Genome Wide Association Analysis, GWAS) между 37045 SNP-маркерами и признаком “узорчатости” на выборке 192 деревьев, полученных в результате скрещивания двух родительских пар карельской березы. Среди 192 потомков от такого скрещивания 129 берез демонстрировали “узорчатый” фенотип, 70 деревьев не проявляли внешних признаков, характерных для карельской березы с узорчатой древесиной. 37045 SNP-маркеров, использованных для анализа 192 деревьев карельской березы, были получены в результате высокопроизводительного генотипирования этой выборки методом RADseq (Peterson et al. 2012) с использованием секвенатора Illumina NovaSeq 6000 (Евроген, Москва).
По результатам анализа ассоциаций был выявлен единственный интервал на хромосоме 10 карельской березы, в пределах которого SNP-маркеры показали достоверную ассоциацию с изучаемым признаком. Один из таких SNP-маркеров, маркирующий нуклеотидную замену (G/A) в позиции 3465040 п.н. на физической карте Betula pendula (Salojärvi et al., 2017, doi:10.1038/ng.3862) объяснял самый высокий процент наблюдаемой изменчивости (56%). Детальный анализ этого участка генома у карельских берез с “узорчатым” фенотипом показал, что в непосредственной близости от этого SNP_3465040, на удалении в 160 п.н. у 92% карельских берез с “узорчатым” фенотипом наблюдается делеция 54 п.н. Эта делеция у “узорчатых” деревьев может быть представлена как в гомо- так и в гетерозиготном состоянии. Делецию легко выявить путем ПЦР со специфичными праймерами, фланкирующими этот полиморфный участок. Полученный таким образом молекулярный маркер является сцепленным с признаком узорчатой древесины у карельской березы.
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области маркерной селекции лесных пород, и представляет собой молекулярный маркер для раннего отбора растений с узорчатой древесиной в потомстве карельской березы как в контролируемых скрещиваниях, так и при свободном опылении.
УРОВЕНЬ ТЕХНИКИ
Молекулярный маркер (ДНК-маркер) представляет собой технологию, с помощью которой в лабораторных условиях в последовательности ДНК можно распознать полиморфный участок, где встречаются однонуклеотидные замены, вставки или делеции. Если такой маркируемый полиморфный участок располагается в непосредственной близости от гена, отвечающего за изменчивость хозяйственно-ценного признака, говорят о ДНК-маркере, сцепленным с признаком.
ДНК-маркер для отбора на ранней стадии деревьев карельской березы, имеющих узорчатый фенотип, представляет собой участок ДНК, расположенный на хромосоме 10 между 3465200 п.н. и 3465254 п.н., который несет в себе генетический полиморфизм в виде делеции размером 54 п.н. Для выявления этой делеции необходимо провести полимеразную цепную реакцию с последующей детекцией ампликонов в агарозном геле со следующими праймерами: SEQ 1: 5'-GGTTGGAAGAGCTCCATGAT; SEQ 2: 5'-GGAAGAATAAATAAGTCTGAGATGCC.
Выделение ДНК осуществляется по модифицированному СТАВ методу (Rahimah et al., 2006). Замороженные образцы листьев помещаются в жидкий азот и гомогенизируются (Precellys 24, Bertin Technologies, Франция). К каждому гомогенизированному образцу добавляют 800 мкл СТАВ-буфера, 0,4 мкл рибонуклеазы А (Qiagen, cat.no 19101, Германия) и 3,2 мкл 2-меркаптоэтанола. Смесь вортексируют и инкубируют в твердотельном термостате 30 мин при 37°С и 30 мин при 65°С. Далее смесь разделяется с помощью хлороформ-изоамиловой смеси 24:1 (800 мкл на 1 образец) и центрифугируется в течении 15 мин при 10 000 об/мин. Верхняя фаза переносится в чистые пробирки 2 мл и проводится повторная очистка хлороформ-изоамилом с последующим переносом верхней фазы в чистые пробирки 1.5 мл. Осаждение ДНК производится холодным изопропанолом, добавляя спирт в количестве 0.8 от объема образца. После добавления спирта пробирки инкубируют при -80°С в течение 15 мин. Далее пробы центрифугируют при 4°С в течение 15 мин при 12 000 об/мин. Супернатант удаляют аспиратором, осадок промывают 70% этанолом и высушивают при комнатной температуре, затем растворяют в 160 мкл стерильной воды.
Качество выделенной ДНК оценивали на спектрофотометре (Spectrostar nano, BMG Labtech, Германия) и визуализировали на электрофорезе. Концентрацию измеряли на флуориметре (Qubit 4, Invitrogen, США) и доводили до 10 нг/мкл.
Для проведения полимеразной цепной реакции можно использовать ДНК выделенную из исследуемых образцов любым доступным методом или коммерческим набором. Используемая матричная ДНК не должна иметь примесей ингибиторов ПЦР и иметь высокую частоту, соотношение поглощения при длине волны 260/280 должно быть близко к 1,8, а соотношение при длине волны 260/230 близко к 2,0-2,2. Оценку чистоты ДНК рекомендуется производить на наноспектрофтометре, а оценку целостности ДНК с использование электрофореза в агроном геле.
Реакционная смесь для ПЦР содержит 1 × Taq-буфер (2,5 мМ Mg2+); 200 мкМ дНТФ; ДНК-полимераза Taq 2,5 ЕД («Евроген», Москва); 0,4 мкМ каждого праймера; ~20 нг матричной ДНК, стерильную дистиллированную воду в конечном объеме 25 мкл. Программа амплификации включает начальную стадию денатурации при 95°С в течение 3 мин, затем 30 циклов денатурация при 95°С в течение 30 с, отжиг матрицы с праймерами при 58°С в течение 30 с, элонгация 72°С в течение 45 с и заключительный цикл элонгации при 72°С в течение 5 мин.
После проведения ПЦР проводят разделение продуктов амплификации в агарозном геле с целью интерпретации результатов амплификации. Электрофоретическое разделение ДНК проводят в агарозных гелях (концентрация агарозы 1-1,5%) в горизонтальных блоках при напряженности электрического поля 5-10 В/см. В качестве электролита использовали трис-ацетатный буфер (40 мМ трис-ацетат, рН 8,0; 0,02 М ацетат натрия, 0,002 М EDTA). О ходе электрофореза судят по миграции бромфенолового синего (Serva, Германия), добавленного в пробы перед их внесением в лунки геля. ДНК регистрировали по флуоресценции в ультрафиолетовом свете после экспозиции геля в растворе (10 мкг/мл) бромистого этидия с помощью установки видео- документации гелей Gel-Doc (Bio-Rad, США).
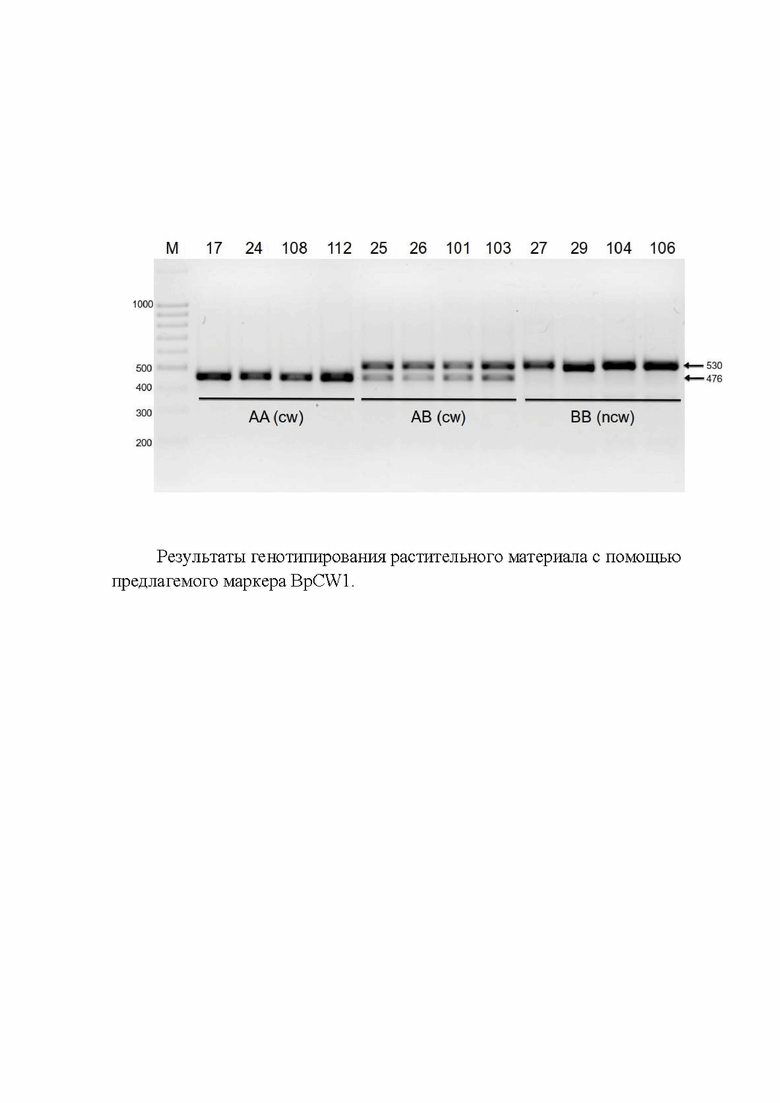
Могут быть получены продукты амплификации длиной 476 п.н. и 530 п.н.. Образцы с гомозиготной делецией 476/476 п.н. и гетерозиготной делецией 476/530 п.н. проявляют фенотип узорчатой древесины, то время как образцы без делеции, имеющие 530/530 п.н., обладают фенотипом древесины без узора. Пример визуализации продуктов ПЦР-амплификации фрагментов ДНК приведен на рисунке.
На электрофореграмме (фиг.) представлен результат ПЦР-амплификации фрагмента ДНК, содержащего делецию, ассоциированную с фенотипом узорчатой древесины. Образцы растений 17, 24, 108, 112 и 25, 26, 101, 103, демонстрирующие фенотип узорчатой древесины (cw), несут делецию в гомозиготном (AA) и гетерозиготном состоянии (AB), соответственно. Образцы 27, 29, 104, 106 не несут делецию (BB) и демонстрируют фенотип безузорчатой древесины (ncw).
Список литературы:
1. Hynynen, J., Niemisto, P., Vihera-Aarnio, A., Brunner, A., Hein, S., & Velling, P. (2010). Silviculture of birch (Betula pendula Roth and Betula pubescens Ehrh.) in northern Europe. Forestry, 83(1), 103-119. https://doi.org/10.1093/forestry/cpp035
2. Viherä-Aarnio, A., & Hagqvist, R. (2017). Curly birch (betula pendula var. Carelica), wooden “marble” from finland-soon easily available. Proceedings of the International Scientific Conference on Hardwood Processing.
3. Ermakov, V. (1986). Mekhanizmy adaptatsii berezy k usloviyam Severa[Mechanisms of birch adaptation to the conditions of the North]. Izd-vo" Nauka," Leningradskoe otd-nie.
4. Johnsson, H. (1951). Avkommor av Masur bjork (Experiments with Masur Birch). Sartryck Ur Svenska Skogsvardsforeningens Tidskrift, 1, 12.
5. Larsen, C. (1940). Curly Birch. Dansk Skovforeningens Tidsskrift, 33-72.
6. Heikinheimo, O. (1951). Experiences in the growing of curly birch. Commun. Inst. For. Fenn, 39, 1-26.
7. Kärkkäinen, K., Viherä-Aarnio, A., Vakkari, P., Hagqvist, R., & Nieminen, K. (2017). Simple inheritance of a complex trait: Figured wood in curly birch is caused by one semi-dominant and lethal Mendelian factor? Canadian Journal of Forest Research, 47(7), 991-995. https://doi.org/10.1139/cjfr-2017-0007
8. Viherä-Aarnio, A., & Hagqvist, R. (2017). Curly birch (betula pendula var. Carelica), wooden “marble” from finland-soon easily available. Proceedings of the International Scientific Conference on Hardwood Processing.
9. Vetchinnikova, L.V., & Titov, A. F. (2023). Curly Birch: Some Secrets Remain. Biology Bulletin Reviews, 13(2), 162-174. https://doi.org/10.1134/S207908642302010X
10. Peterson, B.K., Weber, J.N., Kay, E. H., Fisher, H. S., & Hoekstra, H. E. (2012). Double digest RADseq: An inexpensive method for de novo SNP discovery and genotyping in model and non-model species. PloS One, 7(5), e37135. https://doi.org/10.1371/journal.pone.0037135
11. Rahimah, A.R., Cheah, S.C., & Rajinder, S. (2006). Freeze drying of oil palm (Elaeis guineensis) leaf and its effect on the quality of extractable DNA. Journal of Oil Palm Research, 18, 296-304.
| название | год | авторы | номер документа |
|---|---|---|---|
| Трансгенное растение березы с ранним цветением | 2015 |
|
RU2619173C1 |
| Способ выращивания карельской березы | 2021 |
|
RU2772492C1 |
| СПОСОБ ДИАГНОСТИКИ УЗОРЧАТОЙ ТЕКСТУРЫ ДРЕВЕСИНЫ КАРЕЛЬСКОЙ БЕРЕЗЫ | 2015 |
|
RU2596013C1 |
| ТРАНСГЕННОЕ РАСТЕНИЕ БЕРЕЗЫ С ПОВЫШЕННОЙ ПРОДУКТИВНОСТЬЮ | 2013 |
|
RU2593721C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ РАСТЕНИЙ РОДА BETULA L. | 2016 |
|
RU2652184C1 |
| Способ выявления саженцев карельской березы с потенциальной способностью формировать узорчатую древесину | 2015 |
|
RU2621254C1 |
| СПОСОБ МОЛЕКУЛЯРНОГО МАРКИРОВАНИЯ, ОСНОВАННЫЙ НА МИКРОСАТЕЛЛИТНЫХ ЛОКУСАХ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ИДЕНТИФИКАЦИИ ГЕНОТИПОВ БЕРЕЗЫ | 2016 |
|
RU2646112C1 |
| СПОСОБ ВЫРАЩИВАНИЯ КАРЕЛЬСКОЙ БЕРЕЗЫ | 1992 |
|
RU2038749C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИМОРФИЗМА ГЕНА HSP70.1, ОБУСЛАВЛИВАЮЩЕГО ТЕПЛОВОЙ СТРЕСС КРУПНОГО РОГАТОГО СКОТА | 2023 |
|
RU2826316C1 |
| Способ диагностики аллельного состояния гена Vi4, контролирующего фиолетовую окраску зерна у ржи | 2021 |
|
RU2787110C1 |
Изобретение относится к области биохимии, в частности к ДНК-маркеру для отбора на ранней стадии деревьев карельской березы. Изобретение позволяет отбирать деревья карельской березы на ранней стадии. 1 ил., 1 пр.
ДНК-маркер для отбора на ранней стадии деревьев карельской березы, имеющих узорчатый фенотип, представляет собой участок ДНК, расположенный на хромосоме 10 между 3465200 п.н. и 3465254 п.н., который несет в себе генетический полиморфизм в виде делеции размером 54 п.н. и может быть выявлен амплификацией с парой праймеров:
5'-GGTTGGAAGAGCTCCATGAT; и
5'-GGAAGAATAAATAAGTCTGAGATGCC.
| СПОСОБ ДИАГНОСТИКИ УЗОРЧАТОЙ ТЕКСТУРЫ ДРЕВЕСИНЫ КАРЕЛЬСКОЙ БЕРЕЗЫ | 2015 |
|
RU2596013C1 |
| БИОЛОГИЧЕСКИЙ ДНК МАРКЕР ДЛЯ ОПРЕДЕЛЕНИЯ СОРТОВ КАРТОФЕЛЯ, НАБОР И СПОСОБ СОРТОВОЙ ИДЕНТИФИКАЦИИ КАРТОФЕЛЯ | 2009 |
|
RU2413774C1 |
| RU 2013149034 A, 10.05.2015. | |||
Авторы
Даты
2024-07-30—Публикация
2023-09-02—Подача