2.Способ по п. 1, отличающ и и с я тем, что при выращивании бактерий Methylococcus с испольэоваиием газообразных углеводородов
в качестве и сточника углерода культивирование ведут при давлении 5-50 кг/см , а разность рН в ферментере и накопительной емкости составляет 0,8-1,0 единицы рН.
3.Способ по п. 1, отличающий с я тем, что при выращивании дрожжей рода Candida с использованием жидких н-парафинов в качестве источника углерода, культивирование ведут при давлении 5-15 кг/см , а разность рН в ферментере и накопительной емкости составляет О , 5 - 0,6 единицы рН.
4. Способ по п. 1, о т л и чающийся тем, что газовую фазу перед возвратом в ферментер очищают от углекислого газа раствором щелочи.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выращивания микроорганизмов | 1989 |
|
SU1712420A1 |
| Способ выращивания микроорганизмов | 1979 |
|
SU908084A2 |
| Способ получения биомассы | 1977 |
|
SU705796A1 |
| Штамм метанокисляющих бактерий Methylococcus capsulatus ГБС-15 для получения микробной белковой массы | 2016 |
|
RU2613365C1 |
| Способ получения микробного белка на основе углеводородного сырья | 2019 |
|
RU2720121C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОБНОЙ БЕЛКОВОЙ МАССЫ И СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2020 |
|
RU2779644C1 |
| Ферментационная установка для культивирования метанокисляющих бактерий Methylococcus capsulatus | 2020 |
|
RU2743581C1 |
| ФЕРМЕНТАЦИОННАЯ УСТАНОВКА ДЛЯ МЕТАНАССИМИЛИРУЮЩИХ МИКРООРГАНИЗМОВ | 2015 |
|
RU2580646C1 |
| Штамм Methylococcus capsulatus - продуцент высокобелковой биомассы | 2022 |
|
RU2787202C1 |
| Способ культивирования аэробных метанассимилирующих микроорганизмов | 2021 |
|
RU2768401C1 |
1. СПОСОБ ВЫРАЩИВАНИЯ МИКРООРГАНИЗМОВ в аэробных условиях на питательной среде, содержащей источники азота, фосфора, калия, магния и микроэлементов в присутствии углеводородов в качестве источника углерода при повьииенном давлении в фер- мент'ере с последующим сбором суспензии микроорганизмов в накопительной емкости при атмосферном давлении, отличающийся тем, что, с целью увеличения выхода биомассы, образующуюся в процессе культивирования газовую фазу возвращают в- «^ ферментер в количестве, обеспечивающем заданную разность рН среды в ферментере и в накопительной емкости.««минмип»!:««««Ш1миаг(ЛСХ)ас ^ а>&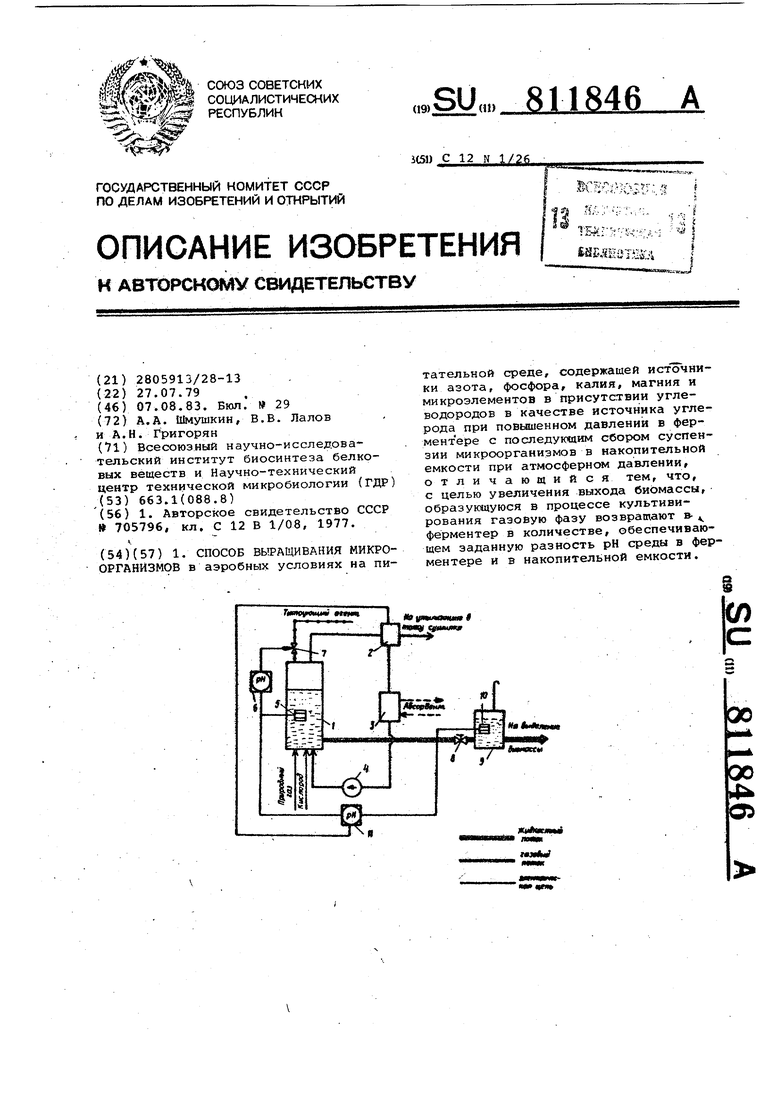

Изобретение относится к микробиологической промышленности, а име но к способу выращивания микроорганизмов на углеводородном субстрате. Известен способ выращивания микро организмов в аэробных условиях на питательной среде, содержащей источ ники азота, фосфора, калия, магния и микроэлементов в присутствии угле водородов в качестве источника угле рода, при повышенном давлении в фер ментере с последук«аим сбором суспен зии микроорганизмов в накопительной ёмкости при атмосферном давлении Clj По этому способу неутилизированную газовую фазу, содержащую углеводороды, сжигают, что приводит к н производительному расходу сырья, а следовательно, к низкому выходу биомассы от субстрата. Цель изобретения - увеличение выхода биомассы. Указанная цель достигается тем, что при осуществлении способа выращивания микроорганизмов в aэpoVныx условиях на питательной среде, содер жащей источники азота, фосфора, , магния и микроэлементов в присутствии углеводородов в качестве источника углерода. При повышенном давлении в ферментере с последующим сбором суспензии микроорганизмов в накойительной емкости при атмосферно давлении образующуюся в процессе куп тивированйя газовую фазу возвращают в ферментер в количестве, обеспечивающем заданную разность рН среды в ферментере и в накопительной емкости. При этом при выращивании бактерий рода Methylococcus с использованием газообразных углеводородов в качестве источника углерода культивирование ведут при давлении 5-50 кг/см и разность рН в ферментере и накопительной емкости составляет 0,81,0 единицы рН, а при выращивании дрожжей рода Candida с йСпойьзовайием жидких н-парафинов в качестйе | источника углерода культивирование ведут при давлении 5-15 кг/см и разность рН в ферментере и накопительной емкости составляет 0,5-0,6 единицы рН, при этом целесообразно газовую фазу перед возвратом в ферментер очищать от углекислого газа расТ;Вором щелочи.. На чертеже изображена принципиальная технологическая схема процесса выращивания. Процесс аэробного выращивания микроорганизмов осуществляется в фер-i ментере 1, на водной питательной среде, содержащей источники азота, фосфора, калия, магния и микроорганизмов. Срежее газовое питани е, а именно источник свободного кислорода и углеводороды, являющиеся источником ассимилируемого микроорганизмами углерода, непрерывно подают в ферментер 1. После прохождения через слой культуральной жидкости, в котором происходят процесс майсоперёдачи газообразных компонентов питания в жидкую среду культивирования и их потребление микроорганизмами, неутилизированную газовую среду подают в узел 2 разделения, где часть ее отводят на утилизацию, например в топку сушилки, а остальное количество подают в узел 3 очистки, где происходит частичное поглощение углекислого газа любым известным способом. Очищенный от части углекислого газа поток неутилизированной газовой среды направляют в компрессор 4 для компенсации потерь давления, в затемвновь подают в ферментер 1, в результате чего образуется контур циркуляции газовой фазы процесса выращивания микроорганизмов. Для создания оптимальных условий Р9ста в ферментер 1 непрерывно вводят раствор минеральных компонентов питания в количестве, обеспечивающем поддержание их концентраций в среде культивирования, в диапазоне, дающем максимальную скорость роста 0,1 - 0,2 Кроме тог ферментер 1 оборудован теплообменны устройством (на чертеже не показано для поддержания постоянной температ ры, выбираемой в пределах 30-45с. Оптимальное значение рН среды культивирования в ферментере 1, выбираемое в зависимости от вида микроорганизмов в пределах 5-7, поддерживают контуром регулирования, включающим датчик 5, регулятор 6 и клап 7, управляющий подачей титрующего агента, например. 10%-ного раствора едкого натра, или аммиачной воды. Процесс выращивания микроорганизмов осуществляют при рабочем давлении в ферментере от 5 до 50 кг/см, заданное значение которого поддержива постоянным контуром регулирования |аа чертеже не показан|. Суспензию микроорганизмов непрерывно отводят из ферментера 1 в количестве, обеспечивающем поддержание постоянной концентрации биомассы в среде культивирования 30-50 г АСВ/л. После ониженйя давления в дроссельном вентиле 8 суспензию микроорганизмов собирают в емкости 9, сообщенной с атмосферой.
В емкости 9 установлен датчик рН 10, сигнал которого подается в регулятор 11, где сравнивается с сигналом датчика рН 5, установленного в ферментере 1 при рабочем давлении. Управляющий сигнал регулятора 11, пропорциональный разности рН культуральной жидкости в ферменгере 1 при рабочем давлении и суспензии микроорганизмов в емкости 9 при атмосферном давлении, зависящей от концентрации С02 поступает в узел 2, устанавливая поток неутилизированнойгазовой фазы, рециркулируемый в ферментере 1. .
В том случае, когда разность значений рН презышает заданную величину, пропорциональную предель- , но допустимой неингибирующей концентрации растворенного углекислого газа, управляющий сигнал регулятора 11 уменьшает долю рециркулируемой неутилизированной газовой фазы. Это приводит к уменьшению объемной доли углекислого газа в газовой фазе процесса и уменьшению концентрации расворенной углекислоты.
Пример. Процесс вьгоащивания метанокисляющих микроорганизмов Methylococcus capsuLatus осуществляли на водной питательной Среде, содержащей в расчете на 1 л следующие количества минеральных источни|ков питания, г: Ортофосфорная
кислота (88%)2,5 мл
Сернокислый
магний1,060
Хлористый
калий1,250
Сернокислый
цинк0,015
Сернокислый
марганец0,050
Сернокислая
медь0,100
Борная
кислота0,030
Сернокислое
железо0,150
Молибденокислый
натрий0,0022
Сернокислый.
кобальт0,0024
Культивирование осуществляли при давлении 9 кг/с и температуре 38-40с. Свежее газовое питание в виде смеси природного газа и кислорода в соотношении 1:2 и рециркулируемую газовую среду подавали в количестве 3J HMV на 1 м среды культивирования в ферментере. ,
Образовавшуюся в количестве 542 нм/ч отработанную газовую смесь подавали в узел 2, откуда 99,5% этой смеси (или 541,0 ) направляли в узел 3 для очистки последней от углекислого газа промывкой раствором поташа. Остальное количество отработанной газовой смеси сжигали для получения тепла, используемого при обезвоживании биомассы. После поглощения в узле 3 примерно 14% углекислого газа (или 6 HMVM4) содержащегося в обрабатываемом газовом потоке, 535 нм/м.ч газа возвращали в ферментер. Отбираемый из ферментера 1 поток бактериальной суспензии пропускали через вентиль 8 для снижения давления и собирали в ёмкости 9, сообщенной с атмосферой. При этом датчик 5 для определения рН среды культивирования, расположенный в ферментере 1, с одной стороны, обеспечивал подачу титрукадего агента, например 10%-ногО раствора едкого натра, для поддержания рН 5,55,7, ас другой - соединялся с регулятором 11, регулирующим поток рециркулируемой отработанной газовой фазы, к которому подключен датчик 10, измеряющий рН культуральной жидкости в емкости 9 при атмосферном „давлении. Указанному режиму Ферментации в части газовых потоков сбответствЬвало показание датчика 10 равное 6,5.
Разность показаний датчиков 5 и 10, пропорциональная концентрации растворенной в среде культивирования углекислоты, составляла рН 0,81,0 и обеспечивала стабильный процесс выращивания с продуктивностью 7,2 кг АСБ/м ч. При увеличении концентрации углекислого газа в среде культивирования выше заданного уро ня рН становилось больше заданного значения, что приводило к выработк .сигнала в регуляторе 11, который воздействовал на узел 2 и уменьшал поток рециркулируемого газа. В результате этого уменьшалась концентрация углекислого газа в среде кул тивирования ферментера 1 и величина рН стаиоаилась равной 0,8-1,0 едини цы рН, воздействие на узел 2 прекра щалось и поток рециркулируемой газовой среды возвращался к исходной величине. П р и м е р 2. П{)оцесс выращивания дрожжей рода Candida lipolytic осуществляли в ферментере 1 на водной питательной среде, содержащей на 1 л водопроводной воды следуюгйие количества питательных веществ,г: Фосфорнокислый двузамещенныйаммоний Хлористый калий Сернокислый магний Сернокислый цинк Сернокислый марганец Сернокислое железо Дрожжевой экстракт в качестве источника углерода использовали парафины нормального строения с длиной цепи 10-14 атомов Температуру культивирования поддерживали равной 30-32 С подачей охлаж дающей воды в рубашку теплообменник а заданное значение рН 5,5 автоматически поддерживали подачей аммиач ной воды через клапан 7. После лагфазы культуры переходили на поток со скоростью разбавления 0,1 0,2 ч-, а затем повышали давление со скоростью 0,8 - 1 кг/см -ч. Стабильный непрерывный процесс с рециркуляцией газовой фазы осуществляли при рабочем давлении в ферментере 1 5 кг/см . При этом продуктивность процесса биосинтеза составляла 6,3 кг ACB/M. ч при концентрации биомассы 26 г АСВ/л. Дрожжевую суспензию после снижения давления в вентиле 8 собирали в емкость 9 при атмосферном давлении. Концентрация парафина в подаваемой среде составляла 36 г/л, а в среде культивирования - 1,9 г/л. Свежее газовое питание, технологический кислород, подавали в количестве 10 HMVM.4, а на входе в ферментер 1 с учетом рециркулируемой неутилизированной газовой сре/цл поток составлдл 500 . Количество рециркулируемой газовой фазы задавали таким образом, чтобы разность показаний датчика 5, установленного в ферментере 1 при рабочем давлении, и датчика 10, измеряющего рН суспензии в емкости 9 при атмосферном давлении, составляла О,5-О,6.единицы рН. При этой разности, установленной экспериментально в лабораторных условиях, отсутствует ингибирование процесса роста растворенным в среде культивирования ферментера углекисльпй газом. Таким образом, способ вырш ивания микроорганизмов с регулируелюй по величине разности рН среды фермеятера и накопительной емкости подачей рециркулируемой газовой фазы позволяет повысить выход биомассы от субстрата как за счет более полной утилизации субстрата, так и за счет предот рйщения ингибирования роста избытком углекислого газа.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения биомассы | 1977 |
|
SU705796A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1983-08-07—Публикация
1979-07-27—Подача