Изобретение относится к новым производным бензодиазепина, конкретно трициклическим соединениям общей формулы I 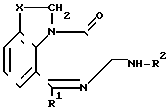 где RI - фенил, возможно замещенный фтором,
где RI - фенил, возможно замещенный фтором,
Х- -СН2- или CHR3, где R3 - С1-С4 алкил, и R2 - 2-индолилкарбонил; фенил (низший) алкеноил, который может быть замещен аминогруппой или низшей алканоиламиногруппой; или R2 - фенилкарбамоил, который может быть замещен галогеном или низшей алкоксигруппой, или их фармацевтически приемлемым солям. Соединения I являются ССК антагонистами и поэтому могут быть полезными в качестве терапевтических агентов при рвоте, панкреатите и т. д.
Цель изобретения - получение новых производных бензодиазепина, обладающих ценными фармакологическими свойствами.
Цель достигается способом получения соединений общей формулы 1, заключающимся в том, что соответствующий амин соединения I подвергают взаимодействию с соединением формулы R2OH, где R2 имеет указанные значения.
Пример получения 1.
(1) К раствору треххлористого бора (4,5 мл) в толуоле (30 мл) добавляют раствор 3,4-дигидро-2Н-1, 4-бензоксазины (5,4 г), бензонитрил (5,05 г) и толуол (19 мл) за 1 ч при 0-5оС, и к этому добавляют алюминийхлорид (5,85 г). Полученную смесь нагревают при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают до 5оС и добавляют 7 мл воды. После добавления 2Н соляной кислоты полученную смесь нагревают при кипении с обратным холодильником в течение 2,5 ч, а затем охлаждают до 10оС. Отделившийся органический слой и экстракт водного слоя этилацетатом объединяют и промывают водной гидроокисью натрия и водой. Остаток хроматографируют на силикагеле, элюируя смесью Н-гексана и этилацетата (10: 1), до получения 5-бензоил-3,4-дигидро-2Н-1,4-бензоксазина (5,7 г) ИК (Нуйоль), 3300, 1615, 1595, 1570, 1500 см-1 ЯМР (СДСl3, δ), 3,50-3,75 (2Н, м), 4,20-4,45 (2Н, м), 6,50-6,85 (8Н, м), 8,35 (1Н, шир. с. ).
По способу примера получения (1) были получены следующие соединения:
(2) 7-(2-фторбензоил)индолин
ИК (Нуйоль), 3370, 1615, 1605, 1575, 1565, 1495 см-1
ЯМР (СДСl3, δ): 3,15 (2Н, триплет, I = 8 Гц), 7,87 (2Н, тр, I = 8 Гц), 6,33-6,70 (1Н, м), 7,0-7,73 (7Н, м)
(3) (2RS(7-(2фторбензоил)-2-метилиндолин
Т. плавления 64-66оС.
Пример получения 2. (1) К раствору 5-бензоил-3,4-дигидро-2Н-1,4-бензоксазин (5,74 г), пирилина (1,9 г) и метиленхлорида (100 мл) по каплям добавляют раствор бромацетилбромида (5,82 г) в метиленхлориде (5 мл) при комнатной температуре. После того, как эти смеси перемешивают в течение 1 ч при той же температуре, при перемешивании добавляют 100 мл воды. Выделяют органический слой, промывают водой, сушат над сульфатом магния и выпаривают. Остаток кристаллизуют смесью диизопропилового эфира и этилацетата. Кристаллы собирают фильтрованием до получения 6,0 г бромацетил-5-бензоил, 3,4-дигидро-2Н-1,4-бензоксазина.
ИК (Нуйоль), 1675, 1663, 1580 см-1.
ЯМР (ДМСО-d6, δ): 3,70-4,25 (2Н, м), 4,10 (2Н, с), 4,30-4,65 (2Н, м), 6,85-7,90 (8Н, м).
П р и м е р 1. (1) К раствору (3RS)-3,4,6,7-тетрагидро-3-гидрокси-4- оксо-1-фенилпирроло (3,2,1-jk)/1,4 бензодиазепина (1,4 г) в тетрагидрофуране (40 мл) добавляют диизопропилэтиламин (0,97 г) и метилхлорид (0,86 г) при 5оС. Затем после того, как смесь перемешивают в течение 2 ч при комнатной температуре, к охлажденной реакционной смеси добавляют 9Н, аммиак в метаноле (30 мл). Реакционную смесь перемешивают в течение 1,5 ч при комнатной температуре. После того, как выпаривают растворитель, остаток перемешивают со смесью воды и этилацетата при перемешивании. Затем выделенный органический слой сушат над сульфатом магния и выпаривают. Остаток хроматографируют на силикагеле и элюируют смесью хлороформа и метанола (15: 1) до получения (3RS)-3-амино-3,4,6,7-тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk)) 1,4-бензодиазепина (460 мг).
ЯМР (СДСl3, δ): 2,40 (2Н, шир. с. ), 2,90-3,60 (2Н, м), 3,73-4,15 (1Н, м), 4,35 (1Н, с), 4,50-4,85 (1Н, м), 6,93-7,65 (8Н, м).
Способом, аналогичным способу примера 1(1), получают следующие соединения:
(2) (6RS)-6-амино-2,3,5,6-тетрагидро-5-оксо-8-фенил-1,4-оксазино (2,3,4-jk) (1,4)бензодиазепин
ЯМР (СДСl3, δ): 2,85-3,50 (1Н, м), 3,90-5,20 (6Н= м), 6,80-8,0 (8Н, м).
(3) (3RS)-3-амино-1-(2-фторфенил)-3,4,6,7-тетрагидро-4-оксопирроло (3,2,1-jk) (1,4)бензодиазепин
ЯМР (СДСl3, δ), 2,63 (2Н, шир. с), 3,03-3,50 (2Н, м), 3,63-4,35 (1Н, м), 4,35-4,95 (1Н, м), 4,45 (1Н, с), 6,85-7,80 (7Н, м)
(4) Смесь (3RS, 6RS)-3-амино-1(2-фторфенил)-3,4,6,7-тетрагидро-6-метил-оксопи- рроло (3,2,1-jk) (1,4)бензодиазепина и (3RS, 6RS)-3-амино-1-(2-фторфенил)-3,4,6,7-тетрагидро-6-метил-4-оксопирроло (3,2,1-jk) (1,4)бензодиазепина
ИК (чистый): 3350, 1688, 1610, 1445, 1220, 1042, 750 см-1
ЯМР (СДСl3, δ): 1,27, и 1,73 ( всего 3Н, каждый д, J = 6 Гц), 2,59 (2H, c), 2,5-3,6 (2Н, м), 4,30 и 4,47 (всего 1Н, каждый с), 4,5-5,2 (1Н, м), 6,8-7,7 (7Н, м).
П р и м е р 2. Смесь (3RS)-3-амино-3,4,6,7-тетрагидро-4-оксо- фенилпирроло (3,2,1-jk) (1,4)бензодиазепина (430 мг): индол-2-карбоновой кислоты (250 мг), 1-гидроксибензотриазола (210 мг) и N, N-диметилформамида (5 мл) перемешивают при 5оС и N-этил-N-(3-диметиламинопропил)карбодиимидгидрохлорида (298 мг) и триэтиламина (160 мг) добавляют к этому. Полученную смесь перемешивают и выливают в смесь этилацетата и воды. Выделяют органический слой, промывают водой, сушат над сульфатом магния и выпаривают; остаток хроматографируют на силикагеле, элюируя смесью хлороформ : этилацетат (10 : 1) до получения (3RS)-3,4,6,7-тетрагидро-3-(2-индолилкарбониламино)4-оксо-1- фенилпирроло(3,2,1-jk)(1,4)бензодиазепина (0,405 г).
Т. плавления: 180-185оС (с разложением)
ЯМР (СДСl3, δ): 2,90-3,50 (2Н, м), 3,75-4,20 (1Н, м), 4,50-4,85 (1Н, м), 5,65 (1Н, д, I = 8 Гц), 6,90-7,70 (13Н, м), 8,03, 1Н, д I = 8 Гц), 6.90-7,70 (13Н, м), 8,03 (1Н, д, I = 8 Гц), 9,85 (1Н, шир. с).
Масс-спектр: м/е = 420 (М+).
По способу примера 2 (1) получаются следующие соединения:
(6RS)-2,3,5,6-тетрагидро-6-(2-индолил- карбониламино)5-оксо-8- фенил-1,4-оксазино(2,3,4-jk)(1,4)бензодиазопин
Т. плавления: 180-185оС (с разложением)
ЯМР (ДМСО d6, δ): 3,10-3,50 (1Н, м), 4,0-4,90 (3Н, м), 5,76 )1Н, д, I = 8 Гц), 6,80-7,75 (13н, м) , 9,45 (1Н, д, I = 8 Гц)
Масс-спектр: м/е = 436 (М+).
(3RS)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2-индолилкарбонил- амино-)-4-оксопирроло(3,2,1-jk)(1,4)бензодиазепин
Т. плавления: 280-285оС (с разложением)
ИК (Нуйоль): 3390, 3250, 1678, 1610, 1600, 1580, 1531, 1500, 1428 см-1
ЯМР (ДМСО-d6, δ): 3,10-3,65 (2Н, м), 3,70-4,20 (1Н, м), 4,30-4,70 (1Н, м), 5,57 (1Н, д, I = 8 Гц), 6,90-7,75 (12Н, м), 9,53 (1Н, д, I = 8 Гц).
Масс-спектр: м/е = 438 (М+).
(4) Смесь (3RS, 6RS)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2 -индолилкарбониламино)6-метил-4-оксопирроло(3,2,1-jk) (1,4)бензодиазепина и (3RS, 6RS)-1-(2-фторфенил)-3,4,6,7- тетрагидро-3-(2-индалилкарбониламино)-6-метил-4-оксопирроло (3,2,1-jk) (1,4)бензодиазепина.
Т. плавления: > 250оС.
ИК (Нуйоль): 3400, 3270, 1675, 1610, 1532, 1450, 1373, 1340, 1225, 1118, 770, 755, 738 см-1
ЯМР (ДМСО d6, δ ): 1,11 и 1,54 (все 3Н, каждый д. I = 6 Гц), 2,5-3,8 (2Н, м), 4,5-5,1 (1Н, м), 5,43 и 5,47 (всего 1Н, каждый д, I = 8 Гц), 6,9-7,7 (7Н, м), 9,43 (1Н, д, I = 8 Гц), 11,6 (1Н, шир. с).
Масс-спектр: м/е = 452 (М+)
П р и м е р 3. По способу примера 1 получают следующее соединение: (3RS)-3-амино-1-(2-фторфенил)-3,4,7,8-тетрагидро- 4-оксо-6Н-пиридо(3,2,1-jk) (1,4)бензодиазепин
ЯМР (СДСl3, δ): 1,60-2,50 (2Н, м), 2,6-3,55 (3Н, м), 3,08 (2Н, с), 4,25-4,85 (1Н, м), 4,55 (1Н, с), 6,80-7,85 (7Н, м).
П р и м е р 4. (1) К раствору (3RS)-3-амино-3,4,6,7-тетрагидро- 4-оксо-1-пирроло(3,2,1-jk) (1,4)бензодиазепин (28,54 г) в N, N-диметилформамида (285 мл) добавляют N-трет-бутоксикарбонил-L-фенилаланин (27,33 г), 1-гидроксибензотриазол (13,92 г) и N, N-дициклогексилкарбодиимид (21,25 г) при перемешивании при комнатной температуре. Полученную смесь перемешивают в тех же условиях в течение 2 ч, полученные осадки отфильтровывают. Полученный фильтрат и промывки(этилацетатом) объединяют и выливают в смесь этилацетата (500 мл) иводы (500 мл) при перемешивании. Выделенный органический слой промывают водой, водным раствором бикарбоната натрия и водой. После сушки над сульфатом магния органический растворитель выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле элюентом из смеси хлороформ : этилацетат (10: 1) до получения смеси (48,82 г) (3R-3-)(2S)-2-трет. -бутоксикарбониламино-3-фенил-пропа- ноил) амино)-3,4,6,7-тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4)бензодиазепина и (3)-(-3-))(2)-трет. -бутокси-карбониламино-3-фенилпропаноил(амино)- 3,4,6,7-тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4)бензодиазепина в виде аморфного вещества.
ЯМР (СДСl3, δ ): 1,41 и 1,43 (9Н, каждый с), 2,9-3,5 (4Н, м), 3,8-4,0) (1Н, м), 4,6-4,7 (2Н, м), 5,0-5,1 (1Н, шир. с), 5,4 (1Н, д, I = 8 Гц), 7,0-7,8 (14Н, м).
По способу примера 4 (1) получают следующее соединение: (2) Смесь 3R(-3-))(2S)-2-трет. -бутоксикарбониламино-3-фенилпропаноил (амино-1-(2-фторфенил)-3,4,6,7-тетрагидро-4-оксопирроло (3,2,1-jk) (1,4)бензодиазепина и (3(-3-))(2)-2-трет. -бутоксикарбониламино-3- фенилпропаноил(амино)1-(2-фторфенил)-3,4,6,7-тетрагид- ро-4- оксопирроло(3,2,1-jk) (1,4)бензодиазепина
ЯМР (СДСl3, δ): 1,40 (9Н, с), 2,93-5,20 (9Н, м), 6,85-7,90 (13Н, м).
П р и м е р 5. Хлористый водород продувают сквозь раствор смеси (48,5 г) (3R(-3-))(2S)-2-трет. -бутоксикарбониламино-3- фенилпропаноил)-амино)-3,4,6,7-тетрагидро-4-оксо-1-фенилпирроло (3,2,1-jk) (1,4)бензодиазепина и (3(-3-))(2)-2-трет. -бутоксикарбонил-амино-3-фенилпропаноил- (амино)-3,4,6,7-тетрагидро-4-оксо-1-фенил- пирроло(3,2,1-jk) (1,4)бензодиазепина в этилацетате (1,0 л) при охлажении в бане со льдом и перемешивании. После того как смесь насыщается хлористым водородом полученную смесь перемешивают при комнатной температуре в течение 1 ч. Хлористый водород удаляют, продувая азот. К полученной смеси добавляют воду и эту смесь хорошо перемешивают. Водный слой выделяют, а органический слой промывают водой. Выделенный водный слой и промывки объединяют, нейтрализуют 20% -ной водной гидроокисью натрия и дважды экстрагируют этилацетатом. После того как эстракты сушат над сульфатом магния растворитель выпаривают при пониженном давлении до получения твердого продукта. Твердую часть собирают фильтрованием и промывают небольшим количеством этилацетата и этилового эфира поочередно до получения неочищенного соединения (13,42 г), которое перекристаллизовывают из этанола до получения (3R)-3-))(2S)-2-амино-3-фенилпропаноил(амино)-3,4,6,7-тетрагид- ро- 4-оксо-1-фенилпирроло (3,2,1-jk) (1,4)бензодиазепина (11,33 г) в виде светло-розовых тонких иголок.
Т. плавления: 94-95оС.
ИК (Нуйоль): 3350, 3150, 1672, 1644, 1597, 1550, 1445, 1372, 1237, 734, 699 см-1
ЯМР (СДСl3, δ ): 1,62 (2Н, шир. с), 2,74 (1Н, дд. I = 14,0 10,5 Гц), 3,1-3,5 (3Н, м), 3,75 (1Н, д, 10,5 Гц), 3,92 (1Н, кв. I = 10,5 Гц), 4,66 (1Н, т, I = 10,5 Гц), 5,45 (1Н, д. I = 8,4 Гц), 7,06-7,6 (13Н, м), 8,94 (1Н, д. I = 8,4 Гц).
Масс-спектр: м/е = 424 (М+).
С другой стороны, фильтрат выпаривают при пониженном давлении. После того как остаток тщательно растирают с небольшим количеством этилацетата, осадок собирают фильтрованием. После двукратной перекристаллизации из этанола получают (3S)-3-))(2S)-2-амино-3-фенилпропаноил(ами- но)3,4,6,7- тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4)бензодиазепина (9,70 г) в виде бесцветных иголок.
Т. плавления: 203-204оС.
ИК (Нуйоль): 3340, 3250, 1680 (пл), 1674, 1660, 1596, 1485, 1445, 1392, 1328, 890, 756, 732, 702 см-1
ЯМР (СДСl3, δ): 1,47 (2Н, шир. с), 2,85 (1Н, дд, I = 14,0 10,5 Гц), 3,1-3,5 (3Н, м), 3,75 (1Н, дд, I = 3,5, 10,5 Гц), 3,97 (1Н, кв, I = 10,5 Гц), 4,64 (1Н, т, I = 10,5 Гц), 5,47 (1Н, д, I = 8,4 Гц), 7,1-7,6 (13Н, м), 8,95 (1Н, д, I = 8,4 Гц).
Масс-спектр: м/е = 424 (М+)
П р и м е р 6. По способу, аналогичному способу примера 5, получают следующие соединения:
(3R)-3-))(2S)-2-амино-3-фенилпропаноил(амино)-1-(2-фторфенил)- 3,4,6,7-тетрагидро-оксопирроло(3,2,1-jk) (1,4)бензодиазепин
ЯМР (СДСl3, δ ): 1,36 (2Н, с), 2,60-4,90 (8Н, м), 5,48 (1Н, д, I = 8 Гц), 6,80-7,85 (12Н, м), 9,0 (1Н, д, I = 8 Гц)
(3S)-3-))(2S)-2-амино-3-фенилпропаноил(амино)-1-(2-фтофенил)- 3,4,6,7-тетрагидро-4-оксопирроло(3,2,1-jk) (1,4)бензодиазепин
ЯМР (СДСl3, δ): 1,65 (2Н, с), 2,60-4,90 (8Н, м), 5,50 (1Н, д, I = 8 Гц), 6,80-7,90 (12Н, м), 8,95 (1Н, д, I = 8 Гц).
П р и м е р 7. К раствору (3S)-3-))(2S)-2-амино-3-фенилпропаноил (амино)-3,4,6,7-тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4)бензодиазепина (2,91 г) в метиленхлориде (60 мл) добавляют фенилизотиоцианат (1,08 г), и полученную смесь нагревают до удаления метиленхлорида, а полученный остаток полностью выпаривают при пониженном давлении. Вязкий остаток извлекают хлороформом и обрабатывают смесью хлороформ/метанол (50: 1) до получения (3S)-3,4,6,7-тетрагидро-1-фенил-3-))(2S)-2-) N-(фенил)тиоуреидо)-3-фенилпропаноил (амино)-4-оксопирроло (3,2,1-jk) (1,4)бензодиазепина (2,95 г) в виде аморфного вещества.
П р и м е р 8. Раствор (3S)-3,4,6,7-тетрагидро-1-фенил-3-))(2S) -2-(N-(фенил)тиоуреидо)-3-фенилпропаноил(амино)-4-оксопиррo- ло (3,2,1-jk) (1,4)бензодиазепина (2,90 г) в трифторуксусной кислоте (10 мл) перемешивают в течение 0,5 ч при 50оС. Реакционную смесь выпаривают при пониженном давлении досуха, а остаток хроматографируют на силикагеле смесью хлороформа и метанола (15: 1) в качестве элюента. Фракции, содержащие целевой продукт, объединяют и промывают разбавленным водным раствором бикарбоната натрия. Органический слой выделяют, сушат над сульфатом магния и выпаривают до получения (3S)-3-амино-3,4,6,7-тетрагидро-4-оксо-1- фенилпирроло(3,2,1-jk) (1,4)бензодиазепина (0,97 г) в виде аморфного вещества.
ЯМР (СДСl3, δ): 2,38 (2Н, шир. с), 3,0-3,5 (2Н, м) 3,8-4,15 (1Н, м), 4,38 (1Н, с), 4,5-4,8 (1Н, м), 6,95-7,65 (8Н, м). (α)D20 = -175,09о(с = = 0,518, СНСl3).
П р и м е р 9. (1) К раствору (3R)-3-))(2S)-2-амино-3-фенилпропаноил)амино)-3,4,6,7- тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4)бензодиазепина (1,99 г) в 30 мл метиленхлорида добавляют 0,76 г фенилизотиоцианата, и полученную смесь нагревают для удаления метиленхлорида, а полученный остаток полностью выпаривают при пониженном давлении. Остаток растворяют в трифторуксусной кислоте (7 мл), и полученную смесь перемешивают при 50оС в течение 25 мин. После удаления трифторуксусной кислоты получают вязкое масло, которое обрабатывают на хроматографической колонке с силикагелем, элюируя смесью хлороформа и метанола (15: 1) в качестве элюента. Фракции, содержащие целевой продукт, объединяют и промывают разбавленным водным бикарбонатом натрия. Органический слой выделяют и сушат над сульфатом магния. После удаления растворителя получают (3R)-3-амино-3,4,6,7-тетрагидро-4-оксо-1- фенилпирроло(3,2,1-jk) (1,4)бензодиазепин (0,91 г) в виде аморфного продукта.
ЯМР (СДСl3, δ): 2,40 (2Н, шир. с), 3,0-3,5 (2Н, м), 3,8-4,3 (1Н, м), 4,40 (1Н, шир. с), 4,5-4,8 (1Н, м), 7,0-7,8 (8Н, м) (α)D20 = = 146,44 о (с = 0,574, СНСl3).
По способy примера 9(1) получают следующие соединения:
(2) (3S)-3-амино-1-(2-фторфенил)-3,4,6,7-тетрагидро-4- оксопирроло(3,2,1-jk) (1,4) бензодиазепин
(α)D25 = 73,4о (с = 0,475, СНСl3)
(3) (3R)-3-амино-1-(2-фторфенил-3,4,6,7-тетрагидро-4-оксопирроло (3,2,1-jk) (1,4)бензодиазепин
(α)25 = 67о ) (с = 0,432, СНСl3)
П р и м е р 10. К раствору 2-амино-4-хлорбензойной кислоты (418,7 мг) и N-метилморфолина (246,8 мг) в смеси метиленхлорида и N, N-диметилформамида (10,1, 35 мл) прикапывают изобутилхлорформат (333,3 мг) при охлаждении при -10оС в бане лед-соль и при перемешивании. Полученную смесь перемешивают при той же температуре в течение 15 мин и нагревают до 0оС. К полученной смеси прикапывают раствор (3RS)-3-амино-3,4,6,7- тетрагидро-4-оксо-1-фенилпирроло (3,2,1-jk) (1,4)бензодиазепина (554,7 мг) в смеси метиленхлорида и N, N-диметилформамида (10: 1,5 мл) в тех же условиях. Полученную смесь перемешивают в течение 1 ч при той же температуре и 12 ч при комнатной температуре. Метиленхлорид удаляют из реакционной смеси. К полученной смеси при перемешивании добавляют этилацетат и водный раствор бикарбоната натрия. Выделенный органический слой промывают водой дважды и сушат над сульфатом магния. После удаления растворителя при пониженном давлении получают масло коричневого цвета (1,22 г), которое хроматографируют на силикагеле, элюируя хлороформом. Фракции, содержащие целевое соединение, объединяют и выпаривают до получения аморфного вещества, которое измельчают, перемешивая в диизопропиловом эфире в течение ночи. Белый порошок собирают фильтрованием и промывают диизопропиловым эфиром до получения (3RS)-3-)(2-амино-4-хлорбензоил)амино)-3,4,6,7-тетрагидро-4- оксо-1-фенилпирроло(3,2,1-jk) (1,4)бензодиазепин(213,5 мг).
Т. плавления: 145-148оС (с разложением).
ИК (Нуйоль): 3410, 3320, 1685 (пл), 1675, 1640, 1610, 1505, 1447, 1373, 1240, 1165, 918, 860, 832, 695 см-1.
ЯМР (СДСl3, δ ): 3,0-3,4 (2Н, м), 3,7-4,1 (1Н, м) 4,4-4,8 (1Н, м), 5,58 (1Н, д, I = 8 Гц), 5,68 (2Н, шир. с), 6,6-7,6 (11Н, м), 7,86 (1Н, д, I = 8 Гц).
Масс-спектр: м/е = 430 (М+).
По способу примера 10 (1) получают следующие соединения:
(2) (3RS)-3-)(2-амино-4-хлорбензоил)амино)1-(2-фторфенил)- 3,4,6,7-тетрагидро-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления, 200-205оС.
ИК (Нуйоль): 3420, 3320, 1675, 1640, 1570, 1500, 1255, 915, 755 см-1.
ЯМР (ДМСО-d6, δ): 2,83-3,6 (2Н, м), 3,6-4,7 (1Н, м), 4,2-4,67 (1Н, м), 5,35 (1Н, д, I = 8 Гц), 6,33-7,63 (11Н, м), 7,72 (1Н, д, I = 9 Гц), 6,22 (1Н, д, I = 8 Гц).
Масс-спектр: м/е = 447 (М+)
(3) (3RS)-3-)(E)-циннамоиламино)-1-(2-фторфенил)-3,4,6,7- тетрагидро-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 189-190оС.
ИК (Нуйоль): 3290, 1675, 1650, 1620, 1530 см-1.
ЯМР (СДСl3, δ ): 3,0-3,6 (2Н, м), 3,8-4,8 (1Н, м), 5,55 (1Н, д, I = 8 Гц), 6,58 (1Н, д, I = 15 Гц), 6,83-7,8 (15Н, м).
Масс-спектр: м/е = 425 (М+), 294 (М+ - 131).
(4) (3RS)-1-(2-фторфенил)-3,4,6,7-тетрагидро-4-оксо-3-)(4- трифторметилбензоил)амино(пирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 199-201оС.
ИК (Нуйоль): 3300, 1670, 1640, 1530, 1325, 1150, 1120, 1065, 850 см-1.
ЯМР (СДСl3, δ): 2,87-3,4 (2Н, м), 3,8-4,23 (1Н, м), 4,43-4,8 (1Н, м), 5,55 (1Н, д, I = 8 Гц), 6,8-8,13 (12Н, м).
Масс-спектр: м/е = 467 (М+)
(5) (3RS)-3,4,6,7-тетрагидро-1-фенил-3-) (4-трифторметилбензоил) амино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин
Т. плавления: 232-235оС.
ИК (Нуйоль): 3350, 3230, 1690, 1660, 1545, 1320, 1240, 1170, 1125, 1060, 860 см-1.
ЯМР (СДСl3, δ ): 3,07-3,49 (2Н, м), 3,92-4,08 (1Н, м), 4,62-4,74 (1Н, м), 5,62 (1Н, д, I = 8 Гц), 7,10-8,11 (13Н, м).
Масс-спектр: м/е = 449 (М+).
(6) (3RS)-3-)(Е)-циннамоиламино)-3,4,6,7-тетрагидро-1-фенил- 4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 224-226оС.
ИК (Нуйоль): 3300, 1680, 1655, 1625, 1510, 1210 см-1.
ЯМР (СДСl3, δ ): 2,77-3,5 (2Н, м), 3,67-4,1 (1Н, м), 4,4-4,77 (1Н, м), 5,48 (1Н, д, I = 8 Гц), 6,43-7,77 (16Н, м).
Масс-спектр: м/е = 407 (М+)
П р и м е р 11. (1) К раствору (3RS)-3-амино-3,4,6,7- тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4) бензодиазепина (0,56 г) в сухом тетрагидрофуране (8 мл) добавляют 4-хлорфенилизоцианат (0,31 г) при перемешивании при комнатной температуре. К смеси дополнительно добавляют тетрагидрофуран (4 мл). Полученную смесь перемешивают в течение 4 ч при комнатной температуре. Белый осадок собирают фильтрованием, промывают холодным тетрагидрофураном и диэтиловым эфиром последовательно и сушат до получения (3RS)-3-)N-(4-хлорфенил)уреидо)-3,4,6,7- тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4) бензодиазепина (0,48 г) в виде белого порошка.
Т. плавления: 263-265оС.
ИК (Нуйоль): 3350, 3250, 1680 (пл), 1672, 1645, 1600, 1547, 1487, 1444, 1396, 1388, 1217, 1166, 825, 695 см-1.
ЯМР (ДМСО-d6, δ): 3,1-3,6 (2Н, м), 3,7-4,3 (1Н, м), 4,3-4,7 (1Н, м), 5,18 (1Н, д, I = 8 Гц), 7,2-7,8 (13Н, м), 9,27 (1Н, шир. с)
Масс-спектр: м/е = 430 (М+).
Способом, аналогичным способу примера 11/1, получают следующие соединения:
(2) (3RS)-3-(N-(4-хлорфенил)уреидо)-1,2-фторфенил)-3,4,6,7- тетрагидро-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 262-264оС (с разложением).
ИК (Нуйоль): 3250, 1675, 1640, 1600, 1545, 1490, 1300, 1215, 820, 750 см-1.
ЯМР (ДМСО-d6, δ): 2,93-3,5 (2Н, м), 3,67-4,1 (1Н, м), 4,23-4,6 (1Н, м), 5,08 (1Н, д, I = 8 Гц), 6,9-7,67 (12Н, м), 9,1 (1Н, шир. с).
(3) (3RS-)-3-)N-(2-хлорфенил)уреидо)= = 3,4,6,7-тетрагидро-4-оксо- 1-фенилпирроло(3,2,1-jk) )1,4) бензодиазепин
Т. плавления: 258-260оС (с разложением)
ИК (Нуйоль): 3250, 1680, 1580, 1640, 1550 см-1.
ЯМР (СДСl3, ): 2,87-3,5 (2Н, м), 3,7-4,1 (1Н, м), 4,2-4,6 (1Н, м), 5,13 (1Н, д, I = 8 Гц), 6,8-7,7 (11Н, м), 8,07 (1Н, д, I = 8 Гц), 8,43 (1Н, д, I = 9 Гц), 8,63 (1Н, шир. с).
(4) (3RS)-3-(N-(2-хлорфенил)уреидо)1-(2-фторфенил)-3,4,6,7- тетрагидро-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин
Т. плавления: 240-241оС.
ИК (Нуйоль): 3720, 1670, 1640, 1590, 1535 см-1.
ЯМР (ДМСО-d6, δ): 3,0-3,5 (2Н, м), 3,83-4,67 (1Н, м), 5,17 (1Н, д, I = 8 Гц), 6,9-7,63 (10Н, м), 8,08 (1Н, д, I = 9 Гц), 8,45 (1Н, д, I = 8 Гц), 8,63 (1Н, с).
(5) (3RS)-1-(2-фторфенил-3,4,6,7-тетрагидро-3)N-(3-метоксифенил) уреидо)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 242-243оС.
ИК (Нуйоль): 3280, 1670, 1630, 1605, 1550, 1285, 1210, 1155 см-1.
ЯМР (ДМСО-d6, δ): 2,9-3,5 (2Н, м), 3,67 (3Н, с), 3,8-4,7 (2Н, м), 5,13 (1Н, д, I = 8 Гц), 6,4-7,7 (12Н, м), 9,0 (1Н, шир. с).
Масс-спектр: м/е = 444 (М+)
(6) (3RS)-3,4,6,7-тетрагидро-3)N-(3-метоксифенил)уреидо)-4-оксо- 1-фенилпирроло(3,2,1-jk) (1,4) бензодиазепин
Т. плавления: 247-248оС.
ИК (Нуйоль): 3260, 1670, 1640, 1555, 1515, 1220, 1150, 1040 см-1.
ЯМР (ДМСО-d6, δ): 2,7-3,3 (2Н, м), 3,5 (3Н, с), 3,6-3,9 (1Н, м), 4,1-4,5 (1Н, м), 4,95 (1Н, д, I = 8 Гц), 6,2-7,6 (13Н, м), 8,85 (1Н, шир. с).
Масс-спектр: м/е = 426 (М+)
П р и м е р 12. (1) К раствору (3S)-3-амино-3,4,6,7-тетрагидро-4-оксо-1-фенилпирроло(3,2,1-jk) (1,4) бензодиазепин (0,97 г), индол-2-карбоновой кислоты (0,564 г), 1-гидроксибензотриазола (472,5 мг) в N, N-диметилформамиде (10 мл) добавляют N-этил-N-(3-диметиламинопропил)карбодиимидогидрохлорид (669,2 мг) и триэтиламин (351,2 мг) при перемешивании при комнатной температуре. Полученную смесь перемешивают в тех же условиях. К реакционной смеси добавляют этилацетат. Полученную смесь промывают водой, водным раствором бикарбоната натрия и водой.
Органический слой выделяют и сушат над сульфатом магния. После удаления растворителя получают аморфный материал (1,55 г), который после хроматографической обработки на силикагеле смесью хлороформа и этилацетата (10: 1) в качестве элюента дает аморфное вещество (1,39 г). Это вещество тщательно растирают в диизопропиловом эфире, а остаток в виде белого порошка собирают фильтрованием. Этот порошок перемешивают в воде в течение 2 дней, снова собирают и сушат при пониженном давлении и нагревают до получения (3S)-3,4,6,7-тетрагидро-3-(2-индолилкарбo- ниламино)- 4-оксо-1-фенилпирроло(3,2,1-jk) (1,4) бензодиазепина (оптическая чистота: 98,4% е. е. ) (1,12 г)
Т. плавления: 177-180оС.
ИК (Нуйоль): 3230, 1675, 1638, 1600, 1530, 1445, 1372, 1300, 1235, 1110, 745 см-1.
ЯМР (СДСl3, δ): 3,0-3,5 (2Н, м), 3,8-4,2 (1Н, м), 4,5-4,85 (1Н, м), 5,68 (1Н, д, I = 7,5 Гц), 7,0-7,8 (13Н, м), 8,07 (1Н, д, I = 7,5 Гц), 9,90 (1Н, шир. с).
Масс-спектр: м/е = 420 (М+).
(α )D20 = -63,8о (с = 0,5, CHCl3).
По способу примера 12(1) получают следующие соединения:
(2) (3RS)-3,4,6,7-тетрагидро-3(2-индолилкарбониламино)-4- оксо-1-фенилпирроло(3,2,1-jk) (1,4) бензодиазепин (оптическая чистота 97,47% е. е).
Т. плавления: 171-177оС (с разложением).
ИК (Нуйоль): 320, 1674, 1638, 1600, 1530, 1445, 1370, 1300, 1236, 1112, 745, 695 см-1.
ЯМР (СДСl3, δ): 3,0-3,5 (2Н, м), 3,8-4,16 (1Н, м), 4,5-4,82 (1Н, м), 5,67 (1Н, д, I = 7,5 Гц), 7,0-7,75 (13Н, м), 8,08 (1Н, д, I = 7,5 Гц), 9,95 (1Н, шир. с).
Масс-спектр: м/е = 420 (М+).
(α )D20 = 64,88о (с = 0,524, СНСl3)
(3) (3S)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2- индолилкарбониламино)-5-оксопирроло(3,2,1-jk) (1,4) бензодиазепин (оптическая чистота: 97,8% е. е. ).
Т. плавления: 270-275оС.
ЯМР (ДМСО-d6, δ): 3,0-3,65 (2Н, м), 3,75-4,20 (1Н, м), 4,30-4,70 (1Н, м), 5,55 (1Н, д, I = 8 Гц), 6,90-7,75 (12Н, м), 9,53 (1Н, д, I = 8 Гц), 11,65 (1Н, шир. с).
Масс-спектр: м/е = 438 (М+)
(α )D25 = 19,8о (с = 0,3, СНСl3).
(4) (3R)-1-(2-фторфенил(-3,4,6,7-тетрагидро-3-(2- индолилкарбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин (оптическая чистота: 93,4% е. е. ).
Т. плавления: 250-265оС (с разложением)
ЯМР (ДМСО-d6, δ): 3,0-3,65 (2Н, м), 3,75-4,20 (1Н, м), 4,30-4,70 (1Н, м), 5,55 (1Н, д, I = 8 Гц), 6,90-7,75 (1Н, м), 9,53 (1Н, д, I = 8 Гц), 11,63 (1Н, шир. с).
Масс-спектр: м/е = 438 (М+).
(α )D25 = -17,8о (с = 0,3, СНСl3)
П р и м е р 13. По способу примера 2(1) получают следующее соединение: (3RS)-1-(2-фторфенил)-3,4,7,8-тетрагидро-3-(2- индолилкарбониламино)-4-оксо-6Н-пиридо(3,2,1-jk) (1,4) бензодиазепин
ЯМР (ДМСО-d6, δ): 1,55-2,25 (1Н, м), 2,75-3,30 (3Н, м), 4,15-4,55 (1Н, м), 5,53 (1Н, д, I = 8 Гц), 6,85-7,70 (12Н, м), 9,40 (1Н, д, I = 8 Гц).
Масс-спектр: м/е = 452 (М+)
П р и м е р 14. По способу примера 2(1) получают следующие соединения:
(1) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил-3-)(Е)-3-(2-(4- имидазолилметиламино(фенил)пропеноиламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепин
Т. плавления: 205-210оС (с разложением)
ИК (Нуйоль): 3200, 2600, 1691, 1645, 1610, 1600, 1540, 1500 см-1.
ЯМР (СДСl3, δ): 3,02-3,34 (2Н, м), 3,85-4,01 (1Н, м), 4,30 (2Н, с), 4,53-4,63 (2Н, м), 5,54 (1Н, д, I = 7,4 Гц), 6,49 (1Н, д, I = 15 Гц), 6,68-7,63 (14Н, м), 7,76 (1Н, д, I = 7,4 Гц), 7,68 (1Н, д, I = 15 Гц).
(2) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-(7- индолинилкарбониламино)-4-оксо-пирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 165-170оС (с разложением)
ИК (Нуйоль): 3310, 1665, 1630, 1590, 1522 см-1.
ЯМР (СДСl3, δ ): 3,04 (2Н, три, I = 8,4 Гц), 3,14-3,20 (1Н, м), 3,28-3,46 (1Н, м), 3,67 (2Н, трис, I = 8,4 Гц), 3,96-4,12 (1Н, м), 4,61-4,73 (1Н, м), 5,62 (1Н, д, I = 7,4 Гц), 6,29 (1Н, шир. с), 6,58-6,66 (1Н, м), 6,98-7,71 (9Н, м), 7,92 (1Н, д, I = 7,4 Гц).
Масс-спектр: м/е = 440 (М+)
(3) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-(3- хинолилкарбониламино-4-оксо-пирроло(3,2,1-jk) (1,4) бензодиазепин гидрохлорид.
Т. плавления: 198-200оС.
ИК (Нуйоль): 3550-3100, 2700-2100, 1660, 1605, 1520 см-1.
ЯМР (СДСl3, δ): 3,07-3,55 (2Н, м), 3,95-4,2 (1Н, м), 4,6-4,8 (1Н, м), 5,83 (1Н, д, I = 7,3 Гц), 7,00-7,27 (4Н, м), 7,51-7,69 (3Н, м), 7,85-7,92 (1Н, м), 8,04-8,11 (1Н, м), 8,26 (1Н, д, I = 8 Гц), 8,84 (1Н, д, I = 8,5 Гц), 9,47 (1Н, д, I = 7 Гц), 9,60 (1Н, с), 9,79 (1Н, с).
(4) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(8- хинолил)пропеноиламино)-4-оксопирроло(3,2,1-jk)(1,4) бензодиазепингидрохлорид.
Т. плавления: 180-185оС.
ИК (Нуйоль): 3280, 1668, 1647, 1623, 1540, 1450, 1372, 1212, 981, 767, 748 см-1.
ЯМР (ДМСО-d6, δ): 3,11-3,49 (2Н, м), 3,99 (1Н, кв. I = 10,8 Гц), 4,52 (1Н, т, I = 9,8 Гц), 5,47 (1Н, д, I = 8,2 Гц), 7,0-9,0 (15Н, м).
(5) (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(2-амино-4-хлорбензоил) -4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 217-220оС.
ИК (Нуйоль): 3400, 3300, 1675, 1630, 1610, см-1.
ЯМР (СДСl3, δ): 3,09-3,46 (2Н, м), 3,97-4,12 (1Н, м), 4,61-4,73 (1Н, м), 5,58 (1Н, д, I = 7,3 Гц), 5,69 (2Н, шир. с). 6,64-7,88 (1Н, м).
Масс-спектр: м/е = 448 (М+)
(α)D25 = 60,59о (с = 0,812, СНСl3)
(6) (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3(2- гидроксифенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 178-192оС (с разложением)
ИК (Нуйоль): 3400-3000, 1650, 1600 см-1.
ЯМР (СДСl3, δ): 3,09-3,47 (2Н, м), 3,97-4,12 (1Н, м), 4,63-4,73 (1Н, м), 5,65 (1Н, д, I = 8 Гц), 6,76-7,72 (13Н, м), 7,98 (1Н, д, I = 16 Гц), 8,76 (1Н, с).
Масс-спектр: м/е = 441 (М+)
(α)D25 = 23,17о / с = 0,902 МеОН)
(7) (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3)(Е)-3-(2- нитрофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 215-220оС (с разложением).
ИК (Нуйоль): 3300, 1670, 1650, 1630, 1550, 1520 см-1.
ЯМР (СДСl3, δ): 3,15-3,47 (2Н, м), 3,96-4,12 (1Н, м), 4,61-4,72 (1Н, м), 5,6 (1н, д, I = 7,8 Гц), 6,56 (1Н, д, I = 15,5 Гц), 6,99-8,17 (13Н, м).
(8) (3RS)-3,4,6,7-тетрагидро-(2-фторфенил)-3-(Е)-3-(4- хлорфенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 153-160оС (с разложением)
ИК (Нуйоль): 330, 1675, 1650, 1620, 1520 см-1.
ЯМР (СДСl3 δ) : 3,09-3,57 (2Н, м), 3,97-4,72 (1Н, м), 4,60-4,72 (1Н, м), 5,59 (1Н, д, I = 8 Гц), 6,61 (1Н, д, I = 16 Гц), 6,99-7,71 (13Н, м).
Масс-спектр: м/е = 459 (М+)
(9) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(-фенилглицил) амино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 135-137оС (с разложением).
ИК (Нуйоль): 3450, 3125, 1675, 1650, 1600, 1530 см-1.
ЯМР (СДСl3, δ ): 3,06-3,18 (2Н, м), 3,89-4,07 (1н, М), 4,57-4,68 (1н, м), 5,48 (1Н, д, I = 8 Гц), 6,7-7,65 (15Н, м), 8,21 (1Н, д, I = 8 Гц).
Масс-спектр: м/е = 428 (М+).
(10) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(4-фторфенил) пропеноиламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 186-193оС.
ЯМР (СДСl3 , δ ): 3,09-3,47 (2Н, м), 3,95-4,11 (1Н, м), 4,60-4,73 (1Н, м), 5,59 (1Н, д, I = 8 Гц), 6,56 (1Н, д, I = 16 Гц), 6,99-7,7 (13Н, м).
Масс-спектр: м/е = 443 (М+).
(11) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(4-нитрофенил) пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 267-269оС.
ИК (Нуйоль): 3300, 1650, 1630, 1595, 1530, 1510 см-1.
ЯМР (СДСl3, δ ): 3,19-3,4 (2Н, м), 4,02-4,08 (1Н, м), 4,62-4,72 (1Н, м), 5,58 (1Н, д, I = 8 Гц), 6,72 (1Н, д, I = 16 Гц), 7,0-7,78 (12Н, м, ) 8,26 (1Н, д, I = 9 Гц).
Масс-спектр: м/е = 470 (М+).
(12) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-(Е)-3-)-4 метилфенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 224-225оС.
ИК (Нуйоль): 3250, 1680, 1600, 1520 см-1.
ЯМР (СДСl3, δ): 2,37 (3Н, с), 3,08-3,46 (2Н, м), 3,95-4,11 (1Н, м), 4,61-4,71 (1Н, м). , 5,6 (1Н, д, I = 8 Гц), 6,59 (1Н, д, I = 16 Гц), 6,98-7,72 (13Н, м).
Масс-спектр: м/е = 439 (М+)
(13) (3RS) - 3,4,6,7-тетрагидро-1-(2-фторфенил)-3)(Е)- 3-(3,4-дихлорфенил)пропеноиламино)-4-оксопирроло(3,2-1-jk)(1,4) бензодиазепин.
Т. плавления: 250-252оС.
ИК (Нуйоль): 3270, 1670, 1620, 1540 см-1.
ЯМР (СДСl3, δ): 3,10-3,47 (2Н, м), 3,96-4,11 (1Н, м), 4,61-4,71 (1Н, м), 5,57 (1Н, д, I = 8 Гц), 1Н, д, I = 16 Гц), 6,99-7,69 (12Н, м).
Масс-спектр: м/е = 493 (М+).
(14) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(4- метоксифенил)пропеноиламино)4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 230-233оС.
ИК (Нуйоль): 3350, 1655, 1625, 1600, 1510 см-1.
ЯМР (СДСl3, δ): 3,08-3,46 (2Н, м), 3,84 (3Н, с), 3,95-4,11 (1Н, м), 4,61-4,71 (1Н, м), 5,60 (1Н, д, I = 8 Гц), 6,5 (2Н, д, I = 16 Гц), 6,89-7,71 (13Н, м).
Масс-спектр: м/е = 455 (М+).
(15) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- хлорфенил)пропеноиламино)-4-оксопиироло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 137-140оС (с разложением)
ИК (Нуйоль): 3250, 1670, 1650, 1635, 1540 см-1.
ЯМР (СДСl3, δ ): 3,09-3,47 (2Н, м), 3,95-4,11 (1Н, м), 4,61-4,73 (1Н, м), 5,6 (1Н, д, I = 8 гц), 6,6-6,67 (1Н, д, I = 16 Гц), 6,98-7,71 (12Н, м), 8,09 (1Н, д, I = 16 Гц).
Масс-спектр: м/е = 459 (М+).
(16) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(3- хлорфенил)пропеноиламино)-4оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 130-135оС (с разложением)
ИК (Нуйоль): 3350-3100, 1690, 1660, 1630 см-1.
ЯМР (СДСl3, δ): 3,09-3,47 (2Н, м), 3,95-4,11 (1Н, м), 4,61-4,77 (1Н, м), 5,58 (1Н, д, I = 8 Гц), 6,64 (1Н, д, I = 16 Гц), 6,99-7,87 (13Н, м).
Масс-спектр: м/е = 459 (М+).
(17) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- нитрофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 170-185оС (с разложением)
ИК (Нуйоль): 3260, 1670 см-1.
ЯМР (СДСl3, δ): 3,09-3,47 (2Н, м), 3,94-4,11 (1Н, м). 4.61-4,72 (1Н, м). 5,60 (1Н, д, I = 8 Гц), 6,57 (1Н, д, I = 15 Гц), 6,99-7,72 (11Н, м), 8,02-8,17 (2Н, м).
(18) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(3,4- дигидроксифенил)пропеноиламино)-4-оксопииролизо(3,2,1-jk) (1,4) бензодиазепин.
ИК (Нуйоль): 3550-3000, 1650, 1600, 1510 см-1.
ЯМР (СДСl3, δ): 3,09-3,46 (2Н, м), 3,90-4,00 (1Н, м), 4,44-4,54 (1Н, м), 5,41 (1Н, д, I = 8 Гц), 5,43-6,50 (1Н, д), 6,98-7,61 (9Н, м), 8,01 (1Н, с), 9,25 (1Н, с), 9,69 (1Н, д, I = 8 Гц).
(19) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(4- имидазолил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепингидрохлорид.
ИК (Нуйоль): 3650-3100, 2750-2200, 1670, 1630, 1600, 1500 см-1.
ЯМР (ДМСО-d6, δ ): 3,09-3,46 (2Н, м), 3,90-4,00 (1Н, м), 4,44-4,54 (1Н, м), 5,41 (1Н, д, I = 8 Гц), 5,43-6,50 (1Н, д), 6,98-7,61 (9Н, м), 8,01 (1Н, с), 9,25 (1Н, с), 9,69 (1Н, д, I = 8 Гц).
(20) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-(3-(2- аминофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин
ИК (Нуйоль): 3400, 3350, 3125, 1690, 1640, 1600, 1540 см-1.
(21) (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- аминофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
ИК (Нуйоль): 3280, 1670, 1645, 1615, 1545 см-1.
(22) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(4- аминофил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
ИК (Нуйоль): 3250, 1675, 1640, 1580, 1530 см-1.
(23) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-(3- (2-карбоксииндол-3-ил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
ИК (Нуйоль): 3250, 170 (пл), 1675, 1645, 1610, 1525, 1450, 1370, 1205, 985, 835, 745 см-1.
(24) (3S)-3,4,6,7-тетрагидро-1(2-фторфенил)-3(3-)(4-(2- гидроксиэтил)пиперазин-1-ил)метил)индол-2-ил(карбониламино)-4- оксипирроло(3,2,1-jk) (1,4) бензодиазепин.
ИК (Нуйоль): 3250, 1690, 1620, 150, 1372, 1141, 1050, 740 см-1.
(25) (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3)(3-)N, N- диметиламинометил)индол-2-ил)карбониламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепингидрохлорид
ЯМР (ДМСО-d6, δ ): 2,72-2,78 (6Н, м), 3,17-3,43 (2Н, м), 4,02 (1Н, кв, I = 10,8 Гц), 4,52 (1Н, т, I = 11,4 Гц), 4,74 (2Н, АВкв), 5,59 (1Н, д, I = 7,7 Гц), 7,1-8,0 (11Н, м), 9,41 (1Н, шир. с), 9,83 (1Н, д, I = 7,7 Гц).
(26) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- ацетамидофенил)пропеноиламино)-4-оксипирроло(3,2,1-jk) (1,4) бензодиазепин.
(27) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3)(3-формилиндол -2-ил)карбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
ИК (Нуйоль): 3200, 1678, 1640, 1580, 1445, 748 см-1.
(28) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(3- гидросииминометилиндол-2-ил)карбониламино)-4-оксипирроло (3,2,1-jk) (1,4) бензодиазепин.
ЯМР (ДМСО-d6, δ ): 3,1-3,5 (2Н, м), 4,00 (1Н, кв, I = 10 Гц), 4,53 (1Н, т. I = 10 Гц), 5,57 (1Н, д, I = 7,6 Гц), 7,05-8,6 (11Н, м), 8,97 (1Н, с), 10,07 (1Н, д, I = 7,6), 11,02 (1Н, с), 12,16 (1Н, с).
(29) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)3-)(Е)-3-(2-аминофенил) пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепингидрохлорид.
ИК (Нуйоль): 3600-3100, 2650-2100, 1600, 1610 см-1
(30) (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-(3-(2- аминофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепингидрохлорид
ИК (Нуйоль): 3600-3100, 2600-2200, 1660, 1610 см-1
П р м е р 15. К раствору (3RS)-3,4,6,7-тетрагидро-1-(2- фторфенил)-3-амино-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (177,7 мг) в N, N-диметилформамиде (4 мл) добавляют (Е)-3-)(2-этоксикарбонил-3-индолил)пропеновой кислоты (156,0 мг), 1-гидроксибензотриазола (81,4 мг), N-этил-N1-(3-диметиламинопропил)карбодиимидгидрохлорид (115,4 мг) и триэтиламина (60,9 мг) при перемешивании в течение 4 ч и оставляют выстаиваться в течение ночи. Реакционную смесь выливают в смесь этилацетата и воды при перемешивании. Выделенный органический слой промывают водой дважды и сушат.
Растворитель удаляют при пониженном давлении до получения аморфного остатка, который обрабатывают на хроматографической колонке с силикагелем элюентом из смеси хлороформа и метанола (10: 1). Фракции, содержащие целевой продукт, объединяют и выпаривают до получения стеклообразного вещества, которое измельчают в смеси диэтилового эфира и метанола. Порошок собирают фильтрованием и сушат при пониженном давлении до получения чистого (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- этоксикарбонилиндол-3-ил)-пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (148,3 мг).
ИК (Нуйоль): 3250, 3180, 1710, 1670, 1605, 1530, 1450, 1240, 1212, 740 см-1.
Масс-спектр: м/е = 536 (М+)
П р и м е р 16. По способу примера 15 получают следующее соединение: (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-) (3-фенилиминометилиндол-2-ил)карбонилами- но)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепин.
ЯМР (СДСl3, δ ): 3,0-3,5 (2Н, м), , 8-4,2 (1Н, шир. кв), 4,5-4,8 (1Н, шир. т), 5,74 (1Н, д, I = 7,5 Гц), 6,9-7,8 (16Н, м), 8,0 (1Н, д, I = 7,5 Гц), 10,4 (1Н, с), 10,9 (1Н, шир. с).
Масс-спектр: м/е = 541 (М+)
П р и м е р 17. К раствору кумариновой кислоты (0,68 г) и N-метилморфолина (0,46 мл) в смеси метиленхлорида и N, N-диметилформамида (10: 1, 52 мл) прикапывают изобутилхлорформат (0,54 мл) при перемешивании при -5оС. Полученную смесь перемешивают при той же температуре в течение 15 мин. К этой смеси при перемешивании при 0оС добавляют раствор (3RS)-3,4,6,7- тетрагидро-1-(2-фторфенил)-3-амино-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (1,0 г) в смеси метиленхлорида и N, N-диметилформамида (10: 1, 9 мл). Полученную смесь перемешивают в течение 1,5 ч при 0оС и в течение 14,5 ч при комнатной температуре. После удаления метиленхлорида из реакционной смеси к остатку при перемешивании добавляют насыщенный водный раствор бикарбоната натрия (50 мл) и этилацетат (50 мл). Выделившийся органический слой промывают водой и сушат над сульфатом магния. После удаления растворителя получают аморфную массу, которую обрабатывают на хроматографической колонке с силикагелем, элюируя смесью хлороформа и метанола (50: 1). Фракции, содержащие целевой продукт, объединяют и выпаривают.
Остаток перемешивают в диизопропиловом эфире в течение нескольких часов, собирают фильтрованием, промывают диизопропиловым эфиром и сушат при пониженном давлении до получения (3RS)-3,4,6,7- тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2-гидроксифенил) пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (853,9 мг) в виде белого порошка.
Т. плавления: 239-241оС (с разложением).
ИК (Нуйоль): 3325, 3200-3000, 1670, 1655, 1610, 1600, 1510 см-1.
Т. плавления: 239-241оС (с разложением).
ИК (Нуйоль): 3325, 3200-3000, 1670, 1655, 1610, 1600, 1510 см-1.
ЯМР (СДСl3, δ ): 2,8-3,5 (2Н, м), 3,8-4,3 (1Н, м), 4,43-4,93 (1Н, м), 5,62 (1Н, д, I = 8 Гц), 6,67-8,1 (14Н, м), 8,57 (1Н, шир. с).
Масс-спектр: м/е = 441 (М+)
П р и м е р 18. К суспендированной смеси порошка железа (3,68 г) и аммонийхлорида (0,44 г) в смеси воды (9,2 мл) и этанола (27,6 мл) добавляют порциями (3RS)-3,4,6,7-тетрагидро-1(2-фторфенил)- 3-) (Е)-3-(2-нитрофенил)пропеноиламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепин (3,68 г) при перемешивании и кипении с обратным холодильником. После добавления дополнительно этанола (10 мл) и воды (3,4 мл), полученную смесь кипятят с обратным холодильником, перемешивают в течение 2,5 ч. Реакционную смесь фильтруют через Целит и несколько раз промывают горячим этанолом. Из фильтрата и промывок этанол удаляют при пониженном давлении. К остатку смеси добавляют насыщенный водный раствор бикарбоната натрия (100 мл), полученную смесь экстрагируют хлороформом. Полученный экстракт промывают водой, сушат над сульфатом магния и выпаривают до получения кристаллического остатка, который измельчают пульверизацией из диизопропилового эфира (100 мл) и собирают фильтрованием до получения (3RS)-3,4,6,7-тетрагидро- 1-(2-фторфенил)-3-)(Е)-3-(2-аминофенил)пропеноиламино)-4- оксопирроло(3,2,1-jk) (1,4) бензодиазепина (1,56) в виде желтого порошка.
Т. плавления: 237-240оС с разложением.
ИК (Нуйоль): 3400, 3350, 3125, 1690, 1640, 1600, 1540 см-1.
ЯМР (СДСl3, δ ): 3,08-3,45 (2Н, м), 3,95-4,14 (3Н, м), 4,60-4,71 (1Н, м), 5,6 (1Н, д, I = 8 Гц), 6,51-7,87 (14Н, м).
Масс-спектр: м/е = 440 (М+).
П р и м е р 19. По способу примера 18 получают следующие соединения:
(1) (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- аминофенил)пропаноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Т. плавления: 228-230оС (с разложением).
ИК (Нуйоль): 3280, 1670, 1645, 1615, 1545 см-1.
ЯМР (СДСl3, δ ): 3,08-3,45 (2Н, м), 4,00 (2Н, с), 3,94-4,10 (1Н, м), 4,60-4,71 (1Н, м), 5,06 (1Н, м, I = 7,9 Гц), 6,55 (1Н, д, I = 15,4 Гц), 6,67-7,68 (12Н, м), 7,83 (1Н, д, I = 15,5 Гц).
(α)D25= 13,02о (с = 0,86 CHCl3)
Масс-спектр: м/е = 440 (М+)
(2) (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(4- аминофенил)пропеноиламино)-4-оксопирроло(3-2-1-jk) (1,4) бензодиазепин.
Т. плавления: 227-228оС.
ИК (Нуйоль): 3250, 1675, 1640, 1580, 1530 см-1.
ЯМР (СДСl3, δ): 3,16-3,33 (4Н, м), 4,00-4,10 (1Н, м), 4,61-4,67 (1Н, м), 5,61 (1Н, д, I = 7 Гц), 6,38-7,72 (14Н, м).
Масс-спектр: м/е = 440 (М+)
П р и м е р 20. К 0,1 н. водной гидроокиси натрия (7,5 мл) по каплям добавляют суспензию (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- этоксикарбонилиндол-3-ил)пропеноиламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепина (268,3 мг) в 95% этаноле (10 мл) при перемешивании при кипячении с обратным холодильником. Полученную смесь кипятят с обратным холодильником в течение 15 мин. Из охлажденной реакционной смеси этанол удаляют при пониженном давлении. К остатку добавляют воду и полученную смесь подкисляют разбавленной соляной кислотой. Полученную смесь экстрагируют этилацетатом. Экстракт прoмывают водой дважды и сушат над сульфатом магния. После удаления растворителя получают кристаллический порошок, который промывают диэтиловым эфиром при перемешивании и собирают фильтрованием до получения (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- карбоксииндол-3-ил)пропениламино-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (192,0 мг).
Т. плавления: 215-217оС (с разложением)
ИК (Нуйоль): 3250, 1700 (пл), 1675, 1645, 1610, 1525, 1450, 1370, 1205, 985, 835, 745 см-1.
ЯМР (ДМСО-d6, δ): 3,1-3,4 (2Н, м), 4,00 (1Н, кв, I = 10,8 Гц), 5,43 (1Н, д, I = 8 Гц), 7,0-7,6 (12Н, м), 8,25 (1Н, д, I = 8 Гц), 8,47 (1Н, д, I = 16 Гц), 9,39 (1Н, д, I = 8 Гц), 12,14 (1Н, с), 13,53 (1Н, шир. с).
П р и м е р 21. (1) К раствору 1-(2-гидроксиэтил)пиперазина (156,2 мг) и параформальдегида (37,9 мг) в уксусной кислоте (4 мл) добавляют (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-(2- индолилкарбониламино)-4-оксипирроло(3,2,1-jk) (1,4) бензодиазепина (438,5 мг) при перемешивании при комнатной температуре. Полученную смесь нагревают при около 85оС в течение 3 ч. После удаления уксусной кислоты к остатку добавляют водный раствор бикарбоната натрия и полученную смесь экстрагируют этилацетатом. Полученный экстракт промывают дважды водой и сушат над сульфатом магния. Растворитель удаляют при пониженном давлении до получения вязкого масла (0,68 г), которое обрабатывают на хроматографической колонке с силикагелем, элюируя смесью хлороформ/метанол (50: 1) до получения бесцветного масла (494,5 мг). Это масло тщательно растирают эфиром до получения (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-) (3-(4-(2- гидроксиэтил)пиперазин-1-ил(метил)-индол-2-ил)-карбониламино) -4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина.
ИК (Нуйоль): 3250, 1690, 1450, 1372, 1141, 1050, 740 см-1
ЯМР (СДСl3, δ): 2,28 (2Н, т, I = 5,2 Гц), 2,53 (4Н, шир. с), 2,68 (4Н, шир. с), 3,07-3,19 (1Н, м), 3,44 (2Н, т, I = 5,2 Гц), 3,2-3,5 (1Н, м), 3,8-4,1 (3Н, м), 4,6-4,7 (1Н, м), 5,77 (1Н, д, I = 7,7 Гц), 7,0-7,8 (12Н, м), 9,79 (1Н, с), 12,46 (1Н, д, I = 7,7 Гц).
Масс-спектр: м/е = 58 = (М+)
(2) Соединение, полученное в примере 21 (1), обрабатывают раствором эфирного хлористого водорода в метаноле до получения (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(3-)(4-(2- гидроксиэтил)пиперазин-1-ил(метил)индол-2-ил(карбамоиламино) -4-окоспирроло(3,2,1-jk) (1,4) бензодиазепиндигидрохлорида (0,25 г).
Т. плавления: 225-232оС. (α)D25 : 13,0о (с = 0,40 МеОН)
П р и м е р 22. (1) К раствору N, N, N', N'-тетраметилдиаминометана (143,1 мг) в дихлорметане (2 мл) добавляют по каплям ацетилхлорид (109,9 мг) при охлаждении в ледяной бане и перемешивании. Полученную смесь перемешивают в тех же условиях в течение 1 ч. К полученной смеси добавляют (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-(2- индолилкарбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин (438,5 мг) при перемешивании при комнатной температуре. Полученную смесь перемешивают в течение 4,5 ч при той же температуре. Растворитель (дихлорметан) удаляют выпариванием, а к остатку добавляют воду. рН водной смеси доводят до 7,5-8 насыщенным водным раствором бикарбоната натрия, и экстракт промывают трижды водой. После того как экстракт сушат над сульфатом магния, растворитель удаляют при пониженном давлении до получения вязкого масла (0,61 г), которое очищают на хроматографической колонке с силикагелем, элюируя смесью хлороформа и метанола (100: 1) до получения (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3) (3-)(N, N- диметиламинометил)индол-2-ил(карбониламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепина (0,6 г).
(2) Полученное в примере 22 (1) соединение обрабатывают эфирным хлористым водородом в метаноле до получения (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(3-(N, N- диметиламинометил)индол-2-ил)карбониламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепингидрохлорида (0,52 г) в виде желтого порошка.
(α)D25 = 83,0о (с = 1,0 МеОН)
ЯМР (ДМСО- d6, δ): 2,72-2,78 (6Н, м), 3,17-3,43 (2Н, м), 4,02 (1Н, кв, I = 10,8 Гц), 4,52 (1Н, т, I = 11,4 Гц), 4,74 (2Н, АВкв), 5,59 (1Н, д, I = 7,7 Гц), 7,1-8,0 (11Н, м), 9,41 (1Н, шир. с), 9,83 (1Н, д, I = 7,7 Гц).
П р и м е р 23. К суспендированному раствору (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2- аминофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (0,5 г) и сухого пиридина (0,28 мл) в метиленхлориде (15 мл) прикапывают ацетилхлорид (0,12 мл) при перемешивании и охлаждении на бане со льдом. Полученный прозрачный раствор перемешивают в течение получаса в тех же условиях и в течение 2 ч при комнатной температуре. Реакционную смесь промывают водой, 1Н соляной килсотой и рассолом. Органический слой сушат над сульфатом магния и выпаривают при пониженном давлении до получения масла, которое обрабатывают на хроматографической колонке, элюируя смесью хлороформа и метанола (50: 1). Фракции, содержащие целевой продукт, объединяют и выпаривают. Остаток пульверизуют в диизопропиловом эфире, собирают фильтрованием, промывают диизопропиловым эфиром и сушат при пониженном давлении при 50оС в течение 6 ч до получения (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3)(Е)-3-(2- ацетамидофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодазепина (372 мл) в виде белого порошка.
Т. плавления: 180-189оС.
ЯМР (СДСl3, δ): 2,21 (3Н, с), 3,07-3,36 (28Н, м), 3,92-4,08 (1Н, м), 4,57-4,69 (1Н, м), 5,52 (1Н, д, I = 8 Гц), 6,56 (1Н, д, I = 15 Гц), 6,99-7,89 (13Н, м).
Масс-спектр: м/е = 482 (М+)
П р и м е р 24. К суспензии (3RS)-3,4,6,7-тетрагидро-1-(2- фторфенил)-3-)(3-фенилиминометилиндол-2-ил)карбониламино)-4- оксопирроло(3,2,1-jk) (1,4) бензодиазепина (1,73 г) в этаноле (30 мл) добавляют 2Н соляную кислоту (20 мл). Полученную смесь перемешивают при 55оС в течение 2 ч. Реакционную смесь охлаждают в ледяной бане в течение 0,5 ч и собирают желтый осадок фильтрованием; его промывают водой и сушат над сульфатом магния до получения (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-3- формилиндол-2-ил)карбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (1,44 г).
ИК (Нуйоль): 3200, 1678, 1640, 1580, 1445, 748 см-1.
ЯМР (ДМСО-d6, δ): 3,1-3,5 (2Н, м), 4,02 (1Н, кв. I = 10 Гц), 4,53 (1Н, т. I = 10 Гц), 5,58 (1Н, д, I = 7,5 Гц), 7,65-8,3 (11Н, м), 10,54 (1Н, с), 11,30 (1Н, д, I = 7,5 Гц), 12,95 (1Н, с)
Масс-спектр: м/е = 466 (М+)
П р и м е р 25. К суспензии (3RS)-3,4,6,7-тетрагидро-1-(2- фторфенил)-3-)(3-формилиндол-2-ил)карбониламино)-4-оксопирроло (3,2,1-jk) (1,4) бензодиазепина (466 мг) в ледяной уксусной кислоте (35 мл) добавляют последовательно гидроксиламингидрохлорид (208,5 мг) и ацетат натрия (246,1 мг) при перемешивании при комнатной температуре. Полученную смесь нагревают при перемешивании при 70оС в течение 8,5 ч и выпаривают при пониженном давлении. К остатку добавляют воду, и полученные осадки собирают фильтрованием и промывают водой дважды и холодным метанолом до получения (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил) -3)(3-гидроксииминометилиндол-2-ил)-карбониламино)-4-оксипирроло (3,2,1-jk) (1,4) бензодиазепина (379,1 мг).
Т. плавления: 50оС.
ЯМР (ДМСО-d6, δ): 3,1-3,5 (2Н, м), 4,00 (1Н, кв. I = 10 Гц), 4,53 (1Н, т, I = 10 Гц), 5,57 (1Н, д, I = 7,6 Гц), 7,05-8,6 (11Н, м), 8,97 (1Н, с)= 10,07 (1Н, д, I = 7,6 Гц)= 11,02 (1Н, с), 12,16 (1Н, с).
Масс-спектр: м/е = 481 (М+)
П р и м е р 26. К раствору (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2-аминофенил) пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (0,5 г) в хлороформе (30 мл) добавляют 6Н соляной кислоты и эфира (30 мл). Полученную смесь выпаривают при пониженном давлении. Остаток промывают этанолом трижды и диизопропиловым эфиром один раз. Остаток пульверизуют в диизопропиловый эфир, и полученную смесь перемешивают в течение 1 ч. Полученный порошок собирают фильтрованием, промывают диизопропиловым эфиром и сушат при пониженном давлении до получения (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3-(2-аминофенил) пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепингидрохлорида.
Т. плавления: 199-203оС (с разложением).
ИК (Нуйоль): 3600-3100, 2650-2100, 1670, 1610 см-1.
ЯМР (ДМСО-d6, δ): 3,1-3,62 (2Н, м), 3,9-4,0 (1Н, м), 4,45-4,55 (1Н, м), 5,41 (1Н, м, I = 8 Гц), 7,04-7,78 (15Н, м), 9,46 (1Н, д, I 8 Гц).
Масс-спектр: м/е = 440 (М+)
П р и м е р 27. По способу примера 26 получают следующее соединение: (3S)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)-3- (2-аминофенил)пропеноиламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепингидрохлорид.
Т. плавления: 190-195оС (с разложением).
ИК (Нуйоль): 3600-3100, 2600-2200, 1660, 1610 см-1
ЯМР (СДСl3, δ): 3,18-3,46 (2Н, м), 3,96-4,01 (1Н, м), 4,44-4,54 (1Н, м), 5,41 (1Н, д, I = 8 Гц), 7,04-7,78 (15Н, м), 9,45 (1Н, д, I = 8 Гц).
(α)D25: 46,81о (с = 0,848 МеОН).
Масс-спектр: м/е = 440 (М+ - 36).
Целевое соединение (1) и его фармацевтически приемлемые соли являются ССК антагонистами и поэтому являются полезными в качестве терапевтических агентов при рвоте, панкреатите и т. п.
Далее ожидается, что целевое соединение (1) и его фармацевтически приемлемые соли обладают желудочным антагонизмом и являются полезными в качестве терапевтического и/или профилактического агента при язвах, избыточной желудочной секреции, синдроме Золлингера-Эллисона и т. д.
Для того, чтобы показатель полезность целевого соединения (1), некотоыре фармакологические активности типичного соединения показаны ниже.
(1) Испытуемое соединение.
(1) (3RS)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2- индолилкарбониламино)-4-эксопирроло(3,2,1-jk) (1,4) бензодиазепин (здесь и далее упоминается как испытуемое соединение А).
(2) (3S)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2- индолилкарбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин (здесь и далее упоминается как испытуемое соединение В).
Соед. А. (3RS)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2- индолилкарбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Соед. В (3S)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2- индолилкарбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин.
Биологические испытания.
1) Испытываемые соединения:
а) (3RS)-1,3, -дигидро-1-метил-3-(2-индолилкарбониламино)-5- фенил-2Н-1,4-бензодиазепин-2-он (соединение патента США 4628084)
1) (3RS)-3-)(Е)-циннамоиламино-(1-1(2-фторфенил)-3,4,6,7- тетрагидро-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин (соединение примера 10 (3) в первоначальном английском описании).
2) (3RS)-3-)(Е)-циннамоиламино(-3,4,6,7-тетрагидро-1-фенил-4- оксопирроло(3,2,1-jk) (1,4) бензодиазепин соединение примера 10/6 (в английском описании).
3) (3RS)-3-)N-(2-хлорфенил)уреидо)1-(2-фторфенил)-3,4,6,7- тетрагидро-4-окоспирроло(3,2,1-jk) (1,4) бензодиазепин (соединение примера 11(4) в первоначальном английском описании).
4) (3RS)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-)N1-(3- метоксифенил)уреидо-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин (соединение примера 11/5) (в английском описании).
5) хлоргидрат (3RS)-3,4,6,7-тетрагидро-1-(2-фторфенил)-3-(Е)-3- (2-аминофенил)пропеноиламино)-4-окоспирроло(3,2,1-jk) (1,4) бензодиазепина (соединение примера 14/29) (в английском описании).
6) (хлоргидрат (3S)-3,5,6,7-тетрагидро-1-(2-фторфенил)-3-)(Е)- 3-(2-аминофенил)пропеноиламино-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепина (соединение примера 14/30) в первоначальном английском описании).
(11) Тест:
Антагонизм ССК рецептора в изолированной донной кольцевой мышце желудка морской свинки.
Методика испытания.
Полоску кольцевой мышцы, суспендированную в 25 мл ванны для органа, содержащей бикарбонатный раствор Кребса (NaCl 117 мм, KCl 4,8 мм, КН2РО4 1,2 мм, MgSO4 1,2 мм, CaCl2 2,5 мм, NaHCO3 25 мм, глюкоза 11 мм и бычий сывороточный альбумин 0,1% выдерживают при 37оС и продувают 95% О2 и 5% СО2.
Полоску помещают под исходное напряжение (растяжение) 0,5 г и уравновешивают в течение 60 мин, во время которых объем ванны заменяют каждые 15 мин. Измеряют изометрическую контракцию, используя преобразователь силы. Прибавляют ССК-8 (3,2 ˙10-7 М) к раствору ванны и измеряют сжимающую силу. После отмывки ССК-8 прибавляют испытуемое соединение. 5 мин спустя прибавляют ССК-8 и измеряют сжимающую силу. Вычисляют антагонизм ССК путем сравнения сжимающей силы, индукционированной ССК в отсутствие и в присутствии испытуемого соединения А.
Результаты испытаний:
Ингибирование (% ): 90,4
(В) Ингибирование связывания (125 I) ССК-8 с ССК рецепторами панкреатитных крыс испытуемым содинением в (ССК анатгонизм IC50 : 6,7 ˙10-10 М.
(С) Ингибирование связывания (125I) ССК-8 с ССК рецепторами мозговой коры испытуемым соединением В 3ССК антагонизм. IС50 : 3,1˙ 10-8М.
(Д) Ингибирующее действие испытуемого соединения В на индуциированный синькой панкреатит у мышей.
АД50 : 0,022 мг/кг
(Е) Действие испытуемого соединения на ингибирование вызванного ССК-8 опорожнения желудка у мышей (ССК антагонизм)
ЕД50 : 0,010 мг/кг
Ш) Результаты испытания:
Испытание на токсичность.
1. Испытываемое соединение:
(3S)-1-(2-фторфенил)-3,4,6,7-тетрагидро-3-(2- индолилкарбониламино)-4-оксопирроло(3,2,1-jk) (1,4) бензодиазепин (соединение примера 12/3) в первоначальном английском описании).
2. Методика испытания и результаты:
Десяти крысам штамм-SD орально даавли суспензию испытываемого соединения (100 мг/кг) в 0,5% метилцеллюлозе один раз в день в течение 14 дней. Все крысы во время периода испытания (14 дней) были живыми. (56) Патент США N 4157332, кл. C 07 D 487/04, 1979.
Заявка ЕР 0116911, кл. C 07 D 487/04, 1984.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2021990C1 |
| АНТИБИОТИЧЕСКАЯ КОМПОЗИЦИЯ | 1988 |
|
RU2029549C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2043365C1 |
| СОЕДИНЕНИЕ ЦЕФЕМА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1992 |
|
RU2024530C1 |
| ПРОИЗВОДНЫЕ ИНДОЛИЛПИПЕРИДИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2039056C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ПОСРЕДНИКОМ КОТОРЫХ ЯВЛЯЕТСЯ ТАХИКИНИН | 1991 |
|
RU2073683C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРАЗОЛПИРИДИНОВОГО ПРОИЗВОДНОГО ИЛИ ЕГО СОЛИ | 1990 |
|
RU2007403C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФЕМА | 1989 |
|
RU2007408C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ЦЕФЕМА ИЛИ ИХ КИСЛОТНО-АДДИТИВНЫХ СОЛЕЙ | 1988 |
|
RU2017744C1 |
| ПРОИЗВОДНЫЕ ИНДОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2045518C1 |

Использование: в качестве терапевтических агентов при желудочно-кишечных заболеваниях: рвоте, панкреатите. Сущность изобретения: продукт - производные бензодиазепина ф-лы 1, где R1-фенил, возможно замещенный фтором, X- -CH2 - или =CHR3, где R3-C1-C4-алкил, R2-2-индолилкарбонил, фенил(низший)алкеноил, который может быть замещен аминогруппой; или R2-фенилкарбамоил, который может быть замещен галогеном или низшей алкоксигруппой, или их фармацевтически приемлемые соли. Предпочтительный продукт: (3S)-1-(2-фторфенил)-3, 4, 6, 7-тетрагидро-3-(2-индолилкарбониламино)-4-оксопирроло(3, 2, 1 - jk)(1,4)-бензодиазепин. Структура ф-лы 1. 1 з. п. ф-лы, 1 табл. 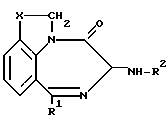
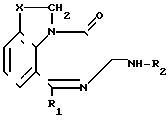
где R1 - фенил, который может быть замещен фтором;
X-CH2- или /CHR3,
где R3 - C1 - C4-алкил;
R2-2-индолилкарбонил, фенил(низший)алкеноил, который может быть замещен аминогруппой или низшей алканоиламиногруппой или R2 - фенилкарбамоил, который может быть замещен галогеном или низшей алкоксигруппой,
или их фармацевтически приемлемые соли.
Приоритеты по признакам:
09.09.88 при R2-2-индолилкарбонил.
Авторы
Даты
1994-02-15—Публикация
1989-09-08—Подача