Изобретение касается нового пиразолпиридинового производного или его фармацевтически пригодной соли, которые являются антагонистами аденозина и обладают различными фармацевтическими действиями, например когнитивным усиливающим действием, обезболивающим действием, опорно-двигательным действием, действием как антидепрессанта, расширяющим сосуды головного мозга действием, мочегонным действием, кардиотоническим действием, способностью повышать скорость прохождения крови в почках, способностью повышать липолиз и целым рядом других ценных свойств.
Новое пиразолпиридиновое соединение, отвечающее данному изобретению, может быть представлено формулой I 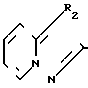 R1 где R1 - фенил;
R1 где R1 - фенил;
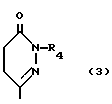
R2 - группа формулы
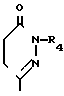
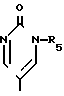
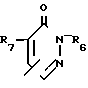
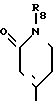 или
или 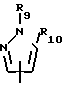
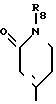
R3 - низший алкил, гидрокси (низший алкил), низший алкокси (низший) алкил, карбокси (низший) алкил, низший алкоксикарбонил (низший) алкил, карбамоил (низший) алкил или N, N-ди (низший) алкилкарбамоил (низший) алкил, где две низшие алкильные группы у атома азота могут быть соединены друг с другом, образуя пипеpидиновое кольцо,
R4 - карбокси (низший) алкил или низший алкоксикарбонил (низший) алкил; R5 - низший алкоксикарбонил (низший) алкил; R6 - низший алкил, карбокси (низший) алкил или низший; алкоксикарбонил (низший) алкил; R7 - водород, карбокси, низший алкоксикарбонил или циано; R8 - карбокси (низший) алкил или низший алкоксикарбонил (низший) алкил; R9 - низший алкил, карбокси (низший) алкил или низший алкоксикарбонил (низший) алкил; R10 - водород или гидрокси.
Известно взаимодействие алкилов с галогенпроизводными (1).
Цель изобретения - синтез новых соединений в ряду пиразолпиридинов по своим свойствам превосходящих структурных аналог, обладающий тем же видом активности.
Поставленная цель достигается предлагаемым способом получения соединений общей формулы 1, заключающимся в том, что соединение общей формулы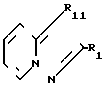 где R1 имеет указанные значения,
где R1 имеет указанные значения,
R2 является группой формулы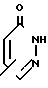
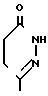
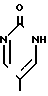
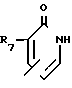
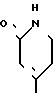 или
или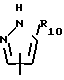 где R7 и R10, каждый, имеет значения, определенные выше, или его соль, подвергают реакции с соединением формулы
где R7 и R10, каждый, имеет значения, определенные выше, или его соль, подвергают реакции с соединением формулы
QY где Q имеет значения R3, R4, R5, R6, R8 и R9, Y - удаляемая группа и, при необходимости, в полученном соединении, где R3, R4, R5, R6, R8 и R9, каждый представляет низший алкоксикарбонил (низший) алкил, удаляют низшую алкильную группу с получением соединения формулы I, где R3, R4, R5, R6, R8 и R9 представляет собой, каждый карбокси (низший) алкил с выделением целевого продукта в свободном виде или в виде соли.
П р и м е р 1. Этилхлорформиат (3,38 г) прибавляют по каплям при перемешивании к раствору 2-фенилпиразоло(1,5- α )пиридина (2,54 г) и пиридазина (5,00 г) в метиленхлориде (5,0 мл) при 10оС. После перемешивания при температуре 10оС в течение 1 ч и затем при комнатной температуре в течение 2 ч реакционную смесь выливают в ледяную воду (100 мл) и экстрагируют этилацетатом. Объединенные экстракты промывают насыщенным водным раствором хлорида натрия (100 мл), сушат в присутствии сульфата магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (150 г) смесью хлороформа и н-гексана (1: 1) в качестве элюанта. Фракции, содержащие головной продукт (соединение (А)), объединяют и упаривают в вакууме с получением 3-(1-этоксикарбонил-1,4-дигидропиридазин-4-ил)-2-фенилпиразоло(1,5- α )пиридина (2,42 г); температура плавления 173-174оС.
ИК (Nujol): 1740, 1700, 1670, 1635, 1615 см-1.
ЯМР (CDCl3, δ ): 1,40 (3Н, т, J = 7,0 Гц), 4,43 (2Н, кв, J = 7,0 Гц), 4,48-4,70 (1Н, м), 5,03 (1Н, дт, J = 8,5 Гц и 3,0 Гц), 6,67-7,82 (10Н, м), 8,50 (1Н, дд, J = 7,0 Гц и 1,0 Гц).
Фракции, содержащие побочный продукт (соединение (В)), объединяют и упаривают в вакууме с получением 3-(2-этоксикарбонил-2,3-дигидро- пиридазин-3-ил)-2-фенилпиразоло(1,5- α)-пиридина (0,39 г); температура плавления 150-152оС;
ИК (Nujol): 1720, 1635 см-1.
ЯМР (CDCl3, δ ): 1,16 (3Н, т, J = 7,0 Гц), 4,18 (2Н, кв, J = 7,0 Гц), 5,67-7,95 (12Н, м), 8,48 (1Н, дд, J = 7,0 Гц и 1,0 Гц).
П р и м е р 2. Воздух барботируют в смесь 3-(1-этоксикарбонил-1,4-дигидропиридазин-4-ил)-2-фенилпиразоло(1,5- α)пиридина (1,12 г) и трет-бутоксида калия (1,18 г) в трет-бутаноле (25 мл) при 50оС в течение 10 мин.
Трет-бутанол упаривают в вакууме и к остатку прибавляют ледяную воду (50 мл). Смесь экстрагируют хлороформом (30 мл, три раза). Объединенные экстракты промывают насыщенным водным раствором хлорида натрия (50 мл), сушат в присутствии сульфата магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (20 г) с хлороформом в качестве элюента. Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме с получением 3-(пиридазин-4-ил)-2-фенилпиразоло/1,5- α /пиридина (0,35 г); температура плавления 204-205оС; ИК (Nujol): 1630, 1580, 1515 см-1.
ЯМР (ДМСО-d6, δ ): 6,97-8,00 (9Н, м), 8,85 (1Н, д, J = 7,0 Гц), 9,03-9,27 (2Н, м).
Вычислено, % : С 74,98; Н 4,44; N 20,58.
С17Н12N4.
Найдено, % : С 75,27; Н 4,63; N 20,38.
П р и м е р 3. 3-(Пиридин-4-ил)-2-фенилпиразоло/1,5- α /пиридин получают в соответствии с методиками примера 1 и примера 2; температура плавления: 166-167оС; ИК (Nujol): 1630, 1600, 1530 см-1.
ЯМР (CDCl3, δ ): 6,83 (1Н, дт, J = 1,5 Гц и 7,0 Гц), 7,20-7,83 (9Н, м), 8,45-8,83 (3Н, м).
Вычислено, % : С 79,68, Н 4,83; N 15,49. С18Н13N3.
Найдено, % : С 80,20; Н 4,86; N 15,56.
П р и м е р 4. Смесь 3-ацетил-2-фенилпиразоло/1,5- α /пиридина (40,00 г) и моногидрата глиоксаловой кислоты (20,27 г) перемешивают и нагревают при 100оС в течение 2,5 ч. Реакционную смесь растворяют в смеси этилацетата (220 мл) и водной гидроокиси натрия (12% , 220 мл). Водный слой промывают 100 мл хлороформа, затем подкисляют 10% -ным водным раствором хлористоводородной кислоты. Смесь экстрагируют хлороформом (150 мл х 2). Экстракты соединяют, промывают насыщенным водным раствором хлорида натрия. Растворитель упаривают и остаток (39,8 г) растворяют в водном растворе аммиака (120 мл), и к раствору прибавляют моногидрат гидразина (42 г). Смесь кипятят с обратным холодильником в течение 2 ч. Преципитаты собирают фильтрацией с получением 3-(3-оксо-2,3-дигидропиридазин-6-ил)-2-фенилпиразоло/1,5- α/пиридина (14,45 г); температура плавления 212-214оС.
ИК (Nujol): 1660, 1625, 1580, 1510 см-1.
ЯМР (CDCl3, δ ): 6,87 (1Н, д, S = 11 Гц), 7,00 (1Н, тд, J = 7 Гц и 1 Гц), 7,08 (1Н, д, J = 11 Гц), 7,23-7,73 (6Н, м), 7,83 (1Н, д, J = 8 Гц), 7,77 (1Н, д, J = 7 Гц).
Вычислено, % : С 70,82; Н 4,20; N 19,43. С17Н12N4О.
Найдено, % : С 70,75; Н 4,83; N 19,24.
П р и м е р 5. Смесь 3-(3-оксо-2,3-дигидропиридазин-6-ил)-2-фенилпиразоло/1,5-α /пиридина (0,43 г), метилакрилата (1,29 г), 40% гидроокиси метанолового триметилбензиламмония (0,4 мл) и метанола (2 мл) в хлороформе (8 мл) нагревают с обратным холодильником в течение 40 мин и затем упаривают в вакууме. К остатку прибавляют метиленхлорид (30 мл) и воду (30 мл), и органический слой выделяют, сушат в присутствии сульфата магния и упаривают в вакууме. Кристаллический остаток перекристаллизовывают из смеси этилацетата и простого диэтилового эфира с получением 3-/2-(2-метоксикарбонилэтил)-3-оксо-2,3- дигидропиридазин-6-ил/ -2-фенилпиразоло/1,5- α /пиридина (0,37 г); температура плавления: 133-133,5оС.
ИК (Nujol): 1730, 1660, 1585 см-1.
ЯМР (CDCl3, δ ): 2,90 (2Н, т, J = 6 Гц), 3,67 (3Н, с), 4,57 (2Н, т, J = 6 Гц), 6,70 (1Н, д, J = 9 Гц), 6,87 (1Н, т. J = 7 Гц), 7,00 (1Н, д, J = 9 Гц), 7,17-7,73 (6Н, м), 8,00 (1Н, д, J = 9 Гц), 8,50 (1Н, д, J = 7 Гц).
Масс-спектр (М+): 374.
Вычислено, % : С 67,37; Н 4,85; N 14,96. С21Н18N4O2
Найдено, % : С 67,31, Н 5,35; N 14,94.
П р и м е р 6. Смесь 3-/2-(2-метоксикарбонилэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (1,94 г) и 24% водного раствора гидроокиси натрия (2 мл) в метанолe (8 мл) нагревают с обратным холодильником в течение 30 мин и затем упаривают в вакууме. Остаток растворяют в воде (30 мл), и водный раствор подкисляют хлористоводородной кислотой и экстрагируют хлороформом (25 мл). Экстракт сушат в присутствии сульфата магния и упаривают в вакууме. Остаток перекристаллизовывают из смеси этанола и н-гексана с получением 3-/2-(2-карбоксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (1,24 г); температура плавления 155,5-156оС.
ИК (Nujol): 1835, 1640, 1570, 1520, 1490 см-1.
ЯМР (CDCl3, δ ): 2,97 (2Н, т, J = 7 Гц), 4,60 (2Н, т, J = 7 Гц), 6,15-7,00 (1Н, шир. д), 6,75-7,70 (9Н, м), 8,00 (1Н, д. J = 9 Гц), 8,53 (1Н, д, J = 7 Гц).
Масс-спектр (М+): 360.
Вычислено, % : С 66,66; Н 4,47, N 15,55. С20Н16N4O3.
Найдено, % : С 66,61, Н 4,61, N 15,50.
П р и м е р 7. К смеси 3-/2-(2-карбоксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (10,0 г), этанола (100 мл) и воды (10 мл) прибавляют раствор гидроокиси натрия (1,11 г) в смеси этанола (40 мл) и воды (15 мл). Реакционную смесь нагревают с обратным холодильником в течение 2 ч с получением прозрачного раствора, затем данный раствор охлаждают. Полученное твердое тело собирают фильтрацией и промывают 85% этанолом (8 мл) и перекристаллизовывают дважды из 83% этанола (48 мл) с получением кристаллов натриевой соли 3-/2-(2-карбоксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2-фенил- пиразоло/ 1,5- α /пиридина (5,13 г); температура плавления: 271-272оС.
ИК (Nujol): 3400, 1670, 1610, 1580, 1530 см-1.
ЯМР (ДМСО-d6, δ ): 2,45 (2Н, т, J = 8 Гц), 4,29 (2Н, т, J = 8 Гц), 6,81 (1Н, д, J = 9 Гц), 7,02 (1Н, д, J = 9 Гц), 7,07 (1Н, тд, J = 7 Гц и 1 Гц), 7,40-7,63 (6Н, м), 8,02 (1Н, д, J = 9 Гц), 8,80 (1Н, д, J = 7 Гц).
Масс-спектр: 360 (М+).
Вычислено, % : С 58,67; Н 4,43; N 13,69. С20Н15N4O3Na ˙3/2 H2O
Найдено, % : С 58,49; Н 4,27, N 13,96.
П р и м е р 8. К смеси 3-хлорпиридазина (0,66 г), 2-фенилпиразоло-/1,5-/пиридина (1,12 г) и хлороформа (6,6 мл) прибавляют этилхлороформиат (1,38 г) при охлаждении на льду и перемешивают в течение 2 ч при комнатной температуре. К реакционной смеси прибавляют метиленхлорид (10 мл). Раствор промывают насыщенным водным раствором кислого углекислого натрия (10 мл) и сушат в присутствии сульфата магния. Органический слой упаривают в вакууме и перекристаллизовывают из смеси этилацетата и 2-пропанола с получением 3-(3-хлор-1-этоксикарбонил-1,4-дигидропиридазин-4-ил)-2- фенилпиразоло/1,5- α /-пиридина (1,60 г); температура плавления: 129,5-131,5оС.
ИК (Nujol): 1715, 1675, 1630 см-1.
ЯМР (СDCl3, δ ): 1,42 (3Н, т, J = 7,1 Гц), 4,42 (2Н, кв, J = 7,1 Гц), 4,80 (1Н, дд, J = 1,6 Гц и 3,6 Гц), 5,00 (1Н, дд, J = 3,6 Гц и 8,2 Гц), 6,86 (1Н, дт, J = 1,4 Гц и 6,8 Гц), 7,15-7,69 (8Н, м), 8,51 (1Н, дд, J = 1,0 Гц и 7,0 Гц).
Вычислено, % : С 63,08; Н 4,50; N 14,71. С20Н17ClN4O2
Найдено, % : С 63,04; Н 4,52; N 14,50.
Следующие соединения (примеры 9 и 10) получены в соответствии с примером 8.
П р и м е р 9. 3-(3-Ацетил-1-этоксикарбонил-1,4-дигидропиридин-4-ил)-2-фенил- пиразоло /1,5- α /пиридин; температура плавления 151-153оС.
ИК (Nujol): 1735, 1660, 1610 см-1.
ЯМР (CDCl3, δ ): 1,32 (3Н, т, J = 7,5 Гц), 2,05 (3Н, с), 4,32 (2Н, кв, J = 7,5 Гц), 4,84 (1Н, д, J = 4,0 Гц), 5,15 (1Н, дд, J = 8,0 Гц и 4,0 Гц), 6,75 (1Н, д, J = 8,0 Гц), 6,80 (1Н, т, J = 7,5 Гц), 7,15 (1Н, т, J 7,5 Гц), 7,16-7,75 (6Н, м), 7,82 (1Н, с), 8,58 (1Н, д, J = 7,5 Гц); Масс-спектр: 387 (М+): 344, 314, 300, 269, 241.
П р и м е р 10. 3-(3-Циано-1-этоксикарбонил-1,4-дигидропиридин-4-ил)-2-фенил- пиразоло/ 1,5- α /пиридин; температура плавления: 182-183оС.
ИК (Nujol): 2215, 1740, 1680, 1620 см-1.
ЯМР (CDCl3, δ ): 1,31 (3Н, т, J = 7,5 Гц), 4,29 (2Н, кв, J 7,5 Гц), 4,75 (1Н, м), 5,14 (1Н, дд, J = 9,0 Гц), и 3,0 Гц), 6,80 (1Н, д, J = 9,0 Гц), 6,93 (1Н, т, J = 7,5 Гц), 7,27 (1Н, т, J 7,5 Гц), 7,36-7,70 (7Н, м), 8,70 (1Н, д, J = 7,5 Гц).
Масс-спектр: 370 (М+), 342, 325, 297, 270.
П р и м е р 11. К смеси 2-фенилпиразоло/1,5- α /пиридина (5,00 г), 3-метилпиридазина (2,90 г) и метиленхлорида (20 мл) прибавляют раствор этилхлорформиата (5,57 г) в метиленхлориде в течение 17 мин при охлаждении на льду и перемешивают в течение 1 ч при такой же температуре и затем в течение 6 ч и 40 мин при комнатной температуре. К реакционной смеси прибавляют метиленхлорид (20 мл) и промывают раствором карбоната калия (10 мл) и насыщенным водным раствором хлористого натрия (10 мл) и сушат в присутствии сульфата магния. Растворитель удаляют и остаток хроматографируют на силикагеле (70 г) со смесью н-гексана и этилацетата (2: 1). Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме и перекристаллизовывают из смеси этилацетата и н-гексана с получением 3-(3-метилпиридазин-4-ил)-2-фенилпиразоло/1,5- α/пиридина (2,36 г); температура плавления: 209-214оС.
ИК Nujol): 1630, 1610 см-1.
ЯМР (CDCl3, δ ): 246 (3Н, с), 6,98 (1Н, т, J = 7,5 Гц), 7,19-7,58 (7Н, м), 7,91 (1Н, д, J = 6,0 Гц), 8,58 (1Н, д, J = 7,5 Гц), 9,32 (1Н, д, J = 6,0 Гц).
Масс-спектр: 286 (М+), 257, 231, 218.
Следующие соединения (примеры 12 и 13) получают в соответствии с примером 11.
П р и м е р 12. 3-(5-Метилпиридазин-4-ил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 158-159,5оС.
ИК (Nujol): 3080, 1630 см-1.
ЯМР (CDCl3, δ ): 1,90 (3Н, с), 6,80 (1Н, т, J = 7,5 Гц), 7,12-7,50 (7Н, м), 8,51 (1Н, д, J = 7,5 Гц), 8,99 (2Н, с).
Масс-спектр: 286 (М+), 257, 243, 218.
Вычислено, % : С 75,50; Н 4,93; N 19,57.
С18Н14N4.
Найдено, % : С 75,22; Н 5,09; N 19,26.
П р и м е р 13. 3-(Пиримидин-4-ил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 130-131оС.
ИК Nujol): 1625, 1580 см-1.
ЯМР (CDCl3, δ ): 6,96-7,06 (2Н, м), 7,35-7,64 (6Н, м), 8,40 (1Н, д, J = 5,4 Гц), 8,22-8,61 (2Н, м), 9,22 (1Н, д, J = 1,3 Гц).
Масс-спектр: 271 (М+), 244, 217.
Вычислено, % : С 74,98; Н 4,44; N 20,57.
С17Н12N4.
Найдено, % : С 74,87; Н 4,62; N 20,33
П р и м е р 14. Смесь 2-фенилпиразоло/1,5- α /пиридина (0,50 г), 2,4-пиперидиндиона (0,292 г), концентрированной серной кислоты (1 капля) и уксусной кислоты (0,5 мл) нагревают при 135оС в течение 13,5 ч. В реакционную смесь прибавляют насыщенный водный раствор кислого углекислого натрия (20 мл) и смесь экстрагируют хлороформом (20 мл х 2). Объединенный экстракт промывают насыщенным водным раствором хлорида натрия (20 мл) и сушат в присутствии сульфата магния. Растворитель упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформа и этилацетата (9: 1) и перекристаллизовывают из этилацетата с получением кристаллов 3-(2-оксо-1,2,5,6-тетрагидропиридин-4-ил)-2-фе- нилпиразоло/1,5-α /пиридина; температура плавления: 188-189оС.
ИК (Nujol): 1655, 1630, 1605 см-1.
ЯМР (CDCl3, δ ): 2,44 (2Н, т, J = 6,5 Гц), 3,44 (2Н, т, J = 6,5 Гц), 6,20 (2Н, с), 6,86 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,20-7,75 (7Н, м), 8,50 (1Н, дт, J = 7,0 Гц и 1,0 Гц).
Вычислено, % : С 74,72; Н 5,23; N 14,53.
С18Н15N3O.
Найдено, % : С 75,13; Н 5,33; N 14,69.
П р и м е р 15. Раствор 3-(3-N, N-диметиламиноакрилоил)-2-фенилпиразоло/1,5- α/ пиридина (0,63 г) гуанидин-гидрохлорида (0,31 г), этилата натрия (0,54 г) и этанола (9 мл) нагревают с обратным холодильником в течение 2 ч. К реакционной смеси прибавляют воду (30 мл) и смесь экстрагируют этилацетатом (60 мл). Органический слой упаривают, после чего остаток перекристаллизовывают из этанола с получением 3-(2-аминопиримидин-4-ил)-2-фенил-пиразоло/1,5- α /пиридина (0,40 г); температура плавления: 222,5-223оС.
ИК (Nujol): 3370, 3320, 3180, 1640, 1560 см-1.
ЯМР (CDCl3, δ): 6,14 (1Н, д, J = 4,8 Гц), 6,52 (2Н, с), 7,05 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 8,53 (1Н, д, J = 8,0 Гц), 8,76 (1Н, д, J = 7,0 Гц).
Масс-спектр: 286.
Вычислено, % : С 71,07; Н 4,56; N 24,37.
С17Н13N5.
Найдено, % : С 70,93; Н 4,59; N 23,74.
П р и м е р 16. Смесь 3-(2-фенилпиразоло/1,5-α /пиридин-3-ил)акрилальдегида (цис- и транс-смесь) (1,15 г) и 1-карбамоилметилпиридинийхлорида (0,80 г), 50% водного диметиламина (0,44 г) и метанола (10 мл) нагревают с обратным холодильником в течение 3 ч. Реакционную смесь упаривают в вакууме и остаток нагревают в течение 10 мин при 200оС. Полученную смесь хроматографируют на силикагеле (80 г) со смесью хлороформа и метанола (100: 1). Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме и перекристаллизовывают из этанола с получением 3-(2-оксо-1,2-дигидропиридин-4-ил)-2-фе- нилпиразоло/1,5-пиридин (0,33 г).
ИК (Nujol): 1655, 1580 см-1.
ЯМР (ДМСО-d6, δ ): 5,72 (1Н, дд. J = 1,8 Гц и 6,8 Гц), 6,30 (1Н, д, J = 1,2 Гц), 7,40 (1Н, дт, J = 1,3 Гц и 6,8 Гц), 7,33-7,62 (7Н, м), 7,73 (1Н, д, J = 9,0 Гц), 8,80 (1Н, д, J = 7,0 Гц), 11,52 (1Н, шир. синглет).
Масс-спектр: 286 (М+ -1), 268.
Вычислено, % : С 73,60; Н 4,69; N 14,30.
С18Н13N3O ˙ 1/3 H2O
Найдено, % : С 73,70; Н 4,82, N 14,28.
П р и м е р 17. Смесь 4-оксо-4-(2-фенилпиразоло/1,5- α/пиридин-3-ил)-масляной кислоты (1,71 г), моногидрата гидразина (1,46 г) и этанола (17 мл) нагревают с обратным холодильником в течение 1 ч. Этанол упаривают в вакууме. К остатку прибавляют воду (20 мл), подкисляют 5% хлористоводородной кислотой и экстрагируют хлороформом (25 мл х 3). Объединенный экстракт промывают насыщенным водным раствором хлорида натрия, сушат в присутствии сульфата магния и упаривают в вакууме. Остаток перекристаллизовывают из этанола с получением кристаллов 3-(3-оксо-2,3,4,5-тетрагидропиридазин-6-ил)-2-фенилпира- золо/1,5- α/пиридина (1,19 г); температура плавления: 187-189оС.
ИК (Nujol): 3325, 1675, 1630 см-1.
ЯМР (ДМСО- α6, δ ): 2,29-2,51 (4Н, м), 7,05 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,37-7,68 (6Н, м), 7,96 (1Н, д, J = 9,0 Гц), 8,78 (1Н, д, J = 7,0 Гц).
Вычислено, % : С 70,33; Н 4,86; N 19,30.
С17Н14N4O.
Найдено, % : С 70,27; Н 4,72; N 19,17.
П р и м е р 18.
Смесь метил 3-(2-фенилпиразоло/1,5- α /пиридин-3-ил)-пропиолата (1,50 г), моногидрата гидразина ); (0,544 г) и этанола (15 мл) нагревают с обратным холодильником в течение 2 ч. Этанол упаривают в вакууме. К остатку прибавляют воду (50 мл) и смесь подкисляют 1 н. раствором хлористоводородной кислоты. Полученные преципитаты собирают фильтрацией и промывают водой. Перекристаллизация из смеси N, N-диметилформамида и воды приводит к получению кристаллов 3-(5-гидроксипиразол-3-ил)-2-фенил-пирa- золо-/1,5- α /пиридина (0,64 г); температура плавления: свыше 300оС.
ИК (Nujol): 2670, 2570, 1640, 1610 см-1.
ЯМР (ДМСО-d6, δ ): 5,43 (1Н, с), 6,97 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,21-7,80 (7Н, м), 8,73 (1Н, д, J = 7,0 Гц).
Вычислено, % : С 69,55; Н 4,38; N 20,28.
С16Н12N4O.
Найдено, % : С 69,46; Н 4,35; N 19,99.
П р и м е р 19. Смесь 3-(2-бромацетил)-2-фенилпиразоло/1,5- α /пиридина (1,87 г), 2-амино-5-метил-1,3,4-тиадиазола (0,68 г) и 1-бутанола (19 мл) нагревают с обратным холодильником в течение 5 ч и 20 мин. Реакционную смесь упаривают в вакууме и остаток берут в метиленхлориде (40 мл). Раствор метиленхлорида промывают водным раствором карбоната калия и сушат в присутствии сульфата магния. Растворитель удаляют и остаток подвергают хроматографии на силикагеле (25 г) с хлороформом в качестве элюента. Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме с получением 3-(2-метилимидазо/2,1- α/1,3,4/-тиадиазол-6-ил-2-фенилпиразоло/1,5- α /пиридина (1,06 г), который перекристаллизовывают из ацетона с получением кристаллов (0,69 г); температура плавления: 204оС.
ИК (Nujol): 3130, 3100, 1635, 1590 см-1.
ЯМР (CDCl3, δ ): 2,65 (3Н, с), 6,75 (1Н, т, J = 7,5 Гц), 7,13 (1Н, т, J = 7,5 Гц), 7,25-7,50 (4Н, м), 7,55-7,80 (2Н, м), 8,14 (1Н, д, J = 9,0 Гц), 8,40 (1Н, д, J = 7,5 Гц).
Масс-спектр: 302 (М+), 261, 221, 193.
Вычислено, % : С 62,24; Н 3,95; N 21,33.
С18Н13N3S.
Найдено, % : С 65,58; Н 3,98; N 21,25.
П р и м е р 20. Смесь 3-(N, N-диметиламино)-2-(2-фенилпиразоло/1,5- α /пиридин-3-ил)акрилальдегида (цис- и транс-смесь) (4,00 г), 2-цианоацетамида (2,31 г), этилата натрия (4,67 г) и этанола (40 мл) нагревают с обратным холодильником в течение 2 ч. После охлаждения реакционной смеси осуществляют прибавление уксусного ангидрида (24 мл) и воды (120 мл), и полученную смесь перемешивают при комнатной температуре. Полученные преципитаты собирают и перекристаллизовывают из смеси N, N-диметилформамида и воды с получением 3-(3-циано-2-оксо-1,2-дигидропиридин-5-ил)-2-фенилпиразоло/1,5- α /пиридина (2,08 г); температура плавления: 312-314оС.
ИК (Nujol): 2240, 1670, 1540 см-1.
ЯМР (ДМСО-d6, δ ): 6,93 (1Н, т, J ) 7,5 Гц), 7,27 (1Н, т, J = 7,5 Гц), 7,33-7,72 (8Н, м), 8,03 (1Н, д, J = 7,5 Гц), 8,71 (1Н, д, J = 7,5 Гц).
Масс-спектр: 312 (М+), 283.
Вычислено, % : С 73,07; Н 3,87; N 17,94.
С19Н12NO.
Найдено, % : С 72,96; Н 4,19; N 17,83.
П р и м е р 21. Смесь 3-(N, N-диметиламино)-2-(2-фенилпиразоло/1,5- α/пиридин-3-ил)акрилальдегида (0,70 г), моногидрата гидразина (0,18 г) и этанола (7 мл) нагревают с обратным холодильником в течение 4 ч. К реакционной смеси прибавляют воду (12 мл) и перемешивают в течение определенного времени при охлаждении на льду. Преципитаты собирают и перекристаллизовывают из смеси этанола и воды с получением 3-(4-пиразолил)-2-фенилпиразоло/1,5- α/пиридина (0,51 г); температура плавления 188-190оС.
ИК (Nujol): 3150, 1630 см-1.
ЯМР (CDCl3, δ ): 6,75 (1Н, т, J = 7,5 Гц), 7,10 (1Н, т, J = 7,5 Гц), 7,25-7,80 (9Н, м), 8,57 (1Н, д, J = 7,5 Гц).
Масс-спектр: 260 (М+), 232, 205.
Вычислено, % : С 73,83; Н 4,65; N 21,52.
С16Н12N4.
Найдено, % : С 73,49; Н 5,01; N 21,18.
Следующие соединения (примеры 22-25) получают в соответствии с примером 21.
П р и м е р 22. 3-(1-Метилпиразол-4-ил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 100-103оС.
ИК (Nujol): 1630 см-1.
ЯМР (CDCl3, δ ): 3,90 (3Н, с), 6,70 (1Н, т, J = 7,5 Гц), 7,07 (1Н, т, J = 7,5 Гц), 7,21-7,46 (5Н, м), 7,48 (1Н, с), 7,60-7,80 (2Н, м), 8,43 (1Н, д, J = 7,5 Гц).
Масс-спектр: 274 (М+), 246.
Вычислено, % : С 74,43; Н 5,14; N 20,42.
С17Н14N4.
Найдено, % : С 74,64; Н 5,46; N 20,36.
П р и м е р 23. 3-(5-Пиримидинил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 163-165оС.
ИК (Nujol): 1625 см-1.
ЯМР (CDCl3, δ ): 6,83 (1Н, т, J = 7,5 Гц), 7,18 (1Н, т, J = 7,5 Гц), 7,25-7,60 (6Н, м), 8,51 (1Н, д, J = 7,5 Гц), 8,70 (2Н, с), 9,10 (1Н, с).
Масс-спектр: 272 (М+), 244, 218.
Вычислено, % : С 74,98; Н 4,44; N 20,57.
С17Н12N4.
Найдено, % : С 75,14, Н 5,04, N 20,42.
П р и м е р 24. 3-(2-Метилпиримидин-5-ил)-2-фенилпиразоло/1,5- α /пиридин, температура плавления: 152-153оС.
ИК (Nujol): 3030-3100, 1635 см-1.
ЯМР (CDCl3, δ ): 2,73 (3Н, с), 6,80 (1Н, т, J = 7,5 Гц), 7,18 (1Н, т, J = 7,5 Гц), 7,20-7,65 (6Н, м), 8,50 (1Н, д, J = 7,5 Гц), 8,60 (2Н, с).
Масс-спектр: 286 (М+), 244, 218.
Вычислено, % : С 75,51; Н 4,93; N 19,57.
С18Н14N4.
Найдено, % : С 75,38; Н 5,14; N 19,16.
П р и м е р 25. 3-(2-Аминопиримидин-5-ил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 304-305оС.
ИК (Nujol): 3400-3050, 1660, 1605 см-1.
ЯМР (ДМСО-d6, δ ): 6,43 (2Н, с), 6,68 (1Н, т, J = 7,5 Гц), 7,02 (1Н, т, J = 7,5 Гц), 7,07-7,45 (6Н, м), 7,93 (2Н, с), 8,48 (1Н, д, J = 7,5 Гц).
Масс-спектр: 287 (М+), 246, 218.
Вычислено, % : С 71,07; Н 4,56; N 24,37.
С17Н13N5.
Найдено, % : С 71,23; Н 4,88; N 24,04.
П р и м е р 26. Смесь 3-(3-оксо-2,3-дигидропиридазин-6-ил)-2-фенилпи- разоло/1,5- α/пиридина (0,47 г), этил-4-бромбутирата (0,32 г). Тритона В (0,5 мл) и хлороформа перемешивают в течение 2 дней при комнатной температуре. Реакционную смесь упаривают и остаток подвергают колоночной хроматографии на силикагеле (20 г) с хлороформом в качестве элюента. Фракции, содержащие целевое соединение, объединяют (20 мл) и концентрируют при пониженном давлении. Остаток растворяют в этилацетате и отфильтровывают. Фильтр упаривают с получением 3-2-(3-этоксикарбонилпропил)-3-оксо-2,3-дигидро- пиридазин-6-ил(-2- фенилпиразоло/1,5- α /пиридина (0,49 г); температура плавления: 71-75оС.
ИК (Nujol): 1730, 1660, 1630, 1590, 1525 см-1.
ЯМР (CDCl3, δ ): 1,25 (3Н, т, J = 6 Гц), 2,00-2,60 (4Н, м), 4,00-4,45 (4Н, Нех), 6,77 (1Н, д, J = 10 Гц), 6,92 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,03 (1Н, д, J = 10 Гц), 7,25-7,80 (6Н, м), 8,00 (1Н, д, J = 9,0 Гц), 8,52 (1Н, д, J = 7,0 Гц).
Масс-спектр: 402.
Вычислено, % : С 68,64; Н 5,51; N 13,92.
С23Н22N4O3.
Найдено, % : С 68,79; Н 5,78; N 13,72.
Следующие соединения (примеры 27-32) получены в соответствии с примером 26.
П р и м е р 27. 3-(2-Метоксикарбонилметил-3-оксо-2,3-дигидропиридазин-6-ил)-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 142,5-143оС.
ИК (Nujol): 1740, 1670, 1630, 1590 см-1.
ЯМР (CDCl3 , δ ): 3,82 (3Н, с), 4,99 (2Н, с), 6,75 (1Н, д, J = 10 Гц), 6,87 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,03 (1Н, д, J = 10,0 Гц), 7,18-7,75 (6Н, м), 7,93 (1Н, д, J = 8,0 Гц), 8,50 (1Н, д, J = 7,0 Гц).
Масс-спектр: 360 (М+).
Вычислено, % : С 66,66; Н 4,47; N 15,55.
C20Н16N4O3.
Найдено. % : С 66,69; Н 4,47; N 15,75.
П р и м е р 28. 3-(2-Метил-3-оксо-2,3-дигидропиридазин-6-ил)-2-фенил-пиразоло/1,5- α /пиридин; температура плавления: 145-145,5оС.
ИК (Nujol): 1675, 1585 см-1.
ЯМР (CDCl3, ν): 3,89 (3Н, с), 6,72 (1Н, д, J = 9 Гц), 6,88 (1Н, тд, J = 6 Гц и 1 Гц), 7,00 (1Н, д, J = 9,0 Гц), 7,15-7,70 (6Н, м), 7,97 (1Н, д, J = 9,0 Гц), 8,50 (1Н, д, J = 8,0 Гц).
Масс-спектр: 302.
Вычислено, % : С 71,51; Н 4,67; N 18,53.
С18Н14N4O.
Найдено, % : С 71,60; Н 4,58; N 18,65.
П р и м е р 29. 3-(2-Пропил-3-оксо-2,3-дигидропиридазин-6-ил)-2-фенил-пиразо- ло/1,5- /пиридин; температура плавления: 110-110,5оС.
ИК (Nujol): 1660, 1590, 1530 см-1.
ЯМР (CDCl3, δ): 1,05 (3Н, т, J = 7,0 Гц), 1,95 (2Н, Нех, J = 7,0 Гц), 4,23 (2Н, т, J = 7,0 Гц), 6,72 (1Н, д, J = 10 Гц), 6,87 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 6,97 (1Н, д, J = 10 Гц), 7,17-7,70 (6Н, м), 7,93 (1Н, д, J = 10 Гц), 8,50 (1Н, д, J Гц).
Масс-спектр: 330.
Вычислено, % : С 72,71; Н 5,49; N 16,69.
С20Н18N4O
Найдено, % : С 72,81; Н 5,65; N 16,98.
П р и м е р 30. 3/2-(2-2-Гидроксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2-фе- нилпиразоло /1,5- α /пиридин; температура плавления: 185,5-187оС.
ИК (Nujol): 3350, 1650, 1580, 1520, 1500 см-1.
ЯМР (CDCl3, δ ): 4,05 (2Н, м), 4,30 (2Н, д, J = 4,0 Гц), 6,70 (1Н, д, J = 10,0 Гц), 6,82 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,00 (1Н, д, J = 10,0 Гц), 7,15-7,60 (6Н, м), 7,87 (1Н, д, J = 10,0 Гц), 8,45 (1Н, д, J = 7,0 Гц).
Масс-спектр: 332 (М+).
Вычислено, % : С 68,66; Н 4,85; N 16,86.
С19Н16N4O2.
Найдено, % : С 67,29; Н 5,05; N 16,42.
П р и м е р 31. 3-/2-(3-Гидроксипропил)-3-оксо-2,3-дигидропиридазин-6-ил/-2-фе- нилпиразоло /1,5- α /пиридин; температура плавления: 164,5-165оС.
ИК (Nujol): 1660, 1590, 1540 см-1.
ЯМР CDCl3, δ ): 2,11 (2Н, кв, J = 6,0 Гц), 3,46-3,70 (3Н, м), 4,46 (2Н, т, J = 6,0 Гц), 6,80 (1Н, д, J = 10,0 Гц), 6,14 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,01 (1Н, д, J = 8,0 Гц).
Масс-спектр: 346 (М+).
Вычислено, % : С 69,35; Н 5,24; N 16,17.
С20Н18N4O2.
Найдено, % : С 69,02; Н 5,28; N 15,74.
П р и м е р 32. 3-/2-(2-Этоксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил/2-фенил- пиразоло /1,5- α /пиридин; температура плавления: 117-118оС.
ИК (Nujol): 1665, 1630, 1590, 1530 см-1.
ЯМР (CDCl3, δ ): 1,23 (3Н, т. , J = 7,0 Гц), 3,59 (2Н, кв, J = 7,0 Гц), 3,92 (2Н, т, J = 6,0 Гц), 4,49 (2Н, т, J = 6,0 Гц), 6,75 (1Н, д, J = 10,0 Гц), 6,94 (1Н, тд, J = 6,0 Гц и 1,0 Гц), 7,00 (1Н, д, J = 10,0 Гц), 7,24-7,76 (6Н, м), 8,12 (1Н, д, J = 12,0 Гц), 8,52 (1Н, д, J = 8,0 Гц).
Масс-спектр: 360 (М+).
Вычислено, % : С 69,98; Н 5,59; N 15,55.
С21Н20N4O2.
Найдено, % : С 70,57; Н 5,52; N 15,82.
П р и м е р 33. 3-/1-(2-Метоксикарбонилэтил)-5-гидроксипиразол-3-ил/-2-фенил- пиразоло /1,5- α /пиридин получают в соответствии с примером 5; температура плавления: 194-196оС.
ИК (Nujol): 2630, 1730, 1635, 1585 см-1.
ЯМР (ДМСО-d6, δ ): 2,49-2,53 (2Н, м), 3,38 (3Н, с), 5,63 (1Н, с), 3,67 (2Н, шир. с), 7,03 (1Н, тд, J = 7,0 Гц и 1,5 Гц), 7,31-7,62 (7Н, м), 8,81 (1Н, д, J = 7,0 Гц), 9,84 (1Н, с).
Вычислено, % : С 64,69; Н 5,12; N 15,04.
С20Н18N4O3 ˙1/2 H2O.
Найдено, % : С 64,99; Н 5,29; N 14,77.
П р и м е р 34. Гидрид натрия (60% , 43,6 мг) прибавляют к смеси 3-(2-оксо-1,2,5,6-тетрагидропиридин-4-ил)-2-фенилпиразоло /1,5- α /пиридина (210 мг), метилакрилата (93,8 мг) и тетрагидрофурана (2,1 мл) при охлаждении на льду. Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч. Затем в смесь прибавляют насыщенный раствор хлорида натрия (20 мл) и экстрагируют этилацетатом (20 мл х 2). Объединенный экстракт промывают насыщенным раствором хлорида натрия (20 мл), сушат в присутствии сульфата магния и упаривают и вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформа и этилацетата в качестве элюента (10: 1) с получением 3-/-(2-метоксикарбонилэтил)-2-оксо-1,2,5,6-тетрагидропиридин-4-ил/-2- фенилпиразоло/1,5- α /пиридина (210,7 мг) в виде масла.
ИК (пленка): 1730, 1640, 1600, 1515 см-1.
ЯМР (CDCl3, δ): 2,41 (2Н, т, J 6,5 Гц), 2,69 (2Н, т, J = 6,5 Гц), 3,47 (2Н, т, J = 6,5 Гц), 3,69 (3Н, с), 3,72 (2Н, т, J = 6,5 Гц), 6,20 (1Н, с), 6,85 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,19-7,74 (7Н, м), 8,48 (1Н, д, J = 7,0 Гц).
Масс-спектр: 375 (М+).
П р и м е р 35. 3-/2-(2-Метоксикарбонилэтил)-3-оксо-2,3, 4,5-тетрагидропиридазин-6-ил/-2- фенилпиразоло/1,5- α/ пиридин получают в соответствии с аналогичным способом примера 34.
ИК (пленка): 1730, 1670 см-1.
П р и м е р 36. Смесь 3-/2-(3-этоксикарбонилпропил)-3-оксо-2,3-дигидропирида- зин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (13,7 г) и гидроокиси натрия (2,73 г) в смеси воды (8,6 мл) и метанола (96 мл) нагревают с обратным холодильником в течение 2 часов, после чего растворитель упаривают в вакууме. Остаток растворяют в воде и водный слой подкисляют хлористоводородной кислотой, после чего экстрагируют хлороформом. Экстракт сушат в присутствии магния и растворитель упаривают в вакууме. Остаток перекристаллизовывают из смеси этанола и н-гексана с получением 3-/2-(3-карбоксипропил)-3-оксо-2,3-дигидропири- дазин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (9,48 г); температура плавления: 240-240,5оС (EtOH).
ИК (Nujol): 1710, 1635, 1560, 1530, 1500 см-1.
ЯМР (ДМСО-d6, δ ): 1,97 (2Н, кв, J = 7,0 Гц), 2,26 (2Н, т, J = 7,0 Гц), 3,23 (1Н, шир), 4,13 (2Н, т, J = 7,0 Гц), 6,77 (1Н, д, J = 10,0 Гц), 7,00 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,03 (1Н, д, J = 10,0 Гц), 7,90 (1Н, д, J = 9,0 Гц), 7,75 (1Н, д, J = 7,0 Гц).
Масс-спектр (М+): 374.
Вычислено, % : С 67,37; Н 4,85; N 14,96.
С21Н18N4O3.
Найдено, % : С 67,10; Н 4,91; N 14,94.
П р и м е р 37. Натриевую соль 3-/2-(3-карбоксипропил)-3-оксо-2,3-дигидропири- дазин-6-ил/-2-фенилпиразоло/1,5- α /пиридина получают из соответствующего свободного соединения (пример 36) в соответствии с традиционным способом; температура плавления: 114-116оС;
ИК (Nujol): 1660, 1585 см-1.
ЯМР (ДМСО-d6, δ): 2,01 (4Н, м), 4,15 (2Н, т), 6,84 (1Н, д, J = 9,0 Гц), 7,00-7,09 (2Н, м), 7,39-7,62 (6Н, м), 7,97 (1Н, J = 8,0 Гц), 8,79 (1Н, д, J = 7,0 Гц).
П р и м е р 38. 3-/2-(4-Этоксикарбонилбутил)-3-оксо-2,3-дигидропиридазин-6-ил/ -2-фенилпиразоло/1,5- α /пиридин получают в соответствии с аналогичным способом примера 26.
ИК (пленка): 1725, 1655, 1590 см-1.
ЯМР (CDCl3, δ ): 1,25 (3Н, т, δ ) = 7,0 Гц), 1,74-2,02 (4Н, м), 2,41 (2Н, т, J = 7,0 Гц), 4,13 (2Н, кв, J = 7,0 Гц), 4,32 (2Н, т, J = 7,0 Гц), 6,87 (1Н, д, J = 8,0 Гц), 7,02-7,07 (2Н, м), 7,40-7,65 (6Н, м), 8,05 (1Н, д, J = 9 Гц), 8,74 (1Н, д, J = 7,0 Гц).
П р и м е р 39. 3-/2-(4-Карбоксибутил)-3-оксо-2,3-дигидропиридазин-6-ил/-2-фе- нилпиразоло /1,5- α /пиридин получают в соответствии со способом примера 36; температура плавления: 182-183оС.
ИК (Nujol): 1710, 1640, 1570, 1530, 1500 см-1.
ЯМР (CDCl3, δ ): 1,74-2,04 (4Н, м), 2,47 (2Н, т, J = 6,0 Гц), 4,31 (2Н, т, J = 6,0 Гц), 6,79 (1Н, д, J 10,0 Гц), 6,91 (1Н, т, J = 6,0 Гц), 7,01 (1Н, д, J = 10,0 Гц), 7,26-7,63 (6Н, м), 7,97 (1Н, д, J = 9,0 Гц), 8,54 (1Н, д, J = 7,0 Гц),
П р и м е р 40. Натриевую соль 3-/2-(4-карбоксибутил)-3-оксо-2,3-дигидропирида- зин-6-ил/-2-фенилпиразоло /1,5- α /пиридина получают из соответствующего свободного соединения (пример 39) в соответствии с традиционным способом; температура плавления: 244-245оС.
ИК (Nujol): 1660, 1650, 1570 см-1.
ЯМР (ДМСО-d6, ν ): 1,38-1,60 (2Н, м), 1,62-1,83 (2Н, м), 1,92 (2Н, т, J = 7,0 Гц), 4,11 (2Н, т, J = 7,0 Гц), 6,85 (1Н, д, J = 10,0 Гц), 7,04-7,09 (2Н, м), 7,42-7,61 (6Н, м), 7,95 (1Н, д, J = 8,0 Гц), 8,81 (1Н, д, J = 7,0 Гц).
П р и м е р 41. Смесь 3-(3-циано-2-оксо-1,2-дигидропиридин-5-ил)-2-фе- нил-пиразоло/1,5- α /пиридина (0,60 г) и 85% гидроокиси калия (0,38 г) в 67% -ном водном растворе этанола (6 мл) нагревают с обратным холодильником в течение 4 ч. После охлаждения реакционную смесь выливают на лед (12 г) и подкисляют 5% -ным раствором хлористоводородной кислоты. Преципитаты собирают и перекристаллизовывают из смеси 11,11-диметилформамида и воды (дважды) с получением 3-(3-карбокси-2-оксо-1,2-дигидропиридин-5-ил)-2-фенилпира- золо/ 1,5- α /пиридина (0,36 г); температура плавления: 335-336оС.
ИК (Nujol): 1700, 1630, 1585, 1535 см-1.
ЯМР (ДМСО-d6, δ ): 6,98 (1Н, т, J = 7,0 Гц), 7,18-7,72 (7Н, м), 7,97 (1Н, д, J = 3,0 Гц), 8,17 (1Н, д, J = 3,0 Гц), 8,77 (1Н, д, J = 7,0 Гц), 12,3-13,8 (2Н, шир. ).
Масс-спектр: 331 (М+), 287.
Вычислено, % : С 68,88; Н 3,95; N 12,68.
С19Н13N3O3
Найдено, % : С 68,58, Н 3,99; N 12,63.
П р и м е р 42. Смесь 3-/1-(2-метоксикарбонилэтил)-2-оксо-1,2,5,6-тетрагидропи- ридин -4-ил/-2-фенилпиразоло/1,5- α /пиридина (440 мг), 1 н, водного раствора гидроокиси натрия (3 мл) и метанола (4 мл) нагревают с обратным холодильником в течение 1,5 ч. Метанол упаривают в вакууме и к остатку прибавляют воду (20 мл). Водный раствор подкисляют 5% -ной хлористоводородной кислотой и преципитаты собирают фильтрацией, промывают водой и затем петролейным эфиром (5 мсл). Преципитаты перекристаллизовывают из 95% этанола с получением кристаллов 3-/1-(2-карбоксиэтил)-2-оксо-1,2,5,6-тетрагидропиридин-4- ил/-2- фенилпиразоло/1,5 - α /пиридина (220 мг); температура плавления: 182-184оС.
ИК (Nujol): 1735, 1640, 1585 см-1.
ЯМР (CDCl3, δ ): 2,42 (2Н, т, J = 6,5 Гц), 2,74 (2Н, т, J = 6,5 Гц), 3,49 (2Н, т, J = 6,5 Гц), 3,73 (2Н, т, J = 6,5 Гц), 6,22 (1Н, с), 7,20-7,74 (8Н, м), 8,49 (1Н, д, J = 7,0 Гц).
П р и м е р 43. Смесь 3-/2-(2-метоксикарбонилэтил)-3-оксо-2,3,4,5-тетрагидропи- ридазин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (484 мг), 1 н. водного раствора гидроокиси натрия (2,1 мл) и метанола (5 мл) перемешивают при комнатной температуре в течение 1 ч. Метанол упаривают в вакууме. К остатку прибавляют воду (10 мл) и раствор подкисляют 5% -ной хлористоводородной кислотой и экстрагируют хлороформом (20 мл х 2). Объединенные экстракты промывают насыщенным водным раствором хлорида натрия (20 мл), сушат в присутствии сульфата магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформа и метанола (30: 1) в качестве элюента, получая 3-/2-(2-карбоксиэтил)-3-оксо-2,3,4,5-тетрагидропиридазин-6- ил/-2-фенилпиразоло-/1,5- α /пиридин (198 мг) в виде масла. Эту свободную кислоту растворяют в смеси 1 н. водного раствора гидроокиси натрия (0,547 мг) и этанола (3 мл) и растворитель упаривают в вакууме. Остаток растирают в порошок с использованием 95% этанола, собирают фильтрацией, промывают ацетоном и сушат с получением порошка натриевой соли 3-/2-(2-карбоксиэтил)-3-оксо-2,3,4,5-тетрагидропирида- зин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (129 мг).
ИК (Nujol): 1640, 1560, 1510 см-1.
ЯМР (D2O, δ ): 2,04 (4Н, с), 2,25 (2Н, т, J = 7,5 Гц), 3,71 (2Н, т, J = 7,5 Гц), 6,71 (1Н, т, J = 7,0 Гц), 7,08-7,23 (6Н, м), 7,63 (1Н, д, J = = 9,0 Гц), 8,06 (1Н, д, J = 7,0 Гц).
Вычислено, % : С 54,79; Н 5,25; N 12,99.
С20Н17NaN4O3 ˙3H2O.
Найдено, % : С 55,46, Н 4,71, N 12,71.
П р и м е р 44. Смесь 3-/1-(2-метоксикарбонилэтил)-5-гидроксипиразол-3-ил/-2- фенилпиразоло /1,5- α /пиридина (0,50 г), 1 н, водного раствора гидроокиси натрия (3 мл) и этанола (5 мл) нагревают с обратным холодильником в течение 2,5 ч. Этанол упаривают в вакууме. Остаток подкисляют 5% -ной хлористоводородной кислотой и экстрагируют хлороформом (25 мл х 2). Объединенный экстракт промывают насыщенным водным раствором хлорида натрия (25 мл), сушат в присутствии сульфата магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформа и метанола (30: 1) в качестве элюента и перекристаллизовывают из этанола с получением кристаллов 3-/1-(2-карбоксиэтил)-5-гидроксипиразол-3-ил/-2- фенилпиразоло/1,5- α /пиридина (141 мг); температура плавления: 211-213оС.
ИК (Nujol): 1705, 1610 см-1.
ЯМР (CDCl3, δ ): 2,11 (2Н, шир. с), 3,89 (2Н, шир. с), 5,83 (1Н, с), 6,91 (1Н, т, J = 6,0 Гц), 7,23-7,71 (7Н, м), 8,54 (1Н, д, J = 6,0 Гц).
Вычислено, % : С 65,51; Н 4,63; N 16,08.
С19Н16N4O3.
Найдено, % : С 65,10; H 4,60, N 16,16.
П р и м е р 45. 3-(3-Карбокси-2-оксо-1,2-дигидропиридин-5-ил)-2-фенил-пиразоло/1,5- α /пиридин (120 мг) расплавляют с использованием электрической горячей пластины при температуре 370оС. Затем данное соединение растворяют в смеси хлороформа (26 мл) и метанола (13 мл), после чего в смесь прибавляют силикагель (1 г) и уголь (0,2 г) и осуществляют фильтрование смеси. Растворитель фильтрата удаляют и осуществляют хроматографию на силикагеле (3 г) с использованием смеси хлороформа, метанола и триэтиламина (200: 10: 1). Фракции, содержащие целевое соединение, собирают и упаривают в вакууме и перекристаллизовывают из этилацетата с получением 3-(2-оксо-1,2-дигидропиридин-5-ил)-2-фенилпиразоло/1,5-α /пиридина (30 мг); температура плавления: 222-224оС.
ИК (Nujol): 1665, 1630 см-1.
ЯМР (ДМСО-d6, δ): 6,39 (1Н, д, J = 9,2 Гц), 6,96 (1Н, т, J = 6,0 Гц), 7,23-7,65 (9Н, м), 8,73 (1Н, д, J = 7,0 Гц), 11,75 (1Н, шир. с).
Масс-спектр: 287 (М+), 258, 231.
Вычислено, % : С 73,70; Н 4,70, N 14,34.
С18Н13N3O) ˙1/3 H2O.
Найдено, % : С 73,88; Н 4,53; N 14,16.
П р и м е р 46. Смесь 3-(3-xлоро-1-этоксикарбонил-1,4-дигидропиридазин-4-ил)-2- фенилпиразоло/1,5- α /пиридина (1,26 г), окиси марганца (IV) (12,6 г) и хлороформа (12,6 мл) нагревают с обратным холодильником в течение 10 ч. После фильтрования органический слой сушат в присутствии сульфата магния. Растворитель удаляют и хроматографию осуществляют на силикагеле (12,6 г) с использованием смеси гексана и этилацетата в качестве элюента. Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме и перекристаллизовывают из смеси этилацетата и н-гексана с получением 3-(3-хлорпиридазин-4-ил)-2-фенилпиразоло/1,5- α/пиридина (0,78 г); температура плавления: 208-210оС.
ИК (Nujol): 1635, 1570 см-1.
ЯМР (CDCl3, δ ): 6,94 (1Н, дт, J = 1,6 Гц и 6,7 Гц), 7,25-7,49 (8Н, м), 8,58 (1Н, ддд, J = 0,96 Гц, 0,96 Гц и 7,0 Гц), 9,06 (1Н, д, J = 4,9 Гц).
Масс-спектр: 306 (М+), 271, 242, 216.
Вычислено, % : 66,56; Н 3,61; N 18,26.
С17Н11ClN4.
Найдено, % : С 66,96; Н 3,63; N 18,31.
П р и м е р 47. Смесь 3-(1-этоксикарбонил-3-ацетил-1,4-дигидропиридин-4-ил)-2-фенилпиразоло/ 1,5- α /пиридина (2,20 г), трет-бутоксида калия (3,19 г) и трет-бутанола (22 мл) нагревают с обратным холодильником в течение 1 ч и 30 мин. Растворитель удаляют и остаток экстрагируют метиленхлоридом. Объединенный экстракт промывают водой и насыщенным водным раствором хлорида натрия и сушат в присутствии сульфата магния. Растворитель упаривают в вакууме. Остаток подвергают хроматографии на силикагеле (12 г) с использованием смеси н-гексана и этилацетата (4: 1) в качестве элюента. Фракции, содержащие целевое соединение, объединяют и растворитель упаривают в вакууме. Перекристаллизация из смеси этилацетата и н-гексана приводит к получению 3-(3-ацетилпиридин-4-ил)-2-фенилпиразоло/1,5- α /пиридина (0,52 г); температура плавления: 159-161оС.
ИК (Nujol): 1690, 1630 см-1.
ЯМР (CDCl3, δ): 1,94 (3Н, с), 6,83 (1Н, т, J = 7,5 Гц), 7,17 (1Н, т, J = 7,5 Гц), 7,20-7,53 (7Н, м), 8,50 (1Н, д, J = 7,5 Гц), 8,65 (1Н, д, J = 5,0 Гц), 8,80 (1Н, с).
Масс-спектр: 313 (М+), 298, 242, 210.
Вычислено, % : С 76,66; Н 4,82; N 13,41.
С20Н15N3O.
Найдено, % : С 76,34; Н 5,48; N 13,17.
П р и м е р 48. 3-(3-Цианопиридин-4-ил)-2-фенилпиразоло/1,5-α /пиридин получают в соответствии с методикой примера 47; температура плавления: 208-210оС.
ИК (Nujol): 2220, 1630, 1585 см-1.
ЯМР (CDCl3, δ ): 6,80 (1Н, т, J = 7,5 Гц), 7,07-7,43 (8Н, м), 8,43 (1Н, д, J = 7,5 Гц), 8,53 (1Н, д, J = 5,0 Гц), 8,77 (1Н, с).
Масс-спектр: 296 (М+), 270.
Вычислено, % : С 77,01; Н 4,08; N 18,91.
С19Н12N4.
Найдено, % : С 77,30; Н 4,17; N 19,02.
П р и м е р 49. Смесь 3-/2-(2-карбоксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2-фенилпиразоло/ 1,5- α /пиридина (0,36 г), метиленхлорида (4 мл) и тионилхлорида (0,08 мл) перемешивают в течение 30 мин при комнатной температуре, затем вновь прибавляют тионилхлорид (0,08 мл) и перемешивание продолжают в течение 60 мин при комнатной температуре. Реакционную смесь упаривают. Остаток растворяют в ацетоне (3 мл), медленно прибавляют к водному раствору аммиака (6 мл), перемешивая при комнатной температуре. Через 20 минут реакционную смесь упаривают и осуществляют прибавление воды (3 мл). Преципитаты собирают фильтрацией и перекристаллизовывают из этанола с получением 3-/2-(2-карбамоил-этил)-3-оксо-2,3-дигидропиридазин-6-ил/-2- фенилпиразоло/1,5- α /пиридина (0,24 г); температура плавления: 215-215,5оС.
ИК (Nujol): 3450, 3330, 3210, 1660, 1595, 1535 см-1.
ЯМР (CDCl3, δ ): 2,89 (2Н, т, J = 7,0 Гц), 4,58 (2Н, т, J = 7,0 Гц), 5,20-5,60 (1Н, с), 6,00-6,50 (1Н, с), 6,70 (1Н, д, J = 10,0 Гц), 7,89 (1Н, т, J = 7,0 Гц), 7,00 (1Н, д, J = 10,0 Гц), 7,20-7,68 (6Н, м), 8,03 (1Н, д. J = 9,0 Гц), 8,50 (1Н, д, J = 7,0 Гц).
Масс-спектр: (М+): 359.
Вычислено, % : С 66,84; Н 4,77; N 19,49.
С20Н17N5O2.
Найдено, % : С 67,11; Н 5,01; N 19,65.
Следующие соединения (примеры 50 и 51) получают в соответствии с аналогичным способом примера 49.
П р и м е р 50. 3-/2-(2-N, N-Диметилкарбамоилэтил)-3-оксо-2,3-дигидропиридазин-6-ил /-2-фенилпиразоло/1,5- α /пиридин; температура плавления: 144-145оС.
ИК (Nujol): 1665, 1640, 1590, 1530 см-1.
ЯМР (CDCl3, δ ): 2,97 (2Н, т, J = 8,0 Гц), 2,98 (3Н, с), 3,03 (3Н, с), 4,61 (2Н, т, J = 8,0 Гц), 6,75 (1Н, д, J = 10,0 Гц), 6,93 (1Н, тд, J = 6,0 Гц и 1,0 Гц), 7,02 (1Н, д, J = 10 Гц), 7,26-8,64 (6Н, м), 8,08 (1Н, д, J = 8,0 Гц), 8,52 (1Н, д, J = 7,0 Гц).
Масс-спектр (М+): 387.
Вычислено, % : С 68,20; Н 5,46; N 18,08.
С22Н21N5O2
Найдено, % : С 68,60; Н 5,67; N 18,04.
П р и м е р 51. 1-/α -{ 6-(2-Фенилпиразоло/1,5- α /пиридин-3-ил)-3-оксо-2,3-дигидропиридазин-2-ил} пропионил/пиперидин; температура плавления: 65-70оС.
ИК (Nujol): 1660, 1630, 1585, 1520 см-1.
ЯМР (CDCl3, δ ): 1,58-1,76 (6Н, м), 2,96 (2Н, т, J = 8,0 Гц), 3,49 (4Н, д, J 32 Гц), 4,61 (2Н, т, J = 8,0 Гц), 6,75 (1Н, д, J = 10,0 Гц), 6,94 (1Н, тд, J = 7,0 Гц и 1,0 Гц), 7,02 (1Н, д, J = 10,0 Гц), 7,26-7,63 (6Н, м), 7,68 (1Н, д, J = 8,0 Гц), 8,53 (1Н, д, J = 7,0 Гц).
Масс-спектр: 427 (М+).
Вычислено, % : С 70,28; Н 5,89; N 16,38.
C25H25N5O2.
Найдено, % : С 69,15; Н 6,01; N 16,18.
П р и м е р 52. К смеси 3-(2-аминопиримидин-5-ил)-2-фенилпиразоло/1,5- α /пиридина (0,70 г) и 50% серной кислоты (5,6 мл) постепенно прибавляют водный раствор (5,6 мл) нитрита натрия (1,68 г) при температуре от 5 до 10оС, и полученную смесь перемешивают в течение 3 ч при той же температуре и затем в течение 2 ч при комнатной температуре. В реакционную смесь прибавляют воду (14 мл). Осадок собирают фильтрацией, подвергают колоночной хроматографии на силикагеле (14 г) с использованием смеси хлороформа и метанола (10: 1) в качестве элюента. Фракции, содержащие целевое соединение, объединяют, и растворитель упаривают в вакууме с получением 3-(2-оксо-1,2-дигидропиримидин-5-ил)-2- фенилпиразоло/1,5-α /пиридина (0,44 г); температура плавления: 324-326оС (разложение).
ИК (Nujol): 3200-2300, 1720, 1700, 1645, 1625 см-1.
ЯМР (ДМСО-o6, ): 6,93 (1Н, т, J = 7,5 Гц), 7,27 (1Н, т, J = 7,5 Гц), 7,33-7,70 (6Н, м), 8,15 (2Н, с), 8,75 (1Н, д, J = 7,5 Гц).
Масс-спектр: 288 (М+), 260, 246, 218.
П р и м е р 53. 3-(2-Оксо-1,2-дигидропиримидин-4-ил)-2-фенилпиразоло/1,5- α / пиридин получают в соответствии с аналогичным способом примера 52, температура плавления; 287-289оС.
ИК (Nujol): 1640, 1610 см-1.
ИК (ДМСО-d6, δ ): 5,91 (1Н, д, J = 6,6 Гц), 7,18 (1Н, т, J = 6,4 Гц), 7,51-7,69 (7Н, м), 8,55 (1Н, д, J = 8,9 Гц), 8,86 (1Н, д, J = 6,8 Гц), 11,1-11,9 (1Н, шир. с).
Масс-спектр: 287 (М+-1), 259, 244.
Вычислено, % : С 68,68, Н 4,41; N 18,84.
С17Н12N4O ˙1/2 H2O
Найдено, % : С 68,48; H 4,24; N 18,51.
П р и м е р 54. Смесь 3-(2-оксо-1,2-дигидропиридин-4-ил)-2-фенилпиразоло/1,5- α /пиридина (0,6 г) и хлорангидрида фосфорной кислоты (1,8 мл) перемешивают при температуре 70оС в течение 6 ч. После охлаждения реакционную смесь выливают на лед (30 г) и делают щелочной с помощью 24% -ного водного раствора гидроокиси натрия (pH 10) и экстрагируют хлороформом (18 мл). Объединенный экстракт промывают водой и водным раствором хлорида натрия и сушат в присутствии сульфата магния. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле (12 г) с использованием хлороформа в качестве элюента. Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме и перекристаллизовывают из смеси этилацетата и диизопропилового эфира с получением 3-(2-хлорпиридин-4-ил)-2-фенилпиразоло/1,5- α /пиридина (0,21 г); температура плавления: 167-168оС.
ИК (Nujol): 1630, 1590, 1530 см-1.
ЯМР (CDCl3, δ): 6,91 (3Н, т, J = 6,8 Гц), 7,15 (1Н, дд, J = 1,5 Гц и 5,2 Гц), 7,25-7,69 (6Н, м), 8,32 (1Н, дд, J = 0,5 Гц и 5,2 Гц), 8,54 (1Н, дд, J = 1,0 и 6,0 Гц).
Масс-спектр: 305 (М+), 270, 243.
Вычислено, % : С 70,71; Н 3,96; N 13,74.
С18Н12ClN3.
Найдено, % : С 70,51; Н 3,95; N 13,62.
П р и м е р 55. 3-(2-Хлорпиримидин-4-ил)-2-фенилпиразоло/1,5- α /пиридин получают в соответствии с аналогичным способом примера 54; температура плавления: 181-182оС.
ИК (Nujol): 1630, 1570, 1530 см-1.
ЯМР (СDCl3, δ ): 6,92 (1Н, д, J = 5,5 Гц), 7,02 (1Н, дт, J = 1,3 Гц и 6,9 Гц), 7,43-7,62 (6Н, м), 8,23 (1Н, д, J = 5,4 Гц), 8,55 (1Н, д, J = 6,9 Гц), 8,64 (1Н, д, J = 9,0 Гц).
Масс-спектр: 306 (М+): 271, 244, 217.
Вычислено, % : С 66,56; Н 3,61; N 18,26.
C17H11ClN4.
Найдено, % : С 66,30; Н 3,52; N 18,59.
П р и м е р 56. Смесь 3-(3-оксо-2,3-дигидропиридазин-6-ил)-2-фенилпирa- золо/1,5-α /пиридина (2,91 г) и хлорангидрида фосфорной кислоты (10 мл) нагревают с обратным холодильником в течение 1 ч. Хлорангидрид фосфорной кислоты упаривают в вакууме. Остаток нейтрализуют насыщенным водным раствором кислого углекислого натрия и экстрагируют хлороформом (30 мл х 3). Объединенный экстракт промывают насыщенным водным раствором хлорида натрия (20 мл) и сушат в присутствии сульфата магния. Растворитель упаривают в вакууме и остаток порошкуют этанолом, собирают фильтрацией, промывают этанолом и сушат с получением кристаллов 3-(3-хлорпиридазин-6-ил)-2-фенилпиразоло-/1,5- α /пиридина (2,42 г); температура плавления: 208-211оС.
ИК (Nujol): 1630, 1575, 1530 см-1.
ЯМР (ДМСО-d6, δ ): 7,14 (1Н, т, J = 7,0 Гц и 1,0 Гц), 7,36 (1Н, д, J = 9,0 Гц), 7,47-7,60 (6Н, м), 7,78 (1Н, д, J = 9,0 Гц), 8,16 (1Н, д, J = 9,0 Гц), 8,87 (1Н, д, J = 7,0 Гц).
Вычислено, % : С 63,65; Н 3,53; N 17,22.
С17Н11ClN4.
Найдено, % : С 63,14; H 3,48; N 17,29.
П р и м е р 57. Смесь 3-(3-хлорпиридазин-6-ил)-2-фенилпиразоло/1,5- α /-пиридина (1,00 г) и раствора диметиламина в метаноле (30 мл) нагревают с обратным холодильником в течение 8,5 ч. Метанол упаривают в вакууме и остаток растворяют в хлороформе (50 мл). Раствор хлороформа экстрагируют 10% -ной хлористоводородной кислотой (50 мл х 2). Водный слой нейтрализуют карбонатом калия и экстрагируют хлороформом (30 мл х 2). Объединенный экстракт промывают насыщенным водным раствором хлорида натрия (30 мл), сушат в присутствии сульфата магния и упаривают в вакууме. Остаток перекристаллизовывают из этанола с получением кристаллов 3-(3-N, N-диметиламинопиридазин-6-ил)-2-фе- нилпиразоло/1,5- α /пиридина (421 мг); температура плавления 190-194оС.
ИК (Nujol): 1630, 1605, 1550, 1530 см-1.
ЯМР (ДМСО-d6, δ ): 3,13 (6Н, (6Н, с), 6,99-7,07 (3Н, м), 7,31-7,59 (6Н, м), 7,96 (1Н, д, J = 9,0 Гц), 8,79 (1Н, д, J = 6,0 Гц).
Вычислено, % : С 72,36; Н 5,43; N 22,21.
С19Н17N5.
Найдено, % : С 72,50; Н 5,33; N 22,16.
П р и м е р 58. К 28% -ному метиловому раствору метилата натрия (3 мл) прибавляют 3-(3-хлорпиридазин-4-ил)-2-фенилпиразоло /1,5-α /пиридин (0,61 г). Смесь нагревают с обратным холодильником в течение 1 ч и упаривают в вакууме. Остаток растворяют в хлороформе (20 мл). Хлороформовый раствор промывают водой (5 мл) и насыщенным водным раствором хлорида натрия (5 мл) и сушат в присутствии сульфата магния. Растворитель удаляют и осуществляют хроматографию на силикагеле (10 г) с использованием н-гексана-этилацетата в качестве элюента. Фракции, содержащие целевое соединение, объединяют, упаривают в вакууме и затем перекристаллизовывают из смеси этилацетата и н-гексана с получением 3-(3-метоксипиридазин-4-ил)-2-фенилпиразоло/1,5- α /пиридинв (0,30 г); температура плавления: 180-182оС.
ИК (Nujol): 1630, 1580, 1510 см-1.
ЯМР (CDCl3 , δ): 3,97 (3Н, с), 6,89 (1Н, дт, J = 1,4 Гц и 6,4 Гц), 7,20-7,52 (8Н, м), 8,55 (1Н, д, J = 6,9 Гц), 8,79 (1Н, д, J = 4,8 Гц).
Масс-спектр: 302 (М+), 279.
Вычислено, % : С 71,51; Н 4,67; N 18,53.
С18Н14N4O.
Найдено, % : С 71,45; Н 4,68; N 18,63.
Следующие соединения (примеры 59 и 60) получают в соответствии с аналогичным способом примера 58.
П р и м е р 59. 3-(2-Метоксипиридин-4-ил)-2-фенилпиразоло/1,5- α /пиридин; температура плавления: 130-132оС.
ИК (Nujol): 1600, 1530 см-1.
ЯМР (CDCl3, δ ): 3,96 (3Н, с), 6,80-6,88 (2Н, м), 7,19 (1Н, дт, J = 1,0 Гц и 6,8 Гц), 7.36-7,39 (3Н, м), 7,57-7,67 (3Н, м), 8,12 (1Н, дд, J = 1,2 Гц и 4,9 Гц), 8,52 (1Н, дд, J = 0,9 Гц и 7,0 Гц).
Масс-спектр: 301 (М+), 270.
Вычислено, % : С 75,73; Н 5,02; N 13,94.
C19H15N3O.
Найдено, % : С 75,72; Н 4,97; N 13,78.
П р и м е р 60. 3-(2-Метоксипиримидин-4-ил)-2-фенилпиразоло/1,5-α /пиридин: температура плавления: 156,5-157оС.
ИК (Nujol): 1620, 1570 см-1.
ЯМР (CDCl3, δ): 4,08 (3Н, с), 6,70 (1Н, д, J = 5,4 Гц), 6,69 (1Н, дт, J = 1,4 Гц и 6,8 Гц), 7,34-7,64 (6Н, м), 8,22 (1Н, д, J = 5,4 Гц), 8,55 (2Н, м).
Масс-спектр: 301 (М+)-+), 271, 243.
Вычислено, % : С 71,51; Н 4,67; N 18,53.
С18Н14N4O.
Найдено, % : С 71,44; Н 4,68; N 18,47.
П р и м е р 61. Раствор метилата натрия в метаноле (28% , 411 мг) прибавляют к смеси 3-(3-хлорпиридазин-6-ил)-2-фенилпиразоло-/1,5-α /пиридина (436 мг) и метанола (4 мл) при комнатной температуре. Реакционную смесь нагревают с обратным холодильником в течение 3 ч. После упаривания растворителя в вакууме к остатку прибавляют насыщенный водный раствор хлорида натрия (20 мл) и экстрагируют хлороформом (20 мл х 3). Объединенный экстракт промывают насыщенным водным раствором хлорида натрия (20 мл), сушат в присутствии сульфата магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (10 г) с использованием хлороформа в качестве элюента и перекристаллизовывают из 95% EtOH с получением 3-(3-метоксипиридазин-6-ил)-2-фенилпира- золо/1,5- α /пиридина (165 мг); температура плавления; 203-205оС.
ИК (Nujol): 1625, 1600 см-1.
ЯМР (CDCl3 δ): 4,18 (3Н, с), 6,78 (1Н, д, J = 9,0 Гц), 6,90 (1Н, тд, J = 8,0 Гц и 2,0 Гц), 7,15 (1Н, д, J = 9,0 Гц), 7,25-7,62 (6Н, м), 8,36 (1Н, дд, J = 9,0 Гц) и 1,0 Гц), 8,53 (1Н, дд, J = 7,0 Гц и 1,0 Гц).
Вычислено, % : С 71,51; Н 4,67; N 18,53.
C18H14N4O.
Найдено, % : С 71,13; Н 5,65; N 18,48.
П р и м е р 62. Концентрированную хлористоводородную кислоту (5 мл) прибавляют к 3-(3-метоксипиридазин-4-ил)-2-фенилпиразоло/1,5- α /пиридину (0,50 г) и нагревают с обратным холодильником в течение 2 часов и 30 минут. После охлаждения к реакционной смеси прибавляют воду (10 мл). Осадок собирают фильтрацией с получением 3-(3-оксо-2,3-дигидропиридазин-4-ил)-2-фенилпиразоло/1,5- α /пиридина (0,41 г).
ИК (Nujol): 1640, 1600, 1530 см-1.
ЯМР (ДМСО-d6, ): 7,01 (1Н, т, J = 6,8 Гц), 7,22 (1Н, д, 4,1 Гц), 7,28-7,61 (7Н, м), 7,84 (1Н, д, J = 4,1 Гц), 8,78 (1Н, д, J = 6,9 Гц), 13,18 (1Н, шир. с).
Масс-спектр: 288 (М+), 261, 231.
Вычислено, % : С 70,82; Н 4,20; N 19,43.
С17Н12N4O.
Найдено, % : С 70,87; Н 4,15; N 19,88.
П р и м е р 63. К этанолу (21 мл) в растворе 3-(3-метилпиридазин-4-ил)-2-фенилпиразоло/1,5- α /пиридина (0,42 г) прибавляют 20% (в отношении массы к объему) этаноловый раствор хлористого водорода при комнатной температуре и перемешивают в течение 1 ч. Преципитаты собирают фильтрацией с получением 3-(3-метилпиридазин-4-ил)-2-фенилпиразоло/1,5-α /пиридинхлоргидрата (0,23 г); температура плавления: 197-201оС (разложение).
ИК (Nujol): 2700-2150, 2080-1980, 1625, 1605 см-1.
ЯМР (ДМСО-d6/D2O, δ ): 2,30 (3Н, с), 7,10 (1Н, т, J = 7,5 Гц), 7,37 (lH, т, J = 7,5 Гц), 7,40-7,67 (6Н, м), 8,10 (1Н, д, J = 5,0 Гц), 8,82 (1Н, д, J = 7,5 Гц), 9,30 (1Н, д, J = 5,0 Гц).
Масс-спектр: 286 (М+ -HCl), 257, 242, 218.
Вычислено, % : С 66,98; Н 4,68; N 17,36.
С18Н14N4 ˙ HCl.
Найдено, % : С 66,26; Н 5,09; N 16,82.
П р и м е р 64. Смесь 3-(3-метилпиридазин-4-ил)-2-фенилпиразоло/1,5 α /-пиридина (0,40 г), хлораль гидрата (0,70 г) и пиридина (4 мл) перемешивают в течение 20 ч при температуре 90-100оС. После охлаждения к реакционной смеси прибавляют метиленхлорид (4 мл) и воду (4 мл) при комнатной температуре, затем перемешивают в течение 3 ч. Преципитаты собирают фильтрацией с получением 3-/3-(2-гидрокси-3,3,3-трихлорпропил)-пиридазин-4-ил/-2-фенил-пиразоло /1,5- α /пиридина (0,26 г); температура плавления: 206-207оС.
ИК (Nujol): 3400-2900, 1625 см-1.
ЯМР (CDCl3 , ): 2,70-3,60 (2Н, м), 4,50-5,30 (1Н, м), 6,80 (1Н, т, J = 7,5 Гц), 7,13-7,40 (8Н, м), 7,45 (1Н, д, J = 7,5 Гц), 9,02 (1Н, д, J = 6,0 Гц).
Масс-спектр: 434 (М+), 397, 361, 326, 286.
П р и м е р 65. К этаноловому (12 мл) раствору 3-/3-(2-гидрокси-3,3,3-трихлорпропил)пиридазин-4-ил/-2-фенилпиразоло/1,5-α /пиридина (1,20 г) прибавляют 24% -ный водный раствор гидроокиси натрия (4,8 мл) и нагревают с обратным холодильником в течение 5 ч. Реакционную смесь упаривают в вакууме и прибавляют 10% хлористоводородную кислоту (12 мл). Преципитаты собирают фильтрацией с получением 3-/3- α (Е)-2-карбоксивинил-пиридазин-4-ил/-2-фенилпиразоло/1,5- α / пиридина (0,64 г); температура плавления: 227-229оС (разложение).
ИК (Nujol): 3100, 2550, 1930, 1700, 1630 см-1.
Масс-спектр: 342 (М+), 297, 257, 195.
ЯМР (ДМСО-d6, δ ): 6,77 (1Н, д, J = 16,5 Гц), 7,06 (1Н, т, J = 7,5 Гц), 7,22 (1Н, д, J = 16,5 Гц), 7,34-7,55 (7Н, м), 7,70 (1Н, д, J = 6,0 Гц), 8,33 (1Н, д, J = 8,5 Гц), 9,25 (1Н, д, 6,0 Гц), 11,8-12,8 (1Н, шир. с).
Следующие соединения (примеры 66-74) получают в соответствии с аналогичным способом примера 1 и примера 2.
П р и м е р 66. 3-(3-Хлорпиридазин-4-ил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 208-210оС.
ИК (Nujol): 1635, 1570 см-1.
П р и м е р 67. 3-(3-Ацетилпиридин-4-ил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 159-161оС.
ИК (Nujol): 1690, 1630 см-1.
П р и м е р 68. 3-(3-Цианопиридин-4-ил)-2-фенилпиразоло/1,5-α /пиридин; температура плавления 208-210оС.
ИК (Nujol): 2220, 1630, 1585 см-1.
П р и м е р 69. 3-(2-Хлорпиридин-4-ил)-2-фенилпиразоло/1,5- α/пиридин; температура плавления: 167-168оС.
ИК (Nujol): 1630, 1590, 1530 см-1.
П р и м е р 70. 3-(3-Хлорпиридазин-6-ил)-2-фенилпиразоло/1,5-α /пиридин; температура плавления: 208-211оС.
ИК (Nujol): 1630, 1575, 1530 см-1.
П р и м е р 71. 3-(3-Метоксипиридазин-4-ил)-2-фенилпиразоло/1,5- α /пиридин; температура плавления: 180-182оС.
ИК (Nijol): 1630, 1580, 1510 см-1.
П р и м е р 72. 3-(2-Метоксипиридин-4-ил)-2-фенилпиразоло/1,5- α /пиридин.
П р и м е р 73. 3-(3-Метоксипиридазин-6-ил)-2-фенилпиразоло/1,5-α /пиридин; температура плавления: 203-205оС.
ИК (Nujol): 1625, 1600 см-1.
П р и м е р 74. 3-(3-Метилпиридазин-4-ил)-2-фенилпиразоло/1,5-α /пиридин гидрохлорид; температура плавления: 197-201оС (разложение).
ИК (Nijol): 2700-2150, 2080-1980, 1625, 1605 см-1.
Следующие соединения (примеры 75-89) получают в соответствии с аналогичным способом примера 5.
П р и м е р 75. 3-/2-(2-Карбоксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2-фенил- пиразоло /1,5- α /пиридин; температура плавления: 155,5-156оС.
ИК (Nujol): 1835, 1640, 1570, 1520, 1490 см-1.
П р и м е р 76. 3-(1-Метилпиразол-4-ил)-2-фенилпиразоло/1,5-α /пиридин; температура плавления: 100-103оС.
ИК (Nujol): 1630 см-1.
П р и м е р 77. 3-/2-(3-Карбоксипропил)-3-оксо-2,3-дигидропиридазин-6-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 240-240,5оС.
ИК (Nujol): 1710, 1635, 1560, 1530, 1500 см-1.
П р и м е р 78. 3-/2-(4-Карбоксибутил)-3-оксо-2,3-дигидропиридазин-6-ил/2- фенилпиразоло/1,5- α /пиридин; температура плавления: 182-183оС.
ИК (Nijol): 1710, 1640, 1570, 1530, 1500 см-1.
П р и м е р 79. 3-/1-(2-Карбоксиэтил)-2-оксо-1,2,5,6-тетрагидропиридин-4-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 182-184оС.
ИК (Nujol): 1735, 1640, 1585 см-1.
П р и м е р 80. Натриевая соль 3-/2-(2-карбоксиэтил)-3-оксо-2,3,4,5-тетрагидропи- ридазин-6-ил/ -2-фенилпиразоло/1,5- α /пиридина.
ИК (Nujol): 1640, 1560, 1510 см-1.
П р и м е р 81. 3-/1-(2-Карбоксиэтил)-5-гидроксипиразол-3-ил/-2-фенилпиразоло- /1,5-α /пиридин; температура плавления: 211-213оС.
ИК (Nujol): 1705, 1610 см-1.
П р и м е р 82. 3-/2-(2-Карбамоилэтил)-3-оксо-2,3-дигидропиридазин-6-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 215-215,5оС.
ИК (Nujol): 3450, 3330, 3210, 1660, 1595, 1535 см-1.
П р и м е р 83. 3-/2-(2-N, N-Диметилкарбамоилэтил)-3-оксо-2,3-дигидропиридазин-6-ил/2-фенилп разоα /пиридин; температура плавления: 144-145оС.
ИК (Nujol): 1665, 1640, 1590, 1530 см-1.
П р и м е р 84. 1-/3-{ 6-(2-Фенилпиразоло/1,5-α /пиридин-3-ил)-3-оксо-2,3-дигидропиридазин-2-ил} пропионил/пиперидин; температура плавления: 65-70оС.
ИК (Nujol): 1660, 1630, 1585, 1520 см-1.
П р и м е р 85. 3-/2-(2-Метоксикарбонилэтил)-3-оксо-2,3-дигидропиридазин-4-ил/- 2- фенилпиразоло/1,5- α /пиридин; температура плавления: 136-138оС.
ИК (Nujol): 1730, 1640, 1600 см-1.
ЯМР (CDCl3, δ): 2,92 (2Н, т, J = 6,0 Гц), 3,72 (3Н, с), 4,57 (2Н, т, J = 6,0 Гц), 6,82 (1Н, т, J = 7,0 Гц), 6.91 (1Н, д, J = 4,5 Гц), 7,1-7,7 (8Н, м), 8,55 (1Н, д, J = 7,0 Гц).
Масс-спектр: 374 (М+), 315, 287.
П р и м е р 86. 3-/1-(2-Метоксикарбонилэтил)2-оксо-1,2-дигидропиримидин-5-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 115-118оС.
ИК (Nujol): 1730, 1660 см-1.
ЯМР (CDCl3, δ); 2,97 (2Н, т, J = 6,0 Гц), 3,66 (3Н, с), 4,16 (2Н, т, J = 6,0 Гц), 6,82 (1Н, т, J = 7,5 Гц), 7,21 (1Н, т, J = 7,5 Гц), 7,33-7,73 (6Н, м), 7,91 (1Н, д, J = 4,0 Гц), 8,49 (1Н, д, J = 4,0 Гц), 8,52 (1Н, с).
Масс-спектр: 374 (М+), 332, 288, 272.
П р и м е р 87. 3-/1-(2-Метоксикарбонилэтил)-2-оксо-1,2-дигидропиридин-4-ил/-2- фенилпиразоло/1,5- α /пиридин, температура плавления: 173-174оС.
ИК (Nujol): 1740, 1660, 1590 см-1.
ЯМР (CDCl3, δ): 2,91 (2Н, т, J = 6,3 Гц), 3,69 (3Н, с), 4,21 (2Н, т, J = 6,3 Гц), 5,98 (1Н, дд, J = 1,9 Гц и 7,1 Гц), 6,72 (1Н, д, J = 1,8 Гц), 6,86 (1Н, дт, J = 1,4 Гц и 6,9 Гц), 7,2-7,4 (1Н, м, J = 7,0 Гц), 7,6-7,7 (2Н, м), 7,74 (1Н, д, J = 9,0 Гц), 8,51 (1Н, д, J = 7,0 Гц).
Масс-спектр: 373 (М+), 314, 286.
П р и м е р 88. 3-1-(2-Метоксикарбонилэтил)-3-карбокси-2-оксо-1,2-дигидропири- дин-5-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 185-186оС.
ИК (Nujol): 1725, 1630, 1560 см-1.
ЯМР (CDCl3, δ): 2,92 (2Н, т, J = 6,0 Гц), 3,68 (3Н, с), 4,31 (2Н, т, J = 6,0 Гц), 6,89 (1Н, т, J = 7,5 Гц), 7,1-7,7 (7Н, м), 7,80 (1Н, д, J = 3,0 Гц), 8,50 (1Н, д, J = 7,5 Гц), 8,57 (1Н, д, J = 3,0 Гц).
Масс-спектр: 373, 314, 287.
П р и м е р 89. 3-/1-(2-Метоксикарбонилэтил)-3-циано-2-оксо-1,2-дигидропиридин-5-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 155-157оС.
ИК (Nujol): 2225, 1725, 1660, 1620 см-1.
ЯМР (CDCl3, δ ): 2,90 (2Н, т, J = 6,0 Гц), 2,63 (3Н, с), 4,20 (2Н, т, J = 6,0 Гц), 6,81 (1Н, т, J = 7,5 Гц), 7,20 (1Н, т, J = 7,5 Гц), 7,4-7,7 (7Н, м), 7,78 (1Н, д, J = 3,0 Гц), 7,49 (1Н, д, J = 7,5 Гц).
Масс-спектр: 398 (М+), 312.
Следующие соединения (примеры 90-92) получают в соответствии с аналогичным способом примера 6.
П р и м е р 90. 3-/2-(2-Карбоксиэтил)-3-оксо-2,3-дигидропиридазин-4-ил/-2-фенил- пиразоло/ 1,5- α /пиридин; температура плавления: 150-152oС.
ИК (Nujol): 1710, 1630, 1590 см-1.
ЯМР (CDCl3, δ): 2,97 (2Н, т, J = 7,0 Гц), 4,58 (2Н, т, J = 7,0 Гц), 6.87 (1Н, дт, J = 1,3 Гц и 6,9 Гц), 6,95 (1Н, д, J = 4,2 Гц), 7,2-7,7 (8Н, м), 8,53 (1Н, д, J = 6,9 Гц).
Масс-спектр: 360 (М+), 288.
П р и м е р 91. 3-/1-(2-Карбоксиэтил)-2-оксо-1,2-дигидропиридин-4-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 238-241оС.
ИК (Nujol): 1700, 1640 см-1.
ЯМР (ДМСО-d6, δ ): 2,70 (2Н, т, 7,5 Гц), 4,06 (2Н, т, J = 7,5 Гц), 6,04 (1Н, дд, J = 1,9 Гц и 7,0 Гц), 6,37 (1Н, д, J = 1,9 Гц), 7,04 (1Н, дт, J = 1,3 Гц и 6,9 Гц), 7,3-7,7 (7Н, м), 7,74 (1Н, д, J = 8,8 Гц), 8,80 (1Н, д, J = 6,9) 12,2-12,6 (1Н, шир. ).
Масс-спектр: 358 (М+), 314, 286.
П р и м е р 92. 3-/1-(2-Карбоксиэтил)-3-карбокси-2-оксо-1,2-дигидропи- ридин-5-ил/-2- фенилпиразоло/1,5- α /пиридин; температура плавления: 209-211оС.
ИК (Nujol): 1730, 1690, 1630 см-1.
ЯМР (ДМСО-d6, δ): 2,83 (2Н, т, J = 6,0 Гц), 4,35 (2Н, т, J = 6,0 Гц), 6,98 (1Н, т, J = 7,5 Гц), 7,2-7,8 (7Н, м), 8,03 (1Н, д, J = 3,0 Гц), 8,44 (1Н, д, J = 3,0 Гц), 8,75 (1Н, дд, J = 7,5 Гц).
Масс-спектр: 403 (М+), 331, 287.
П р и м е р 93. Смесь 3-/1-(2-метоксикарбонилэтил)-3-циано-2-оксо-1,2-дигидрo- пиридин-5-ил/ -2-фенилпиразоло/1,5- α /пиридина (0,46 г) и карбоната калия (0,92 г) в 80% -ном водном этаноле (4,6 мл) перемешивают в течение 6 ч при температуре 80оС. Смесь подкисляют 5% хлористоводородной кислотой pH 2). Полученные преципитаты собирают фильтрацией, промывают водой (10 мл) и подвергают колоночной хроматографии на силикагеле (10 г) с использованием смеси хлороформа, метанола и уксусной кислоты (40: 4: 1). Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме с получением 3-/1-(2-карбоксиэтил)-3-циано-2-оксо-1,2-дигидро- пиридин-5-ил/ -2-фенилпиразоло/1,5- α /пиридин (0,40 г); температура плавления: 196-200оС.
ИК (Nujol): 3400, 2230, 1720, 1660, 1600 см-1.
ЯМР (ДМСО-d6 δ): 2,69 (2Н, т, J = 6,0 Гц), 4,18 (2Н, т, J = 6,0 Гц) 6,99 (1Н, т, J = 7,8 Гц), 7,31 (1Н, т, J = 7,8 Гц), 7,4-7,7 (5Н, м), 7,77 (1Н, д, J = 3,0 Гц), 7,9 (1Н, J = 3,0 Гц), 8,30 (1Н, д. J = 3,0 Гц), 8,76 (lH, д, J = 7,8 Гц).
Масс-спектр: 384 (М+), 312.
Следующие соединения (примеры 94-97) получают в соответствии с аналогичным способом примера 5.
П р и м е р 94. 3-/2-(2-Карбоксиэтил)-3-оксо-2,3-дигидропиридазин-4-ил/-2-фенил- пиразоло /1,5- α/пиридин.
ИК (Nujol): 1710, 1630, 1590 см-1.
П р и м е р 95. 3-/1-(2-Карбоксиэтил)-2-оксо-1,2-дигидропиридин-4-ил/-2-фенилпи- разоло/1,5-α /пиридин.
ИК (Nujol): 1700, 1640 см-1.
П р и м е р 96. 3-/1-(2-Карбоксиэтил)-3-карбокси-2-оксо-1,2-дигидропиридин-5- ил/-2- фенилпиразоло/1,5- α /пиридин.
ИК (Nujol): 1730, 1690, 1630 см-1.
П р и м е р 97. 3-/1-(2-Карбоксиэтил)-3-циано-2-оксо-1,2-дигидропиридин-5- ил/-2-фенилпиразоло/1,5- α /пиридин.
ИК (Nujol): 3400, 2230, 1720, 1660, 1600 см-1.
П р и м е р 98. К смеси 3-(3-карбокси-2-оксо-1,2-дигидропиридин-5-ил)-2-фенилпи- разоло/1,5-α /пиридина (0,92 г) и порошкообразной гидроокиси калия (0,54 г) в 11,11-диметилформамиде (9 мл) прибавляют 93% йодистый метил (0,64 мл) при охлаждении в ледяной ванне (температура 0-5оС), Смесь перемешивают в течение 3 ч при ледяном охлаждении и затем при комнатной температуре в течение 1 ч и разбавляют водой. Полученные преципитаты отфильтровывают и фильтрат подкисляют 5% -ной хлористоводородной кислотой и экстрагируют этилацетатом (20 мл). Экстракт промывают водой (5 мл) и водным раствором хлорида натрия (5 мл), затем сушат в присутствии сульфата магния. Растворитель удаляют и остаток хроматографируют на силикагеле (12 г) с использованием смеси хлороформа и метанола (100: 1) в качестве элюента. Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме с получением 3-(1-метил-3-метоксикарбонил-2-оксо-1,2-дигидропиридин-5-ил)- 2-фенилпиразоло/1,5- α /пиридина (0,34 г); температура плавления: 268-270оС.
ИК (Nujol): 1690, 1670, 1620 см-1.
ЯМР (CDCl3, δ ): 3,54 (3Н, с), 3,86 (3Н, с), 6,82 (1Н, т, J ) 2,5 Гц), 7,18 (1Н, т, J = 7,5 Гц), 7,2-7,8 (9Н, м), 8,18 (1Н, с), 8,50 (1Н, д, J = 7,5 Гц).
Масс-спектр: 359 (М+).
П р и м е р 99. Смесь 2-фенилпиразоло/1,5- α/пиридин-3-карбальдегида (1,00 г), метилацетоацетата (1,10 г) и 14% метанолового аммиака (18 мл) в смеси метанола (20 мл) и хлороформа (10 мл) перемешивают в течение 246 часов при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в метиленхлориде (30 мл). Раствор промывают водой (10 мл) и водным раствором хлорида натрия (10 мл), сушат в присутствии сульфата магния и упаривают в вакууме. Остаток хроматографируют на силикагеле (15 г) с использованием смеси н-гексана и этилацетат (2: 1) в качестве элюента. Фракции, содержащие целевое соединение, объединяют и упаривают в вакууме с получением 3-/2,6-диметил-3,5-бис(метоксикарбонил)-1,4-дигидро- пиридин-4-ил/-2- фенилпиразоло/1,5- α /пиридина. Данное соединение очищают от смеси этилацетата и н-гексана; температура плавления: 183-186оС.
ИК (Nujol): 3330, 3250, 3120, 1690 см-1.
ЯМР (CDCl3 δ): 2,13 (6Н, с), 3,37 (6Н, с), 5,19 (1Н, шир. ), 5,51 (1Н, с), 6,69 (1Н, т, J = 6,8 Гц), 7,06 (1Н, т, J = 6,8 Гц), 7,3-7,7 (6Н, м), 8,36 (1Н, д, J = 6,8 Гц).
Масс-спектр: 417 (М+), 358.
Испытание на активность как мочегонного средства (1). Испытываемое соединение.
3-/2-(2-Карбоксиэтил)-3-оксо-2,3-диги- дропиридазин-6-ил/-2- фенилпиразоло/1,5-а/пиридин
Метод испытания.
Использовались крысы самцы штамма JCL: SD в возрасте 6 недель массой примерно 200 г после 18-часового голодания. Тотчас же после орального ввода дозы испытываемого соединения, суспензированного в 0,5% метилцеллюлозе (0,5% МС), в организм крыс вводили орально физиологический солевой раствор в количестве 20 мл/кг. Крыс помещали по три штуки в камеру для исследования метаболизма. Собирали мочу за шесть часов. Мочевой электролит (Па+) анализировали посредством системы Стат/ионаR (Rechnichon). Испытывали три группы крыс по три штуки в каждой группе.
3. Результаты испытания.
Данные для мочевого электролита (Na+) (% , контроль = 100% ) представлены ниже.
Доза, мг/кг Na+
10,0 244
Испытание на мочегонное действие (2)
Испытываемое соединение.
Натриевая соль 3-/2-(3-карбоксипропил)-3-оксо-2,3-дигидропиридазин-6-ил/ -2-фенилпиразоло/1,5-а/пиридин.
Метод испытания.
Использовались крысы самцы штамма JCL ˙ SD в возрасте 6 недель весом примерно 200 г после голодания в течение 18 часов. Тотчас же после орального ввода испытываемого соединения, суспензированного в 0,5% метилцеллюлозе, (0,5% МС), в организм крыс вводили орально физиологический солевой раствор в количестве 20 мл/кг. Крыс помещали по три штуки в камеру для исследования метаболизма. Собирали мочу за 6 часов. Мочевой электролит (Па+) анализировали посредством системы Стат/ИонR (Eechnichon). Испытывали три группы крыс по три штуки в каждой группе.
Результаты испытания
Величина ED100 (мг/кг) имела следующее значение
ED100 0,31.
Для терапевтического ввода в организм заявленное соединение 1 и его фармацевтически пригодная соль, отвечающие данному изобретению, использовались в форме обычного фармацевтического препарата, который содержит указанное соединение как активный ингредиент, в смеси с фармацевтически пригодными носителями, такими как органический или неорганический твердый или жидкий эксципиент, пригодный для орального, парэнтерального ввода и наружного применения.
Токсичность соединений изобретения является низкой.
Данные сравнительных испытаний.
Методика испытания.
Характерные представители соединений настоящей заявки и представитель соединения известного уровня техники испытывались на диуретическую активность в соответствии с тем же самым методом, что и в случае испытания на диуретическую активность (1) в настоящей заявке.
Испытываемые соединения.
Представителями соединений настоящей заявки были следующие:
(1) 3-[2-(3-этоксикарбонилпропил)-3-оксо-2,3-дигидропиридазин-6-ил] -2-фенилпиразоло/1,5-а/пиридин/соединение примера 26).
(2) 3-[2-(3-карбоксипропил)-3-оксо-2,3-дигидропиридазин-6-ил] - 2-фенилпиразоло/1,5-а/пиридин (соединение примера 36);
(3) 3-(2-пропил-3-оксо-2,3-дигидропиридазин-6-ил/-2-фенилпиразоло/1,5-а/ пиридин (соединение примера 29);
(4) 3-[2-(3-гидроксипропил)-3-оксо-2,3-дигидропиридазин-6-ил] - -2-фенилпиразоло/1,5-а/пиридин (соединение примера 31).
(5) 3-[2-(2-этоксиэтил)-3-оксо-2,3-дигидропиридазин-6-ил] -2- фенилпиразоло/1,5-а/пиридин (соединение примера 32);
(6) 3-[2-(2-N, N-диметилкарбамоилэтил)-3-оксо-2,3-дигидропиридазин-6- ил] -2-фенилпиразоло-/1,5-а/пиридин (соединение примера 83).
(7) Натриевая соль 3-[2-(2-карбоксиэтил)-3-оксо-2,3,4,5-тетрагидропиридазин-6- ил] -2-фенилпиразоло/1,5-а/пиридин (соединение примера 43);
(8) 3-[1-(2-метоксикарбонилэтил)-2-оксо-1,2-дигидропиримидин-5- ил] -2-фенилпиразоло/1,5-а/пиридин (соединение примера 86).
(9) 3-[1-(2-метоксикарбонилэтил-3-циано-2-оксо-1,2-дигидропиридин-5- ил] -2-фенилпиразоло/1,5-а/пиридин (соединение примера 89).
В качестве известного соединения использовалось следующее соединение
(А) 2-фенилпиразоло/1,5-а/пиридин-3-карбонитрил (соединение примера 5 Европейского патента N 299209, противопоставленного экспертом).
Результаты, испытаний.
В таблице показан мочевой электролит (Na+), контроль 100% (каждого испытываемого соединения) доза: 10,0 мг/кг.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗОЛО [1,5-А] ПИРИДИНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2069662C1 |
| ПРОИЗВОДНЫЕ ИНДОЛИЛПИПЕРИДИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2039056C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2021990C1 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1989 |
|
RU2007406C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2043365C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТИАЗОЛА ИЛИ ИХ СОЛЕЙ С ГАЛОИДВОДОРОДНОЙ КИСЛОТОЙ | 1990 |
|
RU2010026C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ЦЕФЕМА ИЛИ ИХ КИСЛОТНО-АДДИТИВНЫХ СОЛЕЙ | 1988 |
|
RU2017744C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АЛКАНСУЛЬФОНАНИЛИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1988 |
|
RU2012557C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ПОСРЕДНИКОМ КОТОРЫХ ЯВЛЯЕТСЯ ТАХИКИНИН | 1991 |
|
RU2073683C1 |
| ПРОИЗВОДНЫЕ ТИАЗОЛА | 1991 |
|
RU2048468C1 |

Использование: в медицине в качестве веществ широкого фармацевтического действия. Сущность изобретения: продукт общей ф-лы 1 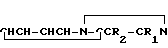 , где R1 - фенил, R2 - группа ф-лы 2 - 7, R3 - алкил, гидроксиалкил, алкоксиалкил, алкоксикарбонил, карбомоилалкил или N, N-диалкил (или совместно образуют пиридиновое кольцо); R4 - карбоксиалкил или алкоксикарбонилалкил; R5 - алкоксикарбонилалкил; R6 - алкил, карбоксиалкил или алкоксикарбонилалкил; R7 - Н, карбокси- или цианогруппа, алкоксикарбонил; R8 - карбоксиалкил или алкоксикарбонилалкил; R9 - алкил, карбоксиалкил, алкоксикарбонилалкил; R10 - Н или ОН, причем во всех случаях использованы низшие алкилы. Реагент 1: продукт ф-лы 1, где вместо R2 использованы группы ф-л 2 - 7 с отсутствующими по соответствующему азоту группами: R3 - R10, или соль этого продукта. Реагент 2: соединения ф-лы QY, где Q значениям R3 - R9, Y - удаляемая группа. Реакцией этих реагентов получают целевой продукт ф-лы 1. При необходимости, в полученном соединении, где R3 - R9 и каждый представляет (низший)алкоксикарбонил(низший)алкил, удаляют низшую алкильную группу. Структура группы ф-лы 2 - 7:
, где R1 - фенил, R2 - группа ф-лы 2 - 7, R3 - алкил, гидроксиалкил, алкоксиалкил, алкоксикарбонил, карбомоилалкил или N, N-диалкил (или совместно образуют пиридиновое кольцо); R4 - карбоксиалкил или алкоксикарбонилалкил; R5 - алкоксикарбонилалкил; R6 - алкил, карбоксиалкил или алкоксикарбонилалкил; R7 - Н, карбокси- или цианогруппа, алкоксикарбонил; R8 - карбоксиалкил или алкоксикарбонилалкил; R9 - алкил, карбоксиалкил, алкоксикарбонилалкил; R10 - Н или ОН, причем во всех случаях использованы низшие алкилы. Реагент 1: продукт ф-лы 1, где вместо R2 использованы группы ф-л 2 - 7 с отсутствующими по соответствующему азоту группами: R3 - R10, или соль этого продукта. Реагент 2: соединения ф-лы QY, где Q значениям R3 - R9, Y - удаляемая группа. Реакцией этих реагентов получают целевой продукт ф-лы 1. При необходимости, в полученном соединении, где R3 - R9 и каждый представляет (низший)алкоксикарбонил(низший)алкил, удаляют низшую алкильную группу. Структура группы ф-лы 2 - 7: 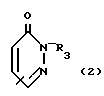
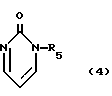
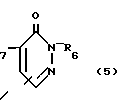
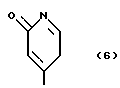 или
или 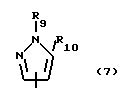
Способ получения пиразолпиридинового производного общей формулы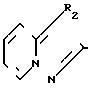 R1
R1
где R1 - фенил;
R2 - группа общей формулы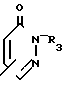 ;
; 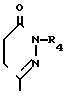 ;
;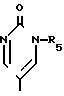 ;
; 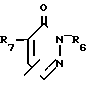 ;
; или
или 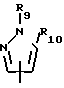
где R3 - низший алкил, гидрокси(низший алкил), низший алкокси(низший алкил), карбокси (низший)алкил, низший (алкоксикарбонил (низший)алкил, карбамоил(низший)алкил, или N, N-ди(низший)алкилкарбамоил(низший)алкил, где две низшие алкильные группы у атома азота могут быть соединены одна с другой, образуя пиперидиновое кольцо,
R4 - карбокси(низший)алкил или низший алкоксикарбонил(низший)алкил;
R5 - низший алкоксикарбонил(низший)алкил;
R6 - низший алкил, карбокси(низший)алкил или низший алкоксикарбонил(низший)алкил);
R7 - водород, карбокси, низший алкоксикарбонил или циано;
R8 - карбокси(низший)алкил или низший алкоксикарбонил(низший)алкил;
R9 - низший алкил, карбокси(низший)алкил или низший алкоксикарбонил(низший)алкил;
R10 - водород или гидрокси,
или его соли, отличающийся тем, что соединение общей формулы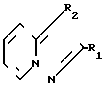
где R1 имеет указанные значения;
R2 - группа общей формулы;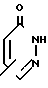 ;
; 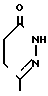 ;
;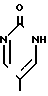 ;
;  ;
;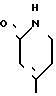 или
или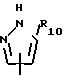 , где R7 и R10 имеет указанные значения;
, где R7 и R10 имеет указанные значения;
или его соль, подвергают реакции с соединением общей формулы
QY,
где Q имеет значения R3 - R8 и R9;
Y - удаляемая группа и при необходимости в полученном соединении, где R3 - R8 и R9 каждый представляет низший алкоксикарбонил(низший)алкил, удаляют низшую алкильную группу,
с получением соединения формулы I, где R3 - R8, R9 представляют собой каждый карбокси(низший)алкил, с выделением целевого продукта в свободном виде или в виде соли.
Авторы
Даты
1994-02-15—Публикация
1990-01-22—Подача