Изобретение касается вакцин против синдрома приобретенного иммунного дефицита (СПИДа), содержащих антитела или их эквиваленты, и лечения и профилактики СПИДа с использованием таких вакцин.
СПИД впервые был обнаружен в США в конце 70-ых годов, когда считали, что это заболевание довольно редкое. Однако с тех пор он получил быстрое распространение и в настоящее время темпы его развития достигли огромных масштабов. Данный вирус заражает главным образом клетки иммунной системы, в частности клетки лейкоцитов, несущих молекулу рецептора СD4 или Т4, кроме того, недавно было обнаружено, что он заражает также клетки нервной системы и клетки последовательности клеточных поколений моноцит-макрофаг.
Если СПИД развивается после заражения данным вирусом (вирус человеческого иммунного дефицита НIV), то субъект сначала становится чувствительным к условно-патогенным инфекциям за счет вируса, делающего иммунную систему непригодной из-за инфекции клеток-помощников СD4. Были распознаны четыре стадии инфекционного заражения. Прогрессивная генерализованная лимфаленопатия (РGL) характеризуется общим недомоганием и хроническими заболеваниями, вызванными другими слабыми инфекциями. Относящийся к СПИДу комплект (АРС) связан с общим ослаблением и хроническими заболеваниями, в то время как состояние, известное как СПИД, характеризуется по меньшей мере одним приступом пневмонии Pneumolystis carynii и обычно саркомой Koposi. Хотя жертвы обычно умирают при сильной форме условно-патогенной (патогенных) инфекции (инфекций), невозможно, чтобы они погибали просто лишь от заражения вирусом человеческого иммунного дефицита (НIV), поскольку данный вирус способен заражать центральную нервную систему (СNS), что приводит к смертельному исходу от нейрологического истощения.
В настоящее время НIV известен как вирус человеческой иммунной недостаточности типа I (НIV-I) и является ретровирусом, относящимся к лентивирусам. Индекс "I" необходим ввиду того, что с тех пор как были получены исходные изоляты в Западной Африке были найдены другие относящиеся к ним вирусы. Эти новые вирусы были выделены из организма пациентов с заболеванием типа СПИД (LAV-2) или из организма здоровых субъектов, сыворотки которых перекрестно взаимодействуют с антигенами (НТLY-IV) вируса иммунного дефицита обезьяны (SIV).
Оба этих вируса близко связаны с вирусом SIV, изоляты были получены от макак резус, африканских зеленых обезьян и черных мангобей. Это небольшая перекрестная реактивность, измеряемая методами иммунноферментного твердофазного анализа (ELISA), точечного метода Вестерна и анализа иммунопреципитации, происходит между сыворотками от пациентов с инфекционным заражением НIV-1 и HIV-2 или антигенами SIV с их гликобелковыми оболочками и аналогично между сыворотками от субъектов с гликобелковой оболочкой НIV-2 и HIV-1. Сыворотки от субъектов, инфекционно зараженных НIV-2, действительно показывают слабую перекрестную нейтрализацию вируса НIV-1, что соответствует тому факту, что имеется относительно небольшое число защищенных зон гомологии последовательности между зонами оболочки НIV-I и HIV-2. Однако несмотря на общее отсутствие перекрестной реактивности, вирусы НIV-1, НIV-2 и STV являются тропическими для одного и того же семейства лимфоцитов.
Было сделано много попыток найти способ лечения или найти вакцину против СПИДа. Препятствием для выявления способа лечения является тот факт, что НIV является ретровирусом, и после того как произошло инфекционное заражение, невозможно полностью удалить вирус из организма. Хотя попытки вести поиски в этом направлении еще продолжаются, важно то, что была найдена вакцина, способствующая предотвращению инфекции. Препятствием для разработки вакцины является способность данного вируса изменять иммуногенные детерминаты его белковой оболочки.
Недавно целый ряд работ был посвящен подгруппе вакцин с использованием основного гликобелка оболочки вируса НIV, кодированного геном env, либо в форме, очищенной от врожденного вируса, либо в форме рекомбинантного белка от бактерий, вакцин, вирусов SV40, или клеточной линии млекопитающих животных, либо в форме синтетических пептидов. Такой подход дал различные результаты. Иммунизация животных некоторыми из этих продуктов выявила специфическую реакцию антитела, которая в некоторых случаях заключает в себе нейтрализующее действие. Однако наблюдаемое нейтрализующее действие было относительно слабым и было специфическим для изолятов вследствие указанной изменчивости белков оболочки между изолятами.
Все изложенное вместе с тем фактом, что реакция нейтрализующего антитела у человека также является слабой, по всей вероятности не обеспечивающей защиту и, кроме того, в некоторой степени специфической для изолятов, говорит о неспособности создания в достаточной мере защитной иммунной реакции против белка оболочки, представленной либо в его естественной форме, либо в виде рекомбинантного или синтезированного продукта.
Для вакцины была предложена возможность использования антител антиидиотипа (анти-Id), т.е. антител, имеющих связывающую точку, которая распознает связывающую точку естественного антитела, или идиотипа (Id), действующего против антигена (Аg). Такой подход к решению проблемы также имеет недостаток, связанный с изменчивостью продукта env. Преимущество использования антитела антиидиотипа в вакцине заключается в том, что оно может принимать форму рецептора вируса или белка оболочки вируса. Однако продуцирование антител антиидиотипа (Ab-2), которые являются точным зеркальным отображением связывающих точек обычных антител (Ab-1), является еще более затруднительным, чем продуцирование Ab-1, поскольку при этом не только должно продуцироваться исходное антитело, которое само по себе полезно, что пока невозможно, но и антиидиотип должен распознавать лишь связывающую точку или паротоп идиотипа.
Были сделаны попытки найти антитело антиидиотипа, которое распознает эпитоп вируса НIV, но такие исследования были неудачными. Попытки найти антитело Ab-1, распознающее вирус НIV за счет использования env, имели лишь ограниченный успех в том, что нейтрализуются лишь определенные штаммы вируса НIV.
Недавно было обнаружено, что НIV связывается с любой клеткой, выражающей сигнальный ген CD4, и что антитела против эпитопов данного сигнального гена блокируют связывание данного вируса. Продуцирование подходящих антител в нужныхх количествах вне организма хозяина фактически невозможно и попытки продуцировать вакцину, стимулирующую генерацию таких антител, не были успешными. Изучаемые до сих пор вакцины заключали в себе синтетические пептиды, принимающие форму эпитопа СD4, распознаваемого вирусом НIV. Эти вакцины были нестойкими из-за того, что они не принимали правильной конфигурации непосредственно при их использовании. Недавно, используя моноклонные антитела CD4, была построена карта эпитопов на СD4, которые очень важны в связывании НIV-1. Было показано, что эпитопы СD4, участвующие в связывании сильно различающихся изолятов вируса НIV, очень близки. Обнаружено, что НIV, НIV-2 и некоторые изоляты SIV используют антиген СD4 как клеточный рецептор в человеческих клетках, что эпитопы при связывании очень близки и что выражение данного рецептора снижает последующую инфекцию.
Было проведено тщательное изучение иммуноглобулиновых идиотипов (Id), поскольку они были впервые распознаны на индуцированных антителах у человека и кроликов. Сетчатая теория иммунорегуляции охватывает концепции, касающиеся идиотипии, и постулирует, что сетки Id за счет реакций Id-анти-Id могут быть включены в регуляцию иммунной системы. Согласно дефиниции терминов Id представляет собой антигенные детерминанты, ассоциированные с изменчивой (V) зоной молекулы антитела. Так, Id может ассоциироваться с точками, входящими в связывание антитела (образованными дополнительно) и/или точками в пределах зоны V, в которой антиген несвязан (мостиковая связь). Id может быть окружен серологическими контрпарами, относящимися к анти-Id. Согласно другой возможности Id и анти-Id относятся соответственно к Ab-1 (первое антитело) и Ab-2 (второе антитело).
Вместе с ретровирусами (как другими вирусами, наделенными оболочкой) эти антигенные детерминаты, ассоциированные с индукцией нейтрализующих антител, обнаруживаются на поверхности гликобелков оболочки.
Генный продукт оболочки вируса НIV синтезирован как полибелковый предшественник, далее он подвергается гликозилированию в инфекционно зараженных клетках. Этот гликозилированный белок с мол.в. 160 к Дальтон (др 160) обрабатывается превращением в субмолекулярную структуру с концевой аминогруппой (др.120) и в субмолекулярную структуру транс-мембраны с карбоксильной группой, др 41.
Проведенные ранее исследования с анти-Id и вирусом гепатита В показали, что внутреннее изображение анти-Id (Аb-2в), который принимает форму исходного антигена, может индуцировать иммунную реакцию Id+анти-НВs+, которая заключает в себе 1d вместе с мышиным анти-НВs+, продуцируемым НВsAg. В противоположность этому анти-НВs, индуцированный АВ-2, выражает Id, который обычно не присутствует в ходе иммунной реакции на НВsAg. Аналогичные результаты были получены для системы ТМУ Id, где Аb-2α индуцировало анти-ТМУ реакцию в мышах ВАLB/с, которая заключала в себе Id вместе с исходным кроличьим анти-ТМУ, используемым для генерации анти-Id.
Таким образом, два различных класса анти-Id могли индуцировать антивирусные реакции без воздействия вирусных антигенов или без иммунизации вирусными антигенами.
Аналогичные результаты были получены с Аb-2α и Аb-2 β, индуцирующими антифосфорилхолиновую иммунную реакцию у мышей.
В данном изобретении предусматривается вакцина, пригодная при использовании для создания иммунитета против вируса типа СПИД и включающая антитело или антитела, или их идиотипические фрагменты, или их эквивалент, направленные либо против вируса типа СПИД, либо против его клеточного рецептора, и нетоксичный фармацевтически пригодный носитель.
Предусматривается способ создания эффективного иммунитета против вирусов типа СПИД у людей, заключающийся в вводе в организм описанной выше вакцины.
Вакцины, отвечающие данному изобретению, особенно пригодны для лечения и профилактики заболеваний типа СПИД. Ранее это было невозможно по изложенным причинам. Использование вакцин освобождает от необходимости вакцинации против каждого индивидуального типа относящегося к СПИДу вируса и обеспечивает универсальную защиту от таких вирусов, разрешая при этом проблему отсутствия иммуногенности естественных вирусных белков.
Кроме того, в изобретении предусматривается способ лечения людей от инфекционного заражения вирусом НIV, заключающийся в вводе в организм эффективного количества вакцины, оказывающей антиСПИДовое действие.
Под термином антиСПИДовое количество имеется в виду то количество вещества или смеси веществ, которые могут в значительной мере предотвращать или устранять инфекционное заражение НIV или другими ретровирусами, вызывающими по меньшей мере один симптом типа СПИД у человека или других млекопитающих животных. Понятие "ретровирусный" относится к тем ретровирусам, которые ответственны за иммунную недостаточность, и особенно к тем, которые вызывают проявление одного или нескольких симптомов, обычно ассоциированных со СПИДом, у человека или других млекопитающих животных.
Вирусы типа СПИД это такие вирусы, которые основаны на распознавании сигнального гена СD4 на неэффективность действия. Следует отметить, что когда указанные вакцины содержат антитела и т.д., которые принимают форму или зеркально отображают распозначительный эпитоп гена СD4, то одна вакцина способна создать иммунитет ко всем вирусам типа СПИД. Этими вирусами типа СПИДа являются предпочтительно вирусы, инфекционно заражающие людей, в частности НIV-1, LAV-2 и НТLY-IV.
Под термином mAb имеется в виду антитело, его диотипный фрагмент или его эквивалент, а также поликулональные антитела, фрагменты и их эквиваленты и в любом случае распознавание вируса типа СПИД или его клеточного рецептора. Данный термин включает также те mAb, которые создаются прививкой СDR (дополнительно детерминирующей зоны), например такие, которые получаются путем прививки СDR от мышиного антитела к человеческому антителу. Фрагменты mAb представляют собой соответственно фрагменты Fab и Fab21 или отображающие их колнированные или синтетические последовательности.
Некоторые эпитопы СD4 (как распознаваемые СD4 mAbs) играют более важную роль в связывании и инфекции вирусами типа СПИД, чем другие. Это определяется по эффективности блокирования синцития (соклетия) под действием mAbs и по способности к перекрестной конкуренции друг с другом. Такой характер подавления высоко воспроизводим, например, с четырьмя отличающимися друг от друга изолятами вируса НIV-I.
В примерах CD4 mAbs разделены на три группы: 1) те, которые эффективны при блокировании взаимодействия НIV - СD4 и действуют таким образом независимо от вирусного изолята или его типа, 2) те 2 mAbs, которые явно неспособны блокировать образование синцития (соклетия) с любым из вирусов или их изоляторов, 3) те 4 mAbs, которые проявляют слабое действие при блокировании синцития и имеют неодинаковую способность блокировать различные изоляты и типы. Эти результаты показывают, что очень близкие эпитопы СD4 включены в связывание env во всех подвергаемых испытанию вирусах.
Связывающая точка вирусов иммунного дефицита является также высоко сохраняемой зоной. Обычно гомология последовательности в гене env различных изолятов вируса НIV-I изменяется за величину вплоть до 30%. Еще большее несходство имеет место между НIV-I и LAY-2 лишь с 41,7% сохраняемой последовательностью по всему гену env. Данные, полученные в результате исследования, в которых образец, содержащий ген env от LAY-1, взаимодействовал с геномом LAY-2 и STLV-IIImac (SICmac), показали отсутствие явной гибридизации между этими зонами.
Аналогичные результаты были получены, когда геном STLV-III был отобран вместе с зоной env LTR вируса HIV-I, в котором наблюдалась лишь очень слабая реакция. При сопоставлении ограничительной карты НТL V-IV с ограничительными картами STLV-IIImac и STLV-IIIaym были обнаружены лишь очень незначительные различия. Эти данные соответствуют данным незначительной реактивности, наблюдаемой между основным гликобелком оболочки вируса НIV-I и реакционными антисыворотками НIV-2 или SIV или наоборот между env продуктом вируса НIV-2 или SIV и антисывороткой вируса НIV-1 3,4.
Важность этих открытий заключается в том, что не обнаружено никаких сохраняемых зон env продукта, по отношению к которым проявляется значительная иммунная реакция. Учитывая то, что связывающая точка вируса гена СD4 в высокой степени сохранена, становится совершенно ясным, что эта связывающая точка недостаточно иммуногенна для того, чтобы вызвать реакцию антитела.
Это может быть результатом "скрытого" эпитопа, который проявляется лишь при близком приближении к гену СD4, маскировки эпитопа путем гликощилирования или под действием салициловой кислоты, принятия формы аутоантигена, например МНС-II, или неконформационного эпитопа, на который В-клетки неспособны реагировать.
Особенно важное преимущество данного изобретения заключается в том, что предложены Id, анти-Id и их эквиваленты, которые распознают обычно недоступный эпитоп на вирусе НIV, обеспечивая таким образом защиту.
Следующее преимущество данного изобретения заключается в том, что предусматриваются противодействующие (или антагонистические) Id, анти-Id и их эквиваленты, которые могут индуцировать те, которые описаны выше.
Модуляция выражения антигена CD4 после выражения клеток вирусом НIV-I происходила в патогенезных процессах при заболеваниях, связанных с данным вирусом. Кроме того, инфекция клеток, несущих СD4, вызванная вирусами иммунного дефицита человека или обезьяны, приводит к значительному снижению СD4.
Все известные вирусы типа СПИДа с возможным исключением НТLV-IV, как известно, вызывают у естественных хозяев синдром типа СПИД; возможно, что эффект чрезмерного снижения нормального выражения СD4 значителен при патогенезе данной вирусной инфекции.
Сочетание др 120 вируса НIV-I с СD4 подавляет активацию Т-клеток в ответ на РНА в конечных клетках, что говорит о том, что потеря функциональных эпитопов или интернализация СD4 приводит к потере некоторых иммунных функций. Таким образом, согласно данному изобретению желательно, чтобы вакцины не были направлены на активное связывание сигнального гена СD4.
Согласно данному изобретению могут использоваться мимотипы указанных антител. Под термином мимотип имеется в виду пептид или пептидное производное, в частности синтезированное для связывания паратопа данного антитела. Мимотипы могут быть получены согласно способам Geysen H.M. и др..
Кроличья антисыворотка, действующая против естественной антигенной детерминанты, ассоциированной с др41, нейтрализует ифективность вируса НIV в условиях ин витро. Данный эпитоп был индентифицирован путем продуцирования антисыворотки в экспериментальных животных, действующей против синтетического пептида (мимотипа), аналогичного последовательности аминокислотных групп 735-752 изолята НТLY-IIIB вируса HIV.
Данное изобретение предусматривает воспроизведение реагента анти-Id, распознающего Id на антителах, действующих против HIV, особенно др 41, синтетического пиптида.
Иммунизация анти-Id индуцирует антипептидную реакцию у мышей BALB/c, которая связывает препарат рекомбинанты др 160. Серологически, индуцированная анти-Id мышиная анти-HIV реакция подавляет Id-анти-Id реакцию и выражает Id, отличный от мышиного анти-HIV, продуцируемого путем иммунизации синтетическим пептидом др41. Эти результаты показывают, что сетки Id принимают участие в модуляции иммунной реакции на НIV.
Было продемонстрировано продуцирование антиидиотипных антител (анти-Id)3 к антителам шимпанзе, направленным против синтетического пептида, соответствующего естественному эпитопу, ассоциированному с др41 гликобелковой оболочки вируса человеческого иммунного дифицита (НIV) у кроликов. Данный пептид аналогичен последовательности аминокислотных групп от 735 до 752 от изолята НТLY-IIIВ вируса НIV.
Иммунизация мышей ВАL B/c анти-Id индуцирует антипептидную реакцию, которая связывает препарат рекомбинантного др160 без последующего экспонирования пептида или др160.
Описанные примеры показывают, что возможно индуцирование популяции Id+ с анти-НIV специфичностью путем иммунизации анти-Id. Кроме того, когда данные вакцины содержат антитела или их эквивалент, например мимотипы, которые принимают форму или зеркально отображают распознавательный эпитоп СD4, происходит ревакцинация рекомбинантным env (например, получаемым из benentech Ine. Калифорния, США) в форме вакцины. Хотя затравку рекомбинантным env не осуществляли, после установления реакции была произведена ревакцинация.
Используемые антитела могли быть либо идиотипными, либо антиидиотипными, либо антителами, воспроизводимыми из них прямым или косвенным образом. В вакцине можно использовать любой тип антитела, обеспечивающего либо активный, либо пассивный иммунитет. Пассивный иммунитет обеспечивается путем инъекции антитела в достаточно большой дозе, чтобы обеспечить защиту от СПИДа как такового. Активный иммунитет может быть создан путем вакцинации иммуногенным количеством антитела, способным вызвать продуцирование антиидиотипа к первому антителу.
Некоторые моноклонные антитела (mAbs) действуют против сигнального гена СD4, включая ОКТ4а и Leu 3а. Они могут быть использованы в вакцинах по данному изобретению. Так, например, создаваемый антиидиотип связывается с оболочкой вируса HIV и особенно с продуктом 120 kD env (др120 или др41). Однако не все антиидиотипы, действующие против mAbs, распознающих сигнальный ген СD4, должны обязательно связываться с HIV, поскольку HIV связывает лишь один или некоторые из эпитопов, присутствующих в молекуле СD4.
Антиидиотипы к таким mAbs, как Leu 3а и ОКТ4а, используемые в качестве компонентов указанных вакцин, создают антиантиидиотипы (Аb-3, известные так же как Ab-I1 ), распознающие СD4 и способные маскировать связывание HIV путем блокирования рецептора.
Хотя согласно данному изобретению могут использоваться любые антитела, желательно, чтобы создаваемый иммунитет был направлен против вирусов, а не против клеточного рецептора. Так, в случае использования анти-СD4 mAbs желательно приготовление вакцин таким образом, чтобы была вызвана реакция антиидиотипа у пациента, и при вводе антиидиотипа анти-СD4 mAb желательно приготовление вакцины таким образом, чтобы она сообщала пациенту пассивный иммунитет.
Согласно одному из аспектов данное изобретение касается главным образом антител антиидиотипа. При использовании в вакцине антиидиотипа существует необходимость в том, чтобы вызвать реакцию антиидиотипа. При использовании антиидиотипа он может служить либо для того, чтобы вызвать реакцию антиантиидиотипа, либо в качестве пассивной вакцины.
Согласно другому аспекту, данное изобретение касается антиидиотипов, но с использованием продуктов генной инженерии или антител, способных маскировать описанные действия. Обычно желательно, чтобы индуцирующие активный иммунитет вакцины содержали компонент антитела, зеркально отображающий сигнальный ген СD4, и чтобы пассивные вакцины содержали компоненты антитела, принимающие форму сигнального гена СD4. Ввод в организм вакцин, отвечающих данному изобретению, различен в зависимости от ряда обстоятельств, включающих такие факторы, как возраст, вес и общее состояние пациента. Вакцина может вводиться в организм в виде единичной достаточной дозы либо в виде серии доз в течение определенного периода времени. Повторение дозированного ввода препарата для активной иммунизации либо для сохранения иммунитета обычно желательно также в последующий период, обычно в последующие три месяца, но такое усиленное дозирование может быть осуществлено и в более ранний период или в любой период времени в течение оставшейся жизни пациента и необходимо столько же повторений.
Для простоты использования вакцины может быть использован фармацевтический солевой раствор в качестве носителя антитела или антител. Однако поскольку реакция антиидиотипа на такую рецептуру обычно не очень сильная, то желательно использовать адъювантный синергист.
Особенно ценными белками адъювантного синергиста и носителя, используемыми в данном изобретении, являются гемоцианин фиссуреля (KLH) и квасцовые препараты, примеры которых даются ниже. Было определено, что использование этих веществ приводит к значительному усилению реакции Аb-2. Антигены, не связанные с белком носителя, могут быть слабо иммуногенными или даже совсем неиммуногенными.
Когда желателен пассивный иммунитет, то не требуется никакого адъювантного синергиста. Однако, если создается антиидиотивная реакция, то адъювантный синергист вместе с иммуностимулирующим количеством mAb особенно полезен.
В случае, когда желательно использование предлагаемой вакцины с целью профилактики, то обычно предпочтительно использование тех вакцин, которые пригодны для стимулирования активного иммунитета. Вакцины, придающие активный иммунитет, пока еще находят профилактическое использование, где имеется риск прямого инфекционного заражения НIV или где предполагается, что активный иммунитет не может быть создан или не может быть создан достаточно быстро.
Когда вакцины предназначены для лечения заболеваний, вызванных инфекционным заражением HIV, то обычно желательно использовать те вакцины, которые способны сообщать пассивный иммунитет для оказания быстрого антиСПИДового действия. Вакцины, пригодные для стимулирования активного иммунитета, могут быть использованы в данных условиях, обеспечивая длительное эффективное действие. При использовании адъювантного синергиста он может вводиться вместе с mab в тех же или других препаратах или отдельно в момент времени, отличный от момента ввода вакцины.
Вакцины, отвечающие данному изобретению, обычно вводятся в организм общепринятым путем, например, они могут вводиться путем внутрибрюшинной, внутримышечной или подкожной инъекции, путем кожного надреза или орально. Такие вакцины обычно содержат фармацевтически пригодный носитель и при желании адъювантный синергист, вещества, придающие вакцине изотоничность с жидкостями организма, и по мере необходимости ароматизирующие средства, эмульгаторы и другие компоненты.
Вакцины, вызывающие пассивный иммунитет, обычно содержат большую дозу mAb, достаточную для создания пассивного иммунитета у пациента. Вакцины для создания иммунной реакции обычно содержат иммуностимулирующее количество Аb, которое обычно меньше того количества, которое требуется для пассивного иммунитета. Такие вакцины могут быть подразделены для отдельного ввода, либо одновременно друг с другом, либо с разрывом по времени, желательно через неделю.
П р и м е р 1. Продуцирование и скрининг антисыворотки антиидиотипа у мышей.
А. Сопряженное связывание моноклонного антитела (mAb) с гемоцианином фиссурелли (КLH).
mАb в форме очищенного иммуноглобулина (1 г) в фосфатном буферном солевом растворе Дюлбекко "А" (РВS "А") подвергали дальнейшему разбавлению в РВS "А" до концентрации 1 мг/мл. Гемоцианин фиссурели (КLH) растворяли в РВS"А" до концентрации 1 мг на мл и диализировали в течение ночи со 100 об. РВS "А" при 4оС. 1 об. раствора mАb смешивали с 1 об. раствора КLH, реагенты сопряженно сцеплялись путем ввода 1 об.% раствора 28%-го глутарового альдегида. После реакции в течение 1 ч при комнатной температуре раствор диализировали со 100 об. РВS "А" в течение ночи при 4оС.
В. Иммунизация мышей.
1.1. Затравка мышей комплексом mАb/KLH
Комплекс mАb/KLH концентрацией 1 мг/мл эмульгировали равным объемом полного адъювантного синергиста Фреда (FCA) до образования эмульсии вода в масле. 200 мл эмульсии, содержащей 100 мкг комплекса mАb/KLH, инокулировали подкожно (SC), вводя ее под кожу живота каждой имбредной мыши Ваlb/C имперского Фонда Исследования рака (ICRF).
1.2. Ревакцинация мышей.
Через 28 дней после затравочной инокуляции мышей 200 мкл эмульсии вода в масле, 100 мкг комплекса mАb/KLH в равных объемах неполного адъювантного синергиста Френда (FIA) инокулировали под кожу брюшка и 200 мкл вводили в бедренную мышцу правой задней ноги.
Спустя 10 дней осуществляли кровопускание из хвоста мышей (с получением примерно от 100 до 200 мкл крови) и мышей оставляли в покое. Через 14 дней после первой ревакцинации каждую мышь подвергали последующей ревакцинации, вводя в брюшную полость 200 мкл раствора mAb/KLH, содержащего 200 мкг данного комплекса. Через 10 дней осуществляли кровопускание из хвоста мышей, как и ранее, и проводили еще одну ревакционную инокуляцию. Спустя еще 10 дней снова осуществляли кровопусканне из хвоста и затем мышей оставляли в покое.
С. Исследование сыворотки на антиидиотипную активность (i). Радиоиммуноанализ связывания на пластинах.
Моноклонное-Id-антитело концентрацией 50 мкг на мл в РВS "А" вводили в 96-ячеистую пластину Кука (Сооke) в количестве 50 мкл на ячейку. После инкубирования при 4оС в течение ночи пластину трехкратно промывали РВS "А"/1% ВSA, затем инкубировали дополнительно с 50 мкг на ячейку РВS "А"/1% ВSА в течение 1 ч при 37оС. Затем РВS "А" заменяли антисывороткой от иммунных мышей при разбавлениях 1/10 или более в РВS "А"/1% ВSА. Отрицательными контрольными группами были лишь РВS А/ВSА, разбавленные растворы сыворотки предиммунных или нормальных мышей, положительная контрольная группа представляла собой многовалентную кроличью антимышиную сыворотку концентрацией 20 мкг/мл или ее разбавленные растворы. Пластину инкубировали в течение 1 ч при 37оС, трехкратно промывали, как указано, и вводили в каждую ячейку от 2000 до 4000 специфических единиц в минуту (СРМ)125I-меченого Id в 50 мкл РВS "А"/ВSА. По прошествии часа пластину снова промывали, ячейки наполняли воском и определяли СРМ для каждой ячейки на ультрограмме LКВ.
Результаты анализа были выражены в процентах 125I-меченой связи с поперечным сцеплением у испытуемых образцов по сравнению с максимальным значением СРМ для положительной контрольной группы.
(ii) Анализ на подавление связывания.
От 2000 до 5000 специфических СРМ антитела идиотипа, меченого 125I, смешивали с антисывороткой от иммунных мышей с различными разбавлениями и инкубировали их при 4оС в течение 0,5 ч на 96-ячеистой пластине Кука. Затем вводили несущие СD4 клетки СЕМ концентрацией 105клеток на ячейку, после чего осуществлялось инкубирование, как указано выше. Клетки трехкратно промывались в РВS "А"/1% BSA путем центрифугирования, ячейки заполнялись воском и измеряли СРМ, связанные с клетками с помощью ультраграммы LКВ.
Д. Скрининг антисыворотки на вирусоспецифическую реактивность.
Непрямое иммунолюминесцентное окрашивание зараженных вирусом клеток
Клетки СЕМ как незараженные, так и зараженные вирусом НIV, инкубировали при концентрации 105 клеток в 50 мкл МЕМ с 2% FCS и 0,1% азида натрия на ячейку 96-ячеистой пластины в течение 0,5 ч при 4оС с 50 мкл как иммунной антисыворотки, так и нормальной мышиной сыворотки с разбавлением 1/10. Клетки трехкратно промывали путем центрифугирования с пропусканием через МЕМ/2% FCS/0,1% азид натрия, затем снова суспензировались в кроличьем многовалентном антимышином 1 г FITC коньюгате (Сигма) с разбавлением 1/100 и инкубировались, как указано выше. Далее клетки еще раз трехкратно промывались, снова суспензировались в 200 мкл МЕМ/2% FCS/0,1% азида натрия при 4оС и определяли процент флюоресценции путем анализа в анализаторе FACS Бектона Дикинсона.
Е. Испытание антисыворотки на нейтрализующее вирус действие.
Подавление индуцированного вирусом образования синцития (соклетия)
Образование вирусоспецифического синцития индуцировали путем смешивания продуцирующей НIV клеточной линии (Н9) с сущей СD4 линией (jМ или С8166) в соотношении 1: 5 в RРМI 1640 + 10% FCS, инкубирования в течение ночи при 37оС. Можно определить подавление образования синцития путем блокирования взаимодействия СD4 - НIV, либо посредством СD4 mAbs, либо посредством антител, направленных против гликобелка оболочки данного вируса. Специфицеское подавление образования синцития посредством реагента, взаимодействующего с вирусом, а не с рецептором, может быть продемонстрировано путем двухэтапного анализа. Антисыворотку с различными степенями разбавления вводили в 105 индикаторных клеток в 50 мкл МЕМ/FCS и инкубировали в течение 0,5 ч при 4оС. Клетки трехкратно промывались и смешивались с продуцирующей НIV клеточной линией в соотношении 5:1. Равное число несущих СD4 индикаторных клеток инкубировали с антисывороткой и смешивали с продуцирующими вирус клетками без какой-либо промывки. Блокирование синцития во втором, но не в первом анализе показал подавление взаимодействия вирус-рецептор на вирусе, а не рецепторе.
Испытуемая антисыворотка имела анти-Id активность, обнаруживаемую при разбавлениях не менее чем 1:250 или 1:200 (табл.1). Эта активность была специфической для иммунизации Id mAb (антисыворотка не связывалась с иррелевантными вантителами или с ОКТ4, mАb, распознающим другой эпитоп СD4) и могла быть блокирована путем ввода Id mАb в антисыворотку в данном анализе.
Окрашивание живых клеток от СЕМ клеток антисывороткой от мышей, иммунизированных любыми mАbs, или окрашивание СЕМ/СВL I клеток антисывороткой от мышей, иммунизированных МТ151, было равноценно окрашиванию обычной мышиной сывороткой. Однако сыворокта от мышей, иммунизированных Leu 3а, окрашивала клетки СЕМ/СВLI при разбавлении 1:10. Для подтверждения того, что сыворотки от мышей Leu За взаимодействовали с вирусоспецифическим агентом, они использовались для иммунопроципитации от меченых 35S-метионином СЕМ клеток незараженных либо зараженных НIV изолятами СВLI или HTLV-IIIRF. Области с молекулярным весом 120 КДальтон были специфически преципитированы из инфекзионно зараженных НIV клеток СЕМ. Никаких областей с даннным молекулярным весом не было обнаружено в контрольном преципитате от незаряженных клеток СЕМ.
Данные антисыворотки оценивались также в анализе на подавление синцития. Ни сыворотка от иммунизированных МТIS I (MAb, распознающий эпитоп СD4, отличный от эпитопа, распознаваемого Leu 3а или ОКТ4а) мышей, ни сыворотка от нормальных мышей не в состоянии подавлять индукцию синцития. Данные в табл. 1 показывают, что сыворотки от мышей, иммунизированных Leu 3а, в состоянии подавлять все испытуемые вирусные изоляты. Н9-АRY-2 нейтрализовался более эффектно, чем Н9/IIIB, и Н9 РUТ и RF требовали более высоких концентраций антисыворотки для подавления синцития.
П р и м е р 2.
А. Генерация моноклонных антиидиотипных антител.
Мышей ВАL В/С в возрасте от 3 до 5 недель иммунизировали путем внутривенного ввода дозой 30 мкг/мышь очищенного Leu-3a Mab (Becten-Dickinsen, Mounatain Ceiw, CA), приготовленого согласно изложенным ниже процедурам (i) или (ii). Было сделано 6 инъекций с недельными интервалами. Через 3 дня после последней инъекции мышей умерщвляли и клетки их селезенки сливали с клеточной линией миеломы NS-1.
(i) Сопряженное сцепление с KLН.
Рассчитать число молей антитела, ЕDАС и КLН, которое должно использоваться, исходя из количества антител, которые должны подвергаться сопряженному сцеплению:
Аb = х молей мол. в. 1g G = 150000
ЕDACх = 10000 (х) моль Igм = 900000
KLH+ = x/50 моль ЕDAC = 191
KLH = 1000000
1. Аb разбавляется в минимальном объеме ВВS или РВS, ЕDAK разбавляется в dH2О, КLН разбавляется в ВВS или РВS; 2. Охладить антитело до 4оС; 3. Добавить ЕDАС. Перемешивать в течение 30 с при 4оС;
4. Добавить КLН. Перемешивать в течение 2 ч при 4оС.
Перемешивать в течение ночи при 25оС.
5. Провести анализ на ВВS;
6. Осаждение квасцами. Белковый концентрат = Ab + KLН, *ЕDAC [1-этил-3-(3-диметиламинопропил)карбодиимид] , Кат.# Е-7750 сигма + КLН (гемоцианин фиссуреля) Кат # 374817 Calbiochem.
(ii) Осаждение квасцами.
Растворы: 10% АIKSO4 (Сульфат калия-алюминия, кат. # А-601 Fisher) в 0,005 мол. РВS, рН 6,2, отфильтрованный (дает 5,6 мг/мл окиси алюминия).
Процедура:
1) добавлять по каплям 0,4 мг окиси алюминия/50 мкг белка в раствор белка с одновременным перемешиванием при комнатной температуре. Довести объем до 10 мл путем добавления РВS;
2) Довести величину рН до 6,8-7,3. Раствор становится очень мутным;
3) выдерживать раствор в течение 2 ч при комнатной температуре так, чтобы квасцы абсорбировались при медленном перемешивании;
4) центрифугировать раствор со скоростью 3000 об/мин в течение 10 мин;
5) проверить оптическую плотность поверхностного слоя, содержащего неабсорбированный белок;
6) промыть гранулы в 0,85%-ном солевом растворе, отцентрифугировать;
7) повторно суспензировать гранулы в РВS до концентрации 100 мкг/мл.
В. Анализ связанного ферментов иммуносорбента.
Анализы HILV-III ELISA (Electro-Nucleonics nc, silver spring, MD) и LAY EIA (Genetics System, WA) осуществлялись согласно ТУ изготовителей.
Конъюгат козьего античеловеческого IgG фермента был заменен антителами козьей антимышиной пероксидазы конского редиса (Vector Laboratories, Burlingame, CA). Анализ методом ЕLISA c использованием псоралена и инактивированного ультрафиолетовыми лучами вируса НIV осуществляли известным способом. Поверхностный слой, содержащий культуру от клеток Н-9, инфекционно зараженных 7-дневным НIV (НТLV-III3), 10-кратно концентрировали и инактивировали путем воздействия (трехкратно) псораленом (Calbiochem, Сан-Диего, Калифорния) при конечной концентрации 10 мкг/мл и путем облучения ультрафиолетовыми лучами (360 нм) в течение 15 мин. Инактивированный НIV затем пропускали через колонку с сефарозой 4В. Свободную массу собирали и концентрировали для использования. Осуществлялся анализ ЕLISA с использованием пластин микротитратора, покрытых 50 мкл антигенов, концентрация которых была установлена путем использования коэффициента экстинкции 14 для 1%-ного раствора при 280 нм.
Для определения связывания НF 1,7 с Leu-3a асцитные жидкости от НF 1,7 или от контрольного моноклонного анти-Id (GB-2), распознающего идиотип, ассоциированный с mАb, специфическим для поверхностного антигена гепатита В, были фракционированы с 50%-м насыщенным сульфатом аммония. Полученный в результате содержащий иммуноглобулин осадок был снова суспензирован в солевом растворе, содержащем буферный раствор бората, и определяли концентрацию антитела с использованием коэффициента экстинкции 14 для 1%-ного раствора при 280 нм. Изменяя концентрации анти-Id, mAbs абсорбировались трехкратно в ячейках пластин микротитратора. После блокирования неспецифических точек 10%-ной козьей сывороткой (NGts) ячейки взаимодействовали с биотинилированным Leu-3а или с контрольным mАb, специфическим для большого опухолевого антигена вируса обезьяны 40 (антигена SV40). Данные антитела биотинилировались с использованием концентрации 7 мг/мл, при анализе использовали разбавление 1:1000 в 10% NGtS. После инкубирования в течение 1 ч при 37оС несвязанные антитела удалялись путем промывки и специфическое связывание определялось с использованием авидина - пероксидазы конской редьки и АВТS вместе с Н2О2.
С. Подавление связывания НF1.7 mAb с Leu-3а.
Пластины микротитратора покрывали 500 нг/ячейка Нf 1,7 mАb, очищенном путем адсорбции на белке А-сефарозе 4В (Pharmacia, Piscataway) и элюирования с этого адсорбента. После блокирования неспецифических точек в покрытые анти-Id ячейки пластин вводили в течение 1 ч 5 мкг различных ингибиторов. После инкубирования и промывки с целью удаления несвязанных антител вводили биотинилированный Leu-3а с разбавлением 1:1000 и осуществляли анализ методом ELISA, как описано выше.
Асцитные жидкости от ТС-1 или от контрольного моноклонного анти-Id, который распознает идиотип, ассоциированный с антителом, специфическим для поверхностного антигена гепатита В, фракционировали с 50%-ным насыщенным сульфатом аммония. Полученный осадок, содержащий иммуноглобулин снова суспензировали в солевом растворе, содержащем буферный раствор бората, и определяли концентрацию антитела с использованием коэффициента экстинкции 14 для 1%-ного раствора при 280 нм. Изменяя концентрации анти-Id, mАbs адсорбировалась в ячейках пластин микротитратора. После блокирования неспецифических точек 10%-ным NGts ячейки взаимодействовали с биотинилированным Leu-3a (А) или с контрольным mAb, специфическим для антигена SV40 (В). Данные антитела биотинилировались при концентрации 7 мг/мл и при анализе использовалось разбавление 1: 1000 в 10%-ном NGts. После инкубирования в течение 1 ч при 37оС несвязанные антитела удалялись путем промывки, специфическое связывание определяли с использованием авидина - пероксидазы конской редьки и АВТS вместе с Н2О2.
D. Иммунофлюоресцентное окрашивание.
Зараженные и незараженные жизнеспособные клетки Н-9 были получены путем центрифугирования с использованием градиентов Ficoll-Hypaque, их двукратно промывали окрашивающим буферным раствором (РВS с введением в него 5% FCS и 0,02% NaNз). Один миллион клеток взаимодействовал с НF1,7 анти-Id или с контрольной группой отрицательных антител того же изотипа в течение 30 мин при 4оС. Затем данные клетки промывались окрашивающим буферным раствором и взаимодействовали с антимышиным IgG (Сuppel Laboratories) козьим FITC еще в течение 30 мин при 4оС. После инкубирования клетки промывались, иммобилизировались в 0,37% -ом формальдегиде и анализировались с использованием анализатора Becton- Dickinson FACS, соединенного с ВD Consort 30 (Becton-Dickinson, Mountain View, CA). Для определения подавления связывания Leu-3а с клетками СD4+посредством НF 1,7 была использована человеческая Т клеточная линия СЕМ А3.0I. FITC-Leu-3a инкубировали с РВS, или с 10 мкг очищенного НF 1,7, или с 10 мкг контрольных анти-Id mАb в течение 1 ч при 4оС и вводили их в 5х105 клеток А3.01. Эти клетки инкубировались в течение 30 мин при 4оС и двукратно промывались и анализировались на анализаторе FACS.
Е. Нейтрализация инфекции НIV в условиях ин витро.
Одну тысячу или сто ТCID50 вируса НIV в 100 мкл инкубировали вместе с 100 mD НF 1,7, или контрольных анти-Id GB-2, или среды разведения в течение 1 ч при 37оС. Концентрации mАbS регулировали так, чтобы конечная концентрация составляла 0,5 мг/мл. После инкубирования обработанный вирус НIV вводили в 106 клеток А3.0I и инкубировали при 37оС в течение 2 ч в присутствии полибрена концентрацией 10 мкг/мл. Затем клетки промывали и снова суспензировали в 10% FCS RPMI 1640 с плотностью 106/мл. При указанных интервалах времени аликвоты жидкой культуры удаляли и определяли активность обратимой транскриптазы. Свободный от клеток НIV собирали из хронически инфекционно зараженной клеточной культуры А3.01, титровали на незараженных клетках А3.0I и титр выражали как инфицирующую дозу 50% культуры ткани (ТСID50).
Гибриды отбирались методом ЕLISA c использованием пластин, покрытых антигеном НIV (табл.2). Из 389 гибридов, подвергнутых испытанию, был найден один, который реагировал во всех трех анализах. Этот mАb, обозначенный НF 1,7, был клонирован дважды путем лимитирующего разбавления. Его изотоп был определен как Ig C2b. Для определения специфичности связывания НF 1,7 пластины микротитратора были покрыты взятыми в разных концентрациях HF1,7 и контрольным mАb, GB-2, они взаимодействовали с биотинилированным Leu-3a или биотинилированным контрольным mАb того же изотопа, что и Leu-3а, но распознающим антиген SV40 Т. HF1,7, анти-Id mАb был специфически связан с биотинилированным Leu-3a и контрольным анти-Id. Ни НF 1,7, ни контрольный анти-Id mАb не были связаны с биотинилированным контрольным mАb, специфическим для антигена SV 40. НF 1,7, анти-Id не реагировал с группой иррелевантных мышиных mАbs, которые включают Leu-I, Leu-2a, Leu-5b, Leu-8, Leu-M1 и IgG нормальных мышей.
При концентрации 5 мкг, иррелевантные mАbs не были способны значительно подавлять связывание Leu-3а с их анти-Id, предел подавления 0-5%, (табл.3). Leu-3а и два других mАbS, которые распознают молекулу СD4 (ОКТ-4 и Т4), были эффективными ингибиторами реакции Id-анти-Id. Эти данные показывают, что НF 1,7 распознают детерминанту Id на Leu-3а. Эта Id детерминанта составила долю других mAbS, которые распознавали СD4, но не присутствовала на mАbS, которые распознавали фенотипные сигнальные гены других лимфоцитов. Leu-3a, ОКТ-4А и Т4 блокируют в условиях ин витро инфекционное заражение вирусом НIV, так что способность подавлять реакцию Id-анти-Id взаимосвязана со способностью блокировать инфекционное заражение НIV в условиях ин витро.
Связывание НF 1,7 mАb c Leu-3а подтверждалось в другом эксперименте на подавление связывания с использованием цитометрии. В анализе с иммунофлюоресцентным окрашиванием с Leu-3а использовалась человеческая Т клеточная линия АЗ-01, примерно 95% которой выражала поверхностную СD4. Инкубирование Leu-3а с НF 1,7 анти-Id приводило в результате к частичному, но довольно значительному снижению интенсивности флюоресцентного окрашивания Leu-3а. На окрашивание Leu-3а клеток АЗ.01 незначительное влияние оказывало предшествующее инкубирование с контрольными анти-Id mАb. Эти данные подтверждают, что анти-Id связывает Leu-3а и частично подавляет связывание Leu-3a c поверхностным СD4, присутствующим на человеческих клетках Т. Следовательно, анти-Id должен распознавать по меньшей мере часть связывающей антитело точки на Leu-3а. Эти характеристики также являются подтверждением того, что HF 1,7 распознает детерминанту Id, ассоциированную со связывающей антитело точкой на Leu-3а.
Для определения выражения антигена, распознаваемого Н 1,7 на поверхности зараженных HIV клеток посредством анти-Id, был осуществлен непрямой иммунофлюоресцентный анализ на незараженных и непрерывно зараженных клетках Н-9. Анти-Id окрашивание зараженных клеток Н-9 приводило в результате к явному увеличению интенсивности флюоресценции, в то время как незараженные клетки Н-9 не окрашивались.
Примерно 25% зараженных НIV клеток Н-9 окрашивались НFI.7 анти-Id.
Для того чтобы определить кинетику поверхностного выражения антигена, распознаваемого анти-Id на клетках, зараженных НIV в условиях ин витро, человеческая Т клеточная линия АЗ-01 была заражена изолятом НIV, обозначенным как NY-5, и на 1-7 день заражения был осуществлен непрямой иммунофлюоресцентный анализ жизнеспособной клеточной мембраны с использованием анти-Id mАb. Антиген, распознаваемый НF 1,7, не был обнаружен вплоть до 4 дня заражения, момента, в который примерно 10-15% клеток АЗ.01 были окрашены. Таким образом, было установлено, что анти-Id распознает детерминанту (детерминанты), присутствующую на зараженных НIV клетках Т.
Для выявления характеристик антигена, реактивного по отношениею к НF 1,7 анти-Id, полосы нитроцеллюлозной бумаги (иммуноточечный анализ Био-Рэд), на которые электроточечным методом наносили антигены НIV, подвергались воздействию НF 1,7 или отрицательного контрольного анти-Id. Собранные человеческие сыворотки СПИДа использовались в качестве положительной контрольной группы при разбавлении 1:100. Человеческая антисыворотка распознавала характеристические белки вируса НIV р18 и р24 и gag предшественника р55 наряду с гликобелком оболочки gp120 и gр41. НF 1,7 анти-Id с молекулярным весом МI в пределах примерно 110-120 КДальтон. Никакой реактивности не было обнаружено к отрицательным контрольным mАb. Анти-Id распознавал гликобелок оболочки НIV, gр120, область, в которой НIV связывает молекулу СD4.
Способность НF 1,7 инактивировать НIV была определена в анализе на определение нейтрализации в условиях ин витро. Результаты представлены в табл. 3. Активность обратимой транскриптазы была подавлена в культурах, обработанных НF 1,7 анти-Id, способом, определяемым дозой вируса. Наиболее явное подавление вирусной репликации наблюдалось на 7-й день выращивания культуры, в которой наблюдалось подавление активности обратимой транскриптазы 58 и 90% при 1000 ТСID50 и при 100 ТСID50 вируса НIV соответственно. На 9-й день подавление активности обратимой транскриптазы у обработанных НF 1,7 культур снижалось до 44 и 80% при 1000 ТСID50 и 100 ТСID50 вируса НIV соответственно. В противоположность этому обработанные GB-2 культуры давали примерно такую же активность обратимой транскриптазы, что была определена в обработанных средой культурах. Повышенная активность обратимой транскриптазы у культур, обработанных ТСI mАb, на 9-й день выращивания культуры являлась вероятно результатом репликации НIV, которая устраняла инактивацию.
П р и м е р 3. Приготовление антител антиидиотипа ОКТ4а.
Мышей иммунизировали, как описано выше, посредством ОКТ4а, полученного способом, описанным в примере 2, А, i, а также способом, описанным в примере 2 А, i c последующим сопряженным сцеплением с КLH за счет использования глутарового альдегида. Полученные сыворотки испытывались на НТLE-III методом ELISA (Electronuclcinics) при OD492. При разбавлениях 1:400 наблюдались положительные результаты лишь для мышей, иммунизированных ОКТ4А без обработки глутаровым альдегидом. Две культуры mАb получились из успешно иммунизированных мышей, которые давали показания ELISA при OD492 >0,5 для связывания как НIV, так и рекомбинанты gр160.
Эти два мАbS подавляли также связывание ОКТ4А (ОD410=0,24), но не ОКТ4В или Leu-2a (ОD410 0,04 и 0,03 соответственно). Испытания осуществлялись, как было описано ранее.
П р и м е р 4. Иммунизация бабуинов ОКТ4а.
Два бабуина иммунизировались осажденным квасцами ОКТ4а 3 раза в 2 недели с последующей иммунизацией более 2 раз в месяц. Анализ НТLV-III ELISA (Vigro) при ОD492 давал показания 0,14 и 0,19. Для рекомбинанты др 160 при ОD410 соответствующие показания были 0,10 и 0,14. Эти данные имеют преимущество перед сопоставимыми данными для отрицательной контрольной и предиммунной сыворотки ОD492 0,02 и 0,04, ОD410 0,02 и 0,03.
Имунная сыворотка бабуинов подавляла окрашивание анти-СD4 клеточных линий Т, включая Leu-3а и ОКТ4А, но не ОКТ4, как это предполагалось, и окрашивала зараженные НIV клетки.
П р и м е р 5. Изучение связывания.
Нейтрализация путем подавления инфиктивности или подавления синцитий показала, что она происходит во всех изоляторах при разбавлении около 1/200. Результаты представлены в табл.4.
Слабое связывание у мыши 2 повышалось с ревакцинацией.
Следовательно, указанные идиотипы анти-Leu 3а распознают зараженные клетки (см. табл.5) и нейтрализуют вирусную инфекционность (см. табл. 6).
П р и м е р 6. Вирусная перекрестная реактивность.
С 4D 4m Аb (Т419ТНУ5D 7), который, как было показано, эффективно подавляет взаимодействие между НIV-1 м СD4 (12), был выбран для сопоставления подавления инфекции переферических кровяных лимфоцитов с вирусами НIV-1 и НIV-2 с последующим продуцированием активности обратимой транскриптазы (RT).
Относительное подавление RT (СРМ х x103), когда клетки обрабатывались до инфекции [НIV (СРМ обратимой транскриптазы) вводимого в 0 день] mAb, примерно одинаково в культурах, зараженных как НIV-1, так и НIV-2 с 7 по 16 день после инфекции.
Периферические кровяные лейкоциты (РВL) культивировались в течение 3 дней в полной питательной среде (10%-я эмбриональная сыворотка теленка RРМI 1640, 0,2 ед/мл сыворотки антиинтерферона и 2,02% полибрено) с введением в нее фитогемаглютинином А (РНА) со степенью разведения 1/300. Клетки разделялись на две аликвоты. Одна инкубировалась в течение 1 ч при 4оС с СD4 mAb 19ТНУ5D7 концентрацией 0,05 г/мл, а другая инкубировалась без mAb. Поверхностные слои от отстоя, содержащие НIV-1 или HIV-2 в различных концентрациях, вводили в обе порции клеток, которые инкубировались в течение 1 ч при 37оС. После трехкратной промывки клетки культивировались в полной питательной среде и те аликвоты, которые предварительно нагревались с mAb, выдерживались в 0,1 мкг mAb для получения 6-дневной культуры. Активность обратимой транскриптазы измеряли в поверхностном слое отстоя, содержащем культуру, в различные моменты времени после заражения.
Подавление синцития осуществлялось при более высоких концентрациях mAb и сопоставлялось после инкубирования в течение ночи несущих СD4 клеточных линий, устойчиво зараженных различными видами вирусов и вирусных изолятов (табл. 7). Большинство mAb, которые подвергались испытанию, разделялись на два основных скопления эпитопов, оба из которых блокируют взаимодействие НIV-CD4, и они составляют группу 1. Все эти mAbS блокируют все испытуемые вирусы за исключением вируса обезьяны Muson-Pfizer D-типа (МРМУ). Группа 2 включала 2 mAbs, которые неспособны были устойчиво подавлять образование синцития с любым из испытуемых вирусов. Четыре других mAbS имели различную способность блокировать взаимодействие между НIV-1, НIV-2 и СD4 и в лучшем случае лишь частично подавляли образование синцития. Эти mAbS неспособны были блокировать ни один из вирусов обезьяны. Псевдотипы вируса везикулярного стоматита (VSV), несущие антигены оболочки вирусов НIV-2 и HIV-2, также подвергались испытанию на зависимость вирусного связывания и пенетрации от рецепторов СD4.
Результаты, приведенные в табл.7, были получены следующим образом. Было использовано 24 СD4 mAbS для подавления образования синцития между продуцирующими HIV T-клеточными линиями Н9, НИТ78 или С8166 и несущими СD4 клеточными линиями С8166 или МТ4. 90 мкл суспензии индикаторной клеточной линии, несущей СD4, в питательной среде RPMI 1640 (Gibco), включающей 10% эмбриональной сыворотки теленка концентрацией 2 х 105клеток на мл, вводили в 10 мкл СD4 mAbS в каждую ячейку пластины микротитратора. СD4 AbS либо представляли собой очищенный иммуноглобулин первоначальной концентрацией 100 г на мл, либо асцитную жидкость с разведением 1/10 с первоначальным титром не менее 1/1000 с иммунофлюоресцентной обработкой. В каждую ячейку пластины вводили дополнительно 100 мкл суспензии продуцирующих вирусы клеток (5 х 104 на мл), пластину инкубировали в течение ночи при 37оС. Шкала оценки пластин была следующей: - = отсутствие подавления синцития (как в ячейках, инкубированных без mAb или иррелевантного mAb); + = частичное подавление синцития (образование синцития 20% ); ++ = =полное подавление синцития. Моноклонными антителами, которые устойчиво блокировали все испытуемые вирусы за исключением МРМУ, были: Leu 3а, ОКТ4а, F101-69, F101-5, EDU-2, NUTH-1, Т4, 19thy 5D7, 94b1, 91d6, ОКТ4, ОКТ4b, ОКТ4d, YIT4, МT151, МT321, МТ310, T4/18Т3А9, 13В8.2 (группа 1).
Антителами, которые не блокируют ни одного из испытуемых штаммов, были: ОКТ4 и ОКТ4С (группа 2).
Результаты, приведенные в табл.8, показывают ту же картину подавления посева VSV (НIV) для типичных mAbS групп 1 и 2, что и для подавления синцития.
Подавление инфекционности псевдотипа VSV (HIV) под действием СD4 mAbS. Псевдотипы VSV (HIV) были получены VSV суперинфекцией продуцирующих HIV клеточных сублиний Н9, они были титрованы на сросшихся несущих СD4 клетках ССRF-СЕM, предварительно обработанных mAb. VSV тромбоциты билы подсчитаны через 48 ч после инфекционного заражения псевдотипом (++ означает снижение тромбоцитов >90%; + обозначает снижение тромбоцитов 40-90%; - означает отсутствие снижения тромбоцитов).
Выражение поверхности клеток антигена СD4 на несущих СD4 клеточных линиях, незараженных или зараженных HIV-1, НIV-2 или SIV, измеряли путем прямого связывания 125I меченых СD4 mAbS. Табл.9 показывает, что СD4 mAbS cнижается после заражения любым из этих вирусов в одинаковой степени. Это было продемонстрировано с mAbS до двух различных эпитопов антиген СD4. В противоположность этим результатам инфекционное заражение вирусом D-типа без использования СD4 в качестве его рецептора не оказывает влияния на выражение СD4.
Связывание СD4 mAbS с незараженными и зараженными вирусами НIV и IV клеточными линиями Т определяли следующим образом. CD4 mAbS, меченые 125I (17), инкубировались в течение 30 мин при 4оС с 2х104 клеток в ячейках 96-ячеистой пластины μ -титратора в присутствии 2% белка носителя BSA (концентрация меченых mAbS предварительно стандартизировалась, так чтобы получалось примерно 1000-2000 связанных mAbS в минуту с клетками СЕМ). Пластины трехкратно промывались, измерялись связанные mAbS на гамма-счетчике. Результаты выражены как среднее значение для трех образцов. Специфичность связывания меченых mAbS определялась путем предварительного инкубирования незараженных клеток с избытком (20 мкг/мл) тех же самых немеченных mAbS.
П р и м е р 7. Использование мимотипов для извлечения антител.
А. Синтетические пептиды и антигены НIV.
Синтез последовательностей пептида 735-752 др160 из изолятов HTLV-IIIB осуществляли способом твердофазного синтеза пептидов. Данный пептид соответствует второй главной предсказанной гидрофильной зоне в др41. Аминокислотная последовательность данного пептида известна.
Контрольный пептид, содержащий распознавательную точку ядерного транспортного сигнала антигена большой опухоли (Т-ag) вируса обезьян (SV40), синтезировали. Был использован пептид очищенный рекомбинанты р160, продуцированный в системе вектора выражения бакуловируса.
В. Антитела и их очистка.
Шимпанзе, используемые в данном исследовании, составляли часть исследования синтетической пептидной вакцины для НIV. Два шимпанзе (Х-99) и (Х-183) получали четыре инъекции по 200 мкг пептида 735-752, сопряженно связанного с КLH до инфекционного заражения HIV. Контрольный шимпанзе (Х-189) получал такие же инъекции пептида ядерного переноса SV40, сопряженно связанного с КLH. Сыворотку от отдельных шимпанзе собирали после третьей и четвертой иммунизаций и до инфекционного заражения вирусом HIV. Первая иммунизация осуществлялась в полном адъювантном синергисте Френда (FCA), и последующие инъекции осуществлялись в неполном адъювантном синергисте Френда.
Три новозеландских белых кролика по- лучали по три в две недели инъекции по 100 мкг пептида 735-752, сопряженно связанного с KLH в FCA. Специфичность кроличьей антисыворотки была известна. Характеристики антисыворотки шимпанзе суммированы в табл.10.
До очистки методом хромографии сродства в колонках с иммуноадсорбентом, содержащим пептид, иммуноглобулин шимпанзе и кроликов осаждали 16%-ым сульфатом натрия (вес./об.). Каждый глобулиновый препарат повторно суспензировали в 20 мкл солевого раствора, содержащего буферный раствор бората (ВВS), и перемешивали в течение ночи при 4оС с иммуноадсорбентами (Сефароза 4В или Аффи-Гель 501), содержащими пептид. После промывки ВВS с целью удаления несвязанных сывороточных белков антипептидные антитела элюировались 5 М иодидом калия. Содержащие белок фракции сливались с полностью диализированными на ВВS фракциями IgG, очищали от полученного антипептидного препарата путем фильтрации через гель сефадекс G-200. Концентрацию иммуноглобулина рассчитывали, используя коэффициент экстинкции 13,5 и 15% для 1% препарата антитела шимпанзе и кроликов соответственно.
С. Приготовление и очистка антител анти-Id.
Приготовление антитела ксеногенных анти-Id новозеландских белых кроликов осуществляли известным способом. Кроликов иммунизировали двухнедельно пептидом IgG анти-НIV шимпанзе Х-99, полученные антисыворотки повторно адсорбировали в колонке с сефарозой 4В, содержащей IgG предварительно иммунизированной шимпанзе Х-99, до тех пор, пока не исчезала вся обнаруживаемая реактивность с изотипными и аллотипными детерминантами. Контрольный анти-Id был получен путем иммунизации кроликов пептидом IgG анти-SV40 шимпанзе Х-189 и последующей адсорбации с целью удаления антиизотипных и антиаллотипных специфичностей с использованием колонок с иммуноадсорбентом, содержащим IgG предварительно иммунизированных шимпанзе. Данные способы приготовления этих колонок с содержащим IgG иммуноадсорбентом путем активации цианогенбромидом были описаны в других публикациях. Кроличьи IgG были очищены от антисыворотки, содержащей адсорбированный анти-Id, путем использования колонки с А-агарозой белка стафилококков.
Обнаружение антител антииммуноглобулина.
Присутствие антиизотипа и антиаллотипа наряду с другими антителами анти-Id было определено путем прямого анализа связывания с использованием IgG, получаемого из предиммунной и содержащей антипептид сыворотки шимпанзе в анализе (ELISA) иммуносорбента, связанного ферментом, усиленным биотином-авидином. 200 нг в 50 мкл IgG шимпанзе адсорбировались в ячейках пластин микротитратора. Неспецифические точки были блокированы, пластины промывались, как описано выше. Кроличьи антисыворотки, содержащие анти-Id, вводили в покрытие IgG шимпанзе ячейки микротитратора. Определяли специфическое связывание, используя биотинилированный козий антикроличий гамма-глуболин и конъюгированную со стрептавидином пероксидазу конской редьки. Субстраты представляли собой 2,2-азино-ди-(3-этил-бензтиаксолинсульфокисло- ту) и Н2О2, колориметрическая реакция прекращалась путем ввода натрийдодецилсульфата. Оптическая плотность каждой ячейки была показана на считывающем устройстве пластины ELISA при 410 нм, как было описано ранее.
Сопряженное сцепление с КLH и осаждение квасцами.
Способы сцепления анти-Id с КLH наряду с осаждением квасцами осуществлялись как описано в примере 2.
F. Ввод анти-Id и пептида 735 в конъюгат 752 КLH.
Взрослым самкам мышей ВALB/с ВyJ. (Jaclson Laboratory Bar Harbor) вводили двухнедельно инъекции 20 мкг IgG в виде квасцового преципитата или конъюгированного с КLH, осажденного квасцами. Осуществляли кровопускание мышей через 14 и 28 дней после последней инъекции кроличьего анти-Ig. Сыворотка, полученная от мышей до иммунизации, служила в качестве отрицательного контроля. Мыши, получающие пептид 735-752, конъюгированный с одним KLH, получали с разрывом 14 дней три внутрибрюшинных инъекции 20 мкг пептина-KLН в виде квасцового преципитата. Эти антисыворотки исследовались через 14 дней после конечной инъекции.
G. Определение активности антипептида и анти-HIV.
Реакцию антипептида 735-752 в мышиных антисыворотках определяли на усиленных биотином-авидином ELISA с использованием меченого биотином козьего антимышиного IgG (b-gamg; Vectеr Laboratories Эж., Burlingame, CA). Содержание сыворотки в антипептиде количественно определяли как конечное значение титра, оно отражает последнее разбавление содержащей антипептид сыворотки, которое дает отличающееся значение ОD410-3 по сравнению со значением ОD410, полученным при разведении предиммунной сыворотки 1:10.
Активность анти-НIV была определена аналогичным образом с использованием рекомбинанты бакуловируса gр160, содержащей аминокислотную последовательность, ассоциированную с изолятом НТLV-IIIВ. Десять панограммов рекомбинанты gp160 (Микрогенезис) наносились на поверхность отдельных ячеек пластин ELISA в ВВS в течение ночи при 4оС. Анализ осуществлялся описанными ранее способами. Титры анти-HIV аналогичным образом выражены как конечные титры последнего разбавления.
Н. Специфичность антитела анти-Id.
Для определения специфичности кроличьего анти-Id осуществлялся следующий анализ связывания. Для трехкратного покрытия ячеек пластины микротитратора использовались различные концентрации кроличьего анти-Id препарата IgG в 50 мкл ВВS, который адсорбировался в ячейках в течение 1 ч при 37оС. Точки неспецифического связывания блокировались нормальной 10%-й козьей сывороткой (NGS), затем пластины промывались в твине 20, включающем солевой раствор, содержащий фосфатный буферный раствор (Т-РВS). Биотинилированные препараты IgG антипептида шимпанзе вводили дозой примерно 10 нг на ячейку, осуществлялось связывание в течение примерно 1 ч при 37оС. IgG, который не обеспечивал специфического связывания анти-Ig, удалялся путем промывки Т-РВS. Определение связывания Id-анти-Id осуществлялось, как описано для антииммуноглобулина методом ELISA.
I. Анализ подавления.
Подавление реакции Id-анти-Id осуществлялось с целью изучения способности подавлять различные антитела шимпанзе и кроликов или мышиную антисыворотку. Постоянное количество кроличьего анти-Id IgG (156 нг в 50 мкл) адсорбировалось на твердой фазе в течение 1 ч при 37оС. Эта концентрация анти-Id соответствовала линейной части кривой связывания Id. Точки неспецифического связывания блокировались путем ввода 10% ТGS в течение 30 мин при 37оС и затем пластины промывались в Т-РВS. Биотинилированные Id шимпанзе Х-99 IgG (b-Id, 10 нг/ячейка) смешивались с различными концентрациями различных ингибиторов и затем вводились трехкратно в ячейки, где инкубировались в течение 1 ч при 37оС. Оcтальная часть анализа осуществлялась так, как описано для антииммуноглобулина (ELISA). Максимальное связывание (отсутствие подавления) наблюдалось в случае ячеек, в которых b-Id вводился без ингибитора.
Для того чтобы определить, может ли анти-Id подавлять I связывание Id с пептидом 735-752, либо с gр160, был проведен анализ конкурентного подавления связывания. Подавление связывания Id либо с пептидом, либо с gр160 изучали таким же образом, как реакцию Id-анти-Id со следующими модификациями: 200 нг пептида 735-752, конъюгационно сцепленного с ВSА, или 10 нг рекомбинанты gр160, адсорбировали с твердой фазой в течение ночи при 4оС. После блокирования с 10% NGS пластины ELISA промывали трехкратно в Т-РВS. Биотинилированный Id (10 нг/ячейка) смешивали с равным объемом анти-Id различных концентраций, затем трехкратно наносили на ячейки микротитратора. Ввода авидина-пероксидазы конской редьки и субстрата осуществляли как описано в других анализах. Подавление реакций Id-анти-Id или Id-пептид рассчитывали по приведенной формуле. Процент подавления равен
100 × 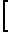 1-
1- 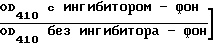
J. Биотинилирование антител.
5 мг очищенного IgG в 0,5 мл ВВS смешивали с 80 мкл 0,5 М NaHCO3, рН 9, 40 мкл d H2O и10 мкл 50 мг/мл раствора биотин-N-оксисукцинимидного сложного эфира (Plerce Chemical Co., Rockford IL.) в обезвоженном диметилформамиде (J. T. Baker Chemical Co., Phillipsturg, NJ.) и инкубировали в течение 1 ч при 25оС. Реакция прекращалась при вводе 25 мкл I М MH4Cl и затем смесь диализировалась в течение ночи на ВВS при 4оС. Биотинилированный IgG смешивались с глицерином и выдерживали при -20оС в темноте.
K. Приготовление иммуноадсорбентов.
Пептид 735-752 сопряжено связывали с активированной цианоген-бромидом сефарозой 4В. Примерно 3 мг пептиза 735-752 сопряженно связывали с 1 мл сефарозы. Определяли количество не подвергнутого сопряженному связыванию пептида в данном потоке по светопоглощению при 275 нм. Эффективность сопряженного связывания составляла 92%. Кроме того, пептид 735-752 и пептид переноса SV 40 Т-аg также сопряженно связывались с аффи-гелем 501 (Bio-Rad Laboratories, Richmеnd, CA). Aффи-гель 501 представляет собой ртутьорганическое производное, которое легко образует меркаптидную связь со свободными SH-группами. Поскольку оба пептида содержат концевые цистеиновые группы, то эта основа использовалась для приготовления колонки пептидного средства. Присутствие свободной восстановленной сульфогидрильной группы на пептиде до сопряженного связывания определялось по реакции свободной Н-группы с реактивом Элльмана. Если присутствовало менее теоретического количества свободных сульфогидрильных групп, то пептиды восстанавливались либо 5 М эквивалентами боргидрида натрия при 4оС, либо дитиотреитолом.
Аффи-гель 501 был уравновешен в 10 мМ NaHPO4, рН 6, примерно 2 мг пептида вводили в 10 мМ NaHPO4 на 1 мл геля и смесь перемешивалась в течение ночи при комнатной температуре. Основа промывалась 50 мМ ацетатом натрия, рН 5, определяли количество пептида, которое не было сопряженно связанным путем измерения оптического поглощения потока при 275 нм. Свободные функциональные точки на геле были насыщены 0,05 М цистеином. Данный гель промывался и выдерживался в 50 мМ NaPO4, рН 7 перед его практическим использованием. Эффективность сопряженного связывания пептида 735-752 и пептида переноса SV 40 составляла соответственно 62 и 77%. Для приготовления антипептида шимпанзе Х-99 IgG для иммунизации кроликов была использована сефароза 4В, активированная цианогенбромидом. По данным связывания с пептидом 735-752, gр160 и анти-Id не обнаружено никакого различия с антителом шимпанзе при использовании двух различных основ хроматографического средства.
L. Точечный анализ Вестерна.
Точечный анализ Вестерна осуществляли с использованием иммуноточечной системы Био-Рэд (Biо-Rad Laborаtories, Ricbimond СА).Нитроцеллюлозные полосы, на которых точечно осаждали подвергнутые электрофорезу антигены НIV, блокировались 20 мМ трис-НСI, 150 мМ буферным раствором NаСl (9), рН 7,4, содержащим 1% ВSА и 02,% твина 20. После блокирования неспецифических точек полосы взаимодействовали с собранной человеческой сывороткой СПИДа (1:100) или сывороткой мышей (1:10) в течение ночи при 4оС. Полосы промывались буферным раствором трис-НСl с целью удаления несвязанных антител. Определяли реактивность человеческого и мышиного антитела с сопряженно связанным с щелочной фосфатазой козьим античеловеческим и антимышиным Ig (Sigma, St donis, MO) соответственно. Используемый субстрат был получен из лабораторий Вio-Rad. Характеристики сыворотки, содержащей антипептид шимпанзе, в отношении связывания антигенов оболочки НIV приведены в табл.10.
Обе антисыворотки шимпанзе взаимодействовали с gp41 согласно точечному анализу Вестерна и gр160 согласно радиоиммунопреципитации. Антисыворотка связывала пептид 735-752 и рекомбинанту gp160 в твердой фазе (ELISA). Эти антисыворотки не были эффективными при нейтрализации инфекционности НIV в условиях ин витро, наблюдалось лишь частичное снижение активности обратимой транскриптазы НIV.
При заражении инфекционным вирусом НIV наблюдается реакция развивающихся антител шимпанзе (антитела к белкам gag), что является показателем вирусной репликации. До инфекционного заражения НIV из шимпанзе Х-99 была отобрана антисыворотка как Id препарат, который должен быть использован для генерации анти-Id.
М. Кроличье антитело к антипептиду IgG шимпанзе Х-99 распознает Id детерминанты.
Для того чтобы продемонстрировать специфичность анти-Id препарат кроличьего антитела, осуществляли анализ связывания с использованием Id наряду с другими IgG препаратами шимпанзе. Двести нанограммов IgG различных шимпанзе связывались с твердой фазой и вводили препарат кроличьего антитела в различных разбавлениях. При разбавлении 1:100 кроличье антитело и анти-Id связывались с идиотипом (ОD401 0,47) антипептида шимпанзе IgG, в то время как не наблюдалось никакой реактивности с IgG от шимпанзе Х-99 до иммунизации (ОD410 0,02) или с предиммунным IgG и IgG пептида анти-SV40 Т-а от шимпанзе Х-189 (ОD4100,008). Кроме того, анти-Id связывал IgG пептида анти-HIV шимпанзе Х-183 (СД 0,19) с его предиммунным препаратом IgG (ОD410 0,006). Эти данные показывают, что кроличий анти-Id распознает детерминанты Id, ассоциированные с иммуногеном пептида анти-HIV от двух различных шимпанзе. Эта детерминанта не присутствовала в их соответствующих препаратах IgG до иммунизации пептидом. В противоположность этому препарат анти-Id к пептиду анти-SV40Т связывал лишь иммуноген Id (шимпанзе Х-189), но не к предиммунному IgG или препарату пептида IgG анти-НIV.
N. Кроличий анти-Id распознает соединяющую точку антигена Id.
Получали четыре типа Аb-2, осуществляя иммунизацию посредством Ab-1. Ab-2a распознает Id, отличный от соединяющей точки антигена. Реакция этого анти-Id не подавляется связыванием с Ab-1 антигеном, используемым для индуцирования Ab-1. Ab-2 β или анти-Id внутреннего отображения принимает форму трехмерной структуры антигена, распознаваемого Ab-1. Реакция Id-анти-Id подавляется антигеном. Эти анти-Id связывают Ab-I, продуцируемый в различных видах, иммунизируемых номинальным антигеном. Было продемонстрировано, что Аb-2 анти-Id включает потенциальные активности вакцины за счет имитирующей способности антигена. Аb-2 γ также распознает подавляемый антигеном Id, но не обладает никакой способностью внутреннего отображения. Эти анти-Id обычно ограничиваются определенными видами инбредных штаммов в пределах данных видов, и подавление антигеном может быть обусловлено пространственными затруднениями. Конечной категорией анти-Id является Аb-2сили эпитела. Такие анти-Id распознают Id и эпитоп на Ab-1 и антиген соответственно.
Далее было проведено исследование с целью определения может ли анти-Id подавлять Ag-1 шимпанзе за счет связывания с антигеном его пептида 735-752 наряду с gр160. Как показано в табл.11, 10 мкг анти-Id могут подавить связывание с пептидом на 47%. Контрольный анти-Id неспособен подавить связывание Аb-1 шимпанзе. Кроме того, анти-Id также частично подавляет связывание Аb-1 с gр160 (24%).
Более высокие концентрации анти-Id не подавляют связывание Id в более высокой степени ни пептида, ни gр160. Наряду с этим эти данные подтверждают, что анти-Id распознает детерминанту, ассоциированную частично со связывающей точкой антигена Ab-1 шимпанзе. Тот факт, что наблюдается лишь частичное подавление, подтверждает, что анти-Id распознает другие детерминанты, ассоциированные с Аb-1, которые не могут участвовать в связывании антигена. Это неудивительно, поскольку анти-Id является поликлонным по своей природе и может содержать смесь различных классов Ab-2, включая Аb-2 β или Аb-2 γ, которые ответственны за связывание с двумя препаратами Аb-1 анти-НIV шимпанзе наряду с подавлением связывания Id с антигеном. Детерминанты связывающей точки неантигена наряду с тем фактом, что анти-Id связывает гомологический препарат Ab-1 в большей степени, чем гетерологический препарат Ab-1 шимпанзе Х-183, подтверждают, что анти-Id может содержать также популяцию Ab-2 α.
Поскольку препарат Ab-1 был очищен методом хроматографии сродства и некоторые пептиды могут быть загрязнены иммуногеном Аb-1, изучают способность кроличьего анти-Id непосредственно связывать пептид 735-752 и gр160. Ни антипептидная активность, ни анти-HIV не была обнаружена в препаратах кроличьей анти-Id. Таким образом, подавление посредством анти-Id связывания антигена Ab-1 и выявление общего Id в двух препаратах антипептида шимпанзе не являлось результатом загрязнения препаратов Аb-1 пептидом и последующей реакции антипептида в препарате кроличьего антитела.
О. Кроличий анти-Id распознает первично идиотип шимпанзе.
Для того чтобы определить, обладает ли анти-Id способностью внутреннего отображения, изучают способность антител антипептидов шимпанзе кроликов и мышей подавлять реакцию Id-анти-Id. Эти эксперименты осуществлялись также в целью подтверждения того, что изотопные и аллотипные детерминанты не распознаваемы в данном анализе. Лишь один из трех препаратов кроличьего антипептида подавлял и ни один из трех препаратов моноклонного антитела мыши ВАLВ/с не подавлял реакцию Id-анти-Id (табл.12).
При концентрации 2,5 мкг пептидный ингибитор шимпанзе Х-99 и Х-183 подавлял реакцию Id-анти-Id соответственно на 85 и 28%. Таким образом, гомологичный Id был значительно лучшим ингибитором реакции. В подтверждение исследований прямого связывания не наблюдалось значительного подавления реакции предиммунным IgG шимпанзе и пептидом анти-SV40 Т-А. Лишь один единственный препарат пептида кроличьего анти-HIV продемонстрировал некоторое подавление реакции Id-анти-Id (40%). Эти данные подтверждают, что препарат анти-Id не состоит в основном из анти-Id внутреннего отображения ввиду неспособности распознавать общий межвидовой идиотип. Кроме того, гомологический Id был наилучшим ингибитором реакции Id-анти-Id. Этот факт наряду с неспособностью некоторых моноклонных антипептидных препаратов кролика и мышей служить в качестве ингибиторов дополнительно подтверждает, что компонент Ab-1 также может присутствовать в анти-Id.
Р. Индукция реакции анти-НIV в мышах, получающих анти-Id.
Проведенные ранее исследования продемонстрировали, что кроличий анти-Id, состоящий главным образом из Ab-2 β или Ab-2 α, может индуцировать реакцию поверхностного антигена антигепатита В в мышах без последующей антигенной стимуляции. В нижеследующем примере проводили исследование с целью определения может ли этот анти-Id индуцировать реакцию анти-HIV, специфическую для пептида 735-752.
Четыре группы мышей по пять штук в каждой группе получали пять внутрибрюшинных инъекций кроличьей анти-Id в виде квасцового преципитата или в состоянии сопряженного связывания с KLН. Две группы получали контрольный анти-Id и другие две группы получали анти-Id, специфический для препарата Ab-I шимпанзе Х-99. Пятая группа мышей иммунизировалась тремя инъекциями пептида 735-752, сопряженно связанного с КLH. Сыворотки от всех групп испытывались на антипептидную и анти-HIV активность в период между 14 и 28 днями после конечной иммунизации. В табл.13 приведены титры анти-Id. Группа, которая получала анти-Id к шимпанзе Х-99 в виде квасцового преципитата, давала как антипептидную, так и анти-HIV реакцию. По сравнению с мышами, которые получали пептид, сопряженно связанный с КLH, средний реципрокный титр конечного антипептида в обработанных анти-Id мышах был примерно в 3 раза меньше (600 по сравнению с 2000). Однако титры анти-HIV между двумя группами были сопоставимы (среднее значение 400 в сравнении с 600). Ни одна из двух иммунизированных анти-Id контрольных групп не показала никакой антипептидной или анти-НIV активности при разбавлении сыворотки 1:20. Таким образом, реакция антипептида или анти-HIV не является результатом реакции антикроличьей IGG или анти-КLH в этих мышах. Иммунизация анти-Id, сопряженно связанным с КLH, также индуцирует как реакцию антипептида, так и реакцию анти-КLH в этих мышах. Иммунизация анти-Id, сопряженно связанным с КLH, так же индуцирует как реакцию антипептида, так и реакцию анти-HIV.
Титр реакций антитела в данной группе мышей в 2-3 раза меньше, чем в группе мышей, получающих осажденный квасцами анти-Id без сопряженного связывания. Таким образом, сопряженное связывание анти-Id, используемого в данном исследовании, с КLH не требуется ни для того, чтобы индуцировать, ни для того, чтобы увеличить реакцию антитела в условиях ин виво.
Индукция антитабачного мозаичного вируса и реакции поверхностного антигена антигепатита В были ранее продемонстрированы как с Аb-2 α, так с Аb-2 β с внутренним отображением.
Q. Анти-Id индицирует анти-HIV, который входит в антипептид Id шимпанзе Х99.
Предыдущие исследования реакции мышиного антитела на поверхностный антиген гепатита В (НВsAg) продемонстрировали, что анти-Id с внутренним отображением индуцирует реакцию антитела на НВsAg, который выражает аналогичный Id при сопоставлении с мышами, иммунизированными НВsAg. Кроме того, анти-Id Ab-2 α индуцирует реакцию антитела на НВsAg, который выражает Id, который не пресутствует на антителах мышей, иммунизированных НВsAg.
Аb-2 α индуцирует обычно недействующие клоны, вызывая секрецию антител в НВsAg, который выражает другой Id при сопоставлении со стимуляцией номинального антигена. Сильное серологическое различие между анти-Id и иммунизированными пептидом группами мышей заключалось в том, что обработанные анти-Id мыши подавляли реакцию Id-анти-Id, в то время как никакого подавления реакции не обнаруживалось у иммунизированных пептидом мышей (см. табл.13). Эти данные показывают, что обработанные анти-Id мыши выражают аналогичный Id, также присутствующий у шимпанзе, иммунизированных пептидом, сопряженно связанным с КLH. Этот Id обычно не выражен в сыворотке мышей, иммунизированных пептидом, сопряженно связанным с КLН. Таким образом, совершенно очевидно, что анти-Id может быть использован для индуцирования серологической реакции, которая обычно не доминирует иммунную реакцию, когда в качестве иммуногена используется антиген. Реакция анти-Id имеет серологические характеристики, аналогичные Ab-1, используемому при создании анти-Id. Сыворотка от мышей, иммунизированных контрольным анти-Id (SV40), не показала способность подавлять реакцию антипептида 735-752 шимпанзе Х-99 анти-Id (табл.13). Эти результаты говорят о том, что предварительная инъекция кроличьей анти-Id приводит к выражению положительных антител Id, которые связывают gр160 и является специфическими для пептида 735-752. Активация клонов, обычно не индуцируемая в ходе иммунной реакции, т.е. недействующих клонов, была выявлена в ходе мышиной иммунной реакции на бактериальный леван. Иммунизация анти-Id, сопряженно связанным с КLH, индуцировала образование антилевана или популяцию анти-НВsAg, которая составляла Id, вместе с популяцией Ab-1, которая обычно не продуцировалась в процессе иммунной реакции на бактериальный леван и НВsAg.
В следующем примере была определена специфичность индуцированной анти-Id реакции анти-HIV и была изучена способность как пептида 735-752, так и gр160 подавлять связывание с данным пептидом (табл.14). Пептид gp41 c концентрацией 10 мкг подавлял связывание анти-НIV мышиной анти-Id с пептидом на 89% . Контрольный пептид SV40 подавлял эту реакцию лишь на 6%. При аналогичных концентрациях ингибитора gр160 был менее эффективным ингибитором реакции анти-Id пептид анти-HIV по сравнению с данным пептидом (52 в отличие от 89%). Эти данные подтверждают, что анти-Id индуцирует реакцию антипептида, которая не полностью ассоциирована с реакцией антинативной gр160. Специфичность индуцированной анти-Id реакции антитела заключает в себе антипептид и анти-gр160 компонент.
Реакция естественного компонента анти-HIV реакции индуцированного анти-Id антитела была подтверждена точечным анализом Вестерна. Иммунизированная анти-Id мышиная сыворотка взаимодействовала с областью молекулярного веса 41 кДальтон. Никакой реактивности не обнаружено с контрольной группой анти-Id мышиной сыворотки. Контрольная человеческая сыворотка от больных СПИДом продемонстрировала реактивность с антигенами оболочки (160, 120 и 41 кD) наряду с белками gag (55, 24 и 18 кD). Эти данные показывают, что реакция анти-НIV в антисыворотке мышей ассоциирована с gр41. Причина того что мышиная антисыворотка не распознает gр160 наряду с gр41 в точечном анализе Вестерна неизвестна. Однако преобладающей реакцией антитела в мышах и шимпанзе, иммунизированных пептидом gр41, сопряженно связанным с КLH, как определено точечным анализом Вестерна, является gр41.
Неспособность антисыворотки, индуцированной мышиным анти-Id, связываться с gр160 может отражать относительно специфическую реакцию антитела, направленную к области, ассоциированной с gр4АI. Кроме того, концентрация в антигене gр160 в данном конкретном точечном анализе Вестерна является оптимальной, поскольку в контрольной сыворотке человеческого СПИДа обнаружена лишь слабая реакция анти-gр160. Это может быть другой возможной причиной, объясняющей, почему индуцированная анти-Id реакция анти-HIV распознает лишь gр41, но не gр160.
Использование: вирусология. Сущность изобретения: для получения вакцины против СПИДа в организм животного вводят антиген, представляющий собой фрагмент 735-752 оболочечного белка до 41, выделяют антитела, затем последние вводят другому животному, у которого выделяют антитела - продуцирующие клетки селезенки, и получают гибридомы. После культивирования гибридом получают антиидиотипное антитело, способное к связыванию с эпитопом распознавания СДЧ - клеточного маркера и ингибированию связывания между клеточным маркером и любым из маркерных антител Leu ЗА и ОКТ 4А. 14 табл.
СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ СПИДА, включающий введение антигена в организм животного, выделение антител с последующим введением их другому животному, выделением антител-продуцирующих клеток селезенки, получением гибридов, их культивированием с получением антиидиотипных антител, отличающийся тем, что, с целью повышения иммуногенности и расширения спектра действия, в качестве антигена используют фрагмент 735 - 752 оболочечного белка др 41, а антиидиотипное антитело способно к связыванию с эпитопом распознавания СДЧ-клеточного маркера и к ингибированию связывания между СДЧ-клеточным маркером и любым из маркерных антител Leu ЗА и ОКТЧА.
| Satientan et al | |||
| Science., 1986, v.234, p.1120-1123. |
Авторы
Даты
1994-06-30—Публикация
1988-11-22—Подача