Изобретение относится к способу и жидкой композиции для инициирования и оптимизации сжигания углеводородных соединений и снижения концентрации вредных соединений в выхлопных газах и выбросах, где жидкую композицию, содержащую пероксид или пероксо-соединение, подают в воздух сжигания или в топливновоздушную смесь.
Предпосылки к созданию изобретения.
В последние годы все большее внимание уделяется загрязнению окружающей среды и высокому энергорасходу особенно из-за драматической гибели лесов. Однако выхлопные газы всегда были проблемой населенных центров. Несмотря на постоянное совершенствование моторов и нагревательной техники с меньшими выбросами или выхлопными газами, все возрастающее число автомобилей и установок сжигания привело к общему увеличению количества выхлопных газов.
Первичной причиной загрязнения выхлопных газов и большого расхода энергии является неполное сгорание. Схема процесса сжигания, эффективность системы зажигания, качество топлива и топливновоздушной смеси определяет эффективность сжигания и содержание несгоревших и опасных соединений в газах. Для снижения концентрации этих соединений применяют различные способы, например рециркуляцию и хорошо известные катализаторы, приводящие к дожиганию выхлопных газов вне зоны основного сжигания.
Сжигание - это реакция соединения с кислородом (О2) под действием теплоты. Такие соединения, как углерод (С), водород (Н2), углеводороды и серы (S) генерируют достаточно теплоты для поддержания своего горения, а например азот (N2) требует подвода теплоты для окисления.
При высокой температуре 1200-2500оС и достаточном количестве кислорода достигается полное сгорание, где каждое соединение связывает максимальное количество кислорода. Конечными продуктами являются СО2(двуокись углерода), Н2О (вода), SО2 и SО3 (оксиды серы) и иногда NО и NО2 (оксиды азота, NОх). Оксиды серы и азота ответственны за закисление окружающей среды, их опасно вдыхать и особенно последние (NОх) поглощают энергию сгорания.
Можно также получать холодные пламена, например голубое колеблющееся пламя свечи, где температура лишь около 400оС. Окисление здесь не является полным и конечными продуктами могут быть Н2О2(перекись водорода), СО (моноокись углерода) и возможно С (копоть). Два последних указанных соединения, как и NО, вредны и могут давать энергию при полном сгорании.
Бензин - это смесь углеводородов сырой нефти с температурами кипения в интервале 40-200оС. Он содержит около 2000 различных углеводородов с 4-9 атомами углерода.
Подробный процесс сжигания очень сложен и для простых соединений. Молекулы топлива разлагаются на более мелкие фрагменты, большинство из которых представляют собой так называемые свободные радикалы, т.е. нестабильные молекулы, быстро реагирующие, например, с кислородом.
Наиболее важными радикалами являются атомарный кислород О, атомарный водород Н и гидроксильный радикал ОН. Последний особенно важен для разложения и окисления топлива как за счет прямого присоединения, так и отщепления водорода, в результате чего образуется вода.
В начале инициирования сжигания вода вступает в реакцию
H2O+M ___→ H·+CH·+M где М - другая молекула, например азот, либо стенка или поверхность искрового электрода, с которой сталкивается молекула воды. Поскольку вода - это очень стабильная молекула, то для ее разложения требуется очень высокая температура. Лучшей альтернативой является добавление перекиси водорода, которая разлагается аналогичным образом
H2O2+M ___→ 2OH·+M
Эта реакция протекает намного легче и при более низкой температуре, особенно на поверхности, где поджигание топливно-воздушной смеси протекает легче и более контролируемым образом. Дополнительным положительным эффектом поверхностной реакции является то, что перекись водорода легко реагирует с копотью и смолой на стенках и свече зажигания с образованием диоксида углерода (СО2), что приводит к чистке электродной поверхности и лучшему зажиганию.
Вода и перекись водорода сильно понижают содержание СО в выхлопных газах следующей схеме
1) CO+O2___→ CO2+O : инициирование
2) O: +H2O ___→ 2OH· разветвление
3) OH·+CO ___→ CO2+H· рост
4) H·+O2___→ OH·+O ; разветвление
Из реакции 2) видно, что вода играет роль катализатора и затем образуется снова. Поскольку перекись водорода приводит к во много тысяч раз более высокому содержанию ОН- радикалов, чем вода, то стадия 3) значительно ускоряется, приводя к удалению большей части образующегося СО. В результате освобождается дополнительная энергия, помогающая поддерживать горение.
NО и NО2 являются высокотоксичными соединениями и приблизительно в 4 раза более токсичны, чем СО. При остром отравлении повреждаются легочные ткани. NО является нежелательным продуктом сгорания. В присутствии воды NО окисляется до НNО3 и в этой форме вызывает приблизительно половину закисления, а другая половина обусловлена Н2SО4. Кроме того, NОх могут разлагать озон в верхних слоях атмосферы.
Большая часть NО образуется в результате реакции кислорода с азотом воздуха при высоких температурах и, следовательно, не зависит от состава топлива. Количество образующихся ПОх зависит от продолжительности поддержания условий сжигания. Если снижение температуры проводится очень медленно, то это приводит к равновесию при умеренно высоких температурах и к относительно низкой концентрации NО.
Следующие способы можно использовать для достижения низкого содержания NО.
1. Двухстадийное сжигание обогащенной топливом смеси.
2. Низкая температура сжигания за счет:
а) большого избытка воздуха,
b) сильного охлаждения,
с) рециркуляции газов сжигания.
Как часто наблюдается при химическом анализе пламени, концентрация NО в пламени более высока, чем после него. Это процесс разложения О. Возможная реакция:
СH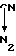 +H2O
+H2O
Таким образом, образование N2 поддерживается условиями, дающими высокую концентрацию CH
Как показывает практика, топлива, содержащие азот, например в форме таких гетероциклических соединений, как пиридин, дают большее количество NО.
Содержание N в различных топливах (приблизительное), %: Cырая нефть 0,65 Асфальт 2,30 Тяжелые бензины 1,40 Легкие бензины 0,07 Уголь 1-2
В SE-В-429.201 описана жидкая композиция, содержащая 1-10 об.% перекиси водорода, а остальное - вода, алифатический спирт, смазочное масло и возможно ингибитор коррозии, где указанную жидкую композицию подают в воздух сжигания или в топливовоздушную смесь. При таком низком содержании перекиси водорода образующееся количество ОН-радикалов не достаточно как для реакции с топливом, так и с СО. За исключением составов, приводящих к самовозгоранию топлива, достигаемый здесь положительный эффект мал по сравнению с добавлением одной воды.
B DЕ-А-2.362.082 описано добавление окисляющего агента, например, перекиси водорода, при сжигании, однако перекись водорода разлагают на воду и кислород с помощью катализатора перед ее вводом в воздух сжигания.
Цель и наиболее важные признаки данного изобретения.
Целью данного изобретения является улучшение сжигания и снижения выброса вредных выхлопных газов при процессах горения, вовлекающих углеводородные соединения, за счет улучшенного инициирования горения и поддержания оптимального и полного сгорания в таких хороших условиях, что содержание вредных выхлопных газов сильно снижается. Это достигается тем, что в воздух сжигания или в воздушно-топливную смесь подают жидкую композицию, содержащую пероксид или пероксо-соединение и воду, где жидкая композиция содержит 10-80 об.% пероксида или пероксо-соединения.
В щелочных условиях перекись водорода разлагается на гидроксильные радикалы и пероксидные ионы по следующей схеме:
H2O2+HO2___→ HO·+O2+H2O
Образующиеся гидроксильные радикалы могут реагировать друг с другом, с пероксидными ионами или с перекисью водорода. В результате этих представленных ниже реакций образуются перекись водорода, газообразный кислород и гидроперекисные радикалы:
HO·+HO· ___→ H2O2
HO·+O ___→ 3O2+OH-
___→ 3O2+OH-
HO·+H2O2___→ HO
O +H2O2___→ O2+HO·+OH-
+H2O2___→ O2+HO·+OH-
O +O2+H2O ___→ IO2+HO
+O2+H2O ___→ IO2+HO
O +IO2 ___→ 3O2+O
+IO2 ___→ 3O2+O +22 ккал.
+22 ккал.
Таким образом образуется газообразный кислород, гидроксильные радикалы, синглетный кислород, перекись водорода и триплетный кислород с выделением энергии 22 ккал. Подтверждено также, что ионы тяжелых металлов, присутствующие при каталитическом разложении перекиси водорода, дают гидроксильные радикалы и пероксидные ионы.
Имеются сведения о константах скорости, например следующие данные для типичных алканов нефти.
Константы скоростей взаимодействия н-октана с Н, О и ОН.
к = А ехp/E/RT Реакция А/см3/моль:c/ E/кДж/моль/ н-С8Н18 + Н 7,1:1014 35,3
+О 1,8:1014 19,0
+ОН 2,0:1013 3,9
Из этого примера мы видим, что атака ОН-радикалами протекает быстрее и при более низкой температуре, чем Н и О.
Константа скорости реакции СО + + ОН _→ СО2 + Н имеет необычную температурную зависимость в силу отрицательной энергии активации и высокого температурного коэффициента. Ее можно записать следующим образом: 4,4 х 106 х Т1,5ехр/3,1/RT. Скорость реакции будет почти постоянной и равной около 1011 см3/моль сек при температурах ниже 1000оК, т.е. вплоть до комнатной температуры. Выше 1000оК скорость реакции возрастает в несколько раз. В силу этого реакция полностью доминирует в превращении СО в СО2 при сжигании углеводородов. В силу этого раннее и полное сгорание СО улучшает термическую эффективность.
Пример, иллюстрирующий антагонизм между О2 и ОН - это реакция NH3-H2О2-NО, где добавление Н2О2 приводит к 90% снижения NОх в бескислородной среде. Если же О2 присутствует, то даже при лишь 2% ПОхснижение сильно уменьшается.
В соответствии с данным изобретением для генерирования ОН-радикалов используют Н2О2, диссоциирующую приблизительно при 500оС. Их время жизни равно максимум 20 мсек.
При нормальном сжигании этанола 70% топлива расходуется на реакцию с ОН-радикалами и 30% - с Н-атомами. В данном изобретении, где уже на стадии инициирования горения образуются ОН-радикалы, резко улучшается сжигание за счет немедленной атаки топлива. При добавлении жидкой композиции с высоким содержанием перекиси водорода (выше 10%) имеется достаточно ОН-радикалов для немедленного окисления образующегося СО. При более низких содержаниях перекиси водорода образующихся ОН-радикалов недостаточно для взаимодействия как с топливом, так и с СО.
Жидкая композиция подается таким образом, что отсутствует химическая реакция в промежутке между контейнером с жидкостью и камерой сгорания, т.е. разложение перекиси водорода на воду и газообразный кислород не протекает, и жидкость без изменений достигает непосредственно зоны сгорания или предкамеры, где смесь жидкости и топлива поджигается вне основной камеры сгорания.
При достаточно высокой концентрации перекиси водорода (около 35%) может протекать самовозгорание топлива и поддержание горения. Поджигание смеси жидкости с топливом может протекать путем самовозгорания или контакта с каталитической поверхностью, при котором запал или что-то подобное не нужно. Поджигание может осуществляться через тепловую энергию, например, запал накапливающее тепло, открытое пламя и т.п.
Смешение алифатического спирта с перекисью водорода может инициировать самовозгорание. Это особенно полезно в системе с предварительной камерой, где можно не допускать смешения перекиси водорода со спиртом до достижения предварительной камеры.
Если снабдить каждый цилиндр инжекторным клапаном для жидкой композиции, то достигается очень точное и адаптированное для всех сервисных условий дозирование жидкости. С помощью контролирующего устройства, регулирующего инжекторные клапаны, и различных датчиков, соединенных с мотором, подающих в контролирующее устройство сигналы о положении вала двигателя, скорости мотора и нагрузке и, возможно, о температуре поджига, можно достичь последовательной инжекции и синхронизации открывания и закрывания инжекторных клапанов и дозирования жидкости не только зависимо от нагрузки и нужной мощности, а также со скоростью мотора и температурой инжектируемого воздуха, что приводит к хорошему движению во всех условиях. Жидкая смесь в некоторой степени заменяет подачу воздуха.
Было проведено большое число испытаний для выявления различий в эффекте между смесями воды и перекиси водорода (23 и 35% соответственно).
Нагрузки, которые выбраны, соответствуют движению по высокоскоростной трассе и в городах. Испытывался мотор В20Е с водяным тормозом. Мотор прогревался перед испытанием.
При высокоскоростной нагрузке на мотор выделение NОх, СО и НС повышается при замене перекиси водорода на воду. Содержание NОхпонижается при увеличении количества перекиси водорода. Вода также снижает содержание NОх, однако при этой нагрузке требуется в 4 раза больше воды, чем 23% перекиси водорода для того же снижения содержания NОх.
При нагрузке движения по городу сначала подают 35% перекиси водорода, при этом скорость и момент мотора несколько возрастают (20-30 оборотов в мин/0,5-1 нМ).
При переходе на 23% перекись водорода момент и скорость мотора снижаются при одновременном возрастании содержания NОх. При подаче чистой воды трудно поддерживать вращение мотора. Содержание НС резко возрастает.
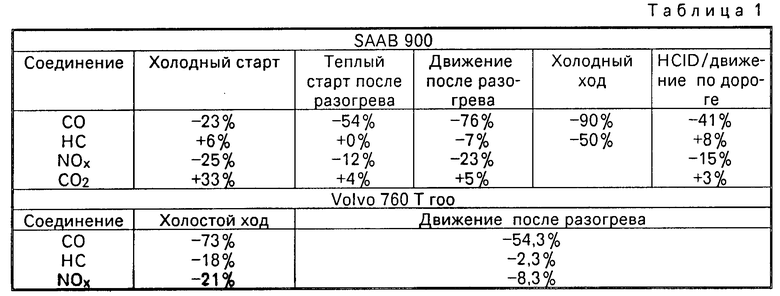
Таким образом, перекись водорода улучшает сгорание, одновременно снижая содержание NОх. Испытания, проведенные в Шведской Инспекции моторов и транспорта на моделях SAAB 900i и VoIvo 760 Тurbo с примешиванием и без примешивания к топливу 35% перекиси водорода дали следующие результаты по выделению СО, НС, NОх и СО2. Результаты представлены в % величин, полученных при использовании перекиси водорода, относительно результатов без использования смеси (таблица 1).
При испытании на Volvo 245 G14FK/84 при холостом ходе содержание СО было равно 4% и содержание НС 65 ч/млн без пульсации воздуха (очистка выхлопного газа). При смешении с 35% раствором перекиси водорода содержание СО снизилось до 0,05% , а НС-содержание - до 10 ч/млн. Время зажигания было равно 10о и обороты на холостом ходу были равны 950 об/мин в обоих случаях.
В испытаниях, проведенных в Норвежском морском технологическом исследовательском институте А/S в Трондхайме выделение НС, СО и NОхпроверяли для Volvo 760 Turbo после ЕСЕ-регулирования N 15.03 с прогретым мотором, начиная с использования или без использования 35% раствора перекиси водорода при сжигании (таблица 2).
Выше указано использование только перекиси водорода. Аналогичный эффект может быть достигнут также с другими перекисями и пероксо-соединениями, как неорганическими, так и органическими.
Жидкая композиция, кроме перекиси и воды, может содержать также до 70% алифатического спирта с 1-8 атомами углерода и до 5% масла, содержащего ингибитор коррозии.
Количество жидкой композиции, примешиваемое в топливу, может варьироваться от нескольких десятых долей процента жидкой композиции от количества топлива до нескольких сотен %. Большие количества используются, например, для трудновоспламеняемых топлив.
Жидкую композицию можно использовать в двигателях внутреннего сгорания и в других процессах сжигания с участием таких углеводородов, как нефть, уголь, биомасса и пр., в сжигающих печах для более полного сгорания и снижения содержания вредных соединений в выбросах.

Использование: в двигателях внутреннего сгорания, в частности в способе обеспечения улучшенного сгорания топлив с участием углеводородных соединений. Сущность изобретения: в способе предусматривается введение в композицию 10-80 об. % перекиси или пероксо-соединения. Композицию вводят отдельно от топлива. 1 з.п. ф-лы, 2 табл.
| ПРОИЗВОДНЫЕ 7-(2-АМИНО-1-ГИДРОКСИ-ЭТИЛ)-4-ГИДРОКСИБЕНЗОТИАЗОЛ-2(3Н)-ОНА В КАЧЕСТВЕ АГОНИСТОВ β-АДРЕНЕРГИЧЕСКИХ РЕЦЕПТОРОВ | 2006 |
|
RU2406723C9 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
Авторы
Даты
1995-01-20—Публикация
1989-05-12—Подача