Изобретение относится к контролю технологических процессов и может быть использовано для контроля состава тар- тратных растворов в технологии химического меднения, в частности, при производстве печатных плат.
В связи с тем, что тартратные растворы химического меднения широко используются в технологии металлизации диэлектриков, а контроль состава многокомпо- нентных технологических растворов несовершенен, разработка способов надежного определения концентраций нескольких компонентов с применением одного физико-химического метода анализа актуальна.
Известен способ контроля концентрации формальдегида в растворе для химического меднения [1]. Способ основан на измерении светопоглощения раствора меднения, пропускании его с помощью компрессора через трубку, нагретую до температуры 107оС, наполненную металлической медью или навитой медной проволокой, и последующем измерении свето- поглощения раствора. По результатам измерений контролируют концентрацию формальдегида. Способ имеет ряд сущест- венных недостатков. При определении концентрации формальдегида в растворе, содержащем CuSO4 ˙ 5H2O до 30-50 г/л и формалина до 10-30 мл/л, трубка быстро забивается выделяющейся металлической медью, что приводит к резкому уменьшению скорости прохождения анализируемого раствора и исключает возможность дальнейшего проведения анализа. При уменьшении скорости анализируемый раствор перегревается и вскипает (теряется проба), что ухудшает точность результатов анализа. При использовании этого способа для контроля концентрации формальдегида в растворах, содержащих никель, концентрация формальдегида фиксируется заниженной вследствие частичного осаждения никеля.
Наиболее близким к настоящему является способ спектрофотометрического определения концентраций меди и никеля в растворах химического меднения [2] . Способ основан на измерении концентрации меди по светопоглощению в области максимума полосы поглощения комплексов меди при 620 нм после разбавления анализируемого раствора, приготовлении модельного раствора меднения, содержащего измеренную концентрацию меди и не содержащего никель, и измерении светопоглощения анализируемого раствора в максимуме полосы поглощения комплексов никеля при 380 нм относительно приготовленного раствора. Способ имеет ряд недостатков: определение меди проводится без учета поглощения комплексов никеля при 620 нм, что приводит к значительным ошибкам в определении концентрации меди и никеля в растворе меднения.
Способ не позволяет сочетать определение щелочи и формальдегида с определением меди и никеля.
Целью изобретения является одновременное определение меди, никеля, щелочи и формальдегида в одной пробе.
Для этого отбирают пробу раствора и измеряют светопоглощение раствора при трех длинах волн, две из которых выбирают на длинноволновом и коротковолновых склонах полосы поглощения комплексов меди с максимумом поглощения при 620 нм, третью - на участке полосы поглощения комплексов никеля с максимумом при 380 нм, где коэффициент экстинкции комплексов никеля превышает коэффициент экстинкции комплексов меди. Затем добавляют раствор соли палладия, серебра или золота, нагревают раствор ниже температуры кипения, отделяют осадок, измеряют светопоглощение раствора при тех же длинах волн, концентрации меди, никеля и показатель щелочности определяют из системы уравнений вида
E(Cu, 1) C(Cu) + E(Ni, 1)C(Ni) +
+E(OH, i)pOH + Eo(1) = A(1)/l
E(Cu, 2)C(Cu) + E(Ni, 2)C(Ni) +
(1)
+ E(OH, 2)pOH + Eo(2) = A(2)/l
E(Cu, 3)C(Cu) + E(Ni, 3)C(Ni) +
+E(OH,3)pOH + Eo(3) = A(3)/l,
а общую концентрацию щелочи определяют по уравнению
C(NaOH) = K110-POH + K2C(Ni)+
(2)
+ K3C(Cu)(K4 - pOH), г/л
где C(Cu), C(Ni) - общие концентрации солей меди и никеля в растворе;
E(Cu, i), E(Ni, i), E(OH,i), Eo(i), K1-K4 - эмпирические коэффициенты, которые предварительно определяют по искусственным смесям с известным содержанием меди, никеля, щелочи и рОН, i = 1,2,3 - индексы длин волн, А - светопоглощение растворов, l - длина оптического пути.
Концентрацию формальдегида определяют по разности концентраций меди и никеля в растворе до добавления раствора соли палладия, серебра или золота и после отделения осадка с использованием предварительно построенного градуировочного графика.
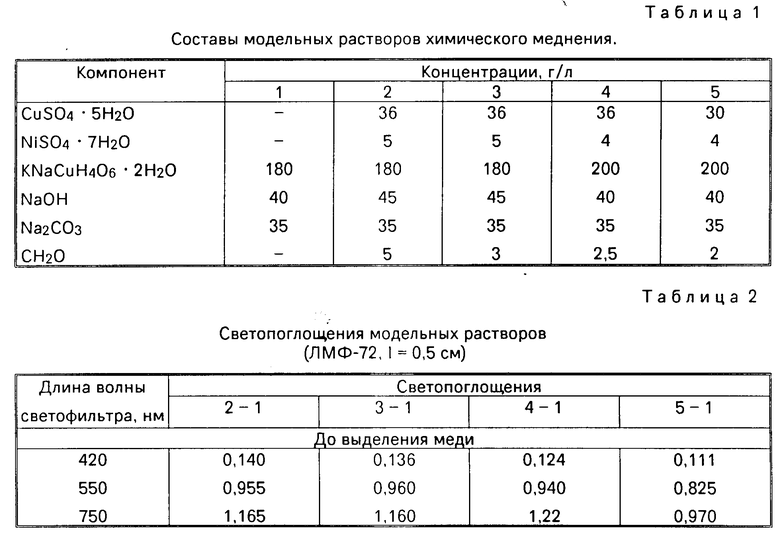
Растворы химического меднения имели следующий состав, г/л: CuSO4 ˙ 5H2O 15-35 NiSO4 ˙ 7H2O 3-5 KNaC4H4O6 ˙ 2H2O 180-200 NaOH 40-50 Na2CO3 35 CH2O 3,5-7 Na2S2O3 0,001
Для таких растворов градуировочные коэффициенты E(Cu,i), E(Ni,i), E(OH, i) и Еo(i) являются константами, численное значение которых зависит только от выбранных длин волн фотометрирования. Для их предварительного определения используют градуировку по стандартным смесям с известными концентрациями компонентов.
Величины К1 - К4 также постоянны для растворов меднения, содержащих определяемые компоненты в указанных диапазонах концентрации и зависят от способа выражения концентраций. рН измеряется потенциометрически, например, со стеклянным электродом. Значения величин К1-К4 рассчитываются путем решения уравнения (2) для стандартных смесей с известными концентрациями компонентов.
В качестве катализатора могут быть использованы растворимые в воде соли палладия, серебра, золота PdCl2, PdSO4, Pd(NO3)2, Pd(ClO4)2, AgNO3, AuCl3, Au2(SO4)3. Наиболее целесообразно в качестве соли благородного металла использовать хлорид палладия, так как эта соль применяется в самом технологическом процессе химического меднения. Количество катализатора, необходимое для обеспечения быстрого взаимодействия формальдегида с ионами металлов, устанавливается экспериментально в зависимости от составов растворов меднения.
Время нагревания раствора после добавления катализатора завиcит от температуры и также подбирается экспериментально, например, для проведения реакции восстановления меди при 95оС раствор следует нагревать не менее 5-6 мин.
Нагревание пробы выше температуры кипения, которая в зависимости от концентрации основных и накапливающихся электролитов колеблется в диапазоне 102-105оС, резко снижает надежность результатов определения формальдегида, вследствие перегрева и вскипания. Верхней границей оптимального диапазона температур является значение температуры кипения анализируемого раствора. Определение концентраций меди и никеля в растворе меднения по измеренным суммарным светопоглощениям при двух длинах волн решением системы линейных уравнений возможно только при постоянной щелочности раствора. При изменении равновесной концентрации щелочи изменяются градуировочные характеристики комплексов, что приводит к неправильным результатам анализа. Уменьшение концентрации щелочи сопровождается сдвигом максимума полосы поглощения комплексов меди в сторону увеличения длин волн.
Оптимальные диапазоны длин волн для регистрации оптических плотностей 720-770 нм, 520-570 нм и 400-440 нм.
В качестве раствора сравнения, как при измерении коэффициентов поглощения, так и при анализе растворов меднения следует использовать раствор, содержащий все компоненты раствора меднения кроме солей меди и никеля.
При контроле состава свежеприготовленного раствора меднения раствор сравнения готовят из исходных компонентов. При контроле состава раствора, эксплуатируемого в течение длительного времени, раствор сравнения готовят путем удаления солей меди и никеля из раствора, аналогичного анализируемому, например, электролизом с разделенными электродами. Такая подготовка раствора сравнения исключает систематические погрешности, обусловленные накапливающимися примесями в процессе эксплуатации ванны.
Конкретная реализация настоящего способа показана на примере одновременного фотометрического определения компонентов модельных растворов химического меднения.
П р и м е р. Определение солей меди, никеля, щелочи и формальдегида в модельных растворах химического меднения.
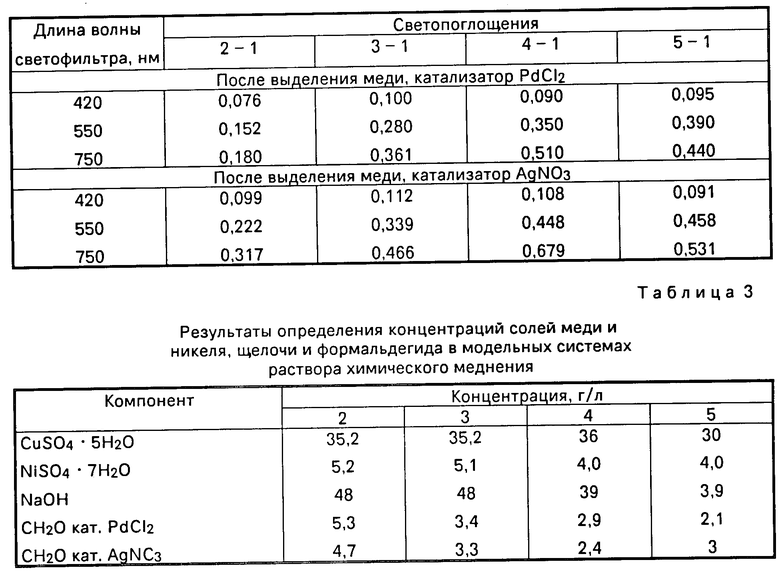
Готовят растворы хлорида палладия и нитрата серебра концентрации 4 мг/мл. Заданные концентрации компонентов модельных растворов приведены в табл.1. Раствор 1 используют в качестве раствора сравнения. Измеряют светопоглощения растворов 2-5 относительно раствора 1 в кюветах с длиной 0,5 см при трех светофильтрах. Результаты измерений представлены в табл.2. К 10 мл каждого из анализируемых растворов (2-5) при перемешивании прибавляют по 0,25 мл раствора хлорида палладия, термостатируют при 95-102оС в течение 5 мин. Растворы с осадком охлаждают, осадок отделяют центрифугированием и измеряют светопоглощение раствора относительно раствора 1 при тех же светофильтрах. Процедуры выделения металлов по реакции с формальдегидом для растворов 2-5 повторяют, используя вместо PdCl2 раствор нитрата серебра. Результаты измерений представлены в табл.2.
Записывают систему уравнений вида (1). (Коэффициенты удельного поглощения определены для трех светофильтров предварительно).
1,4˙ 10-3 С(Cu) + 2,00 ˙10-2C(Ni) +
+ 7,46˙ 10-2 pOH - 0,045 = A (420),
2,41 ˙10-2 C(Cu) - 8,9 ˙10-3 C(Ni) -
- 0,495 pOH + 0,362 = A (550)
3,702 ˙10-2 C(Cu) + 1,730 ˙10-2 C(Ni) +
+ 0,466 pOH - 0,425 = A (750)
Решение системы уравнений получено в следующем виде:
C(CuSO4 ˙ 5H2O) = -8,34(A(420) + 0,045) +
+ 15,17 (A(550) - 0,362) + 17,44 (A(750) +
+ 0,425);
C(NiSО4 ˙7H2О) = 55,82(A(420) + 0,045) +
+3,99 (A(550) - 0,312) - 4,69 (A(750) + 0,425);
pOH = -1,41 (A(420) + 0,045) - 1,35 (A(550) - -0,362) + 0,93 (A(750) + 0,425).
Общую концентрацию щелочи (г/л) определяют по уравнению вида (2) при К3 = 9,25, К4 = 1,04.
 (
(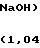

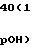 0-pOH+3
0-pOH+3 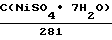 + 9,25
+ 9,25 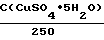 ×
×
(5)
Результаты расчета по уравнениям (4,5) представлены в табл.3. Концентрацию формальдегида определяют из градуировочных зависимостей изменения суммарной концентрации меди и никеля (в моль/л) от концентрации формальдегида.
Общее время реализации способа при анализе одной пробы составляет 10-15 мин, причем концентрации трех компонентов - медь, никель, щелочь - определяются в течение 2-3 мин.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения гетероядерных ацетатных комплексов двухвалентной платины | 2017 |
|
RU2647131C1 |
| Способ измерения уровня рассеянного света в спектрофотометрах | 1983 |
|
SU1176181A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ НАНОАЛМАЗОВ, ДОПИРОВАННЫХ ЭЛЕМЕНТОМ ГРУППЫ 14, И СПОСОБ ИХ ОЧИСТКИ | 2020 |
|
RU2825658C2 |
| 5-Фенилазо-8-меркаптохинолинат натрия моногидрат как аналитический реагент для определения ионов тяжелых металлов | 1988 |
|
SU1657497A1 |
| РАСТВОР ДЛЯ ЛАЗЕРНО-ИНДУЦИРОВАННОЙ МЕТАЛЛИЗАЦИИ ДИЭЛЕКТРИКОВ И СПОСОБ ЛАЗЕРНО-ИНДУЦИРОВАННОЙ МЕТАЛЛИЗАЦИИ ДИЭЛЕКТРИКОВ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2462537C2 |
| Способ селективного выделения обогащенных концентратов платиновых металлов из многокомпонентных растворов | 2021 |
|
RU2764778C1 |
| СПОСОБ ОКИСЛИТЕЛЬНОГО РАЗЛОЖЕНИЯ АНИОНА 1-ГИДРОКСИЭТАН-1,1-ДИФОСФОНОВОЙ КИСЛОТЫ В ВОДНОМ РАСТВОРЕ | 2007 |
|
RU2363666C2 |
| СПОСОБ РАЗРУШЕНИЯ АНИОНА 1-ГИДРОКСИЭТАН-1,1-ДИФОСФОНОВОЙ КИСЛОТЫ В ОТХОДАХ ПРОИЗВОДСТВА | 2011 |
|
RU2500629C2 |
| РАСТВОР ДЛЯ ЛАЗЕРНО-ИНДУЦИРОВАННОЙ МЕТАЛЛИЗАЦИИ ДИЭЛЕКТРИКОВ | 2013 |
|
RU2550507C2 |
| НАНОАЛМАЗ, ДОПИРОВАННЫЙ ГЕТЕРОАТОМОМ | 2020 |
|
RU2817654C2 |
Сущность изобретения: способ предназначен для определения меди, никеля, щелочи и формальдегида в одной пробе раствора химического меднения. Измеряют оптическую плотность пробы при трех длинах волн, две из которых выбирают на длинноволновом и коротковолновом склонах полосы поглощения комплексов меди с максимумом поглощения при 620 нм, третью - на участке полосы поглощения комплексов никеля с максимумом при 380 нм, где коэффициент эстинкции комплексов никеля превышает коэффициент экстинкции комплексов меди. Затем к пробе добавляют раствор соли палладия, серебра или золота и нагревают раствор ниже температуры кипения. После отделения образовавшегося осадка измеряют оптическую плотность раствора при тех же длинах волн. Концентрации меди, никеля и показатель щелочности определяют из системы уравнения вида E(Cu,1)C(Cu) + E(Ni,1)C(Ni) + E(OH,1)pOH + E(Cu,1)C(Cu)+E(Ni,1)C(Ni)+E(OH,1)pOH+E°(1)=A(1)/l, = A(1)/l, E(Cu,2)C(Cu) + E(Ni,2)C(Ni) + E(OH,2)pOH + E(Cu,2)C(Cu)+E(Ni,2)C(Ni)+E(OH,2)pOH+E°(2)=A(2)/l, = A(2)/l, E(Cu,3)C(Cu) + E(Ni,3)C(Ni) + E(OH,3)pOH + E(Cu,3)C(Cu)+E(Ni,3)C(Ni)+E(OH,3)pOH+E°(3)=A(3)/l, = A(3)/l, а общую концентрацию щелочи определяют по уравнению: C(NaOH) = K, 10-pOH+K2C(Ni)+K3C(CU)(K4)(K4-pOH) г/л, где C(Cu), C(Ni) - общие концентрации солей меди и никеля в растворе, E(Cu,i), E(Ni,i), E(OH,i), E°(i) K1-K4 - эмперические коэффициенты, которые предварительно определяют по искусственным смесям с известным содержанием меди, никеля, щелочи и pOH, i = 1, 2, 3 - индексы длин волн, A - оптическая плотность растворов, l - длина оптического пути. Концентрацию формальдегида определяют по разности концентраций меди и никеля в растворе до добавления раствора соли палладия, серебра или золота и после отделения осадка с использованием предварительно построенного градуировочного графика. Для повышения чувствительности и экспрессности способа длины волн выбирают из следующих диапазонов: первая - 720 - 770 нм, вторая - 520 - 570 нм, третья - 400 - 440 нм, а нагревают раствор при 95 - 102°С в течение 5-6 мин. 3 з.п.ф-лы, 3 табл.
E(Cu,1)C(Cu) + E(Ni,1)C(Ni) + E(OH,1)pOH + Eo(1) = A(1)/l;
E(Cu,2)C(Cu) + E(Ni,2)C(Ni) + E(OH,2)pOH + Eo(2) = A(2)/l;
E(Cu,3)C(Cu) + E(Ni,3)C(Ni) + E(OH,3)pOH + Eo(3) = A(3)/l,
а общую концентрацию щелочи определяют по уравнению
C(NaOH) = K110-pOH+ K2C(Ni) + K3C(Cu)(K4 - pOH), г/л,
где C(Cu), C(Ni) - общие концентрации солей меди и никеля в растворе;
E(Cu, i), E(Ni,i), E(OH,i), Eo(i), K1 - K4 - эмпирические коэффициенты, которые предварительно определяют по искусственным смесям с известным содержанием меди, никеля, щелочи и рОН;
i = 1,2,3 - индексы длин волн;
A - светопоглощение растворов;
l - длина оптического пути,
а концентрацию формальдегида определяют по разности концентраций меди и никеля в растворе до добавления раствора соли палладия, серебра или золота и после отделения осадка с использованием предварительно построенного градуировочного графика.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Николаева Е.М., Озерова Г.П | |||
| Спектрофотометрическое определение содержания меди и никеля в растворах химического меднения | |||
| Обмен опытом в радиопромышленности, 1983, N 1, с.49-51. | |||
Авторы
Даты
1995-02-09—Публикация
1991-02-25—Подача