Изобретение касается новых фенилсульфоновых производных, которые являются ингибиторами фермента альдозоредуктазы и которые представляют ценность, например, при лечении некоторых периферических эффектов диабета или галактоземии. Предлагается также способ лечения одного или более таких периферических эффектов с использованием фенилсульфонового производного и фармацевтические композиции, содержащие такие производные. Кроме того, изобретение касается новых процессов производства новых производных и получения медикаментов, содержащих любое из указанных производных.
Фермент альдозоредуктаза является ответственным за каталитическое превращение альдоз, таких как глюкоза и галактоза, в соответствующие альдиты, такие как сорбит и галактозит, соответственно, у теплокровных животных, таких как человек. Альдиты плохо проникают в клеточные мембраны, и коль скоро они образовались, они имеют тенденцию удаляться только при последующем метаболизме. Вследствие этого альдиты имеют тенденцию накапливаться в клетках, где они образуются, вызывая повышение внутреннего осмотического давления, что, в свою очередь, может быть достаточным для разрушения или ухудшения функции самих клеток. В дополнение к сказанному, повышенные уровни альдита могут приводить в результате к аномальным уровням их метаболитов, которые сами по себе могут ухудшать или повреждать клеточные функции. Фермент альдозоредуктаза имеет относительно низкое сродство к субстрату и обычно является эффективным только в присутствии относительно больших концентраций альдозы. Такие большие концентрации присутствуют при клинических состояних диабета (избыточное содержание глюкозы) и галактоземии (избыточное содержание галактозы). Соответственно, альдозоредуктазные ингибиторы полезны при снижении или предовращении развития тех периферических эффектов диабета или галактоземии, которые могут быть следствие частичного накопления сорбита или галактита, соответственно, в тканях, таких как глаза, нервы и почки. Такие периферические эффекты включают, например, макулярную (пятнистую) отечность, катаракту, ретинопатию, нейропатию и ухудшению нервную проводимость.
Хотя был открыт и исследован ряд альдозоредуктазных ингибиторов, существует постоянная потребность в альтернативных ингибиторах. В европейской патентной заявке, имеющей публикационный номер 304190, описывается ряд производных (фенилсульфонил(нитрометана в качестве ингибиторов фермента альдозоредуктазы. Мы обнаружили, что конкретные новые производные (фенилсульфонил)нитрометана, описанные ниже, являются неожиданно сильными ингибиторами альдозоредуктазы, что составляет основу изобретения.
Согласно изобретению предполагается новое соединение (4-амино-2,6-диметилфенилсульфонил)нитрометан (соединение I или его фармацевтически приемлемые соли).
Согласно еще одному аспекту изобретения предполагается фармацевтическая композиция, включающая соединение I или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем или носителем.
Композиции изобретения могут быть представлены в разноообразных общепринятых формах. Они могут быть в форме, подходящей для орального использования (например, в виде таблеток, пилюль, твердых или мягких копсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного использования (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий) или для парэнтерального назначения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного, внутримышечного или внутрисосудистого введения) или в виде суппозиториев для ректального введения.
Композиции согласно изобретению могут быть получены с помощью обычных приемов с использованием общепринятых фармацевтических эксципиентов, хорошо известных в технике. Композиции, предназначенные для орального использования, могут содержать, например, один или более подкрашивающих, подслащивающих, вкусовых и/или предохраняющих агентов, и могут быть в форме твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином. Композици для орального использования могут быть также в форме мягких желатиновых капсул, в которых активный ингредиент смешан с водой или маслом, таким как арахисовое масло, жидкий парафин или оливковое масло.
Подходящие фармацевтически приемлемые эксципиенты для использования в препаративных формах в виде таблеток, включают, например, инертные разбавители, такие как лактоза, карбонат натрия, фосфат кальция или карбонат кальция, гранулирующие или дезинтегрирующие агенты, такие, как кукурузный крахмал или альгиновая кислота; связующие агенты, такие как желатин или крахмал; смазочные агенты, такие, как стеарат магния, стеариновая кислота или тальк; предохраняющие агенты, такие, как этил или пропил п-гидроксибензоат, и антиоксиданты, такие, как аскорбиновая кислота. Таблеточные готовые препаративные формы могут быть без покрытия или с покрытием, или для модификации их дезинтеграции и последующей абсорбции активного ингредиента в желудочно-кишечном такте, или для улучшения их стабильности и/или внешнего вида, в любом случае с использованием обычных агентов для покрытия и процедур, хорошо известных в технике.
Водные суспензии обычно содержат активный ингредиент в тонко измельченном порошкообразном виде вместе с одним или более суспендирующими агентами, такими, как карбоксиметилцеллюлоза натриевая, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинил-пирролидон, камедь трагаканта или камедь акации; диспергирующими или смачивающими агентами, такими как лецитин или продукты конденсации окиси алкилена с жирными кислотами (например, полиоксиэтиленстеарат), или продукты конденсации окиси этилена с алифатическими спиртами с длинной цепью, например, гептадекаэтиленоксицетанол, или продукты конденсации окиси этилена с частичными сложными эфирами, получаемыми из жирных кислот и гекситола, такие как полиоксиэтиленсорбитмоноолеат, или продукты конденсации окиси этилена с частичными сложными эфирами, происходящими из жирных кислот и ангидридов гексита, например, полиэтиленсорбитанмоноолеат. Водные суспензии типично также содержат один или более предохранителей (таких, как этил- или пропил-п-гидроксибензоат, антиоксиданты (также, как аскорбиновая кислота), красящие агенты, вкусовые агенты и/или подслащивающие агенты (такие, как сахароза, сахарин или аспартам).
Масляные суспензии могут образоваться с помощью суспендирования активного ингредиента в растительном масле (таком, как арахисовое масло, оливковое масло, кунжутное масло, или масло кокосового ореха) или в минеральном масле (таким, как жидкий парафин). Масляные суспензии также могут содержать загущающий агент, такой, как пчелиный воск, твердый парафин или цетиловый спирт. Подслащивающие агенты, такие, как представленные выше, и вкусовые агенты могут добавляться для получения приятного на вкус орального препарата. Эти композиции могут предохраняться с помощью добавления антиоксиданта, такого, как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии путем добавления воды, обычно содержат активный ингредиент вместе с диспергирующим или смачивающим агентом, суспендирующим агентом и одной или более предохраняющими или консервирующими добавками. Примерами подходящих диспергирующих или смачивающих агентов и суспендирующих агентов являются те, которые уже упомянуты выше. Могут также присутствовать дополнительные эксципиенты, такие, как подслащивающие, вкусовые и красящие агенты.
Фармацевтические композиции по изобретению могут быть также в форме эмульсий масло-в-воде. Масляной фазой может быть растительное масло, такое, как оливковое масло или арахисовое масло, или минеральное масло, такое, как например, жидкий парафин или смесь любого из них. Подходящими эмульгирующими агентами могут быть, например, встречающиеся в природе камеди, такие, как камедь акации или камедь астрагана (трагаканта), встречающиеся в природе фосфатиды, такие, как соя, лецитин, или сложные эфиры или частичные сложные эфиры, происходящие из жирных кислот и ангидридов гекситола (например, сорбитанмоноолеат) и продукты конденчации указанных частичных сложных эфиров с окисью этилена, такие как полиоксиэтилен-сорбитан-моноолеат. Эмульсии могут также содержать подслащивающие, вкусовые и предохраняющие агенты.
Сиропы и эликсиры могут формулироваться с подслащивающими агентами, такими как глицерин, пропиленгликоль, сорбит, аспартам или сахароза, и могут также содержать деэмульгатор, предохраняющий агент вкусовой и/или красящий агент.
Фармацевтические композиции могут также быть в форме стерильной инъецируемой водной или масляной суспензии, которая может формулироваться согласно известным процедурам с использованием одного или более соответствующих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильный инъецируемый препарат также может представлять собой стерильный инъекцируемый раствор или суспензию в нетоксичном парэнтерально приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле.
Препаративные формы в виде медицинских свечей или суппозиториев могут приготавливаться с помощью смещения активного ингредиента с подходящим нераздражающим эксципиентом, который является твердым при обычных температурах, но жидким при ректальной температуре и следовательно будет расплавляться в прямой кишке, высвобождая лекарство. Подходящие эксципиенты включают, например, масло какао и полиэтиленгликоли.
Топические препаративные формы, такие как кремы, мази, гели и водные или масляные растворы или суспензии могут обычно получаться с помощью формулирования активного ингредиента с обычным топически приемлемым носителем или разбавителем, с использованием общепринятых процедур, хорошо известных в технике. Топические препаративные формы для назначения в глаза обычно будут представлены в виде мази, геля или стерильного раствора, буферированного при офтальмически приемлемой величине рН, например, в интервале рН 7,0-7,6.
Количество активного ингредиента, которое сочетается с одним или более эксципиентами для получения единичной дозированной формы, обязательно будет варьироваться в зависимости от подвергаемого лечению субъекта и от кокретного способа назначения. Например, препаративная форма, предназначенная для орального назначения людям, обычно содержат, например, от 0,5 мг до 1 г активного соединения, компаундированного с подходящим и удобным количеством эксципиентов, которое может изменяться примерно от 5 до 98% по массе от всей композиции. Формы дозированных единиц обычно содержат примерно от 1 мг до 500 мг активного ингредиента.
Особенно подходящие соли включают, например, фармацевтически приемлемые аддитивные соли основания, например, соли щелочных металлов (такие, как соли калия или натрия), щелочно-земельных металлов (таких, как кальций или магний) и аммониевые соли, и соли с органическими основаниями, дающие физиологически приемлемые катионы (такие, как соли с метиламином, диметиламином, триметиламином, пиперидином и морфолином); и фармацевтически премлемые соли с кислотами (такие, как соли с галоидоводородами (особенно хлористым водородом и бромистым водородом), серной кислотой и фосфорной кислотой).
Соединение изобретения может быть получено с помощью стандартных процедур органической химии, уже известных для получения структурно аналогичных соединений, например, с помощью одной или более процедур, описанных в нашей упомянутой выше европейской патентной заявке или процедур, обзор которых дан с статье Zeilstra и др. в Rec. Traw./Chim. Pays Bas 1974, 93, 11-14. Такие процедуры представляются в виде дополнительного признака изобретения и иллюстрируются следующими процедурами.
(а) Удаление защитной группы из защищенной формы соединения. Подходящие защитные группы и приемы, необходимые для их введения и удаления, являются хорошо известными и описываются в стандартных учебниках органической химии.
Особенно подходящей защищенной формой соединения является, например, N-ацильное производное его, и особенно N-(1-6)С алканоильное и бензоильное производное, такое как N-ацетильное, N-пропаноильное, N-бензоильное или N-п-хлорбен- зоильное производное соединения.
Защитная группа может удаляться с помощью обычных процедур. Так, например, из N-ацильного производного защитная группа может удобным образом удаляться с помощью гидролиза, например, с помощью реакции с сильной кислотой, такой, как соляная, фосфорная или серная кислота, или с помощью реакции с сильным основанием, например, гидроокисью щелочного металла, такой, как гидроокись лития, натрия или калия. В любом из случаев гидролиз обычно проводится в водной среде (такой, как вода, необязательно вместе с (1-4)С алканолом, таким, как этанол) и при температуре в интервале, например, 40-100оС.
Исходные защищенные формы соединения могут удобным образом получаться с помощью, например, введения защитной группы в амино-группу на равнней стадии последовательности синтеза. Так, например, N-алканоильные или бензоильные производные соединения могут получаться с помощью взаимодействия 3,5-диметиланилина с подходящим алканоил (или бензоил)-хлоридом, бромидом или ангидридом, давая соответствующий N-ацил-3,5-диметиланилин. Ацилирование обычно проводится с использованием избытка ацилирующего агента в присутствии основания, такого как триэтиламин, в подходящем растворителе или разбавителе, таком, как трет-бутил-метиловый эфир или тетрагидрофуран, и при температуре, например 10-40оС, и удобным образом при температуре окружающей среды или близкой к ней. N-Ацил-3,5-диметиланилин затем хлорсульфонируется с помощью реакции с хлорсульфоновой кислотой, давая (4-N-ациламино-2,6-диметилфенил)сульфонил-хлорид, который восстанавливается, например, подходящим сульфитом (таким, как сульфит натрия) в присутствии подходящего буфера (такого, как бикарбонат натрия) при температуре, например 60-90оС, давая (4-N-ациламино-2,6-диметилфенил)сульфиновую кислоту. Последняя кислота затем превращается в соль ее щелочного металла, а затем вводится в реакцию с нитрометаном в присутствии иода С1-С6 алкоголята щелочного металла, такого как трет-бутилат калия, давая требуемый (4-N-ациламино-2,6-диметилфенилсульфонил)нитрометан. Последняя стадия аналогичная процессу (в), описанному ниже. Общая процедура иллюстрируется сопровождающими примерами.
N-Ацильные производные соединения являются новыми и предлагаются в качестве дальнейшего аспекта изобретения. Некоторые из N-ацильных производных, такие как N-ацетильное производное (4-ацетамидо-2,6-диметилфенилсульфонил)нитрометан, также обладают свойством ингибировать фермент альдозоредуктазу.
(в) Взаимодействие щелочно-металлической соли 4-амино-2,6-диметилбензолсульфиновой кислоты с нитрометаном и иодом в присутствии С1-С6 алкоголята щелочного металла, такого, как трет-бутилат калия, или метилат натрия.
Реакция предпочтительно осуществляется в присутствии подходящего полярного растворителя, например, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинона (ДМР) или N,N-диметилформамида (которые являются предпочтительными) или N-метил-2-пирролидона, и при температуре в интервале, например, -30-20оС, удобным образом примерно при 0оС. Нитрометан обычно присутствует в избытке.
Исходная щелочно-металлическая соль может получаться, например, из соответствующей сульфиновой кислоты с помощью реакции с подходящей гидроокисью щелочного металла или С1-С6 алкоголятом щелочного металла, такими, как метилат или этилат натрия или калия. Сульфиновая кислота сама по себе может получаться аналогичным образом, как соответствующее N-ацильное производное, упомянутое в процессе (а) выше, например, с помощью обычного восстановления 4-амино-2,6-диметилбензолсульфонилхлорида с использованием, например, водного сульфита натрия и бикарбоната натрия. Сульфонилхлорид может получаться, например, из 4-амино-2,6-диметилфенил изотиоцианата по реакции с хлором в воде, с использованием условий, аналогичных условиями, описанным авторами Джонсоном и др. в J.Amer.Chem. Soc. 1939, 61, 2548. Изотиоцинат сам по себе может получаться, например, с помощью реакции 3,5-диметиланилина с тиоцианом (получаемым на месте из тоцианата свинца (II) и хлором в уксусной кислоте или тиоцианатом меди (II) в метил или этил-ацетате.
(с) Окисление тиоэфира, (4-амино-2,6-диметилфенилтио)нитрометана. Подходящие окисляющие агенты включают, например, те, которые хорошо известны в технике для превращения тио в сульфонильные группы и которые совместимы с аминогруппой. Так, например, периодат щелочного металла (такой как метапериодат натрия), персульфат (такой как моноперсульфат калия) или перманганат щелочного металла (такой как перманганат калия) может применяться.
Окисление предпочтительно осуществляется в подходящем обычном растворителе или разбавителе для таких реакций окисления, например, в уксусной или пропионовой кислоте, и при температуре в общем интервале, например, 0-80оС.
В некоторых случаях продукт частичного окисления (4-амино-2,6-диметилфенилсульфинил)нитрометан может получаться в виде выделяемого промежуточного продукта. Данный продукт может затем дополнительно окислять, давая соединение.
Изобретение также включает окисление такого промежуточного продукта в соединение 1, например, с помощью реакции с перманганатом щелочного металла (таким, как перманганат калия) в подходящем растворителе, таком, как водная уксусная кислота, и при температуре в интервале, например 20-80оС.
Исходный простой тиоэфир может получаться с помощью обычных процедур органической химии, например, из калиевой или натриевой соли 4-амино-2,6-диметилфенилтиола с помощью превращения в соответствующую тиоуксусную кислоту (или ее С1-С4 алкиловый эфир, такой как метиловый или этиловый эфир) с помощью реакции с хлор- или бром уксусной кислотой (или С1-С4 алкиловым эфиром ее) в присутствии подходящего основания. Кислота (или ее сложный С1-С4 алкиловый эфир) затем подвергается взаимодействию с С1-С5-алкилнитратом и С1-С6 алканом щелочного металла, например, изопропилнитратом и бутиллитием, в подходящем растворителе или разбавителе, таком как тетрагидрофуран или простой трет-бутилметиловый эфир, и при температуре в интервале, например, от -80 до 10оС, давая щелочно-металлическую соль 2-(4-амино-2,6-диметилфенилтио)-2-нитроуксус- ной кислоты (или ее С1-С4 алкилового эфира. Последняя кислота является нестабильной и легко декарбоксилируется. Подкисление щелочно-металлической соли нитроуксусной кислоты дает возможность выделения требуемого простого тиоэфира. Аналогичным образом, сложный алкиловый эфир нитроуксусной кислоты может гидролизоваться, например, с использованием водного основания, в соответствующую кислоту, а затем подкисляться, давая простой тиоэфир.
4-Амино-2,6-диметилфенилтиол может получиться, например, с помощью взаимодействия 3,5-диметиланилина с тиоцианом (генерируемым на месте из тиоцианата свинца (II) и хлора в уксусной кислоте или с тиоцианатом меди (II), давая 4-амино-2,6-диметилфенил изотиоцианат, который затем восстановаливается, например, боргидридом натрия в этаноле в требуемый тиол.
После этого, когда требуется фармацевтически приемлемая соль, соединение может подвергаться реакции с соответствующим основанием или кислотой, имеющими физиологически приемлемый ион.
Как указывалось выше, соединение ингибирует фермент альдозоредуктазу, и таким образом, оно представляет ценность, например, при лечении тех заболеваний или состояний, которые вызываются избыточными количествами продуктов, таких как сорбит, образуемыми в организме с помощью процессов, катализируемых ферментом альдозоредуктазой.
Свойство ингибирования фермента альдозоредуктазы ин виво может быть продемонстрировано с помощью следующего ниже стандартного лабораторного испытания.
У крыс вызывают диабет (о чем свидетельствует наличие сильной глюкозурии) введением стрептозоцина. Затем животным дают ежедневно испытываемое соединение в течение одного, двух или пяти дней. Затем животных умервщляют через 2-6 ч после окончательного введения дозы препарата, и удаляют глазные хрусталики и/или седалищные нервы. После стандартной процедуры обработки определяются остаточные уровни сорбита в каждой ткани с помощью газо-жидкостной хроматографии после превращения в политриметилсилильное производное. Ингибирование альдозоредуктазы ин виво может затем оцениваться с помощью сравнения уровней сорбита в тканых от диабетической группы крыс, которым вводили препарат, с уровнями у диабетических крыс, которым не давали препарат, и у нормальной группы крыс, которым не давали лекарство.
В типичных примерах описанных выше испытаний ин виво соединение имело показатель ЕD50 для орального назначения примерно 0,9 мг/кг. В противоположность этому структурно аналогичный (4-аминофенилсульфонил)нитрометан, описанный в упомянутой европейской патентной заявке, имел оральный показатель ЕD50 примерно 4,8 мг/кг.
Свойство игибирования фермента альдозоредуктазы может также демонстрироваться ин витро. В стандартной процедуре частично очищенная альдозоредуктаза выделяется известным образом из хрусталиков быка. Затем с использованием стандартных спектрофотометрических методов может быть определено ингибирование в процентах способности данного фермента ин витро катализировать восстановление альдоз в многоатомные спирты, и частично восстанавливатиь глюкозу в сорбит, вызываемое испытываемым соединением.
В типичных примерах описанного испытания ин витро соединение имело показатель lC50 20 х 10-8 М, а известный структурно родственный (4-аминофенилсульфонил) нитрометан имел величину lC50 примерно 100 х 10-8 М.
Данная заявка в основном основана на неожиданном открытии, что соединение, полученное в соответствии со способом изобретения, обладает существенно лучшими ингибирующими свойствами в отношении альдозоредуктазы по сравнению с наиболее близким по структурному строению аналогами, в частности, представленными в заявке СССР N 4356988/04. Ни одно из предпочтительных в плате активности соединений по упомянутой заявке, не содержит аминозаместителя. Утверждают, что в более ранней заявке не имеется указания, следуя которому из всех возможный значений, которое может иметь переменное Q, можно бы получить конкретное соединение, в котором Q представляет собой 4-амино-2,6-диметилфенил. В действительности, если надо получить единственное соединение, представленное в упомянутой заявке, которое имеет аминозаместитель, а именно 4-аминофенилсульфонилнитрометан (пример 26), то это менее активно in vitro, чем другие соединения, представленные там.
Однако из сравнительных данных ясно, что активность (4-амино-2,6-диметилфенилсульфонил)нитрометана (lC50 20 х 10-8 м; орально ЕD50 0,9 мг/кг), является в 5 раз более высокой как in vitro, так и in vivo, чем активность (4-аминофенилсульфонил)нитрометана (lC50 100 х 10-8 м; орально ED50 4,8 мг/кг). Такого значительного повышения активности невозможно было ожидать исходя из заявки 4356988/04.
Кроме того, провели испытания с тем, чтобы показать, что (фенилсульфонил)нитрометан (то есть соединение, не имеющее заместителя в фенильном кольце) имеет оральный показатель ED50 2,8 мг/кг (орально), а (2,6-диметилфенилсульфонил)нитрометан имеет показатель ED50 1,6 мг/кг (орально). Следовательно, введение 4-аминозаместителя в фенилсульфонилнитрометан увеличивает ED50 с 2,8 до 4,8 мг/кг (то есть приводит к значительно меньшей оральной активности соединения). В противоположность этому, введение 4-амино-заместителя в (2,6-диметилфенилсульфонил)нитрометан снижает ED50 с 1,6 до 0,9 мг/кг (то есть приводит к значительно большей оральной активности соединения).
Сделанное сравнение показывает, что соединение, полученное в соответствии с изобретением, обладает совершенно неожиданными свойствами по сравнению с известными соединениями.
Соединение (или его фармацевтически приемлемая соль) прежде всего назначается системно (обычно через рот) теплокровным животным для получения терапевтического или профилактического эффекта за счет ингибирования фермента альдозоредуктазы, например, при суточной дозе в интервале 1-40 мг/кг. В случае людей предусматривается, что общая суточная доза в интервале, например 15-800 мг на человека, будет назначаться, даваться, если необходимо, в виде раздельных доз. Однако точное количество назначаемого соединения будет естественно изменяться несколько, например, в зависимости от возраста и пола пациента и от тяжести и степени состояния, подвергаемого лечению.
Соединение 1 или его фармацевтически приемлемая соль может также назначаться топически, например, с помощью непосредственного топического назначения к тканям или органам, в которых необходимо ингибирование фермента, например к глазам. Точное назначаемое количествор соединения обязательно зависит от используемой препаративной формы. Когда назначается раствор, обычно используется концентрация соединения, составляющая до 0,01% по массе. Аналогичным образом, когда назначается мазь, обычно будет использоваться концентрация соединения до 2% по массе. Топические препаративные формы соединения (или его фармацевтически приемлемой соли) могут назначаться по отношению к глазам животного, например, человека или собаки, требующего лечения и/или предотвращения диабетических катаракт или ретинопатии, обычным образом, например, путем использования глазных капель или топической препаративной формы в виде промывки для глаз.
Соединение 1 может удобным образом назначаться одновременно или примерно в то же самое время, что и один или более других агентов, которые, как известно, оказывают полезное действие при лечении диабета или галактоземии, например, гипогликемический агент, такой как толбутамид, хлорпропамид или глибенкламид. Любой один или более таких агентов могут также удобных образом присутствовать в виде дополнительного активного ингредиента в композиции согласно изобретению.
Изобретение теперь будет проиллюстрировано с помощью следующих ниже неогреничивающих примеров (из которых пример 2 описывает получение промежуточного продукта), и в которых, если не указано иное
(I) растворители удалялись с помощью вращательного испарения в вакууме при температуре бани 40-50оС;
(II) все операции осуществлялись при комнатной температуре, т.е. в интервале 18-26оС;
(III) хроматография на колонке и мгновенная хроматография осуществлялись на двуокиси кремния (Мерк Арт. 7736), а жидкостная хроматография среднего давления (МРLC) на двуокиси кремния (Мерк Арт. 9385), оба материала поставляются фирмой Е Мерк энд Ко. Дармштадт, Западная Германия;
(IY) конечные продукты характеризовались данными микроанализа, ЯМR и/или масс спектроскопии; и
(Y) выходы даны лишь для иллюстрации и необязательно являются максимально достижимыми с помощью разработанного способа.
П р и м е р 1. (4-Ацетамидо-2,6-диметилфенилсульфонил)нитрометан (11,5 г, 40 мМ) добавляется в виде одной порции к кипящей смеси концентрированной соляной кислоты (22мл), воды (110 мл) и этанола (45 мл). Смесь перемешивается при нагревании с обратным холодильником до тех пор, пока не образуется прозрачный раствор (примерно 20 мин), а затем в течение дополнительных 10 мин. Горячая реакционная смесь затем выливается в избыток охлажденного льдом насыщенного раствора бикарбоната натрия. Водная смесь экстрагируется этилацетатом. Объединенные экстракты промываются солевым раствором, сушатся сульфатом магния, и растворитель удаляется выпариванием, давая (4-амино-2,6-диметилфенилсульфонил)нитрометан, в виде твердого вещества, т.пл. 132-133оС (после перекристаллизации из этанола ) с выходом 73% ЯМR (d6-ДMCO, 200 МГц): 2,39 /6Н, с. 6,19 (4Н, с.), 6,35 (2Н, с.);
Найдено, C 44,5; H 4,9; N 11,6.
С9Н12N2O4S
Вычислено, С 44,3; Н 4,9; N 11,5.
П р и м е р 2. Нитрометан (6,72 мл, 124 мМ) добавляется к перемешиваемому раствору метилата натрия (3,01 г, 55,8 мМ) в N,N-диметилформамиде (ДМФ, 250 мл), охлаждается до 0оС на ледяной бане. Когда добавление завершится, перемешивание продолжается дополнительно в течение 30 мин при 0оС. Затем добавляется натриевая соль 4-ацетамидо-2,6-диметилбензолсульфиновой кислоты (11,59 г, 56 ммолей) с последующим немедленным добавлением иода (7,2 г, 28,3 ммоля). Смесь перемешивается в течение 16 ч и оставляется для достижения комнатной температуры. Концентрированный раствор водного сульфита натрия затем добавляется, частично обесцвечивая реакционную смесь, которая затем выливается в воду (примерно 1 л) и подкисляется 2 М соляной кислотой. Водная смесь экстрагируется этилацетатом. Объединенные экстракты промываются водой, затем солевым растворм и сушатся (сульфатом магния). Растворитель удаляется выпариванием, и остаток очищается с помощью жидкостной хроматографии среднего давления (МРLC) на двуокиси кремния, при элюировании смесью этилацетат-гексан (1: 10 об. /об. при постепенном увеличении до 1:5 об,/об.), давая (4-ацетамино-2,6-диметилфенилсульфонил)нитрометан в виде твердого вещества, т. пл. 179-180оС (очищенный с помощью растирания с метанолом) с выходом 21% ЯМR (d6-ДМСО, 100 МГц): 2,08 (3Н, с.), 2,54 (6Н, с.), 6,42 (2Н, с), 7,51 (2Н, с.) 10,26 (1Н, с.).
Найдено, C 46,2; H 5,0; N 9,7.
C11H14N2O5S
Вычислено, C 46,15; H 4,9; N 9,8.
Исходная сульфиновая кислота может быть получена следующим образом.
N-Ацетил-3,5-диметиланилин (полученный в виде твердого вещества, 138оС, с помощью ацетилирования 3,5-диметиланилина) подвергается взаимодействию с избытком хлорсульфоновой кислоты при 60оС с использованием процедуры, аналогичной процедуре, описанной в Organic Syntheses Coll том 1, стр. 85, давая 4-ацетамидо-2,6-диметилбензолсульфонилхлорид в виде твердого вещества (анализ тонкослойной хроматографии (ТХС):Rf примерно 0,27 (SiO2.этилацетат: гексан 1: 1 об./об.) с выходом примерно 90% который используется без сушки или охарактеризования.
Указанный сульфонилхлорид (10,95 г, 50 ммоля) добавляется порциями к энергично перемешиваемому раствору бикарбоната натрия (8,4 г, 100 ммолей) и безводного сульфита натрия (12 г, 95 ммолей) в воде (50 мл) при 70-80оС. Температура поддерживается на уровне 70-80оС с помощью периодического (с перерывами) нагревания. Когда добавление завершается, смеси дают возможность охладиться до комнатной температуры в течение 4 ч и подкисляют ее 2 М соляной кислотой. Выпавшее в осадок твердое вещество собирается с помощью фильтрования, промывается водой, сушится на воздухе, давая 4-ацетамидо-2,6-диметилбензолсульфоновую кислоту в виде твердого вещества с выходом 56-87% ТХС: Rf приблизительно 0,02 (двуокись кремния; этилацетат). Данная кислота превращается в ее натриевую соль путем добавления к раствору метилата натрия (1 экв.) в метаноле и выпаривания получающегося в результате раствора. Натриевая соль используется без очистки и охарактеризования.
П р и м е р 3. (4-Ацетамидо-2,6-диметилфенилсульфонил)нитрометан (1,0 г) добавляется к 2 М раствору гидроокиси натрия (10 мл). Смесь перемешивается при 80оС в течение 1 ч, а затем выливается в смесь льда и воды (50 мл), содержащую уксусную кислоту (1,2 мл). Получающийся в результате белый осадок собирается с помощью фильтрования, промывается водой и сушится в вакууме (Р4О10), давая (4-амино-2,6-диметилфенилсульфонил)нитрометан в виде твердого вещества, т.пл. 132-133оС (после перекристаллизации из этанола) по существу с количественным выходом, в основном идентичный продукту, полученному в примере 1.
П р и м е р 4. Следующие ниже примеры иллюстрируют характерные представители фармацевтических дозировнных форм, содержщих соединение, или его нетоксичную соль, предназначенных для терапевтического или профилактического использовния на людях: (а) Таблетка I мг/таблетку Соединение 100 Лактоза Рh. Eur 182,75 Кроскармеллоза-натрий 12,0
Кукурузнокрахмальная паста (мас./об. паста) 2,25 Стеарат магния 3,0
(в) Таблетка II мг/таблетку Соединение 50 Лактоза Рh.Eur. 223,75 Кроскармеллоза-натрий 6,0 Кукурузный крахмал 15,0
Поливинилпирроли- дон (5 мас./об.паста) 2,25 Стеарат магния 3,0
(с) Таблетка III мг/таблетку Соединение 1,0 Лактоза Рh.Eur. 93,25 Кроскармеллоза-натрий 4,0
Кукурузнокрахмальная паста (5 мас./об.паста) 0,75 Стеарат магния 1,0
(d) Капсула мг/капсулу Соединение 10 Лактоза Рh.Eur. 488,5 Стеарат магния 1,5
Приведенные препаративные формы могут получаться с помощью обычных процедур, хорошо известных в фармацевтической области. Таблетки (а)-(с) могут быть удобным образом энтерическими с нанесенным на них покрытием из обычных средств, например, для получения покрытия из ацетатфталата целлюлозы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения (4-амино-2,6-диметилфенилсульфонил)нитрометана | 1990 |
|
SU1817776A3 |
| ПРОИЗВОДНЫЕ НИТРОМЕТАНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1991 |
|
RU2066680C1 |
| Способ получения производных нитрометана или их щелочных солей | 1988 |
|
SU1804456A3 |
| Способ получения производных нитрометана или их солей щелочных металлов | 1989 |
|
SU1773262A3 |
| ФЕНИЛАЦЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ (4-АМИНО-2,6-ДИМЕТИЛФЕНИЛСУЛЬФОНИЛ)НИТРОМЕТАНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА АЛЬДОЗОРЕДУКТАЗЫ, И КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВОМ ИНГИБИТОРА ФЕРМЕНТА АЛЬДОЗОРЕДУКТАЗЫ | 1991 |
|
RU2068409C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С РОСТОМ НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТИ | 1991 |
|
RU2054003C1 |
| ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2043024C1 |
| ПРОИЗВОДНЫЕ ПРОПЕНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2024496C1 |
| ПРОИЗВОДНЫЕ АРИЛОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2067976C1 |
| СОЛЬ ХИНОЛИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1991 |
|
RU2045527C1 |
Использование: в качестве ингибитора фермента альдозоредуктазы. Сущность изобретения: продукт 1-(4-амино-2,6-диметилфенилсульфонил)нитрометан ф-лы: NH2-Ph(CH3)2-S(O)O-CH2-NO2 . БФ C9H12N2O4S, выход 73% т.пл. 132 - 133°С; 2 - (4-ацетамидо-2,6-диметилфенилсульфонил)нитрометан ф-лы: CH3-C(O)-NH-Ph(CH3)2-S(O)O-CH2-NO2. БФ C11H14N2O5S, выход 21%, т.пл. 179 - 180°С; фармацевтическая композиция на основе соединения 1. Соединение 1 получают из соединения 2 гидролизом сильной кислотой, а соединений 2 получают известными методами. 3 с.п. ф-лы.
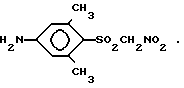
2. (4-Ацетамидо-2,6-диметилфенилсульфонил)нитрометан формулы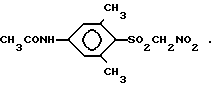
3. Фармацевтическая композиция, обладающая свойствами ингибитора фермента альдозоредуктазы, включающая активный ингредиент и целевые добавки, отличающаяся тем, что в качестве активного ингредиента используют (4-амино-2,6-диметилфенилсульфонил)нитрометан формулы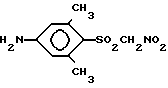
при следующем содержании ингредиентов, мас.
Активный ингредиент 1 35
Целевые добавки Остальное
| УСТРОЙСТВО для ПОШТУЧНОЙ ВЫДАЧИ из стопы | 0 |
|
SU304190A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-05-10—Публикация
1992-03-16—Подача