Данное изобретение относится к получению соединений формулы I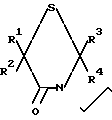

 где R1 и R2 каждый независимо представляет собой водород или низший алкил, или R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, образуют циклопентановое или циклогексановое кольцо; R3 и R4 каждый независимо представляет собой водород или низший алкил; R5представляет водород или низший алкил, Х представляет собой водород или галоген или их фармацевтически приемлемых кислотно-аддитивных солей и, когда это применимо, к их оптических, геометрических и стереоизомеров и рацемических смесей. Указанные соединения являются полезными в качестве антипсихотических агентов.
где R1 и R2 каждый независимо представляет собой водород или низший алкил, или R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, образуют циклопентановое или циклогексановое кольцо; R3 и R4 каждый независимо представляет собой водород или низший алкил; R5представляет водород или низший алкил, Х представляет собой водород или галоген или их фармацевтически приемлемых кислотно-аддитивных солей и, когда это применимо, к их оптических, геометрических и стереоизомеров и рацемических смесей. Указанные соединения являются полезными в качестве антипсихотических агентов.
Предпочтительными являются те из соединений 1, в которых R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, образуют пяти- или шестичленное циклоалкильное кольцо, Х представляет фтор и R5представляет водород.
На протяжении описания и прилагаемой формулы изобретения приведенная формула или название охватывают все геометрические, оптические и стереоизомеры соединений и рацемические смеси, когда существуют такие изомеры и смеси.
В приведенных выше определениях термин "низший" означает, что группа, которую он характеризует, содержит от 1 до 6 атомов углерода. Термин "алкил" относится к углеводороду с прямой или разветвленной цепью, не содержащему ненасыщение, например, к метилу, этилу, изопропилу, трет-бутилу, неопентилу, н-гексилу и др. термин "галоген" относится к представителю семейства галогенов, состоящего из фтора, хлора, брома и иода.
Способ согласно настоящему изобретению осуществляется следующим образом.
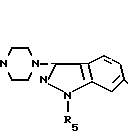
Соединение формулы II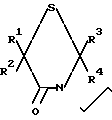
 вводится в реакцию с соединением формулы III
вводится в реакцию с соединением формулы III
H-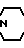 N
N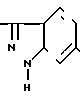
 давая соединение I изобретения формулы
давая соединение I изобретения формулы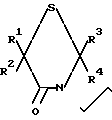

Указанная выше реакция обычно проводится в присутствии подходящей среды, такой как диметилформамид или ацетонитрил, акцептора кислоты, такого как карбонат калия или карбонат натрия, и каталитического количества иодистого калия или иодида натрия, при температуре около 25-120оС.
Для получения соединения I, в котором R5-низшиий алкил, соединение I, в котором R5 представляет водород, подвергается взаимодействию с NaН и метилиодидом или другим пордходящим алкилирующим агентом в подходящей среде, такой как диметилформамид или ацетонитрил, при температуре 60-85оС.
Соединение II обычно получается следующим образом.
Соединение формулы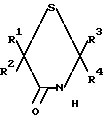 +Br-
+Br- подвергается реакции с 1,4-дибромбутаном, давая соединение II. Данная реакция обычно проводится в присутствии подходящей среды, такой как диметилформамид или тетрагидрофуран, и основания, такого как гидроокись калия, гидроокись натрия или гидрид натрия, при температуре около 23-70оС.
подвергается реакции с 1,4-дибромбутаном, давая соединение II. Данная реакция обычно проводится в присутствии подходящей среды, такой как диметилформамид или тетрагидрофуран, и основания, такого как гидроокись калия, гидроокись натрия или гидрид натрия, при температуре около 23-70оС.
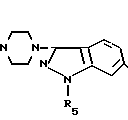
Соединение III получается, как описано в ЕР-А-0417653.
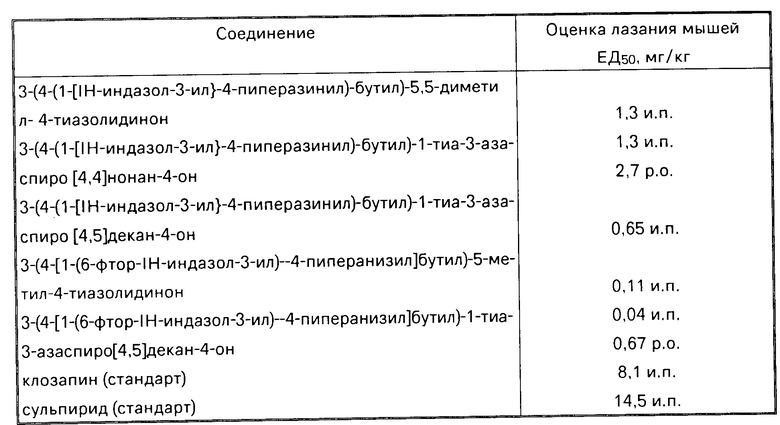
Соединения настоящего изобретения являются потенциально полезными в качестве антипсихотических агентов, как это определяется по методу лазания мышей (СМА).
Анализ лазания мышей (влезания на высоту) описывается авторами P.Protais и др. Psychpharmacol, 50, I (1976) и B. Costall, Eur. J. Pharmacol. 50, 39 (1978).
Самцы мышей СК-1 (весом 23-27 г) помещаются группой в стандартные лабораторные условия. Мышей помещают индивидуально в проволочные клетки (размером 4" x 4" х 10") и дают им 1 ч для адаптации и исследования новых условий окружающей среды. Подкожно вводится апоморфин в дозе 1,5 мг/кг, дозе, вызывающей лазание всех субъектов в течение 30 мин. Соединения, испытываемые на антипсихотическую активность, инъецируются интраперитонально (и.п.) за 30 мин до введения апоморфина при окрининговой дозе 10 мг/кг.
Для оценки реакции лазания снимаются 3 показания через 10, 20 и 30 мин после введения апоморфина по следующей шкале: Лазающее поведение Оценка мышей 4 перебирания лапами по дну (отсутствие лазания) 0 2 перебирания лапами по стене (изредка) 1 4 перебирания лапами по стене (полное лазание) 2
Мышей, стойко лазающих перед инъекцией апоморфина, отбрасывали.
При полностью выработанной реакции лазания животные висят на стенках клетки довольно неподвижно, на протяжении длительных периодов времени. В противоположность этому, лазание вследствие лишь стимуляции к движению обычно длится только несколько секунд.
Оценка эффекта лазания индивидуально суммируется (максимальная оценка 6 для одной мыши при 3 снятиях показаний), а общая оценка контрольной группы (носитель интраперитонально; апоморфин подкожно) устанавливается до 100% Значения ЕД50 с 95% пределами уверенности, вычисленные по анализам линейной регрессии некоторых из соединений данного изобретения, представлены в таблице.
Антипсихотическое действие достигается, когда соединения данного изобретения назначаются субъекту, нуждающемуся в лечении, в эффективной оральной, парэнтеральной или внутривенной дозе от 0,01 до 50 мг/кг веса тела в день. Особенно предпочтительной эффективной дозой является количество примерно 25 мг/кг веса тела в день. Следует понимать, однако, что для любого конкретного субъекта должен назначаться специфический режим дозировок в соответствии с индивидуальными потребностями и профессиональным подходом лица, назначающего или руководящего за назначением указанного выше соединения. Следует также понимать, что дозировки, представленные здесь, являются только примерными, и они на в коей мере не ограничивают объем изобретения.
Эффективные количества соединения настоящего изобретения могут назначаться субъекту с помощью любого из разнообразных методов, например, орально в виде капсул или таблеток, парэнтерально в форме стерильных растворов или суспензий, а в некоторых случаях внутривенно в форме стерильных растворов. Соединения настоящего изобретения, будучи эффективными сами по себе, могут формироваться и назначаться в виде фармацевтически приемлемых аддитивных солей с целью достижения стабильности, удобства или кристаллизации, повышенной растворимости и аналогичных.
Предпочтительные фармацевтически приемлемые аддитивные соли включают соли неорганических кислот, таких как соляная, бромистоводородная, серная, азотная, фосфорная и перхлорная кислоты; а также органических кислот, таких как винная, лимонная, уксусная, янтарная, малеиновая, фумаровая и щавелевая кислоты.
Активные соединения настоящего изобретения могут назначаться орально, например, с инертным разбавителем или с другим съедобным носителем. Они могут заключаться в желатиновые капсулы или прессоваться в таблетки. Для цели орального терапевтического назначения соединения могут вводиться с эксципиентами и использоваться в форме таблеток, пилюль или лепешек, капсул, эликсиров, суспензий, сиропов, вафель, жевательных резинок, и аналогичных. Препараты должны содержать по крайней мере 0,5% активного соединения, но количество можно варьировать в зависимости от конкретной формы и могут составлять удобным образом между 4 и примерно 75% по весу конкретной формы дозированной единицы. Количество соединения, присутствующего в таких композициях, является таким, чтобы получилась подходящая доза. Предпочтительные композиции и препараты согласно настоящему изобретению приготавливаются так, чтобы оральная форма дозированной единицы содержала между 1,0-300 мг активного соединения.
Таблетки, пилюли, капсулы, лепешки и аналогичные формы могут также содержать следующие ингредиенты: связующее, такое как микрокристаллическая целлюлоза, камедь трагаканта, или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, Примогель®, кукурузный крахмал и аналогичные; смазочный агент, такой как стеарат магния или Стеротекс®; скользящий агент (или способствующий плавному прохождению), такой как коллоидная двуокись кремнения; и подслащивающий агент, такой как сахароза или сахарин, или вкусовой или ароматизирующий агент, такой как мята перечная, метилсалицилат, или может добавляться апельсиновая ароматизирующая добавка. Когда формой дозированной единицы является капсула, она может содержать в дополнение к веществам указанного выше типа, жидкий носитель, такой как жирное масло. Другие формы дозированных единиц могут содержать другие разнообразные материалы, которые модифицируют физическую форму дозированной единицы, например, такие как покрытия. Таким образом, таблетки или пилюли могут покрываться сахаром, шеллаком, или другими энтерическими покрывающими агентами. Сироп может содержать в дополнение к активным соединениям сахарозу в качестве подслащивающего агента, и некоторые предохраняющие добавки, красители и окрашивающие и ароматизирующие вещества. Материалы, используемые при приготовлении этих различных композиций, должны быть фармацевтически чистыми и нетоксичными в используемых количествах.
Для целей парэнтерального фармацевтического назначения активные соединения изобретения могут вводиться в растворы или суспензии. Эти препараты должны содержать не менее 0,1% указанного выше соединения, но количество можно варьировать между 0,5 и примерно 30% от веса препарата. Количество активного соединения в таких композициях является таким, чтобы получалась подходящая доза. Предпочтительные композиции и препараты согласно настоящему изобретению приготавливаются так, чтобы парэнтеральная дозировочная единица содержала между 0,5 и 100 мг активного соединения.
Растворы и суспензии могут также включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, фиксированные масла, полиэтиленгликоли, глицерин, пропиренгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты и агенты для установления тонуса, такие как хлористый натрий или декстроза. Парэнтеральный препарат может заключаться в ампулы, одноразовые шприцы или сосуды с множественными дозами, сделанные из стекла или пластика.
Примеры соединений данного изобретения включают:
3-(4-(1-[6-фтор-1Н-индазол-3-ил] -4-пиперазинил)бутил)-2,5,5-триме- тил-4-тиазолидинон; 3-(4-(1-[6-фтор-1Н-индазол-3-ил]-4-пиперазинил)бутил)-2,2,5,5- етраметил-4-тиазолидинон;
3-(4-(1-[6-фтор-1Н-индазол-3-ил] -4-пи-перазинил)бутил-2-метил-1- тиа-3-азаспиро(4.4)нонан-4-он;
3-(4-(1Н-индазол-3-ил)-4-пиперазинил)бутил)-2-метил-1-тиа-3- аза-спиро[4.5]декан-4-он;
3-(4-(1-[6-фтор-1н-индазол-3-ил] -4-пи- перазинил)бутил)-2-метил- 1-тиа-3-азаспиро[4.5]декан-4-он;
3-(4-(1[6-фтор-1Н-индазол-3-ил] -4-пипе- разинил)бутил)-2,2-диметил- 1-тиа-3-азаспиро[4.5]декан-4-он;
3-(4-[1-ацетил-1Н-индазол-3-ил] -4-пипе- разинил)бутил)-5-метил-4- тиазолидинон;
3-(4-[1-(1-ацетил-6-фтор-1Н-индазол-3-ил)-4-пиперазинил] бутил)-1- тиа-3-азаспиро[4.5]декан-4-он;
3-(4-(1-[1-ацетил-6-фтор-1Н-индазол-3-ил] -4-пиперазинил)бутил)-5- метил-4-тиазолидинон;
3-(4-(1-[1-бензоил-6-фтор-1Н-индазол-3-ил] -4-пиперазинил)бутил)- 5-метил-4-тиазолидинон;
3-(4-(1-[1-бензоил-6-фтор-1Н-индазол-3-ил] -4-пиперазинил)бутил)- 1-тиа-3-азаспиро[4.5]декан-4-он.
Следующие примеры даются только для целей иллюстрации и они не должны рассматриваться как ограничивающие данное изобретение. Все температуры даны в градусах Цельсия (оС).
П р и м е р 1. а. 3-(4-бромбутил)-4-тиазолидинон. Смесь 4-оксотиазолидина (25 г), диметилформамида (500 мл) и КОН (27,16 г) перемешивалась в атмосфере азота при комнатной температуре в течение 1,5 часа. К получающейся в результате смеси добавлялся 1,4-дибромбутан (101 мл), и перемешивание продолжалось при комнантной температуре в течение 44 часов. Реакционная смесь выливалась в воду (1000 мл), и водная смесь экстрагировалась три раза 300 мл порциями этилацетата. Объединенные экстракты промывались водой (300 мл) и солевым раствором (300 мл), сушились над сульфатом натрия и концентрировались в вакууме до масла. MPLC аликвоты в 44,95 г давала 7,15 г масла, которое после перегонки давало светлую жидкость, темп. кип. 134-137оС/0,12 мм рт.ст.
Анализ: для С7Н12BrNOS: Вычислено: С35,30 Н 5,08 N 5,88%
Найдено: С 35,24% Н 5,09% N 5,83%
b. 3-(4-бромбутил)-5-метил-4-тиазолидинон. К -74оС раствору 3-(4-бромбутил)-4-тиазолидинона (5,20 г) и тетрагидрофурана (70 мл) в атмосфере азота быстро добавлялся бис(триметилсисли)амид лития (0,023 моль) в тетрагидрофуране (23 мл) с последующим немедленным добавлением метилиодида (7,74 г). Получающийся раствора перемешивался в течение 20 минут (охлаждался с помощью СО2/изопропанольной бани), оставлялся подогреваться до -40оС и подкислялся 1 норм. HCl (200 мл). Получающаяся водная смесь экстрагировалась три раза 100 мл порциями 25% бензол/эфир. Объединенные экстракты промывались солевым раствором (200 мл), сушились сульфатом натрия и концентрировались в вакууме давая жидкость, которая хроматографировалась на силикагеле, элюирование 45% этилацетатом в гексанах, давая 3,84 г масла. Масло перегонялось, давая 2,60 г 3-(4-бромбутил)-5-метил-4-тиазолидинон темп.кип. 123-125оС при 0,20 мм рт. ст.
Анализ: для C8H14 BrNOS: вычислено: С 38,10% Н 5,60 N 5,55%
найдено: С 38,12% Н 5,58% N 5,48%
П р и м е р 2. а. 3-(4-бромбутил)-2,5,5,-триметил-4-тиазолидинон.
К -73оС раствору 3-(4-бромбутил)-5-метил-4-тиазолидинона (6,00 г), иодистого метила (10,99 г) и тетрагидрофурана (50 мл) в атмосфере азота добавлялся бис(триметилсилил)амид лития (0,0500 моль) в тетрагидрофуране (50 мл) со скоростью, обеспечивающей поддержание внутренней температуры менее, чем -55оС. Получающийся раствор перемешивался при температуре менее -55оС в течение 10 мин, оставлялся подогреваться до -40оС, и при этой температуре добавлялся 1 норм. HCl (250 мл). Водная смесь экстрагировалась три раза 125 мл порциями 25% бензол/эфира. Объединенные экстракты промывались солевым раствором (200 мл), сушились (сульфатом натрия), и концентрировались до жидкости, которая хроматографировалась на силикагеле (345 г) при элюировании 35-65% градиентом этилацетата в гексанах, давая 5,07 г жидкости. Данная жидкость перегонялась, давая 3,80 г 3-(4-бромбутил)-2,5,5-триметил-4-тиазолидинона, темп.кип. 109-114оС при 0,20 мм рт.ст.
Анализ: для С10Н18 BrNOS: Вычислено: С 42,86% Н 6,47% N 5,00%
Найдено: С 42,93% Н 6,47% N 5,00%
b. 3-(4-(1-(1Н-индазол-3-ил)пиперазинил(бутил)-2,5,5-триметил- 4-тиазолидинон. Смесь 3-(4-бромбутил)-2,5,5,-триметил-4-тиазолидинона (4,00 г), 1-(1Н-индазол-3-ил)пиперазина (3,18 г), карбоната калия (6,00 г), иодистого натрия (300 г) и ацетонитрила (200 мл) нагревалась при 75оС в атмосфере азота. Спустя 17 часов анализ ТСХ показал отсутствие исходного бромида. Смесь охлаждалась до температуры окружающей среды, фильтровалась, неорганические вещества промывались дихлорметаном, и фильтрат концентрировался при пониженном давлении до жидкости. Неочищенный остаток брался в дихлорметан (220 мл), промывался водой (130 мл), солевым раствором (130 мл), сушился (сульфатом натрия) и концентрировался до жидкости. Жидкость очищалась с помощью хроматографии на силикагеле. Элюирование 5% метанолом в дихлорметане давало 4,22 г твердого вещества. Перекристаллизация из смеси эфир/гексаны давала 2,22 г 3-[4-[1-(1Н-индазол-3-ил)пиперазинил] бутил]-2,5,5,-тримет- ил-4-тиазолидинона, темп. пл. 111-112оС.
Анализ: для С21Н31 N5OS: Вычислено: C 62,81% Н 7,78% 17,44%
Найдено: С 62,88% Н 7,66% 17,47%
П р и м е р 3. а. 3-(4-бромбутил)-1-тиа-3-азаспиро[4.5]декан-4-он. К раствору 3-4(4-бромбутил)-4-тиазолидинона (25 г) в тетрагидрофуране (350 мл), охлажденному до -60оС, добавлялся 1,5-дииодпентан (100 г). Получающаяся суспензия оставлялась охлаждаться до -65оС, и по каплям на протяжении периода 30 мин при поддержании внутренней температуры равной или ниже -55оС добавлялся раствор бис(триметилсилил)амида лития (36,8 г) в гексанах (220 мл). Получающаяся смесь перемешивалась в течение 15 мин, и внутренней температуре давали возможность подниматься до 0оС. Добавлялась 0,5 норм. HCl (500 мл) для погашения реакции, и смесь концентрировалась в вакууме для удаления ТГФ. Водная смесь экстрагировалась дважды 250 мл порциями эфира, промывалась водой (400 мл) и солевым раствором (400 мл), сушилась (сульфатом натрия) и концентрировалась до жидкости. Жидкость хроматографировалась на силикагеле (элюирование 20% ацетат/гексаном), давая жидкость.
b. 3-(4-(1-[1H-индазол-3-ил]-4-пиперазинил)бутил)-1-тиа--азаспиро[4.5] декан-4-о н. Смесь 3-(4-бромбутил)-1-тиа-3-аза- спиро[4.5]декан-4-она (4,06 г), 3-(1-пиперазинил)-1Н-индазола (2,95 г), карбоната калия (5,50 г) и ацетонитрила (250 мл) нагревалась при 80оС в атмосфере азота. Через 20 ч анализ ТСХ (силикагель, 50% эфир/гексаны) показал только следы исходного бромида. Смесь охлаждалась до температуры окружающей среды, добавлялся этилацетат (150 мл), неорганические вещества отфильтровывались, и фильтрат концентрировался при пониженном давлении. Остаток брался в дихлорметан (220 мл), промывался водой (110 мл), солевым раствором (130 мл), сушился (сульфатом натрия) и концентрировался до пены. Пена хроматографировалась на силикагеле при элюировании 10% метанолом в дихлорметане, давая 4,83 г пены, которая затвердевала при добавлении этилацетата. Твердое вещество перекристаллизовывалось из смеси этилацетат/гексаны, давая 2,76 г 3-(4-(1-[1Н-индазол-3-ил] -4-пиперазинил)бутил)-1-тиа-3-азаспиро[4.5] декан-4- она, темп. плав. 159-161оС.
Анализ для С23Н33 N5OS Вычислено: C 64,60% Н 7,78% N 16,38%
Найдено: С 64,50% Н 7,86% N 16,49%
П р и м е р 4. 3-(4-(4-(1-[1H-индазол-3-ил]пиперазинил))-бутил)-5-метил-тиазолидинон. Смесь 3-(4-бромбутил)-5-метил-4-тиазолидинона (3,9 г), 3-(1-пиперазинил)-1Н-индазола (3,0 г), карбоната калия (4,1 г) и иодистого натрия (200 мг) в 150 мл сухого ацетонитрила нагревалась до 80оС при перемешивании в атмосфере азота. Спустя 18 ч не оставалось никакого исходного пиперазина, о чем можно было судить по данным ТСХ. Смесь охлаждалась до комнатной температуры и фильтровалась, и фильтрат концентрировался в вакууме. Остаток хроматографировался на двуокиси кремния с использованием 5:95 смеси метанол:этилацетат в качестве элюента, давая твердое вещество. Данный продукт перекристаллизовывался из смеси эфир/гексан, давая 2,593 г 2-(4-(4-(1-[1Н-индазол-3-ил] пиперазинил))-бутил)-5-метил-тиазолидинона, темп. пл. 105-108оС.
Анализ для C19H27N5OS: Вычислено: С 61,10% Н 7,29% N 18,75%
Найдено: С 61,13% Н 7,21% N 18,67%
П р и м е р 5. а. 3-(4-бромбутил)-1-тиа-3-азаспиро[4.4]нонан-4-он. К -76оС раствору 3-(4-бромбутил)-4-тиазолидинона (4,75 г) и тетрагидрофурана (120 мл) в атмосфере азота добавлялся бис(триметилсилил)амид лития (0,0203 моль) в тетрагидрофуране (20,3 мл) быстро, с последующим немедленным добавлением 1,4-дииодбутана (15,51 г). Спустя 12 мин добавлялся раствор бис(триметилсилил)амид лития (0,0620 моля) в тетрагидрофуране (62 мл) на протяжении периода 30 мин. Получающаяся реакционная смесь оставлялась подогреваться до -45оС, и при этой температуре добавлялась 1 норм. НС (250 мл). Получаящаяся водная смесь экстрагировалась 4 раза 110 мл порциями эфира. Объединенные экстракты промывались солевым раствором (250 мл), сушились (сульфатом натрия), и концентрировались до жидкости. Жидкость хроматографировалась на силикагеле (элюирование 40% этилацетатом в гексанах), давая 3,34 г жидкости. Данная жидкость перегонялась с использованием перегонного аппарата с коротким змеевиком при 0,20 мм рт.ст. давая 2,35 г 3-(4-бромбутил)-1-тиа-азаспиро[4.4]нонан-4-она.
Анализ для С11Н18NOS: Вычислено: С 45,21% Н 6,21% N 4,79%
Найдено: С 45,33% Н 6,19% N 4,81%
b. 3-(4-(1-[1H-индазол-3-ил]-4-пиперазинил)бутил)-1-тиа-3-азаспиро[4.4] нонан-4- он. Смесь 3-(4-бромбутил)-1-тиа-3-аза- спиро[4.4]нонан-4-она (4,00 г) 3-(1-пиперазинил)-1Н-индазола (3,05 г), карбоната калия (6,63 г), иодистого натрия (320 мг) и ацетонитрила (210 мл) нагревалась при 85оС в атмосфере азота. Спустя 4 ч анализ ТСХ (силикагель, 40% этилацетат в гексанах) показал, что исходный бромид полностью потреблялся. Смесь охлаждалась до температуры окружающей среды, добавлялся этилацетат (100 мл), неорганические вещества отфильтровывались, и фильтрат концентрировался при пониженном давлении. Остаток брался в дихлорметан (210 мл), промывался водой (100 мл), солевым раствором (100 мл), сушился (сульфатом натрия) и концентрировался при пониженном давлении до жидкости. Жидкость очищалась с помощью хроматографии на силикагеле с элюированием 5% этанолом в дихлорметане, давая 4,75 г пены, которая затвердевала после добавления эфира. Твердое вещество перекристаллизовывалось из этилацетата, давая 3,51 г 3-(4-(1-[1Н-индазол-3-ил]-4-пиперазинил)бутил)-1-тиа-3-азаспиро[4.4] но- нан-4-она, темп. пл. 166,5-168оС.
Анализ для С22Н31N5OS: Вычислено: С 63,89% Н 7,56% N 16,93%
Найдено: С 63,62% Н 7,61% N 16,73%
П р и м е р 6. 3-(4-(1-[1Н-индазол-3-ил]-4-пиперазинил)бутил-2-метил-1-тиа-3- азаспиро[4.4]нонан-4-он. Смесь 3-(4-бромбу- тил)-2-метил-1-тиа-3-азаспиро[4.4] нонан-4-она (4,20 г), 2-(1-пиперазинил)-1Н-индазола (3,0 г), карбоната калия (5,68 г), а (310 мг), и ацетонитрила (220 мл) нагревалась при температуре между 60 и 80оС в атмосфере азота. Спустя 18 ч анализ ТСХ показал только следы исходного бромида. Смеась охлаждалась до температуры окружающей среды, добавлялся этилацетат (150 мл), неорганические вещества отфильтровывались, и фильтрат концентрировался при пониженном давлении. Остаток брался в дихлорметан (230 мл), промывался водой (130 мл), солевым раствором (130 мл), сушился сульфатом натрия, и концентрировался до пены. Пена хроматографировалась на силикагеле при элюировании 8% метанолом в дихлорметане, давая 5,04 г пены, которая затвердевала после добавления смеси эфир/гексаны. Твердое вещество перекристаллизовывалось из смеси этилацетат/гексаны, давая 3,72 г 3-(4-(1-[1Н-инда- зол-3-ил]-4-пиперазинил)бутил)-2-метил-1-тиа-3-азаcпиро[4.4]нонан-4-она, темп. пл. 113-115оС.
Анализ для С23Н33N5OS: Вычислено: С 64,60% Н 7,78% N 16,38%
Найдено: С 64,71% Н 8,08% N 16,52%
П р и м е р 7. а. 6-фтор-3-(1-пиперазинил)-1Н-индазол-хлоргидрат. К перемешиваемой смеси в атмосфере азота 4-(6-фтор-1-фенилсульфонил-1Н-индазол-3- ил)-1-пиперазинкарбонитрила (25,4 г) в тетрагидрофуране (400 мл) добавлялся по каплям алюмогидрид лития в тетрагидрофуране (130 мл 1 М раствора). Реакционная смесь перемешивалась и нагревалась с обратным холодильником в течение 3 ч, охлаждалась на ледяной бане, и по каплям добавлялась вода. Реакционная смесь фильтровалась, и осадок на фильтре промывался тетрагидрофураном и два раза метанолом. Концентрирование фильтрата давало смолу, которая при растирании с эфиром давала 14,6 г твердого вещества. Твердое вещество растворялось в метаноле, и добавлялся эфирный HCl к раствору до тех пор, пока он не становился кислым. Затем эфир добавлялся к раствору, который сначала давал смолу. Плавающий сверху раствор декантировался со смолы, и после добавления к раствору еще эфира собиралось 5,4 г хлоргидратной соли. Растирание смолы при дефлегмировании этилацетата давало дополнительно 3,2 г соли. Более обильный образец перекристаллизовывался два раза из смеси метанол/эфир, давая 2,2 г 6-фтор-3-(1-пиперазинил)-1Н-индазол-хлоргидрата, темп. пл. 268-270оС.
Анализ для С11Н13FN4 HCl: Вычислено: С 51,47% Н 5,50% N 21,82%
Найдено: С 51,38% Н 5,37% N 21,61%
b. 3-{4-(1-(6-фтор-1Н-индазол-3-ил)-4-пиперазинил)бутил}-1- тиа-3-азаспиро[4.5]декан-4-он. Смесь 6-фтор-3-(1-пи- перазинил)-1Н- индазол-хлоргидрата (4,0 г) карбоната калия (6,5 г), 3-(4-бромбутил)-1-тиа-3-азаспиро[4.5]декан-4-она (5,2 г), иодистого калия (200 мг) и диметилформамида (100 мл) перемешивалась при 75оС в атмосфере азота в течение 17 ч. Охлажденная реакционная смесь выливалась в воде, и водная смесь экстрагировалась этилацетатом. Этилацетатный экстракт промывался водой, сушился сульфатом магния и концентрировался давая 10,3 г твердого вещества. Образец очищался с помощью препаративной жидкостной хроматографии высокой разрешающей способности (HPLC) (силикагель, 6% мектанол-дихлорметан в качестве элюента), давая 4,1 г. Перекристаллизация соединения из изопропилового спирта давала 3,1 г 3-{4-[1-(6-фтор-1Н-индазол-3-ил)-4-пиперазинил] бутил} -1-тиа-3-азаспиро[4.5] д е- кан-4-она, темп. пл. 163-165оС.
Анализ для С23Н32FN5OS: Вычислено: С 62,00% Н 7,24% N 15,72%
Найдено: С 61,81% Н 7,15% N 15,62%
П р и м е р 8. 3-{4-[1-(6-фтор-1Н-индазол-3-ил)-4-пиперазинил] бутил}-1-тиа-3-азаспиро[4.4] нонан-4-он. Смесь хлор- гидрата 6-фтор-3-(1-пиперазинил)-1Н-индазола (4,0 г), карбоната калия (6,5 г), 3-(4-бромбутил)-1-тиа-3-азаспиро[4.4] нонан-4-она (5,0 г), диметилформамида (100 мл) и иодистого калия (200 мг) перемешивалась в течение 16 ч при 65оС в атмосфере азота. Охлажденная реакционная смесь затем выливалась в воду, и водная смесь экстрагировалась этилацетатом. Этилацетатный экстракт сушился сульфатом магния и концентрировался, давая 6,8 г твердого вещества. Образец очищался с помощью препаративной HPLC (силикагель, 6% метанол/дихлорметан), давая 3,0 г. Перекристаллизация из изопропилового спирта давала 2,1 г 3-{4-[1-(6-фтор-1Н-индазол-ил)-4-пиперазинил] бутил} -1-тиа-3-азаспиро[4.4] нонан-4-она, темп. пл. 132-134оС.
Анализ для С22Н30FN5OS: Вычислено: С 61,23% Н 7,01% N 16,23%
Найдено: С 61,37% Н 6,93% N 16,21%
П р и м е р 9. 3-{4-[1-(6-фтор-1Н-индазол-3-ил)пиперазинил] бутил}-5-метил-4-тиазолидинон. Смесь 6-фтор-3-(1-пиперази- нил)-1Н-индазол-гидрохлорида (4,0 г), карбоната калия (6,5 г), 3-(4-бромбутил)-5-метил-4-тиазолидинона (4,3 г), иодистого калия (200 мг) и диметилформамида (100 мл) перемешивалась при 80оС в атмосфере азота в течение 7,5 ч, а затем оставлялась стоять в течение 16 ч при комнатной температуре. Реакционная смесь выливалась в воду, и водная смесь экстрагировалась этилацетатом. Этилацетатный экстракт сушился сульфатом магния и концентрировался, давая 8,0 г жидкости. Образец очищался с помощью препаративной HPLC (силикагель, 6% метано-дихлорметан), давая 3,6 г. Перекристаллизация из изопропилового спирта давала 2,2 г 3-{4-[1-6-фтор-1Н-индазол-3-ил)-пиперазинил]бутил}-5-метил-4- тиазолидинона, темп. пл. 119-120оС.
Анализ для С19Н26FN5OS: Вычислено: С 58,29% Н 6,69% N 17,89%
Найдено: С 58,24% Н 6,74% N 17,80%
П р и м е р 10. 3-{4-[1-(6-фтор-1Н-индазол-3-ил)-4-пиперазинил]бутил}-5,5-димет-ил-4- тиазолидинон. К перемешиваемой смеси 6-фтор-3-(1-пиперазинил)-1Н-индазола (4,4 г), карбоната калия (2,8 г), 3-(4-бромбутил)-5,5-диметил-4-тиазолидинона (6,6 г) и диметилформамида (75 мл) нагревалась при 75оС в течение 4 ч. Реакционная смесь выливалась в воду, и водная смесь экстрагировалась этилацетатом. Этилацетатный экстракт промывался (водой), сушился (сульфатом магния), и растворитель концентрировался, давая масло. После стояния масло кристаллизовалось, и, когда масса растиралась с эфиром, собиралось 3,3 г твердого вещества. Соединение перекристаллизовывалось из смеси толуол-гексан, давая 2,8 г 3-{4-[1-(6-фтор-1Н-индазол-3-ил)-4-пиперазинил/бутил-5,5-диметил-4- тиазолидонина, темп. пл. 123-125оС.
Анализ для С20Н28FN5OS: Вычислено: С 59,24% Н 6,96% N 17,27%
Найдено: С 59,37% Н 6,99% N 17,32%
П р и м е р 11. а. 3-(1-пиперазинил)-1Н-индазол. Смесь 4-(1Н-индазол-3-ил)-1-пиперазинкарбонитрила (8,0 г), и 25% серной кислоты (100 мл) перемешивалась при температуре дефлегмации в течение 4,5 ч. Реакционная смесь охлаждалась на ледяной бане и подщелачивалась добавлением по каплям 50% гидроокиси натрия. Основной раствор экстрагировался этилацетатом. Этилацетатный экстракт промывался водой, сушился сульфатом магния и концентрировался, давая 5,2 г требуемого соединения в виде твердого вещества. Образец перекристаллизовывался два раза из толуола, давая 3,0 г незамещенного индазола, темп. пл. 153-155оС.
Анализ для С11Н14N4: Вычислено: С 65,62% Н 6,98% N 27,70%
Найдено: С 65,21% Н 6,99% N 27,80%
b. 3-(4-(1-[1H-индазол-3-ил]-4-пиперазинил)бутил)-5,5-диметил- 4-тиазолидинон. Перемешиваемая смесь 3-(1-пиперазинил)-1Н-индазола (5,0 г), 3-(4-бромбутил)-5,5-диметил-4-тиазолидинона (6,6 г) и диметилформамида (120 мл) нагревалась при 70-75оС в течение 1,25 ч. Реакционная смесь выливалась в воду, сушилась (сульфатом магния), и растворитель концентрировался, давая твердое вещество. Твердое вещество растворилось с гексаном и собиралось, давая 7,2 г твердого вещества. Перекристаллизация из толуола давала 5,7 г 3-(4-(1-[1Н-индазол-3-ил]-4-пиперазинил)бу- тил-5,5-диметил-4-тиазолидинона, темп. пл. 139-142оС.
Анализ для С20Н29N5OS: Вычислено: С 61,98% Н 7,54% N 18,07%
Найдено: С 62,12% Н 7,51% N 17,85%
П р и м е р 12. 3-{4-[1-Метил-1Н-индазол-3-ил)-4-пиперазинил]-бутил}-5,5-диме-тил- 4-тиазолидин.
К перемешиваемой смеси гидрида натрия (0,66 г), в диметилформамиде (20 мл) в атмосфере азота добавлялся 3-{4-[1-(1Н-индазол-3-ил)-4-пиперазинил] бутил} -5,5-диме- тил-4-тиазолидин (4,4 г), растворенный в горячем диметилформамиде (30 мл). Смесь оставлялась перемешиваться при температуре окружающей среды в течение 1 ч, а затем она охлаждалась до -1оС на соле-ледяной бане. Добавлялся по каплям иодметан (1,78 г), растворенный в диметилформамиде (10 мл), так, чтобы температура не превышала 1оС. После полного добавления ледяная баня удалялась, и реакционная смесь оставлялась перемешиваться в атмосфере азота при температуре окружающей среды в течение 3,5 часа. Реакционная смесь выливалась в воду, сушилась сульфатом магния и концентрировалась, давая 5,0 г жидкости. Жидкость растиралась с гексаном, давая твердое вещество, которое собиралось и сушилось, давая 2,5 г. Соединение перекристаллизовывалось из гексана, давая 2,0 г 3-{4-[1-(1-метил-1Н-индазол-3-ил)-4-пиперазинил]бутил}-5,5- диметил-4-тиазолидин, темп. пл. 91-93оС.
Анализ для С21Н31N5OS: Вычислено: С 62,81% Н 7,78% N 17,44%
Найдено: С 62,97% Н 7,80% N 17,42%
Использование: в медицине в качестве антипсихотического агента. Сущность изобретения: продукт-3-(1-тиазолидинилбутил-4-пиперазинил) 1 Н-индазолы общей ф-лы 1, указанной в описании, где R1 и R2 независимо друг от друга водород, низший алкил или R1 и R2 вместе с углеродом, к которому они присоединены, образуют циклопентановое или циклогексановое кольцо, R3 и R4 независимо друг от друга водород или низший алкил, R5 водород или низший алкил, X-водород или галоген, или их фармацевтически приемлемые кислотно-аддитивные соли. Реагент 1: производное 4-тиазолидинона ф-лы 2, где R1, R2, R3 и R4 указано выше. Реагент 2: 3-(1-пиперазинил)-1Н-индазол ф-лы 3, где X - указано выше. Условия реакции: в среде органического растворителя, нагревание в атмосфере инертного газа. В случае получения соединений, R5 - низший алкил, соединение ф-лы 1, где R3 - водород алкилируют. 1 табл.
СПОСОБ ПОЛУЧЕНИЯ 3-(1-ТИАЗОЛИДИНИЛБУТИЛ-4-ПИПЕРАЗИНИЛ)-1Н-ИНДАЗОЛОВ общей формулы I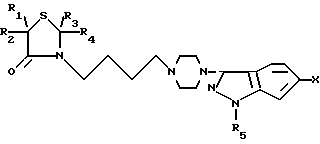
где R1 и R2 каждый независимо друг от друга водород или низший алкил или R1 и R2 взятые вместе с атомом углерода, к которому они присоединены, образуют циклопентановое или циклогексановое кольцо;
R3 и R4 каждый независимо друг от друга водород или низший алкил;
R5 водород или низший алкил;
Х водород или галоген,
или их фармацевтически приемлемых кислотно-аддитивных солей, отличающийся тем, что производное 4-тиазолидинона общей формулы II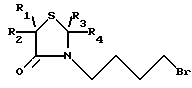
где R1, R2, R3 и R4 имеют указанные значения,
подвергают взаимодействию с 3-(1-пиперазинил)-1Н-индазолом общей формулы III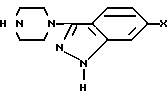
где Х имеет указанные значения,
с последующим выделением соединения общей формулы I, где R5 - водород и R1, R2, R3, R4 и Х имеют указанные значения, в виде свободного основания или в виде фармацевтически приемлемой кислотно-аддитивной соли и полученное при этом соединение при необходимости подвергают взаимодействию с алкилирующим агентом с последующим выделением соединения общей формулы I, где R5 алкил и R1, R2, R3, R4 и Х имеют указанные значения, в виде свободного основания или в виде фармацевтически приемлемой кислотно-аддитивной соли.
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1987, т.1, с.67-68. |
Авторы
Даты
1995-06-27—Публикация
1991-05-20—Подача