Изобретение относится к азотным гетероциклическим соединениям, наделенных высоким противогрибковым действием, способам их получения и их применению в сельском хозяйстве в качестве фунгицидов.
Таким образом, целью изобретения являются соединения общей формулы
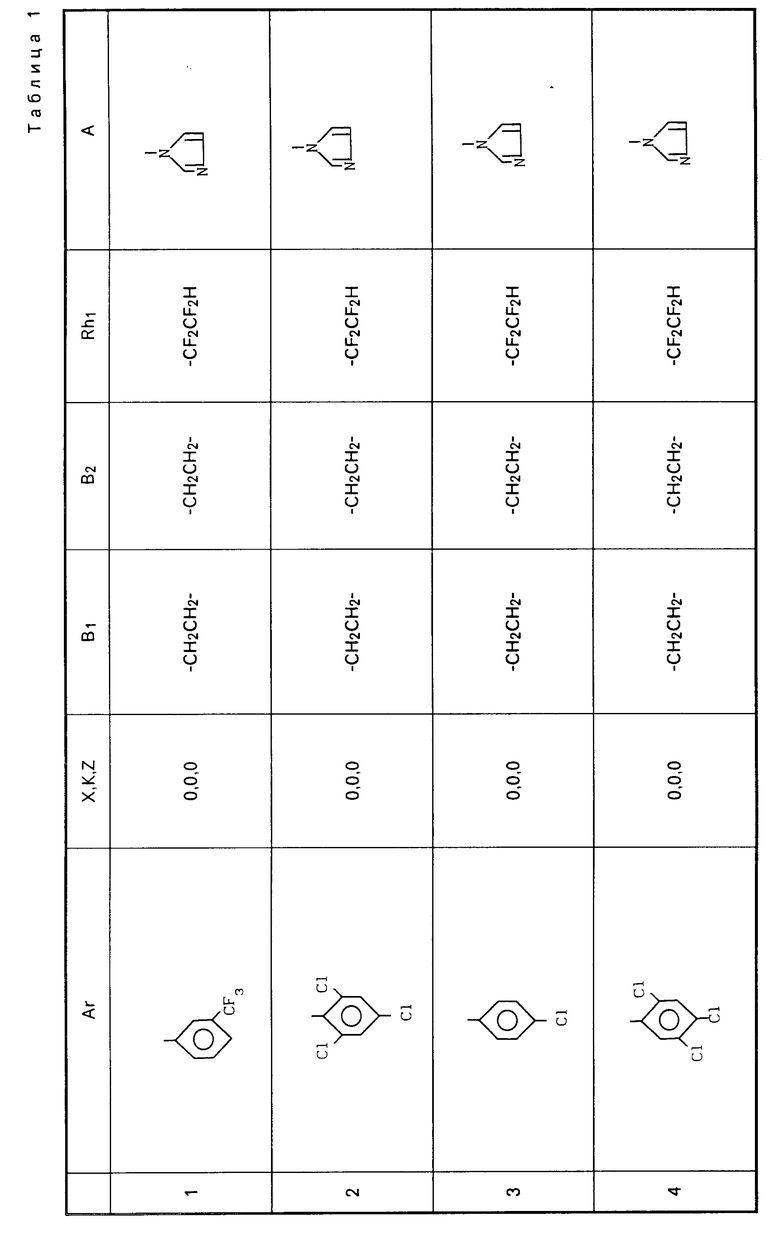
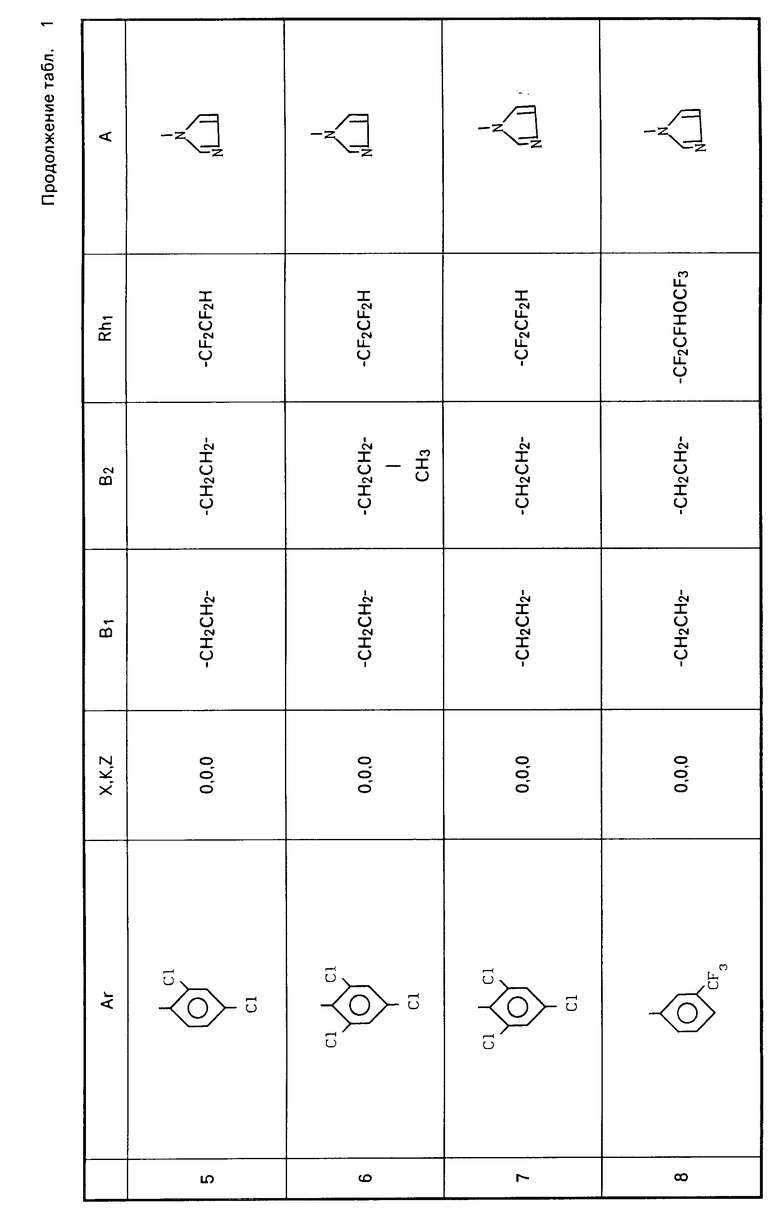
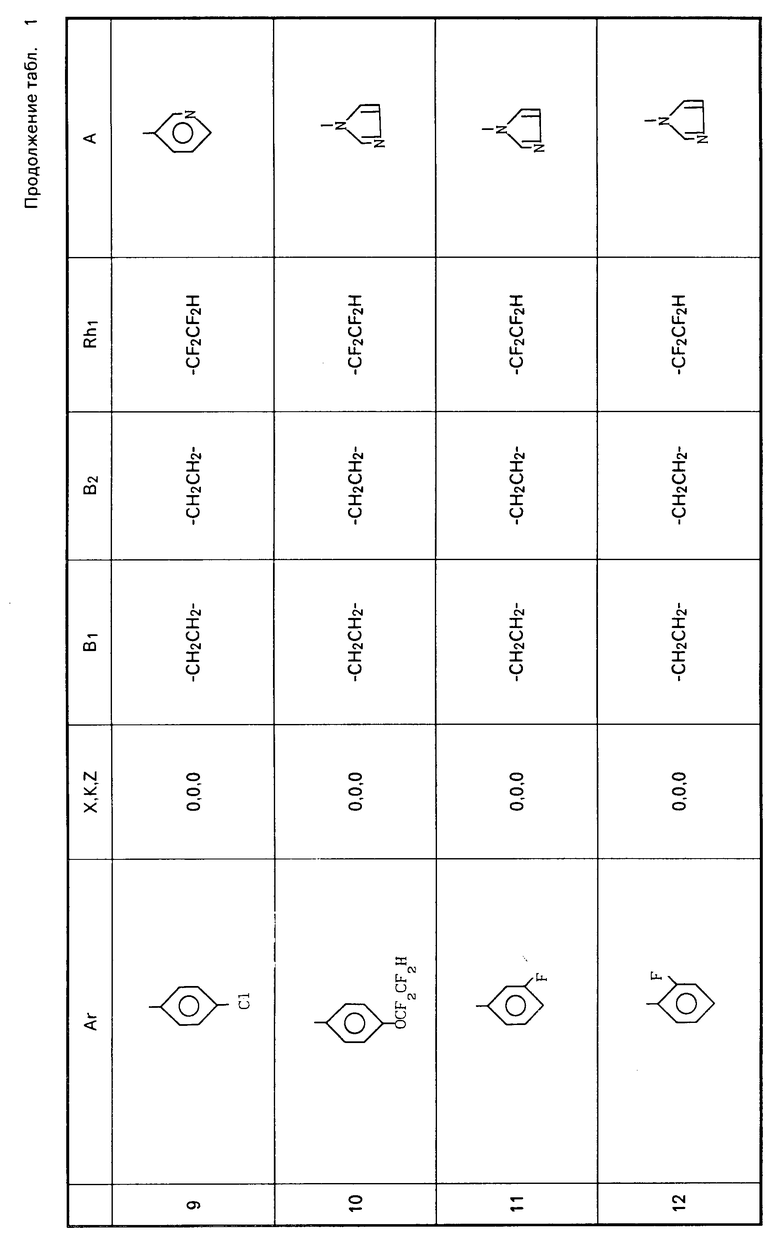
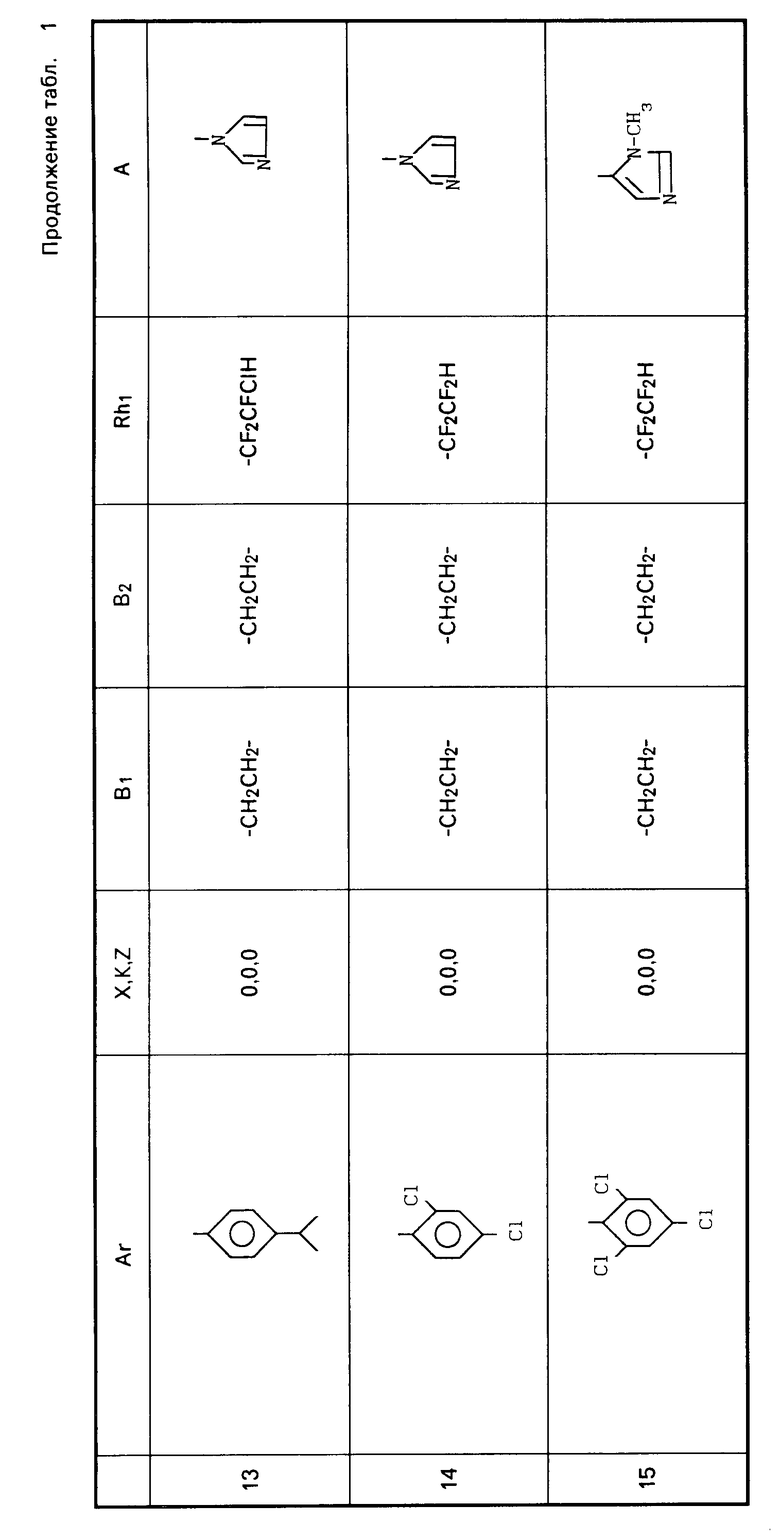
Ar-X-B1-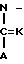 B2-Z-Rh1 где Ar представляет фенил; фенил, замещенный одним или несколькими галоидами, С1-С3-алкилами, С1-С3-галоидалкилами, С2-С4-алкенилами, С2-С4-галоидалкенилами, С1-С3-алкоксигруппами, С1-С4-галоидалкоксигруппами; пиридил, пиридил, который может быть замещен одним или несколькими галоидами или С1-С3-галоидалкилами;
B2-Z-Rh1 где Ar представляет фенил; фенил, замещенный одним или несколькими галоидами, С1-С3-алкилами, С1-С3-галоидалкилами, С2-С4-алкенилами, С2-С4-галоидалкенилами, С1-С3-алкоксигруппами, С1-С4-галоидалкоксигруппами; пиридил, пиридил, который может быть замещен одним или несколькими галоидами или С1-С3-галоидалкилами;
K, X, Z представляют независимо друг от друга О или S;
B1, B2, которые могут быть одинаковы или отличаться друг от друга, каждый представляет С1-С6 алкилиден нормального или изо-строения;
Rh1 представляет C1-C6-галоидалкил, содержащий 1-9 атомов галоида, С2-С8-галоидалкенил, содержащий 1-9 атомов галоида, С3-С8-галоидалкоксиалкил, С3-С8-галоидалкоксиаленил, где галоид предпочтительно представлен фтором;
A представляет азотную гетероциклическую группу, выбранную из радикалов формул: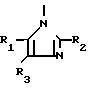
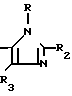
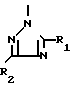
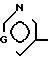 где R1, R2, R3, которые могут быть одинаковы или различны, каждый представляет Н, С1-С6-алкил, С1-С6-галоидалкил, С2-С6-алкенил,
где R1, R2, R3, которые могут быть одинаковы или различны, каждый представляет Н, С1-С6-алкил, С1-С6-галоидалкил, С2-С6-алкенил,
С2-С6-галоидалкенил, С2-С6-галоидалки- нил; G представляет СН или N.
Цель изобретения достигается также с использованием полей соединений общей формулы I, получаемых из неорганической кислоты, в частности, галоидводородной, например йодистоводородной, бромистоводородной, хлористоводородной, серной, азотной, тиоцианистой и фосфорной или органической кислоты, такой как уксусная, пропионовая, этандиовая, пропандиовая, метансульфоновая, бензойная, 4-метилбензсульфоновая кислота и т.д.
комплексов с металлами, образуемых в реакции комплексообразования производного формулы I с органической или неорганической солью металла, такой как галид, нитрат, сульфат, фосфат, например, меди, марганца, цинка или железа.
Примеры соединений общей формулы I, настоящего изобретения приведены в табл. 1.
Соединения общей формулы I могут быть получены с использованием нескольких схем синтеза, одна из которых приведена на чертеже. где V представляет отходящую группу, такую как, например, галоид или сложный эфир сульфоновой кислоты.
Согласно приведенной схеме А соединение формулы VII получают реакцией соединения формулы V с соединением формулы VI в присутствии основания, такого как, например, гидроокись натрия, гидроокись калия, гидрид натрия, трет-бутоксид натрия или карбонат щелочного металла, к которому добавляют катализатор переноса фаз, в приемлемом растворителе, таком как, например, вода или спирты, в частности метанол, этанол, бутанол, этиленгликоль или, если реакцию проводят в условиях переноса фаз, апротонном полярном растворителе, такой как, например, диметилформамид, метилпирролидон или ароматическом растворителе, таком как толуол, или галоидированном растворителе, таком как хлористый метилен или дихлорэтан.
Температура реакции может составлять интервал от 0оС до температуры кипения растворителя в соответствии с методикой, приведенной в "Синтезе органических препаратов" (англ. изд), сборн. т. 1, стр. 435.
Соединение формулы V может быть также использовано в виде соли с щелочным или щелочно-земельным металлом.
Затем соединение формулы VII вводят в реакцию с амином VIII или амином IX в присутствии органического или неорганического основания, такого как, например, гидроокись щелочного металла, карбонат или бикарбонат щелочного металла, триэтиламин или пиридин, или путем использования избытка амина формул VIII или IX в качестве кислотного акцептора, проведения реакции в органическом растворителе и в условиях, аналогичных условиям проведения предшествующей стадии.
В зависимости от применяемого амина получают соответственно промежуточное соединение формулы X или формулы XI.
После этого промежуточное соединение формулы XI вводят в реакцию с карбонильными производными азотного гетероциклического соединения A, например, карбонилдиимидазолом в ароматическом или галоидированном растворителе при температуре, составляющей интервал от 0оС до температуры кипения растворителя, и получением соединения формулы I.
В соответствии с другим путем синтеза соединение формулы XI обрабатывают фосгеном или тиофосгеном в таком органическом растворителе как этилацетат и получают соединение формулы XII, на основе которого в последующей реакции с азотным гетероциклом (А)-типа, например, имидазолом получают соединение формулы I.
Согласно альтернативному пути синтеза соединение формулы XI вводят в реакции с хлорангидридом никотиновой кислоты и получают соединение формулы I.
Промежуточное соединение формулы XI может быть также получено реакцией присоединения соединения формулы Х с полифторолефином, например формулы
CF2=CX1X2, где X1=Cl, F, CF3, OCF3;
X2= F, CF3, в присутствии каталитического или стехиометрического количества сильного основания, такого как гидрид натрия или трет-бутоксид натрия и в таком диполярном апротонном растворителе как, диметилсульфоксид или диметилформамид, или спиртовом растворителе, таком как, например, трет-бутанол в температурном интервале от -20 до 100оС; реакцией щелочно-металлической соли соединения формулы Х с соединением формулы Y-R1, где Y представляет приемлемую отходящую группу, такую как галоид или эфир сульфоновой кислоты.
Аналогично, амин формулы IX может быть синтезирован из соединения формулы VIII использованием методик, приведенных выше для получения соединения формулы XI.
Соединения, имеющие группу Rh1, в которой присутствует по меньшей мере один атом водорода и более одного атома галоида, использованием реакции дегидрогалоидирования могут быть превращены в соответствующие ненасыщенные соединения.
Схема синтеза В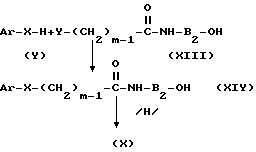 (ХIV) где m=1-6
(ХIV) где m=1-6
В соответствии с приведенной схемой синтеза В амид формулы XIV получают реакцией соединения формулы XIII с соединением формулы V в присутствии органического или неорганического основания и в таком растворителе: как метанол, этанол, этиленгликоль, полиэтиленгликоли, диметилформамид или в условиях реакции переноса фаз.
Затем соединение формулы XIV восстанавливают в соединение формулы Х, например, литийалюминийгидридом в растворителях типа простых эфиров, таких как тетрагидрофуран, после чего промежуточное соединение формулы Х превращают в соединение формулы I одним из способов, отраженных на вышеприведенной схеме синтеза (А).
Схема синтеза С.

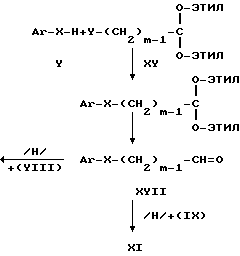 где m=1-6.
где m=1-6.
В соответствии со схемой реакции С реакцией соединений формулы XV с соединениями формулы V получают ацеталь формулы XVI, последующим разблокированием которого синтезируют альдегид формулы XVII, который вводят в реакцию с амином формулы VIII в присутствии восстановителя, например, водорода и катализатора, такого как Pt или Pd в органическом растворителе, таком как, например, метиловый спирт в нейтральной среде или кислой среде, например, в присутствии серной кислоты, с целью получения соединения формулы X, из которого использованием превращений, указанных в схеме реакции А получают соединение формулы I.
В альтернативном варианте альдегид формулы XVII используют в реакции восстановительного алкилирования амина формулы IX, например, в присутствии цианоборгидрида натрия в условиях, известных из соответствующей технической литературы, с получением соединения формулы XI, которое затем превращают в соединение формулы I по одной из приведенных схем синтеза.
Соединения общей формулы I являются очень мощными ингибиторами роста отдельных видов патогенных грибков, поражающих посадки культурных растений.
Эти соединения проявляют как профилактическую, так и лечебную активность при их нанесении на культурные растения или на части таких растений, например листья, в результате чего оказываются особенно эффективными для профилактики заболеваний, вызываемых распространенными патогенными грибками, такими как, например, рода Erysiphe и рода Puccinia.
Примеры заболеваний растений, поддающихся лечению с помощью соединений настоящего изобретения, включают:
Erysiphe graminis на зерновых;
Sphaeroteca fuligirea на тыквенных (напр. огурцах);
Puccinia на зерновых;
Septoria на зерновых;
Helminthasporium на зерновых;
Rhyhchosporium на зерновых;
Podosphaera Leucotricha на яблоневых деревьях;
Uncinula necator на винограде;
Venturia inaegualis на яблоневых деревьях;
Piricularia oryzae на рисе;
Botrytis cinerea;
Fusarium на зерновых и другие заболевания.
Для практического применения в сельском хозяйстве часто удобнее иметь доступные фунгицидные композиции, содержащие в качестве активного компонента одно или несколько соединений формулы I.
Такие композиции могут быть нанесены на любые части растения, например, листья, стебли, ветви и корни, или на семена растений перед их высевом или на почву, в которой растение выращивают.
Могут быть использованы композиции в виде сухих порошков, смачивающихся порошков, концентратов, эмульсий, паст, гранул, растворов, суспензий и т.д. и выбор типа композиции зависит от предполагаемого конкретного применения. Получают композиции известными способами, например, разбавлением или растворением активного вещества в среде растворителя и/или твердом разбавителе, возможно в присутствии поверхностно-активного вещества. В качестве твердых разбавителей или носителей могут быть использованы следующие вещества: окись кремния, каолин, бентонит, тальк, инфузорная земля, доломит, карбонат кальция, окись магния, гипс, глины, искусственные силикаты, аттапульгит, сепилит. В качестве жидких разбавителей помимо воды, разумеется могут быть использованы различного типа растворители, например, ароматические растворители (бензол, ксилол или смеси алкилбензолов), хлорароматические растворители (хлорбензол), парафины (нефтяные фракции), спирты (метанол, пропанол, бутанол), амины, амиды (диметилформамид), кетоны (циклогексанон, ацетофенон, изофорон, этиламилкетон), сложные эфиры (изобутилацетат).
В качестве поверхностно-активных веществ могут быть использованы натриевые, кальциевые или триэтаноламинные соли алкилсульфатов, алкилсульфонатов, алкиларилсульфонатов, полиэтоксилированные алкилфенолы, сконденсированные с окисью этилена жирные спирты, полиэтоксилированные жирные кислоты, лигнинсульфонаты. Композиции могут также включать специальные добавки особого назначения, такие связующие вещества, например гумиарабик, поливиниловый спирт и поливинилпирролидон.
При желании в композиции изобретения могут быть введены также другие совместимые с ними активные вещества, такие как фунгициды, регуляторы роста растений, гербициды, инсектициды, удобрения.
Концентрация активного компонента в приведенных композициях может меняться в широких пределах в зависимости от активного компонента, растения, патогена, окружающих условий и типа применяемого состава. Как правило, концентрация активного вещества составляет интервал 0,1-95 мас. предпочтительно 0,5-90 мас.
П р и м е р 1. Синтез N-2(1,1,2,2-тетрафторэтокси)этил-N-/2-(3-трифторметилфено- кси)этил/ -1-карбоксамидоимидазола (соединение 1).
К раствору 1,3 г N-2-(1,1,2,2-тетрафторэтокси)-этил-N-/2-(3-фторметилфенокси)эти- л/амина в 9 мл толуола добавляют 0,73 г карбонилдиимидазола и смесь перемешивают 8 ч при 80оС в атмосфере азота. После удаления растворителя испарением в вакууме остаток переносят в хлористый метилен и полученный раствор промывают водой, сушат над сульфатом натрия и испаряют при пониженном давлении. Полученный сырой продукт очищают хроматографией на окиси кремния использованием в качестве элюента смеси CH2Cl2-MeOH (95:5 объем/объем (об./об).
Получено 1,2 г масла, спектральная характеристика которого отвечает соединению 1. 1Н-ЯМР (60 МГц) в CD Cl3 δ: 3,93 (2H, т), 3,96 (2Н, т), 4,25 (4Н, т), 6,13 (1Н, тройной т), 7-7,5) (6Н, м), 8 (1Н, с).
П р и м е р 2. Синтез N-2(1,1,2,2-тетрафторэтокси)этил-N-/2-(3-трифторметилфено- кси)этил/амина.
К раствору 2 г 2-/2-(3-трифторметилфенокси)этиламино/-этанола в 14 мл диметилсульфоксида, охлажденному до 5оС, добавляют 0,35 г трет-бутоксида калия, после чего в реакционный сосуд пропускают тетрафторэтилен, в ходе чего наблюдается небольшое выделение тепла. Реакционную смесь оставляют на несколько часов в атмосфере того же газа, после чего раствор переносят к деионизированную воду и экстрагируют хлористым метиленом. Органическую фазу сушат над сульфатом натрия и испаряют. Получено 1,3 г маслянистого остатка.
1Н-ЯМР (60 МГц) в CDCl3, δ: 2,83 (2Н, т), 2,9 (2Н, т), 4,03 (4Н, т), 5,7 (1Н, тройной т), 7-7,5 (4Н, м).
П р и м е р 3. Синтез 2-/2-(3-трифторметилфенокси)этиламино/этанола.
К раствору 141,1 г этаноламина в 33 мл этанола по каплям прибавляют 17,7 г 1-бром-2(трифторметилфенокси)этана и смесь перемешивают 40 ч при комнатной температуре. Затем растворитель испаряют при пониженном давлении, остаток переносят в 5 н. NaOH (26 мл). Полученный раствор экстрагируют хлористым метиленом, экстракт промывают водой, сушат над сульфатом натрия и испаряют досуха. Получено белое кристаллическое вещество, которое переносят в гексан, фильтруют и промывают тем же растворителем. Получено 12,2 г продукта.
1Н-ЯМР (60 МГц) в CDCl3, δ: 2,95 (2H, т), 3,2 (2Н, т), 3,9 (2Н, т), 4,35 (2Н, т), 7-7,5 (4Н, м).
П р и м е р 4. Синтез 1-бром-2-(3-трифторметилфенокси)этана.
К раствору 2,5 г 3-трифторметилфенола и 1,2-дибромэтана (30 г) в деионизированной воде (30 мл) по каплям прибавляют 33%-ный раствор NaOH (17 мл), после чего смесь кипятят 1 ч. Затем реакционную смесь охлаждают, образовавшееся масло отделяют от водной фазы и разгоняют при 15 мм Hg. Отбирают фракцию с температурой кипения 118-120оС, выход целевого продукта 26 г.
1Н-ЯМР (60 МГц) в CDCl3, δ: 2,95 (2Н, т), 3,2 (2Н, т), 3,9 (2Н, т), 4,35 (2Н, т), 7-7,5 (4Н, м).
П р и м е р 5. Синтез N-/2-(1,1,2,2-тетрафторэтокси)этил/-N-/2-(2,4,6, -трихлорфе- нокси)этил/ -1-карбоксамидоимидазола (соединение 2).
Воспроизводят методику примера 1 использованием в качестве исходного соединения N-/2-(1,1,2,2-тетрафторэтокси)этил/ N-/2-(2,4,6-трихлорфенокси)этил/амина.
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,9 (4Н, м), 4,2 (4Н, м), 5,66 (1Н, тройной т), 7-7,44 (3Н, с), 7,9 (1Н, с).
П р и м е р 6. Синтез N-/2-(1,1,2,2-тетрафторэтокси)этил/-N-/2-(2,4,6-трихлорфе- нокси)этиламина.
Воспроизводят методику примера 2 использованием в качестве исходного соединения 2-/2-(2,4,6-трихлорфенокси)этил-амино/ этанола.
1Н-ЯМР (60 МГц) в CDCl3, δ: 2,95 (2H, т), 3,05 (2Н, т), 4,1 (4Н, т), 5,66 (1Н, тройной т), 7,33 (2Н, с).
П р и м е р 7. Синтез 2-/2-(2,4,6-трихлорфенокси)этиламино/этанола.
Воспроизводят методику примера 3 использованием в качестве исходного соединения 1-бром-2-(2,4,6-трихлорфенокси)этана.
1Н-ЯМР (60 МГц) в CDCl3, δ: 2,7 (2Н, т), 2,87 (2Н, т), 3,65 (2Н, т), 4,4 (2Н, т), 7,72 (2Н, с).
П р и м е р 8. Синтез 1-бром-2-(2,4,6-трихлорфенокси)этана.
Воспроизводят методику примера 4 использованием в качестве исходного соединения 2,4,6-трихлорфенола.
1Н-ЯМР (60 МГц) в CDCHl3, δ: 3,65 (2Н, т), 4,3 (2Н, т), 7,31 (2Н, с).
П р и м е р 9-14. Использованием методики, аналогичной методике примера 1, на основе соответствующих аминов получены следующие соединения.
Соединение 3.
N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(4-хлорфенокси)-этил/-1 -карбоксамидоимидазол.
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,9 (4Н, м), 4,2 (4Н, м), 5,6 (1Н, тройной т), 6,6-7,4 (4Н, м), 8 (1Н, с).
Соединение 4. N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(2,4,5-трихлорфенокси)этил/-1-карбокс а- мидимидазол.
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,95 (4Н, м), 4,2 (4Н, м), 5,7 (1Н, тройной т), 6,95-7,5 (4Н, м), 8 (1Н, с).
Соединение 5.
N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(2,4-дихлорфенокси)этил/-1- карбоксамидоимидазол
1Н-ЯМР (60 МГц) в CDCl3, δ: 4,05 (4Н, м), 4,3 (4Н, м), 5,7 (1Н, тройной т), 6,9-7,5 (5Н, м), 8 (1Н, с).
Соединение 6. N-2-(1,1,2,2-тетрафторэтокси)пропил-N-/2-(2,4,6-трихлорфенокси)этил/ -1-карбоксамидоимидазол
1Н-ЯМР (60 МГц) в CDCl3, δ: 1,35 (3Н, д), 3,6-4,3 (7Н, м), 5,7 (1Н, тройной т), 7,5 (4Н, м), 8 (1Н, с).
Соединение 7. N-3-(1,1,2,2-тетрафторэтокси)пропил-N-/2-(2,4,6-трихлорфенокси)этил/-1- карбоксамидоимидазол
1Н-ЯМР (60 МГц) в CDCl3, δ: 2,15 (2Н, м), 3,8 (4Н, м), 4,1 (4Н, м), 5,65 (1Н, тройной т), 7-7,4 (4Н, м), 7,95 (1Н, с).
Соединение 8.
N-2(1,1,2-трифтор-2-трифторметокси- этокси)этил-N-/2-(3-трифторметилфенокси) этил/-1-карбоксамидоимидазол
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,9 (4Н, м), 4,6 (4Н, м), 5,65 (1Н, дв. т), 6,9-7,6 (6Н, м), 8 (1Н, с).
П р и м е р 15. Синтез N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(4-хлорфенокси) этил/-3- карбоксамидопиридина.
Соединение 9.
К раствору N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(4-хлорфенокси)этил/амина (1 г) и никотиноихлорида (0,56 г) в хлористом метилене (6,5 мл) медленно по каплям прибавляют триэтиламин (6,9 г), после чего смесь перемешивают сутки при комнатной температуре. Затем реакционную смесь обрабатывают водой, органическую фазу отделяют, сушат и испаряют при пониженном давлении.
Полученную в результате смесь очищают хроматографированием на окиси кремния использованием в качестве элюента смеси CH2Cl2-MeOH (95:5 об/об). Получено 0,5 г масла, спектральная характеристика которого соответствует соединению 9.
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,9 (4H, м), 4,2 (4Н, м), 5,75 (1Н, тройной т), 6,6-8 (7Н, м), 8,65 (1Н, с).
Соединение 10. N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-/4-(1,1,2,2-тетрафторэтокси)фенокси/ этил/-1-карбоксамидоимидазол.
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,9 (4Н, м), 4,2 (4Н, м), 5,65 (1Н, тройной т), 5,87 (1Н, тройной т), 6,7-7,3 (5Н, м), 7,97 (1Н, с).
Соединение 11.
N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(3-фторэтокси)этил/-1 -карбоксамидоимидазол.
1Н-ЯМР (60 МГц) в CdCl3, δ: 3,8 (4Н, м), 4,25 (4Н, м), 5,75 (1Н, тройной т), 6,5-7,55 (5Н, м), 8,05 (1Н, с).
Соединение 12.
N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(2-фторфенокси)этил/-1- карбоксамидоимидазол.
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,85 (4Н, м), 4,15 (4Н, м), 5,6 (1Н, тройной, т), 6,8-7,4 (5Н, м), 7,93 (1Н, с).
Соединение 13.
N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(4-трет-бутилфенокси)-этил/ -1-карбоксамидоимидазол.
1Н-ЯМР (60 МГц) в CDCl3, δ: 1,4 (9Н, с), 3,87 (4Н, м), 4,2 (4Н, м), 5,6 (1Н, тройной т), 6,75-7,45 (5Н, м), 8 (1Н, с).
Соединение 14.
N-2-(1,1,2-трифтор-2-хлорэтокси)этил-N-/2-(2,4,6-трихлорфенил)этил/ -1-карбоксамидоимидазол.
1Н-ЯМР (60 МГц) в CDCl3, δ: 4 (8Н, м), 6 (1Н, дв. т), 6,6-7,3 (6Н, м), 7,9 (1Н, с).
П р и м е р 16. Синтез N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(2,4,6-трихлорфенокси)этил/ -5-карбоксамидо-1-метилимидазола.
Соединение 15.
Раствор 1-метил-5-карбоксиимидазола (1 г) в хлористом тиониле (30 мл) кипятят 2 ч, избыток хлористого тионила затем испаряют при пониженном давлении и остаток переносят в пиридин (15 мл). Полученный раствор охлаждают до 0оС и к нему медленно по каплям прибавляют раствор N-2-(1,1,2,2-тетрафторэтокси)этил-N-/2-(2,4,6-трихлорфенокси)-этил/амина (2,5 г) в пиридине (5 мл). Смесь перемешивают 18 ч при комнатной температуре, затем переносят в воду и экстрагируют хлористым метиленом. Органическую фазу сушат над сульфатом натрия и испаряют при пониженном давлении. Полученный сырой продукт очищают хроматографированием на окиси кремния использованием в качестве элюента смеси CH2Cl2-MeOH (97: 3 об/об). Получено 0,85 г твердого вещества, спектральные характеристики соответствуют соединению 15.
1Н-ЯМР (60 МГц) в CDCl3, δ: 3,7 (3Н, с), 4,1 (8Н, м), 5,73 (1Н, тройной т), 7,31 (2Н, с), 7,36 (1Н, с).
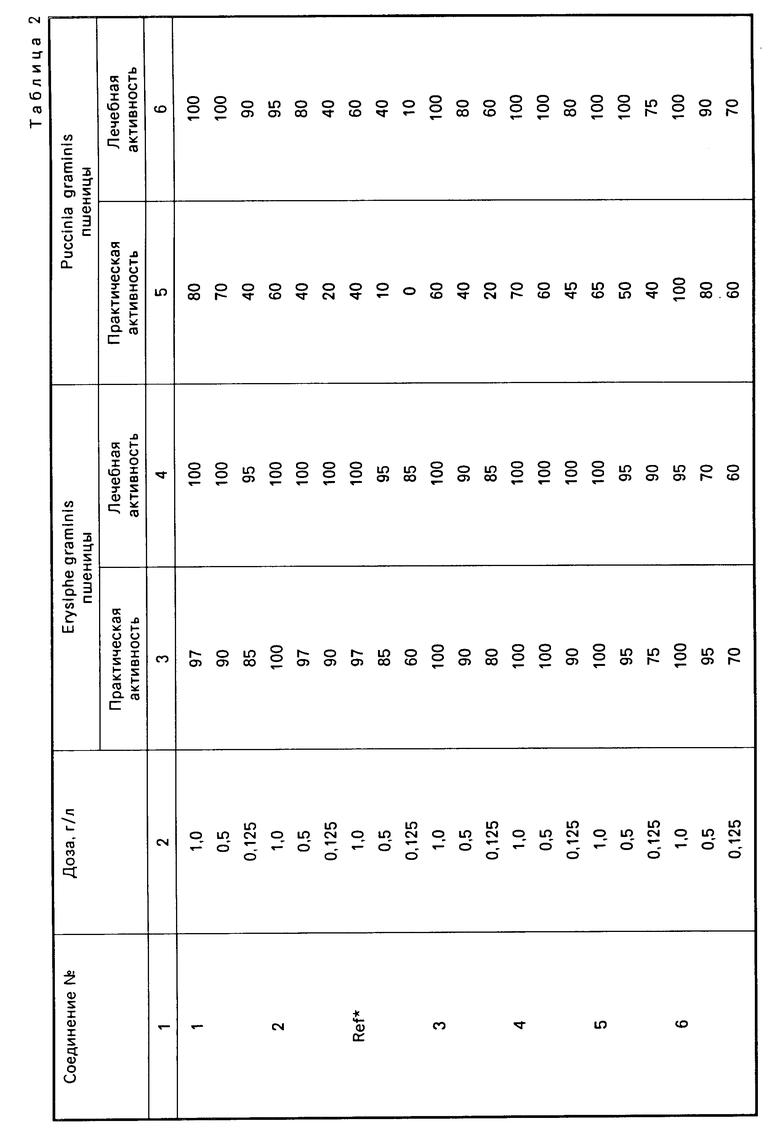
П р и м е р 17. Определение фунгицидной активности на оидиум пшеницы (Erysiphe Graminis D.C.).
Профилактическая активность.
Листья пшеницы сорта Ирнерио, выращенной в горшочках внутри теплицы, обрабатывают опрыскиванием обоих поверхностей водно-ацетонным раствором испытуемого соединения при содержании ацетона 20% (об/об).
После выдерживания в теплице в течение 1 дня при относительной влажности (ОВ) 70% обе поверхности листьев опрыскивают водной суспензией Erysiphe Graminis (20000 кондий/мл).
После 24-часового выдерживания в атмосфере насыщенной влажности при 21оС растения оставляют в теплице для инкубирования грибка.
К концу периода инкубирования (12 дней) визуально определяют степень заражения по оценочной шкале от 100 (здоровое растение) до 0 (полностью зараженное растение).
Лечебная активность.
Листья пшеницы сорта Ирнерио, выращенной в горшочках в теплице, обрабатывают опрыскиванием обоих поверхностей всех листьев водной суспензией Erysiphe Graminis (20000 кондий/мл).
После 24-часового выдерживания в атмосфере с насыщенной влажностью при 21оС обе поверхности всех листьев растений обрабатывают опрыскиванием водно-ацетонным раствором испытуемого соединения при концентрации ацетона 20% (об/об).
В конце инкубационного периода (12 дней) визуально определяют степень заражения по оценочной шкале от 100 (здоровое растение) до 0 (полностью зараженное растение).
Полученные результаты приведены в табл. 2.
П р и м е р 18. Определение фунгицидной активности по отношению к линейной ржавчине пшеницы Puccinia Graminis Pers.
Профилактическая активность.
Листья пшеницы сорта Ирнерио, выращенной в горшочках в теплице, обрабатывают опрыскиванием испытуемым соединением в водно-ацетонном растворе (20% об/об) обоих поверхностей всех листьев.
После 1-го дня в теплице при 23оС и ОВ 70% обе поверхности листьев опрыскивают смесью спор Puccinia Graminis с тальком (100 мг спор на 5 г талька).
После 48 ч в атмосфере с насыщенной влажностью при 21оС растения оставляют в теплице для инкубирования грибка.
В конце периода инкубирования (14 дней) визуально определяют степень заражения по оценочной шкале от 100 (здоровое растение) до 0 (полностью зараженное растение).
Лечебная активность.
Обе поверхности всех листьев пшеницы сорта Ирнерио, выращенной в теплице в горшочках, обрабатывают опрыскиванием смесью спор Puccinia Graminis с тальком (100 мг спор на 5 г талька). Через 48 ч выдерживания в атмосфере с насыщенной влажностью при 21оС обе поверхности листьев обрабатывают испытуемым соединением в водно-ацетонном растворе, содержащeм 20% ацетона (об/об).
В конце периода инкубирования (14 дней) визуально определяют степень заражения по оценочной шкале от 100 (здоровое растение) до 0 (полностью зараженное растение).
Полученные результаты приведены в табл. 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ | 1989 |
|
RU2024510C1 |
| Способ получения триазолильных производных | 1988 |
|
SU1676447A3 |
| СМАЗОЧНАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2071499C1 |
| ШТАММ БАКТЕРИЙ BACILLUS THURINGIENSIS VAR DONEGANI ДЛЯ ПОЛУЧЕНИЯ ИНСЕКТИЦИДНОГО ПРЕПАРАТА ПРОТИВ ЖЕСТКОКРЫЛЫХ НАСЕКОМЫХ, КРИСТАЛЛИЧЕСКИЙ ПАРАСПОРАЛЬНЫЙ БЕЛКОВЫЙ ТОКСИН И СПОСОБ БОРЬБЫ С ЖЕСТКОКРЫЛЫМИ НАСЕКОМЫМИ | 1990 |
|
RU2048099C1 |
| СПОСОБ БОРЬБЫ С ГРИБКОВЫМИ ИНФЕКЦИЯМИ РАСТЕНИЙ | 1989 |
|
RU2067832C1 |
| Способ борьбы с грибковыми инфекциями | 1989 |
|
SU1676436A3 |
| ПРОИЗВОДНЫЕ МОРФОЛИНА | 1991 |
|
RU2038353C1 |
| Способ получения производных триазолилдиоксоланов-1,3 | 1986 |
|
SU1500159A3 |
| СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ СНИЖЕНИЯ АКТИВНОСТИ ГОРМОН-ЧУВСТВИТЕЛЬНОЙ ЛИПАЗЫ | 2002 |
|
RU2317981C2 |
| АНТРАЦИКЛИНОВЫЙ ГЛИКОЗИД И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ | 1990 |
|
RU2073681C1 |

Использование: в качестве препаратов с противогрибковой активностью. Сущность изобретения: азот содержащие гетероциклические соединения формулы I, где радикалы Ar, B, B, Z, Rh, K, X, A имеют соответствующие значения. Структура формулы I 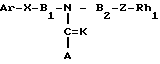 1 ил. 2 табл.
1 ил. 2 табл.
АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ общей формулы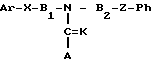
где Ar фенил, замещенный одним или несколькими атомами галоида, С1 - С3-алкилом, С1 С3 галоидалкилом;
K, X, Z кислород;
B1, B2 линейный или разветвленный С1 С6-алкилиден;
Ph С1 С3-галоидалкил, С3 С8-галоидалкоксиалкил;
A имидазол.
| Патент США N 3991071, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-10-10—Публикация
1992-04-28—Подача