Изобретение относится к способу получения основных и кислотных триарилметановых красителей путем каталитического окисления их лейкооснований с использованием в качестве катализаторов вновь синтезированных производных фталоцианина железа. Триарилметановые красители находят широкое применение для крашения бумаги, в текстильной и полиграфической промышленности. В основе промышленного производства триарилметановых красителей лежит процесс окисления соответствующих лейкооснований соединениями переходных металлов: PbO2, KMnO4, K2Cr2Ox. Недостатком этого способа является применение стехиометрических количеств экологически вредных окислителей.
Известен способ получения триарилметановых красителей путем окисления лейкооснований производными n-бензохинона (заместители: Cl, Br, CN) в присутствии кислорода воздуха и комплексного соединения кобальта или железа, в частности незамещенного фталоцианина железа. Недостатком этого способа является использование трудно доступных производных n-бензохинона, затрудняющих выделение красителей, а также протекание процесса при повышенной температуре (50оС).
Целью изобретения является исключение экологически опасных окислителей в производстве триарилметановых красителей, упрощение окислительной системы и создание удобной технологии.
Для достижения указанной цели проводится каталитическое окисление соответствующих лейкооснований триарилметановых красителей общей формулы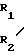 N
N M
M где R1 алкил;
где R1 алкил;
R2 алкил, незамещенный или замещенный бензил;
А незамещенный или замещенный фенил в органических растворителях перекисью водорода с использованием в качестве катализаторов вновь синтезированных производных фталоцианина железа. Реакцию проводят при температуре 0-25оС в течение 15-30 мин, в качестве растворителя применяют алифатические спирты или их смеси с ацетоном, хлороформом или бензолом.
Известный незамещенный фталоцианин железа не может быть использован в предлагаемой системе из-за отсутствия растворимости в предлагаемых органических растворителях.
В качестве катализатора используется замещенные фталоцианины железа (PcFe) следующей общей формулы: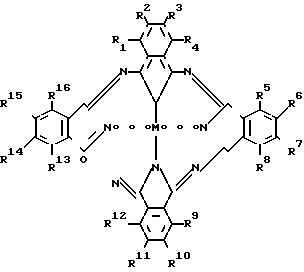 где R1=(R3-R5)=(R7-R9)=(R11-R13)= (R15-R16)=H;
где R1=(R3-R5)=(R7-R9)=(R11-R13)= (R15-R16)=H;
R2=R6=R10=R14=SO2NCH2CH2OH2; (I)
SO2N(C4H9)2; (II)
SO2C6H5 (III)
R1=R3=R4=R5=R7=R8=R9=(R11-R16)=H
R2=R6=R10=SO2N(CH2CH2OH)2 (IV)
SO2N(C4H9)2; (V)
R2=R4=R6=R8=R10=R12=R14=R16=H; R1=R5=R9=R3=NO2
R3=R7=R11=R15=C(CH3)3. (VI)
R2=R3=(R5=R8)=R10=R11=(R19=R16)=H, R1=R4=R9=R12=OCHH11 (VII)
R2=R3=R5=R7=R8=R10=R11=R13=R15=R16=H
R1=R4+R9=R12=OC6H11;
R6=R14=C(CH3)3 (VIII)
П р и м е р 1. Тетракис-4-[бис(2-оксиэтил)-сульфамоил]-фталоцианин железа (I);
Cмесь 4,32 г монокалиевой соли 4-сульфофталевой кислоты, 5,80 г сухой мочевины, 0,73 г сульфата железа и каталитического количества молибдата аммония нагревают 4 ч при 180-190оС, охлаждают, промывают ацетоном, этанолом, сушат, получают 6,28 г технической тетракалиевой соли тетра-4-сульфофталоцианина железа. К смеси 1,5 г полученного комплекса и 1,5 мл диметилформамида добавляют по каплям при перемешивании 5 мл хлористого тионила, смесь нагревают до 80оС и выдерживают 5 ч при 80-85оС. После окончания выдержки реакционную массу охлаждают, выливают на лед, выпавший осадок отфильтровывают и промывают ледяной водой до рН 7. Водную пасту полученного сульфохлорида загружают в 25 мл охлажденного до 0оС ацетона, затем добавляют при температуре не выше 5оС раствор 0,8 г диэтаноламина в 4 мл 75%-ного водного ацетона и 1,5 мл триэтиламина. Реакционную массу перемешивают 2 ч при 0-5оС и 5 ч при 20-25оС, после чего ацетон упаривают, остаток обрабатывают 30 мл 5%-ной соляной кислоты, переосаждают из разбавленного водного раствора щелочи соляной кислотой, осадок промывают на фильтре водой до рН 7, сушат, получают 0,11 г (10% ) комплекса (I). λmax (нм) в 3,5%-ном НСl в этаноле: 684, 614, 362.
Найдено, N 13,95; S 9,87.
C48H52FeN12O16S4.
Вычислено, N 13,58; S 10,37.
П р и м е р 2. Тетракис-4-(дибутилсульфамоил)фталоцианин железа (II).
К смеси 0,5 г технической тетра-4-сульфокислоты, полученной аналогично примеру 1, и 0,3 мл диметилформамида добавляют при перемешивании 2 мл хлористого тионила, реакционную массу нагревают до 80оС, выдерживают 3 ч при 80-90оС, после чего охлаждают, выливают на лед, выпавший осадок отфильтровывают и промывают водой до рН 7. Полученный сульфохлорид PcFe загружают в 7 мл охлажденного до 0-2оС хлороформа и добавляют при перемешивании 1,5 мл дибутиламина, при этом температура реакционной массы не должна подниматься выше 5оС. Смесь перемешивают 2 ч при 0-5оС и 5 ч при 20-25оС, затем растворитель упаривают, остаток обрабатывают концентрированной соляной кислотой, водой, сушат и после хроматографической очистки на окиси алюминия бензолом, а затем смесью бензол-хлороформ (1: 1) получают 0,11 г (9%) дипиридината комплекса (II). λmax (нм) в бензоле: 660, 630п, 598, 410 ш, 344.
Найдено, C 59,14, H 6,82.
C74H94FeN14O8S4.
Вычислено, C 59,58; H 6,35.
П р и м е р 3. Тетра-4-(фенилсульфонил)фталоцианин железа (III).
Смесь 0,30 г 4-(фенилсульфонил)фталимида, 0,15 г безводного дибромида железа, 0,60 г сухой мочевины и каталитического количества молибдата аммония нагревают 1 ч при 210оС, реакционную смесь охлаждают, промывают последовательно водой, концентрированной соляной кислотой, водой, концентрированным водным аммиаком, водой, этанолом, после чего комплекс экстрагируют хлороформом, растворитель упаривают, сухой остаток переосаждают из диметилформамида водой, сушат, получают 0,24 г (76%) комплекса (III) в форме μ-оксодимера.
Найдено, N 10,21.
C112H88FeH18O17S4.
Вычислено, N 9,85.
Кипячением полученного μ -оксодимера в пиридине с последующей хроматографией на Al2O3 пиридином получают комплекс (III) в форме дипиридината. λmax нм (lgε ) в 5% -ном растворе пиридина в бензоле: 665 (5,21), 635 пл, 605 (4,85), 425 (4,32), 345 (4,94). Для получения аддукта комплекса (III) с соляной кислотой бензольный раствор дипиридината комплекса (III) обрабатывают три раза 2 н. раствором соляной кислоты, фильтруют, бензольный раствор отмывают до рН 7, растворитель упаривают, λmax нм (lg ε) в бензоле: 820 (4,41), 730 (4,18), 649 (4,96), 595, 410 пл, 335 (4,90).
П р и м е р 4. Трис-4-[(2-оксиэтил)сульфамоил]фталоцианин железа (IV). Смесь 4 г фталоцианина железа и 18 мл хлорсульфоновой кислоты нагревают 1 ч при 110-115оС, 1 ч при 120-125оС и 1 ч при 135-140оС, охлаждают до 40оС, добавляют 7 мл хлористого тионила, нагревают до 80-85оС и выдерживают при этой температуре 3,5 ч. После окончания выдержки реакционную массу выливают на лед, выпавший осадок отфильтровывают, промывают водой до рН 7 и загружают в 100 мл охлажденной до 0-3оС воды. К суспензии сульфохлорида добавляют при 0-5оС раствор 5 г диэтаноламина в 20 мл воды, выдерживают при этой температуре 2 ч, после чего охлаждение снимают и перемешивание продолжают еще в течение 5 ч при 20-25оС. После окончания выдержки реакционную массу подкисляют концентрированной соляной кислотой до рН 2-4, выпавший осадок отфильтровывают, промывают водой, переосаждают из 1%-ного водного едкого натра соляной кислотой, промывают водой, сушат, получают 2,46 г (33%) комплекса (IV). λmax, нм (lgε ) в 3,5%-ном этанольном растворе соляной кислоты: 674 (4,78).
Найдено, N 14,98; S 8,50.
C44H43FeN11O12S3.
Вычислено, N 14,40; S 8,99.
П р и м е р 5. Трис-4-(дибутилсульфамоил)фталоцианин железа (V).
Аналогично примеру 4 с использованием вместо диэтаноламина 2 г дибутиламина в 60 мл хлороформа получают комплекс (V), после очистки которого аналогично соединению (II), выделяют 1,25 г (14%) дипиридината соединения (I). λmax (нм) в бензоле: 660, 602, 420, 324.
Найдено, N 13,41; S 6,93.
C66H77N13O6S3.
Вычислено, N 14,00; S 7,40.
П р и м е р 6. Тетра-3-нитро-тетра-5-(трет.-бутил)фталоцианин железа (VI). Тщательно перемешанную смесь 0,25 г 3-нитро-5-(трет.-бутил)фталамида, 0,6 г сухой мочевины, 1,25 г сульфата натрия, 0,1 г безводного дибромида железа и каталитического количества молибдата аммония нагревают 0,5 ч при 160-170оС, 1 ч при 180-190оС и 1 ч при 190-200оС. Смесь охлаждают, промывают горячей водой, сушат, комплекс экстрагируют смесью бензола с пиридином и после хроматографии на Al2O3бензолом, а затем 5%-ным раствором пиридина в бензоле получают 0,075 г (27%) дипиридината комплекса (VI). λmax нм (lgε ) в 5% -ном растворе пиридина в бензоле: 661 (5,09), 630 пл (600), 4,56 (420), 4,36 (340), 4,87.
Найдено, N 17,13.
C58H54FeN14O8.
Вычислено, N 17,34.
П р и м е р 7. Тетра-3,3",6,6"-гексилоксифталоцианин железа (VII).
Смесь 0,458 г 3,6-дигексоксифталодинитрила, 0,200 г фталодинитрила, 0,245 г безводного дибромида железа и каталитического количества молибдата аммония нагревают 1 ч при 280оC, охлаждают, растворяют в пиридине, хроматографируют на окиси алюминия хлороформом, растворитель упаривают, остаток промывают этанолом, гексаном, сушат и получают 0,400 г (57%) соединения (VII) в форме μ-оксодимера.
Найдено, N 11,35.
C112H114FeN16O9.
Вычислено, N 11,89.
П р и м е р 8. Тетра-3,3",6,6"-гексилокси-ди-4'4"'(трет-бутил)-фталоцианин железа (VIII). Смесь 0,24 г 4-(трет-бутил)-фталодинитрила, 0,30 г 3,6-дигексоксифталодинитрила, 0,24 г сухой мочевины, 0,13 г в безводного дибромида железа и каталитическое количество молибдата аммония нагревают в течение 40 мин при 260оС, охлаждают, комплекс растворяют в бензоле и хроматографируют на окиси алюминия бензолом, а затем этанолом, собирая вторую (этанольную) фракцию. Растворитель упаривают, сухой остаток промывают водой, 50% -ным этанолом, после чего комплекс экстрагируют гексаном, растворитель упаривают, остаток растворяют при нагревании в пиридине, высаживают водой, отфильтровывают, сушат и получают 0,08 г (17%) дипиридината соединения (VIII).
Найдено, N 11,86.
C74H82FeN10O4.
Вычислено, N 11,38.
В качестве лейкосоединений используют следующие соединения: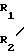 N
N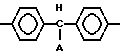 N
N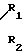
где R1=R2=C2H5; A  (IX)
(IX)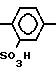 SO3H (XIV)
SO3H (XIV)
R1=R2=CH3; A 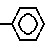 (X)
(X) 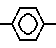 N (CH3)2 (XI);
N (CH3)2 (XI);
R1=C2H5; A CH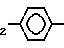 SO3H A
SO3H A 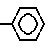 (XII);
(XII);
R1=C2H5; R2 -CH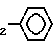 A
A 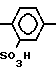 SO3H (XIII)
SO3H (XIII)
В таблице приведены условия проведения эксперимента. Примеры 10-17 проведены аналогично примеру 9.
П р и м е р 9. Получение красителя основного ярко-зеленого. В колбу помещают 0,0021 г катализатора (I), 0,69 мл концентрированной соляной кислоты, 19,3 мл этилового спирта и перемешивают до растворения катализатора. К полученному раствору прибавляют 0,772 г лейкооснования основного ярко-зеленого (IX), перемешивают до получения прозрачного раствора, к которому затем добавляют 0,37 мл 33%-ной перекиси водорода. Выход красителя, определенный по оптической плотности раствора в максимуме полосы поглощения при 630 нм, составляет 98%
П р и м е р 18. Получение красителя основного ярко-зеленого. В колбу помещают 0,11 г катализатора (IV), 5,5 мл концентрированной соляной кислоты, 74 мл этилового спирта и перемешивают до полного растворения катализатора. К раствору катализатора прибавляют 5,0 г лейкооснования основного ярко-зеленого (IX), перемешивают до получения прозрачного раствора, охлаждают до 0-5оС, после чего при перемешивании прибавляют 6,0 мл 22%-ной перекиси водорода. Реакционную смесь выдерживают 30 мин, этиловый спирт отгоняют под вакуумом, из остатка выделяют 5,7 г (90%) красителя основного ярко-зеленого в виде оксалата. Полученный краситель по своим колористическим свойствам близок к стандартному образцу.
П р и м е р 19. Получение красителя основного ярко-зеленого. В колбу помещают 0,171 г катализатора (IV), 27 мл концентрированной соляной кислоты, 555 мл этилового спирта и перемешивают до полного растворения катализатора. К раствору катализатора прибавляют 28,4 г лейкооснования основного ярко-зеленого (IX), перемешивают до получения прозрачного раствора, охлаждают до 0-5оС, после чего при перемешивании прибавляют 19,7 мл 24,5%-ной перекиси водорода. Реакционную смесь выдерживают 1 ч, этиловый спирт отгоняют под вакуумом, из остатка выделяют 30,5 г (85%) красителя основного ярко-зеленого в виде оксалата. Полученный краситель по своим колористическим свойствам соответствует стандартному образцу.
П р и м е р 20. Получение красителя малахитового зеленого.
В колбу помещают 0,0008 г катализатора (IV), 0,34 мл концентрированной соляной кислоты, 9,7 мл этилового спирта и перемешивают до полного растворения катализатора. К раствору катализатора прибавляют 0,33 г лейкооснования малахитового зеленого (Х), перемешивают до получения прозрачного раствора, после чего прибавляют 0,15 мл 27%-ной перекиси водорода. Выход красителя определяют по оптической плотности раствора в максимуме полосы поглощения малахитового зеленого при 621 нм, выход 98%
П р и м е р 21. Получение красителя кристаллического фиолетового. В колбу помещают 0,0008 г катализатора (IV) 0,34 мл концентрированной соляной кислоты, 9,7 мл этилового спирта и перемешивают до полного растворения катализатора. К раствору катализатора прибавляют 0,373 г лейкооснования кристаллического фиолетового (ХI), перемешивают до получения прозрачного раствора, после чего по каплям прибавляют 0,20 мл 27%-ной перекиси водорода. Выход красителя определяют по оптической плотности раствора в максимуме полосы поглощения кристаллического фиолетового при 590 нм, выход 98%
П р и м е р 22. Получение красителя кислотного зеленого.
В колбу помещают 0,0079 г катализатора (IV), 1,38 мл концентрированной соляной кислоты, 40 мл этилового спирта и перемешивают до полного растворения катализатора, после чего прибавляют 40 мл воды и 2,4 г лейкооснования кислотного зеленого (XII). Смесь перемешивают при температуре 55оС до полного растворения лейкооснования, после чего реакционную массу охлаждают до комнатной температуры и добавляют к ней по каплям 1 мл 22%-ной перекиси водорода. По окончании реакции растворитель отгоняют под вакуумом, краситель высушивают под вакуумом при 80оС и получают 2,5 г (99%) красителя кислотного зеленого.
П р и м е р 23. Получение красителя кислотного голубого 0.
В колбу помещают 0,013 г катализатора (IV), 4 г триэтаноламина, 48 мл этилового спирта и перемешивают до полного растворения катализатора, после чего прибавляют 16 мл воды и 4,8 г лейкооснования кислотного голубого 0 (XIII). Смесь перемешивают до полного растворения лейкооснования, к полученному раствору прибавляют смесь, содержащую 16 мл этанола, 5,6 мл концентрированной соляной кислоты и 2 мл 21%-ной перекиси водорода, перемешивают еще 30 мин, после чего спирт отгоняют под вакуумом. К остатку прибавляют раствор соды до рН 7,4, краситель выделяют прибавлением 10%-ного раствора хлористого натрия. Получают 4,2 г (85%) красителя кислотного голубого 0.
П р и м е р 24. Получение красителя кислотного ярко-голубого 3.
В колбу помещают 0,027 г катализатора (IV), 0,9 г триэтаноламина, 12 мл этилового спирта и перемешивают до полного растворения катализатора, после чего прибавляют 4 мл воды и 0,55 г лейкооснования кислотного ярко-голубого 3 (XIV). Смесь перемешивают до полного растворения лейкооснования, к полученному раствору прибавляют смесь, содержащую 4 мл этанола, 1 мл концентрированной соляной кислоты и 0,13 мл 33%-ной перекиси водорода, перемешивают еще 30 мин, после чего спирт отгоняют под вакуумом. К остатку прибавляют раствор соды до рН 7,4, краситель выделяют прибавлением 10%-ного раствора хлористого натрия. Получают 0,49 г (86%) красителя кислотного ярко-голубого 3.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПУРИНОВЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ ТИРОЗИНПРОТЕИНАЗЫ SYK | 2000 |
|
RU2248977C2 |
| АМИНО-ИМИННЫЙ МЕТАЛЛОКОМПЛЕКС И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2827476C1 |
| ДИИМИННЫЙ МЕТАЛЛОКОМПЛЕКС, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2833273C1 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛАЛКИЛПИПЕРАЗИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2243970C1 |
| КРАСЯЩЕЕ ВЕЩЕСТВО | 2010 |
|
RU2450038C1 |
| АМИДЫ N-СУЛЬФОНИЛ- И N-СУЛЬФИНИЛАМИНОКИСЛОТ В КАЧЕСТВЕ МИКРОБИЦИДОВ | 1995 |
|
RU2140411C1 |
| ГАЛОГЕНСЕРЕБРЯНЫЙ ФОТОГРАФИЧЕСКИЙ МАТЕРИАЛ | 1997 |
|
RU2126166C1 |
| ФАРМАЦЕВТИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЫ СЕМЕЙСТВА ТАМ | 2016 |
|
RU2750727C2 |
| СМЕСИ КРАСИТЕЛЕЙ, ХИМИЧЕСКИ АКТИВНЫХ ПО ОТНОШЕНИЮ К ВОЛОКНАМ, И ИХ ИСПОЛЬЗОВАНИЕ В СПОСОБЕ ДВУХ- ИЛИ ТРЕХЦВЕТНОГО КРАШЕНИЯ ИЛИ НАБИВКИ | 2011 |
|
RU2557569C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ БИАРИЛМОЧЕВИН И ИХ АНАЛОГОВ | 2006 |
|
RU2431630C2 |
Сущность изобретения: получение триарилметановых красителей осуществляют путем каталитического окисления соответствующих лейкооснований перекисью водорода в присутствии вновь синтезированных замещенных фталоцианина железа тетракис-4-[бис-(2-оксиэтил)-сульфамоил] фталоцианина железа или тетракис-4-(дибутилсульфамоил) фталоцианина железа, или тетра-4-(фенилсульфонил) фталоцианина железа, или трис-4-[(2-оксиэтил)сульфамоил] фталоцианина железа, или трис-4-(дибутилсульфамоил) фталоцианина железа, или тетра-3-нитро-тетра-5-(трет. -бутил) фталоцианина железа, или тетра- 3,3II, 6,6II, гексоксифталоцианина железа, или тетра- 3,3II, 6,6II, гексокси-ди- 4I, 4III (трет.-бутил) фталоцианина железа. 2 с. п. ф-лы, 1 табл.
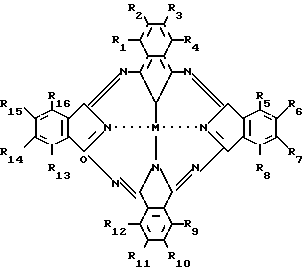
где R1 (R3 R5) (R7 R8) (R11 R13) R15 R16 H;
R2 R6 R10 R14 SO2N(CH2CH2OH)2(I); SO2N(C4H9)2(II); SO2C6H5(III); R1 R3 R4 R5 R7 R8 R9 (R11 R16) H;
R2 R6 R10 SO2N(CH2CH2OH)2(IV); SO2N(C4H9)2(V);
R2= R4 R6 R8 R10 R12 R14 R16 H; R1 R5 R9 R13 NO2;
R3 R7 R11 R15 C(CH3)3(VI);
R2 R3(R5 R8) R10 R11 (R13 R16) H; R1 R4 R9 R12 OC6H11(VII); R2 R3 R5 R7 R8 R10 R11 R13 R15 R16 H;
R1 R4 R9 R12 OC6H11; R6 R14 - C(CH3)(VIII);
в качестве катализатора окисления лейкосоединений триарилметановых красителей.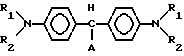
где R1 алкил;
R2 алкил, незамещенный или замещенный бензил;
А незамещенный или замещенный фенил,
в среде органического растворителя в присутствии комплексного соединения переходного металла в качестве катализатора, отличающийся тем, что окисление проводят перекисью водорода, а в качестве катализатора используют замещенное фталоцианина железа общей формулы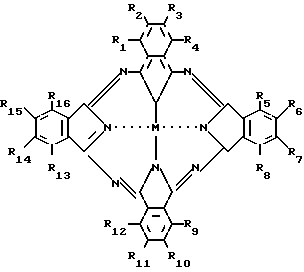
где R1 (R3 R5) (R7 R9) (R11 R13) R15 R16 H;
R2 R5 R10 R14 SO2N(CH2CH2OH)2 (I); SO2N(C4H9)2 (II), SO2C6H5 (III);
R1 R3 R4 R5 R7 R9 (R11 R16) H;
R2 R5 R10 SO2N(CH2CH2OH)2 (IV); SO2N(C4H9)2 (V);
R2 R4 R6 R8 R10 R12 R14 R16 H;
R1 R5 R9 R13 NO2;
R3 R7 R11 R15 C(CH3)3 (VI);
R2 R3 (R5 R8) R10 R11 (R13 R16) - H;
R1 R4 R9 R12 O(C6H11) (VII);
R2 R3 R5 R7 R8 R10 R11 R13 R15 R16 H;
R1 R4 R9 R12 OC6H11; R6 R14 C(CH3)3 (VIII).
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Патент США N 3828071, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-10-10—Публикация
1993-03-24—Подача