Изобретение относится к новым полусинтетическим макролидным антибиотикам азалидного ряда, в частности к 0-метильным производным азитромицина А и их пригодным для фармацевтического применения солям, а также к способу получения этих соединений и промежуточным продуктам для этой цели, к их использованию в производстве лекарственных средств, особенно антибактериальных препаратов.
Эритромицин А представляет собой макролидный антибиотик, химическая структура которого характеризуется наличием 14-членного агликонового кольца с кето-группой в положении С-9 (K. L. Bunch c cоавторами, патент США N 2653899, 9/153). До настоящего времени этот макролидный антибиотик является одним из основных лекарственных препаратов для лечения инфекционных заболеваний у человека. Однако в кислой среде этот антибиотик быстро превращается в ангидроэритромицин, представляющий собой неактивный С-6/С-12 метаболит со спирокетальной структурой (Kurath P. et al. Eхреrientia, 1971, 26, 362). Известно, что спироциклизация эритромицина А эффективно ингибируется посредством химической трансформации С-9 кетона при получении С-9 оксима (Djokic S. et al Tetrahedron Lett, 1967, 1945) или С-9 (R) и С-9 (S) аминов (Еgan R. J. Org. Сhem. 1974, 39, 2492) или посредством элиминирования С-9 кетона при расширении агликонового кольца (Kobrehel G. еt al. патент США N 4328334, 5/1982). В результате перестройки Бекманна в оксиме эритромицина А с последующим восстановлением образующегося иминового эфира (Djokic S et al. J. Сhem. Soc. Perkin. Trans 1, 1, 1986, 1881) происходило формирование 11-аза-10-дезоксо-10-дигидроэритромицина А (9-дезоксо-9а- аза-9а-гомоэритромицина А), который стал первым 15-членным макролидным антибиотиком азалидного ряда. В результате метилирования вновь введенной вторичной аминогруппы в агликоновое кольцо формальдегидом в присутствии муравьиной кислоты с помощью модифицированного метода Еschweiler-Сlark Kobrehel G, Djokic S. Бельгийский патент N 892357, 7/1982) или после предварительной защиты аминогрупп путем их превращения в соответствующие N-оксиды с последующим алкилированием и восстановлением этих N-оксидов (Bright, патент США N 4474768, 10/1984) был получен N-метил-11-аза-10-дезоксо-10- дигидроэритромицин А (9-дезоксо-9а-аза-9а-метил-9а-гомоэритромицин А, Номенклатура по органической химии I UPAC, 1979, 68-70, 549, 500-503), который проходит клинические испытания под незапатентованным названием азитромицин. В сравнении с исходным антибиотиком азитромицин, помимо повышенной стабильности в кислой среде, характеризуется более выраженной активностью по отношению к грамотрицательным микроорганизмам in vitro и более высокой концентрацией в тканях. Оценивается даже возможность его применения в разовой суточной дозе (Katshema J. et al, Antimicrob. Agents Chemother, 1987, 31, 1939).
Известно также, что С-6/С-12 cпирокристаллизация эритромицина А эффективно подавляется посредством 0-метилирования гидроксильной группы в положении С-6 агликонового кольца (Watanabe У. et al. патент США N 4331803, 5/1982). Реакция эритромицина А с бензилхлороформом и последующее метилирование образующегося при этом 2'-0,3'-N-бис(бензилоксикарбонильного) производного при удалении защитной группы в положениях 2'- и 3'-, а также N-метилирование 3'-метил-аминогруппы в условиях восстановления, приводили к образованию больших количеств 11-0-метилированного и 6, 11-ди-0-метилированного эритромицина А, помимо 6-0-метилированного эритромицина А (Morimoto S. et al. J. Antibiot. 1984, 37, 187). Более высокая степень избирательности достигается посредством предварительного оксимирования С-9 кетонов и 0-метилирования соответствующих замещенных и незамещенных бензилоксиминовых производных (Morimoto S. et al. патент США N 4680368, 7/1987). 6-0-метилированный эритромицин А проходит клинические испытания под непатентованным названием кларитромицин. В сопоставлении с эритромицином А кларитромицин характеризуется более высокой активностью по отношению к грамположительным микроорганизмам in vitro (Kirist H. А. еt. аl. Аntimicrobial Agents and Chemother. 1989, 1419).
Проведенный заявителем поиск не выявил изобретений, касающихся 0-метильных производных азитромицина А.
Таким образом предметом изобретения являются новые 0-метильные производные азитромицина формулы (I), а также пригодные для фармацевтического применения их соли.
Кроме того предметом изобретения является способ получения 0-метильных производных азитромицина А формулы I и их пригодных для фармацевтического применения солей, согласно которому азитромицин или его дигидрат (Djokic S. et al. J. Chem, Res. (S), 1988, 1239-12621 (М) 1988, 1239 -12621) формулы II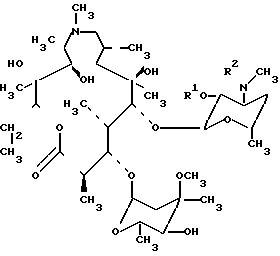 в которой IIa R1 H, R2 СH3, реагирует с бензилхлороформиатом в присутствии избыточного количества подходящего основания, например бикарбоната натрия, в инертном растворителе, например в бензоле, при 25-60оС в течение 3-24 ч в зависимости от температуры реакции с последующим метилированием гидроксильных групп в положениях С-6, С-11 и С-4" нового, еще не описанного промежуточного продукта 2'-03' и N-бис (бензилоксикарбонил)-N-диметилазитромицина А формулы II, в котором IIb R1 R2 СО2СН2С6Н5, 1-18-кратным избыточным количеством соответствующего метилирующего агента, например метил-йодида, диметилсульфата, метил-метан-сульфоната или метил-р-толуолсульфоната, в присутствии соответствующего основ ания, например гидрида натрия, водной гидроокиси калия или гидроокиси натрия, в соответствующем растворителе, например в диметилсульфоксиде или N,N-диметилформамиде, или в их смесях с инертным растворителем, например с тетрагидрофураном, ацетонитрилом, этилацетатом, 1,2-диметоксиэтаном, при температуре от 0оС до комнатной в течение 3-30 ч с образованием смеси 0-метил-2'-0,3'-N-бис-(бензилоксикарбонил)-N-деметил-азитромицина А формулы (I), в котором Ia R1 R2 CO2CH2C6H5, R5 СН3, R4 R5 H Ib R1 R2 CO2CH2C6H5, R5 R4 CH3, R5 H Ic R1 R2 CO2CH2C6H5, R3 R5 H, R4 CH3 Id R1 R2 CO2CH2C6H6, R3 R4 R5 CH3 которую в случае необходимости подвергают:
в которой IIa R1 H, R2 СH3, реагирует с бензилхлороформиатом в присутствии избыточного количества подходящего основания, например бикарбоната натрия, в инертном растворителе, например в бензоле, при 25-60оС в течение 3-24 ч в зависимости от температуры реакции с последующим метилированием гидроксильных групп в положениях С-6, С-11 и С-4" нового, еще не описанного промежуточного продукта 2'-03' и N-бис (бензилоксикарбонил)-N-диметилазитромицина А формулы II, в котором IIb R1 R2 СО2СН2С6Н5, 1-18-кратным избыточным количеством соответствующего метилирующего агента, например метил-йодида, диметилсульфата, метил-метан-сульфоната или метил-р-толуолсульфоната, в присутствии соответствующего основ ания, например гидрида натрия, водной гидроокиси калия или гидроокиси натрия, в соответствующем растворителе, например в диметилсульфоксиде или N,N-диметилформамиде, или в их смесях с инертным растворителем, например с тетрагидрофураном, ацетонитрилом, этилацетатом, 1,2-диметоксиэтаном, при температуре от 0оС до комнатной в течение 3-30 ч с образованием смеси 0-метил-2'-0,3'-N-бис-(бензилоксикарбонил)-N-деметил-азитромицина А формулы (I), в котором Ia R1 R2 CO2CH2C6H5, R5 СН3, R4 R5 H Ib R1 R2 CO2CH2C6H5, R5 R4 CH3, R5 H Ic R1 R2 CO2CH2C6H5, R3 R5 H, R4 CH3 Id R1 R2 CO2CH2C6H6, R3 R4 R5 CH3 которую в случае необходимости подвергают:
А) разделению на колонках из силикагеля (силикагель 60, 70-230 меш, компании Мерк) в системе растворителей СН2Сl2(CH3OH) NH4OН (90:9:0,5) c образованием хроматографически гомогенных соединений (Iа) c Rf 0,660, (Iв) c Rf 0,811, (Ic) с Rf 0,843 и (Iд) с Rf 0,881, в которых затем элиминирую защитные бензилоксикарбонильные группы в положениях 2'- и 3'- посредством гидрогенолиза в растворе низкоатомного спирта, например метанола или этанола, в присутствии катализатора, например палладия черного или палладия на углероде, в атмосфере водорода при давлении 1-20 бар при непрерывном перемешивании реакционной смеси, на протяжении 2-10 ч, при комнатной температуре с образованием (после фильтрации для удаления катализатора и выделения продукта посредством обычных методов экстракции в градиенте рН (рН 5,0 и рН 9,0) из воды соответствующим гидрофобным растворителем, например хлороформом, этилацетатом и т.п.) 0-метил-N-деметил-азитро- мицина А в форме производных формулы (I), в которых
Ie R1 R2 R4 R5 H, R3 СH3
If R1 R2 R5 H, R3 R4 CH3
Ig R1 R2 R3 R5 H, R4 CH3
Ih R1 R2 H, R3 R4 R5 CH3 и которые затем подвергают восстановительному N-метилированию по 3'-метиламиногруппе 1-3-кратными эквивалентными количествами формальдегида (37%) в присутствии равного или удвоенного количества муравьиной кислоты (98-100%) или иного источника водорода в инертном растворителе из числа галогенизированных углеводородов, таких как хлороформ, или низкоатомных спиртов, таких как метанол или этанол, низкоатомных кетонов, таких как ацетон, в условиях противотока при возгонке реакционной смеси, в течение 2-8 ч с образованием после выделения продукта с помощью обычных методов экстракции в градиенте рН (рН 5,0 и рН 9,0), 0-метил-азитромицина А в форме производных формулы (I), в которых
Ii R1 R4 R5 H, R2 R3 CH3
Ij R1 R5 H, R2 R3 R4 CH3
Ik R1 R3 R5 H, R2 R4 CH3
Il R1 H, R2 R3 R4 R5 CH3 или Б) элиминированию защитной бензилоксикарбонильной группы в 2'- и 3'-положениях посредством гидрогенолиза, как описано в пункте А, с образованием смеси 6-0-метил-(Ie), 6,11-ди-0-метил-(If), 11-0-метил-(Ig) и 6,11,4''-три-0-метил-II-деметил-(Ih) азитромицинов А, которую подвергают восстановительному N-метилированию формальдегидом (37%) в присутствии муравьиной кислоты (98-100%) или некоторых других источников водорода, как описано в пункте А, с образованием смеси 6-0-метил-(Ii), 6,11-ди-0-метил (Ij), II-0-метил-(Iк) и 6,11,4''-три-0-метил-(II)-азитромицинов А, которую разделяют на колонке из силикагеля в системе растворителей CH2Cl2/CH3OH/NH4OН (90:9:0,5), с образованием хроматографически гомогенных (тонкослойная хроматография в той же системе растворителей) 0-метильных производных азитромицина А (Ii) c Rf 0,34 6, (Ij) c Rf 0,393 (Iк) с Rf 0,428 и (II) с Rf 0,456.
Пригодные для фармацевтических целей соли соединений формулы I получают в процессе взаимодействия 0-метильных производных азитромицина А (I) по крайней мере с эквимолярными концентрациями соответствующих органических и неорганических кислот, например из числа хлористого водорода, йодистого водорода, серной кислоты, фосфорной кислоты, уксусной кислоты, пропионовой кислоты, трифторуксусной кислоты, малеиновой кислоты, лимонной кислоты, янтарной кислоты, этилянтарной кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты, р-толуолсульфоновой кислоты, лаурилсульфоновой кислоты и т. п. в инертном растворителе. Соли выделяют посредством фильтрации, если они нерастворимы в используемом инертном растворителе, или посредством осаждения (наиболее часто с использованием лиофилизации) отличающимся от растворителя соединением.
0-метилированные производные азитромицина А формулы (Ii) (II) и их пригодные для фармацевтического применения соли обладают высокой антибактериальной активностью. Предварительное определение противобактериальной активности 6-0-метилазитромицина А(Ii) проводили in vitrо на нескольких видах грамположительных и грамотрицательных микроорганизмов, а также на выделенных в клинических условиях возбудителях, в сопоставлении с аналогичной активностью эритромицина А. Определения проводили методом "разведения в пробирках". При этом использовали "мозговой питательной бульон", стандартные штаммы микроорганизмов и штаммы, свежеизолированные из клинического материала. Результаты пересчитывали на минимальную ингибирующую концентрацию или на бактерицидную концентрацию (соответственно МИК и МБК, в мкг/мл). Эти данные, представленные в табл. 1 и 2, свидетельствуют о том, что 6-0-метилазитромицин А характеpизируется несколько более высокой активностью по отношению к изученным штаммам микроорганизмов по сравнению с эритромицином А.
В табл. 3 представлены результаты тестирования 6-0-метил-(Ii),6,11-ди-0-метил-(Ij), 11-0-метил-(Iк) и 6,11,4''-0-метил-(Ie) азитромицина А в сопоставлении с азитромицином. Определение минимальных ингибирующих концентраций (МИК, мкг/мл) на серии стандартных бактериальных штаммов показало, что 6-0-метилазитромицин А (Ii) в два раза более активен по отношению к Bacillus subtilis NCТС 8241 и Sarcina lutea АТСС 9341 и в 4 раза более активен по отношению к Micrococcus flavus AТСС 6538 Р нежели азитромицин. Активность 11-0-метил-азитромицина А (Iк) также была значительно выше, чем у азитромицина, поскольку большинство исследованных штаммов микроорганизмов были в 2-4 раза более чувствительны к действию этого производного по сравнению с исходным материалом.
Также предметом изобретения являются лекарственные формы, обеспечивающие эффективную и в то же время физиологическую дозировку новых соединений согласно изобретению. Препараты (Ii)-(II) и их пригодные для фармацевтического применения соли могут использоваться в качестве терапевтических средств при лечении инфекционных заболеваний человека и животных, вызванных грамположительными бактериями, микоплазмами и патогенными микроорганизмами, обладающими чувствительностью к этим препаратам (Ii)-(II). Эти препараты и их пригодные для фармацевтического использования соли можно вводить перорально или парэнтерально, в частности в форме подкожных или внутримышечных инъекций, в виде таблеток, капсул, порошков, и т.п. которые получают общепринятыми в фармацевтической практике методами.
П р и м е р 1. 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметилазитромицин А (IIв).
Способ А.
48 г NaHCO3 вводят в раствор дигидрата азитромицина (30 г, 0,038 моля) в 140 мл сухого бензола и нагревают полученную смесь, перемешивая при 55-60оС, после чего по каплям добавляют в нее 75 мл бензилхлороформиата (89,63 г, 0,53 моля) на протяжении часа. Реакционную смесь непрерывно перемешивают при указанной температуре в течение 3 ч, после чего оставляют на ночь при комнатной температуре. Бензольную суспензию трижды экстрагируют 150 мл 0,25 н. НСl, полученный бензольный раствор упаривают над СаСl2, фильтруют и снова упаривают при пониженном давлении в густое масло. Полученный остаток по каплям добавляют в 500 мл охлажденного петролейного эфира при непрерывном перемешивании, суспензию продолжают перемешивать на холоде в течение 4 ч, осадок отфильтровывают, промывают петролейным эфиром и высушивают, получая 27,5 г (71,6%) искомого продукта, который после перекристаллизации из смеси эфира с петролейным эфиром имеет точку плавления 148-154оС. ЕI-MS m/s 1003 (М+)
ТLC, СH2Cl2(CH3OН)NH4OН (90:9:0,5) Rf 0,704
IR (СHCl3): 3510, 3350, 2960, 1740, 1690, 1605, 1450, 1380, 1330, 1290, 1255, 1160, 1115, 1050, 995 см-1
1НNMR(CDCl3): 2,201 (3Н, 9а-NCH3), 2,844, 2,802 (3Н, 3'-NCH3), 3,397 (3Н, 3''-OCH3).
13СNMR(CDCl3): 177,260 (С-1), 100,115 (С-1'), 95,149 (С-1''), 75,028 (С-6), 74,607 (С-12), 69,415 (С-9), 64,617 (С-10), 36,964 (9а-NCH3) аnd 26.016 (С-8) ррm
Cпособ Б. 22 г NaHCO3 добавляют в раствор бензилхлороформиат (30 мл, 0,21 моля) в 50 мл сухого бензола при непрерывном перемешивании. Затем постоянно на протяжении 3 ч в полученную смесь добавляют 15 г азитромицина (0,019 моля). После добавления 3/4 общего количества азитромицина в систему вводят еще 15 мл (0,106 моля) бензилхлорофоpмиата. Реакционную смесь оставляют на 24 ч при комнатной температуре в условиях непрерывного перемешивания, фильтруют, фильтрат трижды экстрагируют 15 мл 0,25 н. НСl, высушивают над MgSO4 и упаривают при пониженном давлении. Добавление петролейного эфира приводят к осаждению неочищенного 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил-азитромицина А, который отфильтровывают и сразу же суспендируют в 50 мл охлажденного эфира при непрерывном перемешивании. Суспензию продолжают перемешивать при комнатной температуре на протяжении 1 ч, осадок отфильтровывают и высушивают. Выход гомогенного (по данным тонкослойной хроматографии) конечного продукта составляет 8,67 г (43,09%). Продукт имеет те же физико-химические свойства, что и при получении по способу А.
П р и м е р 2. 0-метилирование 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил-азитромицин А (Iа, Iв, Ic и Iд).
Способ А. 6 мл (0,106 моля) метилированного йода добавляют в раствор продукта, полученного, как описано (6 г, 0,006 моля), в 64 мл диметилсульфоксида с тетрагидрофураном (1:1). После этого в полученную смесь добавляют еще 6,6 мл (0,106 моля) метилированного йода, а затем, постепенно 2,4 г (приблизительно 0,06 моля) NaH (55-60%) в масле при комнатной температуре. Реакционную смесь оставляют при непрерывном перемешивании на 5 ч, затем инкубируют в течение ночи и переливают в насыщенный раствор NaCl (100 мл) и дважды экстрагируют 100 мл этилацетата. Объединенные органические экстракты трижды отмывают 100 мл насыщенного раствора NaCl, высушивают над K2CO3 и упаривают, получая 6,35 г неочищенного искомого продукта. Последний подвергают гидрогенолизу, как описано в примере 9, или в случае необходимости очищают посредством хроматографии на колонке из силикагеля (силикагель 60, 70-230 меш, компании Мерк с использованием системы растворителей СH2Cl2(CH3OН)NH4OH (90:9:0,5).
Посредством концентрации и упаривания фракций Rf 0,881 (тонкослойная хроматография в идентичной системе растворителей) из 1,5 г неочищенного продукта получают 0,12 г хроматографически чистого 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил -6,11,4''-три-0-метил-азитромицина А (Iд):
IHNMR(CDCl3): 2,246 (3Н, 9а-NCH3), 2,831, 2,798 (3Н, 3'-NCH3), 3,367 (3Н, 3''-ОСH3), 3,305 (3Н, 6-ОМе), 3,465 (3Н, 4''-OCH3), and 3,485 (3Н, 11-OCH3) ppm.
13СNMR(CDCl3): 176,975 (С-I), 69,920 (С-9), 35,967 (9а-NCH3), 79,1 (С-6) 52,8 (6-OCH3), 89,0 (С-II), 62,0 (II-OCH3), 87,357 (С-4''), 61,131 (4''-OCH3), 49,176 аnd 49,526 (3''-OCH3) and 36,457 (3'-NCH3) ppm. протяжении часа. Реакционную смесь непрерывно перемешивают при указанной температуре в течение 3 ч, после чего оставляют на ночь при комнатной температуре. Бензольную суспензию трижды экстрагируют 150 мл 0,25 н. НСl, полученный бензольный раствор упаривают над СаСl2, фильтруют и снова упаривают при пониженном давлении в густое масло. Полученный остаток по каплям добавляют в 500 мл охлажденного петролейного эфира при непрерывном перемешивании, суспензию продолжают перемешивать на холоде в течение 4 ч, осадок отфильтровывают, промывают петролейным эфиром и высушивают, получая 27,5 г (71,6%) искомого продукта, который после перекристаллизации из смеси эфира с петролейным эфиром имеет точку плавления 148-154оС. ЕI-MS m/s 1003 (М+)
ТLC, СH2Cl2(CH3OН)NH4OН (90:9:0,5) Rf 0,704
IR (СHCl3): 3510, 3350, 2960, 1740, 1690, 1605, 1450, 1380, 1330, 1290, 1255, 1160, 1115, 1050, 995 см-1
1НNMR(CDCl3): 2,201 (3Н, 9а-NCH3), 2,844, 2,802 (3Н, 3'-NCH3), 3,397 (3Н, 3''-OCH3).
13СNMR(CDCl3): 177,260 (С-1), 100,115 (С-1'), 95,149 (С-1''), 75,028 (С-6), 74,607 (С-12), 69,415 (С-9), 64,617 (С-10), 36,964 (9а-NCH3) аnd 26.016 (С-8) ррm
Cпособ Б. 22 г NaHCO3 добавляют в раствор бензилхлороформиат (30 мл, 0,21 моля) в 50 мл сухого бензола при непрерывном перемешивании. Затем постоянно на протяжении 3 ч в полученную смесь добавляют 15 г азитромицина (0,019 моля). После добавления 3/4 общего количества азитромицина в систему вводят еще 15 мл (0,106 моля) бензилхлорофоpмиата. Реакционную смесь оставляют на 24 ч при комнатной температуре в условиях непрерывного перемешивания, фильтруют, фильтрат трижды экстрагируют 15 мл 0,25 н. НСl, высушивают над MgSO4 и упаривают при пониженном давлении. Добавление петролейного эфира приводит к осаждению неочищенного 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил-азитромицина А, который отфильтровывают и сразу же суспендируют в 50 мл охлажденного эфира при непрерывном перемешивании. Суспензию продолжают перемешивать при комнатной температуре на протяжении 1 ч, осадок отфильтровывают и высушивают. Выход гомогенного (по данным тонкослойной хроматографии) конечного продукта составляет 8,67 г (43,09%). Продукт имеет те же физико-химические свойства, что и при получении по способу А.
П р и м е р 2. 0-метилирование 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил-азитромицин А (Iа, Iв, Ic и Iд).
Способ А. 6 мл (0,106 моля) метилированного йода добавляют в раствор продукта, полученного, как описано (6 г, 0,006 моля), в 64 мл диметилсульфоксида с тетрагидрофураном (1:1). После этого в полученную смесь добавляют еще 6,6 мл (0,106 моля) метилированного йода, а затем, постепенно 2,4 г (приблизительно 0,06 моля) NaH (55-60%) в масле при комнатной температуре. Реакционную смесь оставляют при непрерывном перемешивании на 5 ч, затем инкубируют в течение ночи и переливают в насыщенный раствор NaCl (100 мл) и дважды экстрагируют 100 мл этилацетата. Объединенные органические экстракты трижды отмывают 100 мл насыщенного раствора NaCl, высушивают над K2CO3 и упаривают, получая 6,35 г неочищенного искомого продукта. Последний подвергают гидрогенолизу, как описано в примере 9, или в случае необходимости очищают посредством хроматографии на колонке из силикагеля (силикагель 60, 70-230 меш, компании Мерк с использованием системы растворителей СH2Cl2(CH3OН)NH4OH (90:9:0,5).
Посредством концентрации и упаривания фракций Rf 0,881 (тонкослойная хроматография в идентичной системе растворителей) из 1,5 г неочищенного продукта получают 0,12 г хроматографически чистого 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил -6,11,4''-три-0-метил-азитромицина А (Iд):
IHNMR(CDCl3): 2,246 (3Н, 9а-NCH3), 2,831, 2,798 (3Н, 3'-NCH3), 3,367 (3Н, 3''-ОСH3), 3,305 (3Н, 6-ОМе), 3,465 (3Н, 4''-OCH3), and 3,485 (3Н, 11-OCH3) ppm.
13СNMR(CDCl3): 176,975 (С-I), 69,920 (С-9), 35,967 (9а-NCH3), 79,1 (С-6) 52,8 (6-OCH3), 89,0 (С-II), 62,0 (II-OCH3), 87,357 (С-4''), 61,131 (4''-OCH3), 49,176 аnd 49,526 (3''-OCH3) and 36,457 (3'-NCH3) ppm.
После объединения и упаривания фракций с Rf 0,843, получают 0,32 г хроматографически чистого 2'-0,3'-N-бис(бензилоксикарбонил)-N- диметил-II-0-метил- азитромицина А (I c):
ЕI-MS m/s 1016 (М+)
IH NMR (CDCl3): 2,239 (3Н, 9а-NCH3) 2,805, 2,847 (3Н, 3'-NCH3), 3,374 (3Н, 3''-OCH3) and 3,573 (3H, II-OCH3) ppm.
После упаривания фракций с Rf 0,811 получают 0,316 г 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил-6,11-0-метилазитромицина А (Iв):
IR(CHCl3): 3570, 3490, 1740, 1690, 1455, 1380, 1330, 1295, 1260, 1200, 1160, 1120, 1095, 1055, 1005, 990, 980 сm-1.
IH NMR (CDCl3): 2,292 (3H, 9а-NCH3), 2,838, 2,795 (3Н, 3'NCH3) 3,380 (6H, 6-OCH3 and 3''-OCH3) and 3,488 (3Н, 11-OCH3) ppm.
13СNMR (CDCl3): 177,939 (С-1), 69,471 (С-9), 35,271 (9а-NCH3), 88,994 (С-II), 52,892 (6-OCH3), 61,09 (II-OCH3), 36,851 (3'-NCH3), and 49,549, 49,154 (3''-OCH3) ppm
После концентрирования и упаривания до сухого остатка фракций с Rf 0,661 получают 0,384 г 2'-0,3'-N-бис(бензилоксикарбонил) -N-деметил-6-0-метилазитромицина А (Iа):
ЕI-MS m/s 1016(M+)
IR(CHCl3): 3570, 3500, 2960, 2920, 1740, 1690, 1450, 1380, 1325, 1290, 1255, 1200, 1160, 1120, 1050, 995 cm-1.
IHNMR (CDCl3): 2,288 (3H, 9а-NCH3), 2,805, 2,847 (3Н, 3'-N-CH3)- 3,380 (6H, 6-OCH3 and 3''-OCH3) ppm.
Способ Б. В раствор продукта, полученного, как описано в примере 1 (6 г), в 60 мл диметилсульфоксида с тетрагидрофураном (I:I) постепенно добавляют метилированный йод (3 мл) и 2,1 г NaOH (55-60%), при непрерывном перемешивании в течение 2 ч при 0-5оС. Затем реакционную смесь перемешивают еще в течение часа при 0-5оС, полученную суспензию переливают в насыщенный раствор NaCl и экстрагируют этилацетатом. Органические экстракты отмывают насыщенным раствором NaCl, высушивают над K2CO3 и упаривают до сухого остатка при пониженном давлении. Конечный продукт (2 г) очищают посредством хроматографии на силикагеле в системе растворителей СH2Cl2(СН3OН)NH4OH (90:9:0,5) с выходом 0,89 г 6-0-метилпроизводного (Ia), 0,11 г 6,11-ди-0-метилпроизводного (Iв) и 0,48 г II-0-метилпроиз- водного (Ic).
Способ В. После добавления 6 мл метилированного йода в раствор продукта, полученного, как описано в примере 1, в N,N-диметилформамиде (6 г в 60 мл) в реакционную смесь постепенно вводят 2,4 г (55-60%) NaH, при непрерывном перемешивании на протяжении 2 ч при комнатной температуре. Затем перемешивание реакционной смеси продолжают в течение еще 2 ч при той же температуре, после чего оставляют ее на ночь. Продукт реакции выделяют, как описано в способе А, получая смесь (4,54 г) 6,11-ди-0-метилированного (Iв) и 6,11,4''-три-0-метилированного (Iд) производных. Эту смесь подвергают гидрогенолизу в метаноле (6 мл) в присутствии NaOAc/HOAc буфера (pН 5) и палладия на углероде (2 г, 5%) в качестве катализатора, как описано в примере 3.
После выделения продукта и упаривания растворителя при рН 9,0 получали смесь (2,33 г) 6,11-ди-0-метилазитрофицина А (If) c Rf 0,220 и 6,11,4''-три-0-метил-II-деметилазитромицина А (Ih) c Rf 0,263, которую разделяли на колонке из силикагеля в системе растворителей CH2Cl2(СH3OH)NH4OH (90:9:1), получая хроматографически чистые продукты (II) и (Iп).
П р и м е р 3. 6-0-метил-N-деметилазитромицин А (I е).
2,0 г (0,002 моля) 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил-6-0-метилазитромицина А (Iа) разводили в 30 мл этанола. В полученный раствор добавляли 10 мл воды, содержащей 0,185 мл уксусной кислоты и 0,3 г уксуснокислого натрия (рН 5), а также 0,7 г палладия на углероде (10%). Реакционную смесь перемешивали при пониженном давлении (10 бар) на протяжении 10 ч, катализатор удаляли фильтрованием и упаривали смесь до сухого остатка. Последний растворяли в СНСl3 (30 мл), добавляли воду (30 мл), доводили рН до 5,0 добавляли 1 н. НСl, разделяли отдельные слои и водный слой экстрагировали дважды СНСl3 (оба раза по 15 мл).
В реакционную смесь вводили CHCl3 (30 мл), рН доводили до 9,0, доливая при помешивании 2 н. NaOН, разделяли отдельные слои и снова экстрагировали водный слой СНСl3 (дважды по 15 мл). Объединенные органические экстракты (рН 9,0) сушили над K2CO3, фильтровали и упаривали, получая 1,03 г (70%) искомого продукта.
ЕI-MS m/s 748
TLC, Rf 0,182
IR(CHCl3): 3670, 3500, 2960, 2920, 1725, 1460, 1375, 1345, 1320, 1280, 1260, 1165, 1120, 1085, 1045, 1010, 995, 900 сm-1
1HNMR (CDCl3): 2,278 (3Н, 9а-NCH3), 2,406 (3H, 3'-NCH3), 3,312 (3H, 3''-OCH3), 3,384 (3H, 6-ОСH3) ppm
П р и м е р 4. 6,11-ди-0-метил-N-деметилазитромицин А (If).
Следуя процедуре, описанной в примере 3, посредством гидрогенолиза с использованием палладия на углероде (10%) в этаноле, в присутствии буферного раствора (уксуснокислый натрий/уксусная кислота, рН 5,0) из 0,165 г (0,16 моля) 2'-0,3'-N-бис(бензилоксикарбонил)-N-деметил-6,11-0-метилазитромицина А (Iв) получали 0,093 г (76,2%) хроматографически однородного 6,11-ди-0-метил-N-деметилазитромицина А с точкой плавления 95-98oС.
ЕI-MS m/s 762
TLC, Rf 0,331
1HNMR (CDCl3): 2,265 (3Н, 9а-СH3), 2,422 (3Н,3'-NCH3), 3,312 (3Н, 3''-OCH3), 3,374 (3H, 6-OCH3) and 3,521 (3H, N-OCH3) ppm
13CNMR(CDCl3): 177,7 (С-1), 65,9 (С-9), 36,8 (9а-NCH3), 79,3 (С-6), 88,9 (С-II), 52,7 (6-OCH3), 62,0 (II-OCH3), 33,1 (3'-NCH3), and 49,7 (3''-OCH3) ppm.
П р и м е р 5. 11-0-метил-N-деметилазитромицин А (Ig).
В соответствии с процедурой, описанной в примере 3, из 0,250 г (0,246 ммоля) 2'-0,3'-N-бис(бензилоксикарбонил)-N- деметил-II-0-метилазитромицина А (Ic) посредством гидрогенолиза в присутствии палладия на угле (10%) в метаноле и буферного раствора (уксусно-кислый натрий/уксусная кислота, рН 5,0) получали 0,168 г (89,5%) 11-0-метил-N-деметилазитромицина А (Ig).
ТLC, Rf 0,244
IR(CDCl3): 3500, 2970, 2940, 1736, 1460, 1380, 1165 см-1.
1HNMR (CDCl3): 2,44 (3H,9а-NCH3), 2,458 (3Н, 3'-NCH3), 3,336 (3Н, 3''-OCH3) and 3,590 (3H, II-OCH3) ppm.
13СNMR (CDCl3): 177,6 (С-1), 70,7 (С-9), 35,8 (9а-NCH3), 74,4 (С-6), 85,0 (С-II), 62,7 (11-OCH3), 36,7 (3'-NCH3) and 49,41(3''-OCH3) ppm.
П р и м е р 6. 6-0-метил-азитромицин А (Ii).
Способ А.
В раствор 0,78 г (0,00104 моля) 6-0-метил-N-деметилазитромицина А (Ie) в СНСl2 (50 мл) добавляли 0,085 мл (0,00113 моля) формальдегида (37%) и 0,078 мл (0,00203 моля) муравьиной кислоты (98-100%). Реакционную смесь в условиях противоточной перегонки перемешивали на протяжении 8 ч, затем охлаждали до комнатной температуры и переливали в 50 мл воды. После доведения рН реакционной смеси до 5,0 добавлением 1 н. НСl разделяли образующиеся слои и водный слой дважды экстрагировали СНСl3 (каждый раз по 20 мл). К водной фракции доливали СНСl3 (20 мл), рН доводили до 9,0 при непрерывном перемешивании с 2Н NaOH, образующиеся слои разделяли и водную фракцию снова дважды экстрагировали СНСl3 (по 20 мл). Объединенные экстракты СНСl3 (pН 9,0) подсушивали над K2CO3 и упаривали с выходом 0,495 г (62,74%) конечного продукта, который в случае необходимости дополнительно очищали на колонке из силикагеля в системе растворителей СH2CH2(CH3OH)NH4OH (90:9:0,5), получая хроматографически гомогенный материал (Ii) с точкой плавления 103-109оС.
ЕI-MS m/s 762
TLC, Rf 0,346
IR (Kbr): 3500, 2980, 2940, 1740, 1462, 1385, 1330, 1280, 1260, 1170, 1112, 1059, 1018 и 1055 сm-1
1HNMR (CDCl3): 2,300 (3Н, 9а-NCH3), 2,316 (6Н, 3'-N(CH3)2), 3,333 (3Н, 3''-OCH3) и 3,384 (3Н, 6-OCH3) ppm
13CNMR (CDCl3): 177,540 (С-1), 68,850 (С-9), 36,8 (9а-NCH3), 79,2 (С-6), 52,822 (6-ОСH3), 61,627 (С-10), 40,350 (3'-N(CH3)2) и 49,457 (3''-OCH3) ррm.
Биологическая активность: 1 мг содержит 754 мкг азитромицина.
Способ Б.
В раствор 0,5 г (0,668 ммоля) 6-0-метил-N-деметилазитромицина А в ацетоне (30 мл) добавляли 0,128 мл (1,71 ммоля) формальдегида (37%) и 0,118 мл (3,06 ммоля) муравьиной кислоты (98-100%). Полученную смесь перегоняли в противотоке на протяжении 2 ч. Затем ее охлаждали до комнатной температуры и упаривали ацетон, получая густой сироп. В последний добавляли 20 мл воды и посредством экстракции в градиенте рН метилхлоридом, как описано в способе А, выделяли конечный продукт с выходом 0,46 г (90,3%).
П р и м е р 7. 6,11-ди-0-метилазитромицин А (Ij).
В соответствии с процедурой, описанной в примере 6, из 0,49 г 6,11-ди-0-метил-N-деметилазитромицина А (II) посредством восстановительного N-метилирования формальдегидом (37% 0,083 мл) в присутствии муравьиной кислоты (98-100%) получали 0,46 г (92,3%) искомого продукта.
Еi-MS m/s 776 (М+)
TLC, Rf 0,391
1HNMR (CDCl3): 2,295 (3H, 9а-NCH3), 2,316 (6Н, 3'-N(CH3)2), 3,321 (3Н, 3''-OCH3) 3,38 (3H, 6-OCH3) и 3,524 (3H, 11-OCH3) ppm.
13CNMR (CDCl3): 177,540 (С-1), 68,237 (C-9), 36,739 (9а-NCH3), 88,112 (С-11), 52,653 (6-OCH3) и 61,852 (11-OCH3) ppm.
П р и м е р 8. 11-0-метилазитромицин А (Iк).
В соответствии с процедурой, описанной в примере 6, из 0,32 г (0,43 ммоля) 11-0-метил-N-деметилазитромицина А (Ig) посредством восстановительного метилирования формальдегидом (37% ) в присутствии муравьиной кислоты (98-100%) получали 0,238 г (72,44%) искомого производного 11-0-метилазитромицина А (Iк).
П р и м е р 9. 6-0-Метилазитромицин А (Ii), 6,11-ди-0-метилазитромицин А (Ij), 11-0-метилазитромицин А (Iк) b 6,11,4''-три-0-метилазитромицин А (II).
1. В раствор неочищенного продукта, полученного, как описано в примере 2, в этаноле (2,16 г в 30 мл) добавляли 10 мл воды, содержащей 0,185 мл уксусной кислоты и 0,3 г уксуснокислого натрия, а также 0,7 г палладия на углероде (10% ), после чего реакционную смесь подвергали гидролизу, как описано в примере 3. При рН 9,0 получали 0,98 г смеси 6,0-метил-(Ie), 6,11-ди-0-метил-(If), 11-0-метил-(Ig) и 6,11,4''-три-0-метил-II-деметилазитромицина А (Ih).
2. 0,98 г cмеси, полученной в соответствии с пунктом I, разводили в 50 мл CHCl2, добавляли 0,106 мл формальдегида (37%) и 0,096 мл муравьиной кислоты (98-100%) и подвергали N-метилированию, как описано в примере 6. При рН 9,0 получали 0,537 г смеси, которую хроматографировали на колонке из силикагеля (силикагель 60 компании Мерк, 70-230 меш) в системе растворителей CH2Cl(СH3OH)NH4OH (90:9:1,5), получая 0,238 г хроматографически гомогенного (Ii) с Rf 0,346, 0,065 г (Ij) с Rf 0,391, 0,105 г (Iк) с Rf 0,428 и 0,094 г (II) с Rf 0,456.
П р и м е р 10. 6,11-4''-три-0-метил-N-деметилазитромиин А (Ih).
В соответствии с процедурой описанной в примере 3, из 3,35 г (3,21 ммоля ) 2'-0,3'-II-бис-(бензилоксикарбонил)-N- деметил-6,11,4''-три-0-метилазитромицина А (Iд) посредством гидрогенолиза с палладием на углероде (10% 1 г) в этаноле (50 мл) в присутствии буферного раствора (уксуснокислый натрий/уксусная кислота, рН 5,0) получали 1,41 г (56,7%) искомого продукта, который, в случае необходимости хроматографировали на колонке из силикагеля в системе растворителей CH2Cl2(СH3OH)NH4OH (90:9:0,5) с выходом хроматографически гомогенного вещества (Ih).
ЕI-MS m/s 775
TLC Rf 0,263
1HNMR (CDCl3): 2,262 (3Н, 9а-NCH3), 2,393 (3H, 3'-NCH3), 3,308 (6Н, 3''-OCH3 и 6-OCH3), 3,475 (4''-OCH3) и 3,521 (11-OCH3) ррm.
13СNMR(CDCl3): 175,0 (С-1), 64,8 (С-9), 79,8 (С-6), 50,6 (6-OCH3) 86,1 (С-11), 59,1 (11-OCH3), 87,7 (С-4'') и 60,9 (4''-OCH3) ppm
П р и м е р 11. 6,11-4''-три-0-метилазитромицина А (Il).
В соответствии с процедурой, описанной в примере 6, из 1,2 г (1,55 ммоля) 6,11-4''-три-0-метил-N-деметилазитромицина А (Ih) c использованием 0,131 мл формальдегида (37% 1,71 ммоля) и 0,121 мл (3,15 ммоля) муравьиной кислоты (98-100%) получали 0,75 г (64,4%) искомого продукта.
ЕI-MS m/s 789
TLC, Rf 0,456
1H NMR (CDCl3): 2,216 (3H, 9а-NCH3), 2,311 (6Н, 3'-N(CH3)2), 3,321 (3Н, 3''-OCH3), 3,302 (6-OCH3), 3,482 (4''-OCH3) и 3,521 (11-OCH3) ррm.
13CNMR (CDCl3): 177,859 (С-1), 68,6 (С-9), 36,8 (9а-NCH3), 80,7 (С-6), 51-0 (6-ОСН3), 89,0 (С-11), 62,0 (11-ОСН3), 87,3 (С-4'') и 61,3 (4''-OCH3) ррm.

Использование: в качестве антибактериального агента. Сущность изобретения: О-метильные производные азитромицина ф-лы I, указанной в тексте описания, при соответствующих значениях радикалов и их пригодные для фармацевтического применения соли с неорганическим и органическим кислотами обладают актибактериальной активностью. Способ получения О-метильных производных азитромицина А включает бензилирование азитромицина О-метилирование C 6, C 11, C 4 гидроксильных групп в 2′, О, 3′ N - бис(бензилоксикарбонил)-N-деметилэритромица А/после чего возможно разделение на колонке из силикагеля и еще ряд стадий. Структура соединения ф-лы I: Ia R1=R2=CO2CH2C6H5, R3= CH3, R4=R5=H Ib R1=R2=CO2CH2C6H5, R3= R4=CH3R5=H Ic R1=R2=CO2CH2C6H5, R3= R5=H , R4=CH3 Id R1=R2=CO2CH2C6H5, R3= R4= R5= CH3 Ie R1=R2= R4= R5=H, R3=CH3 If R1=R2=R5=H, R3=R4= CH3 Ig R1=R2=R3= R5=H, R4=CH3 Ih R1=R2= H, R3= R4=R5=CH3 Ii R1=R4=R5=H, R2=R3= CH3 Ij R1=R5=H, R2=R3=R4=CH3 Ik R1=R3=H, R2= R4=CH3 Ie R1=H, R2= R3=R4=R5=CH3 14 з.п. ф-лы.
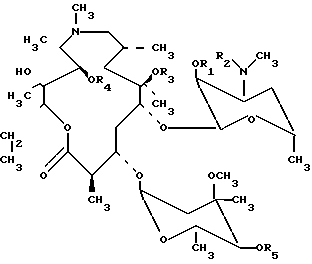
где R1 R2 CO2CH2C6H5; R3 CH3; R4 R5 H;
R1 R2 CO2CH2C6H5; R3 R4 CH3; R5 H;
R1 R2 CO2CH2C6H5; R3 R5 H; R4 CH3;
R1 R2 CO2CH2C6H5; R3 R4 R5 CH3;
R1 R2 R4 R5 H; R3 CH3;
R1 R2 R5 H; R3 R4 CH3;
R1 R2 R3 R5 H; R4 CH3;
R1 R2 H; R3 R4 R5 CH3;
R1 R4 R5 H; R2 R3 CH3;
R1 R5 H; R2 R3 R4 CH3;
R1 R3 R5 H; R2 R4 CH3;
R1 H; R2 R3 R4 R5 CH3,
обладающие антибактериальной активностью.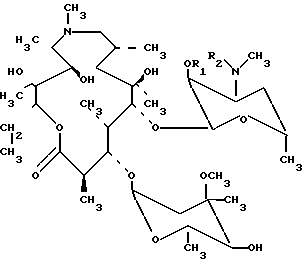
где R1 R2 СН2СН2С6Н5,
в качестве промежуточных соединений для получения О-метильных производных азитромицина А.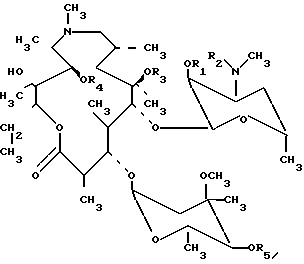
где a)R1 R2 CO2CH2C6H5; R3 CH3; R4 R5 H;
b)R1 R2 CO2CH2C6H5; R3 R4 CH3; R5 H;
c)R1 R2 CO2CH2C6H5; R3 R5 H; R4 CH3;
d)R1 R2 CO2CH2C6H5; R3 R4 R5 CH3;
e)R1 R2 R4 R5 H; R3 CH3; f)R1 R2 R5 H; R3 R4 CH3;
g)R1 R2 R3 R5 H; R4 CH4;
h)R1 R2 H; R3 R4 R5 CH3;
i)R1 R4 R5 H; R2 R4 CH3; j)R1 R5 H; R2 R3 R4 CH3;
k)R1 R3 R5 H; R2 R4 CH3;
l)R1 H; R2 R3 R4 R5 CH3,
отличающийся тем, что азитромицин или его дигидрат общей формулы
где R1 h;
R2 CH3,
подвергают взаимодействию с бензилхлорформиатом в присутствии избыточного количества соответствующего основания, например бикарбоната натрия, в интерном растворителе, например в бензоле, при 25 60oС в течение 3 24 ч с последующим О-метилированием гидроксильных групп в С-6 С-11 и С-4 положениях промежуточного продукта, 2′, 0,3′- N-бис(бензилоксикарбонил)-N-деметилэритромицина А общей формулы II, где R1 R2 CO2CH2C6H5, 1 18-кратным избыточным количеством соответствующего метилирующего агента, например метилированного йода, диметилсульфата, в присутствии соответствующего основания, например, гидроксида натрия, в подходящем растворителе, например в диметилсульфоксиде, или N, N-диметилформамиде или в их смеси с инертным растворителем, например, тетрагидрофураном, ацетонитрилом, этилацетатом, при температуре от 0oС до комнатной температуры 3 30 ч с образованием смеси О-метил- 2′-0,3′-N бис(бензилоксикарбонил)-N-диметилазитромицина А общей формулы I, где R1 R2 COCH2C6H5; R3 CH3; R4 R5 H;
R1 R2 CO2CH2C6H5; R3 R4 CH3; R5 H;
R1 R2 CO2CH2C6H5; R3 R4 CH3; R5 H;
R1 R2 CO2CH2C6H5; R3 R4 R5 CH3,
и которую при необходимости
а) разделяют на колонке из силикагеля и с образованием хроматографически гомогенных соединений a d, в которых затем удаляют защитные группы в положениях 2 и 3 посредством гидрогенолиза в низкоатомных спиртах, например в этаноле или метаноле, в присутствии катализатора, например палладия на углероде, в атмосфере водорода при давлении 1 20 бар, при непрерывном перемешивании реакционной среды в течение 2 10 ч при комнатной температуре с образованием О-метил-N-метил-азитромицина А в форме производных формулы I,
где R1 R2 R4 R5 H; R3 CH3;
R1 R2 R5 H; R3 R4 CH3;
R1 R2 R3 R5 H; R4 CH3;
R1 R2 H; R3 R4 R5 CH3,
которые затем подвергают восстановительному метилированию по 3-метиламиногруппе 1 3 эквивалентными объемами формальдегида и равным или двойным объемом концентрированной муравьиной кислоты при температуре перегонки реакционной смеси в течение 2 8 с образованием О-метил-азитромицина А в форме производных формулы I,
где R1 R4 R5 H; R3 CH3;
R1 R5 H; R2 R3 R4 CH3;
R1 R3 R5 H; R2 R4 CH3;
R1 H; R2 R3 R4 R5 CH3,
или
б)удаляют защитную бензилоксикарбонильную группу в положениях 2 и 3 посредством гидрогенолиза, как описано в пункте а с образованием смеси О-метилозитромицина А в форме производных формулы I
где R1 R4 R5 H; R2 R3 CH3;
R1 R5 H; R2 R3 R4 CH3;
R1 R3 R5 H; R2 R4 CH3;
R1 H; R2 R3 R4 R5 CH3,
которые разделяют на колонке из силикагеля с образованием хроматографически гомогенных производных азитромицина А i l.
| Djokis S.et al | |||
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
Авторы
Даты
1995-10-10—Публикация
1991-07-17—Подача