Изобретение касается новых оксимов олеандомицина, обладающих антибактериальной активностью, и способу их получения.
Олеандомицин представляет собой 14-членный макролидный антибиотик, обладающий спектром действия, аналогичным спектру действия эритромицина (1).
Целью изобретения является создание новых производных олеандомициноксимов, обладающих высокой антибактериальной активностью.
Изобретение охватывает олеандомициноксимы формулы I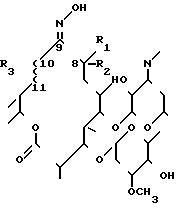 в которой R1 представляет собой СН3, R2 водород, или R1 и R2 вместе друг с другом образуют эпоксидную группу
в которой R1 представляет собой СН3, R2 водород, или R1 и R2 вместе друг с другом образуют эпоксидную группу
R3 представляет собой -ОН и значок ~~ означает одинарную связь или R3 и ~~ вместе образуют двойную связь.
Конкретно соединениями формулы I являются следующие соединения Ia-Ie
IA R1=R2=  O, R3=OH ~~ = одинарная связь
O, R3=OH ~~ = одинарная связь
IB R1=R2=  O, R3 и ~~ = двойная связь
O, R3 и ~~ = двойная связь
IC R1 = R2 = CH2, R3 = -OH ~~ = одинарная связь
Id R1 = -H, R2 = -CH3, R3 = -OH ~~ = одинарная связь
Ie R1 = -CH3, R2 = -H, R3 = -OH ~~ = одинарная связь Олеандомициноксимы формулы I являются новыми соединениями.
Указанные соединения получают путем взаимодействия олеандомицина формулы (II).
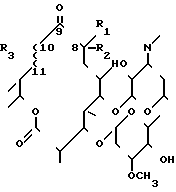 в которой R1, R2, R3 и ~~ имеют указанные значения, с избытком хлоргидрата гидроксиламина.
в которой R1, R2, R3 и ~~ имеют указанные значения, с избытком хлоргидрата гидроксиламина.
В частности, соединения Ia-Ic, как определено выше, могут быть получены путем реакции соединений IIa-IIc:
IIA R1=R2=  O, R3=-OH ~~ = одинарная связь
O, R3=-OH ~~ = одинарная связь
IIB R1=R2=  O, R3 и ~~ = двойная связь
O, R3 и ~~ = двойная связь
IIc R1 = R2 = CH2, R3 = -OH ~~ = одинарная связь
IId R1= -H, R2= -CH3, R3 = -OH ~~ = одинарная связь
IIe R1= -CH3, R2 = -H, R3 = -OH ~~ = одинарная связь с избытком хлоргидрата гидроксиламина.
Указанная реакция может осуществляться с 4-6-молярным избытком хлоргидрата гидроксиламина в присутствии избытка пиридина, служащего, кроме того, в качестве растворителя, в потоке азота, при комнатной температуре, в течение 2-40 ч.
Прекращение реакции определяют методом тонкослойной хроматографии (TLC) на силикагелевых пластинах 60F254 в нижеследующей системе:
A) CHCl3 (CH3OH) конц. HN4OH (6:1; 0,1)
B) CH2Cl2 (CH3OH) конц. NH4OH (90:0:1,5)
Извлечение продуктов осуществляют путем экстракции галогенированными растворителями, например, хлороформом или метиленхлоридом, при величине рН в пределах 7,0-8,5 и в конечном итоге путем испарения досуха органического экстракта.
Получение 8-метилолеандомициноксимов формул Id и Iе осуществляют с использованием в качестве исходного соединения 8-метилолеандомициновых аномеров формул II и IIе, которую без предварительного разделения непосредственно подвергали реакции оксимирования. Получали сырой продукт, состоящий из смеси аномерных оксимов формул (Id) и (Ic), которая разделялась путем хроматографии в колонке с силикагелем при элюировании смесью CH2Cl2CH3OH (85:15).
Антибактериальная активность определялась на ряде стандартных и клинически выделенных штаммов. Результаты выражены в минимальной ингибирующей концентрации (MIC, мкг/мл) и представлены в табл.1 и 2.
П р и м е р 1. В раствор олеандомицинфосфата (IIа) (13,4 г 0,00186 моля) в 19 мл сухого пиридина вводят NH2OH HCl (6 г 0,086 моля), и реакционная смесь перемешивается при комнатной температуре в потоке азота в течение 2 ч. В реакционную смесь вводят воду (400 мл), и она экстрагируется дихлорметаном путем градиентной экстракции при рН равном 5 и 7. Органический экстракт (рН 7,0) выпаривается при пониженном давлении досуха и остаточный продукт выпаривания высушивается в вакууме при 40оС, в результате чего получается 9,1 г (70,0%) продукта.
Rf (А) 0,51.
(В) 0,32.
М+702.
Ультрафиолетовый спектр (МеОН): пик при 290 нм исчезает ( С = 0). Спектр НЯМР (Диметилсульфоксид -d6) δ ч/мин 2,23 [6H, c, (CH3)2N-] 3,33 (3Н, с, 3- ОСН).
10,82 ( = NOH), исчезает в результате ионообмена сD2O.
Спектр13 С-ЯМР (CDCl3) δ ч/мин: 175,8 (С-1, лактон), 159, 6 (-C= N-), 104,3 (С-1'), 99,3 (C-1''), 51,1 (С - 8 - СН2), 40,3 [C-3'-N(CH)]
MIC (мкг/мл) (клинические изоляты)
Strept. pneumoniae 0,5 Strept. serol. группа А 0,5
П р и м е р 2. Ангидроолеандомиционоксим Ib.
Ангидроолеандомицин (IIb) (2,2 г 0,0033 моля) растворялся с сухом пиридине (4 мл), вводили NH2OH HCl (1,2 г 0,017 моля) и реакционная смесь перемешивалась при комнатной температуре в потоке азота в течение 18 ч. Пиридин удаляли путем выпаривания при пониженном давлении и путем ввода воды. В воду добавляли суспензию хлороформа, величину рН доводили до 8,3 путем ввода NaOHz (20% раствор в воде) и раствор экстрагировали хлороформом (3х35 мл). Экстракт высушивали К2СО3) и выпаривали досуха, и в результате получали 21 г (93,0%) белого твердого вещества.
Rf (A) 0,52
(В) 0,37
М+ 68.
Спектр 'H-ЯМР (Диметилсульфоксид-d6) δ ч/млн: 2,21 [6H, c (CH3)2N-], 3,34 (СН, с, 3"-ОСН3), 10,97 (1Н, с, =NOH), исчезает в результате обмена с D2O.
Спектр13 С-ЯМР (CDCl3) δ ч/млн: 174,8 (С-I, лактон) 157,3 (-C = N-), 104,6 (С-I'), 99,5 (C-I"), 130,1 (С-II), 135,0 (С-10), 51,2 (С-8-СН2), 40,3 [C-3'-N(CH3)2]
MIC (мкг/мл) (клинические изоляты)
Strept. pneumoniae 2,0; Strept.serol. группа А 1,0.
П р и м е р 3. 8-Метилен-Олеандомициноксим Iс.
8-Метиленoдеандомицин (IIc) (2,7 с 0,004 моля) растворяют в сухом пиридине (19 мл) и вводят хлоргидрат гидроксиламина (1,35 г 0,019 моля). Реакционная смесь перемешивается при комнатной температуре в потоке азота в течение 2 ч. После экстракции дихлорметаном при величине рН, равной 5 и 7, продукт извлекается путем выпаривания экстракта (рН 7,0) досуха (2,0 г 73,0%).
Rf (А) 0,58
(В) 0,35
М+ 686
Спектр 'Н-ЯМР (Диметилсульфоксид-d6) δ ч/млн: 2,29 [6H, c, (CH3)2N-], 3,34 (CH, c., 3" - ОСН3) 10,28 (1Н, с., =NOH), исчезает в результате обмена с D2O.
Спектр13 С-ЯМР (CDCl3) δ ч/млн: 176,6 (С-1, лактон) 163,4 (-C=N-), 141,4 (С-8), 116,4 (С-8а), 104,6 (С-I') 90,2 (C-I") 40,4 [C-3"-N(CH3)2].
MIC (мкг/мл) (клинические изоляты)
Strept. pneumoniae 1,0; Strept. serol. группа А 1,0
П р и м е р 4. 8-Метил-олеандомициноксимы Id и Iе.
8-Метил-олеандомицин (смесь аномеров IId и IIе).
(1,2 г 0,0018 моля) растворяют в сухом пиридине (4 мл) и вводят NH2OH HCl (0,6 г, 0,0086 моля), и реакционную смесь перемешивают при комнатной температуре в потоке азота. Тонкослойная хроматография показывает полную конверсию соединения IId (Rf(A) - 0,67) по прошествии 5 ч в продукт Id (Rf(A) = 0,48), в то время как исходное соединение IIe (Rf(A) = 0,63) дает продукт Ie (Rf(A) = 0,57) по прошествии 40 ч. Осуществляя градиентную экстракцию метиленхлоридом при величине рН = 7,5, получают продукт в виде смеси изомеров (0,7 г 57%), который может быть разделен в колонке с силикагелем при элюировании CH2Cl/CH3OH (85:15).
Данные изомеры имеют следующие физико-химические свойства:
Id
____
Rf (A)0; 48
(В) 0,34
М+ 688.
Спектр 'H-ЯМР (Диметилсульфоксид-d6) δ ч/млн; 2,42 [6H, c, (CH3)2N-] 3,43 (3H, c., 3"-OCH3), 10,40 (1H, c., =NOH), исчезает в результате обмена с D2О.
Спектр13 С-ЯМР (CDCl3) δ ч/млн: 176,8 (C-1, лактон), 165,5 (-C=N-), 104,7 (C-I'), 99,5 (C-I"), 40,4 [C-3"-N(CH3)2].
Ie
Rf (А) 0,57
М+ 688,
Спектр Н-ЯМР (Диметилсульфоксид-d6) δ ч/млн;
2,29 [6H, c., (CH3)2N-] 3,32 (3Н, с., 3"-ОСН3), 1061 (1Н, с., =NOH) исчезает в результате с обмена с D2O.
Спектр 13 С-ЯМР (CDCl3) δ ч/млн: 176,2 (С-I, лактон), 168,6 (-C=N-), 104,2 (C-1'), 98,5 (C-1") 40,4 [C-3'-N(CH3)2]. Активность: 657 ед/мг Sarcinalutea АТСС9341.
Использование: медицина, антибактериальные средства. Сущность изобретения: продукт - олеандомициноксилин формулы I, приведенной в тексте описания. Соединения формулы I проявляют антибактериальную активность, при этом MJC = 0,2 - 16,0 мкг/мл. Реагент 1: олеандомицины формулы III, приведенной в тексте описаний. Реагент 2 : 4 - 6-молярный избыток хлоридрата гидроксиламина. Условия процесса: избыток пиридина при комнатной температуре, 2 - 40 ч.
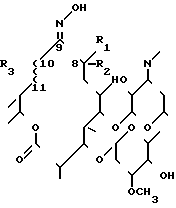
где R1 - водород или метил;
R2 - метил или водород, или R1 и R2 вместе образуют эпоксидную группу или = CH2;
R3 - гидроксигруппа;
~~ - простая или двойная связь,
отличающийся тем, что проводят реакцию олеандомициновых производных общей формулы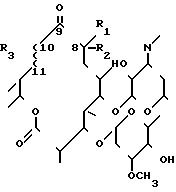
где R1, R2, R3 и ♂~~ имеют указанные значения, с 4 - 6-молярным избытком хлоргидрата гидроксиламина в присутствии избытка пиридина в потоке азота при комнатной температуре в течение 2 - 40 ч с последующим выделением целевого продукта.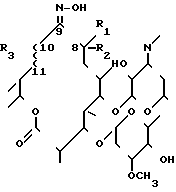
где R1 - метил;
R2 - водород или R1 и R2 вместе образуют эпоксидное кольцо;
R3 - гидроксигруппа;
~~ - простая связь, или R3 и ~~ вместе образуют двойную связь.
| Машковский М.Д | |||
| Лекарственные средства, М.: Медицина, 1986, т.II, с.248. |
Авторы
Даты
1994-10-15—Публикация
1991-03-20—Подача