Изобретение относится к медицине, в частности, к получению биологически активных препаратов, содержащих интерлейкин-2 (ИЛ-2), которые находят применение для профилактики и лечения онкологических заболеваний, хронических инфекций различной природы, первичных и вторичных иммунодефицитов, в лабораторной практике для выведения новых линий опухолевых клеток, для выделения и накопления ретровирусов, для исследовательской работы и т.д.
Известны биологически активные препараты, содержащие рекомбинантный ИЛ-2, полученный методом генной инженерии с использованием бактерии E. coli (Патент США N 4935356, 1990).
Недостатком рекомбинантного интерлейкина-2 является недостаточная его активность, а также необходимость введения его в организм в высоких дозах (3 млн/м2 и более, что приводит к появлению нежелательных побочных эффектов в процессе лечения вплоть до летального исхода, либо необходимость использования дополнительных методов лечения (ЛАК-терапия, ТИЛ-терапия).
Известен также препарат человеческого лейкоцитарного интерферона, состоящий из смеси природных лейкоцитарных интерферонов-α вместе с факторами ингибиции миграции макрофагов и нейтрофилов, фактора некроза опухолей (ФНО-α), интерлейкина-1 (ИЛ-1) в их природном соотношении, полученный из лейкоцитов донорской крови под воздействием непатогенных вирусов с последующим выделением препарата с помощью двукратной обработки (Автореф. диссертации на соискание уч. степени д. м. н. Кузнецова В.П. "Иммунобиологические основы производства медицинских препаратов интерферона" М. 1983).
Недостатком данного препарата является недостаточная иммуномодулирующая активность, обусловленная отсутствием в его составе ИЛ-2, играющего основную роль в иммунном ответе, возможное присутствие вирусов в препарате, обусловленное технологией его получения, а также дорогой и сложный метод его очистки.
Известен также препарат, содержащий нативный ИЛ-2, полученный из лимфобластоидной клеточной линий MLA-144. Способ получения препарата состоит в следующем: 2 ˙ 106 клеток/мл растят в среде, содержащей RPMI 1640, 10%-ную фетальную сыворотку, 2 мм/л L-глутамина, 40 мкг/мл гентамицина сульфата; культивирование осуществляют в течение 3-4 дней. Очистку осуществляют следующим образом: супернатант (надосадочную жидкость) концентрируют лиофилизацией, переносят на колонку Sephadex G-75, собирают активные фракции, которые подвергают двухкратному концентрированию. (Pizza G. Severini G. Menniti D. De Vinci G. Corrado F. (1984). Tumor regression after intra besional injection of Interlenkin-2 (IL-2) in blader cancer. Preliminary report. Int. J. Cancer 34, 359-367).
Данный препарат также обладает недостаточно высокими иммуномодулирующими свойствами.
Наиболее близким к предлагаемому по технической сущности является биологически активный препарат, представляющий собой нативный ИЛ-2, полученный из лимфоцитов периферической крови человека путем их стимуляции активирующими добавками конканавалином А (10 нг/мл) и форбол-12 миристат-13 ацетатом (10 нг/мл) культивирования в течение 36 часов, отделения супернатанта (содержание ИЛ-2 в супернатанте 150-250 ед. ИЛ-2) и последующей 2-х кратной очистной жидкостной хроматографией с использованием различных носителей и элюированием ИЛ-2 1-пронанолом в пиридин-ацетатном буфере. (Korner I.J. Dettmer R. Kopp J. Gaestel M. Malz W. "Simple preparative two-step purification of interlenkin-2 from culture medium of lectin stimulated normal human lymphocytes", J. Immunol. Meth. 87, 185-195, 1986)".
Полученный препарат представляет собой практически чистый ИЛ-2 и не содержит примесей посторонних соединений, в том числе и белков.
Недостатком данного препарата является недостаточно высокая иммуномодулирующая активность, сложная система очистки, недостаточно высокий выход ИЛ-2 при культивировании.
Задачей изобретения является разработка препарата, обладающего более высокими иммуномодулирующими свойствами, получаемого по простой технологии с более высоким выходом цитокинов при культивировании.
Поставленная задача решается предлагаемым биологически активным препаратом, обладающим иммуномодулирующими свойствами и представляющим собой смесь продуктов, включающую интерлейкин-2 в количестве не более 1 мас. биологически активные цитокины в количествах, соответствующих природному соотношению, смесь цепей α- и β-гемоглобина, примеси неустановленного строения, и полученную из мононуклеарных клеток крови млекопитающих путем их стимуляции активирующими добавками Са ионофором, взятым в количестве 1-1000 нг/мл и форбол-12 миристат-13 ацетатом, взятым в количестве 1-100 нг/мл, культивирования и выделения из надосадочной жидкости однократной жидкостной хроматографией.
Биологически активный препарат может содержать фетуин в случае стимуляции мононуклеарных клеток крови млекопитающих активирующими добавками, в состав которых дополнительно введена эмбриональная сыворотка крови млекопитающих в количестве 0,5-10 мас.
Желательно при выделении препарата жидкостной хроматографией использовать 0,01 М водный раствор трифторуксусной кислоты или 15, 30 и 60%-ный раствор ацетонитрила в 0,01 М водном растворе трифторуксусной кислоты.
Желательная концентрация мононуклеарных клеток в культуральной среде от 0,5 до 10 млн/мл.
В предпочтительном варианте мононуклеарные клетки после отделения надосадочной жидкости подвергают повторной стимуляции активирующими добавками.
Оптимальное время культивирования 1-120 ч.
Предлагаемому биологически активному препарату авторами присвоено название "Лимфокинин".
Данный препарат обладает высокими иммуномодулирующими свойствами, т.к. в его составе наряду с ИЛ-2 содержатся другие биологически активные цикотины в природном соотношении, т. е. в том соотношении, в каком они продуцируются клетками здоровых доноров (максимальное содержание их в препарате не более 1 мас.).
Некоторые из числа биологически активных составляющих удалось идентифицировать это ИЛ-1, интерлейкин-6 (ИЛ-6), ФНО-α.
Способ получения препарата прост и позволяет получать целевой препарат "Лимфокинин" с высоким выходом (содержание ИЛ-2 в надосадочной жидкости составляет до 2 ˙ 107 ед. ИЛ-2 в 1 л).
Сущность изобретения состоит в следующем:
Донорскую кровь, забранную в стерильных условиях, помещают в пластиковые мешки вместе с консервантом "глюгицир" (гемоконсервант без левомицетина кислый глюкозоцитратный раствор: цитрата натрия кислого 2 г, глюкозы безводной 3 г, бидистиллированная вода до 100 мл, рН раствора 5,0). 400 мл крови и 100 мл "глюгицира"; (соотношение крови и консерванта 4:1) центрифугируют при 750 g в течение 10 мин. При помощи плазмоэкстрактора лейкомассу выдавливают из мешков в пол-литровые бутыли по 250 мл в каждую. Для осаждения эритроцитов и гранулоцитов в бутыли добавляют по 250 мл полиглюксина (6%-ный раствор декстрана, МВ-60000), смешивают с лейкомассой в отношении 1:1 и отстаивают в течение 90 мин. 300 мл суспензии лейкомассы (без эритроцитов и гранулоцитов) трижды отмывают в среде DMEM или RPMI-1640 (Sigma) заливают во флаконы (Sani-Glas) и инкубируют при +37оС (инкубатор National) в атмосфере с 5%-ным содержанием СО2 в течение двух часов при концентрации клеток 107/мл. После чего популяцию мононуклеарных клеток из флаконов сливают в другие флаконы и помещают в среду в концентрации 0,5-10 млн клеток в 1 мл. Среда состоит из стандартной среды RPMI-1640 или DMEM (Sigma) c добавками в следующих концентрациях: 2-меркаптоэтанол (Serva) 5 ˙ 10-5 M; L-глутамин (Flow) ImM; Hepes (Flow) 1mM; фетально-эмбриональная сыворотка (Flow) 0,5-10% Ca2+-ионофор А23187 (Sigma) I-1000 нг/мл; форбол-12миристат-13ацетат (Sigma) 1-100 нг/мл.
Проведение стимуляции Са++-ионофором и форбол-12миристат-13 ацетатом позволяет повысить концентрации биологически активных субстанций (ИЛ-1, ИЛ-2, ИЛ-6, ФНО-α и др.). Концентрация Са++-ионофора и форбол-12миристат-13ацетата менее 1 нг/мл не позволяет увеличить количество основных составляющих выше минимального значения цитокинов в препарате. Увеличение концентрации Са++-ионофора выше 1000 нг/мл и форбол-12 миристат-13ацетата выше 100 нг/мл не приводит к увеличению выхода продуктов и увеличивает токсичность препарата.
Культивирование желательно проводить в присутствии сыворотки крови млекопитающих, так как сыворотка создает наиболее благоприятные условия для активации и роста стимулируемых мононуклеарных клеток, увеличивая выход конечных продуктов за счет наличия в сыворотке ростовых факторов и гормонов. Использование фетально-эмбриональной сыворотки (ФЭС) в пределах 0,5-10 мас. обусловлено тем, что при этих количествах ФЭС, дает одинаково высокий выход биологически активных составляющих, в то время как повышение концентрации ФЭС не приводит к увеличению активности конечного продукта и увеличивает его токсичность за счет повышения количества белковых соединений, находящихся в ФЭС.
Среду с мононуклеарными клетками разливают по 0,15 литра в роллерные бутыли (1 л) (Wheaton) и инкубируют при +37оС в атмосфере с 5%-ным содержанием СО2 в течение 1-120 ч.
Культивирование в течение менее 1 ч не дает возможности выделения биологически активных компонентов препарата необходимой концентрации. Увеличение времени культивирования свыше 120 ч не имеет смысла, так как концентрационный предел полезных биологически активных субстанций достигнут, и далее могут появляться нежелательные побочные эффекты.
Для осаждения и удаления клеток и клеточного дебриса после инкубации содержимое бутылей центрифугируют на суперцентрифуге при 2500 g в течение 15 мин.
50 г матрикса Lichroprep RP-8 (Merk, диаметр гранул 25-40 мкм, размер пор 6 нм) суспендируют в 300 мл этанола. Полученную суспензию заливают в колонку (Pharmacia) 2,5 х 30 см. После осаждения матрикса вставляют верхний адаптор, подсоединяют колонку к перистальтическому насосу (LCB) и промывают колонку 50 мл дистиллированной воды. После этого колонку уравновешивают пропусканием через нее 500 мл 0,1%-ного водного раствора трифторуксусной кислоты (Sigma) (pH-4). 5 л кондиционной среды пропускают через колонку. Гидрофобные белки, осевшие на матриксе, снимают ступенчатым градиентом 15, 30 и 60%-ного раствора ацетонитрила (Sigma) в 0,01 М водном растворе трифторуксусной кислоты (рН-4) со скоростью потока 90 мл/ч. Раствор элюата смытый 60% -ным раствором ацетонитрила, смешивают со стерильным раствором наполнителя полиглюкина в соотношении 1:2, стерилизуют, разливают во флаконы, замораживают при -70оС, лиофилизируют и используют по назначению.
В качестве наполнителя препарата могут быть использованы также человеческий сывороточный альбумин, маннит и т.д.
Необходимо отметить, что:
в процессе культивирования мононуклеарных клеток не используются антибиотики, что позволяет в 2-3 раза повысить активность супернатанта (надосадочной жидкости) по ИЛ-2;
мононуклеарные клетки после культивирования и сбора надосадочной жидкости возможно использовать повторно. В этом случае мононуклеарные клетки помещают в среду, содержащую 2,0-10 млн клеток в 1 мл. Среда состоит из стандартной среды RPMI-1640 или DMEM (Sigma) с добавками в следующих концентрациях: 2-меркаптоэтанол (Serva) 5 ˙ 10-5 M; L-глутамин (Flow) 1 mM; Hepes (Flow) 1 mM; фетально-эмбриональная сыворотка (Flow) 0,5-10% Ca2+-ионофор А23187 (Sigma) 1-1000 нг/мл; форбол-12миристат-13ацетат (Sigma) 1-100 нг/мл. Среду с мононуклеарными клетками разливают по 0,15 литра в роллерные бутыли (Wheaton) и инкубируют при +37оС в атмосфере с 5%-ным содержанием СО2 в течение 1-60 ч. Для осаждения клеток и клеточного дебриса после инкубации содержимое бутылей центрифугируют на суперцентрифуге при 2500 g в течение 15 мин.
Повторное использование мононуклеарных клеток исключает необходимость их выделения из донорской крови и отмывки, повышая, таким образом, эффективность процесса получения биологически активного супернатанта.
Биологическую активность ИЛ-2 в препарате "Лимфокинин" определяют по пролиферации интерлейкин-2 зависимой линии мышиных цитотоксических Т-лимфоцитов (CTLL). Степень пролиферации определяют по включению 3Н-тимидина в синтез ДНК.
Клетки CTLL помещают в среду RPMI-1640, содержащую 5% фетальной телячьей сыворотки, 0,05 mM 2-меркаптоэтанол, 1 mM L-глутамина и по 100 ед/мл пенициллина и стрептомицина. После чего клетки рассаживают в 96-луночные пластины для микротитрования по 4000 клеток на лунку в объеме 0,2 мл, добавляют в каждую лунку образцы последовательного двукратного разведения и инкубируют в течение 18 ч при температуре +37оС в атмосфере с 5%-ным содержанием СО2. Затем еще 6 ч с добавлением по 1 μ Ci на лунку 3Н-тимидина. В качестве стандарта используют образцы препарата с заранее известной активностью в тех же разведениях.
После инкубации при помощи прибора для полуавтоматического сбора клеток (Cell Harvester) клетки переносят на стеклянные фильтры. Фильтры высушивают и помещают во флаконы, содержащие по 5 мл сцинтилляционной жидкости СЖ-8. Включение 3Н-тимидина измеряют на жидкостном сцинтилляционном β-счетчике.
Активность образца (Р2) определяют по формуле:
P2 (P1 ˙ V2)/V1, где P1 активность стандартного препарата, Ме;
V1 кратность разведения стандартного препарата, дающая 50% от максимума включения 3Н-тимидина;
V2 кратность разведения тестируемого образца, дающая 50% от максимума включения 3Н-тимидина.
Содержание Интерлейкина-1 (ИЛ-1) в препарате "Лимфокинин" оценивают в биотесте с использованием мышиных интерлейкин-1-зависимых клеток линии D 10 G 4.1. Для этого клетки после 7-8 сут культивирования с фидером (спленоцитами мышей СВА). Интерлейкин-2-содержащим супернатантом и кональбумином разводят в 5-7 раз питательной средой RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки (ЭТС) и антибиотики, и дополнительно культивируют 48 ч при 37оС в атмосфере воздуха с 7,5% СО2. Перед внесением в тест клетки отмывают 2-3 раза от остатков фидера или очищают на лимфопрепаративном растворе. В каждую лунку 96-луночной микропланшеты вносят 50 мкл исследуемого или стандартного образца, разведенного средой RPMI-1640, содержащей 5% ЭТС, 2 mM L-глютамина и антибиотики; 50 мкл раствора конканавалина (в конечном разведении 1 мкг/мл), 100 мкл взвеси клеток в концентрации 200 тыс. /мл. Тест-культуры клеток инкубируют в течение 48 ч при 37оС в атмосфере воздуха с 7,5% СО2. Затем вносят 3,7 мБк метил-3Н-тимидина на лунку на 16 ч. Клетки осаждают на фильтры с помощью "харвестера". Счет радиоактивности проводят в β-счетчике. Расчет количества МЕ ИЛ-1 в препарате "Лимфокинин" проводят методом пробит-анализа.
Содержание Интерлейкина-6 (ИЛ-6) в образцах препарата Лимфокинин оценивают с клетками ИЛ-6-зависимой мышиной гибридомы В9. Для этого в лунки плоскодонной микропланшеты вносят 100 мкл двукратно разведенные образцы препарата или стандарта и 100 мкл взвеси клеток (10000 клеток на лунку) в среде RPMI-1640, содержащей 10% ЭТС и антибиотики. Культуры клеток инкубируют в течение 48 ч при 37оС в атмосфере воздуха с 7,5% СО2. Оценку жизнеспособности клеток проводят с помощью МТТ-теста. Для этого на третьи сутки из лунок отбирают по 100 мкл питательной среды и вносят по 20 мкл раствора МТТ (тиазолина голубого) (5 мкг МТТ на 1 мл фосфатно-солевого раствора рН 7,4). Культуры клеток дополнительно инкубируют 4 ч при 37оС. Затем кристаллы формазана в клетках растворяют добавлением 100 мкл 20% раствора додецилсульфата натрия в 50% диметилсульфоксиде (рН 7,4). Оптическую плотность содержимого лунок определяют при 540 нм на ELISA-процессоре после хранения микроплат в течение 16 ч в темноте при 37оС. Активность ИЛ-6 в образцах препарата "Лимфокинин" рассчитывают по отношению к стандарту методом пробит-анализа.
Содержание фактора некроза опухоли-α (ФНО-α) определяют в цитотоксическом тесте на клетках мышей фибробластоидной линии L-929. Для этого клетки культивируют в среде RPMI-1640, дополненной 10% ЭТС и антибиотиками (пенициллин 100 Ед/мл, стрептомицин 100 мкл/мл) в пластиковых культуральных матрицах. Клетки снимают с помощью раствора 0,25% трипсина ЭДТА. Пересев клеток производят каждые 7 дней в концентрации 100 тыс./мл. Для теста клетки вносят в 96-луночные культуральные платы (Flow Lab, Costar) в концентрации 400 тыс./мл и культивируют 24 ч при 37оС и 5% СО2. Затем среду устраняют и к клеткам добавляют двукратные разведения исследуемых образцов, стандартов и контролей RPMI-1640, содержащей 10% ЭТС и актиномицин Д "Serva" в концентрации 1 мкг/мл. Все образцы тестируют в триплетах. Для идентификации цитотоксичности используют асцит гибридомы 10 FN, продуцирующей моноклональные антитела против ФНО-α. Разведения исследуемых образцов предварительно инкубируют с моноклональными антителами против ФНО-α 30 мин при 37оС. Платы инкубируют 20 ч, при 37оС и 5% СО2. Затем среду устраняют и окрашивают клеточный слой 20 мин генцианвиолетом в 20%-ном метаноле. Платы отмывают, высушивают, оптическую плотность измеряют на спектрофотометре Multiscan (Organon Tehnika) при длине волны 540 нм. Активность ФНО-α определяют на основе разведения супернатантов, при котором наблюдалось 50%-ное уменьшение оптической плотности окрашенного слоя клеток по сравнению с контролем клеток, инкубированных в среде. В качестве лабораторного стандарта используют рекомбинантный ФНО-α человека. Активность лабораторного стандарта ФНО-α была определена в нескольких тестах относительно международ- ного стандарта ФНО-α и составляет 30000 Ед/мл.
Ниже приведены примеры, иллюстрирующие сущность изобретения.
П р и м е р 1. Донорскую кровь, забранную в стерильных условиях, помещают в пластиковые мешки типа "гемакон" вместе с консервантом "глюгицир" (соотношение крови и консерванта 4:1) и центрифугируют при 750 g в течение 10 мин. При помощи плазмоэкстрактора лейкомассу выдавливают из мешков в пол-литровые бутыли по 250 мл в каждую. Для осаждения эритроцитов и гранулоцитов в бутыли добавляют по 250 мл полиглюкина (6%-ный раствор декстрана, МВ-60000), смешивают с лейкомассой в отношении 1:1 и отстаивают в течение 90 мин. 300 мл суспензии лейкомассы (без эритроцитов и гранулоцитов) трижды отмывают в среде RPMI-1640 (Sigma), заливают во флаконы (Sani-Glas) и инкубируют при +37оС (инкубатор National) в атмосфере с 5%-ным содержанием СО2 в течение двух часов при концентрации клеток 107/мл. После чего популяцию мононуклеарных клеток из флаконов сливают в другие флаконы (Sani-Glas) и помещают в среду в концентрации 2 млн. клеток в 1 мл. Среда состоит из стандартной среды RPMI-1640 (Sigma) с добавками в следующих концентрациях: 2-меркаптоэтанол (Serva) 5 ˙ 10-5M; L-глутамин (Flow) 1 mM; Hepes (Flow) I mM; фетально-эмбриональная сыворотка (Flow) 2% Ca2+-ионофор А23187 (Sigma) 100 нг/мл; форбол-12миристат-13ацетат (Sigma) 20 нг/мл. Среду с лимфоцитами разливают по 0,15 л в роллерные бутыли (Wheaton) и инкубируют при +37оС в атмосфере с 5% -ным содержанием СО2 в течение 60 ч. Для осаждения клеток и клеточного дебриса после инкубации содержимое бутылей центрифугируют на суперцентрифуге при 2500 g в течение 15 мин.
50 г матрикса LiChroprep RP-8 (Mek) суспендируют в 300 мл этанола. Полученную суспензию заливают в колонку (Pharmacia) диаметром 2,5 х 30 см. После осаждения матрикса вставляют верхний адаптор, подсоединяют колонку к перистальтическому насосу (LCB) и промывают колонку 50 мл дистиллированной воды. После этого колонку уравновешивают пропусканием через нее 50 мл 0,1%-ного водного раствора трифторуксусной кислоты (Sigma) (pH-4). Два литра кондиционной среды пропускают через колонку. Гидрофобные белки, осевшие на матриксе, снимают ступенчатым градиентом 15, 30 и 60%-ным раствором ацетонитрила (Sigma) в 0,01 М водном растворе трифторуксусной кислоты (рН 4), со скоростью потока 90 мл/ч. Раствор элюата (активная фракция, смытая 60%-ным ацетонитрилом в 0,01 М растворе ТФУ) смешивают со стерильным полиглюкином в соотношении 1: 2, стерилизуют, разливают во флаконы, замораживают при -70оС, лиофилизируют и используют по назначению.
Полученный препарат содержит интерлейкина-2 0,075 мас. биологически активные цитокина не более 0,01 мас. фетуин, α- и β-цепи гемоглобина, примеси неустановленного строения, полиглюкин 98,38 мас.
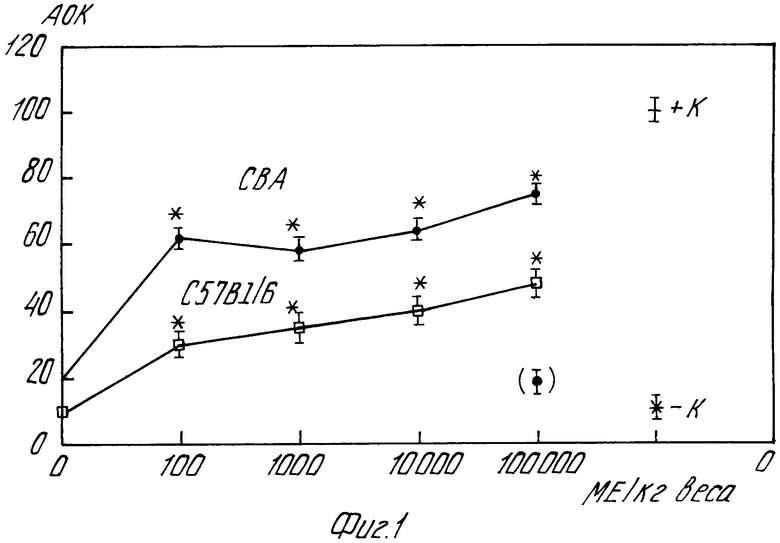
На фиг.1 представлен график, характеризующий влияние препарата "Лимфокинин" на формирование антителооб- разующих клеток (АОК) в селезенке мышей СВА и С 57 В 1/6, иммунизированных ЭБ. По оси абсцисс активность ИЛ-2 в препарате (МЕ/кг веса). По оси ординат количество АОК на 1 млн. спленоцитов. К+ положительный контроль, К- отрицательный контроль, * Р < 0,05, (о) количество АОК, индуцированное введением только "Лимфокинина".
На фиг.2 показана динамика изменения титра комплемента в сыворотке крови морских свинок после введения препарата "Лимфокинин". По оси ординат время (мин) после введения препарата, по оси ординат активность комплемента в сыворотке (ед./мл). 1 морским свинкам вводили физиологический раствор; 2 морским свинкам вводили препарат в количестве 1000 МЕ ИЛ-2 на 1 кг веса; 3 морским свинкам вводили препарат в количестве 10000 МЕ ИЛ2 на 1 кг веса. * Р < 0,05.
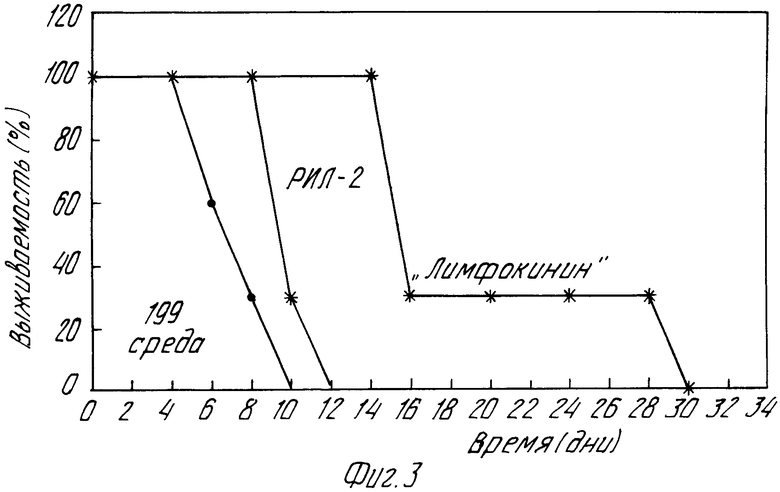
На фиг. 3 показана выживаемость мышей ДВА/2 с лимфолейкозом Р-388 при введении "Лимфокинина" и рекомбинантного ИЛ-2.
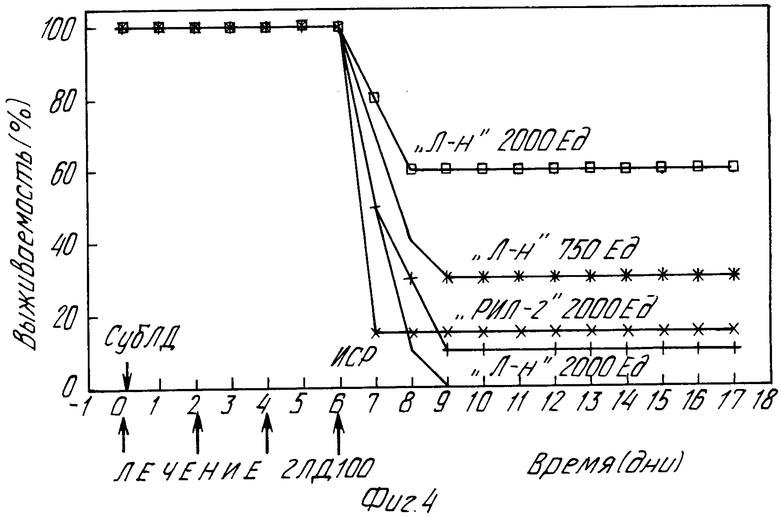
На фиг. 4 приведен график выживаемости мышей со стафилококковым перитонитом при введении рекомбинантного ИЛ-2 и различных доз "Лимфокинина".
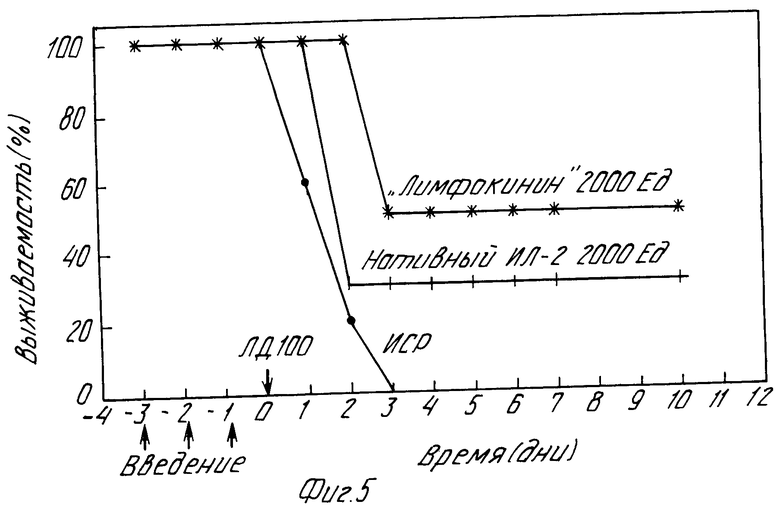
На фиг.5 показано сравнение действия препарата "Лимфокинин" с прототипом нативным Интерлейкином-2 и профилактическое действие "Лимфокинина" и нативного ИЛ-2 при внутрибрюшном введении ЛД 100 инфекта.
Иммуномодулирующая активность препарата "Лимфокинин" была продемонстрирована на:
1) индукции антителообразующих клеток в селезенке мышей (фиг.1). Для этого мышей линии CBA или C 57 BL/6, иммунизированных внутрибрюшинно эритроцитами барана (ЭБ), взятыми в субоптимальной дозе (2 х 107/мышь), и различной дозой препарата "Лимфокинин", через 4 дня забивают. Селезенку выделяют, гомогенизируют, спленоциты отмывают и используют для определения антителообразующих клеток (АОК) в жидкой фазе. Определяют АОК, секретирующие иммуноглобулины класса М. Для этого смешивают 1 объем взвеси клеток, 1 объем 5%-ной взвеси ЭБ, 1 объем адсорбированного комплемента морской свинки, 2 объема среды RPMI-1640. Смесью заполняют стеклянные камеры, которые запаивают парафином с вазелином и инкубируют 1 ч при 37оС. Затем проводят визуальный учет зон гемолиза, соответствующих АОК. Полученные результаты выражают количеством АОК в пересчете на 1 млн. спленоцитов. Каждая группа мышей включала 3 животных. Как показано на фиг.1, препарат, стандартизированный по активности ИЛ-2 100 МЕ/кг веса и более оказывает достоверный стимулирующий эффект на формирование АОК у мышей обеих линий. При этом величины стимулирующего эффекта препарата с активностью ИЛ-2 100 МЕ/кг веса и 105 МЕ/кг веса практически не отличается, что свидетельствует об отсутствии прямой зависимости "доза-эффект" и наличии пороговой зависимости действия препарата на формирование АОК у мышей, иммунизированных ЭБ. Сам препарат в дозе 105 МЕ/кг веса вызывает у мышей обеих линий появление невысокого уровня АОК, продуцирующих антитела (гемолизины) к ЭБ.
2) титровании комплемента сыворотки крови морских свинок (фиг.2). У морских свинок (по 4 особи в группе) из ушной вены забирают 30-60 мкл крови до и через 10 мин и 1 ч после введения препарата "Лимфокинин" в различной дозировке. После образования сгустка кровь центрифугируют, сыворотку забирают и разводят в 50 раз мединал-вероналовым буферным раствором, рН 7,4 (МВБ). Титр комплемента определяют микрометодом по 50%-ному гемолизу. Для этого в круглодонных платах в конечном объеме 100 мкл приготавливают серийные разведения исследуемых сывороток. В качестве отрицательного контроля используют МВБ, в качестве положительного дистиллированную воду. Во все лунки вносят по 100 мкл гемсистемы, состоящей из равных объемов разведенной гемолитической сыворотки и 2% взвеси ЭБ и инкубированной предварительно при 37оС 45 мин. Микропланшеты выдерживают 45 мин при 37оС, центрифугируют, по 50 мкл супернатанта переносят в лунки других микропланшет для учета. Оптическую плотность супернатантов определяют при 405 нм на ELISA-процессоре. Расчет содержания гемолитических единиц (СН50) проводят графическим способом. Активность комплемента оценивают по 50%-ному гемолизу эритроцитов барана. Как видно из фиг.2, в течение 10 мин после введения в кровоток препарат с активностью ИЛ-2 10000 МЕ/кг веса вызывает достоверное повышение активности комплемента (в 2 раза), которое сохраняется и через 1 ч наблюдения. Меньшая доза "Лимфокинина" (1000 МЕ ИЛ-2/кг веса) не вызывает каких-либо изменений активности комплемента, также как и физиологический раствор (контроль).
3) противоопухолевой активности препарата in vivo на мышах DBA/2 с лимфолейкозом Р-388 (фиг.3). С этой целью клетки лимфолейкоза Р-388 вводят внутрибрюшинно мышам в количестве 105/мышь. С 3 по 7 и с 10 по 15 дни после инъекции опухолевых клеток мышам ежедневно внутрибрюшинно вводят: рекомбинантный ИЛ-2 (Cetus) 300 Ед/мышь; "Лимфокинин" 300 Ед/мышь. Выживаемость мышей (8 особей в каждой группе) оценивают в течение 30 дней.
Выявлено увеличение выживаемости мышей с лимфолейкозом Р-388 причем "Лимфокинин" в аналогичных с рекомбинантным ИЛ-2 дозировках (300 Ед/мышь) обладает в 2,5 раза большей активностью.
4) противоинфекционной активности препарата in vivo на мышах со стафилококковым перитонитом (фиг.4). Группы мышей BAIB/C (8-12 мышей в каждой группе) были инфицированы сублетальной дозой (1,0- 1,3 х 109бактерий в 10%-ном растворе поливинилового спирта) стафилококка в 0 день. Через 6 дней после первичного инфицирования внутрибрюшинно вводят 2 ЛД100 инфекта. Рекомбинантный ИЛ-2, различные дозы "Лимфокинина" и изотонический солевой раствор (ИСР, контроль) вводят внутрибрюшинно одновременно с сублетальной дозой инфекта, на 2 и 4 сут после первичного инфицирования. Выживаемость мышей оценивают в течение 30 дней. Как видно из представленных данных, в группах мышей, леченных рекомбинантным ИЛ-2 или "Лимфокинином" и получавших 2 ДЛ100 инфекта на 4 или 6 сут после первичного инфицирования, отмечается высокая выживаемость по сравнению с группами животных, которым вводили ИСР (летальность 100%) причем "Лимфокинин" в аналогичных с рекомбинантным ИЛ-2 дозировках (2000 Ед/мышь) обладает в 4 раза большей активностью.
5) сравнительной противоинфекционной активности препарата in vivo на мышах со стафилококковым перитонитом по отношению к прототипу-нативному ИЛ-2 (фиг. 5). "Лимфокинин", нативный ИЛ-2 (2000 Ед/мышь) и изотонический солевой раствор (ИСР) вводят внутрибрюшинно мышам С 57 В 1/6 за 3,2 и 1 сут до введения ЛД100 инфекта. Выживаемость мышей оценивают в течение 30 дней.
Как видно из представленных данных, Лимфокинин и нативный ИЛ-2 вызывают выживаемость мышей с острой внутрибрюшинной стафилококковой инфекцией при введении ЛД100 инфекта (в группе мышей, которым вводят ИСР 100% летальность), причем активность препарата "Лимфокинин" выше, чем у нативного ИЛ-2 (в 1,5-2 раза) при использовании аналогичных дозировок.
Таким образом, к преимуществам предлагаемого препарата "Лимфокинин" можно отнести следующее:
высокая иммуномодулирующая активность, обусловленная наличием в препарате смеси биологически активных цитокинов (ИЛ-1, ИЛ-2, ИЛ-6, ФНО-α и пр.), оказывающих стимулирующее действие на основные звенья иммунитета;
простая технология получения;
отсутствие антибиотиков при его приготовлении, что повышает активность сырья, из которого получают препарат;
возможность повторного использования мононуклеарных клеток, продуцирующих биологически активные цитокины, что удешевляет процесс и позволяет повысить эффективность использования сырья;
многокомпонентность препарата, состоящего из смеси цитокинов в природном соотношении, исключает необходимость подбора и введения различных рекомбинантных цитокинов, имеющихся в настоящее время в производстве;
наличие естественных носителей (α- и β-цепей гемоглобина).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВЕЩЕСТВА, ОБЛАДАЮЩЕГО ИММУНОСТИМУЛИРУЮЩЕЙ, ПРОТИВОВИРУСНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ, ВЕЩЕСТВО, ПОЛУЧЕНОЕ ЭТИМ СПОСОБОМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2001 |
|
RU2195308C1 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВИРОВАННЫХ МОНОНУКЛЕАРНЫХ ЛЕЙКОЦИТОВ | 2009 |
|
RU2402338C1 |
| СРЕДСТВО НА ОСНОВЕ АРАБИНОГАЛАКТОУРОНАНОВ, ОБЛАДАЮЩЕЕ ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2024 |
|
RU2836422C1 |
| Способ подбора лекарственных средств для реализации фармакологической индукции митохондриальной дисфункции в макрофагах для противоопухолевой терапии | 2023 |
|
RU2810558C1 |
| СПОСОБ АКТИВАЦИИ ЦИТОТОКСИЧЕСКИХ ЛИМФОЦИТОВ ЧЕЛОВЕКА | 2015 |
|
RU2603079C2 |
| Средство гуминовой природы, обладающее иммуномодулирующим действием | 2022 |
|
RU2783772C1 |
| Средство, обладающее иммуномодулирующей активностью | 2018 |
|
RU2697526C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ И КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ПРОЛИФЕРАЦИИ ЧЕЛОВЕЧЕСКИХ Vγ9Vδ2 T-КЛЕТОК | 2019 |
|
RU2791182C2 |
| ИММУНОМОДУЛИРУЮЩЕЕ ГУМИНОВОЕ СРЕДСТВО | 2020 |
|
RU2756353C1 |
| СПОСОБ ДЕТЕКТИРОВАНИЯ СПЕЦИФИЧНОСТИ АКТИВИРОВАННЫХ ЛИМФОЦИТОВ И СРЕДА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2004 |
|
RU2343486C2 |

Использование: медицина, для получения биологически активных препаратов, содержащих интерлейкин-2 (ИЛ-2), который может быть использован для профилактики и лечения онкологических заболеваний, хронических инфекций различной природы, первичных и вторичных иммунодефицитов, а также в лабораторной практике. Сущность изобритения: препарат представляет собой смесь продуктов, включающую ИЛ-2 в количестве не более 1 мас. биологически активные цитокины в количествах, соответствующих природному соотношению, смесь цепей α и b -гемоглобина, примеси неустановленного строения и полученную из мононуклеарных клеток крови млекопитающих путем их стимуляции активирующими добавками Са-ионофором, взятым в количестве 1-1000 нг/мл и форбол-12 миристат-13 ацетатом, взятым в количестве 1-1000 нг/мл, культивирования и выделения из надосадочной жидкости однократной жидкостной хроматографией. Препарат может содержать фетуин в случае введения в состав активирующих добавок эмбриональной сыворотки в количестве 0,5-10 мас. Предпочтительная концентрация клеток в культуральной среде 0,5-10 млн/мл. Желательное время культивирования 1-120 ч. В качестве элюента жидкостной хроматографии желательно использовать 0,01 М раствор трифторуксусной кислоты или 15,30 и 60%-ный раствор ацетонитрила в 0,01 М водном растворе трифторуксусной кислоты. Желательно мононуклеарные клетки после отделения надосадочной жидкости подвергать повторной стимуляции активирующими добавками. Предлагаемый препарат обладает следующими преимуществами: высокая иммуномодулирующая активность; наличие естественных носителей ( a и b -цепей гемоглобина); многокомпонентность препарата исключает необходимость подбора и введения различных рекомбинантных цитокинов; простая технология получения; отсутствие антибиотиков при его приготовлении, что повышает активность сырья; возможность повторного использования мононуклеарных клеток. 5 з. п. ф-лы, 5 ил.
| J.Jmmunol., 1986,87,185-195. |
Авторы
Даты
1995-11-27—Публикация
1993-07-06—Подача