Изобретение относится к N-фенилкарбаматным соединениям или, когда это возможно, их солям, к способам их получения и к сельско-хозяйственной биоцидной (пестицидной) композиций, включающей их для борьбы с вредными организмами (борьбы с вредителями).
N-фенилкарбаматные соединения описываются, например, в (1) выложенной японской патентной заявке N 146881/1988, которая соответствует ЕР-А-268989 патенту США N 4831041:(2)) выложенной японской патентной заявке N 131175/1989, соответствующей ЕР-А-270091 и патенту США N 4996217:(3) Tetrahedron Letters, т.29, N 15, с. 1799-1802, 1988; (4) Journal fur Praktische Chemie, 4. Reine, Band 12. с. 44-49, 1960: (5) Chem. Pharm. Bull. 36 (4), c. 1305-1308 (1988); (6) INGENIERIA Y CIENCIA QUIMICA, 1979, 3 (3), с. 132-133; (7) выложенной японской патентной заявке N 151889, 1975; (8) Journal of Medicinal Chemistry, 1970, том 13, N 4, с. 713-722; и др.
Однако ни один из этих источников не раскрывает такие N-фенилкарбаматные соединения, как представлены общей формулой (1), приведенной ниже.
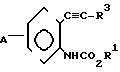
Предлагается N-фенилкарбаматное соединение, представленное следующей общей формулой (1) и его соли, когда это возможно:
A_ 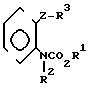 где R1 представляет незамещенную или замещенную алкильную группу;
где R1 представляет незамещенную или замещенную алкильную группу;
R2 атом водорода, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную циклоалкильную группу, или -COX1 группу, в которой Х1 представляет незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную циклоалкильную группу, или незамещенную или замещенную алкокси группу;
Z представляет -CH2S-группу, -SCH2-группу, -СН2О-группу, -ОСН2-группу, -СН2СН2-группу, -СН=СН-группу, -СН ≡ С-группу, -CH2SO-группу, -CH2SO2-группу, -CH2SCH2-группу или -CH2O-N= C(R4)-группу, правая соединительная черточка каждой из которых представляет связь, направленную к R3;
R3 представляет незамещенную или замещенную фенильную группу, незамещенную или замещенную пиридильную группу, незамещенную или замещенную бензотиазолильную группу, незамещенную или замещенную бензоксазолильную группу, незамещенную или замещенную бензимидазолильную группу, незамещенную или замещенную имидазопиридильную группу, незамещенную или замещенную нафтильную группу, незамещенную или замещенную пиримидинильную группу, незамещенную или замещенную тиенильную группу, незамещенную или замещенную фурильную группу, незамещенную или замещенную тиазолильную группу, незамещенную или замещенную оксазолинильную группу, незамещенную или замещенную пиразинильную группу, незамещенную или замещенную тиазолильную группу, незамещенную или замещенную оксазолильную группу, незамещенную или замещенную имидазолильную группу, незамещенную или замещенную пиразолильную группу, незамещенную или замещенную хинолильную группу, незамещенную или замещенную индолильную группу, незамещенную или замещенную пирролильную группу, незамещенную или замещенную безофурильную группу, незамещенную или замещенную бензотиенильную группу, незамещенную или замещенную инданильную группу, незамещенную или замещенную тетрагидронафтильную группу, незамещенную или замещенную дигидробензофурильную группу, незамещенную или замещенную дигидробензотиенильную группу, незамещенную или замещенную бензоксазильную группу, незамещенную или замещенную бензотиазинильную группу, или незамещенную или замещенную бензоильную группу;
R4 представляет атом водорода, незамещенную или замещенную алкинильную группу, незамещенную или замещенную циклоалкильную группу, незамещенную или замещенную алкокси группу, незамещенную или замещенную алкилтио группу, незамещенную или замещенную фенильную группу, циано, группу, -NR5R6 группу, или -CO2R7 группу;
R5 и R6 или каждый независимо представляет атом водорода, незамещенную или замещенную алкильную группу, или объединены друг с другом, образуя 5-7-членную гетероциклическую группу вместе с соседним атомом азота;
R7 представляет незамещенную или замещенную алкильную группу; и А атом водорода, атом галогена, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкокси группу, незамещенную или замещенную фенокси группу, или незамещенную или замещенную пиридилокси группу;
при условии, что (1) R2 представляет атом водорода, когда Z представляет -CH2SO-группу или -CH2SO2-группу, и (2) исключается случай (i) когда R1-метильная группа, R2 атом водорода и -Z-R3 группа 2-нитро-3-пиридилоксиметильная группа, фенилэтинильная группа, стирильная группа или 2-бромбензилокси группа, и (11) когда R1 этильная группа, R2 атом водорода, и -Z-R3 бензилокси группа, фенилэтинильная группа, стиральная группа или 2-бромбензилтио группа.
Предлагаются процессы получения N-фенилкарбаматных соединений, представленных выше приведенной общей формулой (1), или их солей.
Предлагается биоцидная композиция, включающая в качестве эффективного ингредиента N-фенилкарбаматное соединение, представленное общей формулой (1), или его соль.
Заместители замещенной алкильной, алкенильной, алкинильной, циклоалкильной, алкокси или алкилтио групп, включенные в определение, по крайней мере, одного из R1, R2, X1, R4, R5, R6, R7 или А в общей формуле (1), включают атом галогена; цианогруппу; алкоксигруппу, незамещенную или замещенную, по крайней мере, одним атомом галогена и/или, по крайней мере, одной алкоксигруппой; алкилтиогруппу; алкоксикарбонильную группу; алкилкарбонильную группу; или циклоалкильную группу; нитрогруппу; и фенильную группу. Когда число таких заместителей составляет 2 или более, заместители могут быть или одинаковыми или отличными друг от друга.
Заместители замещенной фенильной, пиридильной, бензотиазолильной бензоксазолильной, бензимидазолильной, имидазопиридильной, фенокси, пиридилокси, нафтильной, пиримидинильной, тиенильной, фурильной, тиазолинильной, оксазолинильной, пиразинильной, тиазолильной, оксазолильной, имидазолильной, хинолильной индолильной, пирролильной, бензофурильной, бензотиенильной, инданильной, тетрагидронафтильной, дигидробензофурильной, дигидробензотиенильной, бензоксазинильной, бензотиазинильной, или бензоильной группу, включенной в определение, по крайней мере, одного из R3, R4 и А, включают, например, атом галогена; алкильную группу, незамещенную или замещенную, по крайней мере, одним атомом галогена и/или, по крайней мере, одной алкоксигруппой и/или, по крайней мере алкоксиминогруппой; нитрогруппу; цианогруппу; алкоксикарбонильную группу; алкоксигруппу незамещенную или замещенную, по крайней мере, одним атомом галогена; алкилендиокси группу, незамещенную или замещенную, по крайней мере, одним атомом галогена и/или, по крайней мере, одной алкоксигруппой и/или, по крайней мере, одной алкильной группой; алкилсульфонилокси группу, незамещенную или замещенную, по крайней мере, одним атомом галогена; алкилтиогруппу; алкилсульфонильную группу; алкилсульфинильную группу; арильную группу, такую, как фенильная группа и нафтильная группа; пирролильную группу незамещенную или замещенную, по крайней мере, одной алкильной группой; (2-тетрагидропиранил) оксигруппу; карбамоильную группу, незамещенную или замещенную, по крайней мере, одной алкильной группой; пиридилоксигруппу, незамещенную или замещенную, по крайней мере, одним атомом галогена и/или, по крайней мере, одной трифторметильной группой; диалкиламиногруппу; и алкилкарбонилоксигруппу. Когда число таких заместителей составляет 2 или более, заместители могут быть или одинаковыми или различными.
В качестве алкильной группы или алкильного фрагмента, который также может быть включен в общую формулу (1), могут быть упомянуты, например, алкильные группы, имеющие 1-6 атомов углерода, такие как метил, этил, пропил, бутил, пентил, и гексильная группа. В качестве алкенильной группы или алкенильного фрагмента, которые могут быть включены в общую формулу (1), могут быть упомянуты, например, группы имеющие 2-6 атомов углерода, такие как винил, пропенил, бутенил, пентинил, и гексенильная группа. В качестве алкинильной группы или алкинильного фрагмента, которые могут быть включены в общую формулу (1), могут быть упомянуты, например, алкинильные группы, имеющие 2-6 атомов углерода, такие, как этинильная, пропинильная, бутинильная, пентинильная и гексинильная группа. Эти группы или фрагменты, упомянутые выше, охватывают структурно изомерные группы, имеющие прямую или разветвленную алифатическую цепь. В качестве циклоалкильной группы или циклоалкильного фрагмента, которые могут быть включены в общую формулу (1), например, при обозначении R2, могут быть упомянуты, например, группы, имеющие 3-6 атомов углерода, такие, как циклопропил, циклобутил, циклопентил и циклогексил.
В качестве атомов галогена, которые могут быть включены в общую формулу (1), могут быть упомянуты, например, атом фтора, хлора, брома и атом иода.
R5 и R6 могут быть объединены друг с другом, образуя 5-7-членную гетероциклическую группу вместе со смешным атомом азота. Примеры таких 5-7-членных гетероциклических групп включают насыщенные гетероциклические группы, такие как морфолиногруппа, пирролилидино пиперидино группа; ненасыщенные гетероциклические группы, такие как триазоильная группа и имидазолильная группа.
Когда R3 представляет собой незамещенную или замещенную пиридильную группу, незамещенную или замещенную бензотиазолильную группу, незамещенную или замещенную бензоксазолильную группу, незамещенную или замещенную бензимидазолильную группу, незамещенную или замещенную имидазопиридильную группу, незамещенную или замещенную пиримидинальную группу, незамещенную или замещенную пиразинильную группу, незамещенную или замещенную тиазолильную группу, незамещенную или замещенную оксазолильную группу, незамещенную или замещенную имидазолильную группу, незамещенную или замещенную хинолильную группу, соединение формулы (1) может превращаться в форму соли с кислотным веществом. Примеры таких солей включают соли неорганических кислот, такие как хлоргидрат и сульфат.
Когда Z представляет -CH=CH- группу или -CH2ONK=C(R4)-группу, соединение формулы (1) включает геометрические изомеры в Е-форме и в Z-форме, вследствие содержащейся в нем двойной связи. В данном случае соединение настоящего изобретения охватывает Е изомер, Z изомер и их смесь.
Среди соединений, представленных общей формулой (1), согласно настоящему изобретению предпочитаются следующие соединения.
(I) Соединения формулы (1), в которой представляет -СН=СН-группу или -CH2O- -N=C(R4)-группу, и R4 представляет атом водорода, незамещенную или замещенную алкиль- ную группу, незамещенную или замещенную алкоксигруппу, незамещенную или замещенную алкилтиогруппу, или их соли;
(2) Соединения формулы (1), в которой R2 представляет атом водорода, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкинильную группу или -СОХ1 группу, и Х1 представляет незамещенную или замещенную алкильную группу, или их соли, когда это возможно;
(3) Соединения формулы (1); в которой R3 представляет незамещенную или замещенную фенильную группу, незамещенную или замещенную пиридильную группу, незамещенную или замещенную тиенильную группу, незамещенную или замещенную фурильную группу, незамещенную или замещенную инданильную группу, или незамещенную или замещенную дигидробензофурильную группу, или их соли, когда это возможно.
Более предпочтительными являются соединения формулы (1), в которой R2 представляет незамещенную или замещенную алкильную группу,
Z представляет -CH2O-N=C(R4)-группу, R3 незамещенную или замещенную фенильную группу, незамещенную или замещенную пиридильную группу, незамещенную или замещенную тиенильную группу, незамещенную или замещенную фурильную группу, незамещенную или замещенную инданильную группу, или незамещенную или замещенную дигидробензофурильную группу, и R4 представляет незамещенную или замещенную алкильную группу; и соединения формулы (1), в которой R2 представляет атом водорода или незамещенную или замещенную алкильную группу, представляет -СН= СН- группу, и R3 представляет незамещенную или замещенную фенильную группу. Метильная, этильная и метоксиметильная группы являются более предпочтительными в качестве незамещенных или замещенных алкильных групп, которые могут представлять радикал R2. Метильная группа является более предпочтительной в качестве незамещенной или замещенной алкильной группы, которая может определять R4.
Соединение общей формулы (1) может быть получено, например, в соответствии с одним из следующих процессов реакций 1-6.
(1) Когда Z представляет Z1, который определяет -CH2S-группу, -SCH2-группу, -СН2О-группу, -ОСН2-группу, -СН2СН2-группу, -СН=СН-группу, -С= С-группу, -СН2SCH2-группу или -СН2О-N=C-(R4)-группу, и R4 имеет значения, определенные выше, соединение формулы (1) может быть получено, например, согласно одному из следующих процессов реакций 1-3;
Процесс реакции 1
A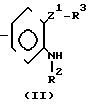 + ClCO2R1___→A
+ ClCO2R1___→A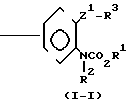
Процесс реакции 2
A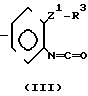 + R1OH___→A
+ R1OH___→A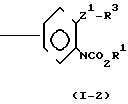
Процесс реакции 3
(I-2)+Y-W ___→ A
В формулах, приведенных в упомянутых выше процессах реакций 1-3, R1, R2, Z, R3 и А имеют значения, определенные выше; Y представляет незамещенную или замещенную алкильную группу, незамещенную или замещен- ную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную циклоалкильную группу, или -СОХ1 группу, где Х1 представляет незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную циклоалкильную группу или незамещен- ную или замещенную алкоксигруппу; и W представляет атом хлора, брома или иода.
В процессе реакции 3 (Х2СО)2О, где Х2 представляет незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, или незамещенную или замещенную циклоалкильную группу, может использоваться вместо Y-W, когда Y представляет -СОХ2, где Х2 имеет те же значения, что определены выше.
(ii) Когда Z представляет группу -CH2SO- или -CH2SO2-, соединение формулы (1) может получаться, например, согласно следующему процессу реакции 4:
Процесс реакции 4
A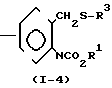 + ок
+ ок щий ____→ A
щий ____→ A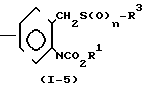
В формулах реакционного процесса 4 R1, R3 и А имеют значения, определенные выше, и n представляет целое число 1 или 2.
(iii) Когда R2 представляет атом водорода и Z представляет группу -СН2О-, СH2S, -CH2SCH2-или -CH2O-N=C(R4)- соединение формулы (1) может получаться, например, согласно следующему процессу реакции 5:
Процесс реакции 5
A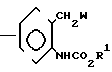 + H-Q-R3 ____→ A
+ H-Q-R3 ____→ A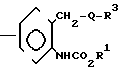
В формуле процесса реакции 5 R1, R3, А и W имеют значения, определенные выше, 0 представляет атом кислорода, атом серы, -SCH2-группу, или -0-N= C(R4)-группу, и соединительная черточка с правой стороны 0 представляет связь, направленную к R3, при условии, что исключаются случаи, когда R1 метильная группа и Q-R3-группа представляет 2 нитро-3-пиридилоксигруппу.
(IV) Когда R2 представляет атом водорода, и Z представляет -C ≡ C-группу, соединение формулы (1) может получаться согласно следующему процессу реакции 6 аналогично методу, описанному, например, в Chem. Pharm. Bull. 86, с. 1305-1308 (1988).
Процесс реакции 6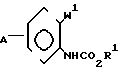



В формулах процесса реакции 6, R1, R3 и А имеют значения, определенные выше, и W представляет атом брома или иода.
Соединение, представленное общей формулой (II), которое используется в процесса реакции 1, может быть получено, например, в соответствии со следующими процессами реакций 7-12, в случае, когда R2 в формуле (II) представляет атом водорода.
(i) Когда Z представляет -CH2O-группу, -CH2S-группу, -CH2SCH2-группу или -CH2- -ON=C(R4)-группу, соединение формулы (II) может быть получено, например, согласно следующему процессу реакции 7:
Процесс реакции 7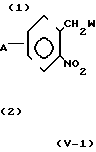
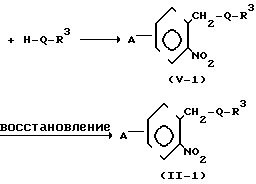
В формулах процесса реакции 7 А, W, Q и R3 имеют значения, определенные выше,
(ii) Когда Z представляет группу -ОСН2- или -SCH2-, соединение формулы (II) может быть получено, например, в соответствии со следующим процессом реакции 8:
Процесс реакции 8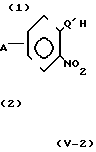
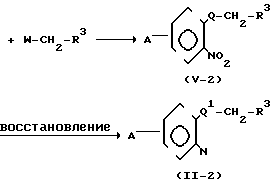
В формулах реакционного процесса 8, А, W и R3 имеют те же значения, что определены выше, и 0 представляет атом кислорода или атом серы.
(iii) Когда Z представляет -СН=СН-группу, соединение формулы (II) может быть получено, например, в соответствии с процессом реакции 9:
Процесс реакции 9
A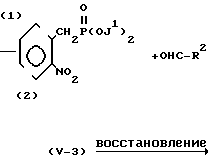
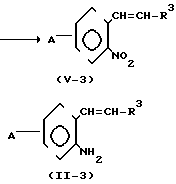
В формулах процесса реакции 9, R3 и А имеют те же значения, что и определены выше, и J1 представляет метильную или этильную группу.
(IV) Когда Z представляет -СН2СН2-группу, соединение формулы (II) может получаться, например, согласно процессу реакции 10:
Процесс реакции 10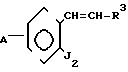
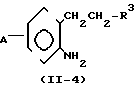
В формулах процесса реакции 10 R3 и А имеют значения, определенные выше, и J2 представляет нитро- или аминогруппу.
(V) Когда Z представляет -С ≡ С-группу, соединение формулы (II) может быть получено например, согласно процессу реакции 11:
Процесс реакции 11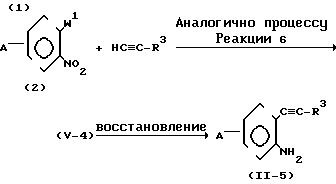 A_
A_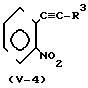
В формулах процесса реакции 11 А, W1 и R2 имеют значения, определенные выше.
(VI) Когда Z представляет собой -SCH2-группу, соединение формулы (II) может получаться, например, в соответствии со следующим процессом реакции 12:
Процесс реакции 12
A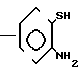 + W-CH2-R3 ____→A
+ W-CH2-R3 ____→A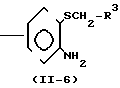
В формулах процесса реакции 12 А, W и R3 имеют значения, определенные выше.
Соединение общей формулы (II), которое используется в реакционном процессе 1, может быть получено, например, согласно следующему реакционному процессу 13, в случае, когда R2 в формуле (II) представляет Y как он определен здесь выше
Процесс реакции 13
A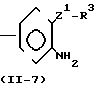 + y-W ____→A
+ y-W ____→A
В формулах процесса реакции 13 A, Z1, R3, Y и W имеют значения, определенные выше.
Соединение, представленное общей формулой, (III), которое используется в процессе реакции 2 может быть получено, например, в соответствии со следующим процессом реакции 14:
Процесс реакции 14:
(11-7)+фосген (III)
Соединение, представленное общей формулой (II), которое используется в процессе реакции 5, может быть получено, например, следующим образом.
(i) Соединение формулы (IV), в котором W представляет атом хлора или брома, может быть получено с помощью взаимодействия производного 2-аминобензилового спирта с ClCO2R1 (где R1 имеет значения, определенные выше) по способу, аналогичному способу в процессе реакции 1 с получением соединения, представленного следующей общей формулой
A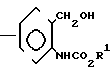 (где R1 и А имеют значения, определенные выше) и подвержения образовавшегося соединения обычному хлорированию, например, с помощью OCl2 или обычному бромированию, например, с помощью SOBr2.
(где R1 и А имеют значения, определенные выше) и подвержения образовавшегося соединения обычному хлорированию, например, с помощью OCl2 или обычному бромированию, например, с помощью SOBr2.
(ii) Соединение формулы (IV), в которой представляет атом иода, может получаться путем взаимодействия с иодидом щелочного металла, таким как иодистый натрий, соединения, полученного на стадии (i) выше, которое имеет формулу (IV), в которой W представляет атом хлора или брома.
Соединение, представленное общей формулой (VI), которое используется в процессе реакции 6, может получаться с помощью реакции с ClCO2R1 (R1 имеет те же значения, что определены выше), соединения представленного следующей общей формулой по способу, аналогичному процедуре, используемой в реакционном процессе 1:
A где А и W1 имеют значения, определенные выше.
где А и W1 имеют значения, определенные выше.
Соединение общей формулы (II) может охватывать его соли и геометрические изомеры в некоторых случаях, точно также, как и соединение общей формулы (1).
Процессы реакций 1, 3, 5, 7 (1), 8 (1), 9 (1), 12 и 13 обычно проводятся в присутствии растворителя и основания. Примеры таких растворителей включают незамещенные или замещенные ароматические углеводороды, такие как бензол, толуол, ксилол, и хлорбензол; галоидированные алифатические углеводороды, такие как хлороформ, четыреххлористый углерод, метиленхлорид, дихлорэтан, трихлорэтан; ациклические или циклические алифатические углеводороды, такие как н-гексан и циклогексан; простые эфиры, такие как диэтиловый эфир, диоксан и тетрагидрофуран; кетоны, такие как ацетон, метилэтилкетон, и метилизобутилкетон; нитрилы, такие как ацетонитрил и пропионитрил; и апротонные полярные растворители, такие как диметилформамид, N-метил-2-пирролидон, диметилсульфоксид и сульфолан. В качестве основания может использоваться или неорганическое основание, или органическое основание. Примеры таких неорганических оснований включают гидроокиси щелочных металлов, такие как гидроокись натрия и гидроокись калия; карбонаты щелочных или щелочноземельных металлов, такие как безводный карбонат калия и безводный карбонат кальция; гидриды щелочных металлов, такие как гидрид натрия; и щелочные металлы, такие как металлический натрий. Примеры таких органических оснований включают пиридин и триэтиламин. Особенно в случае, когда -Z-R3 группа представляет незамещенную или замещенную пиридилтиометильную группу, а также в случае, процесса реакции 9(1), в качестве основания предпочтительно используется гидрид натрия. Температура реакции составляет обычно в интервале от -10 до +150оС, при этом время реакции находится в интервале 0,5-24 ч.
Дополнительно отмечается, что в случае процессов реакции 3 и 13, если необходимо может использоваться катализатор, такой как бромистый тетрабутиламмоний.
Процесс реакции 2 может проводиться в присутствии растворителя и/или катализатора, если необходимо. В качестве растворителей могут быть упомянуты те растворители, которые упоминаются в связи с процессами реакций 1, 3, 5, 7 (1), 8 (1), 9 (1) 12 и 13. В качестве катализатора может быть упомянут триэтиламин, диэтиламин, 1,4-диазабицикло (2.2.2.) октан и др. Температура реакции обычно находится в интервале от 0 до 50оС, при этом время реакции находится в пределах от мгновения до 10 ч.
В качестве окисляющего агента, используемого в процессе реакции 4, могут быть упомянуты м-хлорнадбензойная кислота и аналогичные. Реакция соединения, представленного общей формулой (1-4), с эквимолярным количеством окисляющего агента дает соединение с n 1 в общей формуле (1-5). Реакция соединения, представленного общей формулой (1-4) с двойным молярным количеством окисляющего агента, дает соединение с n в общей формуле (1-5), равным 2. Процесс реакции 4 может обычно осуществляться в присутствии неактивного растворителя, такого как толуол, хлороформ, или метиленхлорид, при температуре от 0 до 130оС в течение 0,1-24 ч.
Способы реакций восстановления, имеющие место в процессах реакций 7 (2) и 8 (2), включают каталитическое восстановление с использованием катализатора, такого как окись платины или палладий на угле; восстановление с использованием металлов, таких как олово, железо или цинк, вместе с кислотой, такой как соляная кислота или серная кислота; восстановление с использованием неорганического соединения, такого, как хлористое олово, сульфат железа (2), гидроокись железа (2) или сульфид натрия, все из которых обычно используются на практике. В случае восстановления с использованием неорганического соединения восстановление может проводиться в присутствии минеральной кислоты, такой как соляная кислота, и в присутствии спирта, такого как этанол, если необходимо.
Способы восстановления, вовлеченные в процессы реакций 9 (2) и 11 (2), включают упомянутые выше методы восстановления с использованием металла вместе с кислотой и упомянутое выше восстановление с использованием неорганического соединения, за исключением каталитического восстановления. Процесс реакции 10 может осуществляться с помощью упомянутого выше каталитического восстановления.
Процесс реакции 14 может осуществляться в присутствии растворителя, примеры которого включают органические растворители, такие как бензол, толуол, ксилол и этилацетат. Температура реакции может лежать в интервале от 50оС до температуры дефлегмации, при этом время реакции может составлять в интервале от момента до 10 ч.
Соединение общей формулы (1) согласно настоящему изобретению полезно в качестве активного ингредиента биоцидных композиций для борьбы с вредными организмами. Например, соединение формулы (1) может использоваться в качестве активного ингредиента сельскохозяйственных и садовых фунгицидов, проявляя превосходное действие в борьбе с заболеваниями растений, такими как цирикуляриоз риса, ризоктониоз риса, гельминтоспориозная пятнистость риса, антракноз огурцов, настоящая мучнистая роса огурцов, поздняя гниль томатов, ранняя гниль томатов, меланоз цитрусовых, обычная зеленая плесень цитрусовых, парша яблони и груши, альтернариоз яблони, ложная мильдью винограда, и серая гниль, склеротиниоз и ржавчина различных культур; и заболеваниями почвы вызываемыми фитопатогенными грибками, такими как Fusarium, Pythium, Phisoctonia Yerticillium и Plasmodiophora. Соединение формулы (1) оказывает особенно превосходное действие в борьбе с цирикуляриозом риса, антракнозом огурцов, настоящей мучнистой росой различных культур, серой плесенью различных культур, склеротиниозом различных культур, ржавчиной разнообразных культур, ложной мильдью огурцов и винограда, и поздней гнилью томатов и картофеля. Соединение настоящего изобретения проявляет не только длительную остаточную активность и превосходное защитное действие, но также оказывает лечебное действие, давая возможность осуществлять подавление заболеваний с помощью обработки ими после заражения. Кроме того, подавление болезней возможно и с помощью обработки почвы соединениями настоящего изобретения. Соединение настоящего изобретения является эффективным не только против восприимчивых штаммов, но также и против различных устойчивых штаммов, таких как настоящая мучнистая роса, устойчивая к беномилу, ложная мильдью устойчивая к металаксилу, и черная плесень, устойчивая к беномилу и/или дикарбоксимиду.
Соединение настоящего изобретения обладает инсектицидной, акарицидной, а также нематоцидной активностью и, следовательно, является эффективным против широкого разнообразия вредителей.
Соединение настоящего изобретения может использоваться в сочетании с вспомогательными добавками с получением разнообразных препаративных форм, таких как эмульгируемый концентрат, дуст, смачиваемый порошок, водный раствор, гранулы, суспензионный концентрат, и др. как и в случае общепринятых сельскохозяйственных химических готовых препаративных форм.
Эти препаративные формы могут на практике использоваться или как таковые, или после разбавления разбавителем, таким как вода, до заданной концентрации. В качестве вспомогательных агентов могут быть упомянуты носители, эмульгирующие агенты, суспендирующие агенты, диспергирующие агенты, спредеры, агенты проникновения, смачивающие агенты, загущающие агенты, и стабилизирующие агенты, которые могут подходящим образом добавляться к соединению настоящего изобретения, в зависимости от желания.
Носители подразделяются на твердые носители и жидкие носители. Примеры твердых носителей включают животные и растительные порошки, такие как крахмал, сахар порошок целлюлозы циклодекстрин, активированный уголь, соевая мука, пшеничная мука, порошок из дегенерированных прицветников, древесная мука, рыбная мука и порошковое молоко; и минеральные порошки, такие как тальк, каолин, бентонит, бентони-алкиламиновый комплекс, карбонат кальция, сульфат кальция, бикарбонат натрия, цеолит, диатомовая земля, белый уголь, глина, глинозем, кремнезем и серый порошок. Примеры жидких носителей включают воду; животные и растительные масла, такие как соевое масло, хлопковое масло, и кукурузное масло; спирты, такие, как этиловый спирт и этиленгликоль; кетоны, такие как ацетон, и метилэтилкетон; простые эфиры, такие как диоксан и тетрагидрофуран; алифатические углеводороды, такие как керосин, ламповое масло, и жидкий парафин; ароматические углеводороды, такие, как ксилол, триметилбензол, циклогексан и растворитель нафта; галоидированные углеводороды, такие как хлороформ и хлорбензол; амиды кислот, такие как диметихлорформамид; сложные эфиры, такие как этилацетат и глицериновые эфиры жирных кислот; нитрилы, такие как ацетонитрил; серусодержащие соединения, такие как диметилсульфоксид; и N-метилпирролидон.
Подходящим весовым соотношением при смешении соединения настоящего изобретения и вспомогательных добавок обычно является соотношение в интервале 0,05:99,95-90:10, и предпочтительно в интервале от 0,2:99,8 до 80:20.
Концентрация соединения настоящего изобретения во время применения варьирует в зависимости от культуры, как объекта обработки, при применении препарата, способа применения, формы препаративной формы, дозы и др. факторов, и поэтому не может быть в основном определена. В случае применения с помощью обработки листвы концентрация соединения настоящего изобретения в качестве активного ингредиента может быть обычно в пределах от 0,1 до 10000 част. /млн. и предпочтительно 1-2000 част./млн.
В случае применения с помощью обработки почвы доза может быть обычно в пределах 10-100000 г/га, и предпочтительно в интервале 200-20000 г/га.
Теперь будет дано описание примеров препаративных форм биоцидной композиции настоящего изобретения для борьбы с вредными организмами, которая включает соединение настоящего изобретения в качестве активного ингредиента. В следующих примерах препаративных форм соединения приводятся под номерами, под которыми они перечислены в табл.2.
Пример препаративной формы 1 (1) Соединение N 132 50 ч. по массе (2) Каолин 40 "
(3) Лигносульфонат натрия 7 "
(4) Полиоксиэтилен- алкилфениловый эфир 3 "
Упомянутые выше компоненты равномерно смешиваются вместе с получением смачиваемого порошка.
Пример препаративной формы 2 (1) Соединение N 19 20 ч. по массе (2) Белая сажа 10 " (3) Каолин 62 "
(4) Полиоксиэтилен- алкилариловый эфир 4 " (5) Лигносульфонат натрия 4 "
Упомянутые выше компоненты равномерно смешиваются вместе, давая смачиваемый порошок.
Пример препаративной формы 3 (1) Соединение N 216 10 ч. по массе (2) Диатомовая земля 15 " (3) Порошок карбоната кальция 69 " (4) Диалкилсульфо- сукцинат 1 " (5) Сульфат полиокси- этилен-алкилфенило- вого эфира 3 " (6) Конденсат-нафталин- сульфоната натрия и формалина 2 "
Упомянутые выше компоненты равномерно смешиваются вместе равномерно, давая смачиваемый порошок.
Пример препаративной формы 4 (1) Соединение N 52 6 ч. по массе (2) Диатомовая земля 88 " (3) Диалкилсульфо- сукцинат 2 "
(4) Сульфат полиокси-
этилен-алкилфенило- вого эфира 4 "
Упомянутые выше компоненты равномерно смешиваются вместе, давая смачиваемый порошок.
Пример препаративной формы 5 (1) Соединение N 240 0,5 ч. по массе (2) Тальк 99,0 " (3) Сульфат низшего спирта 0,5 "
Упомянутые выше компоненты равномерно смешиваются вместе, давая дуст.
Пример препаративной формы 6 (1) Соединение N 193 0,2 ч. по массе
(2) Порошок карбоната кальция 98,8 "
(3) Сульфат низшего спирта 1 "
Упомянутые выше компоненты равномерно смешиваются вместе, давая дуст.
Пример препаративной формы 7 (1) Соединение N 224 20 ч. по массе (2) Ксилол 60 " (3) Полиоксиэтилен-ал- килариловый эфир 20 "
Упомянутые выше компоненты однородно смешиваются в растворе, давая эмульгируемый концентрат.
Пример препаративной формы 8 (1) Соединение N 57 1 ч. по массе (2) Бентонит 33 " (3) Каолин 61 " (4) Лигносульфонат натрия 5 "
Вышеупомянутые компоненты смешиваются с подходящим количеством воды для гранулирования и гранулируются, давая гранулы.
Пример препаративной формы 9 (1) Соединение N 1 10 ч. по массе (2) Кукурузное масло 77 " (3) Полиоксиэтиленовый эфир гидрированного касторового масла 12 " (4) Бентонит-алкил- аминовый комплекс 1 "
Упомянутые выше компоненты равномерно смешиваются вместе и пульверизуются, давая суспензионный концентрат.
Пример препаративной формы 10 (1) Соединение N 19 10 ч. по массе (2) Изопарафиновые насыщенные углеводо- роды (фракция: 210-265 градусов С) 79 " (3) Смесь полиоксиэтилен- фенилфенольного произ- водного и полиоксиэтилен- сорбитаналкилата 10 " (4) Бектонит-алкилами- новый комплекс 1 ч. по массе
Упомянутые выше компоненты равномерно смешиваются вместе и подвергаются тонкодисперсной пульверизации, давая суспензионный концентрат.
Пример препаративной формы 11 (1) Соединение N 159 40 ч. по массе
(2) Оксиэтилированный
полиарилфенолфосфат,
нейтрализованный три- этаноламином 2 " (3) Кремний 0,2 " (4) Ксантовая смола 0,1 " (5) Этиленгликоль 5 " (6) Вода 52,7 "
Упомянутые выше компоненты равномерно смешиваются вместе и пульверизуются (распыляются в порошок) для получения водного суспензионного концентрата.
Пример препаративной формы 12 (1) Соединение N 138 75 ч. по массе (2) Поликарбоксилат натрия 13,5 " (3) Безводный сульфат натрия 10 " (4) Декстрин 0,5 " (5) Алкилсульфонат натрия 1 "
Упомянутые выше компоненты помещаются в высокоскоростной смесительный гранулятор, смешиваются с 20% воды, гранулируются и сушатся для получения водорастворимых гранул.
При желании соединение настоящего изобретения может использоваться в смеси или в сочетании с другими сельскохозяйственными химикатами, примеры которых включают инсектициды, акарициды, нематоциды, фунгициды, противовирусные агенты, аттрактанты, гербициды и регуляторы роста растений. В данном случае эффект соединения или биоцидной композиции настоящего изобретения иногда может усиливаться.
Конкретные примеры активных ингредиентов таких инсектицидов, акарицидов или нематоцидов включают следующие соединения:
Органические фосфатные соединения.
O-(4-бром-2-хлорфенил) O-этил S-пропил фосфоротиоат (обычное название: Профенофос),
O-(2,2-дихлорвинил) O,O-диметилфосфат (Дихлорвос),
O-этил O-[3-метил-4-(метилтио)фенил] N-изопропил фосфороамидат (обычное название: Фенамифос),
O,O-диметил O-(4-нитро-м-толил)фосфоротиоат (Фенитротион),
O-этил O-(4-нитрофенил)фенил фосфонотиат (EPN),
O,O-диметил O-(2-изопропил-6-метилпиримидин-4-ил)фосфоротиоат (диазинон),
O,O-диметил O-(3,5,6-трихлор-2-пиридил)фосфоротиоат (Хлорпирифос-метил),
O,S-диметил N-ацетилфосфороамидоамидотиоат (Ацефат),
O-(2,4-дихлорфенил)-O-этил S-пропил фосфоротиоат (Протиофос) и
(RS)-S-вторбутил O-этил 2-оксо-1,3-тиазолидин-3-ил фосфоротиоат (описанный в патент США N 4590182);
Карбаматные соединения
1-Нафтил N-метилкарбамат (карбарил),
2-изопропоксифенил N-метилкарбамат (Пропоксур),
2-метил-2-(метилтио)пропиональдегид O-метилкарбамоилоксим (Альдикарб),
2,3-дигидро-2,2-диметилбензофуран-7-ил N-метилкарбамат (Карбофуран),
диметил N, N'-[тиобис[(метилимино)карбонилокси] бисэтанимидотиоат (Тиодикарб),
S-метил N-метилкарбамоилокси/тиоацетимидат (Метомил),
N,N-диметил-2-метилкарбамоилокси-мино-2-(метилтио)ацетамид ((Оксамил),
2-этилтииометил/фенил N-метилкарбамат (Этиофенкарб),
2-диметиламино-5,6-диметилпирими-дин-4-ил N,N-диметилкарбамат (Пиримикарб), и
2-втор-бутилфенил N-метилкарбамат (Фенобукарб);
Производные нереистоксина
S,S'-2-диметиламинотриметиленбис(ти- окарбамат) (Картап), и
N,N-диметил-1,2,3-тритиан-5-иламин (Тиоциклам);
Органические соединения хлора
2,2,2-Трихлор-1,1-бис(4-хлорфенил)эта- нол (Дикофол), и
4-хлорфенил-2,4,5-трихлорфенилсуль-фон (Тетрадифон)
Металлоорганические соединения
Бис(трис)2-метил-2-фенилпропил/оло-во оксид (Фенбутатоноксид).
Пиретроидные соединения
(RS)-α-циано-3-феноксибензил-(RS)-2- (4-хлорфенил)-3-метилбутилат (Фенвалерат),
3-феноксибензил-(1RS)-цис-транс-3-(2,2-дихлорвинил)-2,2-диметил- циклопропанкарбоксилат (обычное название: Перметрин),
(RS)-α-циано-3-феноксибензил-(1RS)-цис- транс-3-(2,2-дихлорвинил)- 2,2-диметилциклопропанкарбоксилат (Циперметрин),
(S)-α-циано-3-феноксибензил-(1RS)- цис-транс-3-(2,2-дибромвинил)- 2,2-диметилциклопропанкарбоксилат (Дельтаметрин),
(RS)-циано-3-феноксибензил-(1RS)-цис-транс-3-(2-хлор-3,3,3- трифторпропенил)-2,2-диметилциклопропанкарбоксилат (Цигалотрин), 4-метил-2,3,5,6-тетрафторбензил-3-(2-хлор-3,3,3-трифтор-1-пропенил)- 2,2-диметилциклопропанкарбоксилат (Тефлутрин), и 2-(4-этоксифенил)2-метилпропил 3-феноксибензиловый эфир (Этофенпрокс).
Бензоилмочевиновые соединения
1-(4-Хлорфенил)-3-(2,6-дифторбензоил) мочевина (Дифлубензурон).
1-(3,5-дихлор-4-(3-хлор-5-трифторметил- 2-пиридилокси)фенил)-3- (2,6-дифторбензоил)мочевина (Хлорфлуазурон), и
1-(3,5-дихлор-2,4-дифторфенил)-3-(2,6-фторбензоил)мочевина (Тефлубензурон).
Соединения, подобные ювенильным гормонам
Изопропил (2Е,4Е)-11-метокси-3,7,11-триметил-2,4-додекадиеноат (Метопрен).
Пиридазиноновые соединения
2-Третбутил-5-(4-трет-бутилбензилтио)-4-хлор-3(2-н)пиридазинон (Пиридабен);
Пиразольные соединения
Трет-бутил 4-/(1,3-диметил-5-феноксипиразол-4-ил)- метиленаминооксиметил/бензоат (Фенпироксимат);
Нитросоединения
1-(6-Хлор-3-пиридилметил)N-нитро-им- идазолидин-2-илиденамин (Имидаклоприд),
1-[N-(6-хлор-3-пиридилметил)-N-этил-амино] -1-метиламино-2- нитроэтилен (выложенная европейская патентная заявка N 302389).
2-метиламино-2-(N-метил-П-1)-(6-хлор-3-пиридилметил)амино)-1- нитро-этилен (выложенная европейская патентная заявка N 302389),
1-(6-хлор-3-пиридилметил)амино-1-ди-метиламино-2-нитроэтилен (выложенная европейская патентная заявка N 302389),
1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-аллил-тиоэтилидени) имидазолидин (выложенная европейская патентная заявка N 437784),
1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-этилтиоэтилиден) имидазолидин (выложенная европейская патентная заявка N 437784),
1-(6-хлор-3-пиридилметил)-2-(1-нитро-2-в-метилаллилтиоэтилиден)- имидазолидин (выложенная европейская патентная заявка N 437784),
1-(6-хлор-3-пиридилметил)-3-метил-2-нитрогуанидин (выложенная европейская патентная заявка N 383091),
1-(6-хлор-3-пиридилметил)-3,3-диметил-2-нитрогуанидин (выложенная европейская патентная заявка N 383091),
3-(6-хлор-3-пиридилметил)-2-нитроме-тилен-тиазолидин (выложенная европейская патентная заявка N 192060),
1-(6-хлор-3-пиридилметил)-2-(нитроме- тилен)имидазолидин (выложенная европейская патентная заявка N 163855),
6-(6-хлор-3-пиридилметиламино)-1,3-ди- метил-5-нитро-1,2,3,4- тетрагидропиримидин (выложенная европейская патентная заявка N 366085), и
1-(6-хлор-3-пиридилметил)-5-нитро-3-метил-6-метиламино-1,2,3,4- тетрагидропиримидин (выложенная европейская патентная заявка N 366085);
Динитро соединения
Органические соединения серы
Мочевиновые соединения
Триазиновые соединения
Гидразиновые соединения
Другие соединения
2-Трет-бутиламино-3-изопропил-5-фе-нил-3,4,5,6-тетрагидро-2Н- 1,3,5-тиадиазин-4-он (Бупрофезин),
транс-(4-хлорфенил)-N-циклогексил-4-метил-2-оксотиазолидинон- 3-карбоксамид (Гекситиазокс),
N-метилбис(2,4-ксилилиминометил)ам- ин (Амитраз),
N'-(4-хлор-о-толил)-N,N-диметилформ- амид (Хлордимеформ), и
(4-этоксифенил)-[3-(4-фтор-3-фенокси-фенил)пропил] (Диметил) силан (Силафлуофен).
Соединения настоящего изобретения могут также использоваться в смеси или в сочетании с микробными сельскохозяйственными химикатами 6, такими как В.Т. и вирусы насекомых, и антибиотики, такие, как авермектин и милбемицин.
Конкретные примеры активных ингредиентов, упомянутых выше фунгицидов, включают следующие соединения:
Пиримидинаминовые соединения
2-Анилино-4-метил-6-(1-пропинил/пи-римидин) (описанный в выложенной японской патентной заявке N 208581/1988),
Азольные соединения
1-(4-хлорфенил)-3,3-диметил-1-(1Н-1,2,4-триазол-1-ил)бутанон (Триадимефон),
1-(биренил-4-илокси)-3,3-диметил-1-(1Н-1,2,4-триазол-1-ил)бутин- 2-ол (Битертанол),
1-(N-(4-хлор-2-трифторметилфенил)-2-пропоксиацетимидоил) имидазол (Трифлумизол),
1-[2-(2,4-дихлорфенил)-4-этил-1,3-дио-ксолан-2-ил-метил] -1H-1,2,4- триазол (Этаконазол),
1-[2-(2,4-дихлорфенил)-4-пропил-1,3-ди- оксолан-2-ил-метил]-1H- 1,2,4-триазол (Пропиконазол),
1-[2-(2,4-дихлорфенил)пентил]-1H-1,2,4-триазол (Пенконазол),
бис(4-фторфенил)-метил)(1Н-1,2,4-три- азол-1-ил-метил)силан (Флусилазол),
2(4-хлорфенил)-2-(1Н-1,2,4-триазол-1- ил-метил)гексаннитрил (Миклобутанил),
(2RS, 3RS)2-(4-хлорфенил)-3-циклопропил-1-(1Н-1,2,4-триазол-1- ил-(бутан-2-ил (Ципроконазол),
(RS)-1-(4-хлорфенил)-4,4-диметил-3(1Н-1,2,4-триазол-1-ил-метил)- пентан-3-ол (Тербуконазол),
(RS)-2-(2,4-дихлорфенил)-1-(1Н-1,2,4-три- азол-1-ил)гексан-2-ол (Гексаконазол),
(2RS, 5RS)-5-(1,2,4-дихлорфенил)тетрагидро-5-(1Н-1,2,4-триазол-1- илметил)-2 фурил 2,2,2-трифторэтиловый эфир (Фурконазол-цис), и
N-пропил-N-[2-(2,4,6-трихлорфенокси)этил] -имидазол-1-карбоксамид (Прохлораз),
Хиноксалиновые соединения
6-Метио-1,3-дитио[4,5-b]хиноксалин-2-он (Хинометионат),
Дитиокарбаматные соединения
марганец этиленбис (дитиокарбаматный) полимер (Манеб),
цинк этиленбис (дитиокарбаматный) полимер (Зинеб),
комплекс цинка с этиленбис (дитикарбаматом) марганца (Манеб) (Манкозеб),
дицинк бис(диметилдитиокарбамат) этиленбис (дитиокарбамат) (Поликарбамат) и
цинк пропиленбис (Дитиокарбаматный) полимер (Пропинеб).
Хлорорганические соединения
4,5,6,7-Тетрахлорфталид (Фталид),
тетрахлоризофталонитрил (Хлорталонил) и
пентахлорнитробензол (Хинтозен).
Безимидазольные соединения
метил 1-(бутилкарбамоил)бензимидазол-2-илкарбамат (Беномил),
диметил 4,4'-(o-фенилен)бис(3-тиоаллофанат) (Тиофанат-Метил), и
метил бензимидазол-2-илкарбамат (карбендазим).
Пиридинаминовые соединения
3-хлор-N-(3-хлор-2,6-динитро-4-α, α, α -трифтортолил)-5-трифторметил- 2-пиридинамин (Флуазинам),
Цианоацетамидные соединения
1-(2-циано-2-метоксиминоацетил)-3- этилмочевина (Цимоксанил).
Фениламидные соединения
метил N-(2-метоксиацетил)-N-(2,6-оксилил)-DL-аланинат (Металаксил),
2 метокси-N-(2-оксо-1,3-оксазолидин-3-ил)ацето-2',6'-ксилидил (Оксадиксил),
( ± )- α-2-хлор-N-(2,6-ксилилацетамидо)- γ-бутиролактон (Офурас),
метил-N-фенилацетил-N-(2,6-ксилил)-DL-аланинат (Беналаксил),
метил N-(2-фуроил)-N-(2,6-ксилил)-DL-аланинат (Фуралаксил) и
( ± )-α-[N-(3-хлорфенил)циклопропанкарбо- ксамидо] -γ-бутиролактон (Ципрофурам).
Соединения сульфеновой кислоты
N-Дихлорфторметилтио-N',N'-диметил-N-фенилсульфамид (Дихлорфлуанид)
Соединения меди
Гидроокись меди (гидроокись меди) и
8-хинолинолат меди (Оксин-медь).
Изоксазольные соединения
5-Метилизоксазол-3-ол (Гидроксиизоксазол).
Органофосфорные соединения
Алюминий-трис(этилфосфонат) (фосетил-AL),
O-2,6-дихлор-п-толил-O,O-диметилфос- форотиоат (Толкофос-метил),
S-бензил O,O-диизопропилфосфоротиоат,
O-этил S,S-дифенилфосфородитиоат и
Кислый этилфосфонат алюминия
N-галогентиоалкильные соединения
N-(трихлорметилтио)циклогекс-4-ен-1,2-дикарбоксимид (Каптан),
N-(1,1,2,2-тетрахлорэтилтио)циклогекс-4-ен-1,2-дикарбоксимид (Каптафол) и
N-(трихлорметилтил)фталимид (Фолпет).
Дикарбоксимидные соединения
N-(3,5-дихлорфенил)-1,2-диметилцикл-опропан-1,2-дикарбоксимид (Процимидон),
3-(3,5-дихлорфенил)-N-изопропил-2,4-диоксооифидазолидин-2,4-дион (Винклозолин),
Бензанилидные соединения
α, α, α-трифтор-3'-изопропокси-о-толуанилид (Флутоланил) и
3'-изопропокси-о-толуанилид (Мепронил).
Безамидные соединения
2-(1,3-диметилпиразол-4-илкарбонила- мино)-4-метил-3-пентеннитрил (описанный в Британском патенте N 2190375) и α-(никотиниламино)- (3-фторфенил)-ацетонитрил (описанный в выложенной японской заявке N 135364) (1988);
Пиперазиновые соединения
N, N'-(Пиперазин-1,4-диулбис(трихлор- метил)-метилен))диформамид (трифорин).
Пиридиновые соединения
2',4'-Дихлор-2-(3-пиридил)ацетофенон O-метилоксим (Пирифенокас);
Карбинольные соединения
( ± )-2,4'-дихлор-α-(пиримилин-4-ил)бе- нзнидриловый спирт (Фенаримол), и
( ± )-2,4-дифтор-α-(1Н-1,2,4-триазол-1 ил-метил)бензигидриловый спирт (Флутриафол),
Пиперидиновые соединения
(RS)-1 [3-(4-трет-бутилфенил)-2 метилпропил]пиперидин (Фенпропидин).
Морфолиновые соединения
( ± )-цис-4-[3-(4-трет-бутилфенил)-2-метилпропил]-2,6- диметилморфолин (Фенпропиморф).
Оловоорганические соединения
Гидроокись трифенилолоза (Фентин гидроксид), и
ацетат трифенилола (Фентин ацетат).
Мочевиновые соединения
1-(4-Хлорбензил)-1-циклопентил-3-фе-нилмочевина (Пенцикурон).
Соединения коричной кислоты
(Е, Z) 4-[3-(4-хлорфенил)-3-(3,4-диметоксифенил)акрилоил] морфолин (Диметилморф).
Фенилкарбаматные соединения
Изопропил 3,4-диэтоксикарбанилат (Диэтофенкаб);
Цианопиppольные соединения
3-Циано-4-(2,2-дифтор-1,3-бензодиок-сол-4-ил)пиррол (торговая марка, Сафир), и
3-(2',3'-дихлорфенил)-4-цианопиррол (Фенпиклонил).
Другие активные ингредиенты фунгицидов включают антрахиноновые соединения, соединения кpотоновой кислоты и антибиотики.
Подходящее соотношение при смешении N-фенилкарбаматного соединения настоящего изобретения, представленного общей формулой (1), и другого (или других) сельскохозяйственного химиката, когда они используются в смеси или в сочетании, может обычно быть в пределах от 1:300 до 300:1, и предпочтительно в интервале 1:100 до 100:1.
П р и м е р 1. (Синтез метил N-[2-(3-хлор-5-трифторметил-2 пиридилтиометил)фенил] карбамата (соединение 1)
(1) 2 г 60 мас. гидрида натрия добавлялись к 45 мл тетрагидрофурана при перемешивании при комнатной температуре с последующим добавлением к смеси по каплям раствора 9,9 г 3-хлор-2 меркапто-5-трифторметилпиридина в 40 мл тетрагидрофурана. После завершения добавления по каплям реакционная смесь нагревалась с обратным холодильником в течение 30 мин, и охлаждалась до комнатной температуры с последующим добавлением к ней по каплям раствора 10 г 2 нитро-бензилбромида в 60 мл тетрагидрофурана. После завершения добавления по каплям продолжалось перемешивание при комнатной температуре в течение 15 ч. Реакционная смесь выливалась в воду, подвергалась экстракции этилацетатом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся в результате остаток очищался с помощью хроматографии на силикагельной колонке (проявляющий растворитель: метиленхлорид: гексан 4:1), с получением 12 г 2-(3-хлор-5-трифторметил-2- пиридилтиометил) нитробензола.
(2) Смесь 19,5 г хлористого олова дигидрада и 28,5 мл концентрированной соляной кислоты охлаждалась до 5оС. 10 г 2-(3- хлор-5-трифторметил-2-пиридилтиометил)нитробензола, полученного на стадии (1), добавляясь к охлажденной смеси при встряхивании с последующим добавлением к смеси 52 мл этанола. Получающаяся смесь постепенно нагревалась до 80оС, при этой температуре нагревание продолжалось в течение одного часа. Реакционная смесь охлаждалась, выливалась в воду, и подщелачивалась 40 вес. водным раствором гидроокиси калия. Выпавшее в осадок твердое вещество отфильтровывалось и сушилось; давая 8,3 г 2(3-хлор-5-трифторметил)-2-пиридилтиоме- тил)анилина (промежуточное соединение N 1), имеющего точку плавления 98-102оС.
(3) Раствор 2,23 г 2-(3-хлор-5-трифторметил-2 пиридилтиометил)- анилина и 0,83 г пиридина в 10 мл толуола добавлялся по каплям к раствору 1,1 г хлорформата метила в 10 мл толуола при перемешивании при 10-15оС. После завершения добавления по каплям реакция продолжалась при комнатной температуре в течение 2 ч. После завершения реакции реакционная смесь выливалась в воду, подвергалась экстракции этилацетатом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток промывался гексаном. Выпавшее в осадок твердое вещество отфильтровывалось, давая 1,9 г желаемого продукта (соединение N 1), имеющего точку плавления 111-113оС.
П р и м е р 2. (Синтез метил N-[2-(3-хлор-5-трифторметил-2- пиридилтиометил)фенил]-N-метоксиметил)карбамата (соедине- ние N 3).
0,22 г порошка гидроокиси калия добавлялось понемногу к раствору 1 г соединения, полученного в предыдущем примере синтеза 1 (соединение N 1) в 12 мл тетрагидрофурана, с последующим добавлением к смеси 0,19 г бромистого тетра-н-бутиламмония. К получающейся смеси при комнатной температуре добавлялось 0,43 г хлорметил-метилового эфира, при этом перемешивание продолжалось в течение 15 ч. Реакционная смесь выливалась в воду, подвергалась экстрагированию метиленхлоридом, промывалась водой, и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на силикагельной колонке (проявляющий растворитель: метиленхлорид:гексан 1:1), давая 0,52 г желаемого продукта (Соединение N 3), который показывал показатель преломления nD 26,4 1.5077.
П р и м е р 3 (Синтез метил N-[2-[[ α-метил-3-(трифторметил) бензидиден] аминооксиметил]фенил]карбамата (соединение N 56).
(1) 7,5 г 3'-трифторметилацетофенона, 6,25 г хлоргидрата гидроксиламина и 8,8 г тригидрата ацетата натрия нагревались в 125 мл метанола в условиях дефлегмации в течение одного часа. После завершения реакции метанол отгонялся при пониженном давлении. К получающемуся остатку добавлялось 190 мл воды с последующей экстракцией этилацетатом. Этилацетатный слой сушился над безводным сульфатом натрия и растворитель удалялся с помощью перегонки при пониженном давлении: давая 7,3 г 3'-трифторметилацетофенон-оксима, имеющего точку плавления 63-65оС.
(2) 0,66 г 60 мас. гидрида натрия добавлялось к 18 мл тетрагидрофурана при перемешивании при комнатной температуре с последующим добавлением по каплям к смеси раствора 3 г 3'-трифторметилацетофеноноксима, полученного на стадии (1) в 18 мл тетрагидрофурана. После завершения добавления по каплям реакционная смесь перемешивалась при комнатной температуре в течение одного часа с последующим добавлением по каплям к нему раствора 3 г метил N-[2-(хлорметил)фенил] карбамата в 20 мл тетрагидрофурана. После завершения добавления по каплям перемешивание продолжалось при комнатной температуре в течение 3 ч. Реакционная смесь выливалась в воду, подвергалась экстракции этилацетатом, промывалась водой, сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на силикагельной колонке (проявляющий растворитель: метиленхлорид: гексан 4:1), давая 1,8 г целевого продукта (соединение N 56), имеющего точку плавления 77-80оС.
П р и м е р 4 (Синтез метил N-(метоксиметил)-N-[2-[[ α-метил-3- (трифторметил)бензилиден]-аминооксиметил]фенил]карбама-та (соединение N 57).
0,29 г порошка гидроокиси калия добавлялось понемногу к раствору 1,3 г соединения, полученного в предыдущем примере синтеза 3 (соединение N 56) в 25 мл тетрагидрофурана, с последующим добавлением к смеси 0,25 г тетра-н-бутиламмонийбромида. К получающейся в результате смеси при комнатной температуре добавлялось 0,57 г хлорметилметилового эфира и при этой температуре перемешивание продолжалось в течение одного часа. Реакционная смесь выливалась в воду, подвергалась экстракции простым эфиром, промывалась водой, сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на силикагельной колонке (проявляющий растворитель: метиленхлорид: гексан 3:1), давая 0,81 г целевого продукта (соединение N 57), которое показывало показатель преломления пD19.3.1.4761.
П р и м е р 5 (Синтез метил N-[2-(2-хлорстирил)фенил]карбамата (соединение N 52).
(1) 1,63 г 60 мас. гидрида натрия добавлялось к 20 мл тетрагидрофурана при перемешивании при комнатной температуре, с последующим охлаждением смеси до 0оС и добавлением к ней по каплям раствора 8 г диметил 2-нитробензилфосфоната в 20 мл тетрагидрофурана. После завершения добавления по каплям реакционная смесь перемешивалась при 0оС в течение 30 мин, с последующим добавлением к ней по каплям 6,2 г 2 хлорбензальдегида. После завершения добавления по каплям получающаяся в результате смесь постепенно нагревалась до комнатной температуры, и при этой температуре перемешивание затем продолжалось в течение 17 ч. Реакционная смесь выливалась в воду, подвергалась экстрагированию этилацетатом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на силикагельной колонке (первый проявляющий растворитель: метиленхлорид: гексан 7:3, второй проявляющий растворитель: метиленхлорид: гексан 3:1), давая 5,8 г 2-хлор-2'-нитростибена.
(2) 23 мл концентрированной соляной кислоты добавлялось к 15,1 г дигидрата хлористого олова, давая смесь, к которой при перемешивании добавлялось 5,8 г 2-хлор-2'-нитростильбена, полученного на стадии (1) и 41 мл этанола. После этого получающаяся смесь постепенно нагревалась до температуры дефлегмации, при которой нагревание затем продолжалось в течение 25 мин. Реакционная смесь охлаждалась, выливалась в воду, подщелачивалась водным раствором гидроокиси калия. Выпавшее в осадок полутвердое вещество отфильтровывалось. К полутвердому веществу добавлялся этилацетат с последующим удалением нерастворимых веществ с помощью фильтрования. Фильтрат подвергался перегонке при пониженном давлении, давая 5 г маслянистого 2 амино-2-'-хлорстильбена (промежуточное соединение N 13).
(3) Раствор 5 г 2-амино-2'-хлорстильбена, полученного на стадии (2), и 2,6 г пиридина в 30 мл толуола добавлялся по каплям к раствору 3,4 г метилхлорформата в 39 мл толуола при перемешивании при комнатной температуре. После завершения добавления по каплям реакция продолжалась при комнатной температуре в течение 2 ч. После завершения реакции реакционная смесь выливалась в воду, подвергалась экстрагированию сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался дважды с помощью хроматографии на силикагельной колонке (первый проявляющий растворитель: метиленхлорид: гексан 3:1, и второй проявляющий растворитель: этилацетат: гексан 1: 4), давая 1,85 г желаемого продукта (соединение N 52), имеющего точку плавления 135-137оС.
П р и м е р 6 (Синтез метил N-[2-(2-хлористирил)фенил]-N- (метоксиметил)-карбамата (соединение N 53)).
0,29 г порошка гидроокиси калия добавлялось понемногу к раствору 1 г соединения, полученного в предыдущем примере синтеза 5 (соединение N 52) в 20 мл тетрагидрофурана с последующим добавлением к смеси 0,25 г бромистого тетра-н-бутиламмония. К получающейся смеси добавлялось 0,56 г хлорметил-метилового эфира при комнатной температуре, при которой перемешивание затем продолжалось в течение одного часа и 30 мин. Реакционная смесь выливалась в воду, подвергалась экстрагированию этилацетатом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на силикагельной колонке (проявляющий растворитель: метиленхлорид: гексан 2:1), давая 0,54 г желаемого продукта в форме вязкой жидкости (соединение N 53), данные ЯМР для которого приводятся в описании следующей ниже табл.2, которая будет дана позднее.
П р и м е р 7 (Синтез метил N-[2-(3-хлор-5-трифторметил-2-пиридил-сульфинилме-тил)фенил]карбамата (соединение N 60)).
0,41 г м-хлорнадбензойной кислоты добавлялось понемногу к раствору 0,75 N-[2-(3-хлор-5-трифторметил-2-пиридилтиометил) фенил]-карбамата, полученного таким же образом, как в примере синтеза 1 (соединение N 1) в 20 мл метиленхлорида при перемешивании при комнатной температуре. После завершения добавления реакция продолжалась при комнатной температуре в течение 20 ч. Реакционная смесь выливалась в воду, подвергалась экстрагированию этилацетатом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгоняется при пониженном давлении. Получающийся остаток промывался гексаном. Выпавшее в осадок твердое вещество отфильтровывалось, давая 0,66 г желаемого продукта (соединение N 60), имеющего точку плавления 160-162оС.
П р и м е р 8 (Синтез метил N-[2[[(метилтио)(5-трифторметил-2-пиридил)метилен] аминооксиметил] фенил]карбамата (соединение N 201)).
(1) 180 мл этанола добавлялось к раствору 22 г 2 циано-5-трифторметилпиридина в 180 мл 1,2-дихлорэтана при перемешивании при комнатной температуре с последующим добавлением по каплям к смеси раствора 9,8 г хлоргидрата гидроксиламина в 17 мл воды. Водный раствор 5,6 г гидроокиси натрия в 17 мл воды добавлялось по каплям к получающейся смеси. После завершения добавления по каплям реакционная смесь подогревалась при 80оС в течение 2 ч. Реакционная смесь охлаждалась и удалялись растворимые вещества с помощью фильтрования. Фильтрат подвергался перегонке при пониженном давлении для удаления из него растворителя. Получающийся остаток промывался гексаном. Выпавшее в осадок твердое вещество отфильтровывалось, давая 25 г 5-трифторметил-2 пирилинкарбоксамидоксима, имеющего точку плавления 130-133оС.
(2) 10,25 г 5-трифторметил-2-пиридинкарбоксамидоксима, полученного на предыдущей стадии (1) добавлялись к 175 мл 4 н. соляной кислоты при перемешивании. Получающаяся смесь охлаждалась до 0-5оС с последующим добавлением к ней по каплям водного раствора 4,15 г нитрита натрия в 25 мл воды. После окончания добавления по каплям перемешивание продолжалось при 0-5оС в течение 3 ч. После завершения реакции выпавшее в осадок твердое вещество отфильтровывалось, давая 8,8 г α-хлор-5-трифторметилпиридинкарбоксальдегид-ок- сима.
(3) 10 мл 15 мас. водного раствора метантиолата натрия добавлялись по каплям к раствору 4,49 г α-хлор-5- трифторметилпиридинкарбальдегидоксима, полученного на предыдущей стадии (2), в 10 мл тетрагидрофурана при перемешивании при комнатной температуре. После завершения добавления по каплям перемешивание продолжалось при комнатной температуре в течение одного часа. После завершения реакции реакционная смесь выливалась в воду, подвергалась экстракции простым эфиром, промывалась водой, сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающаяся в результате смесь очищалась с помощью хроматографии на силикагельной колонке (проявляющийся растворитель: метиленхлорид), давая 3,5 г α-метилтио-5-трифторметилпиридинкарбальдегидроксима.
(4) 0,62 г 60 мас. гидрида натрия добавлялось к 20 мл тетрагидрофурана при перемешивании при комнатной температуре, с последующим добавлением по каплям к смеси раствора 3,3 г α-метилтио-5-трифторметилпиридинкарбальдегидоксима, полученного на предыдущей стадии (3) в 30 мл тетрагидрофурана. После окончания добавления по каплям реакционная смесь перемешивалась при комнатной температуре в течение 30 мин с последующим добавлением к ней по каплям раствора 3,35 г метил N-[2-(хлорметил)фенил] карбамата в 30 мл тетрагидрофурана.
После окончания добавления по каплям перемешивание продолжалось при комнатной температуре в течение 3 ч. Реакционная смесь выливалась в воду, подвергалась экстрагированию метиленхлоридом, промывалась водой, сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на силикагельной колонке (проявляющийся растворитель:метиленхлорид:гексан 1:2), давая 3,1 г желаемого продукта (соединение N 201), имеющего точку плавления 120-122оС.
П р и м е р 9 (Синтез метил N-(метоксиметил)-N-[2-[[метилтио)- 5-трифторметил-2-пиридил)-метилен] аминооксиметил] фенил] карбамата (соединение N 202).
0,28 г порошка гидроокиси калия добавлялось понемногу к раствору 1,32 г соединения, полученного в примере синтеза 8 (соединение N 201 в 25 мл тетрагидрофурана, с последующим добавлением к смеси 0,25 н. бромистого тетра-н-бутиламмония. К получающейся в результате смеси при комнатной температуре добавлялось 0,53 г хлорметил-метилового эфира, и при этой температуре перемешивание затем продолжалось в течение одного часа. Реакционная смесь выливалась в воду, подвергалась экстрагированию метиленхлоридом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищали с помощью хроматографии на колонке на силикагеля (проявляющий растворитель:метиленхлорид:гексан 1:2), давая 1,0 г желаемого продукта в виде полутвердого вещества (соединение N 202).
П р и м е р 10 (Синтез метил N-[2-[ α-метилбензилиденаминооксиметил]фенил]кар- бамата (соединение N 131).
2,0 г порошка гидроокиси калия добавлялось понемногу к 30 мл тетрагидрофурана с последующим добавлением к нему по каплям при перемешивании при комнатной температуре раствора 4,06 г ацетофеноноксима в 25 мл тетрагидрофурана. После окончания добавления по каплям реакционная смесь перемешивалась при комнатной температуре в течение 30 мин, с последующим добавлением по каплям к смеси раствора 6,0 г метил N-[2-(хлорметил)фенил] карбамата в 30 мл тетрагидрофурана. После завершения добавления по каплям перемешивание продолжалось при комнатной температуре в течение одного часа и 20 мин. Реакционная смесь выливалась в воду, подвергалась экстрагированию этилацетатом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся остаток очищался с помощью хроматографии на колонке из силикагеля (проявляющий растворитель:метиленхлорид:гексан 3:1), давая 5,7 г желаемого продукта (соединение N 131), имеющего точку плавления 84-88оС.
П р и м е р 11 (Синтез метил N-(метоксиметил)-N-[2-[[ α-метилбензилиден)аминооксиметил]фенил]карбамата (соединение N 132).
0,82 г порошка гидроокиси калия добавлялось понемногу к раствору 3,0 г соединения, полученного в предыдущем примере синтеза 10 (соединение N 131) в 50 мл тетрагидрофурана, с последующим добавлением к нему 0,72 г бромистого тетра-н-бутиламмония. 1,61 г хлорметил-метилового эфира добавлялось к получающейся в результате смеси при комнатной температуре, при которой перемешивание продолжалось затем в течение 30 мин. Реакционная смесь выливалась в воду, подвергалась экстрагированию этилацетатом, промывалась водой и сушилась над безводным сульфатом натрия. Растворитель отгонялся при пониженном давлении. Получающийся в результате остаток очищался с помощью хроматографии на колонке из силикагеля (проявляющийся растворитель:гекcaн:этилацетат 5:1), давая 2,2 г желаемого продукта (соединение N 132), имеющего точку плавления 61-63оС. Данные ЯМР, для которого приведены в описании следующей табл.2, которая будет дана ниже.
Характерные представители примеров промежуточных продуктов общей формулы (II) и соединений общей формулы (I) согласно настоящему изобретению перечисляются в табл.1 и 2 соответственно.
В табл.1 дефис с правой стороны от Z' представляет связь направленную к R3.
1Н-ЯМР данные для промежуточного вещества N 3 (в CDCl3): 3,90-4,67 (шир. с 2Н), 4,43 (с, 2Н), 6,55-7,55 (м, 7Н), 8,33-8,47 (дд, 1Н),
1Н-ЯМР данные для промежут. в-ва N 4 (в CDCl3): 3,50-4,00 (шир. с, 2Н), 3,60 (с, 4Н), 6,60-7,30 (м, 9Н),
1Н-ЯМР данные для промежут. в-ва N 5 (в CDCl3): 3,97-4,40 (шир. с 2Н), 4,50 (с, 2Н), 6,57-7,27 (м, 5Н), 7,80 (дд, 1Н), 8,57 (дд, 1Н).
1Н-ЯМР данные для промежут. в-ва N 6 (в CDCl3): 3,92-4,08 (шир. с, 2Н), 4,42 (с, 2Н), 6,57-7,25 (м, 5Н), 7,58 (дд, 1Н), 8,67 (дд, 1Н).
1Н-ЯМР данные для промежут. в-ва N 11 (в CDCl3): 3,97 (с, 2Н), 4,07-4,43 (шир. с, 2Н), 6,40-7,37 (м, 8Н).
В табл.2 дефис с правой стороны от Z представляет связь, направленную к R3
1Н-ЯМР данные для соединения 4 (в CDCl3): 3,27 (с, 3Н), 3,67 (с, 3Н), 4,47 (с, 2Н), 7,13-7,62 (м, 4Н), 7,73 (д, 1Н), 8,60 (д, 1Н).
1Н-ЯМР данные для соединения 11 (в CDCl3): 2,25 (т, 1Н), 3,67 (с, 3Н), 4,28 (д, 2Н), 4,45 (с, 2Н), 7,13-7,60 (м, 4Н), 7,68 (д, 1Н), 8,58 (д, 1Н),
1Н-ЯМР данные для соединения 20 (в CDCl3): 3,40 (с, 3Н), 3,63 (с, 3Н), 4,50 (с, 2Н), 4,58 (дд, 2Н), 7,17-7,57 (м, 4Н), 7,93 (д, 1Н), 8,73 (д, 1Н),
1Н-ЯМР данные для соединения 21 (в CDCl3): 2,23 (т, 1Н), 3,70 (с, 3Н), 4,38 (ддд, 2Н), 4,53 (с, 2Н), 7,18-7,63 (м, 4Н), 8,00 (д, 1Н), 8,80 (д, 1Н),
1Н-ЯМР данные для соединения 27 (в CDCl3): 3,42 (с, 3Н), 3,65 (с, 3Н), 4,33 (с, 2Н), 4,90 (дд, 2Н), 7,10-7,50 (м, 4Н), 7,43 (д, 1Н), 8,20 (д, 1Н).
1Н-ЯМР данные для соединения 40 (в CDCl3): 3,43 (с, 3Н), 3,68 (с, 3Н), 4,58 (с, 2Н), 4,95 (дд, 2Н), 7,07-7,88 (м, 8Н),
1Н-ЯМР данные в CDCl3 соединения 44: 3,37 (с, 3Н), 3,58 (с, 3Н), 4,12 (с, 2Н), 4,80 (дд, 2Н), 6,97-7,37 (м, 8Н),
1Н-ЯМР данные для соединения 53 (в CDCl3): 3,40 (с, 3Н), 3,62 (с, 3Н), 4,93 (дд, 2Н), 6,85-7,77 (м, 10Н),
1Н-ЯМР данные для соединения 63 (в CDCl3): 3,42 (с, 3Н), 3,53 (с, 3Н), 3,67 (с, 3Н), 4,57 (с, 2Н), 4,98 (дд, 2Н), 7,07-7,62 (м, 7Н).
1Н-ЯМР данные для соединения 67 (в CDCl3): 3,75 (с, 3Н), 4,47 (с, 2Н), 4,52 (дд, 2Н), 7,23-7,67 (м, 4Н), 7,75 (д, 1Н), 8,60 (д, 1Н),
1Н-ЯМР данные для соединения 92 (в CDCl3): 2,18 (с, 3Н), 3,63 (с, 3Н), 4,47 (с, 2Н), 4,80 (дд, 2Н), 7,17-7,67 (м, 4Н), 7,75 (дд, 1Н), 8,60 (дд, 1Н),
1Н-ЯМР данные для соединения 132 (в CDCl3): 2,20 (с, 3Н), 3,40 (с, 3Н), 3,63 (с, 3Н), 4,93 (дд, 2Н), 5,16 (с, 2Н), 7,20-7,67 (м, 9Н).
1Н-ЯМР данные для соединения 159 (в CDCl3): 2,33 (с, 3Н), 3,13 (с, 3Н), 3,70 (с, 3Н), 4,98 (дд, 2Н), 5,20 (с, 2Н), 7,26-7,90 (м, 6Н), 8,50 (д, 2Н),
1Н-ЯМР данные для соединения 193 (в CDCl3): 2,23 (с, 3Н), 2,33 (с, 3Н), 3,43 (с, 3Н), 3,70 (с, 3Н), 5,00 (дд, 2Н), 5,17 (с, 2Н), 7,10-7,50 (м, 8Н).
1Н-ЯМР данные для соединения 202 (в CDCl3): 2,27 (с, 3Н), 3,43 (с, 3Н), 3,67 (с, 3Н), 5,00 (дд, 2Н), 5,27 (с, 2Н), 7,16-8,07 (м, 6Н), 8,90 (д, 1Н).
1Н-ЯМР данные для соединения 217 (в CDCl3): 2,23 (с, 3Н), 3,43 (с, 3Н), 3,70 (с, 3Н), 3,80 (с, 3Н), 5,03 (дд, 2Н), 5,20 (с, 2Н), 6,77-7,63 (м, 8Н),
1Н-ЯМР данные для соединения 224 (в CDCl3): 2,20 (с, 3Н), 3,47 (с, 3Н), 3,73 (с, 3Н), 5,00 (дд, 2Н), 5,17 (с, 2Н), 5,97 (с, 2Н), 6,73-7,60 (м, 7Н),
1Н-ЯМР данные для соединения 227 (в CDCl3): 2,17 (с, 3Н), 3,40 (с, 3Н), 3,63 (с, 3Н), 4,17 (с, 4Н), 4,93 (дд, 2Н), 5,10 (с, 2Н), 6,67-7,53 (м, 7Н),
1Н-ЯМР данные для соединения 240 (в CDCl3): 2,33 (с, 3Н), 3,43 (с, 3Н), 3,67 (с, 3Н), 5,00 (дд, 2Н), 5,20 (с, 2Н), 7,23-7,90 (м, 7Н), 8,50 (д, 1Н),
1Н-ЯМР данные для соединения 321 (в CDCl3): 1,13 (т, 3Н), 2,20 (с, 3Н), 3,05-3,88 (5Н), 5,10 (с, 2Н), 7,00-7,73 (м, 9Н),
1Н-ЯМР данные для соединения 323 (в CDCl3): 1,18 (т, 3Н), 2,23 (с, 3Н), 3,50-3,90 (5Н), 5,13 (с, 2Н), 5,93 (с, 2Н), 6,68-7,62 (м, 7Н),
1Н-ЯМР данные для соединения 328 (в CDCl3): 2,36 (с, 3Н) 3,47 (с, 3Н), 3,73 (с, 3Н), 5,05 (дд, 2Н), 5,30 (с, 2Н), 7,27-8,13 (м, 6Н), 8,80-8,87 (м, 1Н),
1Н-ЯМР данные для соединения 332 (в CDCl3): 1,90-2,23 (5Н) 2,80-3,03 (т, 4Н), 3,46 (с, 3Н), 3,70 (с, 3Н), 5,00 (дд, 2Н), 5,18 (с, 2Н), 7,10-7,60 (м, 7Н),
1Н-ЯМР данные для соединения 335 (в CDCl3): 2,20 (с, 3Н), 3,17 (т, 2Н), 3,43 (с, 3Н), 3,67 (с, 3Н), 4,53 (т, 3Н), 5,00 (дд, 2Н), 5,10 (с, 2Н), 6,65 (д, 1Н), 7,20-7,50 (м, 6Н).
1Н-ЯМР данные для соединения 337 (в CDCl3): 2,20 (с, 6Н), 3,43 (с, 3Н), 3,67 (с, 3Н), 3,80 (с, 3Н), 5,00 (дд, 2Н), 5,13 (с, 2Н), 6,73 (д, 2Н), 7,23-7,53 (м, 6Н),
1Н-ЯМР данные для соединения 343 (в CDCl3): 1,44 (т, 3Н), 2,24 (с, 3Н), 3,42 (с, 3Н), 3,66 (с, 3Н), 3,86 (с, 3Н), 4,10 (кв. 2Н), 5,00 (дд, 2Н), 5,15 (с, 2Н), 6,70-7,60 (м, 6Н).
1Н-ЯМР данные для соединения 345 (в CDCl3): 1,30 (д, 6Н), 2,19 (с, 3Н), 3,42 (с, 3Н), 3,65 (с, 3Н), 4,20-5,00 (м, 3Н), 5,12 (с, 2Н), 6,73-7,60 (м, 8Н).
Дано описание опытных примеров испытания соединений настоящего изобретения в качестве сельскохозяйственных и садовых фунгицидов. Оценка эксплуатационных характеристик проводилась с соответствием со следующей шкалой оценок, если не указано иначе.
(Критерии оценки). Эффект подавления или эффект борьбы наблюдался визуально по степени вспышки заболевания на опытных растениях в день наблюдения и давалась одна из следующих пяти оценок в качестве показателя подавления:
Оценка Степень вспышки заболевания
5 Не наблюдается совсем никаких повреждений.
4 Площадь, число или длина поврежденных участков составляет
менее 10% по сравнению с таковыми на необработанной делянке.
3 Площадь, число или длины поврежденных участков менее 40%
2 Площадь: число или длина повреждений менее 70% от таковых на
необработанной делянке.
1 Площадь, число или длина повреждений составляет 70% или более от
таковых на необработанной делянке.
Пример испытания 1 (Испытание на профилактическое или защитное действие против настоящей мучнистой росы огурцов).
Огурцы (сорт: Суе) выращивались в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда растения огурцов достигали стадии одного листа, растения опрыскивались 10 мл раствора, имеющего заданную концентрацию активного ингредиента, с помощью опрыскивателя. Лоток содержался в помещении или камере с постоянной температурой при 22-24оС в течение примерно 24-48 ч, после чего огурцы опылялись и инокулировались конидиями грибка настоящей мучнистой росы Sphaerotheca fuliginea). На седьмой-тринадцатый день после заражения проверялись площадь повреждений на первом листе для определения оценки в виде показателя борьбы в соответствии с упомянутыми выше критериями оценки. Результаты были следующими.
Оценка Соединение N (Активный ингредиент: 500 част./млн)
5 1, 11, 19, 26, 32, 46, 52, 56, 57, 94, 95, 103,
107, 109, 110, 111, 114, 116, 119, 120, 121, 122,
123, 128, 129, 131, 133, 134, 137, 138, 139, 141,
142, 143, 147, 149, 150, 151, 152, 153, 154, 156,
158, 160, 163, 165, 172, 177, 187, 188, 189, 190,
191, 192, 194, 198, 200, 201, 203, 204, 206, 208,
212, 215, 216, 217, 219, 225, 228, 230, 235, 237,
239, 240, 244, 245, 247, 248, 250, 251, 252, 261,
265, 279, 280, 282, 320, 322, 324, 327, 330, 344,
345, 356, 375, 380, 383, 384, 385, 386, 387, 389,
391, 392, 393, 395, 396, 397, 398, 400, 401, 403,
409, 412, 413, 414.
4 2, 5, 41, 45, 99, 105, 108, 130, 132, 140, 148,
157, 159, 168, 169, 193, 197, 199, 202, 205, 207,
226, 229, 236, 249, 264, 281, 289, 290, 323, 325,
326, 329, 341, 357, 374, 379, 399, 407, 411.
Соединения NN 214 и 218 оба показывали оценку 5 в качестве показателя борьбы, а соединения NN 343, 353 и 404 показывало оценку 4 в качестве показателя борьбы, когда концентрация активного ингредиента в растворах былa 250 част.млн.
Пример испытания 2 (Испытание на защитное действие против Антракноза огурцов).
Огурцы (сорт Суе) выращивались в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда огурцы достигали стадии двух листьев, растения опрыскивались 10 мл раствора, имеющего заданную концентрацию активного ингредиента с помощью опрыскивателя. Лоток хранился в помещении с постоянной температурой при 22-24оС в течение примерно 24 ч, после чего растения опрыскивались и инокулировались суспензией спор грибка антракноза (Collectotrichum lagenarium). На пятый-девятый день после инокулирования проверялась площадь повреждений на первом листе для определения оценки в качестве показателя борьбы в соответствии с упомянутыми выше критериями оценок, результаты были следующими.
Оценка N соединения (Активный ингредиент: 500 част./млн.)
5 4, 5, 7, 9, 27, 52, 53, 56, 109, 387, 389
4 3, 8, 11, 145, 289, 385
Соединение N 57 обнаруживало оценку 5 в качестве показателя борьбы, когда концентрация активного ингредиента в растворе составляла 250 млн. частей.
Пример испытания 3 (Испытание на защитное действие против ложной мучнистой росы огурцов).
Огурцы выращивались (сорт Суе): в полиэтиленовых лотках, имеющих диаметр 7,5 см. Когда огурцы достигали стадии двух листьев, растения опрыскивались 10 мл раствора имеющего заданную концентрацию активного ингредиента с помощью опрыскивателя. Лоток выдерживался в помещении с постоянной температурой при 22-24оС в течение примерно 8-48 ч, после чего огурцы опрыскивались и инокулировались суспензией спор грибка ложной мучнистой росы (Pseudoperonospora cubensis). На четвертый-девятый день после инокуляции проверялись области повреждений на первом листе для определения оценки в качестве показателя борьбы в соответствии с упомянутыми выше критериями оценки. Результаты были следующими.
Оценка Соединение N (Активный ингредиент: 500 част./млн.)
5 1, 3, 4, 5, 6, 7, 8, 9, 11, 19, 20, 21, 22, 23,
25, 26, 27, 33, 34, 35, 37, 39, 40, 41, 42, 43,
46, 47, 49, 50, 51, 93, 95, 98, 101, 113, 124,
131, 134, 137, 161, 162, 170, 198, 201, 209,
220, 221, 226, 234, 247, 258, 306, 327, 380,
4 2, 24, 32, 44, 45, 48, 54, 97, 99, 102, 104,
171, 193, 224, 379, 382, 396
Соединения NN 200 и 403 проявляли оценку 4 в качестве показателя борьбы, когда концентрация активного ингредиента в растворе была 250 част./млн.
Пример испытания 4 (Испытание на защитное действие против пирикуляриоза риса)
Растение риса (сорт: косихикари) выращивалось в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда растение достигало стадии четырех листьев, оно опрыскивалось 20 мл раствором, имеющего заданную концентрацию активного ингредиента, с помощью опрыскивателя. Лоток хранился в помещении с постоянной температурой при 22-24оС в течение 8-24 ч, после чего растение риса опрыскивалось и инокулировалось суспензией спор грибка пирикуляриоза (Pyricularia oryzae). На четвертый-восьмой день после инокуляции проверилось число повреждений и находили оценку как показатель борьбы согласно упомянутым выше критериям оценки. Результаты были следующими.
Оценка Соединение N (Активный ингредиент: 500 част./млн)
5 2, 3, 11, 14, 15, 20, 23, 48, 49, 57, 58, 92,
120, 139, 162, 166, 196, 205, 224, 225, 227,
230, 257, 261, 276, 282, 284, 290, 321, 322,
329, 338, 339, 352, 388, 409.
4 1, 5, 6, 9, 21, 25, 28, 29, 36, 45, 46, 50, 51,
54, 67, 132, 135, 136, 138, 141, 142, 143, 153,
159, 164, 167, 170, 171, 172, 176, 177, 192, 211,
212, 217, 221, 228, 229, 235, 236, 238, 244, 248,
266, 274, 306, 324, 332, 333, 335, 337, 373, 398,
400, 406, 407, 411.
Соединения NN 40 и 7 показывали оценки 5 и 4, соответственно в качестве показателей борьбы, когда концентрация активного ингредиента в растворах была 250 част/млн.
Пример испытания 5 (Испытание на лечебное действие против пирикуляриоза риса)
Растение риса (сорт: Косихикари) выращивалось в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда растение достигло стадии четырех листьев, оно опрыскивалось и инокулировалось суспензией спор-грибка, вызывающего пирикуляриоз (Pyricularia oryzae). Лоток хранили в камере с постоянной температурой при 22-24оС в течение примерно 8-24 ч, после чего растение риса опрыскивалось 20 мл раствора, имеющего концентрацию соединения N 3 (активного ингредиента) 500 част.млн. и с использованием опрыскивателя. На пятый день после инокуляции проверялось число повреждений и определялась оценка 4 в качестве борьбы в соответствии с упомянутыми выше критериями оценки.
Пример испытания 6 (Испытание на профилактическое действие против корончатой ржавчины овса)
Овес (сорт: Зенсин) выращивался в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда овес достигал стадии двух листьев, растение опрыскивалось 20 мл раствора, имеющего заданную концентрацию активного ингредиента, с помощью опрыскивателя. Лоток хранили в камере с постоянной температурой при 22-24оС в течение примерно 8-24 ч, после чего растение риса опылялось и инокулировалось конидиями грибка корончатой ржавчины (Puccinia coronata). На девятый-шестнадцатый день после инокуляции проверялась площадь повреждения второго листа для нахождения оценки как показателя борьбы согласно упомянутым выше критериям оценки. Результаты были следующими.
Оценка Соединение N (Активный ингредиент: 500 част./млн)
5 2, 3, 4, 5, 7, 11, 28, 44, 51, 53, 57, 67, 94,
101, 103, 105, 107, 108, 111, 114, 116, 118,
119, 120, 121, 122, 123, 132, 133, 136, 138,
150, 151, 153, 154, 159, 160, 166, 167, 187,
188, 190, 194, 196, 197, 204, 206, 215, 217,
219, 220, 223, 224, 251, 252, 276, 290, 321,
323, 326, 339, 373, 384, 386, 388, 397, 412.
4 27, 29, 37, 40, 52, 56, 110, 115, 117, 124, 129,
135, 148, 157, 163, 165, 176, 199, 205, 208, 211,
216, 218, 238, 240, 244, 248, 250, 266, 320, 328,
330, 343, 345, 353, 357, 370, 374, 375, 393, 395,
399, 401, 414.
Соединения NN 113, 214 и 280 имели оценку 5 в качестве показателя борьбы, а соединение N 279 имело оценку 4 в качестве показателя борьбы, когда концентрация активного ингредиента в растворах были 250 част.млн.
Пример испытания 7 (Испытание на профилактическое действие против поздней гнили томатов).
Томаты (сорт: Пондероза) выращивался в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда растение достигало стадии четырех листьев, оно опрыскивалось 10 мл раствора, имеющего заданную концентрацию активного ингредиента; с использованием опрыскивателя. Лоток хранили в камере с постоянной температурой при 22-24оС в течение примерно 8-24 ч, после чего растение томатов опрыскивалось и инокулировалось суспензией зооспорангиев грибка поздней гнили (Phytophthora inrestans). На третий-пятый день после инокуляции проверялась площадь повреждения для нахождения оценки как показателя борьбы в соответствии с упомянутым выше критерием оценок. Результаты были следующими.
Оценка Соединение 1 (Активный ингредиент: 500 част./млн)
5 1, 4, 11, 37, 39, 52, 53, 57, 63, 168, 191, 193, 246, 284, 413.
4 3, 5, 7, 8, 14, 40, 45, 61, 67, 152, 203, 352.
Соединение N 51 показывало оценку 4 как показатель борьбы, когда концентрация активного ингредиента в растворах была 125 част./млн.
Пример испытания 8 (Испытание на защитное действие против серой плесени огурцов)
Огурцы (сорт: Суе) культивировались в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда растение огурца достигло стадии двух листьев, оно опрыскивалось 10 мл раствора, имеющего заданную концентрацию активного ингредиента, с помощью опрыскивателя. Лоток хранили в камере с постоянной температурой при 22-24оС в течение примерно 8-24 ч, после чего первый лист инокулировался суспензией спор грибка серой плесени, восприимчивого к Беномилу и дикарбоксамиду (Botrytis cinerea) в картофельноглюкоановой вытяжке (декокте). На третий день после инокуляции проверялась длина поврежденных участков для нахождения оценки как показателя борьбы согласно упомянутым выше критериям оценки. Результаты были следующими.
Оценка Соединение N (Активный ингредиент: 500 част./млн)
4 1, 57, 103, 132.
Пример испытания 9 (Испытание на предотвращающее действие против ризоктониоза риса)
Растение риса (сорт: Косихикари) выращивался в полиэтиленовом лотке, имеющем диаметр 7,5 см. Когда растение риса достигало стадии пяти листьев, оно опрыскивалось 20 мл раствора, имеющего концентрацию соединения N 349 (активного ингредиента) 500 част./млн с помощью опрыскивателя. Лоток хранили в камере с постоянной температурой при 22-24оС в течение примерно 8-24 ч, после чего растение риса инокулировалось путем помещения в пазуху растения рисовой соломы, которая была предварительно заражена грибком ризоктониоза (Phizoctonia soiani). Лоток хранился в инокуляционной камере при температуре 28оС и влажности 100% в течение 5 дней. После этого проверялась длина повреждений для определения оценки как показателя борьбы в соответствии с вышеупомянутыми критериями оценок.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПИРИДИНСУЛЬФОНАМИДА, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ, ПРОИЗВОДНЫЕ ПИРИДИНСУЛЬФОНАМИДА | 1992 |
|
RU2054427C1 |
| ПРОИЗВОДНЫЕ ПИРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2083562C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛИДИНА И ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2009133C1 |
| ПРОИЗВОДНОЕ БЕНЗОИЛПИРИДИНА ИЛИ ЕГО СОЛЬ, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА ФУНГИЦИД, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2255088C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА | 1992 |
|
RU2014326C1 |
| АЛКИЛЕНДИАМИНОВЫЕ ПРОИЗВОДНЫЕ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2069661C1 |
| ПРОИЗВОДНОЕ БЕНЗОКСАЗОЛА, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЯ СИНДРОМА РАЗДРАЖЕННОГО КИШЕЧНИКА ИЛИ ФУНКЦИОНАЛЬНОГО РАССТРОЙСТВА ПИЩЕВАРИТЕЛЬНОГО ТРАКТА | 1999 |
|
RU2204558C2 |
| ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ АМИНОВ, ОБЛАДАЮЩИХ ПОДАВЛЯЮЩИМ ОАС ДЕЙСТВИЕМ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИНГИБИТОР НОАС | 1997 |
|
RU2193554C2 |
| СПОСОБ БОРЬБЫ С НЕЖЕЛАТЕЛЬНЫМ РОСТОМ РАСТЕНИЙ | 1991 |
|
RU2043718C1 |
| ПРОИЗВОДНЫЕ ДИАМИНОТРИФТОРМЕТИЛПИРИДИНА ИЛИ ИХ СОЛИ СО ЩЕЛОЧНЫМИ ИЛИ ЩЕЛОЧНОЗЕМЕЛЬНЫМИ МЕТАЛЛАМИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ФОСФОЛИПАЗУ A | 1991 |
|
RU2057123C1 |
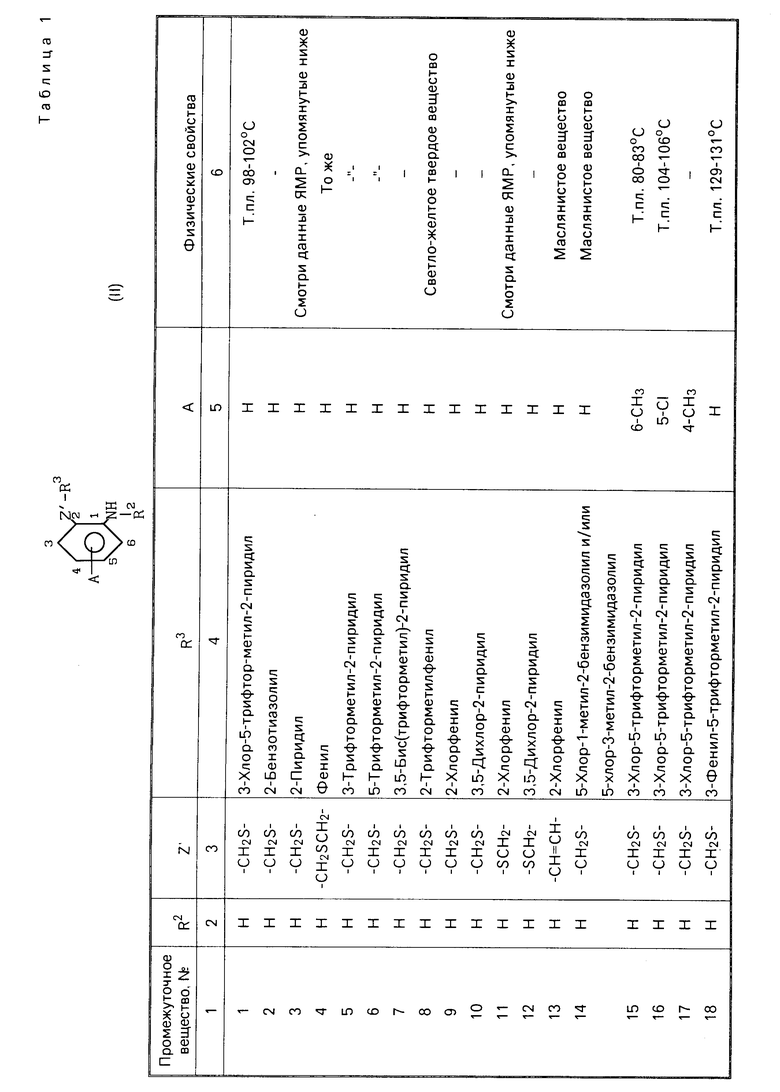
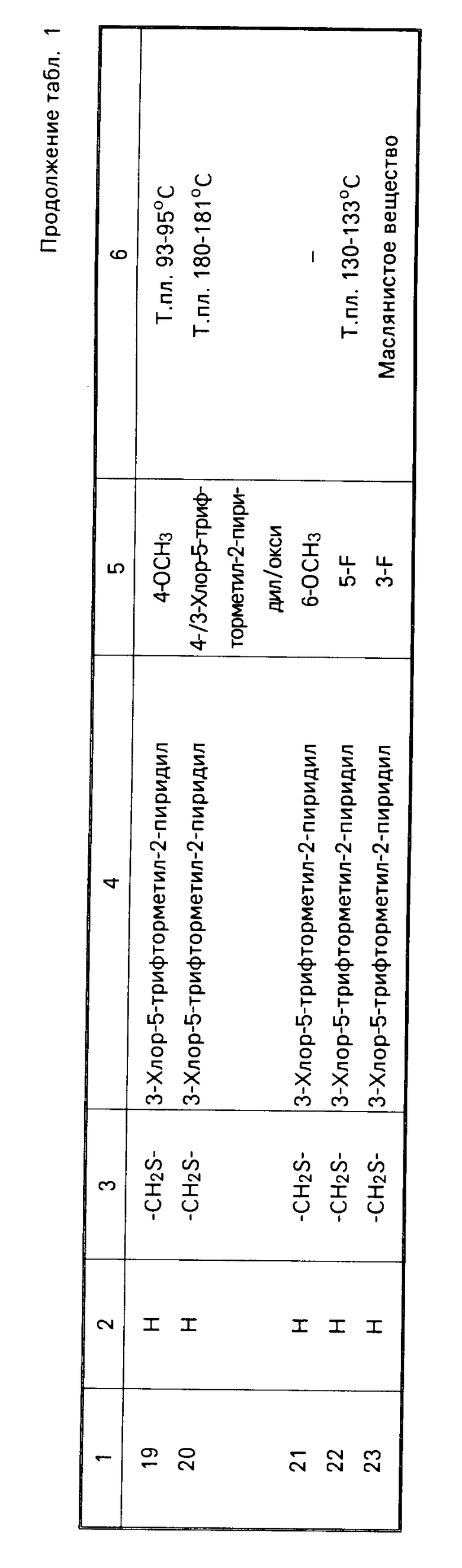
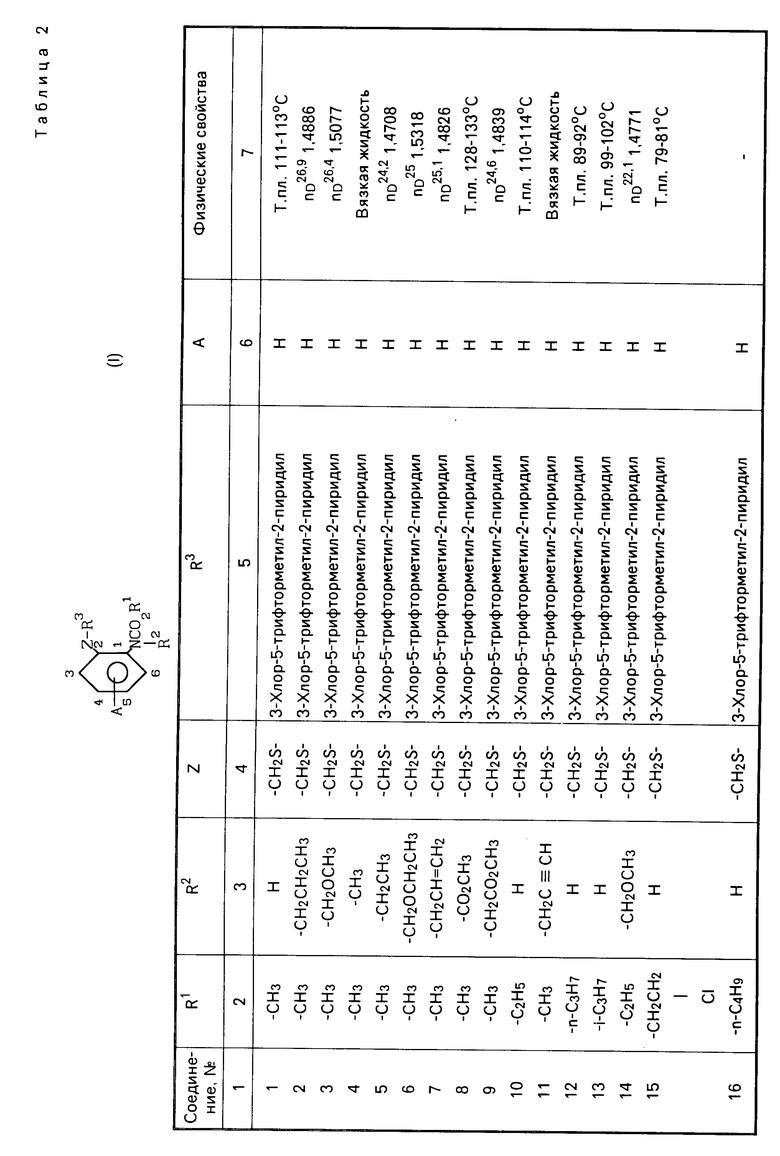
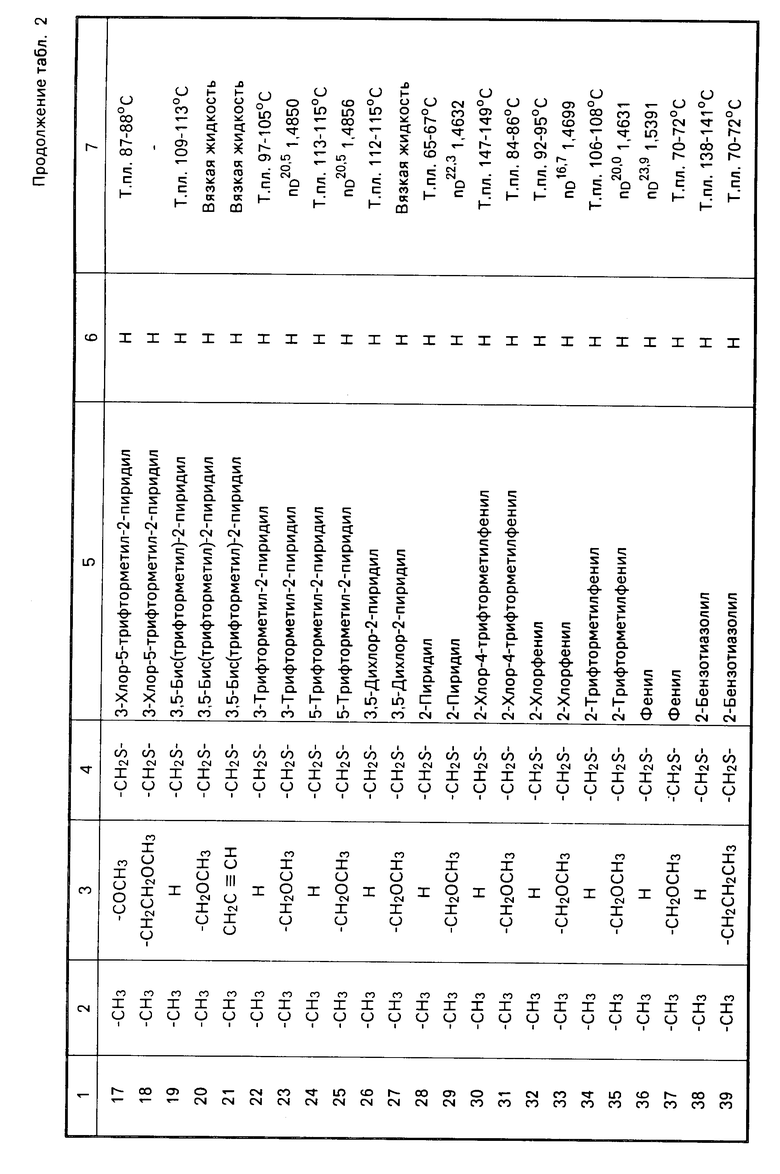
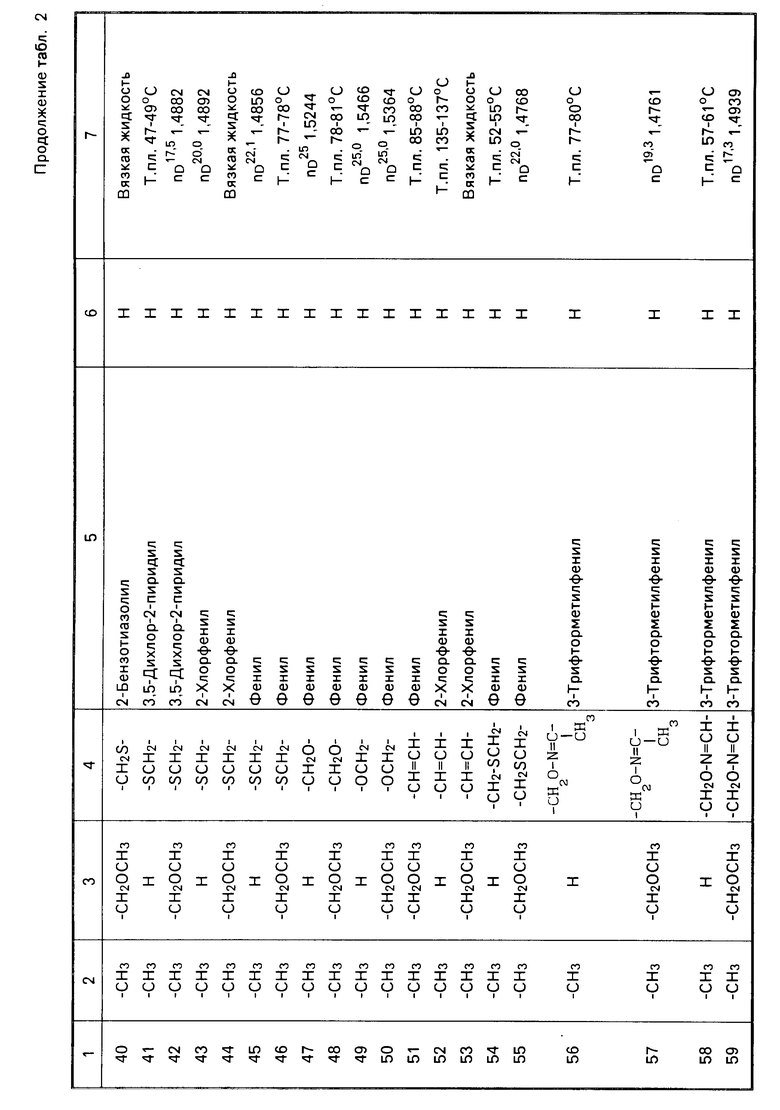
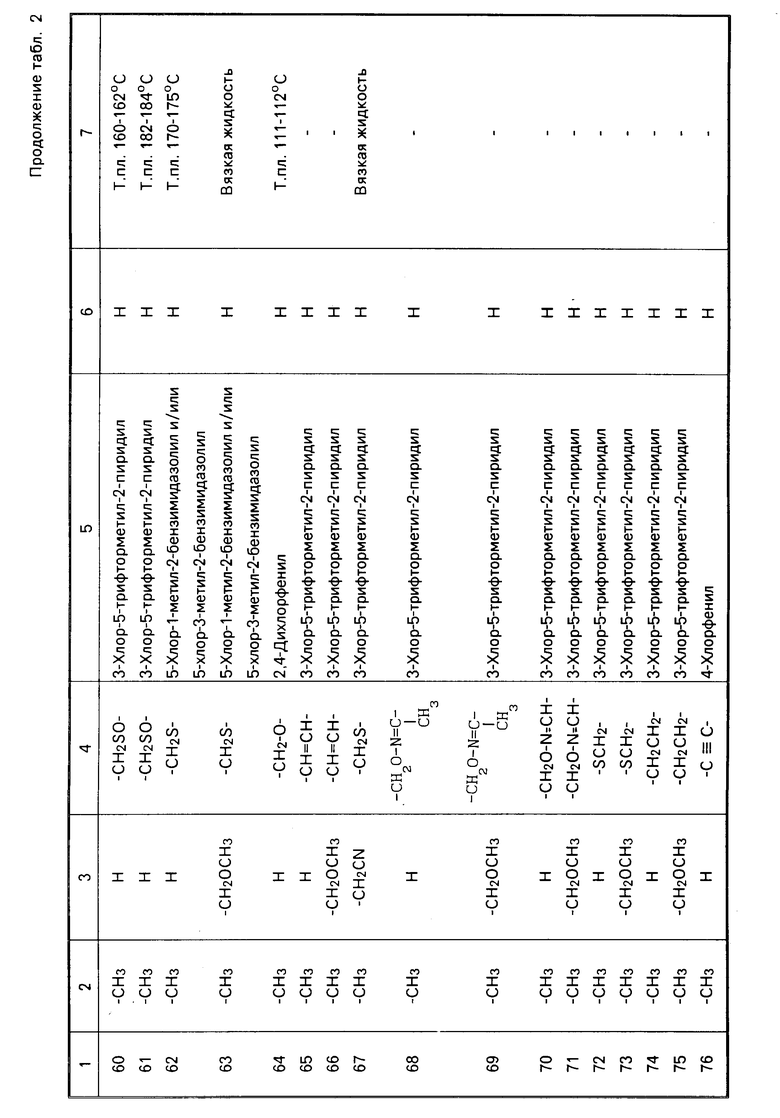
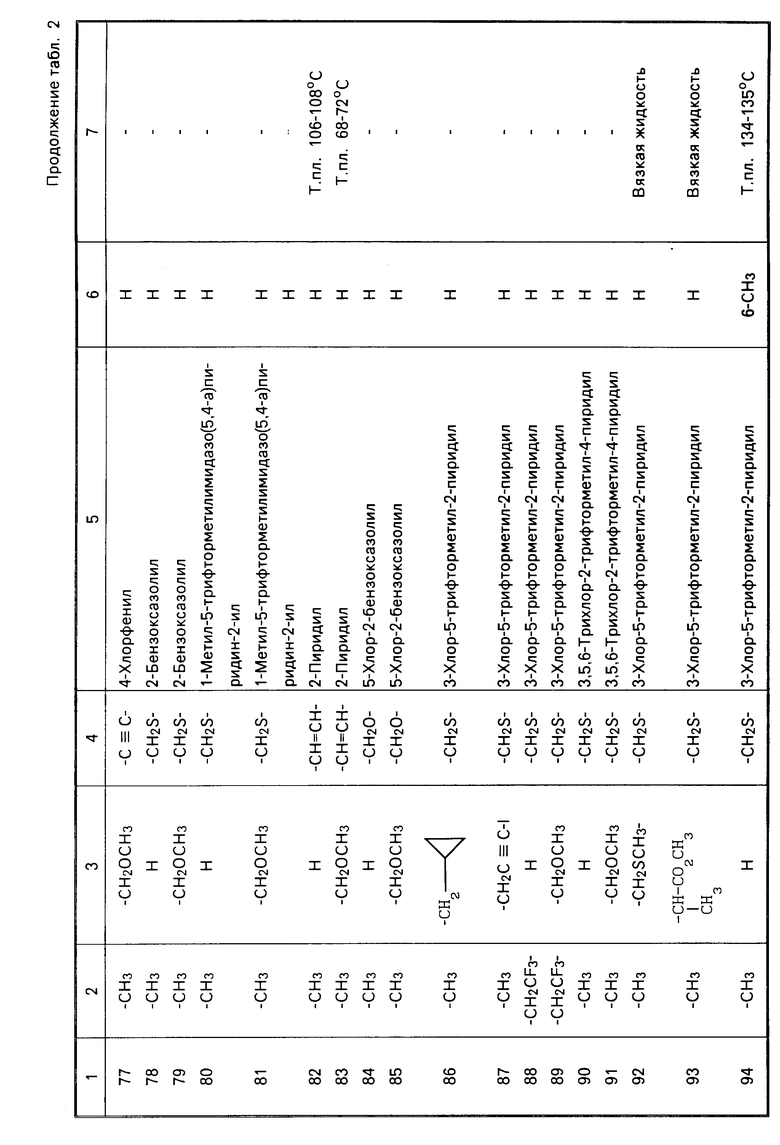
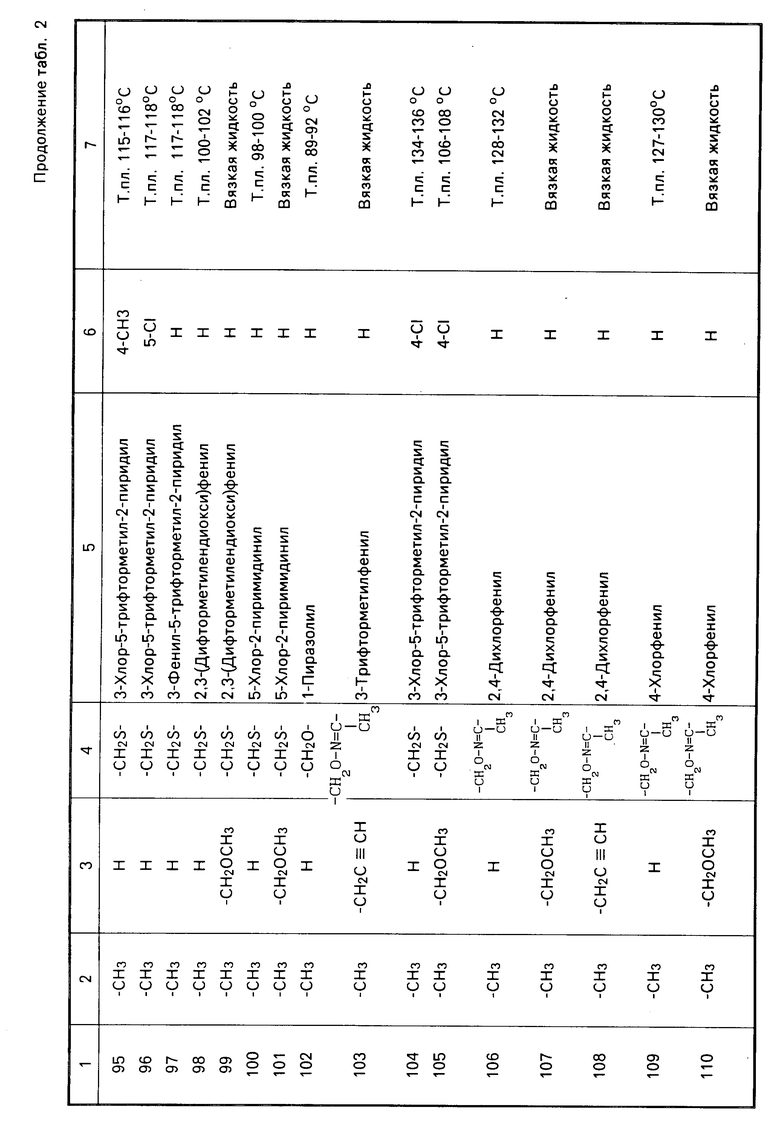
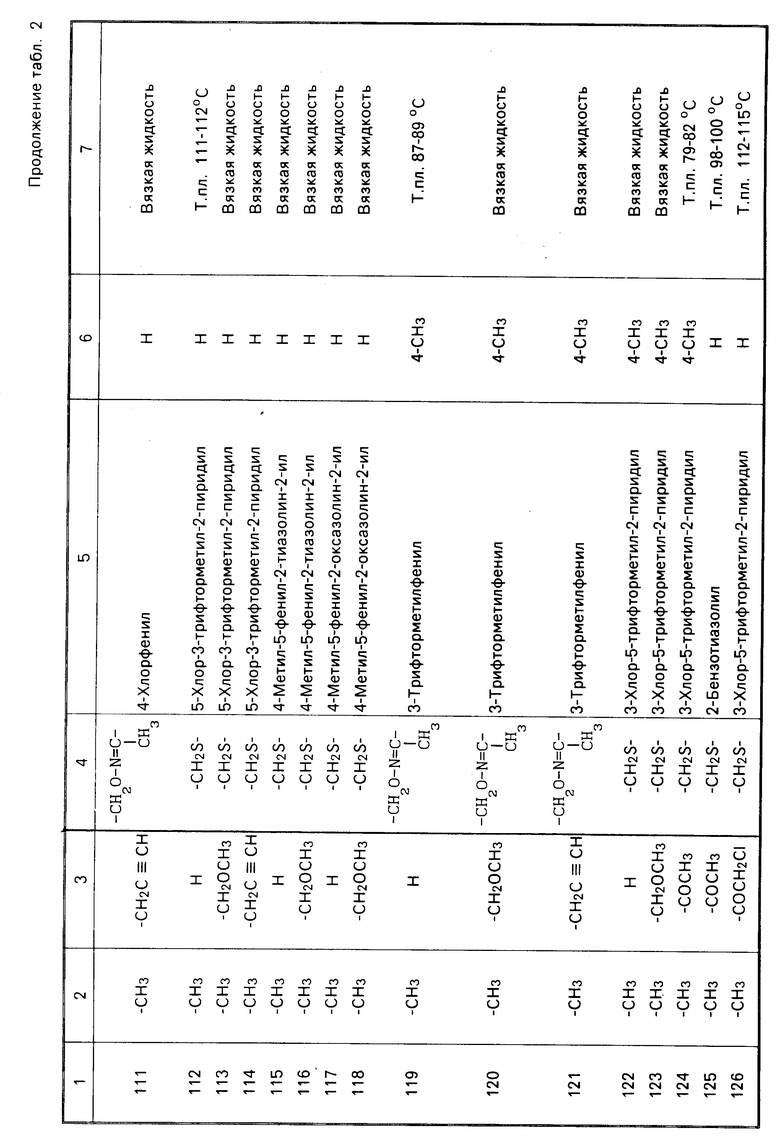
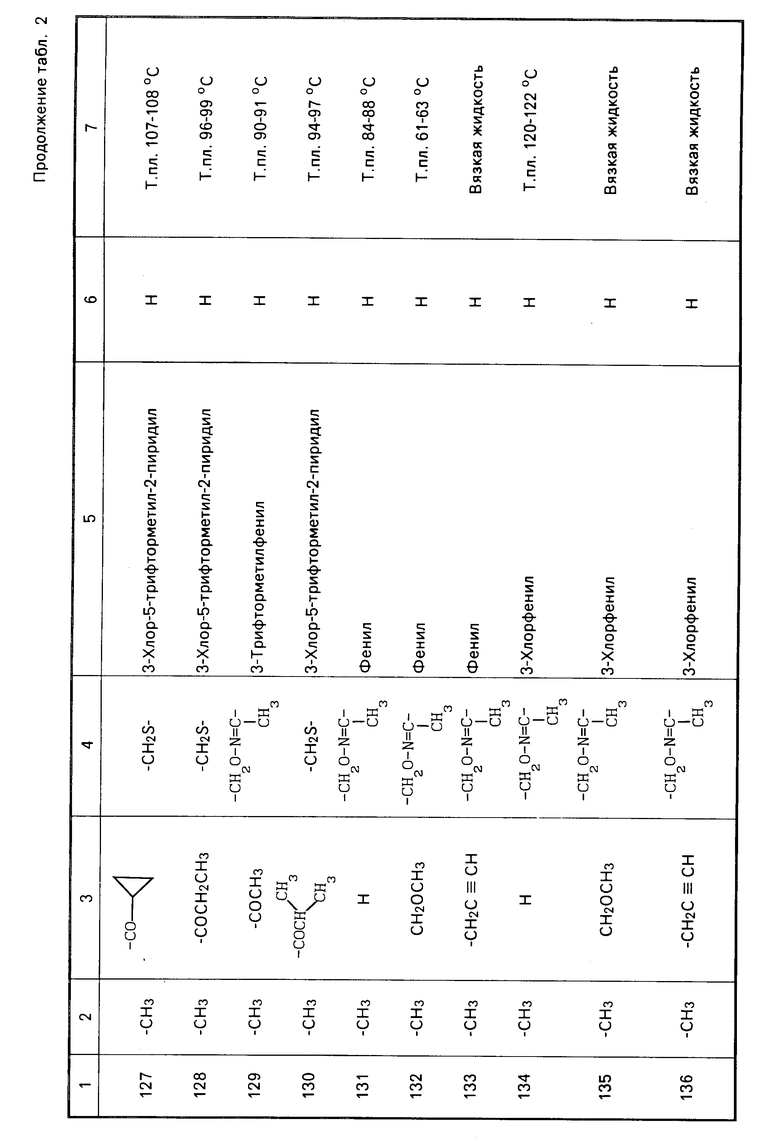
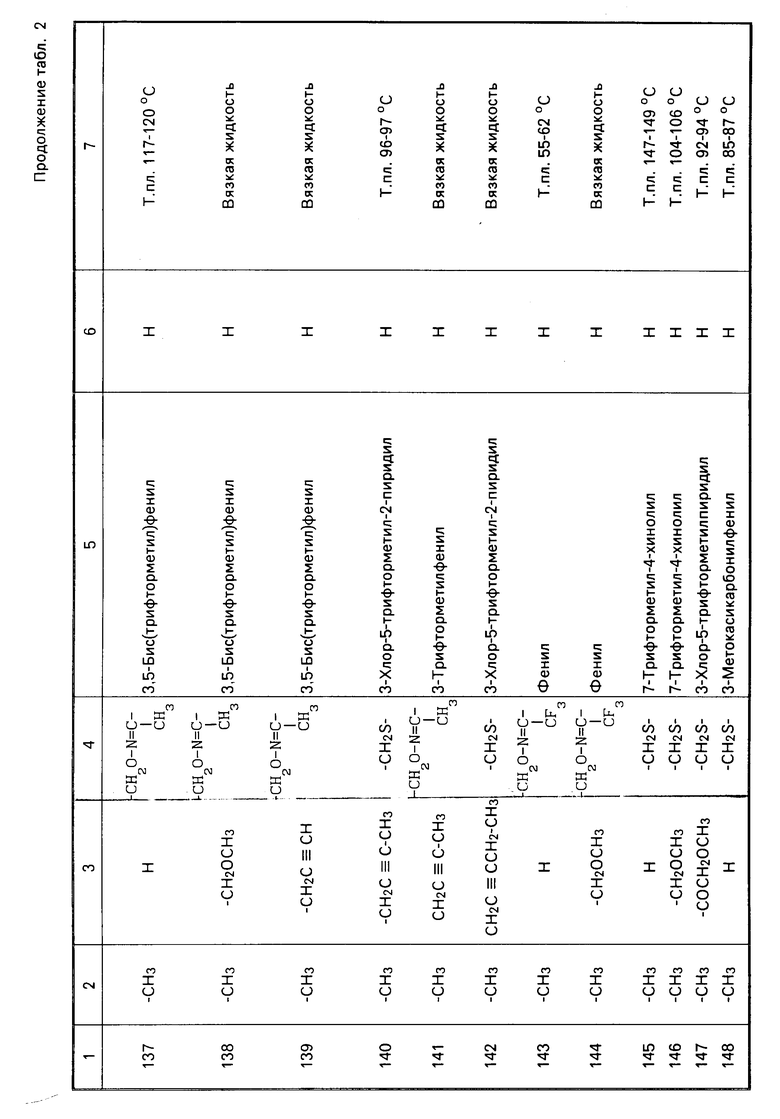
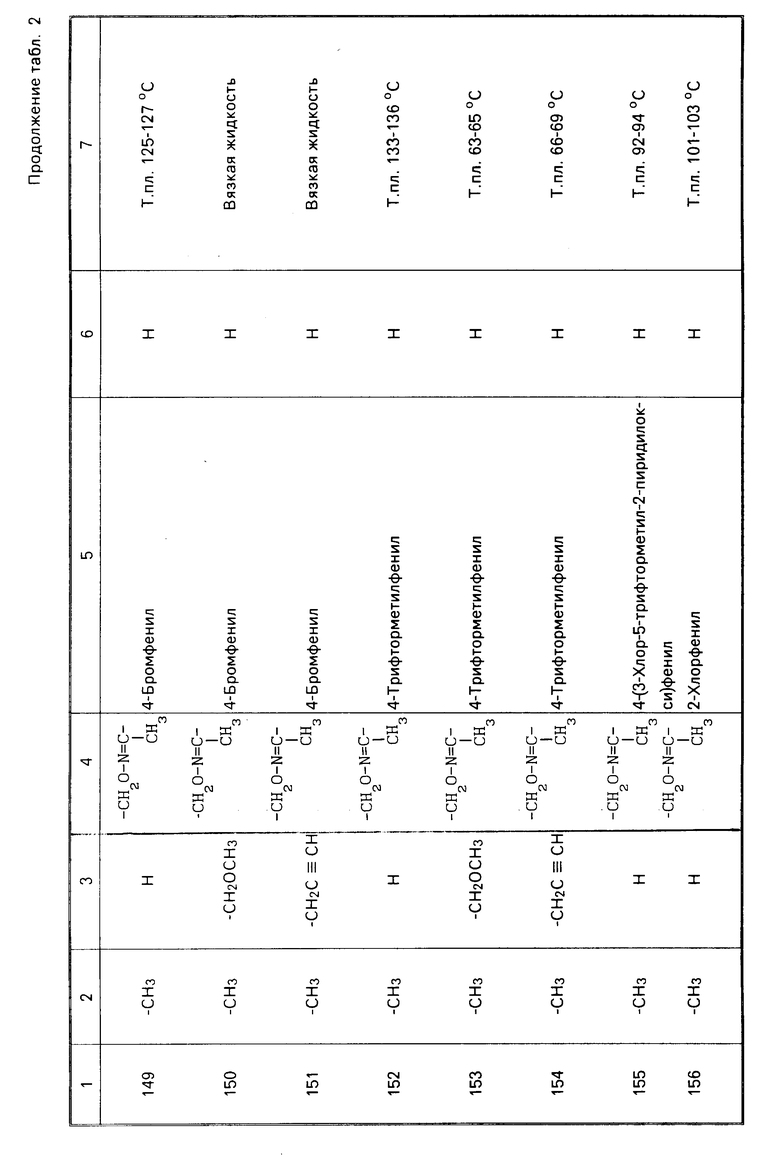
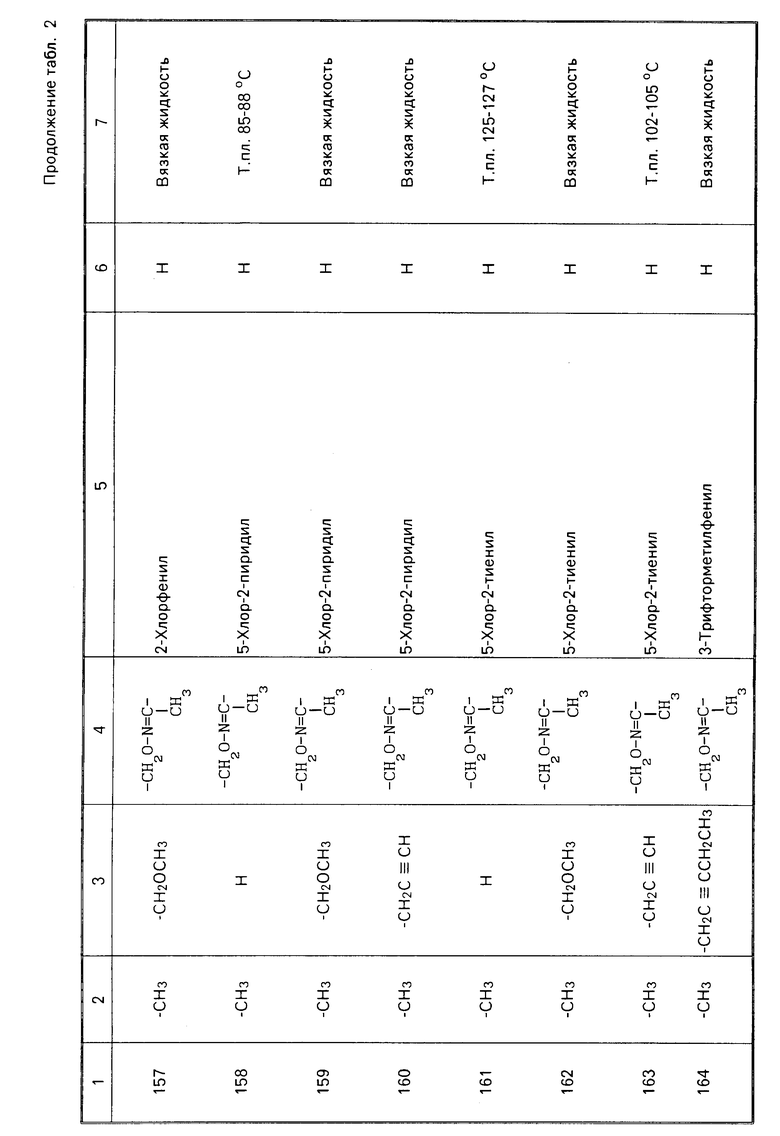
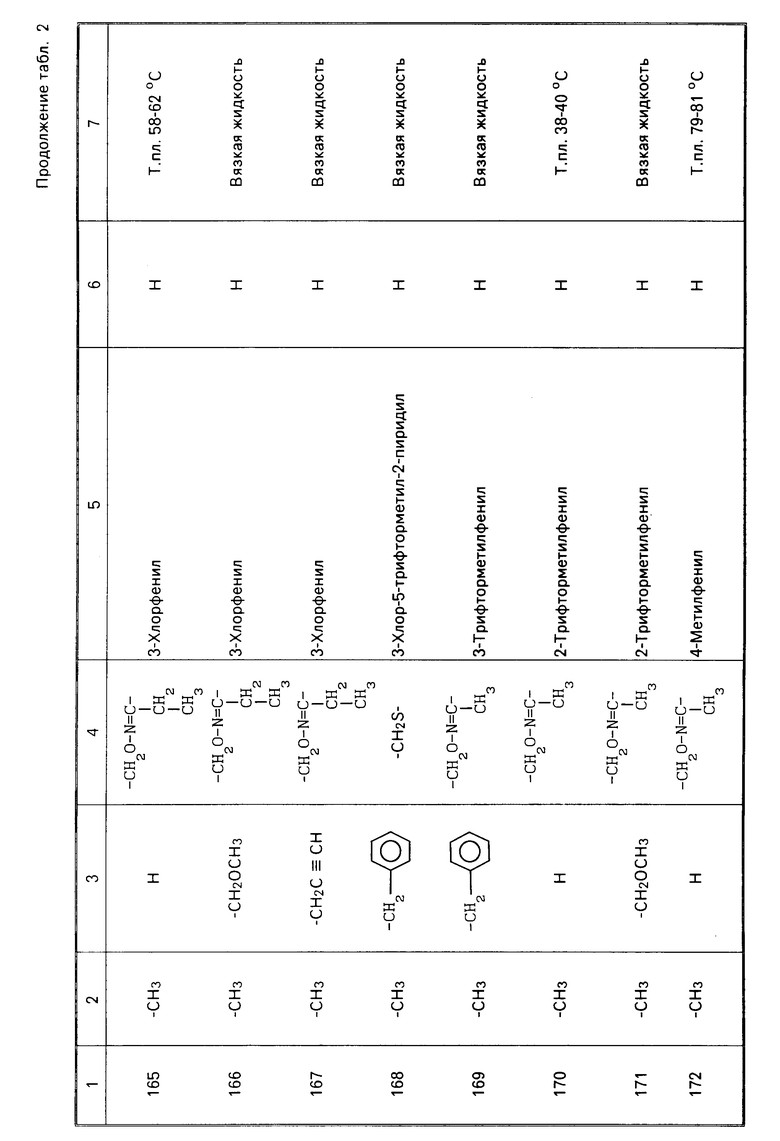
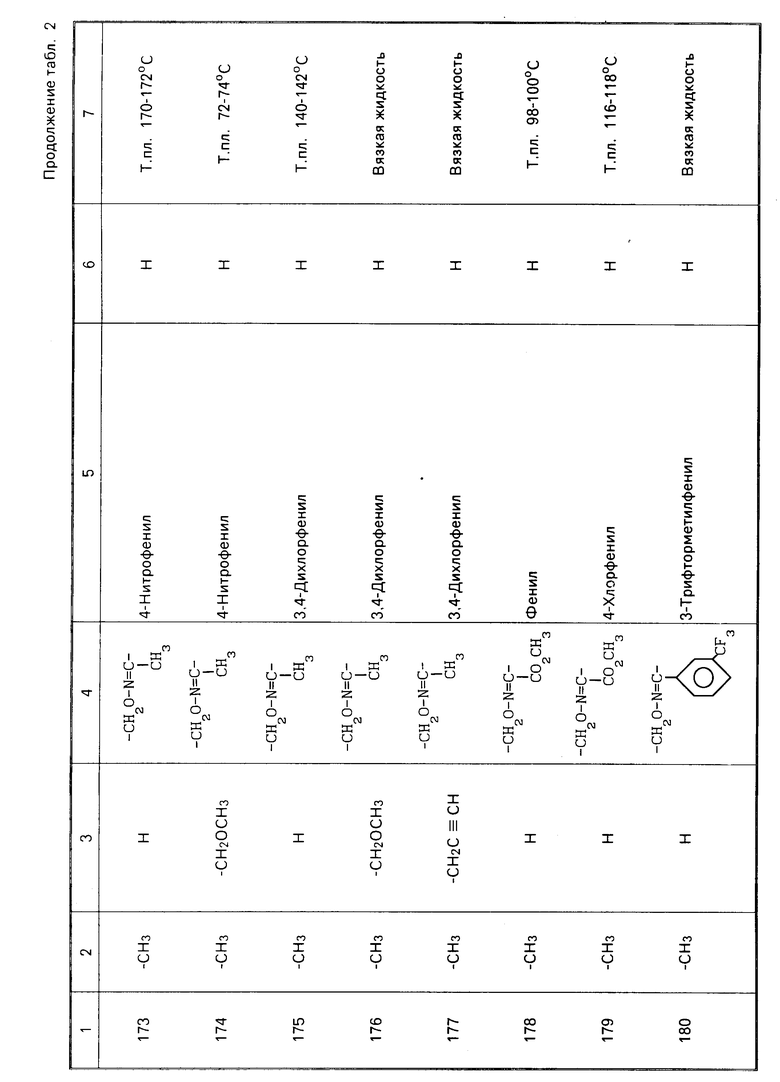
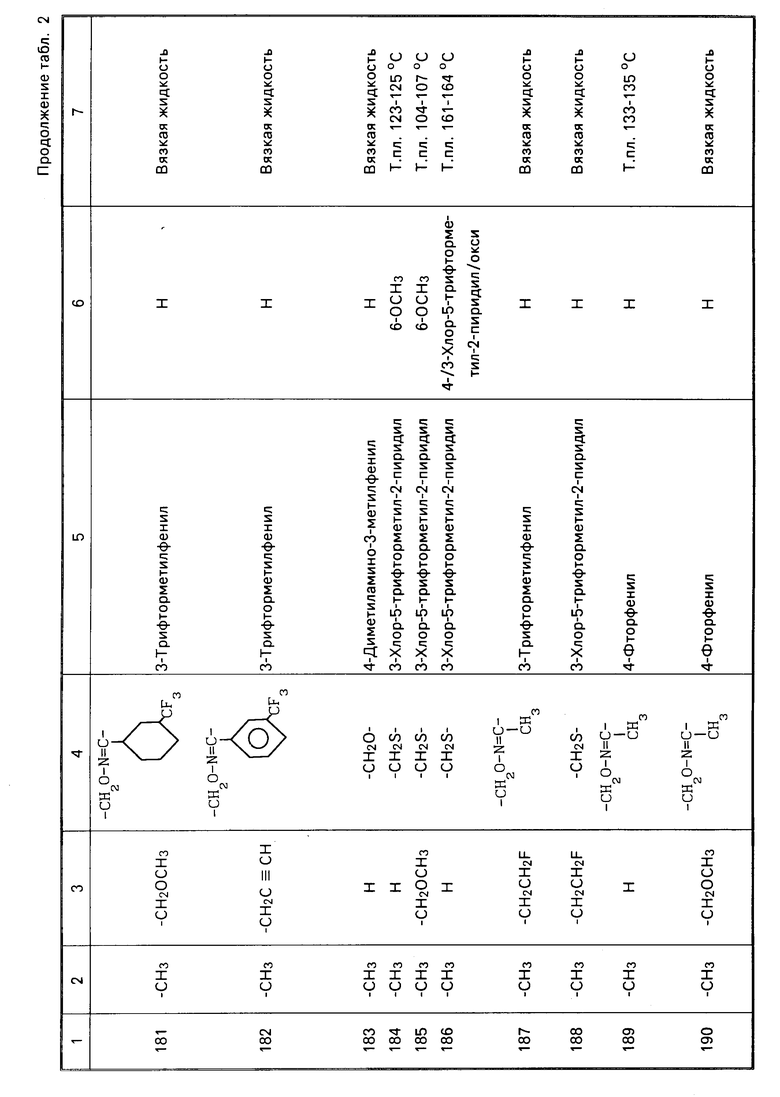
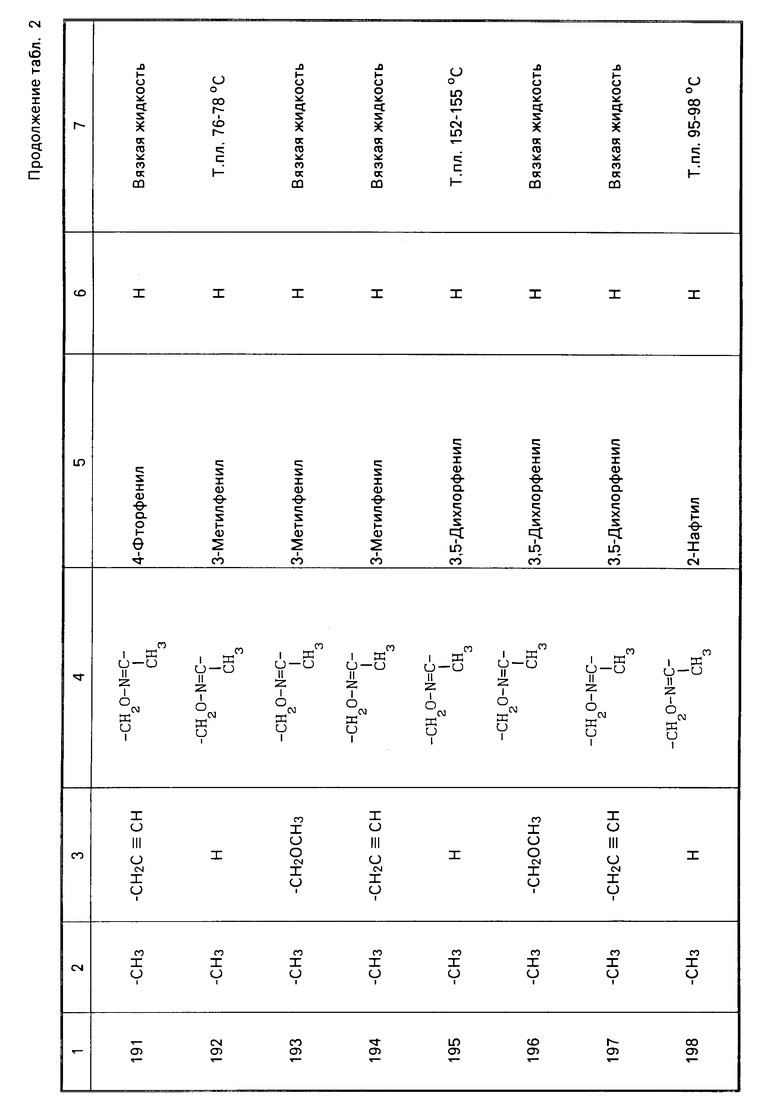
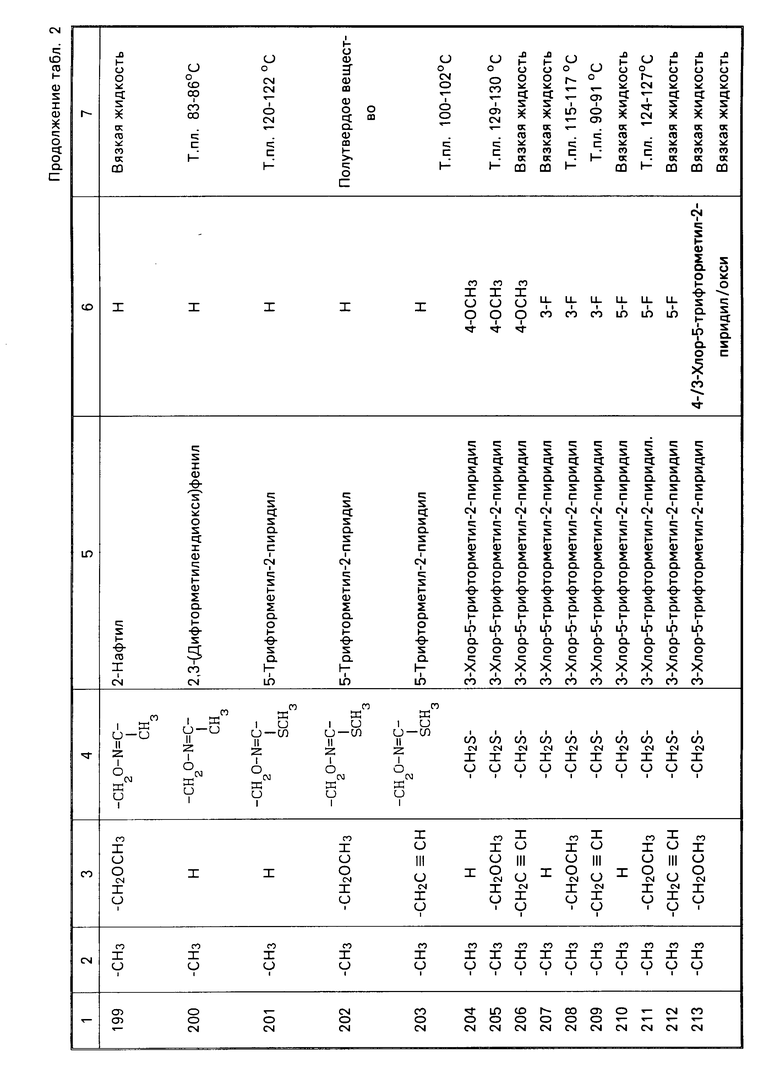
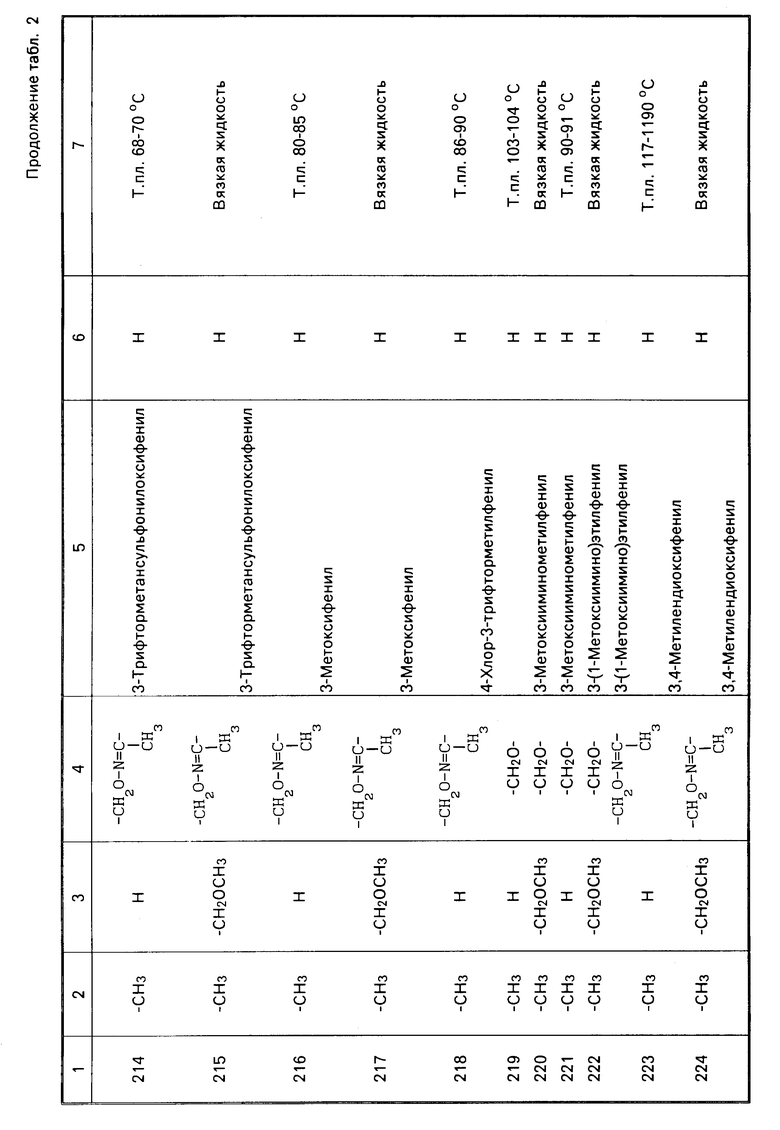
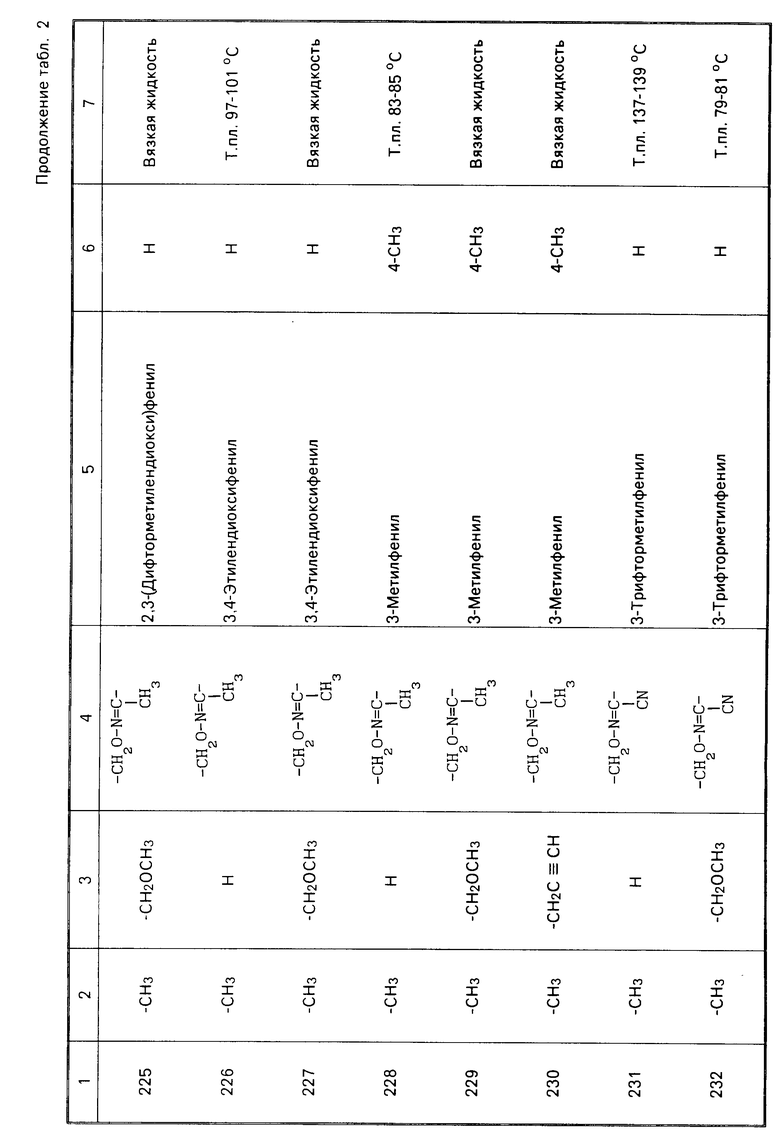




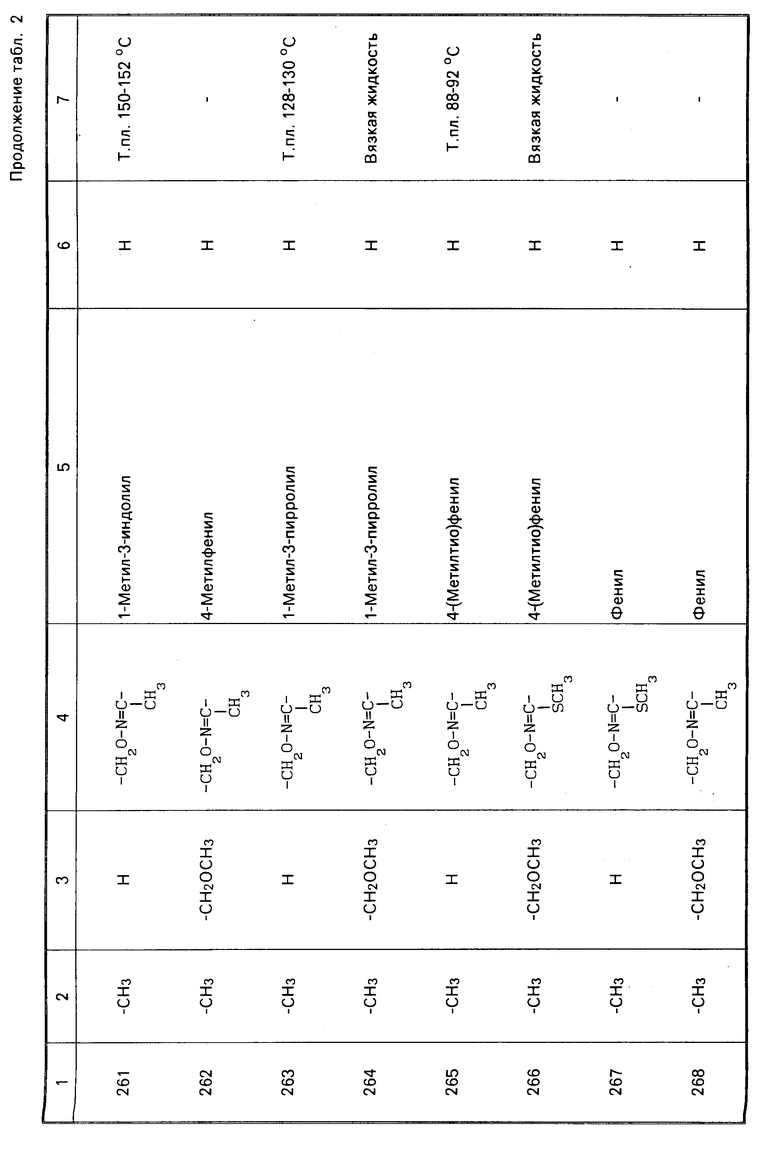
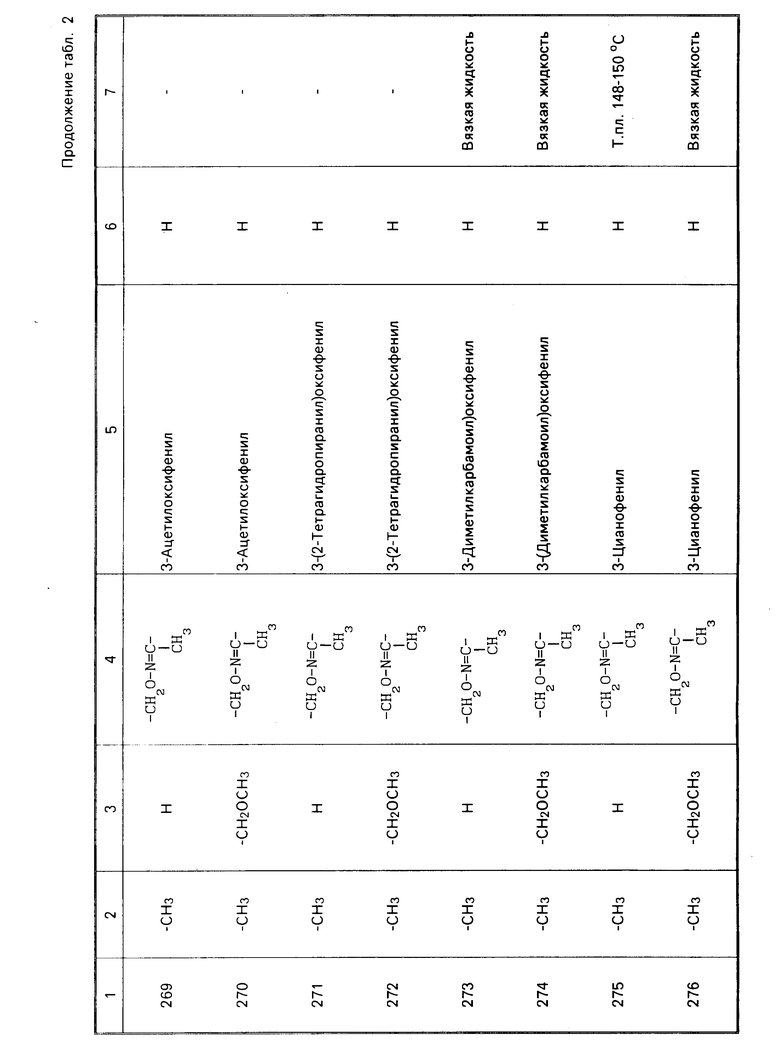
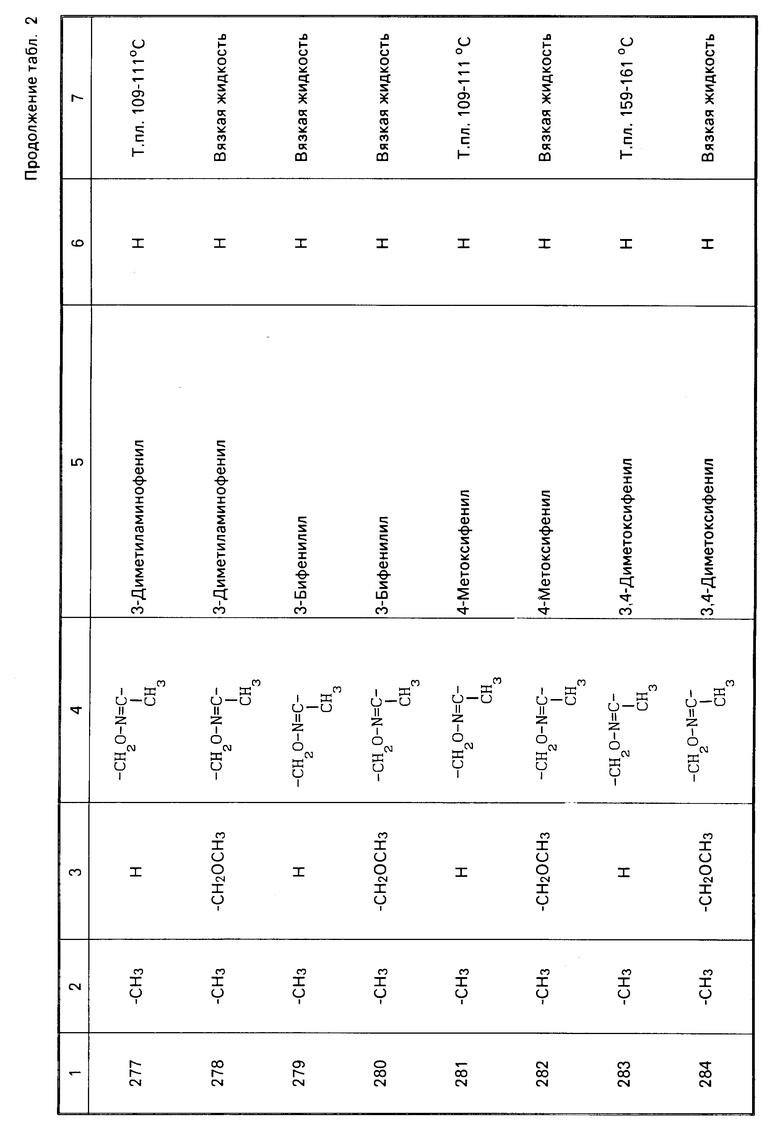


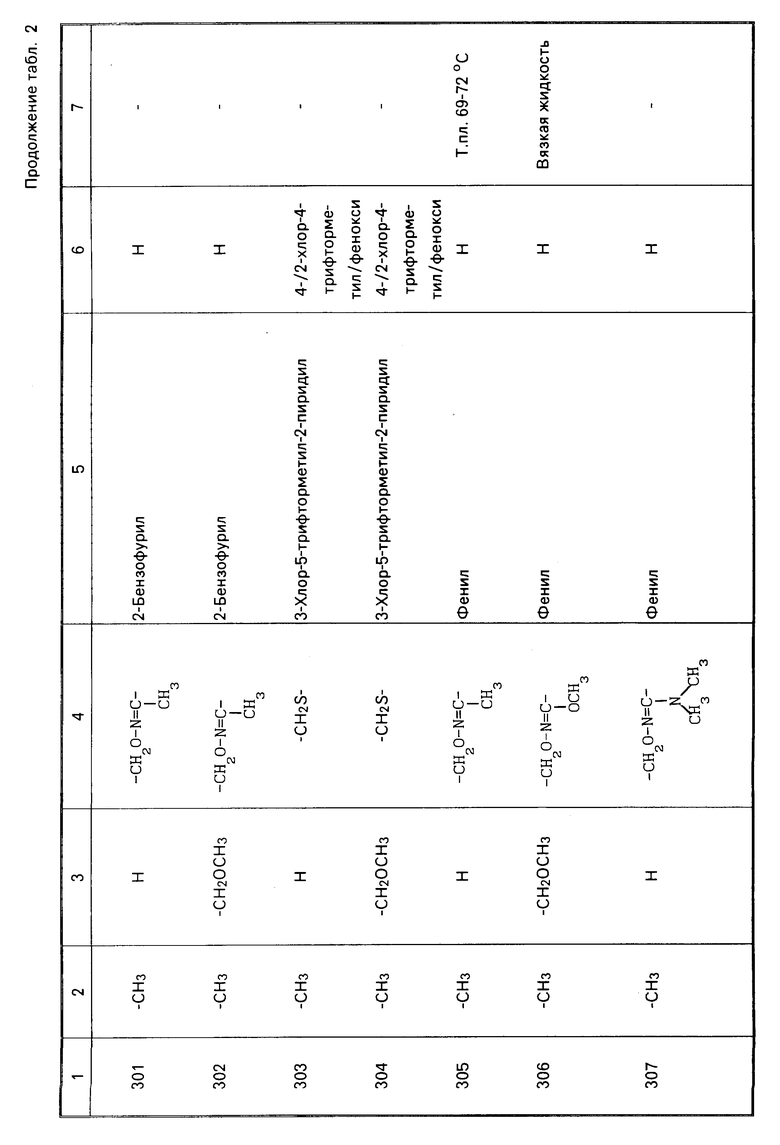
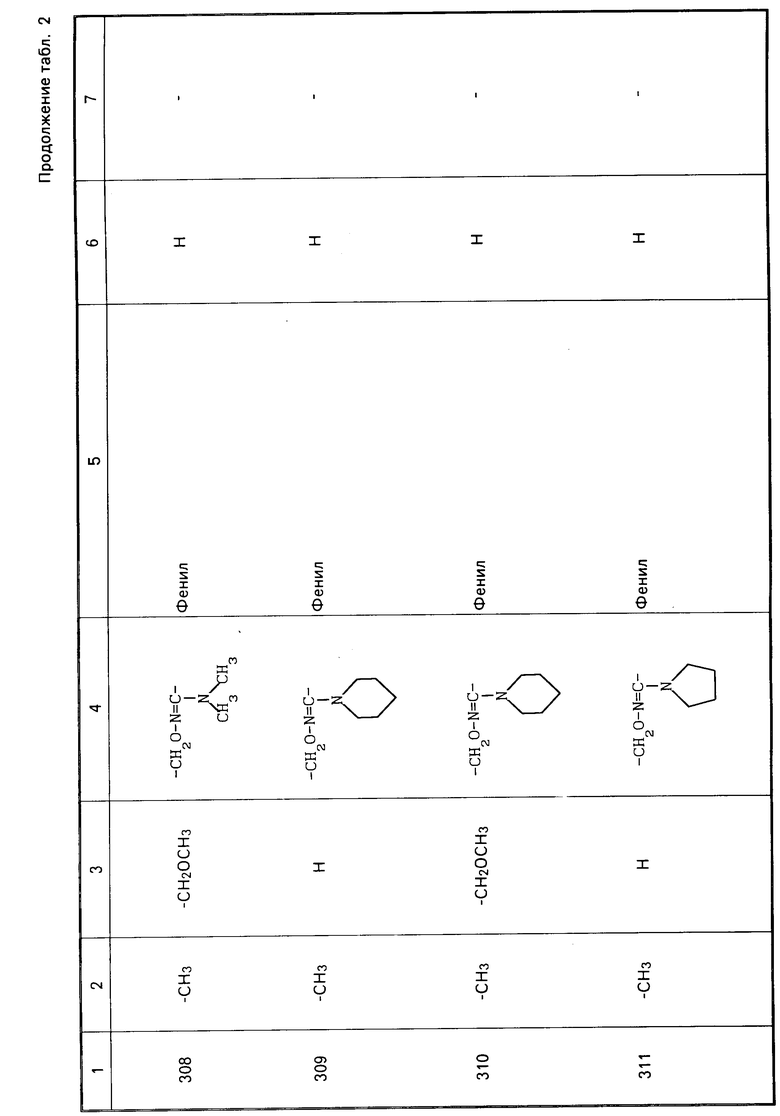
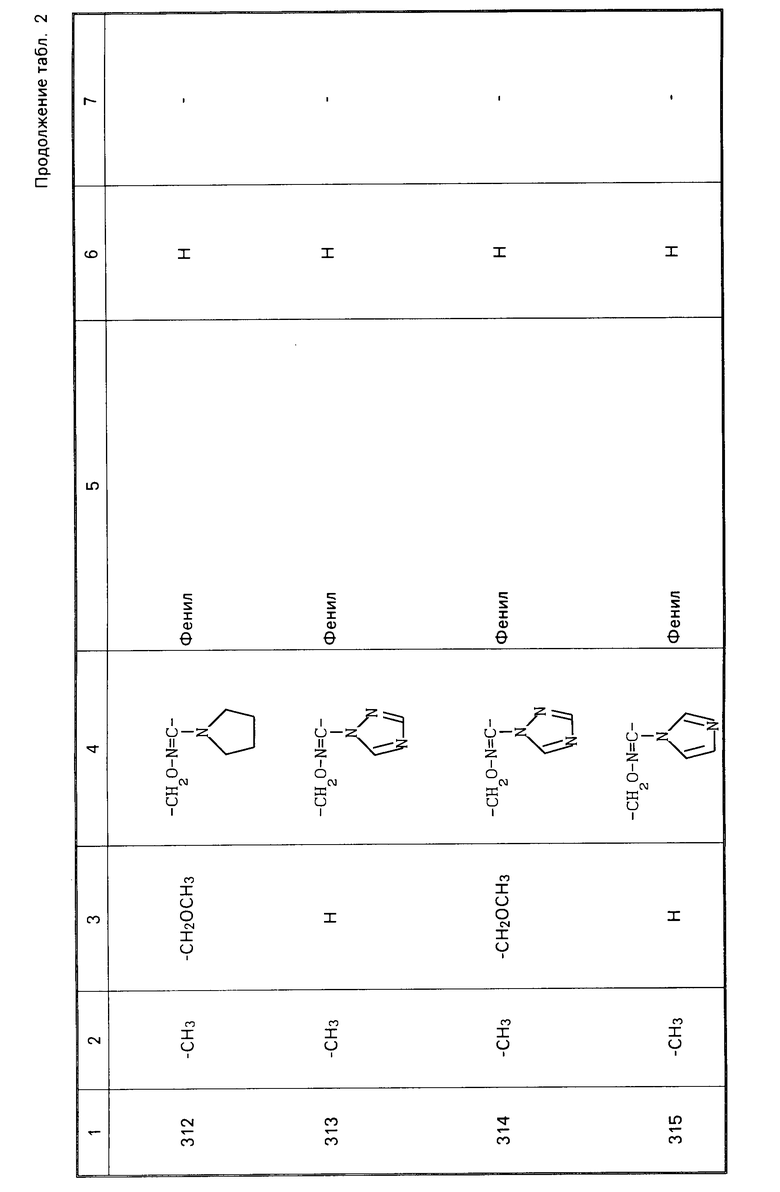
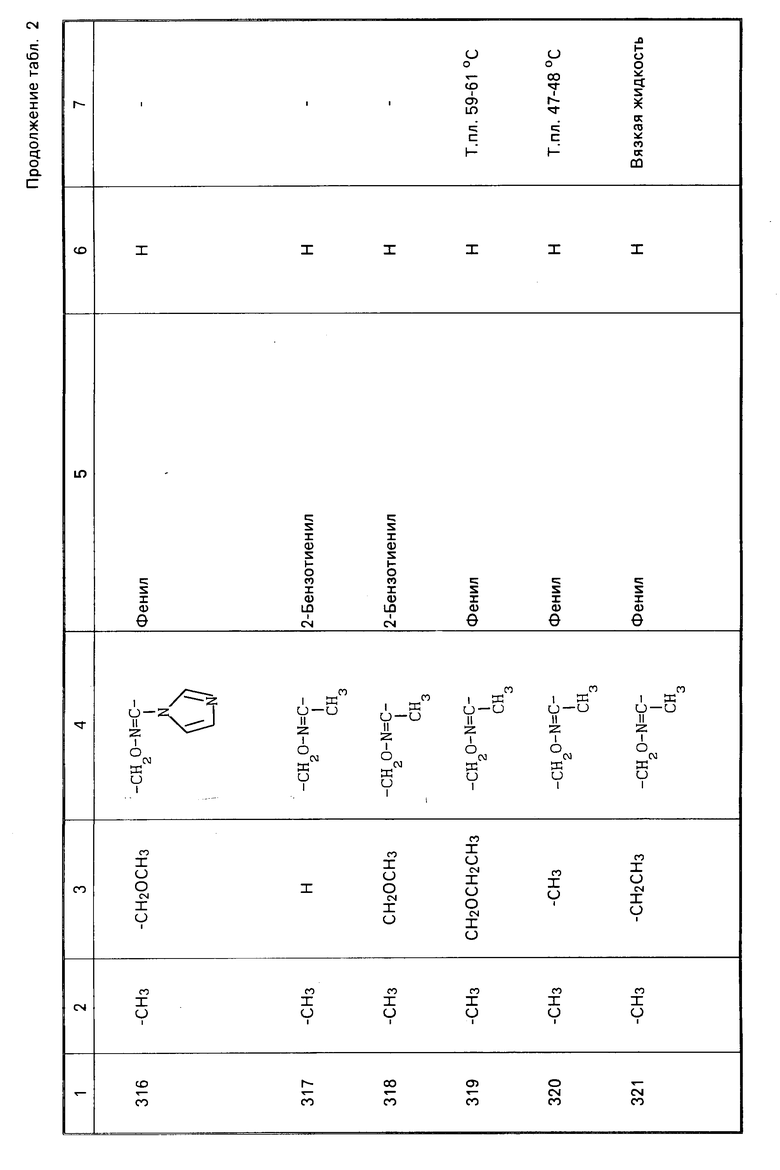
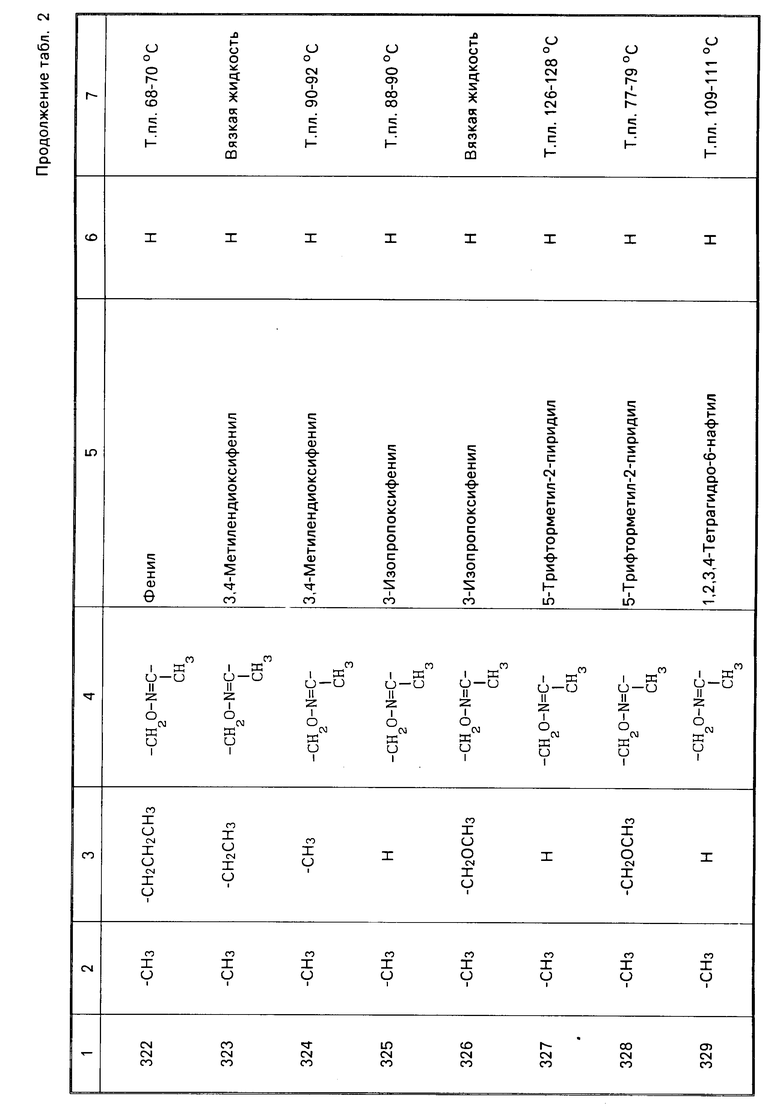


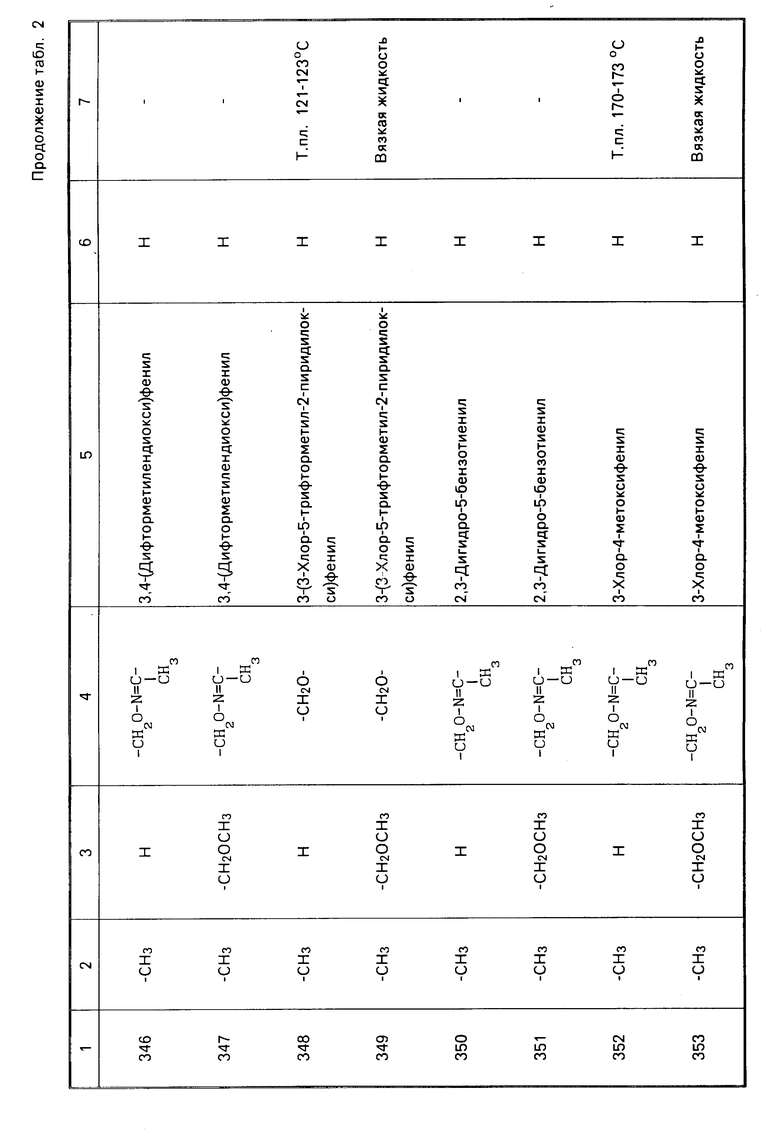
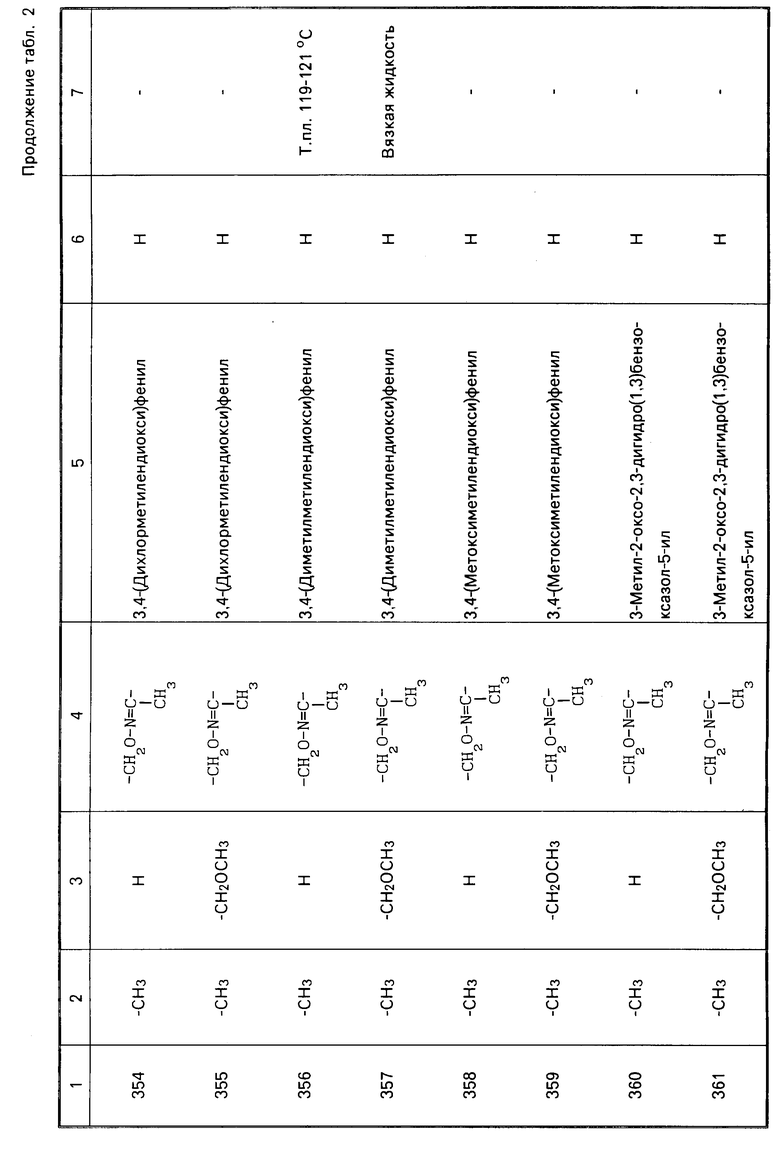

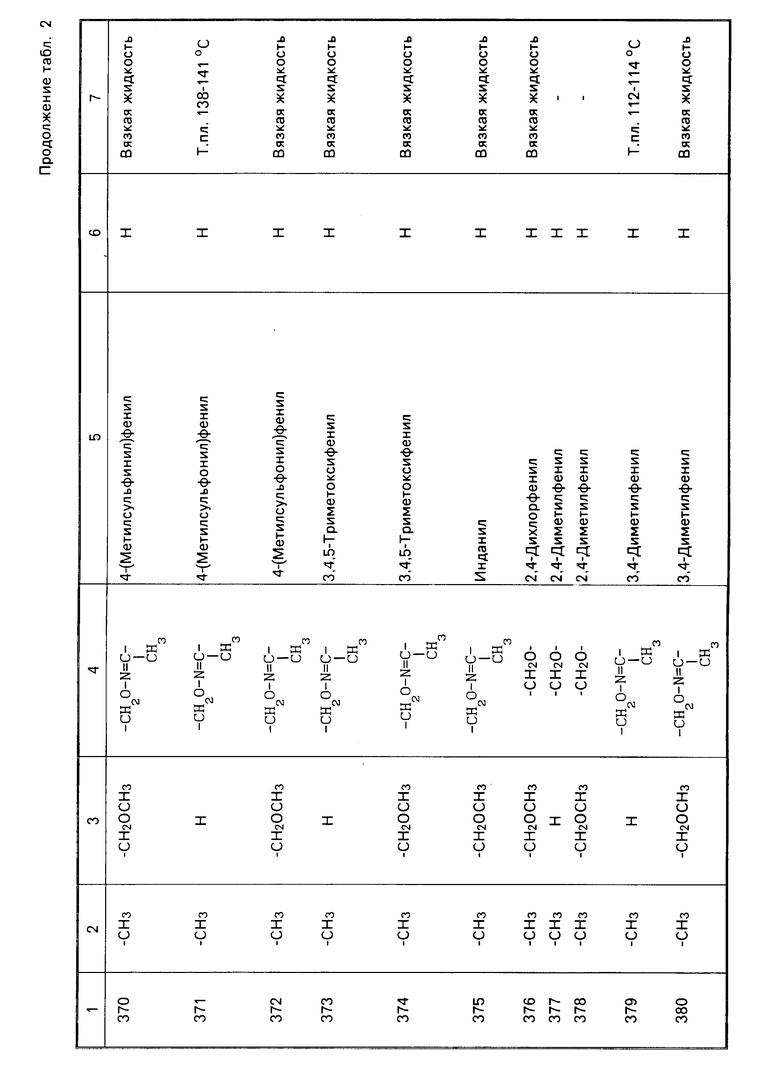
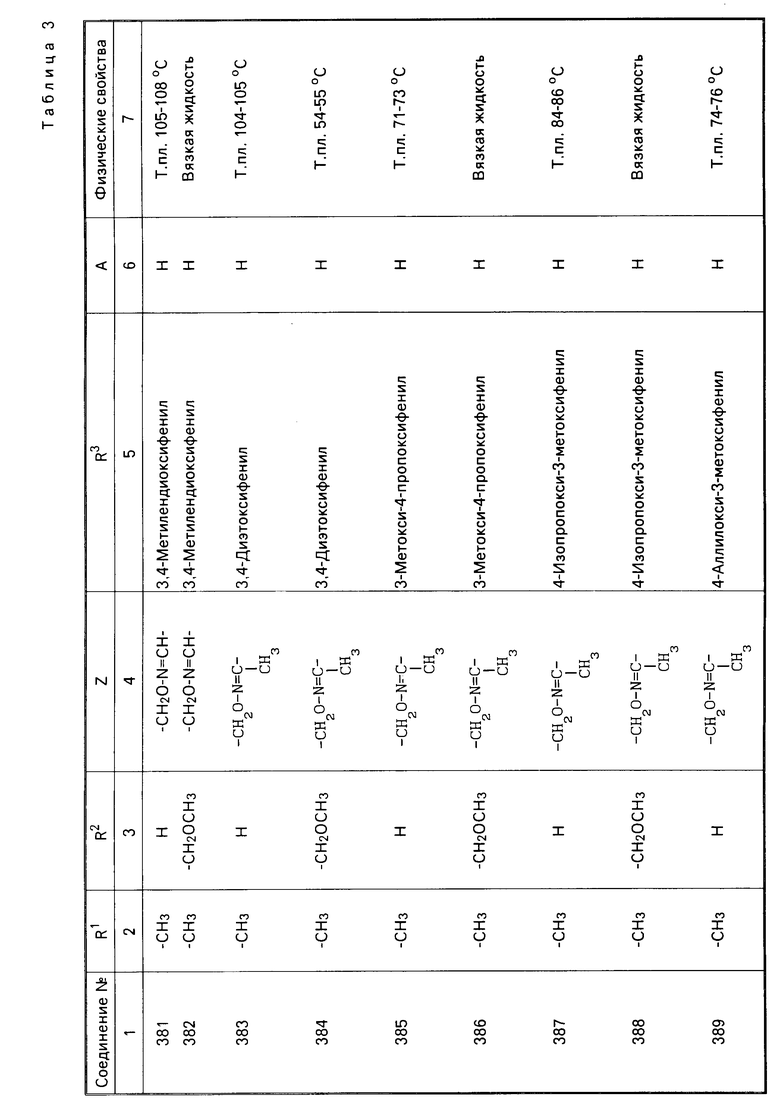
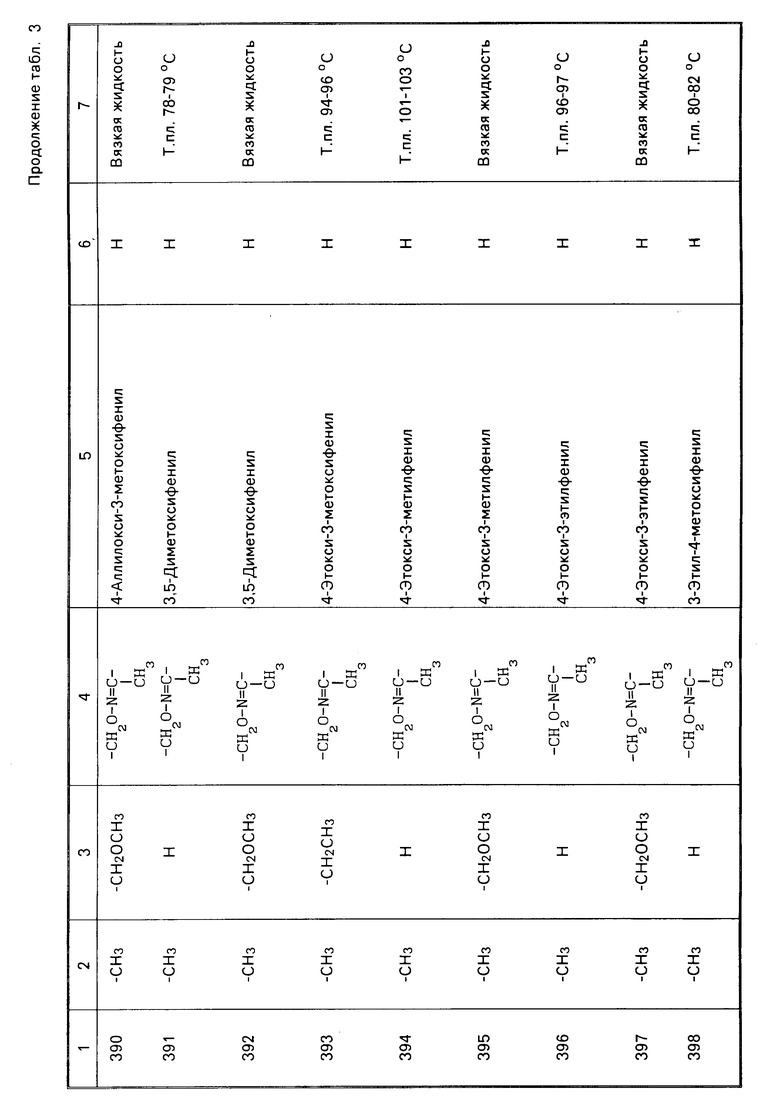
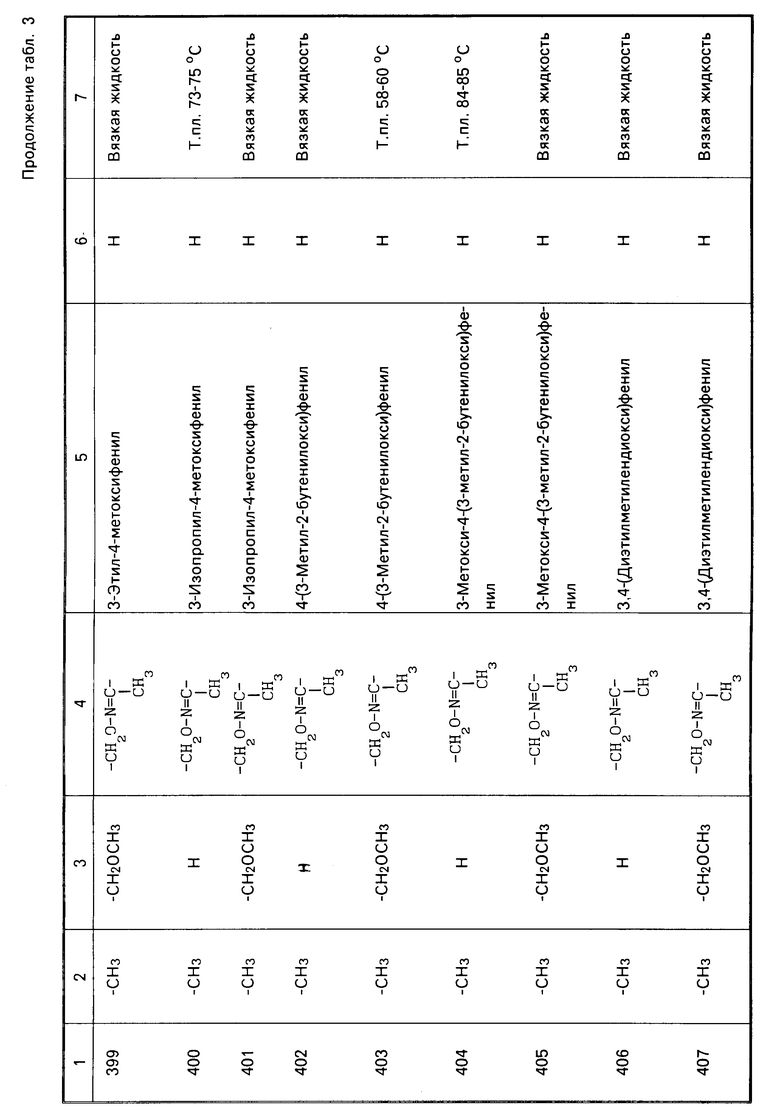
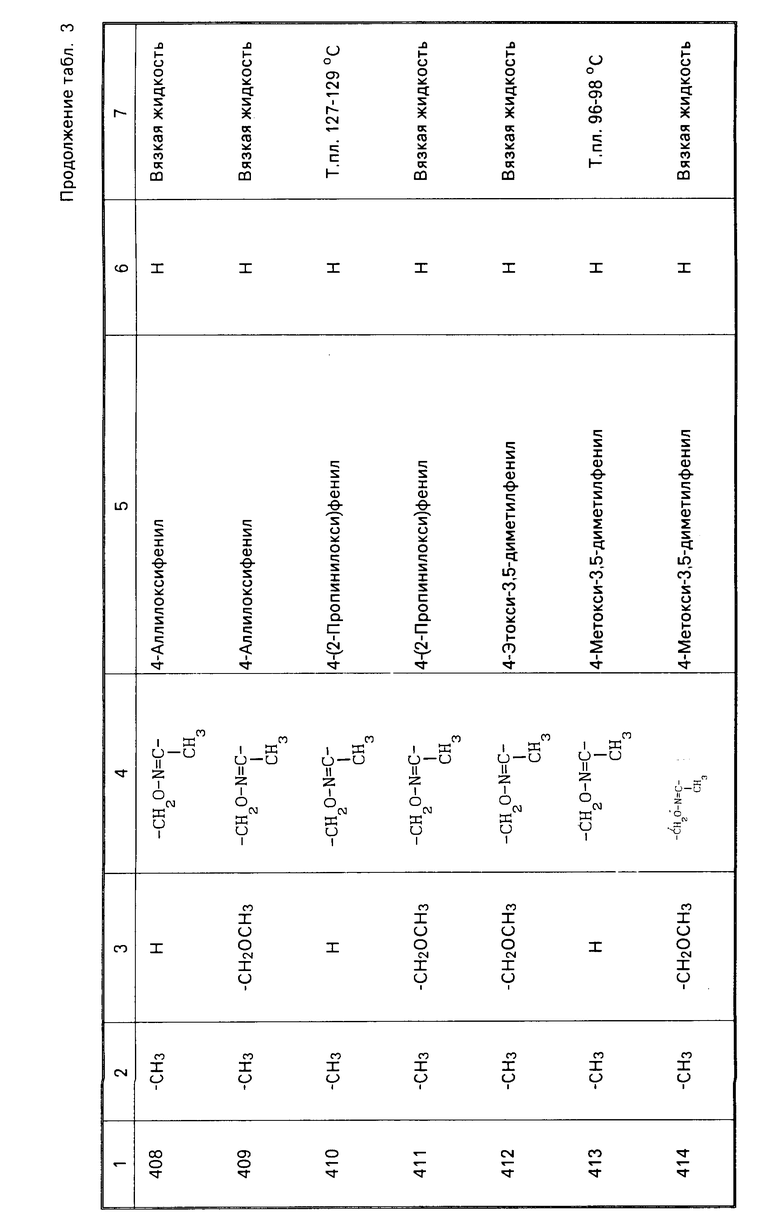
Использование: в качестве активного ингредиента фунгицидной композиции для уничтожения вредных организмов. Сущность изобретения: соединение ф-лы I 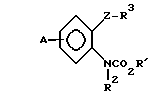 : где R′ представляет низший алкил, который может быть замещен галогеном. R″ H, низший алкил, необязательно замещенный галогеном, низшим алкокси, метилтио, метоксиэтиленокси или фенилом, низшую алкинильную группу или COX′ группу, где X′ низший алкил, Z-CH=CH-группу, или CH2-N = C(R4) группу, правая черточка представляет связь, направленную к R3:R3 фенил, необязательно замещенный одним заместителем, выбранным из галогена, низшего алкила, трифторметила, циано, низшего алкокси, низшего галоидокси, низшего алкенилокси, трифторметансульфонилокси, низшего алкилтио, низшего алкилсульфонила, низшего алкилсульфинила, диметилкарбамоилокси, фенила и пирролила: двумя заместителями, выбранными из галогена, низшего алкила, трифторметила, низшего алкокси и низшего алкенилокси или тремя заместителями, выбранными из низшего алкила и низшего алкокси, дифторметилендиоксифенильную группу, (1-2) с-алкилендиоксифенильную группу, ди-замещенную низшим алкилом-метилендиоксифенильную группу, пиридильную группу, необязательно замещенную галогеном или трифторметилом, нафтильную группу, тиенильную группу, необязательно замещенную галогеном, фурильную группу, метилиндолильную, метилпиррольную группу, индолильную группу, тетрагидронафтильную или дигидробензофурильную группу. R4-H низший алкил, необязательно замешенный галогеном, циклопропил, низшую алкокси, метилтио или морфолиногруппу, A-H, низший алкил, галоген или низшую алкокси группу, за исключением случая, когда R′ метил или этил, R″-H и ZR3 стирильная группа. Описана также фунгицидная композиция, включающая вышеуказанное N-фенилкарбаматное соединение (0,2-75 мас.) и целевые добавки - остальное до 100 мас. 2 с. п. ф-лы, 3 табл.
: где R′ представляет низший алкил, который может быть замещен галогеном. R″ H, низший алкил, необязательно замещенный галогеном, низшим алкокси, метилтио, метоксиэтиленокси или фенилом, низшую алкинильную группу или COX′ группу, где X′ низший алкил, Z-CH=CH-группу, или CH2-N = C(R4) группу, правая черточка представляет связь, направленную к R3:R3 фенил, необязательно замещенный одним заместителем, выбранным из галогена, низшего алкила, трифторметила, циано, низшего алкокси, низшего галоидокси, низшего алкенилокси, трифторметансульфонилокси, низшего алкилтио, низшего алкилсульфонила, низшего алкилсульфинила, диметилкарбамоилокси, фенила и пирролила: двумя заместителями, выбранными из галогена, низшего алкила, трифторметила, низшего алкокси и низшего алкенилокси или тремя заместителями, выбранными из низшего алкила и низшего алкокси, дифторметилендиоксифенильную группу, (1-2) с-алкилендиоксифенильную группу, ди-замещенную низшим алкилом-метилендиоксифенильную группу, пиридильную группу, необязательно замещенную галогеном или трифторметилом, нафтильную группу, тиенильную группу, необязательно замещенную галогеном, фурильную группу, метилиндолильную, метилпиррольную группу, индолильную группу, тетрагидронафтильную или дигидробензофурильную группу. R4-H низший алкил, необязательно замешенный галогеном, циклопропил, низшую алкокси, метилтио или морфолиногруппу, A-H, низший алкил, галоген или низшую алкокси группу, за исключением случая, когда R′ метил или этил, R″-H и ZR3 стирильная группа. Описана также фунгицидная композиция, включающая вышеуказанное N-фенилкарбаматное соединение (0,2-75 мас.) и целевые добавки - остальное до 100 мас. 2 с. п. ф-лы, 3 табл.
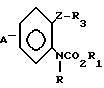
где R1 низшая алкильная группа, которая может быть замещена галогеном;
R2 водород, низшая алкильная группа, необязательно замещенная галогеном, низшим алкокси, метилтио, метоксиэтиленокси или фенилом, низшая алкенильная группа, низшая алкинильная группа или -СОХ1-группа, где Х1 низшая алкильная группа;
Z -СН= СН-группа или -СН2О-N-(R4)-группа связь, справа которой, направленная к R3;
R3 фенильная группа, необязательно замещенную одним заместителем, выбранным из галогена, низшего алкила, трифторметила, циано, низшего алкокси, низшего галоидалкокси, низшего алкенилокси, трифтометансульфонилокси, низшего алкилтио, низшего алкилсульфонила, низшего алкилсульфинила, диметилкарбомоилокси, фенила и пирролила, двумя заместителями, выбранными из галогена, низшего алкила, трифторметила, низшего алкокси и низшего алкенилокси, или тремя заместителями, выбранными из низшего алкила и низшего алкокси, дифторметилендиоксифенильная группа, (1-2)С-алкилендиоксифенильная группа, дизамещенная низшим алкилом метилендиоксифенильная группа, пиридильная группа, необязательно замещенная галогеном или трифторметилом, нафтильная группа, тиенильная группа, необязательно замещенная галогеном, фурильная группа, метилиндоильная, метилпирролильная группа, инданильная группа, тетрагидронафтильная или дигидробензофурильная группа;
R4 водород, низшая алкильная группа, необязательно замещенная галогеном, циклопропильная группа, низшая алкокси, метилтио- или морфолиногруппа;
A водород, низшая алкильная группа, галоген или низшая алкоксигруппа; за исключением случая, когда R1 метильная или этильная группа;
R2 водород,
-ZR3 стирильная группа.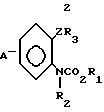
где R1 низшая алкильная группа, которая может быть замещена галогеном;
R2 водород, низшая алкильная группа, необязательно замещенная галогеном, низшим алкокси, метилтио, метоксиэтиленокси или фенилом, низшая алкенильная группа, низшая алкинильная группа или -СОХ1-группа, где Х1 низшая алкильная группа;
Z -СН-СН- или -СН2О-N-(R4)-группа, правая связь каждой из которых направлена к R3;
R3 фенильная группа, необязательно замещенная одним заместителем, выбранным из галогена, низшего алкила, трифторметила, циано, низшего алкокси, низшего галоидалкокси, низшего алкенилокси, трифторметансульфонилокси, низшего алкилтио, низшего алкилсульфонила, низшего алкилсульфинила, диметилкарбомоилокси, фенила и пирролила, двумя заместителями, выбранными из галогена, низшего алкила, трифторметила, низшего алкокси и низшего алкенилокси, или тремя заместителями, выбранными из низшего алкила и низшего алкокси; дифторметилендиоксифенильная группа, (1-2)С-алкилендиоксифенильная группа, ди-замещенная низшим алкилом метилендиоксифенильная группа, пиридильная группа, необязательно замещенную галогеном или трифторметилом, нафтильная группа, тиенильная группа, необязательно замещенную галогеном, фурильная группа, метилиндолильная, метилпирролильная группа, инданильная группа, тетрагидронафтильная или дигидробензофурильная группа;
R4 водород, низшая алкильная группа, необязательно замещенная галогеном, циклопропильная группа, низшая алкокси, метилтио- или морфолиногруппа;
A водород, низшая алкильная группа, галоген или низшая алкоксигруппа, за исключением случая, когда R1 метильная или этильная группа, R2 водород;
ZR3 стирильная группа,
при следующем соотношении ингредиентов, мас.
N-Фенилкарбаматное соединение 0,2-75,0
Целевые добавки Остальное
| Патент США N 4647583, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
Авторы
Даты
1995-12-10—Публикация
1992-02-06—Подача