Изобретение относится к методам диагностики различных патологий, связанных с нарушениями обмена метаболитов (таких как глюкоза, холестерин, лактат, мочевая кислота и др.) и может быть использовано и поэтому рентабельны в применении только для крупных клиник. Кроме того, данные методы не обеспечивают достаточной экспрессности анализа и отличаются значительной дороговизной за счет высокой стоимости оборудования и большого расхода реактивов.
Биосенсорный анализ метаболитов в большинстве случаев лишен перечисленных недостатков. Сейчас в коммерческих биосенсорах в основном применяется амперометрический принцип детекции. В этом случае метаболиты окисляются на мембране в присутствие соответствующего иммобилизованного фермента, а образующийся пероксид водорода детектируется на электроде амперометрически. Амперометрический способ детекции отличается от потенциометрического более сложной приборной частью и высокими требованиями к квалификации обслуживающего персонала.
Прототипом изобретения является способ определения глюкозы и активный элемент (электрод) на основе глюкозооксидазы иммобилизованной на поверхности платины. При этом определение глюкозы осуществляется амперометрически по пероксиду водорода, образующемуся в ходе ферментативного окисления глюкозы в присутствии глюкозооксидазы.
Целью изобретения является разработка простого, прецизионного, инструментального метода для определения содержания метаболитов, способных к ферментативному окислению с образованием пероксида водорода (глюкоза, холестерин, лактат, мочевая кислота и др.), и активных элементов для его проведения. Метод предназначен для широкого использования в диагностике, установления общей клинической картины пациентов и для скрининга среди больших групп населения (диспансерное обслуживание и обследование групп риска).
Сущность нового подхода определения метаболитов в биологических жидкостях заключается в использовании явления безмедиаторного биоэлектрокатализа, позволяющего за счет ферментативного снятия перенапряжения детектировать образование пероксида водорода в присутствии иммобилизованной на электроде пероксидазы. Это свойство положено в основу селективной потенциометрической детекции метаболитов, способных к ферментативному окислению с образованием пероксида водорода. Активный элемент состоит из композитного углеродистого материала и соиммобилизованных на поверхности электрода их пероксидазу и фермент катализатор окисления аналита (глюкозооксидазу или лактатоксидазу, уратоксидазу, холестериноксидазу и т.п.). Каталитическое окисление аналита приводит к образованию пероксида водорода. Безмедиаторный катализ пероксидазой электровосстановления пероксида водорода обуславливает сдвиг электродного потенциала за счет каталитического снятия перенапряжения. При этом скорость роста электродного потенциала пропорциональна концентрации аналита.
Для проведения таких измерений разработан активный элемент (электрод), методика произведения измерений и прибор (биосенсор) для анализа метаболитов.
Преимущества данного подхода обусловлены тем фактом, что изменение электродного потенциала в присутствии пероксида водорода обусловлено прямым биоэлектрокатализом реакции электровосстановления последнего. Этот факт дает возможность отказаться от использования низкомолекулярных медиаторов. Отказ от использования низкомолекулярных медиаторов позволяет реализовать потенциометрическую схему многоразового анализа при отсутствии каких-либо дополнительных реагентов кроме буферного раствора.
Особенность нового подхода заключается в том, что он отличается методической простотой. Электронная часть аппаратурного оформления по существу представляет собой вольтметр с высоким входным импедансом и блок преобразования сигнала. Активные элементы (электроды) исключительно просты в изготовлении и миниатюризированы.
Способ осуществляют следующим образом:
П р и м е р 1. Изготовление активных элементов (электродов).
В 0,5 мл раствора полимера (полиэтиленимина модифицированного последовательно этилбромидом и цетилбромидом по известному методу в бензоле (10 мг/мл) суспендируют 30 мг сажи ПМ-100 с удельной поверхностью 98 м2/г, суспензию наносили на электрод из углеродистого материала (пирографит, графитовое волокно) и высушивают. Электрод обрабатывают в течение 10 ч в 7,5%-ном растворе глутарового альдегида в 0,01 М фосфатном буфере рН 6,8 при 310 К. Затем помещали в раствор пероксидазы и фермента-катализатора окисления аналита в 0,01 М фосфатном буфере рН 6,8, инкубируют в течение 4 ч при 277 К. Ферменты-катализаторы окисления аналита для соответствующих аналитов используются следующие: глюкозооксидаза (глюкоза), холестериноксидаза (холестерин), лактатоксидаза (лактат), уратоксидаза (мочевая кислота). Отношение концентрации фермента к концентрации пероксидазы составляет от 1:5 до 5:1 в зависимости от природы фермента-катализатора окисления аналита.
Полимер, входящий в состав композитного материала активного элемента выполняет следующие основные функции: служит связующим для сажи при сохранении проводимости последней; предоставляет аминогруппы для иммобилизации ферментов на поверхности электрода. Кроме того, модифицированный полиэтиленимин препятствует неспецифической сорбции белков на поверхности электрода, благодаря своим поверхностно-активным свойствам.
П р и м е р 2. Определение глюкозы.
1. Анализ глюкозы в водных растворах. Измерения производят в 0,01 М Na-фосфатном буфере рН 6,8, содержащим 0,05 M NaCl в измерительной ячейке объемом 0,1-1 мл. Электродом сравнения служит Ag/AgCl электрод или электрод из материала активного элемента, не содержащего иммобилизованных ферментов. Регистрация потенциала производится при помощи вольтметра с высоким входным импедансом, имеющим выход на самописец или блок обработки сигнала. Объем вводимой пробы составляет 10% от объема измерительной ячейки.
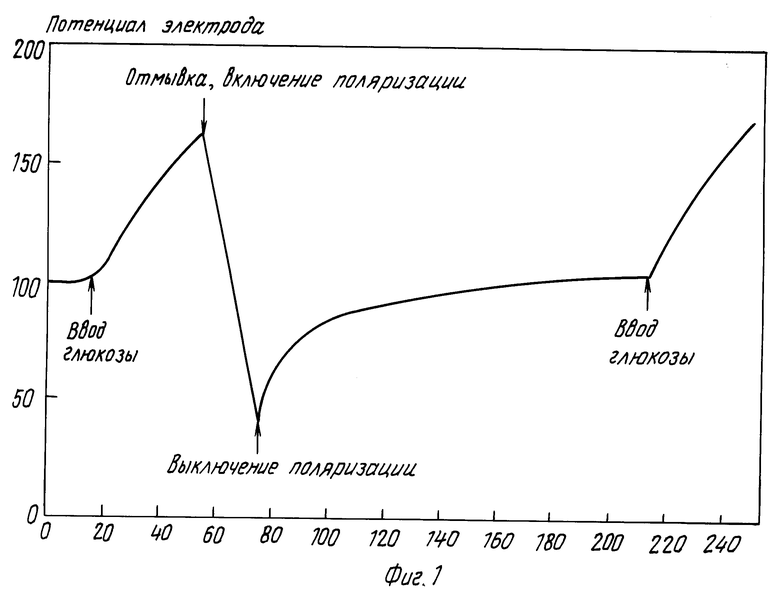
В отсутствие глюкозы в среде на электроде устанавливается потенциал 0-100 мВ. Рост электродного потенциала после инжектирования глюкозы в реакционную ячейку происходит с начальными скоростями в десятки-сотни мВ/мин в зависимости от концентрации глюкозы. Предельное значение потенциала электрода обуславливается снятием перенапряжения электровосстановления пероксида водорода и соответствует приблизительно 400 мВ. Для надежного определения начальной скорости достаточно 10-и секунд. После каждого измерения необходимо снять поляризацию электрода кратковременной (несколько секунд) принудительной катодной поляризацией с использованием вспомогательного электрода. Вспомогательный электрод может быть выполнен из углеродистого материала (пирографит, углеродистое волокно). Рабочий электрод подключают к катоду, а вспомогательный к аноду источника питания (напряжение 1 В). После падения потенциала рабочего электрода ниже фонового значения цепь размыкают. После установления на рабочем электроде фонового значения потенциала можно производить последующее измерение (фиг. 1). Эта процедура достаточно проста и отнимает вместе с промывкой электрода и ячейки не более 1 мин.
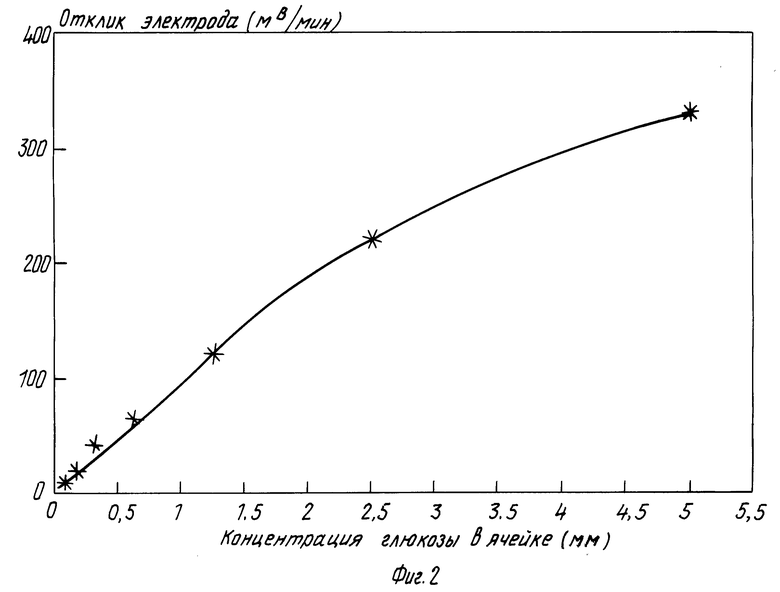
На фиг. 2 приведена калибровочная зависимость скорости роста потенциала активного элемента (электрода) от концентрации глюкозы. Зависимость линейна в диапазоне концентрации глюкозы 0,25-20 мМ (с учетом десятикратного разбавления пробы при инжектировании), что полностью покрывает необходимый клинический диапазон концентраций в крови и моче. Анализ глюкозы в крови ведут аналогично. Способ позволяет определять глюкозу как в плазме так и в цельной крови.
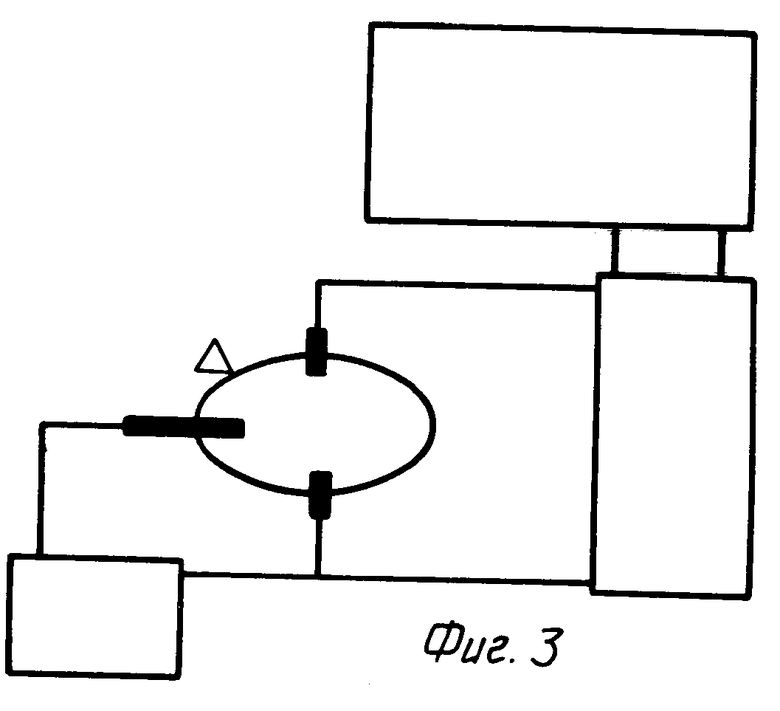
Устройство для проведения измерения концентрации глюкозы (фиг. 3) включает в себя: электрохимическую ячейку, содержащую рабочий электрод (активный элемент), электрод сравнения (Ag/AgСl электрод), вспомогательный электрод (угольный электрод); инжектор пробы; измерительный прибор (вольтметр с входным сопротивлением не ниже 100 МОм); устройство для обработки сигнала (самописец); источник деполяризующего напряжения (гальванический элемент на 1 В). Основным фактором крови (мочи), который может существенно влиять на результаты анализа является аскорбиновая кислота. Аскорбиновая кислота является субстратом пероксидазы и ее наличие приводит к занижению реального значения концентрации аналита при концентрации аскорбата в анализируемой среде свыше 0,1 мМ.
П р и м е р 3. Определение холестерина в биологических жидкостях. Активный элемент готовят аналогично примеру 1, в качестве фермента катализатора окисления аналита используется холестериноксидаза. Измерения ведут аналогично примеру 2. Диапазон определяемых концентраций: 0,5-15 мМ.
П р и м е р 4. Определение лактата в биологических жидкостях. Активный элемент готовят аналогично примеру 1, в качестве фермента катализатора окисления аналита используется лактатоксидаза. Измерение ведут аналогично примеру 2. Диапазон определяемых концентраций: 0,1-15 мМ.
П р и м е р 5. Определение мочевой кислоты в биологических жидкостях. Активный элемент готовят аналогично примеру 1, в качестве фермента катализатора окисления аналита используется уратоксидаза. Измерения ведут аналогично примеру 2. Диапазон определяемых концентраций: 1-20 мМ.
П р и м е р 6. Определение холина в биологических жидкостях. Активный элемент готовят аналогично примеру 1, в качестве фермента катализатора окисления аналита используется холиноксидаза. Измерения ведут аналогично примеру 2. Диапазон определяемых концентраций: 0,2-10 мМ.
Таким образом, описанный метод имеет высокую производительность (до 30 анализов в час), отличается методической простотой (не требует дополнительных реагентов кроме буферного раствора), дешевизной (расход ферментов на 1 активный элемент не превышает 10 мкг, активный элемент выдерживает от 100 до 1000 анализов), и может быть реализован аппаратурно на простой элементной базе.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕТАЛЛОКОМПЛЕКСЫ ПОРФИРИН-КЕТОНОВ, ЧУВСТВИТЕЛЬНЫЙ ЭЛЕМЕНТ ДЛЯ ОПТИЧЕСКОГО ОПРЕДЕЛЕНИЯ КИСЛОРОДА В ЖИДКОЙ ИЛИ ГАЗОВОЙ СРЕДЕ И СПОСОБ ОПРЕДЕЛЕНИЯ КИСЛОРОДА | 1992 |
|
RU2064948C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ МИКРОБИОСЕНСОРА ДЛЯ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ ИЛИ ЛАКТАТА | 2013 |
|
RU2580288C2 |
| БИОСЕНСОР С ПОВЫШЕННЫМ КОЭФФИЦИЕНТОМ ЧУВСТВИТЕЛЬНОСТИ | 2019 |
|
RU2731411C1 |
| БИОСЕНСОР ДЛЯ ОДНОВРЕМЕННОГО ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ И ЛАКТАТА В КРОВИ | 2018 |
|
RU2696499C1 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОБНАРУЖЕНИЯ АНАЛИТА С ИСПОЛЬЗОВАНИЕМ ЭЛЕКТРОХИМИЧЕСКОГО БИОСЕНСОРА | 2018 |
|
RU2735654C1 |
| Способ получения ферментных электродов чувствительных к метаболитам | 1979 |
|
SU891774A1 |
| Тест-полоска для определения содержания этилового спирта в крови электрохимическим способом с помощью портативной амперометрической ячейки | 2019 |
|
RU2713111C1 |
| ГИДРОЗОЛЬ ДЛЯ ФОРМИРОВАНИЯ ПОКРЫТИЙ ЭЛЕКТРОХИМИЧЕСКИХ ПЕРОКСИДЧУВСТВИТЕЛЬНЫХ СЕНСОРОВ И БИОСЕНСОРОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ЭЛЕКТРОХИМИЧЕСКИЙ СЕНСОР И БИОСЕНСОР, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2419785C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ПЕРОКСИДА ВОДОРОДА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ (ВАРИАНТЫ) | 2007 |
|
RU2444006C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОСЕНСОРНОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ МОНО- И ПОЛИСАХАРИДОВ | 2011 |
|
RU2454458C1 |
Использование в медицине, радиологии, ветеринарии, а именно в диагностике различных паталогий, связанных с нарушениями обмена метаболитов, таких как глюкоза, холестерин, лактат, мочевая кислота и др. Сущность изобретения состоит в том, что при определении содержания метаболитов в биологических жидкостях, способных к ферментативному окислению с образованием пероксида водорода в присутствии иммобилизованной на электроде пероксидазы, детектируют образование пероксида водорода за счет ферментативного снятия перенапряжения. Активный элемент состоит из композитного углеродистого материала и соиммобилизованных на поверхности электрода пероксидазы и оксидазы, катализирующей окисление анализируемого субстрата с образованием пероксида водорода, в соотношении 1 5 5 1. 2 с. и 4 з. п. ф-лы, 3 ил.
| Anal.Chimica Acta, 1991, v.242, p.275-278. |
Авторы
Даты
1995-12-10—Публикация
1992-06-25—Подача