Изобретение относится к новому классу пестицидов, которые представляют собой 1,4-бис-замещенные-2,6,7-триоксабицикло(2.2.2)октаны.
Изобретение было разработано при поддержке правительства Соединенных Штатов в соответствии с документом N ЕS00049, выданным Национальным институтом здравоохранения. Правительство Соединенных Штатов обладает определенными правами на это изобретение.
Пестициды представляют собой химикаты, которые используются для воздействия на различных насекомых, находящихся на ценных сельскохозяйственных растениях, домашнем скоте, а также людях и среде их обитания. К классу этих химикатов относятся инсектициды, фунгициды, гербициды (или вещества, предназначенные для уничтожения сорных растений), нематоциды, вещества для уничтожения молюсков, акарициды и вещества для уничтожения паразитов.
В настоящее время известно большое количество классов соединений, которые обладают пестицидной активностью, однако известные пестицидные композиции могут со временем становиться менее эффективными вследствие того, что происходит повышение сопротивляемости тех организмов, для уничтожения которых они предназначены. Этим обуславливается то, что необходимо постоянное развитие и разработка новых типов пестицидов.
Идеальный пестицид должен обладать высокой эффективностью при уничтожении насекомых и являться биологически разлагающимся.
Цель изобретения разработка пестицидных соединений, обладающих требуемыми свойствами.
В соответствии с одним из аспектов настоящего изобретения пестициды содержат соединение, характеризуемое формулой R-C(CH2O)3C-X, где R и Х имеют вышеуказанные значения, причем это соединение обладает пестицидной активностью, поскольку его 50%-ная летальная доза LD50, выраженная в микрограммах соединения на грамм живого веса муки Musca domestica (муха домашняя), составляет не более, чем примерно 400.
В соответствии с другим аспектом настоящего изобретения соединение, характеризуемое формулой R-C(CH2O)3C-X, где R и Х имеют нижеуказанные значения, в композиции с синергетиком для обеспечения пестицидной активности и вместе они обеспечивают 50%-ную летальную дозу LD50, выраженную в микрограммах на грамм живого веса, не превышающую примерно 60.
В соответствии с еще одним аспектом настоящего изобретения композиция, как было указано выше, содержит соединение, характеризуемое формулой R-C(CH2O)3C-X, где R представляет собой пропил, изопропил, бутил, С3-С10-циклоалкил или фенил, Х С6-С10-циклоалкил, С6-С10-циклоалкенил, С2-С6-алкинил или фенил, замещенный одним или более заместителями, выбранными из атома галогена, циано-, азидо- или нитро-группа или С1-С2-алкила, возможно замещенного 1-3 атомом галогена, при условии, что когда Х 4-фторфенил, R не является фенилом.
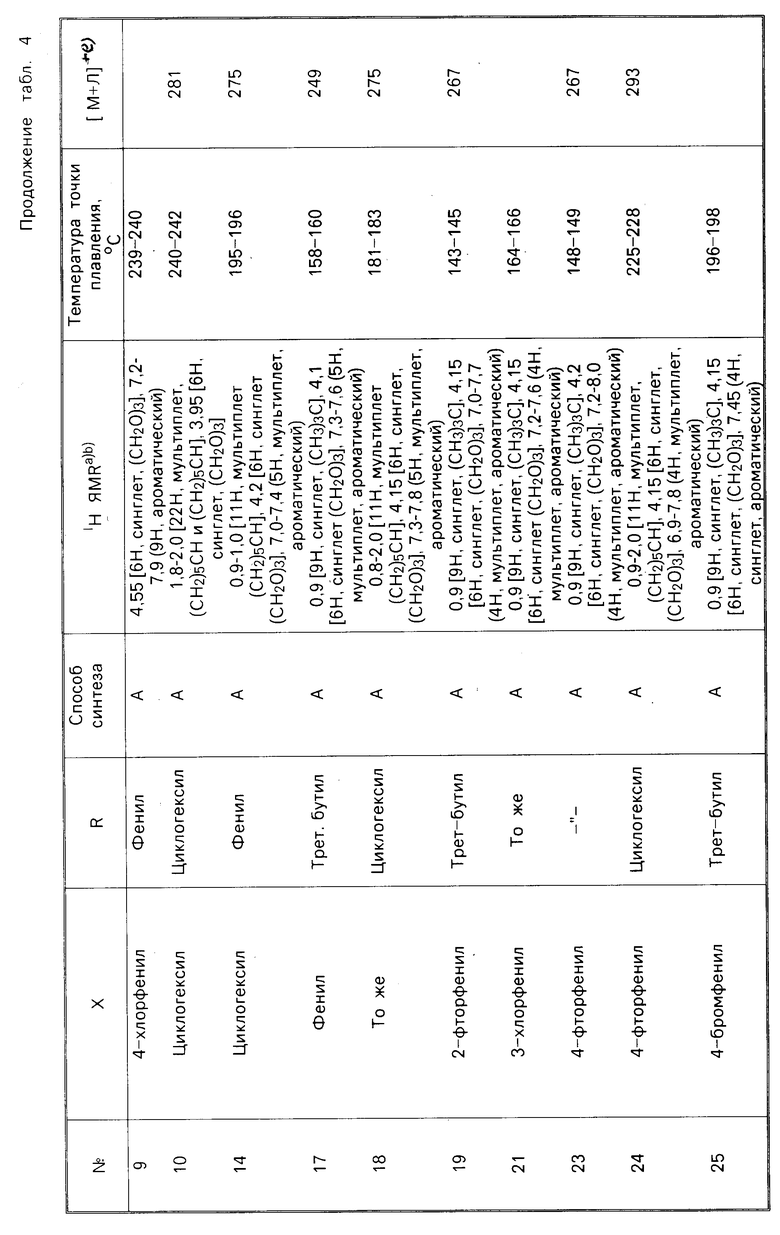
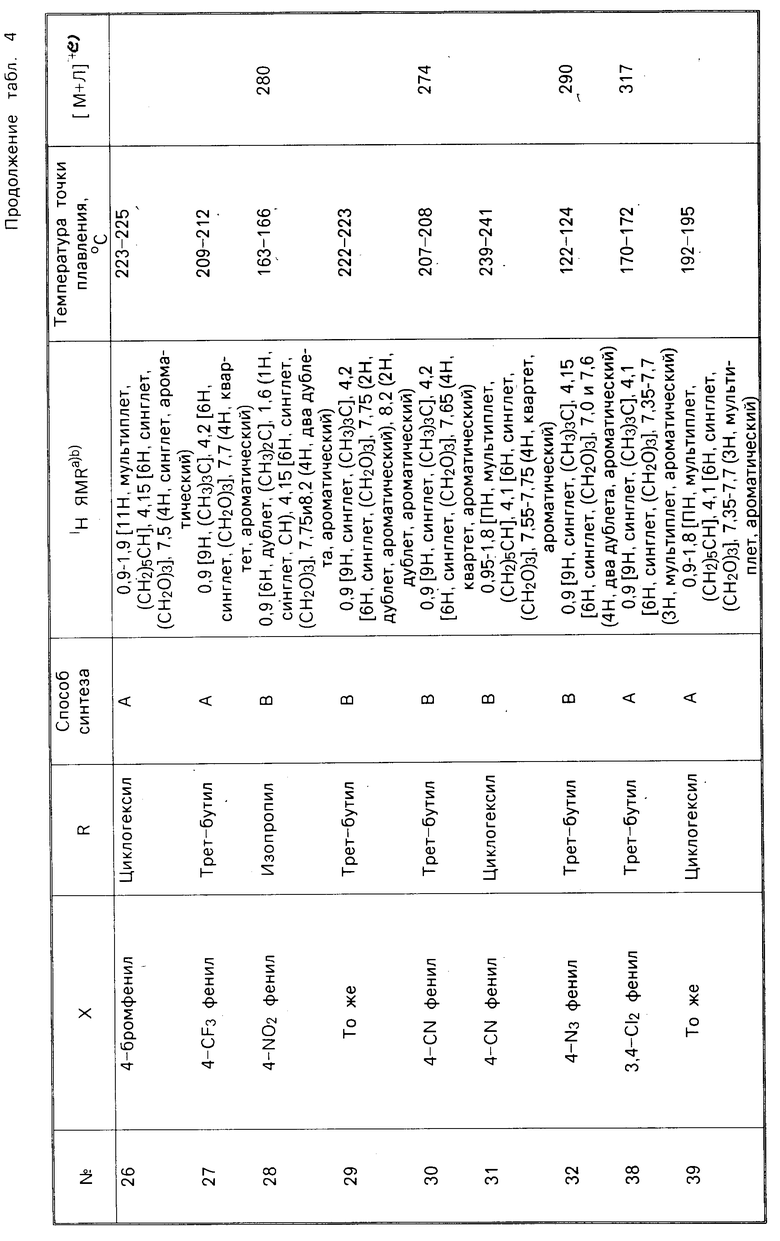
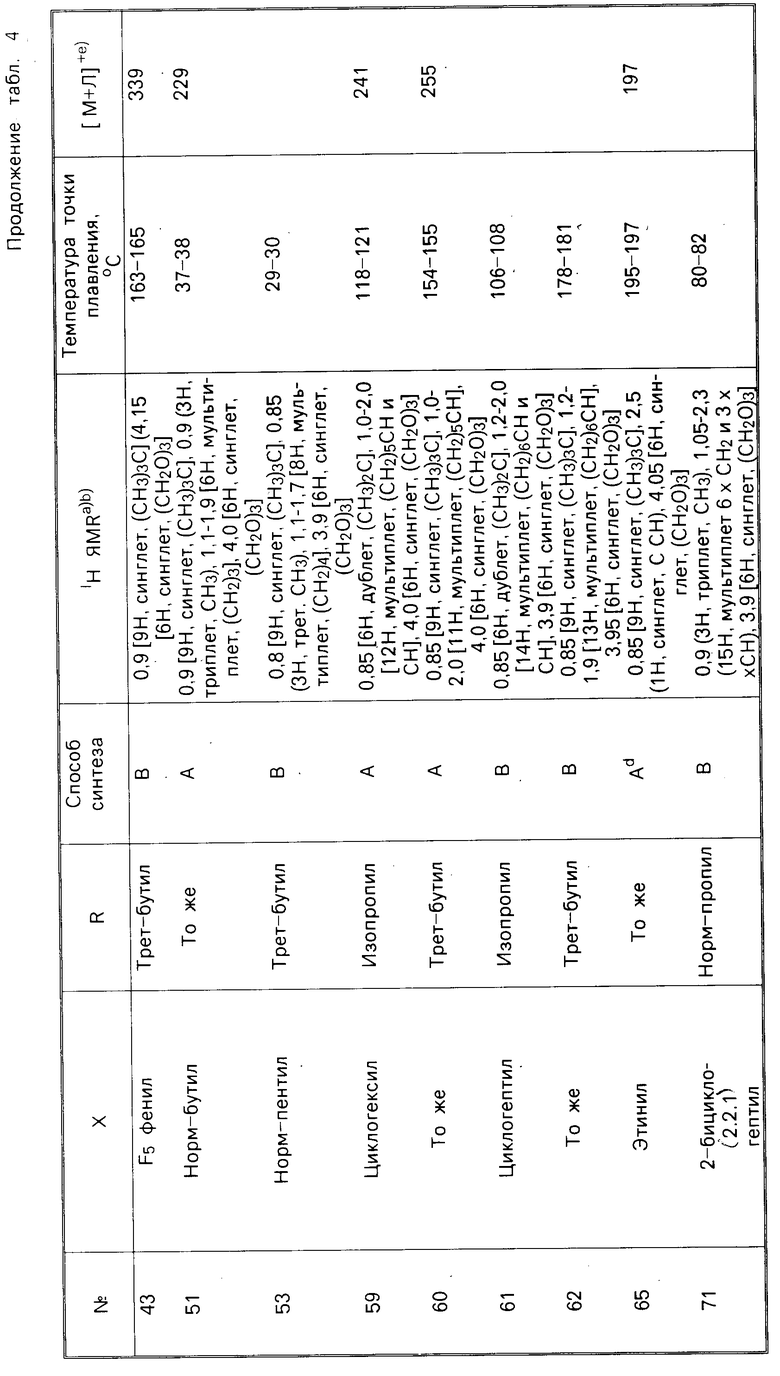
В соответствии с еще одним аспектом настоящего изобретения композиция, как было указано выше, содержит соединение, характеризуемое формулой R-C(CH2O)3C-X, где Х представляет собой 4-хлорфенил и R представляет собой пропил, изопропил, бутил, циклопентил, циклогексил или фенил, или где Х представляет собой циклогексил, а R представляет собой циклогексил или фенил, или где R представляет собой циклогексил, а Х представляет собой фенил, 4-фторфенил, 4-бромфенил, 4-цианофенил, 3,4-дихлорфенил или циклогептил, или где R представляет собой трет-бутил, и Х представляет собой 2-фторфенил, 3-хлорфенил, 4-фторфенил, 4-бромфенил, 4-трифторметилфенил, 4-нитрофенил, 4-цианофенил, 4-азидофенил, 3,4-дихлорфенил, 2,3,4,5,6-пентафторфенил, нор-пентил, циклогексил, циклогептил или этинил или где R представляет собой изопропил, а Х представляет собой 4-нитрофенил, циклогексил или циклогептил; или где R представляет собой норм-пропил, а Х представляет собой 2-бицикло(2.2.1)гептил или циклогексил-3-енил.
В соответствии с другими аспектами настоящего изобретения пестицидные соединения и композиции, указанные выше, используются для уничтожения определенных, заранее выбранных, видов насекомых.
Соединения формулы (I) могут использоваться для борьбы с членистоногими, например, паразитирующими насекомыми и клещами. Поэтому еще одним аспектом настоящего изобретения является также способ борьбы с членистоногими паразитами животных, включающий обработку животных эффективным количеством соединения формулы (I).
Для этих целей соединения формулы (I) могут использоваться как сами по себе, так и в виде известных разбавленных препаратов, например растворов, аэрозолей, лаков, пен, дустов, порошков, водных суспензий, паст, гелей, шампуней, мазей, твердых топлив, твердых источников паров, например брикетов, выделяющих пары активного вещества, смачивающихся порошков, гранулятов, спреев, концентратов эмульсий, масляных суспензий, масляных растворов, пропитанных предметов или препаратов для ополаскивания. Концентраты для ванн не используются сами по себе, а разбавляются водой, после чего животных помещают в ванну, заполненную раствором. Обработка спреями производится вручную или с помощью устройств, создающих сильную струю или устройств для объемного опрыскивания. Животные, растения или поверхности могут быть обработаны спреем высокообъемным способом или же подвергнуты поверхностной обработке малообъемным или ультрамалообъемным способом. Обработка водными суспензиями может осуществляться таким же образом, как и с помощью спреев или водных растворов для ванн. Обработка дустами может осуществляться с помощью специальных устройств для распыления, или же (в случае использования их для обработки животных) они могут помещаться в перфорированные мешки, подвешиваемые на деревья или прикрепляемые к брускам для натирания животных. Пасты, шампуни и смазки могут наноситься вручную или распределяться по поверхности инертного материала. Препараты для полива наносятся небольшими порциями на спину животного таким образом, чтобы вся жидкость или большая ее часть оставалась на животном.
Расход соединения формулы (I) при обработке животного может изменяться в зависимости от природы соединения, промежутка времени между обработками, вида используемого для обработки препарата и предполагаемого паразита, однако, как правило, концентрация его в препарате находится в пределах 0,001-20,0, предпочтительно 0,01-10 мас. Количество наносимого на животного соединения зависит от способа применения, размеров животного, концентрации соединения в используемом препарате, степени разбавления препарата и вида препарата. Обычно оно находится в пределах от 0,0001 до 0,5% (за исключением неразбавленных препаратов, таких как препараты для полива, в которых концентрация соединения формулы (I) находится в пределах от 0,1 до 20,0, предпочтительно от 0,1 до 10%).
Соединения формулы (I) могут использоваться для обработки и защиты растений. В этом случае активный компонент используется в эффективных, с точки зрения акарицидной и инсектицидной активности, количествах. Расход активного компонента при этом зависит от природы используемого соединения, вида препарата, способа его применения, природы растений, предполагаемых вредителей и других факторов. Обычно при обработке сельскохозяйственных культур расход его составляет 0,001-3, предпочтительно 0,01-1 кг/га. Обычно концентрация соединения формулы (I) в препаратах для обработки сельскохозяйственных культур находится в пределах между 0,0001-50, предпочтительно 0,1-15 мас.
К сельскохозяйственным культурам, для обработки которых могут использоваться предлагаемые препараты, относятся хлопчатник, пшеница, кукуруза, рис, сорго, соя, виноград, томаты, картофель, фруктовые деревья и ель.
Дусты, смазки, пасты, поверхностные и объемные спреи и аэрозоли используются для этой цели вышеописанным образом. Концентрация соединения формулы (I) в них находится при этом в пределах 0,001-20 мас.
Было установлено, что соединения формулы (I) обладают активностью по отношению к мухам комнатным (Musca domestica), а также и другим членистоногим паразитам, включая tetranychus urticae Plutella xylostella, различные виды Culex и Blatella germanica. Поэтому они могут использоваться для борьбы с членистоногими, например насекомыми и клещами, в любой области, где они наносят вред, в частности в сельском хозяйстве, животноводстве, медицине, быту.
К насекомым-паразитам, для борьбы с которыми могут использоваться предлагаемые соединения, относятся отряды Coleoptera (например, Anobium, tribolium, Sitophilus, Deabrotica, futhonomus или различные виды Anthrenus), Lepidoptera (например, Ephestia, Plutella, Chilo, Heliothis, Spodoptera или различные виды fineola), Diptera (например, Musca, Aedes, Culex, Glossina, Stomoxys, Haemotobia, Tabanus, Hydrotaea, Lucilia, Chrysomia, Callitroga, Dermatobia, Hypoderma, Liriomyza и различные виды Melophagus), Phthiraptera (Malophaga, например, различные виды Damalina и Anophura, например, Pediculus humanus capitis, Pediculus humanus phythiruspubis Linognathus и Haematopinus), Hemiptera (например, Aphis, Bemisia, Aleurodes, Nibopavata, Nephrotetis или различные виды Cimex), Orthoptera (например, Schisticerca или различные виды Acheta), Dictyoptera (например, Blatella, Periplaneta или различные виды Blatta), Hymenoptera (например, Solenopis или различные виды Monomorium), Isoptera (например, различные виды Reticulitermes), Siphopartera (например, Clenocphalides или Pulex), Thysanura (например, различные виды Lepisma), Dermaptera (например, различные виды Forficula) и Pscoptera (например, различные виды Peripsocus).
К паразитам-клещам относятся, например, различные виды рода Boophilus, Phipiceplialus, Amblyomma, Hyalomma, Ixodes, Haemaphysalis, Dermocentor и Anocentor, а также manges, такие как Sarcoptes Scabiei и Tetranychus, Psoroptes, Psorergates, Notiedres, Chorioptes и различные виды Dimodex.
Предлагаемые соединения могут применяться в комбинации с одним или несколькими другими активными компонентами (например, пиретроидами, карбаматами и органофосфатами) и/или аттрактантами, фунгицидами и т.п. Было установлено, что активность предлагаемых соединений может быть повышена за счет добавки к ним синергистов, например одного из синергистов, относящихся к классу ингибиторов оксидазы, в частности пиперонилбутоксида или N1A 16388; другого соединения в соответствии с настоящим изобретением или пиретроида, обладающего пестицидной активностью. В случае использования в качестве синергиста ингибитора оксидазы соотношение между ним и соединением формулы (I) в препарате находится в пределах между 25:1-1:25, например около 10:1.
Стабилизаторами, вводимыми в препарат для предупреждения возможного химического разложения соединений, могут быть, например, антиокислители, например токоферол, бутилгидроанизол и бутилокситолуол, и акцепторы, например эпихлоргидрин.
Предлагаемые типы пестицидных композиций обладают требуемой высокой пестицидной активностью, в особенности в тех случаях, когда они используются вместе с совместно действующим веществом синергетиком, и эти композиции являются способными к биологическому распаду. Эти пестицидные композиции обладают значительной пестицидной активностью против таких вредных насекомых, как обычная домашняя муха, черный и рыжий тараканы, моль, тля, личинки комаров, клопы и т.д.
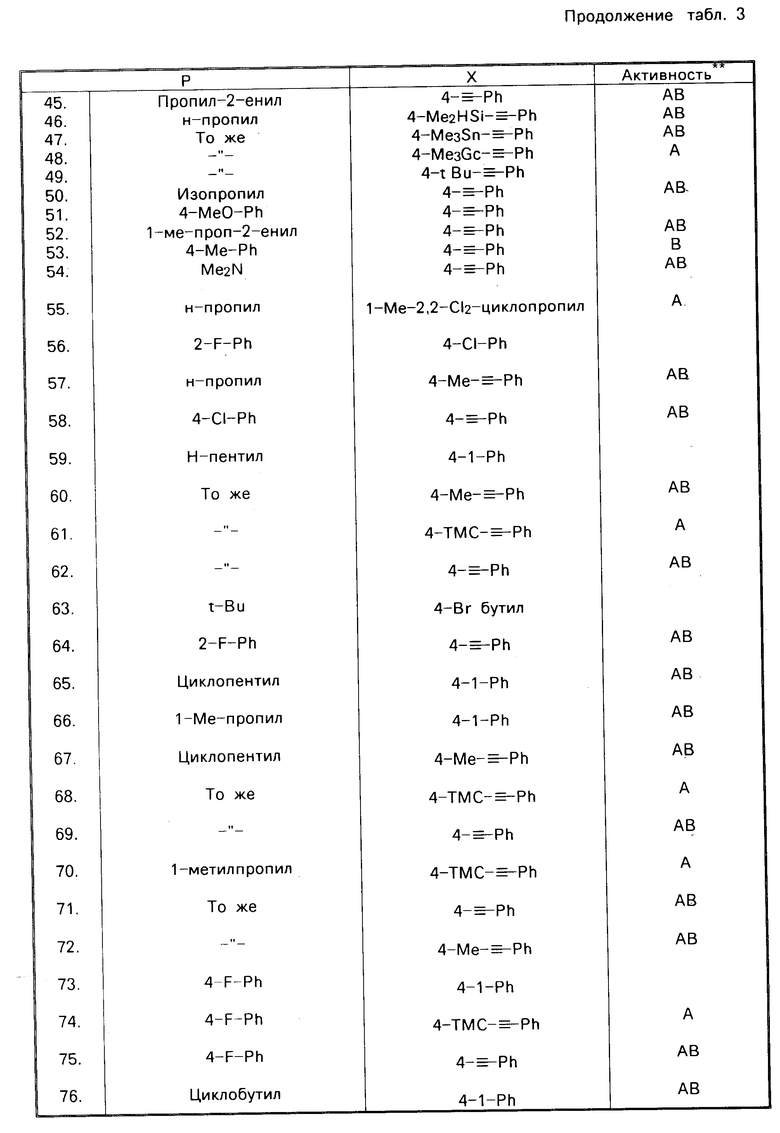
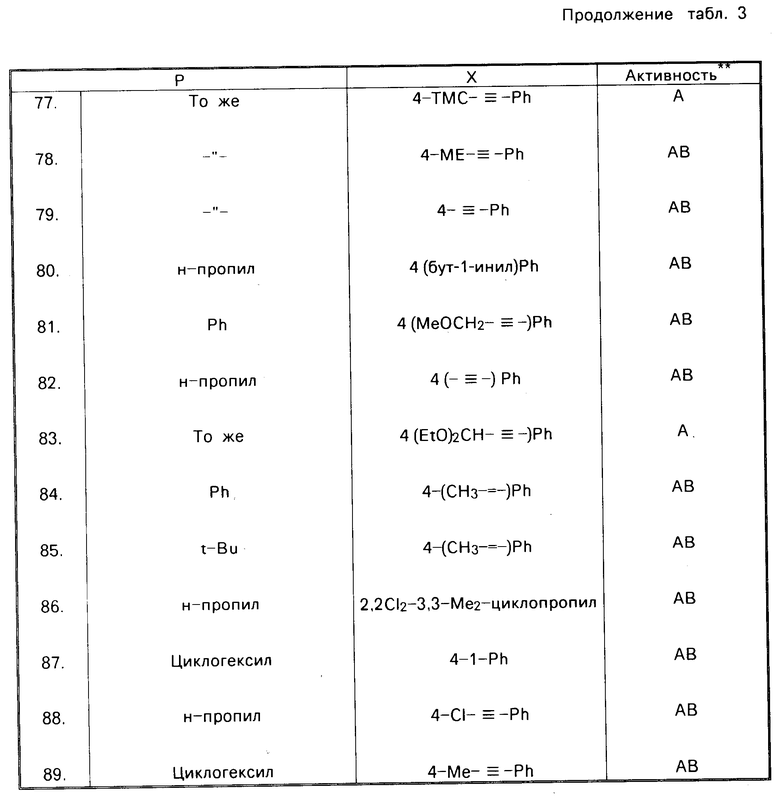
В соответствии с настоящим изобретением предлагается соединение, характеризуемое формулой R-C(CH2O)3C-X, в котором R и Х каждый представляют собой органические заместители, находящиеся, соответственно в 4-м положении и 1-м положении в указанном соединении. Было установлено, что этот класс соединений включает в себя ряд химикатов, которые обладают значительной пестицидной активностью. В табл. 1 и 2 указаны относительные эффективности, касающиеся уничтожения домашних мух и черных тараканов с помощью ряда соединений, отвечающих вышеуказанной формуле, при использовании этих соединений как в чистом виде, так и вместе с синергетиком-бутилатом пиперонила (РВ). В этих таблицах используются следующие сокращения: PL-фенил, n-нормальный, i-изо, S-вторичный, t-третичный и с-цикло, Pr-пропил; Bu-бутил, Pen-пентил; Hex-гексил; Hept-гептил.
Предлагаемые пестициды характеризуются пестицидной активностью, определяемой через 50%-ную летальную дозу LD, выраженную в микрограммах пестицида на грамм живого веса выбранного насекомого, причем эта величина составляет не более, чем примерно 400. Так, например, такая активность была выявлена по отношению к домашней мухе. Предлагаемые пестициды альтернативно или дополнительно обладают пестицидной активностью, выраженной через 50%-ную летальную дозу LD50 в микрограммах пестицида на грамм веса выбранного насекомого, не превышающей примерно 60 и более, предпочтительно не превышающей примерно 20. Такая активность была показана при использовании инсектицида против домашней мухи.
Применение синергистов вместе с пестицидами является хорошо известным фактом, детальное обсуждение этой проблемы приведено в [2]
Предлагаемые соединения становятся даже более эффективными вместе с синергистами, которые действуют таким образом, что ингибируют микросомальные Р-450 оксидазы цитохрома, которые производят детокисление пестицида, обеспечивая более длительный период действия пестицида и следовательно его более высокую токсичность.
Предлагаемые композиции могут быть использованы в сочетании с инертным носителем, который служит в качестве разбавителя или носителя для активных пестицидов. Так, например, токсичное вещество может быть растворено в углеводородах, полученных из нефти, тетрагидрофуране, ацетоне, моноалкиловом эфире этиленгликоля (целлозольве), а также других пригодных инертных носителях перед использованием. Альтернативно токсичное вещество может быть адсорбировано на твердом инертном носителе, таком как тальк, глина, мелкоразмельченная двуокись кремния и им подобных материалах.
Токсичность по отношению к домашним мухам зависит от природы как R-заместителя, так и Х-заместителя, что представлено в табл. 1, данные которой являются основным свидетельством эффективности предлагаемых соединений. Соединения 1,4-бис-замещенные-2,6,7-триоксабицикло(2.2.2)октаны были подвергнуты испытаниям как в чистом виде, так и вместе с бутилатом пиперонила (РВ).
Токсичность предлагаемых соединений по отношению к черным тараканам на примере топического применения 1,4-бис-замещенных-2,6,7-триоксабицикло(2.2.2)октанов была подвергнута испытанию, при этом вещество использовалось как в чистом виде, так и вместе с бутилатом пиперонила. Полученные результаты испытаний представлены в табл. 2.
Определение биологической активности.
Был получен и испытан ряд предлагаемых соединений. Испытания проводились на инсектицидную активность по отношению к Musca domestica как с синергистом, так и без него.
Из результатов этих испытаний следует, что каждое из нижеперечисленных соединений обладает более высокой инсектицидной активностью (более низким значением LD50), чем 1-(н-бутил)-4-(трет.бутил)-2,6,7-триоксабицикло-[2.2.2] октан (соединение 51 в табл. 1 с LD50 450 мкг/г) без синергиста и более высокой активностью с синергистом, чем 1-фенил-4-(трет.бутил)-2,6,7-триоксабицикло[2.2.2] октан (соединение 17 в табл. 1 с LD50 23 мкг/г, с синергистом). В испытанных соединениях 4-м заместителем был трет.бутил, а 1-м заместителем 3-хлор-4-метоксифенил, 4-иодфенил, 3-цианофенил, 4-циано-2-хлорфенил, 4-метоксифенил, 4-метилфенил (толил), 2-бицикло[2.2.1]гептил, циклооктил, 3-циано-4-метилфенил, 3-метокси-4-хлорфенил, 3-этилфенил, 4-триметилсилилэтинилфенил, 4-метокси-3-цианофенил и 4-винилфенил. Кроме того были испытаны и показали такую же высокую активность следующие соединения: 1-(3,4-дибромциклогексил)-4-(н-пропил)-2,6,7-триоксабицикло[2.2.2] октан, 1-(4-цианофенил)-4-аллил-2,6,7-триоксабицикло[2.2.2] октан, 1-(4-этилфенил)-4-фенил-2,6,7-триоксабицикло[2.2.2] октан, 1-(4-хлорфенил)-4-циклогептил-2,6,7-триоксабицикло[2.2.2] октан, 1-(4-цианофенил)-4-изобутил-2,6,7-триоксабицикло[2.2.2] октан, 1-(4-цианофенил)-4-(втор.бутил)-2,6,7-триоксабицикло[2.2.2]октан, 1-(4-цианофенил)-4-(1-метилпроп-2-енил)-2,6,7-триоксабицикло [2.2.2]октан и 1-(4-триметилсилилэтинилфенил)-4-(фенил)-2,6, 7-триоксабицикло [2.2.2]октан.
П р и м е р 1. 50%-ная летальная доза LD50 для домашней мухи.
Соединения, указанные в табл. 1, были подвергнуты испытаниям с целью определения их инсектицидной активности, и эти соединения растворяли в ацетоне или тетрагидрофуране в том случае, если они являлись нерастворимыми в ацетоне. Ряд последовательных растворов был получен с использованием одного и того же растворителя. Растворы соединения объемом 0,5 микролитра наносились топически на ventrum брюшной полости анестезированных взрослых самок домашних мух (Musca domestica); вид SCR спустя 3-5 дней после рождения, каждая муха имела вес 20 мг.
Исследования по определению токсичности проводились путем обработки (топической) домашних мух с использованием бутилата пиперонила в количестве 250 микрограмм на грамм, за 2 или 3 ч перед применением токсичного вещества. Обработанным мухам давали сахар и воду, и уровень смертности определялся спустя 24 ч при 25оС. Данные, представленные в табл. 1, указаны как летальные дозы, выраженные в микрограммах токсичного вещества на 1 г веса насекомого, необходимые для того, чтобы уничтожить 50% летающих насекомых, эти данные обозначены как 50%-ные летальные дозы LD50.
В табл. 1 представлены зависимости между структурой и активностью для соединений, подвергаемых испытаниям на мухах, а также на мухах, предварительно обработанных бутилатом пиперонила. Многие из этих соединений являются активными в том же самом диапазоне для данного вида испытаний, что и производимые в настоящее время промышленностью пестициды.
Значительная инсектицидная активность против обычных домашних мух была обнаружена при соответствующих комбинациях R-заместителя и Х-заместителя. Этими комбинациями являются следующие:
R представляет собой норм.пропил, изопропил, норм.бутил, вторичный бутил, третбутил, циклопентил, циклогексил или фенил, и Х представляет собой норм. бутил, норм. пентил, циклогексил, циклогептил, 4-цианофенил, 3,4-дихлорфенил, 3-хлорфенил, 4-хлорфенил, 4-бромфенил, 4-фторфенил, 4-нитрофенил, 4-азидофенил, пентафторфенил, 2-бицикло[2.2.1] гептил, фенил, 2-фторфенил, 4-трифторметилфенил, этинил или циклогекс-3-енил.
Другие Х или R заместители, которые могут обеспечить активность, представляют собой замещенные циклоалканы или циклоалкены, содержащие от 5 до 10 атомов углерода. R также может обеспечивать активность в тех случаях, когда представляет собой замещенную фенильную группу. Представляется предпочтительным, чтобы R не являлся фенилом в тех случаях, когда Х представляет собой фенил или 4-фторфенил.
Соединения, характеризуемые пестицидной активностью, включают в себя такие соединения, в которых R представляет собой нормальный или разветвленный пропил или бутил, либо фенил или циклоалкил, содержащие от 3 до 10 атомов углерода, а Х представляет собой циклоалкил или циклоалкенил, содержащие от 6 до 10 атомов углерода, либо замещенный фенил. Другой группой соединений, обладающих пестицидной активностью, являются соединения, в которых R представляет собой нормальный или разветвленный пропил или бутил, либо фенил или циклоалкил, содержащие 5 или 6 атомов углерода, а Х представляет собой циклогексил, циклогептил, циклогексенил, этинил или фенил, замещенный гало-, циано-, азидо-, нитро- или С1-2 алкилом, причем указанный С1-2 алкил является замещенным 1-3 атомами галогена. Еще одной группой активных соединений является группа соединений, в которых R представляет собой норм.пропил, нормальный или разветвленный бутил, циклопентил или циклогексил, а Х представляет собой циклогексил, циклогептил или фенил, замещенный в 3-м положении или 4-м положении одним или несколькими гало-, циано-, азидо-, или нитро-. Еще одной группой активных соединений являются те соединения, в которых R представляет собой фенил, а Х представляет собой фенил, замещенный в 3-м положении и/или 4-м положении с помощью хлора и/или брома.
Соединения, которые были получены и подвергнуты испытаниям, с целью определения их инсектицидной активности, и которые характеризуются очень высокой активностью (в общем случае их 50%-ная летальная доза LD50является меньшей или равной примерно 5,5 микрограмм/г живого веса, в тех случаях, когда используются вместе с бутилатом пиперонила) представляют собой такие соединения, в которых:
Х представляет собой 4-хлорфенил, а R представляет собой нормпропил, нормбутил, вторичный бутил, третбутил, циклопентил, циклогексил или фенил;
R представляет собой трет-бутил, а Х представляет собой циклогексил, циклопентил, 4-фторфенил, 4-бромфенил, 4-нитрофенил, 4-цианофенил или 3,4-дихлорфенил; и
R представляет собой циклогексил, а Х представляет собой циклогексил, циклогептил, 4-фторфенил, 4-бромфенил, 4-цианофенил или 3,4-дихлорфенил.
Обобщая вышеуказанное, можно сказать, что R и Х могут представлять собой практически любые органические заместители, которые обеспечивают требуемую инсектицидную активность. Так, инсектицидная активность была установлена в тех случаях, когда Х и R представляют собой норм.алкил, разветвленный алкил, циклоалкил, замещенный циклоалкил, фенил или замещенные фенильные заместители. В то время, как не все соединения с этими заместителями обладают активностью, тем не менее существуют многие пригодные сочетания. Далее простые тесты, проведенные на домашних мухах, или аналогичные тесты, проведенные с любыми другими насекомыми, позволяют быстро выявить те комбинации, которые являются пригодными для использования в целях уничтожения, какого-либо конкретного насекомого.
П р и м е р 2. Испытания с другими насекомыми.
Соединения, указанные в табл. 2, были подвергнуты испытаниям с целью определения их токсичности по отношению к взрослым самцам черных тараканов (Periplaneta Americana). Тест заключался в применении растворов, подвергаемых испытаниям, как было указано в примере 1, в область торакса с использованием одного микролитра раствора носителя на одно насекомое. В каждом случае тараканы также подвергались испытаниям после предварительной топической обработки с помощью бутилата пиперонила в количестве 250 микрограмм/г живого веса за 2 ч до ввода триоксабициклоактана. 50%-ные летальные дозы LD50 определялись спустя 24 ч при 25оС. Соединения, подвергаемые испытанию, были очень сильно подвержены воздействию синергиста бутилата пиперонила с достижением в результате эффективности, аналогичной той, которая была достигнута при испытаниях на домашних мухах, обработанных бутилатом пиперонила, за исключением двух соединений (13 и 38), которые примерно в 10 раз являются более токсичными для домашних мух, чем для тараканов. Другие испытания показали, что соединение 6 является также токсичным для личинок москитов, тли, живущей на черной фасоли, рыжих тараканов, а также клопов. Таким образом широкий диапазон эффективности нового класса пестицидов, указанных выше, был подтвержден.
П р и м е р 3. Опыты с другими синергистами.
Другие синергисты, которые, как известно, являются ингибиторами оксидативной детоксификации, могут быть использованы вместо бутилата пиперонила. Этот эффект был подтвержден при испытаниях на домашних мухах при использовании соединения, в котором R представляет собой третичный бутил, а Х представляет собой 4-хлорфенил. Синергетический эффект, достигаемый при использовании бутилата пиперонила в количестве 250 микрограмм/г, был также достигнут в тех случаях, когда этот синергетик заменяли другими:  -(2-метилпропил)
-(2-метилпропил)  -(2-пропинил) фенилфосфатом при концентрации, равной 125 микрограмм/г живого веса или синергетиком: 0,0-диэтил 0-фенил фосфоротиоатом при концентрации 50 микрограмм/г живого веса. В этих испытаниях синергист и инсектицид были использованы одновременно с тем, чтобы наиболее близко смоделировать ситуации, связанные с применением. Эти синергисты имеют относительно низкую стоимость и токсичность для млекопитающих. Многие соединения таким образом являются пригодными и дают экономический эффект, поскольку синергисты обеспечивают улучшение инсектицидной активности триоксабициклооктанов, применяемых для уничтожения насекомых.
-(2-пропинил) фенилфосфатом при концентрации, равной 125 микрограмм/г живого веса или синергетиком: 0,0-диэтил 0-фенил фосфоротиоатом при концентрации 50 микрограмм/г живого веса. В этих испытаниях синергист и инсектицид были использованы одновременно с тем, чтобы наиболее близко смоделировать ситуации, связанные с применением. Эти синергисты имеют относительно низкую стоимость и токсичность для млекопитающих. Многие соединения таким образом являются пригодными и дают экономический эффект, поскольку синергисты обеспечивают улучшение инсектицидной активности триоксабициклооктанов, применяемых для уничтожения насекомых.
П р и м е р 3в. В опытах, проведенных на домашних мухах с использованием того же соединения, что и в примере 3, но при содержании пиперонилбутоксида 1 г/г активного вещества, наблюдалась такая же активность, как и при меньшем количестве пиперонилбутоксида.
Даже при содержании пиперонилбутоксида 25 г/г активного вещества получаемый препарат обладает такой же активностью.
П р и м е р 4. Опыты по определению токсичности для млекопитающих.
Уровень токсичности для млекопитающих двух соединений, являющихся предметом настоящего изобретения, был определен следующим образом. Эти два соединения индивидуально растворяли в оливковом масле, полученный таким образом раствор вводили внутрибрюшинно мышам для определения смертности через 24 ч. Эти соединения представляли собой следующее: R являлся трет-бутилом, а Х циклогексилом (соединение 60); R представлял собой изопропил, а Х представлял собой циклогексил (соединение 59). Значения 50%-ный летальной дозы LD50 при инъекциях для трет-бутильного соединения и изопропильного соединения составляют соответственно более 200 и более 500 миллиграмм/кг живого веса.
Таким образом предлагаемые соединения характеризуются низкой токсичностью по отношению к млекопитающим, при этом 50%-ная летальная доза LD50 составляет более 200 миллиграмм/кг живого веса. Токсичность по отношению к млекопитающим может изменяться в значительной степени в зависимости от типа носителя, способа введения в организм и вида млекопитающего.
Предлагаемые соединения обладают значительной активностью при их использовании в качестве пестицидов, против большого класса различных видов насекомых. Эти соединения легко подвергаются биологическому распаду.
Одно из преимуществ предлагаемых инсектицидов заключается в том, что их пестицидная активность значительно выше их токсичности по отношению к млекопитающим. Поэтому те небольшие количества этих пестицидов, которые используются при борьбе с паразитами, не будут оказывать вредного действия на млекопитающих. Совершенно очевидно, что это благоприятно сказывается на окружающей среде. Кроме того заявляемые пестициды разлагаются биологически. Заявителем предложен новый широкий класс пестицидов, которые по своему химическому строению существенно отличаются от известных пестицидов. Поэтому они отличаются от неаналогичных известных пестицидов и превосходят их.
П р и м е р 5. Конкурантное или предварительное применение синергиста.
Синергист в равной мере или более эффективен при применении с инсектицидом, в данном примере с соединением 6, в том случае, когда его применяют на два часа раньше.
А. Соединение N 6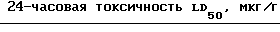
Синергист  а
а и-
и-  ное
ное
РВ 5 мкг/муха 1,25 1,0
NIA 16824 2,5 мкг/муху 1,0 0,35
R33865 1 мкг/муху 0,6 0,6
Эти данные демонстрируют практически равную эффективность совместного применения и предварительной обработки синергистом. 111А 16824 ( -(2-метилпропил)
-(2-метилпропил)  -(2-пропинил) фенилфосфонат описан в описании в примере 3; R 33865
-(2-пропинил) фенилфосфонат описан в описании в примере 3; R 33865  -
- -диэтил
-диэтил  -фенил фосфорнат описан также. Все эти соединения, как и бутилат пиперонила, (РВ), являются известными синергистами инсектицидов.
-фенил фосфорнат описан также. Все эти соединения, как и бутилат пиперонила, (РВ), являются известными синергистами инсектицидов.
П р и м е р 6. Соотношение между синергистом и инсектицидом.
Соотношение синергист инсектицид лежит в интервале от 1 части синергиста к 20 частям инсектицида, до 200 частей синергиста к 1 части инсектицида. См. пример В для соединения 6 и пример С для соединения 6, и пример С для соединения 24.
В. Соединение 6 + РВ/ мкг/г уничтожения
5 мкг/г + 0 10
5 мкг/г + 0,5 мкг/г 20
Отношение синергист инсектицид 110 1,25 мкг/г 0 0
1,25 мкг/г 250 мкг/г 50
Отношение синергист инсектицид 2001
С. Соединение 24 + синергист РВ уничтожения
250 мкг/г 0 30
250 мкг/г 12,5 мкг/г 40
Отношение синергист инсектицид 1 20
1,9 мкг/г 0 0
1,9 мкг/г 250 мкг/г 50
Отношение синергист инсектицид 1321
П р и м е р 7. Использование инсектицидных соединений при уничтожении насекомых растений.
Лист растения диаметром примерно 3 дюйма, опрыскивали 3 мл 1%-ного раствора соединения N 6 в ацетоне. Взрослых особей и нимф насекомых, паразитирующих на ваточнике гигантском, Oneofelus facialus, питающихся этим растением, помещали на обработанный лист. Все насекомые погибали за 12 ч. В контрольном эксперименте ни одно из насекомых, помещенных на лист того же размера, опрысканный только ацетоном, не погибало за 12 ч.
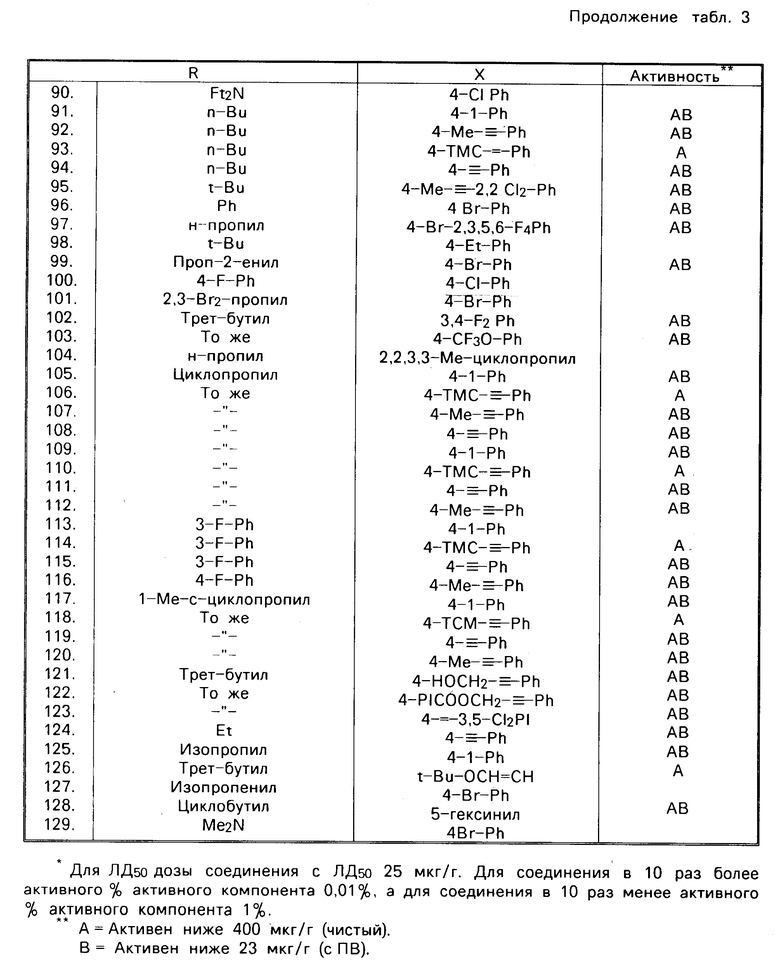
В прилагаемой далее таблице даются дополнительные данные, показывающие эффективность соединений и способов их применения. Испытуемые соединения растворяют в ацетоне и в виде раствора наносят местно на зрелые особи домашней мухи по методике, приведенной ранее в описании. При использовании синергиста его наносят местно в количестве 250 микрограмм/пиперонилбутоксида на грамм мухи за два-три часа перед нанесением испытуемого соединения. Соединения охарактеризованы приведением для каждого из них его строения. Эти соединения активны при дозе ниже 23 мкг/г с пиперонилбутоксидом в синергических композициях, показано, что их активность ниже 40 мкг/г при использовании испытуемых соединений в чистом виде.
Активное вещество и синергист могут быть нанесены совместно с тем же впечатляющим результатом, но ранее представленные данные не указывают на одновременное нанесение токсичного вещества и синергиста. Заявителями использована методика предварительной обработки.
П р и м е р 8. Активность представительных пестицидов выше по сравнению с известными пестицидами.
В табл. 3 приведены значения токсичности (местно) для домашней мухи при 25оС.
Представленные данные указывают на то, что соединения, характеризуемые формулой R-C(CH2O)3C-X, являются эффективными пестицидами.R или Х могут представлять собой алкил, алкинил, циклоалкил или циклоалкенил, каждый из которых может быть нормальным, разветвленным или замещенным, или они могут представлять собой арил или замещенный арил. В тех случаях, когда R представляет собой нормальный или разветвленный алкил, циклоалкил или арил, то полученные соединения дают полезный эффект. Представляется предпочтительным, чтобы количество атомов углерода в R было в диапазоне от 3 до 10. Представляется более предпочтительным, чтобы R являлся н-пропилом, трет-бутилом, циклогексилом, циклопентилом, изо-пропилом, н-бутилом, вторичным бутилом или фенилом. Х предпочтительно должен представлять собой циклоалкил или замещенный циклоалкил, или циклоалкенил, содержащий от 6 до 10 атомов углерода, нормальный алкил, алкинил или замещенный фенил. Эффективными пестицидами являются те пестициды, в которых Х-заместителями являются циклогексенил и циклогептенил. К другим пригодным заместителям относятся норм-пептил, циклогекс-3-енил и 2-бицикло[2.2.1] гептил. Заместителями на фенильной группе в тех случаях, когда фенильная группа представляет собой группу Х, являются галогены, циано-, нитро- или азидогруппы.
Процедуры синтеза. Методы получения соединений, характеризуемых указанной выше общей формулой, представлены в следующих публикациях:
Зависимости между структурой и токсичностью 1-замещенных-4-алкил-2,6,7-триоксабицикло[2.2.2] октанов. Д.С.Милбрат, Дэ.Л.Энгел, Дж.Г.Веркаде и Дж. Е. Касида. Токсикология и прикладная фармакология, 47, 287-293 (1979); (Structere Toxicity Relation ships of 1-Substituted-4 alkyl-2,6,7-trioxabicyclo(2.2.2)octanes, D. S. Milbrath; I.L.Engel; I.G.Verkade; I.E.Casida Toxicology and Applied Pharmacology;  , 287-293 (1979);
, 287-293 (1979);
Зависимости между структурой и токсичностью 2,6,7-триоксабицикло(2.2.2)октанов и аналогичных соединений. Дж.Е.Касида, М.Это, А.Д.Мосциони, Дж.Л.Энгел, Д.С.Милбрат и Дж.Г.Веркаде. Токсикология и прикладная фармакология, 36, 261-279 (1976) (Structure Toxicity Relation ships of 2,6,7-Trioxabicyclo(2.2.2), octanes and Related Compoudns, I.E.Casida; M.Eto; A.D.Moscioni; I.L.Engel; D.S.Milbrath; I.G.Verkade; Toxicology and Applied pharmacology;  , 261-279 (1976);
, 261-279 (1976);
Ядерно-магнитный резонанс в полициклических соединениях. II. Связь дальнего действия Н1 H1 и H1 P31 в некоторых производных адамантана и бицикло(2.2.2)октана. Е.Дж.Борос, К.Дж.Коскран, Р.В.Кинг и Дж.Г.Беркаде, IACS 88, 1140-1143 (1966) (Nuclear-Magnetic Resonance in Polycyc lie Compaunds II Song-Range H1-H1 и H1-P31 Coupling in Sona Ackamantane and Biciclo (2.2.2) octane Derivativer, E.I.Boros; K.I.Coskran, R.W.King; I.G.Werkade; IACS,  , 1140-1143 (1966);
, 1140-1143 (1966);
Необычное поведение гексафторбензола и бензола в эффекте смещения ароматического ядерно-магнитного резонанса. Р.Д.Бертранд, Р.Д.Комптон и Дж.Г.Веркаде, IACS, 92, 2702-2709 (1970) (Unusual Behavior of Hexafluorobenzene and Benzene in the Aromatic Nuclean Magnetic Resonance Shift Effect. R.D.Bertrand, R.D.Compton, I.G.Verkade; IACS,  , 2702-2709 (1970);
, 2702-2709 (1970);
Новый общий синтетический способ к сложным ортоэфирам карбоновой кислоты с мостиковой связью. Е.Дж.Кокей и Н.Раджу. Tetrahedron Letters,  , 5571-5574 (1983) (A. New General Synthetic Route to Bridged Carboxylic Ortho Esters E.I.Cokey; N.Raju; Tetrahedron Letters, 24, 5571-5574 (1983).
, 5571-5574 (1983) (A. New General Synthetic Route to Bridged Carboxylic Ortho Esters E.I.Cokey; N.Raju; Tetrahedron Letters, 24, 5571-5574 (1983).
Промежуточные продукты для этих реакций описаны: Ацетали кетена. XXXIV. Тетра- и пентаметилена кетена ацетали. С.М.Макэлвин и Р.Е.Старн, IACS 77, 4571-4577 (1955), (Ketene Acetals, XXXIV, tetra and Pentamethylene Ketene Acetals, S.M. Mc Elvain; R.E.Starn, IACS,  , 4571-4577 (1955).
, 4571-4577 (1955).
Получение триметилолизобутана путем конденсации изовалерьянового альдегида и формальдегида. М.М.Кетшлах, Д.М.Рутковский и Р.А.Эппель. Оксосинтез, получение методом оксосинтеза альдегидов спиртов и вторичных продуктов на их основе. Всесоюзный научно-исследовательский институт нефтехимических процессов, 156-163 (1963);
Развитие конденсации толенов. О.С.Дермер и П.В.Соломон. IACS 76, 1697-1699 (1954) (Extension of Tollens Condensation; O.C.Dermer; P.W.Solomon. IACS, 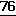 , 1697-1699 (1954);
, 1697-1699 (1954);
Простые циклические эфиры, полученные путем пиролиза сложных карбонатных эфиров. Д. Б. Паттисон, IACS 79, 3455-3456 (1957) (Cyclic Ethers Made by Pyzolysis of Carbonate Ethers, D.B.Pattison; IACS;  , 3455-3456 (1957);
, 3455-3456 (1957);
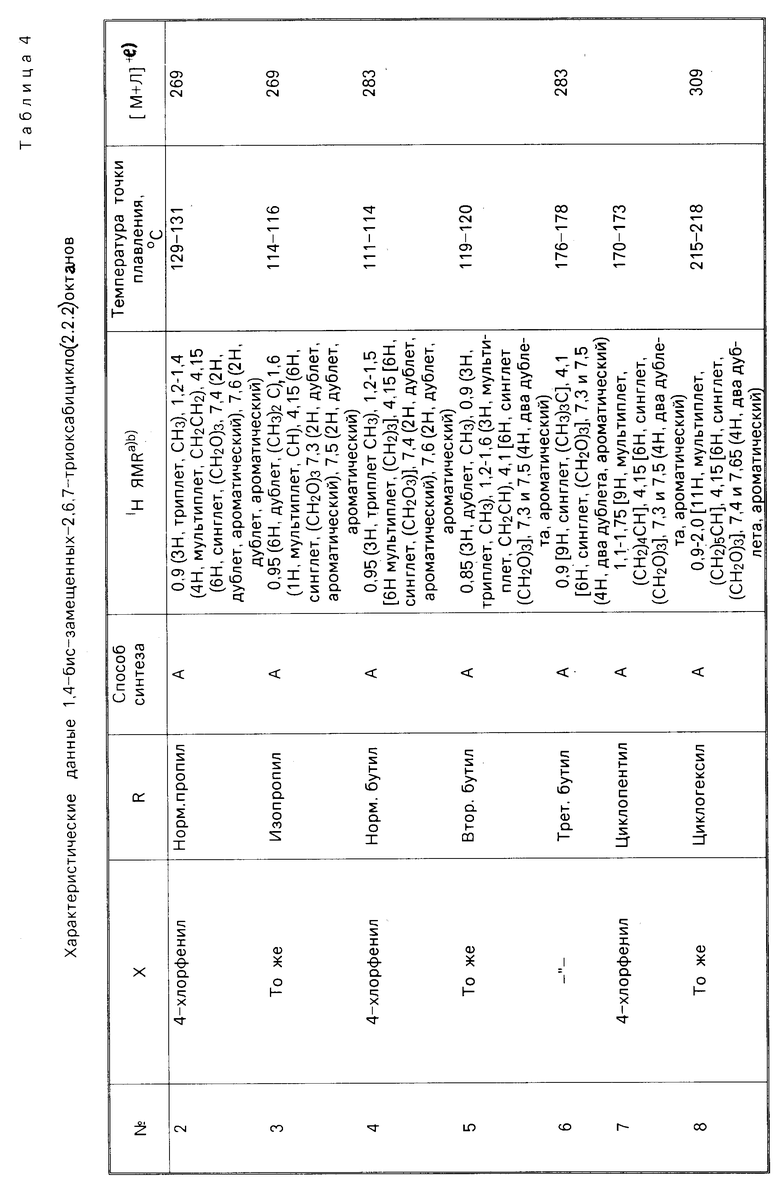
Два характерных метода (А и В) были использованы для получения триоксабицикло октанов (табл. 4). В каждой из процедур в качестве исходного материала использовали триол, синтезированный из соответствующего замещенного ацетальдегида путем реакции оксиметилирования и последующей перекрестной реакции Канницаро (реакция образования спиртов и кислот при окислении восстановлении ароматических альдегидов, пер.). (Реакция описана Дермeром и Соломоном, в 1954 г. и Кетшлафом и др. в 1963 г.). Реакция проводилась по следующей схеме:
RCH2CHO 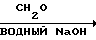 RC(CH2OH)3
RC(CH2OH)3
Каждый триоксабициклооктан давал соответствующие характеристики протонного ядерного магнитного резонанса и соответствующие характеристики масс-спектра. Сокращения, используемые при описании данных спектра ядерно-магнитного резонанса соответствуют: S синглет, d дублет, 2 х d два дублета, dd дублет дублетов, t триплет, 2 х t два триплета, g квартет и m мультиплет.
Способ А. Конденсация триола с ортокарбоксилатом, катализируемая кислотой. (Boros et. al. 1966; Bertrand et. al. 1970). Уравнение реакции имеет следующий вид:
R 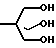
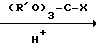 R
R 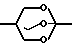 X где RI может быть алкилом или арилом, предпочтительно метилом или этилом. Например, смесь 2-т-бутил-2-гидроксиметил-1,3-пропандиола (R t-Bu) (0,4 г, 2,5 ммоль), триметил ортоциклогексанкарбоксилата (Хос-Нeх; RI СН3) (0,5 г, 2,5 ммоль) и 4-толуолсульфокислоты (10 мг) нагревают до 160оС до тех пор, пока не отгонится метанол. Остаток сушат в вакууме (при 1 мм Hg) и затем пропускают через короткую колонку, наполненную оксидом алюминия, получая триоксабициклооктан 60 (Хос-Нeх; Rt-Bu) (0,6 г, 95%). Аналогичные методики используют для получения соединений 2-9, 13, 14, 17-19, 21, 23-27, 38, 39, 51, 59, 60 и 65.
X где RI может быть алкилом или арилом, предпочтительно метилом или этилом. Например, смесь 2-т-бутил-2-гидроксиметил-1,3-пропандиола (R t-Bu) (0,4 г, 2,5 ммоль), триметил ортоциклогексанкарбоксилата (Хос-Нeх; RI СН3) (0,5 г, 2,5 ммоль) и 4-толуолсульфокислоты (10 мг) нагревают до 160оС до тех пор, пока не отгонится метанол. Остаток сушат в вакууме (при 1 мм Hg) и затем пропускают через короткую колонку, наполненную оксидом алюминия, получая триоксабициклооктан 60 (Хос-Нeх; Rt-Bu) (0,6 г, 95%). Аналогичные методики используют для получения соединений 2-9, 13, 14, 17-19, 21, 23-27, 38, 39, 51, 59, 60 и 65.
Промежуточные триметил ортокарбоксилаты коммерчески доступны или их синтезируют по любому из двух способов, иллюстрируемых сложными метиловыми эфирами. Согласно первому способу, соответствующий бензотрихлорид или бензотрибромид (от бромирования соответствующего толуола N-бромсукцинимидом (NBS)) подвергают замещению галоида метоксидом (McElvain and Venerable, 1950). Эти способы следующие: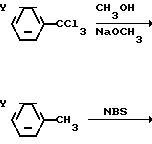
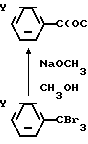 H3)3 где Y представляет собой водород или одну или более других групп, таких как галоид или трифторметил.
H3)3 где Y представляет собой водород или одну или более других групп, таких как галоид или трифторметил.
Согласно второму способу, соответствующий нитрил обрабатывают метанолом и соляной кислотой, получая гидрохлорид иминоэфира, и, в конечном счете, триметил ортокарбоксилат (McElvain and Starn, 1955). Этот способ выглядит следующим образом:
XCN 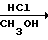 XC
XC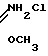
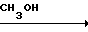 XC(OCH3)3
XC(OCH3)3
Способ В. Перегруппировка ацилированного гидроксиметоксетана (Corey and Raju, 1983). Ацилирование 3-замещенных-3-гидроксиметоксетанов (полученных из соответствующего триола путем пиролиза карбонатного сложного эфира) (Pattison, 1957) дает соответствующие оксетановые сложные эфиры, которые могут перегруппировываться в присутствии эфирата трехфтористого бора с образованием триоксабициклооктанов. Уравнение реакции имеет вид:
R 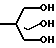
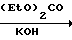 R
R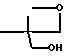
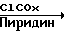

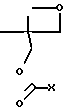
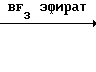

Например, 4-нитробензоил хлорид (2,28 г, 12,3 ммоль) в сухом дихлорметане (4 мл) добавляют к 3-изопропил-3-гидроксиметилоксетану (1,6 г, 12,3 ммоль) в сухом дихлорметане (15 мл) и сухом пиридине (2 мл) при 0оС в атмосфере азота. Раствор перемешивают в течение ночи, затем экстрагируют водой, сушат (сульфат натрия), фильтруют и выпаривают, получая 4-нитробензоиловый эфир (3,4 г, 99%) в виде остатка, который в дальнейшем не очищают. 1Н ЯМР (СDCl3), δ 1,0 (6Н, д, (СН3)2С), 2,3 (1Н, m, С-СН), 4,55 (2Н, с, СН2ОСО), 4,6 (4Н, dd, СН2ОСН2), 8,3 (4Н, q, ароматический).
Этот остаток растворяют в сухом дихлорметане (15 мл) в атмосфере азота, охлаждают до (-)55оС и добавляют 2 мл эфирата трифторида бора. Смеси позволяют нагреться до комнатной температуры и гасят триэтиламином, выпаривают досуха и распределяют между водой и дихлорметаном. Органический слой отделяют, сушат (карбонат калия) и выпаривают.
Остаток очищают, пропуская через короткую колонку с основной окисью алюминия,
с получением триоксабициклооктана 28
(Х 4 NO3Ph; R1 Pr) (1,7 г, 50%)
Аналогично получают соединения 28-32, 43, 53, 61, 62, 71, 72 и 74.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 1,4-бис-замещенных 2,6,7-триоксабицикло (2,2,2)октанов | 1985 |
|
SU1792417A3 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОБИЦИКЛОАЛКАНОВ | 1991 |
|
RU2034847C1 |
| СПОСОБ БОРЬБЫ С ВРЕДИТЕЛЯМИ | 1990 |
|
RU2036582C1 |
| ПРОИЗВОДНЫЕ БЕНЗОФУРАЗАНА ИЛИ БЕНЗО-2,1,3-ТИАДИАЗОЛА И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2189984C2 |
| ЭЛЕМЕНТ ДЛЯ ИЗГОТОВЛЕНИЯ ВТОРИЧНЫХ БАТАРЕЙ | 1992 |
|
RU2099821C1 |
| СОЕДИНЕНИЯ БЕНЗОКСАЗИНА ДЛЯ УСИЛЕНИЯ СИНАПТИЧЕСКОЙ РЕАКЦИИ | 1998 |
|
RU2246497C2 |
| ПРИМЕНЕНИЕ АНАЛОГОВ АЦИЛФУЛЬВЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2145849C1 |
| СПОСОБЫ ЛЕЧЕНИЯ МИТОХОНДРИАЛЬНЫХ НАРУШЕНИЙ | 2000 |
|
RU2394580C2 |
| Способ борьбы с насекомыми | 1976 |
|
SU655281A3 |
| СПОСОБЫ ЛЕЧЕНИЯ МИТОХОНДРИАЛЬНЫХ НАРУШЕНИЙ | 2000 |
|
RU2268732C2 |


Использование: в качестве пестицидов для уничтожения насекомых. Продукт: производные 1,4-бис-замещенных 2, 6, 7-триоксабицикла /2.2.2/ октанов, ф-лы 1 R-C(CH2O)3C-X (1), где R и X имеют соответствующие значения LD50 менее чем примерно 400 мг/кг мули Musca domtica. И LD50 в присутствии синергетика, менее чем примерно 60 мг/кг. Пестицидная активность была обнаружена против широкого класса различных насекомых. Пестицидная активность композиции сильно возрастает при использовании определенных типов синергиста. 4 з. п. ф-лы, 4 табл.
R C(CH2O)3 C X,
где R пропил, бутил, C3 C10-циклоалкил или фенил;
X C6 C10-циклоалкил, C6 - C10-циклоалкенил, C2 C6-алкинил или фенил, замещенный одним или более заместителями, выбранными из галогена, циано-, азидо- или нитрогруппы или C1 C2-алкила, возможно замещенного 1-3 атомами галогена, при условии, что, когда X 4-фторфенил, R не должен являться фенилом.
Приоритет по признакам:
30.01.84 при R C6 C10-циклоалкил, пропил или бутил, X имеет значения, указанные в п.1 формулы изобретения;
23.01.85 при R C6 C10-циклоалкил, пропил, бутил или фенил, X имеет значения, указанные в п.1 формулы изобретения.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Патент США N 4078077, кл | |||
| Способ приготовления хлебного вина | 1925 |
|
SU424A1 |
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
Авторы
Даты
1995-12-27—Публикация
1992-03-20—Подача