Изобретение относится к новым конденсированным гетероциклическим соединениям или их солям. Соединения по этому изобретению являются полезными в качестве лекарственного средства и ингибитора холинэстеразы и, в частности, как лечебное и/или профилактическое средство против старческого слабоумия, болезни Альцгеймера и подобных заболеваний.
В наше время старения общества предлагаются различные средства, которые оказывают лечебное и профилактическое действие в случае старческого слабоумия. Было установлено, что физостигмин, ингибитор холинэстеразы естественного происхождения, обладает лечебным и/или профилактическим действием в отношении старческого слабоумия. Однако, для физостигмина характерны такие недостатки, как короткая продолжительность действия, высокая токсичность и другие недостатки.
Тем временем были созданы искусственные лекарственные средства, представляющие разнообразные гетероциклические соединения, которые могут применяться в качестве ингибиторов холинэстеразы, депрессантов и подобных препаратов /например, патенты США NN 4064255, 4208417, 4849431, 4895841, опубликованная нерассмотренная заявка на патент Японии N 169569/1990 и заявка на европейский патент N 378207/.
Однако, в настоящее время требуется более активное соединение с большей продолжительностью действия, но менее токсичное по сравнению с уже известными соединениями, которые обладают лечебным и/или профилактическим действием в отношении старческого слабоумия.
Настоящим изобретением предусматривается новый класс соединений, которые являются полезными в качестве ингибиторов холинэстеразы и, в частности, как лечебные и/или профилактические средства против старческого слабоумия, болезни Альцгеймера и подобных заболеваний.
Авторы настоящего изобретения исследовали соединения, которые могли бы быть полезны в качестве лекарственного средства для улучшения функций центральной нервной системы и особенно соединений, позволяющих лечить старческое слабоумие, болезнь Альцгеймера и подобные заболевания, возникающие вследствие ишемии мозга, и сумели получить конденсированное соединение формулы /I/:
в которой X представляет атом кислорода, атом серы или R1 N<, где R1 представляет атом водорода, углеводородную группу, которая может быть замещена, или ацильную группу, которая может быть замещена, R2 представляет атом водорода или углеводородную группу, которая может быть замещена, кольцо А является бензольным кольцом, которое может быть замещено, K является целым числом от 0 до 3, m является целым числом от 1 до 8, и n является целым числом от 1 до 6, или его соль.
Соединение /1/ или его соль по настоящему изобретению в структурном отношении характеризуются тем, что гетероцикл, содержащий гетероатом / O, S или N/ и конденсированный в бензольное кольцо, представляет насыщенное кольцо и что замещающая группа формулы: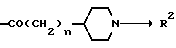
связана непосредственно с атомом углерода в бензольном кольце. Мы считаем, что это соединение является совершенно новым соединением, которое ранее не описывалось в литературе.
Следует указать, что в приведенной выше формуле /1/ "углеводородная группа" из "углеводородной группы, которая может быть замещена", обозначенная символами R1 и R2, включает ациклические, циклические, насыщенные и ненасыщенные группы или такие углеводородные группы в произвольном сочетании.
Ациклическая насыщенная углеводородная группа включает C1-11 алкильные группы с прямой или разветвленной цепью /например, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, н-гексил/.
Ациклическая ненасыщенная углеводородная группа включает C2-4 алкенильные группы /например, винил, аллил, 2-бутенил/ и C2-4 алкильные группы/ например, пропаргил, 2-бутинил/.
Циклическая насыщенная углеводородная группа включает C3-7 моноциклические циклоалкильные группы /например, циклобутил, циклопентил, циклогексил/ и C8-14 мостиковые циклические насыщенные углеводородные группы /например, бицикло [3. 2. 1]окта-2-ил, бицикло [3. 3. 1]иона-2-ил, адапантан-1-ил/.
Циклическая ненасыщенная углеводородная группа включает фенил, нафтил и подобные группы.
"Углеводородная группа" из "углеродной группы, которая может быть замещена", обозначенная символами R1 и R2, может представлять произвольно сочетаемую углеводородную группу из вышеуказанных ациклических, циклических, насыщенных и ненасыщенных углеводородных групп, включающих C7-18 аралкил /такой же как фенил C1-12 алкил и нафтил C1-8 алкил, например, фенилметил, фенилэтил, фенилпропил, фенилбутил, фенилпентил, фенилгексил, a-нафтилметил/, C8-18 арилалкенил /такой как арил C34-12 алкенил, например, стирил, циннамил, 4-фенил-2-бутенил, 4-фенил-3-бутенил/, C8-18 арилалкинил /такой как арил C12-12 алкинил, например, фенилэтинил, 3-фенил-2-пропинил, 3-фенил-пропинил/, C3-7 циклоалкил C1-6 /например, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил, циклогептилэтил, циклопропилбутил, циклобутилбутил, циклопентилбутил, циклогексилбутил, циклогептилбутил, циклопропилпентил, циклобутилпентил, циклопентилпентил, циклогексилпентил, циклогептилпентил, циклопропилгексил, циклобутилгексил, циклопентилгексил, циклогексилгексаил, циклогептилгексил/ и т.д.
Предпочтительные примеры "углеводородной группы" из "углеводородной группы, которая может быть замещена", обозначенной символом R1, включают C1-7 алкильную группу с прямой или разветвленной цепью /например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, третбутил, н-пептил, н-гексил /или C7-10 аралкильную группу/ например, фенилметил, фенилэтил, фенилпропил/, а предпочтительные примеры "углеводородной группы" из "углеводородной группы, которая может быть замещена", обозначенной символом R2, включают C7-10 аралкил /например, фенилметил, фенилэтил, фенилпропил).
Ациклические насыщенные, ациклические ненасыщенные и циклические насыщенные углеводородные группы, указанные выше для символов R1 и R2 могут быть замещены 1 5 заместителями, выбираемыми из группы, включающей галоген /например, фтор, хлор, бром, иод/, нитро, циано, гидрокси, C1-4 алкокси /например, метокси, этокси, пропилокси, бутилокси, изопропилокси/, C1-4 алкилтио /например, метилтио, этилтио, пропилтио/, амино, моно- или ди- C1-4 алкилзамещенную аминогруппу /например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино/, циклическую аминогруппу /например, пирролидино, пиперидино, морфолино/, C1-4 алкилкарбониламино /например, ацетиламино, пропиониламино, бутириламино/, C1-4 алкилсульфониламино/ например, метилсульфониламино, этилсульфониламино/, C1-4 алкоксикарбонил /например, метоксикарбонил, этоксикарбонил, пропоксикарбонил/, гидроксикарбонил, C1-6 алкилкарбонил /например, метилкарбонил, этилкарбонил, пропилкарбонил/ карбамоил моно- или ди- C1-4 алкилзамещенный карбамоил /например, метилкарбамоил, этилкарбомоил/, C1-6 алкилсульфонил /например, метилсульфонил, этилсульфонил, пропилсульфонил/, и т.д.
Заместители в "бензольном кольце, которое может быть замещено", обозначенном как кольцо А в формуле /I/, и заместители в циклической ненасыщенной углеводородной группе, обозначенной символами R1 и R2, включают C1-4 алкил /например, метил, этил, пропил, бутил/, галоген /например, фтор, хлор, бром, иод/, нитро, циано, гидрокси, C1-4 алкокси /например, метокси, этокси, пропилокси, бутилокси, изопропилокси/, C1-4 алкилтио /например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио/, амино, моно- или ди- C1-4 алкилзамещенную аминогруппу /например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино/, циклическую аминогруппу /например, пирролидино, пиперидино, морфолино/, C1-4 алкилкарбониламино /например, ацетиламино, пропиониламино, бутириламино/, аминокарбонилокси, моно- или ди-C1-4 алкилзамещенную аминокарбонилоксигруппу /например, метил-аминокарбонилокси, этиламинокарбонилокси, диметиламинокарбонилокси, диэтиламинокарбонилокси/, C1-4 алкилсульфониламино /например, метил-сульфониламино, этил-сульфониламино, пропилсульфониламино/, C1-4 алкоксикарбонил /например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изобутоксикарбонил/, гидроксикарбонил C1-6 алкилкарбонил /например, метилкарбонил, этилкарбонил, бутилкарбонил/, C3-6 циклоалкилкарбонил /например, циклогексилкарбонил/, карбамоил, моно- или ди-C1-4 алкилзамещенный карбамоил /например, метилкарбамоил, этилкарбамоил, этилкарбамоил, пропилкарбамоил, бутилкарбамоил, диэтилкарбамоил, дибутилкарбамоил /и C1-6 алкилсульфонил /например, метилсульфонил, этилсульфонил, пропилсульфонил/ и C3-6 циклоалкилсульфонил /например, циклопентилсульфонил, циклогексилсульфонил/, а также фенил, нафтил, фенокси, бензоил, феноксикарбонил, фенил- C1-4 алкилкарбамоил /например, фенилметилкарбамоил, фенилэтилкарбамоил, фенилпропилкарбамоил/, фенилкарбамоил, фенил-C1-4 алкилкарбониламино /например, фенилметилкарбониламино, фенилэтилкарбониламино/, бензоил-амино, фенил-C1-4 алкилсульфонил /например, фенилметилсульфонил, фенилэтилсульфонил/, фенилсульфонил, фенил-C1-4 алкилсульфинил /например, фенилметилсульфинил, фенилэтилсульфинил/, фенил C1-4 алкилсульфониламино /например, фенилметилсульфониламино, фенилэтилсульфониламино/ или фенилсульфониламиногруппу, которая может иметь от 1 до 4 заместителей, выбираемых, например, из группы, включающей C1-4 алкильные группы, такие как метил, этил, пропил, бутил, изопропил и т.д. C1-4 алкоксильные группы, такие как метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси и т.д. галоген, такой как хлор, бром и иод, гидрокси, бензилокси, амино, моно- или ди-C1-4 алкилзамещенную аминогруппу, аналогичную указанным выше, нитрогруппу и C1-6 алкилкарбонил, аналогичный указанному выше, и подобные группы. Приемлемое число таких заместителей в бензольном кольце или в циклической ненасыщенной углеводородной группе составляет от 1 до 3.
Произвольно сочетаемая углеводородная группа, обозначенная символами R1 и R2, может быть замещена 1-5 заместителями, выбираемыми из группы, включающей C1-4 алкил /например, метил, этил, пропил, бутил/, галоген /например, фтор, хлор, бром, иод/, нитро, циано, гидрокси, C1-4 алкокси /например, метокси, этокси, пропилокси, бутилокси, изопропилокси/, C1-4 алкилтио /например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио/, амино, моно- или ди- C1-4 алкил замещенную аминогруппу /например, метиламино, этиламино, пропиламино, диметиламино/, циклическую аминогруппу /например, пирролидино, пиперидино, морфолино/, C1-4 алкилкарбониламино /например, ацетиламино, пропиониламино, бутириламино/, аминокарбонилокси, моно- или дис-C1-4 алкилзамещенную аминокарбонилоксигруппу /например, метиламинокарбонилокси, этиламинокарбонилокси, диметиламинокарбонилокси, диэтиламинокарбонилокси/, C1-4 алкилсульфониламино /например, метилсульфониламино, этилсульфониламино, пропилмульфониламино/, C1-4 алкоксикарбонил/ например, метоксикарбонил, этоксикарбонил, пропокси карбонил, изобутоксикарбонил/, гидроксикарбонил, C1-6 алкилкарбонил /например, метилкарбонил, этилкарбонил, бутилкарбонил/, C3-6 циклоалкилкарбонил /например, циклогексилкарбонил/, карбамоил, моно- или ди- C1-4 алкилзамещенный карбамоил /например, метилкарбамоил, этилкарбамоил, пропилкарбамоил, бутилкарбамоил, диэтилкарбамоил, дибутилкарбамоил/, C1-6 алкилсульфонил /например, метилсульфонил, этилсульфонил, пропилсульфонил/ и C3-6 циклоалкилсульфонил /например, циклопентилсульфонил/, циклогексилсуофльнил/, а также фенил, нафтил, фенокси, бензоил, феноксикарбонил, фенил C1-4 алкилкарбамоил /например, фенилметилкарбамоил, фенилэтилкарбамоил, фенилпропилкарбамоил/, фенилкарбамоил, фенил- C1-4 алкилкарбониламино/ например, фенилметилкарбониламино, фенилэтилкарбонил амино/, бензоиламино, фенил- C1-4 алкилсульфонил /например, фенилметилсульфонил, фенилэтилсульфонил/, фенилсульфонил, фенил C1-4 алкилсульфонил /например, фенилметилсульфинил, фенилэтилсульфинил/, фенил C1-4 алкилсульфониламино /например, фенилметилсульфониламино, фенилэтилсульфониламино/ или фенилсульфониламиногруппу, которая может иметь от 1 до 4 заместителей, выбираемых, например, из группы, включающей C1-4 алкильные группы, такие как метил, этил, пропил, бутил, изопропил ит т. д. C1-4 алкоксильные группы, такие как метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси и т.д. галоген, такой как хлор, бром и иод, гидрокси, бензилокси, амино, моно- или ди- C1-4 алкилзамещенную аминогруппу, аналогичную указанным выше, нитрогруппу и C1-6 алкилкарбонил, аналогичный указанному выше, и подобные группы.
"Ацил" из" ацильной группы, которая может быть замещена", обозначеный символом R1, включает ацильные группы карбоновых кислот /например, формил C2-8 алкил- или фенилкарбонильные группы, такие как ацетил, пропионил, бутирил, бензоил и т.д./, ацильные группы сульфокислот /например, C1-7 алкил или фенилсульфонильные группы, такие как метансульфонил, бензолсульфонил, паратолуолсульфонил и т. д./, ацильные группы фосфоновых кислот /например, C1-7 алкид или фенилфосфонильные группы; такие как метанфосфонил, бензолсульфонил, и т.д./ и замещенные оксикарбонильные группы /например, C2-8 алкилоксикарбонильные или C7-8 аралкилоксикарбонильные группы, такие как метилоксикарбонил, трет-бутилоксикарбонил, бензилоксикарбонил и т.д.
Каждая из этих ацильных групп может произвольно иметь от 1 до 3, предпочтительно от 1 до 2 заместителей, таких как галоген /например, фтор, хлор, бром, иод/, аминогруппа, C1-6 алкил или C3-6 циклоалкилзамещенная первичная или вторичная аминогруппа /например, метиламино, этиламино, пропиламино, циклогексиламино, диметиламино, диэтилоамино, диизопропиламино, дициклогексиламино/, C1-4 алкоксильная группа /например, метокси, этокси, пропокси/ и подобные группы.
X предпочтительно представляет R1 N<, причем элементом R1 предпочтительно является водород, метил, этил, бензил, ацетил, бензоил, метоксикарбонил или этоксикарбонил.
R2 предпочтительно представляет бензильную или a нафтилметильную группу, которая является незамещенной или может быть замещена 1 или 2 заместителями, выбираемыми из группы, включающей галоген /например, фтор, хлор/, метил, нитро и/или метокси, при этом более предпочтительные примеры R2 включают незамещенный бензил.
Заместителем в кольце A предпочтительно является фтор, хлор, трифторметил, метил или метокси, при котором предпочтение отдается фтору.
Предпочтительными значениями k и m являются такие значения, которые в сумме образуют целое число от 2 до 6, т. е. когда
образует 5-9 членное кольцо.
Предпочтительным сочетанием значений k и m является такое сочетание, при котором если k равняется 0, то m равняется 2, 3, 4 или 5, если k равняется 1, то m равняется 1, 2 или 3, или если k равняется 2, то m равняется 2. Таким образом, азотсодержащие конденсированные гетероциклические кольца, которые выражены формулой
представляют 2,3-дигидро-1H-индол, 1,2,3,4-тетрагидрохинол, 2,3,4 - 5-тетрагидро-1H-1-бензазепин, 2,3-дигидро-1H-изоиндол, 1,2,3,4-тетрагидроизохинолин, 2,3,4,5-тетрагидро-1H-2-бензазепил, 2, 3, 4, 5 - тетрагидро-1H-3-бензазепин, 1, 2, 3, 4, 5, 6 гексагидро-1-бензазецин, 1, 2, 3, 4, 5, 6 гексагидро-2-бензазоцин, 1, 2, 3, 4, 5, 6 гексагидро-3-бензазоцин, 2, 3, 4, 5, 6, 7 гексагидро-1H-1-бензазонин, 2, 3, 4, 5, 6, 7 гексагидро-1H-2-бензазонин, 2, 3, 4, 5, 6, 7 гексагидро-1H-3-бензазонин, 2, 3, 4, 5, 6, 7 гексагидро-1H-4-бензазонин.
Предпочтительные кислородсодержащие конденсированные гетероциклические кольца, которые выражены формулой
представляют 2,3-дигидробензофуран, 1,3-дигидроизобензофуран 3,4-дигидро-2H-1-бензопиран, 2, 3, 4, 5-тетрагидро-1-бензоксепин, 1, 3, 4, 5 - тетрагидро-2-бензоксепин, 1, 2, 4, 5 тетрагидро-3-бензоксепин, 3, 4, 5, 6 - тетрагидро-2H-1-бензоксоцин, 3, 4, 5, 6 тетрагидро-1H-2-бензоксоцин, 1, 4, 5, 6 тетрагидро-2H-3-бензоксоцин, 2, 3, 4, 5, 6, 7 - гексагидро-1-бензоксонин, 1, 3, 4, 5, 6, 7 гексагидро-2-бензоксонин, 1, 2, 3, 4, 5, 6, 7 гексагидро-4-бензоксонин.
Предпочтительные серосодержащие конденсированные гетероциклические кольца, которые выражены формулой
представляют 2,3-дигидро[b] тиофен, 1, 3,-дигидробензо[c]тиофен, 3,4-дигидро-2H-1-бензотиопиран, 3,4-дигидро-1H-2-бензотиопиран, 2, 3, 4, 5 - тетрагидро-1-бенззотиепин, 1, 3, 4, 5 тетрагидро-2-бензотиепин, 1, 2, 4, 5 - тетрагидро-3-бензотиепин, 3, 4, 5, 6 тетрагидро-2H-1-бензотиоцин, 3, 4, 5, 6 тетрагидро-1H-2-бензотиоцин, 1, 4, 5, 6 тетрагидро-2H-3-бензотиоцин, 2, 3, 4, 5, 6, 7 гексагидро-1-бензотионин, 1, 3, 4, 5, 6, 7 - гексагидро-3-бензотионин, 1, 2, 3, 5, 6, 7 гексагидро-4-бензотионин.
Более предпочтительные гетероциклические кольца, которые выражены формулой
в которой каждый символ имеет указанные выше значения, включают
где R3 представляет атом водорода или C1-3 алкильную группу, C1-3 алкильная группа, обозначаемая символом R3, включает метил, этил, пропил и изопропил.
Предпочтительным примером значения n является 1, 2 или 3, при этом предпочтение отдается 2.
Особенно предпочтительными являются следующие соединения формулы /I/ и их соли. (см. табл. 1 13).
Соль соединения /I/ по настоящему изобретению предпочтительно является физиологически приемлемой солью присоединения кислоты, указанная выше соль включает соли, образуемые с помощью неорганических кислот /например, хлористоводородная кислота, фосфорная кислота, бромистоводородная кислота, серная кислота/, и соли образуемые с помощью органических кислот /например, уксусная кислота, муравьиная кислота, пропионовая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, бензойная кислота, метансульфоновая кислота, бензолсульфоновая кислота/.
Кроме того, если соединение /I/ по настоящему изобретению имеет такую кислотную группу, как COOH, соединение /I/ может образовывать соль с неорганическим основанием /например, натрий, калий, кальций, магний, аммиак/ или с органическим основанием /например, триэтиламин/.
Ниже описывается способ получения соединения /I/ или его соли по настоящему изобретению.
Хотя следующее описание способа получения относится не только к получению соединения /I/, но и к получению его соли, оба эти соединения могут определяться ниже как соединения /I/.
Соединение /I/ можно получить в результате взаимодействия соединения формулы /II/:
в которой Y представляет галоген, n имеет значения, указанные в формуле /I/, Z представляет защитную группу, обеспечивающую защиту аминогруппы, или его соли с соединением формулы /III/:
в которой все символы имеют значения, указанные в формуле /I/, или с его солью, и удаления защитной группы из полученного соединения формулы /IV/:
в которой все символы имеют указанные выше значения, или из его соли.
Y предпочтительно представляет хлор, бром или иод, при этом предпочтение отдается примеру, в которой Y является хлором.
Z предпочтительно представляет ацетил, бензоил, формил, метоксикарбонил, трет-бутоксикарбонил или бензилоксикарбонил, при этом предпочтительные примеры Z включают ацетид и бензоил.
Соединение формулы /II/ или его соль можно получить с помощью известных способов или аналогичных им. Например, это соединение можно получить с помощью способа, описанного в Chemical Pharmaceutical Bulletin, 34, 3747-3761 /1986/.
Соединение формулы /III/ или его соль можно получить в соответствии с известными способами или аналогичными им способами. Например, это соединение можно получить с помощью способов, описанных в журнале "Journal of Organic Chemistry", 34, 2235 /1969/, Journal of the Organic Chemistry", 54, 5574 /1989/, Tetrahedron letters 35, 3023 /1977/, в Бюллетене химического общества Японии, 56, 2300 /1983/ и т.д.
Соль соединения /II/ или соединения /III/ по настоящему изобретению предпочтительно является физиологически приемлемой солью присоединения кислоты. Указанная выше соль включает соли, образованные с помощью неорганических кислот /например, хлористоводородная кислота, фосфорная кислота, бромистоводородная кислота, серная кислота/, и соли, образованные с помощью органических кислот/ например, уксусная кислота, муравьиная кислота, пропионовая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, винная кислота, лимонная кислота, яблочная кислота, щавелевая кислота, бензойная кислота, метансульфоновая кислота, бензолсульфоновая кислота/.
Взаимодействие между соединением /II/ или его солью /например, одна из солей, указанных для формулы /I/ и соединением /III/ или его солью может осуществляться следующим образом. Например, соединение /II/ или его соль подвергают взаимодействию с соединением /III/ без растворителя или в растворителе, при необходимости в присутствии кислоты или подобного вещества. Такой кислотой может быть кислота Льюиса /например, хлорид алюминия, хлорид цинка, хлорид титана/. Количество такой кислоты обычно составляет 1 20 молей, предпочтительно 2 10 ммолей, по отношению к одному молю соединения /II/. Растворителем может быть любой обычный растворитель, используемый в химических реакциях, при условии что он не влияет на ход реакции. Например, в качестве растворителя можно использовать дихлорметан, дихлорэтан, нитробензол, сероуглерод. Температура реакции обычно составляет от -30 до 150oC, предпочтительно от 20 до 100oC. Время реакции обычно равняется 0,5 72 ч. Соединение /III/ или его соль обычно используют в отношении 1 20 молей, предпочтительно 1 5 молей, к одному молю соединения /II/ или его соли.

соединения формулы /II/ можно вводить в соединение формулы /III/ при осуществлении вышеуказанной реакции в любое положение кольца A, в котором оно может быть замещено. Таким положением обычно является положение у атома 6, если каркасная структура соединения /III/ представляет 1, 2, 3, 4 - тетрагидрохинолин /где кольцо A является незамещенным/. Однако, также можно получить и выделить соединения, которые были образованы при введении вышеуказанной группы в другие положения /положения у атомов 5, 7 и 8/.
Полученное таким образом соединение /IV/ или его соль можно выделить и очистить с помощью известных методов, таких как концентрирование, регулирование показателя pH, диспропорционирование, экстракция растворителем, фракционная перегонка, перегонка, кристаллизация, перекристаллизация, хроматография и подобные методы. Однако, реакционную смесь можно непосредственно использовать в качестве материала для следующей стадии реакции.
Удаление защитной группы из соединений /IV/ или его соли может производиться путем обработки соединения /IV/ или его соль выдерживают в водном растворе минеральной кислоты /например, азотная кислота, хлористоводородная кислота, бромистоводородная кислота, иодноватая кислота, серная кислота/ или в гидроксиде щелочного металла /например, гидроксид натрия, гидроксид калия, гидроксид бария, гидроксид лития/ при температуре от 10 до 150oC, предпочтительно от 50 до 100. Такую кислоту или основание обычно используют в отношении 1-100 эквивалентов, предпочтительно 1-40 эквивалентов, к соединению /IV/ или к его соли. Крепость раствора кислоты или основания обычно соответствует 1-10 нормальности, предпочтительно 4-10 нормальности. Время реакции, которое зависит от температуры реакции, обычно составляет от 1 до 24 ч, предпочтительно от 2 до 10 ч.
Полученное таким образом, соединение /I/ /R2=H/ можно выделить и очистить с помощью известных методов, таких как концентрирование, регулирование показателя pH, диспропорционирование, экстракция растворителем, фракционная перегонка, перегонка, кристаллизация, перекристаллизация, хроматография и подобные методы. Однако, реакционную смесь можно непосредственно использовать в качестве исходного материала для следующей стадии реакции.
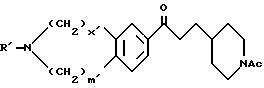
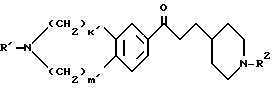
Соединение /I/, в котором R2 представляет группу, не являющуюся атомом водорода, или его соль можно получить в результате взаимодействия соединения /I/ /R2=H/ или его соли с соединением формулы  -J1 /V/ в которой
-J1 /V/ в которой  представляет углеводородную группу, которая может быть замещена, а J1 представляет отщепляемую группу.
представляет углеводородную группу, которая может быть замещена, а J1 представляет отщепляемую группу.
Отщепляемая группа J1 включает галоген /например, хлор, бром, иод/ C1-6 алкилсульфонилоксигруппу /например, метансульфонилокси, этансульфонилокси/ и C6-10 арилсульфонилоксигруппу /например, бензолсульфонилокси, паратолуолсульфонилокси/.
Взаимодействие между соединением /I/ /R2=H/ или его солью и соединением /V/ осуществляется в растворителе или без растворителя и при необходимости в присутствии основания.
Указанное выше основание включает различные неорганические основания, такие как карбонат натрия, карбонат калия, карбонат лития, гидроксид натрия, гидроксид калия, метилат натрия, этилат натрия, гидрид натрия и т.д. а также различные органические основания, такие как пиридин, 4-диметиламинопиридин, триэтиламин и подобные основания. В случае применения растворителя такой растворитель может представлять низшие спирты, такие как метанол, этанол, пропанол, изопропиловый спирт, н-бутанол, трет-бутанол и т.д. простые эфиры, такие как диоксан, простой эфир, тетрагидрофуран и т.д. ароматические углеводороды, такие как толуол, бензол, ксилол и т.д. амиды, такие как диметилформамид, диметилацетамид, гексаметилфосфонотриамид и т.д. сложные эфиры, такие как этилацетат, бутилацетат и т.д. которые не влияют на ход реакции. Эта реакция может осуществляться в условиях охлаждения /от 0 до 10oC/, при комнатной температуре /от 10 до 40oC/ или при нагревании /от 40 до 120oC/, при этом время реакции обычно составляет от 10 мин до 48 ч, предпочтительно от 2 до 16 ч.
Соединение формулы /V/ обычно применяют в предпочтительном отношении от 0,3 до 5,0 молей одному молю соединения /I/ /R2=H/ или его соли. В случае использования основания оно обычно применяется в отношении более одного моля, предпочтительно 1,1 5 молей, к одному молю соединения формулы /I/ /R2=H/ или его соли.
При желании эту реакцию можно ускорить, осуществляя ее в присутствии иодида натрия иодида калия иодида лития или подобного вещества. В таких случаях иодид обычно используется в отношении от 1 до 5 молей, предпочтительно от 1,2 до 1,5 моля, к одному молю соединения /V/. Кроме того, соединение /I/ или его соль также можно получить в результате взаимодействия формулы /VI/:
в которой k, m, n, кольцо А и R2 имеют указанные выше значения, или его соли с соединением формулы /VII/:
в которой  представляет углеводородную группу, которая может быть замещена, или ациальную группу, которая может быть замещена, J1 имеет указанные выше значения, при наличии таких же условий, которые были описаны для реакции между соединением /I/ /R2=H/ или его солью и соединением /V/. Соединение формулы /VI/ или его соль можно получить в соответствии с указанными выше способами либо путем гидролиза соединения /I/ /R2=H/, в которой R1 в которой R1 представляет ацил, или его соли с использованием кислоты или основания. Реакция гидролиза может осуществляться так же, как удаление защитной группы из соединения /IV/ или его соли.
представляет углеводородную группу, которая может быть замещена, или ациальную группу, которая может быть замещена, J1 имеет указанные выше значения, при наличии таких же условий, которые были описаны для реакции между соединением /I/ /R2=H/ или его солью и соединением /V/. Соединение формулы /VI/ или его соль можно получить в соответствии с указанными выше способами либо путем гидролиза соединения /I/ /R2=H/, в которой R1 в которой R1 представляет ацил, или его соли с использованием кислоты или основания. Реакция гидролиза может осуществляться так же, как удаление защитной группы из соединения /IV/ или его соли.
Соединение /I/ также можно получить с помощью других известных способов или аналогичных им способов /например, соединение /I/ можно получить путем восстановления соединений формулы /IV/, в которой Z представляет ацил карбоновой кислоты, при этом также может быть необходима защита и снятие защиты с таких функциональных групп m соединения /IV/, как кетон, в процессе осуществления этого способа/.
Если полученное таким образом соединение /I/ представляет свободное основание соединения, его можно превратить в соль с помощью известных методов. Если полученное соединение представляет соль, ее можно превратить в свободное соединение или в другую соль с помощью известных методов. Полученное таким образом соединение /I/ или его соль можно выделить и очистить с помощью указанных выше методов.
Соединение /I/ или его соль по настоящему изобретению воздействует на центральную нервную систему млекопитающих, обладает сильным ингибирующим действием в отношении холинэстеразы и оказывает значительное воздействие на факторы, вызывающие амнезию у людей и животных /например, у мышей/.
Соединение /I/ или его соль по настоящему изобретению демонстрирует великолепное избирательное воздействие на центральную нервную систему, не затрагивая периферическую нервную систему, по сравнению с физостигмином, и при дозах, препятствующих развитию амнезии, не вызывает побочного действия на периферическую нервную систему, такого как спазмы, слюноотделение и понос, а, если оно и оказывает такое побочное действие, то оно является минимальным. Кроме того, это соединение характеризуется большой продолжительностью действия, а также низкой токсичностью и высокой эффективностью при пероральном введении. Острая токсичность соединения /I/ или его соли по настоящему изобретению наблюдается при дозе более 100 мг/кг.
Поэтому соединение /I/ или его соль по настоящему изобретению является полезным в качестве лекарственного средства, улучшающего функцию мозга у млекопитающих, включая людей.
Соединение /I/ или его соль по настоящему изобретению можно использовать для лечения таких заболеваний, как старческое слабоумие, болезнь Альцгеймера, хорея Гентингтона, гиперкинез и маниакальный синдром, а также для профилактики этих заболеваний.
Соединение /I/ или его соль по настоящему изобретению обычно включается в состав вместе с фармацевтически приемлемым наполнителем и может вводиться перорально или парентерально человеку и другим млекопитающим.
Такие фармацевтические составы могут предназначаться для перорального введения /например, порошки, таблетки, гранулы, капсулы и т.д./ или для парентерального введения /например, суппозитории, инъекции/. Эти лекарственные препараты можно изготовить известными методами. Хотя доза зависит от типа заболевания и симптомов, требующих лечения, обычная дневная доза для перорального введения для взрослых составляет от 0,01 до 100 мг, предпочтительно от 0,1 до 30 мг и предпочтительнее от 0,3 до 10 мг.
Приводимые ниже справочные примеры, рабочие примеры, примеры составов и испытательные примеры предназначены для дальнейшей более детальной иллюстрации настоящего изобретения, и их ни в коем случае нельзя рассматривать как примеры, ограничивающие объем этого изобретения.
В примерах и справочных примерах элюирование при выполнении хроматографии на колонках производили в условиях контроля посредством тонкослойной хроматографии, если нет специального указания. Контроль посредством тонкослойной хроматографии осуществляется с использованием кизельгеля Мерк 60 F254E. Мерк/ в качестве пластинки для тонкослойной хроматографии, растворителя для колоночного элюирования в качестве проявляющего раствора и ультрафиолетового детектора для обнаружения. В качестве дополнительного метода обнаружения применяли метод, в соответствии с которым пятно на пластинке для тонкослойной хроматографии опыляли 48% HBr, нагревали для осуществления гидролиза, опыляли нингидрином и вновь нагревали, при этом изменение окраски в красный красновато-фиолетовый цвет регистрировали как положительную реакцию. Таким образом идентифицировали и собирали фракции, содержащие целевое соединение. Если нет специального указания, то в качестве силикагеля для хроматографии использовали кизельгель Мерк 60 /от 70 до 230 меш/ /Е. Мерк//.
Термин "температура окружающей среды" или "комнатная температура" обычно означает температуру от 5oC до 40oC, а термин "атмосферное давление" означает давление, примерно равное одной атмосфере.
Если нет специального указания, то означает массовые проценты.
Справочный пример1.
1-ацетил-6-[3-/1-ацетилпиперидин -4- ил] -1-оксопропил]-1,2,3,4-тетрагидрохинолин
/I/ в 300 мл уксусной кислоты растворяли 33 г этил- β -/пиридин-4-ил/акрилата и производили каталитическую гидрогенизацию с использованием оксида платины в качестве катализатора, при атмосферном давлении и температуре от 70 до 80oC. После добавления 40 мл уксусного ангидрида катализатор отфильтровывали, а растворитель отгоняли при пониженном давлении. Остаток растворяли в воде и нейтрализовали карбонатом калия, после чего продукт реакции экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия, а растворитель отгоняли, в результате чего было получено 44,8 г масляного продукта.
/2/ В 200 мл метанола растворяли 42,0 г вышеуказанного масляного соединения, после чего добавляли раствор 12,7 г гидроксида калия в 20 мл воды. Эту смесь перемешивали 1,5 часа при температуре 50oC и 12 ч при комнатной температуре. Реакционную смесь нейтрализовали концентрированной хлористоводородной кислотой и отгоняли растворитель. К остатку добавляли метанол, после чего нерастворимое вещество отфильтровывали. Фильтрат концентрировали и образовавшиеся неочищенные кристаллы собирали фильтрованием, что позволило получать 27 г 3-/1-ацетилпиперидин-4-ил/ пропиловой кислоты/ температура плавления 201-206 oC/.
/3/ К 20 мл тионилхлорида добавляли 3,8 г 3-/1-ацетилпиперидин-4-ил/ пропионовой кислоты в виде небольших порций при охлаждении льдом, после чего смесь перемешивали в течение 5 мин. Избыток тионилхлорида отгоняли и к твердому остатку добавляли 15 г сероуглерода и 3,1 г 1-ацетил- 1,2,3,4-тетрагидрохинолина, после чего постепенно добавляли 10,7 г безводного хлорида алюминия при комнатной температуре. Эту смесь нагревали с обратным холодильником в течение 2 ч, а затем выливали в смесь воды со льдом и экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия, а растворитель отгоняли. Остаток очищали с помощью хроматографии / элюент смесь этилацетат и метанола 40 1 /в объемном отношении//, что позволило получить 1,4 г бесцветного масла.
Элементный анализ для C21H28N2O3
Высчитано: C 70,76 H 7,92 N 7,86.
Обнаружено: C 70,68 H 7,80 N 7,64.
Справочный пример 2.
1-ацетил-6-[3-/1-ацетилпиперидин-4-ил/-1- оксопропил-] 1,2,3,4-тетрагидрохинолин /А/ и 1-ацетил-7-[3-/1-ацетилпиперидин-4- ил/-1-оксопропил]-1,2,3,4-тетрагидрохинолин /B/
/1/ К 100 мл тионилхлорида добавляли 26 г 3- /1-ацетилпиперидин-4-ил/ пропионовой кислоты, полученной в соответствии со справочным примером 1 3 /2/, в виде небольших порций при охлаждении льдом. Эту смесь перемешивали в течение 5 мин, после чего избыток тионилхлорида отгоняли, а твердый остаток промывали простым диэтиловым эфиром, что позволило получить 26,4 г 3- /1-ацетилпиперидин-4-ил/-пропионилхлорида в виде бледно-желтого порошка.
/2/ К смеси 42,5 Г 1-ацетил-1,2,3,4-тетрагидрохинозина и 30 мл сероуглерода добавляли 71 г безводного хлорида алюминия, после чего добавляли 26,4 г 3-/1-ацетилпиперидин-4-ил/пропионилхлорида при комнатной температуре. Эту смесь перемешивали в течение 16 ч при комнатной температуре, а затем обрабатывали также, как в справочном примере 1-/3/, в результате чего было получено 25 г смеси 1-ацетило-6-[3-/1-ацетилпиперидин-4-ил/-1-оксопропил-] 1,2,3,4-тетрагидрохинолина /А/ и 1-ацетил-7-[3-/1-ацетилпиперидин-4- ил/-1-оксопропил]-1,2,3,4-тетрагидрохинолина /B/ в виде бледно-желтого масла.
Элементный анализ для C21H28N2O3
Высчитано: C 70,76 H 7,92 N 7,86.
Обнаружено: C 70,81 H 7,69 N 7,83.
Справочный пример 3.
1-Ацетил-5-[3-/1-ацетилпиперидин-4-ил/-1- оксопропил-] 2,3-дигидро-1H-индол
При выполнении методики, описанной в справочном примере 2-/2/, с использованием 24 г 1-ацетил-2,3-дигидро-1H индола было получено твердое вещество. Это твердое вещество перекристаллизовывали из смеси дихлорметана и простого диэтилового эфира с образованием 26 г бесцветных кристаллов с температурой плавления 148 149oC.
Элементный анализ для C20H26N2O3
Высчитано: C 70,15 H 7,65 N 8,18.
Обнаружено: C 69,97 H 7,71 N 7,98.
Справочный пример 4.
1-Ацетил-8[3-/1-ацетилпиперидин-4-ил/-1- оксопропил] 2,3,4,5-тетрагидро-1H-1-бензазепин /A/ и 1-ацетил-7- [3-/1-ацетилпиперидин-4-ил/1-оксопропил] 2,3,4,5-тетрагидро-1H-1-бензазепиг /B/
При выполнении методики, описанной в справочном примере 2-/2/ с использованием 8,7 г 1-ацетил-2,3,4,5-тетрагидро-1H -1- бензазепина было получено твердое вещество, которое затем перекристаллизовывали из смеси дихлорметана и простого диэтилового эфира с образованием 6,5 г указанного в заголовке соединения A в виде бесцветных кристаллов с температурой плавления 133 134 C.
Элементный анализ для C22H30N2O3
Высчитано: C 71,32 H 8,16 N 7,56.
Обнаружено: C 71,10 H 8,21 N 7,6.
Маточный раствор, полученный в результате перекристаллизации, очищали с помощью хроматографии на колонках /элюент: смесь этилацетата и метанола 100 1/, в результате чего было получено 0,3 указанного в заголовке соединения B в виде бледно-желтого масла.
Элементный анализ для C22H30N2O3
Высчитано: C 71,32 H 8,16 N 7,56.
Обнаружено: C 71,13 H 8,04 N 7,43.
Справочный пример 5.
8-[3-/1-ацетилпиперидин-4-ил/-1- оксопропил] 2,3,4,5-тетрагидро-1H-1-бензазепин
При выполнении методики, описанной в примере 7-/1-/, с использованием 2,2 г соединения, полученного в соответствии с примером 17, было получено 2,1 г бесцветных кристаллов с температурой плавления 86 88 C.
Элементный анализ для C20 H28N2O2
Высчитано: C 73,14 H 8,59 N 8,53.
Обнаружено: C 72,81 H 8,38 N 8,47.
Справочный пример 6.
5[3-/1-Ацетилпиперидин-4-ил/-1- оксопропил]1-этил-2,3-дигидро-1H-индол
В 10 мл этанола растворяли 0,8 г 5[3 - /1-ацетилпиперидин-4-ил-/1-оксопропил] 2,3-дигидро-1H-индола, 2,1 -г этилиодида и 0,5 г карбоната калия, после чего этот раствор нагревали с обратным холодильником в течение 24 ч. Твердое вещество и растворитель удаляли, а остаток очищали с помощью хроматографии на колонках /элюент: смесь этилацетата и метанола 20:1/, что позволило получить 0,85 г указанного в заголовке соединения в виде бледно-желтого масла.
Элементный анализ для C20H28N2O2
Высчитано: C 73,14 H 8,59 N 8,53.
Обнаружено: C 73,03 H 8,54 N 8,56.
Справочный пример 7.
При выполнении методики, описанной в справочном примере 6, с использованием соединения, полученного в примере 14-/1/, были получены следующие соединения в виде масла. (см. табл. 14).
Справочный пример 8.
5[-3-/1-ацетилпиперидин-4-ил/-1-оксопропил]-2,3-дигидро-бензофуран
К 200 мл 1,2-дихлорэтана добавляли 9,65 г /44 ммоля/ хлорангидрида 3-/1-ацетилпиперидин-4-ил/пропионовой кислоты и 10365 г /89 ммолей/ 2,3-дигидробензофурана. К этой смеси добавляли 12,82 г. /96 ммолей/ хлорида алюминия в виде ограниченных количеств, после чего эту смесь перемешивали в течение 3 ч при комнатной температуре. Реакционную смесь выливали в смесь воды со льдом и экстрагировали метиленхлоридом. Органические слои соединяли и промывали водой, а затем сушили над безводным сульфатом натрия, вслед за чем отгоняли растворитель. Остаток очищали с помощью хроматографии на колонках из силикагеля /этилацетат/, что позволило получить 10,47 г /78%/ 5[-3-/1-ацетилпиперидин-4-ил/-1-оксопропил] -2,3-дигидробензофурана. Перекристаллизация из метиленхлорида и простого диэтилового эфира привела к образованию бесцветных игл, температура плавления 93 95oC.
Элементный анализ для C18H23NO3
Высчитано: C 71,73 H 7,69 N 4,65.
Обнаружено: C 71,57 H 7,77 N 4,58.
Справочный пример 9.
3-/1-бензоилпиперидин -4- ил/пропионовая кислота
/1/ В 100 мл уксусной кислоты растворяли 12 г этил β -/пиридин-4-ил/акрилата, после чего производили каталитическое восстановление в присутствии 1 г оксида пластины в качестве катализатора при атмосферном давлении и температуре 70 80oC. Катализатор отфильтровывали, растворитель отгоняли при пониженном давлении, а остаток растворяли в 100 мл диоксана. К диоксановому раствору добавляли 100 мл водного раствора 12 г бикарбоната натрия и эту смесь перемешивали в течение 20 мин при комнатной температуре. К полученной смеси по каплям добавляли 8 мл бензоилхлорида при комнатной температуре, после чего эту смесь перемешивали в течение двух часов. Продукт реакции экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия, а растворитель отгоняли с образованием 17,5 г этил-3-/1-бензоилпиперидин-4- ил/пропионата в виде бледно-желтого маслянистого продукта.
/2/ При выполнении методики, описанной в пример 1-/2/, с использованием 17 г соединения, полученного в соответствии с вариантом /1/, было получено 15 г указанного в заголовке соединения в виде бесцветных кристаллов, температура плавления 153 155oC.
Элементный анализ для C15H19NO3
Высчитано: C 68,94 H 7,33 N 5,36.
Обнаружено: C 68,71 H 7,44 N 5,20.
Справочный пример 10.
3-метоксикарбонил-2,3,4,5-тетрагидро-1Н -3- бензазепин
В 150 мл воды растворяли 4,13 г /0,10 моля/ гидроксида натрия. К этому раствору добавляли 15,27 г /10,4 ммоля/ 2,3,4,5- тетрагидро-1Н-3-бензазепина. Реакционную смесь охлаждали льдом и по каплям добавляли 7,9 мл /0,10 моля/ метилхлорформиата. Эту смесь перемешивали в течение 2,5 ч при комнатной температуре, а затем экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия, а растворитель отгоняли, в результате чего было получено 20,46 г /96%/ 3-метоксикарбонил- 2,3,4,5-тетрагидро-1Н-3-бензазепина в виде бесцветных кристаллов. Перекристаллизация из смеси простого диэтилового эфира и н-гексана позволила получить бесцветные иглы, температура плавления 53 54oC.
Элементный анализ для C12H15NO2
Высчитано: C 70,22 H 7,37 N 6,82.
Обнаружено: C 6 70,02 H 7,41 N 6,68.
Справочнй пример 11.
3-меткосикарбонило-7-[3-/1-бензоилпиперидин-4- ил/-1-оксопропил] -2,3,4,5-тетрагидро-1Н-3-бензазепин
При охлаждении льдом 2,5 мл тионилхлорида по каплям добавляли к 1,08 г /4,1 ммоля/ 3-/1-бензоил-пиперидин-4-ил/пропионовой кислоты, полученной в справочном примере 9. Эту смесь перемешивали в течение 40 мин при температуре 0oC, после чего тионилхлорид отгоняли. Остаток растворяли в 20 мл 1,2 дихлорэтана и к этому раствору добавляли 0,81 г /3,9 ммоля/ 3-метоксикарбонил-2,3,4,5-тетрагидро-1Н-3-бензазепина, поулченного в справочном примере 10. К этой смеси добавляли 1,75 г /13,1 ммоля/ хлорида алюминия в виде небольших порций. Полученную смесь перемешивали при комнатной температуре в течение одного часа, затем реакционную смесь выливали в смесь воды со льдом и экстрагировали дихлорметаном. Органические слои соединяли и промывали один раз водой, затем сушили над безводным сульфатом натрия, после чего отгоняли растворитель. Очистка с помощью хроматографии на колонках из силикагеля позволила получить 1,46 г /83%/ 3-метоксикарбонил-7- [3-/1-бензоилпиперидин-4-ил/-1-оксопропил-]2,3-4,5-тетрагидро-1Н-3- бензазепина. Перекристаллизация из смеси этил-ацетата и н-гексана привела к образованию бесцветных игл, температура плавления 120 123oC.
Элементный анализ для C27H32N2O4
Высчитано: C 72,30 H 7,19 N 6,25.
Обнаружено: C 71,99 H 7,22 N 6,12.
Справочный пример 12.
6-[3-/1-Ацетилпиперидин-4-ил/-1-оксопропил] - 3,4-дигидро-2Н-1-бензотиопиран
К смеси 3,4-дигидро-2 Н -1- бензотиопирана /1,5 г/ и 3-/1-ацетилпиперидин-4-ил/пропионилхлорида /2,18 г/ в 1,2 дихлорэтане /20 мл порциями добавляли хлорид алюминия /3,2/ при температуре 10 15oC. Эту смесь перемешивали при комнатной температуре в течение 2 ч, нагревали с обратным холодильником еще в течение 2 ч и выливали в смесь воды со льдом. Полученную смесь экстрагировали дихлорметаном, промывали водой, сушили над безводным сульфатом натрия и отгоняли растворитель. Остаток очищали посредством хроматографии на колонках из силикагеля /проявляющийся растворитель: этилацетат/, в результате чего было получено 2,7 г указанного в заголовке соединения в виде бледно-желтого масла.
Элементный анализ для C19H25NO2
Высчитано: C 68,85 H 7,60 N 4,23.
Обнаружено: C 68,66 H 7,62 H 4,13.
Справочный пример 13.
2-ацетил-8-хлор-1,2,3,4-тетрагидроизохинолин
К смеси 28,6 г 8-хлор-1,2,3,4 тетрагидроизохинолингидрохлорида в 140 мл дихлорметана добавляли 140 мл 1 н водного раствора NaON и 17,6 г NaHCO. К этому раствору по каплям добавляли 14,5 мл уксусного ангидрида при температуре 5oC. Эту смесь перемешивали при комнатной температуре в течение 1 ч. Органический слой отделяли, а водный слой экстрагировали дихлорметаном. Соединенные органические экстракты промывали водой, сушили над безводным сульфатом натрия. Растворитель отгоняли с образованием 29,1 г указанного в заголовке соединения в видео бледно-красного масла.
Элементный анализ для C11H12ClNO
Высчитано: C 63,01 H 5,77 N 6,68.
Обнаружено: C 62,82 H 5,86 N 6,56.
Справочный пример 14.
2-Ацетил-5-[3-[1-бензоилпиперидин-4- ил/-1-оксопропил] 8-хлор-1,2,3,4-тетрагидроизохинолин
При выполнении методики, описанной в справочном примере 11, с использованием 21,0 г соединения, полученного в справочном примере 13, было получено 9,2 г указанного в заголовке соединения в виде бледно-желтого масла.
Элементный анализ для C26H29ClN2O3
Высчитано: C 68,94 X 6,45, H 6,18.
Обнаружено: C 68,83 H 6:52 N 6,04.
Пример 1.
6-[1-оксо-3-/пиперидин-4-ил/-пропил]-1,2,3,4-тетрагидрохинолин
Смесь 1,3 г 1-ацетил-6-[3/1-ацетил- пиперидин-4-ил/-1-оксо-пропил] 1,2,3,4-тетрагидрохинолина, полученного в справочном примере 1, и 20 мл концентрированной хлористоводородной кислоты нагревали с обратным холодильником в течение 16 ч. Затем реакционную смесь концентрировали, а остаток растворяли в воде. Этот раствор промывали простым эфиром, показатель pH водного слоя доводили до 10 с с помощью 10% раствора гидроксида натрия и экстрагировали натрия, а растворитель отгоняли при пониженном давлении, что позволило получить 0,9 г бесцветного масла.
Элементный анализ для C17H24N2O
Высчитано: C 74,96 H 8,88 N 10,29.
Обнаружено: C 74,87 H 8,68 N 10,3.
Пример 2.
6-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] пропил]-1,2,3,4-тетрагидрохинолиндигидрохлорид
К смеси 1,3 г 6-[1-оксо-3-/пиперидин-4- ил/-пропил]-1,2,3,4-тетрагидрохинолина 0,9 г карбоната калия и 10 мл этанола по каплям добавляли 2 мл раствора 0,74 г бензилбромида в этаноле при охлаждении льдом. Эту смесь перемешивали при комнатной температуре в течение 2 ч, после чего удаляли твердое вещество и растворитель. Остаток очищали с помощью хроматографии на колонках/ элюент: смесь этилацеата и метанола=20:1 /в объемном отношении/, после чего элюат, содержащий целевое соединение, перегоняли для удаления растворителя. Остаток обрабатывали 2,4 мл 4 н раствора гидрохлорида в метаноле с образованием твердого вещества. Это твердое вещество, перекристаллизовывали из смеси метанола и простого эфира, что позволило получить 1,55 г бесцветного порошка с температурой плавления 110 - 125oC /разложение/.
Элементный анализ для C24H3N2O•2HCl
Высчитано: C 6,20 H 7,41 N 6,43.
Обнаружено: C 66,00 H 7,35 N 6,22.
Пример 3.
1-/фенилметил/-6-[3-1-/фенилметил/пиперидин-4- ил-] 1-оксопропил] -1,2,3,4-тетрагидрохинолиндигидрохлорид
К 5 мл раствора 0,5 г 6[1-оксо-3-1- /фенилметил/пиперидин-4-ил]-пропил] 1,2,3,4-тетарагидрохинолина/свободное основание/ в соответствии с примером 2 в N, N-диметилформамиде постепенно добавляли 40 мл гидрида натрия /не содержащего масла/, после чего эту смесь перемешивали при комнатной температуре в течение 1 ч. К этому раствору по каплям добавляли 0,22 г бензилбромида при охлаждении льдом и полученную смесь перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь затем обрабатывали также, как в примере 2, а остаток очищали посредством хроматографии на колонках/ элюент: смесь этилацетата и метанола 20:1/ в объемном отношении. Элюент, содержащий целевое соединение, перегоняли при пониженном давлении для удаления растворителя и образовавшееся масло обрабатывали 0,7 мл 4 н. раствором хлористоводородной кислоты в метаноле, в результате чего было получено твердое вещество. Это твердое вещество перекристллизовывали из смеси этанола и простого эфира с образованием 0,28 г бесцветных кристаллов с температурой плавления 112 117oC /разложение/.
Элементный анализ для C31H36N2O•2HCl
Вычитано: C 70,85 H 7,29 N 5,33.
Обнаружено: C 70,81 H 7,12 N 5,18.
Пример 4.
1-метил -6-[3-[1-/фенилметил/пиперидин-4- ил] -1-оксопропил-]1,2,3,4-тетрагидрохинолингидрохлорид
К 3 мл раствора 0,2 г 6-[3-[1-/фенилметил/пиперидин -4-ил-1-]оксопропил] -1,2,3,4-тетрагидрохинолиндигидрохлорида, полученного в соответствии с примером 2, в N, N -диметилформамиде постепенно добавляли 37 мл гидрида натрия /не содержащего масла/. Эту смесь перемешивали при комнатной температуре в течение 1 ч, после чего добавляли 62 мг метилиодида. Полученную смесь перемешивали при комнатной температуре в течение 6 ч и в конце этого периода добавляли в указанном порядке 15 мг гидрида натрия/ не содержащего масла/ и 40 мл этилхлоркарбоната. Эту смесь перемешивали в течение 1 ч, а затем выливали в смесь воды со льдом и экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия, а растворитель отгоняли при пониженном давлении. Остаток очищали посредством хроматографии на колонках /элюент смесь этилацетата и метанола 20:1/ в объемном отношении // и элюент смесь этилацетата и метанола 20 1 /в объемном отношении // и элюат, содержащий целевое соединение, перегоняли при пониженном давлении для удаления растворителя. Образовавшееся масло обрабатывали 0,23 мл 4 н. раствором хлористоводородной кислоты в метаноле, что позволило получить 0,1 г аморфного порошка.
Элементный анализ для C25H32N2O•2HCl
Высчитано: C 66,81 H 7,62 N 6,23.
Обнаружено C 66,83 H 7,55 N 6,09.
Пример 5.
6-[1-оксо-3-[пиперидин-4-ил/пропил] 1,2,3,4-тетрагидрохинолин /А/ и 7-[1-оксо-3-]пиперидин -4-ил /пропил]-1,2,3,4 тетрагидрохтнолин /В/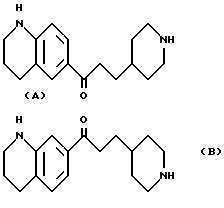
При заполнении методики, описанной в примере 1, с использованием 23 г соединения, полученного в соответствии со справочным примером 2, было получено 16,9 г смеси 6-[1-оксо -3-/пиперидин-4-ил/- пропил]-1,2,3,4-тетрагидрохинолина /А/ и 7-[1-оксо-3-/пиперидина -4-ил/пропил] 1,2,3,4-тетрагидрохинолина /В/ в виде бледно-желтого масла.
Элементный анализ для C17H24N2O
Высчитано C 74,96 H 7,88 N 10,29.
Обнаружено: C 74,69 H 8,90 N 10,2.2
Пример 6.
6-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] пропил]-1,2,3,4-тетрагидрохинолинфумарат /А/ и 7-[1 -оксо-3-[1-/фенилметил/- пиперидин-4-ил]пропил-1,2,3,4-тетрагидрохинолинфумарат /В/
При выполнении методики, описанной в примере 2, с использованием 1,8 г соединения, полученного в примере 5, было получено 1,82 г свободного основания смеси указанных в заголовке соединений А и В. Первый сбор кристаллов /0,65 г/ из расчета этой смеси в простом диэтиловом эфире, то есть 7-[1-оксо-3-[1-/фенилметил/пиперидин-4-ил] пропил] 1,2,3; 4- тетрагидрохинолина /температура плавления 132 135oC обрабатывали эквивалентным количеством фурамовой кислоты, в результате чего было получено 0,69 г указанного в заголовке фумарата /В/ в виде бесцветных кристаллов с температурой плавления 175 177oC /разложение/.
Элементный анализ для C24H30N2O• C4H4O4
Вычислено C 70,27 H 7,16 N 5,85
Обнаружено: C 70,01 H 6,97 N 5,98
Маточный раствор указанного раствора в простом диэтиловом эфире также концентрировали с образованием 0,7 г 6-[1- оксо-3-[1-/фенил-метил/-пиперидин-4-ил] пропил] -1,2,3,4-тетрагидрохинолина в виде кристаллов /температура плавления 126 129oC/. Этот сбор кристаллов обрабатывали эквивалентным количеством фумаровой кислоты, в результате чего было получено 0,78 г указанного в заголовке фумарата /A/ в виде бесцветных кристаллов с температурой плавления 138 142oC /разложение/.
Элементный анализ для C24H30N2O• C4H4O4
Высчитано: C 70,27 H 7,16 N 5,85.
Обнаружено: C 70,13 H 7,13 N 5,77.
Пример 7.
1-метил-6-[1-оксо-3-/пиперидин-4- ил/пропил] -1,2,3,4-тетрагидрохинолин /A/ и 1-метил-7-[1-оксо -3-/пиперидин-4-ил/пропил]-1,2,3,4-тетрагидрохинолин /B/
/1/ К 40 мл раствора 14,2 г соединения, полученного в соответствии с примером 5, в дихлорметане по каплям добавляли 10 мл раствора 5,1 г уксусного ангидрида в дихлорметане при охлаждении льдом. Эту смесь затем перемешивали при комнатной температуре в течение 10 мин, после чего ее промывали 10% раствором гидроксида натрия и сушили над безводным сульфатом натрия. После этого отгоняли растворитель с образованием 14,9 г смеси 6- [1-оксо-3-/1-ацетилпиперидин-4-ил/пропил] -1,2,3,4-тетрагидрохинолина и 7 -[1-оксо-3-/1-ацетилпиперидин-4-ил/-пропил] -1,2,3,4-тетрагидрохинолина в виде бесцветного масла.
/2/ Смесь 7,1 г масла, полученного в соответствии с вариантом /1/ и 1,6 г триметилфосфата нагревали при температуре 190oC в течение 2 ч. После охлаждения до комнатной температуры добавляли 20 мл дихлорметана, а также водный раствор гидроксида натрия /NaOH/H2O 1,74 г /11 мл/ и полученную смесь нагревали с обратным холодильником в течение 2 ч. Слой дихлорметана промывали водой и сушили над безводным сульфатом натрия, в растворитель отгоняли. Остаток очищали с помощью хроматографии на колонках /элюент смесь этилацетата и метанола 30 1/, в результате чего было получено 5,5 г смеси 6-[3-/1-ацетилпиперидин-4-ил/-1-оксопропил-] 1- метил-1,2,3,4-тетрагидрохинолина и 7-[3-/1-ацетилпиперидин -4-ил/-1-оксопропил] -1-метил-1,2,3,4-тетрагидрохинолина в виде бледно-желтого масла.
/3/ При выполнении методики, описанной в примере 1, с использованием 3,9 г масла, полученного в соответствии с вариантом /2/, было получено 3,2 г смеси указанных в заголовке соединений в виде бледно-желтого масла.
Элементный анализ для C18H26N2O
Высчитано: C 75,48 H 9,15 N 9,78.
Обнаружено: C 75,21 H 9,06 N 9,8.
Пример 8.
1-метил-6-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] -пропил] -1,2,3,4-тетрагидрохинолинфумарат /A/ и 1-метил-7-[1-оксо-3- [1/фенилметил/пиперидин-4-ил]пропил]-1,2,3,4-тетрагидрохинолинфумарат /B/
При выполнении методики, описанной в примере 2, с использованием 3,1 г соединения, полученного в соответствии с примером 7, было получено 3,8 г свободного основания смеси указанных в заголовке соединений A и B. Эту смесь очищали с помощью хроматографии/ элюент смесь этилацетата и метанола 50 1/, что позволило получить 1,6 г 1-метил-6-[1-оксо-3- [1-/фенилметил/пиперидин-4-ил] пропил] -1,2,3,4-тетрагидрохинолина /бесцветное масло/ и 1,7 г 1-метил-7-[1-оксо-3-[1/фенилметил/пиперидин -4-ил]пропил]-1,2,3,4-тетрагидрохинолина /бесцветное масло/.
Затем 1,6 г 1-метил-6-[1-оксо-3-[1- /фенилметил/пиперидин-4-ил]-]пропил] -1,2,3,4-тетрагидрохинолина обрабатывали эквивалентным количеством фумаровой кислоты с образованием 1,7 г указанного в заголовке фумарата /A/ в виде бесцветных кристаллов с температурой плавления 170 172oC /разложение/.
Элементный анализ для C25H32N2O• C4H4O4
Высчитано: C 70,71 H 7,37 N 5,69.
Обнаружено: C 70,61 H 7,24 N 5,63.
С другой стороны 1,7 г 1-метил-7-[1-оксо-3- [1-/фенилметил/-пиперидин-4-ил] пропил] -1,2,3,4-тетрагидрохинолина обрабатывали эквивалентным количеством фумаровой кислоты с образованием 1,65 г указанного в заголовке фумарата /B/ в виде бесцветных кристаллов с температурой плавления 143 144oC /разложение/.
Элементный анализ для C25H32N2O• C4H4O4
Высчитано: C 70,71 H 7,37 N 5,69.
Обнаружено: C 70,54 H 7,09 N 5,7.
Пример 9.
1-фенилметил/-6-[1-оксо-3-/пиперидин-4- ил/-пропил]-1,2,3,4-тетрагидрохинолин /A/ и 1-/фенилметил/ -7-[1-оксо-3-/пиперидин-4-ил/пропил]-1,2,3,4-тетрагидрохинолин /B/.

/I/ К смеси 5,2 г соединения, полученного в соответствии с примером 7-/1/, 3,0 г карбоната калия и 30 мл этанола по каплям добавляли 5 мл раствора 2,7 г бензилбромида в этаноле при охлаждении льдом. Эту смесь перемешивали при комнатной температуре в течение 2 ч, после чего удаляли твердое вещество и растворитель. Остаток очищали с помощью хроматографии /элюент: смесь этилацетат и метанола 20:1 /в объемном отношении/, в результате чего было получено 3,2 г 7-[3-/1-ацетилпиперидин-4-ил/-1- оксопропил] 1-/фенилметил/-1,2,3,4-тетрагидрохинолина/ бесцветное масло/ и 1,8 г 6-[3-/1-ацетилпиперидин-4-ил/-1-оксопропил]-1,2,3,4- тетрагидрохинолина.
/2/ Смесь 1,8 г 6-[3-/1-ацетилпиперидин-4- ил/-1-оксопропил]-1,2,3,4-тетрагидрохинолина, полученного в соответствии с вариантом /1/, 1,03 г карбоната калия, 1,96 г бензилбромида и 20 мл этанола нагревали с обратным холодильником в течение 5 ч, после чего удаляли твердое вещество и растворитель. Остаток очищали с помощью хроматографии/элюент: смесь этилацетата и метанола 20: 1/; в результате чего было получено 2,1 г 6[3-/1-ацетилпиперидин-4-ил/-1-оксопропил] 1-/фенилметил/-1,2,3,4 тетрагидрохинолина в виде бесцветного масла.
/3/ При выполнении методики, описанной в примере 1, с использованием 3,15 г 7-[3-/1-ацетилпиперидин-4-ил/-1-оксопропил] -1-/фенилметил/ -1,2,3,4-тетрагидрохинолина, полученного в соответствии с вариантом /1/, было получено 2,8 г 1-/фенилметил/-7-[1-оксо-3-/пиперидин-4-ил/-пропил] -N 1,2,3,4-тетрагидрохинолина /В/ в виде бледно-желтого масла.
Элементный анализ для C24H30N2O
Вычислено: C 7,52 H 8,34 N 7,73.
Обнаружено: C 79,28 H 8,21 N 7,59.
/4/ При выполнении методики, описанной в примере 1, с использованием 1,9 г 6[3-/1-ацетилпиперидин-4-ил/-1-оксопропил]-1-/фенилметил/ -1,2,3,4-тетрагидрохинолина, полученного в соответствии с вариантом /2/, было получено 1,63 г /1-/фенилметил/-6-[1-оксо-3-/пиперидин-4- ил/пропил]-1,2,3,4-тетрагидрохинолина /А/ в виде бледно-желтого масла.
Элементный анализ для C24H30N2O
Вычислено C 79,52 H 8,34 N 7,73.
Обнаружено C 79,43 H 8,16 N 7,48.
Пример 10.
1-/фенилметил/-6-[1-оксо-3-[1- /фенилметил/пиперидин-4-ил] -пропил] -1,2,3,4-тетрагидрохинолинфумарат
При выполнении методики, описанной в примере 2, с использованием 1,5 г соединения, полученного в соответствии с примером 9-/4/, было получено 1,6 г
/фенилметил/-6-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] пропил]1,2,3,4-тетрагидрохинолина/свободное основание/ в виде бесцветного масла. Это масло /1,6 г/ обрабатывали эквивалентным количеством фумаровой кислоты с образованием 1,7 г указанного в заголовке фумарата в виде бесцветных кристаллов с температурой плавления 178-181oC /разложение/.
Элементный анализ для C31H36N2O• C4H4O4
Высчитано C 73,92 H 7,09 N 4,93.
Обнаружено C 7,64 H 7,22 N 4,84.
Пример 11.
1-/фенилметил/-7-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] -пропил] -1,2,3,4-тетрагидрохинолинфумарат
При выполнении методики, описанной в примере 2, с использованием 2,75 г соединения, полученного в соответствии с примером 9-/3/, было получено 2,95 г 1-/фенилметил/-7- [1-оксо-3-[1-фенилметил/пиперидин 4-ил]пропил]-1,2,3,4- тетрагидрохинолина/ свободное основание/ в виде бесцветного масла. Это масло /2,95 г/ обрабатывали эквивалентным количеством фумаровой кислоты с образованием 3,1 г указанного в заголовке фумарата в виде бесцветных кристаллов с температурой плавления 180-182oC /разложение/.
Элементный анализ для C31H36N2O• C4H4O4
Вычислено C 7,92 H 7,09 N 4,93.
Обнаружено C 73,72 H 7,02 N 4,86.
Пример 12.
2,3-дигидро-5-[1-оксо-3-/пиперидин-4-ил/пропил]-1H-индол
При выполнении методики, описанной в примере 1, с использованием 10 г соединения, полученного в соответствии со справочным примером 3, был получен твердый продукт, который перекристиаллизовывали из смеси дихрорметана и простого диэтилового эфира с образованием 7,08 г бледно-желтых кристаллов с температурой плавления 137-139oC.
Элементный анализ для C16H22N2O
Вычитано C 74,38 H 8,58 N 10,84.
Обнаружено C 74,11 H 8,75 N 10,67.
Пример 13.
2,3-дигидро-5-[1-оксо-3-[1-/фенилметил/пиперидин -4-ил] -пропил]-1Н-индолфумарат
При выполнении методики, описанной в примере 2, с использованием 2 г соединения, полученного в соответствии с примером 12, было получено 2,3 г свободного основания указанного в заголовке соединения в виде бесцветных кристаллов с температурой плавления 81-82 C. Эти кристаллы /2,3 г/ затем обрабатывали эквивалентным количеством фумаровой кислоты с образованием 2,6 г указанного в заголовке фумарата в виде бесцветных кристаллов с температурой плавления 150-153 C /разложение/.
Элементный анализ для C23H28N2O• C4H4O4
Вычитано C 69,81 H 6,94 N 6,03.
Обнаружено C 69,68 H 6,71 N 5,93.
Пример 14.
2,3-дигидро-1-метил-5-[1-оксо-3[-1-/фенилметил/пиперидин -4-ил]-пропил] -1н-индолфурмарат
/1/ при выполнении методики, описанной в примере 7-/1/ с использованием 3 г соединения, полученного в соответствии с примером 12, было получено 3,1 г 5-[3-/1-ацетилпиперидин-4-ил/1-оксопропил-] 2,3- дигидро-1Н-индола в виде бесцветных кристаллов с температурой плавления 145-146oC.
Элементный анализ для C18H24N2O2
Высчитано, C 71,97 H 8,05 N 9,33.
Обнаружено C 71,92 H 7,84 N 9,11.
/2/ При выполнении методики, описанной в примере 7-/2/ с использованием 1,5 г соединения, полученного в соответствии с вариантом /1/, было получено 1,25 г 5[3-/1-ацетилпиперидин-4-ил/-1-оксропропил]- 2,2,-дигидро-1-метил-1Н-индонола в виде бесцветного масла.
/3/ При выполнении методики, описанной в примере 1, с использованием 1,0 г соединения, полученного в соответствии с вариантом /2/, было получено 0,83 г 2,3-дигидро-1-метил-5-[1-оксо-3- /пипенридин-4-ил/пропил]1Н-индонола в виде бледно-желтого масла.
Элементный анализ для C17H24N2O
Высчитано: C 74,96 H 8,88 N 10,29.
Обнаружено: C 74,69 H 8,79 N 10,33.
/4/ При выполнении методики, описанной в примере 2, с использованием 0,53 г соединения, полученного в соответствии с вариантом /3/, было получено 0,51 г свободного основания указанного в заголовке соединения в виде бесцветного масла. Это масло /0,51г/ обрабатывали эквивалентным количеством фумаровой кислоты, в результате чего было получено 0,57 указанного в заголовке фумарата в виде бесцветных кристаллов с температурой плавления 147-151oC /разложение,
Элементный анализ для C24H30N2O• C4H4O4
Высчитано: C 70,27 H 7,16 N 5,85.
Обнаружено: C 70,06 H 7,09 N 5,80.
Пример 15.
2,3-дигидро-5-[1-оксо-3[1-/фенилметил/пиперидин-4-ил] пропил] -1- /фенилметил/-1Н-индолфумарат
/1/ При выполнении методики, описанной в примере 9-/2/, с использованием 0,65 г соединения, полученного в соответствии с примером 14-/1/, было получено 0,77 г 5[3-/1-ацетилпиперидин-4-ил/-1-оксопропил]-2,3 -дигидро-1-/фенилметил/-1Н-индонола в виде бесцветного масла.
/2/ При выполнении методики, описанной в примере 1, с использованием 0,67 г соединения, полученного в соответствии с вариантом /1/, было получено 0,65 г 2,3-дигидро-5[-1-оксо-3-/пиперидин-4-ил/-пропил] -1-/фенилметил/-1Н-индонола в виде желтого масла.
Элементный анализ для C23H28N2O
Высчитано: C 79,27 H 8,10 N 8,04.
Обнаружено: C 79,03 H 8,05 N 8,13.
/3/ при выполнении методики, описанной в примере 2, с использованием 0,64 г соединения, полученного в соответствии с вариантом /2/, было получено 0,66 г свободного основания указанного в заголовке соединения в виде бесцветного масла. Это масло /0,66 г/ обрабатывали эквивалентным количеством фумаровой кислоты, в результате чего было получено 0,75 г указанного в заголовке фурмата в виде бесцветных кристаллов с температурой плавления 153-156 C /разложение/.
Элементный анализ для C30H34N2O• C4H4O4
Высчитано C 73,62 H 6,91 N 5,05.
Обнаружено C 73,65 H 6,80 N 5,00.
Пример 16.
1-ацетил-6-[1-оксо-3-[1-/фенилметил/пиперидин-4-ил] пропил]-1,2,3,4-тетрагидрохинолинфумарат
В 10 мл дихлорметана растворяли 0,5 г 6[1-оксо-3- [1-фенилметил/пиперидин-4-ил]пропил]-1,2,3,4-тетрагидрохинолина /свободное основание/, 0,28 г уксусного ангидрида и 0,22 г пиперидина, после чего раствор нагревали с обратным холодильником в течении 2 ч. Растворитель избыток реагентов отгоняли при пониженном давлении, а остаток растворяли в дихлорметане. Раствором промывали 10% гидроксидом натрия, сушили над безводным сульфатом натрия и отгоняли растворитель. Этот остаток очищали с помощью хроматографии /элюент: смесь этилацетата и этанола20:1/, в результате было получено 0,45 г свободного основания указанного в заголовке соединения в виде бесцветного масла. Это масло 0,45 г, обрабатывали эквивалентным количеством фумаровой кислоты с образованием 0,53 г указанного в заголовке фумарата в виде аморфного порошка.
Элементный анализ для C26H32N2O2• C4H4O4
Высчитано: C 69,21 H 6,97 N 5,38.
Обнаружено: C 69,23 H 6,87 N 6,40.
Пример 17.
8-[1-оксо-3-/пиперидин-4- ил/пропил]-2,3,4,5-тетрагидро-1H-бензазепин
При выполнении методики, описанной в примере 1, с использованием 6,5 г соединения А, полученного в соответствии со справочным примером 4, было получено вязкое масло, которое кристаллизовали из гексана с образованием 5 4,6 г бледно-желтых кристаллов с температурой плавления 104-107oC.
Элементный анализ для C18H26N2O
Высчитано C 75,48 H 9,15 N 9,78.
Обнаружено: C 75,24 H 9,09 N 9,66.
Пример 18.
При выполнении методики, описанной в примере 1, с использованием соединений, полученных в соответствии со справочными примерами 4,6 и 7, были получены следующие соединения в виде масел (см. табл. 15).

Пример 19.
При выполнении методики, описанной в примере 13, с использованием соединения, полученного в соответствии с примерами 12, 17 или 18, были получены следующие соединения (см. табл. 16,17).
Пример 20.
2,3-дигидро-5-[1-оксо-3- /пиперидин-4-ил/-пропил]бензофурангидрохлорид
К 30 мл концентрированной хлористоводородной кислоты добавляли 5,00 г 5-[3-/1-ацетилпиперидин-4-ил/-1-оксопропил] -2,3-дигидробензофурана и полученную смесь нагревали с обратным холодильником в течение 14 ч. Реакционную смесь оставляли для охлаждения, а затем подщелачивали разбавленным водным раствором гидроксида натрия и экстрагировали метиленхлоридом. Органические соли соединяли и сушили над безводным сульфатом натрия, а растворитель отгоняли с образованием 4,31 г /100%/ 2,3-дигидро-5[1-оксо-3-/пиперидин-4-ил/пропил]бензофурана /4/. Полученное таким образом твердое вещество растворяли в метаноле, обрабатывали хлороводородом и перекристаллизовывали из смеси метанола и этилацетата, в результате чего были получены бесцветные иглы, температура плавления 203 - 205oC /разложение/.
Элементный анализ для C16H21N2O2HCl
Высчитано C 64,97 H 7,50 N 4,74.
Обнаружено C 64,76 H 7,64 N 4,54.
Пример 21.
2,3-дигидро-5-[1-оксо-3-[1- фенилметил/пиперидин-4-ил-[пропил]бензофурангидрохлорид
В 30 мл раствора смеси тетрагидрофурана и этанола /50/ 50 в объемном отношении/ добавляли 1,52 г 2,3-дигидро-5- [1-оксо-3-пиперидин-4-ил-/пропил] бензофурана, а затем 1,06 к карбоната калия. Полученную смесь охлаждали льдом и по каплям добавляли раствор 0,96 г бензилбромида в этаноле /5 мл/. Эту смесь перемешивали в течение 22 ч при комнатной температуре, после чего отгоняли растворитель. К остатку добавляли воду, которую экстрагировали метиленхлоридом. Органические слои соединяли и сушили над безводным сульфатом натрия, а затем отгоняли растворитель. Остаток очищали посредством хроматографии на колонках из силикагеля /этилацетат/ с образованием 1,13 г /55% / 2,3- дигидро-5-[1-оксо-3-[1-фенилметил/пиперидин-4-ил]пропил-]бензофурана. Продукт растворяли в метаноле, обрабатывали хлороводородом и перекристаллизовывали из смеси этанола и этилацетата, что позволили получить бесцветные иглы /четвертичный гидрат/, температура плавления 143 144oC.
Элементный анализ для C23H27NO2• HCl•1/4H2O
Высчитано C 70,75 H 7,36 N 3,59.
Обнаружено: C 70,49 H 7,26 N 3,62.
Пример 22.
7-[1-оксо-3-[1-фенилметил/пиперидин-4- ил]-пропил]-2,3,4,5-тетрагидро-1H-3-бензазепиндигидрохлорид
В атмосфере азота 0,48 г /1,1 ммоля/ 3- метоксикарбонил-7-[3-/1-бензоилпиперидин-4 -ил/-1-ил/-оксопропил] -2,3,4,5-тетрагидро-1H-3-бензазепина, полученного в соответствии со справочным примером 11, растворяли в 5 мл сухого хлороформа. К этому раствору добавляли 0,3 мл /2,1 ммоля/ иодотриметилсилана. Эту смесь перемешивали в течение 2,5 ч при температуре 50oC. Реакционную смесь оставляли для охлаждения, после чего к ней добавляли 0,4 мл. /10 ммолей/ метанола. К полученной смеси добавляли разбавленный водный раствор гидроксида натрия и водный раствор тиосульфата натрия, после чего производили экстракцию дихлорметаном. Экстракт сушили над безводным сульфатом натрия, а растворитель отгоняли. Остаток растворяли в 15 мл сухого тетрагидрофурана. К этому раствору добавляли 0,13 г 03,4 ммоля/ алюмогидрида лития, после чего эту смесь нагревали с обратным холодильником в течение 5 ч. В реакционную смесь добавляли воду и твердое вещество отфильтровывали. Фильтрат сушили над безводным сульфатом натрия, а растворитель отгоняли. Остаток растворяли в метаноле и обрабатывали хлороводородом, затем отгоняли растворитель с образованием гидрохлорида. К гидрохлориду добавляли смесь 0,3 г /3 ммоля/ хромовой кислоты, 0,3 мл концентрированной серной кислоты и 10 мл водного раствора ацетона /1/1= 0 в объемном отношении/. Полученную смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь выливали в воду и подщелачивали разбавленным водным раствором гидроксида натрия, после чего производили экстракцию дихлорметаном. Экстракт сушили над безводным сульфатом натрия, а растворитель отгоняли. Остаток очищали посредством хроматографии на колонках из оксида алюминия, в результате чего было получено 0,31 г /76%/ 7-[1-оксо-3-[1-/фенилметил/пиперидин-4-ил]пропил] -2,3,4,5-тетрагидро-1Н-3- бензазепина. Этот продукт растворяли в метаноле и обрабатывали 3 н. раствором хлористоводородной кислоты в метаноле с образованием дигидрохлорида в виде аморфного порошка.
Элементный анализ для C25H32N2O• 2HCl•2,5H2O
Высчитано: C 60,72 H 7,95 N 5,66.
Обнаружено: C 60,85 H 8,24 N 5,6.
Пример 23.
3-метил-7-[1-оксо-3-[1-/фенилметил/-пиперидин-4-ил] -пропил]-2,3,4,5-тетрагидро-1Н-3-бензазепиндигидрохлорид
В 40 мл толуола растворяли 1,17 г /2,6 ммоля/ 3-метоксикарбонил -7-[3-/1-бензоилпиперидин-4-ил/1-оксопропил]-2,3,4,5-тетрагидро-1Н-3- бензазепина. К этому раствору добавляли 7 мл этиленгликоля и 10 мг паратолуолсульфокислоты, после чего эту смесь нагревали с обратным холодильником в течение 2,5 ч. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали простым диэтиловым эфиром. Экстракт сушили над безводным сульфатом натрия, после чего растворитель отгоняли. Остаток очищали посредством хроматографии на колонках из силикагеля с образованием 1,22 г /94%/ 7-[2-[2- /1-бензоилпиперидин-4-ил] этил] -1,3-диоксоран-2-ил/-3-метоксикарбонил-2,3,4,5 -тетрагидро-1Н-3-бензазепина. 1,03 г /2,1 ммоля/ полученного выше соединения растворяли в 15 мл сухого тетрагидрофурана после чего к этому раствору добавляли 0,25 г /6,5 ммоля/ алюмогидрида лития. Реакционную смесь нагревали с обратным холодильником в течение 3 ч, затем добавляли воду и фильтровали. Фильтрат сушили над безводным сульфатом натрия, после чего отгоняли растворитель. Остаток растворяли в тетрагидрофуране и к этому раствору добавляли 5,6 мл 1 н раствора HCl, после чего смесь перемешивали в течение 14,5 ч. при комнатной температуре. Реакционную смесь подщелачивали разбавленным водным раствором гидроксида натрия, а затем экстрагировали дихлорметаном. Раствор экстракта сушили над безводным сульфатом натрия, после чего растворитель отгоняли. Остаток растворяли в метаноле и раствор обрабатывали хлороводородом с образованием дигидрохлорида, который затем перекристаллизовывали из смеси этанола и этилацетата, что позволило получить 0,65 г /67%/ бесцветных игл, температура плавления 190 193oC.
Элементный анализ C26H34N2O•2HCl• H2O
Высчитано: C 64,86 H 7,95 5,82.
Обнаружено: C 64,78 H 7,90 N 5,78.
Пример 24.
2,3-дигидро-6-[1-оксо-3-/пиперидин-4-ил/пропил]-1Н-индол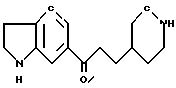
/1/ К смеси 25 г 2,3-дигидро-1-трифторацетилиндола, 25 г хлорангидрида 3-/1-ацетилпиперидин-4-индол/ пропионовой кислоты и 120 мл сероуглерода добавляли 56 г безводного хлорида алюминия при комнатной температуре, после чего эту смесь нагревали с обратным холодильником в течение 30 часов. Реакционную смесь обрабатывали также, как в справочном примере 1-/3/-, в результате чего было получено 9,0 г смеси 6-[3-/1-ацетилпиперидин-4-ил/1-оксопропил] -2,3-дигидро -1-трифторацетил-1Н-индола и 5-[3/-/1-ацетилпиперидин-4-ил/-1- оксопропил] -2,3-дигидро-1-трифторацетил-1Н-индола в виде бледно-желтого маслянистого продукта.
/2/ Маслянистый продукт, полученный в соответствии с вариантом /1/, подвергали такому же взаимодействию, как в примере 1, в результате чего был получен 2,3-дигидро-6-[1-оксо-3-/пиперидин-4-ил-пропил] -1 Н- индолдигидрохлорид. Смесь этого дигидрохлорида и 2,3-дигидро-5-[1-оксо-3-/пиперидин-4-ил/пропил] -1Н-индолдигидрохлорида дважды перекристаллизовывали из смеси метанола и этилацетата с образованием 2,5 г дигидрохлорида указанного в заголовке соединения в виде бесцветного порошка, температура плавления 146 148oC. Полученное таким образом порошкообразное соединение растворяли в воде, показатель pH которой доводили до 10 с помощью 10% раствора гидроксида натрия, и экстрагировали дихлорметаном. Раствор экстракта сушили над безводным сульфатом натрия, а растворитель отгоняли при пониженном давлении, что позволило получить 1,8 г указанного в заголовке соединения в виде бледно-желтого маслянистого продукта.
Элементный анализ: для C16H22N2O
Высчитано: C 74,38 H 8,58 N 10,84.
Обнаружено: C 74,32 H 8,66 N 10,74.
Пример 25.
2,3-дигидро-6-[1-оксо-3-[1-/фенилметил/- пиперидин-4-ил] -пропил-1Н-инжолфумарат
При выполнении методики, описанной в примере 13, с использованием 0,5 г соединения, полученного в соответствии с примером 24. Было получено 0,55 г указанного в заголовке соединения в виде бесцветных кристаллов, температура плавления 157 158oC.
Элементный анализ для C23H28N2O• C4H4O4
Высчитано C 69,81 H 6,94 N 6,03.
Обнаружено C 69,65 H 6,87 N 5,76.
Пример 26.
9[1-оксо-3-/пиперидин-4-ил/пропил] 1,2,3,4,5,6-гексагидро-1-бензазоцин
При выполнении методики, описанной в справочном примере 2-/2/, с использованием 1-этоксикарбонил-1,2,3,4,5,6-гексагидро-1- бензазоцина, был получен остаток. Этот остаток подвергали такому же взаимодействию, что и в примере 1, в результате чего было получено указанное в заголовке соединение в виде бледно-желтого маслянистого продукта.
Элементный анализ для C19H28N2O
Высчитано: C 75,95 H 9,39 N 9,33.
Обнаружено: C 75,73 H 9,38 N 9,10.
Пример 27.
9-[1-оксо-3-[1-/фенилметил/пиперидин-4-ил] пропил] -1,2,3,4,5,6- гексагидро-1-бензазоцинфумарат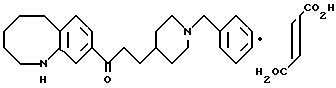
При выполнении методики, описанной в примере 13, с использованием 9-[1-оксо-3-/пиперидин-4-ил/пропил] 1,2,3,4,5,6-гексагидро-1-бензазоцина, было получено указанное в заголовке соединение в виде бесцветных кристаллов.
Элементарный анализ для C26H34N2O • C4H4O4
Высчитано: C 71,12 H 7,56 N 5,53.
Обнаружено: C 70,98 H 7,61 N 5,42.
Пример 28.
1-ацетил-8-[1-оксо-3-[1-/фенилметил/пиперидин-4-ил] -пропил] -2,3,4, 5-тетрагидро-1H-1-бензазепин
При выполнении методики, описанной в примере 16, с использованием 0,3 г 8[1/оксо-3[1-фенилметил/пиперидин-4-ил] пропил] -2,3,4,5 тетрагидро-1H-1-бензазепин, который представляет свободное основание соединения, полученного в соответствии с примером 19, соединение N 16, было получено 0,21 г указанного в заголовке соединения в виде бесцветного порошка, температура плавления 115 116oC.
Элементный анализ для C27H34N2O2
Высчитано C 77,48 H 8,19 N 6,69.
Обнаружено C 77,21 H 7,98 N 6,56.
Пример 29.
3,4-дигидро-6-[1-оксо-3-пиперидин-4-ил/пропил] -2H-1-бензотиопирангидрохлорид
При выполнении, описанной в примере 1, с использованием 2,5 г соединения, полученного в соответствии со справочным примером 12, было получено 2,4 г указанного в заголовке соединения в виде бесцветного порошка, температура плавления 196 199oC.
Элементный анализ для C24H29NOS•HCl
Вычитано: C 62,65 H 7,42 N 4,30.
Обнаружено: C 62,61 H 7,33 N 4,27.
Пример 30.
4,3-дигидро-6-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] -пропил]-2H-1-бензотиопирангидрохлорид
При выполнении методики, описанной в примере 2, с использованием 0,83 г соединения, полученного в соответствии с примером 29, был получен 1,0 г указанного в заголовке соединения в виде бесцветного порошка, температура плавления 186 188oC.
Элементный анализ для C24H29NOS•HCl
Высчитано C 69,29 H 7,27 N 3,37.
Обнаружено C 69,31 H 7,22 N 3,27.
Пример 31.
8-[1-оксо-3-/пиперидин-4-ил/пропил] -2,3,4,5- тетрагидро-1H-2-бензазепиндигидрохлорид /II/ и 7-[1-оксо-3-/пиперидин -4-ил/-пропил]-2,3,4,5-тетрагидро-1H-2-бензазепиндигидрохлорид /B/
При выполнении методики, описанной в справочном примере 1, с использование 5,0 г 2-ацетил-2,3,4,5-тетрагидро-1H-2бензазепина, было получено 4,7 г вязкого масла.
При выполнении методики, описанной в примере 1, с использованием 4,5 г указанного масла, было получено 3,3 г бледно-желтого твердого вещества. Это твердое вещество перекристаллизовывали из метанола с образованием указанного в заголовке соединения /A/ в виде бесцветного порошка, температура плавления > 300oC.
Элементный анализ для C18H26N2O•2HCl
Высчитано: C 60,17 H 7,85 7,80.
Обнаружено: C 59,95 H 7,98 7,77.
Соединение (B) получалось в виде аморфного порошка с помощью концентрирования маточной жидкости, полученной при перекристаллизации соединения (A), упомянутого выше.
Пример 32.
8-[1-оксо-3-[1-/фенилметил/пиперидин-4-ил] пропил-] -2-/фенил метил/-2,3,4,5-тетрагидро-1H-2-бензазепиндигидрохлорид /A/ и 9-[1- оксо-3-[1-/фенилметил/пиперидин-4-ил] пропил] -2,3,4,5-тетрагидро-1H-2- бензазепингидрохлорид /B/
При выполнении методики, описанной в примере 2, с использованием 1,5 г 8-[1-оксо-3-/пиперидин-4-ил/пропил] -2,3,4,5-тетрагидро- 1H-2-бензазепиндигидрохлорида, полученного в соответствии с примером 31, было получено 0,5 г указанного в заголовке соединения /A/ в виде аморфного порошка и 0,1 г указанного в заголовке соединения /B/ в виде аморфного порошка.
8-[1-оксо-3-/1-/фенилметил/пиперидин-4- ил/пропил] -2-/фенилметил/-2,3,4,6-тетрагидро-1H-2-бензазепиндигидрохлорид /A/.
Элементный анализ для C32H38N2O•2HCl
Высчитано: C 71,23 H 7,47 N 5,19.
Обнаружено: C 66,72 H 7,69 N 6,01.
8-[1-оксо-3-/1-фенилметил/пиперидин-4-ил-пропил] -2,3,4,5-тетрагидро-1H-2-бензазепиндигидрохлорид /B/
Элементный анализ для C25H32N2O•2HCl
Высчитано: C 66,81 H 7,62 N 6,23.
Обнаружено: C 66,72 H 7,69 N 6,01.
Пример 33.
8-хлор-5-[1-оксо-3-[1-/фенилметил/пиперидин-4-ил]пропил] -1,2,3,4-тетрагидроизохинолиндигидрохлорид
К расчету 5,99 г /13,22 ммоля/ соединения, полученного в справочном примере 14, в 198 мл метанола добавляли 99 мл 1 н водного раствора NaOH. Эту смесь перемешивали при температуре 60oC в течение 5 ч. После удаления метанола при пониженном водный остаток экстрагировали дихлорметаном. Экстракты сушили над безводным сульфатом натрия, а растворитель отгоняли. Остаток очищали посредством хроматографии на колонках из силикагеля /элюент: смесь этилацетата и метанола 7:3 / в объемном отношении// с образованием 2,59 г 5- [3-/1-бензоилпиперидин-4-ил/-1-оксопропил] -8-хлор-1,2,3,4- тетрагидроизохинола.
К раствору 1,23 г /3,0 ммоля/ полученного выше соединения в 10 мл метанола добавляют 0,75 мл 4 н раствора HCl в метаноле при температуре 5oC, а растворитель отгоняли. К оставшемуся маслу добавляли 60 мл растворителя, 0,21 мл этиленгликоля и 57 мг моногидрата паратолуолсульфокислоты. Эту смесь нагревали с обратным холодильником в течение 2 ч. К реакционной смеси добавляли насыщенный водный раствор NaHCO3 и экстрагировали дихлорметаном. Экстракты сушили над безводным сульфатом натрия, после чего растворитель удаляли при пониженном давлении. Остаток очищали посредством хроматографии на колонках из силикагеля /элюент смесь этилацетата и метанола 7 3/ в объемном отношении/ с образованием 1,31 г 5-[2-2-/1-бензолпиперидин-4-ил/этил]-1,3- диоксоран-2-2ил]-8-хлор-1,2,3,4-тетрагидроизохинолина.
В атмосфере азота к раствору 455 мг /1,0 мг/ полученного выше соединения в 10 мл сухого тетрагидрофурана добавляли 127 мкл хлортриметилсилана при температуре 5oC, после чего смесь перемешивали при комнатной температуре в течение 1 ч. Затем к реакционной смеси добавляли 190 мг алюмогидрида лития и смесь нагревали с обратным холодильником в течение 2,5 ч. К смеси добавляли воду и полученный осадок удаляли фильтрованием. Фильтрат сушили над безводным сульфатом натрия, а растворитель удаляли при пониженном давлении. Смесь остатка и 5 мл 1н водного раствора HCl в 5 мл тетрагидрофурана нагревали при температуре 60oC в течение 3 ч. Реакционную смесь подщелачивали разбавленным водным раствором NaOH, а затем экстрагировали дихлорметаном. Экстракт сушили на безводным сульфатом натрия, после чего растворитель удаляли при пониженном давлении, что позволило получить 200 мг бесцветного масла, которое обрабатывали 4 н раствором HCl в метаноле /2 эквивалента/, в результате чего было получено 205 мг указанного в заголовке соединения в виде аморфного порошка.
Элементный анализ для C24H29ClN2O•2HCl
Высчитано: C 61,35 H 6,65 N 5,96.
Обнаружено: C 61,42 H 6,69 N 5,91.
Пример 34.
7,8-дибром-8-[1-оксо-3-(фенилметил)пиперидин-4- ил)пропил)-2,3,4,5-тетрагидро-1H-бензазепина гидрохлорид.

К раствору 0,73 г соединения 16 (свободного от соли), полученного в примере 19 в уксусной кислоте (50 мл) и воде (10 мл) добавляют бром (0,68 г) при охлаждении льдом. После перемешивания в течение 1 ч к раствору добавляют 10% водный гидроксид натрия до тех пор пока не исчезнет желтое окрашивание. Экстрагируют продукт дихлорметаном и экстракт промывают водой, сушат и выпаривают в вакууме до получения продукта в виде масла.
Остаток обрабатывают этанольным раствором соляной кислоты (два эквивалента) и получившееся твердое вещество перекристаллизовывают из эфира метанового спирта с получением 0,87 г бесцветного порошка с Т.пл. 124 - 126oC.
Элементный анализ: C25H30Br2N2O•2HCl
Вычислено: C 49,45; H 5,31; N 4,61.
Найдено: C 49,33; H 5,21; N 4,68.
Пример состава 1.
/1/ 6-[3-[1-/фенилметил/пиперидин-4-ил] -1 оксопропил] -1,2,3,4-тетрагидрохинолиндигидрохлорид/соединение, полученное в соответствии с примером 2/ 1 г
/2/ лактоза 197 г
/3/ кукурузный крахмал 50 г
/4/ стеарат магния 2 г
Ингредиенты /1/, /2/ и 20 г кукурузного крахмала смешивали друг с другом и полученную смесь гранулировали вместе с пастой, изготовленной из 15 г кукурузного крахмала и 25 мл воды. К этому гранулированному продукту добавляли 15 г кукурузного крахмала и ингредиент /4/, после чего полученный состав подвергали прямому прессованию, в результате чего было изготовлено 2000 таблеток, каждая из которых имела диаметр 3 мм и содержала 0,5 мг ингредиента /1/.
Пример состава 2.
/1/ 6-[3-[1-/фенилметил/пиперидин-4- ил] -1-оксопропил] 1,2,3,4-тетрагидрохинолингидрохлорид /соединение, полученное в соответствии с примером 2/ 2 г
/2/ лактоза 196 г
/3/ кукурузный крахмал 50 г
/4/ стеарат магния 2 г
Ингредиенты /1/, /2/ и 20 г кукурузного крахмала смешивали друг с другом и полученную смесь гранулировали вместе с пастой, изготовленной из 15 г кукурузного крахмала и 25 мл воды. К этому гранулированному продукту добавляли 15 г кукурузного крахмала и ингредиент /4/, после чего полученный состав подвергали прямому прессованию, в результате чего было изготовлено 2000 таблеток, каждая из которых имела диаметр 5 мм и содержала 1 мг ингредиента /1/.
Пример состава 3.
/1/ 8-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] пропил] 2,3,4,5-тетрагидро-1H- 1-бензазепинфумарат /соединение, полученное в соответствии с примером 19, соединение N 16/ 1 г
/2/ лактоза 197 г
/3/ кукурузный крахмал 50 г
/4/ стеарат магния 2 г
Ингредиенты /1/, /2/ и 20 г кукурузного крахмала смешивали друг с другом и полученную смесь гранулировали вместе с пастой, изготовленной из 15 г кукурузного крахмала и 25 мл воды. К ж этому гранулированному продукту добавляли 15 г кукурузного крахмала и ингредиент /4/, после чего полученный состав подвергали прямому прессованию, в результате чего было изготовлено 1000 таблеток, каждая из которых имела диаметр 3 мм и содержала 1,0 мг ингредиента /1/.
Пример состава 4.
/1/ 7-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил] пропил] 2,3,4,5-тетрагидро-1H-3-бензазепиндигидрохлорид /соединение, полученное в соответствии с примером 22/ 2 г
/2/ лактоза 196 г
/3/ кукурузный крахмал 50 г
/4/ стеарат магния 2 г
Ингредиенты /1/, /2/ и 20 г кукурузного крахмала смешивали друг с другом и полученную смесь гранулировали вместе с пастой, изготовленной из 15 г кукурузного крахмала и 25 мл воды. К этому гранулированному продукту добавляли 15 г кукурузного крахмала и ингредиент /4/, после чего полученный состав подвергали прямому прессованию, в результате чего было изготовлено 2000 таблеток, каждая из которых имела диаметр 5 мм и содержала 1 мг ингредиента /1/.
Пример состава 5.
8-[1-оксо-3-[1-/фенилметил/пиперидин-4- ил]пропил]-2,3,4,5-тетрагидро-IH-1-бензазепинфумарат /соединение, полученное в соответствии с примером 19, соединение N 16/ и 1,25 г маннита растворяли в 500 мл дистиллированной воды, показатель pH этого раствора доводили до 5,6 7 с помощью 0,1 н раствора NaOH и общее количество раствора доводили до 1000 мл. Полученный таким образом раствор стерилизовали фильтрованием через фильтр с размером ячеек 0,2 мкм. Полученный раствор разливали в 1 мл ампулы, в результате чего было изготовлено 1000 ампул.
Экспериментальный пример.
Ингибирующая активность в отношении холинэстеразы соединения по настоящему изобретению определяли с помощью /ацетил-3H/ ацетил-холина. В качестве источника холин-эстеразы использовали фракцию гомогената коры головного мозга самцов крыс вида "Wistar", к которой добавляли /ацетил -[3H]/-ацетилхолин и соединение по настоящему изобретению, представляющее соответственно субстрат и испытуемое вещество, после чего эту смесь инкубировали в течение 30 мин. После окончания реакции добавляли сцинтиллятор на основе толуола и после встряхивания производили определение продукта реакции /3H/ уксусной кислоты, который переносился на слой толуола, для чего использовали сцинтилляционный счетчик, позволяющий установить активность холинэстеразы.
Ингибирующую активность в отношении холинэстеразы со стороны испытуемого соединения выражали в виде концентрации, обеспечивающей ингибирование 50% холинэстеразы /IC50/. При помощи аналогичного метода также определяли ингибирующую активность физостигмина в отношении холинэстеразы.
Полученные результаты представлены ниже.
Соединение /I/, NN примеров Ингибирующая активность в отношении ацетилхолинэстеразы /IC 50/ мкм
2 0,014
1 2
3 0,12
4 0,010
6-A 0,54
6-B 0,054
8-A 0,024
8-B 0,036
10 0,16
13 0,020
14 0,010
15 0,068
16 0,014
19 4 0,076
19-5 0,059
19-7 0,050
19-8 0,016
19-9 0,064
19-11 0,011
19-12 0,022
19-13 0,029
19-14 0,047
19-15 0,028
19-16 0,102
19-17 0,081
19-20 0,125
19-21 0,145
21 0,028
22 0,0076
23 0,0065
25 0,113
27 0,127
физостигмин 0,22
Приведенные выше результаты показывают, что соединение по настоящему изобретению обладает великолепной ингибирующей активностью в отношении холинэстеразы.
Соединения по настоящему изобретению воздействуют на центральную нервную систему млекопитающих и проявляют сильную ингибирующую активность в отношении холинэстеразы.
Поэтому данное соединение можно использовать для профилактики и лечения старческого слабоумия, болезни Альцгеймера, хореи Гентингтона и других заболеваний, связанных с нарушением функции мозга, и оно имеет важное значение в качестве лекарственного средства.























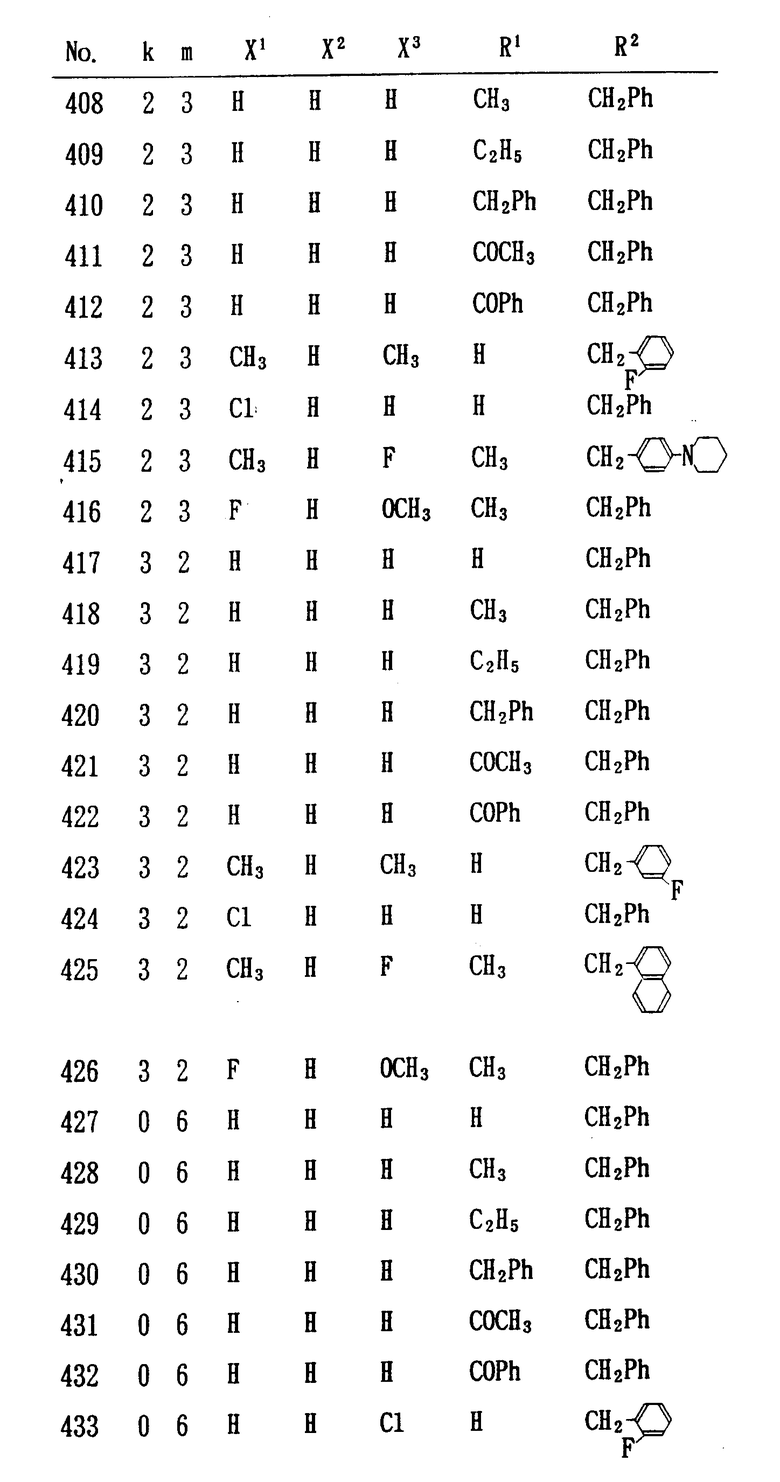

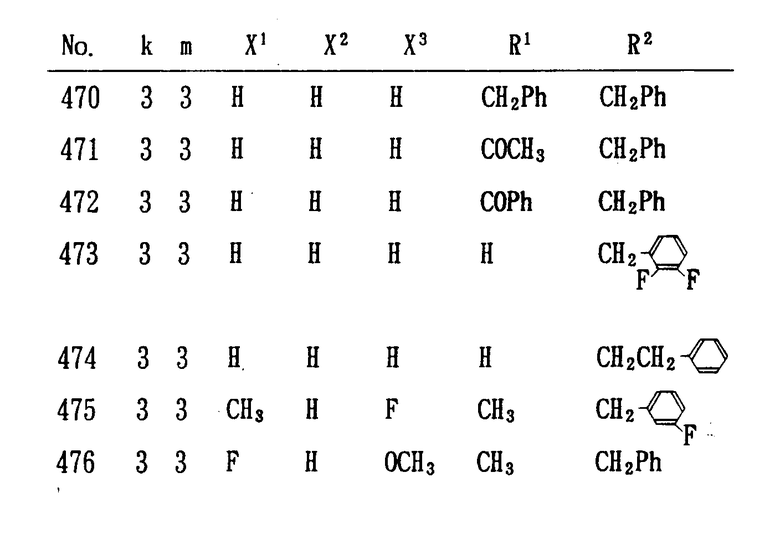




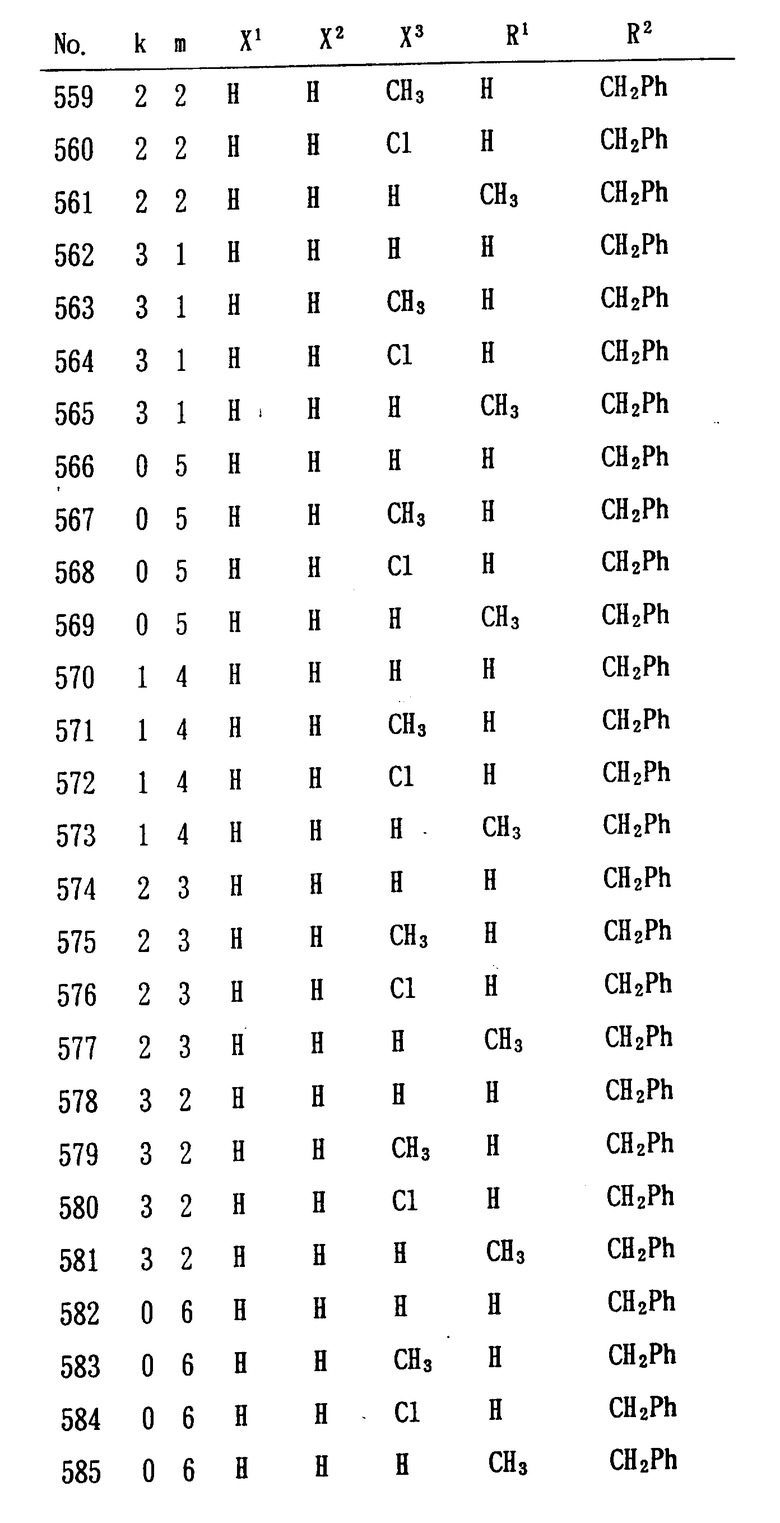

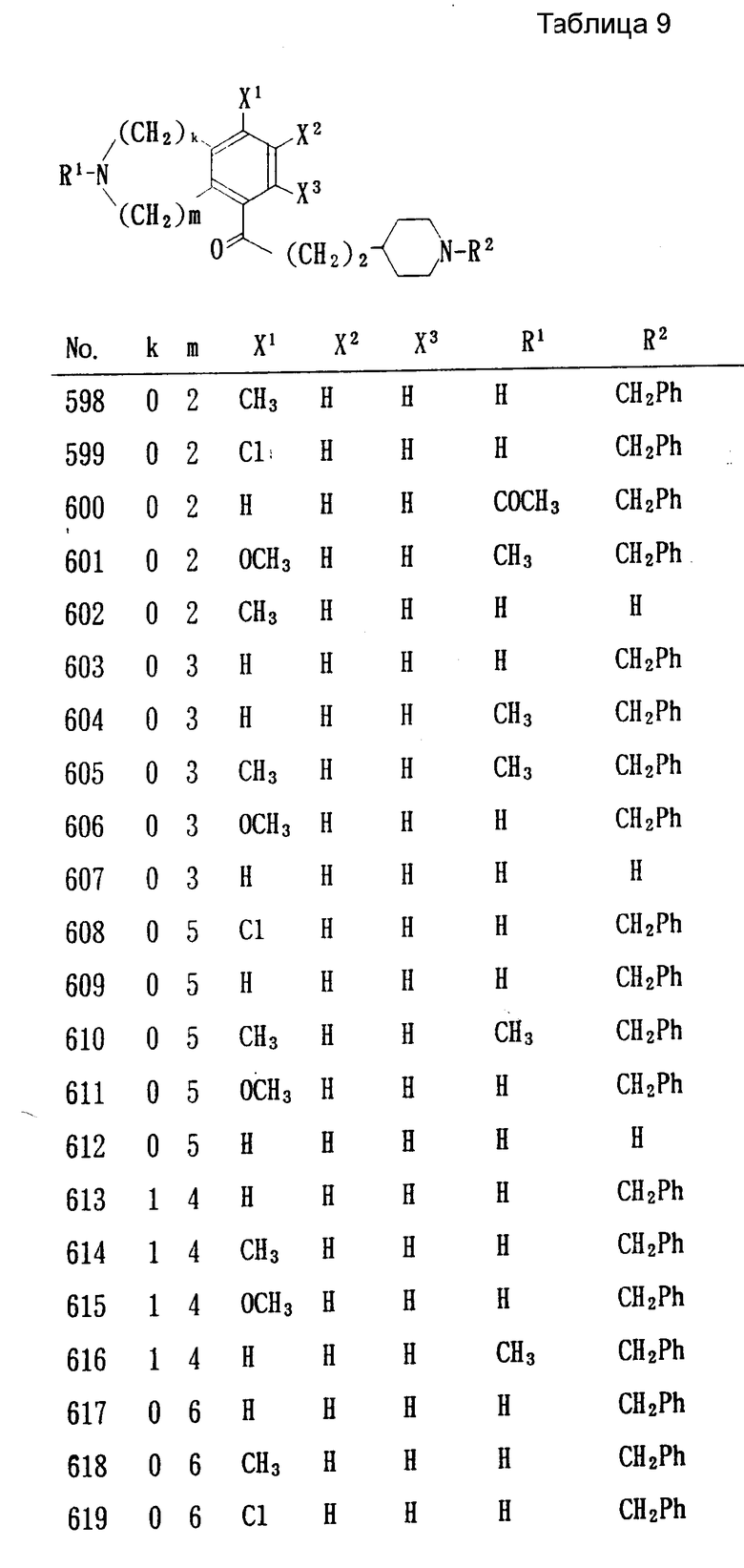




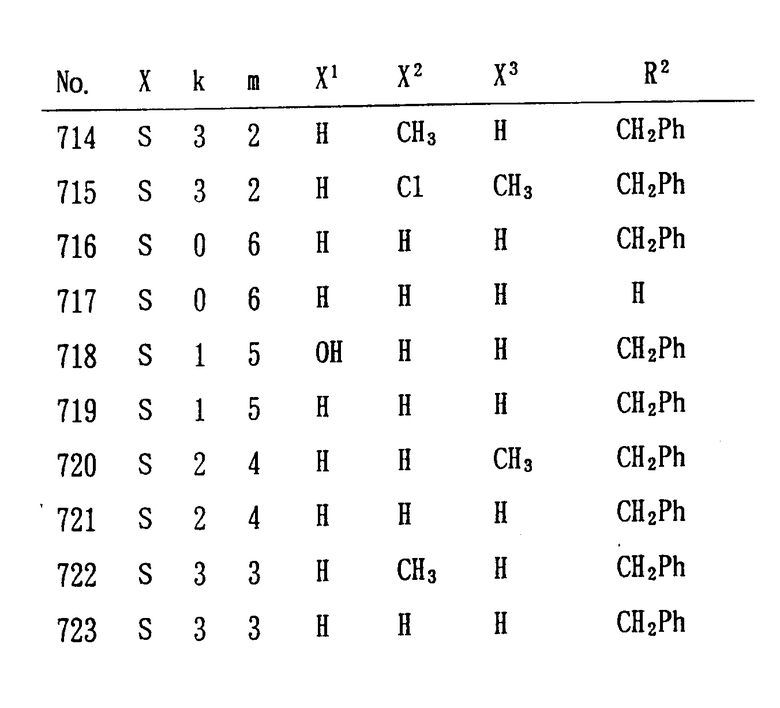



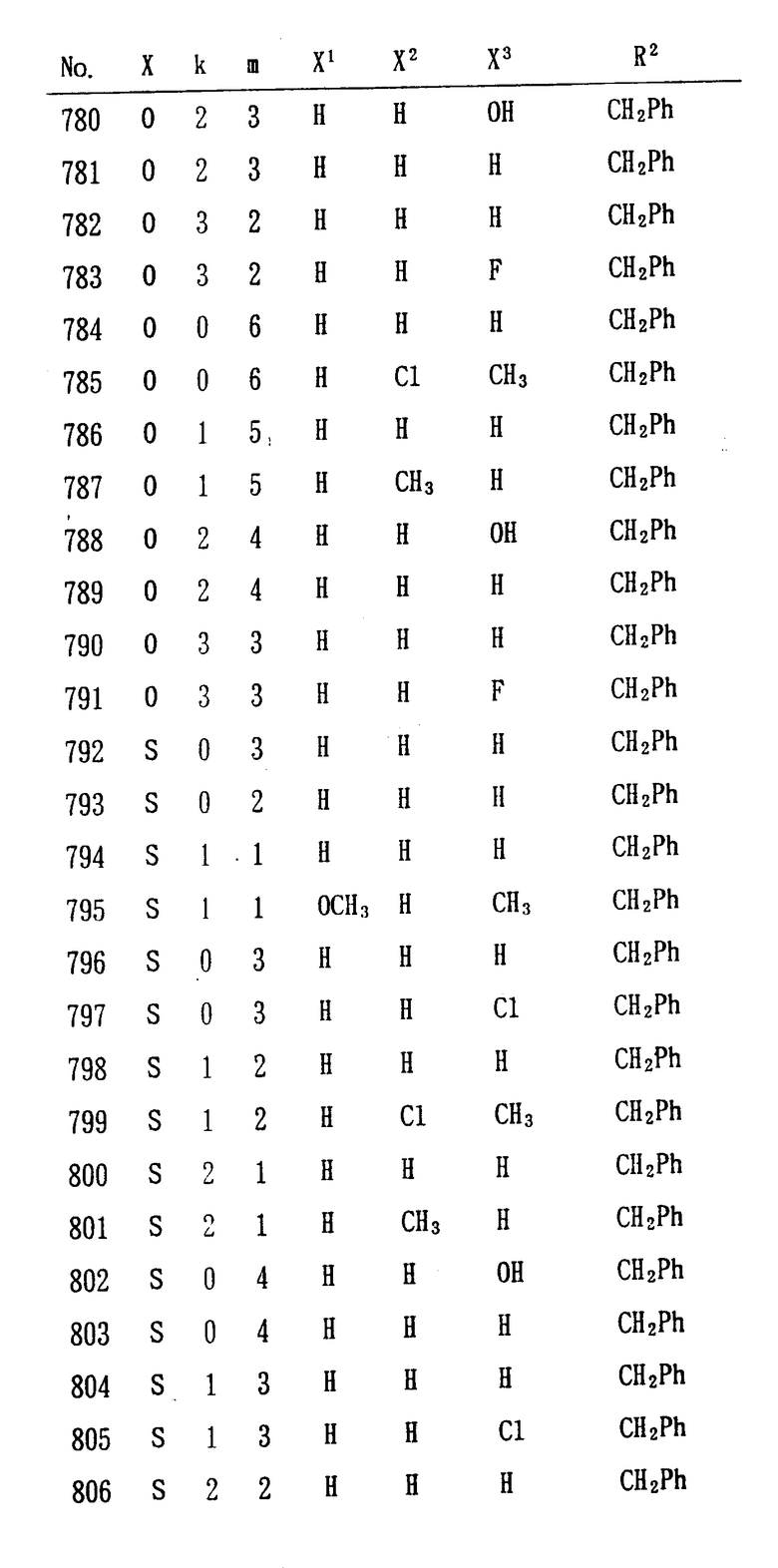






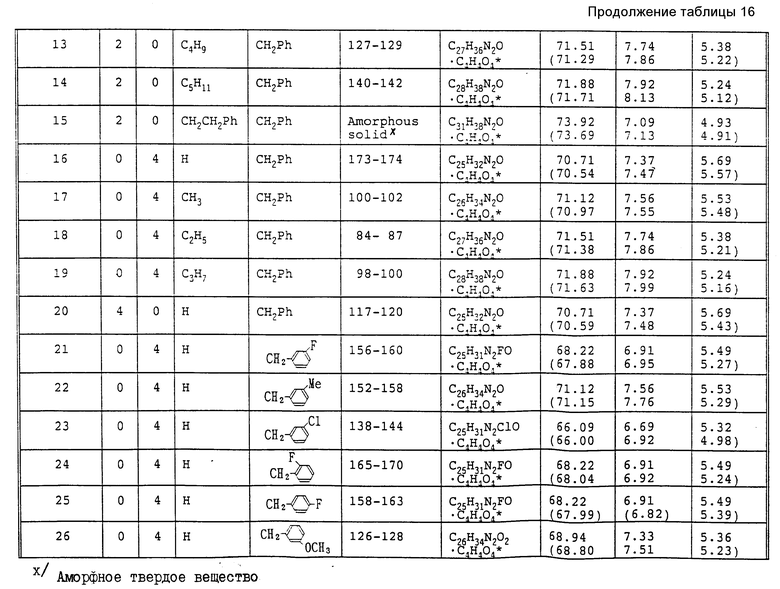


Использование: в медицине в качестве ингибиторов холинэстеразы. Сущность изобретения: Продукты: конденсированные гетероциклические соединения ф-лы 1, где H - O, S или R1 - N  , где R1 - H, C1-C7 - алкил, C7-C10-аралкил, C2-C8 - алкилкарбонил, R2 - H, C7-C10 -аралкил, А - бензольное кольцо, K число от 0 до 3, m - от 0 до 5, n = 2 или его соль. Реагент 1: соединение ф-лы II, где Y - галоген, Z - N - защитная группа. Реагент 2: соединение ф-лы III. 3 с. и 28 з.п. ф-лы, 17 табл.
, где R1 - H, C1-C7 - алкил, C7-C10-аралкил, C2-C8 - алкилкарбонил, R2 - H, C7-C10 -аралкил, А - бензольное кольцо, K число от 0 до 3, m - от 0 до 5, n = 2 или его соль. Реагент 1: соединение ф-лы II, где Y - галоген, Z - N - защитная группа. Реагент 2: соединение ф-лы III. 3 с. и 28 з.п. ф-лы, 17 табл.  .
.

в которой X кислород, сера или
где R1 водород, C1 C7-алкил, C7 - C1 0-аралкил или C2 C8-алкилкарбонильная группа;
R2 водород или C7 C1 0-аралкильная группа, которая может быть замещена C1 C4-алкил, C1 - C4-алкокси, галоген, нитро, гидроксил или C1 - C4-алкиламинокарбонилоксигруппа;
кольцо A бензольное кольцо, которое может быть замещено галогеном;
k 0 3, целое число;
m 0 5, целое число;
n 2,
или его соль. , где R1 имеет значения, указанные в п.1.
, где R1 имеет значения, указанные в п.1.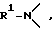 где R1 имеет значения, указанные в п. 1, k 0 2, m 2 5, n 2 и R2 водород или C7 C1 0-аралкильнаяя группа, которая может быть замещена C1 C4-алкилом, галогеном, нитрогруппой или C1 C4-алкоксильной группой.
где R1 имеет значения, указанные в п. 1, k 0 2, m 2 5, n 2 и R2 водород или C7 C1 0-аралкильнаяя группа, которая может быть замещена C1 C4-алкилом, галогеном, нитрогруппой или C1 C4-алкоксильной группой. является
является
13. Соединения по п.1, в которых группа является
является
14. Соединения по п.1, в которых группа является
является
15. Соединения по п.1, в которых группа является
является
16. Соединения по п.1, в которых группа является
является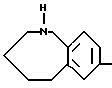
17. Соединения по п.1, в которых группа является
является
или
где R3 водород или C1 C3-алкильная группа;
n 2;
R2 бензильная группа.
в которой X кислород, сера или
где R1 водород, C1 C7-алкил, C7 - C1 0-аралкил или C2 C8-алкилкарбонильная группа;
R2 водород или C7 C1 0-аралкильная группа, которая может быть замещена C1 C4-алкилом, C1 - C4-алкокси, галогеном, нитро, гидроксильной или C1 - C4-алкиламинокарбонилоксигруппой;
кольцо A бензольное кольцо, которое может быть замещено галогеном;
k 0 3; m 1 5; n 2,
или их солей, отличающийся тем, что осуществляют взаимодействие соединения формулы III
в которой все символы имеют указанные значения,
или его соли с соединением формулы II
в которой Y галоген;
Z группа, защищающая аминогруппу; n 2,
или его солью и удаление защитной группы с последующим в случае необходимости взаимодействием полученного соединения, в котором R2 - водород, с соединением формулы R2' Y', в которой R2' - C7 C1 0-аралкильная группа, которая может быть замещена C1 C4-алкилом, C1 C4-алкокси, галогеном, нитро, гидроксильной или C1 C4-алкиламинокарбонилоксигруппами, а Y' отщепляемая группа, или взаимодействием полученного соединения, в котором X -
с соединением формулы R1' Y', в которой R1' C1 - C7-алкил, C7 C1 0-аралкил или C2 - C8-алкилкарбонильная группа, а Y' имеет указанные значения.
Приоритет по пунктам:
22.11.90 по пп.3, 12, 15 и 16;
14.01.91 по пп.2, 13, 14 и 17;
21.08.91 по пп.18, 22, 23 и 27;
24.09.91 по пп.1, 4 11, 19 21, 24 26, 28 31.
| Патент США N 4064255, кл.A 61K 31/455, 1977 | |||
| Патент США N 4208417, кл.A 61K 31/445, 1980 | |||
| Патент США N 4849431, кл.A 61K 31/445, 1989 | |||
| Патент США N 4895841, кл.A 61K 31/55, 1990 | |||
| УСТРОЙСТВО ДЛЯ РАЗДЕЛЕНИЯ ФАРФОРОВЫХ БЛЮДЕЦ ПОСЛЕ ОБЖИГА | 0 |
|
SU330026A1 |
| КОРМОРАЗДАТЧИК | 0 |
|
SU378207A1 |
Авторы
Даты
1997-11-10—Публикация
1991-11-21—Подача