Изобретение относится к лекарственным препаратам на носителе, которые обладают повышенной скоростью растворения.
В фармацевтике в течение некоторого промежутка времени было принято размалывать или сильно измельчать плохо растворимые лекарственные препараты для улучшения их биофармацевтических свойств благодаря увеличению поверхности препарата.
Дополнительно к этому основному способу за последние годы шагнула вперед техника помола с использованием высоких энергий, которая используется для смесей, содержащих лекарственный препарат и специальные материалы подложки.
Эта технология основывается на двух основных элементах:
1) на использовании мельниц (с одним шаром или множеством шаров, растворомешалки и т.д.), в которых импульс от энергии трения между размалывающим средством и порошком очень высок;
2) на использовании материалов подложки (носителя), которые обеспечивают требуемые физико-химические превращения лекарственного препарата.
Первой целью изобретения в этой технологии помола является полное или частичное превращение лекарственного препарата, первоначально находящего в кристаллическом состоянии, в аморфную форму. Это позволяет изменить кинетику растворения лекарственного препарата, профиль кинетической кривой которого включает значения концентраций при пересыщении, которые значительно выше, чем у лекарственных препаратов в кристаллической форме. Другой целью изобретения в этой технологии помола является улучшение смачиваемости и скорости растворения лекарственного препарата.
В патентах США NN 3966899 и 4036990 указано, что для повышения скорости растворения плохо растворимых лекарственных препаратов используется высокоэнергетический помол смесей лекарственных препаратов и бета-1,4-глюкана, затем следует перевод продукта в аморфную форму, что сопровождается дифрактометрией рентгеновскими лучами.
В патенте Японии N 7986607 в качестве материала подложки, используемого для одновременного помола, применяется бета-циклодекстрин, который используется либо один, либо совместно с другими средами для лекарств, такими как лактоза, фосфат кальция и крахмал, которые присутствуют в смеси при помоле.
Бета-циклодекстрин используется в патенте DE N 3427788 для получения комплексов производных бензимидазола путем размалывания в шаровой мельнице. Использование микрокристаллический целлюлозы раскрыто в Химико-фармакологическом бюллетене 78, 3340-6, 1977, Химико-фармакологическом бюллетене 78, 3419 25, 1978 и Химико-фармацевтическом бюллетене 28, 652-6, 1980, при изучении взаимодействия подложка/лекарственный препарат использовался термический анализ и спектрофотометрия.
В Европейском патенте 129893 раскрыто использование силикагеля и других адсорбентов при помоле с использованием высоких энергий для лекарственных препаратов, таких как гризеофульвин, хлорамфеникол и теофиллин, которые позволяют либо повысить скорость растворения, либо они используются для превращения в аморфную форму.
В патенте США N 4639370 раскрыто использование при совместном помоле полимеров, которые хорошо набухают, но нерастворимы в воде, таких как поливинилпирролидоны с поперечными связями, натрийкарбоксиметилцеллюлоза и декстран с поперечными связями, изученные низкорастворимые лекарственные препараты включают медроксипрогестерон ацетат, гризеофульвин и индометацин.
Во всех указанных патентах, касающихся совместного помола лекарственного препарата с носителем с использованием высоких энергий, все приемы направлены на то, чтобы перемешать компоненты и затем размолоть их вместе при отсутствии влаги в течение времени, необходимого для достижения требуемой аморфности и/или скорости растворения. В некоторых случаях необходимое время помола может быть существенным и достигать 24 ч.
Был открыт способ получения лекарственных препаратов на носителе, основанный на совместном помоле действующего вещества с материалом подложки, который имеет значительные преимущества по отношению к известным способам.
У лекарственного препарата, полученного способом согласно изобретению при равных временах помола, скорость растворения значительно выше и фармокинетика лучше, чем у лекарственных препаратов, полученных известным способом. Кроме того, более короткое время помола достаточно для получения такой же скорости растворения лекарственного препарата, что позволяет снизить расходы, а также получать лекарственные препараты пониженной стабильности, которые могли бы разложиться при более длительном времени помола.
Указанный процесс отличается тем, что:
а) действующее вещество и материал подложки в виде порошка смешиваются и по возможности дегазируются;
б) смесь перемалывается в мельнице, в которой помольная камера насыщена паром одного или более растворителей, способных растворить действующее вещество или адсорбироваться на поверхности материала подложки;
в) по окончании помола продукт высушивается под вакуумом и просеивается для удаления комочков.
Продукт, полученный указанным способом, согласно изобретению характеризуется снижением кристалличности действующего вещества, показателем чего является снижение теплоты плавления, снижением размеров кристаллов до мельчайшего уровня, показателем чего является снижение точки плавления, а также возрастанием скорости растворения и улучшение кинетики растворения.
Характеристики и преимущества лекарственных препаратов на носителе, согласно изобретению, станут более понятны из нижеследующего подробного описания изобретения.
Действующее вещество и материал подложки, оба в виде порошка, смешиваются в твердофазном смесителе. Действующее вещество имеет распределение размеров частиц в пределах 0,01 1000 мкм, предпочтительно 0,01 100 мкм, а материал подложки имеет размер частиц в пределах 0,01 1000 мкм, предпочтительно 1 100 мкм.
Смесь нагревается под вакуумом до температуры, не нарушающей стабильности субстанций, для удаления любых ненужных субстанций, которые могут находиться в смеси.
Указанный нагрев может осуществляться в той же камере, в которой осуществлялся размол.
Полученная таким образом смесь направляется в камеру помола совместно с размалывающим средством. Камера посредством клапана связана с емкостью, содержащей соответствующий растворитель в газовой форме.
Клапан открывается одновременно с началом помола с тем, чтобы впустить в камеру растворитель в газовой фазе.
Альтернативно, впуск растворителя в газовой фазе может осуществляться путем открытия клапана непосредственно сразу после заполнения камеры смесью, а непосредственно помол начинается только после некоторого промежутка времени, достаточного для насыщения камеры.
Помол проводится в течение 0,10 48 ч, предпочтительно 0,25-4 ч,
Полученный продукт имеет размер частиц 0,01 100 мкм.
По окончании помола смесь перемещается в печь под вакуумом или другой аналогичный аппарат и высушивается при температуре, достаточной для сохранения стабильности субстанции смеси.
После высушивания продукт просеивается для удаления комочков. Мельница, используемая в способе, согласно изобретению создает высокий импульс энергии между размалывающим средством и порошком. Примерами, не ограничивающими типов применяемых мельниц, могут служить: ротационная мельница, вибромельница с большой частотой вибрации, шаровая мельница, вальцовая мельница, растворомешалка, планетарная мельница и т.д.
Многие лекарственные препараты можно получать заявленным способом, такие как противовоспалительные препараты, анальгетики, транквилизаторы, седативные препараты, оральные противоопухолевые препараты и т.д. Лекарственные препараты, которые можно получать способом согласно изобретению, следующие: гризеофульвин, пироксикам, диацереин, дилтиазем, мегестрол ацетат, нифедипин, ницерголин и т.п. кетопрофен, напроксен, диклофенак, изопрофен, лоразепам, оксазепам и т.д.
В качестве растворителей выбраны такие, которые могут адсорбироваться на материале подложки, и такие, которые могут выступать в роли растворителей для действующего вещества.
Например, в качестве растворителей, которые могут быть использованы в настоящем изобретении, являются вода, метиленхлорид, хлороформ, метанол, этанол, изопропанол и их смеси.
В качестве материала подложки, пригодного для совместного размола в настоящем изобретении, могут быть использованы:
полимеры с перекрестными связями, набухающие в воде, такие как кросповидон, полимерный циклодекстрин с перекрестными связями, натрийкарбоксиметил крахмал, декстран и т.д. с перекрестными связями;
водорастворимые комплексные агенты, такие как циклодекстрин и его производные,
неорганические материалы с развитой поверхностью и/или высокой пористостью, такие как силикагель, двуокись титана, окислы алюминия и т.д.
гидрофильные линейные полимеры, такие как поливинилпирролидон, целлюлоза или ее производные и т.д.
Массовое соотношение материала подложки к лекарственному препарату находится в пределах 100:1 и 1:10 предпочтительно между 10:1 и 1:1.
Характеристики продуктов, получаемых при использовании высокоэнергетических размалывающих технологий, могут быть определены различными способами, такими как:
определение скорости растворения;
определение кинетики растворения;
метод дифференциальной сканирующей калориметрии для измерения теплоты плавления, которая связана с остаточной кристалличностью лекарственного препарата;
метод дифференциальной сканирующей калориметрии иди другой термоаналитический способ для оценки величины снижения точки расплава, которая связана со снижением размеров кристаллов лекарственного препарата до минимального значения.
Заявленный способ имеет ряд преимуществ по сравнению со способами, известными из предшествующего уровня техники.
Во-первых, более короткое время вполне достаточно для достижения требуемой степени измельчения кристаллов лекарственного препарата, что в последствии приводит к значительному снижению затрат энергии. Кроме того, более короткое время помола позволяет размалывать менее стабильные лекарственные препараты, которые могут разрушиться при более длительном времени размола.
При равном времени размола продукты, подученные заявленным способом, при сравнении с полученными известными способами, имеют следующие преимущества, полученные в совокупности или в отдельности:
более высокую степень аморфизации (меньшую остаточную кристалличность лекарственного препарата);
большее снижение размеров кристаллических остатков лекарственного препарата, до минимального уровня, как показано, путем большего уменьшения точки плавления лекарственного препарата;
в случае использования в качестве материала подложки неорганических полимерных материалов с перекрестными связями или пористых достигается большая концентрация лекарственного препарата на поверхностном слое материала подложки;
степень растворения и/или кинетика растворения значительно выше.
Лекарственные препараты на носителе согласно изобретению могут быть использованы для приготовления различных фармацевтических форм, таких как таблетки и капсулы (для непосредственного (немедленного) приема и приема по схеме), суспензии, чрескожные пленки и т.д.
Для приготовления таблеток, которые будут использованы немедленно, или капсул лекарственные препараты смешиваются с наполнителями, которые обычно используются в фармацевтической промышленности, такими как лактоза, крахмал, кальцийфосфат, микрокристаллическая целлюлоза и т.д.
Для приготовления таблеток или капсул, которые будут применяться по схеме, указанные лекарственные препараты смешиваются с полимерами, такими как метилцеллюлоза и ее производные, полиметилметакрилаты, этилцеллюлоза и т.д.
Ниже приводятся примеры получения лекарственных препаратов на носителе согласно изобретению для его иллюстрации. Характеристика полученных продуктов дана в конце примеров.
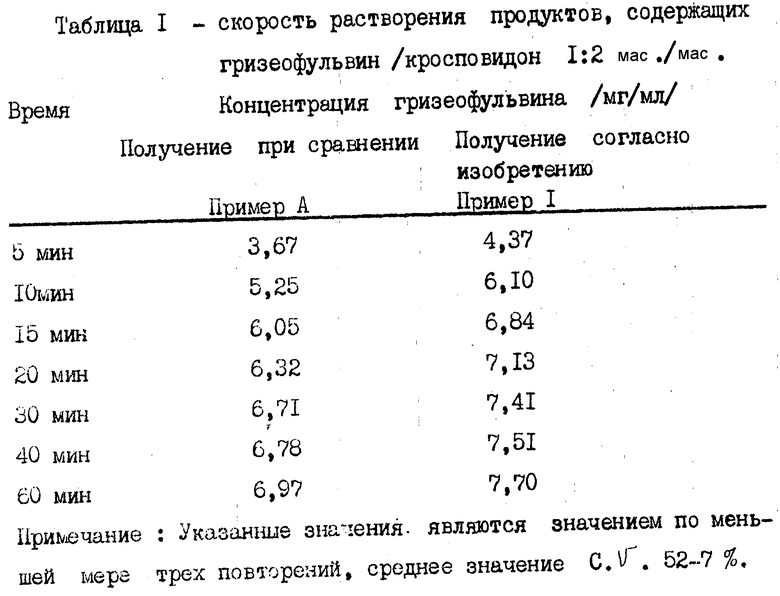
Пример 1. 4г гризеофульвина и 8 г кросповидона (Коллидон-СЛ, БАСФ) просеивались через сито 60 (отверстий на один линейный дюйм) и смешивались в течение 10 мин. Смесь помещалась в помольную камеру высокоэнергетической коллоидной мельницы вместе со средством для помола. Клапан, соединяющий мельницу с емкостью с метиленхлоридом, открывался и помольная камера начинала заполняться метиленхлоридом в парообразном состоянии. Затем проводился совместный помол в течение 2 ч, в течение этого времени поддерживались условия насыщения камеры паром.
По окончании помола полученный порошок имел размер частиц в пределах от 1 до 100 мкм. Затем порошок высушивался при температуре 30oC под вакуумом в течение 3 ч и просеивался через сито 60.
Пример 2. 4 г гризеофульвина и 4 г кросповидона просеивались через мельницу с числом отверстий 60 и перемешивались в течение 10 мин. Затем смесь помещалась в помольную камеру высокоэнергетической коллоидной мельницы совместно со средством для помола. Помольная камера насыщалась паром из емкости с метиленхлоридом, которая соединена с мельницей посредством клапана. Затем проводился помол в течение 2 ч, в течение этого времени поддерживались условия насыщения камеры паром.
По окончании помола полученный порошок имел размер частиц в пределах от 1 до 100 мкм. Затем порошок высушивался при температуре 30oC под вакуумом в течение 3 ч, просеивался через сито 60 и перемешивался.
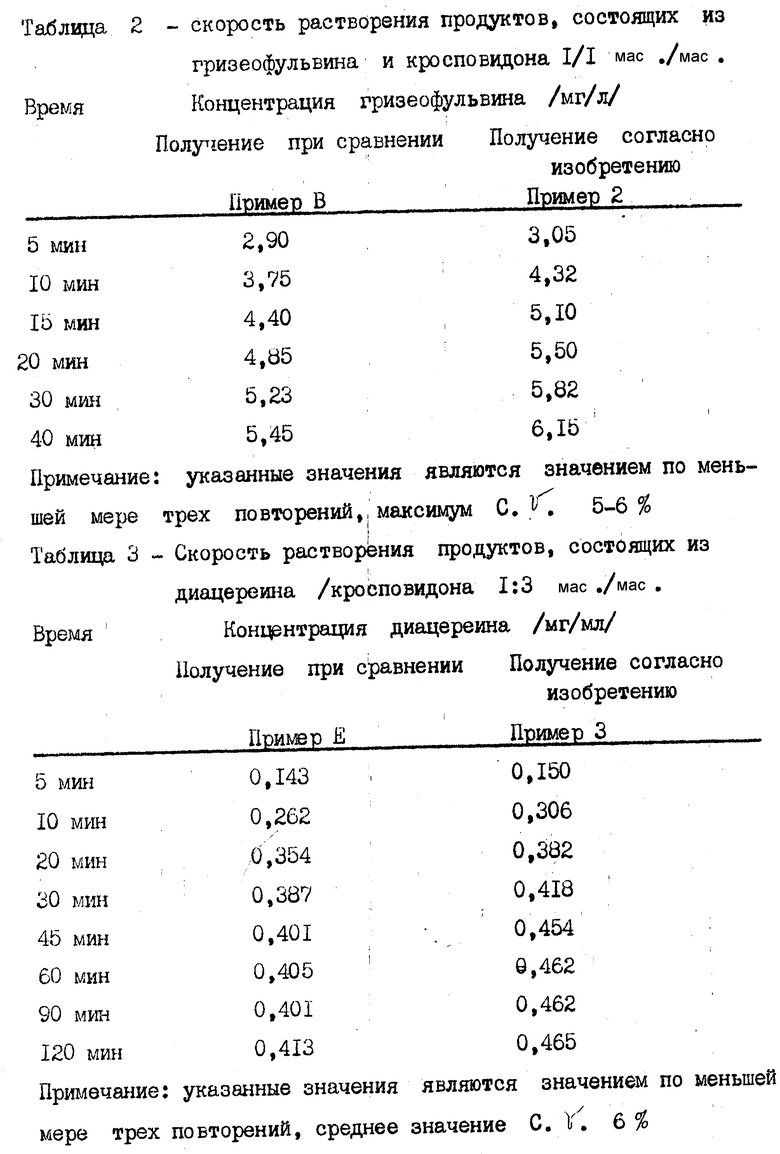
Пример 3. 2,5 г диацереина и 7,5 г кросповидона просеивались через сито 60 и помещались в помольную камеру высокоэнергетической коллоидной мельницы. Мельница работала в течение нескольких секунд для смешивания порошков совместно со средством для помола. Клапан, соединяющий мельницу с емкостью, содержащей метиленхлорид, открывался и помольная камера заполнялась паром растворителя и насыщалась этим паром. Затем проводился помол в течение 1 ч в условиях насыщения. Полученный порошок имел размер частиц в пределах 1-100 мкм. Он высушивался при температуре 30oC под вакуумом в течение 3 ч, просеивался через сито 60 и затем перемешивался.
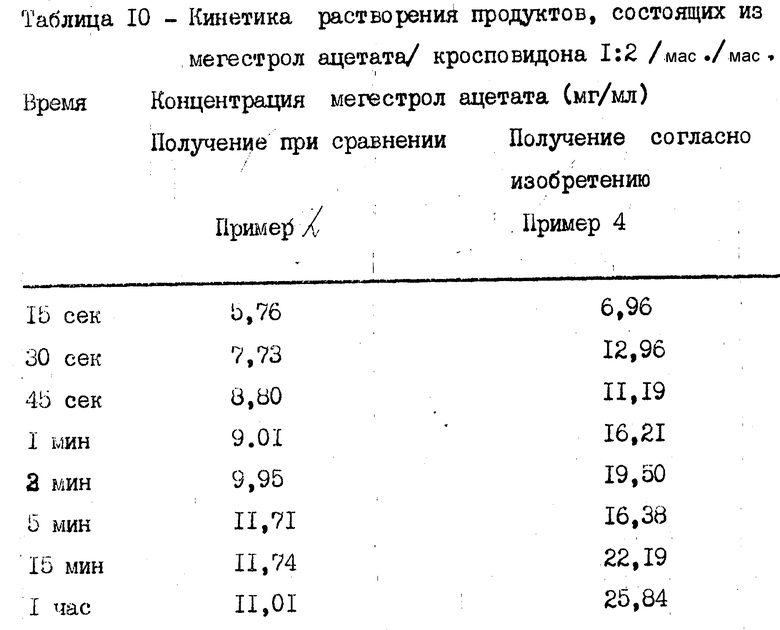
Пример 4. 5 г мегестрола и 10 г кросповидона просеивались через сито 60, смешивались и помещались в помольную камеру высокоэнергетической коллоидной мельницы вместе со средством для помола. Затем камера насыщалась паром метиленхлорида путем открывания клапана, соединяющего мельницу с емкостью, содержащей метиленхлорид, после чего осуществлялся помол в течение 4 ч. По окончании помола полученный порошок имел размер частиц в пределах 1-100 мкм. Он высушивался при 30oC под вакуумом в течение 3 ч, просеивался через сито 60 и затем перемешивался.
Пример 5. 3,5 г мегестрола ацетата и 10,5 г мелкоизмельченного кросповидона просеивались через сито 60, перемешивались и помещались в помольную камеру высокоэнергетической коллоидной мельницы вместе со средством для помола. Порошок нагревался до 80oC в течение 2 ч под вакуумом. Камера насыщалась метиленхлоридом, поступающим из емкости, связанной с мельницей через клапан, а затем производился помол в течение 2 ч. По окончании помола полученный порошок имел размер частиц в пределах 0,1 50 мкм, Он высушивался при 30oC под вакуумам в течение 3 ч, просеивался через сито 60 и затем перемешивался.
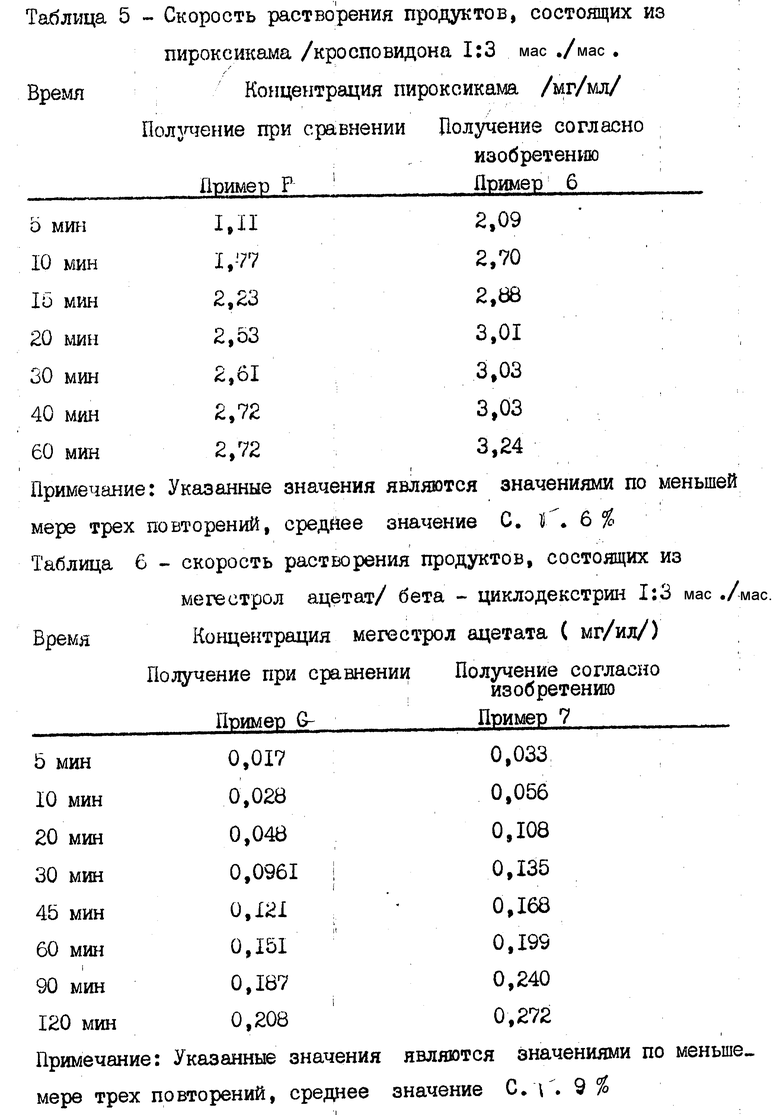
Пример 6. 4 г микросикама и 12 г мелкоизмельченного кросповидона просеивались через сито 60, смешивалась и помещались в помольную камеру высокоэнергетической коллоидной мельницы совместно со средством для помола. Камера насыщалась метиленхлоридом в виде пара, поступающего из емкости, связанной с мельницей через клапан, а затем проводился помол в течение 2 ч. По окончании помола полученный порошок имел размер частиц в пределах 0,1 50 мкм. Он затем высушивался при температуре 30oC в течение 3 ч под вакуумом, просеивался через сито 60 и перемешивался.
Пример 7. 4 г мегестрола и 12 г бета-циклодекстрина (ХИНОИН) просеивались по отдельности через сито 60, смешивались и помещались в помольную камеру высокоэнергетической коллоидной мельницы. Камера насыщалась паром метиленхлорида, поступающего из емкости с метиленхлоридом, связанной с мельницей через клапан, затем осуществлялся помол в течение 2 ч. По окончании помола полученный порошок имел размер частиц в пределах 0,1 100 мкм. Он высушивался при 30oC в течение 3 ч под вакуумом, просеивался через сито 60 и перемешивался.
Пример 8. 1 г пироксикама и 9,16 г бета-циклодекстрина просеивались по отдельности через сито 60, смешивались и помещались в помольную камеру высокоэнергетической коллоидной мельницы совместно со средством для помола. Камера насыщалась метиленхлоридом в парообразном состоянии, поступающим из емкости, соединенной с мельницей через клапан, а затем осуществлялся помол в течение 1 ч. По окончании помола полученный порошок имел размер частиц в пределах 0,1 -100 мкм. Он высушивался, просеивался через сито 60 и затем перемешивался.
Пример 9. 1 г пироксикама и 3,05 г бета-циклодекстрина просеивались по отдельности через сито 60, смешивались и помещались в помольную камеру высокоэнергетической коллоидной мельницы совместно со средством для помола. Порошок нагревался до 80oC в течение 1 ч под вакуумом. Затем камера насыщалась метиленхлоридом в паровом состоянии, поступающим из емкости, соединенной с камерой через клапан, смесь перемалывалась в течение 1 ч. По окончании помола полученный порошок имел размер частиц в пределах 0,1- 100 мкм. Он затем высушивался, просеивался через сито 60 и перемешивался.
Пример 10. 3 г дилтиазема и 9 г полимерного бета-циклодекстрина (связанный поперечными связями с эпихлоргидрином, ХИНОИНОМ) просеивались через сито 60, смешивались и помещалась в помольную камеру высокоэнергетической коллоидной мельницы, Затем камера насыщалась паром, поступающим из емкости, соединенной с мельницей через клапан, проводился помол в течение 1 ч. Полученный порошок имел размер частиц в пределах 1-100 мкм. Он затем высушивался при 60oC в течение 6 ч под вакуумом, просеивался через сито 60 и затем перемешивался.
Пример 11. 3 г гризеофульвина и 9 г бета-циклодекстрина (связанный поперечными связями с эпихлоргидрином, ХИНОИНОМ) просеивались через сито 60, смешивались и помещались в помольную камеру высокоэнергетической коллоидной мельницы. Смесь нагревалась до 100oC в течение 2 ч под вакуумом, затем камера насыщалась паром метиленхлорида, поступающего из емкости, соединенной с мельницей через клапан, и перемалывалась в течение 2 ч. Полученный продукт имел размер частиц в пределах 1 100 мкм. Он высушивался, просеивался через сито 60 и перемешивался.
Пример 12. 4 г пироксикама и 12 г двуокиси кремния (Si-60, МЕРК) просеивались через сито 60, смешивались и помещались в помольную камеру высокоэнергетической коллоидной мельницы совместно со средством для перемалывания. Камера насыщалась в течение 24 ч паром метиленхлорида, поступающего из емкости, соединенной с мельницей через клапан, а затем размалывалась в течение 2 ч. Полученный продукт имел размер частиц в пределах 0,1-50 мкм. Он затем высушивался, просеивался через сито 60 и перемешивался.
Пример 14. 3 г ницерголина и 9 г кросповидона просеивались через сито 60 и перемешивались в течение 10 мин. Смесь помещалась в помольную камеру высокоэнергетической коллоидной мельницы совместно со средством для перемалывания. Помольная камера насыщалась паром метиленхлорида, содержащегося в емкости, соединенной с мельницей через клапан. Затем проводилось размалывание в течение 3 ч, при поддержании насыщения камеры паром. Полученный порошок имел размер частиц в пределах от 1 до 100 мкм. Он затем высушивался при 30oC под вакуумом в течение 3 ч, просеивался через сито 60 и перемешивался.
Далее следуют примеры поручения лекарственных препаратов на носителе, известных из предшествующего уровня техники для полноты сравнения с предшествующими примерами. Характеристики полученных продуктов приведены в конце примеров.
Пример A. 4 г гризеофульвина и 8 г кросповидона размалывались совместно аналогично тому, как описано в примере 1, но без насыщения помольной камеры паром метиленхлорида.
Пример B. 4 г гризеофульвина и 4 г кросповидона размалывались совместно, как описано в примере 2, но без насыщения помольной камеры паром метиленхлорида.
Пример C. 2,5 г диацерина и 7,5 г кросповидона размалывались совместно, как указано в примере 3, но без насыщения помольной камеры паром метиленхлорида.
Пример D. 5 г мегестрол ацетата и 10 г кросповидона размалывались совместно, как указано в примере 4, но без насыщения помольной камеры паром метиленхлорида.
Пример E. 3,5 г мегестрол ацетата и 010,5 г кросповидона размалывались совместно, как указано в примере 5, но без предварительного нагрева порошка до 80oC и без насыщения помольной камеры паром метиленхлорида.
Пример F. 4 г пироксикама и 12 г мелкоразмельченного кросповидона размалывались совместно, как указано в примере 6, но без насыщения помольной камеры метиленхлоридом.
Пример G. 4 г мегестрола ацетата и 12 г бета-циклодекстрина размалывались совместно в точности так, как указано в примере 7, но без насыщения помольной камеры паром метиленхлорида.
Пример H. 1 г пироксикама и 9,16 г бета-циклодекстрина размалывались совместно так, как указано в примере 8, но без насыщения помольной камеры паром метиленхлорида.
Пример I. 1 г пироксикама и 3,05 г бета-циклодекстрина размалывались совместно, как указано в примере 9, но без предварительного нагрева смеси двух порошков до 80oC и без насыщения помольной камеры паром метиленхлорида.
Пример L. 3 г дилтиазема и 9 г полимерного бета-циклодекстрина с перекрестными связями размалывались совместно так, как указано в примере 10, но без насыщения помольной камеры водяным паром.
Пример M. 3 г гризеофульвина и 9 г полимерного бета-циклодекстрина (связанного перекрестными связями с эпихлоргидрином, ХИНОИНОМ) размалываются совместно как указано в примере 11, но без насыщения помольной камеры паром метиленхлорида.
Пример N. 4 г пироксикама и 12 г двуокиси кремния (Si-60) размалывались совместно, как указано в примере 12, но без насыщения помольной камеры паром метиленхлорида.
Испытания свойств.
Результаты, представленные ниже, были получены в результате проведения испытаний продуктов, полученных согласно изобретению, при сравнении с аналогичными продуктами, но полученными известными способами.
Осуществлялось:
определение скорости растворения;
определение кинетики растворения;
дифференциальная сканирующая калориметрия.
Определение скорости растворения.
Данные по скорости растворения лекарственных препаратов на носителе, полученных по способу настоящего изобретения (примеры 1-12), приведены в табл. 1-8 в сравнении со скоростью растворения лекарственных препаратов на носителе, полученных известными способами (примеры A N).
Для всех изученных препаратов был использован способ USP XX N 2, с использованием устройства OTAX при 37oC и спектрофотометра Бекмана DU 65. Во всех примерах использовались такие количества материала образца, чтобы обеспечить условия погружения (т.е. концентрации на 20% меньше, чем растворимость).
Для продуктов, содержащих гризеофульвин, использовалось 900 мл буферного раствора pH 7,5, перемешанного при 150 об/мин, показания были сняты для приемлемо разбавленных образцов при 294 нм.
Для продуктов, содержащих диацереин, использовалось 900 мл буферного раствора, с pH 5,5, перемешанного при 100 об/мин, показания были сняты при 255 нм.
Для продуктов, содержащих мегестрол ацетат, использовалось 900 мл фосфатного буферного раствора с pH 5,2, перемешанного при 150 об/мин, концентрации были определены с использованием устройства СПЕКТРА ФИЗИКС, модель SP 4290/P 8800, движение фазы ацетонитрила / H2O 50/50 V/V со скоростью 1 мл/мин, колонна НОВАПАК C18, детектор VV, модель SP 8490 при 282 нм.
Для продуктов, содержащих пироксикам, использовалось 900 мл буферного раствора pH 5,0, перемешанного при 100 об/мин, спектрофотометрическое считывание показаний осуществлялось при 356 нм.
Как можно видеть из данных, представленных в табл.1-8 для всех лекарственных препаратов и всех использованных материалов подложки скорость растворения для продуктов, полученных способом согласно изобретению, была выше, чем для продуктов, полученных известными способами.
Определение кинетики растворения.
Опыты по определению кинетики растворения проводились в условиях непогружения (т. е. лекарственный препарат был в избытке относительно его растворимости).
Для всех изученных продуктов использовался следующий способ: продукт размола помещался в колбы с 40-50 мл предварительно нагретого буферного раствора с выбранным pH, колбы помещались в термошкаф КЕЛЛАЙ с температурой 37oC и перемешивались (100 150 об/мин). Через определенное время кратное количество раствора удалялось и отфильтровывалось, затем раствор анализировался на спектрометре Бекмана DU 65.
Для продуктов, содержащих мегестрол ацетат, 75 мг продукта использовалось в 50 мл буферного раствора с pH 5,5, спектрофотометрическое считывание проводилось при 296 нм с 4 см ячеек. Перемешивание проводилось с 150 об/мин.
Для продуктов, содержащих пироксам 1,04 г продукта использовалось в 40 мл буферного раствора, с pH 5,0 перемешивание проводилось при 100 об/мин. Спектрофотометрическое считывание осуществлялось при 356 нм.
Из данных, приведенных в табл. 9 и 10, во всех случаях наблюдается более высокая кинетика растворения для продуктов, полученных способом согласно заявленному изобретению по сравнению с продуктами, полученными известными способами.
Данные дифференциального сканирующего калориметра
Еще одной характеристикой продуктов, полученных способом данного изобретения, является то, что они имеют высокую энергию кристаллического состояния, характеризующегося более низкой точкой плавления, чем лекарственный препарат с более низкой теплотой плавления.
Снижение точки плавления связано с образованием очень хороших кристаллов карликовых размеров, известных под названием "карликовые кристаллы" (см. Карли Ф. и др. Материалы 13 контрольного симпозиума биоактивных материалов, Норфолк, США, 1986 г. Материалы Индийской фармацевтической конференции, Лондон 1988 г.).
В табл. 11 приведены термоаналитические данные, относящиеся к продуктам, полученным согласно изобретению, с использованием дифференциального сканирующего калориметра фирмы Меттлер (Швейцария) ТА 3000, с потоком азота и скоростью нагрева 10oK мин-1. В этой же таблице показаны данные по продуктам, полученным известными способами, а также данные по кристаллической активности препаратов. Как видно из таблицы во всех случаях продукты, полученные согласно изобретению, имеют пики расплава при более низких температурах, чем продукты, полученные известными способами.





Использование: в фармацевтике, как препараты с повышенной скоростью растворения. Сущность изобретения: лекарственные препараты, полученные совместным помолом действующего вещества и носителя при их массовом соотношении 1 : 0,1 - 100, в атмосфере паров одного или более растворителей, способных растворять действующее вещество или адсорбироваться на поверхности носителя. Действующие вещества: гризеофульвин, пироксикам, диацерин, дилтиазем, ацетат мегестрола, нифедипин, ницерголин, кетопрофен, напроксен, диклофенак, ибупрофен, лоразепам и оксазепам. Носители: кросповидон, полимерный циклодекстрин сетчатой структуры, натрийкарбоксиметилкрахмал сетчатой структуры, декстран, циклодекстрин, производные циклодекстрина, силикагель, двуокись титана, окислы алюминия, поливинилпирролидон, целлюлоза, производные целлюлозы. Предпочтительное соотношение действующее вещество: носитель 1 : 1 - 10 (мас.). 22 з.п. ф-лы, 12 табл.
| US патент 4639370, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1997-11-27—Публикация
1992-07-16—Подача