Изобретение относится к способу культивирования культур бактерий "Thiobacillus ferrooxidans" до очень высокой плотности путем подпитки формиатом, ограничивающим рост бактерий, в качестве единственного источника энергии. Такие бактерии в больших количествах требуются для более эффективного биовыщелачивания сульфидсодержащих руд металлов, а также применяются в других целях.
Данный способ позволяет выращивать "Thiobacillus ferrooxidans" ("Th.ferrooxidans") до столь высоких концентраций, каких нельзя достичь известными до сих пор методами. Это существенно повышает качество биовыщелачивания сульфидсодержащих руд металлов, с которыми связано применение "Th.ferrooxidans". Любой перебой в поставке этих бактерий может наложиться на качестве выполнения промышленных операций, где эти бактерии применяются.
Под термином "руда" в данном описании могут пониматься и хвосты, и необработанная руда. Хвосты это руды, которые уже обработаны или рассортированы с целью отделения или извлечения более легко извлекаемых металлов или фракций металлов. Необработанная руда, которую надо окислить перед выщелачиванием, это обычная руда, окисление и выщелачивание которой проводят обычными методами, обеспечивающими экономичную ее очистку, например путем цианирования. Окисление перед выщелачиванием обычно делают при обработке сульфидсодержащих и карбонатсодержащих руд, являющихся очень труднообогатимыми рудами.
Выщелачивание в данной области техники известно также как гидрометаллургическое извлечение.
Известно, что усовершенствовать способ выщелачивания можно путем окисления руд, содержащих сульфидные компоненты, с помощью химических и биологических средств, проводя такое окисление перед дальнейшей очисткой посредством цианирования. Например, руду благородного металла, являющуюся труднообогатимой ввиду наличия в ней карбонатсодержащего компонента, можно обработать газообразным хлором, а затем провести цианирование с применением углерода в щелочи, чтобы освободиться в процессе окисления от углерода. Указанный способ имеет много преимуществ, но он имеет и недостатки. Хлор недешев и опасен в обращении. При увеличении содержания углерода в сульфидных рудах издержки на производство и охрану окружающей среды возрастают. Руду, являющуюся труднообогатимой вследствие наличия в ней сульфидов и/или карбонатсодержащих компонентов, можно также предварительно обрабатывать кислородом под давлением или посредством других процессов химического окисления.
Другим традиционным способом обработки является обжиг при высоких температурах, предназначенный для окисления сульфидных и/или углеродсодержащих компонентов руды или другого подлежащего обработке материала. Такие процессы требуют значительных издержек на производство и охрану окружающей среды, которые возрастают с увеличением содержания сульфидов в обрабатываемых рудах. Руды, являющиеся труднообогатимыми ввиду того, что они содержат и карбонатсодержащие, и сульфидные компоненты, очень дороги в окислении обычными химическими методами, поэтому их лучше предварительно обрабатывать посредством биовыщелачивания с последующей экстракцией тиомочевиной (материалы конференции в Сан-Диего "1985 AIME" в ноябре 1985 г.).
Известен также способ добавки "Th.ferrooxidans" в количествах, превышающих те, что имеют место в природе. Бактерии добавляют в хвосты в присутствии дополнительных питательных сред (например - (NH4)2SO4), способствующих росту бактерий. Увеличившаяся в результате этого популяция "Th.ferrooxidans" повышает скорость окисления сульфидсодержащих руд по сравнению с той скоростью окисления, которая наблюдается в отвале хвостов в естественных условиях. (P. B. Marchant, Fundamental and Applied Biohydrometallurqy, New York, N.Y.pp.53-57. 1986.)
Биовыщелачивание проявляет много преимуществ по сравнению с традиционными методами окисления сульфидсодержащих руд с целью повышения извлечения полезных компонентов при выщелачивании. Биовыщелачивание позволяет избежать применения таких компонентов процесса, как газообразный хлор, применения дорогостоящего оборудования нагнетания кислорода под высоким давлением, а также позволяет избежать проблем, связанных с высвобождением в атмосферу двуокиси серы и летучих соединений мышьяка во время процесса высокотемпературного обжига. (Hutchins S.R. Davidson M.S. and etal. Ann.Rev.Mierobiol. 40: 311-336. 1986). С другой стороны, при биовыщелачивании в выщелачивателе остаются мышьяк и другие токсичные материалы, от которых можно избавиться приемлемыми для окружающей среды методами. Другим преимуществом выщелачивания является более эффективное извлечение металлов по сравнению с другими методами. (P.B.Marchant, Fundamental and Applied Biohydromentallurqy, Elsevier New York, N.Y.pp.53-57. 1986).
Известно применение при выщелачивании золота, бактерий "Th.ferrooxidans", которое проявляется в механизмах поглощения закупоривающего полезные компоненты пирита или других сульфидных минералов, за счет чего происходит разрушение частиц руды и высвобождение закупоренного металла с последующим повышением эффективности его извлечения посредством цианирования (Патент США N 4727882).
Таким образом этот способ является наиболее близким аналогом способа извлечения металла из труднообогатимой руды и характеризуется выращиванием Th.ferrooxidans; обработкой труднообогатимой руды культурой Th.ferrooxidans; извлечением металлов из обработанной руды, причем культуру "Th.ferrooxidans" выращивают на растворе минеральных солей. Однако при этом наблюдается очень значительное увеличение извлечения золота из хвостов, подвергнутых выщелачиванию с применением "Th.ferrooxidans" с последующим цианированием, по сравнению с извлечением золота из хвостов, подвергнутых химическому окислению с последующим цианированием. (B.Marchant, Fundamental and Applied Biohydrometallurqy Elsevier, pp. 53-77. 1986). Однако применение подобного процесса для биоокисления пирита потребует инокуляции реакторов или куч концентрированной культурой "Th.ferrooxidans" в большом количестве.
Известен единственный способ выращивания "Th.ferrooxidans", при котором в качестве субстрата культуры применяют соединения, содержащие двухвалентное железо или восстанавливаемую серу (Inqledew W.J.Biochim.Biophys.Acta. 683 89-117. 1962). В качестве среды для выращивания культуры эти неорганические субстраты имеют следующие недостатки. Выращивание культуры на них требует их высокой концентрации, чтобы попытаться скомпенсировать низкие плотности биомасс. Высокая концентрация субстратов сказывается в накоплении минеральных солей и/или преципитатов трехвалентного железа в такой культуре, что резко ограничивает плотности биомасс, получаемых с помощью таких субстратов. Выращивание культуры на минералах вызывает рост издержек и уменьшает количество "Th.ferrooxidans", имеющихся в наличии для выщелачивания.
В данной области техники хорошо известно, что формиат может служить источником энергии для выращивания гетеротрофных и автотрофных бактерий.
Известна также их токсичность для ацидофильных микроорганизмов. (Inqledew W. J. Biochim. Biophys.Acta. 683, 89-117 (1982); Alexander B. and etal, J. Gen. Microbiol. 133, 1171-1179. 1987.) Было полной неожиданностью обнаружить, что "Th. ferrooxidans" может использовать формиат в качестве источника углерода. В технической и научной литературе нет ни материалов, ни даже предположений, что "Th.ferrooxidans" может окислять формиат или использовать его в качестве субстрата для роста.
Это должно стать важным открытием в данной области техники и обеспечить альтернативную среду культуры для "Th.ferrooxidans", которая позволила бы наращивать биомассу высокой плотности и от которой "Th.ferrooxidans" приобрели бы способность расти на минералах, содержащих серу. Для рассматриваемой области было бы также важно обеспечить культуральную среду, которая позволяет выращивать "Th.ferrooxidans" с высокой плотностью биомассы, чтобы обеспечить количество бактерий, оптимальное для биовыщелачивания металлосодержащих руд, десульфуризации угля, десульфуризации стоков и для других целей при минимальных затратах.
Задачей настоящего изобретения является создание способа культивирования культур бактерий "Th. ferrooxidans" высокой концентрации, а также создание способа извлечения металла из труднообогатимой руды, позволяющих существенно повысить качество биовыщелачивания сульфидсодержащих руд металлов. Поставленная задача достигается данным способом культивирования "Th.ferrooxidans", заключающимся в культивировании "Th.ferrooxidans" на среде, содержащей минеральные соли, причем среда дополнительно содержит формиат с концентрацией менее 100 мМ.
Предпочтительно при культивировании на начальной стадии периодически вносят затравочную культуру, а при достижении желаемой плотности биомассы осуществляют непрерывный процесс выращивания биомассы. Также предпочтительно то, что в процессе культивирования биомассу отводят с рециклированием из реактора. А также после выращивания "Th.ferrooxidans" на формиатограниченной культуре производят увеличение концентрации формиата в среде со скоростью, достаточной, чтобы избежать накопления формиата в культуре до уровня, не превышающего 100 мМ.
Предпочтительно формиатограниченную культуру подпитывать периодически или постоянно.
В качестве минеральных солей используют соли, содержащие закисное железо и восстанавливаемые соединения серы.
Предпочтительно также, что в способе культивирования штамм "Th.ferrooxidans" характеризуется штаммом, обозначаемым LMD 81.69 (ATCC 21834). Поставленная задача достигается также данным способом извлечения не менее одного металла из труднообогатимой руды, включающим выращивание "Th.ferrooxidans" на растворе минеральных солей, обработку труднообогатимой руды культурой "Th. ferrooxidans" и извлечение не менее одного металла из руды, причем раствор минеральных солей дополнительно содержит формиат.
Предпочтительно, что в способе металл выбирают из группы, включающей золото, серебро, медь, свинец, висмут, цинк, уран. А трудновосстанавливаемую руду выбирают из группы, включающей сульфидную золотую руду, сульфидную серебряную руду, сульфидную медную руду, сульфидную свинцовую руду, сульфидную висмутовую руду, сульфидную цинковую руду, сульфидную урановую руду и серосодержащий уголь. Или труднообогатимая руда представляет собой комбинацию карбонатсодержащей руды и сульфидных материалов.
Предпочтительно, что в способе штамм "Th.ferrooxidans" имеет характеристику штамма, обозначаемого LMD 81.69 (ATCC 21834).
Кроме того, изобретение относится к способу обработки минералсодержащих стоков, включающему контактирование стоков с "Th.ferrooxidans" в условиях, способствующих обработке содержащихся в стоках минералов "Th.ferrooxidans", выращенными до высокой плотности с помощью культуры с ограниченной концентрацией формиата. В частности, содержащимся в отходах минералом может быть соединение двухвалентного железа или соединение восстанавливаемой серы.
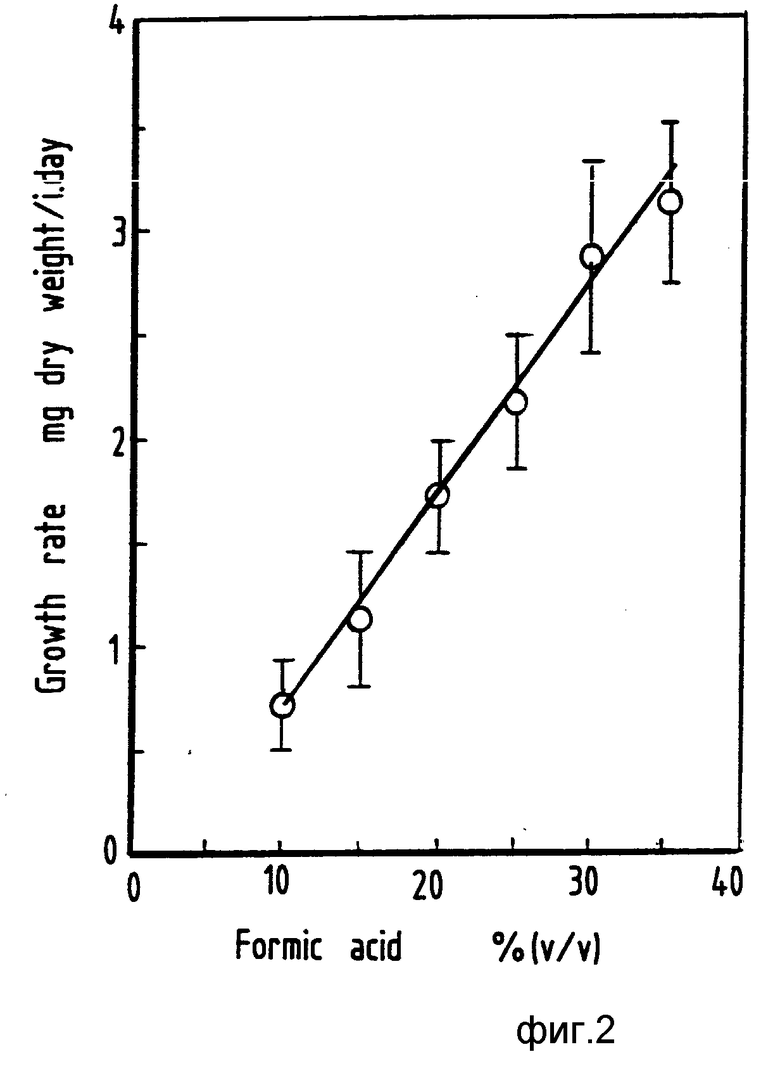
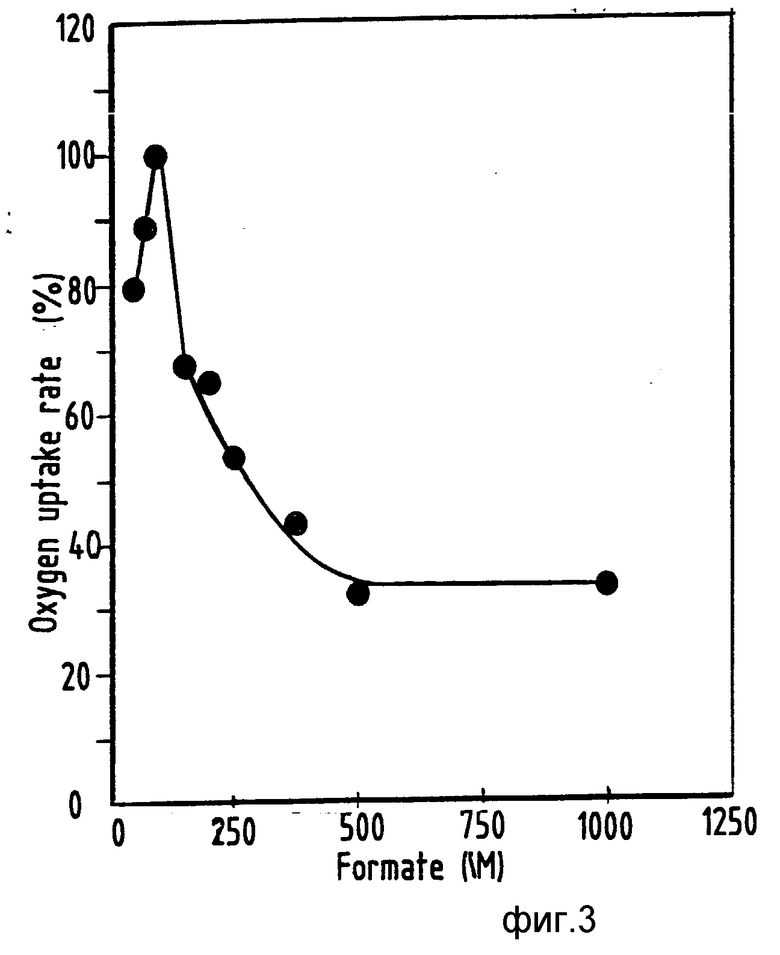
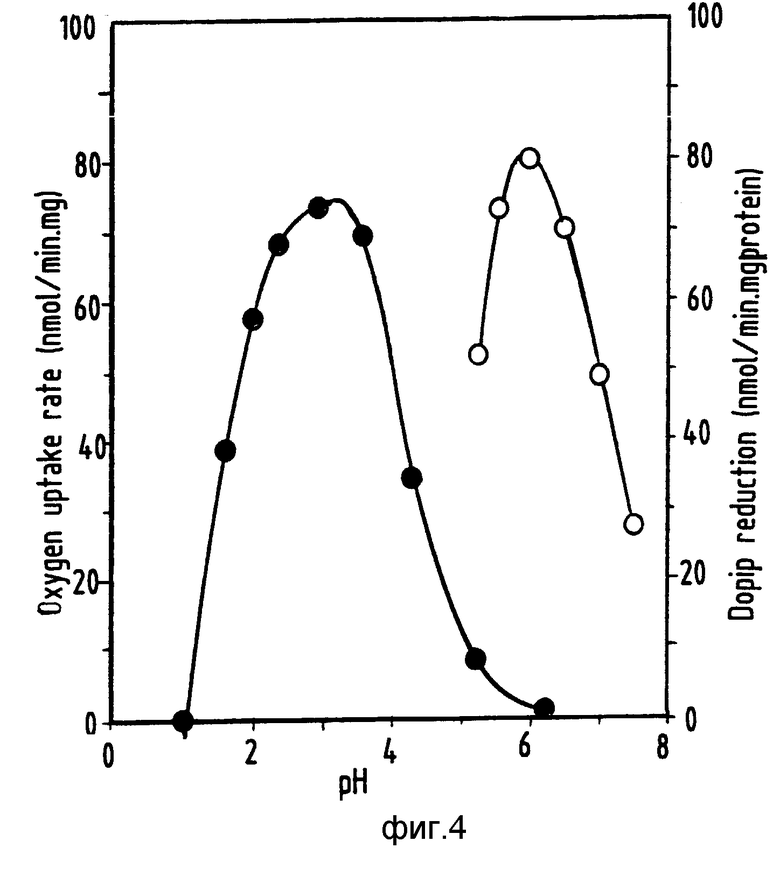
На фиг. 1 показан линейный график роста "Th.ferrooxidans" на испаренном формиате (pH 2,0, 30oC) в функции времени; на фиг.2 линейный график скорости роста "Th. ferrooxidans" на испаренном формиате при изменении концентрации формиата в резервуаре; на фиг.3 график зависимости скорости потребления кислорода от концентрации субстрата; на фиг.4 два графика влияния pH на окисление формиата клетками "Th.ferrooxidans" и бесклеточными экстрактами (о).
На фиг.1 1 оптическая концентрация 420; 2 время, сутки.
На фиг. 2 1 скорость роста, мг массы в сухом состоянии на день инокуляции; 2 концентрация муравьиной кислоты, по объему.
На фиг.3 1 скорость потребления кислорода, 2 концентрация формиата, мкМ.
На фиг. 4 1 скорость потребления кислорода, нмоль•мин-1 мг-1; 2 реакция восстановления дихлорфенолиндофенола, нмоль•мин-1•мг белка.
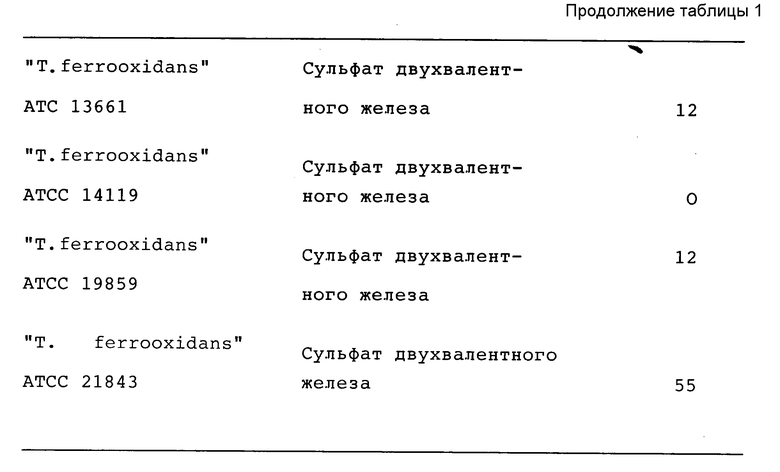
Таким образом, обнаружено, что можно избежать хорошо известного влияния токсичности формиата на "Th. ferrooxidans" в периодической культуре путем использования условий, при которых концентрации субстрата во время выращивания бактерий будут ограничены, например хемостатичной культуры или подпитываемой маточной культуры, при выращивании "Th.ferrooxidans" до достижения высоких плотностей биомассы в культуре. С целью выявления способностей окислять формиат, когда его концентрация мала (100 мкМ), были исследованы многие ацидофильные бактерии, как гетеротрофы, так и факультативные аутотрофы. Параметры окисления формиата ацидофильными бактериями находились в широких пределах (таблица 1).
Наибольшую скорость окисления формиата показал факультативный аутотрофный ацидофильный микроорганизм "Thiobacillus acidophilus", выращенный аутотрофно на формиате (таблица 1). Значительные скорости окисления формиата ((30+63) нмоль O2•мин-1•(мг массы в сухом состоянии)-1) были получены во всех случаях исследований ацидофильных бактерий. Обычно скорости окисления, показанные облигатными автотрофными бактериями, были ниже (таблица 1). Клетки "Thiobacillus thiooxidans" и "Thooacillus concretivorus", выращенные на элементарной сере, вообще не окисляли формиат (таблица 1). Скорости окисления формиата клетками "Th.ferrooxidans", выращенными на соединениях двухвалентного железа, изменялись в зависимости от использованного штамма (таблица 1). Среди штаммов "Th.ferrooxidans" наибольшие скорости поглощения кислорода в зависимости от концентрации формиата показали "Th.ferrooxidans" (ATCC 21834). Эти данные хорошо коррелируют со способностью "Th.ferrooxidans" (ATCC 21834) использовать формиат низкой концентрации в качестве единственного источника энергии в условиях роста при ограниченной концентрации формиата.
Это совершенно неожиданный результат, непредвиденный для данной области техники. Ранее не были известны попытки выращивать "Th.ferrooxidans" на формиате низкой концентрации. Более того, обнаружено, что выращивание "Th. ferrooxidans" с помощью процесса по данному изобретению сохраняет за такими бактериями способность расти на минералах, содержащих сульфиды двухвалентного железа, и окислять их. В данной области науки и техники неизвестно достоверно, могут ли бактерии, адаптировавшиеся ко второму субстрату, сохранять способность мгновенно использовать ранее применявшийся субстрат (Hazeu W. Bijleveld W. Grotenhuis J.T.C. Kakes E. u Kuenen J.G.Antonie van Leeuwenhoek J.Microbiol. 52, 507-518. 1986.)
Имеющиеся в опубликованных работах сообщения о токсичности формиата для "Th.ferrooxidans" подтвердились при неудаче, сопровождавшей попытку вырастить "Th.ferrooxidans" (ATCC 21834) в маточной культуре с формиатом в концентрации 20 мМ как единственным источником энергии. Чтобы избежать отравления "Th.ferrooxidans" формиатом, использовали несколько разных способов доставки формиата в культуру, обеспечивающих его низкие концентрации. Одним из методов было выращивание "Th.ferrooxidans" в культуре типа подпитываемой маточной путем инокуляции "Th.ferrooxidans" во взбалтываемые узкогорлые колбы, оснащенные центральным резервуаром муравьиной кислоты, из которого субстрат мог попадать в среду роста только путем испарения муравьиной кислоты из центрального резервуара и осуществленного растворения ее в среде роста (в качестве дублирующих культур инокулировали клетки тех культур, которые были выращены как периодические на двухвалентном железе). При таком методе скорости роста изменялись во времени по линейному закону, когда концентрация муравьиной кислоты в резервуаре составляла 15% (в объемном отношении) (фиг. 1). Скорость роста в культурах (независимые третьи культуры были инокулированы в виде клеток хемостатных культур с ограниченной концентрацией формиата (D= 0,01 ч-1), pH 2,0, T=30oC, массы в сухом состоянии оценивали по оптической плотности культур с применением калибровочных кривых, построенных при анализах хемостатных культур с ограниченной концентрацией формиата) находилась в линейной зависимости от концентрации муравьиной кислоты в резервуаре (фиг. 2). В таких условиях скорости роста возрастали при увеличении концентрации муравьиной кислоты в резервуаре до 35% (по объему). При дальнейшем увеличении концентрации рост не происходил.
Когда происходит рост "Th.ferrooxidans" на минеральной среде, рост на формиате не сказывается в накоплении минеральных солей. Когда в качестве субстрата используют муравьиную кислоту (HCOOH), она обычно полностью окисляется до образования двуокиси углерода и воды. Таким образом, накопление солей не устанавливает предел максимальной концентрации муравьиной кислоты в находящейся в резервуаре среде.
Такая система подпитки культур путем испарения муравьиной кислоты оказалась полезной для проявления способности амидофильных микроорганизмов использовать формиат в качестве источника энергии. Тем не менее более полезной оказалась хемостатичная культура, в которую непосредственно вводили жидкую форипатсодержащую среду. Используя культуру, в которую непрерывно вводили формиат и которая являлась хемостатичной, получили концентрации биомассы "Th. ferrooxidans" свыше 0,7 г•л-1 при сохранении ею способности окислять двухвалентное железо с высокой скоростью.
Согласно данному изобретению, достигнуты выгодные скорости роста "Th.ferrooxidans" на формиате в хемостатичной культуре. Одним из способов существенного уменьшения времени, необходимого для достижения высоких плотностей биомассы, является начало выращивания культуры как подпитываемой маточной культуры (Pirt S.J."Batch, Fed Batch, and Chemostat Cultivation of Micro-orqanisms" Principles of Microbe and Cell Cultivation, Blackwell Scientific Publications, Oxford, UK. Chapter 21,211-218). Другой способ существенного уменьшения времени, необходимого для достижения высоких плотностей биомассы, состоит в применении системы рециркуляции биомассы, в которой часть биомассы "Th.ferrooxidans" возвращается в культуру. В частности, часть среды извлекается из биореактора, содержащийся в ней культивированный микроорганизм выделяется, а затем помещается обратно в биореактор для обеспечения непрерывного роста (Van Verseveld H.W. et. al. 52, 325-342. 1986).
Пример 1. Условия существования культур и организмов
В этом и следующих примерах были использованы чистые культуры, полученные из собрания культур Laboratory of Microbioloqy and Enzymoloqy, Delft. Предпочтительным штаммом "Th.ferrooxidans" является LMD 81.69 (American Type Culture Collection, Bethesda, MD) (ATCC N 21834). Способы маточного культивирования и среды для выращивания соответствовали тем, которые описаны Kuenen et. el. (Kuenen J.G. and Tuovinen O.H. The Prokaryotes pp.1023-1036 (1981).
Выращивание на формиате в маточной культуре
Для выращивания "Th.ferrooxidans" на испаренном формиате в подпитываемых маточных культурах использовали усовершенствованные колбы Эрленмейера вместимостью 500 мл. Ко дну колб крепили стеклянные трубки (длиной 5 см, диаметром 1 см). Колбы наполняли минеральной средой (pH 2) в количестве 100 мл, в которой не было источника углерода, и инокулировали суспензией клеток "Th. ferrooxidans" (либо клеток урожая маточных культур, выращенных на двухвалентном железе, либо суспензией клеток урожая хемостатных культур, выращенных в среде с ограниченной концентрацией формиата) до достижения плотности приблизительно 15 мг массы в сухом состоянии на литр. После этого в центральную трубку резервуара добавляли 2 мл концентрированной (5-50)% по объему муравьиной кислоты, которая могла попадать в питательную среду только путем испарения. Культуры инкубировали при 30oC на роторной качалке, скорость вращения которой составляла 200 об/мин.
Закваска хемостатичных культур
Хемостатичные культуры заквашивали путем маточного культивирования в минеральной среде (Mackintosh M.E. J.Gen.Microbiol 105, 215-218 (1978) при pH=1,6 в среде 9 К (Silverman M.N. and Lundqren D.G.G.Bacteriol. 77, 642-648 (1959)) и добавления 180 мМ FeSO4•7H2O. Минеральная среда, применявшаяся при непрерывном культивировании "Th.ferrooxidans" на литр деминерализованной воды, содержала: (NH4)2SO4 3,0 г; K2HPO4 1,0 г; MgSO4•7H2O 0,5 г; CaCl2•2H2O
0,05 г; Na2SO4 1,0 г; FeSO4•7H2O 5 мг; ZnSO4•7H2O 1 мг; CuSO4•5H2O 2 мг; MnSO4 1 мг; NaMоO4•2H2O 0,5 мг; CoCl2•6H2O 0,5 мг; Na2SeO4•10H2O 1 мг; NiCl2•6H2O - 1 мг.
Регулировку показателя pH до величины 1,8 проводили путем добавки концентрированной серной кислоты и автоклавирования при температуре 120oC. Растворы муравьиной кислоты стерилизовали автоклавированием при 110oC.
Условия проведения экспериментов
Эксперименты с хемостатическими культурами проводили при температуре 30oC в лабораторных биореакторах вместимостью 20 л при рабочем объеме веществ 18 л. Культуры аэрировали воздухом, который был насыщен водой, при расходе 2,5 л/мин и перемешивали при скорости вращения 500 об/мин. Во время маточного выращивания на двухвалентном железе pH культуры составлял 1,6; этого добивались автоматическим титрованием одномолярной H2SO4. Непрерывное выращивание на муравьиной кислоте не требует титрования культур, pH которых поддерживается на уровне 1,8.
Химические вещества
1,5-биофосфат рибулозы был получен от "Siqma Chemical Co." 14c-NaHCO3 (2,11 ТВо•моль-1 от "Amersham International PLC". Муравьиная кислота ("чда") получена от фирмы "Merck", Дармштадт, ФРГ. Все остальные химические вещества соответствовали степени чистоты, предъявляемой к химическим реактивам, и были получены из различных коммерческих источников.
Контроль чистоты культуры
Чистоту выращенных на формиате хемостатических культур регулярно проверяли с помощью методов иммунофлуоресцентной микроскопии, применяя специальные антисыворотки для выявления чистых культур конкретного организма (Muyzer G. et. el. Appl. Environm. 53, 660-664.1987).
Пример 2.
Аналитические методы
Измерение скорости потребления кислорода в зависимости от концентрации формиата
Клетки периодических культур собирали либо путем центрифугирования (15000 г, 10 мин), либо путем фильтрации через фильтры с мембраной из поликарбоната (диаметр пор 0,2 мкм, производство "Nuclepore", Pleasantor, CA, USA). Клетки промывали и повторно суспендировали в минеральную среду (для "Th.ferrooxidans" pH 1,8; для остальных ацидофильных бактерий pH 3,0). Потребление кислорода измеряли при 30oC с помощью элемента электрода типа Кларка ("Yellow Sprinqs Instruments Inc. Yellow Sprinqs, OH). Скорости потребления кислорода рассчитывали, полагая концентрацию кислорода в насыщенной воздухом воде равной 236 мкМ с поправкой на эндогенное дыхание.
Клетки хемостатичных культур с ограниченными концентрациями формиата испытывали непосредственно в жидкой культуре или после ее разбавления минеральной средой. Скорости эндогенного дыхания клеток, выращенных на хемостатических культурах, были отрицательными.
Анализ содержания углерода, формиата и белка
Для определения содержания углерода в культурах в целом и в надосадочных жидкостях культур использовали анализатор содержания органического углерода "Beckman 915B". Содержание углерода в бактериях рассчитывали по разнице.
Массу бактерий в сухом состоянии определяли с помощью метода, который разработали Pronk et.al. Kuenen J.G.Arch Microbiol 153, 392-398. 1990).
Концентрации формиата в веществе резервуара измеряли с помощью метода, который разработали Lanq and Lanq, Z.anal. Chem. 260, 8-10. 1972).
Концентрация белка в экстрактах без клеток определяли с помощью метода, который разработал Bradford Anal.Bio-Chem 72, 248-254 (1976)); в качестве эталона применяли бычий сывороточный альбумин.
Пример 3.
Окисление формиата ацидофильными бактериями
Целый ряд ацидофильных бактерий, как гетеротрофов, так и (факультативных) аутотрофов, был исследован на предмет выявления их способности потреблять кислород и окислять формиат при его низкой концентрации (100 мкМ).
Способность окислять формиат, судя по результатам экспериментов, оказалась широко распространенной среди эцидофильных бактерий и колебалась в широких пределах (таблица 1). Скорости потребления кислорода в зависимости от концентрации формиата измеряли при 30oC при наличии суспензий клеток, взятых непосредственно из хемостатичной культуры с ограниченной концентрацией формиата (D=0,01 ч-1), pH 1,8, T=30oC). Активность 100% соответствует скорости потребления кислорода 55 нмоль O•мин-1 мг-1. Во всех случаях стехиометрия окисления формиата соответствовала ожидаемой (приблизительно 50 мкМ кислорода потреблялось при окислении формиата в концентрации 100 мкМ).
Наивысшая скорость окисления формиата была показана факультативным аутотрофом "Thiobacillum acidophilus". Этот организм показал явно выраженную способность окислять формиат в целом ряде экспериментов при различных условиях выращивания. Значительные скорости окисления формиата (30-63) нмоль O2•мин-1 (мг массы в сухом состоянии)-1 были также показаны всеми исследованными ацидофильными гетеротрофами. Скорости окисления формиата, которые показаны облигатными аутотрофами, были, как правило, ниже. Клетки "Thiobacillus berrooxidans" LMD 81.55 (American Type Culture Collection, Bethesda, MD) (ATCC N 8085) и "Thiobacillus concretivorus" LMD 81, 54 (American Type Culture Collection, Bethesda MD) (ACTT N 19703), выращенные на элементарной сере, вообще не окисляли формиат. Скорости окисления, проявленные клетками "Th. ferrooxidans", сильно изменялись в зависимости от использованного штамма. Наибольшие скорости потребления кислорода были показаны "Th.ferrooxidans" LMD 81.69 (American Type Culture Collection, Bethesda, MD) (ATCC N 21834).
Пример 4.
Выращивание "Th.ferrooxidans" на формиате
"Th. ferrooxidans" были предварительно выращены как маточная культура на двухвалентном железе концентрации 180 мМ в биореакторе вместимостью 1 л. В конце выращивания маточной культуры ее развитие переключали на непрерывное культивирование при скорости разбавления 0,01 ч-1 и pH, который доводили до 1,6, пресекая преципитацию трехвалентного железа, а затем увеличивали до 1,8. В среде резервуара первоначально была муравьиная кислота концентрации 20 мМ, являющаяся единственным источником энергии. Именно эту концентрацию выбрали для того, чтобы гарантировать, что способность культуры окислять формиат окажется достаточной для пресечения накопления в ней формиата. Концентрацию муравьиной кислоты в среде резервуара наращивали поэтапно. После увеличения концентрации формиата на каждые 20% ее поддерживали на том же уровне до тех пор, пока увеличение концентрации биомассы не нивелировалось (обычно через 2-4 дня). Увеличение концентрации вводимой муравьиной кислоты более, чем на 30% за раз, приводило к вымыванию культуры.
Результирующие хемостатичные культуры с ограниченными концентрациями формиата контролировали на чистоту, используя специальные антисыворотки для выявления "Th. ferrooxidans" (Muyzer Appl. Environ Microbiol 53, 660-664.1987). Все присутствующие в культурах клетки дали положительную реакцию иммунофлуоресценции на антисыворотки флуореспинизотиоцианата (F1TC), предназначенные для выявления "Th.ferrooxidans", но не реагировали с антисыворотками, предназначенными для выявления гетеротрофных ацидофилов "Th.acidophilus" и "Acidiphilium cryptum".
Окисление формиата вводимыми клетками "Th.ferrooxidans" резко тормозилось при концентрациях субстрата свыше 100 мкМ (фиг.3). Это наблюдение объясняет неспособность штаммов "Th.ferrooxidans" расти на формиате в маточных культурах. Оптимум pH для окисления формиата был равен примерно 3,0 (фиг.4). Типовой диапазон значений pH 1,3-3,5; предпочтительный диапазон значений pH 1,8-3,0. Тем не менее, чтобы уменьшить вероятность загрязнения, pH культуры поддерживали на уровне 1,8. Скорость окисления при таком pH -53 нмоль O2•мин-1•мг-1 была, по существу, той же самой, что и скорость, наблюдавшаяся у клеток маточных культур, выращенных на двухвалентном железе (таблица 3). При наблюдавшихся урожаях биомассы (см.ниже) требуемая скорость окисления формиата для выращивания в среде с ограниченными концентрациями формиата при скорости разбавления 0,01 ч-1 равна 60 нмоль O2•мин-1•мг-1. Такая скорость согласуется со скоростями окисления, наблюдавшимися в ходе экспериментов. Дальнейшие повышения скорости роста и потребления формиата возможны при оптимизации таких условий, как температура, аэрация и состав среды.
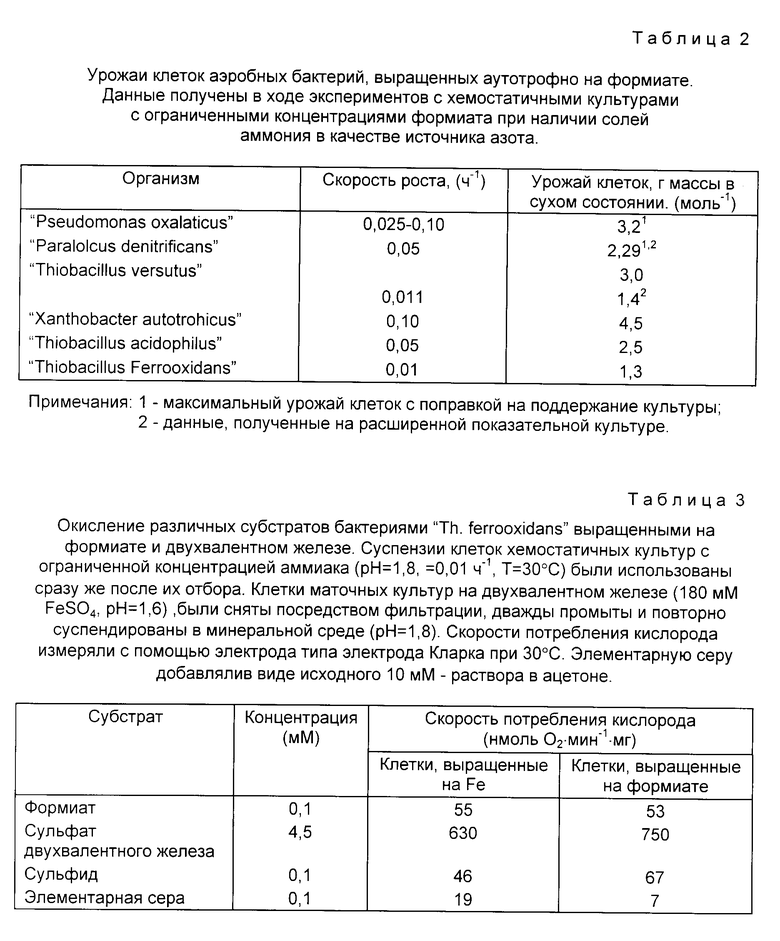
Показанное в опытах значение молярного урожая выращивания "Th.ferrooxidans" на формиате при ограничении его концентрации скоростью разбавления 0,01 ч-1 составляло 1,36 г массы в сухом состоянии (моль формиата) или 0,68 г массы в сухом состоянии • (моль электронов)-1. Этот урожай выше показанного организмом при выращивании на двухвалентном железе 0,23 г массы в сухом состоянии • (моль F2t) (Hazen W. et. el. Proc.Forth Europ.Conqr.Biotechnol 3,497-499. 1987). Урожай выращивания на формиате меньше, чем максимальный урожай для хемостатичных культур с ограниченными концентрациями тетратионата, о котором сообщалось ранее, для этого организма (0,92 г массы в сухом состоянии (моль электронов)-1 (Hazeu W. et. el. Proc.Forth Europ.Conqr.Biotechnol. 497-499. 1987). Наблюдавшийся урожай выращивания "Th.ferrooxidans" был ниже показанного рядом других бактерий, аутотрофно выращенных на формиате (таблица 2). Содержание углерода и белка в выращенных на формиате "Th. ferrooxidans" было 48% соответственно. Требования поддержания культуры могут существенно влиять на урожай клеток при малых скоростях разбавления, которые применялись в экспериментах с хемостатичными культурами.
Чтобы рассчитать теоретически максимальный урожай клеток (Ymax) "Th.ferrooxidans", требуется учесть коэффициент поддержания культуры (Ms) для случая выращивания ее на формиате ограниченной концентрации. Если считать, что коэффициент поддержания (Ms) этой культуры величина такого же порядка, что и коэффициент поддержания "Pseudomonas oxalacticus" (Dijkhuizen L. Wiersma M. and Harder W. "Enerqy production and qrowth of "Pseudomonas oxalacticus" OXI на оксилате и формиате". Arch.Microbiol. 115, 229-236. 1977)),то Ymax "Th. ferrooxidans" должен быть равен приблизительно 2,5 г•моль-1. Это значение похоже на урожаи клеток, выращенных на формиате, показанные другими аутотрофными бактериями (таблица 2).
Удивительно, но клетки хемостатичных культур, выращенных на формиате ограниченной концентрации, сохраняют способность с высокими скоростями окислять двухвалентное железо (таблица 3). Заданные скорости окисления железа оставались неизменными после длительного культивирования (свыше трех месяцев) в хемостатичных культурах с ограниченной концентрацией формиата и не зависели от плотности культуры. Это противоречит сделанным ранее наблюдениям выращивания "Th. ferrooxidans" на соединениях восстанавливаемой серы, когда способность окислять двухвалентное железо терялась (Hazen W. et.el. J.Microbiol 52, 507-518. 1986). "Th.ferrooxidans" выращенные при ограничении концентрации формиата, также проявили окисление сульфидов и элементарной серы с заметными скоростями.
Влияние pH на скорости потребления кислорода, зависящие от концентрации формиата, измерялись с применением суспензий клеток хемостатичной культуры с ограниченной концентрацией формиата (D=0,01 ч-1), pH 1,8, T=30oC). До соответствующей величины pH суспензии доводили путем добавления разбавленных H2SO4 или KOH. Окисление формиата экстрактами без клеток проверяли как зависящее от концентрации формиата восстановление дихлорфенолиндофенола (DCP1P). Измеряли параметры окисления формиата суспензиями клеток (о) и экстрактами без клеток (о) "Th.ferrooxidans" (фиг.4). Наблюдавшиеся скорости потребления кислорода клетками, выращенными на формиате и двухвалентном железе, при наличии в качестве субстратов двухвалентного железа, сульфида или элементарной серы, сравнивались. В присутствии тиосульфата, тетратионата, метанола, формальдегида и молекулярного водорода поглощение кислорода не наблюдалось.
Экстракты без клеток готовили в выращенных на формиате хемостатичных культурах, содержащих фермент RuBPCase, активность которого составляла 10 нмоль•мин-1 (мг белка)-1. Такая активность идентична скорости ассимиляции углерода, рассчитанной по наблюдавшимся урожаям клеток и составу клеток, что указывает на использование формиата клетками "Th.ferrooxidans" посредством цикла Кальвина (Calvin).
Пример 5.
Окисление формиата бесклеточными экстрактами "Th.ferrooxidans"
Приготовление бесклеточных экстрактов
Продукты хемостатичных культур с ограниченной концентрацией формиата собирали при температуре 4oC. Клетки снимали методом центрифугирования (15000 г; 15 мин) и промывали в свежеприготовленном буфере (pH=7,0), содержавшем 50 мМ MOPS (2-(N-морфолино)-гидропропансульфоновую кислоту), 2 мМ-цистеин и 0,2 мМ Fe(NH4)2 (SO4)2 (FOXB. G.et.el. J.Biol.Chem. 264, 10023-10033.1988). Клетки повторно суспендировали в том же самом буфере до конечной концентрации примерно 10 мг массы в сухом состоянии на мл и измельчали путем обработки ультразвуком при температуре 0oC с помощью излучателя ультразвука "MSE" мощностью 150 Вт (10 раз по 30 с с промежуточным охлаждением). Все клетки и остатки были удалены посредством центрифугирования при центробежном усилии 45000 г в течение 20 минут. Чистые остатки надосадочной жидкости, содержавшие (2-5) мг белка на миллилитр, были использованы как бесклеточные экстракты.
Анализ ферментов
Окрашенную дегидрогеназу формиата испытывали методами спектрофотометрии при 30oC, отбирая для опыта смесь в количестве 1 мл, содержавшую фосфат калия концентрации 100 мМ, MgSO4•7H2O концентрации 10 мМ, 0,2-миллимолярный 2,6-дихлорфенолиндофенол ("DCPIP") и бесклеточный экстракт. Реакцию начинали добавлением формиата калия до конечной концентрации 40 мМ. Активность ферментов рассчитывали по уменьшению оптической плотности на длине волны 522 нм, используя коэффициент оптического поглощения для DCP1P, равный 8,6 мМ-1 см-1 (Armstronq J.McD.Biochim.Biophys.Acta 86, 194-197. 1964). Активности ферментов были пропорциональны количеству добавлявшегося фермента.
Дегидрогеназа формиата, связанная никотинамидадениндинуклеотидфосфатом (N"NAD(P)") испытывали в той же системе проб, но заменив DCPIP на 1-миллимолярный никодинамидадениндинуклеотид ("NAD") или на NADP. Восстановление NAD и NADP отслеживали методами спектрофотометрии при длине волны 340 нм.
Карбоксилазу 1,5-бифосфата рибулозы (RuBPase EC 4.1.1.39) EC 4.1.1.39) проверяли по методу Beudeker et. el. Arch.Microbol, 124, 185-189. 1980).
Таким образом, бесклеточные экстракты выращенной на формиате культуры "Th.ferrooxidans" LMD 81.69 (ATCC N 21834) катализировали окисление формиата DCPIP как акцептор искусственных электронов. Оптимум pH дегидрогеназы формиата составлял примерно 6 (фиг.4), подтверждая локализацию цитоплазмы. При таком pH константа Михаэлиса для формиата составляла примерно 0,1 мМ ("Km") при максимальной скорости ("Vmax"), равной 80 нмоль DCPIP•мин-1•(мг белка)-1. Скорости восстановления DCPIP в зависимости от концентрации формиата не повышались при добавке 0,2-миллимолярного метосульфата феназина ("PM S"). В отличие от наблюдений, сделанных на неповрежденных клетках (фиг.1), ингибирование субстрата формиатом не наблюдалось до достижения концентрации 80 мМ. Активность дегидрогеназы формиата в бесклеточных экстрактах была при 4oC нестабильной, а время полужизни составляло приблизительно 4 часа. При наличии акцепторов NAD и NADP активности не наблюдалось.
| название | год | авторы | номер документа |
|---|---|---|---|
| Установка для культивирования культуры микроорганизмов Thiobacillus ferroxidans | 2021 |
|
RU2764030C1 |
| СПОСОБ КУЧНОГО БИООКИСЛЕНИЯ РУДЫ | 1995 |
|
RU2151208C1 |
| СПОСОБ ПЕРЕРАБОТКИ СУЛЬФИДНЫХ РУД И ПИРРОТИНОВОГО КОНЦЕНТРАТА | 2008 |
|
RU2367691C1 |
| Способ выщелачивания урана из пород с незначительным его содержанием | 2016 |
|
RU2653400C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ МЕДИ ИЗ СУЛЬФИДСОДЕРЖАЩЕЙ РУДЫ | 2011 |
|
RU2471006C1 |
| СПОСОБ ЧАНОВОГО БАКТЕРИАЛЬНОГО ВЫЩЕЛАЧИВАНИЯ СУЛЬФИДСОДЕРЖАЩИХ ПРОДУКТОВ | 2007 |
|
RU2337156C1 |
| СПОСОБ ПОДГОТОВКИ СУЛЬФИДНЫХ ЗОЛОТОСОДЕРЖАЩИХ КОНЦЕНТРАТОВ К ИЗВЛЕЧЕНИЮ ЗОЛОТА ЦИАНИРОВАНИЕМ | 1990 |
|
RU1767900C |
| СПОСОБ ИЗВЛЕЧЕНИЯ НИКЕЛЯ ИЗ БИОВЫЩЕЛАЧИВАЕМОГО РАСТВОРА | 1996 |
|
RU2178467C2 |
| ИНТЕГРИРОВАННЫЙ СПОСОБ БИООКИСЛЕНИЯ ДЛЯ ВЫЩЕЛАЧИВАНИЯ СУЛЬФИДНЫХ РУД С ИСПОЛЬЗОВАНИЕМ РЕЗЕРВУАРНОГО/КУЧНОГО МЕТОДОВ | 1998 |
|
RU2188243C2 |
| СПОСОБ ПОДГОТОВКИ РЕАГЕНТА ДЛЯ БАКТЕРИАЛЬНО-ХИМИЧЕСКОГО ВЫЩЕЛАЧИВАНИЯ СУЛЬФИДНЫХ РУД | 1990 |
|
SU1790229A1 |


Назначение: изобретение относится к способу выращивания культуры Thiobacillus ferrooxidans и применению культуры Thiobacillus ferrooxidans для обработки труднообогатимых руд с целью извлечения металлов. Сущность изобретения: культуру Thiobacillus ferrooxidans выращивают на минеральной среде, содержащей формиат в количестве, не превышающем концентрацию 100 микромоль. Труднообогатимую руду обрабатывают культурой Thiobacillus ferrooxidans, выращенной на минеральной среде, содержащей формиат. 2 с. и 13 з.п. ф-лы, 3 табл., 4 ил.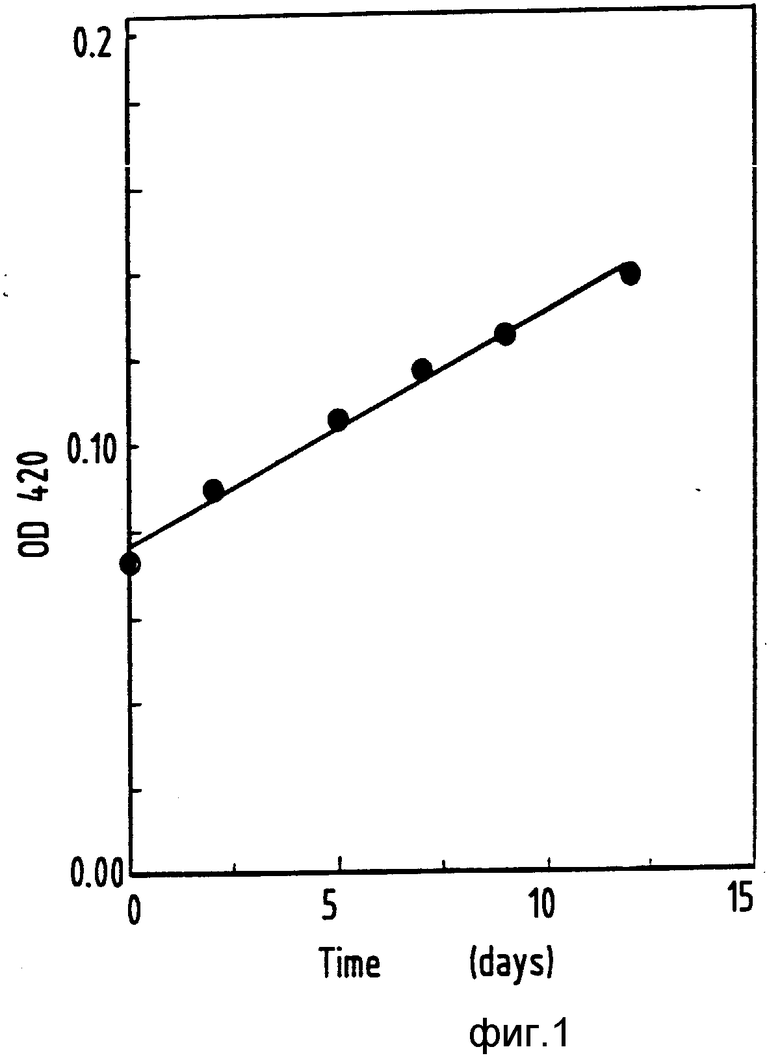
| US, патент, 4727882, кл | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
Авторы
Даты
1997-12-20—Публикация
1992-05-05—Подача