Изобретение относится к новым производным метиленбисфосфоновой кислоты, в особенности к новым, галогензамещенным амидам и эфир-амидам (сложный эфир-амидам) метиленбисфосфоновой кислоты, способам получения этих новых соединений, также как к фармацевтическим композициям, содержащим эти новые соединения.
В нескольких публикациях раскрыты метиленбисфосфоновые кислоты, их соли и некоторые сложные тетраэфиры, но в них содержится несколько упоминаний о соответствующих неполных сложных эфирах, неполных амидах и неполных эфир-амидах.
Получение сложных тетраэфиров метиленбисфосфоновых кислот раскрыто в следующих публикациях: J. Am. Chem. Soc. 78 (1956), 4450; J. Chem. Soc. (1959) 2272; J. Am. Chem. Soc. 84 (1962) 1876; J. Org. Chem. 35 (1970) 3149; J. Org. Chem. 36 (1971) 3843 и "Phosphorus. Sulful and Silicon, 42 (1989) 73.
В европейском патенте 356866 описаны необязательно галогензамещенные сложные эфиры и амид-эфиры метиленбисфосфоновой кислоты, которые обладают ингибирующей биосинтез холестерола активностью.
Согласно изобретению, обнаружено, что новые неполные амиды и неполные эфир-амиды метиленбисфосфоновых кислот и их солей во многих случаях проявляют более благоприятные свойства, чем соответствующие бисфосфоновые кислоты и соли вследствие их лучшей динамики и доступности, их способности участвовать в качестве комплексообразователей в регулировании метаболизма организма, о котором будет говориться далее.
Они хорошо пригодны для лечения расстройств, связанных с метаболизмом кальция и других, особенно двухвалентных, металлов. Они могут быть использованы как для лечения заболеваний скелетной системы, особенно костеобразования и резорбционных нарушений, таких как остеопороз и болезнь Педжета, так и для лечения заболеваний мягких тканей, таких, как отложения и кальцинозы и нарушения при костеобразовании.
С другой стороны, являясь аналогами пирофосфата, новые замещенные производные метиленбисфосфоновой кислоты также пригодны для лечения нарушений (пиро/фосфатных функций организма, включая такие функции, где активная, но склонная к нарушениям или неправильно функционирующая органическая часть соединяется с (пиро)фосфатом или действует как металлический комплекс или как комбинация вышеуказанных последних случаев.
Новые бисфосфонаты регулируют прямо или косвенно качество и уровень катионов и/или пирофосфатных соединений, свободно присутствующих в жидкостях организма, также, как связанных с ними, активных и высвобожденных из тканей. Таким образом они способны регулировать метаболизм, рост и разрушение клеток. Следовательно, они пригодны для лечения, например, рака костей и его метастаз, эктопических кальцинозов, urolithiasis, ревматоидных артритов, костных инфекций и разрушений костей.
Типичным для новых замещенных метиленбисфосфонатов является желательное селективное и контролирующее действие, обеспечивающее лучший терапевтический индекс.
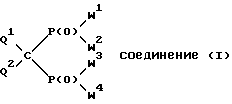
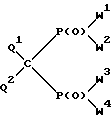
Изобретение относится к новым производным метиленбисфосфоновой кислоты общей формулы I: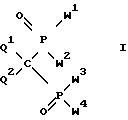
где W1, W2, W3 и W4, независимо друг от друга, обозначают группу OR1 или группу NR2R3, где R1, R2, R3, независимо друг от друга, обозначают водород или линейный или разветвленный, необязательно замещенный C1-C22-алкил; необязательно замещенный, необязательно ненасыщенный C3-C10-циклоалкил, арил, аралкил или силил SiR3, или группы R2 и R3 вместе с соседним атомом азота образуют 3-10-членное насыщенное, частично ненасыщенное или ароматическое гетероциклическое кольцо, в котором, кроме атома азота, могут быть еще один или два гетероатома из группы, включающей N, O и S, при условии, что в формуле I по крайней мере одна из групп W1, W2, W3 и W4 обозначает гидроксил и по крайней мере одна из групп W1, W2, W3 и W4 представляет собой аминогруппу NR2R3;
Q1 и Q2, независимо друг от друга, обозначают водород, фтор, хлор, бром и иод;
включая стереоизомеры, такие, как геометрические и оптически активные изомеры, соединений; также, как к их фармакологически совместимым солям.
Алкил, алкенил и алкинил, в качестве группы R1, R2 и R3, содержат, независимо друг от друга, 1-22, соответственно 2-22 C-атома, предпочтительно 1-7, соответственно 2-7, и преимущественно 1-4, соответственно, 2-4 C-атома.
Циклоалкил или циклоалкенил, в качестве группы R1, R2 и R3, содержит 3-10 C-атомов, предпочтительно 5 или 6 C-атомов, и может быть незамещен или замещен, например, низшим C1-C4-алкилом. Преимущественно он обозначает циклопропильную, циклобутильную, циклопентильную, циклогексильную или циклогептильную или соответствующую циклоалкенильную группу.
Арил или аралкил, в качестве группы R1, R2 и R3, обозначает необязательно замещенный низшим алкилом с C1-C4, низшим алкоксилом с C1-C4 или галогеном моноциклический арил или аралкил, такой, как фенил и бензил, однако, предпочтительно незамещенный фенил или бензил. Галоген представляет собой хлор, бром, фтор или иод.
В силильной группу SiR3 группа R представляет собой низший алкил с C1-C4, и особенно метил, этил, изопропил, бутил, трет.-бутил, или обозначает фенил или R замещенный фенил, а также различные комбинации низших алкилов и фенилов, такие, как диметил-трет. -бутил, метилдиизопропил, диметилфенил, диэтилфенил, метил-трет.-бутил-фенил, диизопропил-/2,6-диметил-фенил/.
Когда R2 и R3 вместе с атомом азота образуют гетероциклическое, любое насыщенное кольцо, то оно представляет собой, например, морфолинил, тиоморфолинил, пиперидинил, пиперазинил, азетидинил, азиридинил, пирролидинил или частично гидрированное ароматическое кольцо, как, например, пирролил, имидазолил, триазолил, тетразолил, оксазолил, тиазолил, пиридил, пиримидил, пиразинил, пиридазинил, азепинил. Эта группа может быть замещена как указано выше для циклоалкила, но, однако, она предпочтительно незамещена, такая, как пирролидинил, морфолинил или пиперазинил.
Q1 и Q2 оба предпочтительно обозначают хлор.
Соли соединений формулы I особенно предпочтительно представляют собой их соли с фармацевтически совместимыми основаниями, такие, как соли металлов, например, соли щелочных металлов, особенно соли лития, натрия и калия, соли щелочноземельных металлов, такие, как соли кальция или магния; соли меди, алюминия или цинка; также, как соли аммония с аммиаком или с первичными, вторичными и третичными, как алифатическими и алициклическими, так и также с ароматическими аминами, и четвертичными аммониевые соли, такие, как галогениды, сульфаты и гидроксиды; соли с аминоспиртами, такие, как этанол-, диэтанол- и триэтаноламины, трис-/оксиметил/-аминометан; 1- и 2-метил- и 1,1-, 1,2- и 2,2-диметиламиноэтанолы; N-моно- и N, N-диалкиламиноэтанолы; N-/оксиметил- и этил/-N,N-этандиамины, также, как простые амино-краун-эфиры и криптаны, и гетероциклические аммониевые соли, такие, как соли азетидиния, пирролидиния, пиперидиния, пиперазиния, морфолиния, пирролия, имидазолия, пиридиния, пиримидиния, хинолиния и т.д.
Примерами предпочтительных соединений изобретения являются: P,P,P'-трис-/диэтиламид/ /дихлорметилен/бисфосфоновой кислоты; P-моно/диэтиламид/ P-моноизопропилового эфира /дихлорметилен/бисфосфоновой кислоты; P, P-бис/диэтиламид/ /дихлорметилен/-бисфосфоновой кислоты; моно/диэтиламид/ /дихлорметилен/бисфосфоновой кислоты; моно/фенил-N-метил-амид/ /дихлорметилен/бисфосфоновой кислоты; моно/бензиламид/ /дихлорметилен/-бисфосфоновой кислоты; P,P'-бис-/диэтиламид/ /дихлорметилен/-бисфосфоновой кислоты.
Изобретение относится также к способу получения соединений формулы I, согласно которому:
а) в соединении формулы I':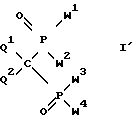 ,
,
в которой Q1 и Q2 имеют вышеуказанное значение, а
W1, W2, W3 и W4 также имеют вышеуказанное значение за исключением гидроксила, по крайней мере одну сложноэфирную группу OR1 и/или амино-группу NR2R3 гидролизуют до свободной гидроксильной группы для получения неполного амида или неполного эфира-амида формулы I, или
б) в метиленбисфосфоновой кислоте с 4-я кислотными группами или ее неполном сложном эфире формулы I'':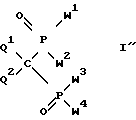 ,
,
который необязательно находится в хлорангидридной форме, и где Q1 и Q2 имеют вышеуказанное значение; W1 W4 обозначают группу OR1, где по крайней мере одна из групп R1 представляет собой водород, а остальные группы R1 имеют вышеуказанное значение; когда в соединении I'' имеется одна гидроксильная группа, то по крайней мере одну сложноэфирную группу OR1 превращают в амидную группу, и когда в соединении I'' имеется более, чем одна гидроксильная группа, то свободную гидроксильную группу амидируют с помощью пригодного амина NHR2R3 и/или сложноэфирную группу превращают в амидную группу для получения неполного амида или неполного эфир-амида формулы I, содержащего по крайней мере одну гидроксильную группу и по крайней мере одну амино-группу, или
в) фосфонат формулы IX:
Y-CQ1Q2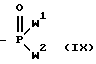 (IХ)
(IХ)
вводят во взаимодействие с активированным фосфатом или гидрофосфатом формулы X: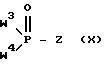 ,
,
где Y обозначает водород, гидроксил или галоген или другую удаляемую группу; Z обозначает водород, галоген, ацилокси, сульфонилокси, алкокси или арилокси; и W1-W4 и Q1 и Q2 имеют вышеуказанное значение, или
вводят во взаимодействие с соответствующим фосфатом формулы X, или
г) бисфосфонит формулы: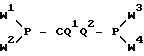 ,
,
где W1-W4 и Q1 и Q2 имеют значение вышеуказанное, или соответствующий гидрофосфонат, окисляют до соединения формулы I, где Q1 и/или Q2 обозначают водород, превращают в соединение формулы I, где Q1 и/или Q2 обозначают галоген; и/или полученное соединение формулы I, где Q1 и/или Q2 обозначают галоген, моно- или ди-дегалогенируют до соединения формулы I, где Q1 и/или Q2 обозначают водород; и/или, если желательно, полученное соединение формулы I превращают в другое соответствующее формуле I соединение путем этерификации до сложного эфира, переэтерификации, амидирования или переамидирования и/или, если желательно, полученный неполный амид или неполный эфир-амид кислоты превращают в соль или полученную соль превращают в свободную кислоту.
Согласно одному варианту способа, соединения получают путем селективного гидролиза сложноэфирной или амидной группы соответствующего тетра(амид-сложный эфир) соединения формулы I. Таким образом, в качестве исходного материала используют соединение, в котором Q1 и Q2 имеют вышеуказанное значение и группы W1-W4 имеют то же самое значение, что и в формуле I, за исключением гидроксила, и по крайней мере одна из групп W1-W4 представляет собой амино-группу NR2R3, и по крайней мере одну сложноэфирную или амидную группу, содержащуюся в соединении, гидролизуют до свободной гидроксильной группы, или по крайней мере одну из нескольких амидных групп оставляют.
За протеканием гидролиза можно следить, например, с помощью хроматографии и путем использования 31Р-ЯМР-спектроскопии. Реакцию можно прерывать, когда концентрация желательного неполного (сложного эфира)амида достигает своего максимума, и продукт может быть выделен из реакционной смеси либо в виде свободной кислоты, либо в виде соли, путем осаждения, экстракции или хроматографически, и солевая форма может быть превращена в свободную кислоту или свободная кислота может быть превращена в ее соль.
Соединения согласно изобретению, следовательно, могут быть получены путем селективной этерификации и амидирования бисфосфоновых кислот. В качестве исходного материала может быть использована тетракислота (W1-W4 OH), которая может представлять собой свободную кислоту или соль, такую, как соль металла или аммония, или соответствующий тетрахлорангидрид бисфосфоновой кислоты, и пригодный амин NHR2R3. Подобным образом, могут быть использованы пригодный неполный сложный эфир кислоты, неполный сложный амид кислоты или неполный эфир-амид кислоты или их соль или соответствующий хлорангидрид кислоты. Сложноэфирная группа может быть обменена на амидную группу через галоидангидрид или непосредственно при использовании известных методов.
Неполные амиды и эфир-амиды согласно изобретению, следовательно, могут быть получены путем построения P-C-P структуры из ее частей: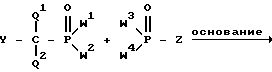 ,
,
где Y обозначает водород, гидроксил, или галоген или другую удаляемую группу; Z обозначает галоген, ацилокси, сульфонилокси, алкокси или арилокси, и W1-W4 и Q1 и Q2 имеют вышеуказанное значение. В качестве основания можно использовать, например, гидрид натрия, бутиллитий или диизопропиламид лития. В исходном материале необязательно присутствующие свободные кислотные участки и/или амино-водороды (одна из групп R1-R3 H) могут быть нейтрализованы путем использования достаточного количества основания, до реакции сочетания.
Также может быть использована реакция Михаэлиса-Арбузова, причем вторым реакционным компонентом является фосфит, или реакция Михаэлиса-Арбузова, где Z обозначает водород.
Амиды и эфир-амиды, согласно изобретению, также можно получать из P-C-P-структур с низкой степенью окисления путем окисления: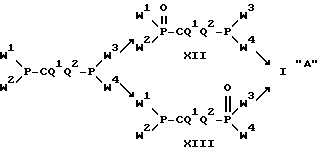 ,
,
где W1-W4 и Q1 и Q2 имеют вышеуказанное значение, и где фосфонитовая структура может существовать в равновесии с гидрофосфонатной структурой. В качестве окислителей пригодны все обычные окислители или их растворы, такие, как пероксид водорода, пергалоидные соединения, надкислоты, перманганат и т. д.
Также, соединения согласно изобретению могут быть получены путем галогенирования соответствующих соединений, где одна или обе группы Q1 и Q2 обозначают водород, или путем обмена галогена(нов) на другой, или путем удаления одного или обоих: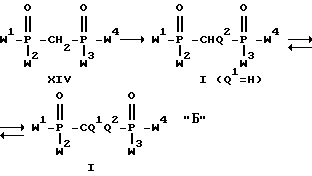 .
.
В формулах W1-W4 и Q1 и Q2 имеют вышеуказанное значение. Галогенирование осуществляют как описано далее.
Неполные амиды и эфир-амиды бисфосфоновых кислот согласно изобретению также могут быть получены из других неполных амидов или эфир-амидов путем осуществления межмолекулярной или внутримолекулярной реакции обмена.
Используемые в качестве исходных материалов в вышеуказанных реакциях тетра(сложный эфир)амиды и соответствующие тетракислоты могут быть получены само по себе известными из литературы способами, путем конструирования P-C-P-структуры из ее частей, например, используя вышеуказанную реакцию Михаэлиса-Беккера, Михаэлиса-Арбузова или карбанионную реакцию.
Если необходимо, полученные соединения могут быть превращены в другие пригодные соединения путем использования реакций обмена, принимая во внимание получение желательного неполного (сложного эфира)амида. Таким образом, амидные и сложноэфирные группы W1-W4 могут быть превращены непосредственно или через соответствующий хлорангидрид фосфоновой кислоты или путем использования других известных методов.
Атомы галогена могут быть введены вместо водорода к углероду, находящемуся между атомами фосфора бисфосфонатов также в форме тетра(сложный эфир)амидов посредством реакции, предпочтительно осуществляемой с помощью гипогалогенида. Также применимы обычные реакции галогенирования, такие, как реакции бисфосфоновых карбанионов, получаемых с сильным основанием, с элементами галогенов или путем галогенирований с помощью N-галоидаминов и других активных галогенидов или полигалоидных соединений.
Галоидные заместители углерода также могут быть введены в бисфосфонатную структуру в виде галогенированного монофосфоната IX, где Q1 и/или Q2 представляют собой галогены. Галоген Y углерода структуры также может быть обменен на водород, часто путем нуклеофильного дегалогенирования, или на другой галоген, при использовании известных реакций. Смешанные галоидные соединения также могут быть получены при применении вышеуказанных реакций галогенирования и обмена постадийно (Phosphows and Sulful, 37/1988/1).
Оптически активные неполные амиды и неполные эфиры-амиды лучше всего могут быть получены путем использования оптически активных соединений, таких, как оптически активные спирты, при получении вышеуказанных исходных материалов, промежуточных соединений и целевых продуктов, или путем реакций обмена.
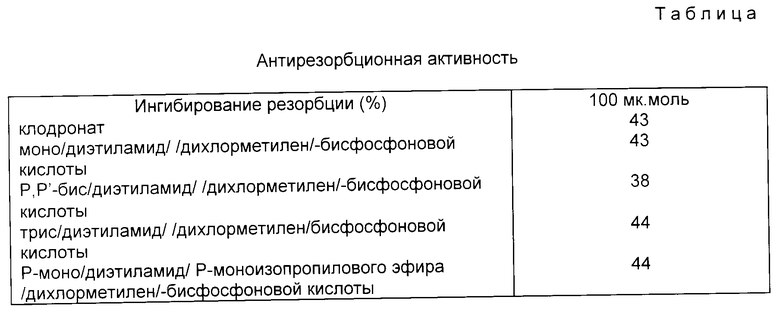
Свойства соединений согласно изобретению испытывались при применении следующей тест-системы.
Ингибирующую резорбцию кости, стимулированную гормоном паращитовидной железы, активность соединений определяли ин витро на своде черепа мыши (Reynolds and Dingle /Calc Tiss Res 1970; 4:339/).
Из таблицы видно превосходство относительно ин витро активности соединений изобретения, особенно принимая во внимание то, что они связываются только в ограниченной степени с гидроксиапатитом и частично ингибируют рост кристаллов. Они обеспечивают лучший терапевтический индекс, проявляя меньше побочных эффектов.
Неполные амиды и неполные эфир-амиды замещенных бисфосфоновых кислот формулы I могут быть использованы в фармации как таковые, или в виде их фармакологическипригодных солей, таких, как соли щелочных металлов или аммония. Такие соли могут быть получены путем реакции (сложный эфир)амидов кислот с соответствующими неорганическими или органическими основаниями. В зависимости от условий реакции, также непосредственно по вышеуказанным реакциям, могут получаться непосредственно соли амидов или эфир-амидов.
Новые соединения I согласно изобретению могут вводиться энтерально (во внутрь) или парентерально. Принимают во внимание все обычные для введения формы, такие, как таблетки, капсулы, гранулы, сиропы, растворы, имплантаты и суспензии. Также могут быть использованы любые вспомогательные средства для получения, растворения или введения препарата, такие, как стабилизаторы, регуляторы вязкости, диспергаторы и буферы.
Такие вспомогательные вещества включают, например, тартратный и цитратный буферы, спирты, ЭДТК и другие нетоксичные комплексообразующие агенты, твердые и жидкие полимеры и другие стерильные субстраты, крахмал, лактозу, маннит, метилцеллюлозу, тальк, кремневые кислоты, жирные кислоты, желатину, агар-агар, фосфат кальция, стеарат магния, животные и растительные жиры и, если желательно, ароматизирующие и подслащивающие агенты.
Дозировка зависит от ряда факторов, например, от рода введения, пола, возраста и индивидуального состояния. Суточные дозы составляют около 1-1000 мг, обычно 10-200 мг на человека, и они могут вводиться в виде одноразовой дозы или могут быть разделены на несколько доз.
Далее приводятся примеры типичной капсулы и таблетки:
Капсула мг/капсула
Активный ингредиент 100.0
Крахмал 20.0
Стеарат магния 1.0
Таблетка
Активный ингредиент 400.0
Микрокристаллическая целлюлоза 20.0
Лактоза 67.0
Крахмал 10.0
Тальк 4.0
Стеарат магния 1.0
Для медицинского использования также внутримышечно или парентерально вводимый препарат может быть изготовлен, например, в виде концентрата для вливания, в котором в качестве вспомогательных веществ с успехом могут быть использованы, например, стерильная вода, фосфатный буфер, NaCl, NaOH или HCl или другие пригодные известные фармацевтические вспомогательные вещества.
Соединения в амидной и эфир-амидной кислотной форме согласно изобретению являются жидкими или воскообразными веществами, обычно растворимыми в органических растворителях и в некоторых случаях в воде. Их соли являются твердыми, кристаллическими или типично порошкообразными веществами, которые обычно хорошо растворяются в воде, в некоторых случаях в органических растворителях, но только некоторые структурные типы плохо растворимы во всех растворителях. Соединения очень стабильны, также в их нейтральных растворах при комнатной температуре.
Структура соединений может быть легко подтверждена с помощью 1Н-, 13С- и 31Р-ЯМР-спектроскопии и FAB-масс-спектрометрии, или, если силилированные, с помощью EI-масс-спектрометрии. Для определения концентрации и примесей весьма подходит 31P-спектрометрии. Также для полярных соединений в качестве таковых может быть использована ионообменная и эксклюзионная ВЭЖХ, а для тетра(сложный эфир)амидов и соответствующих силилированных производных может быть использована газо-жидкостная хроматография или газовая хроматография/масс-спектрометрия. Азот, натрий и другие металлы соединений определяются отдельно, также как возможное содержание кристаллизационной воды.
Пример 1. P',P'-бис/Диэтиламид/ /дихлорметилен/бисфосфоновой кислоты и его динатриевая соль.
3,83 г (0,01 моль) P', P'-бис/диэтиламида/ P, P-диметилового эфира /дихлорметилен/бисфосфоновой кислоты растворяют в 20 мл безводного метиленхлорида и добавляют 3,06 г (0,02 моль) бромтриметилсилана при перемешивании, также как 3,00 г (0,02 моль) иодида натрия и смесь перемешивают в течение 6 ч при комнатной температуре (за протеканием реакции следят с помощью ЯМР). Растворитель выпаривают в вакууме и остаток растворяют в безводном эфире. Смесь отфильтровывают и фильтрат выпаривают под вакуумом до постоянного веса, получая P', P'-бис/диэтиламид/ P, P-бис/триметилсилилового эфира/ /дихлорметилен/бисфосфоновой кислоты с количественным выходом в виде коричневого масла. Остаток после выпаривания растворяют в 30 мл метанола и раствор перемешивают при комнатной температуре в течение 5 мин и выпаривают до постоянного веса под вакуумом, получая P',P'-бис/диэтиламид/ /дихлорметилен/бисфосфоновой кислоты в виде коричневого, вязко-текучего масла. Его растворяют в 35 мл смеси метанола с ацетоном (1:1) и к раствору добавляют, при перемешивании и охлаждении, 3 мл 5н. раствора NaOH. Раствор выпаривают под вакуумом и к остатку добавляют ацетон и смесь перемешивают. Осадок отфильтровывают и промывают ацетоном и сушат на воздухе. Выход составляет 2,8 г (70% от теории) бесцветной, кристаллической динатриевой соли P', P'-бис/диэтиламида/ /дихлорметилен/бисфосфоновой кислоты (31Р-ЯМР /D2O/: δ 6,60 м. д. /P/; 32,16 м.д. /P'/, 2JPP= 15,6 Гц; 3JPH= 9,2 Гц); концентрация которой >90%
Следующие амиды и эфир-амиды бисфосфоновой кислоты, также, как их натриевые соли, могут быть получены аналогичным образом:
Из P'-этил-P-метил-P,P'-бис/диэтиламидо/ /дихлорметилен/-бисфоната через P, P'-бис-/триметилсилил/-P, P'-бис/диэтиламидо/ /дихлорметилен/бисфосфонат: P, P'-бис/диэтиламидо/ /дихлорметилен/-бис-фосфонат (пример 6) /31Р-ЯМР /CDCl3/: d, м.д. 15,66/, который может быть превращен в его динатриевую соль как описано выше /31Р-ЯМР /D2O/: d 13,94 м.д./.
Из P'-этил-P, P-диметил-P'-морфолино/дихлорметилен/бисфосфоната (пример 4) через P,P,P'-трис/триметилсилил/-P'-морфолино/дихлорметилен/ бисфосфонат: P'-морфолино-/дихлорметилен/-бисфосфонат /31Р-ЯМР/ D2O/: d, м.д. 6,02 /P/; 18,06 /P'/; 2JPP=17,6 Гц/ и тринатриевая соль /31Р-ЯМР /D2O/: d, м.д. 9,44 /P/; 10,75 /P'/; 2JPP= 18,1 Гц/.
Из P, P,P'-триметил-P'-дибутиламидо/дихлорметилен/-бисфосфоната (пример 4) через P,P,P'-трис/триметилсилил/-P'-/дибутиламидо/-/дихлометилен/бисфосфонат: P'-/дибутиламидо/ /дихлорметилен/-бисфосфонат /тринатриевая соль, 31Р-ЯМР /D2O/: d, м.д. 9,58 /P/; 12,58 /P'/; 2JPP= 15,2 Гц/.
Из P-метил-P'-бутиламидо/дихлорметилен/бисфосфонат (пример 6) [или P,P, P'-триметил-P-/бутиламидо//дихлорметилен/-бисфосфоната] через P, P, P'-трис/триметилсилил/-P'-/бутиламидо//дихлорметилен/ бисфосфонат: P'-/бутиламидо//дихлорметилен/бисфосфонат/31Р-ЯМР /D2O/: d, м.д. 7,11 /O/; 9,49 /PP/; 2JPP= 21,0 Гц/.
Из P-этил-P, P'-диметил-P'-/диоктиламидо//дихлорметилен/-бис-фосфоната (пример 4) через P,P,P'-трис/триметилсилил/-P'-/диоктиламидо/-/дихлорметилен/-бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 7,16 /P'/, 6,28 /P/, 2JPP= 27,2 Гц/: P'-/диоктиламидо//дихлорметилен/бисфосфонат/ 31Р-ЯМР /CDCl3/: d, м. д. 9,78 /P/, 15,41 /P'/, 2JPP= 23,2 Гц/ и тринатриевая соль /31Р-ЯМР/D2O/: d, м.д. 12,23 /P/, 18,01 /P'/, 2JPP= 22,0 Гц/.
Из P'-этил-P,P-диметил-P'-/бензилметиламидо//дихлорметилен/-бисфосфоната (пример 4) через P,P,P'-трис/триметилсилил/-P'-/бензилметиленамидо// дихлорметилен/бисфосфонат: P'-/бензилметиламидо/-/дихлорметилен/бисфосфонат /31Р-ЯМР /D2O/: d, м.д. 10,32 /P/, 15,60 /P'/; 2JPP= 14,9 Гц/.
Из P'-этил-P,P-диметил-P'-/бензилметиламидо-//хлорметилен/бис-фосфоната (пример 10) через P,P,P'-трис-/триметилсилил/-P'-/бензилметиламидо//хлорметилен/бисфосфонат: P'-/бензилметиламидо//хлорметилен/бисфосфонат.
Из P, P, P'-триметил-P'-/диэтиламидо//хлорметилен/-бисфосфоната (пример 10) через P,P,P'-трис/триметилсилил/-P'-/диэтиламидо/-/хлорметилен/бисфосфонат: P'-/диэтиламидо//хлорметилен/бис-фосфонат /тринатриевая соль, 31Р-ЯМР /D2O/: d, м.д. 9,61 /P/, 17,84 /P'/, 2JPP= 2,9 Гц/.
Из P,P-диметил-P',P'-бис/диэтиламидо//хлорметилен/-бисфосфоната (пример 10) через P,P-бис-/триметилсилил/-P',P'-бис-/диэтил-амидо/-/хлорметилен/-бисфосфонат: P', P'-бис/диэтиламидо/-/хлорметилен/бисфосфонат /динатриевая соль, 31Р-ЯМР /D2O/: d, м.д. 7,92 /P/; 34,17 /P'/, 2JPP= 3,1 Гц, 2JPH= 16,7 Гц/.
P, P-Диметил-P', P'-бис/диэтиламидо//дихлорметилен/бисфосфонат, используемый выше в качестве исходного материала, может быть получен следующим образом:
Стадия 1. В ТГФ-гексановый раствор ДАЛ (диизопропиламид лития), который содержит 0,10 моль ДАЛа, при перемешивании в атмосфере азота и при температуре -75 -78oC, добавляют 10,31 г (0,05 моль) бис/диэтиламида/ метилфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 34,63/ (получен из дихлорангидрида метанфосфоновой кислоты и диэтиламина) в 20 мл безводного ТГФ. После добавления, смесь перемешивают в течение 15 мин, затем добавляют 7,22 г (0,05 моль) диметилового эфира хлорфосфоновой кислоты в 10 мл безводного ТГФ и перемешивание продолжают следующие 15 мин при -75 - -78oC. Температуру смеси повышают до величины около 50oC и pH-значение доводят до примерно 5-6 с помощью 5н. HCl. Смесь нагревают до комнатной температуры и растворитель отгоняют в вакууме. Остаток экстрагируют 3 раза по 70 мл CHCl3 и объединенные экстракты промывают 10%-ным раствором NaHCO3 и водой и сушат MgSO4 и отфильтровывают. Фильтрат выпаривают в вакууме, причем получают около 15,7 г (100% от теории) P,P-диметил-P',P'-бис/диэтиламидо/-метиленбисфосфоната в виде слегка желтоватого масла /31Р-ЯМР /CDCl3/: d, м.д. 25,43 /P/, 25,51 /P'/, 2JPP= 4,5 Гц/, концентрация которого 98%
Следующие симметричные и несимметричные эфир-амиды метиленбисфосфоновой кислоты могут быть получены аналогичным образом.
Из метил/диэтиламидо/метилфосфоната /31Р-ЯМР /CDCl3/: d3 4,56 м.д./ и диметилхлорфосфоната: P, P, P'-триметил-P'-/диэтиламидо/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 23,89 /P/, 25,11 /P'/, 2JPP5,4 Гц/.
Из метил-/диэтиламидо/метилфосфоната и этил/диэтиламидо/хлорфосфоната /31-Р-ЯМР /CDCl3/: d, 16,51 м.д./: P'-этил-P-метил-P,P'-бис/диэтиламидо/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м. д. 26,69 /P/, 26,66 /P'/, 24,78 /24,91 /P/; 2JPP= 7,7 /1,9 Гц/.
Из изопропил/диэтиламидо/метилфосфоната /31Р-ЯМР /CDCl3/: d 27,67 м.д./ и диметилхлорфосфоната: P,P-диметил-P'-изопропил-P'-/диэтиламидо/метиленбисфосфонат/ 31Р-ЯМР /CDCl3/: d, м.д. 22,10 /P/, 24,38 /P'/, 2JPP= 5,8 Гц/.
Из диметилфосфоната и этилморфолинохлорфосфоната /31Р-ЯМР /CDCl3/: d 14,16 м. д. /: P'-этил-P,P-диметил-P'-морфолинометиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 21,43 /P/, 23,39 /P'/ 2JPP= 3,4 Гц/.
Из метил/дибутиламидо/метилфосфоната /31Р-ЯМР /CDCl3/: d 35,94 м.д./ и диметилхлорфосфоната: P, P,P'-триметил-P'-/дибутиламидо/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 24,11 /P/, 25,30 /P'/, 2JPP= 6,1 Гц/.
Из диметилфосфоната и этил/диоктиламидо/хлорфосфоната /31Р-ЯМР /CDCl3/: d 17,23 м. д. /: P'-этил-P,P-диметил-P'-/диоктиламидо/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 23,70 /P/, 24,39 /P'/, 2JPP= 6,4 Гц/.
Из бис/диэтиламидо/метилфосфоната /31Р-ЯМР /CDCl3/: d, м.д. 34,63 / и этил/диэтиламидо/хлорфосфоната /31Р-ЯМР /CDCl3/: d 16,51 м.д./: P-этил-P, P'P'-трис/диэтиламидо/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 27,13 /P/, 27,35 /P'/, 2JPP= 3,9 Гц/.
Из диметилметилфосфоната и этил/бензилметиламидо/хлорфосфоната /31Р-ЯМР /CDCl3/: d 17,69 м.д./: P'-этил-P,P-диметил-P'-/бензилметиламидо/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 24,19 /P/, 24,29 /P'/, 2JPP= 3,0 Гц/.
Из диэтилметилфосфоната и этилпиперидинохлорфосфоната /31Р-ЯМР /CDCl3/. /: P,P,P'-триэтил-P'-пиперидинометиленбисфосфонат.
Из диметилметилфосфоната и метил/диаллиламидо/-хлорфосфоната /31Р-ЯМР /CDCl3/: d 16,18 м.д./: P,P,P'-триметил-P'-/диаллиламидо/метиленбисфосфонат.
Из диметилметилфосфоната и этил/N-метилпиперазино/хлорфосфоната /31Р-ЯМР /CDCl3/: d 14,84 м.д./: P'-этил-P,P-диметил-P'-/N-метилпиперазино/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 21,72 /P/, 23,92 /P'/, 2JPP= 3,4 Гц.
Стадия 2. 15,7 г (0,05 моль) остатка после выпаривания P',P'-бис-/диэтиламида/P, P-диметилового эфира метиленбисфосфоновой кислоты, полученного в стадии 1, растворяют в 200 мл CCl4 и добавляют 200 мл 10%-ного раствора NaOCl и 10 г бензилтриэтиламмонийхлорида. Смесь перемешивают в течение 45 мин при комнатной температуре (за течением реакции следят с помощью ЯМР) и органическую фазу отделяют и промывают водой и сушат над Na2SO4 и отфильтровывают. Фильтрат выпаривают под вакуумом, благодаря чему получают соответственно 15,3 г (80% от теории) P',P'-бис/диэтиламида/P,P-диметилового эфира /дихлорметилен/-бисфосфоновой кислоты в виде слегка желтоватого масла /31Р-ЯМР /CDCl3/: d, м.д. 12,91 /P/, 25,31 /P'/, 2JPP= 22,7 Гц/, концентрация которого 97%
Следующие симметричные и несимметричные эфир-амиды /дихлорметилен/-бисфосфоновой кислоты могут быть получены аналогичным образом.
Из P-этил-P'-метил-P, P'-бис/диэтиламидо/метиленбисфосфоната: P-этил-P'-метил-P, P'-бис/диэтиламидо//дихлорметилен/ бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 16,39/16,48 /P/; 18,60/ 18,36 /P'/; 2JPP= 20,5/17,9 Гц/.
Из P-этил-P, P', P'-трис/диэтиламидо/метиленбисфосфоната: P-этил-P,P', P'-трис/диэтиламидо//дихлорметилен/бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 17,66 /P/, 26,54 /P'/, 2JPP= 20,7 Гц.
Пример 2. Трис/диэтиламид/ /дихлорметилен/бисфосфоновой кислоты и его пиперидиниевая соль.
4,4 г (0,01 моль) P,P',P'-три/диэтиламида/ P-этилового эфира /дихлорметилен/бисфосфоновой кислоты (пример 1) в 22 мл пиперидина перемешивают в течение 1 ч примерно при 100oC и избыток пиперидина выпаривают в вакууме. Остаток в 15 мл безводного эфира перемешивают при охлаждении и осадок отфильтровывают и высушивают на воздухе. Выход составляет приблизительно 4,2 г (85% от теории) бесцветной, кристаллической пиперидиниевой соли трис/диэтиламида/ /дихлорметилен/бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м. д. 12,26 /P/, 30,19 /P'/, 2JPP= 16,5 Гц/, концентрация которой 99% и из которой соответствующая кислота может быть высвобождена путем обработки кислотой.
Используя обработку пиридином получают таким же образом N-этилпиридиниевую соль трис/диэтиламида/ /дихлорметилен/-бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 10,23 /P/, 29,51 /P'/ 2JPP= 17,7 Гц/.
Пример 3. P'-Этиловый эфир P'-морфолино/дихлорметилен/бисфосфоновой кислоты.
1,85 г (0,005 моль) P'-этил-P, P-диметилового эфира P'-морфолино-/дихлорметилен/-бисфосфоновой кислоты (пример 4) и 1,84 г (0,012 моль) триметилсилилбромида в 30 мл безводного CH2Cl2 перемешивают при температуре кипения с обратным холодильником в течение 30 мин и выпаривают под вакуумом. Остаток растворяют в 30 мл безводного метанола и перемешивают 15 мин при комнатной температуре и выпаривают под вакуумом, благодаря чему получают примерно 1,7 г (80% от теории) P'-этилового эфира P' -морфолино/дихлорметилен/бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 8,29 /P/, 13; 39 /P'/, 2JPP= 22,6 Гц/ в виде желтого масла с концентрацией >85%
Пример 4. /Моно/диэтиламид/дихлорметилен/бисфосфоновой кислоты и его тринатриевая соль.
5,5 г (0,02 моль) P'-Диэтиламида P,P,P'-триметилового эфира метиленбисфосфоновой кислоты (пример 1) при 0oC при перемешивании добавляют к смеси, содержащей 26 г NaHCO3, 68 мл 10%-ного раствора NaOCl и 30 г льда, после чего смесь перемешивают в течение 1,5 ч при 0oC и 2,5 ч при комнатной температуре (за ходом реакции следят с помощью ЯМР). Смесь отфильтровывают и фильтрат экстрагируют толуолом. Объединенные толуольные экстракты промывают 10% -ным раствором NaHCO3 и сушат над Na2SO3 и отфильтровывают. Фильтрат выпаривают в вакууме, благодаря чему получают примерно 5,8 г (85% от теории) P'-диэтиламида P,P,P'-триметилового эфира /дихлорметилен/-бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 12,02 /P/, 17,09 /P'/, 2JPP= 1,4 Гц/ в виде бесцветного масла с концентрацией >97%
Остаток после выпаривания гидролизуют до/моно/диэтиламида/дихлорметилен/бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 10.00 /P/, 13,90 /P'/, 2JPP= 18,5 Гц/ через P'-диэтиламид P,P,P'-триметилсилилового эфира /дихлорметилен/-бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 9,10 /P/, 5,29 /P'/, 2JPP= 25,7 Гц/ описанным в примере 1 образом с выходом примерно 90%
Продукт может быть превращен в соответствующую тринатриевую соль путем обработки ацетонового раствора материала с помощью 3-х эквивалентов 5н. раствора NaOH. Концентрация тринатриевой соли, кристаллизованной из смеси воды с метанолом /31Р-ЯМР /D2O/: d, м.д. 10,23 /P/, 15,72 /P'/, 2JPP= 15,2 Гц/ более 95%
Аналогичным образом могут быть получены следующие симметричные и несимметричные эфир-амиды /дихлорметилен/-бисфосфоновой кислоты.
Из P, P, -диметил-P'-изопропил-P'-/диэтиламидо/-метилен/-бисфосфоната (пример 1): P,P-диметил-P'-изопропил-P'-/диэтиламидо/-дихлорметилен/бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 12,13 /P/, 13,50 /P'/, 2JPP= 22,8 Гц/.
Из P'-этил-P,P-диметил-P'-морфолинометиленбисфосфоната (пример 1): P'-этил-P, P-диметил-P'-морфолино/дихлорметилен/бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 11,68 /P/, 12,26 /P'/; 2JPP= 22,4 Гц/.
Из P,P,P'-триметил-P'-/дибутиламидо/метиленбисфосфоната (пример 1): P,P, P'-триметил-P-/диэтиламидо//дихлорметилен-бисфосфонат /31Р-ЯМР /CDCl3: d, м. д. 11,88 /P/, 16,78 /P'/, 2JPP= 21,3 Гц/.
Из P'-этил-P,P-диметил-P'-/диоктиламидо/метиленбисфосфоната (пример 1): P'-этил-P, P-диметил-P'-диоктиламидо/ /дихлорметилен/-бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 11,93 /P/, 15,15 /P'/, 2JPP= 22,1 Гц/.
Из P'-этил-P, P-диметил-P'-/бензилметиламидо/-метилен-бисфосфоната (пример 1): P'-этил-P,P-диметил-P'-/бензилметиламидо/ /диэтилметилен/-бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 11,70 /P/, 15,01 /P'/, 2JPP= 23,0 Гц/.
Из P'-этил-P, P-диметил-P'-/метиламидо/метиленбисфосфоната (пример 9): P'-этил-P, P-диметил-P'-/метиламидо/-/дихлорметилен/-бисфосфонат /31Р-ЯМР /CDCl3/: d, м.д. 13,26 /P/, 10,75 /P'/, 2JPP= 23,0 Гц/.
Из P, P, P'-триметил-P'-/бутиламидо/метиленбисфосфоната: P,P,P'-триметил-P'-/бутиламидо//дихлорметилен/-бисфосфонат
Из P, P,P'-триметил-P'-/пиперидинометиленбисфосфоната: (пример 1): P,P, P'-триметил-P'-пиперидино/дихлорметилен/-бисфосфонат.
Из P,P,P'-триэтил-P'-/диаллиламидо/метиленбисфосфоната (пример 1): P,P, P'-триэтил-P'диаллиламидо-/дихлорметилен/-бисфосфонат.
Пример 5. Тетракис/диэтиламид/ /дихлорметилен/бисфосфоновой кислоты.
К 10,0 г (0,04 моль) тетрахлорангидрида метиленбисфосфоновой кислоты (полученного из тетраизопропилметиленбисфосфоната и пентахлорида фосфора) в 60 мл безводного толуола при температуре ниже 50oC в течение примерно 30 мин добавляют 23,4 г (0,32 моль) диэтиламино в 40 мл безводного толуола, после чего смесь перемешивают в течение 1 ч примерно при 50oC и смесь охлаждают и фильтруют. Фильтрат выпаривают под вакуумом, благодаря чему получают примерно 12,6 г (80% от теории) тетракис/диэтиламида/метиленбисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 27,78 /в виде слегка желтоватого масла с концентрацией более 85%
Остаток после выпаривания (8,0 г 0,02 моль) хлорируют как описано в примере 1 (перемешивание 72 ч при комнатной температуре благодаря чему получают примерно 7,5 г (80% от теории) тетракис/диэтиламида/ /дихлорметилен/бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d 26,29 м.д.) в виде слегка желтоватого масла с концентрацией >90%
Аналогичным образом из тетрахлорангидрида метиленбисфосфоновой кислоты можно получать следующие тетракис-амиды метилен и /дихлорметилен/-бисфосфоновой кислоты: Тетракис/диоктиламидо//дихлорметилен/бисфосфонат /31Р-ЯМР /CDCl3/: d, м. д. 26,50/ через тетракис/диоктиламидо/метиленбисфосфонат /31Р-ЯМР /CDCl3/: d 28,00 м.д./.
Пример 6. P-метиловый эфир P'-морфолино-/дихлорметилен/-бисфосфоновой кислоты и его диморфолиниевая соль.
18,5 г (0,05 моль) P'-этил-P, P-диметилового эфира P'-морфолино-/дихлорметилен/-бисфосфоновой кислоты (пример 4) в 70 мл пиперидина перемешивают в течение 20 мин примерно при 100oC и смесь выпаривают в вакууме. Остаток перемешивают в безводном эфире и осадок отфильтровывают и промывают эфиром и сушат до постоянного веса. Выход составляет примерно 20 г (80% от теории) бесцветной кристаллической дипиперидиниевой соли P-метилового эфира P'-морфолино/дихлорметилен/-бисфосфоновой кислоты /31Р-ЯМР /D2O/: d, м.д. 0,82 /P/, 9,70 /P'/, 2JPP= 15,4 Гц/ с концентрацией >97% и из которой путем кислотной обработки можно высвободить соответствующую свободную бисфосфоновую кислоту /31Р-ЯМР /CDCl3/./.
Аналогичным образом можно получить следующие симметричные эфир-амиды /дихлорметилен/бисфосфоновой кислоты:
Из P,P,P'-триметил-P'-/диэтиламидо//дихлорметилен/-бисфосфоната (пример 4): P-метил-P'-/диэтиламидо//дихлорметилен/-бисфосфонат (диморфолиниевая соль, 31Р-ЯМР /D2O/: d, м.д. 11,10 /P/, 12,76 /P'/; 2JPP= 15,3 Гц).
Из P,P,P'-триметил-P'-/дибутиламидо//дихлорметилен/-бисфосфоната (пример 4): P-метил-P'-/дибутиламидо//дихлорметилен/-бисфосфонат (динатриевая соль, 31Р-ЯМР /D2O/: d, м.д. 11,16 /P/, 12,88 /P'/, 2JPP= 16,2 Гц/.
Из P,P,P'-триметил-P'-пиперидино/дихлорметилен/-бисфосфоната (пример 4): P-метил-P'-пиперидино/дихлорметилен/бисфосфонат (дипиперидиниевая соль, 31Р-ЯМР /D2O/: d, м.д. 10,90 /P/, 10,41 /P'/, 2JPP= 15,3 Гц/.
Из P,P,P'-триэтил-P'-/диаллиламидо//дихлорметилен/-бисфосфоната (пример 4): P-этил-P'-/диаллил//дихлорметилен/-бисфосфонат (динатриевая соль, 31Р-ЯМР /D2O/: d, м.д. 9,98 /P/, 12,48 /P'/, 2JPP= 15,6 Гц).
Из P, P, P'-триметил-P'-/фениламидо//дихлорметилен/-бисфосфоната: P-метил-P'-/фениламидо/-/дихлорметилен/-бисфосфонат) дианилиниевая соль, 31Р-ЯМР /D2O/: d, м.д. 10,25 /P/, 6,60 /P'/, 2JPP= 17,3 Гц).
Из P,P,P'-триметил-P'-/фенилизопропиламидо//дихлорметилен-бисфосфоната: P-метил-P'-/фенилизопропиламидо//дихлорметилен/бисфосфонат (бис-/N-изопропиланилиниевая соль/ 31Р-ЯМР /D2O/: d, м.д. 10,38 /P/, 6,74 /P'/, 2JPP= 17,3 Гц).
Из P'-этил-P,P-диметил-P'-/бензилметиламидо//дихлорметилен/-бисфосфоната (пример 4): P-метил-P'-/бензилметиламидо/-дихлорметилен/бисфосфонат (дипиперидиниевая соль, 31Р-ЯМР /D2O/: d, м.д. 10,86 /P/, 12,20 /P'/, 2JPP= 15,4 Гц).
Из P, P, P'-триметил-P'-/бутиламидо//дихлорметилен/бисфосфоната: P-метил-P'-/бутиламидо//дихлорметилен/-бисфосфонат (31Р-ЯМР /D2O/: d, м.д. 8,15 /P/, 9,30 /P'/, 2JPP= 20,2 Гц).
Из P'-этил-P-метил-P, P'-бис-/диэтиламидо//дихлорметилен/-бисфосфоната (пример 1): P,P'-бис-/диэтиламидо//дихлорметилен/-бисфосфонат (динатриевая соль, 31Р-ЯМР /D2O/: d 13,94 м.д.). (альтернативное получение: пример 1).
Пример 7. P'-Диэтиламид P'-изопропилового эфира /дихлорметилен/-бисфосфоновой кислоты и его динатриевая соль.
7,4 г (0,02 моль) P'-Диэтиламида P'-изопропил-P,P-диметилового эфира /дихлорметилен/бисфосфоновой кислоты (пример 4) растворяют в 120 мл безводного CH3CN и при перемешивании и охлаждении добавляют 5,6 мл (0,04 моль) безводного триэтиламина, также как 20,3 мл (0,16 моль) хлортриметилсилана. Смесь перемешивают при температуре кипения с обратным холодильником в течение 5 ч и выпаривают в вакууме, благодаря чему получают примерно 9,7 г, (100% от теории) почти бесцветного масла P'-диэтиламида P'-изопропил-P, P-бис-/триметилсилил/-эфира /дихлорметилен/бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м.д. 8,92 /P/, 14,51 /P'/, 2JPP= 23,7 Гц/.
Остаток после выпаривания в течение 15 мин перемешивают в 100 мл безводного метанола и смесь выпаривают в вакууме. Выход составляет примерно 6,1 г (90% от теории) почти бесцветного кристаллического P'-диэтиламида P'-изопропилового эфира /дихлорметилен/-бисфосфоновой кислоты /31Р-ЯМР /CDCl3/: d, м. д. 8,37 /P/,15,42 /P'/; 2JPP= 23,0 Гц/ с концентрацией >97% и который путем обработки с помощью гидроксида натрия может быть превращен в соответствующую динатриевую соль (31Р-ЯМР/D2O/: d, м.д. 7,93 /P/; 12,89 /P'/, 2JPP= 15,7 Гц).
Аналогичным образом может быть получен следующий несимметричный эфир-амид (дихлорметилен)-бисфосфоновой кислоты.
Из P'-этил-P, P-диметил-P'-/бензилметиламидо//дихлорметилен-бисфосфната через P'-этил-P, P-бис/триметилсилил/-P'-/бензилметиламидо//дихлорметилен/- бисфосфонат: P'-этил-P'-/бензилметиламидо//дихлорметилен/бисфосфонат, который далее может быть превращен в соответствующую динатриевую соль (31Р-ЯМР /D2O/: d, м.д. 7,63 /P/, 23,86 /P'/, 2JPP= 15,3 Гц).
Пример 8. P, P-Бис(диэтиламидо)-P'-метил-(дихлорметилен)-бисфосфоновая кислота и ее трибутиламмониевая соль.
7,66 г (0,02 моль) P,P-бис(диэтиламидо)-P',P'-диметил(дихлорметилен)-бисфосфоната (пример 1) и 3,71 г (0,02 моль) безводного трибутиламина растворяют в 20 мл безводного хлороформа. Раствор перемешивают при температуре кипения с обратным холодильником в течение 4 ч и растворитель выпаривают под вакуумом, благодаря чему получают примерно 11,1 г (98% от теории) метилтрибутиламмониевой соли P,P-бис-(диэтиламидо)-P'-метил-(дихлорметилен)бисфосфоновой кислоты в виде интенсивно бледно-желтого масла (31Р-ЯМР /CDCl3/: d, м.д. 27,88 (P), 6,17 (P'), 2JPP= 17,2 Гц; 3JPP= 10,2 Гц; 3JPH= 9,0 Гц) с концентрацией 95% и из которой путем обработки кислотой может быть высвобождена соответствующая кислота.
Пример 9. P'-Бензилметиламид P'-этил-P-метилового эфира (дихлорметилен)бисфосфоновой кислоты и его трибутиламмониевая соль.
4,40 г (0,01 моль) P'-Бензилметиламида P'-этил-P,P-диметилового эфира (дихлорметилен)бисфосфоновой кислоты (пример 4) растворяют в 20 мл безводного хлороформа, добавляют 1,85 г (0,01 моль) трибутиламина и перемешивают при температуре кипения с обратным холодильником в течение 4 ч (за течением реакции следят с помощью ЯМР) и выпаривают под вакуумом. Выход составляет примерно 5,8 г (100% от теории) трибутиламмониевой соли P'-бензилметиламида P'-этил-P-метилового эфира (дихлорметилен)бисфосфоновой кислоты в виде масла (31Р-ЯМР /CDCl3/: d, м.д. 4,94 (P), 18,77 (P'), 2JPP= 17,9 Гц) с концентрацией >97% и которую путем кислотной обработки можно превратить в соответствующую кислоту.
Аналогичным образом может быть получен следующий несимметричный эфир-амид (дихлорметилен)бисфосфоновой кислоты.
Из P'-изопропил-P,P-диметил-P'-(диэтиламидо)(дихлорметилен)-бисфосфоната (пример 4): трибутилметиламмониевая соль P'-изопропил-P-метил-(диэтиламидо)(дихлорметилен)бисфосфоната (свободная кислота, 31Р-ЯМР /CDCl3/: d, м.д. 8,53 (P), 15,18 (P'), 2JPP= 21,1 Гц).
Пример 10. (Моно)метиламид (дихлорметилен)бисфосфоновой кислоты и его тринатриевая соль.
1,68 г (0,005 моль) P'-бензилметиламида P'-этил-P,P-диметилового эфира метиленбисфосфоновой кислоты (пример 1) растворяют в 16 мл уксусной кислоты и добавляют 340 мг 10%-ного палладия-на-угле. Смесь гидрируют при комнатной температуре в течение 2,5 ч и катализатор удаляют путем отфильтровывания. К фильтрату добавляют свежий катализатор и гидрирование продолжают в течение 3 ч. Добавляют дополнительные 340 мг свежего катализатора и 5 капель воды и гидрируют в течение 18 ч. Смесь отфильтровывают и фильтрат выпаривают под вакуумом, благодаря чему получают примерно 0,75 г (60% от теории) P'-метиламида P'-этил-P, P-диметилового эфира метиленбисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м. д. 24,73 (P), 2,99 (P'), 2JPP= 5,5 Гц) с концентрацией >90% Полученный после выпаривания остаток хлорируют до получения P'-(моно)метиламида P'-этил-P,P-диметилового эфира (дихлорметилен)бисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м.д. 10,75 (P), 13,26 (P'), 2JPP= 23,0 Гц), согласно способу стадии 2 примера 1, после чего P,P,P'-сложноэфирные группы гидролизуют через образование P'-(моно)метиламида P,P,P'-три(триметилсилилового) эфира (дихлорметилен)бисфосфоновой кислоты с образованием (моно)метиламида (дихлорметилен)бисфосфоновой кислоты, согласно способу примера 1. Путем обработки ацетонового раствора продукта с помощью трех эквивалентов 5н. раствора NaOH получают соответствующую тринатриевую соль в виде бесцветного кристаллического продукта.
Пример 11 (получение исходных соединений).
P'-Бензилметиламид P'-этил-P, P-диметилового эфира (хлорметилен)-бисфосфоновой кислоты.
2,0 г (0,005 моль) P'-Бензилметиламида P'-этил-P,P'-диметилового эфира дихлорметиленбисфосфоновой кислоты (пример 4) в 20 мл этанола, при 0oC, прикапывают к раствору, содержащему 2,4 г Na2SO3 в 40 мл воды. После добавления смесь перемешивают в течение 40 мин (за течением реакции следят с помощью ЯМР). По окончании реакции смесь экстрагируют хлороформом и экстракт промывают водой, сушат над Na2SO4 и отфильтровывают. Фильтрат выпаривают в вакууме, благодаря чему получают примерно 1,5 г (80% от теории) P'-бензилметиламида P'-этил-P, P-диметилового эфира (хлорметилен)бисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м.д. 17,51/17,20 (P), 19,91/19,52 (P'), 2JPP= 6,7/10,5 Гц, пара диастереоизомеров) в виде почти бесцветного масла с концентрацией >90%
Аналогичным образом могут быть получены следующие, симметричные и несимметричные эфир-амиды (хлорметилен)бисфосфоновой кислоты.
Из P,P,P'-триметил-P'-(диэтиламидо) (дихлорметилен)-бисфосфоната (пример 4): P,P,P'-триметил-P'-(диэтиламидо)-(хлорметилен)бисфосфонат.
Из P,P-диметил-P',P'-бис(диэтиламидо)(дихлорметилен)бисфосфоната (пример 1): P,P-диметил-P',P'-бис(диэтиламидо)-(хлорметилен)бисфосфонат.
Пример 12. P,P'-бис(трет.-бутилдифенилсилил)-P'-дибутиламид (дихлорметилен)-бисфосфоновой кислоты.
1,85 г (0,005 моль) P'-Дибутиламида P-метилового эфира (дихлорметилен)бисфосфоновой кислоты (пример 6) и 4,12 г (0,015 моль) трет. -бутилдифенилсилилхлорида в 30 мл безводного CH3CN перемешивают в течение 3 ч при температуре кипения с обратным холодильником и растворитель выпаривают в вакууме. Выход составляет около 4,0 г (100% от теории) P'-дибутиламида P, P'-бис(трет.-бутилдифенилсилил)-P-метилового эфира (дихлорметилен)бисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м.д. 2,34/2,29 (P), 5,20/4,61 (P'), 2JPP= 36,8/27,9 Гц, пара диастереомеров) с концентрацией >85%
1,64 г (0,002 моль) P'-Дибутиламида P,P'-бис(трет.-бутилдифенилсилил)-P-метилового эфира (дихлорметилен)бисфосфоновой кислоты растворяют в 15 мл безводного CH3CN и добавляют 240 мг (0,0029 моль) хлортриметилсилана и 330 мг (0,0022 моль) иодида натрия и смесь перемешивают в течение 1 ч при комнатной температуре и отфильтровывают. Фильтрат выпаривают в вакууме, благодаря чему получают примерно 1,7 г (95% от теории) P'-дибутиламида P,P'-бис(трет.-бутилдифенилсилил)-P-триметилсилилового эфира (дихлорметилен)бисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м.д. 7,17/7,73 (P), 7,46/7,44 (P'), 2JPP= 28,9/31,3 Гц) в виде коричневато-желтого твердого остатка с концентрацией >80%
Остаток после выпаривания перемешивают в течение 15 мин в 10 мл безводного метанола и раствор выпаривают под вакуумом. Остаток перемешивают в 20 мл безводного эфира и смесь фильтруют. Фильтрат выпаривают под вакуумом, благодаря чему получают примерно 1,2 г (95% от теории) P,P'-бис(трет.-бутилдифенилсилил)-P'-дибутиламида (дихлорметилен)бисфосфоновой кислоты (31 Р-ЯМР /CDCl3/: d, м. д. 0,27/2,13 (P), 8,45/7,37 (P'), 2JPP= 23,7/32,3 Гц, пара диастереомеров) в виде бледно-желтого твердого остатка с концентрацией >88%
Пример 13 (получения исходных соединений).
P', P'-Трис(диэтиламид) P-этилового эфира (дибромметилен)бисфосфоновой кислоты,
P, P', P'-трис(диэтиламид) P-этилового эфира (бромметилен)бисфосфоновой кислоты и
P, P', P'-трис(диэтиламид) P-этилового эфира (бромхлорметилен)-бисфосфоновой кислоты.
В раствор гипобромита натрия, который был получен путем добавления 8,4 г брома к 4,6 NaOH в 50 мл воды, добавляют 7,4 г (0,02 моль) P,P',P'-трис(диэтиламида) P-этилового эфира метиленбисфосфоновой кислоты, к которому добавлено 50 мл толуола и 5,0 г бензилтриэтиламмонийхлорида, при перемешивании (пример 1) в течение примерно 10 мин, после чего перемешивание продолжают в течение 24 ч при температуре выше 40oC. Смесь экстрагируют метиленхлоридом и экстракт промывают водой и сушат над Na2SO4 и отфильтровывают. Фильтрат выпаривают под вакуумом, благодаря чему получают примерно 5,8 г (55% от теории) P,P',P'-трис(диэтиламида)P-этилового эфира (дибромметилен)-бисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м.д. 16,95 (P), 25,01 (P'), 2JPP= 16,6 Гц) с концентрацией >90%
Соответствующим образом из P'-этил-P,P-диметил-P'-(бензилметиламидо)метиленбисфосфоната может быть получен P'-этил-P,P-диметил-P'-(бензилметиламидо)(дибромметилен)бисфосфонат (31Р-ЯМР /CDCl3/: d, м. д. 11,95 (P), 14,54 (P'), 2JPP= 18,1 Гц).
К 4,9 г (0,01 моль) P'-бензилметиламида P'-этил-P,P-диметилового эфира (дибромметилен)бисфосфоновой кислоты см. выше) в 70 мл абсолютного этанола, при перемешивании и при 0oC, добавляют 2,5 г ZnCl2•H2O в 100 мл воды, после чего перемешивание продолжают в течение 15 мин и смесь экстрагируют хлороформом. Экстракт сушат над Na2SO4 и отфильтровывают и фильтрат выпаривают в вакууме, благодаря чему получают примерно 2,9 г (70% от теории) P'-бензилметил-амида P'-этил-P, P-диметилового эфира (бромметилен)бисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м.д. 17,29/17,21 (P), 19,76/19,21 (P'), 2JPP= 4,5/10,5 Гц, пара диастереомеров) с концентрацией >90%
Таким же образом из P-этил-P,P',P'-трис(диэтиламидо)(дибромметилен)бисфосфоната можно получить P-этил-P, P', P'-трис(диэтиламидо) (бромметилен)бисфосфонат (31Р-ЯМР /CDCl3/: d, м.д. 22,79/21,87 (P), 25,37/24,71 (P'), 2JPP= 2,7/10,1 Гц, пара диастереомеров).
4,5 г (0,01 моль) P,P',P'-трис(диэтиламида) P-этилового эфира (бромметилен)бисфосфоновой кислоты смешивают с 50 мл толуола, к которому добавлено 3 г бензилтриэтиламмонийхлорида. Смесь нагревают до 40-50oC и добавляют 70 мл 10%-ного раствора NaOCl. Смесь интенсивно перемешивают в течение 24 ч при 40-50oC, после чего органическую фазу отделяют, а водную фазу экстрагируют 2 раза по 50 мл толуолом. Объединенные толуольные фазы промывают 2 раза по 10 мл насыщенным раствором NaCl, сушат над сульфатом натрия и отфильтровывают. Фильтрат выпаривают под вакуумом, благодаря чему получают примерно 3,4 г (70% от теории) P,P',P'-трис(диэтиламида) P-этилового эфира (бромхлорметилен)бисфосфоновой кислоты (31Р-ЯМР /CDCl3/: d, м.д. 17,00/17,23 (P), 25,72/25,32 (P'), 2JPP= 19,2/18,1 Гц, пара диастереомеров).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ МЕТИЛЕНБИСФОСФОНОВОЙ КИСЛОТЫ | 1990 |
|
RU2074860C1 |
| ПРОИЗВОДНЫЕ АНГИДРИДА МЕТИЛЕНБИСФОСФОНОВОЙ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2205833C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ БИСФОСФОНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2079504C1 |
| ПРОИЗВОДНЫЕ МЕТИЛЕНБИСФОСФОНОВЫХ КИСЛОТ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2086556C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛЕНБИСФОСФОНОВЫХ КИСЛОТ ИЛИ ИХ СОЛЕЙ | 1992 |
|
RU2041230C1 |
| ПРОИЗВОДНЫЕ СЛОЖНОГО ЭФИРА БИСПИЛОКАРПИНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2100352C1 |
| ПРОИЗВОДНЫЕ ГУАНИДИНАЛКИЛ-1,1-БИС-ФОСФОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2124519C1 |
| НОВОЕ СОЕДИНЕНИЕ БИСФОСФОНОВОЙ КИСЛОТЫ | 2017 |
|
RU2731615C2 |
| ИСПОЛЬЗОВАНИЕ ПИРИДИЛБИФОСФОНАТОВ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКОГО СРЕДСТВА | 1995 |
|
RU2154482C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ КОМБИНАЦИИ 2-АЛКИЛИДЕНОВЫХ ПРОИЗВОДНЫХ 9-НОР-ВИТАМИНА D И БИСФОСФОНАТА | 2004 |
|
RU2326695C2 |
Использование: в медицине в качестве комплексообразователей в регулировании метаболизма организма. Сущность изобретения: продукты, производные амидов метиленбисфосфоновых кислот общей формулы I, где W1 - W4 - OR1 или NR2R3, где R1 - водород, низший алкил, R2 и R3 - водород или C1-8-алкил, при условии, что, по крайней мере, одна из групп W1 - W4 представляет собой гидроксил, и по крайней мере одна из групп W1 - W4 представляет собой аминогруппу NR2R3, Q1 и Q2 независимо друг от друга обозначают водород или галоген, или их фармакологически приемлемые соли. Реагент 1: метиленбисфосфоновая кислота или ее неполный эфир. Реагент 2: амин NHR2R3. Процесс ведут в среде органического растворителя при комнатной температуре.
 . 1 табл.
. 1 табл.
где W1, W2, W3 и W4 группа OR1 или группа NR2R3, где R1 водород или С1 - С8-алкил, R2 и R3 водород или С1 - С8-алкил, при условии, что по крайней мере одна из групп W1 - W4 гидроксил и по крайней мере одна из групп W1 W4 - аминогруппа NR2R3;
Q1 и Q2 независимо друг от друга водород или галоген,
или их фармакологически приемлемые соли.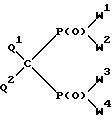
где Q1 и Q2 имеют значения, указанные в п. 1;
W1 W4 имеют значения, указанные в п. 1, за исключением гидроксила,
гидролизуют по крайней мере одну эфирную группу OR1 и/или амидогруппу NR2R3 до свободной гидроксильной группы.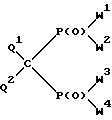
где Q1 и Q2 имеют значения, указанные в п. 1;
W1 W4 группа OR1, где по крайней мере одна из групп R1 водород, а остальные группы R1 имеют значения, указанные в п. 1,
по крайней мере одну эфирную группу OR' превращают в амидную группу, когда в соединении I'' имеется одна гидроксильная группа, в том случае, если в соединении I'' имеется более чем одна гидроксильная группа, то свободную гидроксильную группу амидируют с помощью амина NHR2R3 и/или эфирную группу превращают в амидную группу с получением неполного амида или неполного эфироамида формулы I, имеющего по крайней мере одну гидроксильную и по крайней мере одну амидную группу.
| US, патент, 3683080, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| ЕР, заявка, 0356866, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1997-12-27—Публикация
1993-06-18—Подача