Изобретение относится к области медицинской промышленности, а именно, к способам получения диспергируемых в воде препаратов бета-каротина для лечения различных заболеваний.
Известны способы получения диспергируемых в воде препаратов бета-каротина путем быстрого нагревания бета-каротина в присутствии поверхностно-активных веществ и антиокислителей до температуры 120-180oС, быстрого охлаждения раствора до температуры 80-100oС и дальнейшего охлаждения путем добавления воды [1,2]
Недостатками указанных способов являются следующие: многостадийность процесса, получение солюбилизатов бета-каротина в воде, что затрудняет их хранение в связи с быстрой инактивацией бета-каротина, необходимость быстрого нагрева до температуры 120-180oС и необходимость быстрого охлаждения раствора, что связано с большими затратами энергии и необходимостью использования специальных устройств для нагрева и охлаждения. Полученные по этим способам препараты бета-каротина содержат большое количество поверхностно-активных веществ, что затрудняет их использование для людей и животных в связи с канцерогенными и мутагенными свойствами поверхностно-активных веществ.
Прототипом изобретения является способ получения препарата бета-каротина, диспергируемого в воде путем смешивания исходных компонентов в две стадии до получения порошка целевого продукта и последующей его досушки до влажности 0,2-0,3% [3] При этом на первой стадии смешивают бета-каротин с жидким пищевым маслом в соотношении 1:(0,11-2,4) и стабилизатором до получения пастообразной массы. На второй стадии пастообразную массу интенсивно перемешивают с наполнителем, взятым в количестве 6,6•102-200•102 и летучим органическим растворителем, взятым в количестве 1800-2300% к массе бета-каротина. При этом в качестве наполнителя используют лактозу, либо смесь из лактозы и галактозы в соотношении 1:(1-19).
Предлагаемый способ также является трудоемким, предусматривает использование пищевого масла, стабилизатора, наполнителя и органического растворителя. Способ является многостадийным, так как предусматривает 3 стадии: первое смешивание, второе смешивание и третью стадию сушки для удаления органического растворителя. Указанный способ позволяет получать препараты бета-каротина, обладающие низкой биодоступностью, так как бета-каротин представлен в препарате в виде мелких кристаллов, а не в виде молекул. Препараты бета-каротина, полученные в аналоге, образуют малостойкие водные дисперсии и быстро инактивируются при хранении в условиях комнатной температуры, что затрудняет их использование в технологических процессах и в качестве лекарственных препаратов.
Задачей изобретения является упрощение способа получения препарата бета-каротина, диспергируемого в воде, увеличение эффективности получаемого препарата при использовании для лечения различных заболеваний и повышения его технологичности за счет повышенной стабильности препарата и его растворов при хранении.
Поставленная задача решается путем смешивания кристаллического бета-каротина, фосфолипидов, органического растворителя и сухого порошкообразного наполнителя и удаления летучего органического растворителя в условиях вакуума при постоянном перемешивании. В результате получают сухой порошкообразный препарат бета-каротина, хорошо диспергируемый в воде, стабильный при хранении, эффективный при лечении различных заболеваний и образующий стойкие водные растворы не теряющие активность в течение длительного хранения в условиях положительной температуры и на свету.
В качестве фосфолипидов могут быть использованы отдельные фосфолипиды, смеси фосфолипидов и суммарные фосфолипиды, полученные из растительного, животного или микробиологического сырья.
В качестве органических растворителей могут быть использованы хлороформ, гексан, эфир, бензол и другие растворители, в которых могут быть растворены фосфолипиды и бета-каротин.
В качестве сухих порошкообразных наполнителей могут быть использованы сахара (сорбит, ксилит, маннит и другие), соли (поваренная соль и другие), полисахариды (декстраны и другие), полиэтиленгликоли, поливинилпирролидон и другие вещества.
Существо изобретения иллюстрируется следующими примерами.
Пример 1 (по прототипу).
Первая стадия: смешали 0,25 г кристаллического синтетического бета-каротина и 10 мг бутилоксианизола с 0,5 мл подсолнечного масла до получения пастообразной массы.
Вторая стадия: полученную пастообразную массу смешали с 9,25 г лактозы и 5 мл хлороформа.
Третья стадия: полученный порошок досушили в условиях вакуума в течение одного часа до влажности 0,3% Получили 10,0 г сухого грубодисперсного порошка с содержанием бета-каротина 25+5 мг/г порошка.
Пример 2 (по предлагаемому способу).
Первая стадия: смешали 0,25 г кристаллического синтетического бета-каротина, 2,0 г суммарных фосфолипидов мозга крупного рогатого скота, 7,75 г сорбита и 25,0 мл хлороформа.
Вторая стадия: полученную смесь высушили в условиях вакуума при перемешивании в течение одного часа до влажности 0,5±0,1% Получили 10,0 г сухого мелкодисперсного порошка с содержанием бета-каротина 25±2o мг/г порошка.
Пример 3. Исследование растворимости препаратов бета-каротина в воде.
Получили вододиспергируемые препараты бета-каротина согласно условиям примеров 1 и 2.
По 1,0 г каждого препарата поместили в 10 мл дистиллированной воды и перемешали в течение 5 мин с помощью магнитной мешалки при температурe 20±2oС. Оба препарата хорошо растворились в воде с образованием красновато-желтых растворов.
Данные, представленные в примерах 1 и 2 показывают, что для получения препарата бета-каротина по прототипу, требуется 3 стадии, а для получения препарата бета-каротина по предлагаемому способу 2 стадии. В обоих случаях получили препарат, содержащий 25 мг бета-каротина в 1 г препарата.
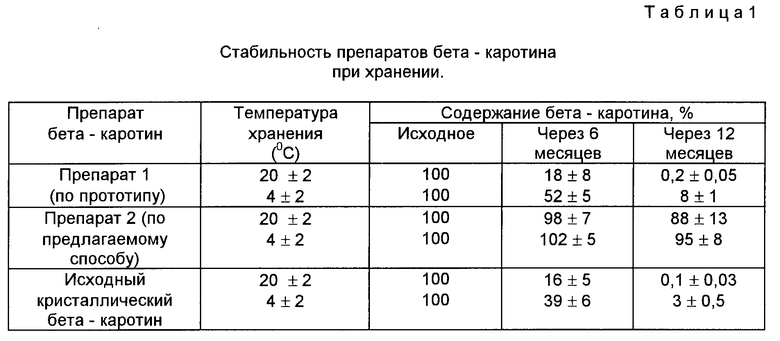
Пример 4. Исследование стабильности препаратов бета-каротина при хранении.
Получили препараты бета-каротина согласно условиям примеров 1 и 2.
Препараты поместили на хранение в условиях температуры плюс 20±2oС и плюс 4±2oС. Определили содержание бета-каротина в препаратах через 6 и 12 месяцев хранения. Результаты исследования представлены в табл.1.
Данные табл.1 показывают, что вододиспергируемый препарат бета-каротина, полученный по предлагаемому способу, сохраняет свою активность в течение 1 года (срок наблюдения) при хранении в условиях температуры плюс 20±2oС и плюс 4±2oС.
Препарат бета-каротина, полученный по прототипу, не пригоден к длительному хранению в условиях положительных температур плюс 20±2oС и плюс 4±2oС и теряет 50-80% своей активности через 6 месяцев хранения и практически инактивируется через 12 месяцев хранения. Сохраняемость препарата бета-каротина, полученного по прототипу, соответствует сохраняемости исходного кристаллического бета-каротина, взятого для получения препарата.
Пример 5. Исследование эффективности диспергируемого в воде препарата бета-каротина при летальном токсикозе, вызванном цитостатическим препаратом 5-фторурацилом.
Известно, что осложнения, наблюдающиеся при лечении онкологических заболеваний цитостатиками, равноценны, а иногда превосходят по тяжести клинические проявления основного заболевания. Поэтому особое значение приобретает поиск средств, направленных на снижение тяжести осложнений химиотерапии. Одним из перспективных направлений такого поиска является изучение применения с этой целью бета-каротина, который обладает радиозащитными свойствами и снижает гибель экспериментальных животных при летальной дозе облучения [4,5]
Изучено влияние перорального применения препаратов бета-каротина, полученных согласно условиям примеров 1 и 2 на течение летального токсикоза, вызванного 5-фторурацилом.
В опытах использовали белых мышей весом 14-18 г.
5-фторурацил (фирмы Serva) разводили физиологическим раствором до конечной концентрации 10 мг/мл. Раствор цитостатика вводили каждой мыши внутрибрюшинно в дозе 300 мг на кг веса тела. Испытания препаратов проводили по следующей схеме: за 7 сут до внутрибрюшинной инъекции 5-фторурацила мышам вводили ежедневно перорально бета-каротин в дозах 0,5 и 5,0 мг/кг веса - препарат, полученный по прототипу и в дозе 0,5 мг/кг веса препарат, полученный по предлагаемому способу. После введения цитостатика введение препаратов бета-каротина продолжали в течение 3 сут. Контрольной группе животных 5-фторурацил вводили на фоне стандартного рациона.
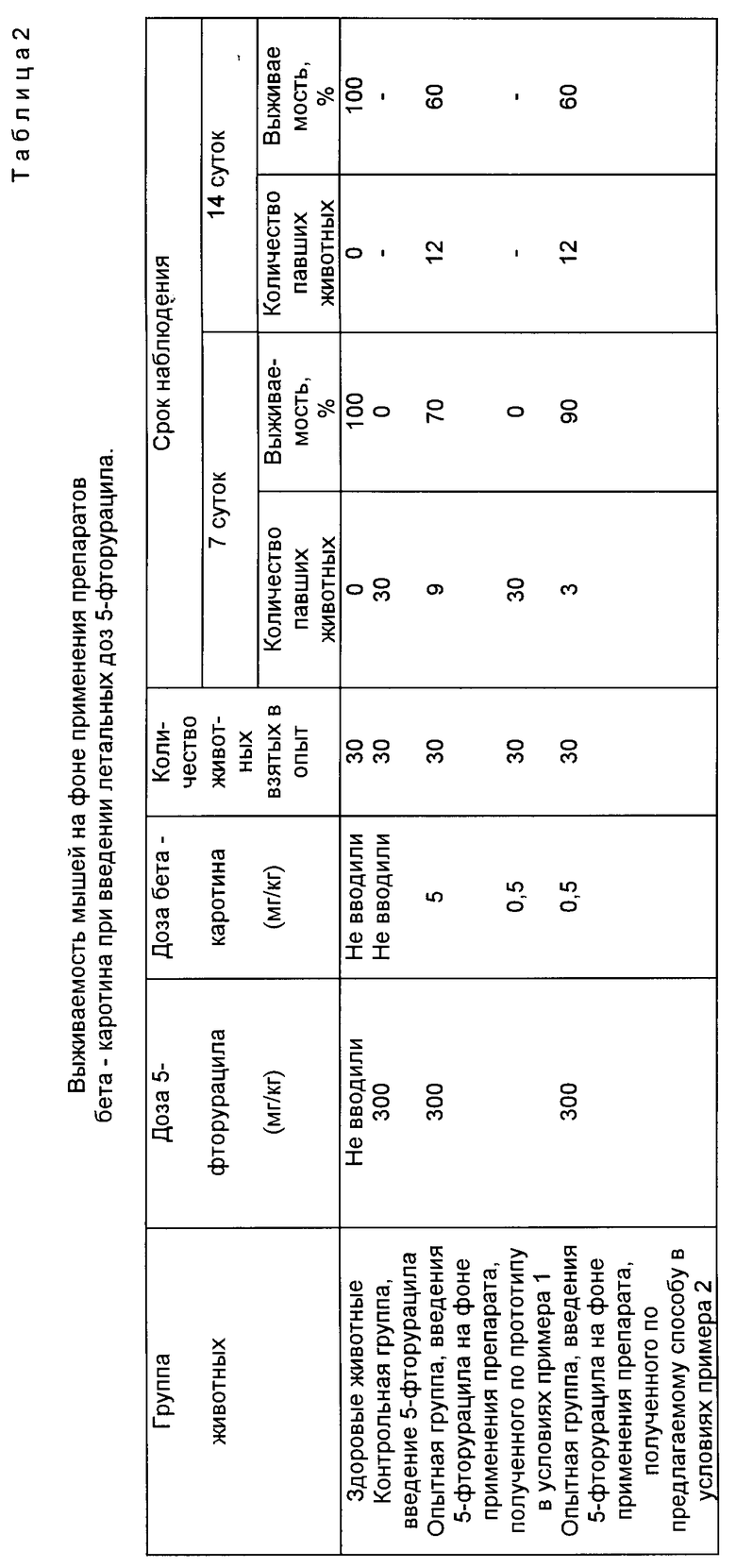
Кроме того, в качестве дополнительного контроля наблюдали группу здоровых интактных животных, получавших только стандартный рацион. Учет павших животных проводили на 7 и 14 сут после введения цитостатика. Результаты исследований приведены в табл.2.
Результаты исследований, представленные в табл.2, свидетельствуют, что введение 5-фторурацила в дозе 300 мг/кг веса контрольной группе животных приводит к 100% их гибели на первом сроке наблюдения (7 сут). В то же время в опытной группе мышей, получавших водорастворимый препарат бета-каротина, полученный по прототипу в дозе 5 мг/кг, к 7 дню погибло 9 из 30 животных, взятых в опыт (выживаемость 70%). К 14 дню наблюдения выживаемость мышей в этой группе составила 60%
Введение препарата бета-каротина, полученного по прототипу в дозе 0,5 мг/кг, не оказывало влияния на выживаемость мышей, получивших летальные дозы цитостатика и все животные в этой группе, как и в контроле, погибли к 7 дню наблюдения.
Наибольшей защитной эффективностью обладал препарат бета-каротина, полученный по предлагаемому способу. При использовании этого препарата в дозе 0,5 мг/кг выживаемость мышей к 7 и 14 дню после введения цитостатика составила 90% и 60% соответственно.
Полученные данные позволяют сделать вывод о высокой биодоступности препарата бета-каротина, полученного по предлагаемому способу. Эффективная доза этого препарата при лечении летального токсикоза, вызванного цитостатиком, была в 10 раз ниже, чем препарата бета-каротина, полученного по прототипу.
Пример 6. Исследование эффективности препаратов бета-каротина при сублетальном токсикозе, вызванном цитостатическим препаратом 5-фторурацилом.
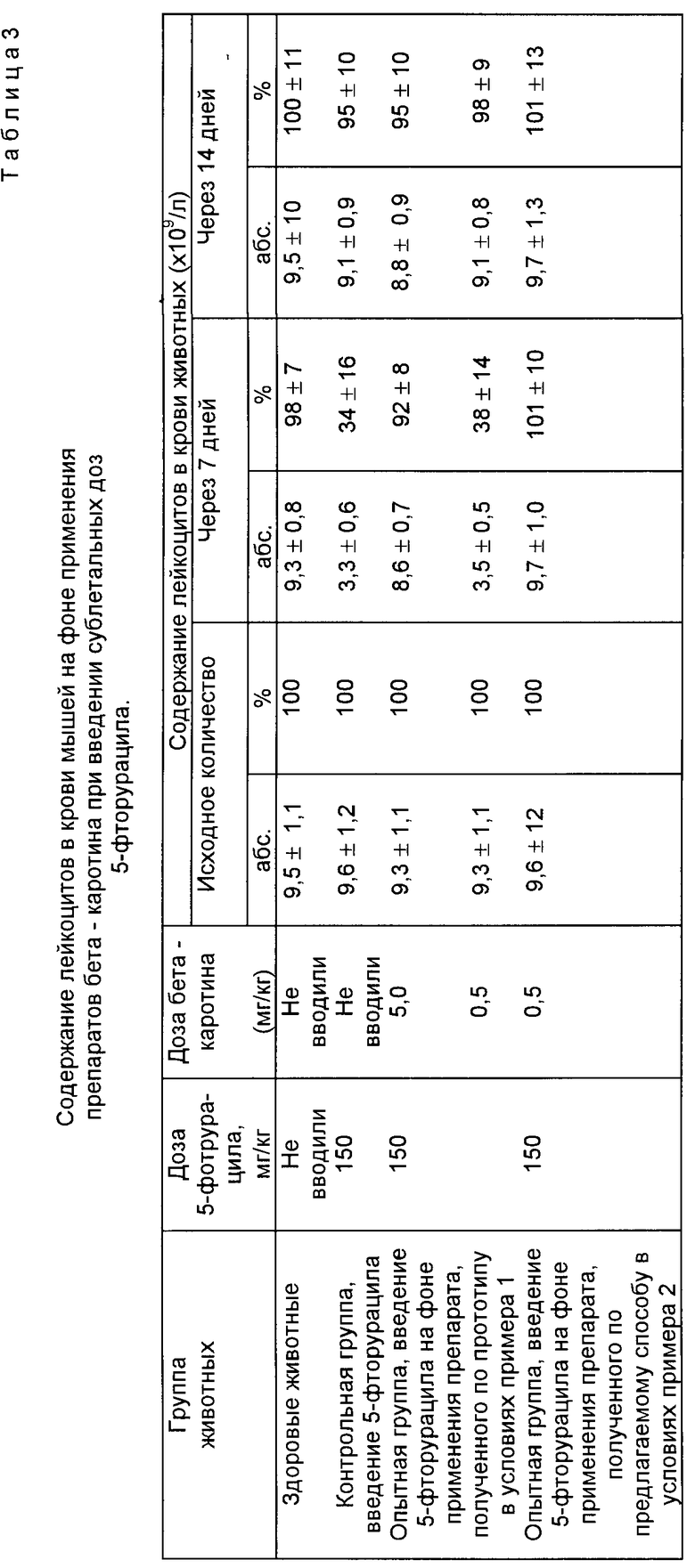
Изучено влияние перорального применения препаратов бета-каротина, полученных по прототипу (пример 1) и по предлагаемому способу (пример 2) на содержание лейкоцитов в крови мышей после введения 5-фторурацила. Для этого цитостатик вводили внутрибрюшинно в субтоксической дозе 150 мг/кг, которая традиционно используется при изучении действия цитостатиков на гепопоэз [6] Препараты бета-каротина применяли аналогично условиям примера 3. Количество лейкоцитов в крови животных подсчитывали после окраски мазков по Романовскому-Гимзе. Результаты исследования представлены в табл. 3.
Данные, представленные в табл. 3 показывают, что у мышей контрольной группы, получивших субтоксическую дозу 5-фторурацила, на 7 сутки развилась лейкопения и количество лейкоцитов составляло 3,3±0,6•109/л при исходном значении 9,6±1,2•109/л. На 14 день после инъекции цитостатика уровень лейкоцитов достигал исходного значения.
В опытных группах мышей, получавших препарат бета-каротина, изготовленный по прототипу в дозе 5,0 мг/кг и получавших препарат бета-каротина, изготовленный по предлагаемому способу в дозе 0,5 мг/кг, уровень лейкоцитов через 7 сут после введения цитостатика не снижался и был близок к исходным значениям. В группе животных, получавших препарат бета-каротина, изготовленный по прототипу, в дозе 0,5 мг/кг, на 7 сут после введения цитостатика развилась лейкопения и количество лейкоцитов составляло 38±14% от исходного количества.
Полученные данные свидетельствуют о том, что эффективная доза препарата бета-каротина, полученного по предлагаемому способу, в 10 раз ниже, чем эффективная доза препарата бета-каротина, полученного по прототипу при лечении лейкопений, вызванных субтоксическими дозами цитостатика 5-фторурацила.
Пример 7. Исследование эффективности препаратов бета-каротина на течение экспериментальной гриппозной инфекции.
Исследована эффективность перорального введения препаратов бета-каротина, полученных по прототипу и по предлагаемому способу на течение экспериментальной гриппозной инфекции. Опыты проводили на белых беспородных мышах. Препараты бета-каротина вводили мышам перорально в течение 5 дней в дозах 0,004 мг и 0,02 мг ежедневно (0,02 мг и 0,1 мг на курс, соответственно).
Для воспроизведения летальной гриппозной инфекции использован вирус гриппа A/Aichi /2/68(H3N2). Животных инфицировали интраназально в дозах 1 ЛД50 и 10 ЛД50 не менее чем за 1 ч после последнего введения препаратов бета-каротина. Степень профилактической эффективности препаратов оценивали по количеству погибших животных, средней продолжительности жизни погибших животных, по степени защиты и индексу защиты животных [7,8]
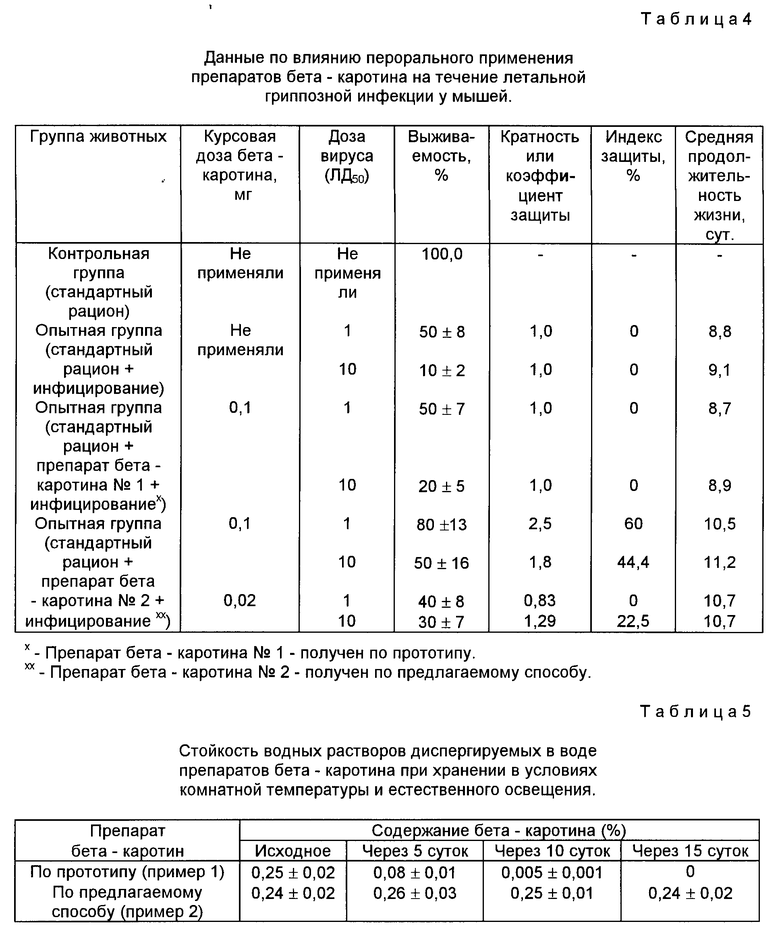
Результаты влияния перорального введения препаратов бета-каротина на течение экспериментальной гриппозной инфекции представлены в табл.4.
Данные табл.4 показывают, что пероральное применение препарата бета-каротина, изготовленного по предлагаемому способу, в курсовой дозе 0,1 мг на животное, проявляет выраженную защиту мышей от летальной гриппозной инфекции, обеспечивая выживаемость 80±13% животных от 50% смертельной дозы вируса гриппа и 50±16% животных от десяти 50% смертельных доз. При этом коэффициент защиты мышей составил 2,5 и 1,8 и индекс защиты 60,0% и 44,4% соответственно при введении одной и десяти 50% летальных доз вируса гриппа. При этом наблюдалось также увеличение средней продолжительности жизни погибших животных от 8,8-9,1 сут в контрольной группе до 10,5-11,2 сут в группе животных, получавших бета-каротин, изготовленный по предлагаемому способу. Этот же препарат, введенный в курсовой дозе 0,02 мг, слабо защищал животных от летальной гриппозной инфекции (индекс защиты 0-22,5%).
Препарат бета-каротина, изготовленный по прототипу и используемый в курсовых дозах 0,1 мг и 0,02 мг на животное, не обеспечивал защиты от летальной гриппозной инфекции (индекс защиты 0).
Пример 8. Исследование стойкости водных растворов диспергируемых в воде препаратов бета-каротина при хранении в условиях комнатной температуры и естественного освещения.
Препараты бета-каротина, полученные в условиях примеров 1 и растворили в дистиллированной воде, смешав 10 г порошка с 90 мл воды. Препараты разлили в пенициллиновые флаконы по 10,0 мл.
Определили содержание бета-каротина в водных растворах сразу после растворения и через 5, 10 и 15 сут хранения в условиях комнатной температуры и естественного освещения. Результаты исследования представлены в табл.5.
Данные табл.5 показывают, что после растворения в воде препарат бета-каротина, изготовленный по прототипу, согласно условиям примера 1 быстро теряет активность при хранении в условиях комнатной температуры и через 15 суток раствор становится бесцветным и бета-каротин в нем не определяется. Препарат бета-каротина, изготовленный согласно предлагаемому способу, после растворения в воде не теряет своей активности в течение 15 дней в условиях комнатной температуры и естественного освещения.
Пример 9 (по предлагаемому способу). Влияние состава фосфолипидов на качество диспергируемого в воде препарата бета-каротина.
Получили 4 образца диспергируемых в воде препаратов бета-каротина согласно условиям примера 2 с использованием следующих фосфолипидов:
1. Яичный лецитин (препарат 1).
2. Лецитин, холестерин и дицетилфосфат в молярном соотношении 10:2:1 (препарат 2).
3. Суммарные фосфолипиды из бобов сои (препарат 3).
4. Суммарные фосфолипиды из микроорганизмов Е.coli штамм М-17 (препарат 4).
Определили содержание бета-каротина в полученных препаратах сразу после изготовления и через 15 дней хранения водных растворов согласно условиям примера 8. Результаты исследования представлены в табл.6.
Данные табл. 6 показывают, что состав фосфолипидов не оказывает влияния на качество диспергируемых в воде препаратов бета-каротина, получаемых по предлагаемому способу. Для получения препаратов могут быть использованы отдельные фосфолипиды,искусственные смеси фосфолипидов,суммарные фосфолипиды из растительного и микробиологического сырья. Кроме этого, данные примера 2 показывают, что для получения препарата могут быть использованы суммарные фосфолипиды из животного сырья.
Пример 10 (по предлагаемому способу). Влияние концентрации фосфолипидов на качество диспергируемого в воде препарата бета-каротина.
Получили 4 образца диспергируемых в воде препаратов бета-каротина согласно условиям примера 2 с использованием следующих концентраций фосфолипидов по отношению к органическому растворителю: 4, 8, 16 и 32% (вес/объем). Определили содержание бета-каротина в полученных препаратах сразу после изготовления. Растворили препараты в воде и определили содержание бета-каротина через 15 дней хранения водных растворов согласно условиям примера 8. Результаты исследования представлены в табл.7.
Данные табл. 7 показывают, что при использовании любых концентраций фосфолипидов в пределах их растворимости в 2,5% растворе бета-каротина в хлороформе могут быть получены кондиционные препараты диспергируемого в воде препарата бета-каротина.
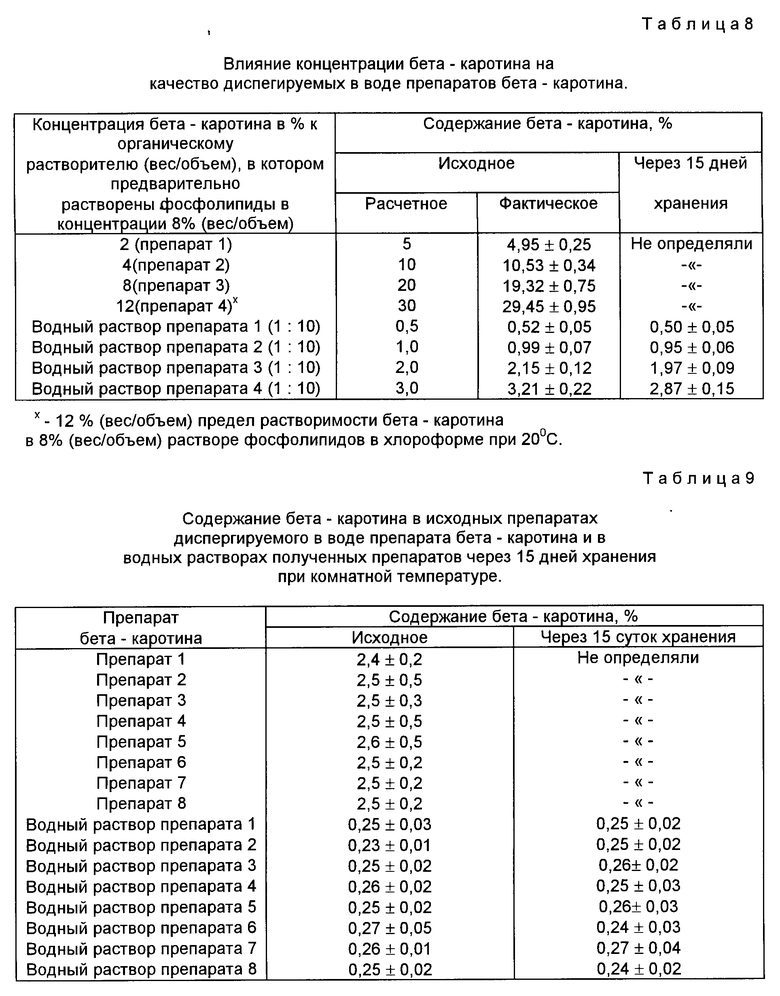
Пример 11 (по предлагаемому способу). Влияние концентрации бета-каротина на качество диспергируемого в воде препарата бета-каротина.
Получили 4 образца диспергируемых в воде препаратов бета-каротина согласно условиям примера 2 с использованием 8% раствора (вес/объем) фосфолипидов в органическом растворителе и следующих концентраций бета-каротина по отношению к органическому растворителю: 2, 4, 8, 12 (вес/объем); 12% (вес/объем) бета-каротина является пределом его растворимости в 8% (вес/объем) растворе фосфолипидов в хлороформе при температуре плюс 20Б198ЮС. Определили содержание бета-каротина в полученных препаратах сразу после изготовления. Растворили препараты в воде и определили содержание бета-каротина в водных растворах согласно условиям примера 8. Результаты исследования представлены в табл.8.
Данные табл. 8 показывают, что при использовании любых концентраций бета-каротина в пределах его растворимости в 8% растворе фосфолипидов в хлороформе (то есть до 12% включительно) могут быть получены кондиционные препараты диспергируемого в воде препарата бета-каротина с содержанием бета-каротина в сухом препарате в концентрациях 5, 10, 20 и 30% (вес/вес).
Использование концентрации бета-каротина выше пределов его растворимости в растворе фосфолипидов в органическом растворителе нецелесообразно, так как бета-каротин кристаллизуется и выпадает в осадок. Бета-каротин в кристаллической форме обладает низкой биодоступностью и малоактивен.
Данные примеров 10 и 11 показывают, что предлагаемый способ позволяет получать кондиционные препараты диспергируемого в воде бета-каротина при использовании фосфолипидов и бета-каротина в концентрациях, обеспечивающих их совместную растворимость в органическом растворителе при заданной температуре. При температуре плюс 20oС (вес/объем) является верхним пределом растворимости суммарных фосфолипидов головного мозга крупного рогатого скота в хлороформе, в котором растворен 1% (вес/объем) бета-каротина. При этой же температуре в 8% (вес/объем) растворе суммарных фосфолипидов головного мозга может быть растворено 12% (вес/объем) бета-каротина. Использование таких концентрацией бета-каротина и фосфолипидов позволяет получать диспергируемые в воде сухие препараты с содержанием бета-каротина до 30% (вес/вес).
Пример 12. Влияние сухих порошкообразных наполнителей на качество диспергируемого в воде препарата бета-каротина.
Получили 8 образцов диспергируемого в воде препарата бета-каротина согласно условиям примера 2 с использованием следующих порошкообразных наполнителей: сорбит (препарат 1), ксилит (препарат 2), маннит (препарат 3), поваренная соль (препарат 4), декстран Т-20 (препарат 5), полиэтиленгликоль м.в. 20000 (препарат 6), поливинилпирролидон (препарат 7), поливиниловый спирт (препарат 8).
Определили содержание бета-каротина в препаратах сразу после их получения и после хранения в течение 15 дней хранения водных растворов согласно условиям примера 8.
Результаты исследования представлены в табл. 9.
Данные табл. 9 показывают, что при использовании различных сухих порошкообразных наполнителей, таких как сорбит, ксилит, маннит, поваренная соль, декстран, полиэтиленгликоль, поливиниловый спирт, поливинилпирролидон и других не растворимых в хлороформе порошков, получаются кондиционные препараты бета-каротина, хорошо диспергируемые в воде.
Таким образом, данные, представленные в примерах 1-12, показывают, что предлагаемый способ позволяет легко получать вододиспергируемые препараты бета-каротина, пригодные для длительного хранения и обладающие высокой эффективностью при применении для лечения и профилактики различных заболеваний.
Литература
1. Патент N 4031094, Германия.
2. Патент N 228528, ЧССР.
3. Патент N 2024505, Россия.
4. Лемберг В.К. Рогачева С.А. Влияние обогащения рациона мышей СВА синтетическим бета-каротином на их выживаемость при гамма-облучении. Радиобиология, 1990, вып.6. с.843-844.
5. Seifter E. Retura D. Padaver J. Morbidity and Mortality reduction by supplemental vitamin A or beta-carote- ne in CBA mice given total body -radiation. J.Nat. Cancer Inst. 1984, v.73, p.1167-177.
6. Lerner C. Harrison D. 5-tluorouracil spares hemopoietic stem cells responsible for long-term repopulation. Exp. Hematol. 1990, v.18, p.119-118.
7. Методы испытания и оценки противовирусной активности химических соединений в отношении вируса гриппа. Л. 1977.
8. Чижов И. П. Ершов Ф.И. Индулен М.К. Основы экспериментальной химиотерапии вирусных инфекций. Рига "Зинатие", 1988.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНЫХ ПРЕПАРАТОВ | 1998 |
|
RU2130771C1 |
| КОСМЕТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2116778C1 |
| ВИТАМИННАЯ ДОБАВКА | 1993 |
|
RU2080858C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ СО СНИЖЕННЫМИ ПОБОЧНЫМИ ЭФФЕКТАМИ, СОДЕРЖАЩАЯ ПРОТИВООПУХОЛЕВЫЙ АГЕНТ И ПРОИЗВОДНОЕ ГИДРОКСАМОВОЙ КИСЛОТЫ | 1998 |
|
RU2214238C2 |
| Рекомбинантный вакцинный препарат пролонгированного действия для профилактики чумы у млекопитающих и человека и способ его получения | 2015 |
|
RU2671525C2 |
| ПРОТИВОМИКРОБНЫЕ СРЕДСТВА НА ОСНОВЕ БЕТА-ГЛЮКАНОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2746504C1 |
| ПРОТИВООПУХОЛЕВЫЕ И АНТИВИРУСНЫЕ ПЕПТИДЫ | 2004 |
|
RU2267496C2 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИТОЧУВСТВИТЕЛЬНЫХ ЛИПОСОМ | 2007 |
|
RU2357724C1 |
| ГИДРАТИРОВАННЫЕ N-ФУЛЛЕРЕН-АМИНОКИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2011 |
|
RU2458046C1 |
| ЭМУЛЬСИОННЫЙ ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2001 |
|
RU2189231C1 |

Изобретение относится к области медицинской промышленности, а именно к способам получения диспергируемых в воде препаратов бета-каротина. Сущность изобретения: осуществляют смешивание кристаллического бета-каротина, сухого порошкообразного наполнителя, фосфолипидов и летучего органического растворителя с последующим удалением растворителя в условиях вакуума при постоянном перемешивании до получения сухого мелкодисперсного порошка. Технический результат: упрощение способа, повышение стабильности препарата. 4 з. п.ф-лы, 9 табл.
2. Способ по п.1, отличающийся тем, что в качестве органического растворителя используют растворитель, в котором растворяются фосфолипиды и бета-каротин.
| RU, патент, 2024505, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-01-20—Публикация
1996-03-06—Подача