Изобретение относится к использованию парамагнитных и сверхпарамагнитных веществ в качестве усиливающих средств для диагностической магнитометрии, особенно использующей магнитометр со сверхпроводящим квантовым интерференционными датчиком (SQUID) и предпочтительно в качестве контрастных - средство для формирования изображений при магнитометрическом формировании изображений, в частности формирования изображений при помощи SQUID.
В 1963 г.Джеймс Цимерман, исследователь в Форд Мотор Компани, наблюдал, что, когда в сверхпроводящей петле присутствует не сверхпроводящий переход, создается особый эффект. Этот эффект чрезвычайно чувствителен к магнитному потоку, и на основе работ Циммермана были разработаны самые высокочувствительные магнитометры SQUID, в настоящее время они выпускаются такими компаниями, как биомагнетик Текнолоджиз Инк из Сан Диего, Калифорния и Сименс АГ из Западной Германии.
Магнитометры SQUID обычно включают сверхпроводящую датчиковую катушечную систему и детекторную систему (SQUID), которая сама по себе включает один или два перехода Джозефсона, введенные в петлю сверхпроводящей проволоки. Магнитный поток в таких петлях квантуют, и изменения магнитного поля, испытываемые датчиковыми катушками, вызывают немедленное и измерение тока, текущего через детектор. Доступные магнитометры SQUID включают как одно-, так и многоканальные датчики, причем последние способны обнаруживать магнитные поля на многих участках одновременно.
Магнитометры SQUID способны измерять магнитные поля вплоть до 10-14 Тл и таким образом способны обнаруживать поля, генерируемые благодаря биологической деятельности, такие, например, как поля порядка 10-13 Тл, которые индуцируются благодаря электрической деятельности мозга. Источники нервных сигналов можно, таким образом, отследить в пределах до нескольких миллиметров (SQUID и их использование в изучении биомагнетизма обсуждается, например, Wolsky и др. Scientific American Februry, 1989, с.60-69, Philo u Rev. Sci. lnatrum. 48: 1529-1536 (1977), Cohen IREE Trans.Mag.MAG-11(2): 694-700 (1975) Far ell и др. Applied Physics Communicationf I/I/: 1-7 (1981), Far ell и др.IEEE Trans. Mag. 16:818-823 (1980), и Brittenham и др. ng.J.Med 307 (27): 1671-1675 (1982). SQUID могут быть разработаны для обнаружения магнитного поля или могут быть градиентометрического типа и может существовать несколько конструкций.
В действительности развитие биомагнитного анализа было тесно связано с разработкой детекторов SQUID, поскольку традиционные магнитометры, например детектор Бартингтона, или гауссметр с преобразователем Холла на несколько порядков менее чувствительны к изменениям магнитного поля.
В изучении биомагнетизма или более конкретно в измерении магнитной восприимчимости in vivo чувствительность SQUID была такой, что внимание исследователей концентрировалось главным образом на трех областях - обнаружении электрической активности в тканях тела посредством обнаружения сопутствующих изменений магнитного поля, in vivo определений концентраций железа в печени с целью обнаружения избытка или недостатка железа в печени, и обнаружении загрязнения ферромагнитными частицами в легких.
В первых двух случаях магнитные поля, обнаруживаемые посредством SQUID, возникают вследствие нормальной или стимулированной нервной деятельности или вследствие обычного присутствия (парамагнитного) железа в печени. В третьем случае загрязнение частицами вызывается магнитными частицами, например магнетитом, и их магнитное действие сначала увеличивается до предела благодаря помещению объекта в магнитное поле. Конечное намагничивание можно обнаружить при помощи SQUID в течение нескольких месяцев, на протяжении которых оно уменьшается.
Благодаря чрезвычайной чувствительности технологии SQUID, позволяющей регистрировать электрическую активность тела, мало значения придавалось использованию SQUID для генерирования изображений, в частности двух или трехмерных изображений внутреннего физического строения тела, а не изображений электрической активности.
Для того, чтобы такое определение местонахождения было эффективным, необходимо иметь возможность генерирования различий магнитной восприимчивости между различными тканями, органами и протоками тела, а не делать это, вызывая злектрическую активность или полагаясь на естественные скопления недиамагнитного вещества, в настоящей работе мы предлагаем применение в диагностической магнитометрии, особенно в магнитометрическом формировании изображений, усиливающих средств, включающих парамагнитные или сверхпарамагнитные вещества.
SQUID достаточно чувствительны, чтобы обнаружить изменения в локальной магнитной восприимчивости в тех случаях, когда такие средства распределяются внутри тела, позволяя тем самым генерировать магнитометрические сигналы с усиленным контрастом или изображения, например, для использования в диагностике.
Таким образом, с точки зрения одного аспекта, настоящее изобретение предусматривает использование физиологически приемлемого парамагнитного или сверхпарамагнитного вещества, в частности парамагнитных хелатов иона лантанидного металла и свободных или связанных с матрицей сверхпарамагнитных частиц, для производства диагностического средства для использования в магнитометрическом анализе, предпочтительно путем магнитометрического формирования изображений человеческого тела или тела животного, предпочтительно млекопитающего.
С точки зрения другого аспекта, изобретение, предусматривая также метод диагностики человеческого тела или тела животного, который включает применение к указанному телу физиологически приемлемого парамагнитного или сверхпарамагнитного вещества и генерирование магнитометрического сигнала по крайней мере части указанного тела, в котором распределяется указанное вещество, предпочтительно, но не существенно использованием системы, основанной на SQUID, особенно на многоканальном SQUID.
С точки зрения следующего аспекта настоящее изобретение также предусматривает метод генерирования магнитометрического изображения человеческого тела или тела животного, который включает применение к указанному телу физиологически приемлемого парамагнитного или сверхпарамагнитного вещества и генерирование магнитометрического изображения по крайней мере части указанного тела, в котором распределяется указанное вещество, в частности генерирование двух или трехмерного структурного изображения, и предпочтительно, но не существенно с использованием устройства для формирования изображения на основе SQUID, особенно многоканального формирователя изображений SQUID
С точки зрения еще одного аспекта, настоящее изобретение также предусматривает способ обнаружения изменений в магнитной восприимчивости внутри человеческого тела или тела животного, этот способ включает применение к указанному телу физиологически приемлемого парамагнитного или сверхпарамагнитного вещества при том, что магнитометр непрерывно или периодически регистрирует магнитную восприимчивость по крайней мере части указанного тела, в котором распределяется указанное вещество, чтобы, например, генерировать магнитометрические сигналы или предпочтительно изображения изменений или аномалий в потоке крови или зарегистрировать размещение и скопление этих веществ в областях тела, например поступление и накапливание целенаправляющих для тканей или органов веществ в намеченной области, например в опухоли или в ретикулоэндотелиальной системе и т.д. можно генерировать их магнитометрическое изображение.
С точки зрения следующего аспекта настоящее изобретение предусматривает также использование физиологически приемлемого парамагнитного или сверхпарамагнитного вещества, в частности парамагнитных хелатов иона лантанидного металла и свободных или связанных с матрицей сверхпарамагнитных частиц для производства диагностической композиции для использования в способе в соответствии с изобретением.
Метод и способ настоящего изобретения можно осуществлять, используя любую магнитометрическую методику, но особенно они подходят для использования магнитометров на основе SQUID. Таким образом, способ настоящего изобретения можно осуществить, используя, например, одноканальные SQUID, но особенно предпочтительно было бы осуществить его, используя многоканальную систему SQUID.
Парамагнитные или сверхпарамагнитные вещества, используемые в соответствии с настоящим изобретением и для удобства называемые здесь магнитометрическими диагностическими средствами, могут ввиду чувствительности магнитометров SQUID представлять собой любое вещество, которое является биологически приемлемым в дозах и в форме и используемом пути применения. Конечно нет необходимости предварительного намагничивать объект после применения диагностического средства перед перемешиванием объекта магнитного поля или магнитно защищенное помещение. Однако контрастное средство может быть предварительно намагничено до применения, может также быть благоприятной предварительная обработка магнитного вещества для предотвращения конгломерации и получения таким образом максимального поля для данной концентрации вещества.
Способ и метод по настоящему изобретению можно осуществить с наложением или без наложения внешнего магнитного поля (т.е. помимо или вместо естественного магнитного поля Земли). Наложенные поля могут быть переменными, например импульсными, или постоянными. В тех случаях, когда используемое контрастное средство является сверхпарамагнитным, метод и особенно способ настоящего изобретения можно благоприятным образом осуществлять с предварительным намагничиванием и при отсутствии наложенного магнитного поля или лишь со статическим наложенным магнитным полем. Однако в тех случаях, когда используемое контрастное средство является парамагнитным, а не сверхпарамагнитным, магнитометрическое исследование в соответствии с настоящим изобретением будет предпочтительно осуществляться с объектом, подвергнутым действию наложенного импульсного или постоянного магнитного поля по крайней мере в интересующей области. Это поле может быть относительно локализовано по действию и может составлять вплоть до 10-4 Тл, но в одном удобном варианте осуществления может иметься основное поле обычно вплоть до 10-1 Тл, генерируемое основными катушками магнитнорезонансного формирователя изображений. В тех случаях, когда контрастное средство является сверхпарамагнитным, внешнее поле можно, но не нужно применять.
Особенно предпочтительные диагностические средства будут включать средства, которые имеют относительно высокие магнитные средства, которые имеют относительно высокие магнитные восприимчивости, в частности сверхпарамагнитные частицы и вещества, содержащие разновидности высокоспиновых парамагнитных металлов, особенно ионы высокоспинового переходного металла и лантанида, в частности ионы Mn, Fe, Dy, Gd, Eu, Tb, Tm, Yb, Er и Ho в особенности Dy (III). Широкое разнообразие таких веществ было предложено для использования в качестве контрастных средств в магниторезонансном формировании изображений (MR1), а контрастные средстве для MR1 будут, как правило, также пригодны для использования в качестве магнитометрических диагностических средств (МД), включая контрастные средства для магнитометрического формирования изображений (MI).
Таким образом, особо можно упомянуть сверхпарамагнитные контрастные средства, уже предложенные для использования в качестве контрастных средств MRI, например, следующими авторами: Jacobsen и др. в патенте США N 14863716, Klaveness и др. в WO-A-89(11878, Schroder и др. в WO-А-35/02772, Groman и др. в WO-A-88/0060, Schering и ЕР-186616, Widder и др. в AJR 148: 399-404 (1987), Hemmingson и др. и Асtа Radiologica 28:706-705 (1987), Hahn и др. в Society of Magnetic Resonance in Medicine, 7th Annual Meeting, 1988, Book of Abstracts,page 738, Saini и др. b Padiology 162:211-216 (1987), Clemen и др. b CMR89), MR20 (1989) и т.д.
Сверхпарамагнитные частицы, свободные и связанные с носителем, хорошо известны и их получение описывается в целом ряде библиографий, например WО-А-83-03920 (Ugelstad), WO-A-89-(03675 (Schreoer), WO-A-83/03426 (Schr6der) WO-A-88/06632 (Josephson), патенте CL N 4675173: ДЕ-А-3508000, патенте США N 4951675 и WO-А-88/00060.
Таким образом, литература содержит много предложений для композиции сверхпарамагнитных частиц, в частности, предполагает, что частицы можно применять или свободными (т. е. без покрытия и не связанными с каким-либо другим веществом), или с покрытием, например покрытие декстраном (см. например, патент США N 445377) или нанесенными на или включенными в матричную частицу (например, полисахарид см. например, WO-А-/03320 и WO-А-85/02772) или связанными с образцами, целенаправляющими для органов или тканей, например, биомолекулой, такой, как антитело или гормон (см. например, WO-А-38/00060 и WO-А-88/06632/.
Благодаря чувствительности SQUID, которая должна позволять обнаруживать очень маленькие количества или даже единственную матричную частицу со сверхпарамагнитным кристаллом, формирование изображений опухолей или обнаружение, использующее связанные с антителами сверхпарамагнитные частицы, может иметь существенный практический интерес.
Для такого формирования изображений опухолей или обнаружения можно удобным образом использовать матричные частицы со сверхпарамагнитным кристаллом, в которых матрица связывается с антителом, или покрытие, например, связывается с антителом, или даже парамагнитные полихелаты, связанные с антителом, предпочтительно полихелаты, в которых хелатированные парамагнитные ионы представляют собой высокосоциновые лантаниды, например, Dy (Ш), Но (III) и Er (III). Парамагнитным полихелатам в последнее время уделяли много внимания как возможным контрастным средствам MR1 и рентгеновского излучения, они обсуждаются, например, в WO-А-50-/12050.
Парентерально применяемые измельченные МД средства также представляют особый интерес в формировании изображений печени, селезенки, благодаря деятельности ретикулоэндетелиальной системы в удалении таких частиц из потока крови. Однако МД средства и особенно измельченные средства можно также с успехом использовать в магнитометрической диагностике или формировании изображений протоков тела или полостей, имеющих нерудные полые протоки, например, желудочно-кишечного тракта, мочевого пузыря и матрики, в тех случаях, когда средство МД можно применять перорально, ректально или через катетер в интересующую полость тела.
Уже известно много различных путей достижения специфичности тканей и органов для растворимых и измельченных диагностических средств.
Так, при помощи присоединения к жирным кислотам и другим веществам с особым гидрофильно/гидрофобным соотношением средство может после внутривенной инъекции эффективно аккумулироваться в гепатоцитах. Гепатоциты также содержат особые лектины, присутствующие на их поверхности. Последние заставляют особые олигосахариды и гликопротеины аккумулироваться в гепатоцитном отделе печени. Клетки Кюпфера, а также эндотелиальные клетки печени также имеют на своей поверхности уникальные лектины, заставляющие другие типы глинопротеинов аккумулироваться в этих отделах. Эндотелиальные клетки печени обладают рецепторами для особых молекул, например гиалуроновой кислоты, позволяющие использовать для этого отдела другие типы целенаправляющих переносчиков.
Можно связывать средство МД с ионоклональными антителами, специфичными почти для каждой макромолекулярной структуры. Различные органы имеют клетки, содержащие на своей поверхности специфические для органа структуры. Таким образом, используя моноклональные антитела, взаимодействующие со специфической для органа структурой, можно получить специфический для органа переносчик.
Кроме того, гормоны, факторы роста и лимфокины часто имеют специфические для органа рецепторы. Следовательно, "естественные" протеины человека этого типа можно также использовать в качестве целенаправляющих средств.
Эти типы целенаправляющих средств будут вызывать аккумулирование в нормальных органах, а если органы деформированы или неоднородны вследствие болезни, сродства МД, присоединенные к таким переносчикам, будут представлять важную диагностическую информация. Однако для непосредственной визуализации болезни следует использовать целенаправляющие переносчики со сродством к специфическим для болезни структурам.
Так, клетки опухолей обладают уникальными поверхностными признаками, и были разработаны моноклональные антитела, взаимодействующие с рядом подобных структур. Таким обраэом, специфические для опухолей моноклональные антитела, связанные со средствами МД, можно использовать для получения информации о болезни, например, посредством визуализации.
Тромбы содержат ряд специфических структур, например фибрин. Следовательно, средства МД, связанные с антителами, специфическими для фибрина, будут после внутривенной инъекции аккумулироваться в сгустках и могут быть использованы для диагностики тромбов.
Так же, как может быть разработан Mabs со сродством сгусткам, существующий в природе протеин tpa имеет сродство к фибрину. Связанные с tPA средства МД, таким образом, аккумулировались бы в тромбах и были бы полезными для их обнаружения.
При некрозе клеток внутриклеточные структуры, такие как миоцин и гистоны, подвергаются действию макромолекул, обычно заключенных в межклеточное пространство. Таким образом, связанные со средствами МД по отношению к обоим указанным структурам можно использовать для визуализации инфарктов/некроза.
В тех случаях, когда сверхпарамагнитные частицы, содержащие контрастную среду, применяются парентерально и особенно интраваскулярно, биоразложение и конечное выделение метаболитов частиц может быть усилено посредством составления композиций частиц с хелатирующим средством в соответствии с описанным в WО-А-89/11873.
Сами по себе сверхпарамагнитные частицы могут быть из любого вещества, которое, хотя предпочтительно нерадиоактивное (если частицы не предназначены также для того, чтобы их обнаруживали по их радиоактивным излучениям при разложении), проявляют сверхпарамагнетизм в кристаллах с размерами домена и суб-домена. Удобно, когда частицы будут из магнитного металла или сплава, например из чистого железа, но более предпочтительно они будут из оксида магнитного железа, например магнетита или феррита такого, как ферриты кобальта, никеля или марганца.
Для использования в качестве средств МД или средств для поиска особо следует упомянуть комплексы парамагнитных металлов, особенно хелатные комплексы, которые были предложены для использования в качестве контрастных средств MRI и рентгеновского излучения.
Для того, чтобы применять парамагнитные металлы в эффективных, но нетоксичных дозах, их в основном нужно применять в ионной форме или более предпочтительно, особенно при более высоких дозах, неионных комплексов, особенно хелатных комплексов, необязательно связанных с носителем большего размера, или целенаправляющими молекулами, которые можно выбрать с тем, чтобы достигнуть особого биораспределения средства МД, например получить целенаправляющее средство для смешения с кровью или ткани, или органа, или уменьшить осмотические свойства МД среды путем увеличения числа парамагнитных центров на молекулу МД средства (или молекулярный ион).
Большое количество соответствующих хелатирующих соединений, полихелатирующих соединений и связанных с макромолекулами хелатирующих соединений для ионов парамагнитных металлов было предложено в патентной литературе за последние десять лет. В этом отношении особое внимание следует уделять патенту США N 4687659 (Quay), патенту США N 4647447 (Gries), патенту США N 4633365 (Sherry), ЕР-А-1586947 (Nycomed), EP-A-299795(Nycomed), WO-A-8933/06979 Nycomed), EP-A-331616 (Sobering), EP-A-292689 (Squibb), EP-A-232751 (Squibb), SP-A-/230893/Bracco/, EP-A-255471 (Schering), EP-A-277088(Schering), EP-A-287465 (Guerbet), N-A-85/05554(Amersham) и документам, упоминаемым в этих патентах, все эти открытия включены в настоящее описание ссылкой.
Особенно подходящие хелатирующие соединения для образования МД средств на основе хелатов парамагнитных металлов для использования в методе и способе настоящего изобретения включают следующие:
N, N, N', N'', N'''-диэтилентриаминпентауксусная кислота (ДТРА), 6-арбоксиметил-3,9-бис/метилкарбамоил-метил/-3,6,9-триазаундекандикарбоновая кислота (ДТРА-ВМА),
6-карбоксиметил-3,5-бис/морфолинокарбонилметил-3,6,9-триазаундекандикарбоновая кислота (ДТРА-ВМО),
1,4,7,10-тетраазациклододекан-N, N', N'', N'''-тетрауксусная кислота (ДОТА),
1,4,7,10-тетраазациклододекан-N, N', N''-триуксусная кислота (ДОЗА), 1-2/оксипропил/-1,4,7,10-тетрааза-N,N',N''-триуксусная кислота (HP-Доза),
1-окси-4,7,10-триазациклододекан-N, N', N''-триуксусная кислота (ДОХА), связанные с полизином ДТРА и производные ДТРА, и ДОЗА и производные ДОЗА (например, ДТРА-полилизин и ДОЗА-полилизин), связанные с декстраном ДТРА и производные ДТРА (ДТРА-декстран), особенно растворимые вещества, имеющие суммарный молекулярньй вес ≥40 КД, предпочтительно в области 60-100 КД, являются эффективными в качестве смешивающегося с кровью средства.
Особенно подходящими ионами парамагнитных металлов для хелатирования такими хелатирующими соединениями являются ионы металлов с порядковыми номерами 21 до 23, 42, 44 и 57 до 71, особенно 57 до 71, более предпочтительно Cr, V, Mn, Fe, Co, Pr, Nd, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb и Lu, в особенности Cr(III), Cr(II), V(II), Mn(III), Mn(II), Fe(III) Fe(II) и Co(II), более предпочтительно Gd(III), Tb(III) Dy(III), Ho(III), Er(III), Tm(III) и Yb(III), из них более предпочтительно Dy(III), Ho(III), и Er(III).
Для того, чтобы осуществлять методы настоящего изобретения с коэффициентом безопасности настолько высоком, насколько это возможно (коэффициент безопасности соотношение между дозой средства МД и его LD50), особенно предпочтительно использовать неионные хелаты или хелаты с низкими осмотическими свойствами, т. е. хелаты, которые не несут суммарного ионного заряда, такие как, например, ДуДТРА-ВМА, или в которых комплекс имеет соотношение между суммарным ионным зарядом и центром парамагнитного металла равное 1,5 или менее.
Кроме того, в тех случаях, когда желательно, чтобы МД средство оставалось полностью или существенной частью внутри протока тела, например в кровеносных сосудах, во время прохождения через интересующую область тела, МД средство предпочтительно использовать измельченным, гидрофильным или смешивающимся с кровью.
Примеры соответствующих смешивающихся с кровью средств включают инертные растворимые связанные с макромолекулой хелаты типа, описанного Nycomed в и ЕР-А-186947 и WO-А-89/06979. Связывание хелатирующего соединения с макромолекулой, например, полисахарида, такого как декстран или его производные, с получением растворимого макромолекулярного хелатирующего соединения, имеющего молекулярный вес выше характерного предела около 40 КД, обеспечивает относительно длительное удерживание контрастного средства в сердечно-сосудистой системе.
Примеры соответствующих гидрофильных средств МД включают хелаты линейных, разветвленных или макроциклических полиаминополикарбоновых кислот и ионов парамагнитных металлов, а также предпочтительно включают хелаты или хелатирующие соединения, в которых одна или более карбоксилатных группировок замещается другими группами, например амидными, сложноэфирными или гидроксаматными, а также такие хелатирующие соединения, в которых основная цепь хелатирующего соединения замещается гидрофильными группировками, такими, например, как оксиалкильные или алкоксиалкильные группы. Хелатируюющие соединения таких типов описываются, например, в Патенте США N 4687658 /Quay/, Патенте США N 4687659 /Quay/, ЕР-А-299795 /Nycomed/ и ЕР-А-130934 /Schering/.
Однако особо следует упомянуть хелаты Gd(III), Dy(III), Ho(III), Er(III) и ДТРА-ВМА, ДТРА-ВМО, HP-ДОЗА, ДОЗА.
Физиологически приемлемые парамагнитные комплексы порфирина, особенно комплексы Mn(III), и менее предпочтительно Gd(III) или Dy(III), также можно использовать в соответствии с настоящим изобретением с особым эффектом, например, при определении местонахождения опухолей. Такие комплексы порфирина описываются, например следующими авторами: Lyon и др. в Magnetic Resonance Medicine 4: 24-33 /1987/, Chen и др. в FEBS 1274 168:70 /1984/ и в Патенте США N 4783529 / Lavelle/. Особо можно упомянуть гематопорфирин, предпочтительно комплексно связанный с Mn(III), но который также можно использовать с кобальтом-58, цинком-65 и палладием-109 в соответствии с описанным Bohdiewiс2 и др.invest. Radiology 25: 765-770 /1990/. Порфирины, такие как тетракис/4-сульфо-натофенил/порфирин /ТРРS / и тетракис / N-метил-4-пиридил/-порфирин /ТМРуР/ уже известны в качестве MRI контрастных средств и описываются в литературе /см. например, Helpern и др. в Maqneti Resonance in Medicine 5: 302-305 /1987/. Patronas и др. в Саnсе, Treatment Repots 70 N.3 р.391 /1986/, Fiel и др. в Magnetic Resonance imaging 5:149-156 /1987/ и Chen и др. выше. Для того, чтобы разместить больший ион металла /например, Gd(III)/, можно в соответствии с настоящим изобретением использовать так называемый "расширенный порфирин" /тексафирин/ в соответствии с описанным в WO-A-90/10633 /Университет Техаса/, J. Am.Chem. Soc. 110; 5586-55 (1988)(Sessler и др.), и Inorganic Chemistry 28: 3390-3333 (1989) (Sessler и др.).
Кроме того, для особого эффекта можно также использовать усилительные парамагнитные комплексы, необязательно связанные с целенаправляющими биомолекулами или макромолекулами, такие как комплексы, описанные в WО-А-90/12050.
Дозы МД средства, используемого в соответствии с методом настоящего изобретения, будут изменяться в зависимости от точной природы используемого МД средства, от используемого магнитометра и от интересующего органа или ткани. Однако предпочтительно дозу следует держать настолько низкой, насколько это возможно, все еще достигая обнаруживаемого изменения в магнитной восприимчивости.
Как правило, МД средства, используемые в соответствии с настоящим изобретенном, следует применять в количестве, достаточном для получения концентрации, выраженной в единицах восприимчивости, составляющей по крайней мере 10-9 электромагнитных единиц/г, предпочтительно по крайней мере 5•10-9 электромагнитных единиц/г, особенно предпочтительно по крайней мере 10-8 электромагнитных единиц/г.
Таким образом, с точки зрения еще одного аспекта настоящее изобретение предусматривает МД среду с магнитной восприимчивостью в водной форме, содержащую физиологически приемлемое парамагнитное или сверхпарамагнитное вещество наряду по крайней мере с одним фармацевтическим носителем или наполнителем, причем магнитная восприимчивость указанной среды (при нормальных условиях) находится в пределах от 10-12 до 10-6, предпочтительно от 10-11 до 2•10-7", особенно предпочтительно от 10-10 до 5•10-8, в частности от 10-9 до 10-8 электромагнитных единиц/г.
Другими словами, для большинства парамагнитных и сверхрамагнитных веществ новая МД среда будет удобным образом содержать магнитный металл при концентрации, составляющей по крайней море 10-14 моль/л, обычно по крайней мере 10-10 моль/л, предпочтительно по крайней мере 10-8 моль/л, в частности по крайней мере 0,05 ммоль/л, особенно по крайней мере 0,2 ммоль/л, более предпочтительно по крайней мере 0,3 ммоль/л, наиболее предпочтительно по крайней мере 1,0 ммоль/л, например от 0,0002 до 2 моль/л, более предпочтительно от 0,0003 до 1,5 моль/л.
МД среда настоящего изобретения может содержать особенно низкие концентрации контрастного средства в тех случаях, когда оно представляет собой высокоспецифичное для небольших опухолей, могут быть достаточными минимальные дозы порядка 10-14 моль/кг, для средств, специфических для печени, минимальные дозы могут быть порядка 10-11 моль/кг, а для средств, которые широко распространяются внутри тела, могут быть достаточными минимальные дозы 10-10 моль/кг. Как правило, дозы будут применяться в объемах от 0,1 мл до 1000 мл. Верхний предел для доз МД средства будет, как правило, сравним с верхним пределом для MRI контрастных средств и может определяться ограничениями, связанными с токсичностью.
Для большинства МД средств достаточная доза будет, как правило, находиться в пределах 0,00 мкмоль до 3 ммоль парамагнитного металла/кг веса тела, особенно 1 мкмоль до 1,5 ммоль/кг, в частности 0,01 до 0,5, и более предпочтительно 0,1-0,4 ммоль/кг.
В тех случаях, когда в соответствии с настоящим изобретенном используют менее чувствительные магнитометры, не являющиеся SQUID, требуемые концентрации МД средства будут конечно выше, чем концентрации, необходимые для использования магнитометров SQUID.
Вполне в пределах квалификации обычного практика в данной области техники определить оптимальную дозу для любого конкретного МД средства при помощи простого эксперимента или in vivo, или in vitro.
В тех случаях, когда МД средство является ионным, как, например, в случае с ДуДТРА, его будет удобно использовать в виде соли с физиологически приемлемым противоионом, например катионом аммония, замещенного анионом, получающимся из неорганической или органической кислоты. В этом отношении особенно предпочтительными являются меглуминовые соли.
Могут быть составлены композиции МД средств с традиционными фармацевтическими или ветеринарными вспомогательными веществами, например стабилизаторами, антиокислителями, средствами, регулирующими осмотические свойства, буферными растворами, средствами, регулирующими pH, и т.д. МД средства могут находиться в виде, подходящем для энтерального или парентерального применения, например перорального, ректального интравескулярного и т.д. Особенно предпочтительно МД средства будут находиться в формах, подходящих для заглатывания, инъекции или вливания непосредственно или после диспергирования, или разбавления физиологически приемлемыми носителем, например водой для инъекций. Таким образом, могут быть составлены смеси контрастных средств в виде традиционных форм принесения, таких как порошки, растворы, суспензии, дисперсии и т. д. однако, растворы, суспензии и дисперсии в физиологически приемлемой среде носителя будут, как правило, предпочтительны.
Поэтому могут составляться смеси средств для применения с использованием физиологически приемлемых носителей или наполнителей в соответствии со способом, полностью находящимся в пределах опыта данной области техники. Например, МД средства необязательно с добавлением фармацевтически приемлемых наполнителей могут быть суспендированы или растворены в водной среде с впоследствии стерилизуемыми конечным раствором или суспензией. Соответствующие добавки включают, например, физиологически биосовместимые буферные растворы, хелатирующие средства (как, например, ДТРА или ДТРА-бисамид, например 6-карбоксиметил-3,9-бис/метилкарбамоил метил/-3,6,9- триазаундекандикарбоновая кислота) или хелатные комплексы кальция (как, например, солевые формы комплекса кальций-ДТРА и комплекса кальций-(ДТРА-бисамид), такие как NaCaДТРабисамид) или (необязательно), например 1- 50 мол. солей кальция или натрия (например, хлорид кальция, глюконат кальция или лактат кальция и т.п.).
Парентерально применяемые формы, например внутривенные растворы, должны быть стерильными и не содержащими физиологически неприемлемых средств и должны иметь низкие осмотические свойства для того, чтобы свести к минимуму раздражение или другие вредные эффекты при применении и, таким образом, МД среда должна предпочтительно быть изотонической или немного гипертонической. Соответствующие переносчики включают водные переносчики, обычно используемые для применения парентеральных растворов, такие как натрий хлоридная инъекция, инъекция Рингера, глюкозная инъекция, глюкозная и натрий хлоридная инъекция, лактированная инъекция Рингера и другие растворы, например, описанные в Remington's Pharmaceutical Sciences, 15 th ed, Easton:Mack Publishing Co. pp. 1405-1412 и 1461-1437 (1975)и The National Formulary XIY, 14 th ed. Washington: American Pharmaceutical Association (1975). Растворы могут содержать консерванты, антимикробные средства, буферные средства и антиокислители, традиционно используемые для парентеральных растворов, наполнители и другие добавки, совместимые со средствами МД и которые не будут мешать производству, хранению или использованию продуктов.
Поскольку контрастную среду MRI можно использовать в качестве среды МД, будет особенно удобным исследовать объект, используя MRI для того, чтобы дополнить или подтвердить диагностическую информации, полученную из магнитометрических исследований. Более того, изображения от MRI и других традиционных средств формирования изображений нужно использовать для предоставления "характерного" изображения, на которое может быть наложена магнитометрическая информация или изображение. Это имеет особое значение в тех случаях, когда биораспределение магнитометрического контрастного средства очень ограничено.
Пример 1. Внутривенное сверхпарамагнитное МД средство для изучения печени, селезенки и перфузии (кровообращения) (сверхпарамагнитные частицы, покрытые декстраном).
Покрытые декстраном сверхпарамагнитные частицы получают из FeCl2, FeCl3 и декстрана в соответствии с примером 7,1 в WO-А-88/00060 (Advanced Magnetics). Средний размер частиц 140 нм.
Готовят дисперсию для инъекций, которая содержит: сверхпарамагнитные частицы, покрытые декстрином 20 мг; физиологический раствор (0,9% хлорида натрия) до 10 мл.
Сверхпарамагнитные частицы диспергируют в солевом растворе и заполняют 10 мл ампулы в асептических условиях. Суспензию обрабатывают ультразвуком перед применением, чтобы обеспечить полное диспергирование частиц.
Пример 2. Внутривенное сверхпарамагнитное средство МД для изучения опухолей (частицы магнетита, покрытые моноклональным антителом).
Сверхпарамагнитные частицы, покрытые моноклональным антителом, получают в соответствии с методом S. Cerdan и др. Magnetic Resonance in Medicine 12: 151-163 (1989).
Антитело представляет собой 33B31 (антитело к IL-2, получаемое от Immunotechl, PPI (антитело саркомы, получаемое от Fodstad, Norwegian Radium Hospital, OsloI, или S4Н9 (антитело к Д2 фрагменту фибриногена, получаемое от Nycomed AS).
Дисперсией частиц заполняют 20 мл ампулы и сушат сублимацией. Каждая ампула содержит 43 мг Fe.
Продукт перед применением диспергируют в 10 мл физиологического раствора.
Пример 3. Внутривенное парамагнитное МД средство для изучения опухолей (моноклональное антитело, меченное стабильными свободными радикалами).
2,2,5,5-тетраметил-3-аминопирролидон-1-оксид радикал связывают с моноклональным антителом в соответствии с методами, описанными в патенте США N 3453288. Антитело такое же, как в примере 2.
Раствором меченого антитела заполняют 10 мл ампулы и сушат сублимацией. Каждая ампула содержит 0,5 ммоль нитроксидных радикалов.
Продукт перед использованием растворяют в 5 мл физиологического раствора.
Пример 4. Внутривенное парамагнитное МД средство для изучения перфузии (Декстран 70-бета-аланин-ДОТА-Ду). Декстран 70-бета-аланин-ДОТА-Ду получают в соответствии с примером 6 в ЕР-А-326226 (Nycomed).
Готовят раствор для инъекций, который содержит: Декстран 70-бета-аланин-ДОТА-Ду 2320 мг и физиологический раствор до 10 мл.
Декстран 70-бета-аланин-ДОТА-Ду растворяют в физиологическом растворе и заполняют 10 мл ампулы в асептических условиях. Раствор содержит 0,14 ммоль Ду-мл.
Пример 5 Внутривенное парамагнитное МД средство (Ду(III)-ДОЗА)
Дисперозий (III) 1,4,7-трискарбоксиметил-1,4,7,10-тетраазациклододекан ) (Ду(III)-ДОЗА) получают в соответствии с примером 10 в ЕР-А-232751.
Готовят раствор для инъекций, который содержит: Ду (III)-ДОЗА 2 ммоль и воду для инъекций до 20 мл.
Ду (III)-ДОЗА растворяют в воде для инъекций, заполняют 20 мл ампулы и стерилизуют нагреванием.
Пример 6. Внутривенное парамагнитное МД средство (Gd(III)-ДТРА).
Гадолиний (III) диэтилентриамин-N, N, N',N'',N''-пентауксусной кислоты ди-N-метилглюкаминовую соль (Gd(III)-ДТРА) готовили в соответствии с примером 5 в патенте США N 4647447 (Sсhering)
Готовят раствор для инъекций, который содержит:
Gd(III)-ДТРА диметилглюкамин 10 ммоль
CaNa3-ДТРА 0,1 ммоль
Вода для инъекций До 20 мл
Gd(III)-ДТРА диметилглюкамин и CaNa3-ДТРА растворяют в воде для инъекций, заполняют 20 мл ампулы и стерилизуют нагреванием.
Пример 7. Внутривенное МД средство (липосомная композиция Ду(III)-ДТРА).
Диспрозий (III) диэтилентриамин-N,N,N',N'',N''-пентауксусной кислоты ди-N-метилглюкаминовую соль (Ду(III)-ДТРА-диметилглюкамин) готовят в соответствии с примером 5 в патенте США N 4647447 (Schering).
Ду(III)- ДТРА диметилглютамин заключают в небольшие однослойные пузырьки в соответствии с методом, описанным в ЕР-А-160552 (Vestar).
Очищенной липосомной дисперсией заполняют 50 мл ампулы и сушат сублимацией. Каждая ампула содержит 0,5 ммоль диспрозия.
Продукт перед применением суспендируют в 20 мл физиологического раствора.
Пример 8. Внутривенное парамагнитное МД средство для изучения опухолей (моноклональное антитело, меченное диспрозием).
Диэтилентриамин N, N, N', N'',N''-пентауксусную кислоту связывают с моноклональными антителами в соответствии с методом, описанным DJ Hоatowich и др. в Science 220:613-615.
Антитело такое же, как в примере 2.
1,0-молярный эквивалент хлорида диспрозия добавляют при перемешивания, величину pH доводят до 5,2, и раствор перемешивают в течение 1 ч.
Раствор диализируют в физиологический раствор в течение 2 дней, затем диализируют в дистиллированную воду. Водный раствором заполняют 5 мл ампулы и лиофилизируют. Каждая ампула содержит 1 ммоль диспрозия.
Перед использованием продукт растворяют в 5 мл или для более низких концентраций в 500 мл физиологического раствора, причем в последнем случае впрыскивается только 5 мл.
Пример 9. Пероральное сверхпарамагнитное МД средство для изучения брюшной полости.
Частицы матрицы сополимера сульфированного стирола-дивинилбензола размером 3 мкм и сами по себе несущие сверхпарамагнитные частицы до суммарного содержания железа 19,4 мас. получают при помощи методов WО-А-83/03920 (SINTEF).
Готовят суспензию для перорального применения, которая содержит, г:
Сверхпарамагнитные частицы 0,1
Оксиэтилцеллюлозу: 8,0
Метил параоксибензоат 0,7
Пропил параоксибензоат 0,15
Этанол 10,0
Сахарин натрия 1,0
Анисовое масло 0,2
Воду До 800г
Оксиэтилцеллюлозу диспергируют в воде при перемешивании в течение 2 ч. Медленно добавляют сахарин натрия и раствор анисового масла, метил и пропил параоксибензоатов в этаноле. Сверхпарамагнитные частицы диспергируют в растворе при интенсивном перемешивания.
Суспензией заполняют 800 мл флакон. Суспензия содержит 15,4 мг железа.
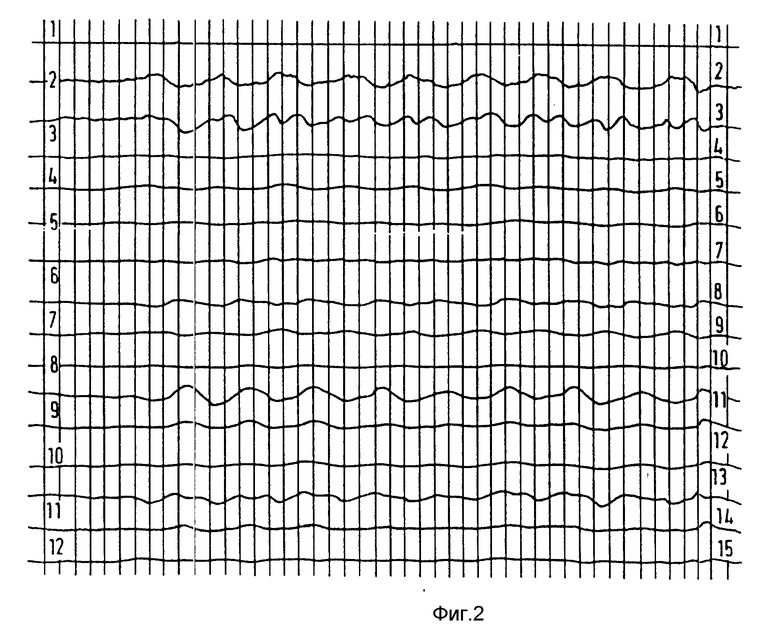
Примеры 10-11. Анализ 0,5%-ных агаровых гелей, содержащих МД средства, на многоканальном SQUID.
Измерительный прибор SQUID: Krenikon (SIMENS AG).
Все образцы во время экспериментов передвигали с одной и той же частотой (приблизительно 4 Гц).
Сигналы SQUID (15 каналов) при отсутствии образца представлены на фиг 1.
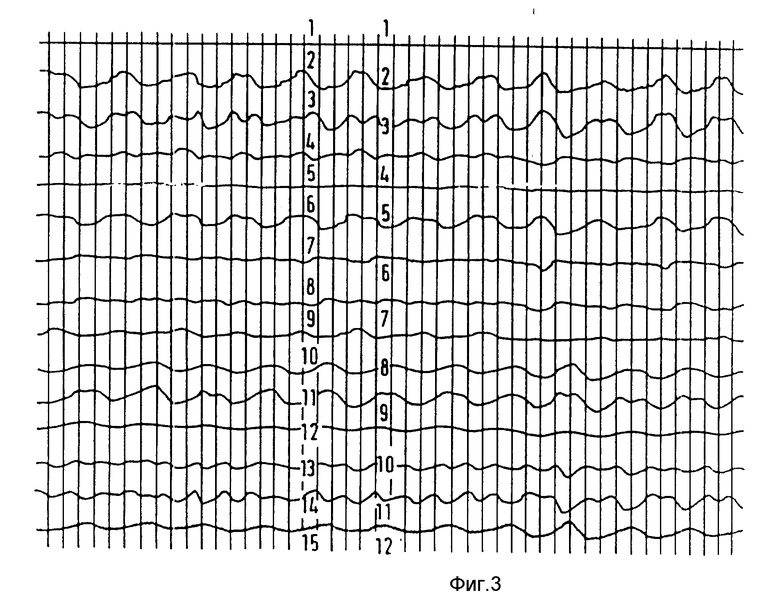
Пример 10. МД средство: сверхпарамагнитные микросферы крахмала, полученные в соответствии с (Schroder и Salford).
Концентрация 0,1 ммоль/кг, расстояние от детектора 1 см.
Результаты представлены на фиг. 2.
Пример 11. МД средство Gd ДТРА-ВМА, полученное в соответствии с патентом США N 4687658 (Quay).
Концентрация 0,1 ммоль/кг, расстояние от детектора 1 см.
Результаты представлены на фиг. 3.
Примеры 12-13. Анализ из тех же самых образцов, что и описанные в примерах 10-11, после намагничивания образцов при помощи небольшого сильного (около 0,3 Тл) постоянного магнита на многоканальном SQUID показывал увеличенный магнитометрический эффект по сравнению с ненамагниченными образцами (поправки на возможное намагничивание пустых пластиковых испытательных трубок сделаны не были).
Примеры 14-15. SQUID анализы образцов в примерах 19-26 осуществляют на измерительном приборе, обнаруживающем магнитные поля. Наблюдается увеличенная эффективность (измерительный прибор, используемый в примерах 10-13, обнаруживает градиенты магнитного поля, а не абсолютные магнитные поля).
Примеры 16-22. Внутривенная МД среда с низкой концентрацией.
МД среду примеров 1-7 разбавляют, 1 об. ч. при помощи 35 об. ч. воды для инъекций, с получением более разбавленной контрастной среды для использования с применением чувствительных магнитометров не основе SQUID.
Еще более низкие концентрации, например, на уровне 10-10-10-6 моль/л можно получить дальнейшим разбавлением.
Изобретение относится к области биологии, в частности к способу исследования организма, основанного на применении физиологически приемлемого парамагнитного или сверхпарамагнитного вещества для получения магниточувствительного средства. Изобретение используется при магнитометрическом анализе тела человека или животного. 2 с. и 14 з.п. ф-лы, 3 ил.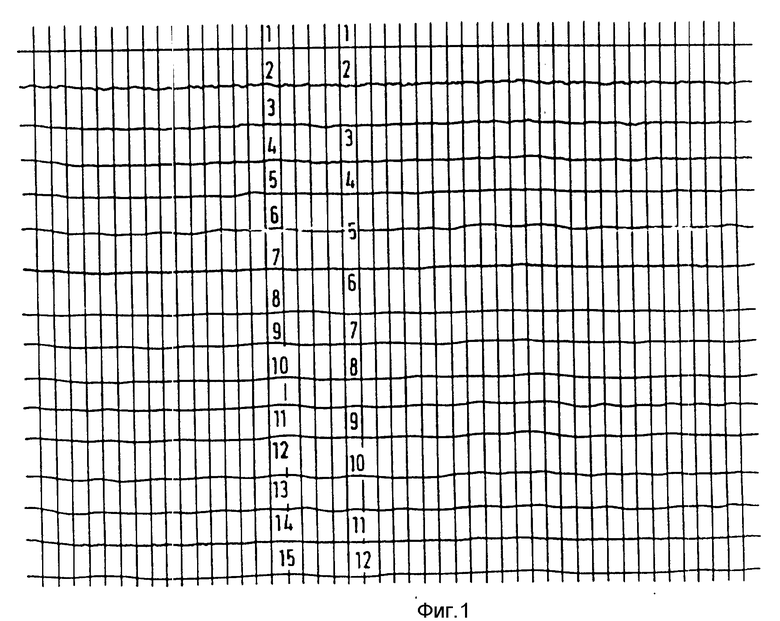
| Scientific American, February, 1989, p | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
Авторы
Даты
1998-01-20—Публикация
1991-03-30—Подача