Изобретение относится к химии и медицине и касается получения препаратов на основе ДНК, обладающих антивирусной, в том числе и анти СПИД/ВИЧ активностью.
Известны способы достижения антивирусной активности препаратов ДНК путем модификации ее с помощью физико-химических или химических методов воздействия.
Так, известны способы модификации ДНК через комплексы с солями поливалентных металлов [4] или ЭДТА [5]. При таком физико- химическом способе модификации препараты ДНК с молекулярной массой 300000-500000 Д смешивают с солями Fe, Ni, Co, Zn, Mn, Mg в молярном соотношении 10-1000:0,5-3,0 [4] либо препараты высокомолекулярной ДНК смешивают с ЭДТА [5].
Получаемые продукты обладают анти-СПИД'овым эффектом. Однако вместе с тем они имеют достаточно значимую цитотоксичность.
Наиболее близким к заявляемому способу является техническое решение задачи повышения антивирусной активности ДНК через преобразование ее в апуриновую или апиримидиновую кислоты (т. е. производные ДНК, лишенные в первом случае пуриновых, а во втором - апиримидиновых оснований [5].
В соответствии со способом [5] апуриновую кислоту (АРА) получают из препаратов Na-ДНК термолизом в кислой среде при pH 1,5 - 4,0. Получаемые АРА не являются полимерами. Они имеют олигомерный характер. Их молекулярная масса не превышает 15-19 кД (2,3). Кроме того, известно, что ДНК денатурирует в этих условиях. Оба фактора отрицательно сказываются на биологической активности ДНК.
Апиримидиновую кислоту в соответствии с тем же способом [5] получают либо щелочным гидролизом с 0,3 N КОН, либо гидразинолизом препаратов ДНК. Однако установлено, что в этих условиях не только происходят денатурация и деструкция длинноцепочечной структуры, но и превращение пуринов в их производные, скорее всего в гидразоны. Таким образом конечное соединение частично теряет пуриновые основания, а частично трансформирует их в дериваты. Такие соединения не могут считаться перспективными в качестве лекарственных препаратов, так как, во-первых, они мутированы, а, во-вторых, они не будут композиционно однородными, т.е. обеспечивающими стабильный и воспроизводимый фармакологический эффект.
Указанных недостатков лишены препараты ДНК, получаемые заявляемым способом. Он позволяет получить нативный, достаточно высокомолекулярный полимер (ММ от 300 до 500 КД) стабильной структуры, не обладающий цитотоксичностью, но имеющий повышенную антивирусную активность.
Сущность предлагаемого способа состоит в том, что ткань молоки осетров, предварительно отделенную от жира и пленок, гомогенизируют в стандартном цитратно-солевом растворе, проводят детергентную депротеинизацию с додецилсульфатом и солевую денатурацию высвободившихся из ДНП белков, после чего осуществляют дозированную ультразвуковую деградацию высокополимерной ДНК в атмосфере воздуха и при 10-18oC в присутствии специальных добавок. Далее проводят обычными методами отделение препарата ДНК от биогенных и небиогенных примесей с использованием сорбентов и мембранной технологии. Очищенный препарат осаждают спиртом и сушат. Конечный препарат для проявления повышенной антивирусной активности и отсутствия цитотоксичности должен удовлетворять следующим _ требованиям: М.М. от 300 до 500 КД; содержание РНК 3,0 - 5,0%; белка 0,7 - 1,5%; металлов переменной валентности не более 0,001%; соотношение N/P от 1,0 до 1,5.
Специальные добавки, вводимые на стадии ультразвуковой обработки, представляют собой одно-, двух- или трехкомпонентные системы, выбранные из следующих групп веществ:
В качестве солей металлов и окислителей (компонент "А") могут быть использованы перекиси, гидроперекиси, диазоаминосоединения, хлораты, хроматы, перманганаты, вводимые в количестве 0,005% - 0,05% от массы молоки.
В качестве углеводов и восстановителей (компонент "Б") могут быть использованы углеводы типа фруктозы, глюкозы, сорбозы, либо такие классы соединений, как сульфиты, тиосульфаты, оксикислоты, оксиальдегиды и другие соединения с восстанавливающей способностью (например, пирогаллол, сульфоксилат и т.д.), вводимые в эквимолярном по отношению к компоненту "А" количестве в двух- трехкомпонентных системах, или в количестве 0,1 - 1% от массы молока в случае однокомпонентных систем добавок.
В качестве компонента "В" используют микроколичества солей металлов переменной валентности в окисной или закисной ионной форме или в виде комплексных солей. Их концентрация в системе должна составлять 0,1 - 0,0001% от молярной концентрации компонента "А". В случае, когда такие количества металлов переменной валентности поступают в реакционную массу с сырьем (молокой, хлоридом натрия и т.д.), то введения компонента "В" не требуется.
Компонент "А" применяется только в сочетании с компонентами "Б" или "Б"+"В".
Обработка биогенной реакционной массы, содержащей ДНК, с помощью указанных систем химических агентов в условиях УЗИ-деградации на воздухе при 10-18oC позволяет в мягких условиях разорвать гликозидные связи в нуклеотидах и получить композиционнооднородные нативные полимеры со стабильными свойствами.
Полученный препарат представляет собой белый порошок с кремовым оттенком, растворяющийся в воде и растворах NaCl.
Существенными признаками предложения следует считать выбор специальных добавок, их концентраций и режимов введения в реакционную смесь, позволяющий получить препарат ДНК с заданными свойствами - высокой противовирусной активностью и низкой токсичностью и стабильными аналитическими характеристиками.
Для раскрытия сущности изобретения ниже приведены результаты экспериментально-клинических исследований по изучению токсичности и противовирусной активности препаратов ДНК, полученных предлагаемым способом.
1. Изучение токсичности препаратов в условиях острого и хронического эксперимента.
5 серийных препаратов, полученных предлагаемым способом, оценивали по методике Гацуро [1] - изучали поведенческие реакции, нервно-мышечную возбудимость, вегетативные рефлексы в условиях острого и хронического введения. Препараты вводили мышам в эквитерапевтических дозах в объеме 0,2-0,5 мл. Наблюдения за животными осуществляли в течение 240 мин после введения препарата, регистрируя состояние каждые 10 мин. Оценка проводилась по восьмибальной шкале.
Оценка поведенческих реакций в течение всего периода наблюдения показала наличие стандартной двигательной активности, возбудимости и реактивности в пределах нормы. Ориентировочные рефлексы без изменений.
Тремора, судорог, нарушений походки и изменений тонуса мускулатуры не выявлено. Рефлексы: роговичный, зрачковый, частота дыханий и сердечных сокращений в пределах физиологический нормы.
При изучении хронической токсичности препарат вводили животным в течение 21 дня, с последующим патологоанатомическим изучением внутренних органов (окраска гематоксилин-эозин и судан III).
При осмотре органы нормального кровенаполнения. Кровоизменений в органах не выявлено. Вес печени в пределах нормы. Признаков интоксикации печени т.е. атрофию, вакуолизацию клеток, полиморфизм, пикноз не обнаружили.
Таким образом, представленные данные свидетельствуют о нетоксичности препаратов, полученных заявленным способом.
2. Изучение противовирусной, анти-ВИЧ активности и цитотоксичности препаратов ДНК, полученных предлагаемым способом.
2. 1. Материалы и методы.
Клетки. В работе была использована перевиваемая лимфобластная линия клеток МТ-4. Клетки культивировали в концентрации 0,2•106 кл/мл в среде RPM 1640, с 15%, фетальной сывороткой телят, 300 мкг/мл 1- глутамина и 100 мкг/мл гентамицина. Клетки культивировали в виде суспензии на 24-луночных планшетах фирмы NUNCLON.
Жизнеспособность клеток определяли с помощью окраски 0,4% трипановым синим.
Препараты. В качестве положительного контроля был использован азидотимидин с концентрацией 5 мкг/мл и 5 препаратов, полученных в виде раствора с концентрацией вещества 5 мкг/мл.
Определение цитотокичности препаратов осуществляли в пластиковых 24-луночных панелях. В каждую лунку панели помещали 1 мл суспензии клеток с концентрацией 0,2•106 в 1 мл, после чего в разные лунки добавляли различные дозы химиопрепаратов - 1600, 1000 и 400 мкг/мл. После обработки клеток химиопрепаратами панель с клетками помещали в термостат и инкубировали при 37oC в атмосфере 5% CO2 и 98% влажности в течение 3-5 сут.
По истечении этого срока проводили учет результатов по количеству живых и мертвых клеток в отдельных лунках планшета.
Определение синцитийобразования проводили методом подсчета синцитиальных клеток в инфицированных культурах, содержащих и не содержащих тестируемые препараты.
Кроме того, использовали перевиваемую человеческую лимфобластную линию клеток Н9 в концентрации 0,3•5•106 клеток в 1 мл. Клетки культивировали в среде RPMI - 1640 с 15% инактивированной эмбриональной телячьей сыворотки 300 мкг/мл L-глютамина, 100 мкг/мл гентамицина, 10 мМ HEPES-буфера и выращивали в виде суспензии.
Аналогичным образом культивировалась клеточная линия Н9/ШВ, инфицированная БИЧ.
Препараты, полученные предлагаемым способом, использовали в концентрации 1600, 1000, 400 мкг/мл.
Иммунофлюоресценция: определение количества клеток экспрессирующих антиген БИЧ проводили по методике Coons A.H. (J. Exp. Med 1955, vol 102, р 49) с использованием сыворотки больного СПИД, содержащие антитела к ВИЧ.
Вирус: Для инфицирования клеток использовали концентрат культуральной жидкости клеток Н9/ШВ, полученный при центрифугировании материала через градиент 20% сахарозы при 24000 об/мин.
Для определения ингибирующего действия препаратов ДНК на репликацию ВИЧ, клетки линии Н9 отделяли от культуральной жидкости центрифугированием при 1000 об/мин в течение 10 мин, ресуспендировали в концентрации 5•105 клеток/мл в свежей питательной среде, содержащей различные дозы препаратов ДНК. Перед внесением в культуру клеток вещества, их инфицировали ВИЧ. Контакт клеток с веществом составлял 1,5 ч. при 37oC.
По окончании инкубации проводили отделение клеток от культуральной жидкости и определяли наличие вирусоспецифического антигена методом ИФ.
2.2. Результаты исследований.
2.2.1. Цитотоксическое действие препаратов.
Исследования показали, что в испытанных дозах препараты различных серий не оказывали токсического действия на клетки.
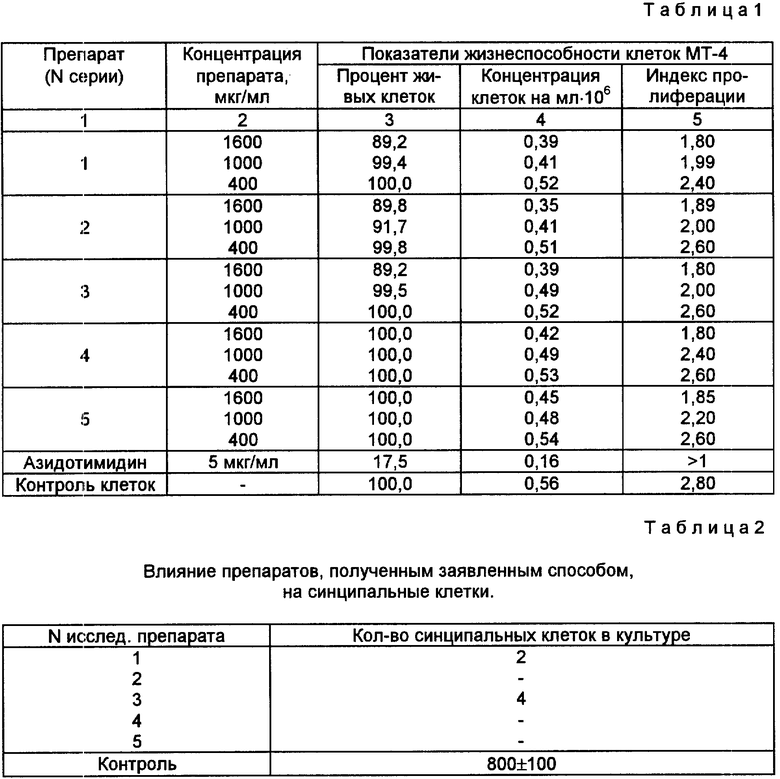
Результаты исследований представлены в табл.1.
В табл.1 представлена сравнительная цитотоксичность препаратов, полученных заявленным способом в культуре клеток МТ-4.
Таким образом из представленной табл.1 видно, что исследуемые препараты всех серий, полученные предлагаемым способом, не обладают цитотоксичностью в системе клеток МТ-4.
2.2.2. Противовирусное действие препаратов на модели штамм III/В ВИЧ - 1.
Определение наличия синцитиальных клеток в контрольных и опытных культурах показало, что если в контрольных пробах без добавления исследуемых препаратов количество клеток составило 800 ± 100 на лунку, то в образцах, содержащих препараты, синцитальных клеток либо не было обнаружено, либо обнаруживались единичные клетки. Результаты представлены в табл.2.
2.2.3. Противовирусное действие на клетках линии Н9, инфицированных вирусом СПИД.
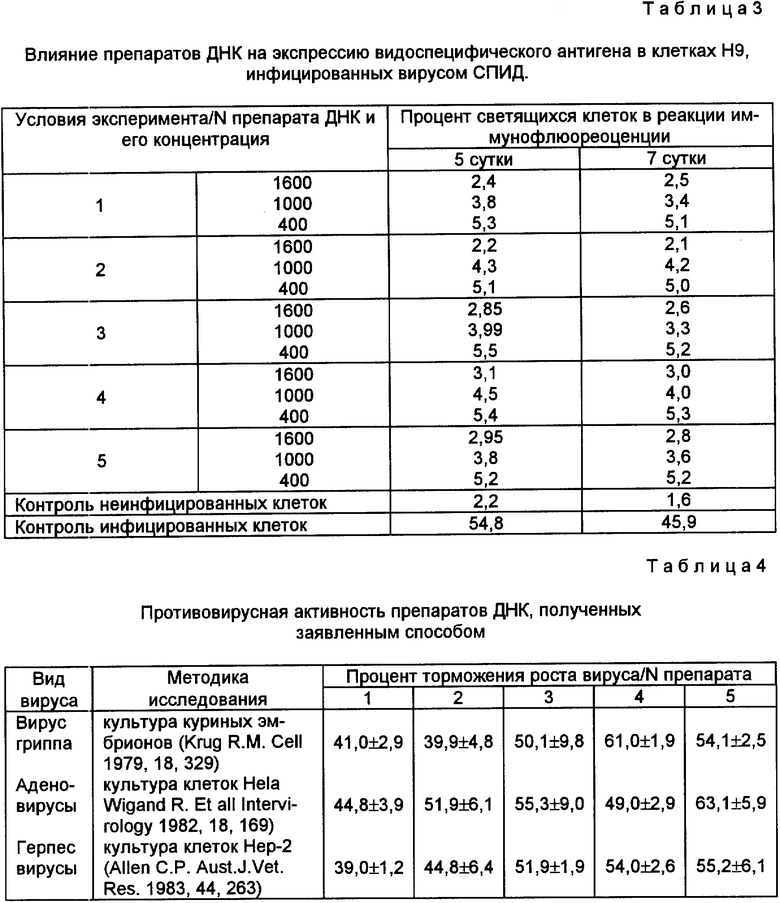
Было показано, что в исследуемых концентрациях препараты ДНК, полученные заявленным способом, обладают противовирусным действием в отношении вируса СПИД. Результаты данной серии опытов представлены в табл.3.
Таким образом из представленных материалов видно, что полученные препараты ДНК обладают выраженным антивирусным действием в отношении ВИЧ-инфекции и при этом не являются цитотоксичными.
3. Изучение противовирусной активности в отношении вируса гриппа, аденовирусов и герпес-вирусов.
В специальных исследованиях с использованием стандартных методик было исследовано противовирусное действие препаратов, полученных предлагаемым способом. Результаты представлены в табл.4.
Таким образом, из представленной табл.4 видно, что препараты, полученные предлагаемым способом, обладают широким спектром противовирусной активности, включающей как антиВИЧ активность, так и ингибирование вирусов других видов.
Пример 1. 1,2 кг предварительно очищенных от пленок и жира замороженных молок осетровых рыб оттаивают до 0 - + 2oC и перерабатывают в фарш, который гомогенизируют в 2,0 л стандартного цитратно-солевого раствора в течение 3-5 мин при 800-1000 об/мин. Гомогенат помещают в 100 л аппарат, добавляют 34 л стандартного цитратно- солевого раствора и 4 л 6%-ного раствора додецилсульфата натрия и, не прекращая перемешивания, нагревают до 60oC и инкубируют при этой температуре в течение 1-1,5 ч. По окончании выдержки при работающей мешалке добавляют в реактор 40 л 23%-ного раствора хлорида натрия и перемешивают еще 1 ч. при 60oC. По истечении этого времени реакционную массу охлаждают до +2 - +5oC и передают на установку для ультразвуковой обработки. Ультразвуковую обработку проводят в открытых ваннах вместимостью 10 л. При этом в ванну помещают 5л реакционной массы. Добавляют 0,1 л водного раствора гидроперекиси изопропилбензола с концентрацией 2,5•10-4моль/л, 0,1 л свежеприготовленного водного раствора диоксималеиновой кислоты с концентрацией 2,5•10-4 моль/л и 10 л раствора соли Мора с концентрацией 2,5•10-7 моль/л, получаемой методом последовательного разбавления более концентрированных растворов. Озвучивание проводят в течение 10 мин при 18oC при частоте тока 750 НГц и интенсивности 8-10 Вт/см2. По окончании озвучивания раствор переносят в смеситель, в котором объединяют все обработанные ультразвуком порции, смешивают их с кизельгуром, взятым в количестве 5 кг и после 15-минутной выдержки подают на фильтрацию на нутч-фильтр. Отфильтрованный раствор целевого продукта дополнительно очищают и концентрируют методом ультрафильтрации на разделительных колоннах с полыми волокнами с диаметром пор, пропускающих молекулы менее 60 кД.
Из очищенного раствора 70%-ным этаноном осаждают целевой продукт, промывают многократно этаноном с переменной (уменьшающейся) концентрацией воды, отделяют от жидкой фазы и сушат. Получают препарат N 1 с содержанием РНК 3,25%; белка - 0,9%, железа - менее 0,001%, соотношением N/P = 1,3, ММ 460 кД.
В опытах по определению острой и хронической токсичности in vivo отмечена нетоксичность препарата. В культуре клеток МТ-4 при добавлении препарата выявлено отсутствие цитотоксичности. На модели штамма Ш/В ВИЧ-1 проявлял антивирусное действие. Эффективен в отношении вирусов гриппа, герпеса, аденовирусов.
Пример 2. Получение целевого продукта проводят приемами, описанными в примере 1, за исключением операции озвучивания: в ванну с 5 л реакционной массы добавляют 40 мл 0,1%-ного раствора перекиси водорода и раствор 0,2 г аскорбиновой кислоты в 1 л воды. Озвучивание проводят в течение 30 мин при 8•10oC при вышеназванных параметрах УЗИ-генератора. Выделенный препарат N 2 имеет ММ 340 кД, содержание РНК 5,0%; белка 1,5%, железа менее 0,001%, отношение N/P=1,0.
Полученный препарат нетоксичен в опытах in vivo и в культуре клеток МТ-4. Обладает противовирусной активностью в отношении вирусов штамма III В ВИЧ-1, герпес-вирусов, вирусов гриппа и аденовирусов.
Пример 3. Получение целевого продукта проводят так же, как в примере 1, за исключением операции озвучивания: в ванну с 5 л реакционной массы добавляют 0,75г глюкозы в 1 л воды. Озвучивание ведут при 15oC в течение 1 ч. при параметрах генератора, указанных в примере 1. Выделенный препарат N 3 имеет М. М. 500 кД, отношение N/P 1,5, содержание РНК 4,7%, белка 1,3%, железа менее 0,001%. Не токсичен в опытах in vivo и в культуре клеток МТ-4. Обладает противовирусной активностью в отношении вирусов ВИЧ-1, герпес вирусов, вирусов гриппа и аденовирусов.
Пример 4. Получение целевого продукта проводят так же, как в примере 3, однако вместо раствора глюкозы вводят 0,08 г раствора сернистого натрия в 100 мл воды. Выделенный препарат N 7 имеет М.М. 4,0%; белка 1,0%; железа менее 0,001%. Не токсичен в опытах in vivo и в культуре клеток МТ-4. Обладает противовирусной активностью в отношении вирусов штамма III-В ВИЧ-1, вирусов гриппа, герпеса и аденовирусов.
Пример 5. Получение целевого продукта проводят так же, как в примере 1, однако на стадии УЗИ-обработки в систему вводят 0,1 л водного раствора гидроперекиси изопропилбензола, с концентрацией 2,5•10-3 моль/л, 0,1 л свежеприготовленного раствора аскорбиновой кислоты с концентрацией 2,5•10-3 моль/л и 1,0 л раствора дихлорида железа с концентрацией 2,5•10-8 моль/л, полученного из более концентрированных растворов методом последовательного разбавления. Выделенный препарат N 5 имеет М.М. 300 кД; отношение N/P=1,0; содержание РНК 3,0%, белка 0,7%, железа менее 0,001%. Не токсичен в опытах in vivo и в культуре клеток МТ-4. Обладает противовирусной активностью в отношении вирусов ВИЧ-1, вирусов гриппа, герпеса и аденовирусов.
Представленные примеры подтверждают существенность заявленных признаков изобретения.
Способ по сравнению с известными дает возможность получить нетоксичные производные ДНК, обладающие широким спектром антивирусной активности.
Список литературы.
1. Гацуро В.В. Метод первичного фармакологического исследования биологически активных веществ. M., 1974.
2. Christoff Tamm Erwin Chargaff. J. Biol.Chem., 203, 689, 1953.
3. W. E. G.Muller, W.Hanske, A.Maictof. R.K.Zahn. Cancer Researchy, 33, 2330, 1973.
4. Международная заявка 93/10793 кл. A 61 K 31/70, A 61 K 9/08, PCT (WO).
5. ФРГ (DE) заявка N OS 37 24951, кл. A 61 K 31/70, C 07 H 21/04, 1989.
Изобретение относится к химии и медицине и касается способов получения антивирусных препаратов на основе ДНК, извлекаемых из животного сырья. Полученные предлагаемым способом препараты нецитотоксичны и обладают активностью в отношении вирусов ВИЧ, герпес вирусов, аденовирусов и вирусов гриппа. Сущность изобретения: к биогенной реакционной массе, содержащей ДНК, добавляют химические агенты, позволяющие в мягких условиях разорвать гликозидные связи в нуклеотидах и получить композиционнооднородные нативные полимеры с мол.массой 300 - 500 кД, соотношением A / P 1,0 - 1,5, содержанием РНК 3,0 - 5,0%; белка 0,7 - 1,5%, металлов не более 0,001%. 6 з.п.ф-лы, 4 табл.
| DE, патент, 3724951, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-04-20—Публикация
1994-11-09—Подача