Изобретение относится к ряду новых производных соединений, известных как "милбемицины", которые являются производными, замещенными в положении 13. Изобретение также предлагает новые способы и композиции для применения этих соединений в сельском хозяйстве и садоводстве, а также способы их получения.
Существует несколько классов известных соединений со структурой на основе 16-членного макролидного кольца, которые получают ферментацией различными микроорганизмами или получают полусинтетически путем химической обработки продуктов такой природной ферментации и которые проявляют акарицидное, инсектицидное, противогельминтное и противопаразитическое действие. Милбемицины и авермектины являются примерами двух классов таких известных соединений, но существуют также различные другие соединения, которые идентифицируются в технике различными наименованиями или кодовыми числами. Названия этих различных макролидных соединений обычно образуют от названий или кодовых чисел микроорганизмов, которые продуцируют встречающиеся в природе соединения каждого класса, и эти названия затем расширяют, чтобы охватить химические производные того же класса, в результате чего, как правило, отсутствует стандартизированная системная номенклатура для таких соединений.
Чтобы избежать путаницы, здесь будет использована стандартизированная система номенклатуры, которая придерживается обычных правил наименования производных органических соединений, которые рекомендуются Международным союзом теоретической и прикладной химии (ИЮПАК). Отдел органической химии. Комиссия по номенклатуре в органической химии, которая основана, прежде всего, на гипотетическом родоначальном соединении, определяемом здесь как "милбемицин", и изображаемом формулой A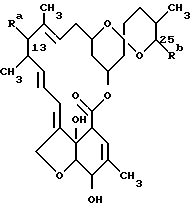 ,
,
где
Ra и Rb - оба атомы водорода.
Во избежание сомнений в формуле A также указываются нумерации положений в системе макролидного кольца, наиболее относящиеся к соединениям предложенного изобретения и соединениям известного уровня техники.
Милбемицины, продуцированные естественным путем, представляют собой ряд макролидных соединений, известных своим антигельминтным, акарицидным и инсектицидным действием. Милбемицин D раскрывается в патенте США 4346171, где он называется "соединение V-41D", и милбемицины A3 и A4 раскрываются в патенте США 3950360. Эти соединения могут быть изображены приведенной выше формулой A, в которой Ra в положении 13 представляет собой атом водорода, и Rb в положении 25 представляет собой метильную группу, этильную группу или изопропильную группу, причем эти соединения называются как милбемицин A3, милбемицин A и милбемицин D соответственно. Аналоги милбемицина, содержащие атом водорода в положении 13 и замещенные в положении 25 втор-бутильной или изопропильной группой, раскрываются, соответственно, в патенте США 4173571 как "агликон 13-дезокси-22,23-дигидроавермектина B1a" и "агликон 13-дезокси-22,23-дигидроавермектина B1b"; и соответствующие 13-гидроксилированные соединения известны как "22,23-дигидро-авермектин B1a" и "22,23-дигидро-авермектин B1b".
Впоследствии получены различные производные исходных милбемицинов и авермектинов и исследована их активность. Например, милбемицины, эстерифицированные в положении 5, раскрываются в патентах США 4199569, 4201861, 4206205, 4173571, 4171314, 4203976, 4289760, 4457920, 4579864 и 4547491, в публикациях европейских патентов 8184, 102721, 115930, 180539 и 184989 и в заявках на патент Японии Kokai (т.е. с открытой выкладкой) 57-120589 и 59-16894.
Производные 13-гидрокси-5-кетомилбемицина раскрываются в патенте США 4423209. Производные милбемицин-5-оксима раскрываются в патенте США 4547520 и в публикации европейского патента 203832. Производные милбемицин-23-оксима раскрываются в публикации европейского патента 259779; и производные милбемицина, содержащие оксиминовый заместитель в положении 13, раскрываются в публикациях европейских патентов 165029 и 341972 и в публикации РСТ ВОИС 93/18041.
Некоторые соединения, в которых 13-гидроксигруппа эстерифицирована, раскрываются в патенте США 4959386, в котором описываются эфиры различных карбоновых кислот. Ни одна из частей карбоновых кислот в положении 13 в этих соединениях известного уровня техники не имеет гетероциклических заместителей. Производные 13-ацетоксимилбемицина, в которых ацетоксигруппа может содержать различные гетероциклилтиогруппы как заместители, раскрываются в публикации европейского патента 549273. Публикация европейского патента 246739 раскрывает 13-алканэфирные милбемицины, которые могут быть замещены в α -положении алканоильной группы различными заместителями, включая арилметил, гетероциклилметил, феноксигруппу и гетероциклилоксигруппу.
Ни одна из групп карбоновых кислот в положении 13 в этих соединениях известного уровня техники не содержит алкоксииминового заместителя, или не содержит арильный или гетероциклильный заместитель с заместителями, содержащими аминозамещенное кольцо.
Раскрыты некоторые милбемицины, содержащие в положении 13 простую эфирную группу. Милбемицины, содержащие в положении 13 фенилалкоксигруппу, раскрыты в публикациях европейских патентов 448243, 444964, 357460 и 594291.
На известном уровне техники не раскрываются милбемицины с простой эфирной группой в положении 13, в которых алкоксигруппа содержит арилоксииминный или гетероциклилоксииминный заместитель.
Разные классы родственных милбемицину макролидных соединений, относящихся к упомянутым выше соединениям, все раскрываются как средства, обладающие одним или несколькими типами активности, т.е. как антибиотики, антигельминтные средства, эктопаразитицидные, акарицидные или иные пестицидные средства. Однако все еще существует необходимость в обеспечении такими средствами с повышенной активностью по отношению к одному или нескольким классам сельскохозяйственных или садовых вредителей.
Теперь обнаружено, что активность таких родственных милбемицину производных может быть усилена путем соответствующего подбора сочетания заместителей для системы макролидного кольца, особенно заместителей в положении 13. В частности, найдено, что активность соединений может быть улучшена за счет соответствующего подбора некоторых весьма характерных сложноэфирных групп и групп простых эфиров в положении 13, как будет описано ниже. Вообще, соединения настоящего изобретения имеют склонность обладать более высокой пестицидной активностью, чем соединения известного уровня техники, а многие соединения предлагаемого изобретения имеют значительно более высокую активность.
Целью изобретения является предложить макролидные соединения, обладающие повышенной активностью. Другая цель изобретения состоит в том, чтобы предложить способы получения таких соединений. И еще одной целью изобретения является предложить пестицидные композиции и способы применения упомянутых соединений.
В соответствии с поставленными целями изобретение предлагает 13-замещенные производные милбемицина общей формулы I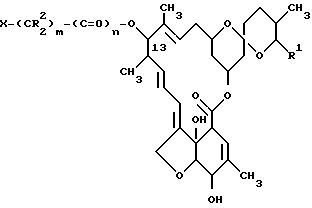
где R1 - метильная, этильная, изопропильная или втор-бутильная группа;
R2 - атом водорода или алкильная группа, содержащая 1 - 3 атома углерода;
X - (a) группа формулы II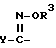
где R3 - атом водорода или алкильная группа, содержащая 1 - 4 атома углерода; и
Y - фенильная группа или 5 - 6 членная гетероциклильная группа с 1-м или двумя гетероатомами в кольце, выбранными из азота, кислорода или серы, причем указанные фенильная и гетероциклильная группы являются незамещенными или замещенными 1 или 2 заместителями (которые могут быть одинаковыми или разными), выбранными из нижеперечисленных заместителей A; или
X - (b) группа, имеющая формулу III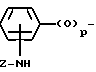 ,
,
где
p = 0 или 1;
Z - алканоильная группа, содержащая 2 - 3 атома углерода; алкилсулфонильная группа, содержащая 1 - 3 атома углерода; алкоксикарбонильная группа, содержащая 2 - 5 атомов углерода; аминоалканоильная группа, содержащая 2 - 7 атомов углерода причем аминофрагмент упомянутой аминоалканоильной группы замещен 1 или 2 заместителями, которые могут быть одинаковыми или разными и которые выбирают из перечисленных ниже заместителей B, алканоильный фрагмент упомянутой аминоалканоильной группы не замещен или замещен фенильной группой или алкилтиогруппой, содержащей 1 - 3 атома углерода); насыщенный 5- или 6-членный гетероциклил карбонильная группа, содержащая в кольце атом азота или содержащая в кольце атомы азота и серы, в которой упомянутый атом азота кольца может быть незамещенным либо замещенным алкоксикарбонилом, имеющим 2 - 5 атомов углерода, и в которой карбонильная группа присоединения к атому, иному, чем упомянутый атом азота кольца; 5- или 6-членный лактам карбонильная группа, в которой карбонильная группа присоединена к атому, иному, чем атом азота лактама; α -алкоксиимино- α -гетероциклилацетоксигруппа, в которой алкоксильный фрагмент содержит 1 - 3 атома углерода, и гетероциклильный фрагмент является 5- или 6-членной ароматической гетероциклической группой, содержащей один или два кольцевых гетероатома, выбираемых из азота или серы, которые могут быть не замещены или замещены алкоксикарбониламиногруппой, имеющей 2 - 5 атомов углерода или галоалканоиламиногруппой, имеющей 2 - 3 атома углерода;
к числу заместителей A относятся: атом галогена; нитрогруппа; гидроксильная группа; алкоксигруппа, содержащая 1 - 4 атома углерода; аралкилоксигруппа, содержащая 7 - 11 атомов углерода; аминогруппа; алканоиламиногруппа, содержащая 1 - 4 атома углерода; галогеналканоиламиногруппа, содержащая 2 - 4 атома углерода; алкилсульфониламиногруппа, содержащая 1 - 3 атома углерода; алкоксикарбониламиногруппа, содержащая 2 - 5 атомов углерода; галогеналкоксикарбониламиногруппа, содержащая 3 - 5 атомов углерода; аминоалканоиламиногруппа, содержащая 2 - 7 атомов углерода, в которой аминогруппа в аминоалканоильном фрагменте может не содержать заместителей или содержать один или два заместителя (которые могут быть одинаковыми или разными), выбираемых из алкоксикарбонильных групп, имеющих 2 - 5 атомов углерода и алканоильных групп, имеющих 2 - 3 атома углерода; и (насыщенный 5- или 6-членный гетероциклил) карбониламиногруппа, содержащая в кольце атом азота, в которой упомянутый атом азота может быть не замещен или замещен алкоксикарбонильной группой, имеющей 2 - 5 атомов углерода, и в которой карбониламиногруппа присоединена к атому, иному, чем упомянутый атом азота кольца;
к заместителям В относятся алкильная группа, содержащая 1 - 3 атома углерода; алканоильная группа, содержащая 2 - 3 атома углерода; алкоксикарбонильная группа; содержащая 2 - 5 атомов углерода; фенилкарбонильная группа, содержащая 7 - 11 атомов углерода; аралкилоксикарбонильная группа, содержащая 8 - 10 атомов углерода; алкоксикарбониламиноалкильная группа, содержащая 1 - 4 атома углерода в своей алкоксильной части и 2 - 3 атома углерода в алканоильной части; и алкоксикарбониламинофенилкарбонильная группа, содержащая 1 - 4 атома углерода в алкоксильной части;
m = 0 или 1; и n = 0 или 1;
при условии, что когда Х - группа упомянутой выше формулы (II), R2 - атом водорода, и m и n - оба - не могут быть равными нулю;
и при условии, что когда X - группа упомянутой выше формулы III, R2 - алкильная группа, содержащая 1 - 3 атома углерода, и m и n - оба - равны 1.
Предпочтительны соединения 1, где X - группа, имеющая упомянутую выше формулу II; и
заместители А выбирают из атома галогена, нитрогруппы, гидроксильной группы, алкоксигруппы, содержащей 1 - 4 атома углерода, аралкилоксигруппы, содержащей 7 - 11 атомов углерода, аминогруппы, алканоиламиногруппы, содержащей 1 - 4 атома углерода, и галогеналканоиламинногруппы, содержащей 2 - 4 атома углерода, а также соединения, в которых X - группа, имеющая упомянутую формулу III, в которой заместитель Z-NH-присоединен в параположении фенильного кольца.
Еще одну группу предпочтительных соединений составляют соединения, где
Х - группа, имеющая упомянутую формулу II; и
Y - фенильная группа, которая замещена в параположении: 1) алкилсульфониламиногруппой, содержащей 1 - 3 атома углерода, 2) алкоксикарбониламиногруппой, содержащей 2 - 5 атомов углерода, 3) галогеналкоксикарбониламиногруппой, содержащей 3 - 5 атомов углерода, 4) аминоалканоиламиногруппой, содержащей 2 - 7 атомов углерода, в которой аминогруппа аминоалканоильной части может быть не замещена или замещена одним или двумя заместителями, выбранными из алкоксикарбонильной группы, имеющей 2 - 5 атомов углерода и алканоильной группы, имеющей 2 или 3 атома углерода, или Y - (насыщенный 5- или 6-членный гетероциклил) карбониламиногруппа, содержащая в кольце атом азота (где упомянутый атом азота может не иметь заместителей или может быть замещен алкоксикарбонилом, имеющим 2 - 5 атомов углерода, и в которой карбониламиногруппа присоединена к атому, иному, чем упомянутый атом азота кольца);
а также соединения 1, в которых
Х - группа, имеющая упомянутую формулу II;
R1 - метильная, этильная, изопропильная или втор-бутильная группа;
R3 - атом водорода или метильная или этильная группа;
Y - фенильная, пиридильная, фурильная, тиенильная, оксазолильная или тиазолильная группа, которая может не иметь заместителей, или иметь 1 или 2 заместителя, выбираемых из заместителей A1, определенных ниже.
Заместители A1 включают 1 атом фтора, 2 атом хлора, 3 атом брома, 4 нитрогруппу, 5 гидроксильную группу, 6 алкоксигруппу, содержащую 1 - 3 атома углерода, 7 аралкилоксигруппу, содержащую 7 - 10 атомов углерода, 8 аминогруппу, 9 алканоиламиногруппу, содержащую 1 или 2 атома углерода, фтор-, хлор- или 10 бромзамещенную алканоиламиногруппу, содержащую 2 или 3 атома углерода, 11 алкилсульфониламиногруппу, содержащую 1 - 3 атома углерода, 12 алкоксикарбониламиногруппу, содержащую 2 или 3 атома углерода, 13 аминоалканоиламиногруппу, содержащую 2 - 5 атомов углерода ( в которой аминогруппа аминоалканоильной части может быть незамещенной или замещенной группой, которую выбирают из алкоксикарбонила, имеющего 2 или 3 атома углерода, и алканоила, имеющего 2 или 3 атома углерода); или Y - (6-членный насыщенный гетероциклил) карбониламиногруппа, содержащая в кольце один атом азота ( в которой атом азота может не быть замещен или может быть замещен алкоксикарбонилом, имеющим 2 - 5 атомов углерода, а карбониламиногруппа замещает атом, иной, чем упомянутый атом азота кольца).
Из числа последних предпочтительны соединения, где
R1 - метильная или этильная группа;
R3 - метильная или этильная группа;
Y - фурильная, тиенильная, тиазолильная, пиридильная или фенильная группа, которая может быть незамещенной или замещенной 1 или 2 заместителями, выбираемыми из заместителей А2, определение которым дается ниже;
заместители A2 включают: атом фтора, атом хлора, атом брома, гидроксильную группу, метоксигруппу, этоксигруппу, бензилоксигруппу, аминогруппу, ацетиламиногруппу, монохлорацетиламиногруппу, монобромацетиламиногруппу, трифторацетиламиногруппу, алкилсульфониламиногруппу, содержащую 1 или 2 атома углерода, аминоалканоиламиногруппу, содержащую 2 или 3 атома углерода ( в которой аминогруппа упомянутой аминоалканоильной части может быть не замещена или замещена группой, которую выбирают из алканоильной группы, содержащей 2 или 3 атома углерода, и алкоксикарбонильной группы, содержащей 2 или 3 атома углерода), пирролидинкарбониламиногруппу (в которой гетероатом азота может не быть замещен или замещен алкоксикарбонильной группой, имеющей 2 или 3 атома углерода, а корбониламиногруппа присоединена к любому другому атому, кроме атома азота), а также соединения, где
Y - фенильная группа, которая может не содержать заместителей или содержать в параположении заместитель, выбираемый из атома фтора, атома хлора, атома брома, гидроксильной группы, метоксигруппы, этоксигруппы, бензилоксигруппы, аминогруппы, ацетиламиногруппы, монохлорацетиламиногруппы, монобромацетиламиногруппы, трифторацетиламиногруппы, алкилсульфониламиногруппы, содержащей 1 или 2 атома углерода, ацетиламиноацетиламиногруппы, и алкоксикарбониламиноалканоиламиногруппы, содержащей 1 или 2 атома углерода в своей алкильной части, и 2 или 3 атома углерода в своей алканоиламино-части.
Предпочтительны также соединения, где
R1 - этильная группа;
R3 - метильная группа;
Y - фенильная группа или фенильная группа, замещенная в параположении метилсульфониламиногруппой или метоксикарбониламиноацетиламиногруппой; и
m = 0, и n=1.
Еще одной группой предпочтительных соединений формулы 1 являются соединения, где
X - группа, имеющая упомянутую формулу III;
Z - алканоильная группа, содержащая 2 или 3 атома углерода: алкилсульфонильная группа, содержащая 1 - 3 атома углерода: алкоксикарбонильная группа, содержащая 2 или 3 атома углерода; аминоалканоильная группа, содержащая 2 - 6 атомов углерода (в которой аминогруппа может быть незамещенной или замещенной 1 или 2 заместителями, которые могут быть одинаковыми или разными, выбираемыми из заместителей B1, определение которым дается ниже, и алканоильная группа может быть не замещена или замещена фенильной группой или алкилтиогруппой, содержащей 1 или 2 атома углерода); (5 - или 6-членный гетероциклил) карбонильная группа, содержащая гетероатом азота (в которой гетероатом азота может быть не замещен или замещен алкоксикарбонильной группой, имеющей 2 - 5 атомов углерода, и карбонильная группа присоединена к атому, иному, чем упомянутый атом азота); (5-членнуая γ - лактам) карбонильная группа, в которой карбонильная группа присоединена к атому в положении 5, и α -алкоксиимино- α -гетероциклилацетоксигруппа, в которой гетерциклильная составляющая представляет собой 5-членную ароматическую гетероциклическую группу, которая мжет быть не замещена или замещена алкоксикарбонильной группой, имеющей 2 - 5 атомов углерода, или галоалканоиламиногруппой, имеющей 2 или 3 атома углерода, и в которой часть алкоксиимина содержит 1 или 2 атома углерода; и
заместители B1 включают алкильную группу, содержащую 1 - 3 атома углерода, алканоильную группу, содержащую 2 или 3 атома углерода, алкоксикарбонильную группу, содержащую 2 - 5 атомов углерода, фенилкарбонильную группу, содержащую 7 - 11 атомов углерода, и алкоксикарбониламиноалканоильную группу, в которой алкоксикарбонильная составляющая содержит 2 - 5 атомов углерода, и алканоильная часть содержит 2 или 3 атома углерода.
а из них еще более предпочтительны соединения, где
R1 - метильная или этильная группа;
Z - алканоильная группа, содержащая 2 или 3 атома углерода; алкилсульфонильная группа, содержащая 1 - 3 атома углерода; аминоалканоильная группа; содержащая 2 - 5 атомов углерода ( в которой аминогруппа может быть замещена 1 или 2 заместителями, выбираемыми из заместителей B2, определение которым дается ниже, и алканоильная группа может не иметь заместителей или быть замещена метилтиогруппой), и (5- или 6-членный гетероциклил) карбонильная группа, содержащая гетероатом азота (в которой гетероатом азота может быть не замещен или замещен алкоксикарбонильной группой, имеющей 2 - 5 атомов углерода);
заместители B2 включают алкильную группу, содержащую 1 - 3 атома углерода, алканоильную группу, содержащую 2 или 3 атома углерода, алкоксикарбонильную группу, содержащую 2 - 5 атомов углерода, и фенилкарбонильную группу, содержащую 7 - 11 атомов углерода: и соединения, где
заместитель Z-NH- находится в параположении фенильного кольца группы упомянутой формулы III, и Z - алкилсульфонильная группа, содержащая 2 или 3 атома углерода; аминоалканоильная группа, содержащая 2 - 4 атома углерода ( в которой аминогруппа необязательно может быть замещена 1 или 2 заместителями, выбираемыми среди заместителей B2, определение которым дается ниже), и (5-членный гетероциклил) карбонильная группа, содержащая гетероатом азота ( в которой гетероатом азота может быть не замещен или замещен алкоксикарбонильной группой, содержащей 2 - 5 атомов углерода); и
заместители B2 включают алкильную группу, содержащую 1 - 3 атома углерода, алканоильную группу, содержащую 2 или 3 атома углерода, алкоксикарбонильную группу, содержащую 2 - 5 атомов углерода, и фенилкарбонильную группу, содержащую 7 - 11 атомов углерода.
Наиболее предпочтительны из вышеперечисленных, отличающиеся тем, что
R1 - этильная группа;
R2 - метильная группа;
p равно 0;
заместитель Z-NH- находится в параположении фенильного кольца;
Z - аминоалканоильная группа, содержащая 2 или 3 атома углерода (в которой аминогруппа может не содержать заместителей или содержать заместитель, выбираемый из заместителей B3, определение которым дается ниже); или (насыщенный 5-членный гетероциклил) карбонильная группа, содержащая гетероатом азота ( в которой гетероатом азота может быть не замещен или замещен алкоксикарбонильной группой, имеющей 2 или 3 атома углерода);
и заместители B3 включают: алкильную группу, содержащую 1 - 3 атома углерода, алканоильную группу, содержащую 2 или 3 атома углерода, и алкоксикарбонильную группу, содержащую 2 или 3 атома углерода.
В группу наиболее предпочтительных соединений данного изобретения входят:
1) 13-( α -метоксииминофенилацетокси)милбемицин A4(изомер А);
2) 13-( α -метоксииминофенилацетокси)милбемицин A4(изометр B);
3) 13-[2-метоксиимино-2-(4-ацетиламиноацетиламинофенил)-этокси]- милбемицин A4;
4) 13-[ α -метоксиимино-(4-метансульфониламинофенил)ацетокси]- милбемицин A4;
5) 13-[α -метоксиимино-(4-ацетиламиноацетиламинофенил)-ацетокси]- милбемицин A4;
6) 13-[ α -метоксиимино-(4-метоксикарбониламиноацетиламинофенил)- ацетокси]милбемицин A3;
7) 13-[ α/ -метоксиимино-(4-метоксикарбониламиноацетиламинофенил)- ацетокси]милбемицин A4;
8) 13-[2-(4-метоксикарбониламиноацетиламинофенил)-2-метилпропионилокси] милбемицин A3;
9) 13-[2-(4-метоксикарбониламиноацетиламинофенил)-2-метилпропионилокси] милбемицин A4;
10) 13-[2-(4-бензоиламиноацетиламинофенил)-2-метилпропионилокси] милбемицин A4;
11) 13-[2-(4-(N-метил)метоксикарбониламиноацетиламинофенил)-2- метилпропионилокси]милбемицин A4;
12) 13-[2-[4-{2-(метоксикарбониламино}пропиониламино)-фенил]-2- метилпропионилокси]милбемицин A4;
13) 13-[2-[4-{2-(метоксикарбониламино)-2-метилпропиониламино}- фенил]-2-метилпропионилокси]милбемицин A4, и
14) 13-[2-[4-[(1-метоксикарбонилпирролидин-2-карбониламино]- фенил]-2-метилпропионилокси]милбемицин A4.
Другим аспектом данного изобретения является акарицидная и инсектицидная композиция, включающая активное вещество - производное милбемицина и целевые добавки, отличающаяся тем, что в качестве указанного производного милбемицина она содержит [13-замещенное производное формулы I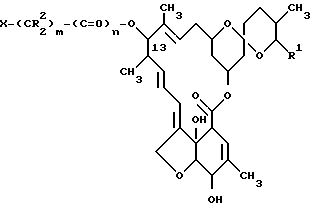 ,
,
где
R1 - метильная, этильная, изопропильная или втор-бутильная группа;
R2 - атом водорода или алкильная группа, содержащая 1-3 атома углерода;
X - (а) группа формулы II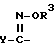 ,
,
где
R3 - атом водорода или алкильная группа, содержащая 1-4 атома углерода; и
Y - фенильная группа или 5 - 6-членная гетероциклильная группа с 1-м или двумя гетероатомами в кольце, выбранными из азота, кислорода или серы, причем указанные фенильная и гетероциклильная группы являются незамещенными или замещены 1 или 2 заместителями (которые могут быть одинаковыми или разными), выбранными из нижеперечисленных заместителей A; или
X - (b) группа формулы III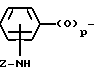 ,
,
где
p = 0 или 1, и
Z - алканоильная группа, содержащая 2 - 3 атома углерода; алкилсульфонильная группа, содержащая 1 - 3 атома углерода; алкоксикарбонильная группа, содержащая 2 - 5 атомов углерода; аминоалканоильная группа, содержащая 2 - 7 атомов углерода (причем амино часть упомянутой аминоалканоильной группы является замещенной 1 или 2 заместителями, которые могут быть одинаковыми или разными, и которые выбирают из перечисленных ниже заместителей B, и алканоильная часть упомянутой аминоалканоильной группы является незамещенной или замещена фенильной группой или алкилтиогруппой, содержащей 1 - 3 атома углерода); насыщенный 5- или 6-членный гетероциклилкарбонильная группа, содержащая в кольце атом азота, причем упомянутый атом азота кольца может быть не замещен либо замещен алкоксикарбонилом, имеющим 2 - 5 атомов углерода, и в которой карбонильная группа присоединена к атому, иному, чем упомянутый атом азота кольца; 5- или 6-членная лактамкарбонильная группа, в которой карбонильная группа присоединена к атому, иному, чем атом азота лактама; α -алкоксиимино- α -гетероциклилацетоксигруппа, в которой алкоксильная часть содержат 1 - 3 атома углерода, и гетероциклильная часть является 5- или 6-членной ароматической гетероциклической группой, содержащей один или два кольцевых гетероатома, выбранных из азота или серы, которые могут быть не замещены или замещены алкоксикарбониламиногруппой, имеющей 2 - 5 атомов углерода:
к числу заместителей A относятся: атом галогена; нитрогруппа; гидроксильная группа; алкоксигруппа, содержащая 1 - 4 атома углерода; аралкилоксигруппа, содержащая 7 - 11 атомов углерода; аминогруппа; алканоиламиногруппа, содержащая 1 - 4 атома углерода; алкилсульфониламино группа, содержащая 1 - 3 атома углерода; аминоалканоиламиногруппа, содержащая 2 - 7 атомов углерода, в которой аминогруппа в аминоалканоильном фрагменте может не содержать заместителей или содержать один или два заместителя (которые могут быть одинаковыми или разными), выбираемых из алкоксикарбонильных групп, имеющих 2 - 5 атомов углерода и алканоильных групп, имеющих 2 или 3 атома углерода; и (насыщенный 5- или 6-членный гетероциклил)карбониламиногруппа, содержащая в кольце атом азота, в которой упомянутый атом азота может быть не замещен или быть замещен алкоксикарбонильной группой, имеющей 2 - 5 атомов углерода, и в которой карбониламиногруппа присоединена к атому, иному, чем упомянутый атом азота кольца.
К заместителям B относятся: алкильная группа, содержащая 1 - 3 атома углерода; алканоильная группа, содержащая 2 - 3 атома углерода; алкоксикарбонильная группа, содержащая 2 - 5 атомов углерода; фенилкарбонильная группа, содержащая 7 - 11 атомов углерода; аралкилоксикарбонильная группа, содержащая 8 - 10 атомов углерода; алкоксикарбониламиноалканоильная группа, содержащая 1 - 4 атома углерода в своей алкоксильной части и от 2 до 3 атомов углерода в алканоильной части; и алкоксикарбониламинофенилкарбонильная группа, содержащая 1 - 4 атома углерода в алкоксильной части;
m = 0 или 1; и n = 0 или 1;
при условии, что когда X - группа упомянутой выше формулы II, R2 - атом водорода, и m, и n - оба - не равны нулю;
и при условии, что когда X - группа упомянутой выше формулы III, R2 - алкильная группа, содержащая 1 - 3 атома углерода, и m, и n - оба - равны 1.
Предпочтительной является композиция, где в соединении I
X - группа, имеющая упомянутую выше формулу II; и заместители A выбирают из атома галогена, нитрогруппы, гидроксильной группы, алкоксигруппы, содержащей 1 - 4 атома углерода, аралкилоксигруппы, содержащей 7 - 11 атомов углерода, аминогруппы, алканоиламиногруппы, содержащей 1 - 4 атома углерода, а также
композиция, где в соединении I
X - группа, имеющая упомянутую формулу III, в которой заместитель Z-NH- присоединен в параположении фенильного кольца.
Еще более предпочтительная композиция, отличающаяся тем, что
X - группа, имеющая упомянутую формулу II;
и Y - фенильная группа, которая замещена в параположении: алкилсульфониламиногруппой, содержащей 1 - 3 атома углерода, аминоалканоиламиногруппой, содержащей 2 - 7 атомов углерода (в которой аминогруппа аминоалканоильной части может быть не замещена или замещена алкоксикарбонильной группой, имеющей 2 - 5 атомов углерода), или Y - 5- или (6-членный насыщенный гетероциклил)карбониламиногруппа, содержащая в кольце один атом азота (в которой у атома азота может не быть заместителя или может присутствовать заместитель, выбираемый из алкоксикарбонила, имеющего 2 - 5 атомов углерода, а карбониламиногруппа присоединена по атому, иному, чем упомянутый атом азота кольца).
Наиболее предпочтительны композиции, содержащие в качестве активного компонента вышеперечисленные соединения 1-14.
Следующим аспектом данного изобретения является способ защиты растений от повреждения паразитами, выбираемыми из группы, состоящей из клещей и насекомых путем обработки растений или локуса эффективным количеством активного соединения, отличающийся тем, что в качестве активного соединения используют соединение общей формулы I.
В предпочтительном варианте его воплощения активным соединением является соединение, выбранное из вышеперечисленных соединений 1-14.
Соединения изобретения могут содержать в своих молекулах несколько асимметричных атомов углерода и, таким образом, могут образовывать оптические изомеры. Хотя все они представлены здесь единой формулой, изобретение включает как отдельные, выделенные изомеры, так и их смеси, включая их рацематы. Когда используют методики стереоспецифического синтеза или используют в качестве исходных соединений оптически активные вещества, тогда можно непосредственно получить отдельные изомеры; с другой стороны, если получают смесь изомеров, отдельные изомеры могут быть получены обычными методиками разделения. В частности, соединения изобретения могут существовать в α - или β -конфигурации, в отношении стереохимии в положении 13 скелета милбемицина. Хотя все такие изомеры и их смеси являются частью изобретения, предпочтительной конфигурацией является β -конфигурация.
Милбемициновые производные, содержащие оксиминовый заместитель в положении 13, в соответствии с изобретением могут существовать в виде син- и антиизомеров относительно атома азота оксимной группы. Когда эти изомеры оксима разделяют колоночной хроматографией, милбемициновое производное с меньшей полярностью обозначают в экспериментах как изомер A, и более полярное производное обозначают как изомер B.
Конкретные примеры соединений изобретения приводятся ниже в табл. 1, 2 и 3.
Соединения в табл. 1 все являются соединениями, имеющими формулу I в соответствии с данным выше определением, в которых X - группа, имеющая упомянутую формулу II.
Соединения в табл. 2 все представляют собой соединения формулы I, в которых в соответствии с приведенным выше определением X - группа, имеющая упомянутую формулу II, при этом
(a) для соединений со 2-1 по 2-96 включительно Y - группа 4-(A-NH)-фенил-, в которой A имеет значения, указанные для упомянутых соединений в табл. 2;
(b) в соединениях со 2-97 по 2-106 включительно Y - группа A-NH-тиазол-4-ил-, в которой A имеет значения, указанные для упомянутых соединений в табл. 2; и
(c) в соединениях со 2-107 по 2-114 включительно Y - группа A-NH-фенил-, в которой A имеет значения, установленные для этих соединений в табл. 2, и префиксная цифра перед каждой группой A указывает положение заместителя A-NH- в фенильном кольце.
Соединения в табл. 3 все являются соединениями формулы I, в соответствии с приведенным выше определением, в которых X - группа, имеющая формулу III, и предпочтительнее группа, имеющая формулу 4-(Z-NH)-C6H4-(O)p-, в которой Z и p имеют установленные выше значения.
В следующих далее таблицах используются аббревиатуры, имеющие следующие значения: Ac - ацетил, AcNH - ацетиламино, BAc - бромацетил, BAcNH - бромацетиламино, Bn - бензил, Bu - бутил, BuO - бутокси, BzO - бензилокси, CAc - хлорацетил, CAcNH - хлорацетиламино, Et - этил, EtO - этокси, Fo - формил, Fu - фурил, Hex - гексил, Lac - лактам, Me - метил, MeO - метокси, Oxa - оксазолил, Pen - пентил, Ph - фенил, PhenO - фенетилокси, Pip - пиперидил, Pr - пропил, PrO - пропокси, Pro - пропионил, ProNH - пропиониламино, Py - пиридил, Pyr - пирролидинил, TfAcNH - трифторацетиламино, Thd - тиазолидинил, Thi - тиенил, Thiz - тиазолил, c - цикло, i - изо, S - вторичный (втор. ), t - третичный (трет.).
Предпочтительными соединениями среди соединений, представленных в табл. 1, являются соединения NN 1-11, 1-12, 1-38, 1-72, 1-73, 1-74, 1-75, 1-77, 1-78, 1-79, 1-80, 1-81, 1-89, 1-90, 1-91, 1-92, 1-93, 1-98, 1-100, 1-102, 1-107, 1-111, 1-114, 1-147 и 1-186. Более предпочтительными соединениями являются соединения NN 1-38, 1-72, 1-73, 1-77, 1-78, 1-79, 1-80, 1-89, 1-92, 1-93 и 1-98. Особенно предпочтительными соединениями являются соединения NN 1-72 и 1-73.
Предпочтительными соединениями среди соединений, представленных в табл. 2, являются соединения NN 2-7, 2-16, 2-22, 2-39, 2-43, 2-45, 2-60, 2-61, 2-62 и 2-65. Более предпочтительными соединениями являются соединения NN 2-7, 2-22, 2-39, 2-43 и 2-45.
Предпочтительными соединениями среди соединений, представленных в табл. 3, являются соединения NN 3-1, 3-11, 3-19, 3-26, 3-27, 3-33, 3-34, 3-36, 3-37, 3-38, 3-39, 3-40, 3-43, 3-46, 3-47, 3-48, 3-49, 3-56, 3-58, 3-61, 3-64, 3-65, 3-68, 3-69, 3-70, 3-71, 3-72, 3-76, 3-77 и 3-78. Более предпочтительными соединениями являются соединения NN 3-11, 3-26, 3-27, 3-36, 3-37, 3-38, 3-39, 3-47, 3-48, 3-56, 3-68, 3-69 и 3-71. Особенно предпочтительными соединениями являются соединения NN 3-26, 3-27, 3-36, 3-37, 3-47, 3-56 и 3-69.
В соответствии с изобретением соединения формулы I могут быть получены способом, включающим следующие стадии:
(a) взаимодействие соединения формулы IV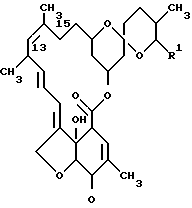 ,
,
(где
R1 имеет те же значения, которые установлены при определении формулы I), с соединением формулы V
B-(CR
(где
R2, m и n имеют те же значения, что и в формуле I, и B - группа формулы II) в соответствии с приведенным выше определением (или группа формулы VI ,
,
где
p имеет те же значения, что и в формуле I, с получением соединения формулы VII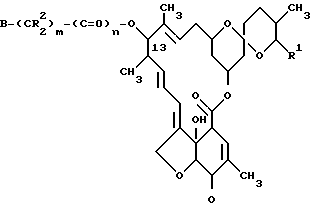 ,
,
(b) восстановление упомянутого соединения формулы VII с получением соединения формулы VIII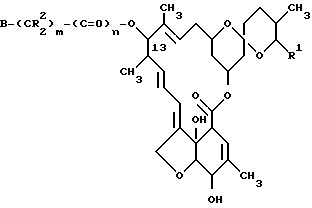 ,
,
и необязательные стадии, либо,
(c1) когда группа B в соединении формулы VIII представляет собой группу упомянутой формулы II (где Y - нитрозамещенная арильная группа, содержащая 6 - 10 атомов углерода, или нитрозамещенную гетероциклическую группу) или группу формулы VI, восстановление упомянутого соединения формулы VIII до соединения формулы IX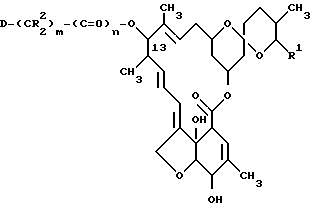 ,
,
где
R1, R2 m и n имеют те же значения, что и в формуле I и D группа формулы II (в соответствии с данным выше определением, в которой Y-аминозамещенная арильная группа, содержащая 6 - 10 атомов углерода, или аминозамещенная гетероциклическая группа), или группа формулы X ,
,
в которой
p имеет значения, установленные для формулы I, либо,
(c2) когда группа B в соединении формулы VIII представляет собой группу упомянутой формулы II (где Y - арильная группа, содержащая 6 - 10 атомов углерода, или гетероциклическая группа, причем упомянутые арильная или гетероциклическая группа содержит по крайней мере один алканоиламинозаместитель, содержащий 1-4 атома углерода, галогеналканоиламинозаместитель, содержащий 2-4 атома углерода, алкоксикарбониламинозаместитель, содержащий 2-6 атомов углерода, или галогеналкоксикарбониламинозаместитель, содержащий 3-5 атомов углерода), деацилирование упомянутого соединения формулы VIII до соединения упомянутой формулы IX, в котором Y - аминозамещенная арильная группа, содержащая 6-10 атомов углерода, или аминозамещенная гетероциклическая группа, и также необязательно
(d) взаимодействие упомянутого соединения формулы IX с соединением формулы XI
E - OH,
[где
E - алканоильная группа, содержащая 1 - 4 атома углерода, галогеналканоильная группа, содержащая 2 - 4 атома углерода, алкилсульфонильная группа, содержащая 1 - 3 атома углерода, алкоксикарбонильная группа, содержащая 2 - 5 атомов углерода, галогеналкоксикарбонильная группа, содержащая 3 - 5 атомов углерода, аминоалкильная группа, содержащая 2-7 атомов углерода (в которой аминогруппа, необязательно, может быть замещена 1 или 2 заместителями, которые могут быть одинаковыми или разными, выбираемыми среди заместителей C, определение которым дается выше, и алканоильная составляющая упомянутой аминоалканоильной группы может быть, необязательно, замещена фенильной группой или алкилтиогруппой, содержащей 1 - 3 атома углерода), (насыщенная 5- или 6-членная гетероциклил)карбонильная группа, содержащая в кольце атом азота (в которой у упомянутого атома азота, необязательно, может присутствовать заместитель, выбираемый среди заместителей C, определение которым дается выше, и в которой карбонильная группа присоединена к любому атому, но не к атому азота), или группа формулы Z, в соответствии с ее определением для формулы I]
или его реакционноспособным производным с образованием соединения формулы XII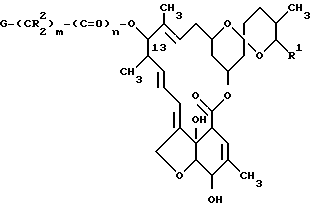 ,
,
(где
R1, R2, m и n имеют значения, установленные при определении формулы I; и G - группа формулы III, определение которой дается выше; или G - группа формулы II, определение которой дается выше, в которой Y - арильная группа, содержащая 6 - 10 атомов углерода, или гетероциклическая группа и в которой упомянутая арильная группа или упомянутая гетероциклическая группа имеют по крайней мере один заместитель формулы XIII
E1 - NH-,
где E1 - те же группы, которые упоминались выше при определении группы E при выборе группы Z).
Подробнее соединения формулы I изобретения в которых X представляет собой группу формулы II, определение которой дается выше, могут быть получены как показано на схеме реакций A, приведенной на фиг. 1, 2.
В приведенных на фиг. 1, 2 формулах R1, R2, R3, m и n имеют установленные выше значения; Y1 - любая из групп Y, значения которой установлены выше, за исключением того, что любую аминозамещенную арильную или аминозамещенную гетероциклическую составляющую заменяют соответствующей нитрозамещенной арильной или нитрозамещенной гетероциклической составляющей; Y2 - аминозамещенная арильная или аминозамещенная гетероциклическая группа в соответствии с их определением для группы Y, которое дается выше; и Y3 - арильная или гетероциклическая группа, определение которым дается выше для группы Y, при этом упомянутые арильная или гетероциклическая группы замещены группой E1NH (XIII), определение которой дается выше.
15-Гидроксимилбемициновое производное формулы IV, которое используют в качестве исходного соединения на стадии A1 в схеме реакций A, может быть получено в соответствии с методикой, описанной в публикации европейского патента 147852.
Другим исходным веществом на стадии A1 в схеме реакций A является вещество, изображаемое формулой Va
Y1-(C=N-OR3)-(CH2)m-(C=O)n-OH,
где
R3, Y1, m. n имеют установленные выше значения.
Когда m равен 0, и n равен 1, α -алкоксииминофенилуксусной кислоты могут быть получены с использованием в качестве исходного вещества коммерчески доступного этилфенилглиоксилата в соответствии с методикой, описанной в патенте США N 4024133.
α -Алкоксиимино-2-фурилуксусной кислоты могут быть получены с использованием в качестве исходных веществ коммерчески доступных 2-фурилкарбоновых кислот в соответствии с методикой, описанной в публикации патента Великобритании 1557423.
α -Алкоксиимино-2-тиенилуксусные кислоты могут быть получены с использованием в качестве исходного вещества коммерчески доступной 2-тиенилглиоксиловой кислоты по методике, описанной в патенте США N 4024133. α -Алкоксиимино-(2-амино-4-тиазолил)уксусная кислота и ее производные могут быть получены с использованием в качестве исходного вещества коммерчески доступной 2-амино-4-триазолилглиоксиловой кислоты по методике, описанной в патенте США 4024133.
α -Алкоксиимино (замешенный фенил)уксусные кислоты могут быть получены при использовании в качестве исходного вещества 2-(замещенный фенил)-1,2-этандиола (который описан в J. Med. Chem. 24, 1360 (1981)), используя методику, описанную в chem. Lett 1350 (1985), для получения простого трет-бутилдиметилсилил-2-оксо-(замещенный фенетил) эфира, который затем вводят во взаимодействие с 0-алкоксигидроксиламином обычными способами, и получают 2-алкоксиимино-2-(замещенный фенил) этанол, который затем окисляют обычными способами и получают нужную α -алкоксиимино-(замещенный фенил)уксусную кислоту. Например, 2-алкоксиимино-2-(4-нитрофенил )уксусная кислота может быть получена по методу, описанному в J. med. chem. 24, 1360 (1981). Метод состоит в превращении исходного вещества - 2-(4-нитрофенил)-1,2-этандиола - в трет-бутилдиметилсилил-2-оксо-2-(4-нитрофенетил)овый эфир (эта реакция описана в Chem. Lett. 1358 (1985), взаимодействии упомянутого эфира с 0-алкоксигидроксиламином с образованием 2-алкоксиимино-2-(4-нитрофенил)этанола и затем окислении полученного вещества обычными способами.
2-Алкоксиимино-2-(4-нитрофенил)уксусная кислота также может быть получена альтернативным способом, при котором этил-4-нитрофенилглиоксалат (описанный в Synthesis, 850 (1990) вводят во взаимодействие с O-алкоксигидроксиламином с последующим гидролизом полученного таким образом сложного эфира.
2-Гидроксиимино-2-(4-нитрофенил)уксусная кислота может быть получена по описанной выше методике с использованием гидроксиламина вместо О-алкоксигидроксиламина.
Когда m равна 1 и n равен 0, производные 2-алкоксиимино-2- (замещенный или незамещенный фенил)этанола, производные 2-алкоксиимино-2-(2-фурил)этанола, производные 2-алкоксиимино-2-(2- тиенил)этанола и производные 2-алкоксиимино-2-(2-амино-4-тиазолил)этанола могут быть получены как описано выше, когда такие соединения являются промежуточными соединениями при синтезе производных α -алкоксииминоуксусной кислоты.
Когда m равен 1 и n равен 1, производные 3-алкоксиимино-3-(замещенный или незамещенный фенил)пропионовой кислоты могут быть получены с использованием описанной выше методики для синтеза α - алкоксииминофенилуксусной кислоты, с применением в качестве исходного вещества коммерчески доступного этилбензоилацетата или этил(замещенный бензоил)ацетата, которые получают обычными способами.
3-Алкоксиимино-3-(4-нитрофенил)пропионовая кислота может быть получена с использованием в качестве исходного вещества этил(4-нитробензоил)ацетата, полученного известным способом, по методике, подобной той, которая описана выше для синтеза 2-алкоксиимино-2-(4-нитрофенил)уксусной кислоты. 3-Гидроксиимино-3- (4-нитрофенил)пропионовая кислота может быть получена из соответствующего производного пропионовой кислоты способом, подобным описанному выше.
Производные 3-алкоксиимино-3-(3-фурил)пропионовой кислоты, производные 3-алкоксиимино-3-(2-тиенил)пропионовой кислоты и производные 3-алкоксиимино-3-(2-амино-4-тиазолил)пропионовой кислоты могут получены по методике, описанной выше для получения производных 3-алкоксиимино-3-(замещенный фенил)пропионовой кислоты.
Стадия A1 в схеме реакций A включает получение соединения общей формулы VIIa путем взаимодействия соединения общей формулы IV с карбоновой кислотой или спиртом общей формулы Va в присутствии сильной кислоты, такой как серная кислота, соляная кислота, метасульфоновая, трифторметансульфоновая, бензолсульфоновая, 4-хлорбензолсульфоновая или трифторуксусная кислота, предпочтительно в присутствии трифторметансульфоновой кислоты.
Количество трифторметансульфоновой или другой используемой сильной кислоты может значительно изменяться в зависимости от реакционноспособности карбоновой кислоты или спирта (Va), которые используют, но составляет не более 1 эквивалента, и как правило, это каталитическое количество.
Реакция иногда может быть ускорена путем добавления в реакционную систему неорганического соединения. Примеры таких неорганических соединений включают соли металлов, такие как трифторметансульфонат меди, иодид меди, иодид цинка, иодид кобальта или иодид никеля, целит, силикагель, оксид алюминия или подобные; предпочтительными являются соли меди, такие как трифторметансульфонат меди или иодид меди, и наиболее предпочтительным является иодид меди.
Не существует особых ограничений по поводу природы растворителя, используемого для реакции, при условии, что растворитель не оказывает неблагоприятного действия на реакцию и может растворять исходные вещества по крайней мере до известной степени. Карбоновая кислота или спирт общей формулы Va иногда сами могут служить растворителями. Примеры предпочтительных растворителей включают ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан или диметоксиэтан; амиды, такие как диметилформамид, диметилацетамид или гексаметилфосфотриамид; сульфоксиды, такие как диметилсульфоксид; и нитрилы, такие как ацетонитрил.
Реакция может быть осуществлена в широком интервале температур, и точная температура не является критической для настоящего изобретения, но обычно реакцию осуществляют при температуре от -10 до 100oC, предпочтительно при 0 - 50oC.
Время, требуемое для реакции, изменяется в зависимости от многих факторов, существенно - от температуры реакции и природы реагентов и растворителя, но обычно при подходящих условиях реакции достаточным является время реакции от 5 мин до 6 ч, в особенности - от 10 мин до 2 ч.
Стадия A2 схемы реакций A включает получение соединения общей формулы Ia путем взаимодействия соединения общей формулы VIIa с восстановителем для восстановления карбонильной группы в положении 5 до гидроксильной группы.
Не существует особых ограничений по поводу восстановителя при условии, что он способен восстанавливать карбонильную группу в положении 5, и при условии, что не затрагиваются другие функциональные группы соединения формулы VIIa, когда карбонильная группа восстановлена. Примеры таких восстановителей включают восстановители, способные генерировать гидрид-анион, такие как борогидрид натрия или диборан, и предпочтительным является борогидрид натрия.
Не существует особых ограничений по поводу природы растворителя, используемого в реакции, при условии, что растворитель не оказывает неблагоприятного действия на реакцию. Когда в качестве восстановителя используют борогидрид натрия, примеры особенно предпочтительных растворителей включают низшие спирты, такие как метанол, этанол или пропанол.
Хотя реакция может быть осуществлена в широком интервале температур и температура не является критической для настоящего изобретения, реакцию обычно осуществляют при 0 - 50oC. Время, необходимое для реакции, также может широко изменяться и не является критическим параметром для изобретения. Однако при подходящих условиях реакции обычно достаточный период времени составляет от 5 мин до 2 ч.
Необязательная стадия A3 схемы реакции A включает получение соединения общей формулы Ib, в котором Y2 представляет собой аминозамещенную арильную или гетероциклическую часть, определение которым дается выше для Y. Этого можно достичь двумя различными способами. Первый из этих способов включает восстановление нитрогруппы соединения общей формулы Ia, в котором Y1 представляет собой нитрозамещенную арильную или гетероциклическую группу.
Восстановление нитрогруппы соединения формулы Ia может быть выполнено любым обычным способом при условии, что упомянутый способ восстановления не действует на какую-либо другую функциональную группу соединения формулы Ia. Одним из примеров такой методики является каталитическое восстановление с использованием катализатора из благородного металла. Примерами предпочтительных катализаторов для применения в реакции являются палладий-на-угле, палладий-на-сульфате бария и оксид платины.
Реакцию обычно и предпочтительно выполняют в присутствии растворителя. Не существует особых ограничений по поводу природы используемого растворителя при условии, что он не оказывает вредного влияния на реакцию и что он может растворять реагенты по крайней мере до некоторой степени. Примерами подходящих для применения растворителей являются спирты, такие как метанол или этанол; простые эфиры, такие как тетрагидрофуран или диоксан; и сложные эфиры, такие как этилацетат.
Реакция может происходить в широком интервале температур, и точная температура не является критическим параметром для предлагаемого изобретения. Реакцию обычно осуществляют при 10 - 80oC. Время, требуемое для реакции, также может изменяться в широких пределах в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Как правило, при подходящих условиях достаточным является период от 10 мин до 5 ч.
Еще одним предлагаемым способом восстановления нитрогруппы является взаимодействие соединения Ia с порошком цинка в присутствии уксусной кислоты. Реакция может протекать в широком интервале температур, и точная температура не является критическим параметром для предлагаемого изобретения. Однако обычно реакцию проводят при температуре от 0oC до комнатной температуры. Время, необходимое для реакции, также может широко изменяться в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. При подходящих условиях обычно достаточным является период от 30 мин до 12 ч.
Другой, альтернативный способ необязательной стадии A3 реакционной схемы A включает деацилирование соединения общей формулы Ia, в которой Y1 представляет собой арильную или гетероциклическую группу, замещенную по крайней мере одним алканоиламинным заместителем, содержащим 1 - 4 атома углерода, алкоксикарбониламинным заместителем, содержащим 2 - 5 атомов углерода, или галогеналкоксикарбониламинным заместителем, содержащим 3 - 5 атомов углерода.
Подходящими алканоиламинозаместителями являются формиламиногруппа и ацетиламиногруппа. Подходящими галогеналканоиламинозаместителями являются монохлорацетиламино- и монобромацетиламиногруппа. Подходящие алкоксикарбониламинозаместители включают трет-бутоксикарбониламиногруппу, и к подходящим галогеналкоксикарбониламинозаместителям относится трихлорэтоксикарбониламиногруппа.
Деацилирование алканоиламино-, галогеналканоиламино-, алкоксикарониламино- или галогеналкоксикарбониламиногруппа соединения формулы Ia может быть осуществлено любым обычным способом при условии, что упомянутое деацилирование не действует на другие функции группы соединения общей формулы Ia.
Деацилирование трет-бутоксикарбониламиноруппы может быть осуществлено, например, при взаимодействии соединения формулы Ia с соляной кислотой в диоксане. Реакция может происходить в широком интервале температур, и точная температура не является критическим параметром для настоящего изобретения. Однако реакцию удобно осуществлять при комнатной температуре. Время, требуемое для реакции, также может изменяться в широких пределах в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителей. Как правило, при подходящих условиях достаточным временем реакции является период 1 - 3 ч.
Деацилирование формиламиногруппы может быть осуществлено, например, путем взаимодействия соединения формулы Ia с соляной кислотой в метаноле. Реакция может проходить в широком интервале температур, и точная температура не является критическим параметром для предлагаемого изобретения. Однако реакцию удобно проводить при температуре приблизительно 10oC. Время, требуемое для реакции, также может широко изменяться, в зависимости от многих факторов, в особенности от температуры реакции и природы используемых реагентов и растворителя. Как правило, при подходящих условиях реакции достаточным периодом времени реакции является период около 1 ч.
Деацилирование трихлорэтоксикарбониламиногруппы может быть осуществлено, например, путем взаимодействия соединения формулы Ia с порошком кадмия в присутствии диметилформамида. Реакция также проходит в широком интервале температур, и точная температура не является критическим параметром для настоящего изобретения. Однако реакция может быть подходящим образом осуществлена при комнатной температуре. Время, требуемое для реакции, также может широко изменяться, и не является критическим параметром для настоящего изобретения, и зависит от многих факторов, в особенности от температуры реакции и природы используемых реагентов и растворителя. Однако при подходящих условиях реакции обычно достаточным является период 1 - 3 ч.
Другим примером подходящего способа деацилирования трихлорэтоксикарбониламиногруппы является обработка соединения формулы Ia цинком и уксусной кислотой. Реакция может протекать в широком интервале температур, и точная температура не является критической для настоящего изобретения. Однако реакцию можно удобно осуществить при комнатной температуре. Время, требуемое для реакции, может широко изменяться в зависимости от многих факторов, в особенности от температуры реакции и природы используемых реагентов и растворителя, и не является критическим для настоящего изобретения. Однако при подходящих условиях достаточным временем реакции является период от 30 мин до 1 ч.
Деацилирование монохлорацетиламиногруппы или монобромацетиламиногруппы может быть осуществлено, например, путем обработки соединения формулы Ia тиомочеивной в диметилформамиде. Реакция может проходить в широком интервале температур, и точная температура реакции не является критическим параметром для настоящего изобретения. Однако реакция может быть подходящим образом осуществлена при температуре от комнатной до 50oC. Время, требуемое для реакции, может широко изменяться в зависимости от многих факторов, в особенности от температуры реакции и природы используемых реагентов и растворителя. Обычно при подходящих условиях достаточным является время реакции 1 - 3 ч.
Необязательная стадия A4 реакционной схемы A включает получение соединения общей формулы Ic путем взаимодействия аминогруппы соединения общей формулы Ib с кислотой формулы E1-OH (где E1 имеет установленные выше значения) или с ее реакционноспособным производным.
Подходящими реакционноспособными производными кислоты формулы E1-OH являются соединения, которые обычно используют в реакциях конденсации, такие как, например, галоидангидрид (обычно, хлорангидрид или бромангидрид), ангидрид кислоты, смешанный ангидрид, активированный сложный эфир или активированный амид.
Когда используют кислоту, изображаемую формулой E1-OH, реакцию осуществляют в присутствии дегидратирующего агента, такого как, например, дициклогексилкарбодиимид (DCC), 2-хлор-1-метилпиридинийиодид, п-толуолсульфоновая кислота или серная кислота, и предпочтительным является 2-хлор-1-метилпиридинийиодид. Количество используемого реагента не является критической для изобретения величиной, но обычно его используют от 1 до 5 эквивалентов, предпочтительно от 1 до 2 эквивалентов, на моль кислоты формулы E1-OH.
Не существует особых ограничений относительно природы используемого в реакции растворителя при условии, что растворитель не оказывает неблагоприятного действия на реакцию и может растворять исходные вещества до некоторой степени. Примерами предпочтительных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол или толуол; галогенированные углеводороды, такие как хлороформ, дихлорметан или 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир или тетрагидрофуран; амиды, такие как N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; нитрилы, такие как ацетонитрил; и смеси одного или нескольких типов таких растворителей. Особенно предпочтительными являются дихлорметан или 1,2-дихлорэтан.
Реакция может протекать в широком интервале температур, и точная температура не является критическим параметром для предлагаемого изобретения. Реакцию удобно осуществлять при температуре от -70 до 90oC, предпочтительно при 0 - 60oC. Время, требуемое для реакции, зависит, главным образом, от температуры реакции и природы используемых исходных веществ, реагентов и растворителей и не является критическим для изобретения. При подходящих условиях реакции достаточным временем реакции обычно является период от 30 мин до целого дня, обычно от 30 мин до 6 ч.
Когда используются галоидоангидрид кислоты, изображаемой формулой E1-OH, реакцию осуществляют предпочтительно в присутствии основания. Используемое основание не является критическим параметром для предлагаемого изобретения. Примерами предпочтительных оснований являются органические основания, такие как, например, триэтиламин, N,N-диметиланилин, пиридин, 4-диметиламинопиридин, 1,5-диазабицикло[4,3.0]нон-5-ен (ДБН) или 1,8-диазабицикло[5,4.0]ундек-7-ен (ДБУ).
Точные количества галоидангидрида и основания, используемых в реакции, не являются критическими величинами для изобретения. Однако реакция может быть осуществлена подходящим образом при использовании 1 - 10 эквивалентов галоидангидрида кислоты формулы E1-OH и 2 - 8 эквивалентов основания по отношению к соединению общей формулы Ib.
Растворитель, температура реакции и время, требуемое для реакции с галоидангидридом кислоты формулы E1-OH, по существу, являются такими же, что и в реакции соединения формулы Ib с самой карбоновой кислотой. Как правило, реакцию осуществляют при 0 - 50oC в течение периода времени от 5 мин до 2 ч.
После завершения каждой стадии реакции нужные соединения формул VIa, Ia, Ib и Ic могут быть выделены из реакционной смеси обычными способами и, если необходимо, очищены обычными способами, такими как колоночная хроматография.
Милбемицины и аналогичные природные продукты, которые могут использоваться в качестве исходных веществ при синтезе соединений формулы IV, обычно получают в виде отдельных соединений или в виде смесей при различном соотношении родственных соединений, и они могут быть введены в реакцию после разделения на различные фракции, или их можно использовать в упомянутых выше реакциях в виде смесей. Следовательно, соединение, используемое на каждой стадии в упомянутых выше реакциях, может представлять собой либо единичное соединение, либо смесь соединений. Соответственно, соединения формулы Ia, Ib или Ic могут быть получены в виде единичных соединений или в виде смеси соединений и могут использоваться как таковые, или могут быть разделены на отдельные соединения перед применением.
Соединения предлагаемого изобретения формулы I, в которых X - группа формулы III, определение которой дается выше, могут быть получены как показано на схеме реакций (реакционной схеме) B (см. фиг. 3, 4).
В формулах на схеме реакций B, R1, R2, p и z имеют установленные выше значения.
Производные 15-гидроксимилбемицинов формулы IV, которые используются в качестве исходных веществ на стадии B1, являются известными соединениями, раскрытыми в публикации европейского патента 147582.
Соединение, которое используется в качестве другого исходного вещества на стадии B1, изображается формулой Vb
[NO2C6H4 - (O)p - C (R2)2 - COOH],
(где
R2 и p имеют установленные выше значения), и может быть получено с применением в качестве исходных веществ коммерчески доступных реагентов хорошо известными способами.
Когда p равен 1, нужное соединение Vb может быть получено гидролизом эфира α -(нитрофенокси)- α -алкилалкановой кислоты (например, эфира α -(4-нитрофенокси)- α -алкилалкановой кислоты), который может быть получен через следующие стадии:
(a) алкилирование в α -положение коммерчески доступного эфира алкановой кислоты с применением галоидангидрида в присутствии основания;
(b) галогенирование в α -положение полученного таким образом эфира α -алкилалкановой кислоты; и
(c) взаимодействие полученного таким образом эфира α -алкил- α -галогеналкановой кислоты (или коммерчески доступного соединения) с нитрофенолом (например, с 4-нитрофенолом) в присутствии основания.
Когда p равен 0, нужное соединение Vb может быть получено гидролизом α -(нитрофенил)- α,α -диалкилацетата (например, α -(4-нитрофенил)- α,α -диалкилацетата), который может быть получен алкилированием коммерчески доступного нитрофенилацетата (например, 4-нитрофенилацетата) алкилгалогенидом в α -положение в присутствии основания.
Стадия B1 реакционной схемы B включает получение соединения общей формулы VIIb путем обработки соединения общей формулы IV карбоновой кислотой общей формулы Vb в присутствии сильной органической кислоты, такой какая использовалась на стадии A1 реакционной схемы A, например трифторметансульфоновой кислотой. Количество используемой сильной органической кислоты, предпочтительные условия, такие как применение неорганического ускорителя, растворители, время и температура реакции подходят те же, что и писанные для стадии A1 реакционной схемы A.
Стадия B2 реакционной схемы B включает получение соединения общей формулы VIIIa при взаимодействии соединения общей формулы VIIb с восстановителем для восстановления карбонильной группы в положении 5 до гидроксильной группы.
Не существует особых ограничений для используемого восстановителя при условии, что другие части соединения формулы VIIb не затрагиваются при восстановлении карбонильной группы. Примерами таких восстановителей являются восстановители, способные генерировать гидрид-анион, такие как борогидрид натрия или диборан, и предпочтителен борогидрид натрия.
Используемый растворитель, интервал температуры реакции и время реакции являются подходящими, когда они такие же, как для стадии A2 приведенной выше реакционной схемы A.
Стадия B3 реакционной схемы B включает получение соединения общей формулы IXa, содержащего аминозаместитель, путем восстановления нитрозаместителя в фенильной или феноксигруппе соединения общей формулы VIIIa, полученного на стадии b2.
Восстановление нитрогруппы соединения общей формулы VIIIa может быть осуществлено обычными способами, описанными для произвольной стадии A3 реакционной схемы A. Примерами подходящих восстановителей, растворителей, температуры реакции и времени реакции являются описанные выше для необязательной стадии A3 схемы реакций A.
Стадия B4 включает получение соединения общей формулы Id, определения для которой приводятся выше, путем взаимодействия кольцевого аминозаместителя соединения общей формулы IXa, полученного на стадии B3, с кислотой формулы Z-OH (в которой Z имеет установленные выше значения) или с ее реакционноспособным производным.
Подходящими реакционноспособными производными кислоты формулы Z-OH являются производные, которые используют в традиционных реакциях конденсации, такие как, например, галоидангидрид (обычно, хлорангидрид или бромангидрид), ангидрид, смешанный ангидрид, активированный эфир или активированный амид.
Когда используют кислоту, изображаемую формулой Z-OH, реакцию осуществляют предпочтительно в присутствии дегидратирующего агента, такого как, например, дициклогексилкарбодиимид (DCC), 2-хлор-1-метилпиридинийиодид, п-толуолсульфоновая кислота или серная кислота и предпочтителен 2-хлор-1-метилпиридинийиодид. Количество используемого реагента не является критическим параметром для изобретения, но обычно используют 1 - 5 эквивалентов, предпочтительно от 1 до 2 эквивалентов, реагента на моль кислоты формулы Z-OH.
Не существует особых ограничений для природы используемого растворителя при условии, что он не оказывает вредного действия на реакцию и может растворять исходные вещества, до некоторой степени. Примерами предпочтительных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол или толуол; галогенированные углеводороды, такие как хлороформ, дихлорметан или 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир или тетрагидрофуран; амиды, такие как N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; нитрилы, такие как ацетонитрил; и смеси одного или нескольких типов этих растворителей. Особенно предпочтительными являются дихлорметан или 1,2-дихлорэтан.
Реакция может происходит в широком интервале температур, и точная температура реакции не является критическим параметром для предлагаемого изобретения. Подходящим образом реакцию осуществляют при температуре от -70 до 90oC, предпочтительно при 0 - 60oC. Время, требуемое для реакции, зависит, главным образом, от температуры реакции и от природы используемых реагентов, исходных соединений и растворителей и не является критическим для изобретения. При подходящих условиях реакции период реакции составляет от 15 мин до целого дня, обычно от 30 мин до 6 ч.
Когда используют галоидангидрид кислоты, изображаемый формулой Z-OH, реакцию осуществляют предпочтительно в присутствии основания. Используемое основание не является критическим обстоятельством для изобретения. Примеры предпочтительных оснований включают органические основания, такие как, например, триэтиламин, N,N-диметиланилин, пиридин, 4-диметиламинопиридин, 1,5-диазабицикло[4.3.0] нон-5-ен (ДБН) или 1,8-диазабицикло[5.4.0] ундек-7-ен (ДБУ).
Точное количество используемых галоидангидрида и основания не является критической величиной для изобретения. Однако подходящим образом реакцию можно осуществить, используя 1 - 10 эквивалентов галоидангидрида кислоты формулы Z-OH и 2 - 8 эквивалентов основания по отношению к соединению общей формулы IXa.
Растворитель, температура реакции и время, требуемое для реакции, которые используют при взаимодействии соединений формулы IXa с галоидангидридами кислот формулы Z-OH, являются, по существу, такими же, как при реакции с самой карбоновой кислотой. Как правило, реакцию осуществляют при температуре 0 - 50oC, и обычно достаточным бывает время реакции от 5 мин до 2 ч.
После завершения реакции на каждой стадии нужные соединения формул VIIb, VIIIa, IXa и Id могут быть извлечены из реакционной смеси обычными способами и при необходимости очищены обычными способами, такими как колоночная хроматография.
Милбемицины и аналогичные природные продукты, которые могут использоваться в качестве исходных веществ для синтеза соединений формулы IV, обычно получают в виде отдельных соединений или в виде смесей с различным соотношением родственных соединений и могут вводиться в реакцию после того, как разделены на различные фракции, или они могут использоваться в упомянутых выше реакциях в виде смесей. Следовательно, соединение, используемое на каждой стадии упомянутых выше реакций может представлять собой либо отдельное соединение, либо смесь соединений. Соответственно, соединение формулы Id может быть получено в виде отдельного соединения или в виде смеси соединений, и, если предпочтительна смесь соединений, она может использоваться как таковая или она может быть разделена на индивидуальные соединения перед использованием.
Соединения изобретения обладают сильным акарицидным действием против взрослых насекомых и яиц паутинных клещиков, принадлежащих к семействам Tetranycnidae, Eriophyidae и т.п., которые паразитируют на фруктовых деревьях, овощах и цветах. Они также являются активными по отношению к клещам семейств Ixodidae, Dermanyssidae, Sarcoptidae и т.п., которые паразитируют на животных. Кроме того, они являются действенными по отношению к резистентным клещам, с которыми трудно бороться известными акарицидами, и которые в последнее время причиняют немало беспокойств.
Соединения изобретения также обладают сильной инсектицидной активностью и, следовательно, могут использоваться в качестве инсектицидов. Активные соединения изобретения показывают определенное профилактическое действие против насекомых-вредителей, но не обладают фитотоксичностью, и поэтому сельскохозяйственные и садовые растения никогда не повреждаются этими соединениями. Соединения изобретения могут использоваться для уничтожения различных насекомых-вредителей, в том числе вредителей, которые повреждают растения, высасывая или поедая их, вредителей, которые паразитируют на растениях, вредителей, которые повреждают материал при хранении, насекомых, которые считаются вредителями из гигиенических соображений и т.п.
Примерами вредных насекомых, которые чувствительны к соединениям изобретения, являются насекомые отрядов Coleoptera, например зерновка фасолевая (azuki bean weevil) (Callosobruchus chinensis), долгоносик рисовый (Sitophilus zeamais), хрущик каштановый (Tribolium castaneum), двадцативосьмиточечная божья коровка (Epilachna vigitioctomaculata), проволочник ячменный (Agriotes fuscicollis), жук соевый (Soybean beetle) (Anomala rufocuprea), жук колорадский (Leptinotarsa decemkineata), жук-блошка (Diabrotica spp.) (здесь и далее - spp. - виды), усач черный (Monochamus alternatus), долгоносик рисовый водяной (Lissorhoptrus oryzophilus) и капюшонник (Lyctus bruneus); Lepidoptera, например, шелкопряд непарный (Lymantria disper), коконопряд (Malacosoma neustria); гусеница капустная обыкновенная (Pieris rapae), совка обыкновенная (Spodoptera litura), капустные "походные черви" (Mamestra brassicae), совка рисовая (Chilo suppressalis), oriental corn borer (Pyrausta nubilalis), средиземноморская огневка (Ephestia cautella), чайная листовертка (Adoxophyea orana), плодожорка яблонная (Carpocapsa pomonella), совка (Agrotis fucosa), моль большая восковая (Galleria mellonella), моль капустная (Plutella myloatella), и цитрусовая минирующая соль (Phyllocnistis citrella); Hemiptera, например цикадка рисовая (Nephotettix cincticeps), дельфацида рисовая (Nilaparvata lugens), червец мучнистый (Pseudococus comstocki), щитовка (Unaspis yanonensis), тля персиковая (Myzus persicae), тля яблоневая листовая (Aphis pomi), тля хлопковая (Aphis gossypii), тля ложнокапустная (Rhopalosiphum pseudobrassicas), кружевница грушевая (Stephanitis nashi), тля овощная обыкновенная (Nazara spp.), клоп постельный (Cimex lectularius), белокрылка тепличная (Trialeurodes vaporariorum), и листоблошка (Psylla spp.); Orthoptera, например, таракан рыжий (Blatella germanica), американский таракан (Reriplaneta americana), медведка африканская (Gryllotalpa africana), и саранча (Locusta migratoria, migratorioides). Isoptera, например термит Yamato(Deucotermes speratus) и термит Coptotermes formosamus; и Diptera, например муха комнатная (Mucus domestica), личинка мухи ростковой (Hylemia platura), желтолихорадочный комар (Aedes aegypti), комар обыкновенный (Culex pipiens), комар малярийный (Anopheles slnensis) и малый комар обыкновенный (Culex tritaeniorhynehus).
Кроме того, в области ветеринарии соединения изобретения являются действенными против различных гельмитов у животных (как против эндо-, так и против эстпаразитов), например насекомых и червей. Примерами вредных гельминтов животных являются овод желудочный большой (Gastrophilus spp.), жигалка осенняя (Stomoxys spp. ), власоед (Trichodectes spp.), клоп-хищнец (Rhodnius spp.) и блоха собачья (Ctenocephalides canis).
Соединения также являются эффективными против различных нематод, которые действуют на животных, имеющих значение для сельского хозяйства. В частности, типичными видами нематод, которые паразитирую на домашнем скоте, домашней птице, комнатных животных, таких как свинья, овцы, козы, коровы, лошади, собаки, кошки или куры и против которых соединения изобретения являются действенными, являются Haemonohus, Trichostrongylus, Ostertagia, Nematodirus, Cooperia, Ascaris, Binostomum, Oesophagostomum, Chabertia, Trichuris, Storongylus, Trichonema, Dictyocaulus, Capillaria, Heterakis, Toxocara, Ascaridia, Oxyuris, Ancylostoma, Uncinaria, Toxascaris, Parascaris.
Некоторые виды паразитов родов Nematodirus, Cooperia и Oesophagostomum поражают кишечник, в то время как некоторые виды родов Haemonchus и Ostertagia паразитируют в желудке, и паразиты, принадлежащие к роду Dictyocaulus обнаружены в легких. Паразиты, принадлежащие к семействам Filariidae и Setariidae, обнаружены во внутренних тканях и органах, например в сердце, кровеносных сосудах, в подкожных тканях и в лимфатических сосудах. Соединения изобретения действуют на всех этих паразитов.
Соединения изобретения также действуют против других паразитов, таких как паразиты родов Ancylostoma, Necator, Ascaris, Strongyloides, Trechinella, Capillaria, Trichuris и Enterobius.
Соединения также являются действенными против паразитов родов Wuchereria, Brugia, Onchoceca и Loa семейства Fillaridae (которые обнаружены в крови, тканях и органах, иных чем желудочно-кишечный тракт, и которые являются важными с медицинской точки зрения), паразитов рода Dracunculus семейства Dracunculidae и внутрикишечных паразитов родов Strongyloides и Trichinell, которые особенно поражают экзоинтестинальный канал.
Когда соединения изобретения используют в качестве антигельминтов для животных, они могут вводиться перорально в виде жидкости для питья. Питье может содержать раствор, суспензию или дисперсию активного соединения в подходящем нетоксичном растворителе или в воде, и в смеси с суспендирующим агентом, таким как бентонит, смачивателем или с другими эксципиентами. Питье, вообще, также может содержать противовспенивающее средство. Активное соединение обычно присутствует в питье в количестве 0,01-5 мас.%, предпочтительнее 0,01-0,1 мас.%.
Композиции могут вводиться перорально в форме сухих твердых препаратов, предпочтительно в форме стандартной дозы, такой как капсулы, драже или таблетки, содержащие нужное количество активного соединения. Эти композиции могут быть получены путем смешения активного соединения до однородного состояния с подходящими измельченными носителями, разбавителями, разрыхлителями и/или связующими, например с крахмалом, лактозой, тальком, стеаратом магния и растительной смолой. Вес и содержание препаратов может изменяться в широких пределах, в зависимости от вида животного, которое лечат, степени заражения, природы паразита и массы тела животного, которое подлежит лечению.
Соединения также могут вводиться в виде добавок к корму животного, и в таком случае эти соединения могут быть равномерно распределены в корме, использованы в виде приправы или в виде гранул. Содержание активного соединения в корме для достижения антигельминтного действия составляет предпочтительно 0,0001 - 0,02%.
Соединения изобретения, когда она растворены или диспергированы в жидком носителе, могут вводиться парентерально животным посредством инъекции в поджелудки, мышцы или трахеи, или могут вводиться подкожный инъекцией. Для парентерального введения активное соединение смешивают предпочтительно с подходящим растительным маслом, таким как арахисовое масло или хлопковое масло. Содержание активного соединения в композиции обычно составляет 0,05-50 мас.%.
Соединения изобретения также могут вводиться местно в смеси с подходящим носителем, таким как диметилсульфоксид или углеводородный растворитель. Такие препараты наносят непосредственно на животное, наружно, путем опрыскивания или купания.
Доза активного соединения может изменяться в зависимости от вида животного, которое лечат, и природы и степени заражения паразитами. Однако наилучшие результаты при пероральном введении достигаются при дозе 0,01 - 100 мг, предпочтительнее 0,5-50 мг на 1 кг веса тела животного. Соединение может вводиться в виде единичной дозы или в виде разделенных доз в течение относительно короткого периода, такого как 1 - 5 дней.
Когда композиции изобретения предназначаются для применения в сельском хозяйстве и садоводстве, возможны различные формы и композиции. Например, композиции могут иметь вид дустов, порошков, растворимых порошков, микрогранул, тонких микрогранул, смачивающихся порошков, разбавленных эмульсий, концентратов эмульсий, водных или масляных суспензий или водных или масляных растворов (которые можно непосредственно применять для опрыскивания или которые можно использовать для разбавления), аэрозолей или капсул из полимерных материалов. Используемый носитель может быть естественного происхождения или синтетическим, органическим или неорганическим, и используется обычно для того, чтобы способствовать активному соединению достигать цели, которая подлежит обработке, и облегчать хранение, транспортировку или обращение с активным соединением. Твердые, жидкие и газообразные носители могут быть выбраны из числа хорошо известных в технике носителей, предназначенных для композиций такого рода.
Такие композиции могут быть приготовлены обычными способами, например путем совместного перемешивания и/или измельчения активного ингредиента (ингредиентов) с носителем или разбавителем (растворителем) и, необязательно, с одним или несколькими поверхностно-активными веществами.
Примерами подходящих растворителей являются ароматические углеводороды, в частности фракции C8-C12 при перегонке нефти, такие как смеси ксилолов или замещенные нафталины; эфиры фталевой кислоты, такие как дибутил- или диоктилфталат; алифатические или алициклические углеводороды, такие как циклогексан или алканы; спирты, такие как этанол, этиленгликоль, монометиловый эфир этиленгликоля или моноэтиловый эфир этиленгликоля; гликоли или их простые эфиры; кетоны, такие как циклогексанон; полярные растворители, такие как N-метил-2-пирролидон, диметилсульфоксид или диметилформамид; произвольно эпоксидированные растительные масла, такие как эпоксидированное арахисовое масло или соевое масло; и вода.
Примерами носителей, которые могут быть использованы, например, в дустах и диспергируемых порошках, являются природные минеральные наполнители, такие как кальцит, тальк, каолин, монтмориллонит или аттапульгит. Чтобы улучшить физические свойства композиции, можно также добавлять высокодисперсную кремниевую кислоту или высокодисперсные абсорбирующие полимеры. Примерами подходящих гранулированных абсорбирующих носителей являются пористые вещества, такие как пемза, измельченный кирпич, сепиолит и бентонит; и непористые вещества, такие как кальцит, и песок. Могут использоваться самые разные предварительно гранулированные материалы, органические и неорганические, приметами которых являются доломит и измельченные растительные остатки.
Когда используют одно или несколько поверхностно-активных веществ, такие вещества могут представлять собой катионогенные, анионогенные и неионогенные соединения, обладающие хорошими эмульгирующими, диспегирующими и смачивающими свойствами, которые per se являются традиционными в составах агрохимикатов и т.п. Может использоваться отдельное такое поверхностно-активное вещество, а также смеси таких поверхностно-активных веществ.
К неионогенным поверхностно-активным веществам, которые могут быть использованы, относятся простые полиоксиэтиленалкиловые эфиры; сложные полиоксиэтиленалкиловые эфиры; простые полиоксиэтиленалкилариловые эфиры; полиоксиэтиленсорбитаналкиловые эфиры; сорбитаналкиловые эфиры; эфиры жирных кислот и сахаров; глицериновые или пентаэритритные эфиры жирных кислот; поверхностно-активные вещества типа плюроника; ацетиленспирты, ацетилендиолы и их этиленоксидные аддукты; кремнийорганические поверхностно-активные вещества и алкилгликозиды.
К анионогенным поверхностно-активным веществам, которые могут использоваться, относятся соли алкилбензолсульфоновых кислот; соли диалкилсульфоянтарных кислот, соли алкилсульфатов; соли алкилметилтауридов; анионогенные поверхностно-активные вещества, полученные эстерификацией серной или фосфорной кислоты упомянутыми выше этиленоксидными аддуктами - неионогенными поверхностно-активными веществами с последующей, если необходимо, нейтрализацией подходящей щелочью; соли лигносульфоновых кислот; соли алкилнафталинсульфоновых кислот; соли фенолсульфокислоты и их конденсаты; полимерные моющие средства из поликарбоновых кислот ил полисульфоновых кислот в форме солей или конденсатов, например, с акриловой кислотой, малеиновой кислотой, стиролсульфоновой кислотой или с винил-радикалом; поверхностно-активные вещества типа крахмала, содержащие продукты присоединения крахмала или декстрина с 1-(2-октеноил)-натрийсукцинатом; соли карбоксиметилцеллюлозы; мыла, такие как натриевые или калиевые соли высших жирных кислот; и соли α - олефин-сульфоновых кислот.
Катионогенные поверхностно-активные вещества, которые могут использоваться, включают поверхностно-активные вещества, являющиеся аминосолями или солями четвертичного аммония, и этилендиоксидные аддукты высших алифатических аминов или амидов жирных кислот.
Амфотерные поверхностно-активные вещества, которые могут быть использованы, включают поверхностно-активные вещества аминокислотного типа бетаина или лецитина.
Обнаружено, что производные различных вышеупомянутых поверхностно-активных веществ, в которых один или несколько атомов водорода замещены атомами фтора, сильно снижают поверхностное натяжение и могут успешно применяться в композициях предлагаемого изобретения.
Композиции изобретения также могут содержать одну или несколько добавок, выбираемых из группы, состоящей из стабилизаторов, противопенных средств, регуляторов вязкости, связующих и адгезивов или их любого из сочетания, а также удобрения и другие активные вещества, чтобы достичь особенного действия.
Инсектицидные и акарицидные композиции, как правило, содержат 0,01-99%, предпочтительнее 0,1-95% активного соединения; 1-99,99% твердой или жидкой добавки и 0-25%, предпочтительнее 0,1-25% поверхностно-активного вещества. Когда коммерческие продукты продают, как правило, в виде концентратов композиций, они обычно разбавляются для окончательного использования до концентрации 0,001-0,0001 мас.% (10-1 ppm).
Все указанные выше проценты представляют собой весовые проценты.
Соединения изобретения могут быть сформулированы в смеси или использоваться в сочетании с другими активными соединениями, например с инсектицидами, пищевыми ядами, бактерицидами, акарицидами, нематоцидами, фунгицидами, регуляторами роста растений или гербицидами. Примерами упомянутых инсектицидов являются фосфороорганические химикаты, карбаматные химические препараты, карбоксилатные препараты, хлорированные углеводороды и инсектициды, продуцированные микроорганизмами.
Соединения изобретения также могут быть сформулированы в смеси или использоваться в сочетании с синергистами. Необходимо, чтобы такие химические препараты и формы предполагаемого применения были пригодными коммерчески. Синергист присутствует независимо от активности в самом соединении, способном усиливать действие активных соединений.
Далее изобретение иллюстрируется, но не ограничивается, примерами, препаративными примерами и примерами композиций, которые иллюстрируют, соответственно, получение некоторых соединений изобретения, исходных веществ, используемых для получения соединений изобретения, и агрохимических композиций, содержащих соединения изобретения. Соединения изобретения указываются под номерами, присвоенными им в приведенных выше табл. 1-3.
Пример 1. 13-( α -Метоксииминофенилацетокси)милбемицин A4 (изомер A).
(Стадия A). 13-( α -Метоксииминофенилацетокси)-5- кетомилбемицин A4.
При охлаждении льдом и в потоке аргона добавляют одну каплю трифторметансульфоновой кислоты к смеси 100 мг (0,18 ммоль) 15-гидрокси-5-кетомилбемицина A4, 64,5 мг (0,36 ммоль) α -метоксииминофенилуксусной кислоты (менее полярный изомер) и 68 мг иодида меди (I) в 5 мл дихлорметана. Полученную в результате смесь перемешивают при комнатной температуре в течение 1 ч. По окончании этого периода реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают 5%-ным водным раствором бикарбоната натрия, затем насыщенным водным раствором хлорида натрия, и сушат над безводным сульфатом магния. Отгоняют растворитель, и полученный в результате остаток очищают колоночной хроматографией на силикагеле, элюируют этилацетатом в гексане со ступенчатым градиентом (10 - 50%), и получают 53 мг названного в заголовке соединения (выход 41%).
Масс-спектр (m/Z): 717 (M+), 659, 539, 520, 502.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 7,46 - 7,54 (2H, мультиплет); 7,31 - 7,41 (3H, мультиплет); 6,55 (1H, синглет); 5,78 - 5,93 (2H, мультиплет); 5,38 - 5,57 (3H, мультиплет); 5,20 (1H, дублет, J = 10,9 Гц); 3,99 (3H, синглет); 3,96 (1H, синглет).
(Стадия B). 13-( α -Метоксииминофенилацетокси)милбемицин A4 (изомер A) (соединение N 1 - 72).
При охлаждении льдом добавляют 3,0 (0,08 ммоль) борогидрида натрия к раствору 43,2 мг (0,06 ммоль) 13-( α -метоксиимнофенилацетокси)-5-кетомилбемицина A4 в 4 мл метанола, и получающуюся в результате смесь перемешивают при 0oC в течение 30 мин. По окончании этого времени реакционную смесь выливают в воду и затем экстрагируют этилацетатом. Экстракт промывают водой, затем насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и полученный в результате остаток очищают колоночной хроматографией на силикагеле, элюируют этилацетатом в гексане со ступенчатым градиентом (25 - 50%), и получают 38 мг (64%) названного в заголовке соединения.
Масс-спектр (m/Z): 719 (M+), 591, 540, 412, 394, 279.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ,ppm: 7,48 - 7,54 (2H, мультиплет); 7,31 - 7,42 (3H, мультиплет); 5,78 - 5,87 (2H, мультиплет); 5,51 (1H, дублет дублетов, J = 8,0, 12,0 Гц); 5,31 - 5,47 (3H, мультиплет); 5,20 (1H, дублет, J = 10,9 Гц); 3,99 (3H, синглет); 3,98 (1H, синглет) .
Примеры 2 - 27. Соединения примеров 2 - 27 синтезируют по методикам, подобным методике, описанной выше в примере 1. Как и в примере 1, сначала на стадии A получают 5-кето-производные нужного милбемицинового соединения, и полученное соединение затем превращают в конечный продукт на стадии B. Выход (%) на каждой стадии указывается после номера соединения. Звездочка в круглых скобках (*) указывает, что полученный продукт используют в последующей реакции без дополнительной очистки, и таким образом, выход на этой стадии не оценивают.
Пример 2. 13-(2-Метоксиимино-2-фенилацетокси)милбемицин A4.
[Соединение N 1-11: стадия A (*) - стадия B (48%)].
Масс-спектр (m/Z): 750 (M+), 687, 656, 554, 540, 504.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 7,60 - 7,69 (2H, мультиплет); 7,28 - 7,39 (3H, мультиплет); 5,63 - 5,81 (2H, мультиплет); 5,13 - 5,46 (4H, мультиплет); 4,46 (2H, синглет); 3,98 (3H, синглет); 3,21 - 3,30 (3H, мультиплет).
Пример 3. 13-[2-Метоксиимино-2-(2-хлорфенил)этокси]милбемицин A4.
[Соединение N 1-12: стадия A (*) - стадия B (74%)].
Масс-спектр (m/Z): 739 (M+), 721, 690, 540, 460.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 7,25 - 7,40 (4H, мультиплет); 5,57 - 5,78 (2H, мультиплет); 5,14 - 5,42 (4H, мультиплет); 4,37 и 5,54 (2H, AB-квартет, J = 15,7 Гц); 3,96 (3H, мультиплет); 3,16 (1H, дублет, J = 9,9 Гц).
Пример 4. 13-[2-Метоксиимино-2-(3-фторфенил)этокси]милбемицин A4.
[Соединение N 1-13: стадия A (*) - стадия B (55%)].
Масс-спектр (m/Z): 723 (M+), 674, 572, 540, 444, 414.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ,ppm: 7,28 - 7,46 (3H, мультиплет); 6,99 - 7,07 (1H, мультиплет); 5,67 - 5,81 (2H, мультиплет); 5,14 - 5,46 (4H, мультиплет); 3,98 (3H, синглет).
Пример 5. 13-[2-Метоксиимино-2-(3-хлорфенил)этокси]милбемицин A4.
[Соединение N 1-14: стадия A (*) - стадия B (61%)].
Масс-спектр (m/Z): 739 (M+), 690, 611, 540, 460.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ,ppm: 7,65 (1H, синглет); 5,52 - 5,58 (1H, мультиплет); 7,25 - 7,36 (2H, мультиплет); 5,65 - 5,80 (2H, мультиплет); 5,15 - 5,45 (4H, мультиплет); 4,42 (2H, синглет); 3,98 (3H, синглет).
Пример 6. 13-( α -Метоксииминофенилацетокси)милбемицин A4 (изомер B).
[Соединение N 1-73: стадия A (*) - стадия B (55%)].
Масс-спектр (m/Z): 719 (M+), 591, 540, 458, 412, 394.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 7,30 - 7,46 (5H, мультиплет); 5,70 - 5,89 (2H, мультиплет); 5,29 - 5,48 (4H, мультиплет); 5,10 (1H, дублет, J = 10,5 Гц); 4,04 (3H, синглет).
Пример 7. 13-( α -Метоксииминофенилацетокси)милбемицин A3.
[Соединение N 1-38: стадия A (78%) - стадия B (75%)].
Масс-спектр (m/z): 705 (M+), 577, 526, 398, 380.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 7,45 - 7,55 (2H, мультиплет); 7,28 - 7,40 (3H, мультиплет); 5,71 - 5,91 (2H, мультиплет); 5,29 - 5,60 (4H, мультиплет); 5,19 (1H, дублет, J = 10,6 Гц); 3,98 (3H, синглет).
Пример 8. 13-( α - Метоксиимино-2-хлорфенилацетокси)милбемицин A4.
[Соединение N1 - 74 стадия A (*) - стадия B (20%)].
Масс-спектр (m/z): 753 (M+), 625, 540.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,55 - 7,60 (2H, мультиплет); 7,25 - 7,41 (3H, мультиплет); 5,78 - 5,91 (2H, мультиплет); 5,28 - 5,52 (4H, мультиплет); 5,12 (1H, дублет, J = 10,5 Гц); 4,04 (3H, синглет).
Пример 9. 13- ( α -Метоксиимино-3-фторфенилацетокси)милбемицин A4.
[Соединение N1 - 75: стадий A (*): стадия B (60%)].
Масс-спектр (m/z): 737 (M*), 680, 609, 552, 522.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 5,77 - 5,98 (2H, мультиплет): 5,30 - 5,61 (4H, мультиплет); 5,20 (1H, дублет, J = 10,6 Гц); 4,00 (3H, синглет).
Пример 10. 13-( α/ -Метоксиимино-3-хлорфенилацетокси)милбемицин A4.
[Соединение N1 - 76: стадия A (*) - стадия B (55%)].
Масс-спектр (m/z): 753 (M+), 625, 540, 456, 412, 394.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,25 - 7,55 (4H, мультиплет); 5,72 - 5,87 (2H, мультиалет); 5,30 - 5,49 (4H, мультиплет); 5,20 (1H, дублет, J = 10,4 Гц); 4,01 (3H, синглет).
Пример 11. 13-( α )-Метоксиимино-4-хлорфенилацетокси)милбемицин A4(изомер A).
[Соединение N1 - 77: стадия A (*) - стадия B (34,0%)].
Масс-спектр (m/z): 753 (M+), 625, 522, 456, 412.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ ,ppm: 7,42 - 7,46 (2H, мультиплет); 7,31 - 7,36 (2H, мультиплет); 5,82 - 5,90 (2H, мультиплет); 5,34 - 5.54 (4H, мультиплет); 5,19 (1H, дублет, J = 10,5 Гц); 3,99 (3H, синглет); 3,97 (1H, дублет, J = 6,0 Гц);
Пример 12. 13-( α -Метоксиимино-4-хлорфенилацетокси)милбемицин A4 (изомер B).
[Соединение N1 - 78: стадия A (55,8%) - стадия B (70,8%)].
Масс-спектр (m/z): 753 (M+), 625, 522, 444, 412.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm: 7,32 - 7,40 (4H, мультиплет); 5,77 - 5,88 (2H, мультиплет); 5,33 - 5,47 (4H, мультиплет); 5,10 (1H, дублет, J = 10,5 Гц); 4,05 (3H, синглет); 3,96 (1H, дублет, J = 6,5 Гц).
Пример 13. 13-( α -Этоксиимино-4-хлорфенилацетокси)милбемицин A4 (изомер A).
[Соединение N1 - 79: стадия A (45%) - стадия B (44%)].
Масс-спектр (m/z): 767 (M+), 639, 554, 522, 412.
Спектр ядерного магнитного резонанаса (CDCl3, 270 МГц), δ , ppm : 7,43 - 7,48 (2H, мультиплет); 7,30 - 7,37 (2H, мультиплет); 5,79 - 5,90 (2H, мультиплет); 5,34 - 5,54 (4H, мультиплет); 5,20 (1H, дублет, J = 10,5 Гц); 4,24 (2H, квартет, J = 5,2 Гц); 3,96 (1H, дублет, J = 6,4 Гц); 1,28 (3H, триплет, J = 7,3 Гц).
Пример 14. 13-( α -Этоксиимино-4-хлорфенилацетокси)милбемицин A4 (изомер B).
[Соединение N1 - 80: стадия A (33%) - стадия B (65%)].
Масс-спектр (m/z): 767 (M+), 639, 540, 444, 412.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm : 7,32 - 7,44 (4H, мультиплет); 5,75 - 5,88 (2H, мультиплет); 5,30 - 5,46 (4H, мультиплет); 5,09 (1H, дублет, J = 10,9 Гц); 4,31 (2H, квартет, J = 7,1 Гц); 3,96 (1H, дублет, J = 6,5 Гц); 1,30 (3H, триплет, J = 7,1 Гц).
Пример 15. 13-( α - Метоксиимино-4-нитрофенилацетокси)милбемицин A4.
[Соединение N1 - 81: стадия A(*) - стадия B (40%)].
Масс-спектр (m/z): 746 (M+), 540, 504.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,27 (2H, дублет, J = 8,6Гц); 7,56 (2H, дублет, J = 8,6 Гц); 5,72 - 5,90 (2H, мультиплет); 5,26 - 5,51 (4H, мультиплет); 5,11 (1H, дублет, J = 10,7 Гц); 4,08 (3H, синглет).
Пример 16. 13-( α -Метоксиимино-2-гидроксифенилацетокси)милбемицин A4.
[Соединение N1 - 89: стадия A (*) - стадия B (24%) ].
Масс-спектр (m/z): 735 (M+), 703, 634, 556, 540.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm : 9,96 (1H, синглет); 7,38 - 7,48 (1H, мультиплет); 6,91 - 7,18 (3H, мультиплет); 5,90 - 6,03 (2H, мультиплет); 5,63 - 5,71 (1H, мультиплет); 5,40 - 5,58 (3H, мультиплет); 5,34 (1H, дублет, J = 10,0 Гц); 4,12 (3H, синглет).
Пример 17. 13-( α - Метоксиимино-2-метоксифенилацетокси)милбемицин A4 (изомер A).
[Соединение N1 - 90: стадия A (*) - стадия B (20%)].
Масс-спектр (m/z): 749 (M+), 634, 600, 558, 506, 472, 412.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm: 7,82 (1H, дублет дублетов, J = 1,7, 7,6 Гц); 7,46 (1H, дублет триплетов, J = 1,7, 7,6 Гц); 7,06 (1H, триплет, J = 7,6 Гц); 6,95 (1H, дублет, J = 7,6 Гц); 5,85 - 5,99 (2H, мультиплет); 5,41 - 5,64 (4H, мультиплет); 5,25 (1H, дублет, J = 10,4 Гц); 4,08 (3H, синглет); 3,76 (3H, синглет).
Пример 18. 13-( α - Метоксиимино-2-метоксифенилацетокси)милбемицин A4 (изомер B).
[Соединение N1 - 91: стадия A (*) - стадия B (15%)].
Масс-спектр (m/z): 749 (M+), 621, 522, 412, 394, 355.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm : 7,27-7,42 (1H,мультиплет); 7,08 (1H, дублет, J=8,1 Гц); 6,87-7,01 (1H, мультиплет); 6,78 (1H, дублет, J=8,1 Гц); 5,74-5,89 (2H, мультиплет); 5,23-5,45 (4H, мультиплет); 5,09 (1H, дублет, J=10,4 Гц); 4,03 (3H, синглет), 3,72 (3H, синглет).
Пример 19. 13-( α )-Метоксиимино-2-этоксифенилацетокси)милбемицин А4 (изомер А).
[Соединение N 1 - 92: стадия А (*) - стадия B (15%)].
Масс-спектр (m/z): 763(V+), 586, 540.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ ,ppm : 7,64 (1H, дублет дублетов, J = 1,7, 7,5 Гц); 7,34 (1H, дублет, триплетов, J=1,7, 7,5 Гц); 6,96 (1H, триплет, J=7,5 Гц); 6,85 (1H, дублет, J=7,5 Гц); 5,71-5,90 (2H, мультиплет); 5,31-5,53 (4H, мультиплет); 5,10 (1H, дублет, J=10,4 Гц); 3,99 (3H, синглет); 3,90-4,05 (3H, мультиплет).
Пример 20. 13-( α -Метоксиимино-2-этоксифенилацетокси) милбемицин А4 )изомер B).
[Соединение N1-93: стадия А(*) - стадия B (12%)].
Масс-спектр (m/z):763 (M+), 634, 540, 506, 442, 412.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm:7,25-7,39 (1H, мультиплет); 6,72-7,14 (3H, мультиплет); 5,70 - 5,90(2H, мультиплет); 5,28-5,50 (4H, мультиплет); 5,08 (1H, дублет, J=10,7 Гц); 4,03 (3H, синглет); 3,89-4,11 (3H мультиплет).
Пример 21. 13-( α )-Метоксиимино-2-бензилоксифенилацетокси) милбемицин А4.
[Соединение N 1 - 98 : стадия A (*) - стадия B (15%)].
Масс-спектр (m/z):825 (M+), 697, 630, 540, 522, 412.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm:7,67-7,7,1 (1H, мультиплет); 7,23-7,35 (6H, мультиплет); 6,75-6,94 (2H, мультиплет); 5,72-5,88 (2H, мультиплет); 5,29-5,42 (4H, мультиплет); 5,22 (1H, дублет, J=10,3 Гц); 5,01-5,09 (2H, мультиплет); 4,00 (3H, синглет).
Пример 22. 13-[ α -Метоксиимино-(2-пиридил)ацетокси] милбемицин А4.
[Соединение N 1-111: стадия A (15%) - стадия B (78%)].
Масс-спектр(m/z):720 (M+), 702, 540, 522, 412.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm:8,66-8,68 (1H, дублет, J=4,8 Гц); 7,73-7,79 (1H, мультиплет); 7,59-7,62 (1H, дублет, J= 8,1 Гц); 7,28-7,33 (1H,мультиплет); 5,74-5,85 (2H, мультиплет); 5,20-5,44 (4H, мультиплет); 5,11 (1H, дублет, J=10,5 Гц); 4,06 (1H, синглет); 3,96 (1H, дублет, J=6,0 Гц).
Пример 23. 13-(3-Метоксиимино-3-фенилпропионилокси)милбемицин А4.
Соединение N 1 - 186: стадия A (61%) - стадия B (74%)].
Масс-спектр (m/z):733 (M+), 702, 605, 586, 572, 554, 540.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm:7,68-7,77 (2H, мультиплет); 7,41-7,50 (3H, мультиплет); 5,84-5,91 (2H, мультиплет); 5,39-5,51 (4H, мультиплет); 5,03 (1H, дублет, J=10,5 Гц); 4,07 (3H, синглет); 3,83 (2H, широкий синглет).
Пример 24. 13-( α )-Гидроксииминофенилацетокси)милбемицин A4.
[Соединение N 1-70: стадия A (61%) - стадия B (41%)].
Масс-спектр (m/z):705 (М+), 577, 540, 522, 504, 412, 394, 279.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 9,45 (1H, широкий синглет); 5,71-5,90 (2H, мультиплет); 5,21-5,51 (4H, мультиплет); 5,12 (1H, дублет, J=10,5 Гц); 4,68 (2H, широкий синглет); 4,30 (1H, триплет, J=7,4 Гц); 4,10 (1H, синглет); 3,97 (1H, дублет, J=6,2 Гц).
Пример 25. 13-( α )-Метоксиимино-2-тиенилацетокси)милбемицин A4.
Соединение N 1-102: стадия A(*) - стадия B (93%)].
Масс-спектр (m/z):725 (M+), 597, 554, 522.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,32-7,38 (1H, мультиплет); 6,95-7,04 (4H, мультиплет); 5,74-5,92 (2H, мультиплет); 5,27-5,58 (4H, мультиплет); 5,18 (1H, дублет, J=10,5 Гц); 4,69 (2H, широкий синглет); 4,30 (1H, мультиплет); 4,09 (1H, синглет); 3,96 (4H, широкий синглет).
Пример 26. 13-[ α -Метоксиимино-(2-хлорацетиламинотиазол-4-ил)ацетокси]- милбемицин A4.
Соединение N 1-108: стадия A (*) - стадия B (60%)].
Масс-спектр при бомбардировке ускоренными атомами (mM/z): 967 (M+ + 150, C40H52ClN3O11S + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm,(1H, широкий синглет); 7,07 (1H, синглет); 5,76-5,93 (2H, мультиплет); 5,28-5,69 (4H, мультиплет); 5,18 (1H, дублет, J=10,4 Гц); 4,69 (2H, широкий синглет); 4,29 (3H, широкий синглет); 4,09 (1H, синглет); 4,03 (2H, синглет); 3,97 (1H, дублет, J=6,2 Гц).
Пример 27. 13-( α )-Метоксиимино-3-фуранилацетокси)милбемицин A4.
[Соединение N 1-100: стадия A(*) - стадия B (64%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,50 (1H, дублет, J=1,8 Гц); 6,45-6,53 (2H, мультиплет); 5,78-5,92 (2H, мультиплет); 5,29-5,54 (4H, мультиплет); 5,16 (1H, дублет, J=10,6 Гц); 4,69 (2H, широкий синглет); 4,30 (1H, мультиплет); 4,08 (1H, синглет), 3,99 (4H, широкий синглет)ю
Пример 28. 13-[ α -Метоксиимино)-(2-аминотиазол-4-ил)ацетокси) милбемицин A4.
[Соединение N 1-107].
При комнатной температуре добавляют 340 мг порошка кадмия к раствору 92 мг (0,1 ммоль) 13-[2-метоксиимино-{ 2-(2,2,2- трихлорэтоксикарбониламино)тиазол-4-ил} ацетокси]милбемицина A4, полученного по методике примера 37, приведенного ниже, в диметилформамиде и уксусной кислоте (1:1 по объему), и полученную в результате смесь перемешивают в течение 2 ч. Реакционную смесь затем выливают в смесь 5 мл этилацетата и 5 мл воды и перемешивают в течение нескольких минут. Нерастворимые отфильтровывают, и фильтрат разделяют на этилацетатный слой и водный слой. Водный слой несколько раз экстрагируют несколькими мл этилацетата. Собирают и соединяют все этилацетатные экстракты, промывают их сначала 4%-ным водным раствором бикарбоната натрия и затем - насыщенным водным раствором хлорида натрия, и сушат над безводным сульфатом натрия. Растворитель испаряют под вакуумом, и остаток очищают колоночной хроматографией на силикагеле, элюируют этилацетатом в гексане со ступенчатым градиентом (25-50%), и получают 33,2 мг названного в заголовке соединения (выход 45%).
Масс-спектр при бомбардировке ускоренными атомами (M/z): 891 (M+ + 150, C38H51N3O10S + триэтаноламин +H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 6,56 (1H, синглет); 5,73-5,90 (2H, мультиплет); 5,29-5,55 (4H, мультиплет); 5,20 (2H, синглет); 5,15 (1H, дублет, J=10,6 Гц); 4,69 (2H,широкий синглет); 4,29 (1H, мультиплет); 4,09 (1H, синглет); 3,99 (4H, широкий синглет).
Пример 29. 13-[α - Метоксиимино-(4- метоксикарбониламиноацетиламинофенил)-ацетокси]милбемицин A4.
[Соединение N 2- 45].
(Стадия А): 13-( α -метоксиимино-4-нитрофенилацетокси)-5- кетомилбемицин А4.
В потоке аргона и при охлаждении льдом добавляют одну каплю трифторметансульфоновой кислоты к раствору 843 мг (1,52 ммоль) 15-гидрокси-5-кетомилбемицина A4, 694 мг (3,03 ммоль) α - метоксиимино-4-нитрофенилуксусной кислоты и 289 мг иодида меди (I) в 5 мл дихлорметана. Полученную в результате смесь перемешивают при комнатной температуре в течение 1 ч, затем реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают сначала 5%-ным водным раствором бикарбоната натрия и затем - насыщенным водным раствором хлорида натрия, и сушат над безводным сульфатом магния. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируют эталацетатом в гексане со ступенчатым градиентом (20-40%) и получают 663 мг (выход 57%) названного в заготовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 8,27 (2H, дублет, J= 9,0 Гц); 7,56 (2H, дублет, J=9,0 Гц); 6,54 (1H, мультиплет); 5,74-5,94 (2H, мультиплет); 5,32-5,54 (3H, мультиплет); 5,12 (1H, дублет, J= 10,5 Гц); 4,74 (2H, широкий синглет); 4,08 (3H, синглет); 4,01 (1H, синглет); 3,88 (1H, синглет).
(Стадия В). 13-( α - Метоксиимино-4-нитрофенилацетокси)-милбемицин A4.
При охлаждении льдом добавляют 87 мг (0,44 ммоль) борогидрида натрия к раствору 337 мг (0,44 ммоль) 13-( α - метоксиимино-4-нитрофенилацетокси)-5-кетомилбемицина A4 в 40 мл метанола, и получившуюся в результате смесь перемешивают при 0oC в течение 30 мин. Реакционную смесь затем выливают в воду и экстрагируют этилацетатом. Экстракт промывают по очереди водой и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (30 - 50%), и получают 332 мг (выход 98%) названного в заголовке соединения.
Масс-спектр (m/z): 764 (M+), 540, 504.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,27 (2H, дублет, J=8,6 Гц); 7,56 (дублет, J = 8,6 Гц); 5,72-5,90 (2H, мультиплет); 5,26-5,51 (4H, мультиплет); 5,11 (1H, дублет, J = 10,7 Гц); 4,08 (3H, синглет).
(Стадия С): 13-( α - Метоксиимино-4-аминофенилацетокси)милбемицин A4.
При комнатной температуре добавляют 1,19 г порошка цинка к раствору 1,98 г (2,59 ммоль) 13-( α -метоксиимино-4-нитрофенилацетокси)милбемицина A4 в 20 мл уксусной кислоты, и полученную в результате смесь перемешивают в течение 2 ч. Реакционную смесь затем смешивают с этилацетатом и отфильтровывают нерастворимые. Фильтрат разбавляют водой и экстрагируют этилацетатом. Экстракт промывают 4%-ным водным раствором бикарбоната натрия и сушат над безводным сульфатом натрия. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируют этилацетатом в гексане со ступенчатым градиентом (40-100%), и получают 789 мг (выход 41%) названного в заготовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,30 (2H, дублет, J = 7,1 Гц); 6,61 (2H, дублет, J = 7,1 Гц); 5,78-5,88 (2H , мультиплет); 5,28-5,54 (4H, мультиплет); 5,17 (1H, дублет, J = 10,6 Гц); 4,66 и 4,70 (2H, АВ-квартет, J 15,5 Гц); 4,30 (1H, триплет, J = 7,0 Гц); 3,93 (3H, синглет).
(Стадия D). Стадия ацилирования 13-[ α -Метоксиимино-(4-метоксикарбониламиноацетиламинофенил)-ацетокси] милбемицин A4.
К раствору 0,815 г (6,12 ммоль) N-метоксикарбонилглицина в 10 мл дихлорметана добавляют по очереди 1,50 г (2,04 ммоль) 13-( α -метоксиимино-4-аминофенилацетокси)милбемицина A4, 0,597 мл (4,28 ммоль) триэтиламина и 1,095 г (4,28 ммоль) 2-хлор-2-метилпиридинийодида, и получившуюся в результате смесь перемешивают при комнатной температуре в течение 1,5 ч. По окончании этого времени реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и концентрируют. Концентрат очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (30-100%), и получают 268 мг (выход 92%) названного в заголовке соединения.
Масс-спектр при бомбардировке ускоренными атомами: 999 (M++ 150, C45H59N3O13 + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,13-8,25 (1H, широкий синглет); 7,55 (2H, дублет, J = 8,7 Гц); 7,47 (2H, дублет, J = 8,7 Гц); 5,75-5,92 (2H, мультиплет); 5,27-5,69 (4H, мультиплет); 5,19 (1H, дублет, J = 10,4 Гц); 4,69 (2H, широкий синглет); 4,50 (1H, мультиплет); 4,11 (1H, синглет); 3,97 (3H, широкий синглет); 3,76 (3H, синглет)
Примеры 30-36. Соединения примеров 30-36 синтезируют по методикам, подобным методике, описанной выше в примере 29. Выход (%), полученный на стадии ацилирования /стадия D/ указывается после номера каждого соединения.
Пример 30. 13-( α -Метоксиимино-4-ацетиламинофенилацетокси)милбемицин A4.
[Соединение N 1-83: стадия D (70%)].
Масс-спектр (m/z): 776 (m+), 758, 522.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,42-7,59 (4H, мультиплет); 7,29 (1H, синглет); 5,75-5,93( 2H, мультиплет,); 5,28-5,59 (4H, мультиплет); 5,20 (1H, дублет, J = 10,5 Гц); 4,70 (широкий синглет); 4,31 (1H, мультиплет); 4,11 (1H, синглет).
Пример 31. 13-[ α -Метоксиимино-(2-ацетиламинотиазол-4-ил)ацетокси]-милбемицин A4.
[Соединение N 1-204: стадия D (55%)].
Масс-спектр при бомбардировке ускоренными атомами (m/z): 933 (M+ + 150, C40H53N3O11S + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 9,37 (1H, синглет); 7,00 (1H, синглет); 5,74-5,90 (2H, мультиплет); 5,29-5,59 (2H, мультиплет); 5,17 (1H, дублет, J = 10,4 Гц); 4,69 (2H, широкий синглет); 4,34(1Н,1 мультиплет); 4,12 (1H, синглет); 3,99 (4H, широкий синглет).
Пример 32. 13-[2- -Метоксиимино-2-(4-ацетиламиноацетиламинофенил)этокси] милбемицин A4.
[Соединение N 2-7, стадия D (65%)].
Масс-спектр при бомбардировке ускоренными атомами: 912 (M+), 150, C43H58N2O10 + триэтаноламино + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,62 (2H, дублет, J = 8,8 Гц); 7,50 (2H, дублет, J=8,8 Гц); 5,64-5,80 (2H, мультиплет, ); 5,18-5,43 (4H, мультиплет); 4,66 (2H, широкий синглет); 4,42 (2H, широкий синглет); 4,28 (1H, мультиплет); 3,99 (1H, синглет); 3,96 (4H, широкий синглет).
Пример 33. 13-[2-Метоксиимино-2-(4-метансульфониламинофенил)этокси]-милбемицин A4.
[Соединение N 2-16: стадия D (70%)].
Масс-спектр при бомбардировке ускоренными атомами: 948 (M+ + 150, C42H58N2O11S + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 7,65 (2H, дублет, J = 8,7 Гц); 7,21 (2H, дублет, J = 8,7 Гц); 6,83 (1H, синглет); 5,64 - 5,82 (2H, мультиплет); 5,17 - 5,43 (4H, мультиплет); 4,66 (2H, широкий синглет); 4,43 (2H, широкий синглет); 4,30 (1H, широкий синглет); 3,97 (3H, синглет); 3,92 (1H, дублет, J = 3,8 Гц).
Пример 34. 13-[ α -Метоксиимино-(4-метансульфониламинофенил)ацетокси] милбемицин A4.
[Соединение N 2-22: стадия D (75%)].
Масс-спектр (m/z): 812 (M+), 522.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ/ ppm: 7,51 (2H, дублет, J = 8,6 Гц); 7,12 (2H, дублет, J = 8,6 Гц); 6,67 (1H, синглет); 5,77 - 5,94 (2H, мультиплет); 5,28 - 5,59 (4H, мультиплет); 5,20 (1H, дублет, J = 10,7 Гц); 4,69 (2H, широкий синглет); 4,30 (1H, дублет, J = 6,2 Гц); 3,98 (4H, широкий синглет).
Пример 35. 13-[ α -Метоксиимино-(4-ацетиламиноацетиламинофенил)ацетокси] милбемицин A4.
[Соединение N 2-39: стадия D (45%)].
Масс-спектр при бомбардировке ускоренными атомами: 938 (M+ + 150, C45H59N3O12 + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 8,77 (1H, синглет); 7,56 (2H, дублет, J = 8,8 Гц); 7,47 (2H, дублет, J = 8,8 Гц); 6,43 (1H, триплет, J = 5,1 Гц); 5,76 - 5,92 (2H, мультиплет); 5,28 - 5,59 (4H, мультиплет); 5,19 (1H, дублет, J = 10,7 Гц); 4,69 (2H, широкий синглет); 4,30 (1H, мультиплет); 4,12 (3H, широкий синглет); 3,98 (4H, широкий синглет).
Пример 36. 13-[ α -Метоксиимино-(4-метоксикарбониламиноацетиламинофенил)ацетокси]милбемицин A3.
[Соединение N 2-43, стадия D (85%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 8,14 (1H, широкий синглет); 7,55 (2H, дублет, J = 8,8 Гц); 7,47 (2H, дублет, J = 8,8 Гц); 5,72 - 5,91 (2Н, мультиплет); 5,27 (4H, мультиплет); 5,20 (1H, дублет, J = 10,4 Гц); 4,69 (2H, широкий синглет); 4,30 (1H, мультиплет); 3,85 - 4,12 (4H, мультиплет); 3,97 (3H, синглет).
Пример 37. 13-[ α -Метоксиимино-(2-(2,2,2-трихлорэтоксикарбониламино)тиазол- 4-ил)ацетокси]милбемицин A4.
[Соединение N 2-101: стадия A (*) - стадия B (65%)].
Масс-спектр при бомбардировке ускоренными атомами (m/z): 1065 (M+ + 150, C41H52Cl3N3O12S + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 7,07 (1H, синглет); 5,77 - 5,92 (2H, мультиплет); 5,28 - 5,49 (4H, мультиплет); 5,17 (1H, дублет, J = 10,5 Гц); 4,88 (2H, синглет); 4,69 (2H, широкий синглет); 4,31 (1H, мультиплет); 4,00 (4H, широкий синглет).
Пример 38. 13-[ α -Метоксиимино-(2-метоксикарбониламинотиазол-4-ил)ацетокси]милбемицин A4.
[Соединение N 2-99: стадия D (50%)].
Масс-спектр при бомбардировке ускоренными атомами (m/z): 949 (M+ + 150 C40H53N3O12S + этаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 8,39 (1H, широкий синглет); 6,96 (1H, синглет); 5,76 - 5,91 (2H, мультиплет); 5,27 - 5,58 (4H, мультиплет); 5,17 (1H, дублет, J = 10,4 Гц); 4,69 (2H, широкий синглет); 4,30 (1H, мультиплет); 4,09 (1H, синглет), 4,00 (4H, широкий синглет).
Пример 39. 13-[ α - Метоксиимино-(2-этоксикарбониламинотиазол-4-ил)ацетокси]милбемицин A4.
[Соединение N 2-100: стадия D (55%)].
Масс-спектр при бомбардировке ускоренными атомами (m/z): 963 (M+ + 150, C41H55N3O12S + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,24 (1H, широкий синглет); 6,98 (1H, синглет); 5,76 - 5,91 (2H, мультиплет); 5,28 - 5,57 (4H, мультиплет); 5,17 (1H, дублет, J = 10,4 Гц); 4,69 (2H, широкий синглет); 4,32 (3H, квартет, J = 7,0 Гц); 4,09 (1H, синглет); 4,00 (3H, синглет); 3,97 (1H, дублет, J = 3,7 Гц).
Пример 40. 13-[ α -Метоксиимино-(2-изопропоксикарбониламинотиазол-4-ил)ацетокси]милбемицин A4.
[Соединение N 2-105: стадия D (60%)].
Масс-спектр при бомбардировке ускоренными атомами (m/z): 977 (M+ + 150 C42H57N3O12S + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 8,31 (1H, широкий); 6,98 (1H, синглет); 5,76 - 5,92 (2H, мультиплет); 5,28 - 5,58 (4H, мультиплет); 5,17 (1H, дублет, J = 10,4 Гц); 5,08 (мультиплет, J = 6,3 Гц); 4,69 (2H, широкий синглет); 4,31 (1H, триплет, J = 6,2 Гц); 4,10 (1H, синглет); 4,00 (3H, синглет); 3,98 (1H, дублет, J = 6 Гц).
Пример 41. 13-[ α -Метоксиимино-[2-(1-метоксикарбонилпирролидин- 2-ил-карбониламино)триазол-4-ил]ацетокси]милбемицин A4.
[Соединение N 2-106: стадия D (50%)].
Масс-спектр при бомбардировке ускоренными атомами (m/z): 1046 (M+ + 150, C45H60N4O3S + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 10,22 (1H, широкий синглет); 7,05 (1H, синглет); 5,74 - 5,91 (2H, мультиплет); 5,28 - 5,57 (4H, мультиплет); 5,17 (1H, дублет, J = 10,4 Гц); 4,69 (2H, широкий синглет); 4,53 (1H, широкий); 4,30 (1H, триплет, J=6,1 Гц); 4,09 (1H, синглет); 4,02 (3H,синглет); 3,97 (1H, дублет, J=6 Гц).
Пример 42. 13-[ α -метоксиимино-(2-метоксикарбониламиноацетиламинотиазол 4-ил)ацетокси]милбемицин A4.
[Соединение N 2-103: стадия D (45%)].
Масс-спектр при бомбардировке ускоренными атомами (m/z): 1006 (M++150, C42H56N4O13S+триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 9,8 (1H, широкий синглет); 7,03 (1H, синглет); 5,76-5,91 (2H, мультиплет); 5,27-5,66 (4H, мультиплет); 5,27-5,66 (4H, мультиплет); 5,17 (1H, дублет, J=10,6 гц); 4,69 (2H, широкий синглет); 4,30 (1H, мультиплет); 4,12 (1H, синглет); 4,09 (2H, синглет); 4,00 (4H, широкий синглет); 3,77 (3H, синглет).
Пример 43. 13-[2-(4-Метоксикарбониламиноацетиламинофенил)-2-метилпропионилокси] милбемицин A4.
(Стадия A). 13-[2-(4-нитрофенил)-2-метилпропионилокси]-5-кетомилбемицин A4.
При охлаждении льдом и в потоке аргона добавляют 15 мкл трифторметансульфоновой кислоты к раствору 188 мг (0,34 ммоль) 15-гидрокси-5-кетомилбемицина A4 и 212 мг (1,01 ммоль) 2-(4-нитрофенил)-2-метилпропионовой кислоты в 8 мл дихлорметана. Полученную в результате смесь перемешивают при комнатной температуре в течение 30 мин. По окончании этого времени реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают сначала 5% водным раствором бикарбоната натрия, затем насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (10-35%), и получают 502 мг (выход 58%) названного в заголовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm: 7,16 (2H, дублет, J=9,8 Гц); 6,54 (1H, триплет, J=1,8 Гц); 5,69-5,91 (2H, мультиплет); 5,29-5,47 /3H,мультиплет/; 4,91 (1H, дублет, J=10,5 Гц); 4,70 (2H, широкий синглет); 3,84 (1H, синглет); 1,63 (6H, синглет).
(Стадия B). 13-[2-(4-нитрофенил)-2-метилпропионилокси]-милбемицин A4.
При охлаждении льдом добавляют 38 мг борогидрида натрия к раствору 502 мг (0,671 ммоль) 13-[2-(4-нитрофенил)-2-метилпропионилокси]-5-кетомилбемицина A4 в 5 мл метанола, и получающуюся в результате смесь перемешивают при 0oC в течение 30 мин. Реакционную смесь затем выливают в воду и экстрагируют этилацетатом. Экстракт промывают сначала водой, затем насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (20- 40%), и получают 300,4 мг (выход 60%) названного в заголовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,17 (2H, дублет, J=9,0 Гц);7,46 (2H, дублет, J=9,0 Гц); 5,66-5,81 (2H, мультиплет ); 5,25-5,48 (3H, мультиплет); 4,90 (1H, дублет, J=10,6 Гц); 4,65 (2H, широкий синглет); 4,28 (1H, триплет, J=6,1 Гц); 4,07 (1H, синглет); 3,94 (1H, дублет, J=6,1 Гц).
(Стадия C). 13-[2-(4-Аминофенил)-2-метилпропионилокси]-милбемицин A4.
Добавляют при комнатной температуре 10 мг цинковой пыли к раствору 23 мг (0,0307 ммоль) 13-[2-(4-нитрофенил)-2-метилпропионилокси)милбемицина A4 в 1 мл уксусной кислоты, и получающуюся в результате смесь перемешивают в течение 2 ч. Реакционную смесь затем разбавляют этилацетатом, и разбавленную смесь фильтруют, чтобы удалить нерастворимые. Фильтрат смешивают с водой и экстрагируют этилацетатом. Экстракт промывают сначала 4% водным раствором бикарбоната натрия, затем насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (30-100%), и получают 14,7 мг (выход 67%) названного в заголовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,08 (2H, дублет, J=8,6 Гц); 6,62 (2H, дублет, J=8,6 Гц); 5,68-5,81 (2H, мультиплет); 5,21-5,44 (4H, мультиплет); 4,85 (1H, дублет, J=10,6 Гц); 4,66 (2H, широкий синглет); 4,79 (1H, широкий синглет); 4,07 (1H, широкий синглет); 3,95 (1H, дублет, J=6,1 Гц).
(Стадия D). 13-[2-(4-Метоксикарбониламиноацетиламинофенил)-2-метилпропионилокси] милбемицин A4.
[Соединение N 3-27].
Добавляют по очереди 3,61 г (5,0 ммоль) 13-[2-(4-аминофенил)-2-метилпропионилокси] милбемицина A4, 1,012 г (10,0 ммоль) триэтиламина и 2,56 г (10,0 ммоль) 2-хлор-1-метилпиридинийиодида к раствору 2,0 г (15,0 ммоль) N-метоксикарбонилглицина в 20 мл дихлорметана. Получающуюся в результате смесь перемешивают при комнатной температуре в течение 1,5 ч. По окончании этого времени реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния, растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (30-100%), и получают 3,53 г (выход 84,4%) названного в заголовке соединения.
Масс-спектр при бомбардировке ускоренными атомами: 984 (M+ + 150, C26H62O12N2 + триэтаноламин + H).
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm: 8,25 (1H, широкий синглет); 7,46 (2H, дублет, J=8,9 Гц); 7,25 (2H, дублет, J=8,9 Гц); 5,70-5,84 (2H, мультиплет); 5,61 (1H,широкий синглет); 5,21-5,41 (4H, мультиплет); 4,86 (1H, дублет, J=10,8Гц); 4,63 и 4,68 (2H, АВ-квартет, J= 15,0 Гц); 4,29 (1H, триплет, J=6,0 Гц); 4,12 (1H, синглет); 4,01 (1H, дублет, J = 5,6 Гц); 3,94 (1H, дублет, J = 6,0 Гц); 3,74 (3H, синглет).
Примеры 44 - 78. Соединения примеров 44 - 78 синтезируют по методикам, подобным методике, описанной в примере 37. Чтобы подробнее проиллюстрировать способ настоящего изобретения, который используют, указываются выходы (%) на стадии D после номера каждого соединения.
Пример 44. 13-[2-(4-Ацетиламинофенокси)-2-метилпропионилокси]милбемицин A4.
[Соединение N 3 - 1 (69%)].
Масс-спектр (m/z): 777 (M+), 759, 741, 540, 522, 412.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm: 7,29 (2H, дублет, J = 9,8 Гц); 7,04 (1H, широкий синглет); 6,75 (2H, дублет, J = 9,8 Гц); 5,75 - 5,87 (2H, мультиплет); 5,28 - 5,46 (4H, мультиплет); 5,01 (1H, дублет, J = 10,5 Гц); 4,64 и 4,70 (2H, AB-квартет, J = 15,0 Гц); 4,29 (1H, дублет, J = 6,0 Гц); 4,07 (1H, широкий синглет); 3,96 (1H, дублет, J = 6,0 Гц); 2,15 (3H, синглет).
Пример 45. 13-[2-(4-Ацетиламинофенил)-2-метилпропионилокси]милбемицин A4
[Соединение N 3-3 (87%)]
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,43 (2H, дублет, J = 8,7 Гц); 7,19 (2H, дублет, J = 8,7 Гц): 5,75 - 5,83 (2H, мультиплет); 5,23 - 5,45 (4H, мультиплет); 4,86 (1H, дублет, J = 10,5 Гц); 4,65 (2H, широкий синглет); 4,29 (1H, триплет, J = 6,2 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J = 6,2 Гц).
Пример 46. 13-[(4-Метансульфониламинофенокси)-2-метилпропионилокси]-милбемицин A4.
[Соединение N 3-11 (72%)].
Масс-спектр (m/z): 813 (M+), 685, 540, 412, 394.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm : 7,08 (2H, дублет, J = 9,8 Гц); 6,77 (2H, дублет, J = 9,8 Гц); 6,39 (1H, синглет); 5,72 - 5,88 (2H, мультиплет); 5,29 - 5,46 (4H, мультиплет); 4,99 (1H, дублет, J = 10,8 Гц); 4,64 и 4,69 (2H, AB-квартет, J = 15,4 Гц); 4,29 (1H, дублет, J = 6,5 Гц); 4,08 (1H, широкий синглет); 3,96 (1H, дублет, J = 6,5 Гц), 2,95 (3H, синглет).
Пример 47. 13-[2-(4-Этоксикарбониламинофенокси)-2-метилпропинилокси]-милбемицин A4.
[Соединение N 3-19 (80%)].
Масс-спектр (m/z): 807 (M+) 633, 522, 504.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm : 7,18 (2H, дублет, J = 9,6 Гц); 6,74 (2H, дублет, J = 9,6 Гц); 6,48 (1H, широкий синглет); 5,71 - 5,88 (2H, мультиплет); 5,27 - 5,48 (4H, мультиплет); 5,01 (1H, дублет, J = 10,4 Гц); 4,65 и 4,71 (2H, AB-квартет, J = 15,5 Гц); 4,28 (1H, широкий синглет); 4,18 (2H, квартет, J = 6,9 Гц); 4,08 (1H, широкий синглет); 3,96 (1H, дублет, J = 6,5 Гц).
Пример 48. 13-[2-(4-Метоксикарбониламиноацетиламинофенил)-2- метилпропионилокси]милбемицин A3.
[Соединение N 3-26 (79%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm : 8,02 (1H, широкий синглет); 7,45 (2H, дублет, J = 8,6 Гц); 7,26 (2H, дублет, J = 8,6 ГЦ); 5,67 - 5,82 (2H, мультиплет); 5,21 - 5,55 (5H, мультиплет); 4,86 (1H, дублет, J = 10,6 Гц); 4,65 (2H, широкий синглет); 4,28 (1H, триплет, J = 6,2 Гц); 4,08 (1H, синглет); 4,00 (2H, дублет, J = 6,0 Гц); 3,94 (1H, дублет, J = 6,2 Гц); 3,75 (3H, синглет).
Пример 49. 13-[2-(4-Метоксикарбониламиноацетиламинофенил)-2-этилбутирилокси] милбемицин A4.
[Соединение N 3-28 (45%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm : 7,92 (1H, широкий синглет); 7,44 (2H, дублет, J = 8,5 Гц); 7,18 (2H, дублет, J = 8,5 Гц); 5,71 - 5,75 (2H, мультиплет); 5,21 - 5,46 (4H, мультиплет); 4,90 (1H, дублет, J = 10,5 Гц); 4,64 (2H, широкий синглет); 4,12 - 4,34 (1H, мультиплет); 4,10 (1H, синглет); 3,99 (2H, дублет, J = 5,9 Гц); 3,94 (1H, дублет, J = 6,2 Гц).
Пример 50. 13-[2(4-Метоксикарбониламиноацетиламинофенокси)-2-метилпропионилокси] милбемицин A4.
[Соединение N 3-29 (23%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm : 7,85 (1H, широкий синглет); 7,32 (2H, дублет, J = 9,1 Гц); 6,75 (2H, дублет, J = 9,1 Гц); 5,72 - 5,90 (2H, мультиплет); 5,25 - 5,52 (5H, мультиплет); 5,01 (1H, дублет, J = 10,6 Гц); 4,67 (2H, широкий синглет); 4,29 (1H, триплет, J = 6,0 Гц); 4,08 (1H, синглет); 3,98 (2H, дублет, J = 4,6 Гц); 3,95 (1H, дублет, J = 6,0 Гц); 3,74 (3H, синглет).
Пример 51. 13-[2-(4-трет-Бутоксикарбониламиноацетиламинофенил)-2- метилпропионилокси)милбемицин A4.
[Соединение N 3-33 (76%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm : 8,05 (1H, широкий синглет); 7,44 (2H, дублет, J = 8,7 Гц); 7,26 (2H, дублет, J = 8,7 Гц); 5,67 - 5,84 (2H, мультиплет); 5,14 - 5,95 (4H, мультиплет); 4,87 (1H, дублет, J = 10,5 Гц); 4,66 (2H, широкий синглет); 4,28 (1H, триплет, J = 6,0 Гц); 4,08 (1H, синглет); 3,95 (2H, дублет, J = 6,2 Гц); 3,92 (1H, дублет, J = 6,0 Гц).
Пример 52. 13-[2-(4-Бензилоксикарбониламиноацетиламинофенил)-2- метилпропионилокси]милбемицин A4.
[Соединение N 3 - 34: (69%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 7,84 (1H, широкий синглет); 7,42 (2H, дублет, J = 8,8 Гц); 7,37 (5H, синглет); 7,25 (1H, дублет, J = 8,8 Гц); 5,68 - 5,72 (2H, мультиплет); 5,24 - 5,49 (6H, мультиплет); 5,18 (2H, синглет); 4,87 (1H, дублет, J = 10,4 Гц); 4,65 (2H, широкий синглет); 4,29 (1H, триплет, J = 6,2 Гц); 4,07 (1H, синглет); 4,00 (2H, дублет, J = 5,9 Гц); 3,95 (1H, дублет, J = 6,2 Гц).
Пример 53. 13-[2-(4-Бензоиламиноацетиламинофенил)-2- метилпропионилокси] милбемицин A4.
[Соединение N 3-36 (45%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 9,17 (1H, синглет); 7,89 (2H, дублет, J = 7,6 Гц); 7,41 - 7,61 (2H, мультиплет); 7,25 (2H, дублет, J = 7,6 Гц); 5,66 - 5,84 (2H, мультиплет); 5,21 - 5,44 (4H, мультиплет); 4,86 (1H, дублет, J = 10,4 Гц); 4,64 (2H, широкий синглет); 4,40 (2H, дублет, J = 4,8 Гц); 4,28 (1H, широкий синглет); 4,16 (1H, синглет); 3,94 (1H, дублет, J = 6,2 Гц).
Пример 54. 13-[2-(4-(N-Метил)метоксикарбониламиноацетиламинофенил)-2- метилпропионилокси]милбемицин A4.
[Соединение N 3-37 (75%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 8,60 (1H, широкий синглет); 7,45 (2H, дублет, J = 8,7 Гц); 7,26 (2H, дублет, J = 8,4 Гц); 5,68 - 5,85 (2H, мультиплет); 5,21 - 5,45 (4H, мультиплет); 4,87 (1H, дублет, J = 10,3 Гц); 4,66 (2H, широкий синглет); 4,29 (1H, триплет, J = 6,2 Гц); 4,07 (1H, синглет); 4,03 (2H, синглет); 3,95 (1H, дублет, J = 6,2 Гц); 3,78 (3H, синглет).
Пример 55. 13-[2-(4-(N-Метил)этоксикарбониламиноацетиламинофенил] -2- метилпропионилокси/милбемицин A4.
[Соединение N 3-38 (89%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,15 (1H, широкий синглет); 7,44 (2H, дублет, J = 8,7 Гц); 7,25 (2H, дублет, J = 8,7 Гц); 5,68 - 5,88 (2H, мультиплет); 5,23 - 5,45 (4H, мультиплет); 4,87 (1H, дублет, J = 10,5 Гц); 4,66 (2H, широкий синглет); 4,29 (1H, триплет, J = 6,2 Гц); 4,22 (2H, квартет, J = 14,2 Гц); 4,07 (1H, синглет); 4,02 (2H, синглет); 3,95 (1H, дублет, J = 6,2 Гц).
Пример 56. 13-[2-(4-Изопропоксикарбониламиноацетиламинофенил)-2- метилпропионилокси]милбемицин A4.
[Соединение N 3-39: (65%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,00 (1H, широкий синглет); 7,44 (2H, дублет, J = 8,7 Гц); 7,26 (2H, дублет, J = 8,7 Гц); 5,68 - 5,85 (2H, мультиплет); 5,22 - 5,45 (5H, мультиплет); 4,98 (1H, гептуплет, J = 6,2 Гц); 4,87 (1H, дублет, J = 10,6 Гц); 4,66 (2H, широкий синглет); 4,28 (1H, триплет, J = 5,9 Гц); 4,08 (1H, синглет); 3,98 (2H, дублет, J = 5,5 Гц); 3,95 (1H, дублет, J = 5,9 Гц).
Пример 57. 13-[2- α -(4-Метоксикарбониламино)- α фенилацетиламинофенил] -2-метилпропионилокси]милбемицин A4.
[Соединение N 3-40 (76%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,29 - 7,48 (7H, мультиплет); 7,22 (2H, дублет, J = 8,6 Гц); 6,02 (1H, дублет, J = 5,9 Гц); 5,67 - 5,82 (2H, мультиплет); 5,19 - 5,45 (4H, мультиплет); 4,86 (1H, дублет, J = 10,6 Гц); 4,65 (2H, широкий синглет); 4,28 (1H, триплет, J = 6,2 Гц); 4,08 (1H, синглет); 3,95 (1H, дублет, J = 6,2 Гц); 3,69 (3H, синглет).
Пример 58. 13-[2-(4-Этоксикарбониламиноацетиламиноацетиламинофенил)-2- метилпропионилокси]милбемицин A4.
[Соединение N 3-41 (53%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,38 (1H, синглет); 7,51 (2H, дублет, J = 8,4 Гц); 7,24 (2H, дублет, J = 8,4 Гц); 6,98 (1H, широкий синглет); 5,68 - 5,85 (2H, мультиплет); 5,23 - 5,49 (5H, мультиплет); 4,86 (1H, дублет, J = 10,5 Гц); 4,65 (2H, широкий синглет); 4,06 - 4,36 (6H, мультиплет); 3,87 - 3,99 (3H, мультиплет);
Пример 59. 13-[2-[4-(Метоксикарбониламино)бензоиламиноацетиламинофенил]- 2-метилпропионилокси]милбемицин A4.
[Соединение N 3-42 (69%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,71 (1H, синглет); 7,82 (2H, дублет, J = 8,6 Гц); 7,48 (дублет, 4H, J = 8,3 Гц); 7,25 (2H, дублет, J = 8,6 Гц); 6,94 (1H, синглет); 5,69-5,85 (2H, мультиплет); 5,23 - 5,44 (4H, мультиплет); 4,87 (1H, дублет, J = 10,6 Гц); 4,65 (2H, широкий синглет); 4,23 - 4,48 (3H, мультиплет); 4,09 (1H, синглет); 3,94 (1H, дублет, J = 6,1 Гц); 3,81 (3H, синглет).
Пример 60. 13-[2-(4-Метоксикарбониламиноацетиламиноацетиламинофенил)-2- метилпропионилокси]милбемицин A4.
[Соединение N 3-43 (48%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,51 (1H, синглет); 7,51 (2H, дублет, J = 8,2 Гц); 7,24 (2H, дублет, J = 8,2 Гц); 5,70 - 5,84 (2H, мультиплет); 5,63 (1H, широкий); 5,23 - 5,42 (5H, мультиплет); 4,65 (2H, широкий синглет); 3,83 - 4,35 (7H, мультиплет).
Пример 61. 13-[2-[4-{ 3-(Метоксикарбониламино)пропиониламино}фенил]-2- метилпропионилокси]милбемицин A4.
[Соединение N 3-43 (66%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,44 (2H, дублет, J=8,6 Гц); 7,25 (2H, дублет, J=8,6 Гц); 5,68-5,83 (2H, мультиплет); 5,24-5,46 (5H, мультиплет); 4,87 (1H, дублет, J=10,3 Гц); 4,65 (2H, широкий синглет); 4,28 (1H, триплет, J=6,1 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J=6,1 Гц); 3,67 (3H, синглет).
Пример 62. 13-[2-[4-{2-(Метоксикарбониамино)пропиониламино}- 2-метилпропионилокси]милбемицин A4.
[Соединение N 3-47 (78%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,12 (1H, широкий синглет); 7,46 (2H, дублет, J=8,6 Гц); 7,25 (2H, дублет, J=8,6 Гц); 5,68-5,83 (2H, мультиплет); 5,17-5,45 (5H, мультиплет); 4,87 (1H, дублет, J=10,6 Гц); 4,66 (2H, широкий синглет); 4,22-4,42 (5H, мультиплет); 4,08 (1H, синглет); 3,95 (1H, дублет, J=6,1 Гц); 3,73 (3H, синглет).
Пример 63. 13-[2-{ 4-(Ацетиламиноацетиламино)фенил} -2- метилпропионилокси]милбемицин A4.
Соединение N 3-48 (45%)].
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц), δ , ppm: 8,72 (1H, широкий синглет); 7,47 (2H, дублет J=8,5 Гц); 7,25 (2H, дублет, J=8,5 Гц); 6,61 (1H, широкий синглет); 5,66-5,80 (2H, мультиплет); 5,26-5,41 (4H, мультиплет); 4,86 (1H, дублет, J=10,5 Гц); 4,61 и 4,67 (2H, AB-квартет, J= 15,5 Гц); 4,28 (1H, триплет, J=6,4 Гц); 4,12 (3H, синглет); 3,95 (1H, дублет, J=6,4 Гц).
Пример 64. 13-[2-[4-{ 3-(Этоксикарбониламино)пропиониламино} фенил]-2- метилпропионилокси]милбемицин A4.
[Соединение N 3-49 (66%].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,50 (1H, широкий синглет); 7,45 (2H, дублет, J=8,6 Гц); 7,25 (2H, дублет, J=8,6 Гц); 5,68-5,82 (2H, мультиплет); 5,22-5,44 (5H, мультиплет); 4,87 (1H, дублет, J= 10,6 Гц); 4,65 (2H, широкий синглет); 4,29 (1H, триплет, J=6,2 Гц); 4,11 (2H, квартет, J=7,1 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц).
Пример 65. 13-[2-[4-{2-(Метоксикарбониламино)-2- метилпропиониламино}-фенил]-2-метилпропионилокси]милбемицин A4.
[Соединение N 3-56 (51%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,63 (1H, широкий синглет); 7,46 (2H, дублет, J=8,7 Гц); 7,24 (2H, дублет, J=8,7 Гц); 5,68-5,82 (2H, мультиплет); 5,24-5,43 (4H, мультиплет); 5,10 (1H, синглет); 4,88 (1H, дублет, J=10,4 Гц); 4,66 (2H, широкий синглет); 4,29 (1H, триплет, J= 6,2 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц); 3,71 (3H, синглет).
Пример 66. 13-[2-[4-{ 2-(Метоксикарбониламино)-4-(метилтио)- бутириламино}фенил]-2-метилпропионилокси]милбемицин A4.
[Соединение N 3-58 (72%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm, 8,13 (1H, широкий синглет); 7,46 (2H, дублет, J=8,7 Гц); 7,26 (2H, дублет, J=8,7 Гц); 5,69-5,83 (2H, мультиплет); 5,26-5,49 (5H, мультиплет); 4,87 (1H, дублет, J= 10,5 Гц); 4,66 (2H, широкий синглет); 4,47 (4H, квартет, J=8,1 Гц); 4,29 (1H, триплет, J=6,2 Гц); 4,07 (1H, синглет ); 3,95 (1H, дублет, J=6,2 Гц); 3,73 (3H, синглет).
Пример 67. 13-[2-[4-{2-(Метоксикарбониламино)-3-метилбутириламино}-фенил]- 2-метилпропионилокси]милбемицин A4.
[Соединение N 3-61 (78%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,83 (1H, широкий синглет); 7,47 (2H, дублет, J=8,7 Гц); 7,24 (2H, дублет, J=8,7 Гц); 5,69-5,83 (2H, мультиплет); 5,22-5,46 (5H, мультиплет); 4,87 (1H, дублет, J= 10,3 Гц); 4,65 (2H, широкий синглет); 4,28 (1H, триплет, J=6,2 Гц); 4,08 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц); 3,71 (3H, синглет).
Пример 68. 13-[2-[4-{ 2-(Этоксикарбониламино)-3-метилбутириламино}фенокси]- 2-метилпропионилокси]милбемицин A4.
[Соединение N 3-62 (52%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,81 (1H, синглет), 7,33 (2H, дублет, J=9,0 Гц); 6,76 (2H, дублет, J=9,0 Гц); 5,72-5,90 (2H, мультиплет); 5,18-5,50 (мультиплет, 5H); 5,01 (1H, дублет, J= 10,6 Гц); 4,68 (1H, широкий синглет); 4,29 (1H, триплет, J=6,2 Гц); 4,08 (1H, синглет); 3,96 (1H, дублет, J=6,2 Гц); 3,71 (3H, синглет).
Пример 69. 13-[2-[4-{2-(Метоксикарбониламино)-4- метилпентаноиламино}-фенил]-2-метилпропионилокси]милбемицин A4.
[Соединение N 3-64 (73%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,02 (1H, широкий синглет); 7,46 (2H, дублет, J=8,6 Гц); 7,24 (2H, дублет, J=8,6 Гц); 5,69-5,81 (2H, мультиплет); 5,24-5,45 (4H, мультиплет); 5,10 (1H, дублет, J=8,3 Гц); 4,87 (1H, дублет, J=10,6 Гц); 4,65 (2H, широкий синглет); 4,20-4,34 (2H, мультиплет); 4,08 (1H, синглет); 3,95 (1H, дублет, J=6,3 Гц); 3,72 (3H, синглет).
Пример 70. 13-[2-[4-{2-(Метоксикарбониламино)-3,3- диметилбутириламино} -фенил[-2-метилпропионилокси] милбемицин A4.
[Соединение N 3-65 (61%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 5,90 (1H, широкий синглет); 7,45 (2H, дублет, J=8,7 Гц); 7,24 (2H, дублет, J=8,7 Гц); 5,67-5,83 (2H, мультиплет); 5,55 (1H, дублет, J=9,8 Гц); 5,24-5,44 (4H, мультиплет); 4,87 (1H, дублет, J = 10,4 Гц); 4,65 (2H, широкий синглет); 4,28 (1H, триплет, J=6,2 Гц); 4,08 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц); 3,70 (3H, синглет).
Пример 71. 13-[2-[4-{1-(Метоксикарбониламино)циклогексан-1- карбониламино}фенокси]-2-метилпропионилокси]милбемицин A4.
[Соединение N 3-66 (37%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,81 (1H, широкий синглет); 7,34 (2H, дублет, J=8,8 Гц); 6,75 (2H, дублет, J=8,8 Гц); 5,71-5,89 (2H, мультиплет); 5,24-5,49 (4H, мультиплет); 5,01 (1H, дублет, J= 10,5 Гц); 4,89 (1H, синглет); 4,68 (2H, широкий синглет); 4,29 (1H, триплет, J= 6,2 Гц); 4,07 (1H, синглет); 3,96 (1H, дублет, J=6,2 Гц); 3,71 (1H, синглет).
Пример 72. 13-[2-[4-{1-(Этоксикарбониламино)циклогексан-1- карбониламино}фенил]-2-метилпропионилокси]милбемицин A4.
[Соединение N 3-68 (55%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,98 (1H, широкий синглет); 7,47 (2H, дублет, J=8,6 Гц); 7,24 (2H, дублет, J=8,6 Гц); 5,68-5,85 (2H, мультиплет); 5,23-5,46 (4H, мультиплет); 4,88 (1H, дублет, J= 10,5 Гц); 4,87 (1H, синглет); 4,66 (2H, широкий синглет); 4,28 (1H, триплет, J= 6,3 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J=6,3 Гц); 3,72 (3H, синглет).
Пример 73. 13-[2-[4-[(1-Метоксикарбонилпирролидин)-2-карбониламино] - фенил]-2-метилпропионилокси]милбемицин A4.
Соединение N 3-69 (78%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,47 (2H, дублет, J=8,8 Гц); 7,24 (2H, дублет, J=8,8 Гц); 5,67 - 5,82 (2H, мультиплет); 5,23-5,45 (4H, мультиплет); 4,88 (1H, дублет, J=10,5 Гц); 4,66 (2H, широкий синглет); 4,28 (1H, триплет, J= 6,1 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J=6,1 Гц); 3,78 (3H, синглет).
Пример 74. 13-[2-[4-(1-Метоксикарбонилпиперидин-2-карбониламино)фенил]- 2-метилпропионилокси]милбемицин A4.
Соединение N 3-71 (65%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,94 (1H, широкий синглет); 7,45 (2H, дублет, J=8,7 Гц); 7,24 (2H, дублет, J=8,71 Гц); 5,68-5,82 (2H, мультиплет); 5,23-5,46 (4H, мультиплет); 4,86-4,97 (2H, широкий синглет); 4,66 (2H, мультиплет); 4,28 (1H, триплет, J=6,2 Гц); 4,08-4,20 (1H, мультиплет); 4,06 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц).
Пример 75. 13-[2-[4-(1-Метоксикарбонилпиперидин-4-карбониламино)фенил]- 2-метилпропионилокси]милбемицин A4.
Соединение N 3-72 (91%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,47 (2H, дублет, J=8,7 Гц); 7,26 (2H, дублет, J=8,7 Гц); 5,68-5,81 (2H, мультиплет); 5,24-5,44 (5H, мультиплет); 4,82-4,93 (2H, мультиплет); 4,62-4,77 (3H, мультиплет); 4,38-4,49 (1H, мультиплет); 4,29 (1H, триплет, J=6,2 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц); 3,83 (3H, синглет).
Пример 76. 13-[2-[4-(3-Метоксикарбонил-1,3-тиазолидин-4-карбониламино)- фенил]-2-метилпропионилокси]милбемицин A4.
Соединение N 3-73 (60%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,47 (2H, дублет, J=8,7 Гц); 7,26 (2H, дублет, J=8,7 Гц); 5,68-5,81 (2H, мультиплет); 5,24-5,44 (5H, мультиплет); 4,82-4,93 (2H, мультиплет); 4,62-4,77 (3H, мультиплет); 4,38-4,49 (1H, мультиплет); 4,29 (1H, триплет, J=6,2 Гц); 4,07 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц).
Пример 77. 13-[2-[4-(5-Кетопирролидино-2-карбониламино)фенил] -2- метилпропионилокси]милбемицин A4.
Соединение N 3-76 (29%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,16 (1H, синглет); 7,52 (2H, дублет, J=8,7 Гц); 7,27 (2H, дублет, J=8,7 Гц); 6,79 (1H, синглет); 5,68-5,74 (2H, мультиплет); 5,22-5,43 (4H, мультиплет); 4,88 (1H, дублет, J=10,4 Гц); 4,65 (2H, широкий синглет); 4,22-4,37 (2H, мультиплет); 4,13 (1H, синглет); 3,94 (1H, дублет, J=6,2 Гц).
Пример 78. 13-[2-[4-{2-(2-Хлорацетиламинотиазол-4-ил)-2- метоксииминоацетиламино}фенил]-2-метилпропионилокси]милбемицин A4.
Соединение N 3-77 (68%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ/ , ppm: 9,88 (1H, широкий синглет); 7,93 (1H, синглет); 7,56 (2H, дублет, J=8,7 Гц); 7,53 (1H, синглет); 7,31 (2H, дублет, J=8,7 Гц); 5,69-5,87 (2H, мультиплет); 5,22-5,45 (4H, мультиплет); 4,90 (1H, дублет, J=10,5 Гц); 4,66 (2H, широкий синглет); 4,29 (3H, широкий синглет); 4,13 (3H, синглет); 4,10 (1H, синглет); 3,95 (1H, дублет, J=6,2 Гц).
Пример 79. 13-[2-[4-{2-(2-Метоксикарбониламинотиазол-4-ил)-2- метоксиимино}-ацетиламинофенил]-2-метилпропионилокси]милбемицин A4.
Соединение N 3-78 (68%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,05 (1H, широкий синглет); 7,57 (2H, дублет, J=8,5 Гц); 7,37 (1H, синглет); 7,30 (2H, дублет, J=8,5 Гц); 5,68-5,88 (2H, мультиплет); 5,21-5,45 (4H, мультиплет); 4,89 (1H, дублет, J= 10,6 Гц); 4,66 (2H, широкий синглет); 4,29 (1H, триплет, J= 6,1 Гц); 4,09 (1H, синглет); 4,05 (3H, синглет); 3,95 (1H, дублет, J=6,1 Гц); 3,86 (3H, синглет).
Пример 80. 13-[2-[4-(N-Метил-N-метоксикарбониламиноацетил)аминофенокси]- 2-метилпропионилокси]милбемицин A4.
Соединение N 3-82 (56%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,97 (1H, широкий синглет); 7,33 (2H, дублет, J=8,9 Гц); 6,76 (2H, дублет, J=8,9 Гц); 5,72-5,88 (2H, мультиплет); 5,26-5,50 (4H, мультиплет); 5,01 (1H, дублет, J= 10,6 Гц); 4,68 (2H, широкий синглет); 4,29 (1H, триплет, J=6,2 Гц); 4,07 (1H, синглет); 4,02 (2H, синглет); 3,96 (1H, дублет, J=6,2 Гц); 3,77 (3H, синглет).
Пример 81. 13-[2-[4-{ 1-(Метоксикарбонилпирролидин)-2-карбониламино} - фенокси]-2-метилпропионилокси]милбемицин A4.
Соединение N 3-83 (26%)].
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 9,00 (1H, широкий синглет); 7,35 (2H, дублет, J=8,9 Гц); 6,75 (2H, дублет, J=8,9 Гц); 5,71-5,90 (2H, мультиплет); 5,26-5,51 (4H, мультиплет); 5,01 (1H, дублет, J= 10,6 Гц); 4,68 (2H, широкий синглет); 4,44 (1H, широкий синглет); 4,29 (1H, триплет, J=6,2 Гц); 4,07 (1H, синглет); 3,96 (1H, дублет, J=6,2 Гц); 3,77 (3H, синглет).
Препаративный пример 1. α -Метоксииминофенилуксусная кислота.
(a) Этил- α -метоксииминофенилацетат.
Добавляют 1,4 г (16,8 ммоль) гидрохлорида O-метилгидроксиламина и 1,16 г (8,4 ммоль) карбоната калия к раствору 0,50 г (2,8 ммоль) этил-фенилглиоксилата в N,N-диметилформамиде, и получающуюся в результате смесь перемешивают при 90oC в течение 4 ч. По окончании этого времени реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния, и растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (10-30%) и получают 0,47 г (выход 67%) менее полярного изомера названного в заголовке соединения.
Менее полярный изомер.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,55-7,64 (2H, мультиплет); 7,32-7,46 (3H, мультиплет); 4,43 (2H, квартет, J=7,2 Гц); 4,02 (3H, синглет); 1,38 (3H, триплет, J=7,2 Гц).
Более полярный изомер.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,42 (5H, синглет); 4,37 (2H, квартет, J=7,1 Гц); 4,06 (3H, синглет); 1,36 (3H, триплет, J=7,1 Гц).
(b) α -Метоксииминофенилуксусная кислота.
Водный раствор 0,90 г (22,6 ммоль) гидроксида натрия добавляют к раствору 0,47 г (2,3 ммоль) этил- α -метоксииминофенилацетата (полученный выше изомер с меньшей полярностью) в метаноле. Получающуюся в результате смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в 1N соляную кислоту, и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и концентрируют, получают названное в заголовке соединение как сырой продукт, который используют в последующей реакции без дальнейшей очистки.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 10,3 (1H, широкий синглет); 7,60-7,72 (2H, мультиплет); 7,32-7,45 (3H, мультиплет); 4,03 (3H, синглет).
Препаративный пример 2. α -Метоксиимино-2-хлорфенилуксусная кислота.
(a) 1-(2-Хлорфенил)-1,2-этандиол-2,0-трет-бутилдиметилсилиловый эфир.
Сначала 1,63 (20,0 ммоль) имидазола, а затем 1,63 г (24 ммоль) трет-бутилдиметилсилилхлорида добавляют при охлаждении льдом к раствору 3,45 г (20 ммоль) 1-(2-хлорфенил)-1,2-этандиола в N,N-диметилформамиде. Получающуюся в результате смесь перемешивают при комнатной температуре в течение 20 мин. По окончании этого времени реакционную смесь выливают в воду и экстрагируют три раза, порциями по 50 мл, этилацетатом. Объединенные экстракты промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (10-20%), и получают 3,58 г (выход 63%) названного в заголовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,58-7,66 (1H, мультиплет); 7,16-7,35 (3H, мультиплет); 5,16 (1H, дублет триплетов, Jд=8,0 Гц, JT)=3,0 Гц); 3,94 (1H, дублет дублетов, J=10,2, 3,0 Гц); 3,46 (1H, дублет дублетов, J=8,0, 3,0 Гц); 3,06 (1H, дублет, J=3,0 Гц); 0,91 (9H, синглет); 0,07 (3H, синглет); 0,05 (3H, синглет).
(b) 2'-Хлор-2-трет-бутилдиметилсилилоксиацетофенон.
Добавляют 70,0 г диоксида марганца к раствору 3,5 г (12,3 ммоль) 1-(2-хлорфенил)-1,2-этандиол-2-О-трет-бутилдиметилсилилового эфира в дихлорметане. Получающуюся в результате смесь перемешивают при комнатной температуре в течение 4 ч и реакционную смесь затем фильтруют через ускоряющую фильтрацию диатомовую землю. Фильтрат концентрируют, и получают 3,05 г (87%) 2'-хлор-2-трет-бутилдиметилсилилоксиацетофенона в виде сырого продукта.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,25-7,48 (4H, мультиплет); 4,75 (2H, синглет); 0,87 (9H, синглет); 0,1 (6H, синглет).
(c) 2'-Хлор-2-гидроксиацетофенон-0-метилоксим.
Добавляют 1,78 г гидрохлорида 0-метилгидроксиламина к раствору 3,05 г полученного выше 2'-хлор-2-трет-бутилдиметилсилилоксиацетофенона в смеси метанола, воды и 1,4-диоксана. Получающуюся в результате смесь перемешивают при комнатной температуре в течение 14 ч и затем реакционную смесь выливают в воду и экстрагируют этилацетатом три раза порциями по 50 мл. Объединенные экстракты промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния, отгоняют растворитель, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (10 - 40%), получают 691 мг (выход 32,4%) изомера O-метилоксима 2'-хлор-2-гидроксиацетофенона с меньшей полярностью и 370 мг (выход 17,3%) изомера с большей полярностью названного в заголовке соединения.
Изомер с меньшей полярностью
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,29 - 7,46 (4H,мультиплет); 4, 69 (2H, дублет, J=7,2 Гц); 4,02 (3H, синглет).
Изомер с большей полярностью.
Спектр ядерного магнитного резонанса (CDCL3, 200 МГц), δ , ppm: 7,41 - 7,47 (1H,мультиплет); 7,29 - 7,38 (1H,мультиплет); 7,14 -7,20 (1H,мультиплет); 4,45 (2H,дублет, J=5,5Гц); 3,89 (3H, синглет).
(d) α -Метоксиимино-2-хлорфенилуксусная кислота.
Добавляют 10 мл реагента Джонса (Jones) хромовый ангидрид в разбавленной серной кислоте ( к раствору 0,40 г 0-метилоксима 2'-хлор-2-гидроксиацетофенона (изомер с меньшей полярностью, полученной выше). Образующуюся в результате смесь перемешивают при комнатной температуре в течение часа, и затем при охлаждении льдом добавляют 10 мл изопропанола. Реакционную смесь выливают в 100 мл воды, и экстрагируют три раза этилацетатом порциями по 10 мл. Объединенные экстракты промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом магния. Растворитель отгоняют, и получают 320 мг (75%) названного в заголовке соединения как сырой продукт.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 7,28-7,50 (4H,мультиплет); 5,25 (1H, широкий синглет); 4,14 (3H, синглет).
Препаративный пример 3. Производные 0-алкилоксима 2-гидроксиацетофенона.
Перечисленные далее производные 0-алкилоксима 2-гидроксиацетофенона, замещенные в фенильной группе, получают по методикам, соответствующим описанным выше в препаративном примере 2 для получения 0-метилоксима 2'-хлор-2-гидроксиацетофенона.
(1) 0-Метилоксим-2-гидроксиацетофенона.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,60-7,69 (2H, мультиплет); 7,34-7,43 (3H, мультиплет); 4,69 (2H, дублет, J=7,0 Гц); 4,04 (3H, синглет); 2,73 (1H, триплет, J=7,0 Гц).
(2) 0-Метилоксим-3'-фтор-2-гидроксиацетофенона.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,30-7,45 (3H, мультиплет); 7,01 - 7,12 (1H, мультиплет); 4,68 (2H, дублет, J=6,9 Гц); 4,04 (3H, синглет); 2,65 (1H, триплет, J=6,9 Гц).
(3) О-Метилоксим-3'-хлор-2-гидроксиацетофенона.
Спектр ядерного магнитного резонанса (CDCl3 200 МГц), δ , ppm: 7,67(1H, мультиплет); 7,49-7,56 (1H, мультиплет); 7,31-7,40 (2H, мультиплет); 4,66 (1H, дублет, J=6,9 Гц); 4,05 (3H, синглет); 2,60 (1H, триплет, J= 6,9 Гц).
Препаративный пример 4. Производные α - метоксиимино-2-хлорфенилуксусной кислоты.
Перечисленные далее производные α - метоксииминофенилуксусной кислоты получают способами, соответствующими способу, использованному выше в препаративном примере 2 для получения α - метоксиимино-2-хлорфенилуксусной кислоты.
(1) α - Метоксиимино-3-фторфенилуксусная кислота.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ ppm: 9,40 (1H, широкий синглет); 7,76-7,97 (1H, мультиплет); 7,15-7,58 (3H, мультиплет); 4,07 (3H, синглет); 3,89 (3H, синглет).
(2) α - Метоксиимино-3-хлорфенилуксусная кислота.
Спектр ядерного магнитного резонанса (CDCl3, 2-00 МГц), δ , ppm: 7,94-8,10 (1H, мультиплет); 7,25-7,70 (3H, мультиплет): 4,09 (3H, синглет).
(3) α - Метоксиимино-4-хлорфенилуксусная кислота.
Изомер с меньшей полярностью.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,59(2H, дублет, J=8,71 Гц); 7,38 (2H, дублет, J=8,71 Гц); 4,10 (3H, синглет).
Изомер с большей полярностью.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,50 (2H, дублет, J=8,91 Гц); 7,42 (2H, дублет, J= 8,91 Гц); 4,12 (3H, синглет).
(4) α -Этоксиимино-4-хлорфенилуксусная кислота.
Изомер с меньшей полярностью.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,69(2H, дублет, J= 9,00 Гц); 7,39 (2H, дублет, J=9,0 Гц); 4,36 (2Р, квартет, J= 7,6 Гц); 1,38 (3H, триплет, J=7,6 Гц).
Изомер с большей полярностью
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,54 (2H, дублет, J=6,6 Гц); 7,47 (2H, дублет, J=6,6 Гц); 4,37 (2H, квартет, J= 7,0 Гц); 1,37 (3H, триплет, J=7,0 Гц).
(5) α - Метоксиимино-2-метоксифенилуксусная кислота.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,65 (1H, дублет дублетов, J=1,6, 7,7 Гц); 7,41 (1H, триплет триплетов, J= 1,6, 8,0 Гц); 6,80 - 7,05 (2H, мультиплет); 4,07 (3H, синглет); 3,82 (3H, синглет).
(6) α - Метоксиимино-2-этоксифенилуксусная кислота.
Изомер с меньшей полярностью.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm : 7,62 (1H, дублет дублетов, J = 1,7, 7,7 Гц); 7,39 (1H, дублет триплетов, J = 1,0, 7,0 Гц); 6,85 - 8,01 (2H, мультиплет); 4,08 (3H, синглет); 4,0-4,13 (2H, мультиплет); 1,40 (3H, триплет, J = 7,0 Гц).
Изомер с большой полярностью.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , pрm: 7,25-7,40 (2H, мультиплет); 6,88-7,05 (2H, мультиплет); 4,08 (3H, синглет); 4,0-4,13 (2H, мультиплет); 1,33 (3H, триплет, J= 7,0 Гц).
(7) α - Метоксиимино-2-бензилоксифенилуксусная кислота.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,70 (1H, широкий синглет); 7,25-7,42 (7H, мультиплет); 7,06 (2H, дублет, J = 8,3 Гц); 6,99 (2H, дублет, J= 8,3 Гц); 5,08 (2H, синглет); 4,04 (3H, синглет).
Препаративный пример 5. 3-Метоксиимино-3-фенилпропионовая кислота.
Названное в заголовке соединение получают, следуя методике получения α -метоксииминофенилуксусной кислоты, описанной в препаративном примере 1, но используя в качестве исходного вещества этилбензоилацетат.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,60-7,71 (2H, мультиплет); 7,34-7,45 (3H, мультиплет); 4,03 (3H, синглет); 3,81 (2H, синглет).
Препаративный пример 6. α -Метоксиимино-4-нитрофенилуксусная кислота.
Названное в заголовке соединение получают в соответствии с методикой получения α -метоксииминофенилуксусной кислоты, описанной в препаративном примере 1, но используя в качестве исходного вещества 4-нитрофенилглиоксилат, описанный в Synthesis, 850 (1990).
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,13 (2H, дублет, J= 7,0 Гц); 7,48 (2H, дублет, J= 7,0 Гц), 3,95 (3H, синглет).
Препаративный пример 7. α - Метоксиимино-2-гидроксифенилуксусная кислота.
Названное в заголовке соединение получают в соответствии с методикой получения α -метоксииминофенилуксусной кислоты, описанной в препаративном примере 1, но используя в качестве исходного вещества 2-гидроксифенилглиоксилат.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,17-7,38 (2H, мультиплет); 6,81-7,08 (2H, мультиплет); 4,08 (3H, синглет).
Препаративный пример 8. α - Метоксиимино-2-пиридилуксусная кислота.
Названное в заголовке соединение получают в соответствии с методикой получения α -метоксииминофенилуксусной кислоты, описанной в препаративном примере 1, но используя в качестве исходного вещества коммерчески доступный этил-2-пиридилглиоксилат.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,50 (1H, дублет, J= 4,9 Гц); 7,75 (1H, дублет триплетов, Jд= 1,6 Гц, Jт= 7,7 Гц); 7,61 (1H, дублет триплетов, Jд= 7,7 Гц, Jт= 1,6); 7,28 (1H, триплет, J= 7,7 Гц); 4,38 (1H, широкий синглет); 3,97 (3H, синглет ).
Препаративный пример 9. α -Метоксиимино-4-нитрофенилуксусная кислота.
(а) Этил - α -метоксиимино-4-нитрофенилацетат.
Добавляют 0,95 г (11,4 ммоль) гидрохлорида O-метилгидроксиламина к раствору 1,18 г (5,7 ммоль) этил-4-нитрофенилглиоксилата (полученного по методике, описанной в Synthesis 850 (1990) в диметилформамиде, и образующуюся в результате смесь перемешивают при комнатной температуре в течение 24 ч. По окончании этого времени реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (10 - 40%), и получают 0,40 г (выход 30%) названного в заголовке соединения.
Спектр ядерного магнитного соединения (CDCL3, 200 МГц), δ , ppm: 8,28 (2H, дублет, J= 9,0 Гц); 7,58 (2H, дублет, J= 9,0 Гц); 4,38 (2H, квартет, J= 7,1 Гц); 4,09 (3H, синглет); 1,37 (3H, триплет, J= 7,1 Гц).
(b) α -метоксиимино-4-нитрофенилуксусная кислота.
Добавляют 5 мл (10 ммоль) 2N водного раствора гидроксида натрия к раствору 1,28 г (5,07 ммоль) этил-α- метоксиимино-4-нитрофенилацетата в метаноле, и образующуюся в результате смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в 1N соляную кислоту и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния, растворитель отгоняют, и получают 1,0 г (выход 88%) названного в заголовке соединения в виде сырого продукта, который используют в последующей реакции без дальнейшей обработки.
Спектр ядерного магнитного резонанса (CDCl3, 200МГц), δ/ , ppm: 8,13 (2H, дублет, J= 9,0 Гц); 7,48 (2H, дублет, J = 9,0 Гц); 3,95 (3H, синглет).
Препаративный пример 10. O-метилоксим-4'-нитро-2-гидроксиацетофенона.
(а) 4-Нитрофенилглиоксиловая кислота.
Добавляют 3 мл (6 ммоль) 2N водного раствора гидроксида натрия к раствору 651 мг (2,92 ммоль) этил-4-нитрофенилглиоксида в метаноле, и получающуюся в результате смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в 2N соляную кислоту и экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и получают 0,8 г (количественный выход) сырой 4-нитрофенилглиоксиловой кислоты.
(b) 1-(4-Нитрофенил)-1,2-этандиол.
При 0oC и в потоке азота добавляют 7 мл 1,0 М тетрагидрофуранового раствора диборан-тетрагидрофуранового комплекса к раствору 0,5 г сырой 4-нитрофенилглиоксиловой кислоты в тетрагидрофуране, и образующуюся в результате смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в воду со льдом и экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и получают 0,56 г (количественный выход) сырого 2-(4-нитрофенил)-1,2-этандиола.
(c) 1-(4-нитрофенил)-1,2-этандиол-2-0-трет-бутилдиметилсилиловый эфир.
Доставляют сначала 0,23 г имидазола, а затем 0,50 г трет-бутилдиметилсилилхлорида к раствору 0,56 г сырого 1-(4-нитрофенил)-1,2-этандиола в диметилформамиде при охлаждении льдом, и образующуюся в результате смесь перемешивают при комнатной температуре в течение 20 мин. По окончании этого времени реакционную смесь выливают в воду и экстрагируют три раза этилацетатом порциями по 50 мл. Объединенные экстракты промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют, и остаток очищают колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (0-30%), и получают 0,58 г (выход 63%) 1-(4-нитрофенил)-1,2-этандиол-2-0-трет-бутилдиметилсилилового эфира.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ, ppm: 8,22 (2H, дублет, J= 8,7 Гц); 4,84 (1H, мультиплет); 3,82 (1H, дублет дублетов, J = 3,9, 10,1 Гц); 3,54 (1H, дублет дублетов, J=7,9, 10,1 Гц); 3,06 (1H, дублет, J=2,9 Гц); 0,91 (9H, синглет); 0,07 (6H, синглет); 0,05 (6H, синглет).
(d) 4'-Нитро-2-трет-бутилдиметилсилилоксиацетофенон.
Добавляют 3,5 г диоксида марганца (IV) к раствору 0,41 г (1,36 ммоль) 1-(4-нитрофенил)-1,2-этандиол-2-0-трет-бутилдиметилсилилового эфира в дихлорметане, и получающуюся в результате смесь перемешивают в течение 4 ч при комнатной температуре. Реакционную смесь затем фильтруют через "Целит" /диатомовая земля/, и фильтрат концентрируют под вакуумом. Остаток очищают колоночной хроматографией, элюируя этилацетатом в гексане со ступенчатым градиентом (0-25%), и получают 0,16 (выход 40%) 4'-нитро-2-трет-бутилдиметилсилилоксиацетофенона.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,32 (2H, дублет, J= 9,0 Гц); 8,11 (2H, дублет, J=9,0 Гц); 4,88 (2H, синглет); 0,91 (9H, синглет); 0,12 (6H, синглет).
(e) 0-Метилоксим-4'-нитро-2-гидроксиацетофенона.
Добавляют 69 мг гидрохлорида О-метилгидроксиламина к раствору 0,12 г (0,41 ммоль) 4'-нитро-2-трет-бутилдиметилсилилоксиацетофенона (полученного выше) в смеси метанола (1,2 мл), 1,4-диоксана (2,0) и воды (2,0 мл). Получающуюся в результате смесь перемешивают в течение 1,5 ч. при 80oC; затем выливают в воду и экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором хлорида натрия, и сушат над безводным сульфатом магния. Остаток очищают хроматографией на силикагеле, элюируя этилацетатом в гексане со ступенчатым градиентом (10-40%), и получают 58 мг (выход 67%) названного в заголовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 8,25 (2H, дублет, J=8,9 Гц); 7,85 (2H, дублет, J=8,9 Гц); 4,73 (2H, дублет, J=6,6 Гц); 4,09 (3H, синглет); 2,44 (1H, триплет, J=6,6 Гц).
Препаративный пример 11.
(Стадия A). 13-[2-Метоксиимино-2-(4-нитрофенил)этокси]-5-кето-мильбемицин A4.
При охлаждении льдом и в потоке аргона добавляют 0,13 мл трифторметансульфоновой кислоты к раствору 821 мг (1,5 ммоль) 15-гидрокси-5-кетомилбемицина A4, 1,08 г (5,16 ммоль) 2-метоксиимино-2-(4-нитрофенил)этанола и 571 мг иодида меди (I) в 10 мл дихлорметана, и получающуюся в результате смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь затем выливают в воду, и экстрагируют этилацетатом. Экстракт промывают сначала 5% водным раствором бикарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют под вакуумом, получают 824 мг сырого названного в заголовке соединения, которое используют в последующей реакции без дополнительной очистки.
(Стадия B). 13-[2-Метоксиимино-2-(4-нитрофенил)этокси]-милбемицин A4.
При охлаждении льдом 200 мг (1,01 ммоль) борогидрида натрия добавляют к раствору 824 мг (1,01 ммоль) сырого 13-[2-метоксиимино-2-(4-нитрофенил-этокси] -5-кетомилбемицина A4 в 40 мл метанола, и получающуюся в результате смесь перемешивают при 0oC в течение 30 мин. Реакционную смесь затем выливают в воду и экстрагируют этилацетатом. Экстракт промывают сначала водой, а затем насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют под вакуумом, получают 720 мг сырого названного в заголовке соединения, которое используют в последующей реакции без дальнейшей очистки.
(Стадия C). 13-[2-Метоксиимино-2-(4-аминофенил)этокси]-милбемицин A4.
При комнатной температуре 130 мг цинковой пыли добавляют к раствору 150 мг (0,20 ммоль) сырого 13-[2-метоксиимино-2-(4-итрофенил)этокси]милбемицина A4 в 40 мл 90% уксусной кислоты, и получающуюся в результате смесь перемешивают в течение 30 мин. Реакционную смесь затем смешивают с этилацетатом, и отфильтровывают нерастворимые вещества. Фильтрат разбавляют водой и затем экстрагируют этилацетатом. Экстракт промывают 4% водным раствором бикарбоната натрия и сушат над безводным сульфатом магния, растворитель отгоняют, и остаток очищают препаративной высокоэффективной жидкостной хроматографией (колонка УМС ODS (10 мкм), 250х20 мм внутр. диам.; элюируют смесью MeOH-H2O (6:1), 10 мл/мин; УФ-обнаружение (240 нм)), и получают 40 мг (выход 28%) названного в заголовке соединения.
Спектр ядерного магнитного резонанса (CDCl3, 200 МГц), δ , ppm: 7,48 (2H, дублет, J=8,7 Гц); 6,24 (2H, дублет, J=8,7 Гц); 5,64-5,79 (2H, мультиплет); 5,15-5,44 (4H, мультиплет); 4,68 (2H, синглет); 4,40 (2H, синглет); 4,29 (1H, триплет, J=5,7 Гц); 3,98 (1H, дублет, J=5,7 Гц); 3,94 (3H, синглет).
Продукт, полученный таким способом, используют в качестве исходного вещества на стадии ацилирования D в приведенных выше примерах 32 и 33.
Агрохимические композиции.
Когда соединения изобретения предназначаются для применения в сельском хозяйстве и садоводстве, возможны различные формы и композиции, и их примеры приводятся далее в примерах композиций. В этих примерах соединение изобретения, которое используется, присутствует в череде отдельных соединений, приведенных ниже в табл. 4 - 12. Все проценты являются массовыми, и соединения изобретения указываются под номерами, присвоенными им в приведенных выше табл. 1 - 3.
Пример композиции 1. Смачивающийся порошок.
Смесь, содержащую 10% соединения изобретения (указываются в табл. 4 - 12), 2,5% додецилбензолсульфоната натрия, 2,5% лигнинсульфоната натрия и 85% диатомовой земли, тщательно перемешивают и распыляют, получают смачивающийся порошок.
Пример композиции 2. Концентрат эмульсии.
Смесь 5% соединения изобретения (указывается в табл. 4-12), 10% "Sorpol SM 100" (торговое название эмульгатора, продукт Toho Chemical Co., Ltd) и 85% ксилола тщательно перемешивают и получают концентрат эмульсии.
Пример композиции 3. Гранулы.
Смесь, содержащую 3% соединения изобретения (указываются в табл. 4-12), % "белой сажи" (торговое название для дегидратирующего агента - диоксида кремния), 5% лигнинсульфоната натрия и 91% глины, тщательно перемешивают и распыляют, хорошо перемешивают с водой, и затем, чтобы приготовить гранулы, гранулируют и сушат.
Пример композиции 4. Концентрат эмульсии.
Растворяют 2,5% соединения изобретения (указываются в табл. 4-12) и 1,0% BHT (антиоксидант) в 26,5% циклогексанона. Раствор смешивают с 50,0% "Sylgard 309" (кремнийорганическое поверхностно-активное вещество от Dow Corning) и 20% "Excepal" (метиловый эфир жирной кислоты арахисового масла от Kao Co., Ltd.) до однородного состояния, и получают концентрат эмульсии.
Биологическое действие.
Активность соединений изобретения иллюстрируется приведенными далее биологическими испытаниями, результаты которых даются в табл. 4-12. Соединения изобретения указываются под номерами, используемыми в приведенных выше табл. 1-3. Соединения с (С1) по (С10) используются в качестве контрольных в целях сравнения, и их формулы приводятся (см. фиг. 5-7). Соединения с (С1) по (С4) и с (С6) по (С10) раскрываются в публикации европейского патента 246739, и соединение (С5) раскрывается в публикации европейского патента 357460.
Эксперимент 1. Инсектицидное действие против капустной совки.
Концентраты эмульсий, полученные так, как описано в примере композиции 2, и содержащие 1% активного ингредиента, разбавляют водой, чтобы довести конечную концентрацию до 1 ppm. Листья капусты погружают в полученные смеси на 10 с и затем сушат на воздухе, после чего каждый лист помещают в полиэтиленовую чашку диаметром 8 см. По десять гусениц капустной совки в третьей возрастной стадии помещают в каждую чашку, и чашки затем закрывают. Чашки устанавливают в условия термостатического регулирования температуры при 25oC на 3 дня, после чего определяют процент смертности (включая симптомы нарушений). В каждом случае параллельно проводят два испытания. Результаты приведены в табл. 4-6, в которых соединения изобретения указываются под номерами, присвоенными им выше в табл. 1-3.
Эксперимент 2. Инсектицидное действие на совку обыкновенную.
Концентраты эмульсий, полученные так, как описано в примере композиции 2, и содержащие 1% активного ингредиента, разбавляют водой, чтобы довести конечную концентрацию до 10 ppm. В каждую из полученных смесей погружают на 20 с по 5 г искусственного корма, и затем корм сушат на воздухе. Затем его помещают в полиэтиленовые чашки, имеющие диаметр 8 см. В каждую чашку помещают десять гусениц совки обыкновенной в третьей возрастной стадии, и чашки закрывают. Чашки составляют в условиях термостатически регулируемой температуры при 25oC на 3 дня, после чего определяют процент смертности (включая симптомы нарушения). Каждое испытание проводят параллельно два раза. Результаты приведены в табл. 7-9.
Эксперимент 3. Инсектицидное действие против восточной чайной листовертки.
Концентраты эмульсий, полученные так, как описано в примере композиции 2, и содержащие 1% активного ингредиента, разбавляют водой до конечной концентрации 10 ppm. В каждую полученную смесь погружают по 5 г искусственного корма ("Insecta L") на 20 с, и затем корм сушат на воздухе. Его помещают в полиэтиленовые чашки, имеющие диаметр 8 см. В каждую чашку помещают по десять гусениц восточной чайной листовертки в четвертой стадии роста, и чашки закрывают. Чашки выдерживают в термостате при 25oC в течение 3 дней, после чего определяют процент смертности (включая симптомы нарушений). Каждое испытание проводят параллельно два раза. Результаты приведены в табл. 10-12.
Эксперимент 4. Акарицидная активность против Tetranychus urticae.
Листья первого порядка растений гороха коровьего вида Vigna sinensis Savi инфицируют чувствительными к органическим фосфатам клещами (Tetranychus urticae). Через сутки после заражения инфицированные растения опрыскивают, используя роторный распылитель Hizubo, 7 мл испытуемого раствора, содержащего испытуемое соединение в концентрации 0,3 ppm, при норме 3,5 мг испытуемого раствора на 1 см2 листа. Состояние растений оценивают через 3 суток, проверяя взрослых клещей под бинокулярным микроскопом для определения живых и погибших особей.
Два растения берут для каждой концентрации и для каждого испытуемого соединения. Во время испытаний растения держат в тепличных условиях при 25oC. Результаты приведены ниже.
Соединение примера N - Смертность, %
1 - 72 - 100
1 - 73 - 100
1 - 77 - 95
1 - 78 - 95
1 - 79 - 95
1 - 80 - 95
3 - 26 - 90
3 - 27 - 95
3 - 56 - 95.
| название | год | авторы | номер документа |
|---|---|---|---|
| 13-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 5-ОКСИМА МИЛБЕМИЦИНА, СОДЕРЖАЩАЯ ИХ АНТИГЕЛЬМИНТНАЯ, АКАРИЦИДНАЯ И ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2128181C1 |
| ПРОИЗВОДНЫЕ 13-(ЗАМЕЩЕННОГО ТИО)АЦЕТОКСИМИЛБЕМИЦИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ ЗАЩИТЫ РАСТЕНИЙ | 1992 |
|
RU2086552C1 |
| ПРОИЗВОДНЫЕ ОКТАГИДРОНАФТАЛИНОКСИМА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2125043C1 |
| ПРОИЗВОДНЫЕ 1,2-ДИФЕНИЛПИРРОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2125044C1 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| АНАЛОГИ ЛИПИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2076107C1 |
| ПРОИЗВОДНЫЕ ОКСИМА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2122998C1 |
| АМИДО- ИЛИ КАРБАМИДО- ПРОИЗВОДНЫЕ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИЕ СОЛИ И КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ АЦИЛ-СОА:ХОЛЕСТЕРИН АЦИЛТРАНСФЕРАЗЫ | 1994 |
|
RU2106340C1 |
| ПЕПТИДНОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2106357C1 |
| ПРОИЗВОДНЫЕ БИФЕНИЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2109736C1 |

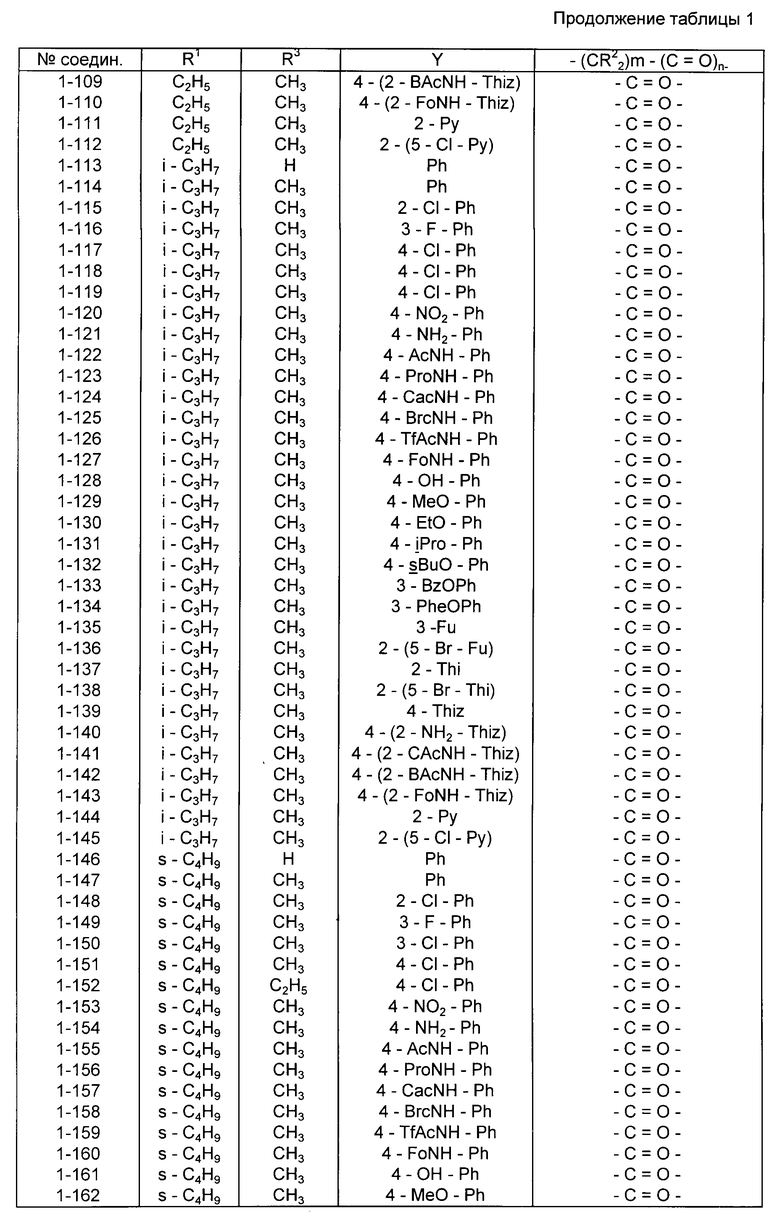
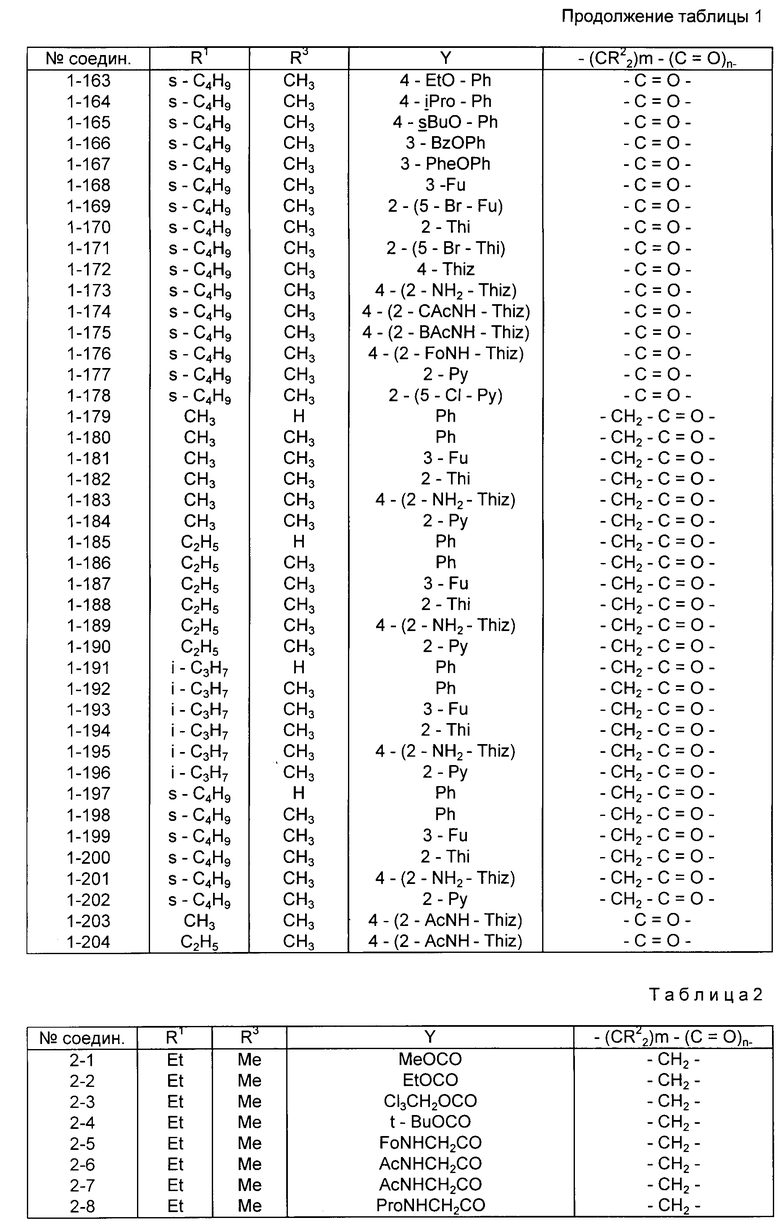
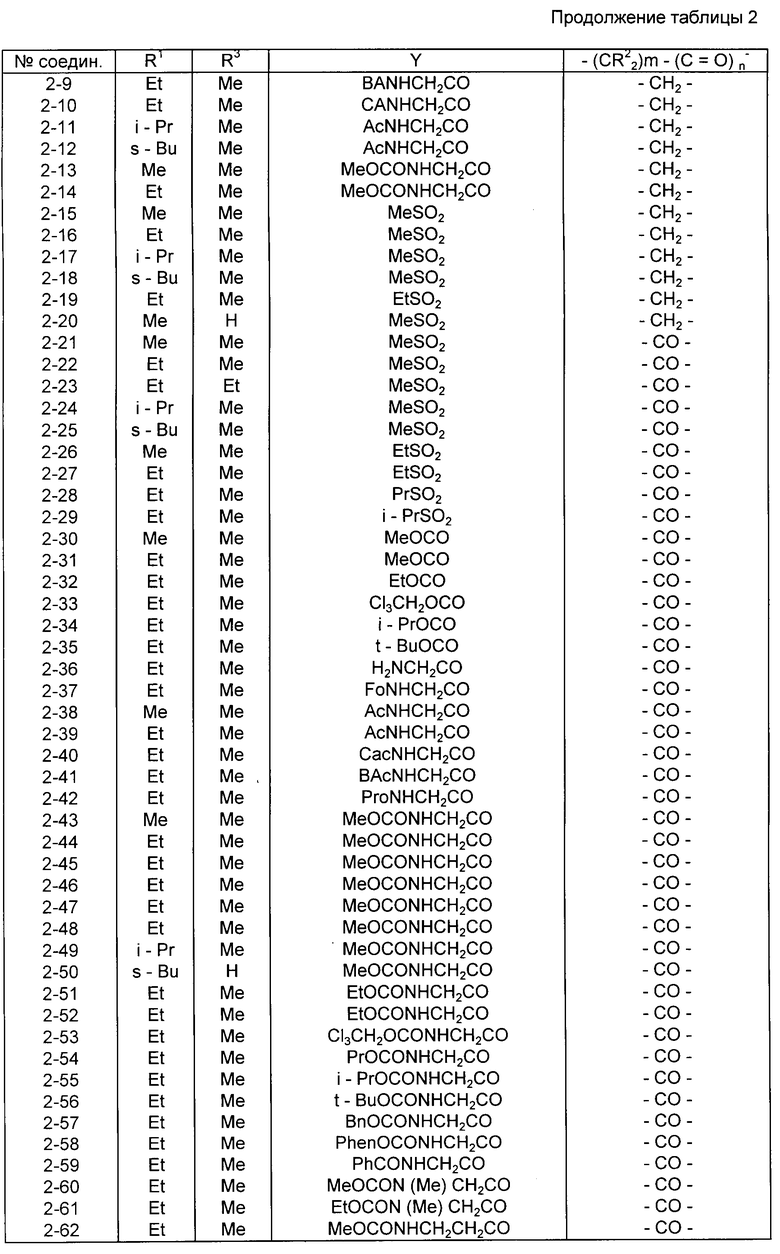
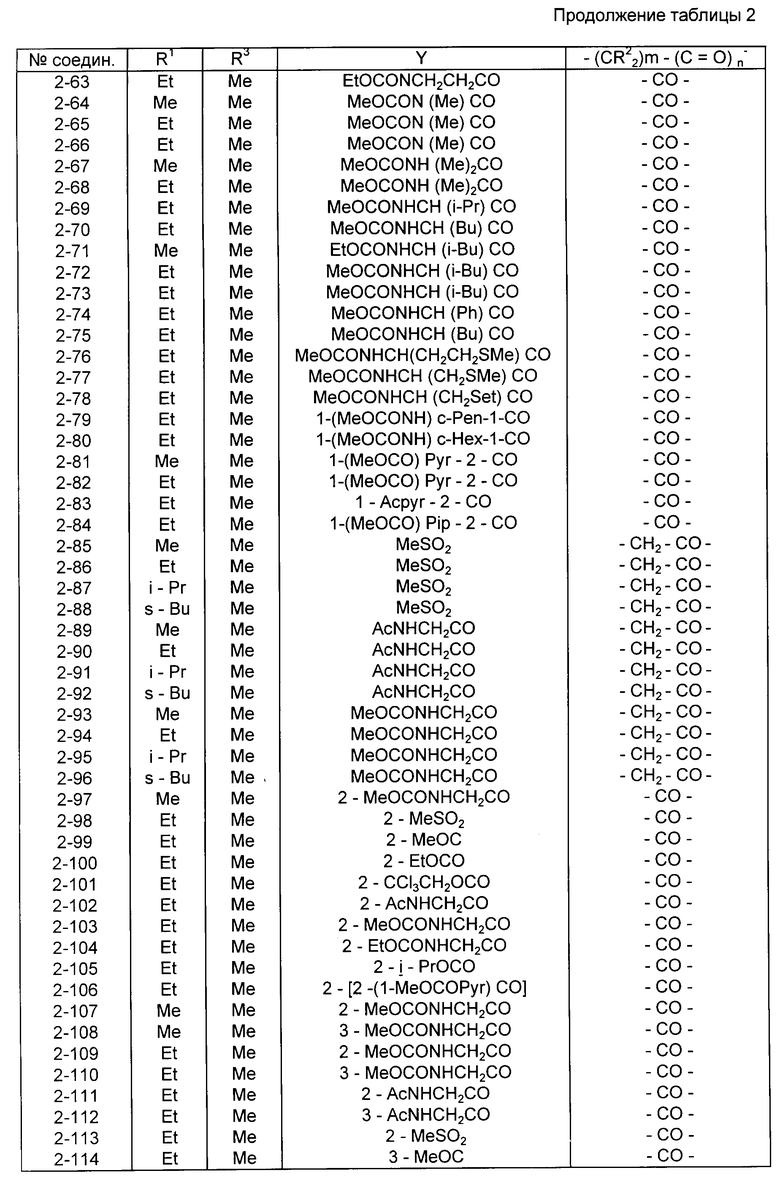
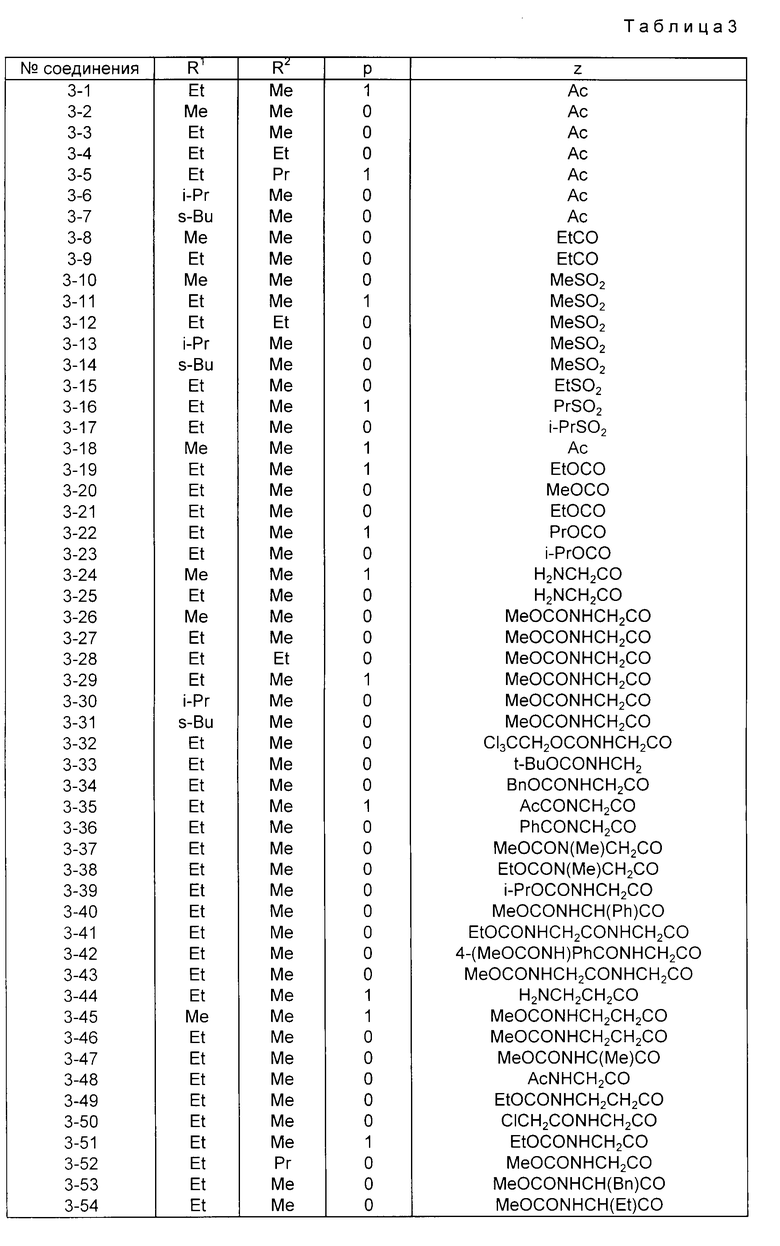

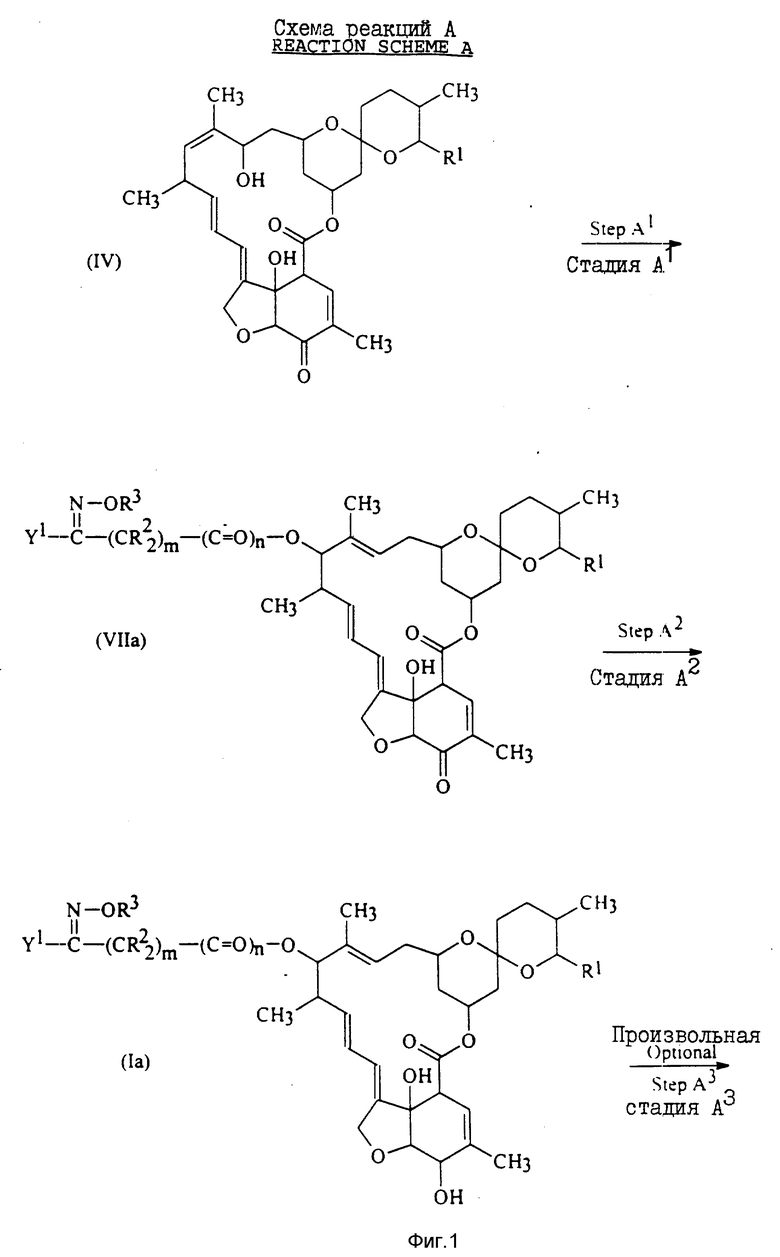
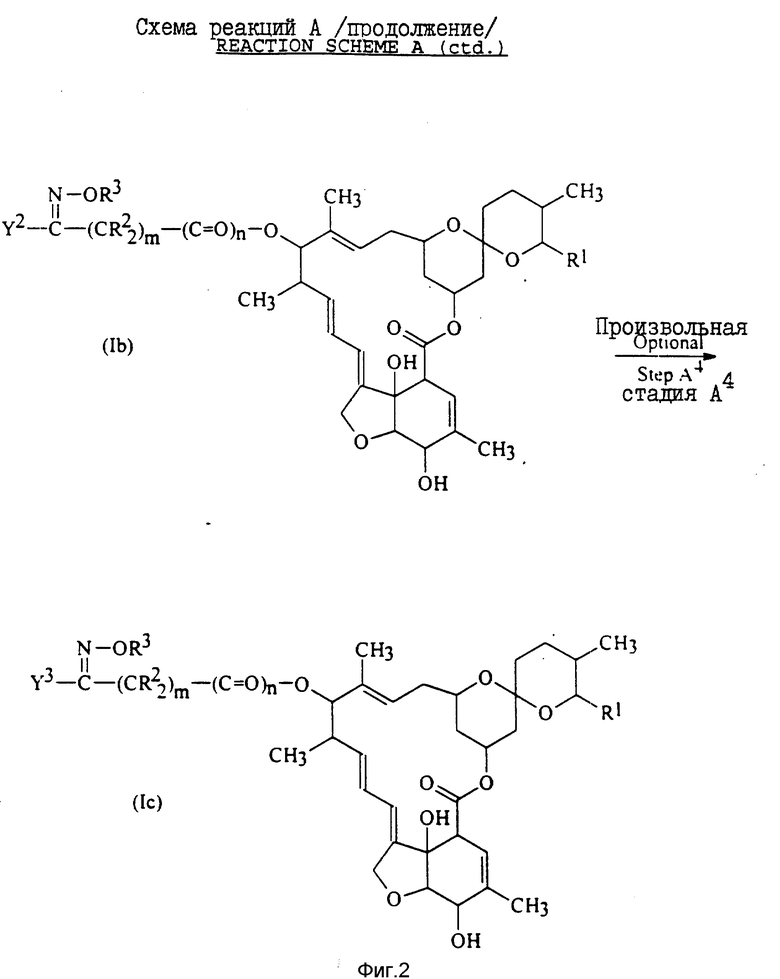
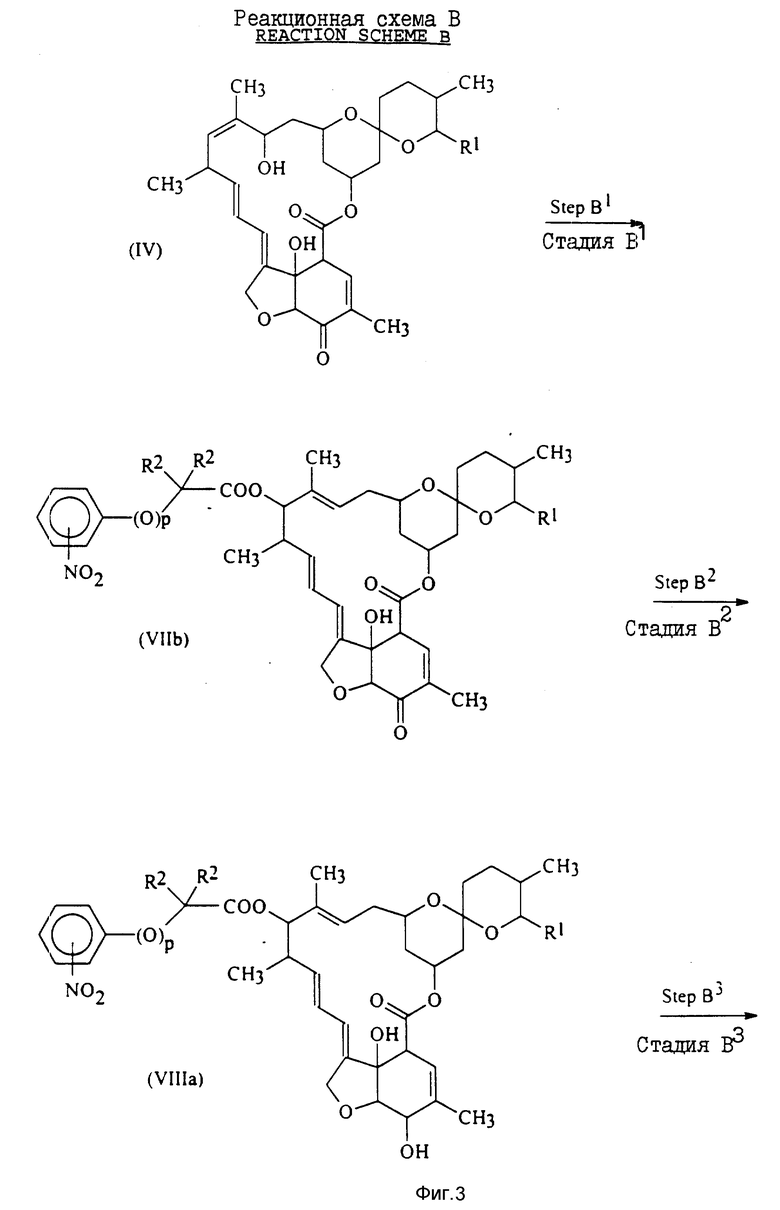
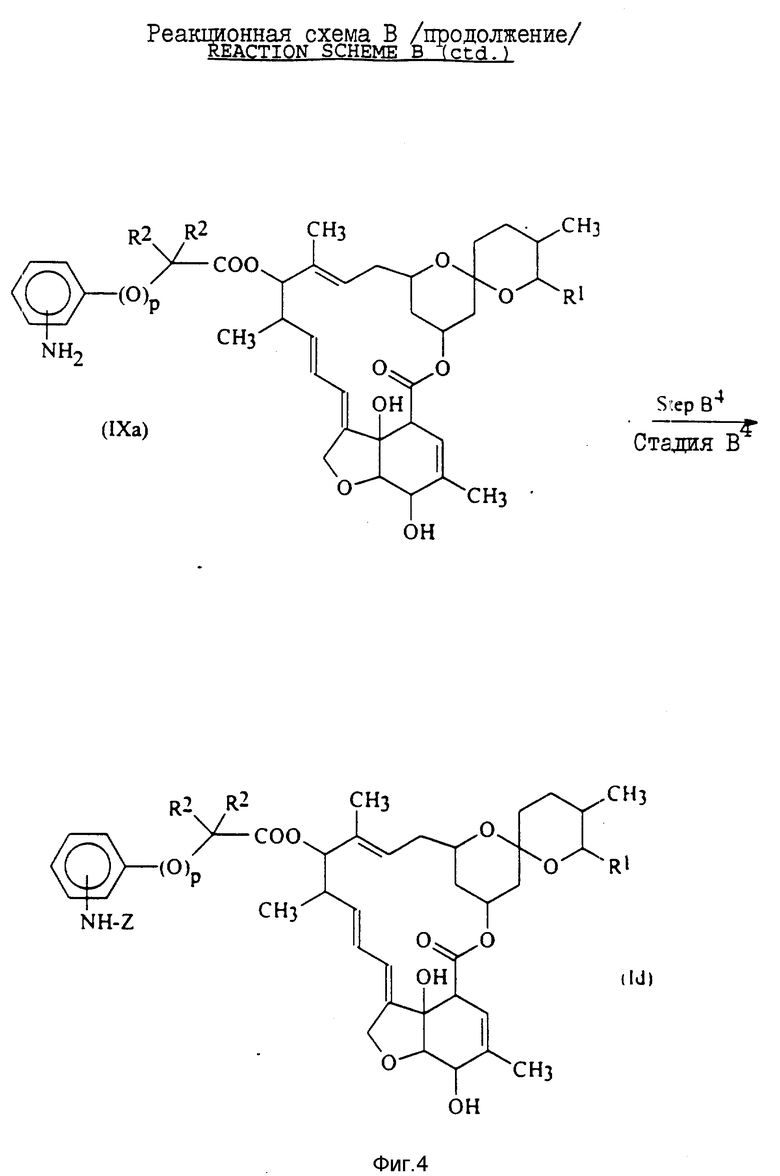
13 - Замещенные производные милбемицина, имеющие формулу I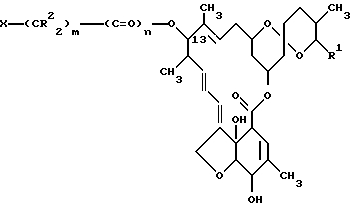
где R1 - метил, этил, изопропил или втор-бутил; R2 - водород и алкил; X - ( α - гидроксиимино- или α -алкоксиимино-замещенный)-арилметил или ( α -гидроксиимино- или α -алкоксиимино-замещенный)-гетероциклилметил, N-замещенный аминофенил или N-замещенную аминофеноксигруппу; m равен 0 или 1, и n равен 0 или 1, являются пригодными как антигельминтные, акарицидные и инсектицидные средства для сельского хозяйства и садоводства. 3 с. и 20 з.п. ф-лы, 12 табл., 7 ил.
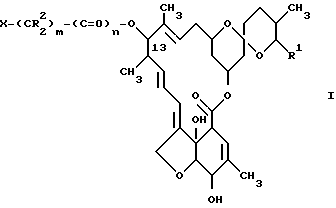
где R1 - метильная, этильная, изопропильная или втор.бутильная группа;
R2 - атом водорода или C1 - C3-алкильная группа;
X - (a) группа формулы II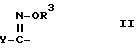
где R3 - атом водорода или C1 - C4-алкильная группа;
Y - фенильная группа или 5 - 6-членная гетероциклильная группа с одним или двумя гетероатомами в кольце, выбранными из азота, кислорода или серы, причем указанные фенильная и гетероциклильная группы являются незамещенными или замещенными 1 или 2 заместителями (которые могут быть одинаковыми или разными), выбранными из ниже перечисленных заместителей А;
или X - (b) группа формулы III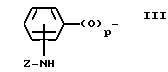
где p = 0 или 1;
Z - C2 - C3-алканоильная группа, C1 - C3-алкилсульфонильная группа, C2 - C5-алкоксикарбонильная группа, C2 - C7-аминоалканоильная группа, (причем аминофрагмент упомянутой аминоалканоильной группы замещен 1 или 2 заместителями, которые могут быть одинаковыми или разными и которые выбирают из перечисленных ниже заместителей B, алканоильный фрагмент упомянутой аминоалканоильной группы не замещен или замещен фенильной группой или C1 - C3-алкилтиогруппой), (насыщенный 5- или 6-членный гетероциклил)карбонильная группа, содержащая в кольце атом азота, или содержащая в кольце атомы азота и серы, в которой упомянутый атом азота кольца может быть незамещенным либо замещенным C2 - C5-алкоксикарбонилом, и в которой карбонильная группа присоединена к атому иному, чем упомянутый атом азота кольца, (5- или 6-членный лактам)карбонильная группа, в которой карбонильная группа присоединена к атому иному, чем атом азота лактама, α-алкоксиимино- α-гетероциклилацетоксигруппа, в которой алкоксильный фрагмент содержит от 1 до 3 атомов углерода и гетероциклильный фрагмент является 5- или 6-членной ароматической гетероциклильной группой, содержащей один или два кольцевых гетероатома, выбираемых из азота или серы, которые могут быть незамещены или замещены C2 - C5-алкоксикарбониламиногруппой, или C2 - C3-галоалканоиламиногруппой, 2 до 3 атомов углерода;
к числу заместителей А относятся атом галогена, нитрогруппа, гидроксильная группа, C1 - C4-алкоксигруппа, C7 - C1 1-аралкилоксигруппа, аминогруппа, C1 - C4-алканоиламиногруппа, C2 - C4-галогеналканоиламиногруппа, C1 - C3-алкилсульфониламиногруппа, C2 - C5-алкоксикарбониламиногруппа, C3 - C5-галогеналкоксикарбониламиногруппа, C2 - C7-аминоалканоиламиногруппа, в которой аминогруппа в аминоалканоильном фрагменте может не содержать заместителей или содержать один или два заместителя (которые могут быть одинаковыми или разными), выбираемых из алкоксикарбонильных групп, имеющих от 2 до 5 атомов углерода и алканоильных групп, имеющих от 2 до 3 атомов углерода, и (насыщенный 5- или 6-членный гетероциклил)карбониламиногруппа, содержащая в кольце атом азота, в которой атом азота может быть незамещен или быть замещен C2 - C5-алкоксикарбонильной группой, и в которой карбониламиногруппа присоединена к атому иному, чем упомянутый атом азота кольца;
к заместителям B относятся C1 - C3-алкильная группа, C2 - C3-алканоильная группа, C2 - C5-алкоксикарбонильная группа, C7 - C1 1-фенилкарбонильная группа, C8 - C1 0-аралкилоксикарбонильная группа, алкоксикарбониламиноалканоильная группа, содержащая от 1 до 4 атомов углерода в своей алкоксильной части и 2 - 3 атома углерода в алканоильной части, и алкоксикарбониламинофенилкарбонильная группа, содержащая от 1 до 4 атомов углерода в алкоксильной части;
m = 0 или 1;
n = 0 или 1;
при условии, что когда X - группа формулы II, R2 - атом водорода, и m и n - оба не могут быть равными нулю,
при условии, что когда X - группа формулы III, R2 - C1 - C3-алкильная группа, и m и n - оба равны 1.
13-(α-метоксииминофенилацетокси)милбемицин А4 (изомер А),
13-(α-метоксииминофенилацетокси)милбемицин А4 (изомер B),
13-[2-метоксиимино-2-(4-ацетиламиноацетиламинофенил)-этокси] -милбемицин А4,
13-[α-метоксиимино-(4-метансульфониламинофенил)ацетокси]-милбемицин А4,
13-[α-метоксиимино-(4-ацетиламиноацетиламинофенил)-ацетокси] -милбемицин А4,
13-[α-метоксиимино-(4-метоксикарбониламиноацетиламинофенил)-ацетокси] -милбемицин А3,
13-[α-метоксиимино-(4-метоксикарбониламиноацетиламинофенил)-ацетокси] -милбемицин А4,
13-[2-(4-метоксикарбониламиноацетиламинофенил)-2-метилпропионилокси] -милбемицин А3,
13-[2-(4-метоксикарбониламиноацетиламинофенил)-2-метилпропионилокси] -милбемицин А4,
13-[2-(4-бензоиламиноацетиламинофенил)-2-метилпропионилокси] -милбемицин А4,
13-[2-(4-(N-метил)метоксикарбониламиноацетиламинофенил) -2-метилпропионилокси]-милбемицин А4,
13-[2-[4-{ 2-(метоксикарбониламино)пропиониламино}-фенил]-2-метилпропионилокси]-милбемицин А4,
13-[2-[4-{ 2-(метоксикарбониламино)-2-метилпропиониламино} -фенил]-2-метилпропионилокси] -милбемицин А4 и
13-[2-[4-[(1-метоксикарбонилпирролидин)-2-карбониламино] -фенил] -2-метилпропионилокси]-милбемицин А4.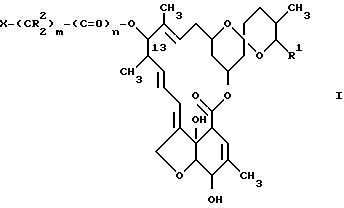
где R1 - метильная, этильная, изопропильная или втор.бутильная группа;
R2 - атом водорода или C1 - C3-алкильная группа;
X - а) группа формулы II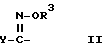
где R3 - атом водорода или C1 - C4-алкильная группа;
Y - фенильная группа или 5 - 6-членная гетероциклильная группа с одним или двумя гетероатомами в кольце, выбранными из азота, кислорода или серы, причем указанные фенильная и гетероциклильная группы являются незамещенными или замещены 1 или 2 заместителями (которые могут быть одинаковыми или разными), выбранными из ниже перечисленных заместителей А;
или X - b) группа формулы III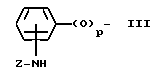
где p = 0 или 1;
Z - C2 - C3-алканоильная группа, C1 - C3-алкилсульфонильная группа, C2 - C5-алкоксикарбонильная группа, C2 - C7-аминоалканоильная группа, (причем аминочасть упомянутой аминоалканоильной группы является замещенной 1 или 2 заместителями, которые могут быть одинаковыми или разными и которые выбирают из перечисленных ниже заместителей B, и алканоильная часть упомянутой аминоалканоильной группы является незамещенной или замещена фенильной группой или алкилтиогруппой, содержащей от 1 до 3 атомов углерода), (насыщенный 5- или 6-членный гетероциклил)карбонильная группа, содержащая в кольце атом азота, причем атом азота кольца может быть незамещен либо замещен C2 - C5-алкоксикарбонилом, и в которой карбонильная группа присоединена к атому иному, чем упомянутый атом азота кольца, (5- или 6-членную лактам)карбонильная группа, в которой карбонильная группа присоединена к атому иному, чем атом азота лактама, α-алкоксиимино-α-гетероциклилацетоксигруппа, в которой алкоксильная часть содержит от 1 до 3 атомов углерода, и гетероциклильная часть является 5- или 6-членной ароматической гетероциклической группой, содержащей один или два кольцевых гетероатома, выбранных из азота или серы, которые могут быть не замещены или замещены C2 - C5-алкоксикарбониламиногруппой,
к числу заместителей А относятся атом галогена, нитрогруппа, гидроксильная группа, C1 - C4-алкоксигруппа, C7 - C1 1-аралкилоксигруппа, аминогруппа, C1 - C4-алканоиламиногруппа, C1 - C3-алкилсульфониламино группа, C2 - C7-аминоалканоиламиногруппа, в которой аминогруппа в аминоалканоильном фрагменте может не содержать заместителей или содержать один или два заместителя (которые могут быть одинаковыми или разными), выбираемых их алкоксикарбонильных групп, имеющих от 2 до 5 атомов углерода и алканоильных групп, имеющих от 2 до 3 атомов углерода, и (насыщенный 5- или 6-членный гетероциклил)карбониламиногруппа, содержащая в кольце атом азота, в которой упомянутый атом азота может быть незамещен или быть замещен C2 - C5-алкоксикарбонильной группой и в которой карбониламиногруппа присоединена к атому иному, чем упомянутый атом азота кольца;
к заместителям B относятся C1 - C3-алкильная группа, C2 - C3-алканоильная группа, C2 - C5-алкоксикарбонильная группа, C7 - C1 1-фенилкарбонильная группа, C8 - C1 0-аралкилоксикарбонильная группа, алкоксикарбониламиноалканоильная группа, содержащая от 1 до 4 атомов углерода в своей алкоксильной части и от 2 до 3 атомов углерода в алканоильной части, и алкоксикарбониламинофенилкарбонильная группа, содержащая от 1 до 4 атомов углерода в алкоксильной части, m = 0 или 1 и n = 0 или 1;
при условии, что когда X - группа упомянутой формулы II, R2 - атом водорода и m и n - оба не равны нулю;
при условии, что когда X - группа упомянутой формулы III, R2 - C1 - C3-алкильная группа, m и n - оба равны 1,
в эффективном количестве.
Приоритет по пунктам:
01.04.94 - по п.2;
17.11.94 - по п.3;
25.01.95 - по п.4.
| US, патент, 4346171, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, патент, 0444964, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, патент, 0448243, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-04-27—Публикация
1995-03-31—Подача