Изобретение относится к ряду новых производных бифенила, которые имеют способность ингибировать действие ангиотензина П (сокращенно АП) и которые можно использовать для лечения и профилактики гипертонии и сердечных заболеваний. Изобретение также обеспечивает методы и препараты, использующие эти новые соединения и способы их получения.
Известно, что система ренин-ангиотензин обеспечивает один из важных механизмов гомеостаза давления крови в живущих животных. Эта система активируется, если давление крови снижается или падает концентрация ионов натрия в жидкостях организма. В результате фермент ренин и ангиотензин - превращающий фермент (сокращенно АПФ) активируются и действуют на ангиотензиноген, который сначала разлагается ренином с образованием ангиотензина (сокращенно АI). АI затем превращается АПФ в АП. Так как АП вызывает сильное сокращение кровеносных сосудов и ускоряет секрецию альдостерона (гормона, который облегчает накопление жидкостей организма и ионов натрия), то активация системы приводит к повышению давления крови. Ингибиторы или подавители системы ренин-ангиотензин, такие как ингибиторы ренина, ингибиторы АПФ и антагонисты АП, расширяют кровеносные сосуды, вызывают снижение давления крови и улучшают функцию кровообращения, которая является основой для использования этих средств при лечении сердечных заболеваний.
В настоящее время клинически используются только ингибиторы АПФ, хотя интенсивно исследуются для этого использования ингибиторы ренина и антагонисты АП. Из них некоторые антагонисты АП пептидного типа, такие как Саралазин, известны много лет, тогда как некоторые антагонисты непептидного типа открыты недавно (например, предложенные в европейских патентах N 28833, 28834, 245637, 253310 и 323841 и в японских заявках N Sho 57-98270 и Hei 3-63264). Большинство из найденных антагонистов АП, имеющих сравнительно сильную активность, имеет в молекуле группы (21-карбоксибифенил-4-ил)метил или (21-(тетразол-5-ил)-бифенил-4-ил)метил, например, как предложено в европейских патентах N 253310 и 324377 и в японских патентах N Hei 3-58942, Hei 3-63264 и Hei 3-95181.
Ближайшим предшественником считается европейский патент N 545912, который описывает ряд производных 1-бифенил-метилимидазола, обладающих превосходной активностью антагонистов АП, но которые отличаются от соединений изобретения в некоторых отношениях, главным образом в природе заместителей на бензольном кольце бифенила, не связанном с метилимидазолом.
Однако активность этих предшественников еще недостаточна и, таким образом, для терапевтического использования нужны антагонисты АП с более сильной активностью.
Обнаружен ряд производных бифенилилметила с превосходной активностью антагонистов рецепторов АП, которые полезны в качестве антигипертонических лекарственных средств и для терапии и профилактики сердечных заболеваний.
Цель изобретения - обеспечить ряд новых производных бифенилилметила.
Дополнительная цель изобретения - обеспечить такие соединения, имеющие активность ингибиторов АП.
Другие цели и преимущества изобретения станут ясны в процессе изложения описания.
Таким образом, изобретение предлагает соединения формулы I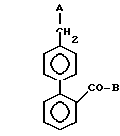
где A - группа формулы IIa, IIb или IIc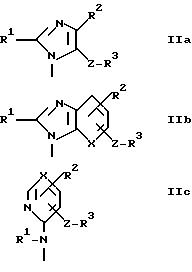
R1 - алкил, имеющий 1 - 6 атомов углерода, алкенил, имеющий 2 - 6 атома углерода, циклоалкил, имеющий 3 - 8 атомов углерода, или группа формулы R4 - Y - R5-, где R4 - водород, алкил, имеющий 1 - 6 атомов углерода или циклоалкил, имеющий 3 - 8 атомов углерода;
R5 - простая связь или алкилен, имеющий 1 - 4 атома углерода, и
Y - атом кислорода, атом серы или иминогруппа  ;
;
R2 - водород, галоген, незамещенный алкил, имеющий 1 - 6 атомов углерода, незамещенный алкенил, имеющий 2 - 6 атомов углерода незамещенный циклоалкил, имеющий 3 - 8 атомов углерода, гидроксигруппа, аминогруппа, алкиламиногруппа, имеющая 1 - 6 атомов углерода, диалкиламиногруппа, в которой каждый алкил имеет 1 - 6 атомов углерода, формил, алкилкарбонил, имеющий 2 - 7 атомов углерода, алкоксигруппа, имеющая 1 - 6 атомов углерода, алкилтиогруппа, имеющая 1 - 6 атомов углерода, цианогруппа, нитрогруппа, замещенный алкил, который имеет 1 - 6 атомов углерода и который замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из заместителей α, определенных ниже, замещенный алкенил, который имеет 2 - 6 атомов углерода и который замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из заместителей α, определенных ниже, или замещенный циклоалкил, который имеет 3 - 8 атомов углерода и который замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из заместителей α, определенных ниже;
R3 - водород, алкил, имеющий 1 - 6 атомов углерода, карбоксигруппа, защищенная карбоксигруппа, карбамоил или тетразол-5-ил;
X - группа формулы -CH=, -N= или C(COOR6)=, где R6 - водород или защитный радикал для карбоксигруппы;
Z - простая связь, алкилен, имеющий 1 - 4 атома углерода, или винилен;
B - карбоксигруппа или тетразол-5-ил, заместители выбирают из группы, состоящей из галогена, гидроксигруппы, аминогруппы, алкиламиногруппы, имеющей 1 - 6 атомов углерода, диалкиламиногруппы, в которой каждый алкил имеет 1 - 6 атомов углерода, формила, алкилкарбонила с 2 - 7 атомами углерода, алкоксигруппы с 1 - 6 атомами углерода, алкилтиогруппы с 1 - 6 атомами углерода, цианогруппы и нитрогруппы
и их фармацевтически приемлемые соли и сложные эфиры.
Изобретение также обеспечивает фармацевтический препарат для лечения или профилактики гипертонии или сердечно-сосудистых заболеваний, который содержит эффективное количество антигипертензивного средства в смеси с фармацевтически приемлемым носителем или разбавителем, в котором антигипертензивное средство выбирают из группы, состоящей из соединений формулы I и их фармацевтически приемлемых солей и сложных эфиров.
Далее изобретение обеспечивает способ лечения или профилактики гипертонии или сердечно-сосудистых заболеваний у млекопитающих, например человека, который заключается в введении эффективного количества антигипертензивного средства млекопитающему, в котором антигипертензивное средство выбирают из группы, состоящей из соединений формулы I и их фармацевтически приемлемых солей и сложных эфиров.
Изобретение также обеспечивает способы получения соединений формулы I и их фармацевтически приемлемых солей и сложных эфиров, которые детально описаны ниже.
Если R1, R2, R3 или R4 - алкил, то он может быть нормальным или разветвленным, имеющим 1-6 атомов углерода, и примеры включают метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, изобутил, пентил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, гексил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 3,3-диметилбутил и 2-этилбутил. Предпочтительно R1 - алкил с 2-5 атомами углерода, особенно этил, пропил или бутил; R2 и R3 - метил, этил, изопропил, трет-бутил, изобутил или 3,3-диметилбутил; R4 - алкил с 1-4 атомами углерода, особенно метил или этил.
Если R2 или заместитель α - алкиламиногруппа, диалуиламиногруппа, алкилкарбонил, алкоксигруппа, алкилтиогруппа или замещенный алкил, причем алкил может быть любым из тех алкилов с 1-6 атомами углерода, которые приведены выше для R1, и являются предпочтительно группами с 1-4 атомами углерода. Метил и этил особенно предпочтительны.
Специфические примеры таких моно- и диалкиламиногрупп включают метиламино-, этиламино-, пропиламино-, изопропиламино-, бутиламино-, изобутиламино-, втор-бутиламино-, трет-бутиламино-, пентиламино-, гексиламино-, диметиламино-, диэтиламино-, дипропиламино-, диизопропиламино-, дибутиламино-, диизобутиламино-, ди-трет-бутиламино-, N-этил-N-метиламино-, N-метил-N-пропиламино-, N-этил-N-пропиламино-, N-метил-N-изопропиламино-, N-метил-N-бутиламино- и N-метил-N-трет-бутиламиногруппа.
Специфические примеры таких алкилкарбонильных групп с 2-7 атомами углерода включают ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил и гептаноил, из которых ацетил и пропионил предпочтительны.
Специфические примеры таких алкоксигрупп с 1-6 атомами углерода включают метокси-, этокси-, пропокси-, изопропокси-, бутокси-, втор-бутокси-, трет-бутокси-, изобутокси-, пентилокси-, 2-метилбутокси-, 3-метилбутокси-, 2,2-диметилпропокси-, гексилокси-, 2-метилпентиокси-, 3-метилпентилокси-, 4-метиленпентилокси-, 3,3-диметилбутокси- и 2-этилбутоксигруппу, из которых метокси- и этоксигруппа предпочтительны.
Специфические примеры таких алкилтиогрупп с 1-6 атомами углерода включают метилтио-, этилтио-, пропилтио-, изопропилтио-, бутилтио-, втор-бутилтио-, трет-бутилтио-, изобутилтио-, пентилтио-, 2-метилбутилтио-, 3-метилбутилтио-, 2,2-диметилпропилтио-, гексилтио-, 2-метилпентилтио-, 3-метилпентилтио-, 4-метилпентилтио-, 3,3-диметилбутилтио- и 2-этилбутилтиогруппу.
Если R2 - замещенный алкил, то сам алкил имеет 1-6 атомов углерода и замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из заместителей α, определенных выше. Нет особенных ограничений на число таких заместителей за исключением налагаемых числом способных замещаться атомов углерода и возможно стерическими ограничениями; предпочтительно число заместителей зависит от природы заместителя. Если заместитель галоген, то их число предпочтительно 1-5 (1-3 в случае метила), более предпочтительно 2-5 (2 или 3 в случае метила). В случае других заместителей единственный заместитель предпочтителен. Если имеются два или более заместителей, то они могут быть одинаковыми или различными. Примеры таких заместителей включают: галогены, такие как фтор, хлор, бром и иод, из которых фтор и хлор предпочтительны, фтор наиболее предпочтителен; гидроксигруппы; аминогруппы; алкиламино- и диалкиламиногруппы, такие как приведенные для R2; формил; алкилкарбонил, алкокси- и алкилтиогруппы, такие как приведенные для R2; цианогруппы и нитрогруппы. Примеры таких замещенных алкилов включают трифторметил, пентафторэтил, гептафторпропил, фторпропил, гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидрокси-1-метилэтил, 1-гидроксипропил, 1-гидрокси-1-метилпропил, 1-гидрокси-2-метилпропил, 1-этил-1-гидроксипропил, 1-гидрокси-2,2-диметилпропил, 2-этил-1-гидроксибутил, 2-этил-1-гидроксипентил, аминометил, 1-аминоэтил, 2-аминоэтил, 1-амино-1-метилэтил, 1-аминопропил, 1-амино-1-метилпропил, 1-амино-2-метилпропил, 1-амино-1-этилпропил, N-метиламинометил, N-этиламинометил, N, N-диметиламинометил, N, N-диэтиламинометил, формилметил, формилэтил, ацетилметил, ацетилэтил, пропионилметил, бутирилметил, изобутирилметил, метоксиметил, 1-метоксиэтил, 2-метоксиэтил, 1-метокси-1-метилэтил, 1-метоксипропил, 1-метокси-1-метилпропил, 1-метокси-2-метилпропил, 1-этил-1-метоксипропил, 1-метокси-2,2-диметилпропил, 1-метокси-2-этилбутил, метилтиометил, этилтиометил, 1-метилтиоэтил, цианометил, 1-цианоэтил, 2-цианоэтил, нитрометил, 1-нитроэтил и 2-нитроэтил, из которых предпочтительны трифторметил, пентафторэтил, гидроксиметил, 1-гидроксиэтил, 1-гидрокси-1-метилэтил, 1-гидроксипропил, 1-гидрокси-2-метилпропил, 1-гидрокси-2,2-диметилпропил, аминометил, N-метиламинометил, N,N - диметиламинометил, N, N-диэтиламинометил, ацетилметил, пропионилметил, метоксиметил и 1-метокси-1-метилэтил.
Если R1 или R2 - незамещенный алкенил или R2 - замещенный алкенил, то это может быть любой алкенил с 2-6 атомами углерода и может быть нормальным или разветвленным. Примеры таких групп включают винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 2-метил-1-пропенил, 1-пентенил, 2-пентенил, 3-метил-2-бутенил и 1-гексенил, из которых предпочтительны группы с 2-4 атомами углерода и наиболее предпочтительны группы с 3-4 атомами углерода. В случае R1 предпочтителен алкенил с 3 или 4 атомами углерода, особенно 1-пропенил и 1-бутенил. В случае R2 предпочительны алкенил c 3-4 атомами углерода, особенно изопропенил и 2-метил-1-пропенил.
Если R2 - замещенный алкенил, то заместитель или заместители могут быть выбраны из группы, состоящей из заместителей, определенных и приведенных выше. Как раньше нет особенных ограничений на число таких заместителей за исключением накладываемых числом способных замещаться атомов углерода и возможно стерических ограничений и предпочтительно число заместителей зависит от природы заместителя. В случае, если заместитель - галоген, то предпочтительное их число составляет 1-3. В случае других заместителей единственный заместитель предпочтителен. Если имеются два или более заместителей, то они могут быть одинаковыми или различными. Примеры таких замещенных групп включают 2,2-дифторвинил, 2,2-дихлорвинил, 3-гидрокси-1-пропенил, 3-гидрокси-2-метил-1-пропенил, 3-амино-1-пропенил, 3-амино-2-метил-1-пропенил, 3-метиламино-1-пропенил, 3-метиламино-2-метил-1-пропенил, 3-(N,N-диметиламино)-1-пропенил, 3-(N,N-диметиламино)-2-метил-1-пропенил, 3-формил-1-пропенил, 3-формил-2-метил-1-пропенил, 2-ацетилвинил, 2-пропионилвинил, 3-метокси-1-пропенил, 3-метокси-2-метил-1-пропенил, 3-метилтио-1-пропенил, 3-метилтио-2-метил-1-пропенил, 3-циано-1-пропенил, 3-циано-2-метил-1-пропенил, 3-нитро-1-пропенил и 2-метил-3-нитро-1-пропенил, из которых мы предпочитаем 2,2-дифторвинил, 2,2-дихлорвинил, 3-гидрокси-1-пропенил, 3-гидрокси-2-метил-1-пропенил, 3-метокси-1-пропенил и 3-метокси-2-метил-1-пропенил.
Если R1, R2 или R4 - циклоалкил или R2 - замещенный циклоалкил, то он может иметь 3-8 атомов углерода, предпочтительно 3-6 атомов углерода. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил, из которых циклопропил, циклобутил, циклопенил и циклогексил предпочтительны. В случае R1 и R4 предпочтителен циклопропил. В случае R2 циклопентил и циклогексил предпочтительны.
Если R2 - замещенный циклоалкил, то это может быть любой циклоалкил, приведенный выше, предпочтительно имеющий 3 - 6 атомов углерода в кольце, возможно замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из заместителей α, определенных и приведенных выше. Как ранее нет особых ограничений на число таких заместителей за исключением накладываемых числом способных замещаться атомов углерода и возможно пространственными ограничениями предпочтительное число заместителей зависит от природы заместителя. В случае, если заместитель - галоген, предпочтительное число составляет 1 - 3. В случае других заместителей предпочтителен единственный заместитель. Если имеются два и более заместителей, то они могут быть одинаковыми или различными. Примеры таких замещенных групп включают 1-хлорциклопентил, 1-хлорциклогексил, 1-гидроксициклопропил, 1-гидроксициклобутил, 1-гидроксициклопентил, 3-гидроксициклопентил, 1-гидроксициклогексил, 4-гидроксициклогексил, 1-гидроксициклогептил, 1-аминоциклопентил, 1-аминоциклогексил, 1-метиламиноциклопентил, 1-метиламиноциклогексил, 1-(N, N-диметиламино)циклопентил, 1-(N,N-диметиламино)циклогексил, 1-формилциклопентил, 1-формилциклогексил, 1-ацетилциклопентил, 1-ацетилциклогексил, 1-метоксициклопропил, 1-метоксициклобутил, 1-метоксициклопентил, 1-метоксициклогексил, 1-метилтиоциклопентил, 1-метилтиоциклогексил, 1-цианоциклопентил, 1-цианоциклогексил, 1-нитроциклопентил и 1-нитроциклогексил, из которых предпочтительны 1-гидроксициклопентил, 1-гидроксициклогексил, 1-метоксициклопентил и 1-метоксициклогексил.
Если R9 или заместитель α - галоген, то он может быть, например, фтор, хлор, бром или иод, предпочтительно фтор, хлор или бром, наиболее предпочтительно фтор или хлор.
Если R5 или Z - алкилен, то он может быть нормальной или разветвленной группой с 1 - 4, предпочтительно с 1 - 2 атомами углерода. Если "свободные" валентности находятся на одном и том же атоме углерода, то такие группы иногда называют "алкилиден", хотя группы, где "свободные" валентности присутствуют на одном и том же атоме углерода и группы, где "свободные" валентности присутствуют на разных атомах углерода, в целом называют "алиилен", как более принято. Примеры таких групп включают метилен, этилен, триметилен, тетраметилен, этилиден, пропилиден, бутилиден и изобутилиден, предпочтительно метилен и этилен, наиболее предпочтительно метилен.
Если R3 или B - защищенная карбоксигруппа, или R6 - защитный радикал для карбоксигруппы, то защитный радикал для карбоксигруппы может быть любым радикалом из тех, которые широко известны в области синтетической органической химии, или они могут быть остатком сложного эфира, способного превращаться в карбоксигруппу в живом организме. Примеры таких защитных групп включают:
алкилы с 1 - 6 атомами углерода, такие как приведены выше для R1, особенно метил, этил и трет-бутил;
галогеналкилы с 1 - 6 атомами углерода, предпочтительно 1 - 4 атомами углерода, такие как трифторметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 2-фторэтил, 2-хлорэтил, 2-иодэтил, 3-хлорпропил, 4-фторбутил и 6-иодгексил, предпочтительно 2,2,2-трихлорэтил и 2-хлорэтил;
гидроксиалкилы с 1 - 6, предпочтительно 2 - 4 атомами углерода, имеющие одну или больше, предпочтительно 1 или 2, гидроксигруппы, такие как гидроксиметил, 2-гидроксиэтил, 2,3-дигидроксипропил, 3-гидроксипропил, 3,4-дигидроксибутил, 4-гидроксибутил, 5-гидроксипентил и 6-гидроксигексил, предпочтительно 2-гидроксиэтил;
алкоксиалкил и алкоксиалкоксиалкил, в которых каждая алкоксигруппа и каждый алкил содержат 1 - 6, предпочтительно 1 - 4, наиболее предпочтительно 1 или 2 атома углерода, такие как метоксиметил, 2-метоксиэтил, 2-этоксиэтил и 2-метоксиэтоксиметил, предпочтительно метоксиметил;
фенацил;
алкоксикарбонилалкил, в котором алкоксигруппа и алкил имеют 1 - 6, предпочтительно 1 - 4, наиболее предпочтительно 1 - 2 атома углерода, такой как метоксикарбонилметил;
цианоалкил, в котором алкил имеет 1 - 6, предпочтительно 1 - 4, наиболее предпочтительно 1 - 2 атома углерода, такой как цианометил и 2-цианоэтил;
алкилтиометил, в котором алкил имеет 1 - 6, предпочтительно 1 - 4, более предпочтительно 1 или 2 атома углерода, такие как метилтиометил и этилтиометил;
арилтиометил, в котором арил имеет 6 - 10, предпочтительно 6 или 10 атомов углерода, такие как фенилтиометил и нафтилтиометил;
алкилсульфонилалкил, в котором каждый алкил имеет 1 - 6, предпочтительно 1 - 4, более предпочтительно 1 или 2 атома углерода и в котором алкил алкилсульфонила может быть незамещен или замещен одним или больше, предпочтительно 1 - 3 атомов галогена, такие как 2-метансульфонилэтил и 2-трифторметансульфонилэтил;
арилсульфонилалкил, в котором арил имеет 6 - 10, предпочтительно 6 или 10 атомов углерода в кольце и алкил содержит 1 - 6, предпочтительно 1 - 4, более предпочтительно 1 или 2 атомов углерода такие как 2-бензолсульфонилэтил и 2-толуолсульфонилэтил;
аралкил, в котором алкил замещен одним или больше, предпочтительно 1 - 3, более предпочтительно 1 или 2 арилами с 6 - 10, предпочтительно 6 или 10 атомами углерода и могут быть замещены одним или больше алкилами, алкоксигруппами или галогенами, причем алкильная часть содержит 1 - 6, предпочтительно 1 - 4, более предпочтительно 1 или 2 атома углерода, а сам аралкил имеет 7 - 13 атомов углерода в целом в арильной и алкильной частях, такие как бензил, фенэтил, 3-фенилпропил, 4-фенилбутил, дифенилметил и нафтилметил;
арил с 6 - 10 атомами углерода, такие как фенил и нафтил;
алканоилоксиалкил, в котором алканоил имеет 1 - 6, предпочтительно 2 - 5 атомов углерода и алкил имеет 1 - 6, предпочтительно 1 - 4, более предпочтительно 1 или 2 атома углерода, такой как формилоксиметил, ацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил, валерилоксиметил, изовалерилоксиметил, гексаноилоксиметил, 1-формилоксиэтил, 1-ацетоксиэтил, 1-пропионилокиэтил, 1-бутирилоксиэтил, 1-пивалоилоксиэтил, 1-валерилоксиэтил, 1-изовалерилоксиэтил, 1-гексаноилоксиэтил, 2-формилоксиэтил, 2-ацетоксиэтил, 2-пропионилоксиэтил, 2-бутирилоксиэтил, 2-пивалоилоксиэтил, 2-валерилоксиэтил, 2-изовалерилоксиэтил, 2-гексаноилоксиэтил, 1-формилоксипропил, 1-ацетоксипропил, 1-пропионилоксипропил, 1-бутирилоксипропил, 1-пивалоилоксипропил, 1-валерилоксипропил, 1-изовалерилоксипропил, 1-гексаноилоксипропил, 1-ацетоксибутил, 1-пропионилоксибутил, 1-бутирилоксибутил, 1-пивалоилоксибутил, 1-ацетоксипентил, 1-пропионилоксипентил, 1-бутиририлоксипентил, 1-пивалоилоксипентил и 1-пивалоилоксигексил, из которых предпочтительны формилоксиметил, ацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил, 1-формилоксиэтил, 1-ацетоксиэтил, 1-пропионилоксиэтил, 1-бутирилоксиэтил и 1-пивалоилоксиэтил, более предпочтительно ацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил, 1-ацетоксиэтил, 1-пропионилоксиэтил, 1-бутирилоксиэтил и 1-пивалоилоксиэтил, и наиболее предпочтительно пивалоилоксиметил и 1-пивалоилоксиэтил;
циклоалканкарбонилоксиалкил, в котором циклоалкан имеет 5 - 6 атомов углерода и алкил имеет 1 - 6, предпочтительно 1 - 4, более предпочтительно 1 или 2 атома углерода, такой как циклопентанкарбонилоксиметил, циклогексанкарбонилоксиметил, 1-циклопентанкарбонилоксиэтил, 1-циклогексанкарбонилоксиэтил, 1-циклопентанкарбонилоксипропил, 1-циклогексанкарбонилоксипропил, 1-циклопентанкарбонилоксибутил и 1-циклогексанкарбонилоксибутил, из которых предпочтительны циклопентанкарбонилоксиметил, циклогексанкарбонилоксиметил, 1-циклопентанкарбонилоксиэтил и 1-циклогексанкарбонилоксиэтил;
алкоксикарбонилоксиалкил, в которой алкоксигруппа и алкил имеют 1-6, предпочтительно 1-5, более предпочтительно 1 или 2 атома углерода для алкила и предпочтительно 1-4 атома углерода для алкоксигруппы, такой как метоксикарбонилоксиметил, этоксикарбонилоксиметил, пропоксикарбонилоксиметил, бутоксикарбонилоксиметил, изопропоксикарбонилоксиметил, изобутоксикарбонилоксиметил, пентилоксикарбонилоксиметил, гексилоксикарбонилоксиметил, 1-метоксикарбонилоксиэтил, 1-этоксикарбонилоксиэтил, 1-пропоксикарбонилоксиэтил, 1-изопропоксикарбонилоксиэтил, 1-бутоксикарбонилоксиэтил, 1-изобутоксикарбонилоксиэтил, 1-пентилоксикарбонилоксиэтил, 1-гексилоксикарбонилоксиэтил, 2-метоксикарбонилоксиэтил, 2-этоксикарбонилоксиэтил, 2-пропоксикарбонилоксиэтил, 2-изопропоксикарбонилоксиэтил, 2-бутоксикарбонилоксиэтил, 2-изобутоксикарбонилоксиэтил, 2-пентилоксикарбонилоксиэтил, 2-гексилоксикарбонилоксиэтил, 1-метоксикарбонилоксипропил, 1-этоксикарбонилоксипропил, 1-пропоксикарбонилоксипропил, 1-изопропоксикарбонилоксипропил, 1-бутоксикарбонилоксипропил, 1-изобутоксикарборнилоксипропил, 1-пентилоксикарбонилоксипропил, 1-гексилоксикарбонилоксипропил, 1-метоксикарбонилоксибутил, 1-этоксикарбонилоксибутил, 1-пропоксикарбонилоксибутил, 1-изопропоксикарбонилоксибутил, 1-бутоксикарбонилоксибутил, 1-изобутоксикарбонилоксибутил, 1-метоксикарбонилоксипентил, 1-этоксикарбонилоксипентил, 1-метоксикарбонилоксигексил и 1-этоксикарбонилоксигексил, из которых предпочтительны метоксикарбонилоксиметил, этоксикарбонилоксиметил, пропоксикарбонилоксиметил, изопропоксикарбонилоксиметил, бутоксикарбонилоксиметил, изобутоксикарбонилоксиметил, 1-метоксикарбонилоксиэтил, 1-этоксикарбонилоксиэтил, 1-пропоксикарбонилоксиэтил, 1-изопропоксикарбонилоксиэтил, 1-бутоксикарбонилоксиэтил, 1-изобутоксикарбонилоксиэтил, 1-метоксикарбонилоксипропил, 1-этоксикарбонилоксипропил, 1-пропоксикарбонилоксипропил, 1-изопропоксикарбонилоксипропил, 1-бутоксикарбонилоксипропил, 1-изобутоксикарбонилоксипропил, 1-метоксикарбонилоксибутил, 1-этоксикарбонилоксибутил, 1-пропоксикарбонилоксибутил, 1-изопропоксикарбонилоксибутил, 1-бутоксикарбонилоксибутил и 1-изобутоксикарбонилоксибутил, более предпочтительно метоксикарбонилоксиметил, этоксикарбонилоксиметил, пропоксикарбонилоксиметил, изопропоксикарбонилоксиметил, бутоксикарбонилоксиметил, изобутоксикарбонилоксиметил, 1-метоксикарбонилоксиэтил, 1-этоксикарбонилоксиэтил, 1-пропоксикарбонилоксиэтил, 1-изопропоксикарбонилоксиэтил, 1-бутоксикарбонилоксиэтил и 1-изобутоксикарбонилоксиэтил и наиболее предпочтительно метоксикарбонилоксиметил, этоксикарбонилоксиметил, изопропоксикарбонилоксиметил, 1-метоксикарбонилоксиэтил, 1-этоксикарбонилоксиэтил и 1-изопропоксикарбонилоксиэтил; циклоалкоксикарбонилоксиалкил, в котором циклоалкан имеет 5 или 6 атомов углерода и алкил имеет 1-6, предпочтительно 1-4, более предпочтительно 1 или 2 атома углерода, такой как циклопентилоксикарбонилоксиметил, циклогексилоксикарбонилоксиметил, 1-циклопентилоксикарбонилоксиэтил, 1-циклогексилоксикарбонилоксиэтил, 1-циклопентилоксикарбонилоксипропил, 1-циклогексилоксикарбонилоксипропил, 1-циклопентиоксикарбонилоксибутил и 1-циклогексилоксикарбонилоксибутил, из которых предпочтительны циклопентилоксикарбонилоксиметил, циклогексилоксикарбонилоксиметил, 1-циклопентилоксикарбонилоксиэтил и 1-циклогексилоксикарбонилоксиэтил;
(5-арил- или 5-алкил-2-оксо-1,3-диоксолен-4-ил)метил, в котором арил имеет 6-10, предпочтительно 6 или 10 атомов углерода и возможно замещен одним или более алкилом, алкоксигруппой или галогеном и алкил имеет 1-6, предпочтительно 1-4, более предпочтительно 1 или 2 атома углерода, такой как (5-фенил-2-оксо-1, 3-диоксолен-4-ил)метил, [5-(4-метилфенил)2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-метоксифенил)-2оксо-1,3-диоксолен-4-ил]метил, [5-(4-фторфенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-хлорфенил)-2-оксо-1,3-диоксолен-4-ил] метил, (5-метил-2-оксо-1,3-диоксолен-4-ил)метил, (5-этил-2-оксо-1,3-диоксолен-4-ил)метил, (5-пропил-2-оксо-1,3-диоксолен-4-ил)метил), (5-изопропил-2-оксо-1,3-диоксолен-4-ил)метил и (5-бутил-2-оксо-1,3-диоксолен-4-ил)метил, из которых предпочтительны (5-фенил-2-оксо-1,3-диоксолен-4-ил)метил, (5-метил-2-оксо-1,3-диоксолен-4-ил)метил и (5-этил-2-оксо-1,3-диоксолен-4-ил)метил, наиболее предпочтительно (5-метил-2-оксо-1,3-диоксолен-4-ил)метил
и фталидил.
Те из приведенных защитных групп, которые содержат арильные кольца, могут быть замещены или незамещены и, если замещены, могут содержать один или больше алкилов с 1-6 атомами углерода, алкоксигрупп с 1-6 атомами углерода или галогенов, которые приведены выше.
Предпочтительными защитными группами являются: алкилы с 1-4 атомами углерода; фенил; нафтил; бензил; бензил, имеющий по меньшей мере один заместитель, выбранный из группы, состоящей из метила, этила, метоксигруппы, этоксигруппы, фтора и хлора; дифенилметил; нафтилметил; алканоилоксиалкил, в которой алканоил имеет 1-5 атомов углерода и алкил имеет 1-4 атома углерода; циклоалканкарбонилоксиалкил, в котором циклоалкан имеет 5-6 атомов углерода и алкил имеет 1-4 атома углерода; алкоксикарбонилоксиалкил, в котором алкоксигруппа и алкил имеют 1-4 атома углерода; циклоалкоксикарбонилоксиалкил, в котором циклоалкан имеет 5 или 6 атомов углерода и алкил имеет 1-4 атома углерода; (5-фенил- или 5-алкил-2-оксо-1,3-диоксолен-4-ил)-метил, в котором алкил имеет 1-4 атома углерода, фталидил.
Более предпочтительными защитными группами являются: алкилы с 1-4 атомами углерода; бензил; алканоилоксиалкил, в котором алканоил имеет 1-5 атомов углерода и алкил имеет 1 или 2 атома углерода; циклоалканкарбонилоксиалкил, в котором циклоалкан имеет 5 или 6 атомов углерода и алкил имеет 1 или 2 атома углерода; алкоксикарбонилоксиалкил, в котором алкоксигруппа имеет 1-4 атома углерода и алкил имеет 1 или 2 атома углерода; циклоалкоксикарбонилоксиалкил, в котором циклоалкан имеет 5 или 6 атомов углерода и алкил имеет 1 или 2 атома углерода; (5-фенил- или 5-алкил-2-оксо-1,3-диоксолен-4-ил)метил, в котором алкил имеет 1 или 2 углерода; фталидил.
Еще более предпочтительными защитными группами являются: алканоилоксиалкил, в которой алканоил имеет 2-5 атомов углерода и алкил имеет 1 или 2 атома углерода; алкоксикарбонилоксиалкил, в котором алкоксигруппа имеет 1-4 атома углерода и алкил имеет 1 или 2 атома углерода; циклоалкоксикарбонилоксиалкил, в которой циклоалкан имеет 5 или 6 атомов углерода и алкил имеет 1 или 2 атома углерода; (5-метил-2-оксо-1,3-диоксолен-4-ил)метил.
Наиболее предпочтительными защитными группами являются: ацетоксиметил, пивалоилоксиметил, этоксикарбонилоксиметил, 1-(этоксикарбонилокси)этил, изопропоксикарбонилоксиметил, 1-(изопропоксикарбонилокси)этил, циклогексилоксикарбонилоксиметил, 1-(циклогексилоксикарбонилокси)этил и (5-метил-2-оксо-1,3-диоксолен-4-ил)метил.
Соединения по изобретению могут образовывать соли. Не существует особых ограничений на природу таких солей при условии, что, если они предназначены для терапевтического использования, то они должны быть фармацевтически приемлемыми, что, как хорошо известно, означает, что они являются не менее активными (или неприемлемо менее активными) или не более токсичными (или неприемлемо более токсичными), чем исходные соединения. Таким образом, так как соединения по изобретению содержат по меньшей мере одну основную группу в своей молекуле, то они могут образовывать кислотные аддиционные соли. Примеры таких кислотных аддиционных солей включают: соли с неорганическими кислотами, особенно галогенводородными кислотами (такими как фтористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота и хлористоводородная кислота), азотная кислота, угольная кислота, серная кислота или фосфорная кислота; соли с низшими алкилсульфокислотами, такими как метансульфокислота, этансульфокислота, трифторметансульфокислота или этансульфокислота; соли с арилсульфокислотами, такими как бензолсульфоксилота, или п-толуолсульфокислота; и соли органическими карбоновыми кислотами, такими как уксусная кислота, фумаровая кислота, винная кислота, щавелевая кислота, малеиновая кислота, яблочная кислота, янтарная кислота, бензойная кислота, миндальная кислота, аскорбиновая кислота, молочная кислота, глюконовая кислота или лимонная кислота. Такие кислотные аддиционные соли можно получать реакцией соединений формулы I с кислотой в обычных условиях.
Также, если соединение по изобретению является соединением, в котором R3 и/или B - карбоксигруппа или тетразол и/или X - группа формулы C(COOR6)=, где R6 - водород, то реакция такого соединения с основанием будет давать соль. Примеры таких соединений включают: соли со щелочными металлами, такими как натрий, калий или литий; соли с щелочно-земельными металлами, такими как барий или кальций; соли с другим металлом, таким как магний или алюминий; аммониевые соли; и соли с органическими основаниями, такие как соли с триэтиламином, диизопропиламином, циклогексиламином, гуанидином или дициклогексиламином.
Соединения по изобретению могут содержать один или больше асимметрических атома углерода в своих молекулах и могут таким образом образовать оптические изомеры. Хотя все изомеры, представленные здесь имеют единственную молекулярную формулу, изобретение включает как индивидуальные, выделенные изомеры, так и их смеси, включая их рацематы. Если применяют методы стереоспецифического синтеза или применяют оптически активные соединения в качестве исходных материалов, то индивидуальные изомеры можно получать непосредственно; с другой стороны, если получают смеси изомеров, то индивидуальные изомеры можно получать непосредственно; с другой стороны, если получают смеси изомеров, то индивидуальные изомеры можно получать обычными методами расщепления.
Предпочтительными классами соединений данного изобретения являются те соединения формулы I и их фармацевтически приемлемые соли и сложные эфиры, в которой:
1(I). A - группа формулы IIa, и R1 - алкил с 2-4 атомами углерода, алкенил с 3-5 атомами углерода, алкоксиалкил, в котором алкоксигруппа имеет 1-3 атома углерода и алкил имеет 1 или 2 атома углерода, алкилтиоалкил, в котором алкилтиогруппа имеет 1-3 атома углерода и алкил имеет 1 или 2 атома углерода, или алкилтиогруппа с 1-3 атомами углерода;
1(II). A - группа формулы IIa, и R2 - водород, галоген, алкил с 1-6 атомами углерода, алкенил с 3-6 атомами углерода или замещенный алкил с 1-6 атомами углерода, замещенный галогеном или гидроксигруппой;
1(III). A - группа формулы IIa, и R3 - карбоксигруппа, защищенная карбоксигруппа, карбамоил или тетразол-5-ил;
1(IV). A - группа формулы IIa, Z - связь, метилен или винилен; и в особенности те соединения, в которых A - группа формулы IIa, и R1, как определено в 1(I), R2, как определено в 1(II), R3, как определено в 1(III) и Z, как определено в 1(IV).
2(I). A - группа формулы IIb, R1 - алкил с 2-4 атомами углерода, циклопропил, алкоксиалкил, в котором алкоксигруппа имеет 1-3 атома углерода и алкил имеет 1 или 2 атома углерода, алкилтиоалкил, в котором алкилтиогруппа имеет 1-3 атома углерода и алкил имеет 1 или 2 атома углерода, алкоксигруппа с 1-3 атомами углерода или алкилтиогруппа с 1-3 атомами углерода;
2(II). A - группа формулы IIb, R2 - водород, галоген или алкил с 1-4 атомами углерода;
2(III). A - группа формулы IIb, R3 - водород, алкил с 1-4 атомами углерода, карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
2(IV). A - группа формулы IIb и X - группа формулы -CH=, группа формулы -II= или группа формулы -C(COOR6)=, в которой R6 - водород или защитный радикал для карбоксигруппы;
2(V). A - группа формулы IIb и Z - простая связь, метил или винилен;
и особенно те, в которых A - группа формулы IIb и R1, как определено в 2(I), R2, как определено в 2(II), R3, как определено в 2(III), X как определено в 2(IV) и Z, как определено в 2(V).
3(I). A - группа формулы IIc и R1 - алкил с 2-4 атомами углерода, алкоксиэтил, в котором алкоксигруппа имеет 1-3 атома углерода, или алкилтиоэтил, в котором алкилтиогруппа имеет 1-3 атома углерода;
3(II). A - группа формулы IIc и R3 - водород, галоген или алкил с 1-4 атомами углерода;
3(III). A - группа формулы IIc и R3 - водород, алкил с 1-4 атомами углерода, карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
3(IV). A - группа формулы IIc и X - группа формулы -CH= или группа формулы -N=;
3(V). A - группа формулы IIc и Z - простая связь, метилен или винилен;
и особенно те, в которых A - группа формулы IIc и R1, как определенно в 3(I), R2, как определенно в 3(II), R3, как определенно в 3(III), X, как определенно в 3(IV) и Z, как определено в 3(V).
4. Если R3 или B - защищенная карбоксигруппа, или R6 - защитный радикал для карбоксигруппы, то защитный радикал - алканоилоксиалкил, в котором алканоил имеет 2-5 атома углерода и алкил имеет 1 или 2 атома углерода, алкоксикарбонилоксиалкил, в котором алкоксигруппа имеет 1-4 атома углерода и алкил имеет 1 или 2 атома углерода, циклоалкоксикарбонилоксиалкил, в котором циклоалкан имеет 5 или 6 атомов углерода и алкил имеет 1 или 2 атома углерода, или (5-метил-2-оксо-1,3-диоксолен-4-ил)метил.
5. B - карбоксигруппа или тетразол-5-ил.
Более предпочтительными классами соединений по изобретению является те соединения формулы I и их фармацевтически приемлемые соли и сложные эфиры, в которой:
6(I). A - группа формулы IIa и R1 - этил, пропил, бутил, 1-пропенил, 1-бутенил, 2-бутенил, метоксиметил, этоксиметил, метилтиометил, этилтиометил, метилтиогруппа или этилтиогруппа;
6(II). A - группа формулы IIa и R2 - хлор, бром, метил, этил, изопропил, 1-гидроксиэтил, 1-гидрокси-1-метилэтил, 1-гидроксипропил, 1-гидрокси-1-метилпропил или 1-гидрокси-2,2-диметилпропил;
6(III). A - группа формулы IIa и R3 - карбоксигруппа, защищенная карбоксигруппа, карбамоил или тетразол-5-ил;
6(IV). A - группа формулы IIa и Z - простая связь или метилен;
и особенно те соединения, в которой A - группа формулы IIa и R1, как определено в 6(I), R2, как определено в 6(II), R3, как определено в 6(III) и Z, как определено в 6(IV).
7(I). A - группа формулы IIb и R1 - этил, пропил, циклопропил, метокси-, этокси-, пропокси-, метилтио- или этилтиогруппа.
7(II). A - группа формулы IIb и R2 - водород, фтор, хлор, метил, этил или изопропил;
7(III). A - группа формулы IIb и R3 - водород, метил, этил, карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
7(IV). A - группа формулы IIb и X - группа формулы -CH=, -N= или -C(COOR6)=, где R6 - водород или защитный радикал для карбоксигруппы;
7(V). A - группа формулы IIb и Z - простая связь или метилен;
и особенно те, в которых A - группа формулы (IIb) и R1, как определено в 7(I), R2, как определено в 7(II), R3, как определено в 7(III), X, как определено в 7(IV) и Z, как определено в 7(V).
8(I). A - группа формулы IIc и R1 - этил, пропил, бутил, 2-метоксиэтил или 2-метилтиоэтил;
8(II). A - группа формулы IIc и R2 - водород, фтор, хлор, метил, этил или изопропил;
8(III). A - группа формулы IIc и R3 - водород, метил, этил, карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
8(IV). A - группа формулы IIc и X - группа формулы -CH= или -N=;
8(V). A - группа формулы IIc и Z - простая связь или метилен;
и особенно те, в которых A - группа формулы IIc и R1, как определено в 8(I), R2, как определено в 8(II), R3, как определено в 8(III), Z, как определено в 8(IV) и Z, как определено в 8(V).
9. Если R3 или B - защищенная карбоксигруппа или R6 - защитный радикал для карбоксигруппы, то защитным радикалом является ацетоксиметил, пивалоилоксиметил, этоксикарбонилоксиметил, изопропоксикарбонилоксиметил, 1-этоксикарбонилоксиэтил, 1-изопропоксикарбонилоксиэтил, циклогексилоксикарбонилоксиметил, 1-циклогексиоксикарбонилоксиэтил или (5-метил-2-оксо-1,3-диоксолен-4-ил)метил.
Наиболее предпочтительными классами соединений по изобретению являются те соединения формулы I и их фармацевтически приемлемые соли и эфиры, в которой:
10(I). A - группа формулы IIa и R1 - этил, пропил или бутил;
10(II). A - группа формулы IIa и R2 - хлор, изопропил, изопропенил, трифторметил, пентафторэтил, 1-гидроксиэтил или 1-гидрокси-1-метилэтил и R3 - карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
10(III). A - группа формулы IIa и R3 - 1-гидрокси-2-метилпропил или 1-гидрокси-2,2-диметилпропил, и R3 - карбамоил;
10(IV). A - группа формулы IIa и Z - простая связь;
и особенно те, в которых A - группа формулы IIa и R1, как определено в 10(I), R2 и R3, как определено в 10(II) или 10(III) и Z, как определено в 10(IV).
11(I). A - группа формулы IIb и R1 - этил, пропил, циклопропил, этокси-, метилтио- или этилтиогруппа;
11(II). A - группа формулы IIb и R2 - водород или метил;
11(III). A - группа формулы IIb и R3 - водород, метил, карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
11(IV). A - группа формулы IIb и X - группа формулы -CH= , -N= или -C(COOR6)=, где R6 - водород или защитный радикал для карбоксигруппы;
11(V). A - группа формулы IIb и Z - простая связь;
и особенно те, в которых A - группа формулы IIb, и R1, как определено в 11(I), R2, как определено в 11(II), R3, как определено в 11(III), X, как определено в 11(IV) и Z, как определено в 11(V).
12(I). A - группа формулы IIc и R1 - этил, пропил, бутил, 2 - метоксиэтил или 2 - метилтиоэтил;
12(II). A - группа формулы IIc и R2 - водород или метил;
12 (III). A - группа формулы IIc и R3 - карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
12 (IV). A - группа формулы IIc, и X - группа формулы -CH=;
12(V). A - группа формулы IIc и Z - простая связь;
и особенно те, в которых А - группа формулы IIc, и R1 как определено в 12(I), R2, как определено в 12(II), R3 как определено в 12 (III), X, как определено в 12(IV) и Z, как определено в 12(V).
13. Если R3 или B - защищенная карбоксигруппа или R6 - защитный радикал для карбоксигруппы, то защитным радикалом является ацетоксиметил, пивалоилоксиметил, этоксикарбонилоксиметил, изопропоксикарбонилоксиметил, 1-этоксикарбонилоксиэтил, 1-изопропоксикарбонилоксиэтил, циклогексилоксикарбонилоксиметил, 1-циклогексилоксикарбонилоксиэтил или (5-метил-2-оксо-1,3-диоксолен-4-ил)метил.
Характерные примеры индивидуальных соединений по изобретению даны формулами I-1 - I-3, приведенными на схеме I (фиг.1), в которых различные символы приведены в табл. 1-3, то есть табл. 1 относится к формуле I-1, табл. 2 относится к формуле I-2 и табл. 3 относится к формуле I-3. Во избежание неясности показана периферическая система нумерации, использованная для идентификации положения заместителей в гетероциклических кольцах формул I-2 и I-3. Следует заметить, что система нумерации, использованная для указания положений заместителей в гетероциклическом кольце формулы I-2, если X-группа формулы -N=, показана в неполной формуле I-2а, в то время как система нумерации, использованная для указания положений заместителей в гетероциклическом кольце формулы I-2, если X - группа формулы -CH= или -C(COOR6)=, показана в неполных формулах I-2b и I-2c соответственно. Та же система нумерации, которая находится в соответствии с рекомендациями ЮПАК, использована ниже для названия соединений. В таблицах для некоторых групп применяют следующие сокращения: Bu -бутил, tBu -трет-бутил, Et -этил, cHx -циклогексил, Me - метил, Mod -(5-метил-2-оксо-1,3-диоксилен-4-ил)метил, Pom - пивалоилоксиметил, Pr - пропил, сPr - циклопропил, iPr - изопропил, Tz - тетразол-5-ил.
Из приведенных в табл. 1-3 соединений предпочтительными являются соединения, имеющие следующие номера: 1-1, 1-2, 1-3, 1-4, 1-6, 1-7, 1-8, 1-9, 1-10, 1-11, 1-16, 1-17, 1-18, 1-19, 1-20, 1-21, 1-22, 1-23, 1-24, 1-25, 1-27, 1-28, 1-29, 1-30, 1-31, 1-32, 1-36, 1-37, 1-38, 1-39, 1-40, 2-1, 2-2, 2-3, 2-4, 2-8, 2-9, 2-10, 2-12, 2-13, 2-14, 2-15, 2-26, 2-27, 2-28, 2-29, 2-30, 2-31, 2-32, 2-33, 2-34, 2-35, 2-36, 2-37, 2-38, 2-39, 2-40, 2-44, 2-45, 2-46, 2-47, 2-48, 2-49, 2-50, 3-1, 3-2, 3-3, 3-4, 3-5, 3-6, 3-8, 3-11, 3-12, 3-13, 3-14, 3-16, 3-23 и 3-24.
Более предпочтительными являются соединения N 1-2, 1-3, 1-6, 1-7, 1-8, 1-9, 1-22, 1-24, 1-25, 1-27, 1-28, 1-29, 1-30, 1-31, 1-40, 2-1, 2-2, 2-3, 2-4, 2-26, 2-27, 2-28, 2-29, 2-30, 2-31, 2-32, 2-33, 2-34, 2-35, 2-40, 2-44, 2-45, 2-46, 2-47, 2-48, 3-1, 3-2, 3-3, 3-4, 3-5, и 3-6.
Наиболее предпочтительны следующие соединения:
1-2. 4-[1-Гидрокси-1-метилэтил)-1-[(21-оксалобифенил-4-ил) метил]-2-пропилимидазол-5-карбоновая кислота.
1-6. 4-(1-Гидроксиэтил)-1-[(21-оксалобифенил-4-ил)метил]- 2-пропилимидазол-5-карбоновая кислота.
1-8. 4-Изопропил-1-[(21-оксалобифенил-4-ил)метил]-2- пропилимидазол-5-карбоновая кислота.
1-22. 4-(1-Гидрокси-2-метилпропил)-1-[(21-оксалобифенил-4-ил)-метил] -2-пропилимидазол-5-карбоксамид.
1-24. 4-(1-Гидрокси-2,2-диметилпропил)-1-[(21-оксалобифенил-4-ил)-метил] -2-пропилимидазол-5-карбоксамид.
1-27. Пивалоилоксиметил-4-(1-гидрокси-1-метилэтил)-1-[(21- оксалобифенил-4-ил)метил]-2-пропилимидазол-5-карбоксилат.
1-28. (5-Метил-2-оксо-1,3-диоксолен-4-ил)метил-4-(1-гидрокси-1- метилэтил)-1-[(21-оксалобифенил-4-ил)метил]-2- пропилимидазол-5-карбоксилат.
1-40. 41-[4-(1-Гидрокси-1-метилэтил)-2-пропил-5-(тетразол -5-ил) имидазол-1-илметил]бифенил-2-ил глиоксиловая кислота.
2-1. 2-Этил-5,7-диметил-3-[(21-оксалобифенил-4-ил)метил] -3H-имидазо[4,5-b] пиридин.
2-2. 5,7-Диметил-3-[(21-оксалобифенил-4-ил)метил] -2-пропил-3H- имидазо[4,5-b]пиридин.
2-26. 2-Этил-[(21-оксалобифенил-4-ил)метил] бензимидазол -7-карбоновая кислота.
2-28. Пивалоилоксиметил-2-этил-1-[(21-оксалобифенил-4-ил)метил] бензимидазол-7-карбоксилат.
2-30. (5-Метил-2-оксо-1,3-диоксолен-4-ил)метил-2-этил-1-[(21- оксалобифенил-4-ил)метил]бензимидазол-7-карбоксилат.
2-44. 2-Этокси-1-[(21 -оксалобифенил-4-ил)метил] бензимидазол-7-карбоновая кислота.
2-45. Пивалоилоксиметил-2-этокси-1-[(21-оксалобифенил-4-ил) метил] бензимидазол-7-карбоксилат.
2-46. (5-Метил-2-оксо-1,3-диоксолен-4-ил)метил-2-этокси-1-[(21- оксалобифенил-4-ил)метил]бензимидазол-7-карбоксилат.
3-2. 2-N[(21 -Оксалобифенил-4-ил)метил]-N-пропиламино никотиновая кислота.
3-5. N-Пропил- N-[41-(3-/тетразол-5-ил/пирид-2-ил)аминометил]бифенил-2-ил глиоксиловая кислота.
и их фармацевтически приемлемые соли и эфиры.
Соединения по изобретению можно получать разными хорошо известными способами, применяемыми для приготовления соединения этого типа. Например, в общем их можно получать реакцией соединений формулы III: Ax-H, в которой Ax - любая из групп А или такая группа, в которой любая реакционноспособная группа или атом являются защищенными, или предшественник группы А с соединениями формулы IV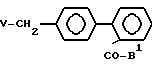
где B1 - защищенная карбоксигруппа или защищенный тетразол-5-ил и
V - галоген, предпочтительно хлор, бром или иод и, если необходимо, удалением защитных групп и/иди превращением предшественника Аx в группу А, как сказано выше, и возможно превращением в соли, этерификацией или диэтерификацией продукта.
Более детально соединения по изобретению можно получать, как показано в реакционных схемах A, B, и C.
Реакционная схема A (фиг. 2).
По этой реакционной схеме соединения формулы IV вводят в реакцию с соединениями формулы IIIa: A1-H, где A1, который более полно определяют дальше, является группой А, в которой соответствующие группы могут быть защищены, и затем, если необходимо, удаляют защитные группы.
В приведенных на фиг.2 формулах: A, B, V и B1 определены выше,
A1 - группа формулы XIa, XIb или XIc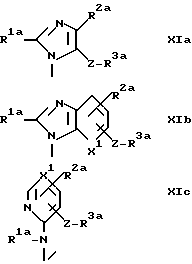
где R1a, R2a, R3a и X1 определены выше, как R1, R2, R3 и X соответственно, но в которых любая первичная или вторичная аминогруппа, любая карбоксигруппа или любой тетразол-5-ил защищены и определены выше.
Не существует особых ограничений на природу защитной группы, применяемой для защиты первичной аминогруппы и вторичной аминогруппы, представленной R1a или R2a, и любые защитные группы, обычно используемые в химии для этой цели, можно также использовать и здесь. Примеры таких защитных групп включают: аралкил, такой как бензил, дифенилметил и тритил; алифатический ацил, такой как формил или трифторацетил; араокилоксикарбонил, такой так бензилоксикарбонил и п-бромбензилоксикарбонил; алкоксикарбонил, такой как трет-бутокси-карбонил. Из них предпочтительны бензил, тритил, трифторацетил, бензилоксикарбонил и трет-бутоксикарбонил, более предпочтительны бензил, бензилоксикарбонил и трет-бутоксикарбонил.
Также не существует ограничений на природу защитной группы, используемой для защиты тетразол-5-ила, представленного R3a и B1, и опять любая группа, используемая для этой цели, может быть применена. Примеры включают аралкил, такой как бензил, дифенилметил и тритил (=трифенилметил), предпочтительно тритил.
Защитный радикал для карбоксигруппы, который может быть представлен или включен в R3a, X1 и B1, может быть любым из тех, которые определены и приведены в примерах выше в связи с R3 и B.
Стадия A1.
В стадии A1 соединения формулы V получают реакцией соединений формулы IIIa с соединениями формулы IV.
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного воздействия на реакцию и на реагенты и что он может растворять реагенты, хотя бы в некоторой степени. Примеры подходящих растворителей включают: углеводороды, особенно ароматические углеводороды, такие как бензол или толуол; простые эфиры, такие как тетрагидрофуран или диоксан; спирты, такие метанол, этанол или трет-бутанол; амиды, такие как диметилацетамид, диметилформамид, N-метил-2-пирролидон или гексаметилфосфортриамид; кетоны, такие как ацетон или метилэтилкетон; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид. Можно применять один растворитель из перечисленных или смесь двух или больше из них, предпочтительны простые эфиры, амиды, кетоны, нитрилы и сульфоксиды.
Реакцию проводят в присутствии основания, природа которого не особенно существенна для данного изобретения, при условии, что оно не имеет вредного воздействия на реагенты. Примеры подходящих оснований включают: карбонаты щелочных металлов, такие как карбонат натрия или калия, гидриды щелочных металлов, такие как гидрид натрия, калия или лития; алкоксиды щелочных металлов, такие как метоксид или этоксид натрия, трет-бутоксид калия или метоксид лития; алкиллитиевые реагенты, такие как метиллитий или бутиллитий; амиды лития, такие как диэтиламид, диизопропиламид или бис(триметилсилил) амид лития; и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия или калия. Из них мы предпочитает карбонаты щелочных металлов, гидриды щелочных металлов, амиды лития и алкоксиды щелочных металлов.
Реакция может протекать в широком интервале температур и точная температура реакции не существенна для изобретения. В общем, мы нашли удобным проводить реакцию при (-10) -(+100)oC, более предпочтительно при 0-80oC, в зависимости от природы исходных соединений формул IIIa и IV, растворителя и основания. Время реакции также может варьироваться в широких пределах в зависимости от многих факторов, особенно от температуры реакции, природы реагентов и используемого растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, обрисованных выше, период от 30 мин до 24 ч, более предпочтительно 1 - 16 ч, обычно будет достаточным.
После завершения реакции целевые соединения формулы V можно выделить из реакционной смеси обычными способами. Например, соединения могут быть получены следующей процедурой: удалением растворителя испарением при пониженном давлении; добавлением воды к остатку; экстракцией остатка органическим растворителем, не смешивающимся с водой, таким как этилацетат; высушиванием экстракта, например безводным сульфатом магния; и удалением растворителя, например испарением. Если необходимо, образующийся продукт может быть далее очищен обычными методами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Стадия А2.
Если необходимо, то можно выполнить стадию А2, которая включает одну или больше из следующих реакций:
Реакция (а): в которой защитные радикалы для карбоксигруппы, входящие в R3a, X1 и B1, удаляют селективно или неселективно.
Реакция (b): в которой удаляют защитные радикалы тетразолила, входящие в R3a и B1.
Реакция (c): в которой удаляют защитные радикалы для первичной и вторичной аминогруппы, входящие в R1a и R2a.
Эти реакции можно проводить в любом подходящем порядке.
Реакция (а).
Реакции, используемые для удаления защитного радикала для карбоксигруппы, будут изменяться в зависимости от вида защитного радикала и могут быть проведены по методикам, хорошо известным в синтетической органической химии.
Например, если защитная группа аралкил, такой как бензил, то защитная группа может быть удалена каталитическим восстановлением в подходящем растворителе в присутствии катализатора (предпочтительно палладия на угле или оксида платины) в присутствии водорода при давлении от атмосферного до 5 атм. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет вредного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол; и карбоновые кислоты, такие как уксусная кислота.
Если защитный радикал для карбоксигруппы трет-бутил или дифенилметил, то он может быть удален реакцией с кислотой (предпочтительно неорганической кислотой, такой как хлористый водород или серная кислота, или органической кислотой, такой как трифторуксусная кислота, метансульфокислота или п-толуолсульфокислота) в подходящем растворителе, природа которого не является решающей при условии, что он не имеет вредного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры растворителей включают: спирты, такие как метанол или этанол; простые эфиры, такие как тетрагидрофуран или диоксан; воду; или смесь воды с одним или больше приведенным органическим растворителем.
Также, если защитный радикал для карбоксигруппы - остаток сложного эфира, то он может быть удален реакцией с основанием (предпочтительно гидроксидом щелочного металла, таким как гидроксид лития, натрия или калия, или карбонатом щелочного металла, таким как карбонат натрия или калия) в подходящем для гидролиза растворителе. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет вредного влияния на реакцию или на реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол; простые эфиры, такие как тетрагидрофуран или диоксан; воду; или смесь воды с одним или больше приведенным органическим растворителем.
Реакция может иметь место в широком интервале температур и точная температура реакции не существенна для изобретения, хотя предпочтительная температура реакции и время реакции будет изменяться в зависимости от метода удаления, растворителя и других факторов. В общем найдено, что удобно проводить реакцию при 0-100oC, более предпочтительно при температуре от комнатной до 80oC. Время реакции также может изменяться в широких пределах в зависимости от многих факторов, особенно от температуры реакции и природы реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, обрисованных выше, период от 30 мин до 24 ч, более предпочтительно 1 - 20 ч, обычно будет достаточным.
Если удаление защитной группы проводят каталитической реакцией, то катализатор предпочтительно отфильтровывают после завершения реакции и упаривают растворитель, чтобы получить продукт. С другой стороны, если удаление защитной группы проводят реакцией с кислотой, то продукт можно получить, собирая кристаллы, выделившиеся в реакционной системе, или концентрируя реакционную смесь. Далее, если удаление защитной группы проводят щелочным гидролизом, то продукт можно получить упариванием органического растворителя, или нейтрализацией образующейся системы кислотой и сбором выделившихся в водном растворителе кристаллов фильтрованием, или подкислением реакционной смеси, экстракцией продукта органическим растворителем, не смешивающимся с водой, и упариванием растворителя. Если необходимо, образующийся продукт может быть далее очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Соответствующий выбор условий реакции и типа реакции удаления позволяет удалить защитные радикалы для карбоксигрупп, входящих в R3a, X1 и B1, селективно или неселективно.
Реакция (b).
Хотя природа реакции, применяемой для удаления тетразоллильной защитной группы, входящей в R3a и B1, будет изменяться в зависимости от вида защитной группы, удаление можно проводить, используя известные методы синтетической органической химии.
Например, если защитная группа тритил, то удаления защитной группы достигают, обрабатывая кислотой в растворителе. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере частично. Примеры подходящих растворителей включают: воду, органические кислоты, такие как муравьиная или уксусная кислоты; простые эфиры, такие как тетрагидрофуран или диоксан; спирты такие как метанол или этанол; или смеси двух или больше из них. Примеры используемых кислот включают: органические карбоновые или сульфоновые кислоты, такие как муравьиная, уксусная, щавелевая, метансульфоновая, п-толуолсульфоновая и трифторуксусная кислоты; и неорганические кислоты, такие как хлористоводородная, бромистоводородная, серная и фосфорная кислоты. Из них предпочитительны уксусная, трифторуксусная или хлористоводородная кислоты.
Реакция может иметь место в широком интервале температур и точная температура реакции не существенна для изобретения. В общем найдено, что реакцию удобно проводить при 0-120oC, более предпочтительно при 10-100oC. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы реагентов и растворителя. Однако при условии что реакцию проводят в предпочтительных условиях, обрисованных выше, период от 30 мин до 24 ч, более предпочтительно 1-16 ч, будет обычно достаточным.
Если защитный радикал бензил или дифенилметил, то он может быть удален каталитическим восстановлением с применением палладия, оксида платины или подобного катализатора, как описано для удаления защитных групп в реакции (а) в стадии А2 реакционной схемы А, когда карбоксигруппа защищена аралкилом.
После завершения реакции удаления защитных групп целевое соединение можно выделить из реакционной смеси обычными способами, например, так же как в реакции (а) в стадии А2 реакционной схемы А.
Реакция (c).
Хотя реакции, применяемые для удаления защитных радикалов для первичных и вторичных аминогрупп, входящих в R1a и R2a, будут изменяться в зависимости от природы защитного радикала, они могут быть проведены, используя методы, хорошо известные в синтетической органической химии.
Например, если защитная группа аралкил, такой как бензил, или аралкилоксикарбонил, такой как бензилоксикарбонил, то они могут быть удалены каталитическим восстановлением в подходящем растворителе в присутствии катализатора (предпочтительно палладия на угле или оксида платины) и в присутствии водорода, предпочтительно при давлении от атмосферного до 5 атм. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол, и карбоновые кислоты, такие как уксусная кислота. Эта реакция может иногда ускоряться добавлением хлористоводородной кислоты, например, в количестве 1-5 эквивалентов на моль защищенного соединения.
Если защитный радикал трет-бутоксикарбонил, то он может быть удален реакцией с кислотой (предпочтительно неорганической кислотой, такой как хлористый водород или серная кислота; или органической кислотой, такой как трифторуксусная, метансульфоновая, п-толуолсульфоновая, муравьиная или уксусная кислоты) в подходящем растворителе. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол; простые эфиры, такие как тетрагидрофуран или диоксан; галогенированные углеводороды, такие как метиленхлорид или хлороформ; воду и смеси воды и одного или больше приведенного органического растворителя.
Если защитный радикал алифатический ацил, такой как формил или трифторацетил, то он может быть удален реакцией с щелочью (предпочтительно гидроксидом щелочного металла, таким как гидроксид натрия или калия, или карбонатом щелочного металла, таким как карбонат натрия или калия) в растворителе, способствующем гидролизу. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол; простые эфиры, такие как тетрагидрофуран или диоксан; воду; и смеси воды и одного или больше приведенного органического растворителя.
Реакция может иметь место в широком интервале температур и точная температура реакции не существенна для изобретения. В общем найдено, что удобно проводить реакцию при 0-100oC, более предпочтительно при температуре от комнатной до 80oC. Время реакции также может варьироваться широко в зависимости от многих факторов, особенно от температуры реакции и природы реагентов и растворителя. Однако при условии что реакцию проводят в предпочтительных условиях, обрисованных выше, период от 30 мин до 24 ч, более предпочтительно 1-16 ч, будет обычно достаточным.
Целевой продукт затем можно выделить из реакционной смеси обычными способами. Например, если удаление защитной группы проводят каталитическим восстановлением, то катализатор предпочтительно отфильтровывают после завершения реакции и растворитель упаривают для получения продукта; в то время как если удаление защиты проводят обработкой кислотой, то целевой продукт в форме соли можно получать, собирая соль, выделившуюся из реакционной системы, или концентрируя реакционную смесь. Далее, если удаление защиты проводят щелочным гидролизом, то продукт получают, собирая его, выделившийся в реакционной системе, или экстрагируя его органическим растворителем, не смешивающимся с водой, и упаривая растворитель. Если необходимо, образующийся продукт может быть далее очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Реакционная схема B (фиг. 3).
Реакционная схема B показывает получение соединений формулы Ia, соответствующих соединениям формулы I, где R3 - карбамоил.
В формулах, приведенных на фиг.3, V и B1 определены выше; A2 - группа формулы XIIa, XIIb или XIIc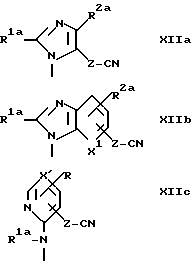
где R1a, R2a, X1 и Z определены выше; и A3 - группа формулы XIIIa, XIIIb или XIIIc
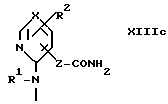
Стадия B1.
В стадии B1 соединения формулы Va получают реакцией соединений формулы IIIb с соединениями формулы IV. Эта стадия идентична стадии A1 реакционной схемы A и может быть проведена с применением тех же реагентов и условий реакции.
Стадия B2.
Стадия B2 необязательна и может включать следующие реакции.
Реакция (а): в которой цианогруппу, входящую в A2, превращают в карбамоил.
Реакция (b): в которой удаляют защитный радикал для карбоксигруппы, входящей в B1 и X1.
Реакция (с): в которой удаляют защитный радикал для тетразолила, входящий в B1.
Реакция (d): в которой удаляют защитные радикалы для первичной и вторичной аминогрупп, входящие в R1a и R2a.
Эти реакции проводят в любом подходящем порядке.
Реакция (a).
Превращение цианогруппы в карбамоил по реакции (a) может быть выполнено реакцией соединений формулы Va с основанием.
Не существует особых ограничений на природу используемого основания при условии, что оно не имеет неблагоприятного воздействия на реагенты, и любое основание, обычно используемое в реакциях этого типа, может быть использовано здесь. Примеры подходящих оснований включают: гидроксиды щелочных металлов, такие как гидроксид лития, натрия или калия и карбонаты щелочных металлов, такие как карбонат натрия или калия.
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол; простые эфиры, такие как тетрагидрофуран или диоксан; воду; и смеси воды с любым одним или больше из таких растворителей.
Реакция может иметь место в широком интервале температур и точная температура реакции не является решающей для изобретения. В целом найдено что удобно проводить реакцию при 0-100oC, более предпочтительно при температуре от комнатной до 80oC. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 30 мин до 24 ч, более предпочтительно 1-6 ч, будет обычно достаточным.
После завершения реакции целевой продукт может быть выделен из реакционной смеси обычными способами. Например, в одной из методик реакционную смесь нейтрализуют, продукт осаждается и может быть собран фильтрованием или нейтрализованную реакционную смесь экстрагируют органическим растворителем, не смешивающимся с водой (таким как этилацетат), и растворитель упаривают для получения продукта. Если необходимо образующийся продукт может быть далее очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Реакции (b), (c) и (d).
Реакция (b), (c) и (d) в этой стадии соответствуют реакциям (a), (b) и (c) стадии A2 реакционной схемы A и могут быть выполнены, используя те же реагенты и условия реакций.
Реакционная схема C (фиг. 4).
Реакционная схема C показывает получения соединений формулы Ib, соответствующих соединениям формулы I, где A - группа формулы IIb.
В формулах, приведенных на фиг.4, R1, R2, R3, R1a, R2a, R3a, X, X1, Z, B, B1 и V определены выше; R7 - защитный радикал для аминогруппы.
Защитный радикал для аминогруппы R7 может быть любым из тех, которые определены и приведены выше для R1a и R2a.
Стадия C1.
В стадии C1 соединения формулы VII получают реакцией соединений формулы VI с соединениями формулы IV. Эта реакция идентична реакции, описанной в стадии A1 реакционной схемы A, и может быть выполнена, используя те же реагенты и условия реакций.
Стадия C2.
В стадии C2 удаляют защитный радикал R7, чтобы получить соединения формулы VIII. Эту стадию выполняют так же, как описано в реакции (с) стадии A2 реакционной схемы A. Если необходимо, защитный радикал R7 можно выделить из других защитных радикалов для первичных и вторичных аминогрупп, входящих в R2a, и можно селективно удалить, выбрав подходящую реакцию или условия реакции.
Стадия C3.
В стадии C3 соединены формулы IX получают восстановлением нитрогруппы соединений формулы VIII. Эту стадию выполняют с использованием методов, хорошо известных в синтетической органической химии.
Например, цель может быть достигнута каталитическим восстановлением. Реакцию проводит в присутствии катализатора, такого как платина, на угле или никель Ренея и в присутствии водорода, предпочтительно под давлением от атмосферного до 5 атм. Реакцию обычно и предпочтительно проводят в растворителе. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол; простые эфиры, такие как метанол или этанол; простые эфиры, такие как тетрагидрофуран или диоксан; сложные эфиры, такие как этилацетат или бутилацетат; и карбоновые кислоты, такие как уксусная кислота, наиболее предпочтителен спирт.
Реакция может иметь место в широком интервале температур и точная температура реакции не является существенной для изобретения. В целом найдено, что удобно проводить реакцию при 0-60oC, более предпочтительно при 10-40oC. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 30 мин до 24 ч, более предпочтительно 1-8 ч, будет обычно достаточен.
После завершения реакции катализатор можно удалить фильтрованием, растворитель упарить при пониженном давлении и получить продукт. Если необходимо, продукт может быть дополнительно очищен обычными методами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Если в качестве восстановителя применяют хлорид олова (II), то способ может быть выполнен реакцией нитросоединений формулы VIII с восстановителем в инертном растворителе (предпочтительно спирте, таком как метанол или этанол). Реакция может иметь место в широком интервале температур, и точная температура реакции не является существенной для изобретения. В целом найдено, что удобно проводить реакцию при температуре до 150oC, более предпочтительно при 50-100oC. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период 1-24 ч, более предпочтительно 2-8 ч, обычно будет достаточен.
После завершения реакции продукт может быть выделен из реакционной смеси обычными методами. Например, в одной подходящей методике: реакционную смесь концентрируют, к остатку добавляют органический растворитель, не смешивающийся с водой, такой как этилацетат, и водный раствор щелочи, такой как гидроксид натрия, и образующуюся смесь перемешивают; образующийся нерастворимый оксид олова удаляют фильтрованием; органический раствор отделяют; растворитель упаривают при пониженном давлении и получают продукт. Если необходимо, продукт может быть дополнительно очищен обычными методами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Возможно проведение реакции восстановления стадии C3 после стадии C1 с последующим удалением защитных радикалов аминогрупп по стадии C2.
Стадия C4.
В стадии C4 соединения формулы X получают реакцией соединений формулы IX с соединением формулы XIV
R1aC(OR8)3,
в которой R1a определен выше; R8 - алкил с 1-6 атомами углерода, предпочтительно метил или этил.
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: углеводороды, такие как гексан, бензол, толуол и ксилол; галогенированные углеводороды, особенно галогенированные алифатические углеводороды, такие как метиленхлорид и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран и диоксан; и сложные эфиры, такие как этилацетат и бутилацетат. Из них предпочтительны углеводороды и галогенированные углеводороды.
Реакция может иметь место в широком интервале температур, и точная температура реакции не существенна для изобретения. В целом найдено, что удобно проводить реакцию при 0-120oC, более предпочтительно при 20-100oC, хотя предпочтительная температура реакции будет меняться в зависимости от природы исходных соединений формул IX и XIV, растворителя и основания. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 30 мин до 24 ч, более предпочтительно 1-8 ч, будет обычно достаточен. Реакцию иногда можно ускорить добавлением каталитического количества кислоты, такой как хлористый водород, п-толуолсульфокислота или уксусная кислота.
После завершения реакции целевые соединения формулы X могут быть выделены обычными методами. Например, в одной подходящей методике: выделившийся продукт собирают фильтрованием или растворитель упаривают при пониженном давлении, к остатку добавляют воду и образующуюся смесь экстрагируют органическим растворителем, не смешивающимся с водой, таким как этилацетат, экстракт высушивают, например, безводным сульфатом магния, и растворитель упаривают с получением продукта. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Если соединения формулы XIV внести в реакционную систему стадии C3, то реакция стадии C4 может иногда протекать одновременно с реакцией стадии C3.
Стадия С5.
Стадия C5 необязательна и может включать следующие реакции.
Реакция (a): в которой селективно или неселективно удаляют защитный радикал для карбоксигруппы, входящий в R3a, X1 и B1.
Реакция (b): в которой удаляют защитный радикал для тетразолила, входящий в R3a и B1.
Реакция (c): в которой удаляют защитные радикалы для первичных и вторичных аминогрупп, входящие в R1a и R2a.
Эти реакции могут быть проведены по тем же методикам, что и соответствующие реакции стадии A2.
Исходные соединения формул III, IIIa и VI, используемых в реакционных схемах A-C (фиг.2-4), известны из патента или могут быть получены известными способами (например, как показано в EP N 503785 и N 459136, J. Med. Chem., 34, 2525 (1991), там же, 34, 2919 (1991), там же 35, 3714 (1992). Исходные соединения формулы (IV) можно получать, например, как показано в последующих реакционных схемах D (фиг.5) или E (фиг.6).
В формулах, приведенных на фиг.5, 6, V определен выше; R9 - защитный радикал для карбоксигруппы, и R10 - защитный радикал для тетразолила. Защитный радикал R9 для карбоксигруппы включает радикалы, приведенные для R3a и B1, и защитный радикал R10 для тетразолила включает радикалы, приведенные для R3a и B1.
Реакционная схема D (фиг. 5).
Реакционная схема D показывает получение соединений формулы IVa, соответствующих соединениям формулы IV, где B1 - защищенная карбоксигруппа.
Стадия D1.
В стадии D1 соединения формулы XVI получают реакцией соединений формулы XV с подходящим количеством, предпочтительно 1-3 эквивалентами, более предпочтительно 1,5-2 эквивалентами, восстановителя (например, гидрида металла, такого как диизобутилалюминийгидрид или литийтриэтоксиалюминийгидрид; никель Ренея - муравьиная кислота; или хлорид олова (II), предпочтительно диизобутилалюминийгидрид) в инертном растворителе (предпочтительно ароматическом углеводороде, таком как бензол, толуол или ксилол или простом эфире, таком как тетрагидрофуран и диоксан).
Реакция может иметь место в широком интервале температур и точная температура реакции не является решающей для изобретения. В целом найдено, что удобно проводить реакцию при (-80) - (+60)oC, более предпочтительно от -30oC до комнатной температуры. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 10 мин до 8 ч, более предпочтительно от 30 мин до 4 ч, обычно будет достаточен.
В конце реакции избыток восстановителя, если необходимо, разлагают добавлением спирта и к реакционной смеси добавляют разбавленную хлористоводородную кислоту и органический растворитель, не смешивающийся с водой (такой как этилацетат), смесь перемешивают, органический раствор отделяют и растворитель удаляют упариванием для получения продукта. Если необходимо, образующийся продукт можно дополнительно очистить обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Стадия D2.
В стадии D2 соединения формулы XVII получают реакцией соединений формулы XVI с цианистыми соединениями (предпочтительно цианидом щелочного металла, таким как цианид натрия или калия, или триалкилсилилцианидом, в котором алкил имеет 1-6 атомов углерода, таким как триметилсилилцианид) в инертном растворителе. Если применяют триалкилсилилцианид, то полученные O-триалкилсилильные производные затем обрабатывают кислотой.
Если применяют цианид щелочного металла, то его применяют в количестве 1-3 эквивалента, более предпочтительно 1,2-2 эквивалента, на моль соединения формулы XVI. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диоксан; галогенированные углеводороды, особенно галогенированные алифатические углеводороды, такие как метиленхлорид или хлороформ; спирты, такие как метанол или этанол; воду; или смесь воды и одного или больше из приведенных органических растворителей. Реакция может иметь место в широком интервале температур, и точная температура реакции не существенна для изобретения.
В целом найдено, что удобно проводить реакцию при (-10) - (+80)oC, более предпочтительно при 0-30oC. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период 1-24 ч, более предпочтительно 2-16 ч, будет обычно достаточен. Эта реакция, если необходимо, может быть ускорена добавлением гидросульфата натрия. После завершения реакции продукт может быть выделен обычными способами, например экстракцией реакционной смеси органическим растворителем, не смешивающимся с водой (таким как этилацетат), и упариванием растворителя из экстракта. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Если применяют триалкилсилилцианид, то его обычно берут в количестве 1-2 эквивалента, более предпочтительно 1,05-1,2 эквивалента на моль соединения формулы XVI и реакцию предпочтительно проводят в присутствии каталитического количества иодида цинка. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: прсотые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диоксан; и галогенированные углеводороды, особенно галогенированные алифатические углеводороды, такие как метиленхлорид и хлороформ. Реакция может иметь мест в широком интервале температур, и точная температура реакции не существенна для изобретения. В целом найдено, что удобно проводить реакцию при (-10) - (+80)oC, более предпочтительно при 10-40oC. Время реакции также может широко варьироваться в зависимости от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 30 мин до 24 ч, более предпочтительно 1 - 6 ч, будет обычно достаточен. После завершения реакции целевой продукт формулы XVII в форме O-триметилсилильного производного может быть получен концентрированием реакционной смеси, экстракцией концентрата органическим растворителем, не смешивающимся с водой, промыванием экстракта водным слабощелочным раствором, таким как водный раствор гидрокарбона натрия, и упариванием растворителя. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Затем удаляют O-триалкилсилильную группу. Эту реакцию проводят, обрабатывая каталитическим количеством кислоты (например, п-толуолсульфокислоты, метансульфокислоты или хлористоводородной кислоты) в подходящем растворителе, природа которого не существенна при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол. Реакция также может иметь место в широком интервале температур, и точная температура реакции не существенная для изобретения. В целом найдено, что удобно проводить реакцию при (-20) - (+60)oC, более предпочтительно вблизи комнатной температуры. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 10 мин до 5 ч, более предпочтительно от 30 мин до 2 ч, будет обычно достаточен.
После завершения реакции продукт может быть выделен из реакционной смеси обычными способами, например концентрированием реакционной смеси, экстракцией концентрата органическим растворителем, не смешивающимся с водой, таким как этилацетат, промыванием экстракта слабощелочным водным раствором, таким как водный раствор гидрокарбоната натрия, и упариванием растворителя. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Однако O-триалкилсилильные производные также можно использовать в качестве исходного материала в стадии D3.
Стадия D3.
В стадии D3 соединения формулы XVIII получают обработкой соединений формулы XVII или их O-триалкилсилильных производных кислотой (предпочтительно концентрированной серной кислотой или концентрированной хлористоводородной кислотой) в подходящем растворителе, природа которого не существенна при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают жирные кислоты, такие как уксусная или пропионовая кислота; простые эфиры, такие как диоксан; воду.
Реакция может иметь место в широком интервале температур, и точная температура реакции не существенна для изобретения. В целом найдено, что удобно проводить реакцию при 50-120oC, более предпочтительно при 80-100oC. Время реакции может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 8 ч до 3 дней, более предпочтительно 16 - 40 ч, будет обычно достаточен.
Продукт реакции может быть выделен из реакционной смеси обычными методами, например концентрированием реакционной смеси, экстракцией концентрата водным раствором щелочи, таким как водный раствор гидроксида натрия, подкислением водного экстракта кислотой, такой как хлористоводородная кислота, экстракцией смеси органическим растворителем, не смешивающимся с водой, таким как этилацетат, и упариванием растворителя. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Стадия D4.
В стадии D4 соединения формулы XIX получают этерификацией соединений формулы XVIII. Эта реакция может быть выполнена по методикам, хорошо известным в синтетической органической химии. Например, этерификация может быть проведена реакцией карбоновых кислот формулы XVIII с соединениями формулы XXIV
R9 - W
где R9 определен выше;
W - галоген, такой как хлор, бром или иод, или группа OSO3R9 (в которой R9 определен выше).
Реакцию обычно и предпочтительно проводят в растворителе. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают амиды, такие как диметилформамид или диметилацетамид; галогенированные углеводороды, такие как метиленхлорид; кетоны, такие как ацетон или метилэтилкетон; и нитрилы, такие как ацетонитрил, из них предпочтительны амиды или кетоны. Реакцию проводят в присутствии основания, например карбоната щелочного металла, такого как карбонат натрия или калия; гидрокарбоната щелочного металла, такого как гидрокарбонат натрия или калия; гидрида щелочного металла, такого как гидрид лития, натрия или калия; или третичного амина, такого как триэтиламин, N-метилморфолин или диизопропилэтиламин. Из них предпочтительны карбонаты металлов или третичные амины. Можно использовать те же самые условия реакции, включая температуру реакции и время реакции, что и в стадии A1 реакционной схемы A.
Если сложноэфирный остаток является алкилом с 1-6 атомами углерода, то карбоновые кислоты можно вводить в реакцию в спирте, имеющем 1-6 атомов углерода, таком как метанол, этанол, пропанол или гексанол, в присутствии кислотного катализатора, такого как хлористый водород или серная кислота, при подходящей температуре, например 0-100oC, в течение достаточного времени, например 1-24 ч. Целевое соединение может, например, быть выделено тем же способом, что и в стадии A1 реакционной схемы A.
Стадия D5.
В стадии D5 соединения формулы XX получают реакцией соединений формулы XIX с окислителем (предпочтительно оксидом металла, таким как диоксид марганца или оксида серебра; смеси комплекса пиридин-триоксид серы и диметилсульфоксида; ангидрида кислоты (такого как трифторуксусный ангидрид или оксалилхлорид-диметилсульфоксид) или ацилхлорида-диметилсульфоксида) в подходящем растворителе, природа которого не существенна при условии, что он не имеет неблагоприятного влияния на реакцию или на используемые реагенты и что он может растворять реагенты по меньшей мере до некоторой степени.
Если применяют оксид металла, то используемым растворителем является предпочтительно галогенированный углеводород, такой как метиленхлорид или хлороформ; углеводород, такой как гексан, бензол, толуол или ксилол; простой эфир, такой как диэтиловый эфир, тетрагидрофуран или диоксан; сложный эфир, такой как этилацетат или бутилацетат; или кетон, такой как ацетон или метилэтилкетон. Температура реакции предпочтительно 0-100oC, более предпочтительно 10-60oC, и время реакции предпочтительно 30 мин - 24 ч, более предпочтительно 1-20 ч. После завершения реакции нерастворимый материал отфильтровывают и растворитель упаривают для получения продукта. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Если применяют смесь комплекса пиридин-триоксид серы и диметилсульфоксида, ангидрид кислоты - диметилсульфоксид или ацилхлорид-диметилсульфоксид, то реакцию предпочтительно проводят в присутствии основания (предпочтительно органический амин, такой как триэтиламин или N-метилморфолин). Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают галогенированные углеводороды, такие как метиленхлорид или хлороформ; углеводороды, такие как гексан, бензол, толуол или ксилол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или диоксан; сложные эфиры, такие как этилацетат или бутилацетат; и кетоны, такие как ацетон или метилэтилкетон. Реакция может иметь место в широком интервале температур, и точная температура реакции не существенна для изобретения. В целом найдено, что удобно проводить реакцию при (-70) - (+60)oC, более предпочтительно (-50) - (+30)oC. Время реакции также может широко варьироваться в зависимости от природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 30 мин до 16 ч, более предпочтительно 1 - 8 ч, обычно будет достаточен. После завершения реакции продукт может быть выделен концентрированием реакционной смеси, экстракцией концентрата органическим растворителем, не смешивающимся с водой, таким как этилацетат, промыванием экстракта водой и упариванием растворителя. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Если защитный радикал R9 для карбоновой кислоты должен быть замещен, то защитный радикал соединений формулы XX может быть удален согласно методу реакции (a) в стадии A2 реакционной схемы A и затем соединения формулы XX могут быть вновь защищены по методу стадии D4 реакционной схемы D или следующим способом.
Карбоновую кислоту, полученную реакцией (a) стадии A2 реакционной схемы A, обрабатывают галогенирующим реагентом (например, пентахлоридом фосфора, тионилхлоридом или оксалилхлоридом) в инертном растворителе (предпочтительно галогенированном углеводороде, таком как метиленхлорид или хлороформ, простом эфире, таком как тетрагидрофуран или диоксан, или ароматическом углеводороде, таком как бензол или толуол) при подходящей температуре, например (-10) - (+100)oC, более предпочтительно при 0 - 80oC, в течение подходящего времени, например от 30 мин до 5 ч, с получением соответствующего ацилгалогенида. Ацилгалогенид затем вводят в реакцию с соответствующим спиртом (например желательно с трет-бутоксидом калия, если получают трет-бутиловый эфир) в присутствии основания (например, органического амина, такого как триэтиламин) при подходящей температуре, например комнатной температуре, в течение подходящего периода, например от 30 мин до 10 ч. Целевое соединение затем может быть выделено обычными способами, например тем же способом, что и способ стадии A1 реакционной схемы A.
Стадия D 6.
В стадии 6 соединения формулы IVa получают реакцией соединения формулы XX с галогенирующим реагентом (предпочтительно N-хлорсукцинимидом, N-бромсукцинимидом или 1,3-дибромдиметилгидантоином) в инертном растворителе (предпочтительно галогенированном углеводороде, таком как метиленхлорид, 1,2-дихлорэтан или четыреххлористый углерод) в присутствии катализатора (предпочтительно бензоилпероксида или азобисизобутиронитрила).
Реакция может иметь место в широком интервале температур, и точная температура реакции не существенна для изобретения. В целом найдено, что удобно проводить реакцию при 0-100oC, более предпочтительно при 20-80oC. Время реакции также может широко варьироваться с зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, обрисованных выше, период от 10 мин до 24 ч, более предпочтительно от 30 мин до 16 ч, обычно будет достаточен. Эту реакцию можно ускорить облучением, например, вольфрамовой лампой.
После завершения реакции реакционную смесь предпочтительно промывают водой и сушат, например, над безводным сульфатом магния, растворитель удаляют испарением и получают целевой продукт. Если необходимо, образующийся продукт может быть дополнительно очищен обычными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Реакционная схема E (фиг. 6).
Реакционная схема E показывает получение соединений формулы IVb, которые соответствуют соединениям формулы IV, где B1 - защищенный тетразолил.
Стадия E1.
В стадии E1 соединения формулы XXI получают превращением цианогруппы соединений формулы XVII в тетразолил. Эту стадию проводят, используя следующие три реакции.
Реакция (a): реакция с азидом щелочного металла.
Соответствующие цианосоединения формулы (XVII) вводят в реакцию с подходящим количеством, например 1 - 5 эквивалентами, более предпочтительно 1 - 3 эквивалентами, азида щелочного металла, такого как азид лития, натрия или калия, в присутствии галогенида аммония. Реакцию обычно и предпочтительно проводят в растворителе. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты. Примеры подходящих растворителей включают: простые эфиры, такие как диоксан или 1,2-диметоксиэтан; спирты, такие как метанол или этанол; амиды, такие как диметилформамид или диметилацетамид; и сульфоксиды, такие как диметилсульфоксид. Применяют галогенид аммония в количестве 0,5-2 эквивалента, более предпочтительно 1-1,2 эквивалента на моль соединений формулы XVII. Примеры подходящих галогенидов аммония включают фторид, хлорид и бромид аммония, предпочтительно хлорид аммония.
Реакция может иметь место в широком интервале температур, и точная температура реакции не существенна для изобретения. В целом найдено, что удобно проводить реакцию при 70 - 150oC, более предпочтительно при 90 - 120oC. Время реакции также может широко варьироваться в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 10 до 7 дней, более предпочтительно 1 - 5 дней, будет обычно достаточен.
После завершения реакции продукт может быть выделен из реакционной смеси обычными способами. Например, к реакционной смеси добавляют воду и органический растворитель, не смешивающийся с водой, такой как этилацетат, органический слой отделяют и растворитель упаривают для получения продукта. Если необходимо, образующийся продукт может быть дополнительно очищен известными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Реакция (b): реакция с триалкил- или триарилоловоазидом.
Цианосоединения формулы XVIII вводят в реакцию с подходящим количеством, например 1-3 эквивалентами, более предпочтительно 1-2 эквивалентами, триалкилоловоазида или триарилоловоазида. Примеры триалкилоловоазидов включают соединения, в которых алкил имеет 1-6 атомов углерода, такие как триметилоловоазид, триэтилоловоазид или трибутиловоазид. Примеры триарилоловоазидов включают трифенилоловоазид и тритолилоловоазид. Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет вредного влияния на реакцию или на участвующие реагенты и что он растворяет реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: углеводороды, такие как бензол, толуол, ксилол или гептан; галогенированные углеводороды, такие как дихлорэтан или хлороформ; простые эфиры, такие как диоксан или 1,2-диметоксиэтан; сложные эфиры, такие как этилацетат или бутилацетат; амиды, такие как диметилформамид или диметилацетамид и сульфоксиды, такие как диметилсульфоксиды. Образующийся аддукт олова затем обрабатывают кислотой (предпочтительно хлористоводородной или серной кислотой), основанием (предпочтительно гидроксидом щелочного металла, таким как карбонат натрия или калия, гидрокарбонатом щелочного металла, таким как гидрокарбонат натрия или калия) или фторидом щелочного металла, таким как фторид натрия или калия. Реакцию обычно и предпочтительно проводят в растворителе. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: растворители, приведенные выше; спирты, такие как метанол или этанол; воду; и водные спирты.
Реакция может иметь место в широком интервале температур, и точная температура реакции не существенна для изобретения. В целом найдено, что удобно проводить реакцию с соединением олова при 60 - 150oC, более предпочтительно при 80 - 120oC, и обработку кислотой, основанием или фторидом при комнатной температуре. Время реакции также может варьироваться широко в зависимости от многих факторов, особенно от температуры реакции и природы используемых реагентов и растворителя. Однако при условии, что реакцию проводят в предпочтительных условиях, описанных выше, период от 8 ч до 7 дней, более предпочтительно 1 - 5 дней, будет обычно достаточен для реакции с соединением олова, в то время как обработка кислотой, основанием или фторидом будет обычно занимать от 30 мин до 24 ч, более предпочтительно 1 - 6 ч.
После завершения реакции продукт может быть выделен обычными способами из реакционной смеси. Например, к реакционной смеси добавляют воду и органический растворитель, не смешивающийся с водой, такой как этилацетат, органический слой отделяют и растворитель упаривают для получения продукта. Если необходимо, образующийся продукт может быть дополнительно очищен известными способами, такими как перекристаллизация или хроматография, особенно колоночная хроматография.
Реакция (c): реакция с триалкил- или триарилоловогалогенидом азидом щелочного металла.
Эту реакцию проводят так же, как реакцию (b), за исключением того, что подходящее количество, например 1-3 эквивалента, более предпочтительно 1-2 эквивалента, триалкил- или триарилоловогалогенида (например триметилоловохлорида, триэтилоловохлорида, трибутилоловохлорида или трифенилоловохлорида) и подходящее количество, например 1-3 эквивалента, более предпочтительно 1-2 эквивалента, азида щелочного металла (предпочтительно азида натрия или калия), применяют вместо триалкил- или триарилоловоазида.
Стадия E2.
В стадии E2 соединения формулы XXII получают, защищая тетразолильную группу соединений формулы XXI. Стадию осуществляют реакцией соединений формулы XXI с соединениями формулы XXV
R10 - W
где R10 и W определены выше.
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не имеет неблагоприятного влияния на реакцию или на участвующие реагенты и что он может растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: амиды, такие как диметилформамид или диметилацетамид; галогенированные углеводороды, такие как метиленхлорид или 1,2-дихлорэтан; кетоны, такие как ацетон или метилэтилкетон; и нитрилы, такие как ацетонитрил, из них предпочтительны амиды и кетоны. Реакцию проводят в присутствии основания, например карбоната щелочного металла, такого как карбонат натрия или калия; гидрокарбоната щелочного металла, такого как гидрокарбонат лития, натрия или калия; пиридина или его производных, таких как пиридин или 1,6-лутидин; или третичного амина, такого как триэтиламин, N-метилморфолин или диизопропилэтиламин. Из них предпочтительно использовать карбонат щелочного металла, пиридин или его производное (которое, если взято в большом избытке, может также служить растворителем) или третичный амин.
В этой стадии можно использовать те же условия реакции, включая температуру реакции и время реакции, и метод выделения продукта реакции, как те, которые использованы в стадии A1 реакционной схемы A.
Стадия E3.
В стадии E3 соединения формулы XXIII получают окислением соединений формулы XXII. Эта стадия заключается в выполнении той же самой реакции, что и в стадии D5 реакционной схемы D, и может быть осуществлена с применением тех же реагентов и условий. Продукт реакции затем можно выделить, как описано в стадии D5.
Стадия E4.
В стадии E4 соединения формулы IVb получают галогенированием соединений XXIII. Эта стадия заключается в выполнении той же самой реакции, что и в стадии D6 реакционной схемы D, и может быть осуществлена с применением тех же реагентов и условий реакции. Продукт реакции затем можно выделить как описано в стадии D6.
Биологическая активность.
Биологическую активность каждого соединения оценивают определением дозы, требуемой для ингибирования прессорного отклика на внутривенный ангиотензин П на пятьдесят процентов (ИД50) у крыс. Самцов крыс Вайстера-Имамичи, каждая массой 300-400 г, наркотизируют внутрибрушинной инъекцией 100 мг/кг тиобутабарбитала /Инактин (торговое название)/ и вводят две канюли: одну в бедренную артерию для измерения кровяного давления, а другую в бедренную вену для инъекции лекарственного средства. Пятьдесят нг/кг ангиотензина П вводят внутривенно с интервалами около 10 мин и наблюдают повышение кровяного давления (обычно около 50 мм рт.ст.). После достижения постоянных прессорных откликов на ангиотензин П внутривенно вводят испытываемое соединение. Через 2 мин снова вводят ангиотензин П и оценивают ингибирующий эффект испытываемого соединения. Для расчета значения ИД50 используют процент ингибирования прессорного отклика на ангиотензин П при постепенном увеличении испытываемого соединения. Ангиотензин П, используемый в этом тесте, растворяют в 0,5% альбумине сыворотки быка, а испытываемые соединения растворяют в 100% диметилсульфоксиде. В табл. 4 приведены определенные таким образом величины ИД50.
Соединения изобретения опознают в табл.4 по номеру одного из последующих примеров, описывающих их получение.
Соединения по изобретению могут быть введены как таковые или в форме обычных фармацевтических препаратов, форма которых зависит от выбранного пути введения. Например, для перорального введения они могут быть введены в состав таблеток, капсул, гранул, порошков, сиропов и т.д. или для парентерального введения они могут быть включены в состав инъекций, суппозиториев и т. д. Эти фармацевтические препараты могут быть произведены обычными способами с применением известных вспомогательных веществ, таких как наполнители, связующие, средств, способствующих распаду, смазок, стабилизаторов и т.д. Хотя дозировка может изменяться в зависимости от симптомов и возраста пациента, природы и тяжести заболевания или нарушения и пути и способа введения, в случае перорального введения взрослому пациенту соединения по изобретению можно обычно вводить при полной дневной дозе 1-1000 мг, предпочтительно 5-300 мг, либо единой дозой, либо разделенной дозой, например 1-3 раза в день; в случае внутреннего введения доза 0,1-100 мг, предпочтительно 0,5-30 мг, может быть введена от одного до трех раз в день.
Изобретение далее иллюстрируется следующими примерами, которые показывают получение различных соединений изобретения. Получение некоторых исходных материалов, используемых в этих примерах, показано в последующих препаратах. В формулах, сопровождающих эти примеры и препараты, используют некоторые сокращения, которые определены в связи с табл. 1-3.
Пример 1. 4-(1-Гидрокси-1-метилэтил)-1-[(21- оксалобифенил-4-ил)метил] -2-пропилимидазол-5-карбоновая кислота (соединение N 1-2).
1(a). Этил-4-(1-гидрокси-1-метилэтил)-1-[(21-метоксилилбифенил-4-ил)метил]-2-пропилимидазол-5-карбоксилат.
140 мг трет-бутоксида калия добавляют при охлаждении льдом к раствору 288 мг этил-4-(1-гидрокси-1-метилэтил)-2-пропилимидазол-5-карбоксилата в 3 мл диметилацетамида и образующуюся смесь перемешивают 5 мин. Затем к смеси добавляют раствор 433 мг метил-(41-бромметилбифенил-2-ил)глиоксилата (получен, как описано в препарате 8) в 5 мл диметилацетамида и перемешивают при комнатной температуре 4 ч. Затем к реакционной смеси добавляют этилацетат и воду, органический слой отделяют и сушат безводным сульфатом натрия. Растворитель отгоняют при пониженном давлении. Остаток хроматографируют на колонке с силикагелем, используя смесь 1:1 по объему этилацетата и гексана в качестве элюента, и получают 447 мг целевого соединения в виде сиропа.
Спектр ядерного магнитного резонанса (CDCl3, 270 МГц, δ млн.-1): 0,98 (3H, триплет, J = 7,5 Гц); 1,26 (3H, триплет, J = 7 Гц); 1,64 (6H, синглет); 1,75 (2H, секстет, J = 7,5 Гц); 2,65 (2H, триплет, J = 7,5 Гц); 3,31 (3H, синглет); 4,27 (2H, квартет, J=7 Гц); 5,51 (2H, синглет); 5,68 (1H, синглет); 6,99 (2H, дублет, J=8,5 Гц) 7,27 (2H, дублет, J=8,5 Гц); 7,42 (1H, дублет, J= 7 Гц); 7,51 (1H, триплет, J=7 Гц); 7,65 (1H, триплет, J=7 Гц); 7,81 (1H, дублет, J=7 Гц).
1(b). 4-(1-Гидрокси-1-метилэтил-1-[(21-оксалобифенил-4-ил)метил] -2-пропилимидазол-5-карбоновая кислота.
Раствор 247 мг гидроксида лития моногидрата в 3 мл воды добавляют к раствору 447 мг этил-4-(1-гидрокси-1-метилэтил)-1- -[(21-метоксалилбифенил-4-ил)метил] -2-пропилимидазол-5-карбоксилата (получен как описано выше в стадии (a)) в 5 мл диоксана и образующуюся смесь перемешивают при комнатной температуре 5 ч. Затем диоксан удаляют испарением при пониженном давлении и добавляют 5,9 мл 1н. водной хлористоводородной кислоты. Выпавшие кристаллы собирают фильтрованием, сушат на воздухе и получают 310 мг целевого соединения, размягчающегося при 163oC и плавящегося при 183-185oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,88 (3H, триплет, J=7,5 Гц); 1,56 (6H, синглет); 1,59 (2H, секстет, J=7,5 Гц); 2,61 (2H, триплет, J=7,5 Гц); 5,71 (2H, синглет); 7,07 (2H, дублет, J=8 Гц); 7,25 (2H, дублет, J=8 Гц); 7,46 (1H, дублет, J=7 Гц); 7,54 (1H, триплет, J=7 Гц); 7,66 - 7,72 (2H, мультиплет).
Пример2.2-Бутил-4-(1-гидрокси-1-метилэтил)-1-[(21-оксалобифенил-4-ил)метил]имидазол-5-карбоновая кислота.
2(a). Этил-2-бутил-4-(1-гидрокси-1-метилэтил)-1-[(21-метоксалилбифенил-4-ил)метил]имидазол-5-карбоксилат.
Опыт проводят по методике, описанной в примере 1(a), но применяют 509 мг этил-2-бутил-4-(1-гидрокси-1-метилэтил)имидазол-5-карбоксилата, 247 мг трет-бутоксида калия и 733 мг метил-(41-бромметилбифенил-2-ил)глиоксилата (полученного как описано в препарате 8). Получают 878 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,91 (3H, триплет, J=7,5 Гц); 1,27 (3H, триплет, J=7 Гц); 1,39 (2H, секстет, J=7,5 Гц); 1,64 (6H, синглет); 1,62-1,75 (2H, мультиплет); 2,67 (2H, триплет, J=7,5 Гц); 3,31 (3H, синглет); 4,27 (2H, квартет, J=7 Гц); 5,51 (2H, синглет); 5,69 (1H, синглет); 6,99 (2H, дублет, J=8 Гц); 7,27 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J= 7 Гц); 7,51 (1H, триплет, J=7 Гц); 7,65 (1H, триплет, J=7 Гц); 7,81 (1H, дублет, J=7 Гц).
2(b). 2-Бутил-4-(1-гидрокси-1-метилэтил)-1-[(21-оксалобифенил-4-ил)метил]имидазол-5-карбоновая кислота.
Опыт проводят по методике, описанной в примере 1 (b), но применяют 878 мг этил-2-бутил-4-(1-гидрокси-1-метилэтил)-1-[(21-метоксалилбифенил-4-ил)метил] имидазол-5-карбоксилата (полученного, как описано выше в стадии (a)) и 364 мг моногидрата гидроксида лития и получают 571 мг целевого соединения в виде порошка, размягчающегося при 140oC и плавящегося при 165-170oC.
Спектр ЯМР (генсадейтерированный диметилсульфоксид, 270 МГц), δ/ млн. -1: 0,82 (3H, триплет, J=7,5 Гц); 1,28 (2H, секстет, J=7,5 Гц); 1,47-1,60 (2H, мультиплет); 1,55 (6H, синглет); 2,63 (2H, триплет, J=7,5 Гц); 6,71 (2H, синглет); 7,08 (2H, дублет, J=8 Гц); 7,26 (2H, дублет, J=8 Гц); 7,46 (1H, дублет, J=7 Гц); 7,55 (1H, триплет, J=7 Гц); 7,67-7,72 (2H, мультиплет).
Пример 3. Хлоргидрат этил-4-(1-гидрокси-1-метилэтил)-1-[(21-оксалобифенил-4-ил) метил]-2-пропилимидазол-5-карбоксилата (хлоргидрат соединения N 1-26).
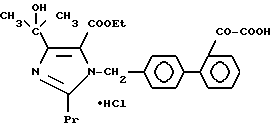
3(а). Этил-1-[(21-трет-бутоксалилбифенил-4-ил)метил]-4- (1-гидрокси-1-метилэтил)-2-пропилимидазол-5-карбоксилат.
Опыт проводят по методике, описанной в примере 1 (а), но используют 2,18 г этил-4-(1-гидрокси-1-метилэтил)-2-пропилимидазол-5- карбоксилата, 1,12 г трет-бутоксида калия и 3,75 г трет-бутил-(41-бромметилбифенил-2-ил)глиоксилата (полученного как описано в препарате 9) и получают 3,73 г целевого соединения в виде смолы.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,98 (3H, триплет, J = 7,5 Гц); 1,16 (9H, синглет); 1,23 (2H, триплет J = 7 Гц), 1,64 (6H, синглет); 1,76 (2H, секстет, J = 7,5 Гц); 2,63 (2H, триплет, J = 7,5 Гц); 4,25 (2H, квартет, J = 7 Гц); 5,50 (2H, синглет); 5,73 (1H, синглет); 7,00 (2H, дублет, J = 8 Гц); 7,30 (2H, дублет, J = 8 Гц); 7,30 (2H, дублет, J = 8 Гц); 7,40 (1H, дублет, J = 7 Гц); 7,48 (1H, триплет, J = 7 Гц); 7,60 (1H, триплет, J = 7 Гц); 7,71 (1H, дублет, J = 7 Гц).
3(b). Хлоргидрат этил-4-(1-гидрокси-1-метилэтил)-1- [(21-оксалобифенил-4-ил)метил]-2-пропилимидазол-5-карбоксилата.
570 мг этил-1-[(21-трет-бутоксиоксалилбифенил-4-ил) метил]-4-(1-гидрокси-1-метилэтил)-2-пропилимидазол-5-карбоксилата (полученного как описано в стадии (a) выше) растворяют в 6 мл 4н. раствора хлористого водорода в диоксане и образующийся раствор перемешивают при комнатной температуре 4 ч. Затем реакционную смесь концентрируют испарением при пониженном давлении и образующийся остаток растирают в диэтиловом эфире, получая 448 мг целевого соединения в виде кристаллического порошка, плавящегося при 156 - 158oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,89 (3H, триплет, J = 7,5 Гц); 1,17 (3H, триплет, J = 7 Гц); 1,50 - 1,65 (2H, мультиплет); 1,61 (6H, синглет); 2,96 (2H, триплет, J = 7,5 Гц); 4,24 (2H, квартет, J = 7 Гц); 5,65 (2H, синглет); 7,17 (1H, дублет, J = 8 Гц); 7,29 (2H, дублет, J = 8 Гц); 7,46 (1H, дублет, J = 7 Гц); 7,57 (1H, триплет, J = 7 Гц); 7,68 - 7,74 (2H, мультиплет).
Пример 4. Хлоргидрат пивалоилоксиметил-4-(1-гидрокси-1-метилэтил)-1-[(21-оксалобифенил-4-ил)метил] -2-пропилимидазол-5- карбоксилата (хлоргидрат соединения N 1-27).
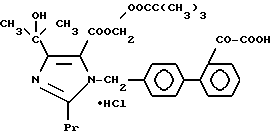
4(a). Пивалоилоксиметил-1-[(21-трет-бутоксиоксалилбифенил -4-ил)метил] -4-(1-гидрокси-1-метилэтил)-2-пропилимидазол-5- карбоксилат.
Опыт проводят по методике, описанной в примере 1 (a), но применяют 1,64 г пивалоилоксиметил-4-(1-гидрокси-1-метилэтил)-2- пропилимидазол-5-карбоксилата, 617 мг трет-бутоксида калия и 2,25 г третбутил- (41-бромметилбифенил-2-ил)глиоксилата (полученного как описано в препарате 9) и получают 936 мг целевого соединения в виде смолы.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,00 (3H, триплет, J = 7,5 Гц); 1,15 (9H, синглет); 1,17 (3H, синглет); 1,62 (6H, синглет) 1,82 (2H, секстет, J = 7,5 Гц), 2,64 (2H, триплет, J = 7,5 Гц); 5,37 (1H, синглет); 5,48 (2H, синглет); 5,84 (2H, синглет); 7,03 (2H, дублет, J = 8 Гц); 7,30 (2H, дублет, J = 8 Гц); 7,39 (1H, дублет, J = 7 Гц); 7,48 (1H, триплет, J = 7 Гц); 7,60 (1H, триплет, J = 7 Гц); 7,71 (1H, дублет, J = 7 Гц).
4(b). Хлоргидрат пивалоилоксиметил-4-(1-гидрокси-1-метилэтил)- 1-[(21-оксалобифенил-4-ил)метил]-2-пропилимидазол-5- карбоксилата.
936 мг пивалоилоксиметил-1-[(21-трет-бутоксалилбифенил- 4-ил)метил]-4-(1-гидрокси-1-метилэтил)-2-пропилимидазол-5- карбоксилата (полученного как описано в стадии (a) выше) обрабатывают 10 мл 4 н. раствора хлористого водорода в диоксане, как описано в примере 3 (b), и получают 655 мг целевого соединения в виде аморфного порошка, размягчающегося при 85oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,88 (3H, триплет, J = 7,5 Гц); 1,10 (9H, синглет); 1,48 - 1,62 (2H, мультиплет); 1,58 (6H, синглет); 2,90 (2H, триплет, J = 7,5 Гц); 5,64 (2H, синглет); 5,88 (2H, синглет); 7,17 (2H, дублет, J = 8 Гц); 7,28 (2H, дублет, J = 8 Гц); 7,46 (1H, дублет, J = 7 Гц); 7,57 (1H, триплет, J = 7 Гц); 7,68 - 7,74 (2H, мультиплет).
Пример 5. Хлоргидрат (5-метил-2-оксо-1,3-диоксолен-4-ил)-метил-4- (1-гидрокси-1-метилэтил)-1-[(21-оксалобифенил-4-ил)метил] -2-пропилимидазол-5-карбоксилата (хлоргидрат соединения N 1-28).
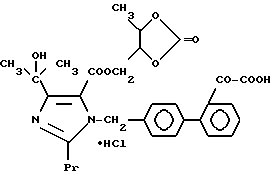
5(a). (5-Метил-2-оксо-1,3-диоксолен-4-ил)метил-1-[(21- трет-бутоксиоксалилоифенил-4-ил)метил] -4-(1-гидрокси-1-метилэтил)- 2-пропилимидазол-5-карбоксилат.
Раствор 315 мг (5-метил-2-оксо-1,3-диоксолен-4-ил)метил-4- (1-гидрокси-1-метилэтил)-2-пропилимидазол-5-карбоксилата и 364 мг трет-бутил(41-бромметилоифенил-2-ил)глиоксилата (полученного как описано в препарате 9) в 10 мл диметилацетамида добавляют по каплям при перемешивании к 3 мл диметилацетамида, содержащего 268 мг порошка карбоната калия, при 60oC. После окончания прибавления образующуюся смесь перемешивают при 60oC 1,5 ч. Затем к реакционной смеси добавляют этилацетат и воду, органический слой отделяют, промывают водой и сушат безводным сульфатом магния. Растворитель удаляют испарением при пониженном давлении. Остаток хроматографируют на колонке через силикагель, используя в качестве элюента смесь 1 : 1 по объему этилацетата и гексана. Полученный кристаллический продукт промывают диизопропиловым эфиром и получают 195 мг целевого соединения, плавящегося при 154 - 156oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,00 (3H, триплет, J = 7,5 Гц); 1,18 (9H, синглет); 1,652 (6H, синглет); 1,78 (2H, секстет J = 7,5 Гц); 2,08 (3H, синглет); 2,66 (2H, триплет, J = 7,5 Гц); 4,92 (2H, синглет); 5,43 (2H, синглет); 5,55 (1H, синглет); 6,96 (2H, дублет, J=8 Гц); 7,30 (2H, дублет, J= 8 Гц); 7,44 (1H, дублет, J=7 Гц); 7,49 (1H, триплет, J=7 Гц); 7,63 (1H, триплет, J=7 Гц); 7,71 (1H, дублет, J=7 Гц).
5(b). Хлоргидрат (5-метил-2-оксо-1,3-диоксолен-4-ил)метил-4-(1-гидрокси- 1-метилэтил)-1-[(21-оксалобифенил-4-ил)метил] -2 -пропилимидазол-5- карбоксилата.
360 мг (5-метил-2-оксо-1,3-диоксолен-4-ил)метил-1-[(21- третбутоксиоксалилбифенил-4-ил)метил] -4-(1-гидрокси-1-метилэтил)-2- пропилимидазол-5-карбоксилата (полученного, как описано выше в стадии (a) обрабатывают 5 мл 4н. раствора хлористого водорода в диоксане, как описано в примере 3(b) и получают 308 мг целевого соединения в виде аморфного порошка, размягчающегося при 80oC и выше.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,89 (3H, триплет, J=7,5 Гц); 1,50-1,62 (2H, мультиплет); 1,59 (9H, синглет); 2,12 (6H, синглет); 2,95 (2H, триплет, J=7,5 Гц); 5,15 (2H, синглет); 5,63 (2H, синглет); 7,15 (2H, дублет, J=8 Гц); 7,27 (2H, дублет, J=8 Гц); 7,48 (1H, дублет, J=7 Гц); 7,57 (1H, триплет, J=7 Гц); 7,68-7,76 (2H, мультиплет).
Пример 6. 4-Гидроксиметил-1-[(21-оксалобифенил-4-ил)метил]-2- пропилимидазол-5-карбоновая кислота (соединение N 1-4).
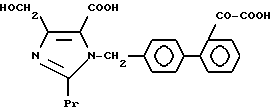
6(a). Этил-4-ацетоксиметил-1-[(21-метоксалилбифенил-4-ил)метил] -2- пропилимидазол-5-карбоксилат.
210 мг карбоната калия и 583 мг метил(41-бромметилбифенил-4-ил)глиоксилата (полученного как описано в препарате 8) добавляют, в указанном порядке к 5 мл раствора 387 мг этил-4-ацетоксиметил-2-пропилимидазол-5-карбоксилата в диметилацетамиде и образующуюся смесь перемешивают при комнатной температуре 16 ч. Затем к реакционной смеси добавляют этилацетат и воду, органический слой отделяют, промывают водой и насыщенным водяным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель удаляют испарением при пониженном давлении. Образующийся остаток хроматографируют на колонке через силикагель, применяя в качестве элюента смесь 2:1 по объему этилацетата и гексана, и получают 696 мг целевого соединения в виде смолы из фракции, элюирующейся первой.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,98 (3H, триплет, J=7,5 Гц); 1,31 (3H, триплет, J=7 Гц); 1,77 (2H, секстет, J=7,5 Гц); 2,12 (3H, синглет); 2,65 (2H, триплет, J=7,5 Гц); 3,30 (3H, синглет); 4,26 (2H, квартет, J=7 Гц); 5,33 (2H, синглет); 5,61 (2H, синглет); 7,04 (2H, дублет, J=8 Гц); 7,27 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J=7 Гц); 7,51 (1H, триплет, J=7 Гц); 7,64 (1H, триплет, J=7 Гц); 7,82 (1H, дублет, J=7 Гц).
Из следующей элюирующейся фракции получают 156 мг этил-5-ацетоксиметил-1- [(21-метоксалилоифенил-4-ил)метил] -2-пропилимидазол-4-карбоксилата, являющегося изомером целевого соединения.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,96 (3H, триплет, J=7,5 Гц); 1,41 (3H, триплет, J=7 Гц); 1,75 (2H, секстет, J=7,5 Гц); 1,92 (3H, синглет); 2,63 (2H, триплет, J=7,5 Гц); 3,41 (3H, синглет); 4,42 (2H, квартет, J=7 Гц); 5,25 (2H, синглет); 5,43 (2H, синглет); 6,99 (2H, дублет, J=8 Гц); 7,29 (2H, дублет, J=8 Гц); 7,40 (1H, дублет, J=7 Гц); 7,52 (1H, триплет, J=7 Гц); 7,64 (1H, триплет, J=7 Гц); 7,80 (1H, дублет, J=7 Гц).
6(b). 4-Гидроксиметил-1-[(21-оксалобифенил-4-ил)метил]-2- пропилимидазол-5-карбоновая кислота.
8,2 мл 1н. водного раствора гидроксида натрия добавляют к раствору 696 мг этил-4-ацетоксиметил-1-[(21-метоксалилоифенил-4- ил)метил]-2-пропилимидазол-5-карбоксилата (полученного как описано в стадии (a) выше) в 8,9 мл диоксана и образующуюся смесь перемешивают при комнатной температуре 16 ч. Затем диоксан отгоняют при пониженном давлении и к оставшемуся водному раствору добавляют 8,2 мл 1н. водного раствора хлористоводородной кислоты. Выпавшие кристаллы собирают фильтрованием и получают 428 мг целевого соединения, плавящегося при 223-225oC (с разложением).
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,88 (3H, триплет, J=7,5 Гц); 1,61 (2H, секстет, J=7,5 Гц); 4,66 (2H, синглет); 5,68 (2H, синглет); 7,09 (2H, дублет, J=8 Гц); 7,27 (2H, дублет, J=8 Гц); 7,45 (1H, дублет, J=7 Гц); 7,54 (1H, триплет, J=7 Гц); 7,65-7,73 (2H, мультиплет).
Пример 7. [41-/4-(1-Гидрокси-1-метилэтил)-2-пропил-5-(тетразол-5- ил)имидазол-1-илметил/бифенил-2-ил]глиоксиловая кислота (соединение N 1-40).
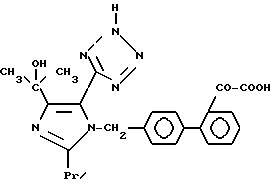
7(a). Метил 41-[4-(1-гидрокси-1-метилэтил)-2-пропил-5-(2- тритилтетразол-5-ил)имидазол-1-илметил]бифенил-2-ил глиоксилат.
Опыт проводят по методике примера 1(a), но применяют 479 мг 4-(1-гидрокси-1-метилэтил)-2-пропил-5-(2-тритилтетразол-5-ил)имидазола, 123 мг трет-бутоксида калия и 336 мг метил-(41-бромметилбифенил-2-ил)глиоксилата (полученного как описано в препарате 8) и получают 527 мг целевого соединения в виде смолы.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,97 (3H, триплет, J=7,5 Гц); 1,57 (9H, синглет); 1,74 (2H, секстет J=7,5 Гц); 3,14 (H, синглет); 5,32 (1H, синглет); 5,43 (2H, синглет); 6,74 (2H, дублет, J=8 Гц); 7,00-7,03 (6H, мультиплет); 7,12 (2H, дублет, J=8 Гц); 7,26-7,37 (10H, мультиплет); 7,51 (1H, триплет, J= 7 Гц); 7,64 (1H, триплет, J=7 Гц); 7,81 (1H, дублет, J=7 Гц).
7(b). Метил[41-/4-(1-гидрокси-1-метилэтил)-2-пропил-5-(тетразол-5- ил)имидазол-1-илметил/бифенил-2-ил]глиоксилат.
1,5 мл воды добавляют к раствору 527 мг метил-[41-/4-(1-гидрокси- 1-метилэтил)-2-пропил-5-(2-тритилтеразол-5-ил)имидазол-1-илметил/бифенил-2- ил] глиоксилата (получен как описано в стадии (a) выше) в 3,5 мл уксусной кислоты и образующуюся смесь перемешивают при 70oC 1,5 ч. Затем добавляют 2 мл воды, образующуюся смесь охлаждают льдом и осадок удаляют фильтрованием. Фильтрат концентрируют упариванием азеотропной перегонкой с толуолом. Получают 206 мг целевого соединения в виде кристаллов с т.пл. 131-132oC (после кристаллизации из смеси диэтиловый эфир и этилацетат).
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,90 (3H, триплет, J=7,5 Гц); 1,47 (6H, синглет); 1:59 (2H, секстет, J=7,5 Гц); 2,80 (2H, триплет, J=7,5 Гц); 3,16 (3H, синглет); 5,67 (2H, синглет); 7,08 (2H, дублет, J=8 Гц); 7,21 (2H, дублет, J=8 Гц); 7,47 (1H, дублет, J=7 Гц); 7,58 (1H, триплет, J=7 Гц); 7,70-7,77 (2H, мультиплет).
7(c). [41-/4-(1-Гидрокси-1-метилэтил)-2-пропил-5-(тетразол-5- ил)имидазол-1-илметил/бифенил-2-ил]глиоксиловая кислота.
Опыт проводят по методике примера 1 (b), но применяют 180 мг метил[41-/4-(1-гидрокси-1-метилэтил)-2-пропил-5-(тетразол-5- ил)имидазол-1-илметил/бифенил-2-ил] глиоксилата (получен как описано в стадии (b) выше) и 77 мг моногидрата гидроксида лития и получают 95 мг целевого соединения с т. пл. 169-170oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,87 (3H, триплет, J=7,5 Гц); 1,43 (6H, синглет); 1,53 (2H, секстет, J=7,5 Гц); 2,81 (2H, триплет, J=7,5 Гц); 5,55 (2H, синглет); 7,12 (2H, дублет, J=8 Гц); 7,22 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J=7 Гц); 7,56 (1H, триплет, J=7 Гц); 7,66-7,75 (2H, мультиплет).
Пример 8. 4-Изопропенил-1-[21-оксалобифенил-4-ил)метил] -2- пропилимидазол-5-карбоновая кислота (соединение N 1-10).
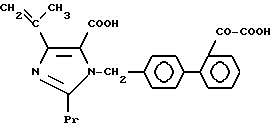
8(a). Этил-4-изопропенил-1-[(21-метоксалилбифенил-4-ил)метил] -2- пропилимидазол-5-карбоксилат.
Опыт проводят по методике, описанной в примере 1 (a), но применяют 445 мг этил-4-изопропенил-2-пропилимидазол-5-карбоксилата, 247 мг трет-бутоксида калия и 733 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен, как описано в препарате 8) и получают 570 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,00 (3H, триплет, J=7,5 Гц); 1,29 (3H, триплет, J=7 Гц); 1,78 (2H, секстет, J=7,5 Гц); 2,16 (3H, синглет); 2,66 (2H, триплет, J=7,5 Гц); 3,32 (3H, синглет); 4,23 (2H, квартет, J= 7 Гц); 5,29 (2H, синглет); 5,57 (2H, синглет); 7,07 (2H, дублет, J=8 Гц); 7,29 (2H, дублет, J=8 Гц); 7,44 (1H, дублет, J=7 Гц); 7,52 (1H, триплет, J=7 Гц); 7,66 (1H, триплет, J=7 Гц); 7,84 (1H, дублет, J=7 Гц).
8(b). 4-Изопропенил-1-[(21-оксалобифенил-4-ил)метил] -2- пропилимидазол-5-карбоновая кислота.
Раствор 279 мг этил-4-изопропенил-1-[(21-оксалобифенил-4- ил)метил]-2-пропилимидазол-5-карбоксилата (получен как описано выше в стадии (a)) в 3 мл диоксана смешивают с раствором моногидрата гидроксида лития в 3 мл воды и образующуюся смесь перемешивают при 80oC 5 ч. Затем диоксан отгоняют при пониженном давлении и к оставшемуся водному раствору добавляют 2,94 мл 1н. водной хлористоводородной кислоты. Выпавшие кристаллы собирают фильтрованием и получают 214 мг целевого соединения, плавящегося при 150-151oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,90 (3H, триплет, J=7,5 Гц); 1,63 (2H, секстет, J=7,5 Гц); 2,07 (6H, синглет); 2,60 (2H, триплет, J=7,5 Гц); 5,21 (1H, синглет); 5,30 (1H, синглет); 5,58 (2H, синглет); 7,10 (2H, дублет, J=8 Гц); 7,26 (2H, дублет, J=8 Гц); 7,46 (1H, дублет, J=7 Гц); 7,54 (1H, триплет, J=7 Гц); 7,66-7,72 (2H, мультиплет).
Пример 9. 4-Изопропил-1-(21-оксалобифенил-4-ил)метил-2- пропилимидазол-5-карбоновая кислота.
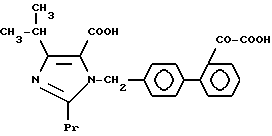
9(a). Этил-4-изопропил-1-[(21-метоксилилбифенил-4-ил)метил] -2- пропилимидазол-5-карбоксилат.
Опыт проводят по методике, описанной в примере 1(a), но применяют 448 мг этил-4-изопропил-2-пропилимидазол-5-карбоксилата, 247 мг трет-бутоксида калия и 733 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и получают 760 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,96 (3H, триплет, J=7,5 Гц); 1,29 (6H, дублет, J=7 Гц); 1,31 (3H, триплет, J= 7 Гц); 1,67 (2H, секстет, J= 7,5 Гц); 2,65 (2H, триплет, J=6,5 Гц); 3,29 (3H, синглет); 3,61 (1H, септет, J= 7,5 Гц); 4,24 (2H, квартет, J=7 Гц); 5,56 (2H, синглет); 7,01 (2H, дублет, J=8 Гц); 7,25 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J=7 Гц); 7,50 (1H, триплет, J= 7 Гц); 7,63 (1H, триплет, J=7 Гц); 7,81 (1H, дублет, J=7 Гц).
9(b). 4-Изопропил-1-[(21-оксалобифенил-4-ил)метил] -2- пропилимидазол-5-карбоновая кислота.
Опыт проводят по методике, описанной в примере 8(b), но применяют 760 мг этил-4-изопропил-1-[(21-метоксалилбифенил-4- ил)метил]-2-пропилимидазол-5-карбоксилата (полученного как описано выше на стадии (a)) и 335 мг моногидрата гидроксида лития и получают 527 мг целевого соединения в виде порошка, плавящегося при 177-178oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,88 (3H, триплет, J=7,5 Гц); 1,21 (6H, дублет, J= 7,5 Гц); 1,60 (2H, секстет, J= 7,5 Гц); 2,60 (2H, триплет, J=7,5 Гц); 3,64 (1H, септет, J=7,5 Гц); 5,62 (2H, синглет); 7,06 (2H, дублет, J= 8 Гц); 7,26 (2H, дублет, J=8 Гц); 7,45 (1H, дублет, J=7 Гц); 7,53 (1H, триплет, J=7 Гц); 7,65-7,72 (2H, мультиплет).
Пример 10. 4-(1-Гидрокси-2-метилпропил)-1-[(21-оксалобифенил-4- ил)метил]-2-пропилимидазол-5-карбоксамид (соединение N 1-22).
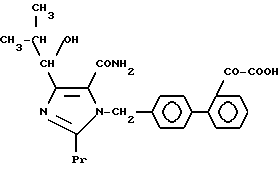
10(a). 4-(1-Гидрокси-2-метилпропил)-1-[(21-метоксалилбифенил-4- ил)-метил]-2-пропилимидазол-5-карбонитрил.
107 мг карбоната калия и 309 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) добавляют к раствору 160 мг 4-(1-гидрокси-2-метилпропил)-2-пропилимидазол-5-карбонитрила в 3,5 мл диметилацетамида и образующуюся смесь перемешивают при комнатной температуре 3 ч. Затем к реакционной смеси добавляют этилацетат и воду, слой этилацетата отделяют и сушат безводным сульфатом магния. Растворитель отгоняют при пониженном давлении. Образующийся остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь 2:1 по объему этилацетата и гексана, и получают 180 мг целевого соединения в виде кристаллов с т.пл. 113oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,94 (3H, дублет, J=6,5 Гц); 0,97 (3H, триплет, J=7,5 Гц); 1,00 (3H, дублет, J= 6,5 Гц); 1,75 (2H, секстет, J= 7,5 Гц); 2,07-2,20 (1H, мультиплет); 2,64 (2H, триплет, J=7,5 Гц); 3,36 (3H, синглет); 4,55 (1H, дублет, J=6 Гц); 5,24 (2H, синглет); 7,13 (2H, дублет, J= 8 Гц); 7,33 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J=7 Гц); 7,52 (1H, триплет, J=7 Гц); 7,65 (1H, дублет, J=7 Гц); 7,82 (1H, дублет, J=7 Гц).
10(b). 4-(1-Гидрокси-2-метилпропил)-1-[(21-оксалобифенил-4-ил)- метил] -2-пропилимидазол-5-карбоксамид.
4 мл 1н. водного раствора гидроксида натрия добавляют к раствору 170 мг 4-(1-гидрокси-2-метилпропил)-1-[(21-метоксалилоифенил-4- ил)метил] -2-пропилимидазол-5-карбонитрила (получен как описано выше в стадии (a)) в 3 мл горячего этанола и образующуюся смесь перемешивают при кипячении с обратным холодильником 2,5 ч. Затем этанол отгоняют при пониженном давлении и к оставшемуся водному раствору добавляют этилацетат. К смеси добавляют 4 мл 1н. водной хлористоводородной кислоты и слой этилацетата отделяют и сушат безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и получают 140 мг целевого соединения в виде кристаллов, плавящихся при 165-170oC (с разложением).
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,69 (3H, дублет, J=6,5 Гц); 0,85 (3H, триплет, J= 7,5 Гц); 1,01 (3H, дублет, J= 6,5 Гц); 1,58 (2H, секстет, J=7,5 Гц); 2,01-2,16 (2H, мультиплет); 2,54 (2H, триплет, J=7,5 Гц); 4,32 (1H, дублет, J=8,5 Гц); 5,54 (1H, дублет, J= 16,5 Гц); 5,79 (1H, дублет, J= 16,5 Гц); 6,21 (1H, широкий синглет); 7,06 (2H, дублет, J=8 Гц); 7,25 (2H, дублет, J=8 Гц); 7,41 (1H, широкий синглет); 7,45 (1H, дублет, J=7 Гц); 7,53 (1H, триплет, J=7 Гц): 7,64-7,71 (2H, мультиплет); 8,49 (1H, широкий синглет).
Пример 11. 4-(1-Гидрокси-2,2-диметилпропил)-1-[(21- оксалобифенил-4-ил)метил]-2-пропилимидазол-5-карбоксамид (соединение N 1-24).
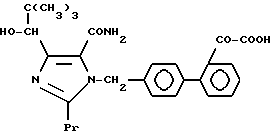
11(a). 4-(1-Гидрокси-2,2-диметилпропил)-1-[(21- метоксалилбифенил-4-ил)метил]-2-пропилимидазол-5-карбонитрил.
Опыт проводят по методике, описанной в примере 10(a), но применяют 170 мг 4-(1-гидрокси-2,2-диметилпропил)-2-пропилимидазол-5- карбонитрила, 307 мг метил(41-бромметилбифенил-2-ил)-глиоксилата (получен как описано в препарате 8) и 106 мг карбоната калия и получают 257 мг целевого соединения в виде кристаллов, плавящихся при 128-130oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,97 (3H, триплет, J=7,5 Гц); 0,99 (9H, синглет); 1,75 (2H, секстет, J=7,5 Гц); 2,64 (2H, триплет, J=7,5 Гц); 2,76 (1H, дублет, J=7 Гц); 3,35 (3H, синглет); 4,45 (1H, дублет, J=7 Гц); 5,23 (2H, синглет); 7,13 (2H, дублет, J=8 Гц); 7,33 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J=7 Гц); 7,53 (1H, триплет, J=7 Гц); 7,66 (1H, триплет, J=7 Гц); 7,82 (1H, дублет, J= 7 Гц).
11(b). 4-(1-Гидрокси-2,2-диметилпропил)-1-[(21-оксалобифенил-4- ил)метил]-2-пропилимидазол-5-карбоксамид.
246 мг 4-(1-гидрокси-2,2-диметилпропил)-1-[(21- метоксалилбифенил-4-ил)метил]-2-пропилимидазол-5-карбонитрила (получен как описано выше в стадии (a)) подвергают гидролизу, используя 6 мл 1н. водного раствора гидроксида натрия, по методике, описанной в примере 10(b), и получают 182 мг целевого соединения в виде кристаллов, плавящихся при 198-200oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,85 (3H, триплет, J=7,5 Гц); 0,89 (9H, синглет); 1,58 (2H, секстет, J=7,5 Гц); 2,56 (2H, триплет, J=7,5 Гц); 4,51 (1H, синглет); 5,48 (1H, дублет, J= 16,5 Гц); 5,81 (1H, дублет, J=16,5 Гц); 6,22 (1H, широкий синглет); 7,05 (2H, дублет, J=8 Гц); 7,26 (2H, дублет, J=8 Гц); 7,39 (1H, широкий синглет); 7,44 (1H, дублет, J=7 Гц); 7,52 (1H, дублет, J=7 Гц); 7,64-7,71 (2H, мультиплет); 8,68 (1H, широкий синглет).
Пример 12. 2-Бутил-4-(1-гидрокси-2-метилпропил)-1-[(21- оксалобифенил-4-ил)метил]имидазол-5-карбоксамид (соединение N 1-23).
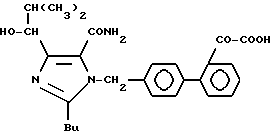
12(a). 2-Бутил-4-(1-гидрокси-2-метилпропил)-1-[(21-метоксалил- бифенил-4-ил)метил]имидазол-5-карбонитрил.
Опыт проводят по методике, описанной в примере 10(a), но применяют 178 мг 2-бутил-4-(1-гидрокси-2-метилпропил)имидазол-5-карбонитрила, 322 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и 11 мг карбоната калия и получают 245 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ/ млн.-1: 0,91 (3H, триплет, J=7,5 Гц); 0,94 (3H, дублет, J=6,5 Гц); 1,00 (3H, дублет, J= 6,5 Гц); 1,37 (2H, секстет, J=7,5 Гц); 1,70 (2H, квинтет, J=8 Гц); 2,07-2,19 (1H, мультиплет); 2,66 (2H, триплет, J=8 Гц); 3,36 (3H, синглет); 4,54 (1H, дублет, J=6 Гц); 5,23 (2H, синглет); 7,13 (2H, дублет, J=8 Гц); 7,33 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J= 7 Гц); 7,52 (1H, триплет, J=7 Гц); 7,66 (1H, триплет, J=7 Гц); 7,82 (1H, дублет, J=7 Гц).
12(b). 2-Бутил-4-(1-гидрокси-2-метилпропил)-1-[(21-оксалобифенил- 4-ил)метил]имидазол-5-карбоксамид.
245 мг 2-бутил-4-(1-гидрокси-2-метилпропил)-1-[(21- метоксалилобифенил-4-ил)метил] имидазол-5-карбонитрила (получен как описано выше в стадии (a)) подвергают гидролизу, используя 6 мл 1н. водного раствора гидроксида натрия, по методике, описанной в примере 10(b) и получают 187 мг целевого соединения в виде порошка с температурой размягчения 144-146oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,69 (3H, дублет, J=6,5 Гц); 0,81 (3H, триплет, J= 7,5 Гц); 1,01 (3H, дублет, J=6,5 Гц); 1,26 (2H, секстет, J=7,5 Гц); 1,52 (2H, квинтет, J=7,5 Гц); 1,99-2,16 (1H, мультиплет); 2,57 (2H, триплет, J=7,5 Гц); 4,33 (1H, дублет, J= 8,5 Гц); 5,55 (1H, дублет, J=16,5 Гц); 5,78 (1H, дублет, J=16,5 Гц); 6,22 (1H, широкий синглет); 7,07 (2H, дублет, J=8 Гц); 7,25 (2H, дублет, J=8 Гц); 7,45 (1H, дублет, J= 7 Гц); 7,54 (1H, триплет, J=7 Гц); 7,50 (1H, широкий синглет); 7,64-7,72 (2H, мультиплет); 8,50 (1H, широкий синглет).
Пример 13. 2-Бутил-4-(1-гидрокси-2,2-диметилпропил)-1-[(21- оксалобифенил-4-ил)метил]имидазол-5-карбоксамид (соединение N 1-25).
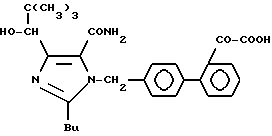
13(a). 2-Бутил-4-(1-гидрокси-2,2-диметилпропил)-1-[(21- метоксалилофенил-4-ил)метил]имидазол-5-карбонитрил.
Опыт проводят по методике, описанной в примере 10(a), но применяют 340 мг 2-бутил-4-(1-гидрокси-2,2-диметилпропил)имидазол-5-карбонитрила, 340 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и 117 мг карбоната калия и получают 335 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,91 (3H, триплет, J=7,5 Гц); 0,99 (9H, синглет); 1,36 (2H, секстет, J=7,5 Гц); 1,69 (2H, квинтет, J=7,5 Гц); 2,66 (2H, триплет, J=7,5 Гц); 3,36 (3H, синглет); 4,46 (1H, синглет); 5,23 (2H, синглет); 7,13 (2H, дублет, J=8 Гц); 7,33 (2H, дублет, J=8 Гц); 7,42 (1H, дублет, J=7 Гц); 7,52 (1H, триплет, J=7 Гц); 7,63 (1H, триплет, J= 7 Гц); 7,82 (1H, дублет, J=7 Гц).
13(b). 2-Бутил-4-(1-гидрокси-2,2-диметилпропил)-1- [(21-оксалобифенил-4-ил)метил]имидазол-5-карбоксамид.
335 мг 2-бутил-4-(1-гидрокси-2,2-диметилпропил)-1- [(21-метоксалилбифенил-4-ил)метил] имидазол-5-карбонитрила (получен, как описано выше в стадии (a) ) гидролизуют, используя 7 мл 1н. водного раствора NaOH, по методике, описанной в примере 10(b), и получают 256 мг целевого соединения в виде кристаллического порошка, плавящегося при 192-194oC (с разложением).
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,81 (3H, триплет, J = 7,5 Гц); 1,26 (2H, секстет, J = 7,5 Гц); 1,51 (2H, квинтет, J = 7,5 Гц); 2,59 (2H, триплет, J = 7,5 Гц); 4,51(1H, синглет); 5,48 (1H, дублет, J = 16,5 Гц); 5,8 (1H, дублет, J = 16,5 Гц); 6,22 (1H, широкий синглет); 7,06 (2H, дублет, J = 8 Гц); 7,26 (2H, дублет, J = 8 Гц); 7,42 (1H, широкий синглет); 7,44 (1H, дублет, J = 7 Гц); 7,53 (1H, триплет, J = 7 Гц); 7,64-7,72 (2H, мультиплет); 8,69 (1H, широкий синглет).
Пример 14. 2-Этоксиметил-4-(1-гидрокси-1-метилэтил)-1-[(21- оксалобифенил-4-ил)метил]имидазол-5-карбоновая кислота (соединение N 1-37).
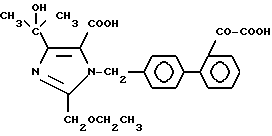
14(a). Этил-2-этоксиметил-4-(1-гидрокси-1-метилэтил)-1- [(21 - метоксалилбифенил-4-ил)метил]имидазол-5-карбоксилат.
Опыт проводят по методике, описанной в примере 1(a), но применяют 400 мг этил-2-этоксиметил-4-(1-гидрокси-1-метилэтил)имидазол-5-карбоксилата, 546 мг метил (41 - бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и 184 мг трет-бутоксида калия и получают 680 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,16 (3H, триплет, J = 7 Гц); 1,28 (3H, триплет, J = 7 Гц); 1,64 (6H, синглет); 3,31 (3H, синглет); 3,54 (2H, квартет, J = 7 Гц); 4,29 (3H, квартет, J = 7 Гц); 4,57 (2H, синглет); 5,55 (1H, синглет); 5,66 (2H, синглет); 7,02 (2H, дублет, J = 8,0 Гц); 7,26 (2H, дублет, J = 8,0 Гц) 7,41 (1H, дублет, J = 7,5 Гц); 7,51 (1H, триплет, J = 7,5 Гц); 7,64 (1H, триплет, J = 7,5 Гц); 7,81 (1H, дублет, J = 7,5 Гц).
14(b). 2-Этоксиметил-4-(1-гидрокси-1-метилэтил)-1-[(21- оксалобифенил-4-ил)метил]имидазол-5-карбоновая кислота.
680 мг этил-2-этоксиметил-4-(1-гидрокси-1-метилэтил)-1- [(21-метоксалилбифенил-4-ил)метил] имидазол-5-карбоксилата (получен как описано выше в стадии (a)) гидролизуют, используя 224 мг моногидрата лития, по методике, описанной в примере 1 (b), и получают 423 мг целевого соединения в виде порошка, плавящегося при 138-140oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 1,04 (триплет, J = 7,0 Гц); 1,56 (6H, синглет); 3,45(2H, квартет, J = 7,0 Гц); 4,47 (2H, синглет); 5,71 (2H, синглет); 7,09 (2H, дублет, J = 8,0 Гц), 7,24 (2H, дублет, J = 8,0 Гц 7,47 (1H, дублет, J = 7,5 Гц); 7,55 (1H, триплет, J = 8,0 Гц); 7,66 - 7,73 (2H, мультиплет).
Пример 15. Хлоргидрат 4-(1-гидрокси-1-метилэтил)-2- (метиламинометил)-1-[(21-оксалобифенил-4-ил)метил] имидазол-5-карбоновой кислоты (хлоргидрат соединения N 1-48).

15(a). Метил-2-(N-трет-бутоксикарбонил-N-метиламинометил) -4-(1-гидрокси-1-метилэтил)-1-[(21 -метоксалилбифенил-4-ил)метил/имидазол-5-карбоксилат.
Опыт проводят по методике, описанной в примере 1 (a), но применяют 265 мг этил-2-(N-трет-бутоксикарбонил-N-метиламинометил)-4-(1-гидрокси-1-метилэтил)имидазол-5-карбоксилата, 310 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и 92 мг трет-бутоксида калия и получают 380 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,28 (3H, триплет, J = 7,5 Гц) 1,34 (9H, синглет); 1,63 (6H, синглет); 2,85 (3H, синглет); 3,32 (3H, синглет); 4,27 (2H, квартет, J = 7,5 Гц); 4,56 (2H, широкий синглет); 5,6 (1H, широкий синглет); 5,63 (2H, широкий синглет), 6,93 (2H, дублет, J = 8,0 Гц); 7,25(2H, дублет, J = 8,0 Гц); 7,39 (1H, дублет, J = 8,0 Гц); 7,5 (1H, триплет, J = 8,0 Гц); 7,64 (1H, триплет, J = 8,0 Гц); 7,80 (1H, дублет, J = 8,0 Гц).
15(b). 2-(N-трет-Бутоксикарбонил-N-метиламинометил)-4- (1-гидрокси- 1-метилэтил)-1-[(21 - оксалобифенил-4-ил)метил]имидазол-5-карбоновая кислота.
Раствор 81 мг моногидрата гидроксида лития в 5 мл воды добавляют к раствору 380 мг метил-2-(N-трет-бутоксикарбонил-N-метиламинометил) -4-(1-гидрокси-1-метилэтил)-1-[(21- метоксалилбифенил-4-ил)метил] имидазол-5-карбоксилата (получен как описано выше в стадии (a)) в 5 мл диоксана и образующуюся смесь перемешивают при комнатной температуре 2,5 ч. Затем диоксан отгоняют при пониженном давлении и к остатку добавляют 1,93 мл 1н. водной соляной кислоты. Осадок отфильтровывают и получают 339 мг целевого соединения в виде аморфного порошка.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 1,31 (9H, широкий синглет); 1,55 (6H, синглет); 2,77 (3H, широкий синглет); 4,43 (2H, широкий синглет); 5,69 (2H, широкий синглет); 7,03 (2H, дублет, J = 8,0 Гц); 7,25 (2H, дублет, J = 8,0 Гц), 7,44 (1H, дублет, J = 8,0 Гц); 7,55 (1H, триплет, J = 7,0 Гц); 7,66-7,72 (2H, мультиплет).
15(c). Хлоргидрат 4-(1-гидрокси-1-метилэтил)-2-(метиламинометил) -1-[(21-оксалобифенил-4-ил)метил]имидазол-5-карбоновой кислоты.
339 мг 2-(N-трет-бутоксикарбонил-N-метиламинометил)-4- (1-гидрокси-1-метилэтил)-1-[(21-оксалобифенил-4-ил)метил] имидазол-5-карбоновой кислоты (получена как описано выше в стадии (b)) обрабатывают 3 мл 4н. раствора хлористого водорода в диоксане, как описано в примере 3 (b) и получают 260 мг целевого соединения, плавящегося при 172-175oC (с разложением).
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 1,60 (6H, синглет); 2,66 (3H, широкий синглет), 4,27 (2H, широкий синглет); 5,75 (2H, синглет); 7,12 (2H, дублет, J = 8,0 Гц); 7,28 (2H, дублет, J = 8,0 Гц); 7,48 (1H, дублет, J = 7,5 Гц), 7,57 (1H, триплет, J - 7,5 Гц); 7,68 - 7,74 (2H, мультиплет).
Пример 16. 2-Этил-5,7-диметил-3-[(21-оксалобифенил-4-ил)-метил]- 3H-имидазо[4,5-b]пиридин (соединение N 2 - 1).
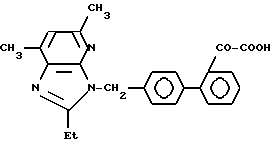
16(a). 2-Этил-3-[(21-метоксилилбифенил-4-ил)метил] - 5,7-диметил-3H-имидазо[4,5-b]пиридин.
Опыт проводят по методике, описанной в примере 1(a), но применяют 350 мг 2-этил-5,7-диметил-3H-имидазо [4,5-b]пиридина, 828 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и 247 мг трет-бутоксида калия и получают 684 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,37 (3H, триплет, J = 7,5 Гц); 2,57 (3H, синглет); 2,64 (3H, синглет); 2,84 (2H, квартет, J = 7,5 Гц); 3,24 (3H, синглет); 5,50 (2H, синглет); 6,90 (1H, синглет); 7,18 (2H, дублет, J = 8 Гц); 7,24 (2H, дублет, J = 8 Гц); 7,41 (1H, дублет, J = 7 Гц); 7,50 (1H, триплет, J = 7 Гц); 7,63 (1H, триплет, J = 7 Гц); 7,80 (1H, дублет, J = 7 Гц).
16(b). 2-Этил-5,7-диметил-3-[(21-оксалобифенил-4- ил)метил] -3H-имидазо/4,5-b/пиридин.
684 мг 2-зтил-3-[(21-метоксилилбифенил-4-ил)метил] - 5,7-диметил-3H-имидазо[4,5-b] пиридина (получен как описано выше в стадии (a)) гидролизуют, используя 201 мг моногидрата гидроксида лития по методике, описанной в примере 1(b), и получают 460 мг целевого соединения в виде порошка, плавящегося при 209 - 210oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 1,28 3H, триплет, J = 7,5 Гц); 2,55 (6H, синглет); 2,83 (2H, квартет, J = 7,5 Гц); 5,53 (2H, синглет); 6,99 (1H, синглет); 7,19 - 7,26 (4H, мультиплет); 7,44 (1H, дублет, J = 7 Гц); 7,54 (1H, триплет, J = 7 Гц); 7-61 - 7,71 (2H, мультиплет).
Пример 17. 2 {N-[(21-Оксалобифенил-4-ил)метил]-N-пропиламино}никотиновая кислота.
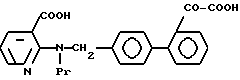
17(a). Этил-2-{ N-[(21-метоксалилбифенил-4-ил)метил]- N-пропиламино}никотинат.
В атмосфере азота 4,65 мл 1 М раствора бис(триметилсилил)амида лития добавляют при (-5) - 0oC к раствору 0,80 г этил-2-пропиламиноникотината в 6 мл тетрагидрофурана и 2 мл гексаметилфосфортриамида и образующуюся смесь перемешивают при указанной температуре 10 мин. Затем добавляют раствор 1,28 г метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) в 8 мл тетрагидрофурана и смесь перемешивают при 10 - 15oC 4 ч. К реакционной смеси добавляют этилацетат и воду, этилацетатный слой отделяют, промывают водой и сушат над безводным MgSO4. Растворитель отгоняют при пониженном давлении, остаток хроматографируют на колонке с силикагелем, применяя в качестве элюента смесь этилацетат/гексан (1:4 по объему) и получают 0,70 г целевого соединения в виде смолы.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,80 (3H, триплет, J = 7,5 Гц); 1,39 (3H, триплет, J = 7,5 Гц); 1,60 (2H, секстет, J = 7,5 Гц); 3,24 (3H, синглет); 3,26 (2H, триплет, J = 7,5 Гц); 4,35 (2H, квартет, J = 7,5 Гц); 4,76 (2H, синглет); 6,70 (1H, дублет, J = 5 и 7,5 Гц); 7,24 (2H, дублет, J = 8 Гц); 7,38 (2H, дублет, J = 8 Гц); 7,44 (1H, дублет, J = 7 Гц); 7,48 (1H, триплет, J = 7 Гц); 7,63 (1H, триплет, J = 7 Гц); 7,91 (1H, дублет дублетов, J = 1,5 и 7,5 Гц); 8,23 (1H, дублет дублетов, J = 1,5 и 5 Гц).
17(b). 2-{ N-{(21-Оксалобифенил-4-ил)метил]-N-пропиламино}-никотиновая кислота.
Раствор 350 мг моногидрата гидроксида лития в 10 мл воды добавляют к раствору 0,70 г этил-2-{N-[(21-метоксилилбифенил- 4-ил)метил]-N-пропиламино} никотината (получен как описано выше на стадии (a)) в 5 мл диоксана и образующуюся смесь перемешивают 4 ч при 70oC. Затем диоксан отгоняют при пониженном давлении, а к оставшемуся водному раствору добавляют 8,33 мл 1н. водной соляной кислоты, выпавшие кристаллы собирают фильтрованием и получают 0,57 г целевого соединения, плавящегося при 179 - 180oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ/ млн. -1: 0,76 (3H, триплет, J = 7,5 Гц); 1,53 (2H, секстет, J = 7,5 Гц); 3,26 (2H, триплет, J = 7,5 Гц); 4,73 (2H, синглет); 6,81 (1H, дублет дублетов, J = 4,5 и 8 Гц); 7,21 (2H, дублет, J = 8 Гц); 7,34 (2H, дублет, J = 8 Гц); 7,48 (1H, дублет, J = 7 Гц); 7,54 (1H, триплет, J = 7 Гц); 7,66 - 7,72 (2H, мультиплет); 7,90 (1H, дублет дублетов, J = 2 и 8 Гц); 8,25 (1H, дублет дублетов, J = 2 и 4,5 Гц).
Пример 18. 2-{N-(2-Метоксиэтил)-N-[(21-оксалобифенил-4"- ил)метил]амино} никотиновая кислота (соединение N 3 - 19).
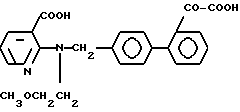
18 (a). Этил-2-{ N-[(21-метоксилибифенил-4-ил)метил] - N-(2-метоксиэтил)амино}никотинат.
Опыт проводят по методике, описанной в примере 17 (a), но применяют 750 мг этил-2-[(2-метоксиэтил)амино]никотината, 1,17 г метил (41-бромметилдифенил-4-ил)глиоксилата (получен как описано в препарате 8) и 4,00 мл 1 М раствора бис(триметилсилил)амида лития в тетрагидрофуране и получают 535 мг целевого соединения в виде сиропа.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,38 (3H, триплет, J = 7,5 Гц); 3,25 (3H, синглет); 3,27 (3H, синглет); 3,52 - 3,61 (4H, мультиплет); 4,33 (2H, квартет, J = 7,5 Гц); 4,81 (2H, синглет); 6,73 (1H, дублет дублетов, J = 4,5 и 8 Гц), 7,24 (2H, дублет, J = 8 Гц); 7,38 (2H, дублет, J = 8 Гц), 7,44 (1H, дублет, J = 7 Гц); 7,48 (1H, триплет, J = 7 Гц); 7,62 (1H, триплет, J = 7 Гц); 7,81 (1H, дублет, J = 7 Гц); 7,92 (1H, дублет дублетов, J = 2 и 8 Гц); 8,24 (1H, дублет дублетов, J=2 и 4,5 Гц).
18(b). 2-{N-(2-Метоксиэтил)-N[(21-оксалобифенил-4-ил) метил]амино}никотиновая кислота.
К раствору 535 мг этил-2-{N-[(21-метоксалилбифенил-4-ил) метил]-N-(2-метоксиэтиламино} никотината (получен как описано выше в стадии (a)) в 4,5 мл диоксана добавляют 1н. водный раствор NaOH и образующуюся смесь перемешивают 19 ч при 50oC. Затем диоксан отгоняют при пониженном давлении, а к оставшемуся водному раствору добавляют 4,5 мл 1н. соляной кислоты. Выпавшие кристаллы собирают фильтрованием и получают 306 мг целевого соединения, плавящегося при 173oC (с разложением).
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 3,16 (3H, синглет); 3,40-3,52 (4H, мультиплет); 4,78 (2H, синглет); 6,83 (1H, дублет дублетов, J=4,5 и 7,5 Гц); 7,21 (2H, дублет, J=8 Гц); 7,34 (2H, дублет, J= 8 Гц); 7,48 (1H, дублет, J=7 Гц); 7,54 (1H, триплет, J=7 Гц); 7,66-7,72 (2H, мультиплет); 7,90 (1H, дублет дублетов, J=1,5 и 7,5 Гц); 8,24 (1H, дублет дублетов, J=1,5 и 4,5 Гц).
Пример 19. Этил-4-(1-гидрокси-1-метилэтил)-1-{ [21- (тетразол-5-ил)карбонил)бифенил-4-ил] метил}-2-пропилимидазол-5- карбоксилат (соединение N 1-50).
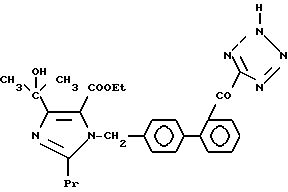
19(a). Этил-4-(1-гидрокси-1-метилэтил)-1-{ [21- (2-тритилтетразол-5-илкарбонил)бифенил-4-ил]метил}-2-пропилимидазол- 5-карбоксилат.
Опыт проводят по методике, описанной в примере 1(a), но применяют 190 мг этил-4-(1-гидрокси-1-метилэтил)-2-пропилимидазол-5- карбоксилата, 93 мг трет-бутоксида калия и 470 мг 41-бромметил- 2-(2-тритилтетразол-5-илкарбонил)бифенила (получен как описано в примере 13) и получают 218 мг целевого соединения в виде аморфного порошка.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,89 (3H, триплет, J=7,5 Гц); 1,12 (3H, триплет, J=7,0 Гц); 1,63 (6H, синглет); 1,60-1,70 (2H, мультиплет); 2,52 (2H, триплет, J=8,0 Гц); 4,14 (2H, квартет, J=7,0 Гц); 5,35 (2H, синглет); 5,74 (1H, синглет); 6,76 (2H, дублет, J=8,5 Гц); 6,92 (5H, дублет, J= 7,5 Гц); 7,07 (2H, дублет, J=8,5 Гц); 7,25-7,38 (1H, мультиплет); 7,45 (1H, триплет, J=7,0 Гц); 7,59 (1H, триплет, J=7,5 Гц); 7,70 (1H, дублет, J= 8,5 Гц).
19(b). Этил-4-(1-гидрокси-1-метилэтил)-1-{ [21-(тетразол- 5-ил-карбонил)бифенил-4-ил]метил}-2-пропилимидазол-5-карбоксилат.
216 мг этил-4-(1-гидрокси-1-метилэтил)-1-{[21-(2- тритилтетразол-5-илкарбонил)биофенил-4-ил] метил}-2-пропилимидазол-5- карбоксилата (получен как описано в стадии (a) выше) детритилируют по методике, описанной в примере 7(b), и получают 151 мг целевого соединения в виде аморфного порошка.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,86 (3H, триплет, J=7,5 Гц); 1,20 (3H, триплет, J=7,5 Гц); 1,53-1,65 (2H, мультиплет); 1,65 (6H, синглет); 2,68 (2H, триплет, J=8,0 Гц); 4,26 (2H, квартет, J=7,5 Гц); 5,41 (2H, синглет); 6,80 (2H, дублет, J=8,0 Гц); 7,24 (2H, дублет, J=8,0 Гц); 7,41-7,49 (2H, мультиплет); 7,58 (1H, триплет, J=7,0 Гц); 7,77 (1H, дублет, J=6,5 Гц).
Пример 20. 4-(1-Гидрокси-1-метилэтил)-1-{ [21-(тетразол-5- ил-карбонил)бифенил-4-ил] метил}-2-пропилимидазол-5-карбоновая кислота (соединение N 1-42).
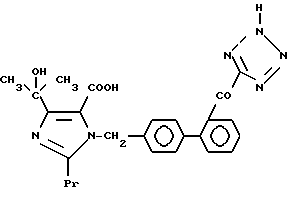
Опыт проводят по методике, описанной в примере 1(b), но применяют 151 мг этил-4-(1-гидрокси-1-метилэтил)-1-{[21- (тетразол-5-илкарбонил)бифенил-4-ил] метил}-2-пропилимидазол-5- карбоксилата и 36 мг моногидрата гидроксида лития и получают 97 мг целевого соединения в виде кристаллического порошка, плавящегося при 166-169oC (с разложением).
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,87 (3H, триплет, J=7,5 Гц); 1,45-1,56 (2H, мультиплет); 1,56 (6H, синглет); 2,58 (2H, триплет, J=7,5 Гц); 5,61 (2H, синглет); 6,94 (2H, дублет, J= 8,5 Гц); 7,19 (2H, дублет, J=8,5 Гц); 7,49-7,58 (2H, мультиплет); 7,67-7,75 (2H, мультиплет).
Пример 21. 2-Этил-5,7-диметил-3-{[21-(тетразол-5- илкарбонил)бифенил-4-ил]метил}-3H-имидазо[4,5-b]пиридин (соединение N 2-51).

21(a). 2-Этил-5,7-диметил-3-{ [21-(2-тритилтетразол-5-илкарбонил) бифенил-4-ил]метил}-3H-имидазо[4,5-b]пиридин.
Опыт проводят по методике, описанной в примере 1(a), но используют 130 мг 2-этил-5,7-диметил-3H-имидазо[4,5-b]пиридина, 522 мг 41-бромметил-2-(2-тритилтетразол-5-илкарбонил)бифенила и 87 мл трет-бутоксида калия и получают 144 мг целевого соединения в виде аморфного порошка.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,23 (3H, триплет, J=7,5 Гц); 2,56 (3H, синглет); 2,63 (3H, синглет); 2,66 (2H, квартет, J=7,5 Гц); 5,34 (2H, синглет); 6,87-6,95 (7H, мультиплет); 6,96 (2H, дублет, J=8 Гц); 7,23-7,40 (10H, мультиплет); 7,37 (1H, дублет, J=7 Гц); 7,46 (1H, триплет, J=7 Гц); 7,58 (1H, триплет, J=7 Гц); 7,71 (1H, дублет, J=7 Гц).
21(b). 2-Этил-5,7-диметил-3-{ (21-(тетразол-5-илкарбонил) бифенил-4-ил] метил}-3H-имидазо[4,5-b]пиридин.
137 мг 2-Этил-5,7-диметил-3-{ [21-(2-тритилтетразол-5-ил- карбонил)бифенил-4-ил] метил} -3H-имидазо[4,5-b] пиридина (получен как описано в стадии (a) выше) детритилируют по методике, описанной в примере 7(b), и получают 68 мг целевого соединения в виде порошка, плавящегося при 174-177oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ/ млн. -1: 1,20 (3H, триплет, J=7,5 Гц); 2,52 (6H, синглет); 2,73 (2H, квартет, J= 7,5 Гц); 5,44 (2H, синглет); 7,03 (1H, синглет); 7,04 (2H, дублет, J=8 Гц); 7,17 (2H, дублет, J=8 Гц); 7,49-7,58 (2H, мультиплет); 7,67-7,55 (2H, мультиплет); 8,31 (1H, синглет).
Пример 22. 2-Бутил-1-[(21-оксалобифенил-4-ил)метил] бензимидазол-5- карбоновая кислота (соединение N 2-53) и 2-бутил-1-[(2-1- оксалобифенил-4-ил)метил]бензимидазол-6-карбоновая кислота (соединение N 2-54).

22(a). Метил-2-бутил-1-[(21-метоксалилбифенил-4-ил)метил]бензимидазол-5- и -6-карбоксилат.
Опыт проводят по методике, описанной в примере 1 (a), но используют 404 мг метил-2-бутилбензимидазол-5-карбоксилата, 637 мг метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и 1200 мг трет-бутоксида калия и получают 620 мг целевого соединения в виде смолы. Из спектров ЯМР установлено, что продукт является смесью 1:1 соединений, содержащих группу метоксикарбонил в положениях 5 и 6.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,96 (3H, триплет, J = 7,5 Гц); 1,47 (2H, секстет, J = 7,5 Гц); 1,88 (2H, квинтет, J = 7,5 Гц); 2,89 (2H, триплет, J = 7,5 Гц); 3,24 и 3,76 (всего 3H, каждый синглет); 3,90 и 3,93 (всего 3H, каждый синглет); 5,41 и 5,45 (всего 2H, каждый синглет); 7,08 - 7,49 (10,5H, мультиплет); 8,48 (0,5H, синглет).
22(b). 2-Бутил-1-[(21-оксалобифенил-4-ил)-метил]бензимидазол-5- и -6-карбоновая кислоты.
650 мг смеси метил-2-бутил-1-[(21-оксалобифенил-4-ил)-метил]бензимидазол-5- и -6-карбоксилатов (получена как описано в стадии (a) выше) гидролизуют, используя 269 мг гидрата гидроксида лития по методике, описанной в примере 1(b), и получают 511 мг целевого соединения в виде порошка, плавящегося при 160 - 180oC. Из спектра ЯМР установлено, что продукт является смесью 1:1 соединений, содержащих карбоксигруппу в положениях 5 и 6.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,89 (3H, триплет, J = 7,5 Гц); 1,39 (2H, секстет, J = 7,5 Гц); 1,75 (2H, квинтет, J = 7,5 Гц); 2,91 (2H, триплет, J = 7,5 Гц); 5,62 и 5,67 (всего 2H, каждый синглет); 7,14 - 7,87 (10H, мультиплет); 8,16 - 8,20 (1H, мультиплет).
Пример 23. 2-Этил-1-[(21-оксалобифенил-4-ил)метил]бензимидазол-7-карбоновая кислота (соединение N 2 - 26).
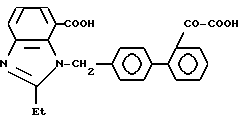
23(a). Этил-2-{ N-трет-бутоксикарбонил-N-[(21- метоксилилбифенил-4-ил)метил]амино}-3-нитробензоат.
Опыт проводят по методике, описанной в примере 1(a), но используют 1,01 г этил-2-трет-бутоксикарбониламино-3-нитробензоата, 1,2 г метил(41-бромметилбифенил-2-ил)глиоксилата (получен как описано в препарате 8) и 155 мг 55% (по массе) дисперсии гидрида натрия в минеральном масле и получают 1,43 г целевого соединения в виде смолы.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,35 (9H, синглет); 1,36 (3H, триплет, J = 7 Гц); 3,31 (3H, синглет); 4,26 (2H, квартет, J = 7 Гц); 4,45 (1H, квартет, J = 14,5 ГЦ); 4,93 (1H, дублет J = 14,5 Гц); 7,15 - 7,27 (4H, мультиплет); 7,41 - 7,51 (3H мультиплет) 7,63 (1H, триплет, J = 7 Гц); 7,79 (1H, дублет, J = 7 Гц); 7,88 (1H, дублет, J = 8 Гц); 8,07 (1H, дублет, J = 7 Гц).
23(b). Этил-2-этил-1-[(21-метоксалилбифенил-4-ил)метил]бензимидазол-7- карбоксилат.
В 10 мл 4н. раствора хлористого водорода в этилацетате растворяют 1,06 г этил-N-трет-бутоксикарбонил-N[(21 - метоксалилбифенил-4-ил)метил]амино-3-нитробензоата (получен как описано выше в стадии (a)) и образующийся раствор оставляют стоять при комнатной температуре 4 ч. Затем реакционную смесь концентрируют упариванием при пониженном давлении и смолоподобный остаток растворяют в 20 мл этанола и 10 мл триэтилопропионата. Добавляют 150 мг 5% платины на угле и образующуюся смесь перемешивают 2 ч в атмосфере водорода при атмосферном давлении и оставляют на ночь при комнатной температуре. Затем катализатор отделяют фильтрованием, реакционную смесь концентрируют упариванием при пониженном давлении, остаток растворяют в этилацетате, раствор встряхивают с насыщенным водным раствором NaHCO3, этилацетатный слой отделяют и сушат над безводным MgSO4. Растворитель удаляют упариванием при пониженном давлении, остаток хроматографируют на колонке, используя в качестве элюента смесь этилацетат/гексан (1:1) и получают 343 мг целевого соединения в виде кристаллов с т. пл. 118 - 119oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,28 (3H, триплет, J = 7,5 Гц); 1,48 (3H, триплет, J = 7 Гц); 2,91 (2H, квартет, J = 7,5 Гц); 3,17 (3H, синглет); 4,26 (2H, квартет, J = 7 Гц); 5,84 (2H, синглет); 6,93 (2H, дублет, J = 8,5 Гц); 7,18 (2H, дублет, J = 8,5 Гц); 7,22 - 7,98 (7H, мультиплет).
23(c). 2-Этил-1-[(21-оксалобифенил-4-ил)метил]бензимидазол-7-карбоновая кислота.
300 мг этил-2-этил-1-(21-метоксалилбифенил-4-ил)бензимидазол-7-карбоксилата (получен как описано выше в стадии (b)) гидролизуют, используя 134 мг моногидрата гидроксида лития по методике, описанной в примере 17(b), и получают 264 мг целевого соединения в виде порошка с т.пл. 278 - 281oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 1,33 (3H, триплет, J = 7,5 Гц); 2,87 (2H, квартет, J = 7,5 Гц); 5,90 (2H, синглет); 6,92 (2H, дублет, J = 8 Гц); 7,19 (2H, дублет, J = 8 Гц); 7,27 (1H, триплет, J = 7 Гц); 7,42 (1H, дублет, J = 7 Гц); 7,53 (1H, триплет, J = 7 Гц); 7,64 - 7,70 (3H, мультиплет); 7,86 (1H, дублет, J = 8 Гц).
Пример 24. 2-Этокси-1-[(21-оксалобифенил-4-ил)метил] бензимидазол-7-карбоновая кислота (соединение N 2 - 44).
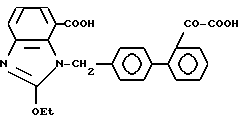
24(a). Этил-2-этокси-1-[(21-метоксалилбифенил-4-ил)метил]бензимидазол-7- карбоксилат.
Опыт проводят по методике, описанной в примере 23(b), но применяют 1,48 г этил-2-{N-трет-бутоксикарбонил-N-[(21-метоксалилбифенил-4-ил) метил]амино} -3-нитробензоата (получен как описано в примере 23 (a)) и заменяют триэтилортопропионат 7 мл тетраэтилортокарбоната. Получают 252 мг целевого соединения в виде смолы.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,32 (3H, триплет, J = 7,5 Гц); 1,50 (3H, триплет, J = 7 Гц); 3,06 (3H, синглет); 4,31 (2H, квартет, J = 7 Гц); 4,67 (2H, квартет, J = 7,5 Гц); 5,71 (2H синглет); 7,08 (2H, дублет, J = 8 Гц); 7,18 (2H, дублет, J = 8 Гц) 7,29 - 8,19 (7H, мультиплет).
24(b). 2-Этокси-1-[(21-оксалобифенил-4-ил)метил] бензимидазол-7-карбоновая кислота.
252 мг этил-2-этокси-1-[(21-метоксалилбифенил-4-ил) метил] бензимидазол-7-карбоксилата (получен как описано в стадии (a) выше) гидролизуют, применяя 136 мг моногидрата гидроксида лития, по методике, описанной в примере 17(b), и получают 186 мг целевого соединения в виде порошка, плавящегося при 158 - 161oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 1,42 (3H, триплет, J = 7,5 Гц); 4,61 (2H, квартет, J = 7,5 Гц); 5,67 (2H, синглет); 7,04 (2H, дублет, J = 8 Гц); 7,10 - 7,97 (9H, мультиплет).
Пример 25. Этил-2-(N-{[21-тетразол-5-илкарбонил)бифенил- 4-ил]метил}-N-пропиламино)никотинат (соединение N 3-25).

25(a). Этил-2-(N-{ [21-тритилтетразол-5-илкарбонил) бифенил-4-ил]метил} -N-пропиламиноникотинат.
Опыт проводят по методике, описанной в примере 18(a), но применяют 640 мг этил-2-пропиламиноникотината, 1,8 г 41-бромметил-2-(2-тритилтетразол-5-илкарбонил)бифенила (получен как описано в препарате 13) и 3,69 мл раствора бис(триметилсилил)амида лития в тетрагидрофуране. Получают 483 мг целевого соединения в виде вспененного твердого вещества.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,73 (3H, триплет, J = 7 Гц); 1,33 (3H, триплет, J = 7 Гц); 1,48 (2H, секстет, J = 7 Гц), 3,13 (2H, триплет, J = 7 Гц); 4,30 (2H, квартет, J = 7 Гц); 4,63 (2H, синглет); 6,68 (1H, дублет дублетов, J = 4,5 и 7,5 Гц); 6,83 - 6,92 (5H, мультиплет); 6,96 (2H, дублет, J = 8,5 Гц); 7,05 (2H, дублет, J = 8,5 Гц); 7,23 - 7,44 (12H, мультиплет); 7,58 (1H, дублет, J = 7,5 Гц); 7,71 (1H, дублет, J = 6,5 Гц); 7,91 (1H, дублет дублетов, J = 2 и 8 Гц); 8,20 (1H, дублет дублетов, J = 2 и 4,5 Гц).
25(b). Этил-1-(N-[21-тетразол-5-илкарбонил)бифенил-4-ил] -метил-N-пропиламино)никотинат.
483 мг этил-2-(N{ [21-(тетразол-5-илкарбонил)бифенил -4-ил]метил}-N-пропиламино)никотината (получен как описано выше в стадии (a)) детритилируют по методике, описанной в примере 7(b), и получают 320 мг целевого соединения в виде смолы.
Спектр ЯМР (CDCl3, 270 МГц), δ/ млн.-1: 0,79 (3H, триплет, J = 7 Гц); 1,39 (3H, триплет, J = 7 Гц); 1,54 (2H, секстет, J = 7 Гц); 3,15 (2H, триплет, J = 7 Гц); 4,37 (2H, квартет, J = 7 Гц); 4,58 (2H, синглет); 6,80 (1H, дублет дублетов, J = 5,5 и 7,5 Гц); 7,06 (2H, дублет, J = 8,5 Гц); 7,16 (2H, дублет, J = 8,5 Гц); 7,44 - 7,52 (2H, мультиплет); 7,61 (1H, триплет, J = 7 Гц); 7,85 (1H, дублет, J = 7 Гц); 8,03 (1H, дублет дублетов, J = 2 и 7 Гц); 8,25 (1H, дублет дублетов, J = 2 и 5 Гц).
Пример 26. 2-(N{ [21-тетразол-5-илкарбонил)бифенил-4-ил] метил}-N-пропиламино)никотиновая кислота (соединение N 3-20).
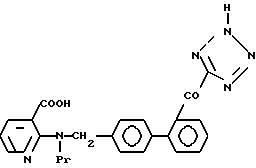
310 мг этил-2-(N-{ /21-(тетразол-5-илкарбонил)бифенил-4- ил/метил}-N-пропиламиноникотината (получен как описано в примере 25 (b)) гидролизуют, используя 6 мл 1н. водного раствора NaOH, и получают 128 мг целевого соединения в виде аморфного порошка, размягчающегося при 107 - 109oC.
Спектр ЯМР (гексадейтерированный диметилсульфоксид, 270 МГц), δ млн.-1: 0,74 (3H, триплет, J = 7 Гц); 1,44 (2H, секстет, J = 7 Гц); 3,12 (3,12 (2H, триплет, J = 7 Гц); 4,59 (2H, синглет); 6,81 (1H, дублет дублетов, J = 4,5 и 8 Гц); 7,13 (2H, дублет, J = 8,5 Гц); 7,19 (2H, дублет, J = 8,5 Гц); 7,54 - 7,61 (2H, мультиплет); 7,74 (1H, триплет, J = 7,5 Гц); 7,80 (1H, дублет, J = 8 Гц); 7,89 (1H, дублет дублетов, J = 2 и 8 Гц); 8,22 (1H, дублет дублетов, J = 2 и 5 Гц).
Препарат 1. 41-Метилбифенил-2-карбальдегид.
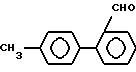
В атмосфере азота 118 мл 1,5 М раствора диизобутилалюминийангидрида в толуоле добавляют по каплям при температуре (-30) - (-20)oC к раствору 22,8 г 41-метилбифенил-2-карбонитрила в 200 мл толуола и смесь перемешивают при комнатной температуре 2 ч. Затем реакционную смесь охлаждают льдом и добавляют к ней 200 мл этилацетата и 60 мл 6н. соляной кислоты в указанном порядке. Этилацетатный слой отделяют, промывают насыщенным водным раствором NaCl и сушат безводным MgSO4. Растворитель удаляют перегонкой при пониженном давлении и получают 23,1 г целевого соединения в виде масла.
Спектр ЯМР (CDCl3, 60 МГц), δ млн.-1: 2,39 (3H, синглет); 7,2 - 7,7 (7H, мультиплет); 10,07 (1H, синглет).
Препарат 2. α-Гидрокси-(41-метилбифенил-2-ил)ацетонитрил.
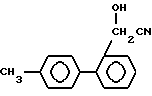
К раствору 23,1 г 41-метилбифенил-2-карбальдегида (получен как описано в препарате 1) в 250 мл метиленхлорида добавляют по каплям 18 мл триметилсилилцианида, затем 0,2 г иодида цинка. Образующуюся смесь перемешивают при 30oC 3 ч и при 50oC 2 ч и растворитель удаляют отгонкой при пониженном давлении. Остаток растворяют в этилацетате, промывают водным раствором NaHCO3 и насыщенным водным раствором NaCl и сушат безводным Na2SO4. Растворитель отгоняют при пониженном давлении и получают 35,0 г O-триметилсилилпроизводного целевого соединения в виде масла.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 0,09 (9H, синглет); 2,43 (3H, синглет); 5,47 (1H, синглет); 7,20 (2H, дуплет, J=7,5 Гц); 7,26 (2H, дублет, J=7,5 Гц); 7,11-7,50 (3H, мультиплет); 7,79-7,82 (1H, мультиплет).
К раствору всего О-триметилсилильного производного в 300 мл метанола добавляют 1,5 г моногидрата п-толуолсульфокислоты и смесь перемешивают при комнатной температуре 30 мин. Затем реакционную смесь концентрируют упариванием при пониженном давлении, остаток растворяют в этилацетате, промывают водным раствором NaHCO3 и насыщенным водным раствором NaCl в указанном порядке и сушат над безводным Na2SO4. Растворитель отгоняют при пониженном давлении и получают 26,1 г целевого соединения в виде масла.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 2,41 (3H, синглет); 2,89 (1H, дублет, J=6 Гц); 5,49 (1H, дублет, J=6 Гц); 7,25 (4H, синглет); 7,26-7,33 (1H, мультиплет); 7,42-7,49 (2H, мультиплет); 7,78-7,81 (1H, мультиплет).
Препарат 3. α-Гидрокси-(41-метилбифенил-2-ил)ацетонитрил.
Раствор 6,0 г KCN в 6 мл воды и раствор 14 г NaHSO3 в 35 мл воды добавляют по каплям при 0-5oC к раствору 8,00 г 41-метилбифенил-2-карбальдегида (получен как описано в препарате 1) в 10 мл диэтилового эфира и образующуюся смесь перемешивают при 5-10oC 3 ч и затем при 20oC 30 мин. Продукт экстрагируют этилацетатом. Экстракт промывают водой, сушат безводным MgSO4 и растворитель упаривают при пониженном давлении. Остаток хроматографируют на колонке силикагеля, применяя в качестве элюента смесь этилацетат/гексан (1:4 по объему), и получают 7,7 г целевого соединения в виде масла. Спектр ЯМР этого соединения идентичен спектру соединения, полученного в препарате 2.
Препарат 4. Метил-α-гидрокси-(41-метилбифенил-2-ил)ацетат.
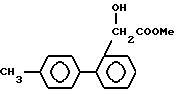
При перемешивании 26,1 α-гидрокси-(41-метилбифенил-2-ил)ацетонитрила (получен как описано в препарате 2) добавляют к смеси 150 мл уксусной кислоты и 150 мл концентрированной соляной кислоты и смесь перемешивают при 120oC 16 ч. Затем реакционную смесь концентрирут упариванием при пониженном давлении. Остаток уксусной кислоты удаляют азеотропной перегонкой с толуолом. Продукт экстрагируют раствором 12 г NaOH в 200 мл воды. Образующийся водный раствор промывают диэтиловым эфиром и добавляют к нему концентрированную соляную кислоту до кислотной реакции. Выделившуюся α-гидрокси (41-метилбифенил-2-ил)уксусную кислоту экстрагируют этилацетатом и раствор сушат над безводным MgSO4. Растворитель удаляют упариванием при пониженном давлении, остаток растворяют в 300 мл метанола и при охлаждении льдом добавляют 13 мл концентрированной водной серной кислоты. Раствор оставляют стоять при комнатной температуры 16 ч. Затем реакционную смесь концентрируют упариванием при пониженном давлении и остаток смешивают с этилацетатом и водой. Органический слой отделяют и промывают водным раствором NaHCO3 и водой в указанном порядке и сушат над безводным Na2SO4. Растворитель отгоняют при пониженном давлении, остаток хроматографируют на колонке с силикагелем, применяя в качестве элюента смесь этилацетат/гексан (1:4 по объему) и получают 19,5 г целевого соединения в виде кристаллов с т.пл. 74-76oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 2,40 (3H, синглет); 3,38 (1H, дублет, J= 4 Гц); 3,69 (3H, синглет); 5,26 (1H, дублет, J=4 Гц); 7,23 (2H, дублет, J=7 Гц); 7,31-7,37 (6H, мультиплет).
Препарат 5. Метил (41-метилбифенил-2-ил)глиоксилат.
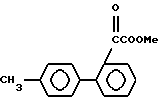
К раствору 10,6 г метил-α-гидрокси-(41-метилбифенил-2-ил)ацетата (получен, как описано в препарате 4) в 200 мл метиленхлорида добавляют 40 г диоксида марганца и образующуюся смесь перемешивают при комнатной температуре 16 ч. Нерастворимые вещества отфильтровывают и фильтрат концентрируют упариванием при пониженном давлении и получают 9,16 г целевого соединения в виде кристаллов с т.пл. 81-84oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 2,46 (3H, синглет); 3,39 (3H, синглет); 7,24-7,32 (4H, мультиплет); 7,50-7,58 (2H, мультиплет); 7,70 (1H, триплет, J=8 Гц); 7,89 (1H, дублет, J=8 Гц).
Препарат 6. (41-Метилбифенил-2-ил)глиоксиловая кислота.
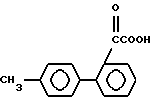
Раствор 1,73 г NaOH в 90 мл воды добавляют к раствору 9,16 г метил-(41-метилбифенил-2-ил)глиоксилата (получен как описано в препарате 5) в 90 мл метанола и образующуюся смесь перемешивают при комнатной температуре 2 ч. Затем метанол отгоняют при пониженном давлении и к отстоявшемуся водному раствору добавляют 14,4 мл 3н. соляной кислоты для достижения pH 2. Выделившееся целевое соединение экстрагируют этилацетатом и экстракт сушат безводным MgSO4. Растворитель отгоняют при пониженном давлении и получают целевое соединение в виде кристаллов с т.пл. 111-112oC.
Спектр ЯМР (CDCl3, 270 МГц), δ/ млн.-1: 2,36 (3H, синглет); 7,13-7,22 (4H, мультиплет); 7,46-7,52 (2H, мультиплет); 7,65 (1H, триплет, J=7 Гц); 7,80 (1H, дублет, J=7 Гц).
Препарат 7. Трет-бутил-(41-метилбифенил-2-ил)глиоксилат.
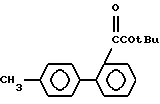
К раствору 6,35 г (41-метилбифенил-2-ил)глиоксиловой кислоты (получена как описано в препарате 6) в 40 мл метиленхлорида добавляют 2 капли диметилформамида, затем по каплям 15 мл оксалилхлорида при комнатной температуре. Образующуюся смесь перемешивают при комнатной температуре 1 ч и 3 ч при 35oC. Раствор упаривают при пониженном давлении, остаток смешивают с бензолом и смесь упаривают при пониженном давлении. Эту процедуру повторяют еще раз и кристаллический остаток растворяют в 30 мл тетрагидрофурана. К раствору добавляют по каплям при (-40)-(-30)oC раствор 4,0 г трет-бутоксида калия в 60 мл тетрагидрофурана и смесь перемешивают при комнатной температуре 2 ч. Затем к реакционной смеси добавляют воду и смесь диэтилового эфира и гексана (2: 1 по объему). Органический слой отделяют, промывают водой и сушат над безводным MgSO4. Растворитель отгоняют при пониженном давлении, остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь этилацетат/гексан (1:9 по объему) и получают 5,06 г целевого соединения в виде масла. Полученный продукт кристаллизуется при стоянии при комнатной температуре, давая кристаллы с т.пл. 50-51oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,16 (9H, синглет); 2,38 (3H, синглет); 7,20-7,26 (4H, мультиплет); 7,39-7,45 (2H, мультиплет); 7,47-7,61 (1H, мультиплет); 7,73-7,68 (1H, мультиплет).
Препарат 8. Метил (41-бромметилбифенил-2-ил)глиоксилат.
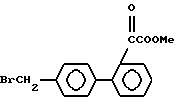
Суспензию 3,66 г метил (41-метилбифенил-2-ил)глиоксилата (получен как описано в препарате 5), 2,56 г N-бромсукцинимида и 0,1 г бензоилпероксида в 100 мл четыреххлористого углерода перемешивают при кипячении с обратным холодильником и 3 ч при обучении вольфрамовой лампой 200 Вт. Затем реакционную смесь промывают водным раствором NaHCO3 и насыщенным водным раствором NaCl в указанном порядке и сушат над безводным MgSO4. Растворитель отгоняют при пониженном давлении, кристаллический остаток промывают диизопропиловым эфиром и получают 3,68 г целевого соединения с т.пл. 93-96oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 3,36 (3H, синглет); 4,53 (2H, синглет); 7,29 (2H, дублет, J=7 Гц); 7,44-7,55 (4H, мультиплет); 7,62-7,68 (1H, мультиплет); 7,84 (1H, дублет, J=6,5 Гц).
Препарат 9. Трет-Бутил (41-бромметилбифенил-2-ил)глиоксилат.
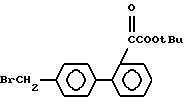
Суспензию 1,78 г трет-бутил(41-метилбифенил-2-ил)глиоксилата (получен как описано в препарате 7), 1,12 г N-бромсукцинимида и 50 мг бензоилпероксида в 50 мл четыреххлористого углерода обрабатывают по методике, описанной в препарате 8, и получают 2,25 г целевого соединения в виде сиропа. Полученный продукт кристаллизуется при комнатной температуре, давая кристаллы с т. пл. 100-120oC.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 1,18 (3H, синглет); 4,52 (2H, синглет); 7,27 (1H, дублет, J=7 Гц); 7,32 (1H, дублет, J=7 Гц); 7,41-7,52 (4H, мультиплет); 7,62 (1H, триплет, J=7 Гц); 7,73 (1H, дублет, J=7 Гц).
Препарат 10. 41-Метил-2-[α-гидрокси(тетразол-5-ил)метил]бифенил.

Раствор 4,73 г α-гидрокси-(41-метилбифенил-2-ил) ацетонитрила (получен как описано в препарате 2) и 20,8 г трибутилоловоазида в 60 мл толуола перемешивают 20 ч при 100oC. В конце этого времени к реакционной смеси добавляют раствор 4,05 г NaOH в 200 мл воды и образующуюся смесь перемешивают при комнатной температуре 1 ч. Реакционную смесь промывают гексаном три раза и добавляют 8,5 мл концентрированной соляной кислоты до кислотной реакции. Выделившееся соединение экстрагируют этилацетатом и сушат над безводным Na2SO4. Растворитель отгоняют при пониженном давлении и получают 3,57 г целевого соединения в виде аморфного твердого вещества. Полученные соединения применяют в следующей стадии (препарат 11) без дополнительной очистки.
Препарат 11. 41-Метил-2-[α-гидрокси-(2-тритилтетразол-5- ил)метил]бифенил.
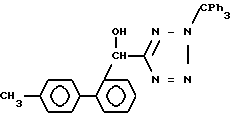
Раствор 5,62 г 41-метил-2-[α-гидрокси(тетразол-5-ил)метил] бифенила (получен как в препарате 10) и 3,92 г тритилхлорида в 100 мл пиридина перемешивают 4,5 ч при 100oC. Затем реакционную смесь концентрируют упариванием при пониженном давлении и остаток растворяют в этилацетате. Раствор промывают водой, 0,5%-ным раствором K2CO3 и насыщенным раствором NaCl в указанном порядке и сушат над безводным Na2SO4. Растворитель отгоняют при пониженном давлении, остаток хроматографируют через колонку с силикагелем, используя в качестве элюента смесь гексана и этилацетата (2:1 по объему), и получают 2,68 г целевого соединения в виде аморфного вещества.
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 2,37 (3H, синглет); 6,20 (1H, синглет); 7,05-7,38 (22H, мультиплет); 7,55-7,59 (1H, мультиплет).
Препарат 12. 41-Метил-2-(2-тритилтетразол-5- илкарбонил)бифенил.
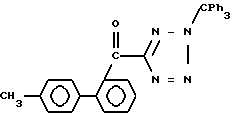
К раствору 2,48 г 41-метил-2-[ α -гидрокси(2- тритилтетразол-5-ил)метил] бифенила (получен как описано в препарате 11) в 50 мл метиленхлорида добавляют 8 г диоксида марганца и образующуюся смесь перемешивают при комнатной температуре 16 ч. Нерастворимые вещества отфильтровывают, а фильтрат концентрируют упариванием при пониженном давлении. Остаток хроматографируют на колонке с силикагелем, используя в качестве элюента смесь гексана и этилацетата (3: 1 по объему), и 1,20 г целевого соединения в виде кристаллов с т.пл. 145-147oC (с разложением).
Спектр ЯМР (CDCl3, 270 МГц), δ/ млн.-1: 2,25 (3H, синглет); 6,82-6,92 (9H, мультиплет); 7,24-7,40 (11H, мультиплет); 7,46 (1H, триплет, J=7,5 Гц); 7,59 (1H, триплет, J=7,5 Гц); 7,74 (1H, дублет, J=8,5 Гц).
Препарат 13. 41-Бромметил-2-(2-тритилтетразол-5- илкарбонил)бифенил.

Суспензию 400 мг 41-метил-2-(2-тритилтетразол-5- илкарбонил)бифенила (получен как описано в препарате 12), 150 мг N-бромсукцинимида и 20 мг бензоилпероксида обрабатывают по методике, описанной в препарате 8 и получают целевое соединение в виде кристаллического порошка с т.пл. 161-163oC (с разложением).
Спектр ЯМР (CDCl3, 270 МГц), δ млн.-1: 4,34 (2H, синглет); 6,84-6,87 (5H, мультиплет); 6,98 (2H, дублет, J=8,0 Гц); 7,10 (2H, дублет, J=8,0 Гц); 7,24-7,39 (11H, мультиплет); 7,48 (1H, триплет, J=7,5 Гц); 7,61 (1H, триплет, J=7,5 Гц); 7,74 (1H, дублет, J=6,0 Гц).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СЛОЖНЫЕ ЭФИРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2086541C1 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ПРИМЕНИМЫЕ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ ЭФФЕКТОРОВ ПРИ МУСКАРИНОВЫХ РЕЦЕПТОРАХ | 1995 |
|
RU2152385C1 |
| 13-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ МИЛБЕМИЦИНА, АКАРИЦИДНАЯ И ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ ЗАЩИТЫ РАСТЕНИЙ ОТ ПОВРЕЖДЕНИЯ ПАРАЗИТАМИ | 1995 |
|
RU2109744C1 |
| 3-ЦИАНОАНДРОСТА-3,5-ДИЕН-1717β-КАРБОНОВАЯ КИСЛОТА В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО ПРОДУКТА, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ | 1993 |
|
RU2114861C1 |
| 13-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 5-ОКСИМА МИЛБЕМИЦИНА, СОДЕРЖАЩАЯ ИХ АНТИГЕЛЬМИНТНАЯ, АКАРИЦИДНАЯ И ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2128181C1 |
| ПРОИЗВОДНЫЕ ОКТАГИДРОНАФТАЛИНОКСИМА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2125043C1 |
| ПРОИЗВОДНЫЕ НЕЙРАМИНОВОЙ КИСЛОТЫ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ИЛИ ИХ СЛОЖНЫЕ ЭФИРЫ, А ТАКЖЕ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СИАЛИДАЗУ-ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 1997 |
|
RU2124509C1 |
| ТИАЗОЛИДИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СПОСОБ СНИЖЕНИЯ СОДЕРЖАНИЯ САХАРА В КРОВИ У МЛЕКОПИТАЮЩИХ | 1992 |
|
RU2095354C1 |
| АНАЛОГИ ЛИПИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2076107C1 |
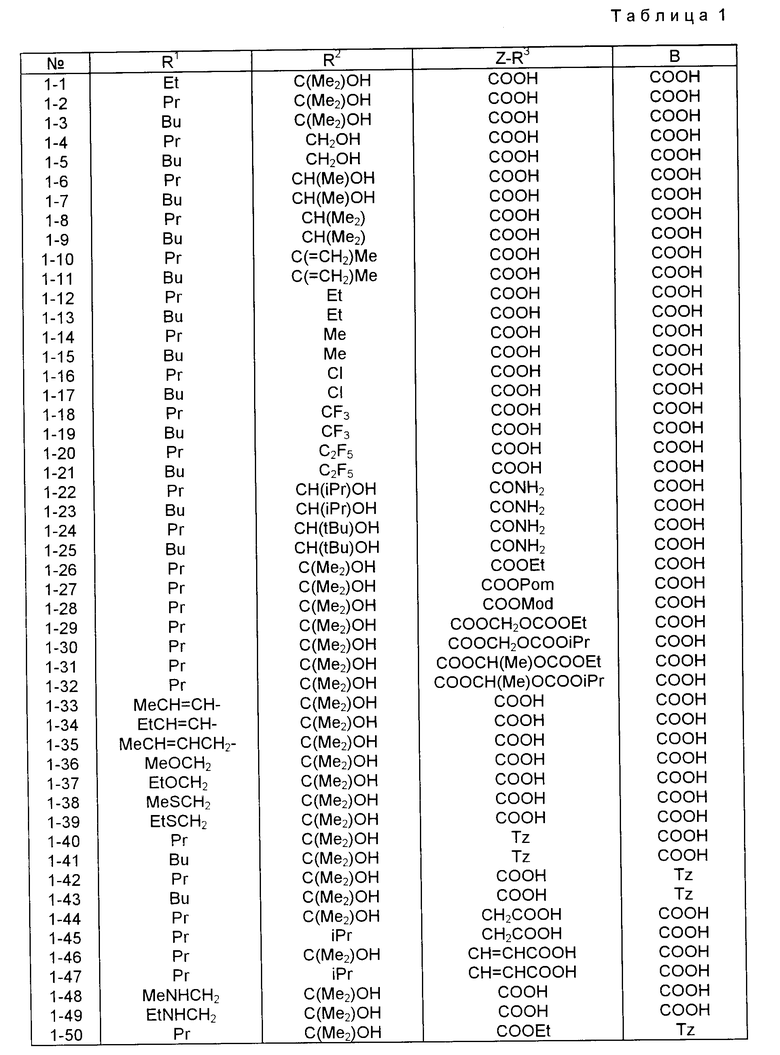
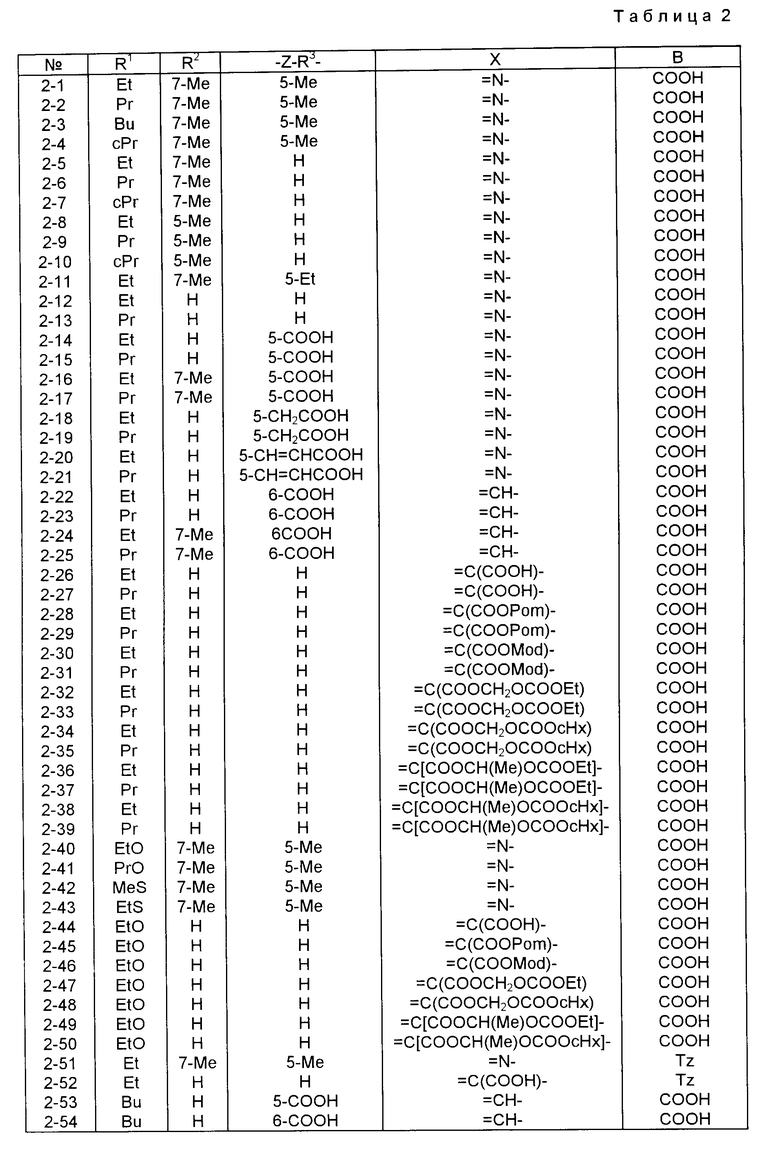
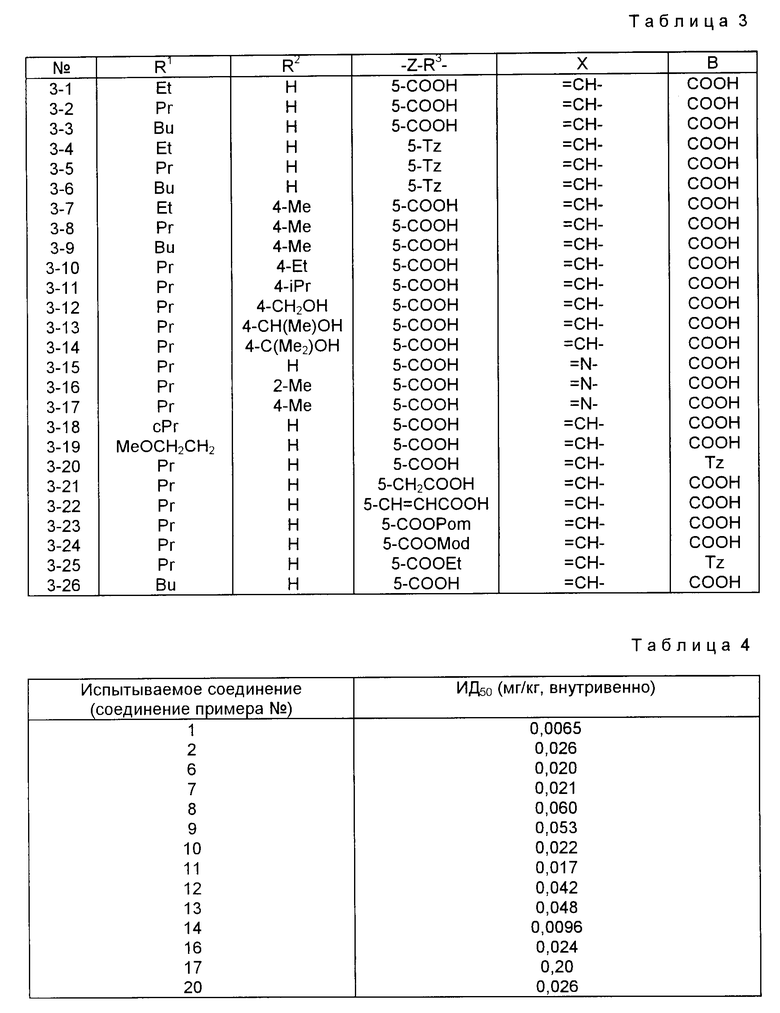
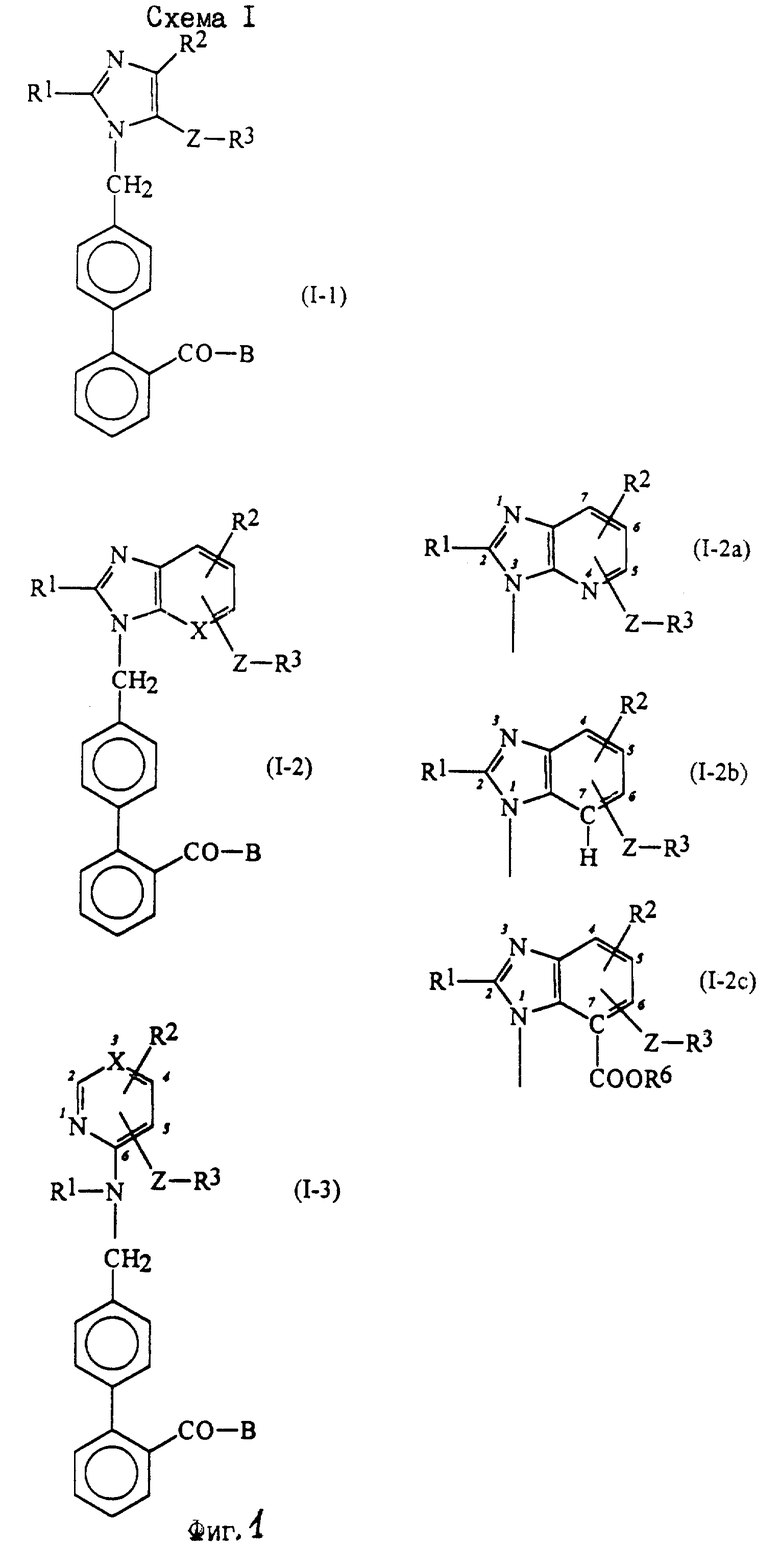
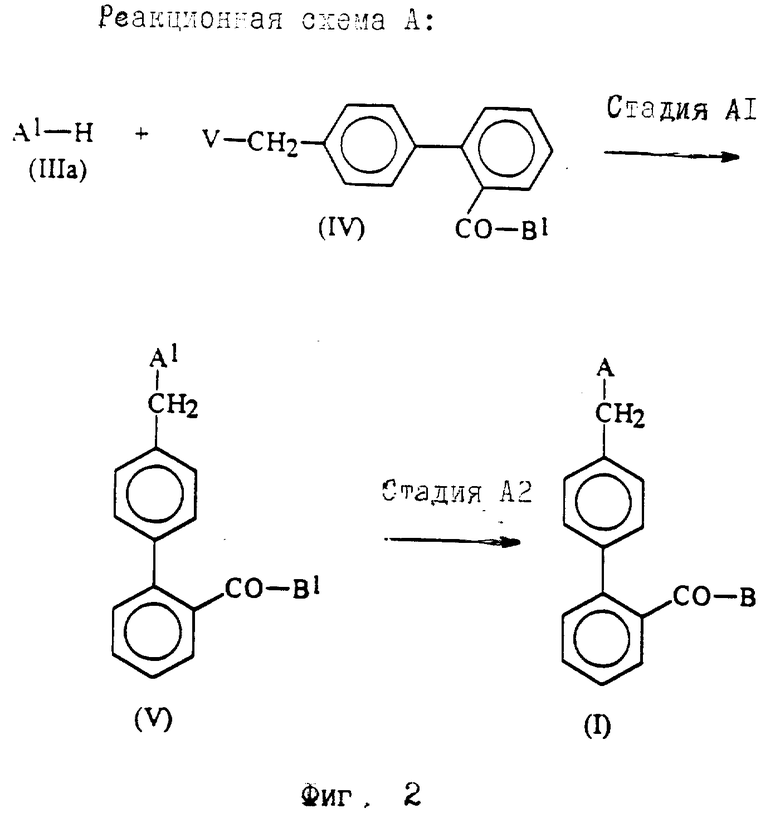
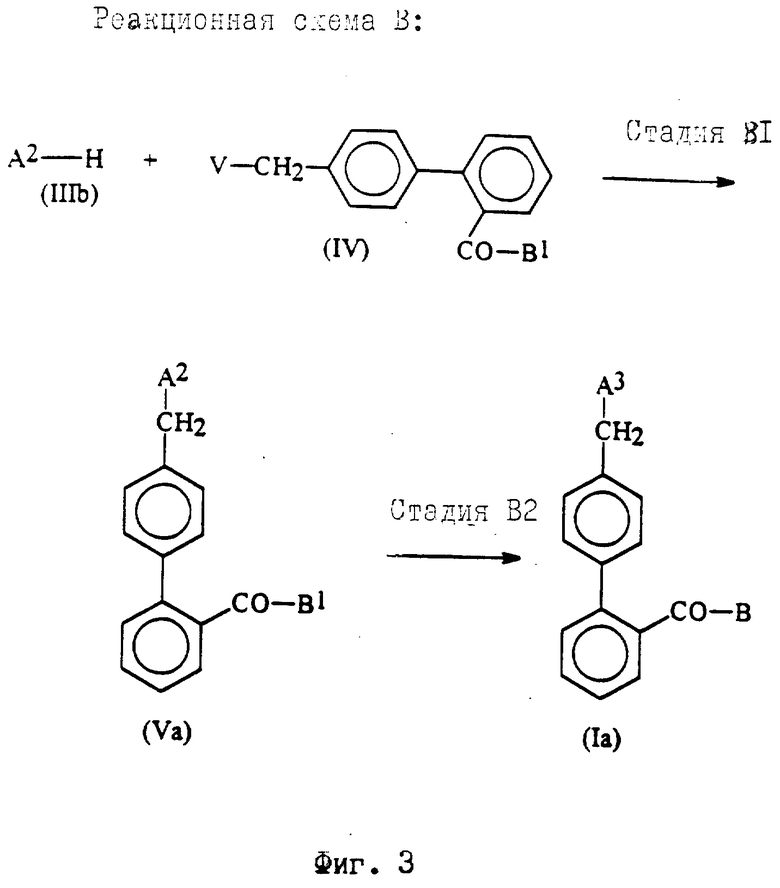
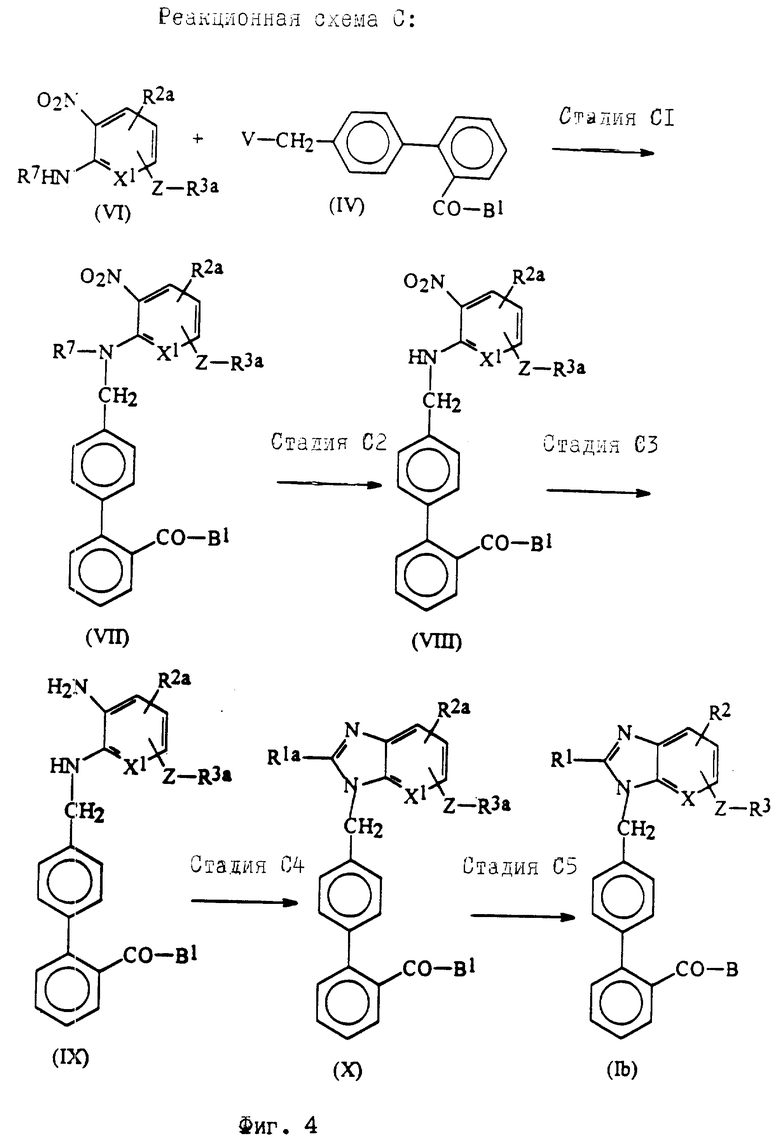
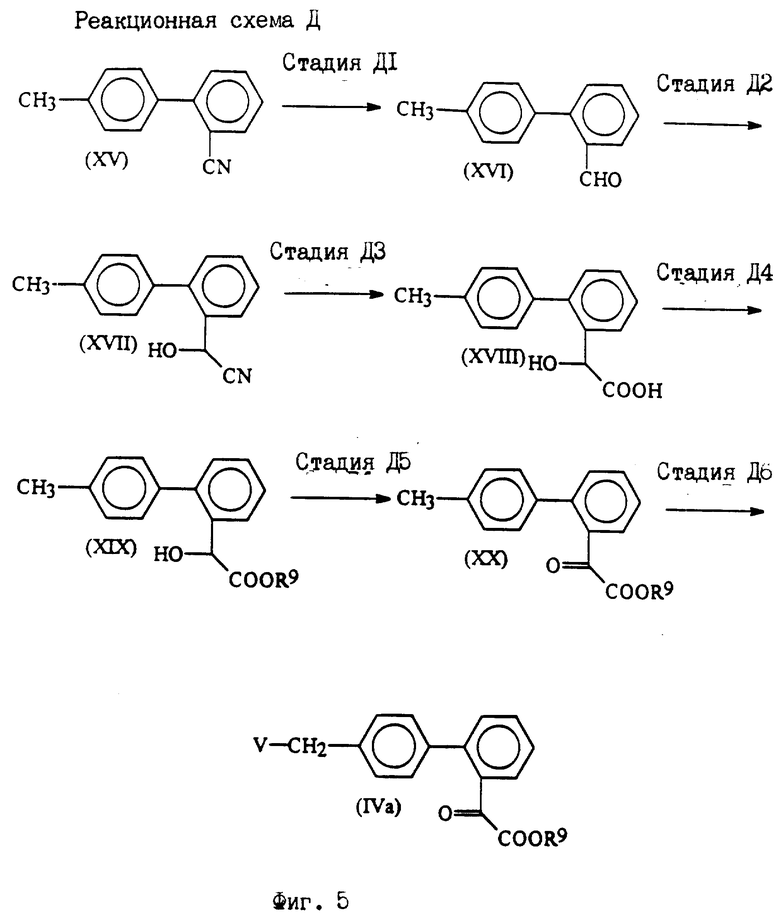
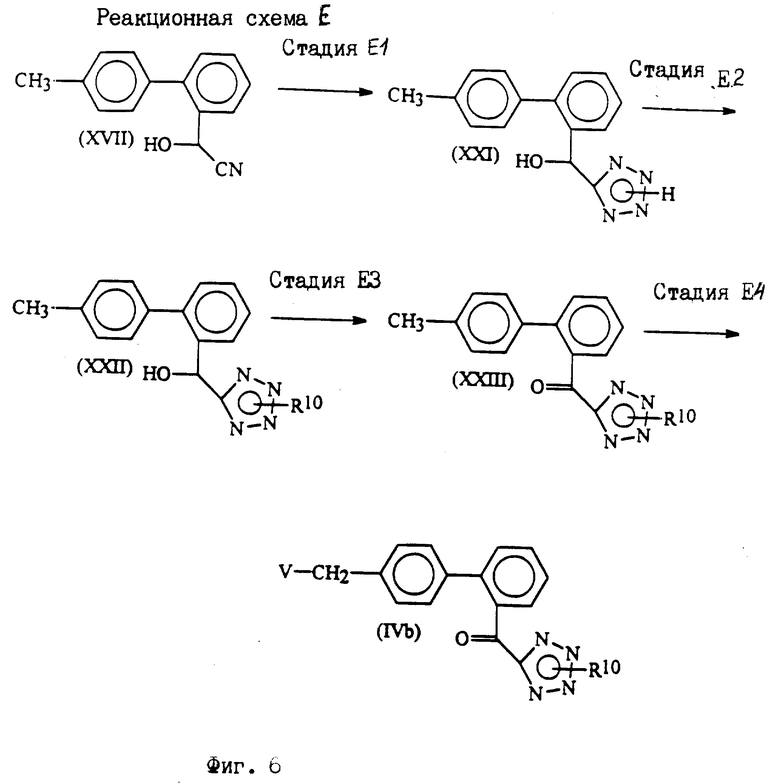
Сущность: производные бифенила, способ их получения. Соединения формулы I
в которой А - группа IIa, IIb или IIc
где R1 - алкил, алкенил, циклоалкил или группа формулы R4-Y-R5, где R4 - водород, алкил или циклоалкил; R5 - простая связь или алкилен, и Y - кислород, сера или иминогруппа; R2 - водород, галоген, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный циклоалкил, формил, алкилкарбонил, гидрокси-, амино-, алкиламино-, диалкиламино-, алкокси-, алкилтио-, циано- или нитрогруппа; R3 - водород, алкил, карбокси- или замещенная карбоксигруппа, карбамоил или тетразол-5-ил; X - группа формулы -CH=, -N= или -C(COOR6)=, где R6 - водород или защитный радикал для карбоксигруппы; Z - простая связь, алкилен или винилен и B - карбокси-, или замещенная карбоксигруппа, или тетразол-5-ил, и их фармацевтически приемлемые соли и сложные эфиры обладают способностью ингибировать действие ангиотензина П и могут быть использованы для лечения и профилактики гипертонии и сердечных заболеваний. 3 с. и 46 з.п. ф-лы, 4 табл., 6 ил.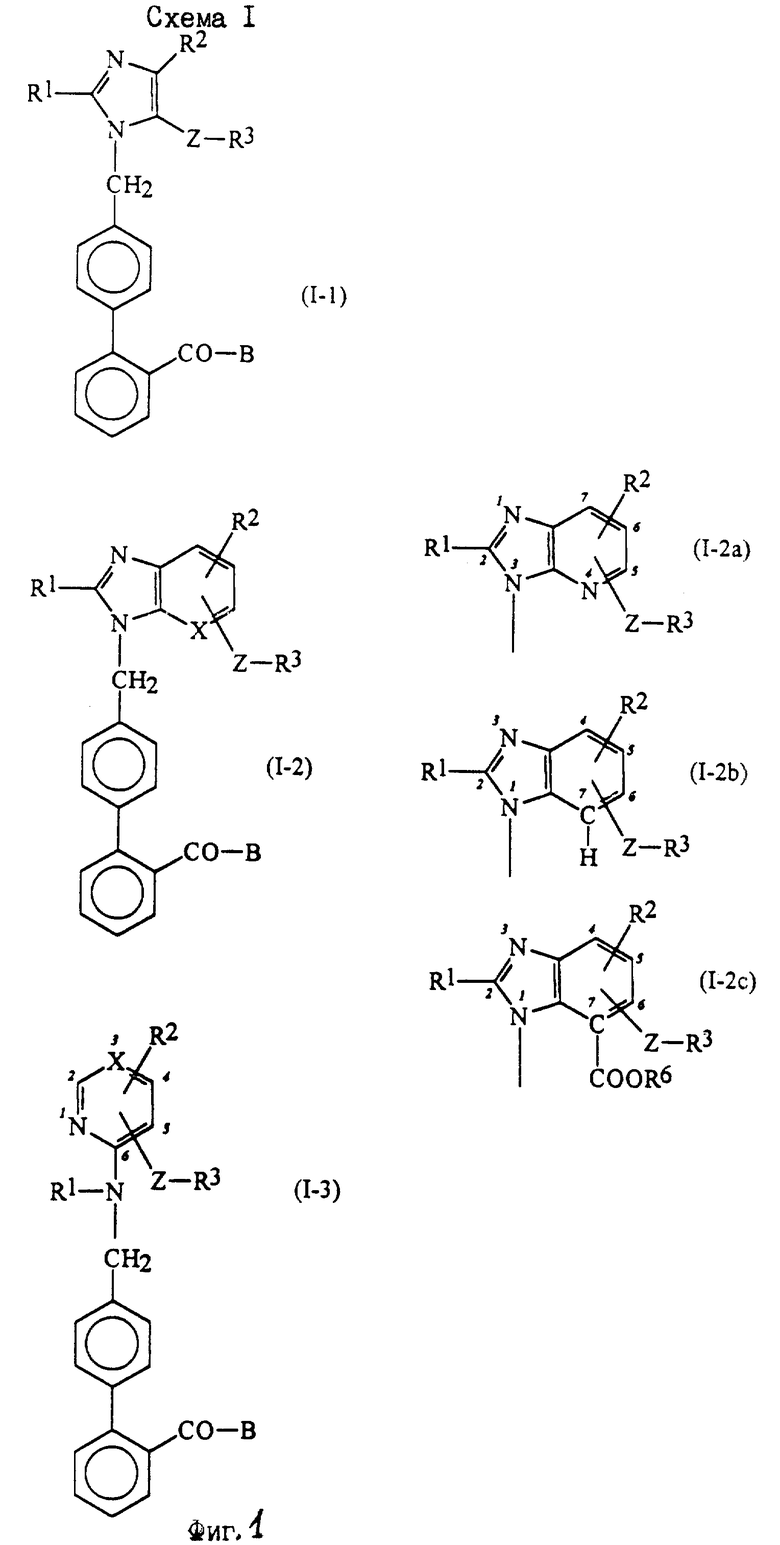
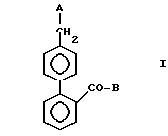
где A - группы формул IIa, IIb или IIc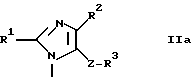
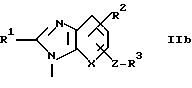
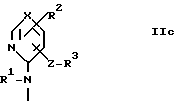
R1 - С1 - С6-алкил, С2 - С6-алкенил, С3 - С8-циклоалкил или группа формулы
R4 - Y - R5,
где R4 - водород, С1 - С6-алкил или С3 - С8-циклоалкил;
R5 - простая связь или С1 - С4-алкилен;
Y - кислород, сера или иминогруппа (=NH);
R2 - водород, галоген, незамещенный С1 - С6-алкил, незамещенный С2 - С6-алкенил, незамещенный С3 - С8-циклоалкил, гидроксигруппа, аминогруппа, С1 - С6-алкиламиногруппа, диалкиламиногруппа, в которой каждая алкильная часть имеет 1 - 6 атомов углерода, формил, С2 - С7-алкилкарбонил, С1 - С6-алкоксигруппа, С1 - С6-алкилтиогруппа, цианогруппа, нитрогруппа, замещенный С1 - С6-алкил, который замещен по меньшей мере одним заместителем, выбранным из заместителей α, определенных ниже, замещенный С2 - С6-алкенил, который замещен по крайней мере одним заместителем, выбранным из заместителей α, определенных ниже, или замещенный С3 - С8-циклоалкил, который замещен по меньшей мере одним заместителем, выбранным из заместителей α, определенных ниже;
R3 - водород, С1 - С6-алкил, карбоксигруппа, защищенная карбоксигруппа, карбамоил или тетразол-5-ил;
X - группа формулы -CH=, -N= или -C(COOR6)=, где R6 - водород или карбоксизащитная группа;
Z - простая связь, С1 - С4-алкилен или винилен;
B - карбоксигруппа, защищенная карбоксигруппа или тетразол-5-ил;
заместители α выбирают из атомов галогена, гидроксигрупп, аминогрупп, С1 - С6-алкиламиногрупп, диалкиламиногрупп, в которых каждый алкил имеет 1 - 6 атомов углерода, формила, С2 - С7-алкилкарбонила, С1 - С6-алкоксигрупп, С1 - С6-алкилтиогрупп, цианогрупп или нитрогрупп,
или их фармацевтически приемлемые соли и/или сложные эфиры.
4-(1-гидрокси-1-метилэтил)-1-[(2'- оксалобифенил-4-ил)метил]-2- пропилимидазол-5-карбоновой кислоты,
4-(1-гидроксиэтил)-1-[2'- оксалобифенил-4-ил)метил]-2-пропилимидазол-5- карбоновой кислоты,
4-изопропил-1-[(2'-оксалобифенил- 4-ил)метил]-2- пропилимидазол-5-карбоновой кислоты,
4-(1-гидрокси-2-метилпропил)-1- [(2'-оксалобифенил-4-ил)метил]- 2-пропилимидазол-5-карбоксамида,
4-(1-гидрокси-2,2-диметилпропил)- 1-[(2'-оксалобифенил-4-ил)- метил]-2-пропилимидазол-5-карбоксамида,
пивалоилоксиметил-4-(1-гидрокси- 1-метилэтил)-1-[2'- оксалобифенил-4-ил)метил]- 2-пропилимидазол-5-карбоксилата,
(5-метил-2-оксо-1,3-диоксолен-4-ил)метил- 4-(1-гидрокси-1-метилэтил)- 1-[(2'-оксалобифенил-4-ил)метил]- 2-пропилимидазол-5-карбоксилата,
{ 4'-[4-(1-гидрокси-1-метилэтил)- 2-пропил-5-(тетразол-5-ил)- имидазол-1-илметил]бифенил-2-ил} глиоксиловой кислоты,
2-этил-5,7-диметил-3(2'- оксалобифенил-4-ил)метил- 3Н-имидазо-[4,5-b] пиридина,
5,7-диметил-3-(2'-оксалобифенил- 4-ил)метил-2-пропил- 3Н-имидазо[4,5-b] пиридина,
2-этил-1-[(2'-оксалобифенил-4- ил)метил]бензимидазол-7-карбоновой кислоты,
пивалоилоксиметил-2-этил-1- [(2'-оксалобифенил-4-ил) метил] бензимидазол-7-карбоксилата,
(5-метил-2-оксо-1,3-диоксолен-4-ил)метил- 2-этокси-1-[(2'- оксалобифенил-4-ил)метил]бензимидазол- 7-карбоксилата,
2-{N[(2'-оксалобифенил- 4-ил)метил]-N- пропиламино}никотиновой кислоты и
(N-пропил-N-{4'- [3-(тетразол-5-ил)пирид-2- ил}аминометил]бифенил- 2-ил)глиоксиловой кислоты,
или их фармацевтически приемлемые соли, или сложные эфиры.
Ax - H, III
где Ax имеет значения А, указанные выше,
или группы формул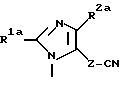
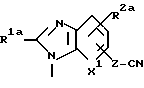
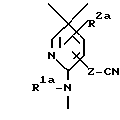
где R1 a, R2 a и X1 имеют значения, приведенные для R1, R2 и X соответственно, но в которых любая первичная или вторичная аминогруппа, любая карбоксигруппа или любой тетразол-5-ил защищены;
Z имеет указанные значения,
с соединением формулы IV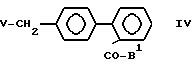
где B1 - защищенная карбоксигруппа или защищенный тетразол-5-ил;
V - галоген,
и, если необходимо, превращают CN-группу соединения III в соответствующую группу R3, удаляют защитные группы с выделением целевого продукта в свободном виде, в виде соли или эфира.
где 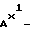 предшественник группы формулы IIb и имеет формулу VI'
предшественник группы формулы IIb и имеет формулу VI'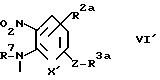
где R2 a, R3 a, X' имеют значения, приведенные для R2, R3 и X соответственно, но в которых любая первичная или вторичная аминогруппа, любая карбоксигруппа или любой тетразол-5-ил защищены;
Z имеет указанные значения;
R7 - аминозащитная группа,
с соединением формулы IV
где B1 - защищенная карбоксигруппа или защищенная тетразол-5-илгруппа;
V - атом галогена,
с получением соединения формулы VII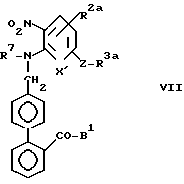
затем удаляют защитную группу R7 в полученном соединении формулы VII и получают соединение формулы VIII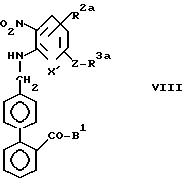
далее восстанавливают нитрогруппу в соединении формулы VIII с получением соединения формулы IX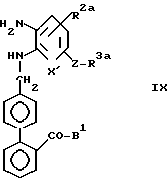
и проводят реакцию соединения IX с соединением формулы XIV
R1 a C(OR8)3 XIV
где R1 a имеет значение, указанное в п.48;
R8 - С1 - С6-алкил,
с получением соединения формулы X
и, если необходимо, удаляют любые защитные группы и/или получают соль, этерифицируют или диэтерифицируют соединение формулы X.
| EP, патент, 545912, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-04-27—Публикация
1993-12-16—Подача