Изобретение относится к новым противовоспалительным и противоаллергическим активным соединениям и способам их получения. Изобретение также относится к фармацевтическим составам, содержащим это соединение, и к методам фармакологического их использования.
Целью настоящего изобретения является предоставление противовоспалительных, иммуноподавляющих и противоаллергических глюкокортикостероидов или их фармацевтических составов с высокой активностью в месте применения, например, в дыхательных путях, на коже, в кишечном тракте, в суставах или в глазах; действие лекарства направлено на неограниченную область мишеней благодаря индукции слабых глюкокортикостероидных системных эффектов.
Более отдаленной целью настоящего изобретения является предоставление фармацевтических составов, содержащих липосомы, которые включают фармакологически активные эфиры стероидов и жирных кислот настоящего изобретения. Для того, чтобы улучшить доставку лекарства и максимально снизить побочные эффекты такого лечения.
Предшествующий уровень техники
Глюкокортикостероиды (ГКС) являются ценными лекарствами при астме и ринитах. Общепринято, что ГКС осуществляют свое лечебное действие путем проявления противовоспалительных и противоанафилактических свойств внутри дыхательных путей и легочной ткани. Долгосрочное использование ГКС через рот в значительной степени противопоказано из-за сильных побочных эффектов за пределами легочной области. Соответственно, только незначительная часть пациентов с астмой или ринитом в настоящее время подвергаются лечению ГКС через рот. Большей безопасности можно достигнуть путем доставки ГКС при помощи ингаляций. Однако сильнодействующие ингаляционные ГКС, которые в настоящее время широко применяются в клинике, - беклометазон-17 α , 21-дипропионат и будезонид - также имеют довольно узкие границы безопасности и
Сущность изобретения
Одной из целей настоящего изобретения является предоставление новых соединений ГКС. Новые соединения отличаются противовоспалительной, иммуноподавляющей и противоанафилактической активностью в месте применения и, в частности, они обладают заметно улучшенным отношением между их эффективностью и способностью вызывать действие ГКС за пределами обработанного участка. Предпочтительным способ назначения новых соединений являются ингаляции, если место применения находится внутри дыхательных путей.
Другой целью настоящего изобретения является предоставление противовоспалительных и противоаллергических составов, содержащих липосомы с заключенными в них стероидными эфирами, для местного назначения, например, введения в дыхательные пути. Эти составы разработаны для улучшения лечебных свойств стероидного эфира путем продления местного удержания в дыхательных путях и направления лекарства к специфическим клеткам мишеней.
Соединения настоящего изобретения характеризуются формулой: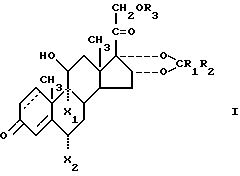 ,
,
или являются их пространственными изомерами. В приведенной формуле 1,2-е положения является насыщенными или представляют собой двойную связь;
R1 - водород или же прямая или разветвленная углеводородная цепь имеющая 1-4 атома углерода;
R2 - водород или же прямая или разветвленная углеводородная цепь, имеющая 1-10 атомов углерода;
R3 - ацил, имеющий прямую или разветвленную, насыщенную или ненасыщенную углеводородную цепь из 4-20 атомов углерода;
по крайней мере один из X2 и X2 является фтором, а другой является водородом при условии, что 1) R1 и R2 одновременно не являются водородом, 2) если 1,2-е положение представлено двойной связью, R1 и R2 одновременно не являются метильной группой, 3) если 1,2-е положение представлено двойной связью, R1 - водород и R2 - прямая или разветвленная углеводородная цепь, имеющая 1-10 атомов углерода, R3 - ацил, имеющий 11-20 атомов углерода.
Ацил может происходить из:
C3H7COOH: масляной кислоты,
C4H9COOH: валериановой кислоты,
C5H11COOH: капроновой кислоты,
C6H13COOH: энантовой кислоты,
C7H15COOH: октановой кислоты,
C8H17COOH: нонановой кислоты,
C9H19COOH: декановой кислоты,
С10H21COOH: ундекановой кислоты,
C11H23COOH:лауриновой кислоты,
C12H25COOH: тридекановой кислоты,
C13H27COOH: миристиновой кислоты,
C14H29COOH: пентадекановой кислоты,
C15H31COOH: пальмитиновой кислоты,
C16H33COOH: гептадекановой кислоты,
С17H35COOH: стеариновой кислоты,
C17H33COOH: олеиновой кислоты,
С17H31COOH: линолевой кислоты,
C17H29COOH: линоленовой кислоты,
C18H37COOH: нонадекановой кислоты,
С19H39COOH: икозановой кислоты,
Предпочтительные ацил-группы происходят от
C11H23COOH: лауриновой кислоты,
C13H27COOH: миристиновой кислоты,
C15H31COOH: пальмитиновой кислоты,
C17H35COOH: стеариновой кислоты,
C17H33COOH: олеиновой кислоты,
C17H31COOH: линолевой кислоты,
C17H29COOH: линоленовой кислоты,
и, в частности, пальмитиновой кислоты.
Прямая или разветвленная углеводородная цепь, имеющая 1-4 атома углерода, предпочтительно является алкильной группой, имеющей 1-4 атома углерода, в особенности метильной группой.
Прямая или разветвленная углеводородная цепь, имеющая 1-10 атомов углерода, предпочтительно является алкильной группой, имеющей 1-10 атомов углерода, а наиболее предпочтительно 1-4 атома углерода, в особенности метильной или пропильной группой.
Предпочтительными соединениями настоящего изобретения являются соединения, у которых в формуле I 1,2-е положение является насыщенным.
Наиболее предпочтительным соединением настоящего изобретения являются те соединения у которых в формуле I 1,3-е положение является насыщенным,
R1 - водород,
R2 - пропиловая группа,
R3 - ацил, имеющий 11-20 атомов углерода,
X1 - фтор,
X2 - фтор,
Следующим по предпочтению соединением настоящего изобретения является соединение, у которого в формуле I 1,2-е положение является двойной связью,
R1 - водород,
R2 - пропиловая группа,
R3 - пальмитоиловая группа,
X1 - фтор,
X2 - фтор.
Наиболее предпочтительное соединение настоящего изобретения имеет формулу: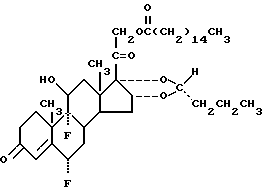
Предпочтительным примером осуществления настоящего изобретения является состав, содержащий предпочтительное соединение настоящего изобретения в сочетании с липосомами.
В тех случаях, когда целью изобретения является предоставлению фармацевтических составов, содержащих липосомы, активным соединением этих составом должно быть соединение по формуле I, где R3 ацил, имеющий 11-20 атомов углерода,
В тех случаях, когда целью изобретения является предоставление фармацевтических составов без липосом, активным соединением этих составов должно быть соединение по формуле I. где R3 - ацил, имеющий 1-10 атомов углерода, предпочтительно: 5-10 атомов углерода.
Индивидуальность стереоизомерных компонентов, присутствующих в смеси стероидов, имеющих вышеприведенную формулу I можно установить следующим образом - по хиральности атома углерода в положении 22 и по отношению заместителя R2: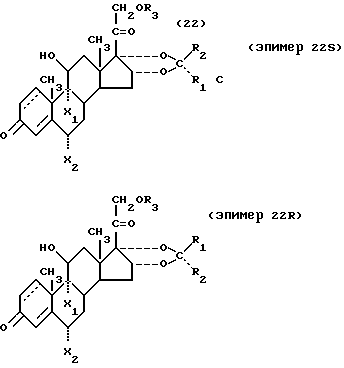
Предпочтительное стереоизомерное соединение имеет конфигурацию 22 R.
Методы приготовления
Староидный эфир
где является
является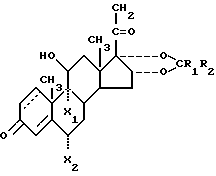
а X1, X2, R1, R2 имеют значения, данные выше, R4 - прямая или разветвленная, насыщенная или ненасыщенная алкильная группа с 3-19 атомами углерода и 1,2-е положение является насыщенными или представляет собой двойную связь, готовится любым из следующим альтернативных методов.
А. Реакция соединения с формулой 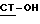 , где
, где 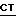 имеет определение, данное выше, с соединением по формуле
имеет определение, данное выше, с соединением по формуле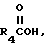
где
R4 имеет определение, данное выше.
Этерификацию 21-гидрокси-соединения можно проводить известным способом, например, реакцией исходного 21-гидрокси-стероида с подходящей карбоновой кислотой, лучше в присутствии трифторуксусного ангидрида, и, предпочтительно, в присутствии кислотного катализатора, например, п-толуолсульфоновой кислоты.
Реакцию лучше проводить в органическом растворителе, таком как бензол или хлористый метилен; обычно реакцию проводят при температуре 20-100oC.
B. Реакция соединения с формулой 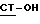 , где
, где 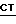 имеет определение, данное выше, с соединением по формуле
имеет определение, данное выше, с соединением по формуле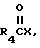
где
R4 имеет определение, данное выше,
X - галоген, такой как хлор, бром, йод и фтор или группа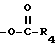 ,
,
где
R4 имеет определение, данное выше.
Исходное 21-гидрокси-соединение можно обработать подходящим галоидным соединением карбоновой кислоты или ангидридом, предпочтительно, в таких растворителях, какими являются галоид-замещенный углеводород, например, хлористый метилен, или эфир, например, диоксан, в присутствии щелочи, такой как триэтиламин ил пиридин, предпочтительно при низкой температуре, например, от -5 до +30oC.
C. Реакция соединения с формулой 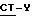 , где
, где 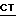 имеет определение данное выше, а Y выбирается из атомов галогенов, например, Cl, Br и I или мезилата и п-толуолсульфоната, с соединением по формуле
имеет определение данное выше, а Y выбирается из атомов галогенов, например, Cl, Br и I или мезилата и п-толуолсульфоната, с соединением по формуле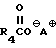 ,
,
где
R4 имеет определение, данное выше а A⊕ является катионом.
Соль подходящей карбоновой кислоты и щелочного металла, например, лития, натрия или калия, или соль триэтил-аммония или трибутил-аммония может реагировать с подходящим алкилированным агентом по формуле 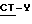 . Реакцию проводят, предпочтительно, в полярном растворителе, таком как ацетон, метилэтилкетон, диметилформамид или диметилсульфоксид, обычно при температуре в диапазоне от 25 до 100oC.
. Реакцию проводят, предпочтительно, в полярном растворителе, таком как ацетон, метилэтилкетон, диметилформамид или диметилсульфоксид, обычно при температуре в диапазоне от 25 до 100oC.
При использовании любого из методов A-C, в том случае, если желательно получить чистый эпимер, может понадобиться конечный этап для разделения смеси эпимеров на ее компоненты.
Фармацевтические препараты
Соединения настоящего изобретения могут быть использованы для различных способов местного назначения в зависимости от места воспаления, например, подкожно, парэнтерально или для местного назначения в дыхательные пути при помощи ингаляций. Главной целью рецепта назначения является достижение оптимальной биологической пригодности активного стероидного ингредиента. В подкожных рецептах этого можно выгодно достигнуть, если стероид растворен в носителе с высокой термодинамической активностью. Для этого могут быть использованы подходящие системы растворителей, включающие подходящие гликоли, такие как пропилен-гликоль или 1-3-бутадиоловый эфир и им подобные, или же их сочетания с водой.
Также возможно растворение стероида, либо полностью либо частично, в липофильной фазе с помощью поверхностного вещества в качестве растворителя. Кожные составы могут быть мазями, масляными растворами в кремах на масляной основе или примочками. При использовании эмульсионного носителя система, включающая растворенный активный компонент, может составлять дисперсную фазу или непрерывную фазу. Стероид может также присутствовать в вышеперечисленных составах в виде очень тонко измельченного твердого вещества.
Стероидные аэрозоли под повышенным давлением предназначаются для ротовых или носовых ингаляций. Аэрозольные системы спланированы таким образом, чтобы дозе на один прием содержала 10 - 1000 мкг, предпочтительно, 20 - 250 мкг, активного стероида. Наиболее активные стероиды назначаются в дозах из нижней части диапазона доз. Очень измельченные стероиды состоят из частичек, в основном, меньших, чем 5 мкм, которые суспендированы в диспергаторной смеси с помощью дисперганта, такого как сорбитантриолеат, олеиновая кислота, лецитин или натриевая соль диоктилсульфоянтарной кислоты.
Стероид может также быть назначен посредством ингаляций сухой пудры.
Одной возможностью является смешивание очень тонко измельченного стероида с веществом-носителем, таким как лактоза или глюкоза. Пудрообразная смесь распределяется по твердым желатиновым капсулам, каждая из которых содержит желаемую дозу стероида. Капсулы затем помещаются в ингалятор для пудры, и доза лекарства при вдыхании попадает в дыхательные пути пациента.
Другой возможностью является формирование очень тонко измельченной пудры в шарики, которые разрушаются в процессе использования дозы. Этими шариками из пудры наполняется лекарственная емкость ингалятора, рассчитанного на много доз, например, Turbuhaler. Дозирующее устройство отмеряет желаемую дозу на один прием, которая затем вдыхается пациентом. По этой системе стероид с веществом-носителем или без него доставляется к пациенту.
Стероид также может быть включен в рецепты, предназначенные для лечения кишечных воспалительных заболеваний, либо через рот, либо через прямую кишку. Рецепты для введения через рот должны быть составлены таким образом, чтобы стероид доставлялся к воспаленным участкам кишечника. Этого можно достичь путем различных сочетаний принципов контроля за освобождением активного вещества в кишечнике и/или замедленным освобождением активного вещества. Для назначения лекарства через прямую кишку подходящим является назначение в виде клизмы.
Приготовление липосомных составов
Лецитины, использованные в этом изобретении, имеют жирнокислотные цепи разной длины и, следовательно, имеют различные температуры фазового перехода. Примерами использованных лецитинов являются те, которые получают из яиц и соевых бобов, а также синтетические лецитины, такие как димиристоил-фосфатидилхолин (ДМФХ), дипальмитоил-фосфатидилхолин (ДПФХ) и дистеароилфосфатидилхолин (ДСФК). Путем манипулирования структурой лецитинов можно сформировать стабильные носители с различными возможностями биологического разрушения. Это дает возможность продлевать освобождение заключенного (в липосомы) стероидного эфира.
Протяженность взаимодействия стероидного эфира, с например, пузырьками дипальмитоилфосфатилилходина (ДПФХ) зависит от длины эфирной цепи, причем установлено, что взаимодействие увеличивается при удлинении цепи.
Включение холестерина или производных холестерина в рецепты липосом стало весьма распространенным благодаря их способности увеличивать стабильность липосом.
На начальных этапах приготовления липосом в соответствии с настоящим изобретением можно следовать традиционным методикам, описанным в литературе, а именно; компоненты растворяют в растворителе, например, эталоне или хлороформе, который затем выпаривают. После этого полученный липидный слой диспергируют в выбранной водной среде, а затем эту смесь либо встряхивают, либо озвучивают с помощью ультразвука. Липосомы настоящего изобретения предпочтительно имеют диаметр между 0,1 и 10 мкм.
В добавление к основному липосомо-образующему липиду (ам), который обычно является фосфолипидом, другие липиды (например, холестерин или холестерин-стеарат) в количестве 0-40% в/в от общего количества липидов могут быть включены для изменения структуры липосомной мембраны. Для оптимизации поглотительной способности липисом может быть включен и третий компонент, который обеспечивает отрицательный заряд (например, дипальмитоил-фосфатидил-глицерин) или положительный заряд (например, стеариламин-ацетат или хлорид цетилпиридиния).
Может быть использован широкий диапазон соотношений стероидного эфира и липидов в зависимости от того, какие условия и липиды используются. Может быть использовано высушивание (высушивание из замороженного состояния или высушивания при распылении) лицесом в присутствии лактозы, содержание которой находится в диапазоне от 0 до 95% от конечного состава.
Составы, в соответствии с настоящим изобретением, которые в особенности предпочтительны, содержат липосомы с (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β - гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дионом. Способы назначения включают пудрообразные аэрозоли, закрывание капель, лечение распыленным лекарством и аэрозоли под повышенным давлением.
Рабочие примеры
Настоящее изобретение будет в дальнейшем проиллюстрировано следующими неограничивающими примерами. В этих примерах для работы, связанной с препаративной хроматографией, использовалась объемная скорость потока 2,5 мл/см2 ч-1. Молекулярные веса во всех примерах определялись с помощью масс-спектрометрии с химической ионизацией (CH4 в качестве газа-реагента), точки плавления определялись на микроскопе Лейтца-Ветцлара с горячим столиком. Анализы ВЭЖХ (высоко эффективная жидкостная хроматография ) были выполнены на колонке μ Bondapak C18 (30o • 3,9 мм в.д.) с объемной скоростью потока 1,0 мл/см2 мин-1 и со смесью этанол/вода в соотношениях между 40:60 и 60:40 в качестве подвижной фазы, если не заявлен другой способ.
Пример 1
(22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дион
Раствор пальмитоил-хлорида (1,2 г) в 10 мл диоксана был добавлен капля за каплей к раствору (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β , 21-дигидроксипрегн-4-ен-3,20-диона (200 мг) в 25 мл пиридина. Реакционная смесь перемешивалась в течение 16 ч при комнатной температуре. Затем добавляли хлористый метилен (150 мл), раствор промывали IM соляной кислотой, 5%-ным водным раствором карбоната калия, водой и высушивали. Неочищенный продукт после упаривания очищали хроматографией на колонке с Сефадексом LH-20 (78•7,5 см), используя хлороформ в качестве подвижной фазы. Фракции 210 - 255 мл собирали и упаривали с образованием 203 мг (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоил-оксипрегн-4-ен-3,20-диона. Точка плавления 87 - 90oC. Молекулярный вес 706 (рассч. 707,0).
Чистота 96% (анализ ВЭЖХ).
Пример 2
(22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дион
К раствору (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор 11β , 21-дигидроксипрегн-4-ен-3,20-диона (50 мг) и пальмитоилхлорида (35 мг) в 10 мл хлористого метилена добавляли капля за каплей раствор триэтиламина (13 мг) в 2 мл хлористого метилена. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем добавляли еще 50 мл хлористого метилена. Далее реакционную смесь обрабатывали как в примере 1. Неочищенный продукт очищали на колонке Сефадекс LH-20 (85% • 2,5 см), используя хлороформ в качестве подвижной фазы. Фракции 210-250 мл собирали и упаривали с образованием 34 мг (22 R) -16α,17α- бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальнитоилоксипрегн-4-ен-3,20 диона. Молекулярный вес 706 (рассч. 707.0).
Чистота 95% (ВЭЖХ-анализ).
Пример 3
(22 S)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дион
Раствор пальмитоил-хлорида (0,4 мл) в 10 мл диоксана был добавлен капля за каплей к раствору (22 S)- 16α,17α -бутилдиендиокси- 6α,9α -дифтор- 11β , 21-дигидроксипрегн-4-ен-3,20 диона (70 мг) в 25 мл пиридина. Реакционная смесь перемешивалась в течение 16 ч при комнатной температуре и далее обрабатывалась как в примере 1. Неочищенный продукт очищали на колонке Сефадекс LH-20 (87•2,5 см), используя хлороформ в качестве подвижной фазы. Фракции 225-265 мл собирали и упаривали с образованием 92 мг (22 S)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-диона в виде масла. Молекулярный вес 706 (рассч. 707.0). Чистота 97% (анализ ВЭЖХ).
Пример 4
(22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-миристоилоксипрегн-4-ен-3,20-дион
Миристоил-хлорид синтезировали нагреванием с обратным холодильником миристиновой кислоты (7,0 г) и тионил-хлорида (9 мл) вы трихлорэтилене (100 мл) в течение 3 ч. Затем растворитель упаривали.
К раствору (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β , 21-дигидроксипрегн-4-ен-3,20-диона (51 мг) в 10 мл хлористого метилена добавляли миристоил-хлорид (32 мг), сопровождавшийся триэтиламином (13 мг), растворенным в хлористом метилене (5 мл). Реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Далее добавляли хлористый метилен и смесь последовательно промывали 0,1М соляной кислотой и водой (3 • 50 мл). После высушивания и упаривания остаток очищали хроматографией на Кизельгеле-60 (Merck), используя смесь гептан: ацетон в соотношении 6:4 в качестве подвижной фазы, с образованием 27 мг (22 R)- 16α,17α -бутилдендиокси- 6α,9α -дифтор- 11β -гидрокси-21-миристоилоксипрегн-4-ен-3,20-диона. Молекулярный вес 678 (рассч. 678,9). Чистота 96,8% (анализ ВЭЖХ).
Пример 5
(22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-лауроилоксипрегн-4-ен-3,20-дион
К раствору (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор -11β, , 21-дигидроксипрегн-4-ен-3,20-диона (51 мг) в 5 мл хлористого метилена добавляли лауроил-хлорид (28 мг), сопровождающийся триэтиламином (13 мг), растворенным в 2 мл хлористого метилена. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, далее добавляли хлористый метилен и органическую фазу промывали последовательно 0,1 М соляной кислотой и водой (3 • 30 мл). После высушивания и упаривания остаток очищали хроматографией на Кизельгеле-60 (Merck), используя смесь гексан : ацетон в соотношении 6:4 в качестве подвижной фазы. Полученный продукт далее был очищен на втором хроматографическом этапе, используя смесь петролейный эфир : этилацетат в соотношении 3:2 в качестве подвижной фазы, с образованием 33 мг (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-дауроилоксипрегн-4-ен-3,20-диона. Молекулярный вес 650 (рассч. 650,8). Чистота 96,9% (анализ ВЭЖХ).
Пример 6
(22 R)- 16α-17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн-4,4-диен-3,20-дион
Раствор пальмитоил-хлорида (2,3 мл) в 15 мл диоксана был добавлен капля за каплей к раствору (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β , 21-дигидроксипрегн-1,4-диен-3,20-диона (700 мг) в 30 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (76 • 6,3 см) с использованием смеси гептан:хлороформ:этанол в соотношении 20:20:1 в качестве подвижной фазы. Фракции 1020-1350 мл собирали и упаривали с образованием 752 мг (22 R) - 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн. -1,4-диен-3,20-диона. Точка плавления 141-145oC; [α]
Пример 7
(22 S)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β гидрокси-21-пальмитоилоксипрегн-1,4-диен-3,20 дион
Раствор пальмитоил-хлорида (0,5 мл) в 5 мл диоксана добавляли капля за каплей к раствору (22 S)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β , 21-дигидроксипрегн-1,4-диен-2,20-диона (150) в 10 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали в колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан:хлороформ:этанол в соотношении 20:20:1 в качестве подвижной фазы. Фракции 215-315 мл собирали и упаривали с образованием 132 мг (22 S)- 16α,17α - бутилдендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн-1,4-диен-3,20-диона. Точка плавления 176 - 180oC; [α]
Пример 8
(22 R)-21-ацетокси- 16α,17α -бутилдендиокси- 6α,9α -дифтор- 11β гидроксипрегн-4-ен-3,20 дион
Раствор ацетил-хлорида (38 мл) в 5 мл диоксана добавляли капля за каплей к раствору (22 S)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β , 21-дигидроксипрегн-4-ен-3,20-диона (75 мг) в 5 мл пиридина. Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После упаривания добавляли хлористый метилен (75 мл), а затем раствор промывали холодным 5% водным раствором карбоната калия и насыщенным раствором хлорида натрия. После упаривания неочищенный продукт очищали хроматографией на колонке с Сефадексом LH-20 (85 • 2,5 см) с использованием хлороформа в качестве подвижной фазы. Фракции 365 - 420 мл собирали и упаривали с образованием 57 мг (22 R)-21-ацетокси- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидроксипрегн-4-ен-3,20 диона. Точка плавления 182 - 189oC; [α]
Пример 9
(22 R)-16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21- валероилоксипрегн-4-ен-3,20-дион
раствор валероил-хлорида (60 мг) в 5 мл диоксана добавляли капля за каплей к раствору (22 R)-16α,17α-бутилидендиокси- 6α,9α -дифтор- 11β -21-дигидроксипрегн-4-ен-3,20 диона (75 мг) в 5 мл пиридина. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После упаривания добавляли хлористый метилен (75 мл), затем раствор промывали холодным водным 5% раствором карбоната калия и насыщенным раствором хлорида натрия. После упаривания неочищенный продукт очищали хроматографией на колонке с Сефадексом LH-20 (85 • 2,5 см) с использованием хлороформа в качестве подвижной фазы. Фракции 265 - 325 мл собирали и упаривали с образованием 50 мг (22 R)-21-ацетокси- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-валероилоксипрег-4-ен-3,20 диона. Точка плавления 181 - 185oC; [α]
Пример 10
(22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-каприлоксипрегн-1,4-диен-3,20-дион
Раствор деканоил-хлорида (0,2 мл) в 3 мл диоксана добавляли капля за каплей к раствору (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -21-дигидроксипрегн-1,4-диен-3,20-диона (100 мг) в 6 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (71 • 6,3 см) с использованием хлороформа в качестве подвижной фазы. Фракции 1470 - 1725 мл собирали и упаривали с образованием 113 мг (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-каприлоксипрегн-1,4-диен-3,20-диона. Точка плавления 182 - 184oC. [α]
Пример 11
6α,9α -Дифтор- 11β, , 21-дигидрокси- 16α,17α [/1-метилэтилиден/бис/окси/]прегн-4-ен-3,20-дион
Суспензию 0,9 г хлорида трис/трифенилфосфин/родия в 250 мл дегазированного толуола гидрогенизовали в течение 45 мин при комнатной температуре и атмосферном давлении. Затем добавляли раствор 1,0 г фторцинолон- 16α,17α -ацетонида в 100 мл абсолютного этанола и гидрогенизацию продолжали еще 40 ч. Продукт реакции упаривали, остаток очищали тонкослойной хроматографией на силикагеле с использованием смеси ацетон/петролейный эфир в качестве подвижной фазы для удаления основной части катализатора. Элюат упаривали, остаток далее очищали хроматографией на колонке с Сефадексом LH-20 (72,5 • 6,3 см) с использованием хлороформа в качестве подвижной фазы. Фракции 3555 - 4125 мл собирали и упаривали с образованием 0,61 г 6α,9α -дифтор- 11β , 24-дигидрокси- 16α,17α -[/1-метилэтилиден/бис/окси/] прегн-4-ен-3,20-диона. Точка плавления 146 - 151oC. [α]
Пример 12
6α,9α -дифтор- 16α,17α -гидрокси- 6α,9α [/1-метоксиэтилиден/бис/окси/] -21-пальмитоилоксипрегн-4-ен-3,20-дион
Раствор пальмитоил-хлорида (2,1 мл) в 15 мл диоксана добавляли каплю за каплей к раствору 11β -дифтор- 16α,17α, 21-дигидрокси- 6α,9α -[/1-метилэтилиден/бис/окси/] прегн-4-ен-3,20-диона (310 мг) в 30 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Софадексом LH-20 (76 • 6,3 см) с использованием смеси гептан:хлороформ:этанол в соотношении 20: 20:1 в качестве подвижной фазы. Фракции 1035 - 1260 мл собирали и упаривали с образованием 158 мг 11β -дифтор- 16α,17α -гидрокси -[α]
Пример 13
(22 R)- и (22 S)-21-ацетокси- 6α -бутилидендиокси- 11β -фтор- 16α,17α -гидроксипрегн-4-ен-3,20-дион
(22 RS)- 6α -бутилидендиокси- 11β -фтор- 16α -21-дигидроксипрегн-4-ен-3,20-дион (68 мг) растворяли в 1 мл пиридина. Добавляли уксусный ангидрид (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем ее вливали в ледяную воду и экстрагировали 3 раза по 25 мл хлористым метиленом. Экстракт высушивали и упаривали. Оставшуюся смесь 22 RS разделяли хроматографией на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20:20:1 в качестве подвижной фазы. Фракции 380 - 400 мл (A) и 420 - 440 мл (B) собирали и упаривали.
После осаждения из смеси хлористый метилен (петролейный эфир фракция A образовала 14 мг (22 S)-21-ацетокси- 17α , 6α -бутилидендиокси- 11β -фтор- [α]
Фракция B после осаждения образована 20 мг (22 R)-21-ацетокси- 6α -бутилидендиокси- 11β -фтор- [α]
Пример 14
(22 RS)- 6α -бутилидендиокси- 11β -фтор- 6α -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дион
К суспензии 1,4 г хлорида трис(трифенилфосфин)родия в 300 мл толуола добавляли раствор 1170 мг 11β,16α,17α, -фтор- 6α -21-тетрагидроксипрегн-1,4-диен-3,20-диона в 250 мл абсолютного этанола. Смесь гидрогенизировали 22 ч при комнатной температуре и атмосферном давлении и упаривали. Остаток осаждали из смеси ацетона с хлороформом с образованием 661 мг 11β,16α,17α -фтор- 6α, 21-тетрагидроксипрегн-4-он-3,20-диона. Молекулярный вес 396 (рассч. 396,5). Чистота 96:6% (анализ ВЭЖХ).
11β,16α,17α -фтор- 16α,17α , 21-тетрагидроксипрегн-4-ен-3,20-дион (308 мг) добавляли порциями к раствору бутанола (115 мг) и 70% хлорной кислоты (0,2 мл) в 50 мл диоксана. Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Затем добавляли хлористый метилен (200 мл), раствор промывали 10%-ным водным раствором карбоната калия, водой и высушивали. Остаток после упаривания очищали на колонке с Сефадексом LH-20 (87•2,5 см) с использованием хлороформа в качестве подвижной фазы. Фракции 420 - 500 мл собирали и упаривали образованием 248 мг (22 RS)- 6α -бутилидендиокси- 11β -фтор- [α]
Раствор пальмитоил-хлорида (0,21 мл) в 3 мл диоксана добавляли капля за каплей к раствору (22RS)- 6α -бутилдендиокси- 11β -фтор- 16α,17α , 21-дигидроксипрегн-4-ен-3,20-диона (50 мг) в 6 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89• 2,5 см) с использованием смеси гептан : хлороформ : этанол в соотношении 20: 20: 1 в качестве подвижной фазы. Фракции 185 - 230 мл собирали и упаривали с образованием 42 мг (22 RS)- 6α -бутилидендиокси- 11β -фтор- 16α,17α -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-диона в виде масла. Молекулярный вес 688 (рассч. 688,97). Чистота 99,0% Распределение между 22 R- и 22 S-эпимерами было 15/85 (анализ ВЭЖХ).
Пример 15
(22 R)- 6α -бутилигендиокси- 11β -фтор- 16α,17α -гидрокси-21-пальмитоилоксипрегн-4-ен-3,2-дион
(22 RS)- 6α -бутилидендиокси- 11β -фтор- μ , 21-дигидроксипрегн-4-ен-3,20-дион (225 мг) разделяли на порции препаративной ВЭЖХ на колонке 16α,17α Bondapak C18 (150•19 мм) с использованием смеси этанол: вода в соотношении 40:60 в качестве подвижной фазы. Фракции, сосредоточенные около 265 мл (A) и 310 мл (B) были собраны и упарены. После осаждения из смеси хлористый метилен/петролейный эфир фракция A образована 68 мг (22R)- 6α -бутилидендиокси- 11β -фтор- [α]
Фракция B после осаждения образована 62 мг (22 S)- 6α -бутилидендиокси- 11β -фтор- [α]
Раствор пальмитоил-хлорида (0,22 мл) в 5 мл диоксана добавляли капля за каплей к раствору (22 R)-6α-бутилидендиокси- 11β -фтор- 16α,17α , 21-дигидроксипрегн-4-ен-3,20-диона (32 мг) в 10 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (87•2,5 см) с использованием хлороформа в качестве подвижной фазы. Фракции 215 - 250 мл собирали и упаривали с образованием 38 мг (22 R)- 6α- бутилидендиокси- 11β -фтор- 16a,17α -гидрокси-21-пальмитоилоксипрегн-4- ен-3,20-диона в виде масла. Молекулярный вес 688,97). Чистота 96,0% (анализ ВЭЖХ).
Пример 16
(22 S)- 6α -бутилидендиокси- 11β -фтор- 16α,17α, -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дион
(22 RS)- 6α -бутилидендиокси- 11β -фтор- 16α,17α , 21-дигидроксипрегн-4-ен-3,20-дион (68 мг) растворяли в 1 мл пиридина. Добавляли уксусный ангидрид (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем ее вливали в ледяную воду и экстрагировали 3 раза по 25 мл хлористым метиленом. Экстракт высушивали и упаривали. Оставшуюся смесь эпимерон 22 RS разделяли хроматографией на колонке с Сефадексом LH-20 (89•2,5 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20: 20: 1 в качестве подвижной фазы. Фракции 380-400 мл (A) и 420-440 мл (B) собирали и упаривали.
После осаждения из смеси хлористый метилен /петролейный эфир фракция F образовала 14 мг (22 S)-21-ацетокси- 6α -бутилидендиокси- 11β -фтор- [α]
Фракция B после осаждения образовала 20 мг (22 R)-21-ацетоки- 6α -бутилидендиокси- 11β -фтор- [α]
К раствору 14 мг (22 S)-21-ацетокси- 6α -бутилидендиокси- 11β -фтор- 16α,17α -гидроксипрегн-4-ен-3,20-диона в 2 мл этанола добавляли 2 мл 2М соляной кислоты. После перемешивания при 60oC в течение 5 ч реакционную смесь нейтрализовали насыщенным водным раствором гидрокарбоната натрия и экстрагировали 3 раза по 25 мл хлористого метилена. Объединенные экстракты промывали водой, высушивали и упаривали. Остаток очищали на колонке с Сефадексом LH-20 (87 • 2,5 см) с использованием хлороформа в качестве подвижной фазы, фракции 455-510 мл собирали и упаривали с образованием 7 кг (22 S)- 6α -бутилидендиокси- 11β -фтор- 16α,17α, 21-дигидроксипрегн-4-ен-3,20-диона. Молекулярный вес 450 (рассч. 450,6). Чистота 96,6%.
Раствор пальмитоил-хлорида (195 мг) в 5 мл диоксана добавляли капля из каплей к раствору (22 S)- 6α -бутилидендиокси- 11β -фтор- 16α,17α , 21-дигидроксипрегн-4-ен-3,20-диона (32 мг) в 10 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20: 20: 1 в качестве подвижной фазы. Фракции 205 - 245 мл собирали и упаривали с образованием 37 мг (22 S)- 6α -бутилидендиокси- 11β -фтор- 16α,17α -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-диона в виде масла. Молекулярный вес 688 (рассч. 688,97). Чистота 96,4% (анализ ВЭЖХ).
Пример 17
(22 RS)- 6α -бутилидендиокси- 11β -фтор- 16α,17α -гидрокси-21-лауролоксипрегн-4-ен-3,20-дион
Раствор лауроил-хлорида (0,4 мл) в 3 мл диоксана добавляли капля за каплей к раствору (22 RS)- 6α -бутилдендиокси- 11β -фтор- 16α,17α , 21-дигидроксипрегн-4-ен-3,20-диона (50 мл) в 6 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20: 10: 1 в качестве подвижной фазы, фракции 215-250 мл собирали и упаривали с образованием 15 мг (22 RS)- 6α -бутилидендиокси- 11β - фтор- [α]
Пример 18
(22 R)- 6α -бутилидендиокси- 11β -гидрокси-21-пальмитоилоксипрегн-1,4-диен-3,20 дион
6α -фтор- 11β,16α,17α , 21-тетрагидроксипрегн-1,4-диен-3,20-дион (400 мг) порциями добавляли к раствору бутаналя (0,18 мл) и 70% хлорной кислоты (0,2 мл) в 50 мл диоксана. Реакционная смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли хлористый метилен (200 мл) и раствор промывали 10% водным раствором карбоната калия, водой и высушивали. Остаток после упаривания очищали на колонке с Сефадексом LH-20 (75 • 6,3 см) с использованием хлороформа в качестве подвижной фазы. Фракции 2880-3300 мл собирали и упаривали с образованием 1209 мг (22 R)- 16α,17α -бутилидендиокси- α -фтор- 11β , 21-дигидроксипрегн-1,4-диен-3,20-диона. Молекулярный вес 448 (рассч. 448,5). Чистота составляла 95,7%. Распределение между 22 R и 22 S - эпимерами было 55/45 (анализ ВЭЖХ).
(22 RS)- 16α,17α -бутилидендиокси- 6α -фтор- 11β , 21-дигидрокси-прегн-1,4-3,20-дион (36 мг) хроматографировали на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20: 20:1 в качестве подвижной фазы. Фракции 1720-1800 мл (A) и 1960-20258 мл (B) собирали и упаривали. Две продукта осаждали из смеси хлористый метилен /петролейный эфир. Продукт из фракции А (12 мг) методами 1H ЯМР и масс-спектрометрии был идентифицирован с (22 S)- 16α,17α -бутилидендиокси- 6α -фтор- 11β , 21-дигидроксипрегн-1,4-диен-3,20-дионом, а продукт из фракции В (10 мг) - с его 22 R - эпимером.
Эпимеры имеют следующие свойства. Эпимер 22 S : точка плавления 172 - 180oC; [α]
Раствор пальмитоил-хлорида (172 мг) в 5 мл диоксана добавляли капля за каплей к раствору (22 R)- 16α,17α -бутилидендиокси- 6α -фтор- 11β , 21-дигидроксипрегн-1,4-диен-3.20-диона (56 мг) в 10 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20: 20: 1 в качестве подвижной фазы. Фракции 225-285 мл собирали и упаривали с образованием 31 мг (22 R)- 16α,17α -бутилидендиокси- 6α -фтор- 11β -гидрокси-21-пальмитоилоксипрегн-1,4-диен-3,20-диона. Точка плавления 95 - 100oC. [α]
Пример 19
(22 S)- 16α,17α -бутилидендиокси- 6α -фтор-11 β -гидрокси-21-пальмитоилоксипрегн-1,4-3,20-дион
Раствор пальмитоил-хлорида (110 мг) в 5 мл диоксана добавляли капля за каплей к раствору (22 S)- 16α,17α -бутилидендиокси- 6α -фтор- 11β , 21-дигидроксипрегн-1,4-диен-3,20-диона (46 мг) в 10 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан:хлороформ в соотношении 20:20:1 в качестве подвижной фазы. Фракции 185-225 мл собирали и упаривали с образованием 37 мг (22 S)- 16α,17α -бутилидендиокси- 6α -фтор- 11β -гидрокси-21-пальмитоилоксипрегн-1,4-диен-3,20-диона. Точка плавления 65 - 68oC. [α]
Пример 20
6α -фтор- 11β , 21-дигидрокси- 16α,17α [/1-метил-этилиден/-бис/окси/] прегн-4-ен-3,20-дион
Суспензию 2,1 г хлорида трис/трифенилфосфин/родия в 500 мл толуола гидрогенизировали при комнатной температуре и атмосферном давлении в течение 45 мин при наличии катализатора в растворе. Затем добавляли раствор 2,0 г 6α -фтор- 11β , 21-дигидрокси- 16α,17α - [/1-метилэтилиден/бис/окси/] прегн-1,4-диен-3,20-диона в 1000 мл абсолютного этанола и гидрогенизацию продолжали в течение еще 65 ч. Реакционную смесь упаривали, остаток очищали на колонке с Сефадексом LH-20 (71 • 6,3 см) с использованием хлороформа в качестве подвижной фазы, фракции 2010-2445 мл собирали и упаривали с образованием 1,51 г 6α -фтор 11β 21-дигидрокси- 16α,17α -[/1-метилэтилиден/бис/окси/] прегн-4-ен-3,20-диона. Точка плавления 209-219oC, [α]
Пример 21
6α -фтор- 11β -гидрокси- 16α,17α - [/1-метилетилиден/бис/окси/]-21-пальмитоилоксипрегн-4-ен-3,20-дион
Раствор пальмитоил-хлорида (0,21 мл) в 3 мл диоксана добавляли капля за каплей к раствору 6α -фтор- 11β , 21-дигидрокси- 16α,17α [/1-метилэтилиден/бис/окси/]прегн-4-ен-3,20-диона в 6 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт на колонке с Сефадексом LH-20 (76•6,3 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20:20:1 в качестве подвижной фазы. Фракции 1035 - 1230 мл собирали и упаривали с образованием 63 мг 6α -фтор- 11β -гидрокси- 16α,17α [/1-метилэтилиден/бис/окси/]-21-пальмитоилоксипрегн-4-ен-3,20-диона. Точка плавления 99 - 101oC. [α]
Пример 22
9α -фтор- 11β , 21-диридрокси- 16α,17α [/1-метилэтилиндон/бис/окси/] прегн-4-ен-3,20-дион
Раствор 675 мг хлорида Трис/трифенилфосфин/родия в 250 мл толуола гидрогенизировали при комнатной температуре и атмосферном давлении в течение 45 мин. Добавляли раствор 1 г триамцинолон- 16α,17α -ацетонида в 100 мл абсолютного этанола и гидрогенизацию продолжали в течение еще 40 ч. Реакционную смесь упаривали, основную часть катализатора удаляли тонкослойной хроматографией с использованием смеси ацетон/ петролейный эфир (т. кип. 40 - 60oC) в соотношении 40:60 в качестве подвижной фазы. Неочищенный продукт далее очищали на колонке с Сефадексом LH-20 (72,5 • 6,3 см) с использованием хлороформа в качестве подвижной фазы. Фракции 2746 - 3195 мл собирали и упаривали с образованием 404 мг 9α -фтор- 11β , 21-дигидрокси- 16α,17α -[/1-метилэвилиден/бис/окси/] прегн-4-ен-3,20-диона. Точка плавления 238 - 41oC [α]
Чистота 99% (анализ ВЭЖХ).
Пример 23
9α -фтор- 11β -гидрокси- 16α,17α -[/1-метилэтилиден/бис/окси/] -21- пальмитоилоксипрегн-4-ен-3,20-дион
Раствор пальмитоил-хлорида (0,69 мл) в 10 мл диоксана добавляли капля за каплей к раствору 9α -фтор- 11β , 21-дигидрокси- 16α,17α -[/1-метилэтилиден/бис/окси/] прегн-4-ен-3,20-диона в 20 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89•2,5 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20:20:1 в качестве подвижной фазы. Фракции 240 - 305 мл собирали и упаривали с образованием 102 мг 6α -фтор- 11β -гидрокси- 16α,17α -[/1-метилэтилиден/бис/окси/] -21- пальмитоилокстпрегн-4-ен-3,20-диона в виде масла. Молекулярный вес 674 (рассч. 674,94). Чистота 98% (анализ ВЭЖХ).
Пример 24
(22 RS)- 16α,17α -бутилидендиокси- 9α -фтор- 11β -гидрокси-21- пальмитоилоксипрегн-4-ен-3,20-дион
К раствору свеже-перегнанного бутаноля (100 мг) и 0,2 мл хлорной кислоты (70%) в 50 мл очищенного высушенного диоксана добавляли 9α -фтор- 11β,16α,17α , 21-тетрагидроксипрегн-4-он-3,20-дион (340 мг) маленькими порциями с перемешиванием в течение 20 мин. Реакционную смесь перемешивали при комнатной температуре в течение еще 5 ч. Добавляли хлористый метилен (200 мл), раствор промывали водным раствором карбоната калия, водой и высушивали над безводным сульфатом магния. Неочищенный продукт, полученный продукт, полученный после упаривания, очищали на колонке с Сефадексом LH-20 (72,5•6,3 см) с использованием хлороформа в качестве подвижной фазы. Фракции 2760 - 3195 мл собирали и упаривали с образованием 215 мг (22 RS)- 16α,17α -бутилдендиокси- 9α -фтор- 11β -21-дигидроксипрегн-4-ен-3,20-диона. Молекулярный вес 450 (рассч. 450,6). Чистота 97,4% (анализ ВЭЖХ).
Раствор пальмитоил-хлорида (0,13 мл) в 2.5 мл диоксана добавляли капля за каплей к раствору (22 RS)- 16α,17α -бутилидендиокси- 9α -фтор- 11β , 21-дигидроксипрегн-4-ен-3,20-диона (40 мг) в 5 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (87 • 2,5 см) с использованием хлороформа в качестве подвижной фазы. Фракции 220 - 300 мл собирали и упаривали с образованием 42 мг (22 RS)- 16α,17α -бутилидендиокси- 9α -фтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-диона в виде масла. Молекулярный вес. 688 (рассч. 688,97). Распределение между 22 R- и 22 S -эпимерами было 61/39 (анализ ВЭЖХ).
Пример 25
(22 R)- 16α,17α -бутилидендиокси- 9α -фтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен=3,20-дион
(22 S)- 16α,17α -бутилидендиокси- 9α -фтор- 11β -21-дигидрокси-прегн-4-ен-3,20-дион (200 мг) разделяли хроматографией на колонке с Сефадексом LH-20 (76•6,3 см) с использованием смеси гептан: хлороформ: этанол в соотношении 20:20:1 в качестве подвижной фазы. Фракции 7560 - 8835 мл (A) и 8836 - 9360 мл (B) собирали упаривали. Продукт из фракции A (128 мг) был идентифицирован методами IH ЯМР и масс-спектрометрии с (22 S)- 16α,17α -бутилидендиокси- 9α -фтор- 11β -21-дигидроксипрегн-4-ен-3,20-дионом, а продукт из фракции B (50 мг) - с его 22 R-эпимером.
Эпимеры имели следующие свойства. Эпимер 22 S точка плавления 180 - 190oC: [α]
Раствор пальмитоил-хлорида (0,34 мл) в 5 мл диоксана добавляли капля за каплей к раствору (22 R)- 16α,17α -бутилидендиокси- 9α -фтор- 11β , 21-дигидроксипрегн-4-ен-3,20-диона (50 мг) и 10 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан: хлороформ этанол в соотношении 20:20:1 в качестве подвижной фазы. Фракции 180 - 205 мл собирали и упаривали с образованием 36 мг (22 R)- 16α,17α -бутилидендиокси- 9α -фтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-диона в виде масла. Чистота 96,3% (анализ ВЭЖХ). Молекулярный вес 688 (рассч. 688,97).
Пример 26
(22S S)- 16α,17α -бутилидендиокси - 9α -фтор- 11β - гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дион
Раствор пальмитоид-хлорида (0,14 мл) в 15 мл диоксана добавляли капля за каплей к раствору (22 S)- 16α,17α -бутилидендиокси- 9α - фтор- 11β , 21-дигидроксипрегн-4-ен-3,20-диона (41 мг) в 3 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (89 • 2,5 см) с использованием смеси гептан: хлороформ: этанол и соотношении 20:20:1 в качестве подвижной фазы. Фракции 215 - 260 мл собирали и упаривали с образованием 26 мг (22 S)- 16α,17α -бутилидендиокси- 9α -фтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-диона в виде масла. Чистота 91,4 (анализ ВЭЖХ). Молекулярный вес 688 (рассч.688.97).
Пример 27
(22 R)- 16α,17α -бутилидениокси - 9α -фтор- 11β -гидрокси-21-пальмитолоксипрег-1,4-диен-3,20-дион
Раствор пальмитоил-хлорида (75 мг) в 2,5 мл диоксана добавляли капля за каплей к раствору (22 R)- 16α,17α -бутилидендиокси- 9α - фтор - 11β , 21-дигидроксипрегн-1,4-диен-3,20-диона (25 мг) в 5 мл пиридина. Реакционную смесь перемешивали при комнатной температуре в течение ночи и обрабатывали как в примере 1. Неочищенный продукт очищали на колонке с Сефадексом LH-20 (85 • 2,5 см) с использованием хлороформа в качестве подвижной фазы. Фракции 235 - 285 мл собирали и упаривали с образованием 27 мг (22 R)- 16α,17α -бутилидендиокси- 9α -фтор- 11β - гидрокси-21-пальмитоилоксипрегн-1,4-диен-3,20-диона. Точка плавления 116 - 121oC. [α]
Пример 28
Фармацевтические препараты
Следующие примеры, неограничивающие изобретение, иллюстрируют рецепты, предназначенные для различных местно-действующих форм назначения. Количество активного стероида в кожных рецептах обычно составляет 0,001-0,2% (вес/вес), предпочтительно 0,01-0,1% (вес/вес).
Рецепт 1. Мазь
Стероид, очень мелко измельченный - 0,025 г
Жидкий парафин - 10,0 г
Мягкий белый парафин - до 100,0 г
Рецепт 2. Мазь
Стероид - 0,025 г
Пропилен-гликоль - 5,0 г
Сорбитан-сесквиолеат - 5,0 г
Жидкий парафин - 10,1 г
Мягкий белый парафин - до 100,0 г
Рецепт 3. Масляный раствор в креме на водной основе
Стероид - 0,025 г
Цетанол - 5,0 г
Глицерин-моностеарат - 5,0 г
Жидкий парафин - 10,0 г
Цетомакрогель 1000 - 2,0 г
Лимонная кислота - 0,1 г
Цитрат натрия - 0,2 г
Пропилен-гликоль - 35,0 г
Вода - до 100,0 г
Рецепт 4. Масляный раствор в креме на водной основе
Стероид, очень мелко измельченный - 0,025 г
Белый мягкий парафин - 15,0 г
Жидкий парафин - 5,0 г
Цетанол - 5,0 г
Сарбимакреголь-стеарат - 2,0 г
Сорбитан-моностеарат - 0,5 г
Сорбиновая кислота - 0,2 г
Лимонная кислота - 0,1 г
Цитрат натрия - 0,2 г
Вода - до 100,0 г
Рецепт 5. Водный раствор в креме на масляной основе
Стероид - 0,025 г
Белый мягкий парафин - 35,0 г
Жидкий парафин - 5,0 г
Сорбитан-сесквиолеат - 5,0 г
Сорбиновая кислота - 0,2 г
Лимонная кислота - 0,1 г
Цитрат натрия - 0,2 г
Вода - до 100,0 г
Рецепт 6. Примочка
Стероид - 0,25 мг
Изопропиловый спирт - 0,5 мл
Карбоксивинилполимер - 3 мг
NaOH - с.н.
Вода - до 1,0 г
Рецепт 7. Суспензия для вливания
Стероид, очень тонко измельченный - 0,05-10 мг
Натрий-карбоксиметилцеллюлоза - 7 мг
NaCl - 7 мг
Полиоксиэтилен (20)сорбитанмоноолеат - 0,5 мг
Фенил-карбинол - 8 мг
Стерильная вода - до 1,0 мл
Рецепт 8. Аэрозоль для ингаляций через рот и через нос
Стероид, очень мелко измельченный - 0,1% в/в
Сорбитан-триолеат - 0,7% в/в
Трихлорформетан
24,8% в/в
Дихлортетрафторэтан - 24,8% в/в
Дихлордифторметан - 49,6% в/в
Рецепт 9. Раствор для распыления
Стероид - 7,0 мг
Пропилен-гликоль - 5,0 мг
Вода - до 10,0 мг
Рецепт 10. Пудра для ингаляций
Желатиновые капсулы, заполненные смесью
Стероид, очень тонко измельченный - 0,1 мг
Лактоза - 20 мг
Пудра вдыхается при помощи аппарата для ингаляций
Рецепт 11. Пудра для ингаляций
Пудрой, сформированной в шарики, выполняется многоразовый ингалятор для пудры. Каждая доза содержит
Стероид, очень тонко измельченный - 0,1 мг
Рецепт 12. Пудра для ингаляций
Пудрой, сформированной в шарики, заполняется многоразовый ингалятор для пудры. Каждая доза содержит
Стероид, очень тонко измельченный - 0,1 мг
Лактоза, очень тонко измельченная - 1 мг
Рецепт 13. Капсулы для лечения тонкой кишки
Стероид - 1,0 мг
Сахарные шарики - 321 мг
Аквакоат EOD 30 - 6,6 мг
Ацетилтрибутил-цитрат - 0,5 мг
Полисорбат 80 - 0,1 мг
Еудрагит L100-55 - 17,5 мг
Триэтилцитрат - 1,8 мг
Тальк - 8,8 мг
Пеногаситель MMS - 0,01 мг
Рецепт 14. Капсулы для лечения толстой кишки
Стероид - 2,0 мг
Сахарные шарики - 305 мг
Аквакоат ECD 30 - 5,0 мг
Ацетилтрибутилцитрат - 0,4 мг
Полисорбат 80 - 0,14 мг
Еудрагит NE30D - 12,6 мг
Еудрагит S100 - 12,6 мг
Тальк - 12,6 мг
Рецепт 15. Клизма через прямую кишку
Стероид - 0,02 мг
Натрий-карбоксиметилцеллюлоза - 25 мг
Двунатриевая соль этилендиаминтетрауксусной кислоты - 0,5 мг
Метил-парагидроксибензоат - 0,8 мг
Пропил-парагидроксибензоат - 0,2 мг
Хлорид натрия - 7,0 мг
Безводная лимонная кислота - 1,8 мг
Полисорбат 80 - 0,01 мг
Очищенная вода - до 1,0 мл
Рецепт, содержащий стероид, связанный с липосомами
A. Приготовление дипальмитоилфосфатидилхлолин (45 мг), димиристоилфосфатидилхолин (7 мг), дипальмитоилфосфатидилглицерин (1 мг) и (22 R)- 16α,17α -бутилидендиокси- 6α,9α -дифтор- 11β -гидрокси-21-пальмитоилоксипрегн-4-ен-3,20-дион (5 мг) смешивают в стеклянной пробирке. Все компоненты растворяют в хлороформе. Большую часть растворителя упаривают с использованием N2, а затем под пониженным давлением, в результате чего образуется тонкая пленка липидных соединений на поверхности стеклянной пробирки. К липидам добавляют водный раствор NaCl (0,9%). Образование липосом проводится при температуре, которая выше температуры фазового перехода липидов. Липосомы формируют путем встряхивания или озвучивания раствора с подбором условий озвучивания на ультразвуковом приборе. Получаемая суспензия содержит липосомы, размер которых находится в диапазоне от очень маленьких пузырьков до 2 мкм.
B. Приготовление рецептов для ингаляций
Приготовление липосом выполняется в соответствии с примером A, причем водный раствор содержит 10% лактозы. Соотношение между лактозой и липидами составляет 7: 3. Суспензия липосом замораживается на сухом льду и лиофилизируется. Сухой продукт очень тонко измельчают с образованием частиц, у которых массовое значение аэродинамического диаметра (МЗАД) составляет 2 мкм.
Фармакология
Избирательность местного противовоспалительного действия можно продемонстрировать на следующих моделях дыхательных путей.
Значительная часть вдыхаемого ГКС откладывается в глотке, а впоследствии при заглатывании оказывается в кишечнике. Эта часть содействует нежелательным побочным эффектам стероида, поскольку она действует за пределами области, предназначенной для лечения (легкие). Следовательно, выгодно использовать ГКС с высокой местной противовоспалительной активностью в легких, но чтобы при этом они вызывали слабое действие ГКС после приема через рот. Поэтому исследования были направлены на то, чтобы определить действие, вызываемое ГКС после местного применения в легких, а также после назначения через рот; различие между действием глюкокортикостероида в обработанном участке легких и за пределами этого участка было проверено следующим образом.
Модели для проверки
A. Модель для проверки желательного местного противовоспалительного действия на слизистой оболочке дыхательных путей (левая доля легких)
Крыс Spraque Dawley (250 г) слегка анестезировали с использованием эфрана, и пробный глюкокортикостероидный препарат (в липосомах, суспендированных в растворе соли) в количестве 0,5 мл/кг вливали прямо в левую долю легких. Через 2 ч суспензию Сефадекса (5 мг/кг в объеме 1 мл/кг) вливали в прокол трахеи, сделанный над бифуркацией, так что суспензия достигала обеих - правой и левой - долей легких. Через 20 ч крыс забивали, левые доли легких вырезали и взвешивали. Контрольные группы получали носитель вместо препарата глюкокортикостероида и раствор соли вместо суспензии Сефадекса для того, чтобы определить вес отека от Сефадекса, необработанного лекарством, и вес нормального легкого.
B. Модель для проверки нежелательного системного действия глюкокортикостероида, принятого через рот
Крыс Spraque Dawley (250 г) слегка анестезировали с использованием эфрана и им давали (через рот) пробный ГКС-препарат в объеме 1,0 мл/кг. Через 2 ч суспензию Сефадекса (5 мг/кг в объеме 1 мл/кг) вливали в прокол трахеи над бифуркацией, так что суспензия достигала обеих - левой и правой - долей легких. Через двадцать часов крыс забивали и взвешивали доли легких. Контрольные группы получали носитель вместо препарат глюкокортикостероида и раствор соли вместо суспензии Сефадекса для того, чтобы определить вес отека от Сефадекса, необработанного лекарством, и нормальный вес.
Результаты сравнительного исследования приведены в таблице. Фармакологический профиль проверяемых соединений настоящего изобретения сравнивался с таковым будезонид-21-пальмитата и флуметазон-21-пальмитата в липосомах. Все (проверенные) стероиды настоящего изобретения показали более высокую противовоспалительную эффективность в легких после местного применения по сравнению с будезонид-21-пальмитатом в липосомах. Более того, результаты также демонстрируют более высокую избирательность в отношении легких проверяемых соединений настоящего изобретения в сравнении с выбранными соединениями предшествующего уровня, поскольку доза, требуемая для подавления отека легкого [ED50] при назначении через рот вышеназванных соединений в 158 раз (пример 3), в 247 раз (пример 7) и в 559 раз (пример 1) выше, а доза будезонид-21-пальмитата в 66 раз выше и доза флуметазон-21-пальмитата в 8 раз выше, чем дозы, необходдимые для подавления отека легкого при местном применении в легком этих лекарств.
Таким образом, можно заключить, что соединения настоящего изобретения хорошо подходят для местного лечения воспалительных повреждений кожи и различных полостей тела (например, легких, носа, кишок и суставов).
| название | год | авторы | номер документа |
|---|---|---|---|
| 22R- ИЛИ 22S-ЭПИМЕРЫ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1992 |
|
RU2111212C1 |
| СЛОЖНЫЕ ЭФИРЫ 16 АЛЬФА 17 АЛЬФА - АЦЕТАЛЬЗАМЕЩЕННОЙ АНДРОСТАН-17 БЕТА - КАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ | 1991 |
|
RU2081879C1 |
| ПЕРОРАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНОГО ТРАКТА | 1990 |
|
RU2134104C1 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА Н, К-АТФАЗЫ ДЛЯ ЛЕЧЕНИЯ НОСОВЫХ ПОЛИПОВ | 1997 |
|
RU2197966C2 |
| ДИДЕЗОКСИДИДЕГИДРОКАРБОЦИКЛИЧЕСКИЕ НУКЛЕОЗИДЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1989 |
|
RU2114846C1 |
| СПОСОБ КОНДИЦИОНИРОВАНИЯ ВЕЩЕСТВ | 1994 |
|
RU2148992C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЛУМЕТАЗОНА, СОЕДИНЕНИЕ | 2002 |
|
RU2260596C1 |
| СПОСОБ ПОЛУЧЕНИЯ (22R,S)- 16α, 17α -БУTИЛИДEHДИOKCИ- 11β, 21 -ДИГИДPOKCИПPEГHA-1,4-ДИEH-3,20-ДИOHA | 1990 |
|
RU2048472C1 |
| ПРОИЗВОДНЫЕ АНДРОСТЕНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2194053C2 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |

Использование: в качестве антиаллергического и противовоспалительного препарата. Стероидные эфиры формулы I, приведенной в описании, или их стереоизомеры, в положении 1, 2 может присутствовать двойная связь, R1-H, C1-C4-алкил, R2-H, C1-C6-алкил, R3-C4-C20-ацил, один из X1 и X2-F, а второй - H или F, при условии, что R1 и R2 одновременно Н, или когда 1, 2 - двойная связь присутствует, то R1 - H, а R2 - C1-C6-алкил, и R3 - C11-C20-ацил. 1 получают взаимодействием 21-гидроксипроизводного 1 с соединением формулы R4COX, где R4 - C3-C19-алкил, Х - галоген или группа -ООСR4, с последующим при необходимости разделением на стереоизомеры. 1 используют в дозе от 10 до 1000 мкг в качестве активного начала в фармкомпозиции, а в качестве носителя - липосомы. 3 с. и 18 з.п.ф-лы, 1 табл.
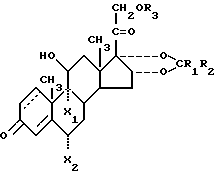
или их стероизомеры, причем в 1,2-м положении присутствует одинарная или двойная углерод-углеродная связь;
R1 - водород, прямой или разветвленный C1 - C4-алкил;
R2 - водород или прямой или разветвленный C1 - C6-алкил;
R3 - C4 - C20-ацил, имеющий прямую или разветвленную, насыщенную или ненасыщенную углеводородную цепь,
по меньшей мере один из радикалов X1 и X2 - фтор, а второй - водород или фтор при условии, что R1 и R2 одновременно не являются водородом; или когда 1,2-е положение - двойная связь, то R1 и R2 одновременно не являются метильными группами, или, когда 1,2-е положение - двойная связь, то R1 - водород, а R2 - C1 - C6-алкил и R3 - ацил C11 - C20.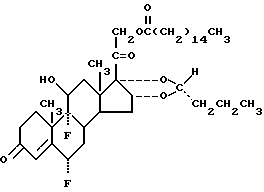
14. Способ получения соединений по п.1, отличающийся тем, что соединение общей формулы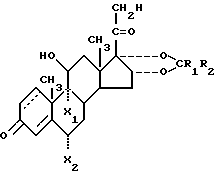
где R1, R2, X1 и X2 имеют значения по п.1, подвергают взаимодействию с соединением общей формулы
R4COX,
где R4 - прямой или разветвленный, насыщенный или ненасыщенный C3 - C19 - алкил;
X - галоген или фрагмент -OOCR4,
и затем при необходимости полученную смесь эпимеров разделяют на составляющие ее стереоизомеры.
Авторы
Даты
1998-06-10—Публикация
1992-01-29—Подача