Изобретение относится к новому процессу изготовления (22R, S)-16α, 17α-бутилидендиокси-11β, 21-дигидроксипрегна-1,4- диен-3,20- диона(будезонида) (I) путем реакции 11β, 16α, 17α, 21-тетрагидроксипрегна-1,4-диен- 3,20-диона (16α-гидроксипреднизолона)
(I) путем реакции 11β, 16α, 17α, 21-тетрагидроксипрегна-1,4-диен- 3,20-диона (16α-гидроксипреднизолона)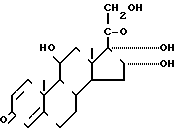 (II) с бутаналом СН3СН2СН2СНО в среде растворителя в присутствии кислотного катализатора.
(II) с бутаналом СН3СН2СН2СНО в среде растворителя в присутствии кислотного катализатора.
В соответствии с известным процессом, сущность которого раскрывается в [3] будезонид изготавливается путем реакции 16α-гидроксипреднизолона с бутаналом в диоксане в присутствии хлорной кислоты в качестве катализатора. Продукт реакции выделяют путем разбавления прореагировавшей смеси в хлориде метилена, нейтрализации посредством промывки в водном карбонате калия и воде и испарении растворителя с последующим процессом кристаллизации из эфира-лигроина. Затем продукт очищали посредством хроматографии, например, на установке "Сефадекс". Главные недостатки диоксана заключаются в его способности проникать сквозь защитные покрытия на кожу, образовывать перекиси. Другим недостатком известного процесса является применение хлорной кислоты, являющейся сильным окислителем, в результате чего ее применение в качестве катализатора сказывается в ухудшении качества выделения продукта реакции, а это затрудняет и удорожает последующий процесс очистки и обработки продукта.
Цель изобретения состоит в том, чтобы создать новый процесс, дающий более качественную реакцию выделения продукта и обеспечивающий более простую и более экономичную обработку и очистку продукта.
Цель достигается тем, что процесс по изобретению осуществляется в ацетонитриле, а в качестве катализатора применяется р-толуолсульфокислота.
Сочетание менее основного (по сравнению с диоксаном) растворителя ацетонитрила и обеднителя, например n-толуолсульфокислоты, дает более качественную реакцию выделения, упрощает и удешевляет процесс обработки и очистки продукта реакции по сравнению с известным процессом, в котором применяются диоксан и хлорная кислота.
Согласно предпочтительному примеру осуществления данного изобретения реакцию останавливают путем добавления воды и корректировки должным образом рН реагирующей смеси. Это можно сделать и путем добавления в воду водного карбоната гидрогенизованного натрия. После этого продукт кристаллизуется. Кристаллы отфильтровывают, растворяют в хлориде метилена и метаноле, а затем кристаллизуют путем добавления подходящего углеводорода типа лигроина, гексана, циклогексана или гептана, получая неочищенный продукт, который затем рекристаллизуется в метаноле воде с целью получения чистого будезонида.
Процесс изготовления будезонида по изобретению состоит, таким образом, из двух стадий.
Стадия 1. Изготовление неочищенного будезонида.
16α-гидроксипреднизолон реагирует с бутаналом в ацетонитриле. В качестве катализатора добавляют n-толуолсульфоновую кислоту. Реакционную смесь разбавляют водой и водным карбонатом гидрогенизованного натрия. После охлаждения до 5-15оС кристаллизовавшийся продукт отфильтровывают и промывают водой. Затем влажную или сухую среду фильтрата растворяют в хлориде метилена. Если вещество используется во влажном виде, то образовавшуюся при растворении водную фазу удаляют. Добавляют метанол и осаждают результирующий неочищенный будезонид путем добавки лигроина или другого подходящего углеводорода (например, гексана, гептана или циклогексана), после чего неочищенный будезонид отфильтровывают.
Стадия 2. Изготовление чистого будезонида.
Неочищенный будезонид растворяют в метаноле при температуре около 60оС. Раствор фильтруют сквозь плотный фильтр и кристаллизуют продукт путем добавки воды. После охлаждения до температуры 5-20оС, фильтрации и промывки в метаноле воде, будезонид сушат в вакууме при температуре 40-45оС. Этот процесс проще, гораздо экономичнее и менее опасен для здоровья, чем известный процесс.
Рабочий пример. Реакцию выполняют в атмосфере азота. 15,4 г n-толуолсульфоновой кислоты растворяют в 200 мл ацетонитрила. В раствор добавляют 50,0 г 16α-гидроксипреднизолона и 17,6 мл бутанала. Температура увеличивается до 25оС. Через 30 мин растворяется большинство материала. Вскоре после этого продукт начинает кристаллизоваться. Через 3 ч реакцию останавливают путем добавления 75 мл насыщенного водного раствора карбоната гидрогенизованного натрия, в результате чего кристаллизуется продукт. Высушенный продукт растворяют в хлориде метилена и метаноле и кристаллизуют путем добавления лигроина (барометрическое давление 40-65), получая неочищенный будезонид.
Неочищенный будезонид рекристаллизуют из метанола воды, получая чистый будезонид с соотношением изомеров A B≈1 1 (определено методом жидкостной хроматографии высокого давления), [α] 25 100,0о (с 0,2; СН2Cl2); M+ 430 (теоретическое значение 430,5).
| название | год | авторы | номер документа |
|---|---|---|---|
| 22R- ИЛИ 22S-ЭПИМЕРЫ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1992 |
|
RU2111212C1 |
| СТЕРОИДНЫЕ ЭФИРЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2112775C1 |
| СЛОЖНЫЕ ЭФИРЫ 16 АЛЬФА 17 АЛЬФА - АЦЕТАЛЬЗАМЕЩЕННОЙ АНДРОСТАН-17 БЕТА - КАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ | 1991 |
|
RU2081879C1 |
| ПЕРОРАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНОГО ТРАКТА | 1990 |
|
RU2134104C1 |
| 11,21-ДИАЦЕТАТ (22RS)-16α,17α -БУТИЛИДЕНДИОКСИ- 11β,21 -ДИГИДРОКСИПРЕГНА-1,4-ДИЕН-3,20-ДИОН В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО ПРОДУКТА В СИНТЕЗЕ БУДЕСОНИДА | 1989 |
|
SU1660379A1 |
| Способ получения 16, 17-ацетальзамещенных прегнан-21- овой кислоты в виде их стереоизомеров | 1986 |
|
SU1839673A3 |
| Способ получения стероидных полупродуктов или их 22R/S стереоизомеров | 1986 |
|
SU1779257A3 |
| Способ получения производных 4-прегнена или смеси их стереоизомеров или 22-эпимеров | 1981 |
|
SU1156600A3 |
| ПРОИЗВОДНЫЕ ПРЕДНИЗОЛОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1994 |
|
RU2132854C1 |
| ДИДЕЗОКСИДИДЕГИДРОКАРБОЦИКЛИЧЕСКИЕ НУКЛЕОЗИДЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1989 |
|
RU2114846C1 |
Использование: в медицине, в частности в синтезе известного противовоспалительного и антиаллергического препарата. Сущность изобретения: продукт (22R, S)- 16α, 17α -бутилидендиокси- 11β, 21 -дигидрооксипрегна-1,4-диен-3.2 0-дион, угол вращения при 25°С (+)100 (с 0,2, дихлорметан). мол.м. 430. Реагент 1: 11β, 16α, 17α 21-тетрагидропрегна-1,4-диен-3,20-дион. Реагент 2: бутаналь. Условия процесса: в среде ацетонитрила в присутствии п-толуолсульфокислоты. Реакцию прекращают добавлением воды и водного гидрокарбоната натрия. Перекристаллизацию ведут из хлористого метилена и метанола добавлением лигроина, гексана, циклогексана или гептана, а рекристаллизацию в метаноле и воде. 2 з. п. ф-лы.
Способ получения (22R,S) - 16α, 17α бутилидендиокси- 11β, 21-дигидроксипрегна-1,4-диен-3,20-диона формулы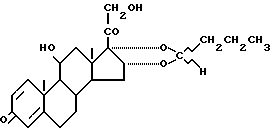
взаимодействием 11β, 16α, 17α, 21 -тетрагидроксипрегна-1,4-диен-3,20-диона формулы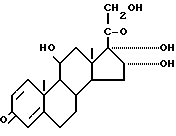
с бутаналом CH3CH2CH2CHO в среде растворителя в присутствии катализатора, отличающийся тем, что реакцию ведут в ацетонитриле с использованием в качестве катализатора п-толуолсульфокислоты.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ борьбы с вредными насекомыми | 1984 |
|
SU1429922A3 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
1995-11-20—Публикация
1990-09-27—Подача