Изобретение относится к извлечению веществ органическими экстрагентами из водных растворов и может быть использовано в цветной и черной металлургии, а также для очистки промышленных и бытовых стоков.
Известны способы экстракции ионов из растворов, включающие подготовку исходного раствора и экстрагента, контакт раствора и экстрагента. Подготовка исходного раствора включает создание определенных кислотно-основных характеристик раствора [1].
Недостатками способов является то, что в ряде случаев в процессе экстракции кислотно-основные характеристики раствора изменяются, что сказывается на кинетике процесса и степени извлечения экстрагируемого вещества, т.к. в процессе экстракции не корректируют эти характеристики до оптимальных значений.
Наиболее близким к заявленному техническим решением является способ экстракции меди кислыми органическими растворителями по реакции типа
Cu
В этом способе в зависимости от состава применяемых экстрагентов создают определенные кислотно-основные характеристики исходного раствора.
Недостатком способа является то, что в процессе экстракции не регулируют кислотно-основные характеристики исходного раствора до оптимальных значений, что снижает степень извлечения экстрагируемого вещества, ухудшает кинетические параметры процесса, увеличивает расход экстрагента.
Задачей изобретения является интенсификация процесса экстракции за счет регулирования кислотно-основных характеристик в процессе экстракции.
Технический результат, который может быть получен при осуществлении изобретения, заключается в улучшении кинетических характеристик процесса и степени извлечения экстрагируемого вещества, а также в уменьшении расхода экстрагента и числа операций экстракции.
Данный технический результат достигается тем, что в известном способе экстракции ионов из растворов, включающем обработку раствора и экстрагента, контакт растворов и экстрагента, в процессе экстракции отклонение величины pH экстракции от оптимального значения в зависимости от времени экстракции поддерживают согласно следующей зависимости:
ΔpH = ΔpHoexp(-ktm). (1) ,
где
ΔpH - отклонение величины pH от оптимального значения;
t - время экстракции;
ΔpΗo - максимальное отклонение величины pH от оптимального значения в начальный момент времени;
k и m - константы, определяемые по экспериментальным данным.
Величина pH среды для ряда систем является интегрирующим показателем сложного физико-химического процесса экстракции, регулированием которого до оптимального значения улучшали физико-химические характеристики процесса.
Непрерывную нейтрализацию раствора до оптимальных значений pH осуществляли небольшими порциями нейтрализатора, т.к. при добавлении значительного количества последнего можно перейти в область pH, в которой экстракция осуществляется медленно.
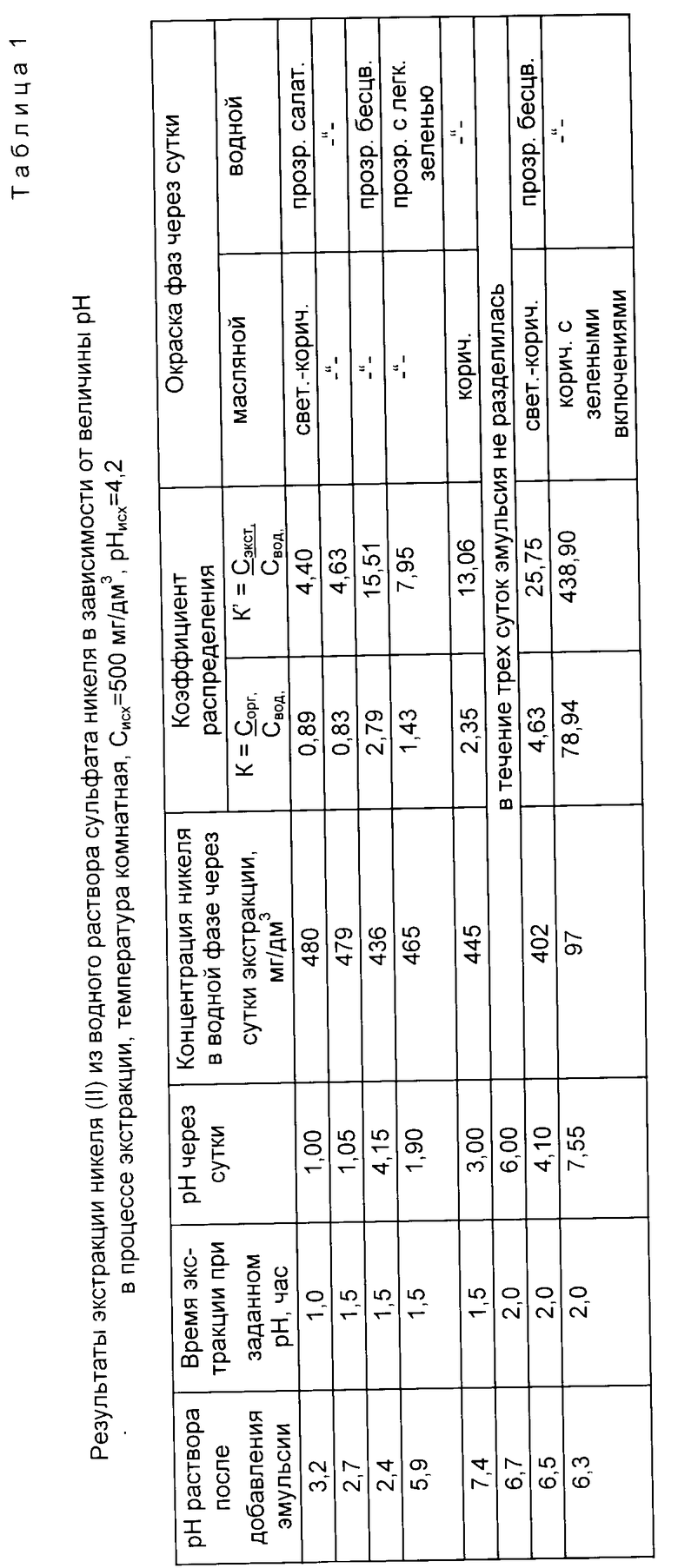
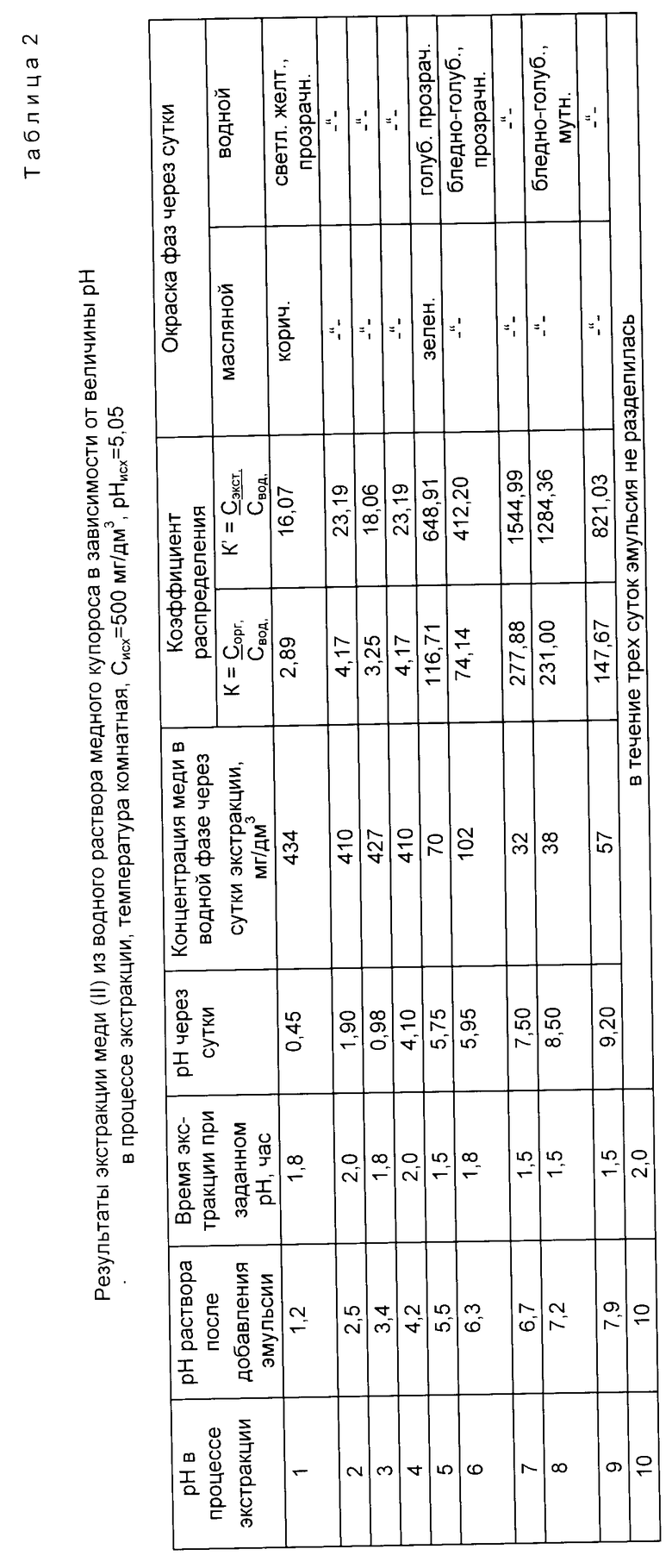
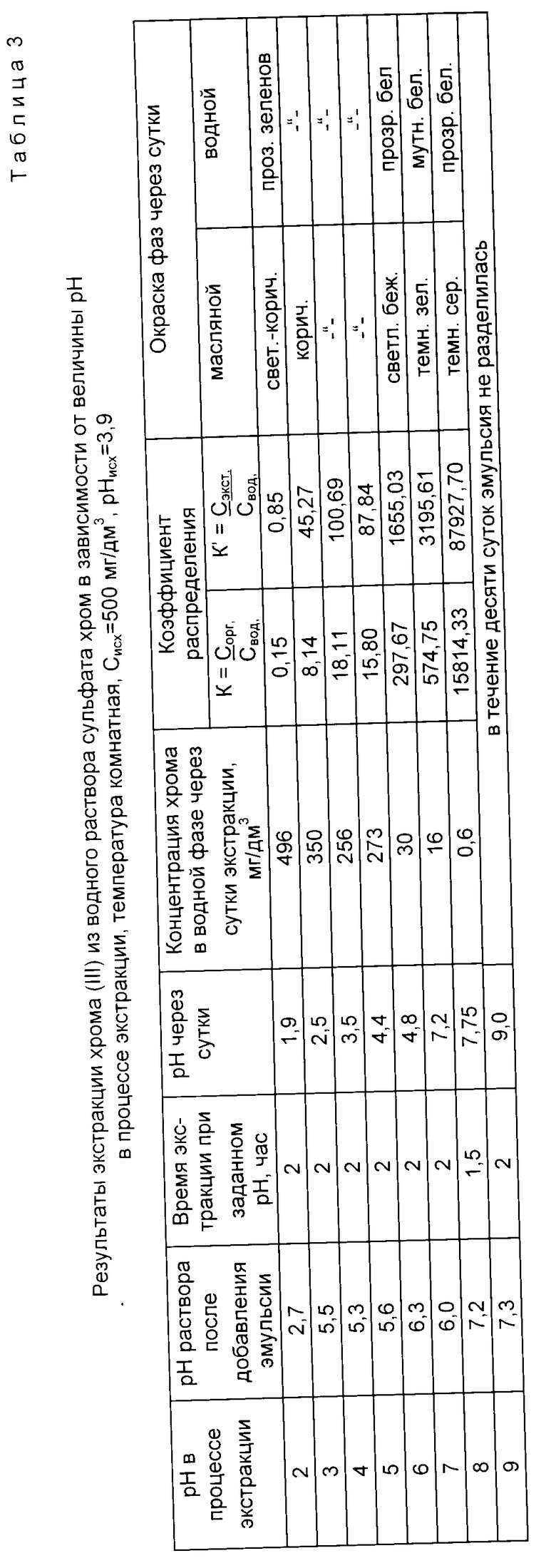
Сущность способа поясняется данными табл. 1 - 3 и фиг. 1 - 6, где даны показатели экстракции никеля, меди и хрома из водных растворов с концентрацией 500 мг/дм3 по металлу при нейтрализации раствора до заданной величины pH экстракции и поддержании ее постоянной во времени экстракции в соответствии с уравнением (1), которое для процессов, представленных данными табл. 1 - 3 и графиков фиг. 1 - 6, имело вид
ΔpH = ΔpHoexp(-0,01t3,5), (2)
где
t - время, мин.
В качестве экстрагента использовали техническую смазку, СП-3 состава, мас.%:
Олеиновая кислота - 10 - 12
Триэтаноламин - 4,5 - 6,0
Машинное масло (инертный разбавитель) - Остальное
Примеры конкретного выполнения способа.
Экстракцию осуществляли из 200 дм3 исходного раствора сульфата никеля, или меди, или хлора с концентрацией 500 мг/дм3 по металлу (Me = Ni(II), Cu (II), Cr (III).
Исходный раствор готовили растворением в воде солей NiSO4•7H2O, CuSO4•5H2O и Cr2(SO4)3•6H2O марки х.ч., концентрацию металла определяли объемным, весовым и фотокалориметрическим методами соответственно, кислотно-основные характеристики раствора контролировали pH-метром.
Показатели экстракции представлены в виде C, в мг/дм3 в расчете на металл, - концентрации металла (Me = Ni, Cu, Cr), K = Cорг/Cвод и K' = Cэкстр/Cводн - коэффициенты распределения металла между органической (смазка СП-3) или экстрагентом (олеиновая кислота и триэтаноламин) и водной фазами pH - постоянной величины pH раствора в процессе экстракции.
Экстрагент добавляли к исходному водному раствору сульфата объемом 190 дм3 в количестве 10 дм3 (5 мас.%).
Время перемешивания и поддержания заданного значения pH составляло 1 - 2 ч, по истечении этого времени в дальнейшем кислотно-основные характеристики системы изменялись незначительно. По достижении равновесия между органической и водной фазами через сутки отстаивания органическую фазу отделяли от осветленной водной фазы, в последней определяли pH и остаточную концентрацию металла.
Используя значения концентраций металла в водном растворе исходном и после экстракции, рассчитывали коэффициенты распределения.
Пример 1 (табл. 1, фиг. 1 и 2).
Экстракцию никеля (II) из водного раствора осуществляли в соответствии с уравнением (2), в котором 1,25 ≤ ΔpHo≤ 4,4. В интервале 1 ≤pH≤7 постоянную величину pH в процессе экстракции поддерживали нейтрализацией раствора щелочью NaOH, при pH 8 постоянную величину pH экстракции поддерживали нейтрализацией раствора кислотой H2SO4.
Лучшие показатели экстракции получены при pH 8 за время 2 ч; K = 83,09; K' = 471,10.
Пример 2 (табл. 2, фиг. 3 и 4).
Экстракцию меди (II) из водного раствора осуществляли в соотношении с уравнением (2), в котором 0,2 ≤ ΔpHo≤ 1,3 при оптимальном значении pH экстракции, находящемся в пределах значений 4≤pH≤10.
Постоянную величину pH в процессе экстракции поддерживали нейтрализацией раствора кислотой H2SO4.
Из данных табл. 2 и графиков фиг. 3 и 4 следует, что экстракция меди (II) предлагаемым способом завершалась за время не более 2 ч, максимальные коэффициенты распределения K = 231,00 - 277,88 и K' = 1309,77 - 1575,58 получены при pH 7,2 - 8,5.
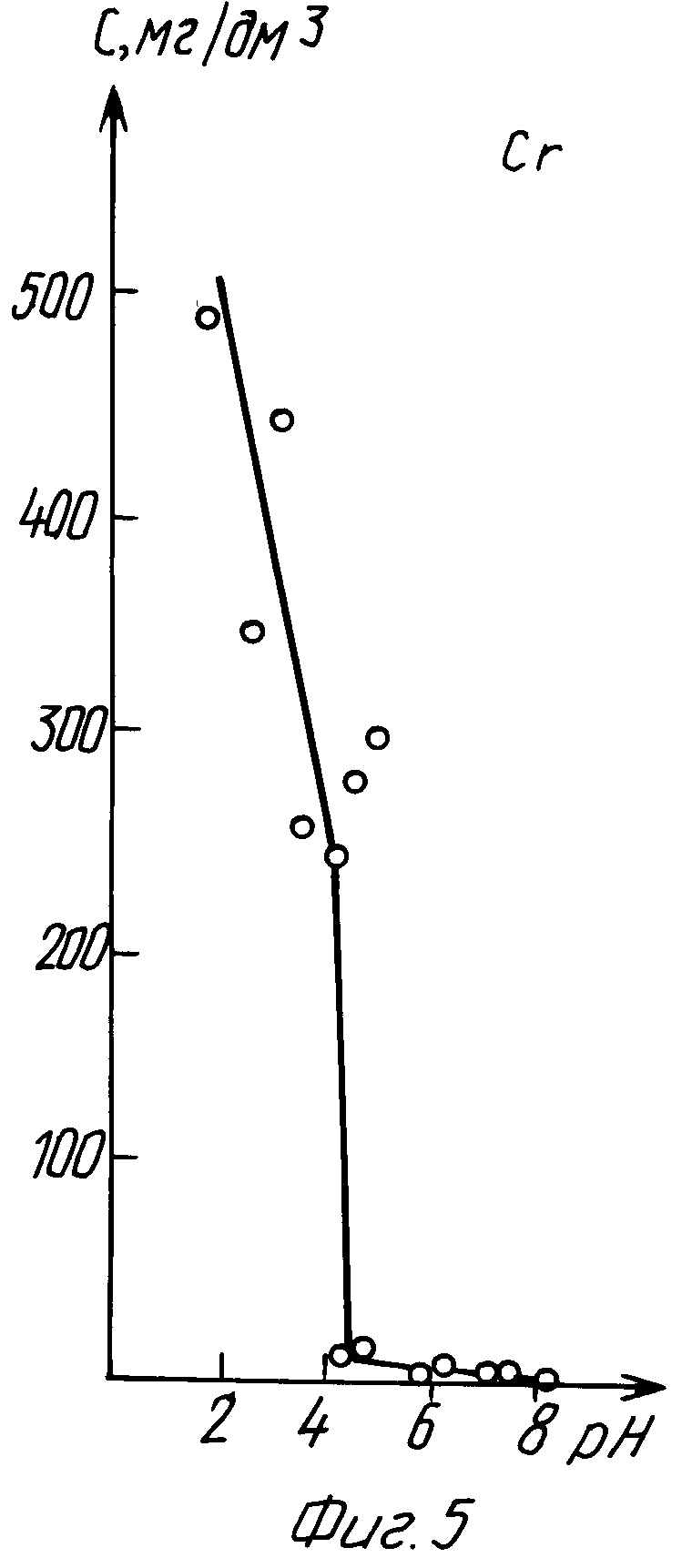
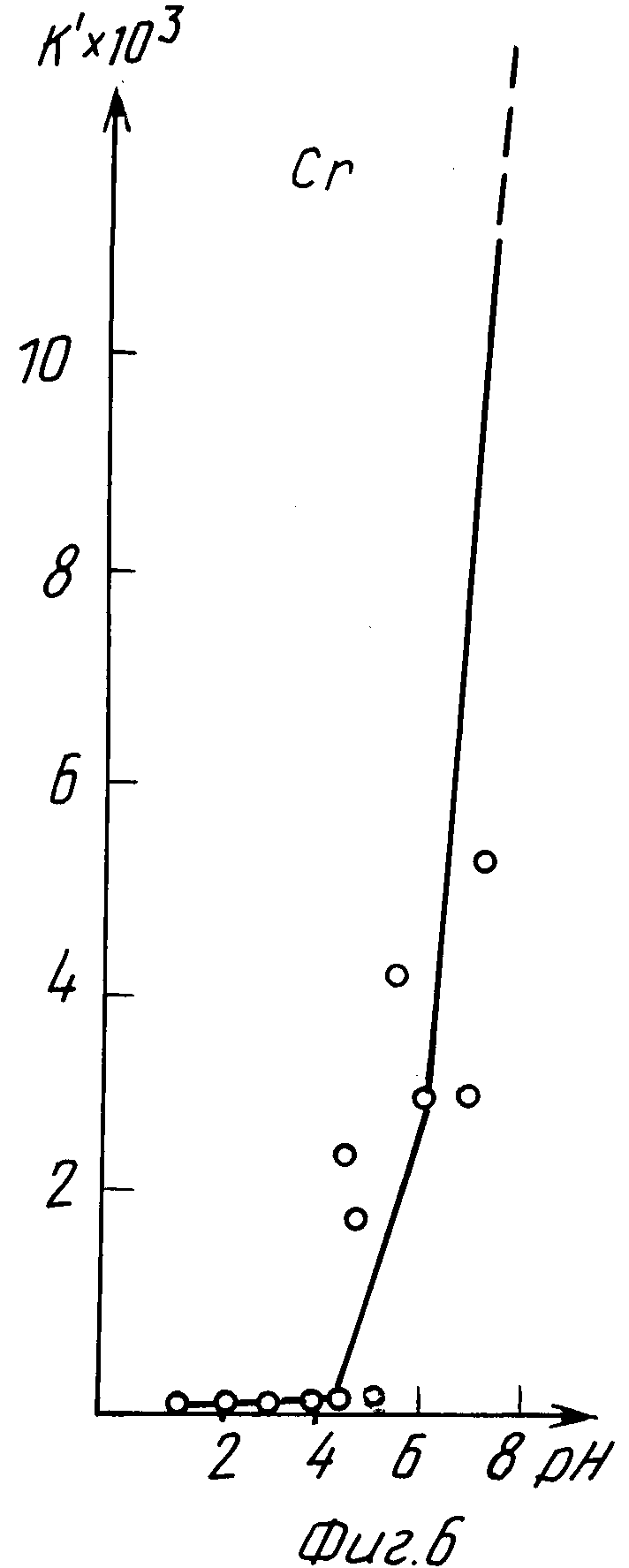
Пример 3 (табл. 3, фиг. 5 и 6).
Экстракцию хрома (III) из водного раствора осуществляли в соответствии с уравнением 2, в котором 0,3 ≤ ΔpHo≤ 1,5 при оптимальном значении pH экстракции, находящемся в пределах значений 4<pH<8.
В интервале 4≤pH≤6 постоянную величину pH в процессе экстракции поддерживали нейтрализацией раствора щелочью NaOH, в интервале 7≤pH≤8 постоянную величину pH в процессе экстракции поддерживали нейтрализацией раствора кислотой H2SO4.
Из данных табл. 3 и графиков фиг. 5 и 6 следует, что экстракция хрома (III) предлагаемым способом завершалась за время не более 2 ч, максимальные коэффициенты распределения K = 16000 и K' = 90000 получены при pH 7,75.
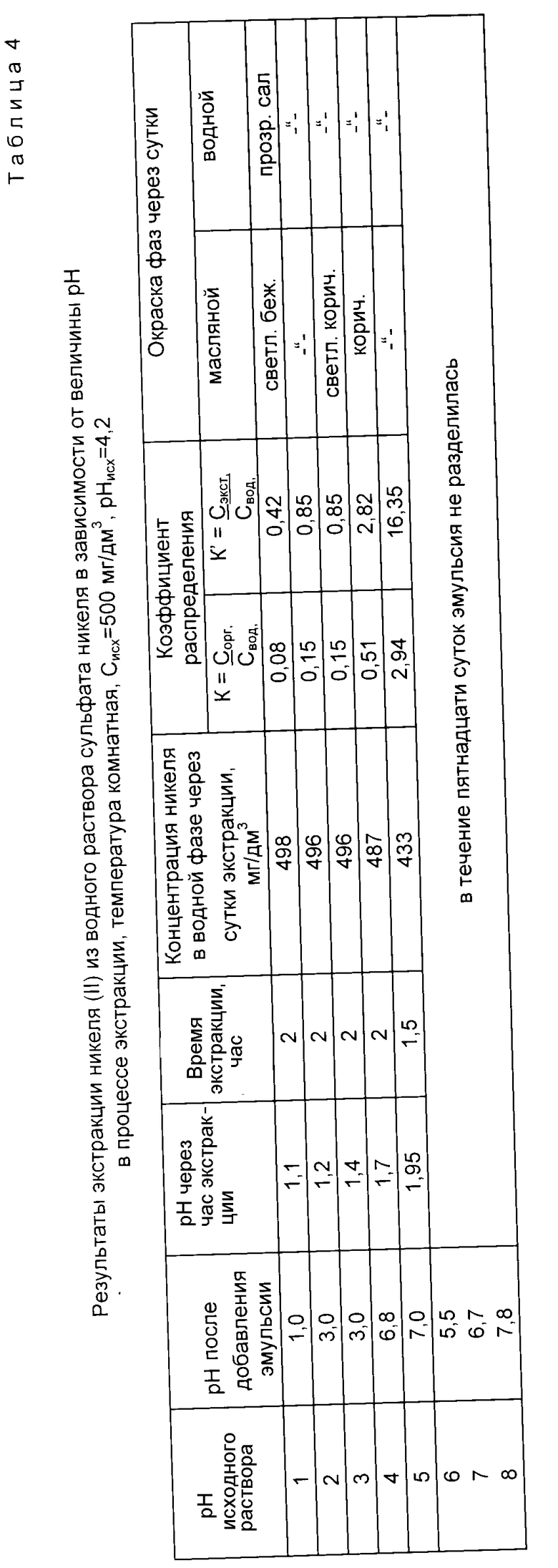
Для сравнения результатов экстракции по предлагаемому способу и прототипу в табл. 4 - 6 даны результаты экстракции никеля (II), меди (II) и хрома (III) в зависимости от величины pH исходного раствора без последующего регулирования величины pH в процессе экстракции (прототип).
Экспериментальные данные, представленные в табл. 4 - 6, получены при следующих условиях. К исходному раствору объемом 190 дм3 с определенной величиной pH добавляли экстрагент в количестве 10 дм3. Если при добавлении экстрагента величина pH изменялась, ее корректировали до значения pH исходного раствора, в дальнейшем в процессе экстракции величина pH не регулировалась.
В табл. 4 даны результаты экстракции никеля (II) в зависимости от величины pH исходного раствора без последующего регулирования pH в процессе экстракции (прототип).
Из данных табл. 4 следует, что в результате экстракции pH исходного раствора изменяется в сторону подкисления.
Лучшие показатели экстракции K = 3,09 и K' = 16,35 получены при pHисх = 5, через сутки pH уменьшилось до значения 1,95.
Из сравнения данных табл. 1 и 4 следует, что предлагаемый способ расширяет интервал pH экстракции и степень извлечения никеля (II), коэффициент распределения никеля по сравнению с таковым по прототипу возрастает на порядок.
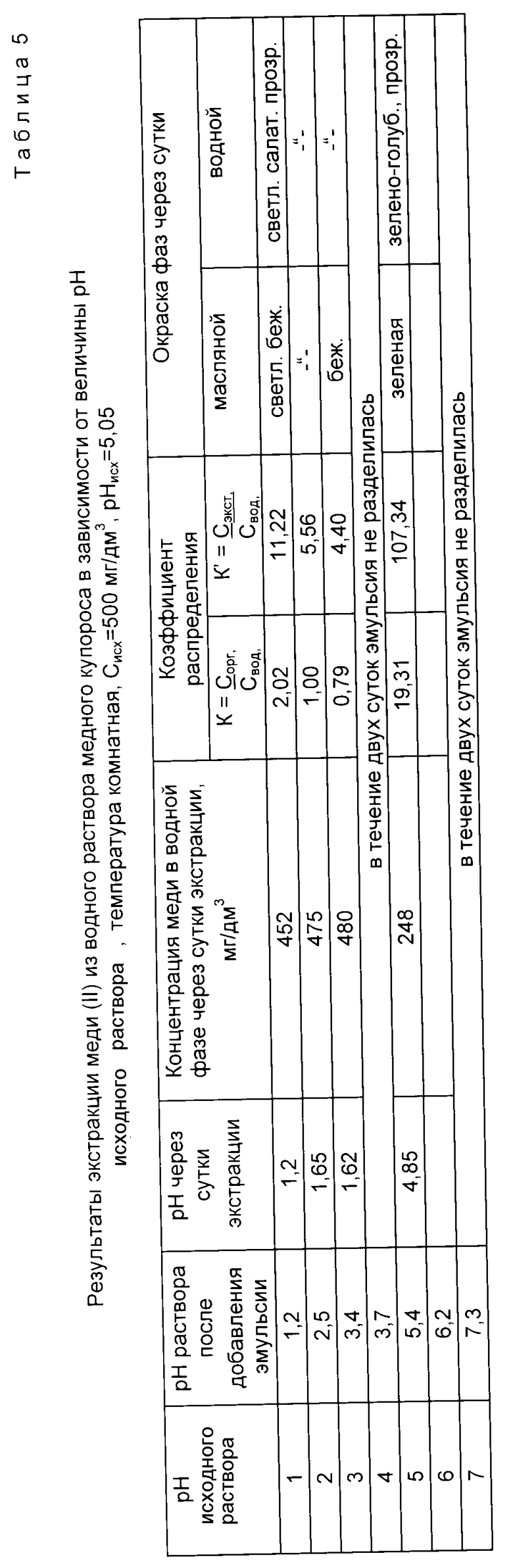
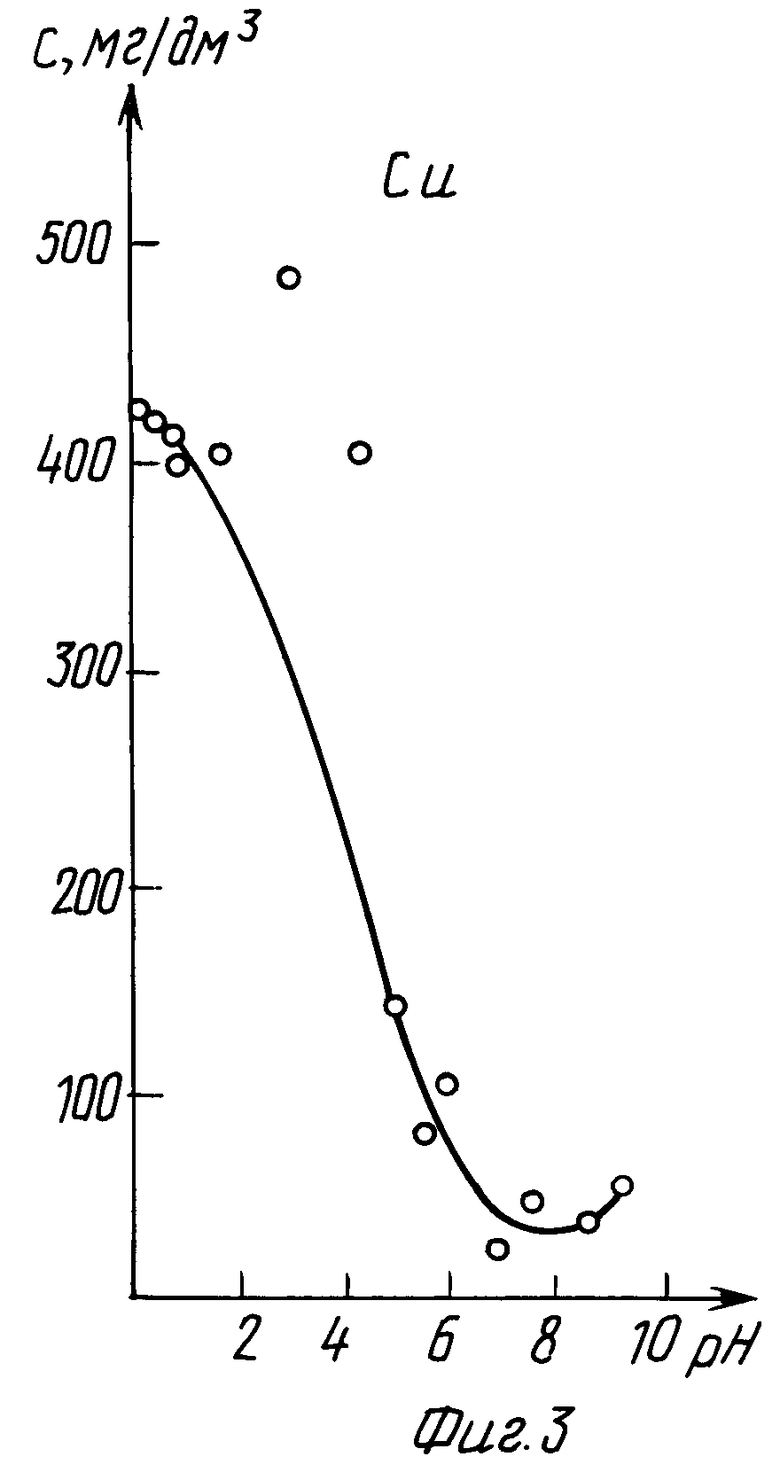
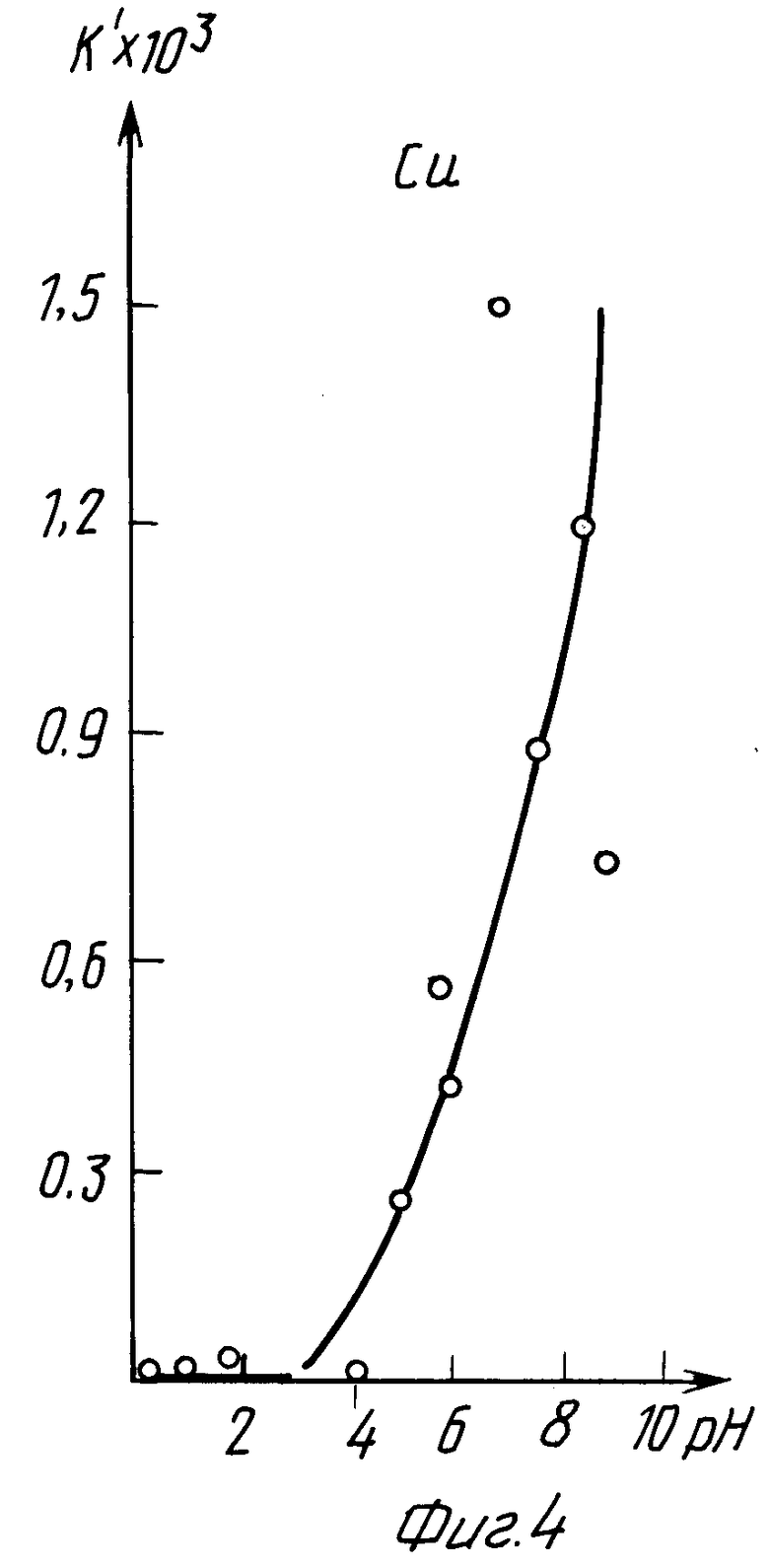
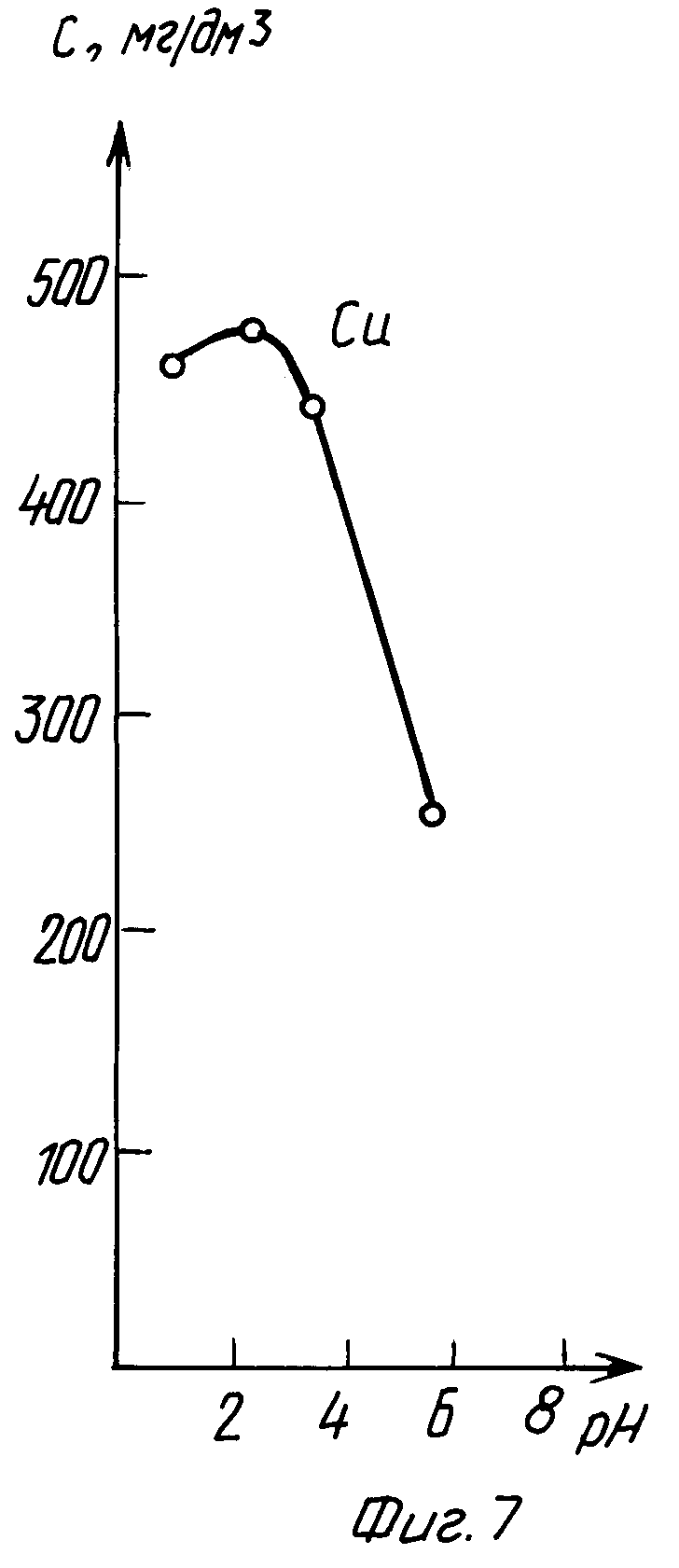
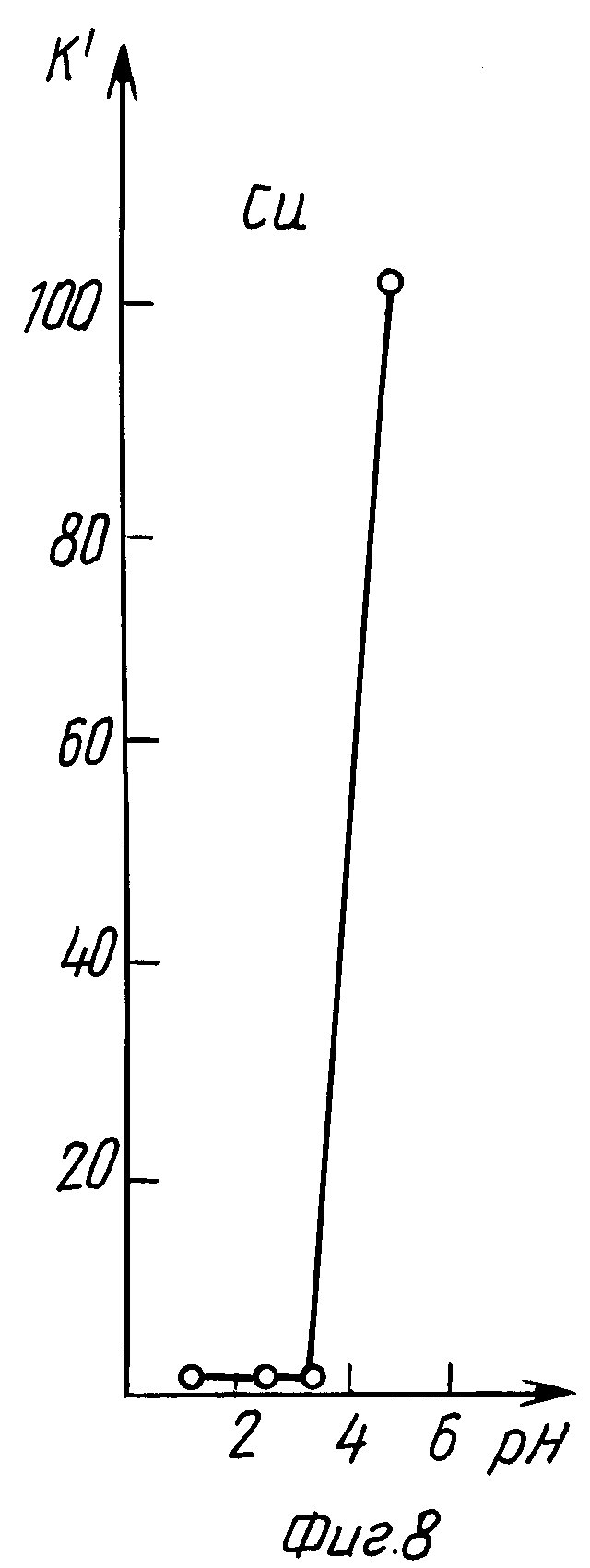
В табл. 5 и на графиках фиг. 7 и 8 даны результаты экстракции меди (II) в зависимости от pH исходного раствора без последующего регулирования pH в процессе экстракции (прототип).
Из данных табл. 5 и графиков фиг. 7 и 8 следует, что в результате экстракции pH исходного раствора изменяется в сторону подкисления.
Лучшие показатели экстракции K = 19,31 и K' = 107,34 получены при pHисх = 5, через сутки pH уменьшилось до значения 4,85.
Из сравнения данных табл. 2 и 5, а также графиков фиг. 3, 4 и 7, 8 следует, что предлагаемый способ расширяет интервал pH экстракции и степень извлечения меди (II), коэффициент распределения меди по сравнению с таковым по прототипу возрастает на два порядка.
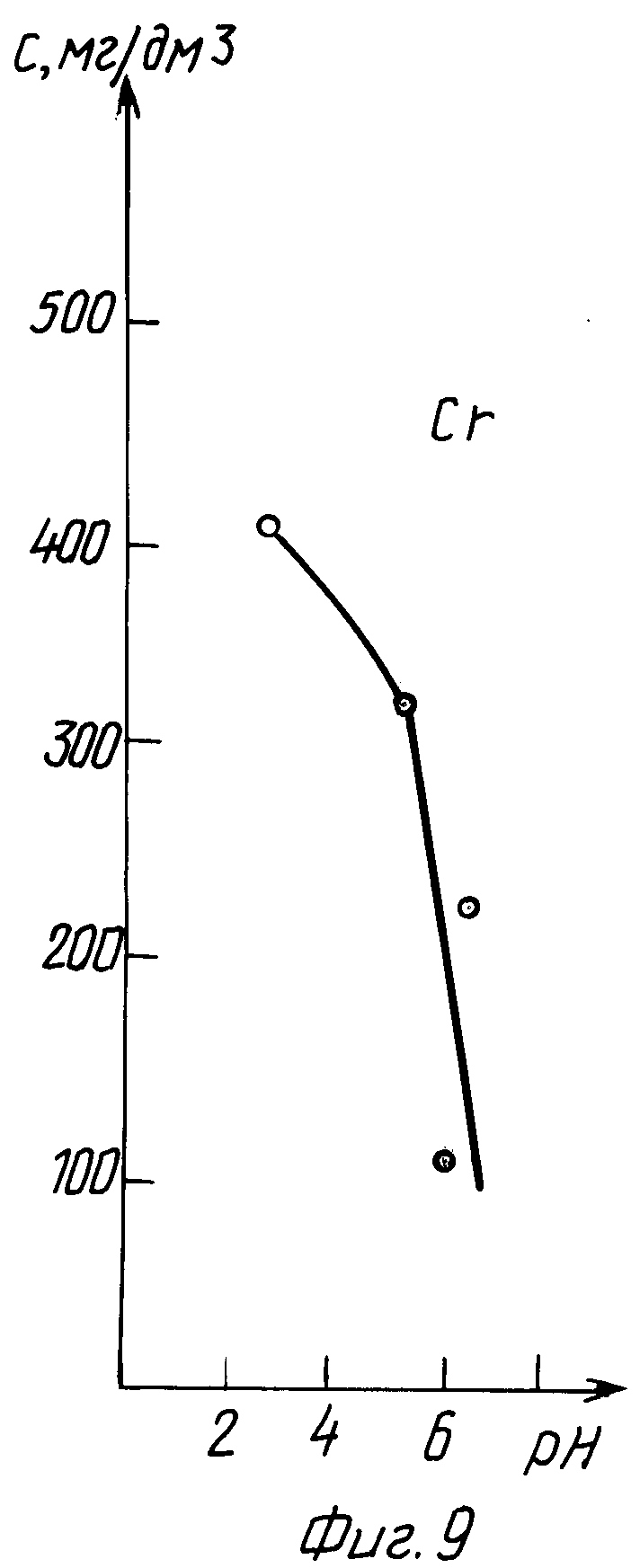
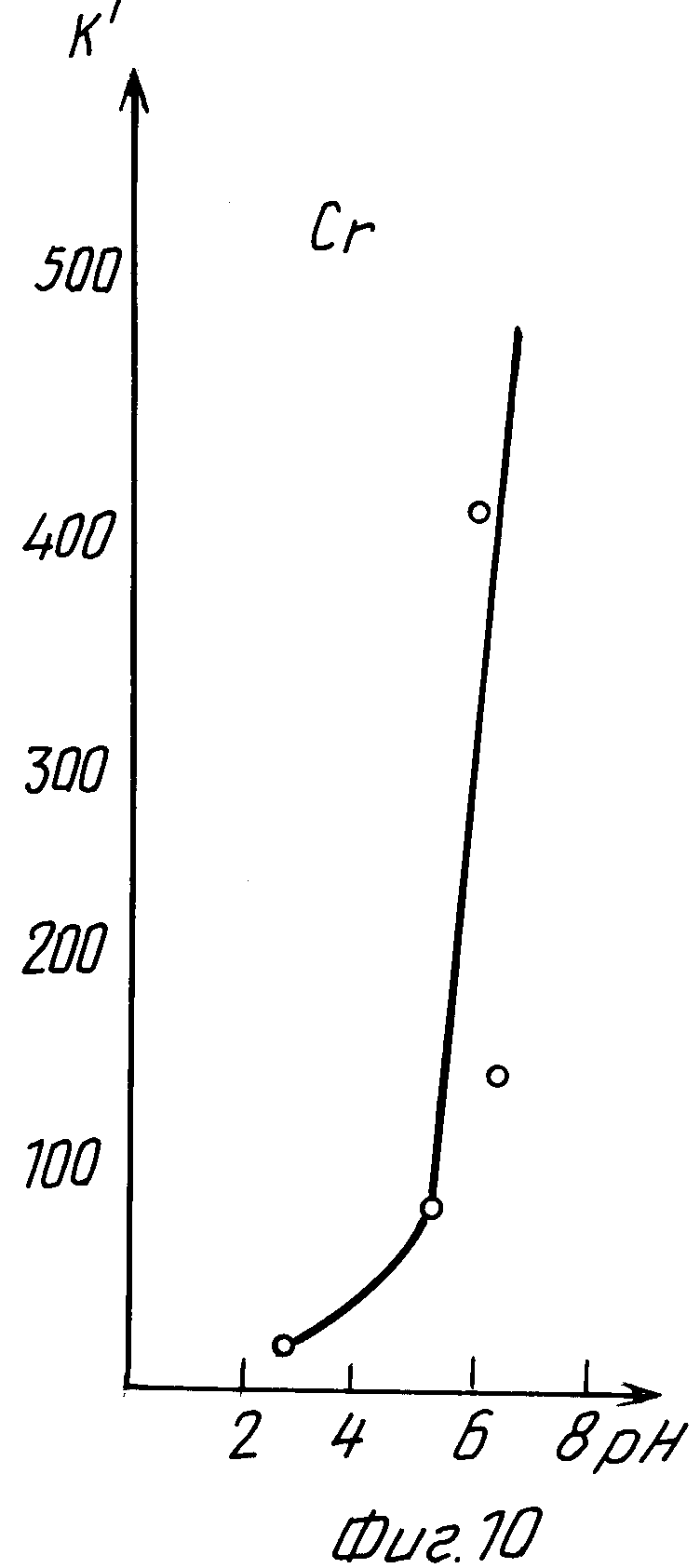
В табл. 6 и на графиках фиг. 9 и 10 даны результаты экстракции хрома (III) в зависимости от величины pH раствора без последующего регулирования pH в процессе экстракции (прототип).
Из данных табл. 6 и графиков фиг. 9, 10 следует, что в результате экстракции pH исходного раствора изменяется в сторону подкисления.
Лучшие показатели экстракции K = 70,62 и K' = 392,66 получены при pH 7, через сутки pH уменьшилось до значения 4,8.
Из сравнения данных табл. 3 и 6, а также графиков фиг. 5, 6 и 9, 10 следует, что предлагаемый способ расширяет интервал pH экстракции и степень извлечения хрома (III), коэффициент распределения хрома по сравнению с таковым по прототипу возрастает на три порядка.
Предлагаемый способ по сравнению с прототипом интенсифицирует процесс экстракции, улучшает процесс отстоя и разделения фаз, позволяет осуществлять селективное извлечение элементов.
Селективное извлечение элементов можно осуществлять как при заданной величине pH, так и путем постепенного изменения величины pH в сторону увеличения или уменьшения и поддержания измененной величины pH раствора на каждой периодической операции экстракции. Тт

Изобретение относится к извлечению веществ органическими экстрагентами из водных растворов и может быть использовано в цветной и черной металлургии, а также для очистки промышленных и бытовых стоков. Способ заключается в том, что в процессе экстракции отклонение величины рН экстракции от оптимального значения в зависимости от времени экстракции поддерживают согласно зависимости (1), указанной в описании изобретения. За счет регулирования кислотно-основных характеристик в процессе экстракции осуществляется интенсификация процесса. 10 ил., 6 табл.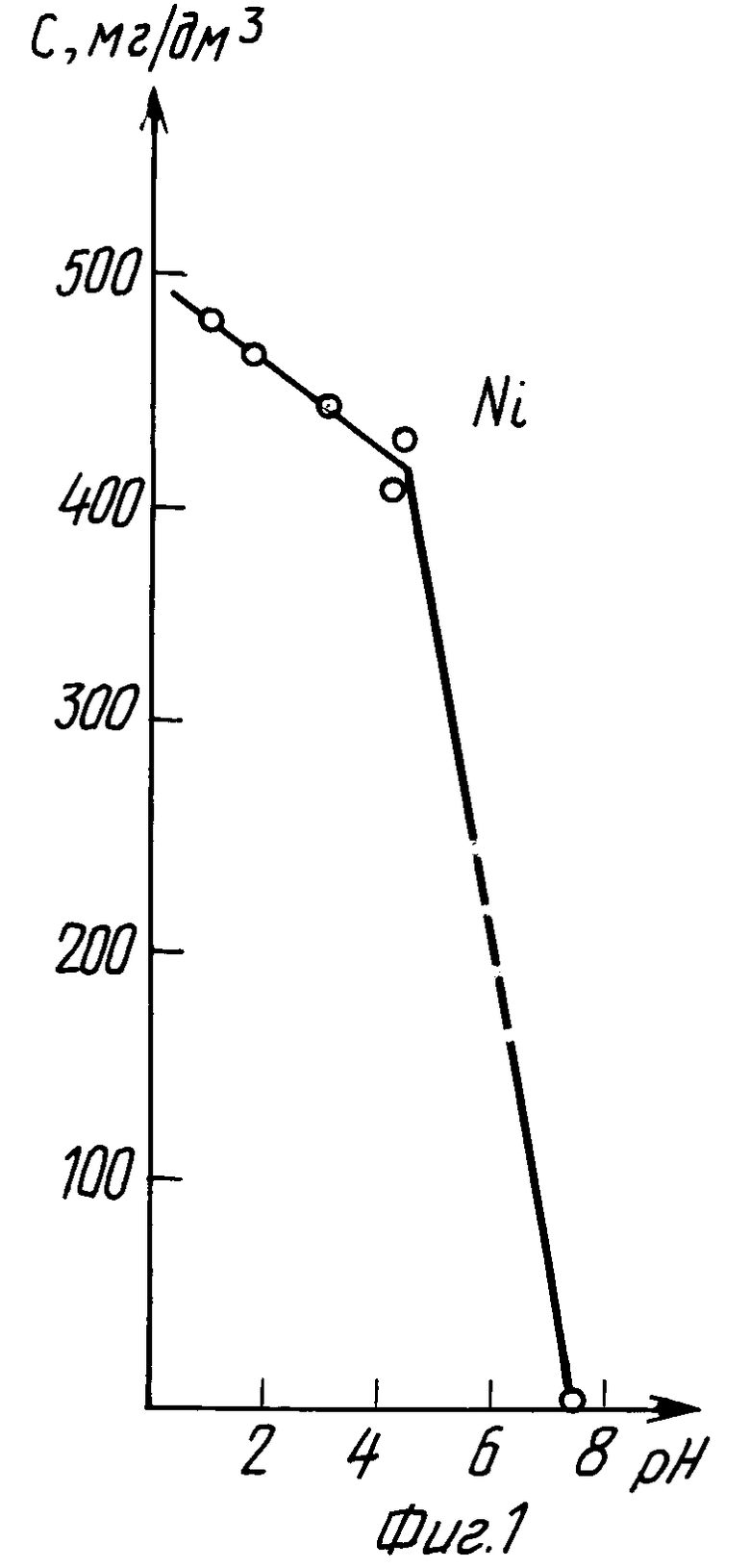
Способ экстракции ионов из растворов, включающий обработку экстрагента и раствора, контакт экстрагента и раствора, отличающийся тем, что в процессе экстракции отклонение величины pH экстракции от оптимального значения в зависимости от времени экстракции поддерживают согласно следующей зависимости:
ΔpH = ΔpHoexp(-ktm),
где ΔpH - отклонение величины pH от оптимального значения;
ΔpΗo - максимальное отклонение величины pH от оптимального значения в начальный момент времени;
t - время экстракции;
k, m - константы, определяемые по экспериментальным данным.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Вольдман Г.М., Зеликман А.Н | |||
| Теория гидрометаллургических процессов | |||
| - М.: Металлургия, 1993 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Бубнов В.К | |||
| и др | |||
| Теория и практика добычи поле зных ископаемых для комбинированных способов выщелачивания | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
Авторы
Даты
1998-06-27—Публикация
1997-04-02—Подача