Изобретение относится к новым 1,2,4-замещенным пиперидинам формулы I:
где
R1 означает незамещенный или замещенный галогеном и/или трифторметилом фенил- или дифенил-C1-C4-алкил, 9-флуоренил, пиридил-C1-C4-алкил, хинолил-C1-C4-алкил, 5-хлор-2-(1H-1,2,4-триазолил-1-ил)-фенокси-C1-C4-алкил, незамещенный или замещенный C1-C4-алкилом, C1-C4-алкоксилом, гидроксилом, галогеном, трифторметилом, ди-C1-C4-алкил амино-группой и/или циано-группой бензоил, нафтоил, 9-флуореноил, фенил- или дифенил-C2-C4-алканоил, нафтил-C2-C4-алканоил, диметилциклогексаноил, хинолилкарбонил, пиридил-C2-C4-алканоил, бензилоксикарбонил, незамещенный или замещенный ацетилом или 4-карбоксамидобутироилом фенилаланинил или фенилкарбамоил, 2,3,4,9-тетрагидро-1H-пиридо[3,4-b] индол-3-ил-карбонил;
R2 означает незамещенный или замещенный галогеном фенил или нафтил;
R3 означает водород, C1-C4-алкил, циклогексил- или фенилкарбамоил, или 3-аминокарбонилпропионил; и
R4 означает в случае необходимости замещенный C1-C4-алкилом или C1-C4-алкоксилом фенил, нафтил, бензил, пиридил, в случае необходимости C-замещенный C1-C4-алкоксилом или N-замещенный C2-C4-алканоилом индолил, хинолил, бензофуранил, в случае необходимости замещенный C1-C4-алкилом бензтиофенил, дигидробензопиранил или анилино-группу;
X1 означает простую связь, метилен, гидроксиметилен или карбонил;
X2 означает простую связь; и
X3 означает простую связь, метилен, этилен, бензилиден или карбонил; и их солям, а также к способу получения этих соединений, содержащим их фармацевтическим композициям, обладающим антагонистическим действием по отношению к веществу Р.
Соединения формулы I имеют основной характер и могут соответственно образовывать кислые аддитивные соли и внутренние соли.
Кислыми аддитивными солями соединений формулы 1 являются, например, их фармацевтически приемлемые соли с подходящими минеральными кислотами, например, галоидводородными кислотами, серной или фосфорной кислотами, в частности, гидрохлориды, гидробромиды, сульфаты, гидросульфаты или фосфаты, или соли с подходящими алифатическими или ароматическими сульфоновыми кислотами или N-замещенными сульфаминовыми кислотами, например, метансульфонаты, бензолсульфонаты, п-толуолсульфонаты или N-циклогексилсульфаминаты (цикламаты).
Для выделения или очистки могут использовать и неприемлемые с фармацевтической точки зрения соли. Для фармацевтического использования могут применяться только фармацевтически приемлемые, нетоксичные соли, которые поэтому являются предпочтительными.
Предлагаемые в соответствии с настоящим изобретением соединения обладают ценными фармакологическими свойствами. В частности, они оказывают явно выраженное антагонистическое действие по отношению к веществу P и имеют типичный для антагонистов по отношению к этому веществу спектр свойств. Так, например, соединения формулы I и их фармацевтически приемлемые соли; начиная с концентрации примерно 10 мкМ/л, полностью тормозят in vitro связывание 3H-вещества-Р с бычьей сетчаткой в радиорецепторном анализе по H.Bittiger: Ciba Foundation Symposium 91, 196-199 (1982). В опытах in vivo при внутривенном введении, при дозах, начиная примерно с 0,01 мг/кг, они тормозят вызываемое веществом P расширение сосудов в ухе морской свинки (при проведении измерений по методике Andrews и Heime, Regul. Pept. 25, 267-275 (1989)), а при дозе примерно 1,0 мг/кг (при внутривенном введении) - индуцированные вагально спазмы бронхов морской свинки (при проведении измерений по методике Lundberg et al., Proc. Nat. Acad. Sci. (США) 80, 1120-1124), из чего следует, что их можно использовать для лечения астмы. Возможность их применения для лечения заболеваний центральной нервной системы вытекает из оказываемого ими тормозящего действия на индуцируемое метиловым эфиром вещество P, вводимое icv-способом, на изменение поведения песчанки (по методике A.Vassout et al., Meeting on Substance P, Worcester, Mass. (1990)), при ED50 выше примерно 10 мг/кг (при подкожном введении), выше примерно 30 мг/кг (при внутрибрюшинном введении) и выше примерно 100 мг/кг (при оральном введении).
Вещество P представляет собой природный ундекапептид семейства техикинина. Оно образуется в организме млекопитающих и является с фармакологической точки зрения нейропептидом. Вещество P играет существенную роль при различных заболеваниях, например, при болях, мигренях и некоторых нарушениях центральной нервной системы, в частности, при состоянии страха, шизофрении и депрессиях, а также при некоторых моторных нарушениях, таких как болезнь Паркинсона, и при воспалительных заболеваниях, таких как ревматический артрит, ирит и конъюктивит, при заболеваниях органов дыхания, таких как астма и хронический бронхит, при заболеваниях кишечно-желудочного тракта, таких как неспецифический язвенный колит и болезнь Крона, и при гипертензии.
Поэтому не было недостатка в попытках получить антагонисты вещества Р. Однако многие из известных в настоящее время антагонистов вещества P представляют собой пептидные соединения, которые в отношении метаболизма являются слишком неустойчивыми, чтобы их можно было использовать в качестве активных веществ лекарственных препаратов.
В отличие от этого предлагаемые в соответствии с настоящим изобретением антагонисты вещества P формулы 1 и их фармацевтически приемлемые соли являются метаболически стабильными и поэтому их с успехом можно использовать в качестве терапевтических препаратов для лечения вышеуказанных заболеваний.
Наиболее предпочтительными согласно изобретению являются названные в примерах соединения формулы 1 и их соли.
Настоящее изобретение относится далее к основанным на известных методах способам получения предлагаемых соединений формулы 1. Для получения 1,2,4-замещенных пиперидинов общей формулы 1а
в которой
R1, R2, R3, R4, X1 и X2 имеют значения, определенные выше, X3 - карбонил, или их солей, соединение формулы III
в которой
R1, R2, R3, X1 и X2 имеют вышеуказанные значения, подвергают взаимодействию с кислотой формулы IV
где
R4 имеет вышеуказанные значения, или ее реакционноспособным производным, и полученную при этом смесь изомеров при необходимости разделяют на компоненты и отделяют предпочтительный изомер и/или полученное свободное соединение переводят в соль или полученную соль переводят в свободное соединение.
Соединения формулы I, в которых R3 означает водород, могут быть получены путем удаления аминозащитной группы в соединении формулы IX
в которой
R1, R2, R4, X1, X2 и X3 имеют вышеуказанные значения,
Y - аминозащитная группа, или его соли.
Полученную при этом смесь изомеров при необходимости разделяют на компоненты и отделяют предпочтительный изомер и/или полученное свободное соединение переводят в соль или полученную соль переводят в свободное соединение.
Взаимодействие соединений формул III и IV осуществляют обычным образом, например, при температуре разложения образующихся вначале аммониевых солей или в присутствии средства, способствующего протеканию конденсации, например, водоотнимающего средства, или основного средства, способствующего протеканию конденсации, и в присутствии растворителя или разбавителя.
Так, например, взаимодействие с кислотами формулы IV предпочтительно осуществляют в присутствии водоотнимающего средства, например, N,N-дициклогексилкарбодиимида, или при температуре разложения образующейся вначале аммониевой соли, тогда как взаимодействие с реакционноспособными сложными эфирами соединения формулы IV или его ангидридом предпочтительно осуществляют в присутствии основного средства, способствующего протеканию конденсации, например, гидроксида или карбоната щелочного металла, или третичного или стерически затрудненного вторичного органического амина, например, три(низший)алкиламина, в частности, триэтиламина или диизопропиламина, или ароматического азотистого основания, например, пиридина.
Исходные соединения формулы III могут быть получены обычным образом, например, путем введения в соединения формулы IIIa
остатка R1 взаимодействием с N-ацилирующим или N-алкилирующим агентом, или путем взаимодействия в восстановительных условиях с соединением формулы R1=0, где R1 имеет вышеопределенные значения.
При необходимости реакцию проводят в условиях термического разложения образующихся промежуточных аммониевых солей или в присутствии средства, способствующего протеканию конденсации, например, водосвязывающего средства, или основного средства, способствующего конденсации, и в присутствии растворителя, или разбавителя. Так, например, взаимодействие с кислотами формулы R1COOH предпочтительно проводят в присутствии водосвязывающего средства, например, N, N-дициклогексилкарбодиимида, или в условиях термического разложения образующейся вначале аммониевой соли, тогда как взаимодействие с галоидангидридами или ангидридами кислот указанной формулы и с соединениями формулы R1Yb, где Yb - галоген, в частности, хлор, бром или иод, или сульфонилоксигруппа, например, алкан- или незамещенная или замещенная бензолсульфонилоксигруппа, например, метан-, этан-, бензол-, п-толуол- или п-бромбензолсульфонилоксигруппа, предпочтительно проводят в присутствии основного средства, способствующего протеканию конденсации, например, гидроксида или карбоната щелочного металла, или третичного или стерически затрудненного вторичного органического амина, например, три(низший)алкиламина, в частности, триэтиламина или диизопропиламина, или ароматического азотистого основания, например, пиридина.
Взаимодействие с соединениями формулы R1=0 проводят, например, в присутствии водорода и катализатора гидрирования, например, платинового или палладиевого катализатора или никеля Ренея, или в присутствии гидрида двух легких металлов, например, натрийборгидрида или натрийцианборгидрида, предпочтительно в среде инертного в условиях проведения реакции растворителя, например, низшего спирта, в частности, метанола или этанола или ди(низший)алкилового или ди(низший)алкиленового эфира, например, диэтилового эфира, диоксана или тетрагидрофурана.
В исходных соединениях формулы IX в соответствии с вариантом способа защитная группа Y, защищающая аминогруппу, означает, например, низшую алканоильную группу, которая может быть галогенирована, например, трифторацетил, или ацильную группу полуэфира муравьиной кислоты, например, низшую алкоксикарбонильную или α -фенил(низший)алкоксикарбонильную группу, в частности, трет.-бутилоксикарбонил или бензилоксикарбонил, или силильную группу, например, три(низший)алкилсилил, в частности, триметилсилил. Отщепление этой защитной группы осуществляют обычным образом, например, путем обработки кислотой, или в случае использования в качестве исходного материала соединений формулы IX, у которых Y означает галоидированный низший алканоил, например, трифторацетил, путем восстановительного отщепления, например, путем обработки двойным гидридом легких металлов, например, натрийборгидридом, предпочтительно в среде низшего алканола, например, метанола.
Исходные соединения формулы IX могут быть получены аналогично способу получения промежуточных соединений формулы III, причем в этом случае в качестве исходных используют соединения формулы IXa.
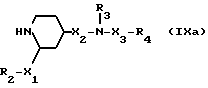
Настоящее изобретение относится также к промежуточным производным пиперидона формулы X
где
R1 означает незамещенный или замещенный C1-C4-алкилом, C1-C4-алкоксилом, гидроксилом, галогеном, трифторметилом, ди-C1-C4-алкиламино и/или цианогруппой бензоил, нафтоил, 9-флуоренил, хинолилкарбонил;
R2 - незамещенный или замещенный галогеном фенил или нафтил;
X1 - гидроксиметилен;
и их кислотно-аддитивным солям.
Настоящее изобретение относится, в частности, к приведенным в примерах соединениям формулы X и их солям.
Предлагаемый в соответствии с изобретением способ их получения заключается в том, что производное пиперидона общей формулы Ха
в которой
R2 и X1 имеют вышеуказанные значения, подвергают взаимодействию с соединением, вводящим R1 остаток с последующим выделением целевого соединения в свободном виде или в виде кислотно-аддитивной соли.
Примерами соединений, с помощью которых вводится остаток R1, являются соединения формулы R1-Y10 (Xb), в которой Y10 означает реакционно-способную группу, например, галоген или сульфонилокси-группу, в частности, бензол-, п-толуол- или метансульфонилокси-группу, R1 имеет вышеуказанные значения.
Реакцию проводят обычным образом, например, в присутствии основного средства, способствующего протеканию конденсации, например, гидрокарбоната щелочного металла, в частности, гидрокарбоната натрия, предпочтительно в двухфазной системе, содержащей воду, например, в смеси метиленхлорида и воды.
Соединения формулы Ха в свою очередь могут быть получены путем взаимодействия N-защищенного пиперидин-4-онкеталя, например, 1- (трет.-бутилоксикарбонил)пиперидин-4-он-этиленкеталя, с альдегидом формулы R2-CH=O (Xc), например, в присутствии соединения металла, в частности, углеводородного соединения щелочного металла, предпочтительно (низший)алкиллитиевого соединения, в частности, втор.-бутиллития, предпочтительно в среде эфироподобного растворителя, например, диэтилового эфира, при -30 : -80oC, например, при -60: -75oC.
Соединения формулы I, где X3 означает метилен или этилен, также могут быть получены конденсацией соединений формулы III
где
R1, R2, R3, X1 и X2 имеют значения, определенные выше, с соответствующими альдегидами или кетонами в восстановительных условиях.
Полученные описанными способами соединения могут быть обычным образом переведены в другие соединения формулы I.
Так, например, соединения формулы I, у которых X1 означает карбонил, можно обычным образом восстановить в соответствующие соединения формулы I, у которых X1 означает гидроксиметилен. Аналогичным образом полученные соединения формулы I, у которых X1 означает гидроксиметилен и/или X3 означает карбонил, могут быть восстановлены в соответствующие соединения формулы I, у которых X1 и/или X3 означают метилен.
Далее, в полученных соединениях формулы I, у которых R3 означает атом водорода, можно ввести остаток R3, отличный от водорода, например, алкил, путем обычного алкилирования. И, наоборот, у полученных соединений формулы I, у которых R3 означает алкил, в частности, метил, алкильную группу можно отщепить путем обработки их эфиром галогенмуравьиной кислоты, например, метиловым эфиром.
Полученные соли могут быть обычным образом, например, путем обработки основанием, например, гидроксидом щелочного металла, карбонатом или гидрокарбонатом металла или аммиаком, или одним из вышеназванных солеобразующих оснований или кислотой, например, минеральной кислотой, в частности, хлористым водородом, или одной из других вышеназванных солеобразующих кислот, переведены в свободные соединения.
Полученные соли могут быть обычным образом переведены в другие кислые аддитивные соли, например, путем обработки подходящей солью металла, например, солью натрия, бария или серебра, другой кислоты, в среде подходящего растворителя, в котором образующаяся неорганическая соль нерастворима и поэтому выпадает в осадок, сдвигая равновесие реакции, а также основные соли, путем выделения свободной кислоты и повторного перевода ее в соль.
Соединения формулы 1, включая и их соли, могут быть также получены в форме гидратов или включать использующийся для кристаллизации растворитель.
Вследствие большой близости между свойствами новых соединений в свободной форме и в форме их солей, как при более раннем упоминании, так и впоследствии, под свободными соединениями и их солями в общем имеются в виду и соответствующие соли, соответственно свободные соединения.
Полученные смеси диастереоизомеров и рацемические смеси, благодаря различию физико-химических свойств отдельных их компонентов, могут быть обычным образом, например, с помощью хроматографии и/или фракционной кристаллизации разделены на чистые диастереоизомеры, соответственно рацематы, которые могут быть далее с помощью известных методов разделены на оптические антиподы. Это можно сделать, например, путем перекристаллизации из оптически активного растворителя, с помощью микроорганизмов или путем взаимодействия смеси диастереоизомеров или рацематов с оптически активным вспомогательным соединением, например, в соответствии с содержащимися в соединениях формулы 1 кислыми, основными или функциональными отщепляющимися группами с оптически активной кислотой, основанием или оптически активным спиртом. Таким образом, смеси диастереоизомерных солей или функциональных производных, например, сложных эфиров, могут быть разделены на отдельные диастереоизомеры, из которых затем нужные энантиомеры могут быть выделены в свободном виде обычным образом. Подходящими для этой цели основаниями, кислотами или спиртами являются, например, оптически активные алкалоидные основания, в частности, стрихнин, цинхонин или бруцин, или D- или L-(1- фенил)этиламин, 3-пипеколин, эфедрин, амфетамин и другие аналогичные основания, которые могут быть получены синтетически; оптически активные карбоновые или сульфоновые кислоты, например, хинная кислота, D- или L-винная, D- или L-ди-о-толуилвинная, D- или L-яблочная, D- или L-миндальная или D- или L-камфаросульфоновая кислоты, или оптически активные спирты, например, борнеол или L- или L-(1-фенил)этанол.
Настоящее изобретение относится также к вариантам осуществления способа, в соответствии с которыми на одной из стадий в качестве исходного материала используют получаемое промежуточное соединение и затем проводят остальные стадии или используют исходный материал в виде соли или, в частности, получают ее в условиях проведения реакции.
Новые исходные соединения, которые были специально получены для получения соединений в соответствии с настоящим изобретением, в частности, те из них, использование которых приводит к получению вышеотмеченных предпочтительных соединений формулы I, способ их получения и их применение в качестве промежуточных продуктов также составляет предмет настоящего изобретения.
Новые соединения формулы I могут, например, применяться в форме фармацевтических композиций, содержащих терапевтически эффективное количество активного вещества, при желании в комбинации с неорганическими или органическими, твердыми или жидкими фармацевтически приемлемыми носителями, которые могут использоваться для энтерального, например, орального или парентерального введения.
Так, например, используют таблетки или желатиновые капсулы, содержащие активное вещество в комбинации с разбавителями, например, лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или смазочными добавками, например, кремнеземом, тальком, стеариновой кислотой или ее солями, например, стеаратом кальция или магния, и/или полиэтиленгликолем.
Такие таблетки могут, кроме того, содержать связующее, например, магнийалюминийсиликат, крахмалы, например, кукурузный, пшеничный, рисовый крахмал или крахмал маранты, желатин, трагант, метилцеллюлозу, натриевую карбоксиметилцеллюлозу и/или поливинилпирролидон, и, при желании, разрыхлитель, например, крахмал, агар, альгиновую кислоту или ее соль, например, альгинат натрия, и/или шипучие смеси, или абсорбенты, красители, вкусовые и сладкие вещества. Новые соединения формулы 1 могут также применяться в виде композиций для парентерального введения или растворов для вливания. Такими растворами предпочтительно являются изотонические водные растворы или суспензии, которые в случае, например, лиофилизированных препаратов, содержащих только одно активное вещество или активное вещество в комбинации с носителем, например, маннитом, могут быть приготовлены непосредственно перед употреблением. Предлагаемые фармацевтические композиции могут быть стерилизованными и/или содержать вспомогательные добавки, например, консерванты, стабилизаторы, смачиватели и/или эмульгаторы, агенты растворения, соли для регулирования осмотического давления и/или буферы. Предлагаемые в соответствии с настоящим изобретением фармацевтические композиции, которые при желании могут содержать другие фармакологически активные вещества, получают обычным образом, например, с помощью обычных способов смешения, гранулирования, дражжирования, растворения или лиофилизации, и содержат примерно 0,1 - 100, предпочтительно примерно 1 - 50, а лиофилизаты примерно до 100% активного вещества.
Дозировка фармацевтических композиций может зависеть от различных факторов, таких как способ введения, вид, возраст и/или индивидуальное состояние пациента. Суточные дозы в случае орального введения находятся в пределах от примерно 0,25 до примерно 10 мг/кг и для теплокровных с весом примерно 70 кг - предпочтительно от примерно 20 до примерно 500 мг.
Изобретение иллюстрируется нижеприведенными примерами. Температуры указаны в градусах Цельсия, а давление - в атм.
Пример 1.
(2R, 4S) и (2R,4R)-2-бензил-1-(3,5-диметилбензоил)-N-(2-фенэтил)-4-пиперидинамин-гидрохлорид
К смеси 3,65 г (11,4 ммоль) (2R,4RS)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина в 30 мл метанола, 935 мг (11,4 ммоль) ацетата натрия, 0,65 мл (11,4 ммоль) уксусной кислоты и 1,44 г (12 ммоль) фенилацетальдегида добавляют порциями в течение 10 мин, в атмосфере азота, при 0oC 1,26 г (17,1 ммоль) натрийцианборгидрида (85%). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре, добавляют к ней еще 0,376 г (2,4 ммоль) фенилацетальдегида и перемешивают в течение 16 ч при 4oC.
После этого удаляют метанол в ротационном выпарном аппарате и распределяют красноватую реакционную смесь между эфиром и 1н. раствором бикарбоната натрия. Органические фазы промывают рассолом, высушивают над сульфатом магния и упаривают досуха. В результате получают смесь гидрохлоридов целевых соединений формул
в виде желтой маслянистой жидкости. Эту смесь для разделения диастереоизомеров подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака (97,5: 2,25:0,25). При этом диастереоизомеры получают в виде свободных оснований.
Тонкослойная хроматография: смесь метиленхлорида и метанола (98:2)
диастереоизомер A (2R,4R):Rf = 0,16; температура плавления 248 - 249oC,
[α]D = -56,9o (c = 0,946, метанол); MS: M+ = 426 (свободное основание).
диастереоизомер В (2R,4S): Rf = 0,06; температура плавления 270oC (с разложением);
[α]D = +30,6o (с=0,759, метанол); MS: M+ = 426 (свободное основание).
Исходные соединения для получения указанных продуктов получают следующим образом:
а) этиловый эфир (R)-3-бензиламино-4-фенилмасляной кислоты
К раствору 42,2 г (0,203 моль) этилового эфира (R)-3-амино-4- фенилмасляной кислоты, получаемого путем этерификации известной (R)-3-амино-4-фенилмасляной кислоты этанолом, 11,6 мл (0,203 моль) ледяной уксусной кислоты, 33,3 г (0,406 моль) ацетата натрия и 20,9 мл (0,207 моль) бензальдегида в 400 мл метанола добавляют при -5 - +5oC порциями 19,1 г (0,304 моль) натрийцианборгидрида. После окончания добавления смесь выдерживают в течение еще часа при комнатной температуре для завершения реакции. Желтую суспензию упаривают почти досуха в ротационном выпарном аппарате и распределяют кашицеобразный остаток между уксусноэтиловым эфиром и водой, pH которой с помощью раствора аммиака устанавливают равным примерно 8. Органические фазы промывают водой и рассолом до нейтральной реакции, высушивают над сульфатом магния и упаривают досуха, получая в результате желтую маслянистую жидкость, которую подвергают хроматографии на силикагеле с использованием в качестве элюента смеси метиленхлорида и метанола в соотношении 99:1. В результате получают целевое соединение в виде слегка желтоватой маслянистой жидкости. Путем добавления к эфирному раствору целевого соединения щавелевой кислоты получают оксалат.
Температура плавления 142 - 143oC.
Тонкослойная хроматография: метиленхлорид/метанол (95:5); Rf= 0,63; MS: М+ - 91 = 206 (60%); [α]D = +3o (c = 1, этанол) свободное основание; [α]D = -0,8o (с = 1, CHCl3) оксалат
C21H25NO6 (оксалат) C рассчитано 65,11%, найдено 65,12%; H, рассчитано 6,51%, найдено 6,46%; N, рассчитано 3,6%, найдено 3,77%.
b) метиловый эфир (R)-N-бензил-N-[(1-этоксикарбонилметил- 2-фенил) этил] карбамоилуксусной кислоты
К охлажденному на бане с ледяной водой раствору 115,8 г (0,389 моль) этилового эфира (R)-3-бензиламино-4-фенилмасляной кислоты, 56,8 мл (0,408 моль) триэтиламина и 366 мг диметиламинопиридина в 630 мл толуола добавляют по каплям в течение 2,5 ч раствор 43,8 мл (0,408 моль) хлорангидрида монометилового эфира малоновой кислоты в 480 мл толуола таким образом, чтобы температура смеси оставалась в пределах 0 - 5oC. Суспензию оставляют стоять в течение 2 ч для завершения реакции и выливают затем в 500 мл ледяной воды. Органическую фазу отделяют, промывают последовательно 0,1N раствором соляной кислоты, 1N раствором бикарбоната натрия и ледяной водой, высушивают над сульфатом натрия и упаривают досуха.
Остаток в виде желтой маслянистой жидкости подвергают хроматографии на силикагеле, используя в качестве элюента смесь уксусноэтилового эфира и гексана (1:2). В результате получают целевое соединение.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1: 2), Rf = 0,25; MS : М+ = 397 (3%); [α]D = +19,5o (с=1,3, CHCl3).
c) метиловый эфир (6R)-1,6-дибензил-2,4-диоксо-3-пиперидинкарбоновой кислоты
К раствору 53,9 г (0,135 моль) метилового эфира (R)-N-бензил-N-[(1- этоксикарбамоилметил-2-фенил)-этил]-карбамоилуксусной кислоты в 520 мл трет. -бутанола добавляют при комнатной температуре 15,2 г (0,135 моль) трет.-бутанолята калия и оставляют смесь стоять в течение часа для завершения реакции. После этого светло-желтую суспензию смешивают при комнатной температуре с 1 экв. (8,1 г) уксусной кислоты и упаривают смесь до объема примерно 100 мл. Концентрат разбавляют 300 мл воды и подвергают экстракции (трижды, порциями по 300 мл) уксусноэтилового эфира. Органические фазы промывают последовательно водой и рассолом, высушивают объединенные органические фазы над сульфатом натрия и упаривают досуха, получая в результате целевое соединение в виде прозрачной желтой маслянистой жидкости, которую без дополнительной очистки используют на следующей стадии. Тонкослойная хроматография: уксусноэтиловый эфир/метанол (1:1) Rf = 0,3.
(6R)-1,6-дибензил-2,4-пиперидинон
Раствор 106,1 г (0,301 моль) метилового эфира (6R)-1,6-дибензил-2,4-диоксо-3-пиперидинкарбоновой кислоты в 298 мл толуола и 445 мл 10%-ного (об. %) раствора уксусной кислоты нагревают в течение 2,5 ч при 80oC. Реакционную смесь охлаждают затем до комнатной температуры, нейтрализуют путем добавления 48 г твердого карбоната натрия при охлаждении ледяной водой, разделяют фазы и водную фазу еще раз подвергают экстракции 300 мл уксусноэтилового эфира. Объединенные органические фазы промывают водой, а затем рассолом, высушивают над сульфатом натрия и упаривают досуха. Остающуюся в виде остатка маслянистую жидкость кристаллизуют из эфира, получая в результате целевое соединение. Температура плавления 97 - 97,5oC.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (2: 1), Rf = 0,31; [α]D = +166,9o (с=1, CHCl3); MS:М+ = 293 (2,4%).
е) (2R,4RS)-1,2-дибензил-4-пиперидинамин
(вариант е1)
е1а) (6R)-1,6-дибензил-4-(метоксиимино)-2-пиперидон
Раствор 10 г (0,034 моль) (6R)-1,6-дибензил-2,4-пиперидиндиона в 68 мл пиридина смешивают с 3,9 г (0,037 моль) метоксиамингидрохлорида и нагревают в течение часа при 85oC.
Прозрачный желтый раствор выливают затем в охлажденный льдом 1н. раствор соляной кислоты (pH около 3) и подвергают экстракции толуолом. Органические экстракты промывают 1н. раствором соляной кислоты, а затем 1н. раствором соды и рассолом, высушивают над сульфатом натрия и упаривают досуха, получая в результате целевое соединение в виде воскообразных кристаллов. Температура плавления 63 - 77oC.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1:1), Rf= 0,52; MS: М+= 322 (1,4%).
По данным 1H-ЯМР (CDCl3) полученный продукт представляет собой смесь син- и антиизомеров в соотношении примерно 7:3.
Метокси-сигналы оксимового эфира равны соответственно 3,92 и 3,88 м.д.
e1b) (2R,4RS)-1,2-дибензил-4-пиперидинамин
В дистилляционном аппарате с колонкой Vigreux в качестве насадки и холодильником, охлаждаемым водой с температурой 40oC, кипятят раствор 9,19 г (0,0285 моль) (6R)-1,6-дибензил-4-(метоксиимино)-2-пиперидона в 90 мл тетрагидрофурана в атмосфере аргона. К этому раствору добавляют по каплям в течение 20 мин 6,1 мл (0,0643 моль) боран-диметилсульфидного комплекса и затем в течение еще 4 ч еще 9 мл (0,0949 моль) этого же комплекса. В процессе добавления комплекса выделяющийся диметилсульфид выходит из дистилляционного аппарата.
После окончания добавления боран-диметилсульфидного комплекса реакционную смесь охлаждают на ледяной бане до 0 - 4oC и гидролизуют избыток борана путем медленного добавления 20 мл метанола. После окончания энергично протекающего экзотермического гидролиза растворитель отгоняют непосредственно из аппарата в вакууме, создаваемом с помощью водоструйного насоса. Затем к остатку добавляют 90 мл 5N раствора соляной кислоты и кипятят смесь в течение 2 ч. Охлажденный до комнатной температуры раствор разбавляют 200 мл воды, подвергают экстракции эфиром для удаления кислой и нейтральной части, охлаждают водную фазу на бане с ледяной водой, устанавливают ее pH с помощью 5N едкого натра, равным примерно 9, и подвергают основную часть экстракции смесью эфира и тетрагидрофурана (2:1). Органические экстракты высушивают над сульфатом магния и упаривают досуха, получая в результате сырое основание в виде желтоватой маслянистой жидкости, которую без дополнительной очистки используют на следующей стадии.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:10:0,4); Rf = 0,3.
Путем растворения в метанольном растворе соляной кислоты и добавления эфира получают аморфный дигидрохлорид целевого соединения. Температура плавления 150 - 182oC.
Вариант е2)
е2а) (6R)-1,6-дибензил-2,4- пиперидиндион-4-этиленкеталь
Раствор 30 г (0,102 моль) (6R)-1,6-дибензил-2,4-пиперидиндиона, 50 мл этиленгликоля и 1,8 г моногидрата п-толуолсульфокислоты в 800 мл толуола нагревают в течение 3 ч с водоотделителем. Охлажденный до комнатной температуры раствор промывают 100 мл 1н. раствора бикарбоната натрия и затем рассолом, высушивают органическую фазу над сульфатом магния и упаривают досуха, получая в результате сырой кеталь в виде маслянистой жидкости, которую подвергают хроматографии на силикагеле с использованием в качестве элюента уксусноэтилового эфира и кристаллизуют полученную маслянистую жидкость из эфира. В результате получают целевое соединение в виде белых кристаллов. Температура плавления 91 - 93oC.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (3: 1), Rf = 0,53; MS: М+ = 337.
e2b) (2R)-1,2-дибензил-4-пиперидонэтиленкеталь
Раствор 10,2 г (0,0302 моль) (6R)-1,6-дибензил-2,4-пиперидиндион-4-этиленкеталя в 100 мл тетрагидрофурана смешивают в атмосфере аргона в течение 10 мин с 7,6 мл (0,0756 моль) боран-диметилсульфидного комплекса и кипятят смесь в течение часа с обратным холодильником. После этого добавляют к охлажденному до комнатной температуры раствору 40 мл 2N раствора едкого натра и снова кипятят смесь в течение 2 ч с обратным холодильником, удаляют затем тетрагидрофуран в ротационном выпарном аппарате и подвергают реакционную смесь экстракции эфиром. Органические экстракты промывают раствором бикарбоната натрия, высушивают над сульфатом магния и упаривают досуха, получая в результате целевое соединение.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (2: 1), Rf = 0,81; MS: М+ = 323.
e2с) (2R)-1,2-дибензил-4-пиперидон
Раствор 85,7 г (0,261 моль) (2R)-1,2-дибензил-4-пиперидонэтиленкеталя в 170 мл диоксана и 1000 мл 2,25М раствора соляной кислоты нагревают в течение 29 ч при 70oC. После этого диоксан удаляют в вакууме, pH водной фазы устанавливают с помощью 30%-ного раствора едкого натра при охлаждении ледяной водой, равным примерно 8, и подвергают ее экстракции эфиром.
Эфирные экстракты промывают 1N раствором бикарбоната натрия, высушивают над сульфатом натрия и упаривают досуха, получая в результате целевое соединение в виде красноватой маслянистой жидкости, которую из-за нестабильности без дополнительной очистки подвергают дальнейшей переработке.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1:1), Rf= 0,71; FD-MS: М+ 279.
е2d) (2R)-1,2-дибензил-4-(метоксиимино)-пиперидин
3 г (0,01071 моль) (2R)-1,2-дибензил-4-пиперидона, 4,4 г (0,0537 моль) ацетата натрия и 942 мг (0,0113 моль) метоксиамингидрохлорида растворяют в 30 мл этанола и нагревают полученный раствор в течение 30 мин при 60oC. После этого этанол удаляют в вакууме и распределяют остаток между водой и уксусноэтиловым эфиром. Органические экстракты высушивают над сульфатом натрия и упаривают досуха, получая в результате сырой продукт. Этот сырой продукт подвергают хроматографии на силикагеле, используя в качестве элюента смесь уксусноэтилового эфира и гексана (3:1), получая в результате целевое соединение в виде маслянистой жидкости.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1:1), Rf1 = 0,84, Rf2= 0,76 (син)-анти-оксимовый эфир;
MS: М+308 (1%), M+ -91:217 (90%).
1H-ЯМР-спектр (CD3OD) δ (м.д.) 3,85 (s, =N-OCH3), 3,825 (s: примерно 1: 1).
е2е) (2R,4RS)-1,2-дибензил-4-пиперидинамин
В растворе 5,43 г (17,6 ммоль) (2R-1,2-дибензил-4-(метоксиимино)-пиперидина в 60 мл тетрагидрофурана конденсируют при -78oC 180 мл высушенного над гидроксидом калия газообразного аммиака. К этому раствору добавляют при -70oC 3,7 г (69 ммоль) хлорида аммония и порциями 1,6 г (70,4 ммоль) металлического натрия. Через час к образующейся суспензии добавляют еще 3,7 г хлорида аммония и 0,6 г металлического натрия и перемешивают смесь в течение 2 ч при -70oC. После этого удаляют охлаждающую баню и отгоняют газообразный аммиак. Остаток распределяют между 1N раствором едкого натра и эфиром, отделяют органическую фазу, водную фазу еще раз подвергают экстракции, органические фазы промывают рассолом, высушивают объединенные органические фазы над сульфатом натрия и упаривают досуха, получая в результате целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1); Rf = 0,33; MS: М+ = 280.
f) (2R,4RS)-N-(1,2-дибензил-4-пиперидил)-трифторацетамидтрифторацетат
Раствор 6,88 г (24,5 ммоль) (2R,4RS)-1,2-дибензил-4-пиперидинамина в 20 мл метиленхлорида, охлаждаемый на ледяной бане, смешивают с 5,1 мл (36,8 ммоль) ангидрида трифторуксусной кислоты и затем перемешивают в течение часа при комнатной температуре. После этого реакционную смесь упаривают досуха, получая в результате целевое соединение в виде желтоватой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (190:9:1); Rf = 0,41 (цис-), соответственно 0,57 (транс)диастереоизомеры. MS : М+ -91 (бензил) = 285 (14%).
g) (2R,4RS)-N-(2-бензил-4-пиперидил)-трифторацетамидтрифторацетат
К раствору 19,3 г (39,4 ммоль) (2R,4RS)- N-(1,2-дибензил-4-пиперидил)-трифторацетамидтрифторацетата в 160 мл диоксана добавляют в атмосфере азота 3,0 г 10%-ного палладиевого катализатора на угле и проводят гидрирование при комнатной температуре и нормальном давлении. Реакционную смесь отделяют затем от катализатора путем фильтрования через цеолит $$$ остаток промывают диоксаном. Фильтрат упаривают досуха и высушивают в высоком вакууме, получая в результате целевое соединение, которое используют далее без дополнительной очистки.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1); Rf = 0,24, соответственно 0,3 (два плохо разделяемых диастереоизомера).
h) (2R,4RS)-N-[2-бензил-1-(3,5-диметилбензоил)-4-пиперидил]- трифторацетамид
К охлажденной ледяной водой смеси 1,39 г (3,44 ммоль) (2R,4RS)-N-(2-бензил-4-пиперидил)-трифторацетамидтрифторацетата и 10 мл смеси толуола и воды (1: 1) добавляют при перемешивании 710 мг твердого бикарбоната натрия и 712 мг 3,5-дибензоилхлорида. После этого реакционной смеси дают нагреться до комнатной температуры, перемешивают ее в течение 2 ч и распределяют между толуолом и 1N раствором бикарбоната натрия. Органические фазы промывают водой, высушивают над сульфатом магния и упаривают досуха. Бесцветную маслянистую жидкость подвергают хроматографии на силикагеле с использованием в качестве элюента смеси уксуснокислого эфира и гексана (1:2), получая в результате целевое соединение, которое используют далее без дополнительной очистки.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (190: 9: 1); Rf= 0,5 (при этих условиях не происходит разделения диастереоизомеров). MS: М+ = 418 (3%); М+ -91 (43%).
i) (2R,4RS)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамин
Раствор 4,73 г (10,4 моль) (2R,4R)-N-[2-бензил-1-(3,5- диметилбензоил)-4-пиперидил] -трифторацетамида в 50 мл смеси тетрагидрофурана и метанола в соотношении 1: 1 смешивают при комнатной температуре в атмосфере азота с 4,1 мл 5N раствора гидроксида натрия и кипятят смесь в течение 5 ч с обратным холодильником. После окончания реакции реакционную смесь охлаждают ледяной водой, устанавливают ее pH с помощью 1N раствора соляной кислоты равным примерно 1 и удаляют органические растворители в ротационном выпарном аппарате. Остающуюся кислую водную фазу подвергают экстракции эфиром для удаления кислой и нейтральной частей, устанавливают затем ее pH путем добавления 10N раствора гидроксида натрия при охлаждении ледяной водой равным примерно 10 и подвергают экстракции эфиром.
Органические фазы промывают рассолом, высушивают над сульфатом натрия и упаривают досуха, получая в результате свободное основание в виде коричневатой маслянистой жидкости, которую используют далее без дополнительной очистки.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1); Rf= 0,29; MS: М+ = 322 (0,03%), М+ -91 = 231 (62%).
Аналогичным образом, используя в качестве исходного соединения L-фенилаланинол, в соответствии с вышеприведенной последовательностью реакций получают (2R,4RS)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамин.
Пример 2.
(2R*,4S*)-2-бензил-1-(2-нафтоил)-N-(4-хинолилметил)-4-пиперидинамин
К раствору 106 мг (0,182 ммоль) (2R*,4S*)-2-бензил-1-(2-нафтоил)-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина в 1,5 мл метанола добавляют при 0oC в течение 20 мин 28 мг (0,73 ммоль) натрийборгидрида (в три приема) и затем смесь перемешивают в течение 3 ч при 0oC. После этого ее смешивают с 0,6 мл (0,18 ммоль) ацетона и перемешивают 10 мин. Затем удаляют метанол в ротационном выпарном аппарате и распределяют твердый белый остаток между этилацетатом и водой.
Органические фазы промывают рассолом, высушивают над сульфатом магния и упаривают досуха. Полученную белую пену подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 1500:50:1. В результате получают целевое соединение формулы
®
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,34; FD-MS: M+ = 485.
Исходное соединение для получения указанного продукта получают следующим образом:
а) 2-бензил-N-бензилоксикарбонил-2,3-дигидро-4-(1H)-пиридон
К раствору 104 г (0,95 моль) 4-метоксипиридина в 1 л безводного тетрагидрофурана добавляют по каплям в течение 20 мин при -70oC в атмосфере аргона 165 мл (1,16 моль) бензилового эфира хлормуравьиной кислоты. После этого разбавляют густую суспензию бежевого цвета 200 мл безводного тетрагидрофурана, добавляют к ней по каплям в течение 75 мин, поддерживая температуру -70oC, реактив Гриньяра, приготовленный в 160 мл безводного эфира из 35,5 г (1,46 моль) магниевых стружек и 460 мл (1,46 моль) 3-молярного раствора бензилхлорида в безводном эфире.
После выдержки в течение еще 10 мин реакционной смеси дают нагреться до комнатной температуры, разбавляют ее 500 мл эфира, добавляют к ней по каплям 900 мл 4N соляной кислоты и разделяют фазы. Органические фазы промывают водой и рассолом, высушивают над сульфатом магния и упаривают досуха. Остаток подвергают хроматографии на силикагеле, используя в качестве элюента смесь гексана и этилацетата в соотношении 3:1.
В результате получают целевое соединение в виде бесцветной вязкой маслянистой жидкости.
Тонкослойная хроматография: гексан:этилацетат (1:3); Rf = 0,7.
ИК: 1725, 1665, 1602 см-1.
b) (2R*,4R*)-2-бензил-4-оксипиперидин
Гидрируют 150 г (0,467 моль) 2-бензил-N-бензилоксикарбонил-2,3-дигидро-4-(1H)-пиридона в 1,5 л метанола в присутствии 7,5 г Pd/C (10%-ный) в качестве катализатора, добавляют затем 50 г никеля Ренея и еще 200 мл метанола и выдерживают смесь до окончания гидрирования. После фильтрования фильтрат упаривают в ротационном выпарном аппарате и коричневую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 60:10:1. В результате получают целевое соединение в виде полукристаллической массы, которую используют далее без дополнительной очистки. Путем кристаллизации пробы из смеси эфира и гексана получали белые кристаллы с температурой плавления 111 - 112oC.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (40:10:1); Rf = 0,55; FD-MS: М+ = 191.
с) (2R*,4R*)-2-бензил-1-трет.-бутоксикарбонил-4-оксипиперидин
Перемешивают раствор 28 г (146 ммоль) (2R*,4R*)-2- бензил-4-оксипиперидина и 35,1 г (161 ммоль) дитрет.-бутилкарбоната в 500 мл хлороформа при 50oC течение 20 ч, после этого упаривают в ротационном выпарном аппарате и желтую маслянистую жидкость подвергают хроматографии на силикагеле с использованием в качестве элюента смеси метиленхлорида, метанола и концентрированного аммиака в соотношении 2000:50:1. В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/ концентрированный аммиак (2000:50:1); Rf= 0,40; FD-MS: М+ = 291.
d) (2R*,4R*)-2-бензил-1-трет.-бутоксикарбонил-4- (метансульфонилокси)-пиперидин
К раствору 62,4 г (214 ммоль) (2R*,4R*)-2-бензил-1-трет.-бутоксикарбонил-4-оксипиперидина в 75 мл пиридина добавляют по каплям при охлаждении льдом 33,3 мл (428 ммоль) хлорангидрида метансульфоновой кислоты.
После выдержки в течение 30 минут при 0oC суспензию перемешивают 3 ч при комнатной температуре. После упаривания в ротационном выпарном аппарате реакционную смесь растворяют в этилацетате, промывают раствор водой и рассолом, высушивают над сульфатом магния и упаривают в ротационном выпарном аппарате. При кристаллизации на эфире получают целевое соединение в виде белых кристаллов. Температура плавления 110 - 115oC.
Тонкослойная хроматография: толуол/этилацетат (4:1);
Rf = 0,42; FD-MS:M+ = 369.
е) (2R*,4S*)-2-бензил-1-трет.-бутоксикарбонилпиперидин-4- азид
Перемешивают в течение 3 ч при 80oC в атмосфере аргона смесь 98,9 г (267 ммоль) (2R*,4R*)-2-бензил-1-трет.-бутилоксикарбонил- 4-(метансульфонилокси)-пиперидина, 14,4 г (294 ммоль) азида лития и 500 мл N, N-диметилформамида. Реакционную смесь разбавляют затем этилацетатом, промывают водой и рассолом, высушивают над сульфатом магния и упаривают досуха. Коричневатую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь толуола и этилацетата в соотношении 9:1. В результате получают целевое соединение в смеси с 2-бензил-N-трет.-бутоксикарбонил- 1,2,5,6-тетрагидропиридина в весовом соотношении 4,2:1 (по данным 1H-ЯМР), который больше уже нельзя отделить.
Тонкослойная хроматография: толуол/этилацетат (9:1) Rf)= 0,59.
FD-MS: М+ = 316. ИК: 2100, 1685 см-1.
f) (2R*,4S*)-2-бензил-1-трет.-бутоксикарбонил-4-пиперидинамин
Смесь 4,16 г (13,1 ммоль) (2R*,4S*)-2-бензил-1-трет.-бутоксикарбонил-4-пиперидиназида и 0,99 г (3,62 ммоль) 2-бензил-N-трет.-бутоксикарбонил- 1,2,5,6-тетрагидропиридина (рассчитано из данных 1H-ЯМР-спектра) гидрируют водородом в 100 мл метанола в присутствии 1 г 10%-ного Pd/C.
После окончания поглощения водорода катализатор отфильтровывают и фильтрат упаривают в ротационном выпарном аппарате. Коричневую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 350:50:1.
В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1) Rf= 0,4. FD- MS: М+ = 290.
g) (2R*,4S*)-2-бензил-1-трет.-бутилоксикарбонил-N-(4- хинолилметил)-4-пиперидинамин
Перемешивают смесь 5 г (17,2 ммоль) (2R*,4S*)-2-бензил-1-трет.-бутоксикарбонил-4-пиперидинамина и 2,7 г (17,2 ммоль) хинолин-4-карбоксальдегида в 50 мл толуола при комнатной температуре и через 2 ч смешивают ее с 2,8 г (23,3 ммоль) безводного сульфата магния. Еще через 16 ч смесь фильтруют и фильтрат упаривают. Коричневую маслянистую жидкость растворяют в 50 мл метанола и смешивают раствор с 0,69 г (18,3 ммоль) натрийборгидрида, добавляемого в 4 приема. После перемешивания в течение 3 ч при комнатной температуре реакционную смесь упаривают, остаток растворяют в этилацетате и промывают водой и рассолом. Органические фазы высушивают над сульфатом магния и упаривают досуха. Коричневую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 850:50:1. В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf= 0,38; FD-MS: М+ = 431.
h) (2R*, 4S*)-2-бензил-1-трет. - бутоксикарбонил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Смешивают раствор 6,2 г (14,4 ммоль) (2R*,4S*)-2- бензил-1-трет.-бутоксикарбонил-N-(4-хинолилметил)-4-пиперидинамина и 2,6 мл (18,7 ммоль) триэтиламина в 60 мл метиленхлорида при 0oC атмосфере аргона с 2,2 мл (15,8 ммоль) трифторацетангидрида и перемешивают реакционную смесь в течение 3 ч при 0oC. После этого разбавляют ее метиленхлоридом и промывают водой.
Органические фазы высушивают над сульфатом магния и упаривают досуха. В результате получают целевое соединение в виде желтой маслянистой жидкости, представляющей собой чистый по данным тонкослойной хроматографии продукт.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,62. DCl-MS: (М+Н)+ = 528.
i) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
К охлаждаемым льдом 7,73 г (14,7 ммоль) (2R*,4S*)-2-бензил-1-трет.-бутоксикарбонил-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина добавляют по каплям в течение 3 мин 250 мл 6N раствора хлористого водорода в диоксане и смесь перемешивают в течение часа при комнатной температуре. Затем ее упаривают в ротационном выпарном аппарате, подщелачивают 1N раствором гидрокарбоната натрия и подвергают экстракции метиленхлоридом. Органические фазы высушивают над сульфатом магния и упаривают досуха. Коричневатую маслянистую жидкость (7,14 г) подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 700:50:1. В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf= 0,42. DCI-MS: (М+Н)+ = 428. ИК: 1690 см-1
j) (2R*, 4S*)-2- бензил-1-(2-нафтоил)-N-(4-хинолилметил)-N-трифторацетил-4- пиперидинамин
К раствору 97 мг (0,56 ммоль) нафтойной кислоты в 1 мл толуола добавляют по каплям в течение 10 мин в атмосфере аргона при 50oC раствор 58 мкл (0,795 ммоль) тионилхлорида в 0,2 мл толуола и реакционную смесь перемешивают в течение 2 ч при 80oC.
После этого ее упаривают в ротационном выпарном аппарате, дважды смешивают с толуолом, каждый раз с 1 мл, и снова упаривают. Коричневую маслянистую жидкость растворяют в 1 мл метиленхлорида, добавляют ее в атмосфере аргона при 0oC к раствору 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина и смесь перемешивают в течение 2 ч при 0oC. Затем ее смешивают с водой и подвергают экстракции метиленхлоридом. Органические фазы промывают рассолом, высушивают над сульфатом магния и упаривают досуха.
Желтую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 100:50:1. В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf= 0,36. FD-MS: М+ = 581.
Пример 3.
(2R*, 4S*)-2-бензил-1-(3-трифторметилбензоил)-N-(4- хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,184 г (0,307 ммоль) (2R*, 4S*)-2-бензил-1-(3-трифторметилбензоил)-N-(4-хинолилметил) -N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,046 г (1,23 ммоль) натрийборгидрида. В результате получают целевое соединение формулы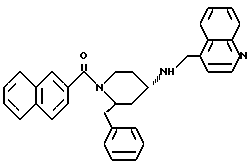
в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf= 0,28. FD-MS: М+ = 503.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3-трифторметилбензоил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2, 106 мг (0,56 ммоль) трифторметилбензойной кислоты подвергают взаимодействию вначале с 58 мкл (0,795 ммоль) тионилхлорида и затем с 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина с образованием целевого продукта.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf= 0,56. FD-MS: М+ = 599.
Пример 4.
(2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензил] -N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,271 г (0,406 ммоль) (2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)- бензоил]-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,061 г (1,23 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,21. FD-MS: М+ = 571.
Исходное соединение для получения указанного продукта получают следующим образом:
а) (2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил] -N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
К раствору 200 мг (467 ммоль) (2R*,4S*)-2-бензил-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина и 113 мг (561 ммоль) 3,5-бис-(трифторметил)-бензойной кислоты в 3 мл метиленхлорида добавляют 143 мг (561 ммоль) хлорангидрида бис-(2-оксо-3- оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина и перемешивают реакционную смесь в течение 16 ч при комнатной температуре.
После этого ее разбавляют метиленхлоридом и органическую фазу по разу промывают 10%-ной лимонной кислотой, 1N раствором гидрокарбоната натрия и рассолом, высушивают над сульфатом магния и упаривают досуха.
Желтоватую пену подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 1000: 50: 1. В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,34. FD-MS: М+ = 667.
Пример 5.
(2R*, 4S*)-2-бензил-1-(3,5-диметоксибензоил)-N-(4- хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 250 мг (0,423 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-диметоксибензоил)-N-(4-хинолилметил) -N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 64 мг (1,69 ммоль) натрийборгидрида. В результате получают целевое соединение формулы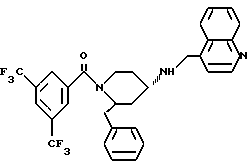
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,23. DCI-MS: (М+Н)+ = 496.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3,5-диметоксибензоил)-N-(4-хинолилметил) -N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 200 мг (0,467 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил) -N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 102 мг (0,561 ммоль) 3,5-диметоксибензойной кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,31. FD-MS: М+ = 591.
Пример 6.
(2R*,4S*)-2-бензил-1-(1-нафтоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 200 мг (0,344 ммоль) (2R*, 4S*)-2-бензил-1-(1-нафтоил)-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 52 мг (1,37 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,35. FD-MS: М+ = 485.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(1-нафтоил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
К раствору 96 мг (0,561 ммоль) 1-нафтойной кислоты в 2 мл сухого метиленхлорида добавляют при 0oC 92 мкл (0,655 ммоль) 1-хлор-N,N-2-триметил-1-пропен-1-амина и перемешивают смесь в течение часа при 0oC еще час при комнатной температуре.
К образовавшемуся желтому раствору добавляют затем раствор 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетилпиперидинамина и 130 мкл (0,936 ммоль) триэтиламина в 3 мл метиленхлорида в течение 10 мин, по каплям, при комнатной температуре. После перемешивания в течение 3 ч при комнатной температуре добавляют воду, органическую фазу отделяют и еще дважды промывают ее водой. Органические фазы высушивают над сульфатом магния и упаривают досуха. Желтую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 800:50:1- В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,49. FD-MS: М+ = 581.
Пример 7.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 1,21 г (2,01 ммоль) (2R*, 4S*)-2-бензил-1-(3,5- дихлорбензоил)-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,305 мг (8,06 ммоль) натрийборгидрида. В результате получают целевое соединение формулы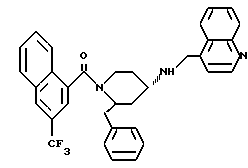
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,37. FD-MS: М+ = 503.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил) -N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2j, 1,11 г (5,85 ммоль) дихлорбензойной кислоты подвергают взаимодействию вначале с 0,63 мл (8,77 ммоль) тионилхлорида, а затем с 1 г (2,34 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина с образованием в результате целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,65. FD-MS: М+ = 599.
Пример 8.
(2R*,4S*)-2-бензил-1-(2-хинолилкарбонил)-N-(4-хинолилметил)- 4-пиперидинамин
Таким же образом, как это описано в примере 2, 155 мг (0,266 ммоль) (2R*, 4S*)-2-бензил-1-(2-хинолилкарбонил)-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 40 мг (1,06 ммоль) натрйборгидрида. В результате получают целевое соединение формулы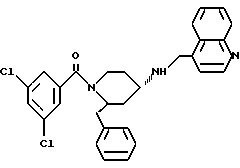
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,42. FD-MS: М+ = 486.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2-хинолиноил)-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2j, 97 мг (0,56 моль) хинолин-2-карбоновой кислоты подвергают взаимодействию вначале с 58 мкл (0,795 ммоль) тионилхлорида, а затем с 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина, получая в результате целевое соединение.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,45. FD-MS: М+ = 582.
Пример 9.
(2R*, 4S*)-2-бензил-1-(4-хлорфенилацетил)-N-(4- хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 256 мг (0,441 ммоль) (2R*, 4S*)-2-бензил-1-(4-хлорфенилацетил) -N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 66 мг (1,76 ммоль) натрийборгидрида. В результате получают целевое соединение формулы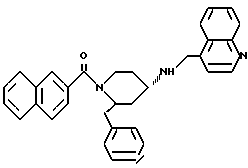
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf= 0,48. FD-MS: М+ = 484.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(4-хлорфенилацетил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2j, 96 мг (0,56 ммоль) 4- хлорфенилуксусной кислоты подвергают взаимодействию вначале с 58 мкл (0,795 ммоль) тионилхлорида, а затем с 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4- пиперидинамина с образованием в результате целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,39. FD-MS: М+ = 580.
Пример 10.
(2R*, 4S*)-2-бензил-1-(бензилоксикарбонил)-N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 80 мг (0,142 ммоль) (2R*, 4S*)-2-бензил-1-(бензилоксикарбонил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 22 мг (0,57 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде бесцветной маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf= 0,43. FD-MS: М+ = 465.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(бензилоксикарбонил)- N-(4-хинолилметил)-4-пиперидинамин
К раствору 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина в 4 мл метиленхлорида добавляют при 0oC 67 мкл (0,468 ммоль) бензилового эфира хлормуравьиной кислоты и 72 мкл (0,515 ммоль) триэтиламина и перемешивают смесь при этой температуре в течение 16 ч. После этого к ней добавляют еще 34 мкл (0,234 ммоль) бензилового эфира хлормуравьиной кислоты и 36 мкл (0,257 ммоль) триэтиламина и перемешивают в течение 3 ч при комнатной температуре. Затем ее разбавляют метиленхлоридом и органическую фазу промывают рассолом, высушивают над сульфатом магния и упаривают досуха. Маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента метиленхлорид/метанол/концентрированный аммиак (1000: 50:1). В результате получают целевое соединение в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,61. FD-MS: М+ = 561.
Пример 11.
(2R*,4S*)-2-бензил-1-(2-фенилэтил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 215 мг (0,494 ммоль) (2R*,4S*)-2-бензил-1-(2-фенилэтил)-N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина подвергают взаимодействию с 77 мг (1,97 ммоль) натрийборгидрида. В результате получают целевое соединение формулы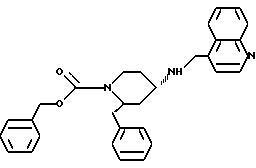
в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,34. FD-MS: М+ = 435.
Исходное соединение для получения указанного продукта получают следующим образом:
а) (2R*, 4S*)-2-бензил-1-(2-фенилэтил)-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
209 мкл (0,936 ммоль) фенилацетальдегида добавляют по каплям в течение 10 мин при комнатной температуре к раствору 100 мг (0,233 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина, 58 мг (0,702 ммоль) ацетата натрия, 44 мг (0,702 ммоль) натрийцианборгидрида и 67 мкл (1,17 ммоль) уксусной кислоты в 2 мл этанола. Реакционную смесь перемешивают в течение 16 ч при комнатной температуре. После упаривания в ротационном выпарном аппарате остаток растворяют в этилацетате, органическую фазу промывают водой и рассолом, высушивают над сульфатом магния и упаривают досуха.
Желтую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 2000:50:1. В результате получают целевое соединение в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf = 0,33. FD-MS: М+ = 531.
Пример 12.
(2R*,4S*)-2-бензил-1-(2-нафтилацетил)-N-(4-хинолилметил)-4- пиперидинамин
Таким же образом, как это описано в примере 2, 160 мг (0,269 ммоль) (2R*, 4S*)-2-бензил-1-(2-нафтилацетил)-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 42 мг (1,13 ммоль) натрийборгидрида. В результате получают целевое соединение формулы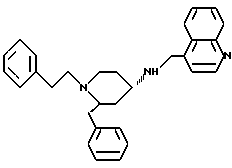
в виде бесцветной маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,27. FD-MS: М+ = 499.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2-нафтилацетил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 6, 105 мг (0,561 ммоль) нафтилуксусной кислоты подвергают взаимодействию вначале с 92 мкл (0,655 ммоль) 1-хлор-N,N-2-триметил-1-пропен-1-амина, а затем с 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4- пиперидинаминаи и 130 мкл (0,936 ммоль) триэтиламина с образованием в результате целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,56. FD-MS: М+ = 595.
Пример 13.
(2R*, 4S*)-2-бензил-1-(4-хинолилметил)-N-(4-хинолилметил)-4- пиперидинамин
Таким же образом, как это описано в примере 2, 128 мг (0,225 ммоль) (2R*, 4S*)-2-бензил-1-(4-хинолилметил)-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 34 мг (0,872 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,45. FD-MS: М+ = 490.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(4-хинолилметил)-N-(4-хинолилметил) -N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 11, 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 88 мг (1,4 ммоль) натрийцианборгидрида, 115 мг (1,4 ммоль) ацетата натрия, 134 мкл (2,34 ммоль) уксусной кислоты и 294 мг (1,87 ммоль) хинолин-4-карбоксальдегида с образованием целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,33. FD-MS: М+ = 568.
Пример 14.
(2R*,4S*)-2-бензил-1-(2,4-дихлорбензил)-N-(4-хинолилметил)-4- пиперидинамин
Таким же образом, как это описано в примере 2, 128 мг (0,218 ммоль) (2R*, 4S*)-2-бензил-1-(2,4-дихлорбензил)-N-(4-хинолилметил) -N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 34 мг (0,920 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,25. FD-MS: М+ = 472.
Исходное соединение для получения указанного продукта получают следующим образом:
(а) (2R*, 4S*)-2-бензил-1-(4-хинолилметил)-N-(4-хинолилметил) -N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 11, 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 88 мг (1,4 ммоль) натрийцианборгидрида, 115 мг (1,4 ммоль) ацетата натрия, 134 мкл (2,34 ммоль) уксусной кислоты и 294 мг (1,87 ммоль) хинолин-4- карбоксальдегида с образованием целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,33. FD-MS: М+ = 568.
Пример 15.
(2R*, 4S*)-2-бензил-1-(2,2-дифенилэтил)-N-(4-хинолилметил) -4-пиперидинамин
Таким же образом, как это описано в примере 2, 170 мг (0,280 ммоль) (2R*, 4S*)-2-бензил-1-(2,2-дифенилэтил)-N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина подвергают взаимодействию с 42 мг (1,12 ммоль) натрийборгидрида. В результате получают целевое соединение формулы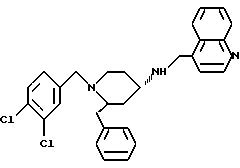
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,28. FD-MS: М+ = 511.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2,2-дифенилэтил)-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 11, 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина подвергают взаимодействию с 88 мг (1,4 ммоль) натрийцианборгидрида, 115 мг (1,4 ммоль) ацетата натрия, 134 мкл (2,34 ммоль) уксусной кислоты и 335 мкл (1,87 ммоль) дифенилацетальдегида с образованием целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf = 0,50. FD-MS: М+ = 607.
Пример 16.
(2R*,4S*)-2-бензил-1-(фенилкарбамоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 210 мг (0,384 ммоль) (2R*, 4S*)-2-бензил-1-(фенилкарбамоил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 58 мг (1,54 ммоль) натрийборгидрида. В результате получают целевое соединение формулы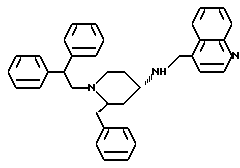
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1), Rf = 0,33. FD-МS: М+ = 450.
Исходное соединение для получения указанного продукта получают следующим образом:
(а) (2R*, 4S*)-2-бензил-1-(фенилкарбамоил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
К раствору 72 мг (0,608 ммоль) фенилизоцианата в 5 мл толуола добавляют раствор 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина и перемешивают реакционную смесь 2 ч при 100oC.
Белую суспензию охлаждают и фильтруют. В результате получают целевое соединение в виде белых кристаллов с температурой плавления 245oC (с разложением).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,76. FD-MS: М+ = 546.
Пример 17.
(2R*,4S*)-2-бензил-1-(дифенилацетил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 235 мг (0,387 ммоль) (2R*, 4S*)-2-бензил-1-(дифенилацетил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 58 мг (1,51 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,49. FD-MS: М+ = 525.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(дифенилацетил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2j, 248 мг (1,17 ммоль) дифенилуксусной кислоты подвергают взаимодействию вначале с 128 мкл (1,76 ммоль) тионилхлорида, а затем с 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина с образованием целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,45. FD-MS: М+ = 621.
Пример 18.
(2R*, 4S*)-2-бензил-1-(2-пиридилацетил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 180 мг (0,329 ммоль) (2R*, 4S*)-2-бензил-1-(2-пиридилацетил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 50 мг (1,32 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,28. FD-MS: М+ = 450.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2-пиридилацетил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 200 мг (0,467 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 98 мг (0,561 ммоль) гидрохлорида 2-пиридилуксусной кислоты, 143 мг (0,562 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 209 мкл (1,50 ммоль) триэтиламина. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf= 0,60. FD-MS: М+ = 546.
Пример 19.
(2R*, 4S*)-2-бензил-1-(4-пиридилацетил)-N-(4-хинолилметил)- 4-пиперидинамин
Таким же образом, как это описано в примере 2, 200 мг (0,366 ммоль) (2R*, 4S*)-2-бензил-1-(4-пиридилацетил)-N-(4- хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 55 мг (1,46 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf= 0,31. FD-MS: М+ = 450.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(4-пиридилацетил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 98 мг (0,561 ммоль) гидрохлорида 4-пиридилуксусной кислоты, 143 мг (0,562 ммоль) хлорангидрида бис-(2- оксо-3-оксазолидинил)-фосфиновой кислоты и 209 мкл (1,50 ммоль) триэтиламина. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf= 0,56. FD-MS: М+ = 546.
Пример 20.
(2R*, 4S*)-2-бензил-1-(2,3-дифенилпропионил)-N-(4-хинолилметил) -4-пиперидинамин
Таким же образом, как это описано в примере 2, 340 мг (0,535 ммоль) (2R*, 4S*)-2-бензил-1-(2,3-дифенилпропионил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 81 мг (2,14 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,37. FD-MS: М+ = 539.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2,3-дифенилпропионил)-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 300 мг (0,702 ммоль) (2R*, 4S*)- 2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 190 мг (0,842 ммоль) (R,S)-2,3- дифенилпропионовой кислоты, 214 мг (0,842 ммоль) хлорангидрида бис- (2-оксо-3-оксазолидинил)-пропионовой кислоты и 216 мкл (1,54 ммоль) триэтиламина. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,74. FD- MS: М+ = 635.
Пример 21.
(2R*, 4S*)-2-бензил-1-[(3S)-(2,3,4,9-тетрагидро-1Н-пиридо [3,4-b]индол-3-ил)карбонил]-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как описано в примере 2, 197 мг (0,315 ммоль) смеси диастереоизомеров (2R*, 4S*)-2-бензил-1- [(3S)-(2,3,4,9-тетрагидро-1Н-пиридо[3,4-b] индол-3-ил)карбонил] -N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 48 мг (1,26 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,50. FD-MS: M+ = 529.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[(3S)-(2,3,4,9-тетрагидро- 1Н-пиридо [3,4-b] индол-3-ил)карбонил]-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
К раствору 338 мг (0,399 ммоль) (2R*,4S*)-2-бензил-1-[(3S)-[2-(9-флуоренилметилоксикарбонил)-2,3,4,9- тетрагидро-1Н-пиридо[3,4-b] индол-3-ил)-карбонил] -N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина в 3 мл N,N-диметилформамида добавляют 1,97 мл (19,9 ммоль) пиперидина и перемешивают смесь в течение 2 ч при комнатной температуре. Затем ее упаривают в ротационном выпарном аппарате и остаток для разделения диастереоизомеров подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 2000:50:1.
Тонкослойная хроматография: метиленхлорид/метанол /концентрированный аммиак (700:50:1).
Диастереоизомер A: Rf = 0,21. FD-MS: M+ = 625.
Диастереоизомер B: Rf = 0,13. FD-MS: M+ = 625.
Пример 22.
(2R*, 4S*)-2-бензил-1-(3-метоксибензоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 230 мг (0,409 ммоль) (2R*, 4S*)-2-бензил-1-(3-метоксибензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 81 мг (2,14 ммоль) натрийборгидрида. В результате получают целевое соединение формулы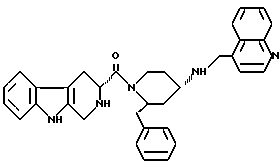
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,26. FD-MS: M+ = 465.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3-метоксибензоил)-N-(4-хинолилметил)-N -трифторметилацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина подвергают взаимодействию с 85 мг (0,561 ммоль) 3-метоксибензойной кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,45. FD-MS: M+ = 561.
Пример 23.
(2R*, 4S*)-2-бензил-1-(3-N, N-диметиламинобензоил)-N-(4-хинолилметил)- 4-пиперидинамин
Таким же образом, как это описано в примере 2, 225 мг (0,391 ммоль) (2R*, 4S*)-2-бензил-1-(3-N, N-диметиламинобензоил)-N-(4-хинолилметил)- N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 59 мг (1,56 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,36. FD-MS: M+ = 478.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3-N, N-диметиламинобензоил)-N-(4-хинолилметил)- N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 93 мг (0,561 ммоль) 3-N,N-диметиламино-бензойной кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,65. FD-MS: M+ = 574.
Пример 24.
(2R*, 4S*)-2-бензил-1-(цис, цис-3,5-диметилциклогексилкарбонил)-N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 195 мг (0,345 ммоль) (2R*, 4S*)-2-бензил-1-(цис,цис-3,5-диметилциклогексилкарбонил)-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 52 мг (1,38 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,24. FD-MS: M+ = 469.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(цис, цис-3,5-диметилциклогексилкарбонил)-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 87 мг (0,561 ммоль) цис,цис-3,5-диметилциклогексилкарбоновой кислоты (полученной по методу H. Van Beekum et al., Koninkl. Ned. Akad. Wetenschap, Proc. Ser. B. 64, 161 /1961/), 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,32. FD-MS: M+ = 565.
Пример 25.
(2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензил] -N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 280 мг (28 ммоль) (2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 65 мг (1,71 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,35. FD-MS: M+ = 557.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензил] -N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Перемешивают в течение 17 ч при 60oC смесь 129 мкл (0,702 ммоль) 3,5-бис-(трифторметил)-бензилбромида, 194 мг (1,40 ммоль) карбоната калия и 300 мг (0,702 ммоль) (2R*,4S*)-2-бензил-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина в 3 мл N,N-диметилформамида. После этого суспензию фильтруют, хорошо промывают ацетоном и фильтрат упаривают в ротационном выпарном аппарате. Остаток растворяют в метиленхлориде и промывают последовательно 10%-ным водным раствором лимонной кислоты, 1н. раствором гидрокарбоната натрия, водой и рассолом и высушивают над сульфатом магния. Желтую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении (3000:50:1). В результате получают целевое соединение в виде желтой маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (3000:50:1); Rf = 0,36. FD-MS: M+ = 653.
Пример 26.
(2R*, 4S*)-2-бензил-1-[2-(5-хлор-1Н-1,2,4-триазол-1-ил)-феноксиэтил] -N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 100 мг (0,54 ммоль) (2R*, 4S*)-2-бензил-1-[2-(5-хлор-1Н-1,2,4-триазол-1-ил)-феноксиэтил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 23 мг (0,62 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,23. FD-MS: M+ = 553.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[2-(5-хлор-1Н-1,2,4-триазол-1-ил)-феноксиэтил]-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 24, 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 141 мг (0,468 ммоль) 2-[5-хлор-(1Н-1,2,4-триазол-1-ил)фенокси] -этилбромида и 129 мг (0,936 ммоль) карбоната калия. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,23. FD-MS: M+ = 649.
Пример 27.
Диастереоизомер A (2R*, 4S*)-2-бензил-1-[(S)-фенилаланил] -N- (4-хинолилметил)-4-пиперидинамина
Таким же образом, как это описано в примере 2, 112 мг (0,195 ммоль) диастереоизомера A (2R*, 4S*)-2-бензил-1-[(S)-фенилаланил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 30 мг (0,801 ммоль) натрийборгидрида. В результате получают целевое соединение формулы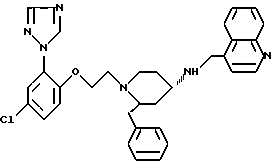
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,21. FD-MS: M+ = 478.
Исходное соединение для получения указанного продукта получают следующим образом:
a) (2R*,4S*)-2-бензил-1-[(S)-N-трет.-бутоксикарбонилфенилаланил]-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4, 300 мг (0,702 ммоль) (2R*, 4S*)-2-бензил-М-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина подвергают взаимодействию с 223 мг (0,842 ммоль) (S)-N-трет.-бутоксикарбонилфенилаланина, 214 мг (0,842 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 215 мкл (1,54 ммоль) триэтиламина. В результате получают целевое соединение в виде желтой маслянистой жидкости, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1), Rf = 0,37. FD-MS: M+ = 674.
b) Диастереоизомеры (2R*,4S*)-2-бензил-1-[(S)-фенилаланил]-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина
К 920 мг (1,36 ммоль) (2R*,4S*)-2-бензил-1-[(S)-N-трет.- бутоксикарбонилфенилаланил]-N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина добавляют 3,1 мл (4,09 ммоль) трифторуксусной кислоты и перемешивают реакционную смесь в течение 2 ч при комнатной температуре. Затем ее упаривают в ротационном выпарном аппарате, остаток растворяют в воде, подщелачивают при 0oC 1н. раствором гидрокарбоната натрия и подвергают экстракции метиленхлоридом. Органические фазы промывают рассолом, высушивают над сульфатом магния и упаривают досуха. Остаток для разделения смеси диастереоизомеров подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 2500:50:1.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1):
Диастереоизомер A: Rf = 0,24. FD-MS: M+ = 574.
Диастереоизомер B: Rf = 0,22. FD-MS: M+ = 574.
Смешанные фракции диастереоизомеров A и B не разделяли.
Пример 28.
Диастереоизомер B (2R*, 4S*)-2-бензил-1-[(S)-фенилаланил] -N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 115 мг (0,200 ммоль) диастереоизомера B (2R*, 4S*)-2-бензил-1-[(S)-фенилаланил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 30 мг (0,801 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,20. FD-MS: M+ = 478.
Получение исходного соединения см. в примере 27a.
Пример 29.
Диастереоизомер A (2R*, 4S*)-2-бензил-1-[(R)-фенилаланил] -N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 174 мг (0,303 ммоль) диастереоизомера A (2R*, 4S*)-2-бензил-1-[(R)-фенилаланил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 46 мг (1,211 ммоль) натрийборгидрида. В результате получают целевое соединение формулы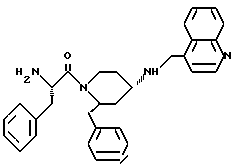
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,28. FD-MS: M+ = 478.
Исходные соединения для получения указанного продукта получают следующим образом:
Диастереоизомеры (2R*, 4S*)-2-бензил-1-[(R)-фенилаланил]-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 27b, 1,10 г (1,63 ммоль) (2R*,4S*)-2-бензил-1-[(R)-N-трет.-бутоксикарбонилфенилаланил]-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина обрабатывают 3,8 мл (48,8 ммоль) трифторуксусной кислоты. В результате получают диастереоизомеры целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1);
Диастереоизомер A: Rf = 0,52. FD-MS: M+ = 574.
Диастереоизомер B: Rf = 0,50. FD-MS: M+ = 574.
Смешанные фракции диастереоизомеров A и B не разделяли.
Пример 30.
Диастереоизомер B (2R*,4S*)-2-бензоил-1-[(R)-фенилаланил]-N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 92 мг (0,160 ммоль) диастереоизомера B (2R*, 4S*)-2-бензоил-1-[(R)-фенилаланил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 25 мг (0,640 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,49. FD-MS: M+ = 478.
Получение исходного соединения см. в примере 27a.
Пример 31.
(2R*, 4S*)-2-бензил-1-[(3)-N-ацетил-фенилаланил]-N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 160 мг (0,259 ммоль) смеси диастереоизомеров (2R*, 4S*)-2-бензил-1-[(S)-N-ацетил- фенилаланил]-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 39 мг (1,04 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,22. FD-MS: M+ = 520.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[(S)-N-ацетилфенилаланил] -N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
К раствору 180 мг (0,313 ммоль) смеси диастереоизомеров (2R*,4S*)-2-бензил-1-[(S)-фенилаланил] -N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина в 2 мл пиридина добавляют при 0oC 35 мкл (0,376 ммоль) уксусного ангидрида и перемешивают смесь в течение 2,5 ч при 0oC. После упаривания в ротационном выпарном аппарате маслянистый остаток растворяют в метиленхлориде и промывают водным раствором лимонной кислоты и 1н. раствором гидрокарбоната натрия. Органические фазы высушивают над сульфатом магния и упаривают досуха. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,39. FD-MS: M+ = 616.
Пример 32.
(2R*, 4S*)-2-бензил-1-[(R)-N-ацетилфенилаланил] -N-(4-хинолилметил)-4- пиперидинамин
Таким же образом, как это описано в примере 2, 185 мг (0,411 ммоль) смеси диастереоизомеров (2R*,4S*)-2-бензил-1-[(R)-N-ацетилфенилаланил] -N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 62 мг (1,64 ммоль) натрийборгидрида. В результате получают целевое соединение формулы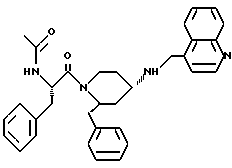
в виде белой пены, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,42. FD-MS: M+ = 520.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[(R)-N-ацетилфенилаланил] -N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 31, 200 мг (0,348 ммоль) смеси диастереоизомеров (2R*,4S*)-2-бензил-1-[(R)-фенилаланил]-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 39 мг (0,417 ммоль) уксусного ангидрида. В результате получают целевое соединение в виде смеси диастереоизомеров (белая пена).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,28. FD-MS: M+ = 616.
Пример 33.
(2R*, 4S*)-2-бензил-1-[(S)-N-(4-карбоксамидо-бутирол)-фенилаланил] -N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 152 мг (0,221 ммоль) смеси диастереоизомеров (2R*, 4S*)-2-бензил-1-[(S)-N- (4-карбоксамидо-бутироил)-фенилаланил] -N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина подвергают взаимодействию с 34 мг (0,88 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,50. FD-MS: M+ = 591.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[(S)-N-(4-карбоксамидо-бутироил)-фенилаланил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
К раствору 200 мг (0,348 ммоль) смеси диастереоизомеров (2R*,4S*)-2-бензил-1-[(S)-фенилаланил] -N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина в 2 мл метиленхлорида добавляют при 0oC 179 мкл (1,04 ммоль) диизопропилэтиламина и 108 мг (0,348 ммоль) амида моно-2,4,5-трихлорфенилового эфира глутаровой кислоты и перемешивают белую суспензию в течение 2 ч при 0oC и в течение 16 ч при комнатной температуре. После упаривания образующегося в результате реакции бесцветного раствора в ротационном выпарном аппарате остаток в виде маслянистой жидкости растворяют в метиленхлориде и промывают 5%-ным водным раствором лимонной кислоты и 1N раствором гидрокарбоната натрия.
Органические фазы высушивают над сульфатом магния и упаривают досуха. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,13. FD-MS: M+ = 687.
Пример 34.
(2R*, 4S*)-2-бензил-1-[(R)-N-(4-карбоксамидо-бутироил)-фенилаланил] -N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 210 мг (0,305 ммоль) смеси диастереоизомеров (2R*, 4S*)-2-бензил-1-[(R)-N- (4-карбоксамидо-бутироил)-фенилаланил] -N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 46 мг (1,22 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,56. FD-MS: M+ = 591.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[(R)-N-(4-карбоксамидо-бутироил)-фенилаланил] -N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 33, 222 мг (0,386 ммоль) смеси диастереоизомеров (2R*,4S*)-2-бензил-1-[(R)-фенилаланил]-N- (4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 198 мкл (1,16 ммоль) диизопропилэтиламина и 120 мг (0,386 ммоль) амида моно-2,4,5-трихлорфенилового эфира глутаровой кислоты. В результате получают целевое соединение в виде белой пены, представляющее собой смесь диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,38. FD-MS: M+ = 687.
Пример 35.
(2R*,4S*)-2-бензил-1-бензоил-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 234 мг (0,440 ммоль) (2R*, 4S*)-2-бензил-1-бензоил-N-(4-хинолилметил)-N-трифторацетил -4-пиперидинамина подвергают взаимодействию с 67 мг (1,76 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,33. FD-MS: M+ = 435.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-бензоил-N-(4-хинолилметил)-N-трифторацетил-4- пиперидинамин
К раствору 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина в 4 мл метиленхлорида добавляют при 0oC 72 мкл (0,515 ммоль) триэтиламина и 54 мкл (0,468 ммоль) бензоилхлорида. Реакционную смесь перемешивают в течение 3 ч при 0oC, затем смешивают ее с водой и подвергают экстракции метиленхлоридом.
Органические фазы высушивают над сульфатом магния и упаривают досуха. Желтую маслянистую жидкость подвергают хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 1000:50:1. В результате получают целевое соединение в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1), Rf = 0,72. FD-MS: M+ = 531.
Пример 36.
(2R*,4S*)-2-бензил-1-(3-хлорбензоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 254 мг (0,449 ммоль) (2R*, 4S*)-2-бензил-1-(3-хлорбензоил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 68 мг (1,80 ммоль) натрийборгидрида. В результате получают целевое соединение формулы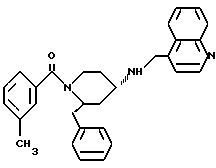
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,29. FD-MS: M+ = 470.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(4-хлорбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 35, 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 72 мкл (0,515 ммоль) триэтиламина и 60 мкл (0,468 ммоль) хлорбензоилхлорида с образованием целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,71. FD-MS: M+ = 566.
Пример 37.
(2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилметил)-N- (3-карбоксамидопропионил)-4-пиперидинамин
К раствору 181 мг (0,299 ммоль) (2R*,4S*)-2-бензил-1-(3,5- дихлорбензоил)-N-(4-хинолилметил)-N-(3-карбоксамидопропионил)-4- пиперидинамина в 2 мл тетрагидрофурана добавляют 92 мг (0,99 ммоль) 1-оксибензотриазола и 138 мг (0,899 ммоль) N,N-дициклогексилкарбодиимида, перемешивают смесь в течение получаса при комнатной температуре, добавляют к ней 2,1 мл (15 ммоль) 7М раствора аммиака в этаноле и перемешивают в течение 36 ч при комнатной температуре. После этого ее упаривают в ротационном выпарном аппарате, суспендируют остаток в смеси метиленхлорида и эфира (1:1) и фильтруют белую суспензию. Фильтрат упаривают в ротационном выпарном аппарате, и желтую маслянистую жидкость хроматографируют на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 1000:50:1.
В результате получают целевое соединение формулы
в виде белого твердого вещества.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,23. FD-MS: M+ = 602, 604.
В качестве побочного продукта при хроматографии получают (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилметил)-N -(3-N-циклогексил-карбамидопропионил)-4-пиперидинамин.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,40. FD-MS: M+ = 684, 686.
Пример 38.
(2R, 4S)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил)-N- (4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 3,35 г (7,78 ммоль) (2R, 4S)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил)-4-пиперидинамина подвергают взаимодействию с 1,34 г (8,56 ммоль) хинолин-4-карбоксальдегида и 1,3 г сульфата магния в 30 мл толуола, а затем восстанавливают полученное соединение 324 мг (8,56 ммоль) натрийборгидрида в 25 мл метанола. В результате получают целевое соединение формулы
(3,5 г, 79%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,21. FD-MS: M+ = 571.  = +0,7 (с=1, MeOH), ИК: 1635 см-1
= +0,7 (с=1, MeOH), ИК: 1635 см-1
Исходное соединение для получения указанного продукта получают следующим образом:
a) (2R,4S)-2-бензил-1-трет.-бутоксикарбонил-4-оксипиперидин
К раствору 26,9 г (92,3 ммоль) (2R*,4S*)-2-бензил-1- трет.-бутоксикарбонил-4-оксипиперидина в 200 мл пиридина добавляют при 0oC 24 г (111 ммоль) хлорангидрида (-)-камфановой кислоты и образующуюся гетерогенную смесь перемешивают в течение 2 ч при 0oC затем в течение 16 ч при комнатной температуре. После упаривания в ротационном выпарном аппарате реакционную смесь растворяют в метиленхлориде, дважды промывают 10%- ной лимонной кислотой, 1 раз водой и 1 раз рассолом, высушивают над сульфатом магния и упаривают в ротационном выпарном аппарате. В результате получают 47,8 г смеси диастереоизомеров эфира камфановой кислоты в виде оранжевой маслянистой жидкости. Диастереоизомер A: Rf = 0,52. Диастереоизомер B: Rf = 0,47. Эту смесь хроматографируют на силикагеле, используя в качестве элюента смесь толуола и этилацетата в соотношении 9:1, и диастереоизомерные эфиры кристаллизуют из гексана.
В результате получают диастереоизомер A в виде белых кристаллов (14,2 г, 33%) с температурой плавления 114-115oC и диастереоизомер B в виде белых кристаллов (15,3 г, 35%) с температурой плавления 138-139oC.
Раствор диастереоизомера B в 300 мл метанола смешивают с 130 мл 0,5 раствора едкого натра и перемешивают реакционную смесь при комнатной температуре в течение 18 ч. После упаривания в ротационном выпарном аппарате реакционную смесь растворяют в метиленхлориде, промывают водой и рассолом, высушивают над сульфатом магния и упаривают в ротационном выпарном аппарате. В результате получают целевое соединение в виде желтой маслянистой жидкости (9,3 г, 98%).
Тонкослойная хроматография: толуол/этилацетат (7:3); Rf = 0,34. FD-MS: M+ = 291. [α]D = + 32oC (с=1, метанол).
b) (2R,4S)-2-бензил-1-трет.-бутоксикарбонил-4-(метилсульфонилокси)- пиперидин
Таким же образом, как это описано в примере 2d, 9,3 г (32 ммоль) (2R, 4S)-2-бензил-1-трет.-бутоксикарбонил-4-оксипиперидина подвергают взаимодействию с 5 мл (63,8 ммоль) хлорангидрида метансульфоновой кислоты в 10 мл пиридина. В результате получают целевое соединение (11 г, 93%) в виде бесцветных игольчатых кристаллов. Температура плавления 137oC.
Тонкослойная хроматография: толуол/этилацетат (4:1); Rf = 0,42.
[α]D = +21oC (с=1, MeOH).
c) (2R,4S)-2-бензил-1-трет.-бутоксикарбонил-4-пиперидиназид
Таким же образом, как это описано в примере 2e, 10,9 г (29,6 ммоль) (2R, 4S)-2-бензил-1-трет. -бутоксикарбонил-4-(метилсульфонилокси)- пиперидина подвергают взаимодействию с 1,6 г (32,6 ммоль) азида лития в 60 мл N,N-диметилформамида. В результате получают целевое соединение в смеси с 2-бензил-N-трет. -бутоксикарбонил-1,2,5,6- тетрагидропиридином (9,2 г, в весовом соотношении по данным ЯМР 4,7:1), который уже невозможно отделить.
Тонкослойная хроматография: толуол/этилацетат (9:1); Rf = 0,59.
d) (2R,4S)-2-бензил-4-пиперидиназид
Смесь, полученную в примере 38c (расчетное содержание (2R,4S)-2-бензил-1-трет. -бутоксикарбонил-4-пиперидиназида), 7,58 г (80%), смешивают с 36 мл трифторуксусной кислоты и перемешивают смесь 90 минут при комнатной температуре.
После этого ее упаривают в ротационном выпарном аппарате, остаток растворяют в метиленхлориде и промывают 2М раствором едкого натра. Органические фазы высушивают над сульфатом магния и упаривают досуха. Остаток хроматографируют на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 1000:50:1.
В результате получают целевое соединение в виде желтой маслянистой жидкости (4,7 г, 92%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,63. ИК: 1635 см-1, [α]D/ = -28o (с=1, метанол).
е) (2R,4S)-2-бензил-1-[3,5-бис-(трифторметил)бензоил]-4-пиперидиназид
Таким же образом, как это описано в примере 4a, 2,2 г (10,2 ммоль) (2R, 4S)-2-бензил-4-пиперидиназида подвергают взаимодействию с 2,5 г (12,2 ммоль) 3,5-бис-(трифторметил)-бензойной кислоты, 3,1 г (12,2 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 3,1 г (22,4 ммоль) триэтиламина. В результате получают целевое соединение (4,16 г, 90%) в виде желтой маслянистой жидкости.
Тонкослойная хроматография: толуол/этилацетат (9:1); Rf = 0,45. FD-MS: M+ = 456. [α]D = +5,1o (с=1, метанол).
f) (2R,4S)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил]-4-пиперидинамин
Таким же образом, как это описано в примере 2f, 4,1 г (9,0 ммоль) (2R, 4S)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил]-4-пиперидиназида гидрируют в присутствии 10% Pd/C. В результате получают целевое соединение (3,38 г, 87%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,47. FD-MS: M+ = 430.
[α]D = -3,0o (с = 1, метанол).
Пример 39.
Таким же образом, как это описано в примере 2g, 1,95 г (5,37 ммоль) (2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 0,93 г (5,90 ммоль) хинолин-4- карбоксальдегида и 0,9 г сульфата магния в 18 мл толуола и затем восстанавливают полученное соединение 233 мг (5,90 ммоль) натрийборгидрида в 18 мл метанола.
В результате получают целевое соединение формулы
[α]D
в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,35. FD-MS: M+ = 503.
 = -19o (c=1, MeOH). ИК: 1635, 1595, 1565 см-1.
= -19o (c=1, MeOH). ИК: 1635, 1595, 1565 см-1.
Исходное соединение для получения указанного продукта получают следующим образом:
a) (2R,4S)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидиназид
К раствору 2,4 г (11,1 ммоль) (2R,4S)-2-бензил-4-пиперидиназида и 2,2 мл (15,5 ммоль) триэтиламина в 35 мл метиленхлорида по каплям добавляют при 0oC раствор 2,8 г (13,3 ммоль) 3,5-дихлорбензоилхлорида. После перемешивания в течение 18 ч при 0oC смесь упаривают в ротационном выпарном аппарате, и остаток в виде желтой маслянистой жидкости распределяют между метиленхлоридом и водой. Органические фазы промывают рассолом, высушивают над сульфатом магния и упаривают досуха. Полученную маслянистую жидкость хроматографируют на силикагеле, используя в качестве элюента смесь толуола и этилацетата в соотношении 9: 1. В результате получают целевое соединение (4,04 г, 94%) в виде полукристаллической массы.
Тонкослойная хроматография: толуол/этилацетат (9:1); Rf = 0,51. FD-MS: M+ = 388, 390. [α]D = +33,4o (с=1, MeOH).
b) (2R,4S)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамин
Таким же образом, как это описано в примере 2f, 4,02 г (10,3 ммоль) (2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидиназида гидрируют на 10% Pd/C. В результате получают целевое соединение (1,97 г, 52%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,40. FD-MS: M+ = 362, 364. ИК: 3660, 3360, 1630 см-1.
[α]D = +22,7o (с=1, метанол).
Пример 40.
(2R*,4S*)-2-бензил-1-(2,4-дихлорбензоил)-N-(4-хинолилметил)- 4-пиперидинамин
Перемешивают в течение 18 ч при 0oC раствор 195 мг (0,325 ммоль) (2R*, 4S*)-2-бензил-1-(2,4-дихлорбензоил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина и 26 мг (0,649 ммоль) гидроксида натрия в 2 мл метанола и 2 мл тетрагидрофурана, после чего реакционную смесь упаривают, остаток растворяют в метиленхлориде, промывают водой и рассолом, органические фазы высушивают над сульфатом магния и упаривают досуха.
Желтую маслянистую жидкость хроматографируют на силикагеле, используя в качестве элюента смесь метиленхлорида, метанола и концентрированного аммиака в соотношении 800:50:1. В результате получают целевое соединение формулы
[α]D
(157 мг, 96%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,45. FD-MS: M+ = 503, 505.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2,4-дихлорбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 35a, 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 91 мкл (0,655 ммоль) триэтиламина и 78 мкл (0,561 ммоль) 2,4-дихлорбензоилхлорида с образованием целевого соединения (240 мг, 86%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,57. FD-MS: M+ = 599, 601.
Пример 41.
(2R*,4S*)-2-бензил-1-(фенилацетил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 40, 192 мг (0,352 ммоль) (2R*, 4S*)-2-бензил-1-(фенилацетил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 141 мкл (0,704 ммоль) 5N раствора едкого натра в 1 мл тетрагидрофурана и 1 мл метанола. В результате получают целевое соединение формулы
(73 мг, 46%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,43. FD-MS: M+ = 449.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(фенилацетил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 35а, 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 72 мкл (0,515 ммоль) триэтиламина и 62 мкл (0,468 ммоль) фенацетилхлорида с образованием целевого соединения (208 мг, 81%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,54. FD-MS: M+ = 545.
Пример 42.
(2R*,4S*)-2-бензил-1-(2,6-дихлорбензоил)-N-(4-хинолилметил)-4- пиперидинамин
Таким же образом, как это описано в примере 40, 138 мг (0,230 ммоль) (2R*, 4S*)-2-бензил-1-(2,6-дихлорбензоил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 18,4 мг (0,460 ммолл) гидроксида натрия в 1,5 мл тетрагидрофурана и 1,5 мл метанола. В результате получают целевое соединение формулы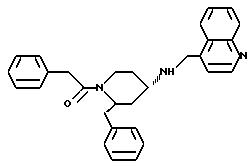
(56 мг, 48%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,50. FD-MS: M+ = 503, 505.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2,6-дихлорбензоил)-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 35а, 200 мг (0,468 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 91 мкл (0,655 ммоль) триэтиламина и 80 мкл (0,561 ммоль) 2,6-дихлорбензоилхлорида с образованием целевого соединения (158 мг, 56%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,63. FD-MS: M+ = 599, 601.
Пример 43.
(2R*, 4S*)-2-бензил-1-(3,5-дибромбензоил)-N-(4-хинолилметил)-4- пиперидинамин
Таким же образом, как это описано в примере 2, 0,166 г (0,241 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дибромбензоил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,037 г (0,96 ммоль) натрийборгидрида. В результате получают целевое соединение формулы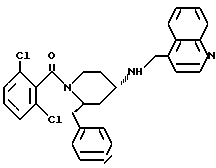
(0,094 г, 66%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,23. FD-MS: M+ = 591, 593, 595.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3,5-дибромбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2а, 197 мг (0,70 ммоль) 3,5-дибромбензойной кислоты (полученной по методу в соответствии с J. Organometallic Chem. 215, 281 /1981/) подвергают взаимодействию с 2 мл (27 ммоль) тионилхлорида, а затем с 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина и 130 мкл (0,936 ммоль) триэтиламина с образованием целевого соединения (168 мг, 52%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,60. FD-MS: M+ = 687, 689, 691.
Пример 44.
(2R*,4S*)-2-бензил-1-(9-флуореноил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,238 г (0,384 ммоль) (2R*, 4S*)-2-бензил-1-(9-флуореноил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,066 г (1,54 ммоль) натрийборгидрида. В результате получают целевое соединение формулы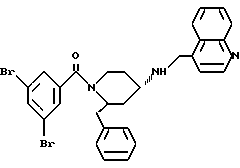
(0,155 г, 79%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,36. FD-MS: M+ = 523.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(9-флуореноил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4а, 200 мг (0,467 ммоль) (2R*, 4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-N-пиперидинамина подвергают взаимодействию с 78 мг (0,562 ммоль) 9-флуоренкарбоновой кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение (241 мг, 82%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,58. FD-MS: M+ = 619.
Пример 45.
(2R*,4S*)-2-бензил-1-(3-толуоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,251 г (0,460 ммоль) (2R*, 4S*)-2-бензил-1-(3-толуоил)-N-(4-хинолилметил)-N -трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,070 г (1,84 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
(0,172 г, 83%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,27. FD-MS: M+ = 449.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3-толуоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2a, 96 мг (0,70 ммоль) м-толуиловой кислоты подвергают взаимодействию вначале с 2 мл (27 ммоль) тионилхлорида, а затем с 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина и 118 мкл (0,842 ммоль) триэтиламина с образованием целевого соединения (251 мг, 98%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,51. FD-MS: M+ = 545.
Пример 46.
(2R*,4S*)-2-бензил-1-(3-бромбензоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,271 г (2R*,45*)-2-бензил-1-(3-бромбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,067 г (1,78 ммоль) натрийборгидрида.
В результате получают целевое соединение формулы
(0,212 г, 93%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,29. FD-MS: M+ = 513, 515.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*,4S*)-2-бензил-1-(3-бромбензоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2a, 141 мг (0,70 ммоль) м-бромбензойной кислоты подвергают взаимодействию вначале с 2 мл (27 ммоль) тионилхлорида, а затем с 200 мг (0,468 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина и 118 мкл (0,842 ммоль) триэтиламина с образованием целевого соединения (271 мг, 95%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,71. FD-MS: M+ = 609, 611.
Пример 47.
(2R*,4S*)-2-бензил-1-(3,5-диоксибензоил)-N-(4-хинолилметил)-4- пиперидинамин
Таким же образом, как это описано в примере 2, 0,097 г (0,172 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-диоксибензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,026 г (0,688 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
(0,023 г, 29%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,57. FD-MS: M+ = 467.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3,5-диоксибензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,467 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 87 мг (0,562 ммоль) 3,5-диоксибензойной кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение (99 мг, 38%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,41. FD-MS: M+ = 563.
Пример 48.
(2R*,4S*)-2-бензил-1-(3-цианбензоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,248 г (0,446 ммоль) (2R*, 4S*)-2-бензил-1-(3-цианбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,068 г (1,78 ммоль) натрийборгидрида. В результате получают целевое соединение формулы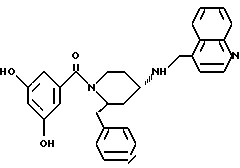
(0,157 г, 62%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,51. FD-MS: M+ = 460.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(3-цианбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,467 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 69 мг (0,514 ммоль) 3-цианобензойной кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение (250 мг, 96%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,53. FD-MS: M+ = 566.
Пример 49.
(2R*,4S*)-2-бензил-1-(2-хлорбензоил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,165 г (0,291 ммоль) (2R*, 4S*)-2-бензил-1-(2-хлорбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,044 г (1,16 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
(0,109 г, 80%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000: 50:1); Rf = 0,33. FD-MS: M+ = 469. ИК: 3680, 1640, 1605, 1580 см-1
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(2-хлорбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,467 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 88 мг (0,560 ммоль) 2-хлорбензойной кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение (179 мг, 68%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf = 0,42. FD-MS: M+ = 565, 567.
Пример 50.
Таким же образом, как это описано в примере 2, 0,202 г (0,291 ммоль) (2R*, 4S*)-2-бензил-1-(4-хлорбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,054 г (1,43 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
(0,136 г, 81%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000: 50:1); Rf = 0,17. FD-MS: M+ = 469, 471. ИК: 3675, 1625, 1595, 1570 см-1
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(4-хлорбензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,467 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 88 мг (0,560 ммоль) 4-хлорбензойной кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-З-оксазолидинил)-фосфиновой кислоты и 144 мкл (1,03 ммоль) триэтиламина. В результате получают целевое соединение (210 мг, 80%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,44. FD-MS: M+ = 565, 567.
Пример 51.
(2R*,4S*)-2-бензил-1-(9-флуоренил)-N-(4-хинолилметил)-4-пиперидинамин
Таким же образом, как это описано в примере 40, 130 мг (0,219 ммоль) (2R*, 4S*)-2-бензил-1-(9-флуоренил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 500 мкл (0,500 ммоль) 1N раствора едкого натра в 1 мл тетрагидрофурана и 1 мл метанола. В результате получают целевое соединение формулы
(49 мг, 45%) в виде белой пены.
Тонкослойная хроматография: толуол/этилацетат (1:1); Rf = 0,26.
FD-MS: M+ = 495.
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(9-флуоренил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 25a, 200 мг (0,467 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию со 138 мг (0,561 ммоль) 9-бромфлуорена и 155 мг (1,12 ммоль) карбоната калия в 2,5 мл ацетона. В результате получают целевое соединение (131 мг, 47%) в виде маслянистой жидкости.
Тонкослойная хроматография: толуол/этилацетат (1:1); Rf = 0,43. FD-MS: M+ = 591.
Пример 52.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилметил)-N-метил- 4-пиперидинамин
К раствору 150 мг (0,297 ммоль) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилметил)-4-пиперидинамина в 2 мл 1,2-диметоксиэтана добавляют при 0oC в один прием 13,4 мг (0,446 ммоль) 80%-ной суспензии гидрида натрия в минеральном масле (суспендированного в гексане и отделенного путем декантации). После перемешивания в течение 10 мин при 0oC и в течение 30 мин при комнатной температуре смесь снова охлаждают до 0oC и добавляют к ней 22 мкл (0,357 ммоль) метилиодида. После этого ее перемешивают в течение 96 ч при комнатной температуре, отгоняют растворитель в ротационном выпарном аппарате и хроматографируют остаток на силикагеле, используя в качестве элюента смесь толуола и этилацетата в соотношении 1:1. В результате получают целевое соединение формулы
(20 мг, 13%) в виде белой пены.
Тонкослойная хроматография: толуол/этилацетат (1:1); Rf = 0,45. FD-MS: M+ = 517, 519.
Пример 53.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилметил)-N- циклогексилкарбамоил-4-пиперидинамин
Таким же образом, как это описано в примере 16a, 200 мг (0,396 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилметил)-4- пиперидинамина подвергают взаимодействию с 66 мкл (0,515 ммоль) циклогексилизоцианата. В результате получают целевое соединение формулы
(165 мг, 66%) в виде белых кристаллов.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,44. FD-MS: M+ = 628, 630.
Пример 54.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилметил)-N- фенилкарбамоил-4-пиперидинамин
Таким же образом, как это описано в примере 16a, 200 мг (0,396 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N- (4-хинолилметил)-4-пиперидинамина подвергают взаимодействию с 45 мг (0,377 ммоль) фенилизоцианата. В результате получают целевое соединение формулы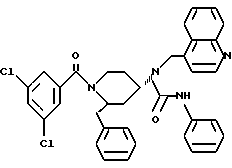
(129 мг, 52%) в виде твердого остатка.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,42. FD-MS: M+ = 622, 624.
Пример 55.
(2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-фенилэтил)-4-пиперидин
Таким же образом, как это описано в примере 2, 0,130 г (0,231 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-фенилэтил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,035 г (0,923 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
(0,101 г, 94%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); RfRf = 0,34. FD-MS: M+ = 466, 468.
Исходное соединение для получения указанного продукта получают следующим образом:
a) (2R*, 4S*)-2-бензил-1-трет.-бутоксикарбонил-N- (2-фенилэтил)-4-пиперидинамин
Таким же образом, как это описано в примере 11а, 1 г (3,44 ммоль) (2R*, 4S*)-2-бензил-1-трет.-бутоксикарбонил-4-пиперидинамина подвергают взаимодействию с 1 мл (4,48 ммоль) фенилацетилальдегида, 0,433 г (6,89 ммоль) натрийцианборгидрида, 0,791 г (9,64 ммоль) ацетата натрия и 434 мкл уксусной кислоты с образованием целевого соединения (805 мг, 60%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,35. FD-MS: M+ = 394.
b) (2R*,4S*)-2-бензил-1-трет.-бутоксикарбонил-N-(2-фенилэтил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2h, 618 мг (1,57 ммоль) (2R*, 4S*)-2-бензил-1-трет. -бутоксикарбонил-N- (4-хинолилметил)-4-пиперидинамина подвергают взаимодействию с 240 мкл (1,72 ммоль) ангидрида трифторуксусной кислоты и 284 мкл (2,04 ммоль) триэтиламина. В результате получают целевое соединение (572 мг, 75%) в виде белой пены.
Тонкослойная хроматография: толуол/этилацетат (9:1); Rf = 0,47. FD-MS: (M+H)+ = 491.
c) (2R*,4S*)-2-бензил-N-(2-фенилэтил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 38d, 615 мг (1,25 ммоль) (2R*, 4S*)-2-бензил-1-трет.-бутоксикарбонил-N-(2-фенилэтил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 1,9 мкл (25 ммоль) трифторуксусной кислоты. В результате получают целевое соединение (308 мг, 63%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,63. FD-MS: M+ = 390.
d) (2R*,4S*)-2-бензил-1-(3.5-дихлорбензоил)-N-(2-фенилэтил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 2a, 189 мг (0,992 ммоль) 3,5-дихлорбензойной кислоты подвергают взаимодействию вначале с 0,108 мл (1,49 ммоль) тионилхлорида, а затем со 155 мг (0,397 ммоль) (2R*,4S*)-2-бензил-N-(2-фенилэтил)-N-трифторацетил-4-пиперидинамина и 166 мкл (1,19 ммоль) триэтиламина с образованием целевого соединения (135 мг, 60%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,70. FD-MS: M+ = 562, 564.
Пример 56.
(2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил] -N- (2-фенилэтил)-4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,190 г (0,301 ммоль) (2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил] -N- (2-фенилэтил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,046 г (1,21 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
(0,123 г, 76%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,22. FD-MS: M+ = 534. ИК: 1630 см-1
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-[3,5-бис-(трифторметил)-бензоил] -N- (2-фенилэтил)-N-трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 150 мг (0,384 ммоль) (2R*, 4S*)-2-бензил-N-(2-фенилэтил)-N-трифторацетил-4- пиперидинамина подвергают взаимодействию с 93 мг (0,461 ммоль) 3,5-бис-(трифторметил)-бензойной кислоты, 117 мг (0,461 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 118 мкл (0,845 ммоль) триэтиламина. В результате получают целевое соединение (191 мг, 79%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf = 0,79. FD-MS: M+ = 630.
Пример 57.
(2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-нафтоил)-4-пиперидинамин
Таким же образом, как это описано в примере 2j, 142 мг (0,825 ммоль) 2-нафтойной кислоты подвергают взаимодействию вначале с 2 мл (27 ммолей) тионилхлорида, а затем с 200 мг (0,550 ммоль) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина и 138 мкл (0,991 ммоль) триэтиламина с образованием целевого соединения формулы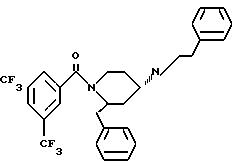
(272 мг, 96%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000: 50: 1); Rf = 0,73. FD-MS: M+ = 516, 518, 520. ИК: 3420, 1625 см-1.
Исходное соединение для получения указанного продукта получают следующим образом:
a) (2R*,4S*)-2-бензил-4-пиперидиназид
Таким же образом, как это описано в примере 38d, 15 г (38,3 ммоль) смеси в соответствии с примером 2e подвергают взаимодействию с 70 мл трифторуксусной кислоты. В результате получают целевое соединение (7,15 г, 87%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,57. FD-MS: M+ = 216.
b) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидиназид
Таким же образом, как это описано в примере 2j, 6,62 г (3,47 ммоль) 3,5-дихлорбензойной кислоты подвергают взаимодействию вначале с 3,78 мл (52,0 ммоль) тионилхлорида, а затем с 3,0 г (13,9 ммоль) (2R*,4S*)-2-бензил-4-пиперидиназида и 5,8 мл (41,6 ммоль) триэтиламина с образованием целевого соединения (5,18 г, 96%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf = 0,77. FD-MS: (M+H)+= 389, 391.
c) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамин
Таким же образом, как это описано в примере 2f, 11,0 г (28,3 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидиназида гидрируют на 10%-ном Pd/C. В результате получают целевое соединение (8,76 г, 85%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350:50:1); Rf = 0,40. FD-MS: M+ = 362, 364.
Пример 58.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(3,5-диметилбензоил)-4-пиперидинамин
Таким же образом, как это описано в примере 57, 124 мг (0,825 ммоль) 3,5-диметилбензойной кислоты подвергают взаимодействию вначале с 2 мл (27 ммоль) тионилхлорида, а затем с 200 мг (0,550 ммоль) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина и 138 мкл (0,991 ммоль) триэтиламина с образованием целевого соединения формулы
(200 мг, 73%).
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000: 50: 1); Rf = 0,61. FD-MS: (M+H)+ = 494, 496. ИК: 3420, 1625 см-1.
Пример 59.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хинолилкарбонил)-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,550 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 105 мг (0,660 ммоль) хинолин-4-карбоновой кислоты, 168 мг (0,661 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 169 мкл (1,21 ммоль) триэтиламина. В результате получают целевое соединение формулы
(278 мг, 97%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700: 50: 1); Rf = 0,45. FD-MS: M+ = 517, 519. ИК: 3395, 1755, 1620 см-1.
Пример 60.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(3-индолилкарбонил)-4- пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,550 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 106 мг (0,661 ммоль) индол-3-карбоновой кислоты, 168 мг (0,661 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 169 мкл (1,21 ммоль) триэтиламина. В результате получают целевое соединение формулы
(92 мг, 33%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (350: 50: 1); Rf = 0,61. FD-MS: M+ = 505, 507. ИК: 3450, 3260, 1770, 1635 см-1.
Пример 61.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-индолилкарбонил)-4- пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,550 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 106 мг (0,661 ммоль) индол-2-карбоновой кислоты, 168 мг (0,661 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 169 мкл (1,21 ммоль) триэтиламина. В результате получают целевое соединение формулы
(89 мг, 32%) в виде белых кристаллов с температурой плавления 254oC.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000: 50: 1); Rf = 0,56. FD-MS: M+ = 505, 507. ИК: 3430, 3290, 1625 см-1.
Пример 62.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(5-метокси-2- индолилкарбонил)-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,550 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 126 мг (0,661 ммоль) 5-метокси-индол-2-карбоновой кислоты, 168 мг (0,661 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 169 мкл (1,21 ммоль) триэтиламина. В результате получают целевое соединение формулы
(118 мг, 41%) в виде белых кристаллов с температурой плавления 251oC.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000: 50: 1); Rf = 0,81. FD-MS: M+ = 535, 537. ИК: 3440, 3280, 1625 см-1.
Пример 63.
(2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(1-нафтоил)-4-пиперидинамин
Таким же образом, как это описано в примере 39a, 150 мг (0,431 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 75 мкл (0,495 ммоль) 1-нафтоилхлорида и 81 мкл (0,578 ммоль) триэтиламина. В результате получают целевое соединение формулы
(208 мг, 97%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000: 50: 1); Rf = 0,85. FD-MS: M+ = 516, 518. ИК: 3680, 3400, 1620 см-1.
Пример 64.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(фенилацетил)-4- пиперидинамин
Таким же образом, как это описано в примере 39a, 200 мг (0,551 ммоль) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 88 мкл (0,661 ммоль) фенилацетилхлорида и 108 мкл (0,771 ммоль) триэтиламина. В результате получают целевое соединение формулы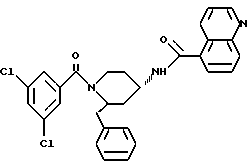
(127 мг, 48%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000: 50:1); Rf = 0,56. FD-MS: M+ = 480, 482. ИК: 3660, 3405, 1665, 1630 см-1.
Пример 65.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-метоксибензил)-4- пиперидинамин
Таким же образом, как это описано в примере 2g, 200 мг(0,551 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 75 мг (0,551 ммоль) 2-метоксибензальдегида и 90 мг сульфата магния в 2 мл толуола и затем образующееся соединение восстанавливают 22 мг (0,584 ммоль) натрийборгидрида. В результате получают целевое соединение формулы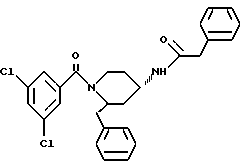
(170 мг, 64%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (700:50:1); Rf = 0,66. FD-MS: M+ = 482, 484. ИК: 1620 см-1.
Пример 66.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-[3-(N-ацетил)-индолилметил]- 4-пиперидинамин
Таким же образом, как это описано в примере 2g, 200 мг (0,551 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 113 мг (0,606 ммоль) N-ацетилиндол-3-карбоксальдегида и 90 мг сульфата магния в 2 мл толуола и затем образующееся соединение восстанавливают 31 мг (0,826 ммоль) натрийборгидрида в 3 мл метанола. В результате получают целевое соединение формулы
(30 мг, 10%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000: 50: 1), Rf = 0,57. FD-MS: M+ = 533, 535. ИК: 1720, 1680, 1635 см-1.
Пример 67.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-бензо[b] -фуранилметил)- 4-пиперидинамин
Таким же образом, как это описано в примере 2g, 200 мг (0,551 ммоль) (2R*, 4S*)-2-бензоил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 97 мг (0,661 ммоль) бензофуран-2-карбоксальдегида и 90 мг сульфата магния в 2 мл толуола и затем образующееся соединение восстанавливают 22 мг (0,584 ммоль) натрийборгидрида в 2 мл метанола. В результате получают целевое соединение формулы
(150 мг, 55%) в виде маслянистой жидкости.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf = 0,18. FD-MS: M+ = 492, 494. ИК: 1630 см-1
Пример 68.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-[(3-метилбензо[b] -тиофен- 2-ил)-метил]-4-пиперидинамин
Таким же образом, как это описано в примере 2g, 200 мг (0,551 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 116 мг (0,661 ммоль) 3-метилбензо[b]-тиофен- 2-карбоксальдегида и 90 мг сульфата магния в 2 мл толуола и затем образующееся соединение восстанавливают 22 мг (0,584 ммоль) натрийборгидрида в 2 мл метанола. В результате получают целевое соединение формулы
(75 мг, 25%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (2000:50:1); Rf = 0,38. FD-MS: M+ = 522, 524. ИК: 1630 см-1.
Пример 69
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(5-метоксииндол-3-ил-метил)- 4-пиперидинамин
Таким же образом, как это описано в примере 2g, 200 мг (0,551 ммоль) (2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 116 мг (0,661 ммоль) 5-метоксииндол-3-карбоксальдегида и 90 мг сульфата магния в 2 мл толуола и затем образующееся соединение восстанавливают 22 мг (0,584 ммоль) натрийборгидрида в 2 мл метанола. В результате получают целевое соединение формулы
(98 мг, 34%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,42. FD-MS: M+ = 521, 523. ИК: 3460, 1630 см-1.
Пример 70
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(3-индолилметил)- 4-пиперидинамин
Таким же образом, как это описано в примере 2g, 200 мг (0,551 ммоль) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 80 мг (0,551 ммоль) индол-3-карбоксальдегида и 90 мг сульфата магния в 2 мл толуола и затем образующееся соединение восстанавливают 22 мг (0,584 ммоль) натрийборгидрида в 2 мл метанола. В результате получают целевое соединение формулы
(75 мг, 28%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (400:50:1); Rf = 0,49. FD-MS: M+ = 491, 493. ИК: 3460, 1630 см-1.
Пример 71.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-фенилкарбамоил- 4-пиперидинамин
Таким же образом, как это описано в примере 16a, 200 мг (0,551 ммоль) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-4-пиперидинамина подвергают взаимодействию с 85 мг (0,716 ммоль) фенилизоцианата. В результате получают целевое соединение формулы
(160 мг, 60%) в виде белой пены.
Тонкослойная хроматография: толуол/этилацетат (1:1); Rf = 0,40. FD-MS: M+ = 481, 483. ИК: 1600, 1690 см-1.
Пример 72.
(2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-дифенилметил-4-пиперидинамин
Раствор 200 мг (0,551 ммоль) (2R*,4S*)-2-бензил-1-(3,5-дихлорбензоил)- 4-пиперидинамина и 110 мг (0,606 ммоль) бензофенона в 5 мл толуола кипятят в течение 18 ч с обратным холодильником. После этого реакционную смесь упаривают в ротационном выпарном аппарате, растворяют остаток в 3 мл метанола и добавляют к полученному раствору при комнатной температуре 69 мг (1,10 ммоль) натрийцианборгидрида. С помощью 80 мкл уксусной кислоты pH реакционной смеси устанавливают равным 5 и перемешивают ее в течение 68 ч при комнатной температуре. В результате получают целевое соединение формулы
(120 мг, 41%) в виде белой пены.
Тонкослойная хроматография: толуол/этилацетат (7:3); Rf = 0,79. FD-MS: M+ = 528, 530. ИК: 1630 см-1.
Пример 73.
(2R*, 4S*)-2-бензил-1-(3,5-дихлорбензоил)-N-(3,4-дигидро-2H-1-бензопиран-2-карбонил)-4-пиперидинамин
К раствору 108 мг (0,606 ммоль) 3,4-дигидро-2Н-1-бензопиран-2- карбоновой кислоты в 3 мл тетрагидрофурана добавляют при 0oC 125 мг (0,606 ммоль) N, N'-дициклогексилкарбодиимида, перемешивают реакционную смесь в течение часа и добавляют к ней 177 мкл (1,27 ммоль) триэтиламина и 200 мг (0,551 ммоль) (2R*,4S*)-2-бeнзил-1-(3,5-диxлopбeнзoил)-4-пипepидинaминa.
Смеси дают нагреться до комнатной температуры и перемешивают ее при этой температуре в течение 16 ч. После этого ее упаривают в ротационном выпарном аппарате, суспендируют в смеси метиленхлорида и эфира в соотношении 1:1 и фильтруют белую суспензию. После упаривания в ротационном выпарном аппарате реакционную смесь растворяют в метиленхлориде, дважды промывают 10%-ным раствором лимонной кислоты и по разу водой, 2N раствором едкого натра и рассолом, высушивают над сульфатом магния и упаривают в ротационном выпарном аппарате. Желтую маслянистую жидкость хроматографируют на силикагеле, используя в качестве элюента смесь толуола и этилацетата в соотношении 7:3. В результате получают смесь диастереоизомеров целевого соединения формулы
(69 мг, 24%) в виде белой пены.
Тонкослойная хроматография: толуол/этилацетат (1:1); Rf = 0,56. FD-MS: M+ = 522, 524. ИК: 3410, 1675, 1630 см-1.
Пример 74.
(2R*, 4S*)-2-бензил-l-(4-метоксибензоил)-N-(4-хинолилметил)- 4-пиперидинамин
Таким же образом, как это описано в примере 2, 0,175 г (0,321 ммоль) (2R*, 4S*)-2-бензил-1-(4-метоксибензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамина подвергают взаимодействию с 0,047 г (1,25 ммоль) натрийборгидрида. В результате получают целевое соединение формулы
(0,100 r, 69%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,21. FD-MS: M+ = 465. ИК: 1620 см-1
Исходное соединение для получения указанного продукта получают следующим образом:
(2R*, 4S*)-2-бензил-1-(4-метоксибензоил)-N-(4-хинолилметил)-N- трифторацетил-4-пиперидинамин
Таким же образом, как это описано в примере 4a, 200 мг (0,467 ммоль) (2R*,4S*)-2-бензил-N-(4-хинолилметил)-N-трифторацетил-4-пиперидинамина подвергают взаимодействию с 85 мг (0,562 ммоль) п-анисовой кислоты, 143 мг (0,561 ммоль) хлорангидрида бис-(2-оксо-3-оксазолидинил)-фосфиновой кислоты и 91 мкл (0,655 ммоль) триэтиламина. В результате получают целевое соединение (170 мг, 65%) в виде белой пены.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (1000:50:1); Rf = 0,37. FD-MS: M+ = 561.
Пример 75.
Таким же образом, как это описано в примерах 1-74, могут быть получены следующие соединения:
(2R*,4S*)-2-бензил-1-(3,5-диметилбензоил)-N-бензил-N-карбамоил-4- пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3-фенилпропил)-4- пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3-фенилпропил)-4- пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-метоксибензил)-4- пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-метоксибензил)-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2-метоксифенил)этил] -4- пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2-метоксифенил)этил] -4- пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2-метоксифенил)пропил] -4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2-метоксифенил)пропил]-4- пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-трифторметилбензил)-4- пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-трифторметилбензил)-4- пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2-трифторметилфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2-трифторметилфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2-трифторметилфенил)пропил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2- трифторметилфенил)пропил]-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3-трифторметилбензил)-4- пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3-трифторметилбензил)-4- пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(3-трифторметилфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(3-трифторметилфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(3- трифторметилфенил)пропил]-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(3- трифторметилфенил)пропил]-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(4-трифторметилбензил)-4- пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(4-трифторметилбензил)-4- пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(4-трифторметилфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(4-трифторметилфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(4- трифторметилфенил)пропил]-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(4- трифторметилфенил)пропил]-4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,3-диметоксибензил)-4- пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,3-диметоксибензил)-4- пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,3-диметоксифенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,3-диметоксифенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,3-диметоксифенил)пропил] - 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,3-диметоксифенил)пропил] - 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,4-диметоксибензил)-4- пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,4-диметоксибензил)-4- пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,4-диметоксифенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,4-диметоксифенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,4-диметоксифенил)пропил] - 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,4-диметоксифенил)пропил] - 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,5-диметоксибензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,5-диметоксибензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,5-диметоксифенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,5-диметоксифенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,5-диметоксифенил)пропил] - 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,5-диметоксифенил)пропил] - 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,6-диметоксибензил)- 4-пиперидинамин;
(2S, 4S)-2-бeнзил-1-(3,5-димeтилбeнзoил)-N-(2,6-димeтoкcибeнзил)- 4-пипeридинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,6-диметоксифенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,6-диметоксифенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,6-диметоксифенил)пропил] - 4- пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,6-диметоксифенил)пропил] - 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,3-метилендиоксибензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,3-метилендиоксибензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,3-метилендиоксифенил) этил]-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,3-метилендиоксифенил) этил]-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,3-метилендиоксифенил) пропил]-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,3- метилендиоксифенил)пропил]-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,4-метилендиоксибензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2,4-метилендиоксибензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,4-метилендиоксифенил) этил]-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2,4-метилендиоксифенил) этил]-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,4-метилендиоксифенил) пропил]-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2,4- метилендиоксифенил)пропил]-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(хинолин-2-илметил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(хинолил-3-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2-хлорфенил)пропил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(2-хлорфенил)пропил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(3-хлорфенил)пропил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(3-хлорфенил)пропил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(4-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(4-хлорбензил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(4-хлорфенил)пропил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-[3-(4-хлорфенил)пропил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(4-метоксинафт-1-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(4-метоксинафт-1-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3,4-этилендиоксибензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3,4-этилендиоксибензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(хинолин-2-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(хинолин-2-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(хинолин-3-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(хинолин-3-илметил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[3-(2-хлорфенил)пропил] - 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[3-(2-хлорфенил)пропил] - 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[3-(3-хлорфенил)пропил] - 4-пиперидинамин;
(2S,4S)-2-бeнзил-1-(3,5-дитpифтopмeтилбeнзoил)-N-[3-(3-хлорфенил)пропил] - 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(4-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(4-хлорбензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[3-(4-хлорфенил)пропил] - 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-[3-(4-хлорфенил)пропил] - 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(4-метоксинафт-1- илметил)-4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(4-метоксинафт-1- илметил)-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(3,4- этилендиоксибензил)-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дитрифторметилбензоил)-N-(3,4- этилендиоксибензил)-4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(хинолил-2-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(хинолил-2-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(хинолил-3-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(хинолил-3-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[3-(2-хлорфенил)пропил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[3-(2-хлорфенил)пропил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[3-(3-хлорфенил)пропил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[3-(3-хлорфенил)пропил]- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хлорбензил)-4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-хлорбензил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[3-(4-хлорфенил)пропил]- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-[2-(4-хлорфенил)пропил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-метоксинафт-1-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(4-метоксинафт-1 -илметил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(3,4-этилендиоксибензил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-дихлорбензоил)-N-(3,4-этилендиоксибензил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(индол-2-илметил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(индол-3-илметил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(хинолин-2-илметил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(хинолин-2-илметил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(хинолин-3-илметил)- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(хинолин-3-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(2-хлорбензил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[2-(2-хлорфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[3-(2-хлорфенил)пропил] - 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[3-(2-хлорфенил)пропил] - 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(3-хлорбензил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[2-(3-хлорфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[3-(3-хлорфенил)пропил] - 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[3-(3-хлорфенил)пропил] - 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(4-хлорбензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(4-хлорбензил)- 4-пиперидинамин;
(2R,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2S,4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[2-(4-хлорфенил)этил]- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[3-(4-хлорфенил)пропил] - 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-[3-(4-хлорфенил)пропил] - 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(4-метоксинафт-1-илметил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(4-метоксинафт-1-илметил)- 4-пиперидинамин;
(2R, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(3,4-этилендиоксибензил)- 4-пиперидинамин;
(2S, 4S)-2-бензил-1-(3,5-диметоксибензоил)-N-(3,4-этилендиоксибензил)- 4-пиперидинамин.
Пример 76.
(2R, 4S)- и (2R,4R)-2-бензил-1-(3,5-диметилбензоил)-N-(4-хинолилметил)- 4-пиперидинамин-дигидрохлорид
Таким же образом, как это описано в примере 1, используя в качестве исходного соединения 1,26 г (3,9 ммоль) (2R,4R)- и (2R,4S)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина, получают в виде смеси примерно 70% (2R,4R) и примерно 30% (2R,4S)-диастереоизомеров, путем восстановления борандиметилсульфидом в соответствии с примером 1b и при использовании 2,26 г (14,4 ммоль) хинолин-4-карбоксальдегида гидрохлорида обоих указанных диастереоизомеров целевого соединения.

Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1)
Диастереоизомер A (2R,4S): Rf = 0,5. MS:M+ = 463;
Диастереоизомер B (2R,4R): Rf = 0,45. MS:M+ = 463.
Tпл = 144-145oC; 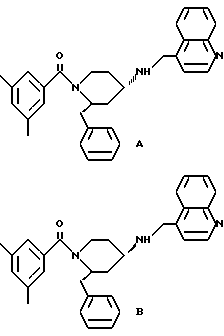 = +25oC (c=0,94, в этаноле).
= +25oC (c=0,94, в этаноле).
Полученные диастереоизомеры, растворенные в уксусноэтиловом эфире, обрабатывают эфирным раствором HCl, получая в результате дигидрохлорид целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный, аммиак (90:9:1).
Диастереоизомер A (2R,4S): Rf = 0,5. Tпл=172-174oC.
[α]D = -55,7oC (с= 1, этанол).
Диастереоизомер B (2R,4R): Rf = 0,45. Tпл=174-176oC.
[α]D = +18oC (с= 1, этанол).
Пример 77.
(2S, 4R)- и (2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-фенетил)- 4-пиперидинамино-дигидрохлорид
Таким же образом, как это описано в примере 1, используя в качестве исходного материала 1,87 г (5,8 ммоль) (2S,4R)- и (2S,4S)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина, путем восстановления боран-диметилсульфидом в соответствии с примером e1b и с использованием фенилацетальдегида получают в виде смеси примерно 70% (2S,4S)- и примерно 30% (2S,4R)-диастереоизомеров гидрохлорида обоих указанных диастереоизомеров целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (98:2).
Диастереоизомер A (2S,4S): Rf = 0,16. Tпл = 250-251oC.
[α]D = +56,2oC (с=0,980, метанол). MS:M+ = 426 (свободное основание).
Диастереоизомер B (2S,4R): Rf = 0,06. Tпл = 250oC (с разложением);
[α]D = -29,7oC (с=0,768, метанол). MS:M+ = 426 (свободное основание).
Пример 78.
(2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(3-хинолилметил)- 4-пиперидинамин
Таким же образом, как описано в примере 1, используя 511 мг (1,59 ммоль) (2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина и хинолин-3-карбальдегид, получают названное соединение путем кристаллизации из гексан/этилацетата (1:1) в форме бесцветных кристаллов.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1); Rf = 0,5. Tпл = 91-93oC. MS:M+ = 463 (свободное основание). [α]D = +0,7o (с=1,09, метанол).
Пример 79.
(2R, 4S)-2-бeнзил-1-(3,5-диметилбензоил)-N-(2-хинолилметил)- 4-пиперидинамин-гидрохлорид
Таким же образом, как описано в примере 1, используя в качестве исходного материала 541 мг (1,68 ммоль) (2R,4S)-2-бензил-1-(3,5- диметилбензоил)-4-пиперидинамина с помощью хинолин-3-карбальдегида, получают дигидрохлорид целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1); Rf = 0,5. Tразл, начиная с 110oC. MS:M+ = 463 (свободное основание). [α]D = +4,8o (с=1,105, метанол).
Пример 80.
(2R, 4S) и (2R,4R)-2-бензил-1-(3,5-диметилбензоил)-N-бензил- 4-пиперидинамин-гидрохлорид
Таким же образом, как описано в примере 1, используя в качестве исходного материала 0,748 г (2,3 ммоль) (2R,4R) и (2R,4R)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина путем восстановления борандиметилсульфидом в соответствии с примером e1b и с помощью бензальдегида получают в виде смеси примерно 70% (2R,4R)- и примерно 30% (2R,4S)-диастереоизомеров гидрохлориды обоих диастереоизомеров целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (95:4,5:0,5).
Диастереоизомер A (2R,4R): Rf = 0,45. Tпл = 244-246oC.
[α]D = -50,4o (с=0,979, хлороформ); MS:M+ = 412 (свободное основание).
Диастереоизомер B (2R,4S): Rf = 0,33, аморфный.
[α]D = +7,9o (с=1,0, хлороформ); MS:M+ = 412 (свободное основание).
Пример 81.
(2S,4R)- и (2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-бензил- 4-пиперидинамин-гидрохлорид
Таким же образом, как описано в примере 1, используя в качестве исходного материала 4,5 г (13,95 ммоль) (2S,4R)- и (2S,4S)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина, путем восстановления боран-диметилсульфидом в соответствии с примером e1b и с помощью бензальдегида получают в виде смеси примерно 70% (2S,4S)- и примерно 30% (2S,4R)-диастереоизомеров гидрохлориды обоих диастереоизомеров целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (95:4,5:0,5).
Диастереоизомер A (2S,4S): Rf = 0,45. Tпл = 246-247oC.
[α]D = +51,2o (с=0,672, хлороформ); MS:M+ = 412 (свободное основание).
Диастереоизомер B (2S,4R): Rf = 0,33, аморфный.
[α]D/ = -7,7o (с = 0,784, хлороформ); MS:M+ = 412 (свободное основание).
Пример 82.
(2R, 4S)- и (2R,4R)-2-бензил-1-(3.5-диметилбензоил)-N-(4-пиридилметил)- 4-пиперидинамин-гидрохлорид
Таким же образом, как описано в примере 1, используя в качестве исходного материала 100 мг (0,279 ммоль) (2R,4R)- и (2R,4S)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина, путем восстановления боран-диметилсульфидом в соответствии с примером e1b и с помощью пиридин-4-карбальдегида получают в виде смеси примерно 70% (2R,4R)- и примерно 30% (2R,4S)-диастереоизомеров дигидрохлориды обоих диастереоизомеров целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1).
Диастереоизомер A (2R,4R): Rf = 0,68, разложение, начиная с 142oC.
[α]D = -57,3o (с=0,508, этанол); MS:M+ = 413 (свободное основание).
Диастереоизомер B (2R,4S): Rf = 0,44, разлагается, начиная с 145oC.
[α]D = +23,0o (с=0,300, этанол); MS:M+= 413 (свободное основание).
Пример 83.
(2R, 4S)- и (2R,4R)-2-бензил-1-(3,5-диметилбензоил)-N-(3-пиридил)- 4-пиперидинамин-гидрохлорид
Таким же образом, как описано в примере 1, используя в качестве исходного материала 100 мг (0,279 ммоль) (2R,4R)- и (2R,4S)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина, путем восстановления борандиметил-сульфидом в соответствии с примером e1b и с помощью пиридин-3-карбальдегида получают в виде смеси примерно 70% (2R,4R)- и примерно 30% (2R,4S)-диастереоизомеров дигидрохлориды обоих диастереоизомеров целевого соединения.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1).
Диастереоизомер A (2R,4R): Rf = 0,68, разложение, начиная с 105oC.
[α]D = -52,6o (с=1,06, этанол); MS:M+ = 413 (свободное основание).
Пример 84.
(2S, 4R)- и (2S,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(4-хинолилметил)- 4-пиперидинамин
Таким же образом, как описано в примере 1, используя в качестве исходного материала 12,1 г (37,5 ммоль) (2S,4R)- и (2S,4S)-2-бензил-1-(3,5-диметилбензоил)-4-пиперидинамина, путем восстановления борандиметил-сульфидом в соответствии с примером e1b и с помощью хинолин-4-карбальдегида получают оба диастереоизомерных соединения в виде смеси примерно 70% (2S,4S)- и примерно 30% (2S,4R)-диастереоизомеров.
Тонкослойная хроматография: метиленхлорид/метанол/концентрированный аммиак (90:9:1).
Диастереоизомер A (2S,4R): Rf = 0,59, Tпл = 144-145oC (свободное основание);
[α]D = -25,1o (с=1,0, этанол); MS:M+ = 463 (свободное основание).
Пример 85.
(2R*, 4S*1'R*)-N-бензил-1-(3,5-диметилбензоил)-2-(1'-окси-1'-бензил)- 4-пиперидинамин (диастереоизомер A) и (2R*,4R*,1'R*)-N-бензил-1-(3,5- диметилбензоил)-2-(1'-окси-1'-фенилметил)-4-пиперидинамин (диастереоизомер B)
[α]D
Кипятят c обратным холодильником в течение 18 ч при одновременном азеотропном удалении воды раствор 400 мг (1,18 ммоль) (2R*,1'R*)-1-(3,5-диметилбензоил)-2-(1'-окси-1'-фенилметил)-4-пиперидона и 139 мг (1,3 ммоль) бензиламина в смеси толуола и гексана. Реакционную смесь затем упаривают при пониженном давлении, остаток в виде маслянистой жидкости растворяют в метаноле, смешивают при 0-5oC со 111 мг натрийцианборгидрида (85%-ная эмульсия в минеральном масле) и перемешивают смесь в течение 4 ч при 25oC. Растворитель затем отгоняют при пониженном давлении, и сырой продукт растворяют в смеси уксусноэтилового эфира и 10%-ного раствора карбоната натрия. Органическую фазу отделяют, высушивают над сульфатом натрия и упаривают при пониженном давлении. В результате хроматографии на силикагеле с использованием в качестве подвижной фазы уксусноэтилового эфира получают оба целевых соединения.
Тонкослойная хроматография (уксусноэтиловый эфир):
Диастереоизомер A: Rf = 0,28, Tпл = 159-160oC.
Диастереоизомер B: Rf = 0,09, Tпл = 190-192oC.
Исходное соединение может быть получено следующим образом:
a) 1-трет.-бутоксикарбонил-4-пиперидин-этиленкеталь
К раствору 14,3 г 4-пиперидонэтиленкеталя в 100 мл толуола добавляют медленно при перемешивании при 0-5oC 26,1 г дитрет.-бутилдикарбоната, растворенного в 20 мл толуола. Смесь перемешивают в течение 2 ч при комнатной температуре, затем упаривают ее при пониженном давлении и перегоняют при пониженном давлении. В результате получают 22,2 г целевого соединения. Температура кипения 83-85oC (0,2 тор.).
Тонкослойная хроматография (уксусноэтиловый эфир/гексан) (1:3): Rf = 0,20.
b) (2R*, 1'R*)-l-трет.-бутоксикарбонил-2-(1'-окси-1'-фенилметил)- 4-пиперидонэтиленкеталь (диастереоизомер A) и (2R*,1'S*)-1-трет.-бутоксикарбонил-2-(1'-окси-1'-фенилметил)- 4-пиперидонэтиленкеталь (диастереоизомер B)
24,3 г (100 ммоль) 1-трет.-бутоксикарбонил-4-пиперидонэтиленкеталя и 32,8 мл тетраметилэтилендиамина растворяют в 100 мл диэтилового эфира, охлаждают раствор до -70oC и медленно смешивают с 87,5 мл (120 ммоль) раствора втор. -бутиллития (1,4-молярный раствор в смеси циклогексана и изопентана). Смесь перемешивают в течение 4 ч при -70oC, после чего добавляют к ней в один прием 12,72 г (120 ммоль) бензальдегида и нагревают до 0oC. Затем ее смешивают с насыщенным раствором хлорида аммония и встряхивают в делительной воронке с уксусноэтиловым эфиром. Органическую фазу отделяют, промывают насыщенным раствором поваренной соли, высушивают над сульфатом натрия и упаривают при пониженном давлении. В результате хроматографии на силикагеле с использованием уксусноэтилового эфира в качестве подвижной фазы получают 12,2 г диастереоизомера A и 21,6 г диастереоизомера В целевого соединения.
Тонкослойная хроматография (смесь уксусноэтилового эфира и гексана в соотношении 1:1):
Диастереоизомер A (2R*,1'R*): Rf = 0,43, Tпл = 133-134oC.
Диастереоизомер B (2R*,1'S*): Rf = 0,34, Tпл = 114-116oC.
c) 2-(1'-oкcи-1'-фeнилмeтил)-4-пипeридoн
Суспензию 2,6 г (7,44 ммоль) (2R*,1'R*)-1-трет.-бутоксикарбонил- 2-(1'-окси-1'-фенилметил)-4-пиперидонэтиленкеталя в 30 мл 6N соляной кислоты нагревают в течение часа при 60oC, затем охлаждают, нейтрализуют карбонатом натрия и встряхивают в делительной воронке с уксусноэтиловым эфиром. Органическую фазу высушивают над сульфатом натрия и упаривают при пониженном давлении. В результате получают целевое соединение с Tпл = 124-126oC, Rf (метиленхлорид/метанол/25%-ный раствор аммиака (90:9,5:0,5).
d) (2R*,1'R*)-1-(3,5-диметилбензоил)-2-(1'-окси-1'-фенилметил)- 4-пиперидон
Сырой продукт растворяют в смеси 20 мл дихлорметана и 20 мл насыщенного раствора гидрокарбоната натрия, охлаждают при перемешивании до 0-5oC в течение 1,5 ч по каплям при перемешивании добавляют к 1,5 r (8,9 ммоль) 3,5-диметилбензоилхлорида. Смесь перемешивают в течение еще 1 ч, разбавляют уксусноэтиловым эфиром, промывают последовательно 1N HCl и насыщенным раствором поваренной соли, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Целевое соединение может быть очищено путем хроматографии на силикагеле с использованием в качестве подвижной фазы смеси уксусноэтилового эфира и гексана в соотношении 1:1. В результате получают 1,71 г целевого соединения.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1: 1); Rf = 0,19; FD-MS: M+ = 338.
Таким же образом, как это описано выше в пунктах b), c) и d), могут быть получены следующие соединения:
(2R*, 1'R*)-1-(3,5-бистрифторметилбензоил)-2-[1'-окси-1'(4- хлорфенил)метил]-4-пиперидон.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1: 1); Rf = 0,35; FD-MS: M+ = 479, 481.
(2R*,1'R*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'(3,4-дихлорфенил)-метил]- 4-пиперидон.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1: 1), Rf = 0,16; Tпл = 222-223oC.
(2R*, 1'S*)-1-(3,5-бистрифторметилбензоил)-2-[1'-окси-1'(4-хлорфенил)- метил]-4-пиперидон;
(2R*, 1'R*)-1-(3,5-бистрифторметилбензоил)-2-[1'-окси-1'(3,4-дихлорфенил)- метил]-4-пиперидон;
(2R*,1R'*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-метоксифенил)-метил]- 4-пиперидон;
(2R*,1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-метоксифенил)-метил]- 4-пиперидон;
(2R*,1'R*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(3-метоксифенил)-метил]- 4-пиперидон;
(2R*,1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(3-метоксифенил)-метил]- 4-пиперидон;
(2R*, 1'R*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-трифторметилфенил)- метил]-4-пиперидон;
(2R*, 1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-трифторметилфенил) метил]-4-пиперидон;
(2R*, 1'R*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлор-3- трифторметилфенил)-метил]-4-пиперидон и;
(2R*, 1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлор-3- трифторметилфенил)-метил]-4-пиперидон.
Пример 86.
(2R*, 4S*, 1'R*)-2-(1'-окси-1'-фенилметил)-1-(3,5-диметилбензоил)- N-(хинолилметил)-4-пиперидинамин (диастереоизомер A) и (2R*, 4R*,1'R*)-1-(3,5-димeтилбeнзoил)-2-(1'-oкcи-1'-(фeнилмeтил)-N-(4- xинoлилмeтил)-4-пиперидинамин (диастереоизомер B)
Целевое соединение может быть получено таким же образом, как это описано в примере 85, с использованием в качестве исходного материала 4-хинолилметиламина. Его диастереоизомеры могут быть разделены и очищены с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы уксусноэтилового эфира и смеси уксусноэтилового эфира и метанола в соотношении 50:1.
Тонкослойная хроматография (уксусноэтиловый эфир):
Диастереоизомер A (2R*,4S*,1'R*), выход 180 мг; Rf = 0,08; FD-MS: M+ = 479.
Диастереоизомер B (2R*, 4R*,1'R*), выход 35 мг; Rf = 0,01; FD-MS: M+ = 479.
Пример 87.
(2R*, 4S*,1'S*)-1-(3,5-диметилбензоил)-2-(1'-окси-1'-фенилметил)- N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер A) и (2R*,4R*.1'S*)-1-(3,5-диметилбензоил)-2-(1'-окси-1'-фенилметил)- N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер B)
Целевое соединение может быть получено таким же образом, как это описано в примере 85, с использованием в качестве исходного материала 420 мг (1,24 ммоля) (2R*, 1'S)-1-(3,5-диметилбензоил)-2-(1'-окси-1'- фенилметил)-4-хинолилметиламина. Оно может быть разделено на отдельные диастереоизомеры и очищено с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы уксусноэтилового эфира и смеси дихлорметана, метанола и 35%-ного раствора аммиака в соотношении 95:4,5:0,5.
Тонкослойная хроматография (уксусноэтиловый эфир):
Диастереоизомер A (2R*,4S*,1'S*), выход 250 мг; Rf = 0,08; FD-MS: M+ = 479.
Диастереоизомер B (2R*,4R*,1'S*), выход 170 мг; Rf = 0,01; FD-MS: M+ = 479.
Исходный материал может быть, например, получен следующим образом:
a) (2R*, 1'S*)-(3,5-диметилбензоил)-2-(1'-окси-1'-фенилметил)- 4-пиперидон
Целевое соединение получают таким же образом, как это описано в примере 1c, из 860 мг (2,46 ммоль) (2R*,1'S)-1-трет.-бутоксикарбонил- 2-(1'-окси-1'-фенилметил)-4-пиперидонэтиленкеталя (пример 1b) с последующей колоночной хроматографией на силикагеле с использованием в качестве подвижной фазы смеси уксусноэтилового эфира и гексана в соотношении 2:3.
Выход 400 мг.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1: 1); Rf = 0,24; FD-MS: M+ = 337.
Пример 88
(2R*,4S*,1'R*)-2-[1'-окси-1'-(4-хлорфенил)метил]-1-(3,5-диметилбензоил)- N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер A) и (2R*,4R*,1'R*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлорфенил)метил] - N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер В)
Целевое соединение может быть получено таким же образом, как это описано в примере 1, из 310 мг (0,833 ммоль) (2R*,1'R*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлорфенил)метил] - 4-пиперидона и 145 мг (0,92 ммоль) 4-хинолилметиламина с последующим разделением и очисткой с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы смеси уксусноэтилового эфира и изопропанола в соотношении 95:5-90:10.
Диастереоизомер A: выход 225 мг. Диастереоизомер B: выход 80 мг.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный аммиак (90:10: 0,5):
Диастереоизомер A (2R*,4S*,1'R*); Rf = 0,47; FD-MS: (М'+1)+ = 514.
Диастереоизомер B (2R*,4R*,1'R*); Rf = 0,35; FD-MS: M+ = 513.
Исходный материал может быть, например, получен следующим образом:
a) (2R*,1'R*)-1-трет.-бутоксикарбонил-2-[1'-окси-1'-(4-хлорфенил) метил] -4-пиперидонэтиленкеталь (диастереоизомер A) и (2R*,1'S*)-1-трет.-бутоксикарбонил-2-[1'-окси-1'-(4-хлорфенил)метил] - 4-пиперидонэтиленкеталь (диастереоизомер B)
Целевое соединение может быть получено таким же образом, как это описано в примере 1b, исходя из 4-хлорбензальдегида, и разделено и очищено с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы смеси уксусноэтилового эфира и гексана в соотношении 1:3, а также путем кристаллизации из смеси уксусноэтилового эфира и гексана.
Тонкослойная хроматография (уксусноэтиловый эфир/гексан, (1:1):
Диастереоизомер A (2R*,1'R*); Rf = 0,44; Tпл = 129-130oC;
Диастереоизомер B (2R*,1'S*); Rf = 0,35; Tпл = 160-161oC.
b) (2R*,1'R*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлорфенил)метил]- 4-пиперидон
Целевое соединение может быть получено таким же образом, как это описано в примере 1c, и перекристаллизовано из уксусноэтилового эфира. Tпл = 222-225oC.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1: 1); Rf = 0,17.
Пример 89
(2R*,4S*,1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлорфенил)метил]- N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер A) и (2R*.4R*,1'S*)-1-(3.5-диметилбензоил)-2-[1'-окси-1'-(4-хлорфенил)метил] - N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер B)
Целевое соединение может быть получено таким же образом, как это описано в примере 1c, с использованием в качестве исходного материала (2R*,1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлорфенил)метил] - 4-пиперидона и с последующим разделением и очисткой с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы смеси дихлорметана, метанола и 25%-ного аммиака в соотношении 95:4,5:0,5.
Тонкослойная хроматография (уксусноэтиловый эфир):
Диастереоизомер A (2R*,4S*,1'S*); Rf = 0,24; FD-MS: M+ = 514.
Диастереоизомер B (2R*,4R*,1'S*); Rf = 0,06; FD-MS: M+ = 514.
Исходный материал может быть, например, получен следующим образом:
a) (2R*,1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(4-хлорфенил)метил]- 4-пиперидинамин
Целевое соединение может быть получено таким же образом, как это описано в примере 1c, исходя из (2R*,1'S*-трет.-бутоксикарбонил-2-[1'- окси-1'-(4-xлopфенил)метил]-4-пипеpидoнэтиленкетaля (пример 4a, диастереоизомер B). Tпл = 195-197oC.
Тонкослойная хроматография (уксусноэтиловый эфир/гексан) (1:1):
Rf = 0,26.
Пример 90.
(2R*, 4S*, 1'S*)-1-(3,5-диметилбензоил)-2-[1'-окси-1'-(3,4- дихлорфенил)метил] -N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер A) и (2R*, 4R*, 1'S*)-1-(3,5-диметилбензоил)-2-[1'- окси-1'-(3,4-дихлорфенил)метил]-N-(4-хинолилметил)-4-пиперидинамин (диастереоизомер B)
Целевое соединение получают таким же образом, как это описано в примере 1, исходя из (2R*,1'S*)-1-(3,5-диметилбензоил)-2-[1'- oкcи-1'-(3,4-дихлорфенил)метил] -4-пиперидона, с последующим разделением с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы смеси дихлорметана, метанола и 25%-ного раствора аммиака.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный аммиак, 90:9,5: 0,5):
Диастереоизомер A (2R*,4S*,1'S*); Rf = 0,38; Tпл = 138-140oC
Диастереоизомер B (2R*,4R*,1'S*); Rf = 0,22; Tпл = 188-190oC.
Исходный материал может быть, например, получен следующим образом:
a) (2R*, 1'R*)-1-трет. -бутоксикарбонил-2-[1'-окси-1'-(3,4- дихлорфенил)метил] -4-пиперидинаминэтиленкеталь (диастереоизомер A) и (2R*,1'S*)-1-трет.-бутоксикарбонил-2-[1'-окси-1'-(3,4-дихлорфенил)метил]- 4-пиперидонэтиленкеталь (диастереоизомер B)
Целевое соединение может быть получено таким же образом, как это описано в примере 1b, при использовании вместо бензальдегида 3,4-дихлор-бензальдегида. Диастереоизомеры могут быть разделены с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы смеси уксусноэтилового эфира и гексана в соотношении 1:3, и перекристаллизации из смеси уксусноэтилового эфира и гексана.
Тонкослойная хроматография (уксусноэтиловый эфир/гексан, (1:1).
Диастереоизомер A (2R*,1'R*); Rf = 0,57; ИК-спектр (CH2Cl2): 3700-3300, 1680 см-1;
Диастереоизомер B (2R*,1'S*); Rf = 0,48; Tпл = 160-162oC.
b) (2R*, 1'S*)-1-(3,5-диметилбензоил)-2-[1'-oкcи-1'-(3,4- диxлopфeнил)метил]-4-пиперидон
Целевое соединение может быть получено таким же образом, как это описано в примере 1c, исходя из (2R*,1'S)-1-трет.-бутоксикарбонил-2-[1'- окси-1'-(3,4-дихлорфенил)метил] -4-пиперидонэтиленкеталя и перекристаллизовано из смеси уксусноэтилового эфира и гексана. Tпл = 152-152,5oC.
Тонкослойная хроматография: уксусноэтиловый эфир/гексан (1: 1); Rf = 0,24.
Пример 91.
(2R*,4S*)-N-бензил-(3,5-диметилбензоид)-2-бензоил-4-пиперидинамин
Раствор 30 мг (2R*,4R*,1'R*)-N-бензил-N-трифторацетил-1-(3,5-диметилбензоил)-2-бензоил-4-пиперидинамина в 5 мл метанола и 1 мл 5N раствора гидроксида натрия нагревают в течение 10 мин при 60oC. Затем смесь охлаждают до комнатной температуры, разбавляют ее 10%-ным водным раствором гидрокарбоната натрия и дважды встряхивают в делительной воронке с дихлорметаном. Органические фазы объединяют, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. В результате получают целевое соединение формулы
которое выделяют с помощью колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы уксусноэтилового эфира.
Тонкослойная хроматография уксусноэтиловый эфир: Rf = 0,17; ИК-спектр (CH2Cl2): 1685, 1625, 1500 см-1
Исходный материал может быть, например, получен следующим образом:
a) (2R*, 4R*,1'R*)-N-бензил-N-трифторацетил-1-(3,5-диметилбензоил)- 2-бензоил-4-пиперидинамин
Раствор 80 мг (0,19 ммоль) (2R*,4R*,1'R*)-N-бензил-1-(3,5-диметилбензоил)- 2-(1'-окси-1'-фенилметил)-4-пиперидинамина (диастереоизомер B) в 1 мл пиридина смешивают при 0oC с 0,167 мл трифторацетангидрида и перемешивают смесь в течение 2 ч при 0oC. Затем ее разбавляют диэтиловым эфиром и разделяют фазы. Органическую фазу промывают 4N соляной кислотой и насыщенным раствором поваренной соли и упаривают досуха при пониженном давлении. Сырой продукт для удаления дважды трифторацетилированных побочных продуктов нагревают в 3 мл этанола и 0,5 мл триэтиламина до 55oC и снова упаривают при пониженном давлении. Остаток растворяют в 3 мл дихлорметана, содержащего молекулярное сито 3 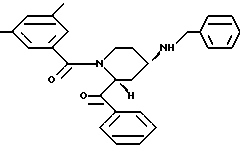 , и смешивают с 5 мг перрутената тетрапропиламмония и 100 мг морфолин-N-оксида. Смесь перемешивают 16 ч, фильтруют, разбавляют дихлорметаном, промывают последовательно раствором гидросульфата натрия, насыщенным раствором поваренной соли, 5%-ным раствором сульфата меди, упаривают при пониженном давлении и перекристаллизовывают остаток из смеси диэтилового эфира и гексана. Tпл = 138-139oC.
, и смешивают с 5 мг перрутената тетрапропиламмония и 100 мг морфолин-N-оксида. Смесь перемешивают 16 ч, фильтруют, разбавляют дихлорметаном, промывают последовательно раствором гидросульфата натрия, насыщенным раствором поваренной соли, 5%-ным раствором сульфата меди, упаривают при пониженном давлении и перекристаллизовывают остаток из смеси диэтилового эфира и гексана. Tпл = 138-139oC.
Тонкослойная хроматография (уксусноэтиловый эфир/гексан, (1:1); Rf = 0,71.
Пример 92.
(2R*, 4S*)-2-(4-хлорбензил)-1-(3,5-диметилбензоил)-N-(4-хинолилметил)- 4-пиперидинамин
Смесь 550 мг (1,54 ммоль) (2R*,4S*)-2-(4-хлорбензил)-1-(3,5- диметилбензоил)-4-пиперидинамина и 242 мг (1,54 ммоль) 4-хинолин-карбоксальдегида растворяют в 30 мл толуола и упаривают при пониженном давлении досуха. Описанную операцию повторяют еще 2 раза. Остаток растворяют в 10 мл этанола, смешивают раствор с 70 мг (1,85 ммоль) бороната натрия и перемешивают смесь в течение 3 ч при 25oC. Затем ее подкисляют 1N соляной кислотой и перемешивают в течение еще часа. После этого реакционную смесь вливают в насыщенный водный раствор карбоната натрия и экстрагируют уксусноэтиловым эфиром. Органическую фазу промывают насыщенным раствором поваренной соли, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Сырой продукт дважды перекристаллизовывают из уксусноэтилового эфира и получают в результате 320 мг целевого соединения формулы
в виде белых кристаллов. Tпл = 148-149oC. MS:M+ = 497.
Исходное соединение может быть получено следующим образом:
a) N-5-(4-хлорфенил)пент-1-ен-4-ил-3,5-диметилбензамид
К перемешиваемому раствору 5,0 г (25,5 ммоль) 2-[1-(4-хлорфенил)пент-4-ениламина и 5,33 мл (38,4 ммоль) триэтиламина в 100 мл дихлорметана при 0oC добавляют в течение 2 ч 4,3 г (25,6 ммоль) 3,5-диметилбензоилхлорида. Реакционную смесь перемешивают в течение еще часа, после чего смешивают с 1N соляной кислотой и подвергают экстракции дихлорметаном. Органическую фазу промывают до нейтральной реакции насыщенным раствором поваренной соли и упаривают при пониженном давлении. Сырой продукт перекристаллизовывают из смеси уксусноэтилового эфира и гексана, получая в результате 7,36 г (88%) белых кристаллов с Tпл = 116-118oC.
Тонкослойная хроматография (гексан/уксусноэтиловый эфир, 3: 1); Rf = 0,37.
b) N-[5-(4-хлорфенил)пент-1-ен-4-ил]-N-этоксиметил-3,5-диметилбензамид
К энергично перемешиваемому раствору 5,5 г (16,8 ммоль) N-[5-(4-хлорфенил)пент-1-ен-4-ил] -3,5-диметилбензамида и 100 мг хлорида бензилтрибутиламмония в 15 мл 50%-ного водного раствора гидроксида натрия и 15 мл дихлорметана добавляют при 0-5oC небольшими порциями в течение 2 ч 2,36 мл (25,2 ммоль) хлорметилэтилового эфира. Органическую фазу растворяют в дихлорметане и воде, органическую фазу отделяют, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Маслянистый остаток подвергают очистке с помощью хроматографии на силикагеле, используя в качестве подвижной фазы смесь уксусноэтилового эфира и гексана в соотношении 1:4.
Тонкослойная хроматография (уксусноэтиловый эфир/гексан); Rf = 0,50.
1H-ЯМР (300 МГц, CDCl3): смесь ротамеров,  = 7,31-7,18 (m, 4H); 7,04-6,85 (m, 2,6Н); 6,42 (br.s, 0,4Н); 5,92-5,60 (m, 1H); 5,20-5,02 (m, 2H); 4,54-4,24 (m, 2H): 3,96-3,67 (m, 1H); 3,25-2,40 (m, 6H), 2,28 (s, прим. 5H); 2,24 (s, прим. 1H); 1,34-1,21 (m, прим. 0,5H); 1,08 (t, J=7, прим. 2,5H).
= 7,31-7,18 (m, 4H); 7,04-6,85 (m, 2,6Н); 6,42 (br.s, 0,4Н); 5,92-5,60 (m, 1H); 5,20-5,02 (m, 2H); 4,54-4,24 (m, 2H): 3,96-3,67 (m, 1H); 3,25-2,40 (m, 6H), 2,28 (s, прим. 5H); 2,24 (s, прим. 1H); 1,34-1,21 (m, прим. 0,5H); 1,08 (t, J=7, прим. 2,5H).
c) (2R*, 4S*)-2-(4-(хлорбензил)-l-(3,5-диметилбензоил)-N-ацетил- 4-пиперидинамин
К охлажденному до - 20oC раствору 1,0 г N-[5-(4-хлорфенил)пент-1-ен-4-ил] -N-этоксиметил-3,5-диметилбензамида в ацетонитриле добавляют последовательно 0,61 мл четыреххлористого олова и 0,24 мл ацетангидрида. Реакционную смесь перемешивают в течение 2 ч при 20oC в течение часа при 25oC выливают затем в насыщенный водный раствор гидрокарбоната натрия и подвергают экстракции уксусноэтиловым эфиром. Органическую фазу отделяют, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Полученное сырое целевое соединение (оранжевая маслянистая жидкость) подвергают очистке с помощью хроматографии на силикагеле, используя в качестве подвижной фазы смесь дихлорметана, метанола и 25%-ного раствора аммиака в соотношении 95:5: 0,1.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:10:1/5); Rf = 0,45. FD-MS: M+ = 398.
d) (2R*,4S*)-2-(4-хлорбензил)-1-(3,5-диметилбензоил)-4-пиперидинамин
Суспензию 730 мг (1,83 ммоль) (2R*,4S*)-2-(4-хлорбензил)-1-(3,5- диметилбензоил)-N-ацетил-4-пиперидинамина в 6N соляной кислоте нагревают в течение 16 ч при 100oC. При этом исходное соединение переходит в раствор. Реакционную смесь подщелачивают с помощью 10%-ного водного раствора карбоната натрия и подвергают экстракции уксусноэтиловым эфиром. Объединенные органические фазы высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Полученное сырое целевое соединение подвергают очистке с помощью хроматографии на силикагеле, используя в качестве подвижной фазы смесь дихлорметана, метанола и 25%-ного раствора аммиака в соотношении 90: 10: 0,1. В результате получают целевое соединение в виде почти бесцветной смолы.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:10:0,1); Rf = 0,26. FD-MS: (M+1)+ = 357.
Пример 93.
(2R*, 4S*)-2-(3,4-дихлорбензил)-1-(3,5-диметилбензоил)-N-(4-хинолилметил)- 4-пиперидинамин
Целевое соединение формулы
δ/
может быть получено таким образом, как это описано в примере 8, с использованием в качестве исходного материала (2R*,4S*)-2-(3,4-дихлорбензил)-1-(3,5-диметилбензоил)-4-пиперидинамина. Tпл = 121=124oC
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:9,5:0,5); Rf = 0,30. FD-MS: (M+1)+ = 531/533.
Исходное соединение может быть получено следующим образом:
a) N-[5-(3,4-дихлорфенил)пент-1-ен-4-ил]-3,5-диметилбензамид
Целевое соединение с 93%-ным выходом получают таким же образом, как это описано в примере 92a. Tпл = 155-157oC.
ИК-спектр (KBr): 3230, 1625, 1595 см-1
Тонкослойная хроматография (гексан/уксусноэтиловый эфир, 2: 1); Rf = 0,46.
b) N-[5-(3,4-дихлорфенил)пент-1-ен-4-ил] -N-этоксиметил-3,5-диметилбензамид
Целевое соединение получают таким же образом, как это описано в примере 92b.
ИК-спектр (пленка): 1640, 1600 см-1.
Тонкослойная хроматография (гексан/уксусноэтиловый эфир, 2: 1); Rf = 0,58.
c) (2R*,4S*)-N-ацетил-2-(3,4-дихлорбензил)-1-(3,4-диметилбензоил)- 4-пиперидинамин
Целевое соединение получают таким же образом, как это описано в примере 92c.
ИК-спектр (KBr): 3260, 1655, 1605, 1595, 1540 см-1.
Тонкослойная хроматография (дихлорметан/метанол, 10:1); Rf = 0,32.
d) (2R*,4S*)-2-(3,4-дихлорбензил)-1-(3,4-диметилбензоил)-4-пиперидинамин
Целевое соединение получают таким же образом, как это описано в примере 92d.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 300:25:3); Rf = 0,46.
Пример 94.
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-фенил-N-(4-хинолилметил)- 4-пиперидинамин
Суспензию 211 мг (0,60 ммоль) (2R*,4S*)-N-ацетил-1-(3,5-диметилбензоил)- 2-фенил-4-пиперидина в 8 мл 6N соляной кислоты нагревают в атмосфере инертного газа в течение 16 ч при 100oC. При этом происходит полное растворение исходного соединения. Раствор охлаждают до комнатной температуры, нейтрализуют его раствором карбоната натрия и экстрагируют уксусноэтиловым эфиром.
В результате колоночной хроматографии на силикагеле с использованием в качестве подвижной фазы смеси дихлорметана и метанола в соотношении 95:5-90: 10 получают 135 мг амина, который без предварительной очистки подвергают взаимодействию с 60 мг (0,38 моль) хинолин-4-карбоксальдегида в толуоле при одновременном азеотропном удалении воды. После отгонки растворителя в качестве остатка получают маслянистую жидкость, которую растворяют в этаноле и при 0oC смешивают с 14 мг (0,38 ммоль) натрийборгидрида. После выдержки в течение 1,5 ч реакционную смесь обрабатывают 1N соляной кислотой, перемешивают в течение часа при 25oC нейтрализуют 10%-ным водным раствором карбоната натрия. После этого ее встряхивают в делительной воронке с уксусноэтиловым эфиром, органическую фазу отделяют, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении.
Целевое соединение формулы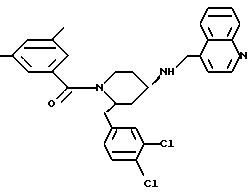
выделяют c помощью колоночной хроматографии на силикагеле, используя в качестве подвижной фазы смесь дихлорметана и изопропанола в соотношении 9:1.
Тонкослойная хроматография (дихлорметан/изопропанол, 9:1); Rf = 0,51. FD-MS: M+ = 449.
Исходное соединение может быть получено следующим образом:
a) (2R*,4S*)-N-ацетил-1-бензилоксикарбонил-2-фенил-4-пиперидинамин
К раствору 2,03 г (9,90 ммоль) N-бут-3-ен-1-ил-O-бензилкарбоксамида и 1,14 г (10,7 ммоль) бензальдегида в 1 мл (810,6 ммоль) ацетангидрида и 20 мл ацетонитрила добавляют при -20oC 1,41 мл (12,0 ммоль) четыреххлористого олова. Смесь выдерживают в течение 16 ч при -20oC, после чего обрабатывают ее 10%-ным раствором гидрокарбоната натрия и подвергают экстракции уксусноэтиловым эфиром. Органическую фазу высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Полученное сырое целевое соединение кристаллизуют из смеси уксусноэтилового эфира и гексана. Tпл = 139-140oC.
CI-MS:(M+H)+ = 353, (M+NH4)+= 370.
b) (2R*,4S*)-N-ацетил-1-(3,5-диметилбензоил)-2-фенил-4-пиперидинамин
Раствор 496 мг (1,41 ммоль) (2R*,4S*)-ацетил-1-бензил-оксикарбонил- 2-фенил-4-пиперидинамина в 30 мл этанола и 8 мл 1N соляной кислоты смешивают с 50 мг 1%-ного Pd/C и перемешивают в атмосфере водорода до прекращения его поглощения. После этого катализатор отфильтровывают через диатомовую землю и фильтрат упаривают досуха при пониженном давлении. Остаток растворяют в воде и в 5 мл дихлорметана и 5 мл 10%-ного водного раствора гидрокарбоната натрия и при перемешивании в течение часа при 0oC медленно смешивают с 285 мг (1,69 ммоль) 3,5-диметилбензоилхлорида. Реакционную смесь подвергают экстракции дихлорметаном, органическую фазу отделяют, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Целевое соединение перекристаллизовывают из уксусноэтилового эфира.
Tпл = 201-203oC. CI-MS: (М+Н)+ = 351.
Пример 95.
(2R*,4S*)-1-(3,5-дихлорбензоил)-2-фенил-N-(4-хинолилметил)- 4-пиперидинамин
Целевое соединение формулы
может быть получено таким же образом, как это описано в примере 94.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака. 90:9,5:0,5); Rf = 0,46. FD-MS: M+ = 489.
Исходное соединение может быть получено следующим образом:
a) (2R*,4S*)-N-ацетил-1-(3,5-дихлорбензоил)-2-фенил-4-пиперидинамин
Целевое соединение получают таким же образом, как это описано в примере 94b, исходя из 3,5-дихлорбензоилхлорида. Tпл = 161-163oC.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:9,5:0,5); Rf = 0,55.
Пример 96.
(2R*,4S*)-1-(1-нафтоил)-2-фенил-N-(4-хинолилметил)-4-пиперидинамин
Целевое соединение формулы
получают таким же образом, как это описано в примере 95.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:9,5:0,5); Rf = 0,41. FD-MS: M+ = 471.
Исходное соединение может быть получено следующим образом:
a) (2R*,4S*)-N-ацетил-1-(1-нафтоил)-2-фенил-4-пиперидинамин
Целевое соединение получают таким же образом, как это описано в примере 94b.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:9,5:0,5); Rf = 0,42.
Пример 97.
(2R*, 4S*)-1-(3.5-диметилбензоил)-2-(1-нафтил)-N-(4-хинолилметил)- 4-пиперидинамин
Целевое соединение формулы
получают таким же образом, как это описано в примере 94.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:9,5:0,5); Rf = 0,50. FD-MS: M+ = 499.
Исходное соединение может быть получено следующим образом:
a) (2R*,4S*)-N-ацетил-1-бензилоксикарбонил-2-(1-нафтил)-4-пиперидинамин
Целевое соединение получают таким же образом, как это описано в примере 94a, исходя из нафталин-1-карбоксальдегида (вместо бензальдегида).
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:9,5:0,5); Rf = 0,31. FD- MS: M+ = 402.
b) (2R*, 4S*)-N-ацетил-1-(3.5-диметилбензоил)-2-(1-нафтил)-4-пиперидинамин
Целевое соединение получают таким же образом, как это описано в примере 94b.
Тонкослойная хроматография (дихлорметан/метанол/25%-ный раствор аммиака, 90:9,5:0,5); Rf = 0,26. FD-MS: M+ = 400.
Пример 98.
Таким же образом, как это описано в примерах 85-97, могут быть получены следующие соединения:
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(2-нафтил)-N-(4-хинолилметил)- 4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(4-метоксифенилметил)- N-(4-хинолилметил)-4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(3-метоксифенилметил)- N-(4-хинолилметил)-4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(4-нитробензил)-N-(4-хинолилметил)- 4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(4-трифторметилфенилметил)- N-(4-хинолилметил)-4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(2,4-дихлорфенилметил)- N-(4-хинолилметил)-4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(2-фенилэтил)-N-(4-хинолилметил)- 4-пиперидинамин,
(2R*, 4S*)-1-(3,5-димeтилбeнзoил)-2-(2-фeнилэтeнил)-N-(4-xинoлилмeтил)- 4-пиперидинамин,
(2R*, 4S*)-l-(3,5-диметилбензоил)-2-бензоил-N-(4-хинолилметил)- 4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(4-хлорбензил)-N-(4-хинолилметил)- 4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(бензоилметил)-N-(4-хинолилметил)- 4-пиперидинамин,
(2R*, 4S*)-1-(3,5-диметилбензоил)-2-(4-хлорбензоилметил)- N-(4-хинолилметил)-4-пиперидинамин.
Пример 99.
Таблетки, содержащие по 50 мг (2R,4S)-2-бензил-1-(3,5-диметилбензоил)- N-(2-фенетил)-4-пиперидинамина или его соли, например, гидрохлорида, могут быть получены следующим образом.
Состав для 10000 таблеток, г:
Активное вещество - 500,0
Лактоза - 500,0
Картофельный крахмал - 352,0
Желатин - 8,0
Тальк - 60,0
Стеарат магния - 10,0
Диоксид кремния (высокодисперсный) - 20,0
Этанол - Нужное количество
Активное вещество смешивают c лактозой и 292 г картофельного крахмала, смесь увлажняют этанольным раствором желатина и гранулируют, пропуская через сито. После высушивания добавляют остальное количество крахмала, стеарат магния, тальк и диоксид кремния, и прессуют из смеси таблетки весом по 145,0 мг с содержанием активного вещество 50,0 мг, на которых при желании могут быть сделаны насечки для удобства при необходимости применять меньшую дозировку.
Пример 100.
Таблетки с лаковой оболочкой, содержащие по 100 мг (2R,4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-фенетил)-4-пиперидинамина или его соли, например, гидрохлорида, могут быть получены следующим образом.
Состав для 1000 таблеток, г:
Активное вещество - 100,0
Лактоза - 100,0
Кукурузный крахмал - 70,0
Тальк - 8,5
Стеарат кальция - 1,5
Оксипропилметилцеллюлоза - 2,36
Шеллак - 0,64
Вода - Нужное количество
Метиленхлорид - Нужное количество
Смешивают активное вещество, лактозу и 40 г кукурузного крахмала, увлажняют смесь клейстером, приготовленным из 15 г кукурузного крахмала и воды (при нагревании) и гранулируют. Гранулят высушивают, добавляют к нему остальное количество кукурузного крахмала, тальк и стеарат кальция и перемешивают смесь, после чего прессуют из нее таблетки весом 280 мг, которые лакируют раствором оксипропилметилцеллюлозы и шеллака в метиленхлориде. Вес готовых лаковых таблеток 283 мг.
Пример 101.
Желатиновые капсулы, содержащие 100 мг активного вещества, например, (2R, 4S)-2-бензил-1-(3,5-диметилбензоил)-N-(2-фенетил)- 4-пиперидинамина или его соли, например, гидрохлорида, могут быть, например, получены следующим образом.
Состав для 1000 капсул, г:
Активное вещество - 100,0
Лактоза - 250,0
Микрокристаллическая целлюлоза - 30,0
Лаурилсульфат натрия - 2,0
Стеарат магния - 8,0
Лаурилсульфат натрия просеивают через сито с размером ячеек 0,2 мм в лиофилизированное активное вещество. Оба компонента тщательно перемешивают. Затем в смесь просеивают вначале лактозу через сито с размером ячеек 0,6 мм, а затем микрокристаллическую целлюлозу через сито с размером ячеек 0,9 мм и смесь снова тщательно перемешивают в течение 10 мин. После этого в нее просеивают стеарат магния через сито с размером ячеек 0,8 мм. После перемешивания в течение еще 3 мин по 390 мг полученной композиции заполняют в желатиновые капсулы размера O.
Пример 102.
Таким же образом, как это описано в примерах 99-101, могут быть получены фармацевтические составы, содержащие другое активное вещество формулы 1 в соответствии с одним из вышеприведенных примеров.
Биологические испытания полученных соединений на антагонистическое действие по отношению к веществу P проводились на тест модели Andrews и Heime (Regul. Pept. 25, 267-275, 1989). Результаты испытаний представлены в таблице.
Полученные соединения не обладают сколько-нибудь выраженной токсичностью и могут быть отнесены к группе малотоксичных веществ.

Изобретение относится к новым 1,2,4-замещенным пиперидинам формулы 1, где R1 - незамещенный или замещенный галогеном и/или трифторметилом фенил или дифенил-C1-C4-алкил, ; 9-флуоренил, пирадил-C1-C4-алкил; хинолил-C1-C4-алкил; 5-хлор-2-[1H-1,2,4-триазолил-1-ил]-фенокси-C1-C4-алкил, незамещенный или замещенный C1-C4-алкилом, C1-C4-алкоксилом, гидроксилом, галогеном, трифторметилом, ди-C1-C4-алкиламино-группой и/или цианогруппой бензоил; нафтоил; 2-флуореноил; фенил- или дифенил-C2-C4-алканоил; нафтил-C2-C4-алканоил; диметилциклогексаноил; хинолилкарбонил; пиридил-C2-C4-алканоил; бензилоксикарбонил, незамещенный или замещенный ацетилом или 4-карбоксамидобутироилом фенилаланинил или фенилкарбамоил; 2,3,4,9-тетрагидро-1Н-пиридо[3,4-b] индол-3-ил-карбонил; R2 - незамещенный или замещенный галогеном фенил или нафтил; R3 - водород, C1-C4-алкил, циклогексил- или фенилкарбамоил, или 3-аминокарбонилпропионил; R4 - в случае необходимости замещенный C1-C4-алкилом или C1-C4-алкоксилом фенил, нафтил, бензил, пиридил, в случае необходимости, C-замещенный C1-C4-алкоксилом или N-замещенный C2-C4-алканоилом индолил; хинолил; бензофуранил; в случае необходимости замещенный C1-C4-алкилом бензтиофенил, дигидробензопиранил или анилино-группа, X1 - простая связь, метилен, гидроксиметилен или карбонил, X2 - простая связь, X3 - простая связь, метилен, этилен, бензилиден или карбонил или их солям. Соединения формулы 1 обладают антагонистическим действием по отношению к веществу P и являются основой фармацевтической композиции, обладающей указанным действием. Изобретение также относится к промежуточным производным пиперидона формулы X и их кислотно-аддитивным солям, где R1 означает при необходимости замещенный C1-C4-алкилом, C1-C4-алкоксилом, гидроксилом, галогеном, трифторметилом, ди-C1-C4-алкиламино и/ии цианогруппой бензоил нафтоил, 9-флуоренил; хинолилкарбонил, R2 - незамещенный или замещенный галогеном фенил или нафтил, X1 - гидроксиметилен. Соединения формулы 1, где X3 означает карбонил, получают взаимодействием аминов формулы III, в которой R1, R2, R3, X1 и X2 имеют вышеуказанные значения с кислотами формулы IV, где R1 имеют вышеуказанные значения, или их реакционно-способными производными. Соединения формулы 1, где R3 означает водород, получают путем удаления защитной группы в соединениях формулы IX. Промежуточные соединения формулы X получают взаимодействием соединений формулы Xa с соединением, вводящим R4 остаток. 6 с. и 98 з.п. ф-лы, 1 табл. Формулы соединений: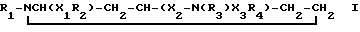

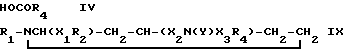

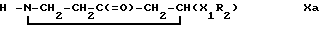 л
л

где R1 - незамещенный или замещенный галогеном и/или трифторметилом фенил- или дифенил-C1 - C4-алкил; 9-флуоренил; пиридил-C1 - C4-алкил; хинолил - C1 - C4-алкил; 5-хлор-2-[1H-1,2,4-триазол-1-ил] -фенокси-C1 - C4-алкил; незамещенный или замещенный C1 - C4-алкилом, C1 - C4-алкоксилом, гидроксилом, галогеном, трифторметилом, ди-C1 - C4-алкиламиногруппой и/или цианогруппой бензоил; нафтоил; 9-флуореноил; фенил- или дифенил-C2 - C4-алканоил; нафтил-C2 - C4-алканоил; диметилциклогексаноил; хинолилкарбонил; пиридил-C2 - C4-алканоил; бензилоксикарбонил; незамещенный или замещенный ацетилом или 4-карбоксамидобутироилом фенилаланил или фенилкарбамоил; 2,3,4,9-тетрагидро-1H-пиридо-[3,4-b]индол-3-илкарбонил;
R2 - незамещенный или замещенный галогеном фенил или нафтил;
R3 - водород; C1 - C4-алкил, циклогексил- или фенилкарбамоил или 3-аминокарбонилпропионил;
R4 - в случае необходимости, замещенный C1 - C4-алкилом или C1 - C4-алкоксилом фенил, нафтил, бензил, пиридил; в случае необходимости, C-замещенный C1 - C4-алкоксилом или N-замещенный C2 - C4-алканоилом индолил; хинолил; бензофуранил; в случае необходимости, замещенный C1 - C4-алкилом бензтиофенил; дигидробензопиранил или анилиногруппу;
X1 - простая связь, метилен, гидроксиметилен или карбонил;
X2 - простая связь;
X3 - простая связь, метилен, этилен, бензилиден или карбонил,
или их соли.
где R1 - незамещенный или замещенный C1 - C4-алкилом, C1 - C4-алкоксилом, гидроксилом, галогеном, трифторметилом, ди-C1 - C4алкиламино- и/или цианогруппой бензоил; нафтоил; 9-флуоренил; хинолилкарбонил;
R2 - незамещенный или замещенный галогеном фенил или нафтил;
X1 - гидроксиметилен,
или их кислотно-аддитивные соли.
в которой R1, R2, R3, R4, X1 и X2 имеют значения, определенные в п.1 формулы,
X3 - карбонил,
или их солей, отличающийся тем, что соединение формулы III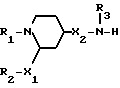
в которой R1, R2, R3, X1 и X2 имеют вышеуказанные значения,
подвергают взаимодействию с кислотой формулы IV
где R4 имеет вышеуказанное значение,
или ее реакционно-способным производным и полученную при этом смесь изомеров, при необходимости, разделяют на компоненты и отделяют предпочтительный изомер и/или полученное свободное соединение переводят в соль или полученную соль переводят в свободное соединение.
в которой R1, R2, X1, X2 и X3 имеют значения, определенные в п.1 формулы,
или их солей, отличающийся тем, что в соединении формулы IX
в котором R1, R2, R4, X1, X2 и X3 имеют вышеуказанные значения,
Y - аминозащитная группа,
или его соли, удаляют защитную группу Y и полученную при этом смесь изомеров, при необходимости, разделяют на компоненты и отделяют предпочтительный изомер и/или полученное свободное соединение переводят в соль или полученную соль переводят в свободное соединение.
в которой R1, R2 и X имеют значения, определенные в п.96, или их кислотно-аддитивных солей, отличающийся тем, что производное пиперидона общей формулы Xa
в которой R2 имеет вышеуказанные значения,
подвергают взаимодействию с соединением, вводящим R1 остаток, с последующим выделением целевого соединения в свободном виде или в виде кислотно-аддитивной соли.
| EP, 0428434A1, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-07-10—Публикация
1992-08-11—Подача