Изобретение касается производных N-фенил-2-пиримидинамина формулы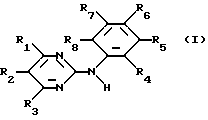
где R1 означает связанный атомом углерода пиридил и N-оксидопиридил, R2 и R3 означают водород, R4 - водород или низший алкил, R5 - водород, низший алкил или трифторметил, R6 - водород, R7 - нитро, фторзамещенный низший алкоксил или остаток формулы II
-N(R9)-C(=O)-R10 (II)
где R9 - водород, R10 - означает связанный атомом углерода пиридил, C5-C7-алкил, тиенил, 2-нафтил или циклогексил, или необязательно замещенный галоидом, цианогруппой, низшим алкоксилом, карбоксилом, низшим алкилом или 4-метилпиперазинилметилом фенил, R8 - водород, или солей этих соединений по меньшей мере с одной солеобразующей группой.
Связанный атомом углерода с пиримидиновым кольцом пиридил означает 2-, 4-, или 3-пиридил, предпочтительно 3-пиридил.
Фторзамещенный низший алкоксил означает низший алкоксил, несущий один, предпочтительно несколько фторзаместителей, в частности, трифторметокси или 1,1,2,2-тетрафторэтокси.
Приставка "низший" в рамках данного изобретения означает радикалы, имеющие 1-7 атомов углерода, предпочтительно 1-4 атома углерода.
Низший алкил означает предпочтительно метил или этил.
Алифатический радикал R10 по меньшей мере с 5 атомами C имеет предпочтительно не более чем 22 атома C, как правило, не более чем 10 атомов C и обозначает замещенный или предпочтительно незамещенный алкинильный, алкенильный или предпочтительно алкильный радикал, как, например, C5-C7-алкил, например н-пентил. Ароматический радикал R10 имеет до 20 атомов C и является незамещенным или замещенным, например, соответственно незамещенный или замещенный нафтил, как, в частности, 2-нафтил, или предпочтительной фенил, причем заместители отобраны предпочтительно из циано, незамещенного или замещенного гидрокси, амино или 4-метилпиперазинил (низшим алкилом), как, в частности, метил, из трифторметила, свободного, этерифицированного гидрокси, свободного алкилированного или ацилированного амино и из свободного или этерифицированного карбокси. В ароматическо-алифатическом радикале R10 ароматическая часть имеет вышеуказанное определение, а алифатическая часть обозначает предпочтительно низший алкил, как, например, C1-C2-алкил, который является замещенным или предпочтительно незамещенным, например, бензил. Циклоалифатический радикал R10 имеет, в частности, до 30, преимущественно до 20, и в первую очередь до 10 атомов C, является моно- или полициклическим и замещенным или предпочтительно незамещенным, например, в частности, 5- или 6-звенный циклоалкильный радикал, как, например, предпочтительно циклогексил. В циклоалифатическо-алифатическом радикале радикал R10 обозначает циклоалифатическую часть, как указано выше, а алифатическая часть обозначает предпочтительно низший алкил, как, например. C1-C2-алкил, который является замещенным или предпочтительно незамещенным. Гетероциклический радикал R10 содержит, в частности, до 20 атомов C и предпочтительно насыщенный или ненасыщенный моноциклический радикал с 5 или 6 кольцевыми звеньями и 1-3 гетероатомами, которые отобраны предпочтительно из азота, кислорода и серы, в частности, например, тиенил или 2-, 3- или 4-пиридил или би- или трициклический радикал, где, например, на указанном моноциклическом радикале конденсируются (аннелируются) один или два бензольных радикала. В гетероциклически-алифатическом радикале радикал R10 обозначает гетероциклическую часть, как определено выше, а алифатическая часть обозначает предпочтительно низший алкил, как, например, C1-C2-алкил, который является замещенным или предпочтительно незамещенным. Этерифицированная простым эфиром гидроксильная группа обозначает предпочтительно низший алкокси. Этерифицированная сложным эфиром гидроксильная группа представляет собой этерифицированную сложным эфиром гидроксильную группу, предпочтительно с органической карбоновой кислотой, как, например, низшей алкановой кислотой, или с неорганической кислотой, как, например, галогенводородной кислотой, как, например, низший алканоилокси или, в частности, галоген, как, например, иод, бром или, в частности, фтор или хлор.
Алкилированный амино представляет собой, например, низший алкиламино, как, например, метиламино, или ди-низший алкиламино, как, например, диметиламино. Ацилированный амино представляет собой, например, низший алканоиламино или бензоиламино.
Этерифицированный сложным эфиром карбоксил представляет собой, например, низший алкоксикарбонил, как, например, метоксикарбонил.
Замещенные фенильный радикал может нести до 5 заместителей, как, например, фтор, однако, в частности, при более крупных заместителях, как правило, замещается только одно-трехкратно. В качестве примеров для замещенного фенила следует отметить 4-хлорфенил, пентафторфенил, 2-карбоксифенил, 2-метоксифенил, 4-фторфенил, 4-цианофенил и 4-метилфенил.
Солеобразующие группы в соединении формулы I представляют собой группы или радикалы с основными или кислыми свойствами. Соединения по меньшей мере с одной основной группой или по меньшей мере одним основным радикалом, например, одной свободной аминогруппой, одним пиразинилрадикалом или одним пиридилрадикалом могут образовать соли присоединения кислоты, например, с неорганическими кислотами, как, например, соляной кислотой, серной кислотой или фосфорной кислотой, или с подходящими органическими карбоновыми или сульфокислотами, например, алифатическими моно- и дикарбоновыми кислотами, как, например, трифторуксусная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, оксималеиновая кислота, яблочная кислота, винная кислота, лимонная кислота, щавелевая кислота или аминокислоты, как, например, аргинин или лизин, ароматическими карбоновыми кислотами, как, например, бензойная кислота, 2-феноксибензойная кислота, 2-ацетоксибензойная кислота, салициловая кислота, 4-аминосалициловая кислота, ароматически-алифатические карбоновые кислоты, как, например, миндальная кислота или коричная кислота, гетероароматическими карбоновыми кислотами, как, например, никотиновая кислота или изоникотиновая кислота, алифатическими сульфокислотами, как, например, метан-, этан- или 2-оксиэтансульфокислота, или ароматическими сульфокислотами, как, например, бензоил-, п-толуол- или нафталин-2-сульфокислота. При наличии нескольких основных групп могут образоваться соли присоединения моно- или поликислот.
Соединения формулы I с кислыми группами, например, свободной карбоксильной группой в радикале R10, могут образовать соли металлов или аммония, как, например, соли щелочных или щелочноземельных металлов, например соли натрия, калия, магния или кальция или соли аммония с аммиаком или подходящими органическими аминами, как, например, тритичными моноаминами, например, триэтиламином или три-(2-оксиэтил)-амином, или гетероциклическими основаниями, например, N-этилпиперидином или N,N'-диметилпиперазином.
Соединения формулы I, имеющие как кислые, так и основные группы, могут образовать внутренние соли.
Для выделения или очистки соединений, также используемых в качестве промежуточного продукта, могут найти применение фармацевтически непригодные соли. Для терапевтического использования применяют только фармацевтически пригодные, нетоксичные соли, являющиеся вследствие этого предпочтительными.
Вследствие тесной взаимосвязи между новыми соединениями в свободной форме и в форме их солей, включая такие соли, которые могут использоваться как промежуточные продукты, например, при очистке новых соединений или для их идентификации, под свободными соединениями, упомянутыми выше и указанными ниже, следует понимать также соответствующие соли.
Соединения формулы I имеют ценные фармакологические свойства и могут использоваться, например, как противоопухолевое средство и как средство против атеросклероза.
Фосфорилирование белков давно известно, как важное средство, используемое при дифференцировании и размножении клеток. Фосфорилирование катализируется посредством протеинкиназ, которые подразделяют на серин/треонинкиназы и тирозинкиназы. К серин/треонинкиназам относится протеинкиназа C, к тирозинкиназам относится тирозинкиназа рецептора PDGF (фактор роста производный тромбоцита).
Соединения формулы I, где R4 и R8 обозначают водород, избирательно подавляют фермент протеинкиназу C.
Протеинкиназа C, зависящая от фосфолипидов или кальция, встречается внутри клетки в нескольких видах (распределение видов по тканевым особенностям) и участвует в различных основных процессах, как, например, передача сигнала, пролиферация и дифференцирование, а также извлечение гормонов и нейротрансмиттеров. Активизация этого фермента осуществляется либо путем гидролиза фосфолипидов клеточной мембраны с помощью рецепторов, либо путем прямого взаимодействия с определенными биологически активными веществами, ускоряющими рост опухоли. Клеточные функции, управляемые протеинкиназой C, могут подвергаться воздействию в результате изменения ферментной активности протеинкиназы C.
Для определения подавляющего воздействия на протеинкиназу C используют протеинкиназу C из свиного головного мозга, которую очищают по способу, описанному T. Uchida и C. R. Filburn в журнале J. Biol. Chem. 259, 12311-4 (1984). Определение подавляющего действия на протеинкиназу C соединений формулы I осуществляется по методике D. Fabro et al., Arch. Biochem. Biophys. 239, 102-111 (1985). В этом испытании соединения формулы I подавляют протеинкиназу C уже при концентрации IC50 и примерно между 0,1 и 10 мкмоль/л, в частности, примерно между 0,05 и 5 мкмоль/л. В противоположность этому соединения формулы I подавляют другие ферменты, например, протеинкиназу A, протеинфосфорилазукиназу и определенные типы протеинтирозинкиназы, например, протеинтирозинкиназа рецептора EGF (эпидермический фактор роста), лишь при значительно повышенной концентрации, например, в сто раз. Это показывает избирательность соединений формулы I. Принимая во внимание снижение нежелательных побочных действий, важно, чтобы вещества, подавляющие протеинкиназу C, были по возможности избирательны. Таким образом другие ферменты подвергаются, по возможности, незначительному воздействию, в частности, если влияние активности других ферментов, учитывая излечиваемую болезнь, не имеет равнодействующего или синергистического эффекта.
Основываясь на подавляющее действие на протеинкиназу C соединения формулы I, где R4 и R8 обозначают водород, и их соли, используемые в фармацевтике, могут применяться в качестве подавляющих рост опухоли, иммуномодулированных и антибактериальных биологически активных веществ, кроме того, как средство против атеросклероза, заболевания иммунной системы СПИДа, а также заболеваний сердечно-сосудистой системы и центральной нервной системы.
Как уже было сказано выше о подавляющем действии на протеинкиназу C, соединения формулы I, где R4 и R8 обозначают водород, и их соли, используемые в фармацевтике, имеют свойства, направленные против быстрого увеличения новообразований, которые можно продемонстрировать на следующем опыте: При этом определяется подавляющее действие соединений формулы I на рост человеческих раковых клеток мочевого пузыря Т24. Эти клетки инкубируют в "минимальной поддерживающей среде Eagle", в которую добавляют 5% (v/v) зародышевую телячью сыворотку, во влажном инкубаторе при температуре 37oC и 5 объемных процентах CO2 в воздухе. Раковые клетки (1000 - 1500) пересевают в 96-ячейковые микротитрационные планшеты и инкубируют в вышеуказанных условиях в течение ночи. Испытуемое вещество добавляют разбавленным в первый день. Планшеты инкубируют в вышеуказанных условиях в течение 5 дней. В течение этого промежутка времени контрольные культуры проходят, по меньшей мере, 4 разделения клеток. После инкубации клетки фиксируют 3,3% (вес/объем) водным глутаральдегидным раствором, промывают водой и окрашивают 0,05% (вес/объем) водным метиленовым синим раствором. После промывки красящее вещество элюируют 3% (вес/объем) водной соляной кислотой. Затем измеряют оптическую плотность (ОП) в каждой ячейке, прямопропорциональную количеству клеток, с помощью фотометра (Titertek multiskan) при 665 нм. Величины IC50 рассчитывают с помощью компьютерной системы при использовании формулы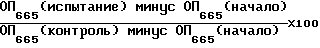
Величины IC50 определяют ту концентрацию биологически активных веществ, при которой количество клеток на каждую ячейку в конце инкубационного времени достигает только 50% количества клеток в контрольных культурах. Полученные таким образом величины IC50 находятся для соединений формулы I примерно между 0,1 и 10 мкмоль/л.
На основании описанных свойств соединения формулы I, где R4 и R8 обозначают водород, могут применяться в качестве биологически активных веществ, подавляющих опухолевые новообразования, например, для терапии опухоли мочевого пузыря.
Кроме того, они могут использоваться, как указано выше, для изменения протеинкиназы C, и, в частности, для болезней, требующих подавления протеинкиназы C.
Соединения формулы I, где R4 и R8 обозначают водород, подавляют частично не только протеинкиназу C, а уже при концентрации IC50 примерно между 0,01 и 5 мкмоль/л, в частности, примерно между 0,05 и 1 мкмоль/л, также определенные тирозинкиназы, как, например, PDGF-рецептор-киназа или abl-киназа, например, v-abl-киназа. Соединения формулы I, где радикал R4 отличается от водорода и обозначает, например, низший алкил, как, например, метил, особенно избирательны для PDGF- и abl-тирозинкиназ и практически не подавляют протеинкиназу C.
PDGF (фактор роста производный тромбоцита) представляет собой очень часто встречающийся фактор роста, играющий важную роль как при нормальном росте, так и при патологическом размножении клеток, как, например, при возникновении рака и при заболеваниях гладких мышечных клеток кровеносных сосудов, например при атеросклерозе и тромбозе.
Подавление протеинкиназы C и киназы рецептора PDGF действует в этом смысле с квазисинергическим эффектом в одинаковом направлении относительно регулирования роста клеток.
Подавление активности тирозинкиназы рецептора, стимулирующего PDGF, измеряют in vitro в иммунокомплексах рецептора PDGF клеток BALB/c3T3, аналогично описанию E. Andrejaukas-Buchdunger и U. Regenass в Cancer Research 52, 5353-5358 (1992).
Вышеуказанные соединения формулы I подавляют PDGF-зависимое бесклеточное фосфорилирование рецептора при концентрации 0,005 - 5 мкмоль/л, в частности, 0,01 - 1,0, преимущественно 0,01 - 1,0 мкмоль/л. Подавление тирозинкиназы рецептора PDGF в целых клетках прослеживается с помощью графического анализа Вестерна (Western), также аналогично описанию в вышеуказанной публикации в Cancer Research. В этом испытании подавление стимулированного лигандой автофосфорилирования рецептора PDGF в мышиных клетках BALB/c измеряют с помощью антител анти-фосфотирозина. Вышеуказанные соединения формулы I подавляют активность тирозинкиназы рецептора PDGF при концентрации 0,005 - 5 мкмоль/л, в частности, 0,01 - 1,0, предпочтительно 0,01 - 0,1 мкмоль/л. Кроме того, эти соединения в концентрации ниже 1,0 мкмоль/л также подавляют рост клеток клеточной линии, зависимой от PDGF, а именно мышиных фибробластов BALB/c3T3.
Вышеуказанное подавление v-abL-тирозинкиназы определяется по методам N. Lydon et al., Oncogene Research 5, 161-173 (1990) и J. F. Geissler et al., Cancer Research 52, 4492 - 4498 (1992). При этом в качестве субстратов применяют [Val5]-ангиотензин II и [ γ- 32P]-ATP.
На основании описанных свойств соединения формулы I могут применяться не только в качестве биологически активных веществ, подавляющих опухолевые новообразования, но также в качестве средства против атеросклероза и тромбоза. Кроме того, они рассматриваются как модуляторы протеинкиназы C и могут применяться, в частности, для лечения болезней, требующих подавления киназы рецептора PDGF.
Кроме того, соединения формулы I препятствуют образованию сопротивляемости (сопротивляемость многим лекарственным препаратам) при лечении рака другими химиотерапевтическими средствами или устраняют уже имеющуюся сопротивляемость против других химиотерапевтических средств.
В первую очередь предпочтительными являются следующие соединения:
производные N-фенил-2-пиримидинамина формулы I, в которой R4 означает водород, а остальные заместители имеют вышеприведенные для формулы I значения, и их фармацевтически приемлемые соли, содержащие по меньшей мере одну солеобразующую группу;
производные N-фенил-2-пиримидинамина формулы I, в которой R4 означает низший алкил, а остальные заместители имеют вышеприведенные для формулы I значения, и их фармацевтически приемлемые соли, содержащие по меньшей мере одну солеобразующую группу;
производные N-фенил-2-пиримидинамина формулы I, где R1 означает связанный атомом углерода пиридил, R2, R3, R4, R5, R6 и R8 означают водород, а R7 означает нитрогруппу или остаток формулы II, где R9 означает водород, R10 представляет собой связанный атомом углерода пиридил, C5-C7алкил, тиенил, циклогексил или необязательно замещенный фтором, хлором, цианогруппой, низшим алкоксилом, карбоксилом, низшим алкилом или 4-метилпиперазинилметилом фенил, и их фармацевтически приемлемые соли.
Из указанных соединений особенно предпочтительными являются следующие соединения
N-(3-нитрофенил)-4-(3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(4-хлорбензоиламидо)-фенил] -4-(3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-(3-бензоиламидофенил)-4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(2-пиридил)карбоксамидофенил] -4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(3-пиридил)карбоксамидофенил] -4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(4-пиридил)карбоксамидофенил] -4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-(3-пентафторбензоиламидофенил)-4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(2-карбоксибензоиламдо)-фенил] -4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-(3-п-гексаноиламидофенил)-4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-(3-нитрофенил)-4- (4-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(2-метоксибензоиламидо)-фенил] -4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(4-фторбензоиламидо)-фенил]-4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(4-цианобензоиламидо)-фенил] -4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(2-тиенилкарбоксамидо)-фенил] -4- (3-пиридил)-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-(3-циклогексилкарбоксамидофенил)-4- (3-пиридил-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(4-метилбензоиламидо)-фенил]-4- (3-пиридил-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[3-(4-хлорбензоиламдо)-фенил] -4- (4-пиридил-2-пиримидинамин, или его фармацевтически приемлемая соль;
N{ 3-[4-(4-метилпиперазинометил)-бензоиламидо] -фенил}-4- (3-пиридил-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-(5-бензоиламидо-2-метилфенил)-4- (3-пиридил-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-{5-[4-(4-метилпиперазинометил)-бензоиламидо]-2-метилфенил}-4- (3-пиридил-2-пиримидинамин, или его фармацевтически приемлемая соль;
N-[5-(4-метилбензоиламидо)-2-метилфенил] -4- (3-пиридил-2-пиримидинамин, или его фармацевтически приемлемая соль.
Соединения формулы I и соли этих соединений по меньшей мере с одной солеобразующей группой могут быть получены следующими способами:
а) соединение формулы III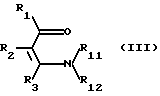
где R11 и R12 независимо друг от друга означают низший алкил и R1, R2 и R3 имеют вышеуказанные значения, причем, если в соединении формулы III имеются функциональные группы, то они могут быть, при необходимости, защищены, за исключением групп, участвующих в реакции, или соль этого соединения подвергают взаимодействию с соединением формулы IV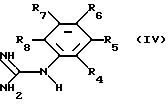
где заместители имеют вышеуказанные значения, или его солью, причем существующие в соединении формулы IV функциональные группы, за исключением гуанидиновой группы, участвующей в реакции, находятся при необходимости в защищенной форме, и отщепляют имеющиеся защитные группы;
б) для получения соединения формулы I, где радикалы R4, R5, R6 и R8 имеют вышеуказанные значения, и R7 означает остаток формулы II -N(R9)-C(= O)-R10 соединение формулы V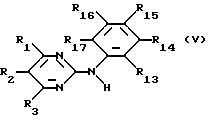
где радикал R16 означает аминогруппу, а радикалы R13, R14, R15 и R17 означают водород, и остальные заместители, имеющие вышеуказанные значения, подвергают взаимодействию с соединением формулы VI
HO-C(=O)-R10 (IV)
где заместители и символы имеют вышеуказанные значения, причем имеющиеся в соединении формулы VI функциональные группы, за исключением участвующей в реакции HO-C(=O)-группы существуют при необходимости в защищенной форме, или подвергают взаимодействию с реакционноспособным производным соединения формулы VI и отщепляют в случае необходимости имеющиеся защитные группы;
в) для получения соединения формулы I, где R1 означает N-оксидопиридил, и где прочие заместители и символы имеют вышеуказанные значения, соединение формулы I, где R1 означает пиридил, преобразуют с помощью подходящего окислителя в N-оксидосоединение, и при необходимости полученное по одному из способов а)-в) соединение формулы I преобразуют в его соль, или полученную соль соединения формулы I преобразуют в свободное соединение.
Осуществление вышеуказанных вариантов способа разъясняется нижеследующим образом:
В общем плане:
Конечные вещества формулы I могут содержать заместители, которые могут использоваться в качестве защитных групп в исходных веществах для получения других конечных веществ формулы I. Поэтому в качестве "защитной группы" в рамках этого текста, если не подразумевается другое, называется только такая легко отщепляемая группа, которая не является составной частью соответствующего требуемого конечного вещества формулы I.
Защитные группы, их введение и отщепление описаны, например, "Protective Groups in Organic Chemistry", Plenum Press, London, New York, 1973, и в "Methoden der organischen Chemie", Houden-Weyl, 4. Auflage, Bd. 15/1, Georg-Thieme-Verlag, Stuttgard 1974, а также в Theodora W. Greene, "Protective Groups in Organic Synthesis", John Wiley & Sons, New York, 1981. Характерным для защитных групп является то, что они могут отщепляться без нежелательных побочных реакций, например, сольволитических, восстановительных, фотолитических или также при физиологических условиях.
Гидроксильными защитными группами являются, например, ацилрадикалы, как в данном случае, например, замещенный галогеном низший алканоил, как например, 2,2-дихлорацетил, или ацилрадикалы сложных полуэфиров угольной кислоты, в частности, третбутилоксикарбонил, в данном случае замещенный бензилоксикарбонил, например, 4-нитробензилоксикарбонил, или дифенилметоксикарбонил, или 2-галоген(низший алкоксикарбонил), как, например, 2,2,2-трихлорэтоксикарбонил, кроме того, тритил или формил, или органические силил- или станнил-радикалы, кроме того, легко отщепляемые этерифицированные простым эфиром группы, как, например, трет.-низший алкил, например, трет.-бутил, 2-окса- или 2-тиаалифатические или циклоалифатические углеводородные радикалы, в первую очередь 1-(низший алкокси)низший алкил или 1-(низший алкилтио)низший алкил, например, метоксиметил, 1-метоксиэтил, 1-этоксиэтил, метилтиометил, 1-метилтиоэтил или 1-этилтиоэтил, или 1-окса- или 2-тиациалоалкил с 5-6 кольцевыми атомами, например, тетрагидрофуран или 2-тетрагидропиранил, или соответствующие тиааналоги, а также в данном случае замещенный 1-(фенил)низший алкил, как в данном случае замещенный бензил или дифенилметил, причем в качестве заместителей фенильных радикалов рассматриваются, например, галоген, а именно хлор, низший алкокси, как, например, метокси и/или нитро.
Защищенная аминогруппа может существовать, например, в виде легко расщепляемой ациламино-, арилметиламино-, этерифицированной простым эфиром меркаптоамино-, 2-ацил-низшей-алк-1-ениламино-, силил- или станниламиногруппы или в качестве азидогруппы.
В соответствующей ациламиногруппе ацил представляет собой, например, ацилрадикал органической карбоновой кислоты, содержащей, например, до 18 атомов углерода, в частности, алканкарбоновой кислоты, замещенной в данном случае, например, галогеном или арилом, или бензойной кислоты, замещенной в данном случае, например, галогеном, низшей алкокси или нитро, или сложного полуэфира угольной кислоты. Такие ацильные группы представляют собой, например, низший алканоил, как, например, формил, ацетил или пропионил, галоген-низший алканоил, как, например, 2-галогенацетил, в частности, 2-хлор-, 2-бром-, 2-иод-, 2,2,2-трифтор- или 2,2,2-трихлорацетил, в данном случае бензоил, замещенный галогеном, низшей алкокси или нитро, например, бензоил, 4-хлорбензоил, 4-метоксибензоил или 4-нитробензоил, или разветвленный в первом положении низшего алкильного радикала или замещенный соответствующим образом в 1 или 2 положении низший алкоксикарбонил, в частности, трет.-низший алкоксикарбонил, например, трет.-бутилоксикарбонил, арилметоксикарбонил с одним или двумя арильными радикалами, представленными в данном случае предпочтительно через низший алкил, в частности, трет.-низший алкил, как, например, трет. -бутил, низший алкокси, как, например, метоксигруппа, гидроксильная группа, галоген, например, хлор, и/или нитро, одно- или многозамещенный фенил, как, например, в данном случае замещенный бензилоксикарбонил, например, 4-нитробензилоксикарбонил, или замещенный дифенилметоксикарбонил, например, бензгидрилоксикарбонил или ди-(4-метоксифенил)-метоксикарбонил, ароилметоксикарбонил, где ароильная группа представляет в данном случае, например, бензоил, замещенный предпочтительно галогеном, как, например, бром, например, фенацилоксикарбонил, 2-галоген-низший алкоксикарбонил, например, 2,2,2-трихлорэтоксикарбонил, 2-бромэтоксикарбонил или 2-иодэтоксикарбонил, или 2-(тризамещенный силил)-этоксикарбонил, где заместители независимо друг от друга означают в данном случае замещенный, например, низшим алкилом, низшей алкокси, арилом, галогеном или нитроалифатический, аралифатический, циклоалифатический или ароматический углеводородный радикал, содержащий до 15 атомов C, как, например, соответствующий, в данном случае замещенный низший алкил, фенил(низший алкил), циклоалкил или фенил, как, например, 2-[три(низший алкил)силил]этоксикарбонил, как, например 2-триметилсилилэтоксикарбонил или 2-(ди-н-бутилметилсилил)этоксикарбонил, или 2-триарилсилилэтоксикарбонил, как, например, 2-трифенилсилилэтоксикарбонил.
Другие, рассматриваемые в качестве аминозащитных групп, ацильные радикалы также представляют собой соответствующие радикалы органических фосфорных, фосфоновых или фосфиновых кислот, как, например, ди(низший алкил)фосфорил, например, диметилфосфорил, диэтилфосфорил, ди-н-пропилфосфорил или диизопропилфосфорил, дициклоалкилфосфорил, например, дициклогексилфосфорил, в данном случае незамещенный или замещенный дифенилфосфорил, в данном случае ди-(фенил-низший алкил)-фосфорил, например, дибензилфосфорил или ди-(4-нитробензил)-фосфорил, в данном случае замещенный фенилоксифенилфосфорил, например, фенилоксифенилфосфорил, ди(низший алкил)-фосфинил, например, диэтилфосфинил, или в данном случае замещенный дифенилфосфинил, например, дифенилфосфинил.
В арилметиламиногруппе, представляющей моно-, ди- или, в частности, триарилметиламиногруппу, арильные радикалы представляют собой в данном случае, например, замещенные фенильные радикалы. Такими группами являются, например, бензил-, дифенилметил- и, в частноси, тритиламиногруппы.
Этерифицированная простым эфиром меркаптогруппа в защищенной таким радикалом аминогруппе представляет собой, в первую очередь, арилтио или арил(низший алкил)тио, где арил обозначает в данном случае фенил, замещенный, например, низшим алкилом, как, например, метилом или трет.-бутилом, низшей алкокси, как, например, метокси, галогеном, как, например, хлором, и/или нитро. Соответствующая аминозащитная группа представляет собой, например, 4-нитрофенилтио.
В используемом в качестве аминозащитной группы 2-ацил-низшем алк-1-ен-1-илрадикале ацил представляет собой соответствующий радикал низшей алканкарбоновой кислоты, в данном случае замещенной, например, низшим алкилом, как, например, метилом или трет.-бутилом, низшим алкокси, как, например, метокси, галогеном, как, например, хлором и/или нитро, бензойной кислоты, или, в частности, сложного полуэфира угольной кислоты, как, например, низший алкилполуэфира угольной кислоты. Соответствующие защитные группы представляют собой, в первую очередь, 1-(низший алканоил)-проп-1-ен-2-ил, например, 1-ацетил-проп-1-ен-2-ил, или 1-(низший алкоксикарбонил)-проп-1-ен-2-ил, например 1-этоксикарбонил-проп-1-ен-2-ил.
Предпочтительными аминозащитными группами являются ацильные радикалы сложных полуэфиров угольной кислоты, в частности, трет.-бутилоксикарбонил, а данном случае, например, как указано, замещенный бензилоксикарбонил или дифенилметоксикарбонил, или 2-галоген-(низший алкоксикарбонил), как, например, 2,2,2-трихлорэтоксикарбонил, кроме того, тритил или формил. Отщепление защитных групп, которые не являются составной частью необходимого конечного продукта формулы I, осуществляется известным способом, например, с помощью сольволиза, в частности, гидролиза, алкоголиза или ацидолиза, или с помощью восстановления, в частности, гидрогенолиза или химического восстановления, в данном случае ступенчато или одновременно.
Защищенную аминогруппу освобождают известными и в зависимости от типа защитных групп различными способами, предпочтительно с помощью сольволиза или восстановления. 2-Галоген(низший алкоксикарбониламино) [в данном случае после преобразования 2-бром(низший алкоксикарбониламиногруппы) в 2-иод(низший алкоксикарбониламиногруппу)] , ароилметоксикарбониламино или 4-нитробензилоксикарбониламино может расщепляться, например, путем обработки соответствующим химическим реагентом, как, например, цинк в присутствии соответствующей карбоновой кислоты, как, например, водной уксусной кислоты. Ароилметоксикарбониламино также может расщепляться путем обработки нуклеофильным, предпочтительно солеобразующим реактивом, как, например, тиофенолят натрия, и 4-нитробензоилоксикарбониламино также путем обработки щелочным металлом, например, дитионитом натрия. В данном случае замещенный дифенилметоксикарбониламино, трет.-низший алкоксикарбониламино или 2-(тризамещенный силил)этоксикарбониламино может расщепляться путем обработки соответствующей кислотой, например, муравьиной или трифторуксусной кислотой; в данном случае замещенный бензилоксикарбониламино, например, с помощью гидрогенолиза, то есть путем обработки водородом в присутствии соответствующего канализатора гидрирования, как, например, палладиевого катализатора; в данном случае замещенный триарилметиламино или формиламино, например, путем обработки кислотой, как, например, минеральной кислотой, например, хлористоводородной кислотой, или органической кислотой, как, например, муравьиной, уксусной или трифторуксусной кислотой, в данном случае в присутствии воды, и аминогруппа, защищенная органической силильной группой, может освобождаться, например, с помощью гидролиза или алкоголиза. Аминогруппа, защищенная через 2-галогенацетил, например, 2-хлорацетил, может освобождаться путем обработки тиомочевиной в присутствии основания, или солью тиоловой кислоты, как, например, алкоголиза или гидролиза, полученного продукта конденсации. Аминогруппа, защищенная через 2-замещенный силилэтоксикарбонил, может также преобразовываться в свободную аминогруппу путем обработки солью, производящей фториданионы, фтористоводородной кислоты.
Гидроксильная группа, защищенная через соответствующую ацильную группу, органическую силильную группу или в данном случае через замещенный 1-фенил(низший алкил), освобождается аналогично соответственно защищенной аминогруппе. Гидроксильная группа, защищенная в данном случае через замещенный 1-фенил(низший алкил), например, бензил, освобождается предпочтительно путем каталитического гидрирования, например, в присутствии катализатора палладия на угле. Гидроксильная группа, защищенная через 2,2-дихлорацетил, освобождается, например, через основный гидролиз, гидроксильная группа, этерифицированная трет. -низшей алкильной группой 2-окса- или 2-тиа-алифатическим или циклоалифатическим углеводородным радикалом, через ацидолиз, например, путем обработки минеральной кислотой или сильной карбоновой кислотой, например, трифторуксусной кислотой. Гидроксильная группа, этерифицированная органическим силильным радикалом, например, триметилсилилом, также может освобождаться с помощью фториданиона соли фтористоводородной кислоты, например, фторида тетрабутиламмония.
Способ а:
Предпочтительно R11 и R12 обозначают метил.
Свободные функциональные группы в соединении формулы IV, защищенные предпочтительно легко отщепляемыми защитными группами, представляют собой, в частности, амино-, окси- и карбоксильные группы.
Соль соединения формулы IV представляет собой предпочтительно соль присоединения кислот, например, нитрат или одну из солей присоединения кислот, указанную для конечного продукта формулы I.
Реакция осуществляется в соответствующем растворителе или суспендирующем агенте, например, подходящем спирте, как, например, 2-метоксиэтанол, или подходящем низшем алканоле, например, изопропаноле, при температуре между комнатной температурой (примерно 20oC) и 150oC, например, в условиях рефлюкса. В частности, если соединение формулы IV используется в качестве соли, то эта соль, предпочтительно in situ, преобразуется посредством соответствующего основания, как, например, гидроокиси щелочного металла, например, едкого натра, в свободное соединение.
Предпочтительно исходят из соединений формулы IV, где один или два из радикалов R4, R5, R6, R7 и R8 независимо друг от друга обозначают водород, низший алкил, который является незамещенным или замещенным свободной или алкилированной аминогруппой, пиперазинилом, пиперидинилом, пирролидинилом или морфолинилом, низшим алканоилом, трифторметилом, свободной, этерифицированной простым или сложным эфиром, гидроксильной группой, алкилированной или ацилированной аминогруппой или свободной или этерифицированной сложным эфиром карбоксильной группой.
Исходный материал формулы III получают путем взаимодействия соединения формулы VII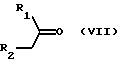
где заместители имеют вышеуказанные значения, с соединением формулы VIII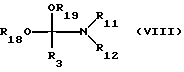
где R18 и R19 обозначают низший алкил и остальные заместители имеют вышеуказанные значения, аналогично способу, описанному в EP 233461A. Типичными представителями соединения формулы VIII является N,N-диметилформамид-диметилацеталь и N,N-диметилацетамид-диметилацеталь. Реакция осуществляется при многочасовом, например, 4 - 24-часовом нагреве реагентов формул VII и VIII<в присутствии, либо, при необходимости, в присутствии растворителя до температуры примерно между 50oC и 150oC.
Исходный материал формулы III получают альтернативным способом также путем преобразования соединения формулы VII сложным эфиром формулы R3-C(= O)-O-CH2-CH3, где R3 имеет вышеуказанное значение, и реакции полученного продукта с амином формулы H-N(R11)-R12, где заместители имеют вышеуказанные значения.
Исходный материал формулы IV получают в виде соли присоединения солей путем взаимодействия соединения формулы IX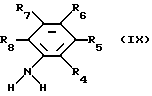
где заместители имеют вышеуказанные значения, с цианамидом (NC-NH2). Реакция осуществляется в соответствующем растворителе или суспендирующем агенте, например, соответствующем спирте, например, соответствующем низшем алканоле, как, например, этанол, в присутствии эквимолярных количеств солеобразующей кислоты при температуре между комнатной температурой и 150oC, например, в условиях рефлюкса.
Способ b:
Свободная функциональная группа в соединении формулы VI, защищена предпочтительно легко отщепляемой группой и представляет собой, в частности, карбоксильную группу, которая не должна участвовать в нужных реакциях.
Реакционноспособное производное соединения формулы VI представляет собой, в частности, реакционноспособный (активированный) сложный эфир, реакционноспособный ангидрид или реакционноспособный циклический амид.
Реакционноспособные (активированные) сложные эфиры кислоты формулы VI представляют собой, в частности, связанные по атому углерода этерифицированного радикала ненасыщенные сложные эфиры, например, типа сложного винилового эфира, как, например, непосредственно сложные виниловые эфиры (которые можно получить путем переэтерификации соответствующего сложного эфира винилацетатом; метод активированного сложного винилового эфира), сложные карбамоилвиниловые эфиры (которые можно получить, например, путем обработки соответствующей кислоты изоксазоловым реактивом; метод 1,2-оксазолия или Вудворда), или сложный 1-(низший алкокси)виниловый эфир (который можно получить, например, путем обработки соответствующей кислоты низшим алкоксиацетиленом; этоксиацетиленовый метод), или сложные эфиры типа амидинов, как, например, N,N'-дизамещенный сложный амидиноэфир (который можно получить путем обработки соответствующей кислоты соответствующим N,N'-дизамещенным карбодиимидом, например, N,N'-дициклогексилкарбодиимидом; карбодиимидный метод), или N,N'-дизамещенные сложные амидиноэфиры (которые можно получить путем обработки соответствующей кислоты N,N'-дизамещенным цианамидом; цианамидный метод), соответствующие сложные ариловые эфиры, в частности, сложные фениловые эфиры, соответственно замещенные заместителями, притягивающими электроны (которые можно получить путем обработки соответствующей кислоты соответственно замещенным фенолом, например, 4-нитрофенолом, 4-метилсульфонилфенолом, 2,4,5-трихлорфенолом, 2,3,4,5,6-пентахлорфенолом или 4-фенилдиазофенолом, в присутствии конденсационного средства, как например, N,N'-дициклогексилкарбодиимид; метод активированных сложных ариловых эфиров), сложные цианметиловые эфиры (которые можно получить путем обработки соответствующей кислоты хлорацетонитрилом в присутствии основания; метод сложного цианметилового эфира), сложный тиоэфир, в частности, в данном случае сложный фенилтиоэфир, замещенный, например, нитро (который можно получить путем обработки соответствующей кислоты в данном случае замещенным, например, нитротиофенолом, в том числе с помощью ангидридного или карбодиимидного метода; метод активированного сложного тиолового эфира), сложные амино- или амидоэфиры (которые можно получить, например, путем обработки соответствующей кислоты соединением N-оксиамино или N-оксиамидо, например, N-оксисукцинимидом, N-оксипиперидином, N-оксифталимидом или 1-оксибензтриазолом, например, по ангидридному или карбодиимидному методу; метод активированного эфира N-оксикислоты) или сложные силиловые эфиры (которые можно получить путем обработки соответствующей кислоты силилирующим средством, например, гексаметилсилазаном, но не аминогруппами).
Ангидридами кислоты формулы VI могут быть симметричные или предпочтительно смешанные ангидрид этой кислоты, как, например, ангидриды с неорганическими кислотами, как, например, галогенидангидриды кислоты, в частности, хлорангидриды кислоты, которые можно получить путем обработки соответствующей кислоты тионилхлоридом, фосфорпентахлоридом или оксалилхлоридом; метод хлорангидридной кислоты), азиды (которые можно получить из соответствующего сложного эфира кислоты через соответствующий гидразид и его обработки азотной кислотой; азидный метод), ангидриды полупроизводных угольной кислоты, как, например, соответствующих сложных эфиров, например, низших этиловых полуэфиров угольной кислоты (которые можно получить путем обработки соответствующей кислоты сложными низшими алкиловыми эфирами галогенной, как, например, хлормуравьиной кислоты или 1-низший алкоксикарбонил-2-низший алкокси-1,2-дигидрохинолином, например, 1-низший алкоксикарбонил-2-этокси-1,2-дигидрохинолином; метод смешанных ангидридов O-алкилугольной кислоты), или ангидриды дигалогенированной, в частности, дихлорированной фосфорной кислотой (которую можно получить путем обработки соответствующей кислоты хлорокисью фосфора; метод хлорокиси фосфора), или ангидриды органических кислот, как, например, смешанные ангидриды органических карбоновых кислот (которые можно получить путем обработки соответствующей кислоты галоидангидридом замещенной низшей алкан- или фенилалканкарбоновой кислоты, например, хлорангидридом фенилуксусной, пивалиновой или трифторуксусной кислоты; метод смешанных ангидридов карбоновой кислоты) или органических сульфокислот (которые можно получить путем обработки соли, как, например, соли щелочного металла соответствующей кислоты, соответствующим органическим галоидангидридом сульфокислоты, как, например, хлорангидридом низшей алкан- или арил-, например метан- или п-толуолсульфокислоты; метод смешанных ангидридов сульфокислоты), а также симметричные ангидриды (которые можно получить путем конденсации соответствующей кислоты в присутствии карбодиимида или 1-диэтиламинопропина; метод симметричных ангидридов).
Соответствующие циклические амиды представляют собой, в частности, амиды с пятизвенными диазациклами ароматического характера, как, например, имидазол (которые можно получить путем обработки соответствующей кислоты с помощью N, N'-карбонилдиимидазола; имидазолидный метод), или пиразолом, например, 3,5-диметилпиразолом (которые получают, например, через гидразид кислоты путем обработки ацетилацетоном; пиразолидный метод).
Производные кислот формулы VI, используемые в качестве ацилирующих средств, могут также образовываться in situ. Таким образом можно получить in situ, например, N,N'-дизамещенный сложный амидиноэфир, введя в реакцию смесь исходного материала формулы V и кислоты, используемой в качестве ацилирующего средства, в присутствии соответствующего N,N-дизамещенного карбодиимида, например, N,N'-дициклогексилкарбодиимида. Кроме того, можно получить сложный амино- или амидоэфир кислот, используемых в качестве ацилирующего средства, в присутствии ацилируемого исходного материала формулы V, преобразуя смесь соответствующих исходных веществ кислоты и амина в присутствии N,N'-дизамещенного карбодиимида, например, N,N'-дициклогексилкарбодиимда, и N-оксиамина или N-оксиамида, например, N-оксисукцинимида, в данном случае в присутствии соответствующего основания, например, 4-диметиламинопиридина.
Предпочтительно реакция осуществляется таким образом, что реакционноспсобное производное карбоновой кислоты соединения формулы: VI преобразуют соединением формулы V, где участвующая в реакции амино- или гидроксильная группа существует в свободной форме.
Реакция может осуществляться известным способом. Причем условия реакции прежде всего зависят от того, активирована ли, и каким образом карбоксильная группа ацилирующего средства. Обычно реакцию проводят в присутствии соответствующего растворителя или разбавителя или их смеси и, в случае необходимости, в присутствии конденсирующего средства, чтобы например, если участвующая в реакции карбоксильная группа представляет ангидрид, могло быть также средство, связующее кислоту. Реакцию проводят при охлаждении или нагревании, например, в диапазоне температур примерно от -30oC до примерно +150oC, в частности, примерно от 0oC до +100oC, предпочтительно от комнатной температуры (примерно 20oC) до 70oC, в открытом или закрытом реакционном сосуде и/или в атмосфере инертного газа, например, азота. Обычные конденсирующие средства представляют собой, например, карбодиимиды, например, N,N'-диэтил-N, N'-дипропил-, N, N'-дициклогексил- или N-этил-N'-(3-диметиламинопропил)-карбодиимид, соответствующие карбонильные соединения, например, карбонилдиимидазол, или соединения 1,2-оксазолия, например, 2-этил-5-фенил-1,2-оксазолий-3'-сульфонат и 2-трет. -бутил-5-фенил-1,2-оксазолий-3'-сульфонат и 2-трет.-бутил-5-метилизоксазолий-перхлорат, или соответствующее ациламиносоединение, например, 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин. Обычные кислотообразующие конденсирующие средства представляют собой, например, карбонаты щелочных металлов или гидрокарбонаты щелочных металлов, например, карбонат натрия или калия или гидрокарбонат натрия или калия (обычно вместе с сульфатом), или органические основания, как, например, пиридин или пространственно затрудненные три(низший алкил)амины, например, N, N-диизопропил-N-этиламин.
Исходный материал формулы V получают путем восстановления нитрогрупп(ы) в соединении формулы I, где радикал R7 обозначает нитрогруппу. Это восстановление может осуществляться, например, путем каталитического гидрирования в соответствующем растворителе, как, например, в тетрагидрофуране. В качестве катализатора гидрирования используют предпочтительно палладий на активированном угле (5%) и гидрирование в этом случае проводят при нормальном давлении.
Способ c:
Соответствующим окислителем для превращения соединения формулы I, где R1 означает пиридил, в N-оксидосоединение является предпочтительно соответствующая надкислота, например, соответствующая пербензойная кислота, как, например, м-хлорпербензойная кислота. Реакция осуществляется в инертном растворителе, например, галогенированном углеводороде, как, например, предпочтительно метиленхлорид, при температуре примерно между -20oC и 150oC, главным образом примерно между 0oC и точкой кипения соответствующего растворителя, обычно ниже 100oC, и предпочтительно при комнатной температуре или легко повышающейся температуре (20oC - 70oC).
Соли присоединения кислот соединений формулы I получают известным способом, например, путем обработки кислотой или соответствующим анионообменным реактивом.
Соли присоединения кислот можно перевести в свободные соединения, например, путем обработки соответствующим основным средством.
Смеси изомеров можно разделять на отдельные изомеры обычным способом, например, путем фракционированной кристаллизации, хроматографии и т.д.
Вышеописанные способы, включая способы отщепления защитных групп и дополнительные мероприятия, касающиеся способа, осуществляются, если не указано иное, известным способом, например, в присутствии или отсутствии, предпочтительно, инертных растворителей и разбавителей, при необходимости, в присутствии конденсирующих средств или катализаторов, при пониженной или повышенной температуре, например, в диапазоне температур примерно от -20oC до примерно 150oC, в частности, примерно от 0oC до примерно 70oC, предпочтительно примерно от 10oC до примерно 50oC, главным образом при комнатной температуре, в соответствующем сосуде и, при необходимости, в атмосфере инертного газа, например, азота.
При этом, учитывая все заместители, находящиеся в молекуле, при необходимости, например, в присутствии легко гидролизуемых остатков, необходимо применять особенно щадящие условия для реакции, как, например, краткая продолжительность реакции, использование слабокислых или слабоосновных средств в более низкой концентрации, стехиометрические соотношения количеств, выбор соответствующих катализаторов, растворителей, температурных условий и/или давления.
Изобретение касается также тех вариантов выполнения способа, при которых исходят из соединения, полученного на какой-либо ступени способа в качестве промежуточного продукта и выполняют отсутствующие ступени способа или прерывают способ на какой-либо ступени или получают исходное вещество в условиях реакции, или используют в виде реакционноспособного производного или соли. При этом предпочтительно исходят из таких исходных веществ, которые согласно изобретению приводят к вышеописанным особо ценным соединениям.
Предпочтительно используются такие исходные вещества и выбираются такие условия реакции, при которых достигается получение соединений, указанных в качестве особенно предпочтительных.
Соединения согласно изобретению могут использоваться для лечения теплокровных животных, страдающих опухолевыми заболеваниями, причем теплокровным животным, нуждающимся в таком лечении, дают необходимое для подавления опухоли количество соединения формулы I или его фармацевтически приемлемой соли. Кроме того, соединения формулы I или его фармацевтически приемлемые соли могут применяться для подавления киназы рецептора PDGF. Соединения формулы I, где R4 и R8 означают водород, или его фармацевтически приемлемые соли могут применяться для подавления протеинкиназы C у теплокровных животных. Соединения формулы I и их фармацевтически приемлемые соли могут найти применение для получения фрамацевтических препаратов, используемых при лечении человеческих или животных организмов. При этом организму весом примерно 70 кг в зависимости от вида, возраста, индивидуального состояния, способа применения и соответствующей клинической картины назначаются действующие дозы, например, ежедневные дозы примерно 1 - 1000 мг, в частности, 50 - 500 мг.
Изобретение касается также фармацевтической композиции, обладающей противоопухолевой активностью, которая содержит эффективное количество, в частности, для профилактики или лечения одной из вышеуказанных болезней, активного вещества вместе с фармацевтически применимыми наполнителями, подходящими для местного, внутреннего, например, орального или ректального, или парентерального применения, и которые могут быть неорганическими или органическими, твердыми или жидкими. Для орального введения используют, в частности, таблетки или желатиновые капсулы, содержащие биологически активное вещество вместе с разбавителями, как, например, лактоза, глюкоза, сукроза, маннитол, сорбитол, целлюлоза и/или глицерин, и/или смазочные средства, например, кремнезем, тальк, стеариновая кислота или ее соли, как, например, стеарат магния или кальция, и/или полиэтиленгликоль. Таблетки могут содержать также связующие вещества, как, например, силикат магния и алюминия, крахмалы, как, например, кукурузный, пшеничный или рисовый крахмал, желатин, метилцеллюлозу, натрийкарбоксиметилцеллюлозу и/или поливинилпирролидон, и, при необходимости, диспергаторы, например, крахмалы, агар, альгиновую кислоту или ее соль, как, например, альгинат натрия, и/или шипучие смеси, или адсорбенты, красители, вкусовые вещества и сладкие вещества. Кроме того, фармакологически эффективные соединения настоящего изобретения можно применять в виде парентерально вводимых препаратов или инфузионных растворов. Такие растворы представляют собой предпочтительно изотонические водные растворы или суспензии. Причем они, например, в лиофилизированных препаратах, содержащих биологически активное вещество отдельно или вместе с наполнителем, например, маннитом, могут изготавливаться перед употреблением. Фармацевтические препараты могут быть простерилизованы и/или могут содержать вспомогательные вещества, как, например, консервирующие, стабилизирующие, смачивающие и/или эмульгирующие средства, растворяющие средства, соли для регулирования осмотического давления и/или буферный раствор. Данные фармацевтические препараты, которые, при необходимости, могут содержать другие фармакологические действенные вещества, как, например, антибиотики, изготавливаются известным способом, например, с помощью обычных способов: смешивания, гранулирования, дражирования, растворения или лиофилизации и содержат примерно от 1% до 100%, в частности, примерно от 1% до примерно 20% активного вещества (активных веществ).
Нижеследующие примеры поясняют изобретение, не ограничивая его в какой-либо форме. Величины Rf определяют на силикагелевых тонкослойных пластинах (фирма Мерк, Дармштадт, Германия). Соотношение растворителей друг к другу в использованных смесях растворителей представлено в объемных долях (v/v), температуры указаны в градусах Цельсия.
Пример 1. К раствору 30 г (0,17 молей) 3-диметиламино-1-(3-пиридил)-2-пропен-1-она (описан в EP 0233461A) в 250 мл добавляют 41,3 г (0,17 молей) нитрата 3-нитрофенилгуанидина, суспендированного в 50 мл изопропанола. После добавления 7,49 г (0,19 моль) едкого натра желтую суспензию кипятят 8 часов с обратным холодильником. После охлаждения до 0oC отфильтровывают и дополнительно промывают 200 мл изопропанола. Продукт фильтрации суспендируют в 300 мл воды и перемешивают 30 минут, фильтруют и промывают 200 мл воды. После повторного суспендирования в 200 мл этанола и промывания с помощью 200 мл этанола-простого диэтилового эфира (1:1) получают N-(3-нитрофенил)-4-(3-пиридил)-2-пиримидинамин; температура плавления 212 - 213oC, Rf = 0,75 (хлороформ : метанол = 9:1).
Исходный материал получают следующим образом:
Этап 1.1: К желтой суспензии из 82,88 г (0,6 ммолей) 3-нитроанилина в 200 мл этанола по каплям добавляют 42 мл (0,6 мол) азотной кислоты (65%-ной). После ослабления экзотермической реакции добавляют 75,7 г (0,9 молей) цианамида (50% в воде) и реакционную смесь кипятят в течение 21 часа с обратным холодильником. После охлаждения до 0oC отфильтровывают и 6 раз промывают с помощью этанола-простого диэтилового эфира (1:1). После высушивания при высоком вакууме и температуре 40oC получают нитрат 3-нитрофенилгуанидина; температура плавления 205 - 207oC.
Этап 1.2: 8 г (0,35 молей) натрия в 260 мл толуола при 100oC суспендируют с помощью вибрационного смесителя. После охлаждения до 0oC по каплям при охлаждении добавляют 17 мл (0,42 молей) метанола и затем перемешивают в течение 45 минут при 75oC. При 25oC по каплям при охлаждении льдом добавляют раствор 38,5 мл (0,35 молей) 3-ацетилпиридина и 28 мл (0,35 молей) сложного этилового эфира муравьиной кислоты в 300 мл толуола в течение 45 минут. Желтую суспензию перемешивают 16 часов при температуре 25oC и затем смешивают с 23,7 г (0,52 молей) диметиламина. После подачи 100 мл толуола перемешивают 45 минут при 25oC, затем при 0oC по каплям добавляют раствор из 20 мл уксусной кислоты в 150 мл толуола в течение 30 минут и затем кипятят в течение 1 часа с обратным холодильником. После охлаждения до 25oC отфильтровывают, промывают с помощью 500 мл толуолгексана (1:1) и фильтрат концентрируют до начала кристаллизации. После охлаждения до 0oC, отфильтровывания и высушивания при 80oC при высоком давлении получают 3-диметиламино-1-(пиридил)-2-пропен-1-он; температура плавления 81 - 82oC.
Пример 2. 100 мг (0,38 ммолей) N-(3-аминофенил)-4-(3-пиридил)-2-пиримидинамина растворяют в 5 мл пиридина, смешивают с 58,5 мкл (0,46 ммолей) 4-хлорбензоилхлорида и перемешивают в течение 24 часов при комнатной температуре. Реакционную смесь смешивают с 10 мл воды, охлаждают до 0oC и отфильтровывают. После промывания водой и высушивания получают N-[3-(4-хлорбензоиламидо)-фенил]-4-(3-пиридил)-2-пиримидинамин; температура плавления 238 - 240oC. Rf = 0,66 (хлороформ : метанол = 9:1).
Исходные материалы получают следующим образом:
Этап 2.1: Суспензию 17,0 г (0,058 молей) M-(3-нитрофенил)-4-(3-пиридил)-2-пиримидинамина в 1700 мл тетрагидрофурана перемешивают с 1,7 г палладия на активированном угле (5%) в атмосфере водорода при нормальном давлении в течение 21 часа. Суспензию фильтруют и фильтрат концентрируют на ротационном выпарном аппарате. Оставшийся желтый твердый продукт перемешивают в течение ночи в 200 мл метиленхлорида. После фильтрации и высушивания получают N-(3-аминофенил)-4-(3-пиридил)-2-пиримидинамин; температура плавления 89 - 90oC, Rf = 0,38 (хлороформ : метанол = 9:1).
Пример 3. Раствор 100 мг (0,38 молей) N-(3-аминофенил)-4-(3-пиридил)-2-пиримидинамина в 5 мл пиридина смешивают с 53 мкл (0,46 ммолей) бензоилхлорида и перемешивают в атмосфере азота в течение 24 часов при комнатной температуре. Реакционную смесь смешивают с 10 мл воды, охлаждают до 0oC, отфильтровывают и промывают водой. После высушивания при высоком давлении получают N-(3-бензоиламидофенил)-4-(3-пиридил)-2-пиримидинамин; температура плавления 207 - 209oC, Rf = 0,53 (хлороформ : метанол = 9:1).
Пример 4. Раствор 100 мг (0,38 молей) N-(3-аминофенил)-4-(3-пиридил)-2-пиримидинамина и 59 мг (0,46 ммолей) хлорангидрида 2-пиридинкарбоновой кислоты в 5 мл пиридина перемешивают при комнатной температуре в атмосфере азота в течение 4 часов. После добавления 30 мг (0,23 ммолей) хлорангидрида 2-пиридинкарбоновой кислоты перемешивают в течение 18 часов, затем добавляют еще 25 мг (0,19 ммолей) хлорангидрида 2-пиридинкарбоновой кислоты и перемешивают в течение 72 часов при температуре 5oC. После добавления 10 мл воды и охлаждения до 0oC отфильтровывают и промывают водой. В результате хроматографического разделения (силикагель, CHCl3/MeOH = 9:1) получают N-[3-(2-пиридил)-карбоксамидофенил]-4-(3-пиридил)-2-пиримидинамин; температура плавления 187 - 190oC, Rf = 0,58 (хлороформ : метанол = 9:1).
Пример 5 Аналогично примеру 4 из хлорангидрида 3-пиридинкарбоновой кислоты получают N-[3-(-пиридил-карбоксамидофенил]-4-(3-пиридил)-2-пиримидинамин; температура плавления 217 - 220oC, Rf = 0,29 (хлороформ : метанол = 9:1).
Пример 6. Аналогично примеру 4 из хлорангидрида 4-пиридинкарбоновой кислоты получают N[3-(4-пиридил)-карбоксамидофенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 224 - 226oC, Rf = 0,29 (хлороформ : метанол = 9:1).
Пример 7. Раствор 100 мг (0,38 ммолей) N-(3-аминофенил)-4-(3-пиридил)-2-пиримидинамина в 5 мл пиридина смешивают с 63 мкл (0,46 ммолей) пентафторбензоилхлорида и перемешивают в атмосфере азота при комнатной температуре в течение 17 часов. Коричневую реакционную смесь смешивают с 10 мл воды, охлаждают до 0oC и отфильтровывают. Остаток перекристаллизовывают из этанол-ацетона и получают кристаллический продукт N-(3-пентафторбензоиламинофенил)-4-(3-пиридил)-2-пиримидинамин; температура плавления 234 - 244oC, Rf = 0,41 (хлороформ : метанол = 9:1).
Пример 8. 28 мг (0,19 ммолей) ангидрида фталевой кислоты добавляют в раствор 50 мг (0,19 ммолей) N-(3-аминофенил)-4-(3-пиридил)-2-пиримидинамина в 1 мл пиридина. Через 2,5 часа желтый реакционный раствор смешивают еще с 14 мг (0,095 ммолей) ангидрида фталевой кислоты и перемешивают в течение 20 часов при 25oC. Суспензию фильтруют, промывают немного охлажденным пиридином. Остаток извлекают после двухкратной промывки с помощью 2,5 мл абсолютного этанола и получают N-[3-(2-карбоксибензоиламидо)-фенил]-4-(3-пиридил)-2-пиримидинамин; температура плавления 206 - 209oC, Rf = 0,07 (хлороформ : метанол = 9:1).
Пример 9. Раствор 100 мг (0,38 ммолей) N-(3-аминофенил)-4-(3-пиридил)-2-пиримидинамина и 105 мкл (0,46 ммолей) ангидрида капроновой кислоты в 5 мл пиридина перемешивают в течение 24 часов при 25oC в атмосфере азота и затем концентрируют на ротационном выпарном аппарате. Остаток очищают с помощью тонкослойной хроматографии (силикагель, хлороформ : метанол 95:5), после чего получают N-(3-н-гексаноиламидофенил)-4-(3-пиридил)-2-пиримидинамин; температура плавления 180 - 184oC, Rf = 0,78 (хлороформ : метанол = 9:1).
Пример 10. 1 г (5,68 ммолей) 3-диметиламино-1-(2-пиридил)-2-пропен-1-она (EP 233461A) растворяют в 8 мл изопропанола и смешивают с 1,38 г (5,68 ммолей) нитрата 3-нитрофенилгуанидина. После добавления 0,25 г (6,24 ммолей) едкого натра желтую суспензию нагревают в условиях рефлюкса в течение 20 часов, затем охлаждают до 0oC, отфильтровывают и промывают с помощью 30 мл изопропанола. Продукт фильтрации перемешивают в течение 20 минут в 15 мл этанола, отфильтровывают и промывают немного охлажденным этанолом. Получают N-(3-нитрофенил)-4-(2-пиридил)-2-пиримидинамин; температура плавления 213 - 219oC.
Пример 11. К раствору 1 г (5,68 ммолей) 3-диметиламино-1-(4-пиридил)-2-пропен-1-она (патент США 4281000) в 8 мл изопропанола добавляют 1,38 г (5,68 ммолей) нитрата 3-нитрофенилгуанидина и 0,25 г (6,24 ммолей) едкого натра. Желтую суспензию нагревают в течение 20 часов с обратным холодильником и затем охлаждают до 0oC. После промывания 30 мл изопропанола продукт перемешивают с 15 мл этанола и затем с 15 мл воды и отфильтровывают. После высушивания при высоком вакууме получают N-(3-нитрофенил)-4-(4-пиридил)-2-пиримидинамин; температура плавления 282 - 284oC.
Пример 12. Аналогично примеру 2 из 2-метоксибензоилхлорида получают N-[3-(2-метоксибензоиламидо)-фенил]-4-(3-пиридил)-2-пиримидинамин; температура плавления 115 - 117oC, Rf = 0,76 (хлороформ : метанол = 9:1).
Пример 13. Аналогично примеру 2 из 4-фторбензоилхлорида получают N-[3-(4-фторбензоиламдо)-фенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 215 - 216oC, Rf = 0,34 (хлороформ : метанол = 9:1).
Пример 14. Аналогично примеру 2 из 4-цианобензоилхлорида получают N-[3-(4-цианобензоиламидо)-фенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 220 - 222oC, Rf = 0,31 (хлороформ : метанол = 9:1).
Пример 15. Аналогично примеру 2 из хлорангидрида 2-тиофенкарбоновой кислоты получают N-[3-(2-тиенилкарбоксамидо)-фенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 139 - 141oC, Rf = 0,35 (хлороформ : метанол = 9:1).
Пример 16. Аналогично примеру 2 из хлорангидрида циклогексанкарбоновой кислоты получают N-(3-циклогексилкарбоксамидофенил)-4-(3-пиридил)2-пиримидинамин; температура плавления 205 - 206oC, Rf = 0,36 (хлороформ : метанол = 9:1).
Пример 17. Аналогично примеру 2 из 4-метилбензоилхлорида получают N-[3-(4-метилбензоиламидо)-фенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 214 - 216oC, Rf = 0,64 (хлороформ : метанол = 9:1).
Пример 18. Аналогично примеру 2 при обработке 100 мг (0,38 ммолей) N-(3-аминофенил)-4-(4-пиридил)-2-пиримидинамина с помощью 58 мкл (0,46 ммоль) 4-хлорбензоилхлорида получают N-[3-(4-хлорбензоиламидо)-фенил]-4-(4-пиридил)-2-пиримидинамина; температура плавления 258 - 261oC, Rf = 0,37 (CHCl3 : метанол = 9:1).
Исходные материалы получают следующим образом:
Этап 18.1: Аналогично этапу 2.1 при обработке 300 мг (1,0 ммоль) N-(3-нитрофенил)-4-(4-пиридил)-2-пиримидинамина (см. пример 11) в атмосфере водорода получают N-(3-аминофенил)-4-(4-пиридил)-2-пиримидинамин; температура плавления 200 - 202oC, Rf = 0,27 (CHCl3 : метанол = 95:5).
Пример 19. Аналогично примеру 2 из 98 мг (0,3 ммолей) 4-(4-метилпиперазинометил)-бензоилхлорида получают N-{3-[4-(4-метилпиперазинометил)-бензоиламидо] -фенил} -4-(3-пиридил)-2-пиримидинамин; температура плавления 198 - 201oC.
Пример 20. Раствор 8,0 г (28,85 ммолей) N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидинамина и 4,0 мл (34,6 ммоль) бензоилхлорида в 320 мл пиридина перемешивают при комнатной температуре в атмосфере азота в течение 23 часов. Реакционную смесь концентрируют при высоком вакууме, смешивают с 200 мл воды и после охлаждения до 0oC отфильтровывают. После высушивания при 80oC при высоком вакууме сырой продукт суспендируют с CH2Cl2-метанолом (95%5) и отфильтровывают. Получают N-(5-бензоиламидо-2-метилфенил) -4-(3-пиридил)-2-пиримидинамин. После хроматографического разделения получают другое количество этого продукта; температура плавления 173 - 176oC, Rf = 0,65 (CHCl3 : метанол = 9:1).
Исходный материал получают следующим образом:
Этап 20.1: К желтой суспензии 20,0 г (0,13 молей) 2-амино-4-нитротолуола в 50 мл абсолютного этанола по каплям в течение 5 минут добавляют 9,1 мл (0,13 молей) 65%-ной азотной кислоты. После ослабления экзотермической реакции добавляют 8,32 г (0,198 молей) цианамида, растворенного в 8,2 мл воды. Коричневую реакционную смесь кипятят с обратным холодильником в течение 25 часов, охлаждают до 0oC и отфильтровывают. После 4-кратного промывания с помощью 100 мл этанола-простого диэтилового эфира (1:) и высушивания получают нитрат 2-метил-5-нитрофенилгуанидина; температура плавления 219 - 226oC.
Этап 20.2: К раствору 170 г (0,96 молей) 3-диметиламино-1-(3-пиридил)-2-пропен-1-она в 2,0 л изопропанола добавляют 248,2 г (0,96 молей) нитрата 2-метил-5-нитрофенилгуанидина. После добавления 42,5 г едкого натра красноватую суспензию кипятят с обратным холодильником в течение 12 часов. После охлаждения до 0oC, отфильтровывания, промывания с помощью 2,0 л изопропанола и 3-кратного промывания с помощью 400 мл метанола и высушивания получают N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамин, температура плавления 195 - 198oC, Rf = 0,68 (метиленхлорид : метанол = 9:1).
Этап 20.3: Суспензию 143,0 г (0,46 молей) N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина в 7,15 л сложного этилового эфира уксусной кислоты перемешивают с 14,3 г палладия на активированном угле (10% Pd) в атмосфере водорода при нормальном давлении в течение 6,5 часов. Суспензию фильтруют и фильтрат концентрируют на ротационном выпарном аппарате. Сырой продукт перекристаллизовывают из метиленхлорида. Получают N-(5-амино-2-метилфенил)-4-(3-пиридил)-2-пиримидианмин; температура плавления 138 - 140oC. Rf = 0,36 (метиленхлорид : метанол = 9:1).
Пример 21. Аналогично примеру 20 из 10,68 г (32,8 молей) 4-(4-метилпиперазинометил)-бензоилхлорида получают N-{ 5-[4-(4-метилпиперазинометил)-бензоиламидо] -2-метилфенил} -4-(3-пиридил)-2-пиримидинамин; температура плавления 211 - 213oC, Rf = 0,33 (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 95:5:1).
Пример 22. Аналогично примеру 20 из 0,23 мл (1,7 ммолей) п-толуолхлорида получают N-[5-(4-метилбензоиламидо)-2-метилфенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 102 - 106oC, Rf = 0,4 (метиленхлорид : метанол = 9:1).
Пример 23. Аналогично примеру 20 из 330 мг (1,73 ммолей) 2-нафтоилхлорида получают N-[5-(2-нафтоиламидо)-2-метилфенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 97 - 1012, Rf = 0,45 (метиленхлорид : метанол = 9:1).
Пример 24. Аналогично примеру 20 из 0,22 мл (1,73 ммолей) 4-хлорбензоилхлорида получают N-[5-(4-хлорбензоиламидо)-2-метилфенил] -4-(3-пиридил)-2-пиримидинамин.
Пример 25. Аналогично примеру 20 из 0,28 мл (1,87 ммолей) 2-метоксибензоилхлорида получают N-[5-(2-метоксибензоиламидо)-2-метилфенил] -4-(3-пиридил)-2-пиримидинамин; температура плавления 88 - 92oC, Rf = 0,45 (метиленхлорид : метанол = 9:1).
Пример 26. Аналогично примеру 1 из 1,0 г (5,68 ммолей) 3-диметиламино-1-(3-пиридил)-2-пропен-1-она и 1,53 г (5,68 ммолей) нитрата 3-трифторметоксифенилгуанидина получают N-(3-трифторметоксифенил)-4-(3-пиридил)-2-пиримидинамин; Rf = 0,7 (хлороформ : метанол = 9:1).
Исходные материалы получают следующим образом:
Этап 26.1: Аналогично этапу 1,1 из 2,0 г (11,3 ммолей) 3-трифторметоксианилина и 1,4 г (16,6 ммолей) цианамида (50% в воде) получают нитрат 3-трифторметоксифенилгуанидина; Rf = 0,1 (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 150:10:1).
Пример 27. Аналогично примеру 1 из 1,0 г (5,68 ммолей) 3-диметиламин-1-(3-пиридил)-2-пропен-1-она и 1,78 г (5,68 ммолей) нитрата 3-(1,1,2,2-тетрафторэтокси)-фенилгуанидина получают N-[3-(1,1,2,2-тетрафторэтокси)-фенил] -4-(3-пиридил)-2-пиримидинамин; Rf = 0,75 (хлороформ : метанол = 9: 1).
Исходный материал получают следующим образом:
Этап 27.1: Аналогично этапу 1.1 из 2,09 г (10 ммолей) 3-(1,1,2,2-тетрафторэтокси)-анилина и 1,26 г (15 ммолей) цианамида (50% в воде) получают нитрат 3-(1,1,2,2-тетрафторэтокси)-фенилгуанидина; Rf = 0,15 (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 150:10:1).
Пример 28. Аналогично примеру 1 из 1,0 г (5,68 ммолей) 3-диметиламино-1-(3-пиридил)-2-пропен-1-она и 0,46 г (5,68 ммолей) нитрата 3-нитро-5-метилфенилгуанидина получают N-(3-нитро-5-метилфенил)-4-(3-пиридил)-2-пиримидинамин; Rf = 0,72 (хлороформ : метанол = 9:1).
Исходный материал получают следующим образом:
Этап 28.1: Аналогично этапу 1.1 из 1,52 г (10 ммолей) 3-нитро-5-метиланилина и 1,26 г (15 ммолей) цианамида (50% в воде) получают нитрат 3-нитро-5-метилфенилгуанидина; Rf = 0,1 (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 150:10:1).
Пример 29. Аналогично примеру 1 из 1,0 г (5,68 ммолей) 3-диметиламино-1-(3-пиридил)-2-пропен-1-она и 1,76 г (5,68 ммолей) нитрата 3-нитро-5-трифторметилфенилгуанидина получают N-(3-нитро-5-трифторметилфенил)-4-(3-пиридил)-2-пиримидинамин; Rf = 0,8 (хлороформ : метанол = 9:1).
Исходные материалы получают следующим образом:
Этап 29.1: Аналогично этапу 1.1 из 2,06 г (40 ммолей) 3-нитро-5-трифторметиланилина и 1,26 г (15 ммолей) цианамида (50% в воде) получают нитрат 3-нитро-5-метилфенилгуанидина; Rf = 0,2 (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 150:10:1).
Пример 30. 200 мг (0,68 ммолей) N-(3-нитрофенил) -4-(3-пиридил)-2-пиримидинамина суспендируют в 5 мл метиленхлорида и смешивают с 225 мг (0,71 ммолей) 3-хлорпербензойной кислоты. Через 2 часа добавляют еще 10 мл метиленхлорида. Суспензию перемешивают еще 20 часов при комнатной температуре. После фильтрации и тонкослойной хроматографии (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 90:10:1) остатка получают N-(3-нитрофенил)-4-(N-оксидо-3-пиридил)-2-пиримидинамин; Rf 0,4 (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 90:10:1), температура плавления 252 - 258oC.
Пример 31. 150 мг (0,39 ммолей) N-(3-бензоиламидо-5-метилфенил)-4-(3-пиридил)-2-пиримидинамина суспендируют в 6 мл метиленхлорида и смешивают с 129 мг (0,41 ммолей) 3-хлорпербензойной кислоты. Через 22 часа отфильтровывают и остаток очищают с помощью тонкослойной хроматографии (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 90:10:1). Получают N-(3-бензоиламидо-5-метилфенил)-4-(N-оксидо-3-пиридил)-2- пиримидинамин; Rf = 0,3 (метиленхлорид : метанол : 25%-ный водный аммиачный раствор = 90:10:1), температура плавления 295 - 300oC.
Пример 32. Таблетки, содержащие 20 мг биологически активного вещества, например, одно из описанных в примерах 1 - 31 соединений формулы I, получают в следующем составе обычным способом:
Состав
Биологически активное вещество - 20 мг
Пшеничный крахмал - 60 мг
Молочный сахар - 50 мг
Коллоидная кремниевая кислота - 5 мг
Тальк - 9 мг
Стеарат магния - 1 мг
Всего - 145 мг
Изготовление: Биологически активное вещество смешивают с одной частью пшеничного крахмала, молочным сахаром и коллоидной кремневой кислотой и смесь пропускают через сито. Другую часть пшеничного крахмала клейстеризуют с помощью 5-кратного количества воды в водяной бане и порошковую смесь перемешивают с помощью этого клейстера, пока не образуется слабая пластическая масса.
Пластическую массу продавливают через сито с размером отверстий примерно 3 мм, высушивают и полученный сухой гранулят еще раз пропускают через сито. Затем остаточный пшеничный крахмал, тальк и стеарат магния добавляют к смеси и смесь запрессовывают в таблетки весом 145 мг.
Пример 33. Таблетки, содержащие 1 мг биологически активного вещества, например, одно из описанных в примерах 1 - 31 соединений формулы I, получают в следующем составе обычным способом:
Состав
Биологически активное вещество - 1 мг
Пшеничный крахмал - 60 мг
Молочный сахар - 50 мг
Коллоидная кремневая кислота - 5 мг
Тальк - 9 мг
Стеарат магния - 1 мг
Всего - 126 мг
Изготовление: Биологически активное вещество смешивают с одной частью пшеничного крахмала, молочным сахаром и коллоидной кремневой кислотой и смесь пропускают через сито. Другую часть пшеничного крахмала клейстеризуют с 5-ти кратным количеством воды в водяной бане и порошковую смесь перемешивают этим клейстером до образования слабой пластической массы.
Пластическую массу продавливают через сито с отверстиями размером 3 мм, высушивают и полученный сухой гранулят еще раз пропускают через сито. Затем добавляют остаточный пшеничный крахмал, тальк и стеарат магния и смесь запрессовывают в таблетки весом 126 мг.
Пример 34. Капсулы, содержащие 10 мг биологически активного вещества, например, одно из соединений формулы I, описанных в примерах 1 - 31, изготавливают обычным способом, как описывается ниже:
Состав
Биологически активное вещество - 2500 мг
Тальк - 200 мг
Коллоидная кремневая кислота - 50 мг
Изготовление: Активное вещество смешивают с тальком и коллоидной кремневой кислотой до однородного состояния, смесь пропускают чрез сито с отверстиями размером 0,5 мм и порциями весом 11 мг заполняют твердые желатиновые капсулы соответствующего размера.
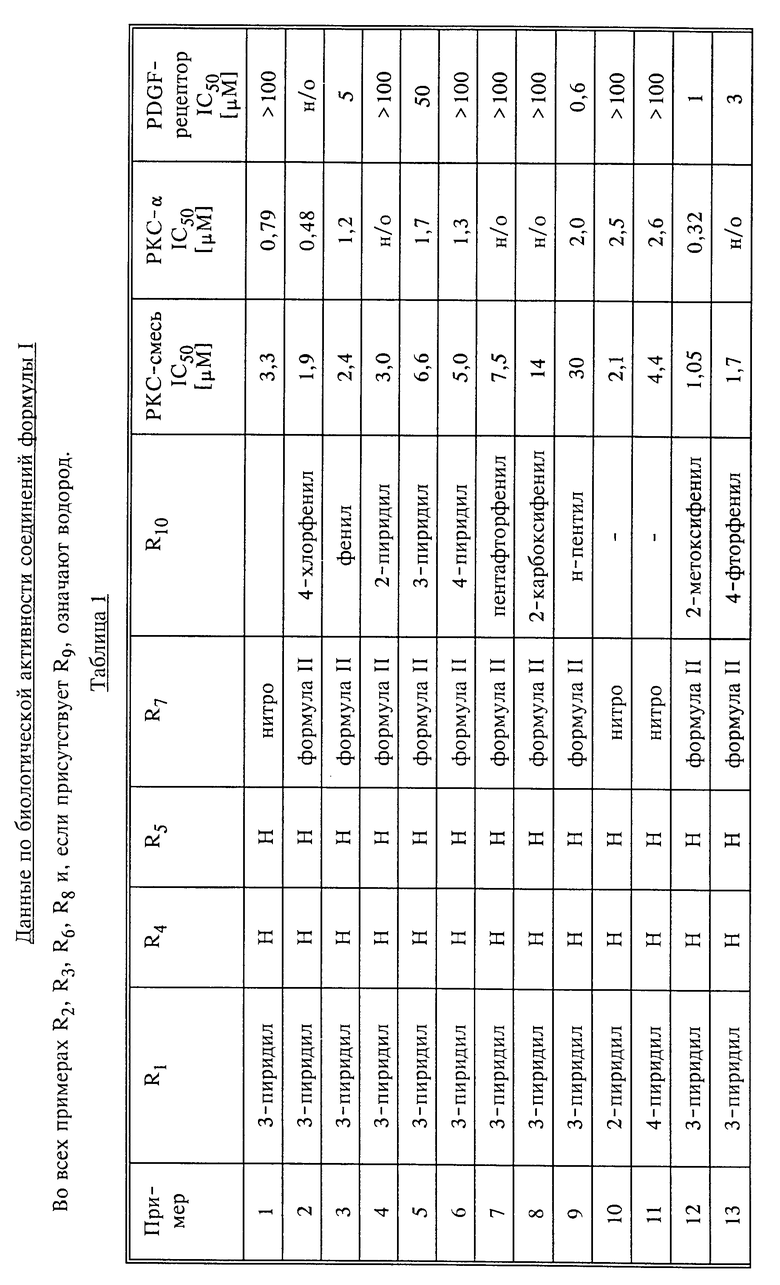
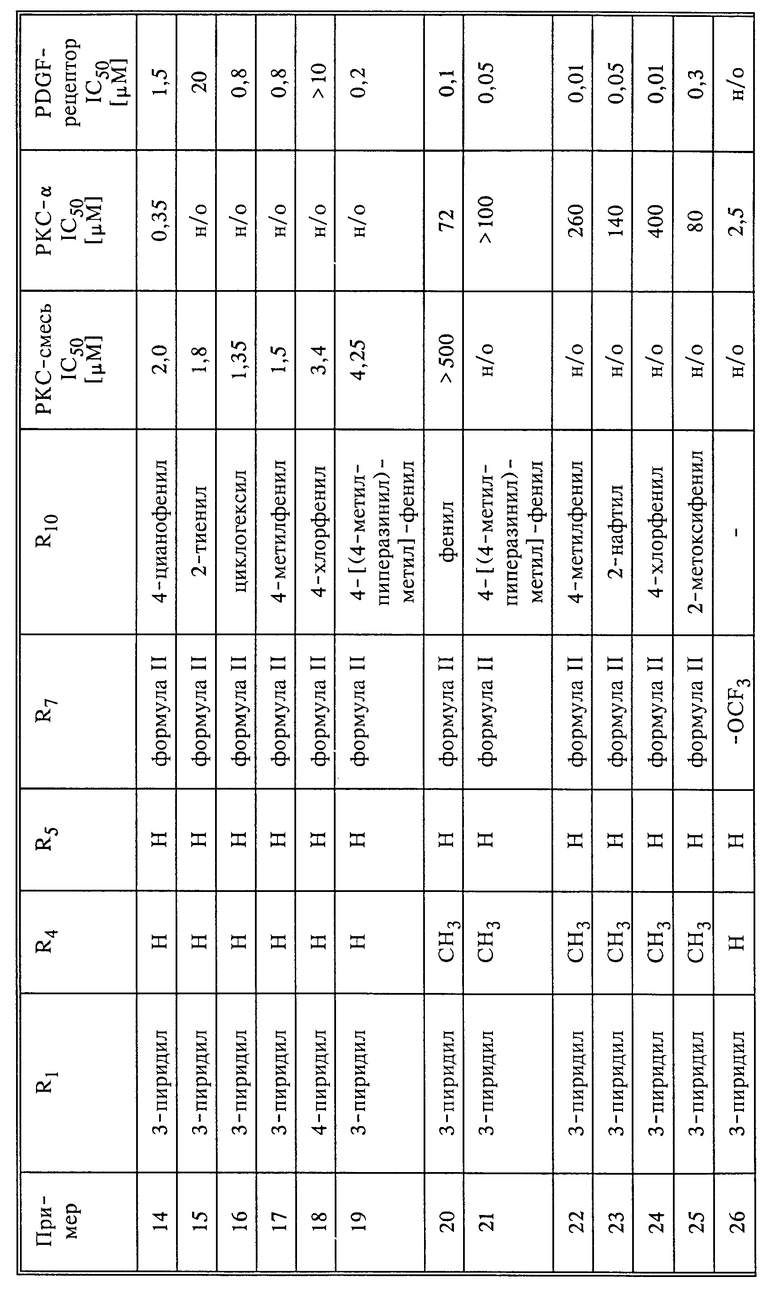
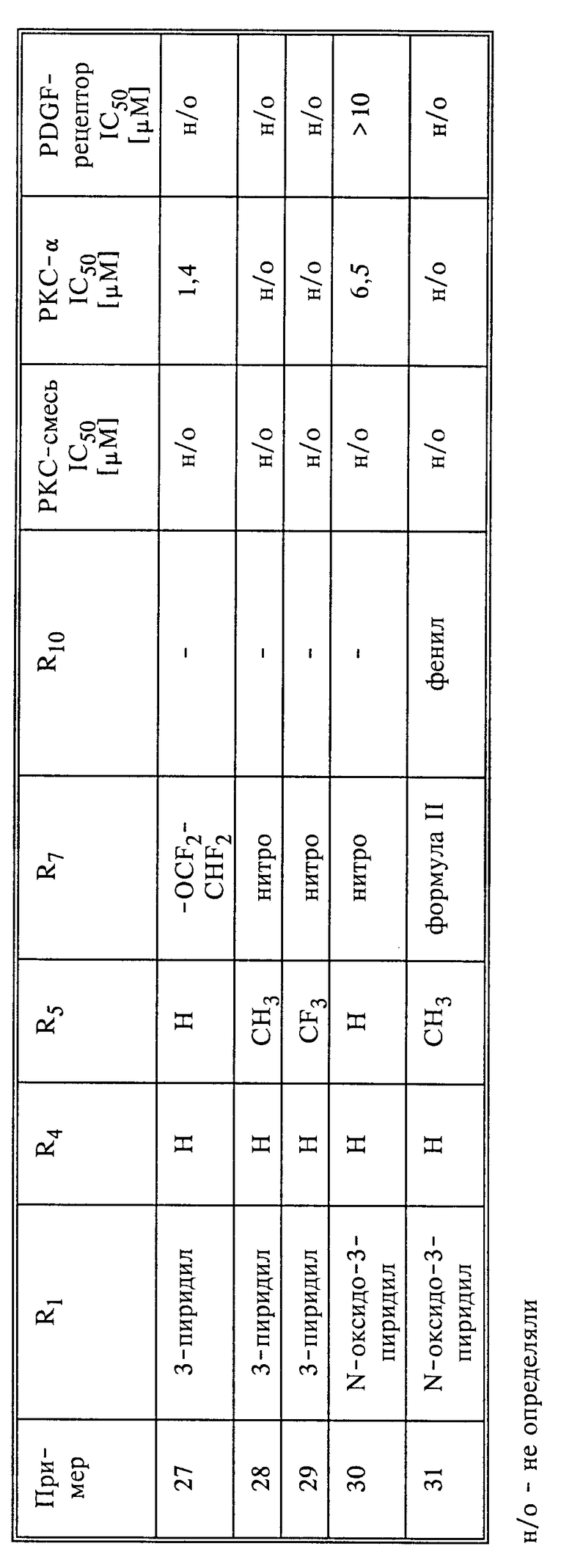
В табл. 1 представлены данные по биологической активности соединений формулы I, полученных в соответствующих примерах. В табл. 1 приведены значения IC50, демонстрирующие подавляющее действие тестируемых в соответствии с ране указанными методиками соединений на протеинкиназы.
В соответствии с этим тестом была использована смесь различных изоформных протеинкиназ C (PKC) (первая из трех колонок по испытаниям). В противоположность этому в следующей колонке со значениями IC50 для "PKC- α" показаны данные, полученные для чистой α -изоформы PKC. В последнюю колонку сведены данные для соединений, касающиеся факторов роста PDGF.
Речь идет о факторе роста, играющем важную роль как при нормальном, так и при патологическом размножении клеток, причем как в тканях новообразований (рак, карцинома), так и гладкой мускулатуры (атеросклероз, тромбоз). Поэтому в таблице приведены значения IC50 для подавления активности тирозинкиназных рецепторов, стимулирующих PDGF.
Исследования показали, что все соединения формулы I обладают противоопухолевой активностью.
На основании данных, полученных в испытаниях in vitro, были отобраны лучшие соединения, которые затем исследовались уже в опытах in vivo на противоопухолевую активность с использованием человеческих c-sis- и v-sis-экспрессированных BALB/c3T3-клеток, которые являются высокоонкогенными, на бесшерстных мышах. Максимально толерантной дозой для одноразового орального или внутрибрюшинного введения вещества, полученного в примере 20 (фигурирует при испытаниях под N CGP 53716), у мышей BALB/c была доза более 250 мг/кг. Противоопухолевая активность проявлялась при введении в дозах между 50 мг/кг и 6,3 мг/кг.
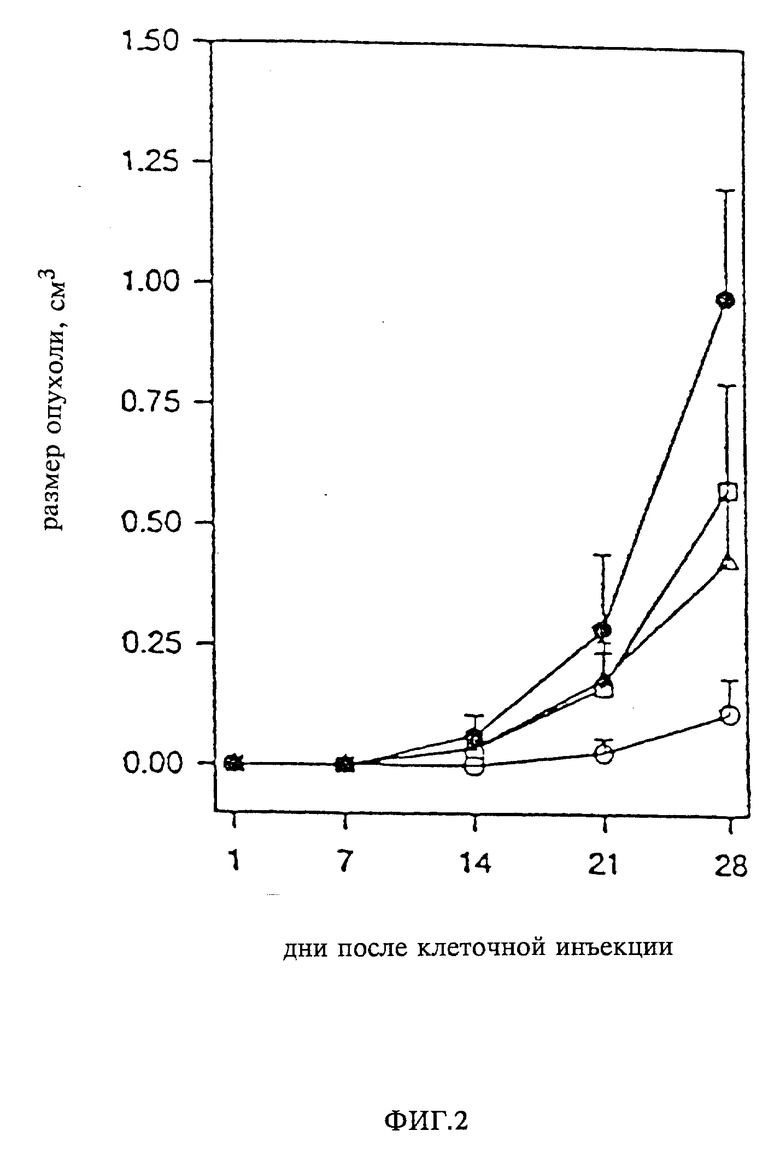
Детально были изучены (in vivo) также соединения из примеров 1 и 21 (NN CPG 57148 и CPG 53506) на противоопухолевую активность. Максимально толерантная доза для одноразового перорального или внутрибрюшинного введения 57148B мышам BALB/c составляла более 500 мг/кг. BAKB/c AMuLV (лейковирусы) и BALB/c 3T3 v-sis-клетки, которые являются чувствительными в пробах на образование колоний, были использованы для испытаний соединения 57148B на противоопухолевую активность у мышей самок BALB/c (мыши бесшерстные). Одноразовая дневная доза при внутрибрюшинном введении составляла 50, 12,5 или 3,13 мг/кг CGP 57148B, вводимая в течение последующих 30 дней. При этом было обнаружено сильное противоопухолевое действие по отношению к AMVuLV-трансформированных BALB/c3T3 опухолей (фиг. 1). Подобные противоопухолевые испытания с использованием v-sis-трансформированных BALB/c 3T3 клеток были осуществлены с выявлением дозозависимой противоопухолевой активности (фиг. 2). Максимальные значения T/C (•100%) (лечение/контроль) 4% (AMuLV опухоли) и 11% (v-sis-опухоли) были получены в случаях, когда CGP 57148B вводился в дозе 50 мг/кг веса тела.
Тест на противоопухолевую активность композиции с соединением CGP 53506 (соединение примера 21).
Противоопухолевая активность CGP 53056 изучалась в отношении карциномы T24 человеческого мочевого пузыря, трансплантированной самкам бесшерстных мышей линии BALB/c.
Используемый состав содержал 5 диметилсульфоксида, 0,5% Твина 80 и 94,5% хлорида натрия 0,9%.
Распорядок лечения был следующим: Ежедневное использование препарата в течение последующих 15 дней со дня начала лечения - на 9-ый день после трансплантации опухоли.
Результаты представлены в табл. 2.
Полученные соединения относятся к категории слабо- и среднетоксичных веществ (испытания проведены на мышах и собаках).

Производные N - фенил-2-пиримидинамина формулы I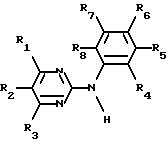
где R - обозначает связанный атомом углерода пиридил или N - оксидопиридил, R2, R3, R6, R8, R9 - водород, R4 - водород или низший алкил, R5- водород, низший алкил или трифторметил, R7-нитро, фторзамещенный низший алкокси или остаток формулы II: -N(R9)-C(O)-R10, R10 - связанный атомом углерод пиридил, C5-С7-алкил, тиенил, 2-нафтил, циклогексан или необязательно замещенный галоидом, цианогруппой, низшим алкоксилом, карбоксилом, низшим алкилом или 4-метилпиперазинилметилом, фенил, или их соли. Фармкомпозиция, на основе соединения I обладают противоопухолевой активностью. 2 с. и 25 з. п.ф-лы, 2 ил, 2 табл.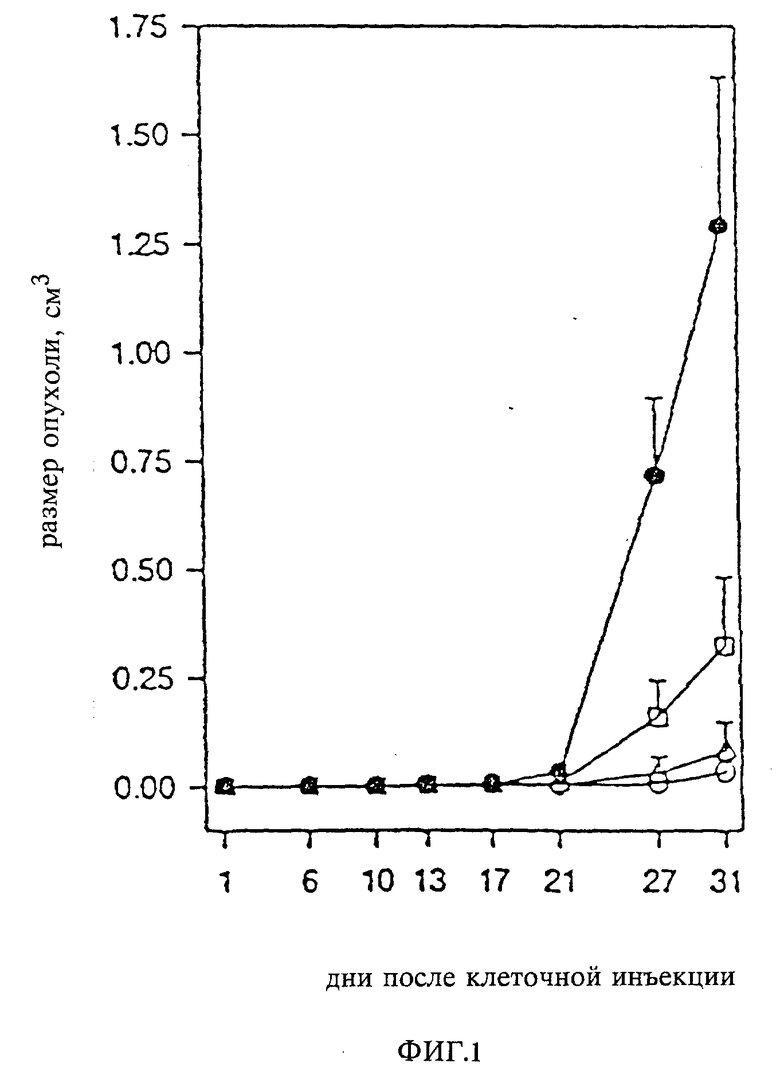
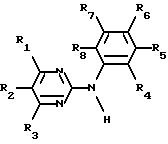
где R1 означает связанный атомом углерода пиридил или N-оксидопиридил, R2 и R3 означают водород, R4 - водород или низший алкил, R5 - водород, низший алкил или трифторметил, R6 - водород, R7 - нитро, фторзамещенный низший алкоксил или остаток формулы II
-N(R9)-C(=O)-R10
где R9 - водород, R10 означает связанный атом углерода пиридил, C5 - C7 алкил, тиенил, 2-нафтил или циклогексил, или необязательно замещенный галоидом, цианогруппой, низшим алкоксилом, карбоксилом, низшим алкилом или 4-метилпиперизинилметилом фенил, R8 - водород, или соли этих соединений по меньшей мере с одной солеобразующей группой.
| US 4719213, 1986 | |||
| Противоопухолевая терапия | |||
| Справочник/ Под ред.Переводчиковой Н.И | |||
| - М.: Медицина, 1986, с.14-17, 25-26. |
Авторы
Даты
1999-02-10—Публикация
1993-04-01—Подача