Изобретение относится к ряду новых производных стероидов, которые обладают способностью подавлять активность или действие тестостерон-5альфа-редуктазы и поэтому могут применяться для лечения или профилактики гипертрофии предстательной железы. Настоящее изобретение представляет также способы и композиции, в которых используются эти новые соединения, а также способ их получения. Тестостерон представляет собой активный гормон, который вырабатывается в мужских семенных железах. Под действием 5-альфа-редуктазы он может восстанавливаться до 5альфа-дигидротестостерон, который проявляет активность, в числе прочего, в предстательной железе.
Высокое содержание 5альфа-дигидротестостерона является причиной функциональных нарушений, включая увеличение предстательной железы, угри, облысение у мужчин и гирсутизм у женщин. Увеличение предстательной железы, иначе называемое "гипертрофией предстательной железы" представляет собой возрастное прогрессирующее заболевание, которым страдает значительная часть мужчин в возрасте свыше 50 лет. Поскольку это заболевание может привести к затрудненному мочеиспусканию, обычно оно излечивается хирургическими методами, которые вызывают нежелательные побочные действия, включая стерильность. Чтобы избежать этого, были предприняты попытки разработать лекарственные средства, которые помогут предотвратить или излечить это состояние. Хорошие результаты приносит назначение так называемых "антиандрогенов", таких как эстрогенов или их производных, однако эти препараты вызывали побочное действие, такое как феминизация, которая представляется нежелательной большинству мужчин.
Таким образом, возникает потребность в лекарственном препарате, который способен излечить или предотвратить гипертрофию, не приводя к таким последствиям, как феминизация, вызываемая антиандрогенами.
Другие воздействия высокого содержания 5-альфа-дигидротестостерона - т. е. угри, облысение у мужчин и гирсутизм у женщин - на являются серьезными с медицинской точки зрения, но приносят много огорчений пациентам, и для лечения этих воздействий в настоящее время нет надежных медицинских средств.
Поскольку ингибиторы 5-альфа-редуктазы не снижают активности тестостерона, было выдвинуто предложение о том, что эти соединения могут оказать требуемое действие, ряд таких соединений были разработаны и продемонстрировали правильность исходной гипотезы.
Например, Европатенты N 4949 и 155096 описывают некоторые производные андростана, которые, как было заявлено, обладают активностью ингибиторов 5альфа-редуктазы. Однако эти соединения отличаются от соединений по настоящему изобретению тем, что имеют гетероциклическое кольцо в так называемом "кольце А" стероидной группы, вместо карбоциклического кольца, как в соединениях по изобретению.
Наиболее близкими прототипами соединений по изобретению считаются соединения, описанные в Европатенте N 289327 и в журнале "J. MED. CHEM." 33, 943-950 (1990), особенно соединения, описанные на стр. 945, а также соединения, описанные в журнале "BIOCHEMISTRY", 29,2815-2824 (1990); все указанные публикации описывают соединения, которые здесь и далее будут обозначаться как "соединение А" и "соединение В" и которые представляют собой соответственно 17бета-(диизопропилкарбамоил)андроста-3,5-диен-3-карбоновую кислоту и 17бета-трет-бутилкарбамоиландроста-3,5-диен-3-карбоновую кислоту и описываются следующими формулами (соответственно, формулой А и формулой В):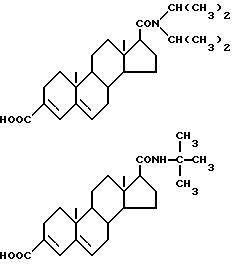
Из этих двух соединений трет-бутила (соединение В) имеет лучший баланс активности, токсичности и эффективности, в настоящее время это соединение проходит испытания в фазе III в качестве возможного коммерческого лекарственного препарата.
Краткое изложение изобретения.
Нами открыта серия новых производных андростана, обладающих ценной активностью в качестве ингибитора 5альфа-редуктазы, причем активность наших соединений значительно выше (в наших тестах на порядок) активности лучших прототипов, а именно производного трет-бутила (соединение В).
Таким образом, целью изобретения является создание серии новых производных андростана.
Более конкретно, целью изобретения является создание такие соединения, которые обладают активность в качестве ингибитора 5альфа-редуктазы.
Другие задачи и преимущества изобретения раскрыты в описании.
Соединениями по настоящему изобретению являются соединения формулы (I)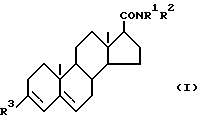 ,
,
где
R 1 представляет собой атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода; или замещенную алкильную группу с 1-6 атомами углерода и по меньшей мере с одной замещенной группой, выбираемой из группы, в которую входят арильные группы, указанные ниже, и ароматические гетероциклические группы, указанные ниже; R 2 представляет собой замещенную алкильную группу с от 1 до 6 атомами углерода и по меньшей мере с одной замещенной группой, выбираемой из группы, в которую входят арильные группы, указанные ниже, и ароматические гетероциклические группы, указанные ниже, причем указанная алкильная группа при желании дополнительно может иметь одну гидроксильную или карбоксильную замещенную группу; либо диариламиногруппу, в которой два арильных фрагмента идентичны или отличны один от другого, причем каждый из них имеет указанные ниже значения; R 3 представляет собой карбоксильную группу или группу формулы -CONHSO2R4, где R4 представляет собой алкильную группу с от 1 до 6 атомами углерода.
Указанные арильные группы представляют собой карбоциклические ароматические группы, имеющие от 6 до 14 атомов углерода в кольце, которые могут быть незамещенными или замещенными по меньшей мере одной замещающей группой, выбираемой из группы, состоящей из замещающих групп А, указанных ниже;
указанные ароматические гетероциклические группы имеют 5 или 6 атомов в кольце, причем от 1 до 3 из них представляют собой гетероатомы, выбираемые из группы, состоящей из гетероатомов азота, кислорода и серы, причем указанная группа может быть незамещенной или замещенной по меньшей мере одной замещающей группой, выбираемой из группы, состоящей из замещающих групп B, указанных ниже;
указанные замещающие группы А выбирают из группы, состоящей из алкильных групп с от 1 до 6 атомами углерода; алкоксильных групп с от 1 до 6 атомами углерода; алкоксикарбонильных групп с от 2 до 7 атомами углерода; гидроксильных групп; атомов галогена; аминогрупп; алкиламиногрупп с от 1 до 6 атомами углерода; диалкиламиногрупп, в которых каждая алкильная группа имеет от 1 до 6 атомов углерода; алифатических ациламиногрупп, имеющих от 1 до 6 атомов углерода; ароматических ациламиногрупп, в которых ароматическим фрагментом является карбоциклическая арильная группа, имеющая от 6 до 10 атомов углерода в кольце, причем данная группа может быть незамещенной или замещенной по меньшей мере одной замещающей группой, выбираемой из группы, состоящей из замещающих групп С, указанных ниже; цианогрупп; нитрогрупп; а также карбоксильных групп;
указанные замещающие группы B выбирают из группы, состоящей из алкильных групп с от 1 до 6 атомами углерода; алкоксильных групп с от 1 до 6 атомами углерода; гидроксильных групп; атомов галогенов; карбоциклических арильных групп, имеющих от 6 до 10 атомов углерода, которые могут быть незамещенными или замещенными по меньшей мере одной замещающей группой, выбираемой из группы, состоящей из замещающих групп С, указанных ниже; аминогрупп; алкиламиногрупп с от 1 до 6 атомами углерода; диалкиламиногрупп, в которых каждая алкильная группа имеет от 1 до 6 атомов углерода; алифатические ациламиногруппы с от 1 до 6 атомами углерода; ароматические ациламиногруппы, в которых каждый ароматический фрагмент представляет собой карбоциклическую арильную группу с от 6 до 10 атомами углерода в кольце, которая может быть незамещенной или замещенной по меньшей мере одной замещающей группой, выбираемой из группы, состоящей из замещающих групп С, указанных ниже; нитрогруппы; а также карбоксильной группы;
указанные замещающие группы С выбирают из группы, состоящей из алкильных групп с от 1 до 6 атомами углерода; алкоксильных групп с от 1 до 6 атомами углерода; гидроксильных групп; атомов галогенов; аминогрупп; алкиламиногрупп с от 1 до 6 атомами углерода; диалкиламиногрупп, в которых каждый алкильный фрагмент имеет от 1 до 6 атомов углерода алифатических ациламиногрупп с от 1 до 6 атомами углерода; цианогрупп; нитрогрупп; а также карбоксильных групп;
а также фармацевтически приемлемые соли и сложные эфиры этих соединений и другие физиологически функциональные производные указанных соединений формулы (I), которые в теле млекопитающего способны превращаться в соединения формулы (I).
Изобретение представляет также фармацевтическую композицию для лечения или профилактики нарушений, возникающих в результате высокого содержания 5альфа-редуктазы, особенно гипертрофии предстательной железы, причем указанная композиция содержит эффективное количество активного соединения в смеси с фармацевтически приемлемым носителем или разбавителем, причем указанное активное соединение выбирают из группы, состоящей из соединений формулы (I), описанных выше, и фармацевтически приемлемых солей и сложных эфиров этих соединений.
Изобретение предоставляет также способ лечения или профилактики нарушений, возникающих в результате высокого содержания 5-альфа-редуктазы, особенно гипертрофии предстательной железы у млекопитающих, включая человека, причем данный способ включает назначение указанному млекопитающему эффективного количества активного соединения, причем указанное активное соединение выбирают из группы, состоящей из соединений формулы (I), описанных выше, и фармацевтически приемлемых солей и сложных эфиров этих соединений.
Изобретение предоставляет также способы приготовления соединений по настоящему изобретению, каковой способ более подробно описан ниже.
Подробное описание изобретения.
В соединениях по настоящему изобретению, где R 1 представляет собой алкильную группу с от 1 до 6 атомами углерода, эта алкильная группа может иметь прямую или разветвленную цепь с от 1 до 6, предпочтительно от 1 до 4 атомами углерода, примеры таких групп включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, вторичную бутильную, трет-бутильную, пентильную, изопентильную, неопентильную, 2-метилбутильную, 1-этилпропильную, 4-метилпентильную, 3-метилпентильную, 2-метилпентильную, 1-метилпентильную, 3,3-диметилбутильную, 2,2-диметилбутильную, 1,1-диметилбутильную, 1,2-диметилбутильную, 1,3-диметилбутильную, 2,3-диметилбутильную, 2-этилбутильную, гексильную и изогексильную группы, особенно метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, пентильную, и гексильную группы. Из этих групп мы отдает предпочтение алкильным группам с от 1 до 4 атомами углерода, еще лучше, если это группы, имеющие от 1 до 3 атомов углерода, наиболее предпочтительными являются метильная, этильная, изопропильная и изобутильная группы, причем лучше всего подходит метильная группа.
Если R1 и R2 представляют собой замещенную группу алкильную, то эта группа может иметь прямую или разветвленную цепь, как описано выше, примеры таких групп приведены для незамещенных алкильных групп, которые могут быть представлены радикалом R1, такие как метильная, этильная, пропильная, изопропильная, трет-бутильная и 1-метилпентильная группы. Предпочтение отдается следующим алкильным группам, которые могут представлены радикалом R2: алкильной группе с от 1 до 4 атомами углерода, более предпочтительными являются алкильные группы с от 1 до 3 атомов углерода, а наиболее предпочтительными являются метильная, этильная и изопропильная группы.
В случае, если радикалы R1 и R2 представляют собой замещенные алкильные группы, то соединение может иметь одну или более замещающих групп, выбираемых из группы, состоящей из арильных групп и ароматических гетероциклических групп, описанных выше, примеры которых приведены ниже. Если замещенные алкильные группы представлены только радикалом R2, то при желании эти замещенные группы могут быть выбраны также из группы, состоящей из гидроксильных групп и карбоксильных групп. Особых ограничений в количестве таких замещенных групп нет, за исключением того, что количество таких групп может быть ограничено количеством замещаемых позиций, или требованиями, предъявляемыми к стероидам, в целом, однако, предпочтение отдается соединениям, содержащим от 1 до 3 таких замещаемых групп, более предпочтительными являются соединения с 1-2 группами, лучше всего - с одной. Если имеется две или более замещающих групп, эти группы могут быть одними и теми же или различными.
В тех случаях, когда замещающей группой на замещаемых алкильных группах, представленных радикалами R1 и R2, является арильная группа, то этой группой является карбоциклическая ароматическая группа (т.е. ароматическая группа, содержащая одно или более колец, в которых все атомы являются атомами углерода) с от 6 до 14 атомами углерода в кольце, предпочтительно с от 6 до 10 атомами углерода, еще лучше - с от 6 или 10 атомов углерода, примеры таких групп включают фенильную, инденильную, 1-нафтильную, 2-нафтильную, бифениленильную, аценафтиленильную, флуоренильную, фенантрильную и антрильную группы, из которых предпочтительными являются фенильная и нафтильная группы, наиболее предпочтительная фенильная группа.
Такие арильные группы могут быть незамещенными или замещенными одной или более замещающими группами А, описанными выше, примеры замещающих групп А приведены ниже. Если арильные группы являются замещенными, то особых ограничений в отношении количества замещающих групп А нет, за исключением того, что количество замещающих групп может быть ограничено количеством замещаемых позиций или требованиями, предъявляемыми к стероидам. В целом предпочтительно, чтобы количество замещающих групп составляло от 1 до 4, лучше - от 1 до 3, а лучше всего, чтобы таких групп было одна или две. Если имеется две или более замещающих групп, эти группы могут быть одними и теми же, или различными. Примеры таких замещающих групп А включают:
алкильные группы с от 1 до 6 атомами углерода, такие как группы, приведенные в числе незамещенных групп, которые могут быть представлены радикалом R1;
алкоксильные группы с от 1 до 6 атомами углерода, такие как метоксильная, этоксильная, пропоксильная, изопропоксильная, бутоксильная, изобутоксильная, вторичная бутоксильная, трет-бутоксильная, пентилоксильная, изопентилоксильная, неопентилоксильная, 2-метилбутоксильная, 1-этилпропоксильная, 4-метоксипентилоксильная, 3-метоксипентилоксильная, 2-метоксипентилоксильная, 1-метоксипентилоксильная, 3,3-диметилбутоксильная, 2,2-диметилбутоксильная, 1,1-диметилбутоксильная, 1,2-диметилбутоксильная, 2-этилбутоксильная, гексилоксильная и изогексилоксильная группы, из которых предпочтительными являются метоксильная и этоксильная группы;
алкоксикарбонильные группы с от 2 до 7 атомов углерода, алкоксильные фрагменты которых имеют от 1 до 6 атомов углерода, такие как метоксикарбонильная, этоксикарбонильная, пропоксикарбонильная, изопропоксикарбонильная, бутоксикарбонильная, изобутоксакарбонильная, вторичная бутоксикарбонильная, трет-бутоксикарбонильная, пентилоксикарбонильная, изопентилоксикарбонильная, 2-метилбутоксикарбонильная, 1-этилпропоксикарбонильная, 4-метоксипентилоксикарбонильная, 3-метоксипентилоксикарбонильная, 2-метоксипентилоксикарбонильная, 1-метоксипентилоксикарбонильная, 3,3-диметилбутоксикарбонильная, 2,2-диметилбутоксикарбонильная, 1,1-диметилбутоксикарбонильная, 1,2-диметилбутоксикарбонильная, 1,3-диметилбутоксикарбонильная, 2,3-диметилбутоксикарбонильная, 2-этилбутоксикарбонильная, гексилоксикарбонильная, изогексилоксикарбонильная группы, из которых метоксикарбонильная и этоксикарбонильная группы являются предпочтительными;
гидроксильные группы;
атомы галогенов, таких как фтора, хлора, брома и иода, из которых атомы фтора, хлора и брома являются предпочтительными, причем наиболее предпочтительными являются атомы фтора и хлора;
аминогруппы;
алкиламиногруппы с от 1 до 6 атомами углерода, такие как метиламино-, этиламино-, пропиламино-, бутиламино-, изобутиламино-, пентиламино- и гексиламиногруппы; из этих групп мы предпочитаем группы, в которых алкильный фрагмент имеет от 1 до 4, лучше - 1 или 2 атома углерода;
диалкиламиногруппы, в которых каждый алкильный фрагмент имеет от 1 до 6 атомов углерода, такие как диметилаино-, диэтиламино-, метилэтиламино-, дипропиламино-, диизопропиламино-, дибутиламино-, дипентиламино-, дигексиламино-, метилбутиламино- и этилпропиламиногруппы; из них мы предпочитаем группы, в которых каждый алкильный фрагмент имеет от 1 до 4, лучше 1 или 2 атома углерода;
алифатические ациламиногруппы с от 1 до 6 атомами углерода, такие как формиламино-, ацетиламино-, пропиониламино-, бутириламино-, валериламино-, изовалериламино-, пивалоиламино-, гексаноиламиногруппы, из которых группы, имеющие от 1 до 5 атомов углерода, являются предпочтительными, а группы, имеющие 1 или 3 атома углерода, являются наиболее предпочтительными;
ароматические ациламиногруппы, в которых ароматический фрагмент представляет собой карбоциклическую арильную группу, имеющую от 6 до 10, предпочтительно 6 или 10 атомов углерода в кольце (например, фенильная или нафтильная группы), причем эта группа может быть незамещенной или замещенной по меньшей мере одной замещающей группой, выбираемой из группы, в которую входят замещающие группы C, описанные выше, такие как бензольная или нафтоильная группы, и замещенные производные этих групп;
цианогруппы; нитрогруппы; а также карбоксильные группы.
Примеры группы и атомов, включенных в список замещающих групп C, совпадают с соответствующими группами и атомами, включенными в список замещающих групп A и приведены выше.
Из указанных замещающих группа A мы отдаем предпочтение алкильным группам, имеющим от 1 до 4 атомов углерода, алкоксильным группам, имеющим от 1 до 4 атомов углерода, алкоксикарбонильным группам, имеющим 2 или 3 атома углерода, гидроксильным группам, атомам галогенов, аминогруппам, алкиламиногруппам, имеющим от 1 до 4 атомов углерода, диалкиламиногруппам, в которых каждый алкильный фрагмент имеет от 1 до 4 атомов углерода, а также алифатическим ациламиногруппам, имеющим от 1 до 3 атомов углерода, более предпочтительными являются метильная, этильная, метоксильная, этоксильная, метоксикарбонильная, этоксикарбонильная, гидроксильная, амино-, метиламино-, этиламино-, диметиламино-, диэтиламино-, метилэтиламино-, формиламино-, и ацетиламиногруппы, а также атомы фтора, хлора и брома; наиболее предпочтительными являются метильная, метоксильная, этоксильная, и гидроксильная группы и атомы фтора и хлора.
В тех случаях, когда замещающая группа на замещенных алкильных группах, представленных радикалом R1 или R2, является ароматической гетероциклической группой, эта гетероциклическая группа имеет 5 или 6 атомов в ароматическом кольце. Эта группа имеет также от 1 до 3 гетероатомов, выбираемых из группы, в которую входят атомы азота, атомы кислорода и атомы серы, причем остающиеся атомы в кольце являются атомами углерода. В целом, в тех случаях, когда имеется при гетероатома, мы предпочитаем, чтобы 1, 2 или 3, предпочтительно 2 или 3 атома были атомами азота и соответственно 2, 1 или 0, предпочтительно 1 или 0 атомы были атомами кислорода и/или атомами серы. В тех случаях, когда имеется 1 или 2 гетероатома, их можно свободно выбирать из атомов азота, кислорода или серы. Примеры таких групп включают фурильную, тиенильную, пиридильную, пирролильную, имидазолильную, тиазолильную, изотиазолильную, оксазолильную, изоксазолильную, пиразинильную, пиримидинильную и пиридазинильную группы.
Из этих групп мы предпочитаем фурильную, тиенильную и пиридильную группы, более предпочтительными являются фурильная и тиенильная группы, наиболее предпочтительна тиенильная группа. Такие ароматические гетероциклические группы могут быть незамещенными или замещенными по меньшей мере одной или более замещающими группами В, описанными выше. При наличии замещенных групп нет особых ограничений по количеству замещающих групп В, за исключением того, что количество замещающих групп может быть ограничено количеством замещаемых позиций или требованиями, предъявляемыми к стероидам. В целом предпочтительно, чтобы число замещающих групп составляло от 1 до 3, лучше всего 1 или 2. При наличии двух или более замещающих групп эти группы могут быть одними и теми же или различными.
Примеры таких замещающих групп В включают соответствующие группы и атомы, приведенные выше в связи с описанием замещающих групп А, а также арильные группы, имеющие от 6 до 10 атомов углерода, такие как группы, примеры которых приведены выше и включены в список арильных групп, которые могут быть представлены радикалом R1. В частности, предпочитаемые замещающие группы включают алкильные группы, имеющие от 1 до 6 атомов углерода (такие, как группы, примеры которых приведены выше для радикала R1) и атом галогена (такой, как атом фтора, хлора, брома и иода).
Более предпочтительными замещающими группами являются алкильные группы, имеющие от 1 до 4 атомов углерода, атомы фтора и атомы хлора, еще более предпочитаемыми являются метильная и этильная группы, а наиболее предпочитаемой является метильная группа.
R3 и, возможно, замещающие группы A, B и C могут представлять карбоксильные группы, а также группа, представленная R2, может включать карбоксильную группу и таким образом, соединения по настоящему изобретению могут образовывать соли и сложные эфиры, а также другие производные, которые хорошо известны в данной области, такие как амиды. Нет никаких ограничений относительно природы таких солей, эфиров и других производных, при условии, что они предназначены для терапевтических целей, являются приемлемыми с фармацевтической точки зрения, обладают не меньшей активностью (или слишком малой активностью) и не являются более токсичными (или чрезмерно токсичными), чем исходные соединения. Однако в тех случаях, когда соединения предназначены для других целей, например для использования в качестве промежуточных соединений при приготовлении других соединений, даже эти ограничения можно не применять.
Предпочтительными эфирными группами являются группы, которые in vivo могут превращаться в карбоксильные группы. Примеры таких эфирных групп включают:
алкильные группы, имеющие от 1 до 6, предпочтительно от 1 до 4 атомов углерода, такие как группы, примеры которых приведены в отношении радикала R1; галоалкильные группы, имеющие от 1 до 6, предпочтительно от 1 до 4 атомов углерода, такие как трифторметильная, 2,2,2-трифторэтильная, 2,2,2,-трихлорэтильная, 2-фторэтильная, 2-хлорэтильная, 2-иодэтильная, 3-хлорпропильная, 4-фторбутильная и 6-иодгексильная группы, предпочтительно 2,2,2-трихлорэтильная и 2-хлорэтильная группы;
гидроксиалкильные группы, имеющие от 1 до 6, предпочтительно от 1 до 4 атомов углерода, такие как 2-гидроксиэтильная, 2,3-дигидроксипропильная, 3-гидроксипропильная, 3,4-дигидроксибутильная и 4-гидроксибутильная группы, предпочтительно, 2-гидроксиэтильная группа;
алкоксиалкильные и алкоксиалкоксиалкильные группы, в которых алкильные и алкоксильные группы, каждая, имеют от 1 до 6, предпочтительно от 1 до 4 атомов углерода, такие, как метоксиметильная, 2-метоксиэтильная, 2-этоксиэтильная, и 2-метоксиэтильная, 2-этоксиэтильная и 2-метоксиэтоксиэтельная группы, предпочтительно метоксиметильная группа;
фенацильная группа;
алкоксикарбонилалкильные группы, в которых алкильные и алкоксильные группы, каждая, имеют от 1 до 6 атомов, предпочтительно от 1 до 4 атомов углерода, такие как метоксикарбонилметильная группа;
цианоалкильные группы, в которых алкильный фрагмент имеет от 1 до 6, предпочтительно от 1 до 4 атомов углерода, такие как цианометильная и 2-цианоэтильная группы;
алкилтиометильные группы, в которых алкильный фрагмент имеет от 1 до 6, предпочтительно от 1 до 4 атомов углерода, такие как метилтиометильная и этилтиометильная группы;
арилтиометильные группы, в которых арильный фрагмент имеет от 6 до 10 атомов в кольце и может быть незамещенным или замещенным по меньшей мере одной замещающей группой, выбираемой из группы, в которую входят замещающие группы С, приведенные выше, такие как фенилтиометильная и нафтилтиометильная группы;
алкилсульфонилалкильные группы, в которых каждый алкильный фрагмент имеет от 1 до 6, предпочтительно от 1 до 4 атомов углерода, и в которых алкилсульфонильный фрагмент может быть незамещенным или замещенным по меньшей мере одним атомом галогена, такие как 2-метансульфонилэтильная и 2-трифторметансульфонилэтильная группы;
арилсульфонилалкильные группы, в которых арильный фрагмент имеет от 6 до 10 атомов углерода в кольце и может быть незамещенным или замещенным по меньшей мере одной замещающей группой, выбираемой из группы, в которую вводят замещающие группы C, приведенные выше, и алкильный фрагмент которых имеет от 1 до 6, предпочтительно от 1 до 4 атомов углерода, такие как 2-бензолсульфонилэтильная и 2-толуолсульфонилэтильная группы;
аралкильные группы, в которых арильный фрагмент имеет от 6 до 10 атомов углерода и может быть незамещенным или замещенным по меньшей мере одной замещающей группой, выбираемой из группы, в которую входят замещающие группы С, приведенные выше, и алкильный фрагмент которых имеет от 1 до 6, предпочтительно от 1 до 3 атомов углерода, такие как бензильная, нафтилметильная, дифенилметильная, тритильная, 6-фенилгексильная, 4-метилбензильная, 2,4,6-триметилбензильная, 3,4,5-триметилбензильная, 4-метоксибензильная, 4-хлорбензильная и 4-бромбензильная группы, предпочтительно, те аралкильные группы, в которых арильный фрагмент представляет собой фенильную группу, а алкильный фрагмент имеет от 1 до 6, предпочтительно от 1 до 3 атомов углерода, еще лучше подходят бензильная, 4-метилбензильная, 4-хлообензильная и 2-бромбензильная группы;
арильные группы, такие как группы, описание и примеры которых приведены в связи с арильными группами, которые могут замещать замещенные алкильные группы, представленные радикалами R1 и R2;
силильные группы формулы - SiRaRbRc, где 1, 2 и 3 радикалов Ra, Rb, и Rc, которые могут иметь одинаковые или различные значения, каждое представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода (примеры этих групп приведены при описании радикала R1) и, соответственно 2, 1 и 0 радикалов Ra, Rb и Rc, представляют собой арильные группы, такие как группы, приведенные при описании арильных групп, которые могут быть группами, замещающими замещенные алкильные группы, представленные радикалом R1 или R2; примеры подобных силильных групп включают триметилсилильную, триэтилсилильную, изопропилдиметилсилильную, трет-бутилдиметилсилильную, метилдиизопропилсилильную, метилди-трет-бутилсилильную, триизопропилсилильную, метилдифенилсилильную, изопропилдифенилсилильную, бутилдифенилсилильную и фенилдиизопропилсилильную группы, предпочтительными группами являются триметилсилильная, трет-бутилдиметилсилильная метилдифенилсилильная группы;
алканоилоксиалкильные группы, в которых алканоильные и алкильные группы, каждая, имеют от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода в случае алкильных групп или от 1 до 5 атомов углерода в случае алканоильных групп, в числе этих групп формилоксиметильная, ацетоксиметильная, пропионилоксиметильная, бутирилоксиметильная, пивалоилоксиметильная, валерилоксиметильная, изовалерилоксиметильная, гексаноилоксиметильная, 1-формилоксиэтильная, 1-ацетоксиэтильная, 1-пропионилоксиэтильная, 1-бутирилоксиэтильная, 1-пивалоилоксиэтильная, 2-валерилоксиэтильная, 2-изовалерилоксиэтильная, 1-гексаноилоксиэтильная, 2-формилоксиэтильная, 2-ацетоксиэтильная, 2-пропионилоксиэтильная, 2-бутирилоксиэтильная, 2-пивалоилоксиэтильная, 2-валерилоксиэтильная, 2-изовалерилоксиэтильная, 2-гексаноилоксиэтильная, 1-формилоксипропильная, 1-ацетоксипропильная, 1-пропионилоксипропильная, 1-бутирилоксипропильная, 1-пивалоилоксипропильная, 1-валерилоксипропильная, 1-изовалерилоксипропильная, 1-гексаноилоксипропильная, 1-ацетоксибутильная, 1-пропионилоксибутильная, 1-бутирилоксибутильная, 1-пивалоилоксибутильная, 1-ацетоксипентильная, 1-пропионилоксипентильная, 1-бутирилоксипентильная, 1-пивалоилоксипентильная и 1-пивалоилоксигексильная группы, предпочтительными являются формилоксиметильная, ацетоксиметильная; пропионилоксиметильная, бутирилоксиметильная, пивалоилоксиметильная, 1-формилоксиэтильная, 1-ацетоксиэтильная, 1-пропионилоксиэтильная, 1-бутирилоксиэтильная и 1-пивалоилоксиэтильная группы,
более предпочтительными являются ацетоксиметильная, пропионилоксиметильная, бутирилоксиметильная, пивалоилоксиметильная, 1-ацетоксиэтильная, 1-пропионилоксиэтильная, 1-бутирилоксиэтильная и 1-пивалоилоксиэтильная группы, самыми предпочтительными являются пивалоилоксиметильная и 1-пивалоилоксиэтильная группы;
циклоалканкарбонилоксиалкильные группы, в которых циклоалкановый фрагмент имеет от 5 до 7, предпочтительно 5 или 6 атомов углерода, а алкильный фрагмент имеет от 1 до 6, предпочтительно 1 до 4 атомов углерода (примеры таких групп приведены выше в связи с радикалом R1), в числе подобных групп циклопентанкарбонилоксиметильная, циклогексанкарбонилоксиметильная, 1-(циклопентанкарбонилокси)метильная, 1-(циклогексанкарбонилокси)этильная, 1-(циклопентанкарбонилокси)пропильная, 1-(циклопентанкарбонилокси)бутильная, 1-(циклогексанкарбонилокси)бутильная, циклогептанкарбонилоксиметильная, 1-(циклогептанкарбонилокси)этильная, 1-(циклогептанкарбонилокси)пропильная и 1-(циклогептанкарбонилокси)бутильная группы, предпочтительными являются циклопентанкарбонилоксиметильная, циклогексанкарбонилоксиметильная, 1-(циклопентанкарбонилокси)этильная, 1-(циклогексанкарбонилокси)этильная группы;
алкоксикарбонилоксиалкильные группы, в которых алкильная и алкоксиалкильная группы, каждая, имеет от 1 до 6, предпочтительно от 1 до 4 атомов углерода, в числе таких групп метоксикарбонилоксиметильная, этоксикарбонилоксиметильная, пропоксикарбонилоксиметильная, изопропоксикарбонилоксиметильная, бутоксикарбонилоксиметильная, изобутоксикарбонилоксиметильная, пентилоксикарбонилоксиметильная, гексилоксикарбонилоксиметильная, 1-метоксикарбонилоксиэтильная, 1-этоксикарбонилоксиэтильная, 1-пропоксикарбонилоксиэтильная, 1-изопропоксикарбонилоксиэтильная, 1-бутоксикарбонилоксиэтильная, 1-изобутоксикарбонилоксиэтильная, 1-пентилоксикарбонилоксиэтильная, 1-гексилоксикарбонилоксиэтильная, 2-метоксикарбонилоксиэтильная, 2-этоксикарбонилоксиэтильная, 2-пропоксикарбонилоксиэтильная, 2-изопропоксикарбонилоксиэтильная, 2-бутоксикарбонилоксиэтильная, 2-изобутоксикарбонилоксиэтильная, 2-пентилоксикарбонилоксиэтильная, 2-гексилоксикарбонилоксиэтильная, 1-метоксикарбонилоксипропильная, 1-этоксикарбонилоксипропильная, 1-пропоксикарбонилоксипропильная, 1-изопропоксикарбонилоксипропильная, 1-бутоксикарбонилоксипропильная, 1-изобутоксикарбонилоксипропильная, 1-пентилоксикарбонилоксипропильная,
1-гексилоксикарбонилоксипропильная, 1-метоксикарбонилоксибутильная, 1-этоксикарбонилоксибутильная, 1-пропоксикарбонилоксибутильная, 1-изопропоксикарбонилоксибутильная, 1-бутоксикарбонилоксибутильная, 1-изобутоксикарбонилоксибутильная, 1-метоксикарбонилоксипентильная, 1-этоксикарбонилоксипентильная, 1-метоксикарбонилоксигексильная и 1-этоксикарбонилоксигексильная группы, предпочтительными являются метоксикарбонилоксиметильная, этоксикарбонилоксиметильная, пропоксикарбонилоксиметильная, изопропоксикарбонилоксиметильная, бутоксикарбонилоксиметильная, изобутоксикарбонилоксиметильная, 1-метоксикарбонилоксиэтильная, 1-этоксикарбонилоксиэтильная, 1-пропоксикарбонилоксиэтильная, 1-изопропоксикарбонилоксиэтильная, 1-бутоксикарбонилоксиэтильная, 1-изобутоксикарбонилоксиэтильная, 1-метоксикарбонилоксипропильная, 1-этоксикарбонилоксипропильная, 1-пропоксикарбонилоксипропильная, 1-изопропоксикарбонилоксипропильная, 1-бутоксикарбонилоксипропильная, 1-изобутоксикарбонилоксипропильная, 1-метоксикарбонилоксибутильная, 1-этоксикарбонилоксибутильная, 1-пропоксикарбонилоксибутильная, 1-изопропоксикарбонилоксибутильная, 1-бутоксикарбонилоксибутильная и 1-изобутоксикарбонилоксибутильная группа, более предпочтительными являются метоксикарбонилоксиметильная, этоксикарбонилоксиметильная, пропоксикарбонилоксиметильная, изопропоксикарбонилоксиметильная, бутоксикарбонилоксиметильная, изобутоксикарбонилоксиметильная,
1-метоксикарбонилоксиэтильная, 1-этоксикарбонилоксиэтильная, 1-пропоксикарбонилоксиэтильная, 1-изопропоксикарбонилоксиэтильная, 1-бутоксикарбонилоксиэтильная и 1-изобутоксикарбонилоксиэтильная группы, а наиболее предпочтительными являются метоксикарбонилоксиметильная, этоксикарбонилоксиметильная, изопропоксикарбонилоксиметильная, 1-метоксикарбонилоксиэтильная, 1-этоксикарбонилоксиэтильная, и 1-изопропоксикарбонилоксиэтильная группы;
циклоалкилоксикарбонилоксиалкильные группы, в которых циклоалкильный фрагмент имеет от 5 до 7, предпочтительно 5 или 6 томов углерода, а алкильный фрагмент имеет от 1 до 6, предпочтительно от 1 до 4 атомов углерода (примеры подобных групп приведены в связи с радикалом R1), в числе таких групп циклопентилоксикарбонилоксиметильная, циклогексилоксикарбонилоксиметильная, 1-(циклопентилоксикарбонилокси)этильная, 1-(циклогексилоксикарбонилокси)этильная, 1-(циклопентилоксикарбонилокси)пропильная, 1-(циклогексилоксикарбонилокси)пропильная, 1-(циклопентилоксикарбонилокси)бутильная, 1-(циклогексилоксикарбонилокси)бутильная, циклогептилоксикарбонилоксиметильная, 1-(циклогептилоксикарбонилокси)пропильная и 1-(циклогептилоксикарбонилокси)-бутильная группы, предпочтительными являются циклопентилоксикарбонилоксиметильная, циклогексилоксикарбонилоксиметильная, 1-(циклопентилоксикарбонилокси)этильная и 1-(циклогексилоксикарбонилокси)этильная группы;
(5-арил- или 5-алкил-2-оксо-1,3-диоксолен-4-ил)метильные группы, в которых арильный фрагмент имеет от 6 до 10 атомов углерода в кольце и может быть незамещенным или замещенным по меньшей мере одной замещающей группой, выбираемой из группы, в которую входят замещающие группы C, приведенные выше, а алкильный фрагмент имеет от 1 до 6, предпочтительно от 1 до 4 атомов углерода (примеры таких групп приведены выше в связи с радикалом R1), в числе таких групп (5-фенил-2-оксо-1,3-диоксолен-4-ил)метильная, [5-(4-метилфенил)-2-оксо-1,3-диоксолен-4-ил] метильная, [5-(4-метоксифенил)-2-оксо-1,3-диоксолен-4-ил]метильная, [5-(4-фторфенил)-2-оксо-1,3-диоксолен-4-ил]метильная, [5-(4-хлорфенил)-2-оксо-1,3-диоксолен-4-ил] метильная, (5-метил-2-оксо-1,3-диоксолен-4-ил)метильная,
(5-этил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-пропил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-изопропил-2-оксо-1,3-диоксолен-4-ил)метильная и (5-бутил-2-оксо-1,3-диоксолен-4-ил)метильная группы, предпочтительными являются (5-фенил-2-оксо-1,3-диоксолен-4-ил)метильная и (5-этил-2-оксо-1,3-диоксолен-4-ил)метильная группы, а наиболее предпочтительной является (5-метил-2-оксо-1,3-диоксолен-4-ил)метильная группа;
фталидильная группа.
Из вышеуказанных групп особенно предпочтительными являются алкильные группы, имеющие от 1 до 4 атомов углерода; бензильные группы; замещенные бензильные группы, имеющие от 1 до 3 замещающих групп, выбираемых из групп, в которую входят метильная, этильная, метоксильная и этоксильная группы и атомы фтора и хлора; дифенилметильная группа; нафтилметильная группа; алканоилоксильные группы, в которых алканоильный фрагмент имеет от 1 до 5 атомов углерода, а алкильный фрагмент имеет от 1 до 4 атомов углерода; циклоалканкарбонилоксиалкильные группы, в которых циклоалкильный фрагмент имеет от 5 до 7 атомов к кольце, а алкильный фрагмент имеет от 1 до 4 атомов углерода; алкоксикарбонилоксиалкильные группы, в которых алкоксильный и алкильный фрагменты, каждый, имеют от 1 до 4 атомов углерода; циклоалкилоксикарбонилоксиалкильные группы, в которых циклоалкильный фрагмент имеет от 5 до 7 атомов углерода в кольце, а алкильный фрагмент имеет от 1 до 4 атомов углерода; (5-фенил- или 5-алкил-2-оксо-1,3-диоксолен-4-ил)метильные группы, в которых алкильный фрагмент имеет от 1 до 4 атомов углерода; а также фталидильная группа.
В числе более предпочтительных групп сложных эфиров следующие: алкильные группы, имеющие от 1 до 4 атомов углерода; бензильные группы; алканоилоксиалкильные группы, в которых алканоильный фрагмент имеет от 1 до 5 атомов углерода, а алкильный фрагмент имеет 1 или 2 атома углерода; циклоалканкарбонилоксиалкильные группы, в которых циклоалкильный фрагмент имеет от 5 до 7 атомов углерода в кольце, а алкильный фрагмент имеет 1 или 2 атома углерода; алкоксикарбонилоксиалкильные группы, в которых алкоксильный фрагмент имеет от 1 до 4 атомов углерода, а алкильный фрагмент имеет 1 или 2 атома углерода; циклоалкоксикарбонилоксиалкильные группы, в которых циклоалкильный фрагмент имеет от 5 до 7 атомов углерода в кольце, а алкильный фрагмент имеет 1 или 2 атома углерода; (5- фенил, 5-метил- или 5-этил-2-оксо-1,3-диоксолен-4-ил)метильные группы; а также фталидильная группа;
Наиболее предпочтительные группы сложных эфиров включают следующие: метильные группы; этильные группы, пивалоилоксиметильные группы, этоксикарбонилоксиметильные группы, 1-(этоксикарбонилокси)этильные группы, изопропоксикарбонилоксиметильные группы, 1- (изопропоксикарбонилокси)этильные группы, (5-метил-2-оксо-1,3-диоксолен-4-ил)метильную группу и фталидильные группы.
Те соединения по настоящему изобретению, которые содержат карбоксильную группу, могут образовывать также соли. В числе примеров таких солей следующие: соли щелочных металлов, таких как натрий, калий или литий; соли щелочноземельных металлов, такие как барий или кальций; соли других металлов, таких как марганец или алюминий; аммониевые соли; соли органических оснований, такие как соли триэтиламина, циклогексиламина, дициклогексиламина и гуанидина; а также соли основных аминокислот, такие как лизин или аргинин. В тех случаях, когда соединение по настоящему изобретению содержит основную группу, такую как аминогруппа, в своей молекуле, то такое соединение может образовывать соли при добавке кислот.
В числе таких солей - соли неорганических кислот, особенно галоидоводородных кислот (таких, как фтористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота или хлористоводородная кислота), азотной кислоты, угольной кислоты, серной кислоты или фосфорной кислоты; соли низших алкилсульфоновых кислот, таких как метансульфоновая кислота, трифторметансульфоновая кислота или этансульфоновая кислота; соли арилсульфоновых кислот, таких как бензолсульфоновая кислота или n-толуолсульфоновая кислота; соли органических карбоновых кислот, таких как уксусная кислота, фумаровая кислота, винная кислота, щавелевая кислота,
малеиновая кислота, яблочная кислота, янтарная кислота, бензойная кислота, миндальная кислота, аскорбиновая кислота, молочная кислота, глюконовая кислота или лимонная кислота; а также соли аминокислот, таких как глютаминовая кислота или аспаргиновая кислота.
В числе примеров алкильных групп, которые могут быть выражены радикалом R4, можно привести следующие; алкильные группы, примеры которых приведены выше в связи с радикалом R1, особенно метильная и этильная группа.
В целом в соединениях по настоящему изобретению желательно, чтобы радикал R1 представлял собой атом водорода, а радикал R2 имел вышеуказанные значения.
В числе предпочтительных групп формулы -NR1R2 следующие; бензиламино-, (2-, 3- или 4-метилбензил)амино-, (2-,3- или 4-метоксибензил)амино-, (2-,3- или 4-фторбензил)амино-, (2-, 3- или 4-хлорбензил)амино-, фенетиламино-, (2-, 3- или 4-метилфенетил)-амино-, (2-,3- или 4-метоксифенетил)амино-, (2-, 3- или фторфенетил)амино-, (2-, 3- или 4-хлорфенетил)амино-, (3-фенилпропил)-амино-, (1-метил-1-фенилэтил)амино-, [1-метил-1-(2-,3- или 4-метилфенил)этил] амино-, [1-метил-1-(2-, 3- или 4-метоксифенил)-этил]амино-, [1-метил-1-(2-,3- или 4-фторфенил)этил]амино-, [1-метил-1-(2-,3- или 4-хлорфенил)этил] амино-, [1-метил-1-(2-,3- или 4-гидроксифенил)этил]амино-, [1-метил-1-(2-, 3- или 4-аминофенил)этил]амино-, [1-метил-1-(2-, 3 или 4-метиламинофенил)этил] амино-, [1-метил-1-(2-, 3- или 4-этиламинофенил)этил]-амино-, [1-метил-1-(2-, 3- или 4-диметиламинофенил)этил]амино-, [1-метил-1-(2-, 3- или 4-ацетамидофенил)этил] амино-, [1-метил-1-(2,3-, 2,4- 2,5-, 2,6-, 3,4-, 3,5-, или 3,6-диметоксифенил)-этил]амино-, [1,1-диметил-2-фенилэтил)амино-, [1,1-диметил-2- -(2-, 3- или 4-метиленфенил)этил]амино-,[1,1-диметил-2-(2-, 3- или 4-метоксифенил)этил] амино-, [1,1-диметил-2-(2-, 3- или 4-фторфенил)этил]амино-, [1,1-диметил-2-(2-,3- или 4-хлорфенил)-этил]амино-, бензгидриламино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)-диметилбензгидрил]амино-, [(2-, 3-, или 4-), (2'-, 3', или 4'-)-диметоксибензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)-дифторбензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)-дигидроксибензгидрил] амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)-ди(диметиламино)бензгидрил] амино-, (2-, 3- или 4-метилбензгидрил)амино-, (2-, 3- или 4-метоксибензгидрил)амино-, (2-,3- или 4-фторбензгидрил)амино-, (2-, 3- или 4-хлорбензгидрил)амино-,
(2-, 3- или 4-гидроксибензгидрил)амино-, (2-, 3- или 4-аминобензгидрил)амино-, (2-, 3- или 4-диметиламинобензгидрил)-амино-, (1,1-дифенилэтил)амино-, (1,2-дифенилэтил)амино-, [2-(2-, 3- или 4-метилфенил)-1-фенилэтил] амино-, [2-(2-, 3- или 4-метоксифенил)-1-фенилэтил]амино-, [2-(2-, 3- или 4-фторфенил)-1-фенилэтил] амино-, [2-(2-, 3- или 4-хлорфенил)-1-фенилэтил] -амино-, [1-(2-, 3- или 4-фторфенил)-2-(2-, 3- или 4-фторфенил)-этил] амино-, [1-(2-, 3- или 4-хлорфенил)-2-(2-, 3- или 4-хлорфенил)этил]амино-, [1-(2-, 3- или 4-хлорфенил)-2-(2-, 3- или 4-метоксифенил)этил]амино-, [1-(2-, 3- или 4-метилфенил)-2-(2-, 3- или 4-метилфенил)этил]амино-, [1-(2-, 3- или 4-гидроксифенил)-2-(2-, 3- или 4-гидроксифенил)этил]амино-, [1-(2-, 3- или 4-аминофенил)-2-(2-, 3- или 4-аминофенил)этил]амино-, [1-(2-, 3- или 4-диметиламинофенил)-2-(2-, 3- или 4-диметиламинофенил)этил]-амино-, [2-(2-, 3- или 4-фторфенил)-1-(2-, 3- или 4-метилфенил)-этил]амино-, [2-(2-, 3- или 4-фторфенил)-1-(2-, 3- или 4-метоксифенил)этил]амино-, [2-(2-, 3- или 4-гидроксифенил)-1-фенилэтил] -амино-, [2-(2-, 3- или 4-аминофенил)-1-фенилэтил] амино-, [2-(2-, 3- или 4-диметиламинофенил)-1-фенилэтил]амино-, [1-(2-, 3- или 4-метоксифенил)-2-фенилэтил]амино-, 1-метил-1,2-дифенилэтил)амино-, (2,2-дифенилэтил)амино,
[2-(2-, 3- или 4-метилфенил)-2-(2-(2-, 3- или 4-метилфенил)этил]амино-, [2-(2-, 3- или 4-метоксифенил)-2- (2-(2-, 3- или 4-метоксифенил)этил]амино-, (1-бензил-4-фенилбутил)амино-, (1,1-дифенилэтил)амино-, [1-(2-, 3- или 4-фторфенил)-1-(1-(2-, 3- или 4-фторфенил)этил]амино-, [1-(2-, 3- или 4-метилфенил)-1-(2-(2-, 3- или 4-метилфенил)этил]амино-, [1-(2-, 3- или 4-метоксифенил)-1-(2-(2-, 3- или 4-метоксифенил)этил]амино-, [1-(2-, 3- или 4-гидроксифенил)-1-фенилэтил] амино-, [1-(2-, 3- или 4-аминофенил)-1-фенилэтил] амино-, [1-(2-, 3- или 4-диметиламинофенил)-1-фенилэтил]амино-, тритиламино-, [(2-', 3- или 4-), (2'-, 3'- или 4'-), (2''-, 3''- или 4'')триметилтритил] -амино-, [(2-, 3- или 4-), (2-', 3- или 4-), (2'-, 3'- или 4'-), (2''-, 3''- или 4'')трифтортритил]-амино-, [1-бензил-2-фенилэтил)амино-, []1-(2-, 3- или 4-фторбензил)-2-(2-, 3- или 4-фторбензил)-2-(2-, 3- или 4-фторфенил)этил]амино-, (1-бензил-1-метил-2-фенилэтил)амино-, [1-(2-, 3- или 4-хлорбензил)-2- (2-, 3- или 4-фторфенил)этил]амино-, [1-(2-, 3- или 4-фторбензил)-2- (2-, 3- или 4-фторфенил)-1-метилэтил]амино-, [1-метил-2- (2-, 3- или 4-метилфенил)-3-(2-, 3- или 4-метилфенил)пропил]амино-, [2-(2-, 3- или 4-фторфенил)-3-(2-, 3- или 4-фторфенил)-1-метилпропил]амино-, (1,3-дифенилпропил)-амино-, [1-(2-, 3- или 4-метилфенил)-3-(2-, 3- или 4-метилфенил)-пропил]амино-, [1-(2-, 3- или 4-метоксифенил)-3-(2-, 3-
или 4-метоксифенил)-пропил]амино-, (1,4-дифенилбутил)амино-, [1-(2-, 3- или 4-хлорфенил)-4-(2-, 3- или 4-хлорфенил)бутил]амино-, [1-(2-, 3- или 4-метоксифенил)-4-(2-, 3- или 4-метоксифенил)бутил]амино-, (1-метил-3,3-дифенилпропил)амино-, [3-(2-, 3- или 4-фторфенил)-3-(2-, 3- или 4-фторфенил)-1-метилпропил] амино-, [1-метил-3-(2-, 3- или 4-метилфенил)-3-(2-, 3- или 4-метилфенил)пропил] амино-, N-бензил-N-метиламино-, N-бензил-N- N-бензил-N-этиламино, N-бензил-N-изопропил-амино, N-бензил-N-изобутиламино, N-бензил-N-трет-бутиламино, N-(2-, 3- или 4-фторбензил)-N-изопропиламино-, N-(2-, 3- или 4-хлорбензил-N-изопропиламино-, N-(2-, 3- или 4-метилбензил)-N-изопропиламино-, N-(2-, 3- или 4-метоксибензил)-N-изопропиламино-, N-(2-, 3- или 4-гидроксибензил)-N-изопропиламино-, N,N-дибензиламино-, N-бензил-N-(2-, 3- или 4-метоксибензил)амино-, N-(2-, 3- или 4-фторбензил)-N-(2-, 3- или 4-фторбензил)амино-, N-(2-, 3- или 4-метилбензил)-N-(2-, 3- или 4-метилбензил)амино-, N-(2-, 3- или 4-метоксибензил)-N-(2-, 3- или 4-метоксибензил)амино-, N-(2-, 3- или 4-гидроксибензил)-N-(2-, 3- или 4-гидроксибензил)амино-, N-(2-, 3- или 4-аминобензил)-N-(2-, 3- или 4-аминобензил)амино-, N-(2-, 3- или 4-диметиламинобензил)-N-(2-, 3-
или 4-диметиламинобензил)амино-, N-бензил-N-фенилэтиламино-, N-бензил-N-(1-фенилэтил)амино-, N-бензил-N-(1-метил-1-фенилэтил)амино-, N,N-дифенилэтиламино-, N, N-бис-(1-фенилэтил)амино-, N-бензил-N-(3-фенилпропил)амино-, (2-, или 3-фурилметил)амино-, (2- или 3-тиенилметил)амино-, (2-, 3- или 4-пиридилметил)амино-, (2- или 5-метил-2- или 3-фурилметил)амино-, (2- или 5-метил-2- или 3-тиенилметил)амино-, [2-(2- или 3-фурил)этил]амино-, [2-(2- или 3-тиенил)-этил]амино-, [2-(2- или 3-фурил)пропил]амино-, [3-(2- или 3-тиенил)пропил] амино-, [бис-(2- или 3-фурил)метил]амино-, [1,1-бис-(2- или 3-фурил)этил]амино-, [1,1-бис-(2- или 3-тиенил)этил]амино-, [(2- или 5-метил-2 или 3-фурилметил), (2- или 5-метил-2- или 3-фурилметил)]амино, [(2- или 5-метил-2- или 3-тиенилметил), (2- или 3-метил-2- или 3-тиенилметил]амино-, [1-(2- или 3-фурил)-1-метилэтил]амино-, [1-(2- или 3-тиенил)метилэтил]амино-, [1-(2- или 5-метил-2- или 3-тиенил)-1-метилэтил]амино-, [1-(2- или 3-фурил)-2-(2- или 3-фурил)этил]амино-, [1-(2- или 5-метил-2- или 3-фурил)-1-метилэтил] амино-, [1-(2- или 3-тиенил)-2-(2- или 3-тиенил)этил]амино-, [1-(2- или 3-фурил)-2-фенилэтил] амино-, [1-(2- или 3-фурил)-2-(2-, 3- или 4-метил-фенил)этил] амино-, [2-фенил-1-(2- или 3-тиенил)этил]амино-, [1-фенил-2-(2-
или 3-тиенил)этил]амино-, [2-(2-, 3- или 4-метилфенил)-1-(2- или 3-тиенил)этил]амино-, [2-(2-, 3- или 4-хлорфенил)-1-(2- или 3-тиенил)этил]амино-, [2-(2-, 3- или 4-фторфенил)-1-(2- или 3-тиенил)этил]амино-, [2-(2-, 3- или 4-метоксифенил)-1-(2- или 3-тиенил)этил]амино-, N-(2- или 3-фурилметил)-N-(2- или 3-фурилметил)амино-, N-(2- или 3-тиенилметил)-N-(2- или 3-тиенилметил)амино-, 1-(2-, 3- или 4-фторфенил)-2-(2- или 3-тиенил)этил амино-, N-бензил-N-(2- или 3-фурилметил)амино-, N-бензил-N-(2- или 3-тиенилметил)амино-, (2-гидрокси-1,2-дифенилэтил)амино-, N'N'-дифенил-гидразино-, N'-(2-, 3- или 4-метилфенил)-N'-фенил-гидразино, N'-(2-, 3- или 4-метоксифенил)-N'-фенилгидразино, N'-(2-, 3- или 4-хлорфенил)-N'-фенилгидразино, N'-(2-, 3- или 4-фторфенил)-N'-фенилгидразино, N'-(2-, 3- или 4-гидроксифенил)-N'-фенилгидразино, N'-(2-, 3- или 4-аминофенил)-N'-фенилгидразино, N'-(2-, 3- или 4-диметиламинофенил)-N'-фенилгидразино, N'-(2-, 3- или 4-ацетомидофенил)-N'-фенилгидразино, N'-(2-, 3- или 4-метилфенил)-N'-(2-, 3- или 4-метилфенил)гидразино- и N'-(2-, 3- или 4-метоксифенил)-N'-(2-, 3- или 4-метоксифенил)гидразиногруппы.
Более предпочтительные группы формулы -NR1R2 включают: (1-метил-1-фенилэтил)амино-, [1-метил-1-(2-, 3- или 4-метилфенил)-этил]амино-, [1-метил-1-(2-, 3- или 4-метоксифенил)-этил]амино-, [1-метил-1-(2-, 3- или 4-фторфенил)-этил]амино-, [1-метил-1-(2-, 3- или 4-хлорфенил)-этил]амино-, [1-метил-1-(2-, 3- или 4-гидроксифенил)-этил]амино-, [1-метил-1-(2-, 3- или 4-аминофенил)-этил] амино-, [1-метил-1-(2-, 3- или 4-диметиламинофенил)-этил] амино-, [1-метил-1-(2-, 3- или 4-ацетамидфенил)-этил]амино-, [1-метил-1-(2,3-, 2,4-, 2,5-, 2,6-, 3,4-, 3,5-, или 3,6-диметоксифенил)этил]амино-, (1,1-диметил-2-фенилэтил)амино-, бензгидриламино-, этил)амино-, бензгидриламино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-) диметилбензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)диметоксибензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)- дифторбензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)- дигидроксибензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)- диаминобензгидрил] амино-, 3(2-, 3- или 4-), (2'-, 3'- или 4'-) ди-(диметиламино)бензгидрил/амино-, (2-, 3- или 4-метилбензгидрил)амино-, (2-, 3- или 4-метоксибензгидрил)амино-, (2-, 3- или 4-фторбензгидрил)амино-, (2-, 3-
или 4-хлорбензгидрил)амино-, (2-, 3- или 4-гидроксибензгидрил)амино-, (2-, 3- или 4-аминобензгидрил)амино-, (2-, 3- или 4- диметиламинобензгидрил)амино-, (1,1-дифенилэтил)амино-, (1,2-дифенилэтил)амино-, [2-(2-, 3- или 4-фторфенил] амино-, [2- (2-, 3- или 4-метоксифенил)-1-фенилэтил]амино-, [1-(2-, 3- или 4- фторфенил)-2-((2-, 3- или 4-фторфенил)этил]амино-, [1-(2-, 3- или 4- хлорфенил)-2-(2-, 3- или 4-хлорфенил)этил]амино-, [1-(2-, 3- или 4- хлорфенил)-2-(2-, 3- или 4-метоксифенил)этил]амино-, [1-(2-, 3- или 4- метилфенил)-2-(2-, 3- или 4-метилфенил)этил]амино-, [1-(2-, 3- или 4- гидроксифенил)-2-(2-, 3- или 4-гидроксифенил)этил]амино-, [1- (2-, 3- или 4-аминофенил)-2-(2-, 3- или 4-аминофенил)этил]амино-, [1-(2-, 3- или 4-диметиламинофенил)-2-(2-, 3- или 4-диметиламинофенил)этил]амино-, [2-(2-, 3- или 4-фторфкнил)-1- (2-, 3- или 4-метилфенил)этил]амино-, [2-(2-, 3- или 4-фторфенил)- 1-(2-, 3- или 4-метоксифенил)этил]амино-, [2-(2-, 3- или 4- гидроксифенил)-1-фенилэтил] амино-, [2-(2-, 3- или 4-аминофенил)-1- фенилэтил]амино-, [2-(2-, 3- или 4-диметиламинофенил)-2-фенилэтил] амино-, (1-метил-1,2-дифенилэтил)амино-, (2,2-дифенилэтил)амино-, (1,1-дифенилэтил)амино-, [1-(2-, 3- или 4- фторфенил)-1-(2-, 3- или 4-фторфенил)этил]амино-, [1-(2-, 3-
или 4- метилфенил)-1-(2-, 3- или 4-метилфенил)этил]амино-, [1-(2-, 3- или 4-метоксифенил)-1-(2-, 3- или 4-метоксифенил)этил] амино-, [1-(2-, 3- или 4-гидроксифенил)-1-фенилэтил] амино-, [1-(2-, 3- или 4-аминофенил)-1-фенилэтил] амино, [1-(2-, 3- или 4- диметиламинофенил)-1-фенилэтил]амино-, тритиламино-, (1-бензил-2-фенилэтил)амино-, (1-бензил-1-метил-2-фенэтил)амино-, N-бензил-N-этиламино-, N-бензил-N-изопропиламино-, N-бензил-N-трет- бутиламино-, N-(2-, 3- или 4-фторбензил)-N-изопропиламино-, N-(2-, 3- или 4-метилбензил)-N-изопропиламино-, N-(2-, 3- или 4- метоксибензил)-N-изопропиламино-, N-(2-, 3- или 4-гидроксибензил)- N-изопропиоамино-, N,N-дибензиламино-, N-(2-, 3- или 4- метоксибензилэамино-, N-(2-, 3- или 4-фторбензил)-N-(2-, 3- или 4- фторбензил)амино-, N-(2-, 3- или 4-метоксибензил)-N-(2-, 3- или 4- метоксибензил)амино-, N-(2-, 3- или 4-метоксибензил)-N-(2-, 3- или 4- метоксибензил)амино-, N-(2-, 3- или 4-гидроксибензил)-N-(2-, 3- или 4- гидроксибензил)амино-, N-(2-, 3- или 4-аминобензил)-N-(2-, 3- или 4- аминобензил)амино-, N-(2-, 3- или 4-диметиламинобензил)- N-(2-, 3- или 4-диметиламинобензил)амино-, [бис((2-или 3-фурил)метил]амино-, [бис((2-или 3-тиено)метил]амино-, 1,1-бис-(2- или 3-диенил)этил]амино-, [(2- или 5-метил-2- или 3-тиенил),
(2- или 5-метил-2-3-тиенил)метил]амино-, [1-(2- или 3-тиенил)метил]амино-, [1-(2- или 3-тиенил)-1-метилэтил] амино-, [1-(2- или 3-фурил)-1-метилэтил] амино-, [1-(2- или 5-метил-2- или 3-фурил)-1-метилэтил]амино-, [1-(2- или 3-фурил)-2-(2- или 3-фурил) этил]амино-, [1-(2- или 3-фурил)-1-метилэтил] амино-, [1-(2- или 3-тиенил)-2-(2- или 3-тиенил)этил]амино-, [1-(2- или 3-фурил)-2- фенилэтил]амино-, [2-фенил-1-(2- или 3-тиенил)этил]амино-, [1-фенил-2-(2- или 3-тиенил)этил]амино-, [2-(2- или 3- или 4-метилфенил)-1-(2- или 3-тиенил)этил] амино-, [2-(2- или 3- или 4-хлорфенил)-1-(2- или 3-тиенил)этил] амино-, [2-(2- или 3- или 4-фторфенил)-1-(2- или 3-тиенил)этил] амино-, [2-(2- или 3- или 4-метоксифенил)-1-(2- или 3-тиенил)этил]амино-, N-(2- или 3-тиенилметил)-N-(2- или 3-тиенилметил)амино-, [1-(2- или 3- или 4-фторфенил)-2-(2- или 3-тиенил)этил]амино-, N',N'-дифенилгидразино, N'0(2-, 3- или 4-метилфенил)-N'-фенилгидразино-, N'-(2-, 3- или 4-метоксифенил)- N'-фенилгидразино-, N'-(2-, 3- или 4-метоксифенил)-N'-фенилгидразино-, N'-(2-, 3- или 4-хлорфенил)-N'-фенилгидразино, N'-(2-, 3- или 4-фторфенил)-N'-фенилгидразино-, N'-(2-, 3- или 4- гидроксифенил)-N'-фенилгидразино-,
N'-(2-, 3- или 4-аминофенил)- N'-фенилгидразино-, N'-(2-, 3- или 4-диметиламинофенил)-N'- фенилгидразино-, N'-(2-, 3- или 4-ацетамидофенил)-N'-фенилгидразино-, N'-(2-, 3- или 4-метилфенил)-N'-(2-, 3- или 4-метилфенил)гидразино-, N'-(2-, 3- или 4-метоксифенил)-N'-(2-, 3- или 4-метоксифенил)- гидразиногруппы.
Еще большее предпочтение отдается следующим группам формулы -NR1R2: (1-метил-1-фенилэтил)амино-, [1-метил-1-(2-, 3- или 4-метилфенил)этил]амино-, [1-метил-1-(2-, 3- или 4-метоксифенил)этил]амино-, [1-метил-1-(3,4- или 3,5-диметоксифенил)этил]амино-, [1-метил-1-(2-, 3- или 4-фторфенил)этил]амино-, [1-метил-1-(2-, 3- или 4-хлорфенил)этил]амино-, [1-метил-1-(2-, 3- или 4-гидроксифенил)этил] амино-, [1-метил-1-(2-, 3- или 4-диметиламинофенил)этил] амино-, [(1,1-диметил-2-фенил)этил/амино-, бензгидриламино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)диметилбензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)диметоксибензгидрил]амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)дифторбензгидрил] амино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)дихлорбензгидрил] амино-, (2-, 3- или 4-метилбензгидрил)амино-, (2-, 3- или 4- метоксибензгидрил)амино-, (2-, 3- или 4-фторбензгидрил)амино-, (2-, 3- или 4-хлорбензгидрил) амино-, (2-, 3- или 4-гидроксибензгидрил)амино-, (1,1-дифенилэтил) амино-, (1,2-дифениэтил)амино-, [2-(2-, 3- или 4-хлорфенил)-1- фенилэтил] амино-, [2-(2-, 3- или 4-фторфенил)-1-фенилэтил]амино-, [2-(2-, 3- или 4-метлфенил)-1-фенилэтил]амино-, [2-(2-, 3- или 4-метоксифенил)-1-фенилэтил] амино-, N,N-дибензиламино-, N-(2-, 3- или 4-фторфенил)-N-(2'-, 3- или 4-фторбензил)амино-, N-(2-, 3- или 4-метилбензил)-N-(2-, 3- или 4-метилбензил)амино-, N-(2-, 3- или 4-метоксибензил)-N-(2-, 3- или 4-метоксибензил)амино-, [1-(2- или 3-тиенил)-1-(2- или 3-тиенил)-метил]амино-, [2-фенил-1-(2- или 2-тиенил)этил]амино-, [1-метил-1-(2- или 3-тиенил)этил]амино-, [1-метил-1-(2- или 5-метил-2- или 3-тиенил)этил]амино-, [1-метил-1-(2- или 3-фурилэтил]амино-, [1-метил-1-(2- или 5-метил-2-фурил)этил]амино-, N', N'-дифенилгидразино-, N'-(2-, 3- или 4-метоксифенил)-N'-фенилгидразино-, N'-(2-, 3- или 4-фторфенил)-N'-фенилгидразино-, N'-(2-, 3- или 4-метоксифенил)- N'-(2-, 3- или 4-метоксифенил)гидразиногруппа.
Наиболее предпочитаемыми группами формулы -NR1R2 являются следующие: (1-метил-1фенилэтил)амино-, [1-метил-1-(2-, 3- или 4-метилфенил)этил]амино-, [1-метил-1-(2-, 3- или 4-метоксифеил)-этил] амино-, [1-метил-1-(3,4 или 3,5-диметилфенил)этил] амино-, [1-метил-1-(2-, 3- или 4-фторфенил)этил]амино-, [1-метил-1-(2-, 3- или 4-хлорфенил)этил]амино-, [1-метил-1-(2-, 3- или 4-гидроксифенил)этил] амино-, [1-метил-1-(2-, 3- или 4-диметиламинофенил)-этил] амино-, (1,1-диметил-2-фенилэтил)амино-, бензгидроамино-, [(2-, 3- или 4-), (2'-, 3'- или 4'-)диметилбензгидрил]амино-, [(2-, 3- или 4-),(2'-, 3'-, или 4'-)диметоксибензгидрил] амино-, [(2-, 3- или 4-),(2'-, 3'-, или 4'-)дифторбензгидрил]амино-, [(2-, 3- или 4-),(2'-, 3'- или 4'-)дихлорбензгидрил] амино-, (2-, 3- или 4-метилбензгидрил)амино-, (2-, 3- или 4-метоксибензгидрил)амино-, (2-, 3- или 4-гидроксибензгидрил)амино-, (1,1-дифенилэтил)амино-, [1-метил-1-(2- или 3-тиенил)этил]амино-, [1-метил-1-(2- или 5-метил-2- или 3-тиенил)этил] амино-, [1-метил-1-(2- или 3-фурилэтил] амино-, [1-метил-1-(2- или 5-метил-2- или 3-фурил)этил]аминогруппы.
В зависимости от природы замещающей группы соединения по настоящему изобретению могут содержать один или более асимметрический атом углерода в своих молекулах и в этом случае они могут образовывать оптические изомеры. Несмотря на то, что в настоящем описании все эти изомеры представлены одной молекулярной формулой, настоящее изобретение включает как индивидуальные изолированные изомеры, так и их смеси, включая рацематы. В тех случаях, когда применяются методы стереоспецифического синтеза или в качестве исходных материалов используют оптически активные соединения, можно приготовить непосредственно отдельные изомеры; с другой стороны, если приготовлена смесь изомеров, то отдельные изомеры можно получить с применением обычных способов разделения.
Предпочтительными классами соединений по настоящему изобретению являются те соединения формулы (I) и соли, эфиры и другие функциональные производные этих соединений, в которых:
(A) R1 представляет собой: атом водорода; алкильную группу, имеющую 3 атома углерода; бензильную группу; замещенную бензильную группу, имеющую по меньшей мере одну замещающую группу, выбираемую из группы, в которую входят алкильные группы, имеющие от 1 до 4 атомов углерода, алкоксильные группы, имеющие от 1 до 4 атомов углерода, атомы галогена, аминогруппы, алкиламиногруппы, имеющие от 1 до 4 атомов углерода, диалкиламиногруппы, в которых каждый алкильный фрагмент имеет от 1 до 4 атомов углерода, гидроксильные группы, алкоксикарбонильные группы, имеющие от 2 до 5 атомов углерода и алифатические ациламиногруппы, имеющие от 1 до 5 атомов углерода; фурилметильную группу; или тиенилметильную группу;
(B) R2 представляет собой: замещенную алкильную группу, имеющую от 1 до 4 атомов углерода и замещенную с одной или двумя замещающими группами, выбираемыми из группы, в которую входят фенильные группы, замещенные фенильные группы, тиенильные группы, фурильные группы, замещенные фурильные группы и замещенные тиенильные группы, в которых группа или группы, замещающие фенильную группу, выбирают из группы, в которую входят:
алкильные группы, имеющие от 1 до 4 атомов углерода, алкоксильные группы, имеющие от 1 до 4 атомов углерода, атомы галогенов, гидроксильные группы, аминогруппы, алкиламиногруппы, имеющие от 1 до 4 атомов углерода, диалкиламиногруппы, в которых каждый алкильный фрагмент имеет от 1 до 4 атомов углерода, алкоксикарбонильные группы, имеющие от 2 до 5 атомов углерода, и алифатические ациламиногруппы, имеющие от 1 до 5 атомов углерода;
а также группу или группы, замещающие тиенильную или фурильную группы, которые выбирают из группы, в которую входят алкильные группы, имеющие от 1 до 4 атомов углерода;
или диариламиногруппу, в которой каждый арильный фрагмент представляет собой карбоциклическую ароматическую группу, имеющую от 6 до 10 атомов углерода в кольце и которая может быть незамещенной или замещенной по меньшей мере одной замещающей группой, выбираемой из группы, в которую входят: алкильные группы, имеющие от 1 до 4 атомов углерода, алкоксильные группы, имеющие от 1 до 4 атомов углерода, атомы галогенов, гидроксильные группы, аминогруппа, алкиламиногруппы, имеющие от 1 до 4 атомов углерода, диалкиламиногруппы, в которых каждый алкильный фрагмент имеет от 1 до 4 атомов углерода, алкоксикарбонильные группы, имеющие от 2 до 5 атомов углерода и алифатические ациламиногруппы, имеющие от 1 до 5 атомов углерода;
(C) R3 представляет собой: карбоксильную группу; алкоксикарбонильную группу, имеющую от 2 до 5 атомов углерода; бензилоксикарбонильную группу; бензилоксикарбонильную группу, замещенную по меньшей мере одной замещающей группой, выбираемой из группы, в которую входят метильная, этильная, метоксильная и этоксильная группа и атомы фтора и хлора; нафтилметоксикарбонильную группу; дифенилметоксикарбонильную группу; алканоилоксиалкоксикарбонильную группу, в которой алканоильный фрагмент имеет от 1 до 5 атомов углерода, а алкоксильный фрагмент имеет от 1 до 4 атомов углерода; циклоалканкарбонилоксиалкоксикарбинильную группу, в которой циклоалкан имеет от 5 до 7 атомов углерода, а алкоксильный фрагмент имеет от 1 до 4 атомов углерода; алкоксикарбонилоксиалкоксикарбонильную группу, в которой каждый алкоксильный фрагмент имеет от 1 до 4 атомов углерода; циклоалкилоксикарбонилоксиалкоксикарбонильную группу, в которой циклоалкильный фрагмент имеет от 5 до 7 атомов углерода, а алкоксильный фрагмент имеет от 1 до 4 атомов углерода; (5-фенил- или 5-алкил-2-оксо-1,3-диоксилен-4-ил)-метоксикарбонильную группу, в которой алкильный фрагмент имеет от 1 до 4 атомов углерода; фталидилоксикарбонильную группу; или группу формулы -CONHSO2R4, где R4 представляет собой алкильную группу, имеющую от 1 до 4 атомов углерода.
Более предпочтительными соединениями по настоящему изобретению является такие соединения формулы (I), а также соли, сложные эфиры и другие функциональные производные этих соединений, в которых:
(D)R представляет собой: атом водорода; изопропильную группу; бензильную группу; замещенную бензильную группу, имеющую по меньшей мере одну замещающую группу, выбираемую из группы, в которую входят метильная, этильная, метоксильная, этоксильная, гидроксильная, этоксикарбонильная, метоксикарбонильная, аминогруппа, метиламино-, этиламино-, диметиламино-, диэтиламино-, формамидо- и ацетамидогруппы, а также атомы фтора хлора и брома; тиенилметильную группу;
(E)R2 представляет собой: замещенную алкильную группу, имеющую от 1 до 4 атомов углерода и имеющую одну или две замещающие группы, выбираемые из группы, в которую входят фенильные группы; замещенные фенильные группы, имеющие по меньшей мере одну замещающую группу, выбираемую из группы, в которую входят метильная, этильная, метоксильная, этоксильная, гидроксильная, метоксикарбонильная, этоксикарбонильная, амино-, метиламино-, этиламино-, диметиламино-, формамидо- и ацетамидогруппы, а также атомы фтора, хлора и брома; фурильные группы; метилзамещенные фурильные группы; тиенильные группы, а также метилзамещенные тиенильные группы; дифениламиногруппу; или замещенную дифениламиногруппу, имеющую по меньшей мере одну замещенную группу, выбираемую из группы, в которую входят метильная, этильная, метоксильная, этоксильная, гидроксильная, метоксикарбонильная, этоксикарбонильная, амино-, метиламино-, этиламоно-, диметиламино-, диэтиламино-, формамидо-, а также ацетамидогруппы, а также атомы фтора, хлора и брома;
(F) R3 представляет собой: карбоксильную группу; алкоксикарбонильную группу, имеющую от 2 до 5 атомов углерода; бензилоксикарбонильную группу; алканоилоксикарбонильную группу, в которой алканоильный фрагмент имеет от 1 до 5 атомов углерода, а алкоксильный фрагмент имеет 1 или 2 атома углерода; циклоалканкарбонилоксиалкоксикарбонильную группу, в которой циклоалкан имеет от 5 до 7 атомов углерода, а алкоксильный фрагмент имеет 1 или 2 атома углерода; метоксикарбонильную или этоксикарбонильную группу, которая замещена алкоксикарбонилоксильной группой, имеющей от 2 до 5 атомов углерода; циклоалкилоксикарбонилоксиалкоксикарбонильную группу, в которой циклоалкильный фрагмент имеет от 5 до 7 атомов углерода, а алкоксильный фрагмент имеет 1 или 2 атома углерода; (5-фенил-, 5-метил- или 5-этил-2-оксо-1,3-диоксолен-4-ил)-метоксикарбонильную группу; фталидилоксикарбонильную группу; или группу формулы -CONHSO2R4, где R4 представляет собой метильную или этильную группу.
Еще более предпочтительными соединениями по настоящему изобретению являются те соединения формулы (I) и соли, сложные эфиры и другие функциональные производные этих соединений, в которых:
(G) R1 и R2 независимо друг от друга выбирают из группы, в которую входят бензильные группы и замещенные бензильные группы, имеющие по меньшей мере одну замещенную группу, выбираемую из группы, в которую входят метильная, метоксильная, гидроксильная и ацетамидогруппы, а также атомы фтора и хлора; или
(H) R1 представляет собой атом водорода, а R2 представляет собой: замещенную алкильную группу; имеющую от 1 до 4 атомов углерода, и имеющую одну или две замещенные группы, выбираемые из группы, в которую входят: фенильные группы; замещенные фенильные группы, имеющие по меньшей мере одну замещающую группу, выбираемую из группы, в которую входят метильная, метоксильная, гидроксильная, диметиамино- и ацетамидо-группы, а также атомы фтора и хлора; фурильные группы и тиенильные группы; дифениламиногруппу; или замещенную дифениламиногруппу, имеющую по меньшей мере одну замещенную группу, выбираемую из группы, в которую входят метильная, метоксильная, гидроксильная, диметиламино- и ацетамидогруппы, а также атомы фтора и хлора.
(I) R3 представляет собой карбоксильную группу, метоксикарбонильную группу, пивалоилоксиметоксикарбонильную группу, этоксикарбонилоксиметоксикарбонильную группу, 1-(этоксикарбонилокси)этоксикарбонильную группу, изопропоксикарбонилоксиметоксикарбонильную группу, 1-(изопропоксикарбонилокси)этоксикарбонильную группу, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонильную группу, фталидилоксикарбонильную группу или группу формулы -CONHSO2R4, где R4 представляет собой метильную группу.
Наиболее предпочтительными соединениями по настоящему изобретению являются те соединения формулы (I), а также соли, сложные эфиры и другие функциональные производные этих соединений, в которых:
(J) R1 представляет собой атом водорода, R2 представляет собой алкильную группу, имеющую от 1 до 3 атомов углерода и замещенную одной или двумя замещающими группами, выбираемыми из группы, в которую входят: замещенные фенильные группы, имеющие по меньшей мере одну замещающую группу, выбираемую из группы, в которую входят метильная, метоксильная и гидроксильная группы, а также атомы фтора и хлора; фурильные группы и тиенильные группы.
(K) R3 представляет собой карбоксильную группу, метоксикарбонильную группу или этоксикарбонильную группу;
(K) R2 представляет собой 2-гидроксиизопропильную группу или 1-карбоксиэтильную группу, имеющую по меньшей мере одну замещающую группу, выбираемую из группы, в которую входят арильные группы, указанные выше, и ароматические гетероциклические группы, указанные выше.
Конкретные примеры соединений по настоящему изобретению включают те соединения формулы (I), в которых R1, R2 и R3 имеют значения, приведенные в таблице 1, в которой использованы следующие сокращения: Ac - ацетил; Bu - бутил; Bz - бензил; Bzh - бензгидрид; Et - этил; Fur - фурил; Me - метил; Mod - (5-метил-2-оксо-1,3-диоксолен-4-ил)метил; Ph - фенил; Phth - фталидил; Piv - пивалоил; Pr - пропил; iPr - изопропил; Thi - тиенил.
Из этих соединений предпочтительными являются соединения N 1, 2, 4, 5, 8, 9, 12, 14, 17, 19, 22, 27, 28, 29, 31, 33, 45, 48, 64, 50, 66, 67, 69, 73, 76, 78, 79, 82, 86, 88, 127, 130, 140, 142, 145, 149, 152, 157, 159, 166, 168, 178, 180, 182, 190, 191, 192, 193, 194, 195, 196, 197, 200 и 201, более предпочтительными являются соединения N 1, 2, 4, 5, 12, 14, 22, 27, 28, 31, 64, 66, 67, 76, 78, 127, 142, 145, 149, 159, 166, 168, 178, 190, 192, 194, 195, 197, 200 и 201.
Наиболее предпочтительными являются соединения N:
1. 17-[N-(1,2-дифенилэтил)карбамоил]андроста-3,5-диен-3- карбоновая кислота;
2. 17-[N-(дифенилметил)карбамоил]андроста-3,5-диен-3- карбоновая кислота;
14. 17-[N-(4,4'-диметоксибензгидрил)карбамоил]андроста-3,5-диен-3- карбоновая кислота;
66. 17-[N-(1-метил-1-фенилэтил)карбамоил]андроста-3,5-диен-3- карбоновая кислота;
67. 17-{ N-[1-метил-1-(2-тиенил)этил] карбамоил} андроста- 3,5-диен-3-карбоновая кислота;
78. 17-{ N-[1-(4-фторфенил)-1-метилэтил]-карбамоил}андроста- 3,5-диен-3-карбоновая кислота;
127. 17бета-[N-(4-гидроксибензгидрил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота;
149. 17-{ N-[1-(3,5-диметоксифенил)-1-метилэтил] карбамоил} андроста- 3,5-диен-3-карбоновая кислота;
159. 17-[N-(дифениламино)карбамоил} андроста-3,5-диен-3- карбоновая кислота;
166. 17-{ N-[1-(3-метоксифенил)-1-метилэтил]карбамоил}андроста- 3,5-диен-3-карбоновая кислота;
168. 17-{ N-[1-(2-метоксифенил)-1-метилэтил]карбамоил}андроста- 3,5-диен-3-карбоновая кислота;
178. 17-[N-(альфа, альфа-диметилфурил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота;
190. 17-{N-[1-(4-N,N-диметиламинофенил)-1-метилэтил]карбамоил}андроста- 3,5-диен-3-карбоновая кислота;
192. 17-{ N-[1-(3,4-диметоксифенил)-1-метилэтил] карбамоил} андроста- 3,5-диен-3-карбоновая кислота;
194. 17-{ N-[1-(4-этоксифенил)-1-метилэтил] карбамоил}андроста- 3,5-диен-3-карбоновая кислота; а также
200. 17-{ N-[1-метил(3,4,5-триметоксифенил)этил] карбамоил} -андроста- 3,5-диен-3-карбоновая кислота;
и фармацевтически приемлемые соли и сложные эфиры этих соединений.
Соединения по настоящему изобретению могут быть приготовлены различными известными способами, используемыми для приготовления известных соединений этого типа. Например, в общем, они могут быть приготовлены путем гидролиза соединения формулы (VI)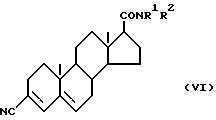 ,
,
(где
R1 и R2 имеют вышеуказанные значения) до получения соответствующей карбоновой кислоты формулы (Ia)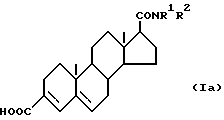 ,
,
(где
R1 и R2 имеют вышеуказанные значения), затем, если необходимо, карбоксильную группу в 3 позиции превращают в любую другую группу, выраженную радикалом R3 в соединении формулы (I), а при желании получают соль или сложный эфир соединения формулы (Ia).
Более подробно (начиная с известных или легкодоступных исходных материалов) соединения по настоящему изобретению могут быть приготовлены способом, который иллюстрирует нижеследующая схема реакций A.
В приведенных формулах схемы R1, R2 и R3 имеют вышеуказанные значения; а R5 представляет собой карбоксизащищающую группу, предпочтительно алкильную группу, имеющую от 1 до 6 атомов углерода (примеры подобных групп приведены выше в связи с радикалом R1), или группу формулы - SiRaRbRc (где Ra, Rb и Rc имеют вышеуказанные значения).
На этапе A1 съемы реакций соединение формулы (III) приготавливают следующим образом: соединение формулы (II) взаимодействуют с диалкилцианофосфатом (в котором каждая алкильная группа имеет от 1 до 6 атомов углерода) или с диарилцианофосфатом (в котором арильная группа может представлять собой одну из групп, примеры которых приведены выше при описании замещающих групп радикала R2) в инертном растворителе в присутствии цианида щелочного металла, после чего полученный эфир фосфорной кислоты взаимодействует с кислотой.
Специальных ограничений в отношении типа используемого цианида щелочного металла нет, могут быть использованы любые цианиды щелочных металлов, которые обычно используются в реакциях этого типа. Примеры таких соединений включают: цианид лития, цианид натрия и цианид калия, из которых мы отдает предпочтение цианиду лития.
Точно также нет специальных ограничений относительно природы диалкил- или диарилцианофосфатов, используемых на этом этапе, в числе примеров этих соединений диметилцианофосфат, диэтилцианофосфат, дифенилцианофосфат и дитолилцианофосфат, из которых мы предпочитаем диэтилцианофосфат или дифенилцианофосфат.
Выбор кислоты, применяемой во второй части этого этапа, не играет решающей роли в настоящем изобретении, в числе примеров подходящих кислот льюисовы кислоты, такие как трифторид бора, комплекс трифторид бора - диэтиловый эфир, хлорид аммония, хлорид цинка и тетрахлорид олова, из которых мы предпочитаем трифторид бора или комплекс трифторид бора - диэтиловый эфир.
Реакцию предпочтительно проводят в присутствии растворителя, тип которого не столь важен, при условии, что этот растворитель не оказывает нежелательного действия на реакцию и способен растворять реагенты по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; галоидзамещенные углеводороды, особенно галоидзамещенные алифатические углеводороды, такие как метиленхлорид и хлороформ; из них мы отдаем предпочтение в первой реакции простым эфирам, а во второй - ароматическим углеводородам.
Реакцию можно проводить в широком диапазоне температур, и выбор точной температуры не играет роли для настоящего изобретения. В целом, мы считаем, что удобно проводить первую стадию реакции при температурах от -20 до +50oC, более предпочтительно от 0 до 30oC, более предпочтительно от 0 до 30oC, а вторую стадию реакции лучше проводить при температурах от -50 до +50oC, более предпочтительно, от -20 до 30oC. Время протекания реакции может быть самым различным, в зависимости от многих факторов, в частности от температуры реакции и характера реагентов. Однако в большинстве случаев первую стадию реакции желательно проводить в течение от 5 мин до 5 ч, предпочтительно в течение от 10 мин до 1 ч, а для проведения второй стадии реакции обычно достаточно от 30 мин до 10 ч, желательно от 1 ч до 5 ч.
После завершения каждой из этих реакций искомое соединение может быть извлечено из реакционной смеси одним из обычных способов. Например, один из подходящих способов извлечения искомого соединения состоит в следующем: растворитель удаляют перегонкой при пониженном давлении; к остатку добавляют воду, затем смесь экстрагируют органическим растворителем, не смешивающимся с водой, таким как этилацетат. Экстракт высушивают безводным сульфатом магния, после чего растворитель удаляют перегонкой до получения искомого соединения. При необходимости полученное соединение может подвергаться последующей очистке с применением одного из известных способов, таких как рекристаллизация или различные способы с применением хроматографии, в частности колоночной хроматографии. Однако в соответствующих случаях можно использовать продукт первой и второй стадии реакции в последующих реакциях без какого-либо промежуточного выделения или очистки этого продукта.
Соединение формулы (II) и соединение формулы (II)', которые используют в качестве исходных материалов в схемах реакций A и B соответственно, являются известными или могут быть приготовлены известным способом (например, как описано в "J. Med. Chem.", 27, 1690 (1984); а также в "J. Med. Chem.", 29, 2298 (1986)).
На этапе A2 приготавливают соединение формулы (IV) путем гидролиза соединения формулы (III) с основанием в инертном растворителе.
Нет специальных ограничений относительно природы основания при условии, что оно не оказывает отрицательного действия на другие части молекулы. В числе примеров подходящих оснований: гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; а также карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; из этих соединений мы предпочитаем гидроксиды щелочных металлов.
Реакцию обычно проводят в присутствии инертного растворителя, тип растворителя не столь важен, при условии, что этот растворитель не оказывает неблагоприятного действия на реакцию и способен растворять реагенты (по меньшей мере до некоторой степени). В числе примеров подходящих растворителей: простые эфиры, такие как тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и бетанол; гликоли и гликольэфиры, такие как этиленгликоль, пропиленгликоль и диметиловый эфир этиленгликоля; вода; а также смеси любых двух или более из этих растворителей; из числа указанных растворителей мы предпочитаем спирты.
Реакция проходит при широком диапазоне температур, выбор точной температуры не играет роли для настоящего изобретения. В общем, мы считаем удобным проводить реакцию при температурах от 0 до 150oC, лучше - от 30 до 100oC. Время, необходимое для реакции, может быть различным, в зависимости от многих факторов, в частности, от температуры реакции и типа реагентов. Однако в большинстве случаев для протекания реакции достаточно от 1 до 50 ч, предпочтительно от 3 до 20 ч.
После завершения реакции искомое соединение можно извлечь из реакционной смеси с помощью одного из известных способов. Например, один из таких способов состоит в следующем: растворитель удаляют перегонкой при пониженном давлении; в остаток добавляют водный раствор кислоты, такой как разбавленную соляную кислоту; полученную смесь экстрагируют органическим растворителем, не смешивающимся с водой, таким как хлористый метилен; экстракт высушивают безводным сульфатом магния; растворитель удаляют перегонкой до получения искомого соединения. При необходимости полученное соединение можно подвергнуть дальнейшей очистке с применением одного из обычных способов, таких как рекристаллизация или различные способы с применением хроматографии, в частности колоночной хроматографии.
Этапы A1 и A2 можно проводить в обратном порядке, то есть цианогруппу (этап A1) можно вводить после гидролиза (этап A2) или до него.
На этапе A3 приготавливают соединение формулы (VI) путем взаимодействия соединения формулы (IV) или реакционного производного этого соединения с соединением формулы (V). Эту реакцию можно проводить по одному из известных способов, которые применяются при синтезе пептидов, в числе таких способов ацилгалогенидный способ, азидный способ, способ с применением активного эфира, способ с применением смешанных ангидридов кислоты и способ конденсации.
Ацилгалогенидный способ можно осуществить следующим образом: соединение формулы (IV) взаимодействуют с галогенирующим агентом в инертном растворителе при соответствующей температуре, затем полученное соединение взаимодействуют с амином формулы (V) в соответствии со способом, описанным, например, в патенте Японии N Sho-54-145669 (Европейском патенте N 4949A), которые приведены здесь для сведения.
Вышеуказанный азидный способ может быть осуществлен следующим образом: соединение формулы (IV) или сложный эфир этого соединения взаимодействуют с гидразином в инертном растворителе (например, диметилформамиде) при соответствующей температуре, предпочтительно приблизительно соответствующей комнатной температуре, до получения гидразина аминокислоты, который затем взаимодействует с соединением азотистой кислоты до превращения его в азидное соединение. Это азидное соединение затем взаимодействуют с аминным соединением формулы (V).
Нет каких-либо особых ограничений относительно типа используемого соединения азотистой кислоты, любое такое соединение, обычно используемое в реакциях этого типа, может быть использовано и в данном случае. В числе примеров таких соединений следующие: нитриты щелочных металлов, такие как нитрат натрия; алкилнитриты, такие как изоамилнитрит.
Реакцию гидразида с соединением азотистой кислоты предпочтительно проводить в инертном растворителе, тип которого не столь важен, при условии, что этот растворитель не оказывает нежелательного воздействия на реакцию и способен растворить реагенты (по меньшей мере до некоторой степени). В числе примеров подходящих растворителей следующие: амиды, такие как диметилфомамид и диметилацетамид; сульфоксиды, такие как диметилсульфоксид; пирролидоны, такие как N-метилпирролидон. Следующий этап реакции с амином формулы (V) обычно проводят в одной реакционной смеси. Реакции могут проходить в широком диапазоне температур, точное указание температуры не является важным для настоящего изобретения. В общем, мы считаем удобным проводить реакцию с соединением азотистой кислоты при температурах в пределах от -50 до 0oC, а реакцию с амином формулы (V) при температурах в пределах -10 до +10oC. Время, необходимое для реакции, может быть различным, в зависимости от многих факторов, в частности от температуры реакции и типа реагентов. Однако в большинстве случаев для первого этапа достаточно от 5 мин до 1 ч, а для второго - от 10 до 5 дней.
Способ с применением активного эфира проводят в соответствии со способом, описанным в Заявке на патент Японии N Hei 2-172,999 (Европатент N 478 066A), в Заявке на патент Японии N Hei 4-288,096 (Европатент N 367502A) или в Европатенте N 85 301122, которые упомянуты здесь для сведения, который состоит в следующем: соединение формулы (IV) взаимодействуют с активным этерифицирующим агентом до получения активного эфира, который затем взаимодействует с аминным соединением формулы (V).
Эти две реакции предпочтительно проводят в инертном растворителе, тип которого не столь важен, при условии, что он не оказывает нежелательного воздействия на реакцию и способен растерять реагенты (по меньшей мере до некоторой степени). В числе примеров подходящих растворителей: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, особенно галогенированные алифатические углеводороды, такие как метиленхлорид и хлороформ; эфиры, такие как диэтиловый эфир и тетрагидрофуран; амиды, такие как диметилформамид и диметилацетамид; нитрилы, такие как ацетонитрил; а также амины, такие как пиридин и триэтиламин.
Нет особых ограничений относительно типа активного этерифицирующего агента, примеры подходящих соединений включают: N-гидрокси соединения, такие как N-гидроксисукцинимид, 1-гидроксибензотриазол и N-гидрокси-5-норборнен-2,3-дикарбоксиимид; а также дисульфиды, такие как дипиридилдисульфид. Активная реакция этерификации, предпочтительно, проводится в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид, карбонилдиимидазол или трифенилфосфин.
Реакция протекает при широком диапазоне температур, настоящее изобретение не предполагает выбора точно определенной температуры. В общем, мы считаем удобным проводить реакцию активной этерификации при температурах в пределах от -10 до 100oC, а реакцию между активным эфирным соединением и амином формулы (V) при комнатной температуре. Время, необходимое для протекания реакции, может быть различным, в зависимости от многих факторов, в частности от температуры реакции и типа реагентов. Однако в большинстве случаев для каждой реакции достаточно от 30 мин до 80 ч.
Эти реакции могут проводиться в присутствии диметиламинопиридина.
Способ с применением смешанных ангидридов кислоты осуществляют следующим образом: приготавливают ангидриды соединения формулы (IV), затем смешанные ангидриды взаимодействуют с амином формулы (V).
Реакцию для приготовления смешанных ангидридов кислоты можно проводить следующим образом: соединение формулы (IV) взаимодействуют с агентом, способным образовывать смешанные ангидриды кислоты, например: алкил C1-C6-галоформиат, такой как этилхлорформиат или изобутилхлорформиат; алканоил C2-C5-галид, такой как пивалоилхлорид; диалкил(C1-C6)цианофосфат, такой как диэтилцианофосфат; или диарилцианофосфат, такой как дифенилцианофосфат. Реакцию обычно проводят в присутствии инертного растворителя (например, одного или более вышеприведенных галогенированных углеводородов, амидов и эфиров).
Реакцию, предпочтительно, проводят в присутствии органического амина, такого как триэтиламина или N-метилморфолина.
Реакция протекает при широком диапазоне температур, для настоящего изобретения не требуется выбор конкретной температуры. В общем, мы считаем удобным проводить реакцию при температурах в пределах от -10 до +50oC. Время протекания реакции может быть различным и зависит от многих факторов, в частности от температуры реакции и типа реагентов. Однако в большинстве случаев для протекания реакции достаточно от 30 мин до 20 ч.
Реакцию между полученными смешанными ангидридами кислоты и амином формулы (V) предпочтительно проводят в присутствии инертного растворителя (например, одного или более из вышеуказанных амидов и эфиров) в присутствии органического амина, такого как триэтиламин, N,N-диметиламинопиридин или N-метилморфолин, при подходящей температуре, например при температуре от 0 до 80oC; в течение от 1 до 30 ч.
Эту реакцию можно проводить также следующим образом: соединение формулы (IV), амин формулы (V) и агент для образования смешанных ангидридов кислоты взаимодействуют одновременно.
Способ с применением конденсирующего агента можно осуществит следующим образом: соединение формулы (IV) и амин формулы (V) взаимодействуют непосредственно в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид, карбонилдиимидизол или 1-метил-2-хлоропиридинийиодид/триэтиламин. Эту реакцию проводят также, как реакцию для приготовления активного эфира, которая описана выше.
Соединение формулы (VI) можно получить очень просто и при хорошем выходе продукта, если провести реакцию соединения формулы (IV) с амином формулы (V) в инертном растворителе в присутствии основания и в присутствии сульфонильного соединения формулы:
Rd - SO2X или /Rd - SO2/2O,
где
Rd является C1-C6-алкилом, трифторметилом, камфилом, изоцианогруппой или C6-C10-арилом, который может быть замещенным или может быть замещен C1-C6-алкилами, C1-C6-алкокси или атомом галоида, а X является атомом галоида).
Реакцию обычно и предпочтительно проводят в присутствии растворителя, природа которого не является критической, при условии, что он не оказывает вредного воздействия на реакцию и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие диэтиловый эфир, тетрагидрофуран, диоксан и диметоксиэтан; амиды, такие как диметилформамид, диметилацетамид и гексаметилфосфоротриамид; сульфоксиды, такие как диметилсульфоксид; и галоидированные углеводороды, особенно галоидированные алифатические углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; из них мы предпочитаем галоидированные углеводороды.
Альтернативно, большой избыток жидкого амина, такого как триэтиламин или пиридин, может быть использован также в качестве растворителя и он также может служить в качестве основания.
Не имеется особых ограничений для применяемого основания и любые основания, обычно используемые в реакциях этого типа, могут в равной мере быть применены здесь. Примеры таких соединений включают органические амины, такие как триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, N,N-диметиламинил, N,N-диэтиланилин, пиридин, 4[N,N-диметиламино]пиридин, хинолин, 1,5-диазабицикло[4,3,0] нона-5-ен (ДБН) и 1,8-диазабицикло[5,4,0]ундец-7-ен (ДБУ), из которых мы предпочитаем триэтиламин, N,N-диметиланинил или пиридин. Также возможно использовать два или более из приведенных выше оснований одновременно в этой реакции.
Предпочтительные соединения формулы Rd-SO2X включают метансульфонилхлорид, метансульфонилбромид, этансульфонилхлорид, пропансульфонилхлорид, бензолсульфонилхлорид, толуолсульфонилхлорид, 2,4,6-триметилбензосульфонилхлорид, хлорбензолсульфонилхлорид, бромбензолсульфонилхлорид, метоксибензолсульфонилхлорид, камфаросульфонилхлорид и хлорсульфонилизоцианат, из которых предпочтительными являются метансульфонилхлорид, бензолсульфонилхлорид, толуолсульфонилхлорид и камфаросульфонилхлорид.
Предпочтительные соединения формулы /Rd - SO2/2O включают ангидрид метансульфоновой кислоты, ангидрид трифторметансульфоновой кислоты, ангидрид этансульфоновой кислоты, ангидрид бензолсульфоновой кислоты, ангидрид толуолсульфоновой кислоты, ангидрид хлорбензолсульфоновой кислоты и ангидрид камфаросульфоновой кислоты, из которых предпочтительными являются ангидрид метансульфоновой кислоты, ангидрид трифторметансульфоновой кислоты, ангидрид бензолсульфоновой кислоты и ангидрид толуолсульфоновой кислоты.
Реакция будет проходить в широком интервале температур и точный выбор температуры реакции не является критическим для изобретения. Обычно мы считаем удобным проводить реакцию при температуре от -70 до +50oC, более предпочтительно от -50 до +30oC. Время, требующееся для реакции, может подобным образом широко варьировать в зависимости от многих факторов, например температуры реакции и природы реагентов. Однако в большинстве случае для реакции будет достаточным период времени от 15 мин до 20 ч, более предпочтительно от 30 мин до 10 ч.
Эту реакцию более предпочтительно проводить при растворении соединений формулы (IV) и 1-10 эквивалентов основания в инертном растворителе, а затем добавляют 1-5 эквивалентов амина формулы (V) или в таком порядке, или в обратном порядке для этой смеси.
Соответствующие амидные соединения формулы (VI) также могут быть получены по указанной выше реакции, но при использовании диметилформамидфосфорилоксихлорида или реагента Вильсмейера, такого как хлорметилендиметилиминийхлорид, вместо сульфонильного соединения.
Эту реакцию более предпочтительно проводить при растворении соединения формулы (IV) и 1-5 эквивалентов реагента Вильсмейера в инертном растворителе с последующим добавлением 1-10 эквивалентов основания и 1-5 эквивалентов амина формулы (V) к этой смеси.
На стадии A4 соединение формулы (Ia), которое является соединением формулы (I), в котором R3 является карбоксилом, получают гидролизом соединения формулы (VI). При желании он может быть превращен на стадии A5 в любую другую группу, включенную в определение R3 путем защиты карбоксильной группы, полученной в результате карбоновой кислоты или сульфониламидирования полученной в результате карбоновой кислоты.
Гидролиз на стадии A4 может быть проведен при взаимодействии соединения формулы (VI) с основанием в инертном растворителе. Примеры оснований и инертного растворителя, которые могут быть применены, являются практически такими же, как были использованы на стадии A2 выше; однако предпочтительным инертным растворителем является гликоль
Реакция будет проходить в широком интервале температур и выбор точной температуры реакции не является критическим для изобретения. Обычно мы считаем удобным проводить реакцию при температуре в интервале от 50 до 250oC, более предпочтительно от 100 до 200oC. Время, требующееся для реакции, может подобным образом широко варьировать в зависимости от многих факторов, например температуры реакции и природы реагентов. Однако в большинстве случаев обычно будет достаточным период времени от 3 ч до 50 ч, более предпочтительно от 6 ч до 20 ч.
После завершения реакции целевое соединение может быть выделено из реакционной смеси традиционными методами. Например, одна подходящая процедура извлечения заключается в удалении растворителя отгонкой при пониженном давлении и добавлении водной кислоты, такой как разбавленная соляная кислота, к остатку для его подкисления. Полученную в результате смесь затем можно экстрагировать несмешивающимся с водой органическим растворителем, таким как метиленхлорид. После сушки экстракта над сульфатом магния отгоняют растворитель при пониженном давлении, получают целевое соединение. При необходимости получения в результате соединения могут быть дополнительно очищены традиционными способами, такими как различные хроматографические методики, например хроматографией на колонке.
Если R1 или R2 включают алканоиламиногруппу, они оба могут быть гидролизованы во время этой реакции гидролиза. В этом случае соответствующее аминосоединение может быть превращено в алканоиламидное соединение, при желании, традиционными способами. Эта реакция может быть проведена при взаимодействии соответствующего аминосоединения с алканоилгалоидом (таким, как ацетилхлорид, ацетилбромид, пропионилхлорид, бутирилхлорид и изобутирилхлорид) или со смешанным ангидридом муравьиной кислоты или уксусной кислоты или с ангидридом кислоты (таким, как уксусный ангидрид, пропионовый ангидрид, бутириловый ангидрид и изобутириловый ангидрид). Реакция может быть проведена таким же образом, как описано для реакции смешанного ангидрида кислоты с амином на стадии A3.
Также, если R1 или R2 включают алкоксикарбонильную группу, они обе могут быть гидролизованы с получением соответствующей карбоновой кислоты. При желании она может быть превращена в алкиловый сложный эфир с помощью традиционной реакции этерификации, которая может быть проведена таким же образом, как реакция защиты карбоксила, описанная ниже, где примерно один эквивалент этерефицирующего агента используют и разделяют реакционную смесь для получения целевого соединения.
Реакция защиты карбоксила может быть проведена в присутствии органического или неорганического основания по хорошо известным на данном уровне техники методикам синтетической органической химии. Например, ее обычно и предпочтительно проводят в инертном растворителе, природа которого не является критической, при условии, что он не оказывает вредного воздействия на реакцию и что он растворяет реагенты, по крайней мере, до определенной степени. Примеры подходящих растворителей включают: амиды, такие как N,N-диметилформамид или N,N-диметилацетамид; галоидированные углеводороды, особенно галоидированные алифатические углеводороды, такие как метиленхлорид и простые эфиры, такие как тетрагидрофуран или диоксан. Более предпочтительно проводить реакцию при взаимодействии с солью щелочного металла, такой как натриевая соль или калиевая соль, соответствующей карбоновой кислоты формулы (Ia) соединения формулы (VIII);
R6 - Y, (VIII)
где
R6 является C1-C6-алкилом, C1-C6-галоидалкилом, C1-C6-оксиалкилом, алкоксиалкилом, в котором алкокси и алкильная часть обе имеют от 1 до 6 атомов углерода, алкоксиалкоксилалкильной группой, в которой алкокси и алкильные части все имеют от 1 до 6 атомов углерода, фенацильной группой, алкоксикарбонилалкильной группой, в которой алкокси и алкильные части обе имеют от 1 до 6 атомов углерода, C1-C6-цианоалкильной группой, C1-C6-алкилтиометильной группой, C6-C10-арилтиометильной группой, в которой арильная группа может быть такой, как определена и подвержена примерами выше в отношении арильных групп, которые могут быть заместителями у замещенных алкильных групп, представленных R1; алкилсульфонилалкильной группой, в которой обе алкильные части имеют от 1 до 6 атомов углерода и которые необязательно замещены атомом галоида; арилсульфонилалкильной группой, в которой арильная группа может быть такой, как определено и подтверждено примерами выше в отношении арильной группы, которая может быть заместителем у замещенных алкильных групп, представленных R1, и предпочтительно является незамещенной или является алкилзамещенной арильной группой, а алкильная часть имеет от 1 до 6 атомов углерода; C7-C13-аралкильной группой, C6-C10-арильной группой, например, как определена и подтверждена примерами выше в отношении арильных групп, которые могут быть заместителями на замещенных алкильных группах, представленных R1; группой формулы - SiRaRbRc, где Ra, Rb и Rc имеют указанные ранее значения; алканоилоксиалкильной группой,
в которой алканоильная и алкильная части обе имеют от 1 до 6 атомов углерода; циклоалканкарбонилоксиалкильной группой, в которой циклоалкановая часть имеет от 5 до 7 атомов углерода в цикле, а алкильная часть имеет от 1 до 6 атомов углерода; алкоксикарбонилоксиалкильной группой, в которой алкокси и алкильная части все имеют от 1 до 6 атомов углерода; циклоалкилоксикарбонилоксиалкильной группой, в которой циклоалкильная часть имеет кольцо из 5-7 атомов углерода, а алкильная часть имеет от 1 до 6 атомов углерода; (5-арил- или 5-алкил-2-оксо-1,3-диоксолен-4-ил)метильной группой, в которой арильная часть может быть такой, как определена и подтверждена примерами выше в отношении арильных групп, которые могут быть заместителями на замещенных алкильных группах, представленных R1, а предпочтительно незамещенной или является алкилзамещенной арильной группой, и алкильная часть имеет от 1 до 6 атомов углерода; или фталидильной группой; и Y является атомом галоида (таким, как хлор, бром или иод) или сульфонилоксигруппой (такой, как метансульфонилокси, этансульфонилокси, n-толуолсульфонилокси- или трифторметансульфонилоксигруппой).
Альтернативно, если защищающей карбоксил группой является алкильная группа, реакция защиты может быть проведена путем взаимодействия соответствующей карбоновой кислоты с ди-C1-C6-алкилсульфатом, таким как диметилсульфатом или диэтилсульфатом, или с диазо-C1-C6-алкилом, таким как диазометаном, диазоэтаном или диазопропаном.
Примеры подходящих оснований включают: гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; и органические амины, такие как триэтиламин, N,N-диметиламинопиридин или N-метилморфолин.
Реакция будет проходить в широком интервале температур, и выбор точной температуры реакции не является критическим для изобретения. Обычно мы считаем удобным проводить реакцию при температуре в интервале от -20 до +50oC, более предпочтительно от 0 до 30oC. Время, требующееся для реакции, может подобным образом широко варьировать в зависимости от многих факторов, например температуры реакции и природы реагентов. Однако в большинстве случаев будет достаточным период времени от 30 мин до 5 ч, более предпочтительно от 1 до 3 ч.
После завершения реакции целевое соединение может быть выделено из реакционной смеси традиционными методами. Например, одна подходящая процедура извлечения состоит из удаления растворителя путем отгонки при пониженном давлении, добавления к остатку воды и экстракции полученной в результате смеси несмешивающимся с водой растворителем, таким как этилацетат. Экстракт затем сушат над безводным сульфатом магния, после чего отгоняют растворитель и получают целевое соединение. При необходимости полученные в результате соединения могут быть дополнительно очищены традиционными способами, такими как перекристаллизация или различные хроматографические методики, например хроматография на колонке.
Реакция сульфониламидирования может быть проведена при взаимодействии соответствующей карбоновой кислоты с активным этерифицирующим агентом, чтобы получить активный сложный эфир, а затем проводят взаимодействие этого активного сложного эфира с соединением формулы (IX):
MNHSO2R4,
где
R4 имеет указанные ранее значения, а M является щелочным металлом, таким как натрий или калий.
Реакция получения активного сложного эфира может быть проведена таким же образом, как описано для соответствующей реакции на стадии A3 выше. Соединение формулы (IX) может быть получено традиционными способами, например при взаимодействии соответствующего сульфонамида с алкоксидом щелочного металла, таким как метоксид натрия, этоксид натрия или трет-бутоксид калия, при подходящей температуре, например при комнатной температуре, в течение соответствующего период времени, например от 10 мин до 3 ч., обычно в инертном растворителе, таком как один из тех, что предложены здесь далее для реакции между активным сложным эфиром и соединением формулы (IX).
Реакцию между активным эфиром и соединением формулы (IX) можно проводить при взаимодействии этих соединений в инертном растворителе, природа которого не является критической для настоящего изобретения, при условии, что он не оказывает вредного воздействия на реакцию и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: амиды, такие как N,N-диметилформамид, N,N-диметилацетамид или гексаметилфосфоротриамид; сульфоксиды, такие как диметилсульфоксид, простые эфиры, такие как тетрагидрофуран и диоксан.
Реакция будет проходить в широком интервале температур и точной выбор температуры реакции не является критическим для настоящего изобретения. Обычно мы считаем удобным проводить реакцию при температуре в интервале от -20 до 100oC, более предпочтительно от 0 до 50 oC. Время, требующее для реакции, подобным образом может широко варьировать в зависимости от многих факторов, например, температуры реакции и природы реагентов. Однако в большинстве случаев будет достаточным период времени от 5 мин до 10 ч., более предпочтительно от 10 мин до 3 ч.
После завершения реакции целевое соединение может быть выделено из реакционной смеси традиционными методами. Например, одна подходящая процедура извлечения заключается в удалении растворителя отгонкой при пониженном давлении, добавлении воды к остатку и экстракции полученной в результате смеси несмешивающимся с водой растворителем, таким как этилацетат. Затем экстракт сушат над безводным сульфатом магния, растворитель отгоняют, получают целевое соединение. При необходимости полученные в результате соединения смогут быть дополнительно очищены обычными способами, такими как перекристаллизация или различные хроматографические методики, например, хроматография на колонке.
Соединения, в которых R2 является алкилом, имеющим гидроксильный или карбоксильный заместители в дополнение к арильному или ароматическому заместителю, могут быть получены по тем же процедурам, как описано в приведенных выше стадиях, но при использовании соответствующего аминного соединения формулы (V) в стадии A3; такие соединения также могут быть получены путем окисления in vivo в результате нормального метаболизма млекопитающих.
Альтернативный способ получения соединения формулы (VI), полученного как описано выше на стадии A3, показан в реакционной схеме B:
В приведенных выше формулах R1 и R2 имеют указанные ранее значения.
На стадии B1 соединение формулы (VII) получают при взаимодействии соединения формулы (II') с аминным соединением формулы (V). Эта реакция по существу является такой же, какой она может быть проведена с использованием тех же реагентов и условий реакции, как на стадии A3 в реакционной схеме A.
На стадии B2 соединение формулы (VI) получают при цианировании соединения формулы (VII). Эта реакция является такой же и может быть проведена с использованием тех же реагентов и условий реакции, как стадия A1 в реакционной схеме A.
Соединение (VI') формулы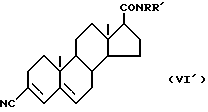 ,
,
(где
R и R' могут быть одинаковыми или различными друг от друга и каждый представляет собой атом водорода или C1-C6-алкил, такой, как те, что описаны и подтверждены примерами выше в отношении R1) может быть получено при взаимодействии соединения (II') с соединением формулы (V'):
NHRR',
(где
R и R' имеют указанные ранее значения), как описано в стадии B1 и в стадии B2 реакционной схемы B. Это соединение формулы (VI') может быть превращено путем гидролиза в соединении формулы (X)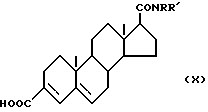 ,
,
(где
R и R' имеют значения, указанные ранее). Следовательно, соединение формулы (VI') является хорошим промежуточным продуктом для получения соединения формулы (X). Эта реакция по существу является такой же, как и реакция стадии A4 в реакционной схеме A, и может быть проведена с использованием тех же реагентов и условий реакции.
Предпочтительными соединениями формулы (VI') являются те, у которых R является атомом водорода и R' является C1-C4-алкилом, или у которых R и R' являются одинаковыми или отличными друг от друга и каждый является C1-C4-алкилом, а более предпочтительные соединения являются теми, у которых R является атомом водорода, а R' является трет-бутильной группой, или R и R' являются одинаковыми и каждый является этилом или изопропилом.
Соединения (VI) и (VI') являются новыми соединениями, полезными в качестве промежуточных продуктов при получении соединений (I) и других активных соединений этого типа, и, следовательно, также составляют часть настоящего изобретения.
Аминосоединения формулы (V), используемые в качестве исходного материала в различных приведенных выше реакциях, являются известными соединениями или могут быть получены известными способами (например, Synthesis, 593 /1976/; J. Org, Chem., 36, 305 /1971/; Angew. Chem., 82, 138 /1970/; Synthetic, 24 /1978/; Sinthetic Commun. , 18, 777 /1988/; Synthetic Commun., 18, 783 /1988/; Organic Reaction, 3, 337 /1946/; Org. Synthesis, 51, 48 /1971/; Tetrahedron, 30, 2151 /1974/; J. Org. Chem., 37, 188 /1972/).
Аминосоединение формулы (V), в которой R2 является алкилом, имеющим гидроксильный или карбоксильный заместители в дополнение к арильному или ароматическому гетероциклическому заместителю, может быть получено традиционными методами, хорошо известными на данном уровне техники.
Например, некоторые аминосоединения формулы (V) могут быть получены, как показано на схемах C, D и E.
В формулах этих схем R6 и R7 являются одинаковыми или различными и могут быть любой из арильных групп, определенных и подтвержденных примерами выше в отношении R2; R8 является аклилом, имеющим 1-6 атомов углерода, как определено и подтвеждено примерами выше в отношении R1; и R9 является сложноэфирным остатком, например как описано выше в отношении защищающих групп для R3, но предпочтительно алкилом.
Реакция в реакционной схеме C может быть проведена с использованием трихлорида титана по способу, описанному в Synthetic Communication, 18, с. 777, 1988 г.
Реакции в реакционной схеме D включают реакцию Гриньяра, азидирование гидроксильной группы в полученном в результате соединении (XV) и восстановление, в таком порядке, в соответствии со способом, описанным в Synthesis с. 24, 1978 г.
Реакции в реакционной схеме E включают реакцию генерации активного карбоната, реакции образования азида кислоты, реакцию образования изоцианата и гидролиз изоцианата, в таком порядке, в соответствии со способом, описанным в Journal of Organic Chemistry 45, с. 415, 1980 г.
Другой альтернативный способ получения соединений формулы (I) из соединений формулы (VI) показан на реакционной схеме F.
В приведенных на схеме формулах R1, R2 и R3 имеют указанные ранее значения.
На стадии F1 соединение формулы (XXII) получают восстановлением цианогруппы соединения формулы (VI), чтобы получить альдегидную группу.
Не имеется особых ограничений для природы применяемого восстанавливающего агента и любой восстанавливающий агент, обычно используемый в реакциях этого типа, может быть в равной мере применен здесь. Примеры таких восстанавливающих агентов включают восстанавливающие агенты типа органического гидрида алюминия, такие как ди(изобутил)алюминийгидрид и ди(метоксиэтокси)алюминийнатрийдигидрид.
Реакцию предпочтительно проводят в присутствии растворителя, природа которого не является критической, при условии, что он не оказывает вредного влияния на реакцию и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диметоксиэтан, диметиловый эфир диэтиленгликоля и диоксан; галоидированные углеводороды, особенно галоидированные алифатические углеводороды, такие как метиленхлорид, четыреххлористый углерод, дихлорэтан и хлороформ; и амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфоротриамид.
Реакция может быть проведена в широком интервале температур, и выбор точной температуры реакции нее является критическим для настоящего изобретения. Обычно мы считаем удобным проводить реакцию при температуре от -100 до +30oC, более предпочтительно от -10 до +20oC. Время, требующееся для реакции, подобным образом может широко варьировать в зависимости от многих факторов, например температуры реакции, исходных материалов, примененного растворителя и природы реагентов. Однако в большинстве случаев период времени от 30 мин до 10 ч, более предпочтительно от 1 ч до 5 ч будет достаточным.
После окончания реакции целевое соединение (XXII) может быть выделено из реакционной смеси традиционными способами. Например, одна подходящая процедура извлечения состоит из добавления воды для гидролиза, если нужно, регулирования pH смеси до величины в интервале от кислого до нейтрального; если образуется осадок, осадок удаляют фильтрованием; к остатку добавляют воду и экстрагируют смесь несмешивающимся с водой органическим растворителем; добавления воды к остатку и экстракции смеси несмешивающимся с водой органическим растворителем, таким как этилацетат. Затем экстракт сушат над безводным сульфатом магния, после чего удаляют растворитель отгонкой, получают целевое соединение. При необходимости полученные в результате соединения могут быть дополнительно очищены традиционными способами, такими как кристаллизация или различные хроматографические методики, например хроматография на колонке.
На стадии F2 соединение формулы (I), которое является соединением настоящего изобретения, получают путем окисления альдегидной группы соединения формулы (XXII) в карбоксильную группу, с последующей защитой или сульфониламидированием полученной карбоксильной группы по той же методике, что описана в стадии A4 в реакционной схеме A.
Не имеется особых ограничений для природы использованного окисляющего агента и любой окисляющий агент, обычно применяемый в реакциях окисления для превращения альдегидной группы в карбоксильную группу, в равной мере может использован здесь. Примеры таких соединений включают: неорганические металлические окисляющие агенты, например оксиды марганца (такие, как перманганат калия или диоксид марганца), оксиды рутения (такие, как тетраоксид рутения), соединения селена (такие, как диоксид селена), соединения железа (такие как хлорид железа), соединения осмия (такие, как тетраоксид осмия), соединения серебра (такие, как оксид серебра), соединения хромовой кислоты ( такие, как хромат калия, комплекс хромовый ангидрид - серная кислота или комплекс хромовый ангидрид - пиридин) и соединения церия (такие, как церий аммоний нитрат (ЦАН)); и неорганические окисляющие материалы, например молекулы галогена (такие, как молекулы хлора, молекулы брома и молекулы иода), периодные кислоты (такие, как периодат натрия), озон, водный пероксид водорода, соединения азотистой кислоты (такие, как азотистая кислота), хлористые соединения ( такие, как хлорид калия и хлорит натрия) и соединения надсерной кислоты (такие, как персульфат калия и персульфат натрия). Разумеется, более предпочтительными являются соединения хромовой кислоты (такие, как хромат калия, комплекс хромовый ангидрид - серная кислота и комплекс хромовый ангидрид - пиридин), соединения церия (такие, как церий аммоний нитрат (ЦАН)), хлористые соединения (такие как хлорит калия и хлорит натрия) и соединения серебра (такие, как оксид серебра).
Реакцию обычно и предпочтительно проводят в присутствии растворителя, природа которого не является критической, при условии, что он не оказывает вредного воздействия на реакцию и что он растворяет реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включает: ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие, как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диметоксиэтан, диметиловый эфир диэтиленгликоля и диоксан; галоидированные углеводороды, такие как метиленхлорид, тетрахлоруглерод, дихлорэтан и хлороформ; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфототриамид; сульфоксиды, такие как диметилсульфоксид; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол и изоамиловый спирт; разбавленные водные кислоты, такие как водная серная кислота; водные основания, такие как водные гидроксид натрия; вода; кетоны, такие как пиридин, и нитрилы, такие как ацетонитрил.
Реакция будет происходить в широком интервале температур и выбор точной температуры реакции не является критическим. Обычно мы считаем удобным проводить реакцию при температуре от -10 до +30oC, более предпочтительно от 0o до примерно комнатной температуры. Время, требующееся для реакции, также подобным образом широко можно варьировать в зависимости от многих факторов, например температуры реакции, исходных материалов, применяемого растворителя и природы реагентов. Однако в большинстве случаев будет достаточным период времени от 10 мин до 10 ч, более предпочтительно от 30 мин до 5 ч.
В упомянутой выше реакции окисления процесс может быть ускорен при добавлении катализатора межфазного переноса, такого как триэтилбензиламмонийхлорид или трибутилбензиламмонийбромид, к реакционной смеси.
После окончания реакции целевое соединение формулы (I) может быть выделено из реакционной смеси традиционными способами. Например, одна подходящая процедура заключается с регулировании при необходимости pH смеси до величины в интервале от кислой до нейтральной, при осаждении удаляют осадок фильтрованием, к остатку добавляют воду и экстрагируют смесь несмешивающимся с водой органическим растворителем, таким как этилацетат. Экстракт затем сушат над безводным сульфатом магния, после чего удаляют растворитель отгонкой, получают целевое соединение. При необходимости полученные в результате соединения могут быть дополнительно очищены традиционными способами, такими как перекристаллизация или различные хроматографические методики, например, хроматография на колонке.
Еще один альтернативный способ получения соединения настоящего изобретения (I) из соединения (VII) показан на реакционной схеме G.
В приведенных на схеме формулах R1, R2, R3 и Y имеют указанные ранее значения, а R5' является алкилом, содержащим 1 - 10, предпочтительно 1 - 6 атомов углерода, которые могут быть такими, как определено в отношении R5, или циклоалкилом, имеющим 5 - 7 атомов углерода.
На стадии G1 соединение формулы (XXIII) получают при замене карбоксильной группы соединения формулы (VII) отщепляющейся группой Y в присутствии основания.
Не имеется особых ограничений относительно природы реагентов, используемых для введения группы Y и здесь может быть использован любой реагент, обычно используемый в реакциях этого типа. Примеры таких соединений включают: трифторметансульфонилирующие агенты, такие как ангидрид трифторметалсульфоновой кислоты, и N,N-ди(трифторметансульфонил)анилид; тригалоиды фосфора, такие как трихлорид фосфора, трибромид фосфора и трииодил фосфора; пентагалоиды фосфора, такие как пятихлористый фосфор, пятибромистый фосфор и пятииодистый фосфор; органические ацилгалоиды, такие как оксалилхлорид; и оксигалоиды фосфора, такие как оксихлорид фосфора, оксибромид фосфора и оксииодид фосфора. Из них мы предпочитаем трифторметансульфонилирующие агенты.
Не имеется особых ограничений по природе используемого основания и здесь могут быть в равной мере применены любые основания, обычно используемые в реакциях этого типа. Примеры таких соединений включают: органические амины, такие как триэтиламин, трипропиламины, трибутиламин, диизопропилэтиламин, N, N-диметиланилин, N,N-диэтиланилин, пиридин, N-метилморфолин, 2,6-ди-(трет-бутил), 4-метилпиридин, 4-(N,N-диметиламино)пиридин, хинолин, 1,5-диазобицикло(4,3,0)нона-5-ен (ДБН) и 1,5-диазабицикло-(5,4,0)ундец-7-ен (ДБУ), и металлоорганические основания, такие как бутиллитий, диизопропиламид лития и бис(триметилсилил)амид лития.
Реакцию предпочтительно проводить в присутствии растворителя, природа которого не является критической, при условии, что он не оказывает вредного воздействия на реакцию и может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диметоксиэтан, диметиловый эфир диэтиленгликоля и диоксан; галоидированные углеводороды, особенно галоидированные алифатические углеводороды, такие как метиленхлорид, четыреххлористый углерод, дихлорэтан и хлороформ; и амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфоротриамид.
Реакция может проходить в широком интервале температур и точный выбор температуры не является критическим для настоящего изобретения. Обычно мы считаем, что удобно проводить реакцию при температуре от -50 до +30oC, более предпочтительно от 0oC до примерно комнатной температуры. Время, требующееся для реакции, подобным образом может широко варьировать в зависимости от многих причин, например температуры реакции, исходных материалов, применяемого растворителя и природы реагентов. Однако во многих случаях для реакции будет достаточным интервалом от 10 мин до 8 ч, более предпочтительно от 30 мин до 5 ч.
После окончания реакции целевое соединение формулы (XXIII) может быть выделено из реакционной смеси традиционными способами. Например, одна подходящая процедура включает, если необходимо, установление нейтрального pH, если имеется осадок, его удаление фильтрацией, добавление воды к остатку, экстракцию смеси несмешивающимся с водой растворителем, таким как этилацетат. Затем экстракт сушат над безводным сульфатом магния, после чего удаляют растворитель отгонкой, получают целевое соединение. При необходимости полученное в результате соединение может быть дополнительно очищено традиционными способами, такими как перекристаллизация или различные хроматографические методики, например хроматография на колонке.
На стадии G2 получают соединение формулы (XXIV) путем замены отщепляемой группы Y в соединении (XXIII) на защищенную карбоксильную группу формулы -COOR5. Эта реакция может быть проведена при взаимодействии соединения формулы (XXIII) с монооксидом углерода и спиртом для обеспечения группы R5', в присутствии основания и палладиевого катализатора (и, при необходимости, фосфина), необязательно в присутствии дополнительного растворителя, по методике, описанной, например, в EP-0465123A, EP-0465141A, или в Journal of Medicinal Chemistry, 33, 943 (1990).
Не имеется особых ограничений на используемый палладиевый катализатор и в равной мере может быть применен любой палладиевый катализатор, обычно используемый в реакциях этого типа. Примеры таких катализаторов включают тетракистрифенилфосфин палладий, бистрифенилфосфин палладий (II) диацетат и хлорид палладия; из них мы предпочитаем бистрифенилфосфин палладий (II) диацетат.
Не имеется особых ограничений на применяемый фосфин и здесь может быть применен любой фосфин, обычно используемый в реакциях этого типа. Примеры таких фосфинов включают трифенилфосфин и трибутилфосфин, из них мы предпочитаем трифенилфосфин.
При одновременном использовании палладиевого катализатора и фосфина они образуют комплекс и принимают участие в реакции. Например, при использовании в качестве палладиевого катализатора палладий (II) диацетата и трифосфина в качестве фосфина они образуют бис-(трифенилфосфин)палладий (II) диацетат и принимают участие в реакции.
Не имеется особых ограничений природы используемого основания и здесь могут быть применены любые основания, обычно используемые в реакциях такого типа. Примеры таких соединений включают органические амины, такие как триэтиламин, трибутиламин, диизопропилэтиламин, N,N-диметилаланин, N,N-диэтилаланин, пиридин, N-метилморфолин, 2,6-ди(трет-бутил)-4-метилпиридин, 4-N, N-диметиламино/пиридин, хинолин, 1,5-диазабицикло[4,3,0]-нона-5-ен, (ДБН), 1,4-диазабицикло[2,2,2] октан (ДАБЦО) и 1,8-диазабицикло-(5,4,0)ундец-7-ен (ДБУ); и металлоорганические основания, такие как бутиллитий, диизопропиламид и бис-(триметилсилил)амид лития.
В этой реакции могут быть добавлены четвертичные аммониевые соли (такие, как бензилтриэтиламмоний хлорид или тетрабутиламмоний хлорид) или простые краун-эфиры (такой, как дибензо-18-краун-6) в реакционную смесь, чтобы обеспечить более эффективное протекание реакции.
Реакцию обычно и предпочтительно проводят в присутствии растворителя, природа которого не является критической, при условии, что он не оказывает вредного воздействия на реакцию и может растворять реагенты, по крайней мере, до некоторой степени. Однако существенным является спирт, из которого будет происходить группа R5', такой как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, трет-бутанол, изоамиловый спирт, октанол или циклогексанол. Следовательно, примеры подходящих растворителей включают сам спирт и смеси спирта и одного или более растворителей, рекомендованных для использования на стадии G1.
Реакция будет проходить в широком интервале температур и выбор точной температуры реакции не является критическим для настоящего изобретения. Обычно мы считаем, что удобно проводить реакцию при температуре от -10 до +50oC, более предпочтительно от 0oC до комнатной температуры. Время, требующееся для реакции, подобным образом может широко варьировать в зависимости от многих факторов, например температуры реакции, исходных материалов, применяемого растворителя и природы реагентов. Однако в большинстве случаев для реакции будет достаточен период времени от 2 до 50 ч, более предпочтительно от 3 до 30 ч.
По окончании реакции целевое соединение формулы (XXIV) может быть выделено из реакционной смеси традиционными способами. Например, одна подходящая процедура извлечения состоит из нейтрализации pH, при необходимости; если имеется осадок, его удаляют фильтрованием; добавляют воду к остатку; экстрагируют смесь несмешивающимся с водой растворителем, таким как этилацетат. Затем сушат экстракт над безводным сульфатом магния, после чего отгоняют растворитель, получают целевое соединение. При необходимости полученное в результате целевое соединение может быть дополнительно очищено традиционными способами, такими как перекристаллизация или различные хроматографические методики, например, хроматография на колонке.
На стадии G3 получают соединение формулы (I) гидролизом защищающей карбоксил группы в соединении формулы (XXIV) в соответствии со способом, описанным на стадии A2, с последующим необязательным сульфонамидированием или защитой карбоксильной группы, полученной таким образом, в соответствии с процедурой, описанной на стадии A4.
Альтернативно, обрабатывают соединение формулы (XXIII), полученное на стадии G1, основанием и алкановой кислотой (такой, как муравьиная кислота или уксусная кислота), и затем обрабатывают его диоксидом углерода с последующим гидролизом продукта, при этом получают соединение, соответствующее соединению формулы (XXIV), но которое имеет свободную карбоксильную группу. При желании соединение формулы (I) может быть получено при защите или сульфонамидировании полученной таким образом карбоксильной группы в соответствии с методикой, описанной на стадии A4.
Не имеется особого ограничения для природы применяемого основания и здесь в равной мере может быть использовано любое основание, обычно применяемое для реакций этого типа для регенерации аниона. Примеры таких оснований включают: металоорганические основания, такие как бутиллитий, фтор-бутиллитий, трет-бутиллитий, диизопропиламид лития и бис-(триметилсилил)амид лития; и органические основания, такие как триэтиламин, трибутиламин и диизопропиламин.
Реакцию обычно проводят в присутствии растворителя, природа которого не является критической, при условии, что он не оказывает вредного воздействия на реакцию и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диметоксиэтан, метиловый эфир диэтиленгликоля и диоксан; галоидированные углеводороды, особенно галоидированные алифатические углеводороды, такие как метиленхлорид, четыреххлористый углерод, дихлорэтан и хлороформ; амиды, такие как формамид, диметилформамид, диметилацетат амид и гексаметилфосфоротриамид; и сульфоксиды, такие как диметилсульфоксид.
Реакция будет проходить в широком интервале температур и выбор точной температуры реакции не является критическим для настоящего изобретения. Обычно мы считаем удобным проводить реакцию при температуре от -100 до +30oC, более предпочтительно от -78 до 0oC. Время, требующееся для реакции, подобным образом может широко варьировать в зависимости от многих факторов, например, температуры реакции, исходных материалов, применяемого растворителя и природы реагентов. Однако во многих случаях для прохождения реакции будет достаточно от 1 до 10 ч, более предпочтительно от 2 до 8 ч.
После завершения реакции целевое соединение формулы (I) может быть выделено из реакционной смеси традиционными способами. Например, одна подходящая процедура извлечения состоит из добавления воды для гидролиза; при потребности, нейтрализуют pH; если имеется осадок, его удаляют фильтрованием, добавляют воду к остатку и экстрагируют смесь несмешивающимися с водой органическими растворителями, таким как этилацетат. Потом экстракт сушат над безводным сульфатом магния, после чего отгоняют растворитель, получают целевое соединение. При необходимости полученные в результате соединения могут быть дополнительно очищены традиционными способами, такими как перекристаллизация или различные хроматографические методики, например хроматография на колонке.
Биологическая активность
Новые стероидные производные настоящего изобретения показали отличную способность ингибировать тестостерон 5α-редуктазу в сочетании с низкой токсичностью и, следовательно, они могут быть полезными для профилактики и лечения гипертрофии простаты, а так же других заболеваний, вызванных избыточными уровнями 5α-дигидротестостерона.
Эта активность показана в следующих тестах, в которых соединения настоящего изобретения идентифицированы по одному из последующих примеров, в которых проиллюстрировано их получение. Известным соединением B является 17β -трет-бутилкарбамоиландроста-3,5-диен-3- карбоновая кислота, как обсуждалось ранее.
(1) Получение 5α-редуктазы из простаты крыс.
Брюшные предстательные железы у взрослых самцов крыс (масса тела 300 - 350 г; линия Спрэг-Доули) вырезают ножницами и прибавляют примерно 5-кратное количество по отношению к ткани буфера. Использованный буфер представляет собой 20 мМ калийфосфатный буфер, содержащий 0,33 М сахарозы, 1 мМ дитиотрейтола, 50 мМ восстановленного никотинамидоадениндинуклеотид фосфата (NADPH) и 0,001 мас.% фенилметилсульфонилфторида (PMSF). Затем ткань гомогенизируют, сначала гомогенизируют Политрон (торговое название) (выпускается фирмой Кинематика, GmbH), а затем в стеклянном гомогенизаторе Тефлон (Тефлон является торговым названием). Затем суспензию гомогенизированной ткани простаты центрифугируют (60 мин 140000 xg) и суспендируют осадок при добавлении примерно 5-кратного количества приведенного выше буфера. Суспензию снова центрифугируют (140000 xg, 60 мин). Полученный в результате осадок используют в качестве 5α-редуктазы крыс. Устанавливают концентрацию протеина от 30 до 40 мг/сл добавлением описанного выше буфера и препарат затем хранят замороженным при -80oC. Измерение количества протеина осуществляют, используя Био-Рад Протеина Аналитический способ, а в качестве стандарта используют бычий γ-глобулин (Фракция Коха II, производство Сигмы).
(2) Тест на ингибирование 5α- редуктазы крысы.
Растворяют 5 мкл испытуемого соединения в диметилсульфоксиде или этаноле (конечная концентрация испытуемого соединения 10-8 М) и помещают в пробирку для испытаний полученный в результате раствор, 0,5 мл 40 мМ калийфосфатного буфера (pH 6,5), содержащего 5α-редуктазу крысы, как описано выше (количество протеина 1 мг), 1 мкМ (14C)-тестостерона, 1 мМ дитиотрейтола и 500 мкМ NADPH. Затем смесь инкубируют при 37oC в течение 15 - 30 мин. Испытание также проводят на контрольной группе введением только растворителя. После инкубации для прекращения реакции добавляют 2 мл этилацетата, содержащего по 10 мкг каждого из тестостерона, 5α- дигидротестостерона и андростандиона. Реакционную смесь центрифугируют (1400 xg, 5 мин), а затем этилацетатную фракцию переносят для разделения в испытательную пробирку и выпаривают досуха в присутствии циркулирующего газообразного азота. Стероид растворяют в 40 мкл этилацетата и наносят пятно на пластину для тонкослойной хроматографии (LK5DF пластина оксида кремния, производство фирмы Ватман). Затем пластину дважды проявляют при комнатной температуре смесью этилацетата и циклогексана (1:1 по объему). Стероидную фракцию идентифицируют в ультрафиолетовом свете и окрашивают, используя водный раствор 1 мас.%/объем сульфата цезия и 10 мас.%/ объем серной кислоты. Измеряют профили радиоактивности пластины для тонкослойной хроматографии с использованием био-имэдж-анализатора (производство Фуджи Фото Филм). Активность ферментная выражают как пропорцию добавленного (14C)-5a-дигидротестостерона, который получается из (14C)-тестостерона (скорость конверсии /%/). Кроме того, активность ингибирования 5α-редуктазы крысы в образце определяют с использованием следующей формулы.
Активность ингибирования 5α- редуктазы крысы = (скорость конверсии испытуемой группы)/(скорость конверсии контрольной группы) • 100 (%).
Результаты приведены в таблице 2.
Как можно видеть из приведенных выше результатов, соединения настоящего изобретения обладают отличной ингибирующей активностью против действия 5α-редуктазы, которая на порядок выше, чем у наиболее близкого известного соединения, которое само изучается для терапевтического применения на людях.
Соединения настоящего изобретения могут быть введены любым подходящим путем и могут быть сформулированы, как это хорошо известно на данном уровне техники, а фармацевтические композиции с традиционными вспомогательными веществами, носителями, разбавителями или другими активными соединениями, в зависимости от природы заболевания, подлежащего лечению, и путем введения. Например, при оральном введении соединения могут быть сформулированы как таблетки, капсулы, гранулы, порошки и сиропы, а для парентерального введения они могут быть сформулированы как препараты для инъекций и свечи. Эти фармацевтические препараты могут быть сформулированы традиционными способами с использованием таких вспомогательных добавок, как носители, связующие, дезинтеграторы, смазки, стабилизаторы и корригирующие агенты. Хотя доза может варьировать в зависимости от симптомов, массы тела и возраста пациента, а также от природы и серьезности заболевания, которое подлежит лечению или профилактике, обычная дневная доза для взрослого составляет от 0,01 до 1000 мг, предпочтительно от 0,1 до 100 мг, которая может быть введена как одна доза или дробные дозы, несколько раз в день.
Изобретение далее иллюстрируется следующими примерами, которые показывают приготовление некоторых соединений настоящего изобретения, и последующими приготовлениями, которые иллюстрируют получение некоторых исходных материалов, используемых в этих примерах.
Пример 1. 17β-[N-(дифенилметил)карбамоил]андроста-3,5-диен-3- карбоновая кислота (соединение N 2).
1(а). Метил-3-цианоандроста-3,5-диен 17β-карбоксилат.
Растворяют 3,0 г цианида лития и 16 мл диэтилцианофосфата в 200 мл сухого тетрагидрофурана и прибавляют понемногу 10 г метил-3-оксо-4-андростен-17β-карбоксилата при комнатной температуре к полученному в результате раствору. Реакционную смесь перемешивают при комнатной температуре в течение 15 мин, после чего отгоняют тетрагидрофуран при пониженном давлении. Остаток растворяют в 300 мл смеси 1 : 1 по объему этилацетата и бензола, полученный раствор промывают 4 раза водой, а затем один раз насыщенным раствором хлористого натрия. Затем его сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный в результате остаток растворяют в 100 мл сухого бензола и прибавляют 2 мл комплекса трехфтористый бор - диэтиловый эфир, к полученному раствору, который затем перемешивают 3 ч при комнатной температуре.
По окончании этого времени реакционную смесь разбавляют 300 мл диэтилового эфира. Разбавленную смесь промывают водой, водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия, в таком порядке, после чего сушат над безводным сульфатом магния, и затем концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке через 100 г силикагеля, используя метод градиентной элюации смесями этилацетата и гексана в соотношении в интервале от 4 : 96 до 12 : 88 по объему в качестве элюента, получают 9,5 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 1,70 (3H, синглет), 0,93 (3H, синглет), 0,90 - 2,50 (18H,мультиплет), 3,67 (3H, синглет), 5,77 (1H, триплет, J=3 Гц), 6,65 (1H, синглет).
ИК-спектр (KBr), λмакс см-1: 2940, 2885, 2205, 1729, 1635, 1603, 1436, 1200, 1161, 1058, 935, 652, 541.
1 (b). 3-Цианоандроста-3,5-диен- 17β -карбоновая кислота.
Растворяют 8,8 г метил-3-цианандроста-3,5-17β-карбоксилата (полученного, как описано на стадии (a)) и 4,3 г гидроксида калия в смеси 20 мл воды и 200 мл метанола, полученный раствор кипятят с обратным холодильником в течение 10 ч. По окончании этого времени отгоняют метанол из реакционной смеси при пониженном давлении, смесь подкисляют добавлением разбавленной соляной кислоты и три раза экстрагируют метиленхлоридом. Органический экстракт промывают водой, а затем насыщенным водным раствором хлористого натрия и сушат над безводным сульфатом магния. Затем его концентрируют при пониженном давлении. Полученный остаток хроматографируют на колонке со 150 г силикагеля, используя метод градиентной элюации смесями ацетона и метиленхлорида в соотношениях в интервале от 2 : 98 до 16 : 84 по объему в качестве элюента, получают 7,1 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,78 (3H, синглет), 0,94 (3H, синглет), 0,90 - 2,50 (18H, мультиплет), 5,77 (1H, триплет, J=3 Гц), 6,65 (1H, синглет).
ИК-спектр (KBr), λмакс см-1: 2968, 2944, 2855, 2205, 1698, 1634, 1603, 1421, 1296, 1238, 932, 730, 650.
1 (c). N-(дифенилметил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Растворяют 1,0 г 3-цианандроста-3,5-диен-17β-карбоновой кислоты (полученной, как описано на стадии (b)), 1,0 г дифенилметиламина и триэтиламина в 10 мл сухого метиленхлорида и к полученному раствору прибавляют 0,75 мл диэтилцианофосфата при комнатной температуре. Реакционную смесь перемешивают всю ночь при комнатной температуре, после чего разбавляют 100 мл метиленхлорида, затем промывают 1н. водной соляной кислотой, водой, водным раствором бикарбонатом натрия и насыщенным водным раствором хлористого натрия в таком порядке. Затем раствор сушат над безводным сульфатом магния, после чего концентрируют при пониженном давлении. Полученный остаток подвергают хроматографии на колонке с 40 г силикагеля, используя метод градиентной элюции смесями ацетона и метиленхлорида в соотношениях от 1 : 99 до 4 : 96 по объему в качестве элюента, получают 0,85 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,70 (3H, синглет), 0,92 (3H, синглет), 0,90 - 2,00 (13H, мультиплет), 2,18 - 2,36 (25, мультиплет), 5,76 (1H, триплет, J=2 Гц), 5,88 (1H, дублет, J=8 Гц), 6,29 (1H, дублет, J=8 Гц), 6,64 (1H, синглет), 7,21 - 7,36 (10H, мультиплет).
ИК-спектр (KBr), λмакс см-1: 2967, 2950, 2912, 2205, 1664, 1636, 1603, 1485, 1449, 1199, 757, 697.
1 (d). 17β-[N-(дифенилметил)карбамоил] андроста-3,5-диен-3-карбоновая кислота.
Растворяют 0,8 г N-дифенилметил)-3-цианоандроста-3,5-диен-17β-карбоксамида (полученной, как описано на стадии (c)) и 0,6 г гидроксида калия в смеси 14 мл воды и 20 мл этиленгликоля, затем смесь 16 ч кипятят с обратным холодильником. По окончании этого времени реакционную смесь охлаждают до комнатной температуры и подкисляют добавлением разбавленной водной соляной кислоты. Затем смесь экстрагируют три раза метиленхлоридом. Объединенные органические экстракты промывают водой и насыщенным водным раствором хлористого натрия в таком порядке, и сушат над безводным сульфатом магния. Потом смесь концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с силикагелем (35 г), используя метод градиентной элюции смесями ацетона и метиленхлорида в соотношениях от 2 : 98 до 12 : 88 по объему в качестве элюента, получают 650 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,91 (3H, синглет), 0,90 - 2,60 (18H, мультиплет), 5,86 (1H, триплет, J=3 Гц), 5,89 (1H, дублет, J=8 Гц), 6,30 (1H, дублет, J=8 Гц), 7,13 (1H, синглет), 7,20 - 7,40 (10H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3337, 2942, 1710, 1698, 1634, 1530, 1496, 1367, 1230, 1203, 1170, 755, 700, 641.
Пример 2. 17β -[N-(1-(4-метоксифенил)-1- метилэтил)карбамоил)андроста-3,5-диен-3-карбоновая кислота (соединение N 142).
2(a). S-2-пиридил-3-оксо-4-андростен-17β-триокарбоксилат.
Растворяют 10,0 г 3-оксо-4-андростен-17β-карбоновой кислоты, 14,0 г 2,2'-пиридилдисульфида и 16,7 г трифенилфосфина в 100 мл сухого толуола и полученный раствор перемешивают 24 ч при комнатной температуре в токе азота. По окончании этого времени реакционную смесь подвергают без дополнительной обработки хроматографии на колонке с силикагелем, используя смесь 1:1 по объему гексана и этилацетат в качестве элюента, получают 12,0 г целевого соединения в виде белых кристаллов.
ЯМР-спектр (CDCl3) δ ппм: 0,80 (3H, синглет), 0,95 - 2,12 (13H, мультиплет), 1,19 (3H, синглет), 2,20 - 2,49 (6H, мультиплет), 2,74 (1H, триплет I = 9,3 Гц), 5,74 (1H, синглет), 7,27 - 7,31 (1H, мультиплет), 7,59 - 7,63 (1H, мультиплет), 7,70 - 7,77 (1H, мультиплет), 8,61 - 8,64 (1H, мультиплет),
ИК-спектр (KBr) λмакс см-1: 2967, 2936, 1691, 1664, 1568, 1563, 1418.
2(b). N-[1-(4-метоксифенил)-1-метилэтил)-3-оксо-4-андростен- 17β -карбоксамид.
Растворяют 610 г S-2-пиридил-3-оксо-4-андростен-17β-тиокарбоксилата (полученного, как описано на стадии (a)) в 1 мл сухого метиленхлорида и прибавляют к полученному раствору 630 мг 1-(4-метоксифенил)-1-метилэтиламина (полученного, как описано в приготовлении 10a). Затем смесь перемешивают при комнатной температуре 3 дня. По окончании этого времени реакционную смесь без дополнительной обработки подвергают хроматографии на колонке с силикагелем, используя метод градиентной элюции смесями метиленхлорида и ацетона в соотношениях в интервале от 3 : 2 до 1 : 1 по объему в качестве элюента, продукт перекристаллизовывают из диизопропилового эфира, получают 670 мг целевого соединения в виде белых кристаллов.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,91 - 1,90 (12H, мультиплет), 1,19 (3H, синглет), 1,70 (3H, синглет), 1,17 (3H, синглет), 1,99 - 2,46 (8H, мультиплет), 3,79 (3H, синглет), 5,47 (1H, синглет), 5,73 (1H, синглет), 6,86 (2H, дублет), J = 8,8 Гц).
ИК-спектр (KBr) λмакс см-1: 3353, 2966, 2941, 1661, 1614, 1513, 1454.
2(c). N-[1-(4-метоксифенил)-1-метилэтил]-3-цианоандроста- 3,5-диен- 17β -карбоксамид.
Растворяют 660 мг N-[1-(4-метоксифенил)-1-метилэтил]-3- оксо-4-андростен-17β-карбоксамида (полученного, как описано в стадии (b)) в 5 мл сухого тетрагидрофурана и к полученному раствору прибавляют 0,30 мл диэтилцианофосфата и 67 мг цианида лития. Затем смесь 30 мин перемешивают при комнатной температуре. В конце этого времени отгоняют растворитель из реакционной смеси при пониженном давлении и полученный в результате остаток растворяют в смеси 1 : 1 по объему этилацетата и гексана. Полученный раствор затем промывают водой и насыщенным водным раствором хлористого натрия в таком порядке, затем его сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Полученный остаток растворяют в 5 мл сухого толуоле, полученный таким образом раствор перемешивают 4 ч при комнатной температуре, в то время как прибавляют каждые 30 мин комплекс трехфтористый фтористый бордиэтиловый эфир в количестве 20 мкл. По окончании этого времени к реакционной смеси прибавляют насыщенный водный раствор бикарбоната натрия, полученную смесь экстрагируют смесью 1 : 1 по объему этилацетата и бензола. Экстракт промывают водой и насыщенным водным раствором хлористого натрия в таком порядке и сушат над безводным сульфатом магния. Затем из смеси удаляют растворитель выпариванием при пониженном давлении. Остаток хроматографируют на колонке с силикагелем, используя метод градиентной элюции смесями гексана и этилацетата в соотношениях от 3 : 1 до 3 : 2 по объему в качестве элюента, продукт кристаллизуют из диизопрпилового эфира, получают 300 мг целевого соединения в виде белых кристаллов.
ЯМР-спектр (CDCl3) δ ппм: 0,70 (3H, синглет), 0,93 (3H, синглет), 0,97 - 1,92 (10H, мультиплет), 1,70 (3H, синглет), 1,71 (3H, синглет), 1,99 - 2,38 (10H, мультиплет), 3,79 (3H, синглет), 5,49 (1H, синглет), 5,77 (1H, триплет, J = 3,2 Гц), 6,65 (1H, синглет), 6,86 (1H, дублет, J = 8,8 Гц), 2,34 (2H, дублет, J = 8,8 Гц).
ИК-спектр (KBr) λмакс см-1: 3399, 2962, 2914, 2199, 1681, 1615, 1598, 1512, 1455.
2(d). 17β-{ N-[1-(4-метоксифенил)-1-метилэтил]карбамоил} андроста-3,5-диен-3-карбоновая кислота.
Суспендируют 280 мг N-[1-(4-метоксифенил)-1-метилэтил]- 3-цианоандроста-3,5-диен-17β-карбоксамида (полученного, как описано на стадии (c)) в 15 мл этиленгликоля, к полученной суспензии прибавляют раствор 2,2 г гидроксида калия в 5 мл воды. Затем смесь кипятят с обратным холодильником в течение 24 ч в токе азота. В конце этого времени реакционную смесь охлаждают до комнатной температуры и подкисляют ее добавлением 10 мас.% /объем водной соляной кислоты, а затем смесь экстрагируют метиленхлоридом. Экстракт промывают водой и насыщенным водным раствором хлористого натрия в таком порядке, после чего сушат над безводным сульфатом натрия. Затем растворитель удаляют из смеси выпариванием при пониженном давлении. Остаток перекристаллизовывают из смеси ацетона и диэтилового эфира, полученные в результате кристаллы отфильтровывают. Маточную жидкость очищают хроматографией на колонке с силикагелем, используя метод градиентной элюции смесями метиленхолрида и ацетона в соотношениях в интервале от 9 : 1 до 7 : 3 по объему в качестве элюента, получают 269 мг целевого соединения в виде белых порошкообразных кристаллов.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,93 (3H, синглет), 1,03 - 2,60 (18H, мультиплет), 1,70 (3H, синглет), 1,72 (3H, синглет), 3,80 (3H, синглет), 5,51 (1H, синглет), 5,85 (1H, триплет, J = 2,7 Гц), 6,86 (2H, дублет, J = 8,8 Гц), 7,12 (1H, синглет), 7,34 (2H, дублет, J = 8,8 Гц).
ИК-спектр (KBr) λмакс см-1: 3448, 2966, 2940, 1663, 1612, 1514, 1420.
Пример 3. 17β-[N-(дифенилметиламино)карбамоил] андроста- 3,5-диен-3-карбоновая кислота (соединение N 159).
3(a). S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат.
Растворяют 7,0 г 3-цианоандроста-3,5-диен-17β-карбоновой кислоты (полученной, как описано в примере 1(b)), 10,2 г трифенилфосфина и 8,8 г 2,2'-дипиридилдисульфида в 100 мл сухого бензола, полученный раствор перемешивают при комнатной температуре всю ночь. По окончании этого времени реакционную смесь без дополнительной обработки хроматографируют на колонке с 350 г силикагеля используя метод градиентной элюции смесями ацетона и метиленхлорида в соотношениях от 1:99 до 2:98 по объему в качестве элюента, получают 6,9 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,79 (3H, синглет), 0,94 (3H, синглет), 0,80-2,50 (17H, мультиплет), 2,74 (1H, триплет, J=9 Гц), 5,77 (1H, триплет, J= 2 Гц), 6,65 (1H, синглет), 7,25-7,31 (1H, мультиплет), 7,60-7,64 (1H, мультиплет), 7,71-7,78 (1H, мультиплет), 8,61-8,64 (1H, мультиплет).
ИК-спектр (KBr) ( λмакс см-1: 2957, 2946, 2911, 2200, 1708, 1631, 1573, 1454, 1420, 1152, 1039, 768.
3(b), N,N-дифенил-3-цианоандроста-3,5-диен-17β-цианогидразид.
Растворяют 505 мг S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилата (полученного, как описано на стадии (a)), в 7 мл пиридина и прибавляют к полученному раствору 330 мг 1,1-дифенилгидразина гидрохлорида. Затем смесь перемешивают всю ночь при комнатной температуре. По окончании этого времени из реакционной смеси удаляют растворитель отгонкой при пониженном давлении, остаток хроматографируют на колонке с силикагелем, используя метод градиентной элюции смесями метиленхлорида и ацетона в соотношениях от 99:3 до 9:1 по объему в качестве элюента, продукт кристаллизуют из диизопропилового эфира, получают 500 мг целевого соединения в виде белых кристаллов.
ЯМР-спектр (CDCl3) (δ ппм: 0,74 (3H, синглет), 0,94 (3H, синглет), 1,03-1,95 (12H, мультиплет), 2,04-2,38 (6H, мультиплет), 5,77 (1H, триплет, J= 2,9 Гц), 6,65 (1H, синглет), 6,98-7,33 (10H, мультиплет), 7,43 (1H, синглет).
ИК-спектр (KBr)( λмакс см-1: 3230, 2943, 2909, 2208, 1667, 1634, 1591, 1496.
3(c). 17β-[N-(дифениламино)карбомоил] андроста-3,5-диен-3- карбоновая кислота.
Повторяют процедуру, подобную описанной в примере 1(d), с тем исключением, что в качестве исходного материала используют N,N-дифенил-3-цианоандроста-3,5-диен-17β-карбонилгидразид (полученный как описано на стадии (b)), в относительном количестве, подобном использованному в этом примере, получают целевое соединение с выходом 80%.
ЯМР-спектр (CDCl3) δ ппм: 0,74 (3H, синглет), 0,93 (3H, синглет), 1,02-2,58 (18H, мультиплет), 5,86 (1H, триплет, J=2,7 Гц), 6,98-7,36 (11H, мультиплет), 7,44 (1H, синглет).
ИК-спектр (KBr) ( λмакс см-1: 3265, 2940, 1677, 1633, 1591, 1495.
Пример 4. 17β -[N-(1-метил-1-фенилэтил)карбамоил]андроста-3,5-диен-3-карбоновая кислота (соединение N 66).
4(a). N-(1-метил-1-фенил)-3-цианоандроста-3,5-диен- 17β - карбоксамид.
Повторяют процедуру, описанную в примере 3(b), с тем исключением, что S-2-пиридил-3-цианоандроста-3,5-диен- 17β -тиокарбоксилат (полученный, как описано в примере 3(a)) и 1-метил-1-фенилэтиламин используют в качестве исходных материалов в относительных пропорциях, подобных тем, что использованы в примере 3, получают целевое соединение с выходом 75%.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,94 (3H, синглет), 0,98-1,92 (12H, мультиплет), 1,71 (3H, синглет), 1,73 (3H, синглет), 2,02-2,40 (6H, мультиплет), 5,53 (1H, синглет), 5,77 (1H, триплет, J=3,4 Гц), 6,65 (1H, синглет), 7,19-7,44 (5H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3445, 2964, 2896, 2761, 2202, 1685, 1640, 1603, 1495.
4(b). 17β-[N-(1-метил-1-фенил)карбамоил] андроста-3,5-диен-3-карбоновая кислота.
Проверяют процедуру, описанную в примере 1(d), с тем исключением, что в качестве исходного материала используют N-(1-метил-1-фенилэтил)-3-цианоандроста 3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a), в относительном количестве, подобном использованному в том примере, получают целевое соединение с выходом 82%.
ЯМР-спектр (CDCl3) δ ппм: 0,72 (3H, синглет), 0,93 (3H, синглет), 1,01-2,57 (18H, мультиплет), 1,71 (3H, синглет), 1,74 (3H, синглет), 5,54 (1H, синглет), 5,87 (1H, широкий синглет), 7,14 (1H, синглет), 7,20-7,44 (5H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3440, 2940, 1680, 1667, 1608, 1495.
Пример 5. 17β-[N-(1-метил-1-(3-тиенилэтил/карбамоил]андроста-3,5-диен-3-карбоновая кислота (соединение N 191).
Повторяют процедуру примера 4(a) и 4(b), с тем исключением, что в качестве исходных материалов используют S-2-пиридил-3-цианоанлроста-3,5-диен- 17β -тиокарбоксилат (полученный, как описано в примере (3a)) и 1-метил-1-(3-тиенилэтиламин, полученный, как описано в приготовлении 11(b) в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 55%.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,93 (3H,синглет), 1,70 (3H, синглет), 1,73 (3H, синглет), 5,53 (1H, синглет), 5,85 (широкий синглет), 6,9-7,0 (2H, мультиплет), 7,14 (1H, синглет, 7,28 (1H, мультиплет).
Пример 6. 17β-[N-(1,2-дифенилэтил)карбамоил]андроста-3,5-диен-3-карбоновая кислота (соединение N 1).
6(a). N-(1,2-дифенилэтил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Повторяют процедуру, описанную в примере 3(b), с тем исключением, что в качестве исходного материала используют S-2-пиридил-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(a)) и 1,2-дифенилэтиламин в отрицательных количествах, подобных использованным в этом примере, получают целевой продукт с количественным выходом.
ИК-спектр (KBr) λмакс см-1: 3416, 2965, 2948, 2913, 2204, 1658, 1636, 1603, 1495, 1454, 1234, 699.
6(b). 17β-[N-(1,2-дифенилэтил)карбамоил]андроста-3,5-диен- 3-карбоновая кислота.
Работают по методике примера 1(d), но используют 630 мг N-(1,2-дифеилэтил)-3-цианоандроста-3,5-диен-17β-карбоксамида (полученного, как описано на стадии (а)), получают целевое соединение с выходом 41%.
ЯМР-спектр (CDCl3) δ ппм: 0,50 и 0,54 (вместе 3H, каждый синглет) 0,88 и 0,90 (вместе 3H, каждый синглет), 0,93-2,55 (18H, мультиплет), 5,24-5,39 (1H, мультиплет), 5,50 и 5,60 (вместе 1H, каждый дублет, J = 7,0 Гц), 5,84 (1H, синглет), 7,04-7,35 (11H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3029, 2940, 1671, 1633, 1610, 1496, 1278, 1188, 698.
Пример 7. 17β-[N-(1-(3,4-диметоксифенил)-1-метилэтил)карбамоил]-андроста-3,5- диен-3-карбоновая кислота (соединение N 192)
7(a). N-[1-(3,4-диметоксифенил)-1-метилэтил]-3- цианоандроста-3,5-диен- 17β -карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(а)) и 1-3,4-диметоксифенил-1-метилэтиламин (полученный, как описано в приготовлении 10e), в относительных количествах, подобных использованным в этом примере, получают целевое соединение с выходом 60%.
ИК-спектр (KBr) λмакс см-1: 3374, 2965, 2938, 2203, 1676, 1634, 1604, 1518, 1453, 1261, 1145, 1029.
7(b). 17β-[N-(1-(3,4-диметоксифенил)-1-метилэтил)карбамоил]- андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но в качестве исходного материала используют N-(1-(3,4-диметоксифенил)-1-метилэтил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (а)) в относительном количестве, подобном использованному в этом примере, получают целевое соединение с выходом 58%.
ЯМР-спектр (CDCl3) δ ппм: 0,72 (3H, синглет), 0,92 (3H, синглет), 1,03-2,57 (18H, мультиплет), 1,71 (3H, синглет), 1,72 (3H, синглет), 3,86 (3H, синглет), 3,88 (3H, синглет), 5,51 (1H, синглет), 5,86 (1H, синглет), 6,81-6,84 (1H, мультиплет), 6,95-6,99 (2H, мультиплет), 7,14 (1H, синглет).
ИК-спектр (KBr) λмакс см-1: 3437, 2967, 2939, 1674, 1633, 1610, 1518, 1453, 1262, 1145, 1028, 803, 766, 641.
Пример 8. 17β-[N-(1-(2-метоксифенил)-1-метилэтил)карбамоил] андроста-3,5-диен-3-карбоновая кислота (соединение N 168).
8(a)N-[1-(2-метоксифенил)-1-метилэтил] -3-цианоандроста-3,5- диен- 17β -карбоксамид.
Работают по методике, описанной в примере 3(b), но используя в качестве исходного материала S-2-пиридил-3-цианоандроста-3,5- диен- 17β -тиокарбоксилат (полученный, как описано в примере 3(а)) и 1-(2-метоксифенил)-1-метилэтиламин (полученный, как описано в приготовлении 10c), в относительных пропорциях, подобных использованным в этом примере, получают целевое соединение с выходом 96%.
ИК-спектр (KBr) λмакс : 3386, 2939, 2203, 1675, 1633, 1602, 1490, 1451, 1380, 1241, 1029, 752.
8(b), 17β -[N-(1-(2-метоксифенил)-1-метилэтил)карбамоил] - андроста-3,5-диен-3-карбоновая кислота.
Работают по методике, описанной в примере 1(d), но используя в качестве исходного материала N-(1-(2-метоксифенил)-1-метилэтил] - 3-цианоандроста-3,5-диен- 17β -карбоксамид (полученный, как описано га стадии (а)) в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 50%.
ЯМР-спектр (CDCl3) δ ппм: 0,67 (3H, синглет), 0,91 (3H, синглет), 1,00-2,56 (18H, мультиплет), 1,77 (3H, синглет), 1,81 (3H, синглет), 3,83 (3H, синглет), 5,86 (1H, синглет), 5,97 (1H, синглет), 6,87-6,97 (2H, мультиплет), 7,14 (1H, синглет), 7,19-7,26 (1H, мультиплет), 7,38-7,42 (1H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3450, 2972, 2939, 1670, 1634, 1607, 1490, 1452, 1268, 1241, 1189, 1019, 754, 641.
Пример 9. 17β-[N-(1-(3-метоксифенил)-1-метилэтил)карбамоил]андроста-3,5- диен-3-карбоновая кислота (соединение N 166).
9(а). N-[1-[3-метоксифенил] -1-метилэтил] -3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен- 17β -тиокарбоксилат (полученный, как описано в примере 3(а)) и 1-(3-метоксифенил)-1-метиоэтиламин (полученный, как описано в приготовлении 10 b) в относительных количествах, подобных тем, что были использованы в этом примере, получают целевое соединение с выходом 64%.
ИК-спектр (KBr) λмакс см-1: 3347, 2966, 2940, 2203, 1675, 1633, 1603, 1584, 1486, 1448, 1266, 1049, 700.
9(b). 17β-[N-[1-[(3-метоксифенил)-1-метилэтил)карбамоил]-андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного материала N-[1-(3-метоксифенил)-1-метилэтил] -3-цианоандроста-3,5-диен- 17β -карбоксамид (полученный, как описано на стадии (а), в относительном количестве, подобно тому, что использовано в этом примере, получают целевое соединение с выходом 33%.
ЯМР-спектр (CDCl3) δ ппм: 0,73 (3H, синглет), 0,93 (3H, синглет), 1,04-2,57 (18H, мультиплет), 1,70 (3H, синглет), 1,72 (3H, синглет), 3,80 (3H, синглет), 5,54 (1H, синглет), 5,65 (1H, синглет), 6,75-6,79 (1H, мультиплет), 6,95-7,02 (2H, мультиплет), 7,14 (1H, синглет), 7,23-7,29 (1H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3438, 2966, 2939, 1666, 1632, 1608, 1583, 1498, 1454, 1428, 1275, 1233, 1188, 1049, 780, 701.
Пример 10. 17β-[N-[1-[3,5диметоксифенил)-1-метилэтилен)карбамоил]андроста-3,5-диен-3 -карбоновая кислота (соединение N 149).
10(а). N-[1-[3,5-диметоксифенил] -1-метилэтил]-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(в), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(а)) и 1-(3,5-диметоксифенил)-1-метилэтиламин (полученный, как описано в приготовлении 10 d), в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 83%.
ИК-спектр (KBr) λмакс см-1: 3358, 2965, 2202, 1679, 1633, 1598, 1504, 1453, 1421, 1204, 1153, 1052, 696,
10(b). 17β-[N-[1-[(3,5-диметоксифенил)-1-метилэтил)карбамоил] -андроста-3,5-диен-3 -карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного материала N-/1-/3,5-диметоксифенил/-1-метилэтил]-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (а), в относительном количестве, подобном тому, что использовано в этом примере, получают целевое соединение с выходом 51%.
ЯМР-спектр (CDCl3) δ ппм: 0,74 (3H, синглет), 0,93 (3H, синглет), 1,04-2,63 (18H, мультиплет), 1,68 (3H, синглет), 1,71 (3H, синглет), 3,79 (6H, синглет), 5,53 (1H, синглет), 5,85 (1H, синглет), 6,34 (1H, триплет, J = 2,0 Гц), 6,56 (2H, дублет, J = 2,0 Гц), 7,13 (1H, синглет).
ИК-спектр (KBr) λмакс см-1: 3344, 2965, 2039, 1676, 1634, 1598, 1503, 1456, 1423, 1229, 1204, 1154, 1066, 834, 696, 640.
Пример 11. 17β-[N-[1-[4-метилфенил)-1-метилэтил)карбамоил] андроста-3,5-диен-3 -карбоновая кислота (соединение N 196).
11(a). N-[1-[4метилфенил] -1-метилэтил] -3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(b)) и 1-(4-метилфенил)-1-метилэтиламин (полученный, как описано в приготовлении 10 h) в относительных пропорциях, подобных тем, как использовано в этом примере, получают целевое соединение с выходом 88%.
ИК-спектр (KBr) λмакс см-1: 3446, 2963, 2203, 1685, 1637, 1604, 1495, 1382, 1257, 810, 541.
11(b). 17β-[N-[1-[(4-метилфенил)-1-метилэтил)карбамоил]-андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного материала N-[1-(4-метилфенил)-1-метилэтил] -3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (а), в относительном количестве, подобно тому, что использовано в этом примере, целевое соединение получают с выходом 47%.
ЯМР-спектр (CDCl3) δ ппм: 0,72 (3H, синглет), 0,92 (3H, синглет), 0,99-2,56 (18H, мультиплет), 1,70 (3H, синглет), 1,72 (Синглет), 2,32 (3H, синглет), 5,52 (1H, синглет), 5,86 (1H, синглет), 7,14 (2H, дублет, J = 7,8 Гц), 7,15 (1H, синглет), 7,28 (2H, дублет, J = 7,8 Гц).
ИК-спектр (KBr) λмакс см-1: 3437, 2968, 1666, 1633, 1610, 1494, 1452, 1420, 1277, 1188, 815, 640, 552.
Пример 12. 17β-[N-[1-(1-этил-1-фегнилпропил)карбамоил]андроста-3,5-диен-3 -карбоновая кислота (соединение N 195). 12(a). N-(1-этил-1-фенилпропил)-3-цианоандлроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(a)) и 1-этил-1-фенилпропиламин, в относительных пропорциях, подобных тем, что использовано в этом примере, получают целевое соединение с выходом 79%.
ИК-спектр (KBr) λмакс см-1: 3358, 2965, 2937, 2203, 1678, 1634, 1603, 1510, 1495, 1446, 1380, 1235, 757, 698.
12(b). 17β-[N-[1-(1-этил-1-фенилпропил)карбамоил]-андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного материала N-(1-этил-1-фенилпропил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (а), в относительном количестве, подобном использованному в этом примере, целевое соединение получают с выходом 37%.
ЯМР-спектр (CDCl3) δ ппм: 0,72 (6H, триплет, J= 7,6 Гц), 0,77 (3H, синглет), 0,93 (3H, синглет), 1,03-2,57 (22H, мультиплет), 5,42 (1H, синглет), 5,88 (1H, синглет), 7,19-7,37 (5H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3441, 2968, 2939, 1675, 1633, 1608, 1495, 1446, 1421, 1378, 1279, 1188, 757, 698, 640.
Пример 13. 17β-[N-[1-(4-этоксифенил)-1-метилэтил)-1-метилэтил]карбамоиландроста-3,5-диен-3 -карбоновая кислота (соединение N 194). 13(a). N-[1-(4-этоксифенил)-1-метилэтил]-3-цианоандроста-3,5-диен-17β- карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(a)), и 1-(4-этоксифенил)-1-метилэтиламин (полученный, как описано в приготовлении 10g), в относительных пропорциях, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 91%.
ИК-спектр λмакс см-1: 3361, 2969, 2940, 2203, 1678, 1633, 1609, 1512, 1453, 1243, 1181, 1048, 833.
13(b). 17β-[N-(1-(4-этоксифенил)-1-метилэтил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного соединения N-[1-(4-этоксифенил)-1-метилэтил] -3-цианоандроста- 3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a), в относительном количестве, подобном тому, что использовано в этом примере, получают целевое соединение с выходом 50%.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,92 (3H, синглет), 1,05 - 2,50 (18H, мультиплет), 1,40 (3H, триплет, J=6,8 Гц), 1,70 (3H, синглет), 1,72 (3H, синглет), 4,00 (2H, квартет, J=6,8 Гц), 5,49 (1H, синглет), 5,86 (1H, синглет), 6,84 (2H, дублет, J=7,0 Гц), 7,14 (1H, синглет), 7,32 (2H, дублет, J=7,0 Гц).
ИК-спектр (KBr) λмакс см-1: 2968, 2938, 1682, 1631, 1609, 1512, 1280, 1244, 1183, 1047, 926, 824, 639.
Пример 14. 17β-[N-(1-метил-1-(2-тиенил)этил)карбамоил]андроста- 3,5-диен-3-карбоновая кислота (соединение N 67).
14 (a). N-[1-метил-1-(2-тиенил)этил] -3-цианандроста-3,5-диен- 17β-карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3 (a)) и 1-метил-1-(2-тиенил)этиламин (полученный, как описано в приготовлении 11a), в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 88%.
ИК-спектр (KBr) λмакс см-1: 3350, 2966, 2941, 2203, 1679, 1634, 1603, 1500, 1452, 1382, 1246, 695.
14(b). 17β-[N-(1-метил-(2-тиенил)этил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного соединения N-[1-метил-1-(2-тиенил)этил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a)), в относительном количестве, подобном тому, что использовано в примере, получают целевое соединение с выходом 57%.
ЯМР-спектр (CDCl3) δ ппм: 0,72 (3H, синглет), 0,92 (3H, синглет), 0,95 - 2,57 (18H, мультиплет), 1,82 (3H, синглет), 1,83 (3H, синглет), 5,54 (1H, синглет), 5,85 (1H, синглет), 6,95 (1H, дублет, из дублетов, J=5,0 и 3,0 Гц), 7,10 (1H, дублет из дублетов, J=3,0 и 1,0 Гц), 7,15 (1H, синглет), 7,19)(1H, дублет из дублетов, J=5,0 и 1,0 Гц).
ИК-спектр (KBr) λмакс см-1: 3400, 2965, 2940, 1673, 1633, 1609, 1490, 1419, 1279, 1188, 704.
Пример 15. 17β-[N-(4-оксибензгидрил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота (соединение N 127).
15(a). N-[4-оксибензгидрил)-3-цианандроста-3,5-диен- 17β - карбоксамид.
Работа по методике примера 3(b), но используя в качестве исходного материала S-2-пиридил-3-цианандроста-3,5-диен- 17β -тиокарбоксилат (полученный, как описано в примере 3 (a)) и 4-оксибензгидриламин (полученный по приготовлению 13), в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 82%.
ИК-спектр (KBr) λмакс см-1: 3327, 2966, 2942, 2204, 1640, 1614, 1601, 1514, 1495, 1232, 1171, 699.
15(b). 17β-[N-(4-оксибензгидрил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного соединения N-[4-оксибензгидрил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a)), в относительном количестве, подобном тому, что использовано в примере, получают целевое соединение с выходом 34%.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,91 (3H, синглет), 1,06 - 2,64 (19H, мультиплет), 5,87 (1H, синглет), 5,87 и 5,97 (вместе 1H, каждый дублет, J= 7,0 Гц), 6,72 - 6,76 (2H, мультиплет), 7,03 - 7,37 (8H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 3310, 2966, 2940, 1675, 1636, 1614, 1514, 1495, 1271, 1232, 1186, 1172, 699.
Пример 16. 17β-[N-(4,4'-дифторбензгидрил)карбамоил]андроста- 3,5-диен-3-карбоновая кислота (соединение N 12).
16(a). N-[4,4'-дифторбензгидрил)-3-цианандроста-3,5-диен-17β-карбоксамид.
Работа по методике примера 3(b), но используя в качестве исходного материала S-2-пиридил-3-цианандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3 (a)) и 4,4'-дифторбензгидриламин (полученный по приготовлению 12), в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 91%.
ИК-спектр (KBr) λмакс см-1: 3346, 2967, 2948, 2912, 2205, 1661, 1636, 1604, 1508, 1488, 1229, 1158, 833, 552.
16(b). 17β-[N(4,4'-дифторбензгидрил)карбамоил)андроста- 3,5-диен-3-карбоновая кислота.
Работают по методике примера 1 (d), но используя в качестве материала N-(4,4'-дифторбензгидрил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a)), в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 34%.
ЯМР (CDCl3) δ ппм: 0,70 (3H, синглет), 0,92 (3H, синглет), 0,96 - 2,56 (18H, мультиплет), 5,78 (1H, дублет, J = 7,8 Гц), 5,86 (1H, синглет), 6,25 (1H, дублет, J = 7,8 Гц), 7,07 (4H, мультиплет), 7,13 - 7,23 (5H, мультиплет),
ИК-спектр (KBr) λмакс см-1: 2942, 2910, 1669 1634, 1607, 1508, 1419, 1279, 1228, 1189, 1158, 833, 552.
Пример 17. 17β-[N-(4,4'-диметоксибензгидрил)карбамоил)андроста- 3,5-диен-3-карбоновая кислота (соединение N 14).
17(a) N-(4,4'-диметоксибензгидрил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3 (b), но используя в качестве исходных продуктов S-2-пиридил-3-андроста-3,5-диен-17β-тиокарбоксилат (полученный по методике примера 3(a)) и 4,4'-диметоксибензгидриламин (полученный, как описано в приготовлении 14), в относительных пропорциях, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 79%.
ИК-спектр (KBr) λмакс см-1: 3425, 2945, 2908, 2205, 1657, 1637, 1607, 1511, 1488, 1248, 1176, 1036, 835, 567.
17(b) 17β-N-(4,4'-диметоксибензгидрил)карбамоил) андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1 (d), но используя в качестве материала N-(4,4'-дифторбензгидрил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a)), в относительном количестве, подобном использованному в этом примере, получают целевое соединение с выходом 52%.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,91 (3H, синглет), 1,02 - 2,49 (18H, мультиплет), 3,79 (6H, синглет), 5,81 (1H, дублет, J = 7,8 Гц), 5,86 (1H, синглет), 6,19 (1H, дублет, J=7,8 Гц), 6,82 - 6,89 (4H, мультиплет), 7,12 - 7,17 (5H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2940, 2910, 1666 1635, 1610, 1511, 1248, 1175, 1035, 629, 640, 565.
Пример 18. 17β-[N-1-(4-N, N-диметиламинофенил)-1-метилэтил) карбамоил] андроста-3,5-диен-3-карбоновая кислота (соединение N 190).
18(a) N-[1-(N, N-диметиламинофенил)-1-метилэтил] -3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3 (b), но используя в качестве исходных материалов S-2-пиридил-3-цианандроста-3,5-диен-17β-тиокарбоксилат (полученный по методике примера 3(a)) и 1-[4-N,N-диметиламинофенил)-1- метилэтиламин (полученный, как описано в приготовлении 10), в относительных пропорциях, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 83%.
ИК-спектр (KBr) λмакс см-1: 3351, 2965, 2039, 2202, 1677, 1632, 1632, 1614, 1522, 1493, 1446, 1359, 1200, 815.
18(b) 17β -[N-(1-(4-N, N'-диметиламинофенил)-1-метилэтил)- карбамоил)андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного продукта [N-(1-(4-N,N-диметиламинофенил)-1-метилэтил]- 3-цианандроста-3,5-диен- 17β -карбоксамид (полученный, как описано на стадии (a)), в относительном количестве, подобном использованному в этом примере, получают целевое соединение с выходом 35%.
ЯМР-спектр (CDCl3) δ ппм: 0,73 (3H, синглет), 0,93 (3H, синглет), 0,99 - 2,57 (18H, мультиплет), 1,71 (3H, синглет), 1,73 (3H, синглет), 2,95 (6H, синглет), 5,48 (1H, синглет), 5,89 (1H, синглет), 6,65 - 6,85 (2H, широкий синглет), 7,14 (1H, синглет), 7,25 - 7,37 (2H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2967, 2939, 2915, 1680, 1664, 1631, 1613, 1522, 1498, 1420, 1359, 1276, 949, 817, 640.
Пример 19. 17β-[N-(1-(4-фторфенил)-1-метилэтил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота (соединение N 78).
19(a). N-[1-(4-фторфенил-1-метилэтил)карбамоил] андроста- 3,5-диен- 17β-карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен- 17β -тиокарбоксилат (полученный как описано в примере 3(a)) и 1-(4-фторфенил)-1-метилэтиламин (получен, как описано в приготовлении 10f), в относительных пропорциях, подобных использованным в этом примере, получают целевое соединение с выходом 82%.
ИК-спектр (KBr) λмакс см-1: 3439, 2966, 2946, 2204, 1673, 1634, 1601, 1512, 1494, 1232, 1164, 836.
18(b). 17β-[N-(1-(4-фторфенил)-1-метилэтил)карбамоил] андроста- 3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходного материала N-[1-(4-фторфенил)-1-метилэтил] -3-цианоандроста-3,5-диен-17β-карбоксамид (полученный на стадии (a)), в относительном количестве, подобном использованному в этом примере, получают целевое соединение с выходом 55%.
ЯМР-спектр (CDCl3) δ ппм: 0,69 (3H, синглет), 0,93 (3H, синглет), 1,00-2,57 (18H, синглет), 1,68 (3H, синглет), 1,70 (3H, синглет), 5,53 (1H, синглет), 5,68 (1H, синглет), 7,00 (2H, триплет, J=8,8 Гц), 7,13 (1H, синглет), 7,37 (2H, дуплет дуплетов J=8,8 Гц; 5,4 Гц)
ИК-спектр (KBr) λмакс см-1: 3440, 2966, 2939, 1633, 1609, 1510, 1420. 1276. 1231, 832, 551.
Пример 20. 17β-[N-(4-хлорбензгидрилкарбамоил]анроста-3,5-диен-3-карбоновая кислота (соединение N 27).
20 (a)-N-(4-хлорбензгидрил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но используя в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный по методике 3(a)) и 4-хлорбензгидриламин, в относительных пропорциях, подобных использованным в этом примере, получают целевое соединение с выходом 70%.
ИК-спектр (KBr) λмакс см-1: 3349, 2965, 2945, 2205, 1661, 1637, 1603, 1490, 1543, 1090, 1014, 754.
20(b). 17β -[N-(4-хлорбензгидрилкарбамоил]андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя N-[4-хлорбензгидрил)-3-цианоанлроста-3,5-диен- 17β -карбоксамид (полученный по методике стадии (a) в качестве исходного материала в относительном количестве, подобном использованному в этом примере, получают целевое соединение с выходом 38%.
ЯМР-спектр (CDCl3) δ ппм: 0.70 (3H, синглет), 0,91 т 0,92 (вместе 3H, каждый синглет), 1,00-2,56 (18H, мультиплет), 5,82-5,87 (2H, мультиплет), 6,25 и 6,26 (вместе с 1H, каждый дуплет, J=7,8 Гц), 7,13-7,38 (10H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2941, 2910, 1674, 1635, 1613, 1490, 1279, 1209, 1188, 1090, 1014, 700.
Пример 21. 17β-[N-(4-метоксибензгидрил)карбамоил]андроста-3,5-диен-3-карбоновая кислота (соединение N 28).
21(a). N-(4-метоксибензгидрил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но используют в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(a)) и 4-метоксибензгидриламин (полученный, как описано в приготовлении 15), в относительных количествах, подобных использованным в этом примере, получают целевое соединение с выходом 82%.
ИК-спектр (KBr) λмакс см-1: 3344, 2964. 2945. 2910, 2205, 1661, 1636, 1607. 1511, 1493, 1249, 1177, 1033, 700.
21(b). 17β-[N-(4-метоксибензгидрил)карбамоил] андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используя в качестве исходных материалов N-(4-метоксибензгидрил)-3-цианоандроста-3,5-диен-3-тиокарбоксамид (полученный, как описано на стадии (a), в относительном количестве, подобном тому, что использовано в этом примере, получают целевое соединение с выходом 37%.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,91 (3H, синглет), 1,00-2,56 (18H, мультиплет), 3,79 и 3,80 (вместе 3H, каждый синглет), 5,85 (1H, дуплет, J= 7,8 Гц), 5,86 (1H, синглет), 6,24 (1H, дуплет, J=7,8 Гц), 6,84-6,90 (2H, мультиплет), 7,10-7,37 (8H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2939, 2910, 1672, 1635, 1612, 1511, 1495, 1454, 1248, 1177, 1033, 699, 640.
Пример 22. 17β-[N-(1,1-диметил-2-фенилэтил)карбакоил]андроста-3,5-диен-3-карбоновая кислота (соединение N 76).
22(a). N-(1,1-диметил-2-фенилэтил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но используют в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (получен, как описано в примере 3(a) и 1,1-диметил-2-фенилэтиламин в относительных пропорциях, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 82%.
ИК-спектр (KBr) λмакс см-1: 3436, 2965, 2938, 2916, 2205, 1678, 1633, 1604, 1501, 1451, 1385, 1233, 922, 729, 705.
22(b) 17β-[N-(1,1-диметил-2-фенилэтил)карбамоил] андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используют в качестве исходного материала N-(1,1-диметил-2-фенилэтил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a), в относительном количестве, подобном тому, что использовано в этом примере, получают целевое соединение с выходом 45%.
ЯМР-спектр (CDCl3) δ ппм: 0,73 (3H, синглет), 0,91 (3H, синглет), 0,96-2,56 (18H, мультиплет), 1,27 (3H, синглет), 1,44 (3H, синглет), 2,82 (1H, дуплет, J=13,2 Гц), 3,21 (1H, дуплет, J=13,2 Гц), 4,99 (1H, синглет), 5,85 (1H, синглет), 7,14 (1H, синглет), 7,16-7.32 (5H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2963, 2939, 2913, 1681, 1661, 1633, 1610, 1502, 1419, 1276, 1169, 924, 701.
Пример 23. 17β-[N-(α,α-диметилфурфурил/карбамоил)андроста- 3,5-диен-3-карбоновая кислота (соединение N 178).
23(a). N(α,α-диметилфурфурил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но используют в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(a)) и α,α-диметилфурфуриламин (полученный, как описано в приготовлении 11c), в относительных количествах, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 71%.
ИК-спектр (KBr) λмакс см-1: 2968, 2945, 2911, 1707, 1631, 1603, 1573, 1449, 1420, 1038, 767.
23(b) 17β-[N-(α,α-диметилфурфурил)карбамоил] андроста-3,5- диен-3-карбоновая кислота.
Работают по методике примера 1d, но используют в качестве исходного материала N-(α,α-диметилфурфурил)-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a), в относительном количестве, подобном тому, что использовано в этом примере, получают целевое соединение с выходом 27%.
ЯМР-спектр (CDCl3) δ ппм: 0,67 (3H, синглет), 0,92 (3H, синглет), 0,99-2,57 ()18H, мультиплет), 1,70 (3H, синглет), 1,72 (3H, синглет), 5,52 (1H, синглет), 5,86 (1H, синглет), 6,19-6,21 (1H, мультиплет), 6,30-6,32 (1H, мультиплет), 7,14 (1H, синглет), 7,31 - 7,33 (1H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2969, 2940, 1678, 1633, 1609, 1494, 1419, 1271, 1186, 735.
Пример 24. 17β-[N-((1S)-2-(4-метилфени)-1-фенилэтил)карбамоил) адроста-3,5-диен-3-карбоновая кислота (соединение N 22).
24(а). [N-((1S)-2-(4-метилфенил)-1-фенилэтил] -3- цианоандроста-3,5-диен-3- 17β-карбоксамид.
Работают по методике примера 3(b), но используют в качестве исходных материалов S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (полученный, как описано в примере 3(a)) и S-2-(4-метилфенил)-1-фенилэтиламин в относительных пропорциях, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 77%.
ИК-спектр (KBr) λмакс см-1: 3413, 2963, 2943, 2202, 1657, 1634, 1604, 1515, 1495, 1455, 1212, 703, 554.
24(b). 17β-[N-((1S)-2-(4-метилфенил)-1-фенилэтил)карбамоил] андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1d, но используют в качестве исходного материала N-[(1S)-2-(4-метилфенил)-1-фениэтил] -3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (a), в относительном количестве, подобном тому, что использовано в этом примере, получают целевое соединение с выходом 50%.
ЯМР-спектр (CDCl3) δ ппм: 0,54 (3H, синглет), 0,89 (3H, синглет), 0,91-2,55 (18H, мультиплет), 2,29 (3H, синглет), 2,98-3,12 (2H, мультиплет), 5,24 (1H, квартет, J = 7,3 Гц), 5,59 (1H, дублет, J = 7,3 Гц), 5,85 (1H, синглет), 6,94 (2H, дублет, J = 8,0 Гц), 7,04 (2H, дублет), 7,13 (1H, синглет), 7,20 - 7,34 (5H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2942, 2913, 1669, 1635, 1516, 1500, 1421, 1276, 1189, 700.
Пример 25. 17β-(N, N-дибензилкарбамоил)андроста-3,5-диен-3-карбоновая кислота (соединение N 4).
25(a). N,N-дибензил-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике примера 3(b), но в качестве исходных материалов используют S-2-пиридил-3-цианоандроста-3,5-диен-17β-тиокарбоксилат (получен по методике, описанной в примере 3(a)) и N,N-дибензиламин в относительных пропорциях, подобных тем, что использованы в этом примере, получают целевое соединение с выходом 80%.
ИК-спектр (KBr) λмакс см-1: 2943, 2929, 2904, 2205, 1641, 1604, 1495, 1467, 1426, 1206, 955, 734, 696.
25(b). 17β-N,N-дибензилкарбамоил)андроста-3,5-диен-3-карбоновая кислота.
Работают по методике примера 1(d), но используют в качестве исходного материала N,N-дибензил-3-цианоандроста-3,5-диен-17β-карбоксамид (полученный, как описано на стадии (b)), в относительном количестве, подобном тому, что использовано в этом примере, получают целевое соединение с выходом 33%.
ЯМР-спектр (CDCl3) δ ппм: 0,92 (6H, синглет), 0,97-2,55 (17H, мультиплет), 2,76 (1H, триплет, J = 8,8 Гц), 3,75 (1H, дублет, J = 14,6 Гц), 4,17 (1H, дублет, J = 17,1 Гц), 4,95 (1H, дублет, J = 17,1 Гц), 5,48 (1H, дублет, J = 14,6 Гц), 5,85 (1H, синглет), 7,10 - 7,40 (11H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2329, 2943, 2911, 1706, 1673, 1631, 1422, 1280, 1206, 1190, 701.
Пример 26. Пивалоилоксиметил-17β-[N-(1-(4-метоксифенил)-1- метилэтил)-карбамоил]антроста-3,5-диен-3-карбоксилат (соединение N 145).
Прибавляют при охлаждении льдом 1 мл пивалоилоксиметилиодида к 15 мл диметилацетамидного раствора, содержащего 196 мг 17β -[N-(1-(4-метоксифенил)-1-метилэтил)карбамоил] антроста-3,5-диен-3- карбоксилата натрия (полученного при взаимодействии соединения, описанного в примере 2, с гидроксидом натрия по обычному процессу солеобразования). Полученный раствор затем перемешивают 1 ч, после чего разбавляют этилацетатом, промывают водой и сушат над безводным сульфатом натрия. Потом удаляют растворитель выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с силикагелем, используя метод градиентной элюции растворами, содержащими от 1 до 3% по объему ацетона в метиленхлориде, в качестве элюента, получают 157 мг целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,93 (3H, синглет), 1,15 (3H, синглет), 1,71 (3H, синглет), 1,72 (3H, синглет), 3,81 (3H, синглет), 5,51 (1H, синглет), 5,7-6,1 (3H, мультиплет), 6,87 (2H, дублет, J = 8,8 Гц), 7,12 (1H, синглет), 7,34 (2H, дублет, J = 8,8 Гц).
Пример 27. Метил-17β-[N-(дифенилметил(карбамоил]антроста-3,5- диен-3-карбоксилат.
Прибавляют 2 мл метанола, 0,13 мл триэтиламина и 110 мг бис(трифенилфосфин)палладий (II) ацетата к 8 мл диметилформамидного раствора, содержащего 300 мг 17β-(N-дифенилметилкарбамоил)андроста-3,5-диен-3-трифторметансульфоната (полученного, как описано в приготовлении 5). Реакционную смесь затем перемешивают при комнатной температуре в токе монооксида углерода в течение 4 ч, после чего ее разбавляют диэтиловым эфиром, промывают водой, водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия в этом порядке, сушат над безводным сульфатом натрия. Затем его концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с силикагелем (20 г), используя метод градиентной элюции смесями ацетона и метиленхлорида в соотношении от 1:99 до 3: 97 по объему в качестве элюента, получают 214 мг целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,90 (3H, синглет), 0,81-2,56 (18H, мультиплет), 3,74 (3H, синглет), 5,79 (1H, синглет), 5,91 (1H, дублет, J = 7,9 Гц), 6,29 (1H, дублет, J = 7,9 Гц), 7,03 (1H, синглет), 7,22 - 7,40 - (10H, мультиплет).
Пример 28. 17β -[N-(дифенилметил)карбамоил]андроста-3,5-диен- 3-карбоновая кислота (соединение N 2).
Прибавляют 10 мл воды и 1 г гидроксида калия к раствору 25 мл метанола, содержащего 214 мг метил-17β-(N-дифенилметилкарбамоил)антроста-3,5-диен-3-карбоксилата (полученного по методике примера 27). Затем реакционную смесь 4 ч кипятят с обратным холодильником. По окончании этого времени удаляют метанол из реакционной смеси отгонкой при пониженном давлении. После чего смесь подкисляют добавлением 1н. водной соляной кислоты и экстрагируют три раза метиленхлоридом. Объединенные органические экстракты промывают водой и насыщенным водным раствором хлористого натрия в этом порядке, сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с 20 г силикагеля, используя метод градиентной элюции, в качестве элюента используют смеси ацетона и метиленхлорида в соотношениях от 2:98 до 50:50 по объему, получают 110 мг целевого соединения.
ЯМР-спектр и ИК-спектр были идентичными тем же данным, полученным для соединения, описанного в примере 1(d).
Пример 29. 17β-[N-(дифенилметил)карбамоил] антроста-3,5-диен-3- карбоновая кислота (соединение N 2).
Прибавляют 1 мл триэтиламина, 0,5 мл муравьиной кислоты и 110 мг бис-(трифенилфосфин)палладий (II) ацетата к 10 мл диметилформамидного раствора, содержащего 300 мг 17β-(N-дифенилметилкарбамоил)антроста-3,5-диен-3-трифторметансульфоната (полученного, как описано в приготовлении 5). Реакционную смесь затем перемешивают 4 ч при комнатной температуре в токе монооксида углерода. В конце этого времени к реакционной смеси прибавляют 30 мл воды и перемешивают 1 ч при комнатной температуре, реакционную смесь подкисляют добавлением 1н. соляной кислоты. Затем ее экстрагируют три раза метиленхлоридом. Объединенные органические экстракты промывают водой и насыщенным водным раствором хлористого натрия в таком порядке, сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке, содержащей 20 г силикагеля, используя метод градиентной элюции смесями ацетона и метиленхлорида в отношениях от 2:98 до 50:50 по объему в качестве элюента, получают 161 мг целевого соединения.
Данные спектров ЯМР и ИК являются идентичными тем, что получены для соединения, описанного в примере 1d.
Пример 30. 17β-[N-(2-метоксифенил-1-метилэтил)карбамоил] андроста-3,5-диен-3-карбоновая кислота (соединение N 168).
Работают по методике, описанной в приготовлении 7, но используя в качестве исходного материала N-[1-(3-метоксифенил)-1-метилэтил]-3-формиландроста-3,5-диен-17β-карбоксамид (полученный, как описано в приготовлении 8), в относительном количестве, подобном тому, что использовано в этом приготовлении, получают целевое соединение с выходом 37%.
Данные ЯМР- и ИК-спектров являются идентичными тем, что получены для соединения примера 8.
Пример 31. 17β -[N-(1-(3-диметоксифенил)-1-метилэтил)карбамоил] андроста-3,5-диен-3-карбоновая кислота (соединение N 166).
Работают по методике приготовления 7, но используя в качестве исходного соединения N-[1-(3-метоксифенил)-1-метилэтил]-3-формиландроста-3,5-диен- 17β карбоксамид (полученный по методике приготовления 9), в относительном количестве, подобном тому, что использовано в этом приготовлении, получают целевое соединение с выходом 54%.
Данные ЯМР- и ИК-спектров являются идентичными тем, что получены для соединения, описанного в примере 9.
Приготовление 1. N-трет-бутил-3-оксо-4-андростен-17β-карбоксамид.
Работают по методике примера 2 (b), но используя в качестве исходного материала 9,77 г S-2-пиридил-3-оксо-4-андростен-17β-тиокарбоксилата (полученного по методике примера 2 (a)) и 14 мл трет-бутиламина, получают 8,9 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,74 (3H, синглет), 1,21 (3H, синглет), 1,37 (9H, синглет), 5,11 (1H, широкий синглет), 5,74 (1H, синглет).
ИК-спектр (KBr) λмакс см-1: 3450, 2965, 1674, 1501.
Приготовление 2. N-трет-бутил-3-цианоандроста-3,2-диен-17β-карбоксамид.
Работают по методике примера 2 (c), но исходя из 100 мг N-трет-бутил-3-оксо-4-андростен-17β-карбоксамида (полученного в приготовление 1), 0,2 мл диэтилцианофосфата и 200 мг комплекса трехфтористый бордиэтиловый эфир, получают 86 мг целевого соединения в виде кристаллического вещества, т. пл. 198 - 200oC.
ЯМР-спектр (CDCl3) δ ппм: 0,74 (3H, синглет), 0,93 (H, синглет), 1,38 (9H, синглет), 5,08 (1H, широкий синглет), 5,79 (1H, широкий синглет), 6,55 (1H, синглет).
ИК-спектр (KBr) λмакс см-1: 3421, 2967, 2206, 1669, 1499.
Приготовление 3. 17β-(N-трет-бутилкарбамоил)андроста-3,5-диен-3-карбоновая кислота.
Работа по методике примера 2 (d), но исходя из 250 мг N-трет-бутил-3-цианоандроста-3,5-диен-17β-карбоксамида (полученного по методике приготовления 2), получают 225 мг целевого соединения.
Данные ЯМР- и ИК-спектров являются идентичными тем, что были получены для соединения 7.
Приготовление 4. 17β-[N-(дифенилметилкарбамоил)андроста-4-ен-3-он.
Работают по методике примера 2 (b), но исходя из S-2-пиридил-3-оксо-4-андростен-17β-тиокарбоксилата (полученного по методике примера 2 (a)) и бензгидриламина в качестве исходного материала, в относительных пропорциях, подобных тем, что были использованы в этом примере, получают целевое соединение с выходом 85%.
ЯМР-спектр (CDCl3) δ ппм: 0,73 (3H, синглет), 0,90 - 2,53 (20H, мультиплет), 1,19 (3H, синглет), 5,74 (1H, синглет), 5,92 (1H, дублет, J=7,9 Гц), 6,30 (1H, дублет, J=7,9 Гц), 7,22 - 7,34 (10H, мультиплет).
Приготовление 5. 17β-(N-диметилфенилкарбамоил)андроста-3,5-диен-3-трифторметансульфонат.
Прибавляют 0,6 г 2,6-ди-трет-бутил-4-метилпиридин к 40 мл сухого метилхлоридного раствора, содержащего 1,0 г 17β-(N-дифенилметилкарбамоил)андроста-4-ен-3-она (полученного по методике приготовления 4), а затем 0,45 мл ангидрида трифторметансульфоновой кислоты постепенно прибавляют при 0oC в токе азота. Затем реакционную смесь перемешивают 30 мин при 0oC, после чего разбавляют диэтиловым эфиром, промывают водным раствором хлористого натрия, в таком порядке, сушат над безводным сульфатом натрия и концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с силикагелем, используя 55 г силикагеля и метод градиентной элюции смесями ацетона и метиленхлорида в соотношениях от 1 : 99 до 3 : 97 по объему в качестве элюента, получают 1,1 г целевого продукта.
ЯМР-спектр (CDCl3) δ ппм: 0,71 (3H, синглет), 0,96 (3H, синглет), 0,86 - 2,58 (18H, мультиплет), 5,57 (1H, дублет, J=3,3 Гц), 5,90 (1H, дублет, J=7,9 Гц), 5,98 (1H, синглет), 6,29 (1H, дублет, J=7,9 Гц), 7,22 - 7,36 (10H, мультиплет).
Приготовление 6. N-трет-бутил-3-формиландроста-3,5-диен-17β-карбоксамид.
Прибавляют 2 мл 1 М раствора диизобутилалюминийгидрида в толуоле при 0oC к 10 мл сухого толуольного раствора, содержащего 380 мг N-трет-бутил-3-цианоандроста-3,5-диен-17β-карбоксамида (полученного в приготовлении 2). Реакционную смесь затем перемешивают при 0oC в течение 30 мин, после чего прибавляют к смеси 30 мл водного раствора 1,5 г винной кислоты. Реакционную смесь затем перемешивают 2 ч при комнатной температуре, потом три раза экстрагируют метиленхлоридом. Объединенные органические экстракты промывают водой и насыщенным водным раствором хлористого натрия в таком порядке. Потом их сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с 50 г силикагеля, используя метод градиентной элюции смесями ацетона и метиленхлорида в соотношении от 1:99 до 4:96 по объему в качестве элюента, получают 325 мг целевого соединения.
ЯМР-спектр (CDCl3 δ ппм: 0,73 (3H, синглет), 0,92 (3H, синглет), 1,05-2,60 (18H, мультиплет), 1,36 (9H, синглет), 5,09 (1H, широкий синглет), 5,98 (1H, триплет, J=3,0 Гц), 6,78 (1H, дублет, J=2,0 Гц), 9,47 (1H, синглет).
ИК-спектр (KBr λмакс см-1: 2964, 2943, 2905, 1672, 1631, 1501, 1451, 1385, 1252, 1220, 1171, 716, 646.
Приготовление 7. 17β-(N-трет-бутилкарбамоил)андроста-3,5-диен-3-карбоновая кислота.
Прибавляют 600 мг дигидрата фосфата натрия и 1,2 г хлорида натрия в таком порядке при комнатной температуре к смеси 7,5 мл трет-бутанола, 2,0 мл воды и 1 мл 2-метил-2-бутена, содержащей 400 мг N-трет-бутил-3-формиландроста-3,5-диен-17β-карбоксамида (полученного по методике приготовления 6). Затем реакционную смесь перемешивают 15 мин. По окончании этого времени реакционную смесь закаливают, выливая в охлажденный льдом водный раствор тиосульфата натрия, затем ее подкисляют добавлением 1н. водной соляной кислоты и экстрагируют три раза этилацетатом. Объединенные органические экстракты промывают водой и насыщенным водным раствором хлористого натрия, сушат над сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток кристаллизуют при добавлении диэтилового эфира, получают 225 мг целевого соединения.
ЯМР-спектр (CLCl3 δ ппм: 0,73 (3H, синглет), 0,91 (3H, синглет), 1,05-2,55 (18H, мультиплет), 1,35 (9H, синглет), 5,09 (1H, широкий синглет), 5,86 (1H, синглет), 7,14 (1H, синглет).
ИК-спектр (KBr) λмакс см-1: 2964, 2939, 2910, 1671, 1633, 1612, 1505, 1450, 1420, 1364, 1278, 122, 1190, 926, 640.
Приготовление 8. N-[1-(2-метоксифенил)-1-метилэтил]-3-формиландроста-3,5-диен-17β-карбоксамид.
Работают по методике приготовления 6, но используя в качестве исходного материала N-[1-(2-метоксифенил)-1-метилэтил] -3-цианоандроста-3,5-диен-17β-карбоксамид (полученный по методике примера 8(a)), в относительном количестве, подобном тому, тому, что использовано в этом приготовлении, целевое соединение получают с выходом 74%.
ЯМР-спектр (CDCl3) δ ппм: 0,67 (3H, синглет), 0,92 (3H, синглет), 1,04-2,54 (18H, мультиплет), 1,77 (3H, синглет), 1,81 (3H, синглет), 3,83 (3H, синглет), 5,94 (1H, синглет), 5,98 (1H, триплет, J=3,0 Гц), 6,78 (1H, синглет), 6,88-6,97 (2H, мультиплет), 7,21-7,26 (1H, мультиплет), 7,40 (1H, дублет дублетов, J= 8,0 и 1,0 Гц), 9,47 (1H, синглет).
Приготовление 9. N-[1-(3-метоксифенил)-1-метилэтил]-3-формиландроста-3,5-диен-17β-карбоксамид.
Работают по методике приготовления 6, но исходя из N-[1-(-метоксифенил)-1-метилэтил] -3-цианоандроста-3,5-диен-17β-карбоксамида (полученного по методике примера 9(a)) в качестве исходного материала в относительном количестве, подобном тому, что использовано в этом приготовлении, получают целевое соединение с выходом 95%.
ЯМР-спектр (CDCl3) δ ппм: 1,73 (3H, синглет), 0,93 (3H, синглет), 1,00-2,56 (18H, мультиплет), 1,70 (3H, синглет), 1,72 (3H, синглет), 3,80 (3H, синглет), 5,53 (1H, синглет), 5,97 (1H,синглет), 6,76-6,84 (2H, мультиплет), 6,96-7,01 (2H, мультиплет), 7,22-7,28 (1H, мультиплет), 9,47 (1H, синглет).
Приготовление 10а. 1-[4-Метоксифенил]-1-метилэтиламин.
10(a). (i)1-(4-метоксифенил)-1-метилэтилазид.
Раствор, содержащий 25 г метил-4-метоксибензоата в 100 мл сухого тетрагидрофурана, прибавляют по каплям при охлаждении льдом к 300 мл 1н, раствора метилмагнийбромида в тетрагидрофуране. Реакционную смесь затем перемешивают 30 мин при комнатной температуре. В конце этого времени прибавляют водный раствор хлористого аммония к реакционной смеси, которую затем перемешивают 10 мин и три раза экстрагируют диэтиловым эфиром. Органический экстракт промывают водой и насыщенным водным раствором хлористого натрия в этом порядке, после чего сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток растворяют в смеси 200 мл хлороформа и 100 мл ацетона, прибавляют 20 г азида натрия к этому раствору, а затем 60 мл трифторуксусной кислоты и 100 мл хлороформа прибавляют по каплям при охлаждении льдом и перемешивании к этому раствору. Смесь 2 ч перемешивают при комнатной температуре, после чего оставляют стоять при комнатной температуре. Затем к смеси прибавляют воду и нейтрализуют смесь добавлением карбоната калия. Затем смесь экстрагируют три раза метиленхлоридом. Объединенные органические экстракты промывают водой и насыщенным водным раствором хлористого натрия в этом порядке, сушат над сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с 300 г силикагеля и используют метод градиентной элюции смесями диэтилового эфира и гексана в соотношении от 1:99 до 4:96 по объему в качестве элюента, получают 21,0 г (выход 73,8%) целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 1,61 (6H, синглет), 3,81 (3H, синглет), 6,89 (2H, дуплет, J=9 Гц), 7,36 (2H, дублет. J=9 Гц).
10(a). /ii/ 1-(4-Метоксифенил)-1-метилэтиламин.
Прибавляют 1,58 г оксида платины к раствору 21,0 г 1-(4-метоксифенил)-1-метилэтилоазида (полученного, как описано в стадии (a)) в 100 мл метанола. Реакционную смесь затем перемешивают 5 ч в токе водорода. По окончании этого времени смесь фильтруют, разбавляют метиленхлоридом и промывают водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлористого натрия в этом порядке. Затем ее сушат безводным сульфатом магния и концентрируют выпариванием при пониженном давлении, получают 17,2 г (выход 95%) целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 1,49 (6H, синглет), 1,89 (2H, синглет), 3,80 (3H, синглет), 6,86 (2H, дублет J=9 Гц), 7,43 (2H, дуплет, J=9 Гц).
ИК-спектр (KBr) λмакс см-1 : 2963, 2936, 1611, 1513, 1288, 1248, 1183, 1035, 831.
Приготовление 10b. 1-(3-Метоксифенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используя метил-3-метоксибензоат в качестве исходного материала в относительном количестве, подобном тому, что используют в этом приготовлении, получают целевое соединение с выходом 31%.
ЯМР-спектр (CDCl3) δ ппм: 1,49 (6H, синглет), 1,81 (2H, широкий синглет), 3,82 (3H, синглет), 6,74-6,79 (1H, мультиплет), 7,06-7,10 (2H, мультиплет), 7,22-7,29 (1H, мультиплет).
ИК-спектр (жидкая пленка) λмакс см-1: 2964, 1602, 1582, 1487, 1430, 1289, 1250, 1048, 872, 782, 702.
Приготовление 10c. 1-(Метоксифенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используя метил-2-метоксибензоат в качестве исходного материала в относительном количестве, подобном тому, что было использовано в этом приготовлении, получают целевое соединение с выходом 81%.
ЯМР-спектр (CDCl3) δ ппм: 1,53 (6H, синглет), 2,06 (2 H, широкий синглет), 3,88 (3H, синглет), 6,89-6,93 (2H, мультиплет), 7,19-7,24 (1H, мультиплет), 7,32-7,35 (1H, мультиплет).
ИК-спектр (жидкая пленка) λмакс см-1: 2965, 1597, 1581, 1489, 1464, 1436, 1236, 1028, 754.
Приготовление 10d. 1-(3,5-Диметоксифенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используют в качестве исходного материала метил-3,5-диметоксибензоат в относительном количестве, подобном тому, что использовано в этом приготовлении, получают целевое соединение с выходом 75%.
ЯМР-спектр (CDCl3) δ ппм: 1,48 (6H, синглет), 1,81 (2H, широкий синглет), 3,80 (6H, синглет), 6,34 (1H, триплет, J=2 Гц), 6,66 (2H, дуплет, J=2 Гц).
ИК-спектр (жидкая пленка) λмакс см-1: 2964, 1596, 1457, 1423, 1204, 1154, 1053, 854, 699.
Приготовление 10a. 1-(3,4-Диметоксифенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используя в качестве исходного материала метил-3,4-диметоксибензоат в относительном количестве, подобном тому, что использовано в этом приготовлении, выход целевого продукта 61%.
ЯМР-спектр (CDCl3) δ ппм: 1,49 (6H, синглет), 1,73 (2H, широкий синглет), 3,87 (3H, синглет), 3,91 (3H, синглет), 6,82 (1H, дублет, J=8 Гц), 7,01 (1H, дублет дублетов, J=2 и 8 Гц), 7,10 (1H, дублет, J=2 Гц).
ИК-спектр (жидкая пленка λмакс см-1: 2963, 1604, 1519, 1258, 1147, 1028, 766, 649.
Приготовление 10f. 1-(4-Фторфенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используя в качестве исходного продукта метил-4-фторбензоат в относительном количестве, подобном тому, что было использовано в этом приготовлении, получают целевое соединение с выходом 20%.
ЯМР-спектр (CDCl3) δ ппм: 1,48 (6H, синглет), 1,63 (2H, широкий синглет), 6,96-7,03 (2H, мультиплет), 7,44-7,50 (2Н, мультиплет).
ИК-спектр (жидкая пленка) λмакс см-1: 2967, 1601, 1509, 1228, 1162, 835, 809, 551.
Приготовление 10g. 1-(4-Этоксифенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используют в качестве исходного материала метил-4-этоксибензоат в относительном количестве, подобном тому, что было использовано в этом приготовлении, получают целевое соединение с выходом 60%.
ЯМР-спектр (CDCl3) δ ппм: 1,40 (3H, триплет, J=7 Гц), 1,48 (6H, синглет), 1,68 (2H, широкий синглет), 4,02 (2H, квартет, J=7 Гц), 6,82-6,88 (2 H, мультиплет), 7,37-7,43 (2H, мультиплет).
ИК-спектр (жидкая пленка) λмакс см-1: 2977, 1609, 1512, 1245, 1183, 1048, 834, 560.
Приготовление 10h. 1-(4-Метилфенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используя в качестве исходного материала метил-4-метилбензоат в относительном количестве, подобном тому, что использовали в этом приготовлении, получают целевое соединение с выходом 34%.
ЯМР-спектр (CDCl3) δ ппм: 1,48 (6H, синглет), 1,62 (2H, широкий синглет), 2,33 (3H, синглет), 7,14 (2H, дублет, J=9 Гц), 7,39 (2H=9 Гц).
ИК-спектр (жидкая пленка) λмакс см-1: 2965, 1587, 1514, 1360, 1189, 1115, 1020, 817, 722, 552.
Приготовление 10. 1-(4-N, N-Деметиламинофенил)-1-метилэтиламин.
Работают по методике приготовления 10a, но используя в качестве исходного материала метил-4-N, N-диметиламинобензоат в относительном количестве, подобном тому, что использовали в этом приготовлении, получают целевое соединение с выходом 48%.
ЯМР-спектр (CDCl3) δ ппм: 1,48 (6H, синглет), 1,70 (2H, широкий синглет), 2,95 (6H, синглет), 6,65-6,80 (2H, мультиплет), 7,30 (2H, дублет, J=9 Гц).
ИК-спектр (жидкая пленка) λмакс см-1: 2960, 1615, 1525, 815.
Приготовление 11a. 1-Метил-1-(2-тиенил)этиламин.
11(a). (i) Метил-2-метил-2-(2-тиенил)пропионат.
Промывают гексаном 9,2 г гидрида натрия (в виде 55 мас.% ч. дисперсии в минеральном масле) и смешивают со 140 мл сухого диметилформамида. Затем по каплям прибавляют 30 мл раствора 15 г метил-2-тиофенацитата в диметилформамиде при охлаждении льдом этой смеси. Полученную смесь перемешивают 30 мин при комнатной температуре и охлаждают. Постепенно по каплям прибавляют 18 мл метилиодида и перемешивают смесь всю ночь при комнатной температуре. Затем выливают в лед-воду и экстрагируют три раза диэтиловым эфиром. Объединенные органические экстракты промывают водой и насыщенным водным раствором хлористого натрия в этом порядке, сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении, получают 17,5 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 3,68 (3H, синглет), 6,93 - 6,95 (2H, мультиплет), 7,18 - 7,21 (1H, мультиплет).
11(a). (ii) 2-Метил-2-(2-тиенил)пропионовая кислота.
Раствор, содержащий 17,5 г метил-2-метил-2-(2-тиенил)пропионата (полученного), как описано на стадии (i), 12,6 г гидроксида калия, 72 мл воды и 168 мл 1,4-диоксана кипятят с обратным холодильником в течение 2 ч. По окончании этого времени его разбавляют льдом-водой и экстрагируют дважды диэтиловым эфиром. Водный слой делают слабокислым pH, экстрагируют три раза диэтиловым эфиром, промывают водой и насыщенным раствором водным хлористого натрия в этом порядке, сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении, получают 15,8 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 1,68 (6H, синглет), 6,93 - 7,02 (2H, мультиплет), 7,19 - 7,23 (1H, мультиплет).
11(a). (iii) 2-Метил-2-(2-тиенил)пропионилазид.
Постепенно прибавляют 10,6 мл этилхлоркарбоната, поддерживая температуру ниже 0oC к раствору 15,8 г 2-метил-2-(2-тиенил)-пропионовой кислоты (полученной на стадии (ii) и 15,6 мл триэтиламина в 210 мл ацетона. Реакционную смесь перемешивают 2 ч при 0oC, после чего прибавляют 110 мл водного раствора, содержащего 10,3 г азида натрия, к смеси при 0oC. Реакционную смесь затем перемешивают 2 ч при 0oC, разбавляют водой и три раза экстрагируют диэтиловым эфиром. Объединенные органические экстракты промывают 1 н. соляной кислотой, водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия в этом порядке, после чего сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении, получают 18,5 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 1,66 (6H, синглет), 6,91 - 7,00 (2H, мультиплет), 7,18 - 7,25 (1H, мультиплет).
11(a). (iv) 1-Метил-1-(2-тиенил)этиламин.
Раствор 370 мл сухого бензола и 18,5 г 2-метил-2-(2-тиенил)-пропионилазида (полученного на стадии (iii) кипятят с обратным холодильником 4 ч. По окончании этого времени удаляют растворитель из реакционной среды до конечного объема 270 мл выпариванием при пониженном давлении. Затем к оставшемуся раствору прибавляют 97 мл концентрированной водной соляной кислоты при охлаждении льдом и реакционную смесь 5 ч перемешивают при комнатной температуре. По окончании этого времени ее разбавляют водой и дважды экстрагируют диэтиловым эфиром. Устанавливают pH оставшегося водного слоя до щелочного pH добавлением водного раствора гидроксида калия. Затем три раза экстрагируют диэтиловым эфиром, промывают насыщенным водным раствором хлористого натрия, сушат при прониженном давлении, получают 8,4 г целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 1,57 (6H, синглет), 1,76 (2H, широкий синглет), 6,89 - 6,94 (2H, мультиплет), 7,13 - 7,16 (1H, мультиплет).
ИК-спектр (жидкая пленка) λмакс см-1: 2966, 1589, 1465, 1362, 1241, 852, 826, 697.
Приготовление 11b. 1-Метил-1-(3-тиенил)этиламин.
Работают по методике приготовления 11a, но используя в качестве исходного материала метил-3-тиенилацетат, в относительном количестве, подобном тому, что было использовано в этом приготовлении, получают целевое соединение с выходом 32%.
ЯМР-спектр (CDCl3) δ ппм: 1,48 (6H, синглет), 1,61 (2H, синглет), 7,09 - 7,14 (1H, мультиплет), 7,25 - 7,29 (2H, мультиплет).
ИК-спектр (CDCl3) λмакс см-1: 3350, 2260, 2940, 1580.
Приготовление 11c. α,α-диметилфурфуриламин.
Работают по методике приготовления 11a, но используя в качестве исходного материала этил-1-(2-фурил)пропионат в относительном количестве, подобно тому, что было использовано в этом приготовлении, получают целевое соединение с выходом 40%.
ЯМР-спектр (CDCl3) δ ппм: 1,46 (6H, синглет), 1,66 (2H, синглет), 6,05 - 6,07 (1H, мультиплет), 6,26 - 6,29 (1H, мультиплет), 7,31 - 7,33 (1H, мультиплет).
ИК-сепктр (CDCl3) λмакс см-1: 3300, 2960, 1710, 1590.
Приготовление 12. 4,4-Дифторбензгидриламин.
Прибавление 57,04 г ацетата аммония и 12,69 г цианборгидрида натрия к раствору 15,68 г 4-фторбензофеноноксима в 315 мг метанола. Смесь перемешивают при комнатной температуре и затем прибавляют по каплям 135 мл, 17 - 19% объем, водного раствора треххлористого титана в течение 4 ч 50 мин. Реакционную смесь перемешивают 1,5 ч, разбавляют водой и экстрагируют метиленхлоридом. В этой точке отфильтровывают осадок, используя целит (торговое название) как фильтрующую добавку. Фильтрат сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с силикагелем, используя метод градиентной элюции растворами ацетона в метиленхлориде в пропорции от 2 - 5 об.% в качестве элюента, получают 11,66 г (выход 79%) целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 5,11 (1H, синглет), 6,92 (4H, мультиплет), 7,25 (4H, мультиплет).
ИК-спектр (жидкая пленка) λмакс см-1: 1602, 1506, 1223, 1155.
Масс-спектр (M/Z): 219 (M+), 203, 201, 138, 123.
Приготовление 13. 4-Оксибензгидриламин.
Повторяют процедуру, подобную той, что описана в приготовлении 12, но используя 36 мл метанольного раствора, содержащего 4,28 г 4-оксибензофенонаксима, 17,03 г ацетата аммония, 3,79 г цианоборгидрида натрия и 40,1 мл 17 - 19 об.% водного раствора треххлористого титана, и используют разбавленный водный раствор бикарбоната натрия вместо водного раствора гидроксида натрия, в качестве экстрагирующего растворителя используют этилацетат. Полученный остаток хроматографируют на колонке с силикагелем и элюируют 80 об.% раствором этилацетата в гексане, самим этилацетатом, и 3 об.% раствором метанола в этилацетате, получают 2,74 г целевого соединения в виде кристаллов, т. пл. 113 - 115oC (после перекристаллизации из метиленхлорида).
ЯМР-спектр (гексадейтерированный диметилсульфоксид), δ ппм: 5,0 (1H, синглет), 6,68 (2H, дублет, J = 9 Гц), 7,1 - 7,5 (7H, мультиплет).
ИК-спектр (Нуйол - торговое названием) λмакс см-1: 3336, 2923, 1609, 1591, 1576, 1248.
Элементный анализ:
Вычислено для C13H13NO,%: C 78,36, H 6,58, N 7,03
Найдено,%: C 77,97; H 6,61; N 6,93.
Приготовление 14. 4,4'-Диметоксибензгидриламин.
Работают по методике приготовления 12, но используя 10,7 г 4,4'-диметоксибензофеноноксима, 33,9 г ацетата аммония, 7,46 г цианборгидрида натрия и 79 мг 17 - 19 об.%, водного раствора треххлористого титана, 8,18 г целевого соединения получают в виде маслянистого вещества.
ЯМР-спектр (CDCl3) δ ппм: 3,78 (6H, синглет), 5,09 (1H, синглет), 6,85 (4H, дублет, J = 9 Гц), 7,26 (4H, дублет, J = 9 Гц).
ИК-спектр (жидкая пленка) λмакс см-1: 2953, 2834, 1608, 1583, 1508, 1246.
Масс-спектр (M/Z): 243 (M+), 242, 227
Приготовление 15. 4-Метоксибензгидриламин.
Работают по методике приготовления 12, но используя 9,4 г 4-метоксибензофеноноксима, 33,9 г ацетата аммония, 7,46 г цианборгидрида натрия и 79 мл 17-19 об.%, водного раствора треххлористого титана, 6,78 г целевого соединения получают в виде маслянистого вещества.
ЯМР-спектр (CDCl3) δ ппм: 3,76 (3H, синглет), 5,10 (1H, синглет), 6,84 (2Р, дублет, J = 9 Гц), 7,1-7,5 (7H, мультиплет).
ИК-спектр (жидкая пленка) λмакс см-1: 3025, 2834, 1609, 1584, 1509, 1247.
Масс-спектр (M/Z): 213 (M+), 197, 182, 136.
Приготовление 16а. N-(дифенилметил)-3-цианоандроста-3,5-17β-карбоксамид.
Прибавляют 0,106 мл бензгидриламина к раствору 100 мг 3-цианоандроста-3,5-диен-17β-карбоновой кислоты (полученной, как описано в примере 1 (b)), каталитического количества 4-диметиламинопиридина и 0,131 мл триэтиламина в 4 мл метиленхлорида. Затем делят 88,0 мг тозилхлорида на три части и прибавляют к этой реакционной смеси с интервалом 30 мин при комнатной температуре при перемешивании. Час спустя после окончания прибавления тозилхлорида реакционную смесь разбавляют метиленхлоридом и промывают 1н. водной соляной кислотой, водой, водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия в таком порядке. Затем сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток кристаллизуют из ацетона, получают 138 мг (выход 92%) целевого соединения.
Данные ЯМР- и ИК-спектров являются идентичными тем, что были получены для соединения примера 1(c).
Приготовление 16b. N-трет-бутил-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике приготовления 16a, но используют в качестве исходных материалов 3-цианоандроста-3,5-диен-17β-карбоновую кислоту (полученную, как описано в примере 1(b)) и трет-бутиламин в относительных порциях, подобных тем, что были использованы в этом приготовлении, получают целевое соединение с выходом 81%.
Данные ЯМР- и ИК-спектров являются идентичными тем, что были получены для соединения, полученного в приготовлении 2.
Приготовление 16c. N-[1-(3,5-диметоксифенил)-1-метилэтилен] -3-цианоандроста-3,5-иден-17β-карбоксамид.
Работают по методике приготовления 16а, но используют 3-цианоандроста-3,5-диен-17β-карбоновую кислоту (полученную по методике примера 1(b)) и 1-(3,5-диметоксифенил)-1-метилэтиламин в качестве исходных материалов в относительных пропорциях, подобных тем, что были использованы в этом приготовлении, получают целевое соединение с выходом 98%.
Данные ЯМР- и ИК-спектров являются идентичными тем, что были получены для соединения примера 10(а).
Приготовление 16d. N-[1-(4-метоксифенил)-1-метилэтил]-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике приготовления 16a, но используют в качестве исходных материалов 3-цианоандроста-3,5-диен-17β-карбоновую кислоту (полученную, как описано в примере 1(b)) и 1-(4-метоксифенил)-1-метилэтиламин в относительных пропорциях, подобных тем, что были использованы в этом приготовлении, получают целевое соединение с выходом 93%.
Данные ЯМР- и ИК-спектров являются идентичными тем, что были получены для соединения примера 2(c).
Приготовление 16e. N-(1-метил-1-фенилэтил)-3-цианоандроста-3,5-диен-17β-карбоксамид.
Работают по методике приготовления 16a, но в качестве исходных материалов используют 3-цианоандроста-3,5-диен-17β-карбоновую кислоту (полученную по методике примера 1(b)) и 1-метил-1-фенилэтиламин в относительных пропорциях, подобных тем, что были использованы в приготовлении, получают целевое соединение с выходом 74%.
Данные ЯМР- и ИК-спектров являются идентичными полученным для соединения примера 4(a).
Приготовление 16f. N-[1-(3,5-диметоксифенил)-1-метилэтил]-3- цианоандроста-3,5-диен-17β-карбоксамид.
Готовят реагент Вильсмейера из 1,7 мл диметилформамида, 1,8 мл оксихлорида фосфора и 5 мл метиленхлорида. Затем прибавляют 0,23 мл этого реагента Вильсмейера к раствору 100 мг 3-цианоандроста-3,35-диен-17β-карбоновой кислоты (полученной по методике примера 1(b)) в 2 мл метиленхлорида. Затем реакционную смесь перемешивают при комнатной температуре в течение 40 мин, после чего прибавляют раствор 1-(3,5-диметоксифенил)-1-метилэтиламин (полученный по методике приготовления 10d) и 70 мкл триэтиламина в 2 мл метиленхлорида. Затем реакционную смесь разбавляют этилацетатом, промывают разбавленной соляной кислотой, водным раствором хлористого натрия, 5 мас.% объем водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия в таком порядке. Затем сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток хроматографируют на колонке с силикагелем, используя метод градиентной элюции растворами 1 - 4% по объему ацетона в метиленхлориде в качестве элюента, получают 76 мг (выход 50%) целевого соединения.
Данные ЯМР- и ИК-спектров являются идентичными тем, что были получены для соединения примера 10(a).
Приготовление 17. N-(дифенилметил)андроста-3-ен-3-он-17β-карбоксамид.
Прибавляют 0,108 мл бензгидриламина к раствору 100 г андроста-4-ен-3-он-17β-карбоновой кислоты, каталитического количества 4-диметиламинопиридина и 0,132 мл триэтиламина в 4 мл метиленхлорида. Разделяют на 3 части 0,037 мл метансульфонилхлорида и прибавляют в эту реакционную смесь с интервалами в 30 мин и при комнатной температуре при перемешивании. Час спустя после окончания прибавления метансульфонилхлорида реакционную смесь разбавляют метиленхлоридом, промывают 1н. водной соляной кислотой, водой, водным раствором бикарбоната натрия в таком порядке. Затем ее сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток кристаллизуют из ацетона, получают 113,2 мг (выход 74%) целевого соединения.
ЯМР-спектр (CDCl3) δ ппм: 0,72 (3H, синглет), 0,77 - 2,44 (20H, мультиплет), 1,18 (3H, синглет), 5,73 (3H, синглет), 5,88 (1H, дублет, J = 8 Гц), 6,28 (1H, дублет, J = 8 Гц), 7,21 - 7,36 (10H, мультиплет).
ИК-спектр (KBr) λмакс см-1: 2941, 2875, 1665, 1616, 1518, 1495, 1449, 1230, 699.
Приготовление 18. N-(дифенилметил)андроста-4-ен-3-он-17β-карбоксамид.
Прибавляют 0,108 мл бензгидриламина к раствору 100 мг андроста-3-ен-3-он- 17β -карбоновой кислоты, каталитического количества 4-диметиламинопиридини и 0,132 мл триэтиламина в 4 мл метиленхорида. Разделяют на три части 0,050 мл трифторметансульфонилхлорида и прибавляют к этой реакционной смеси с интервалами в 30 мин при комнатной температуре при перемешивании. Час спустя после окончания прибавления трифторметансульфонилхлорида реакционную смесь разбавляют метиленхлоридом, промывают 1н. водной соляной кислотой, водой, водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия в таком порядке. Затем ее сушат над безводным сульфатом магния и концентрируют выпариванием при пониженном давлении. Полученный остаток кристаллизуют из ацетона, получают 135,2 мг (89%) целевого соединения, имеющего те же свойства, что и продукт приготовления 17.
Приготовление 19. N-(дифенилметил)андроста-4-ен-3-он-17β-карбоксамид.
Прибавляют 0,108 мл бензгидриламина к раствору 100 мг андроста-4-ен-3-он-17β-карбоновой кислоты, каталитического количества 4-диметиламинопиридина и 0,132 мл триэтиламина в 4 мл метиленхлорида. Разделяют на три части 0,060 мл бензолсульфонилхлорида и прибавляют к этой реакционной смеси с интервалами 30 мин при комнатной температуре и перемешивании. Час спустя после окончания прибавления бензолсульфонилхлорида реакционную смесь разбавляют метиленхлоридом, промывают 1 н. водной соляной кислотой, водой, водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия в таком порядке. Затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток кристаллизуют из ацетона, получают 130,1 мг (выход 85%) целевого соединения, имеющего те же самые свойства, что и продукт приготовления 17.2
| название | год | авторы | номер документа |
|---|---|---|---|
| СТЕРОИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1993 |
|
RU2097387C1 |
| ПРОИЗВОДНЫЕ НЕЙРАМИНОВОЙ КИСЛОТЫ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ИЛИ ИХ СЛОЖНЫЕ ЭФИРЫ, А ТАКЖЕ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СИАЛИДАЗУ-ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 1997 |
|
RU2124509C1 |
| 13-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 5-ОКСИМА МИЛБЕМИЦИНА, СОДЕРЖАЩАЯ ИХ АНТИГЕЛЬМИНТНАЯ, АКАРИЦИДНАЯ И ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2128181C1 |
| МОДИФИЦИРОВАННЫЕ ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДЫ, КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2111971C1 |
| АЗАСТЕРОИДНЫЕ СОЕДИНЕНИЯ | 1991 |
|
RU2070204C1 |
| ПРОИЗВОДНЫЕ ОКТАГИДРОНАФТАЛИНОКСИМА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2125043C1 |
| ПРОИЗВОДНЫЕ БИФЕНИЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2109736C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ПРИМЕНИМЫЕ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ ЭФФЕКТОРОВ ПРИ МУСКАРИНОВЫХ РЕЦЕПТОРАХ | 1995 |
|
RU2152385C1 |
| ПРОИЗВОДНЫЕ 1,2-ДИФЕНИЛПИРРОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2125044C1 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
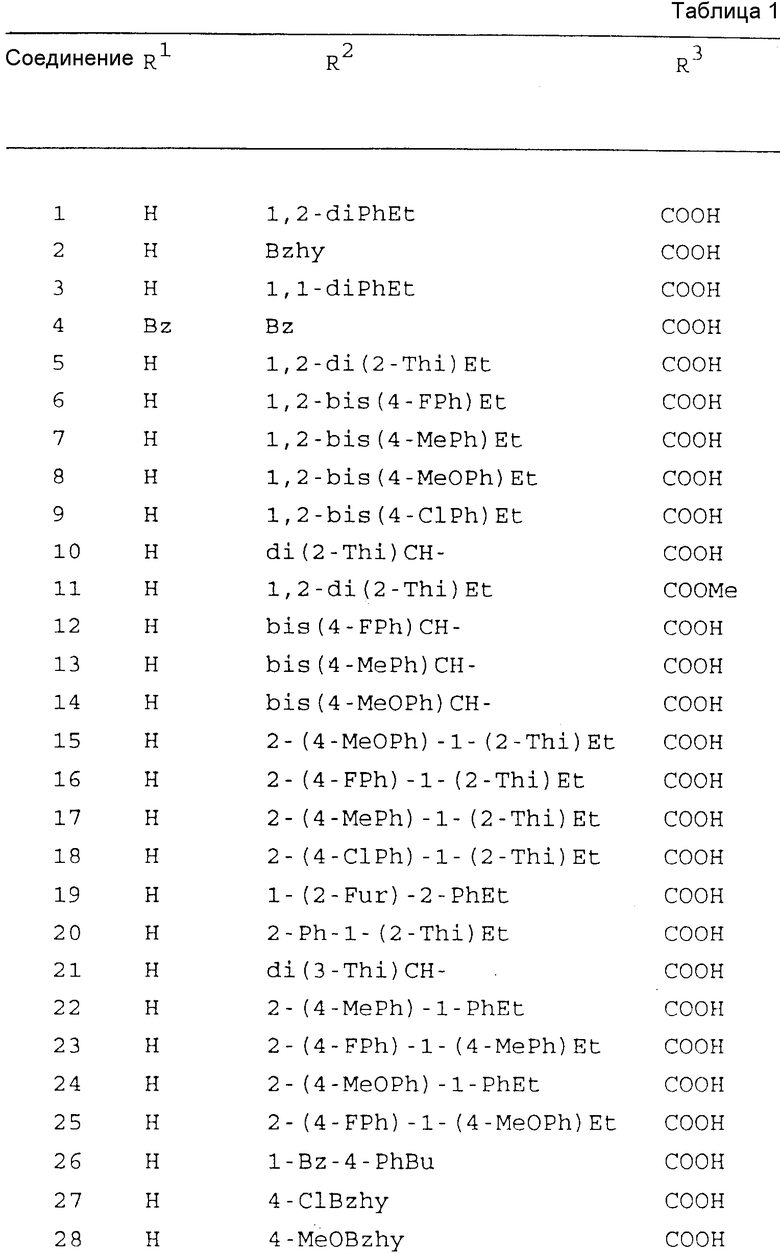


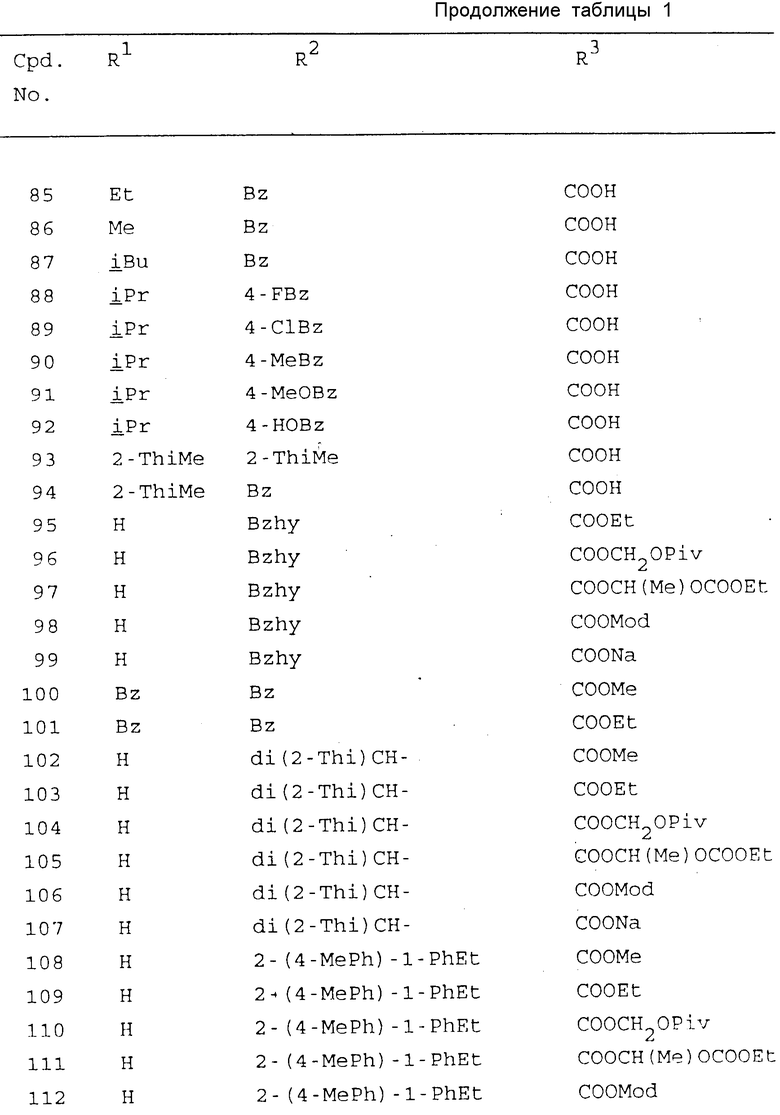
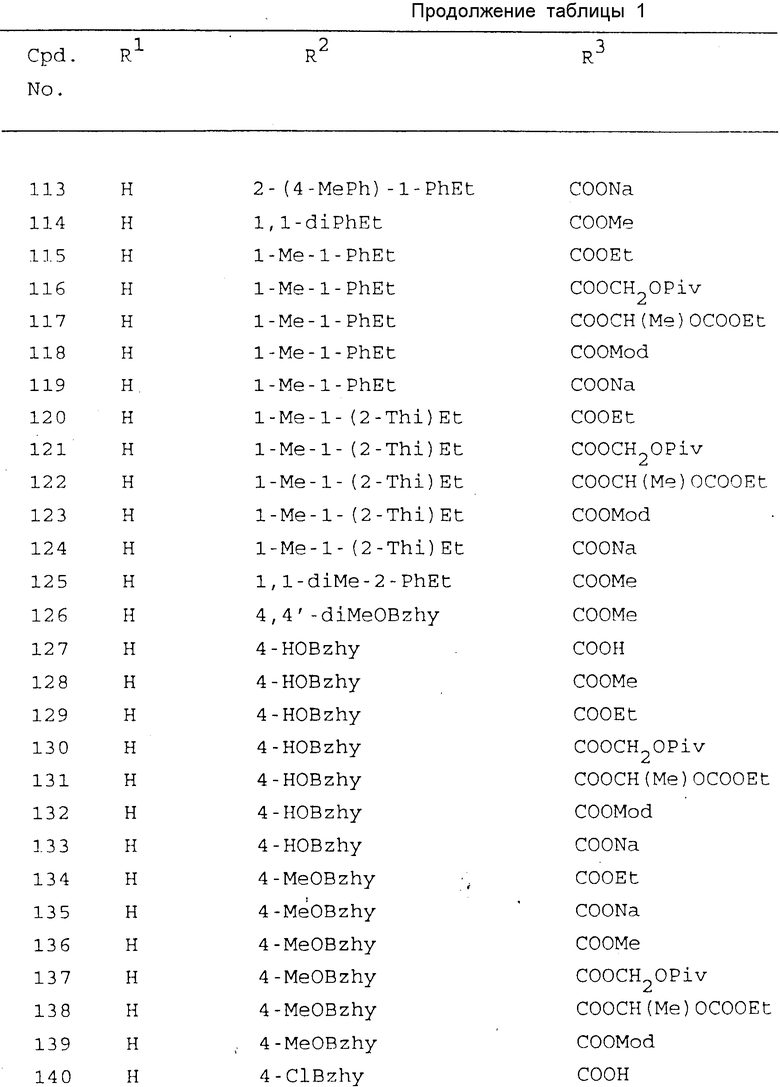




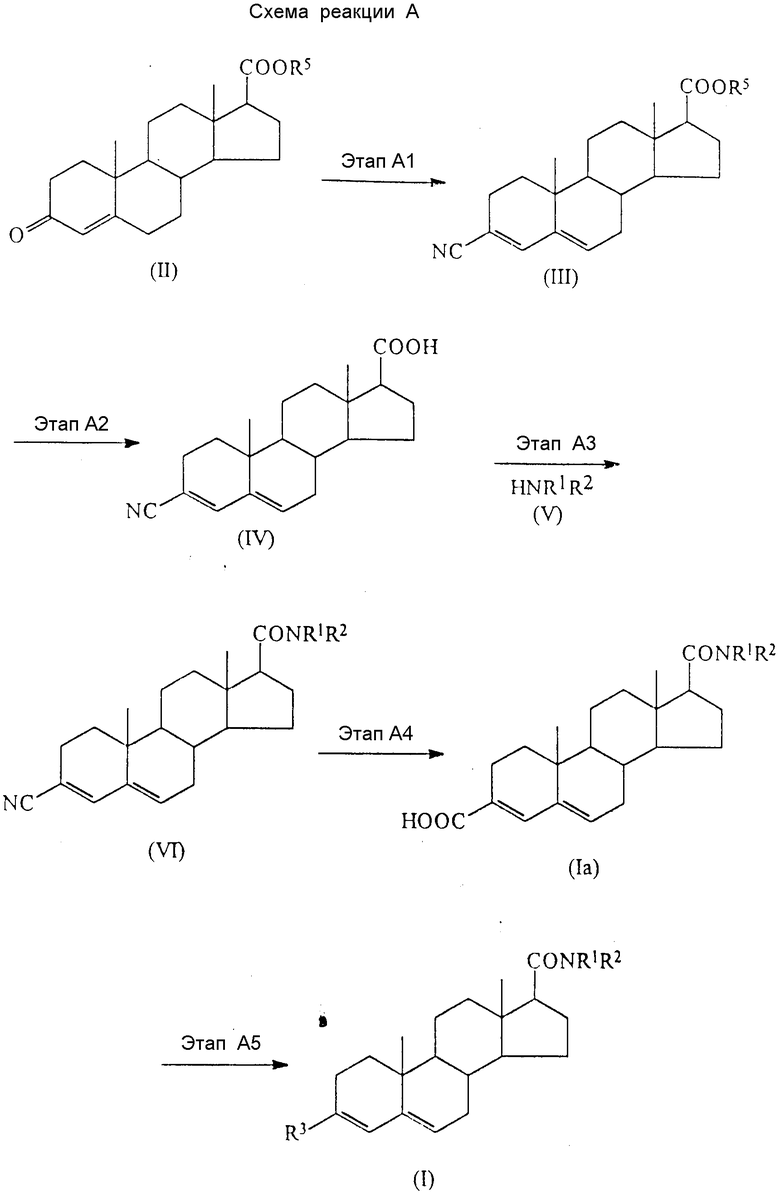
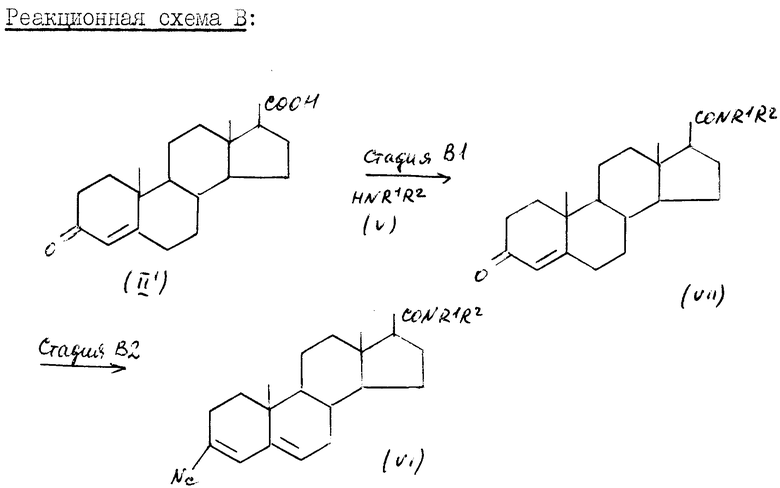
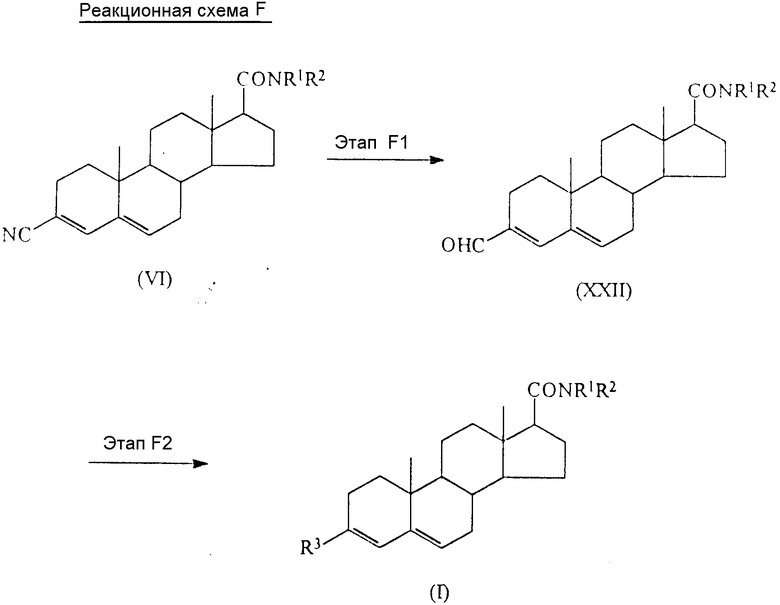
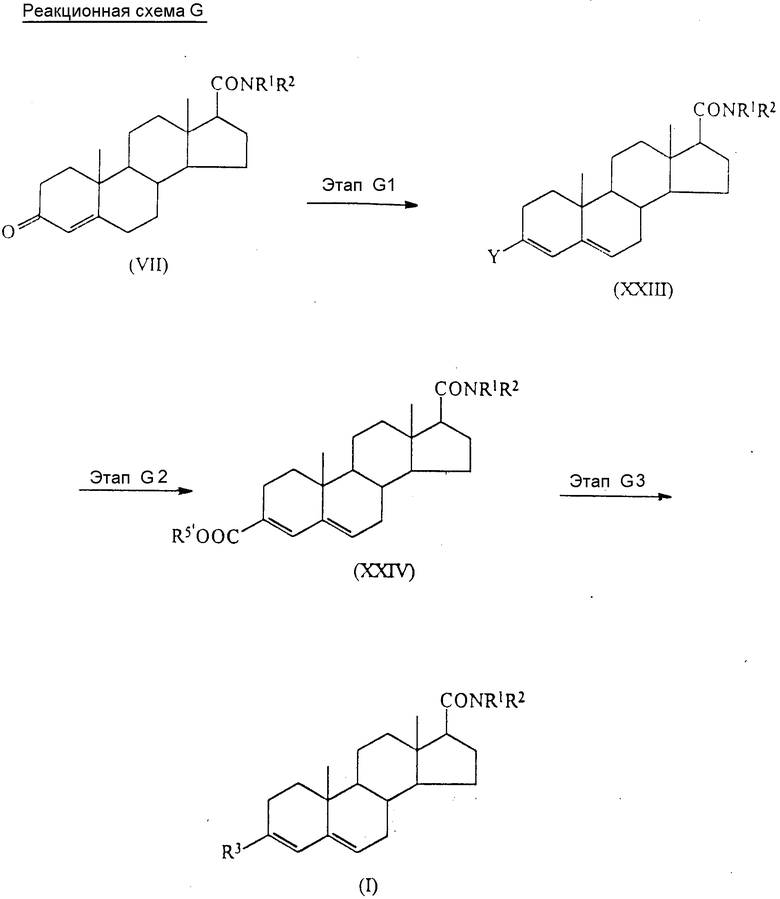
Предложена 3-циано-андроста-3,5-диен-17β-карбоновая кислота формулы (IV), приведенной в описании, используемая в качестве промежуточного продукта при получении соединений общей формулы (I), приведенной в описании, где R1 - водород, C1-C6-алкил, замещенный по меньшей мере одним фенильным радикалом возможно имеющим по меньшей мере один заместитель, выбранный из заместителей А, R2 - замещенный C1-C6-алкил, имеющий по крайней мере один заместитель, выбранный из фенила, фурила, тиенила или дифениламино-групп, при этом фенильная группа может быть замещена, по крайней мере, одним заместителем, выбранным из заместителей A, заместители A выбраны из алкильных C1 - C6-групп, алкокси-C1-C6-групп, гидроксигрупп, атомов галогена или диалкил-C1-C6-аминогрупп, R3-карбоксигруппа, а также его фармацевти приемлемые соли и сложные эфиры, имеющие ценную 5α-редуктазную активность, и которые поэтому могут использовать для для лечения и профилактики, кроме прочих заболеваний, гипертрофии простаты, а также других расстройств, вызываемых повышенными уровнями 5α-дигидротестостерона. 2 с.п.ф-лы, 2 табл.
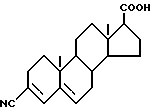
в качестве промежуточного продукта при получении соединений общей формулы I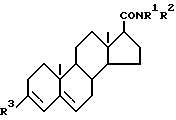
где R1 - атом водорода или C1-C6 - алкил, имеющий по меньшей мере один заместитель, выбранный из фенильных групп, которые являются незамещенными или замещенными по меньшей мере одним заместителем, выбранным из заместителей А, определенных ниже;
R2 - замещенный C1-C6 - алкил, имеющий по меньшей мере один заместитель, выбранный из фенила, фурила, тиенила или дифениламиногрупп, при этом фенильная группа может быть замещена по крайней мере одним заместителем, выбранным из заместителей А, определенных ниже;
R3 - карбоксигруппа,
указанные заместители А выбраны из алкильных C1-C6-групп, алкокси-C1-C6-групп, гидроксигрупп, атомов галогена или диалкил-C1-C6-аминогрупп, или их фармацевтически приемлемых солей или сложных эфиров.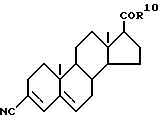
где R10 - гидрокси- или группа OR5, где R5 - карбокси-защитная группа, или группа -NR1R2, где R1 и R2 имеют указанные в п.1 значения, или группа -NRR1, где R и R1 могут быть одинаковыми или различными и каждый представляет водород или C1-C6-алкил, отличающийся тем, что соединение общей формулы III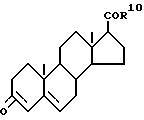
где R10 имеет вышеуказанные значения,
подвергают реакции с диалкил-C1-C6-цианофосфатом или с дифенилцианофосфатом в присутствии цианида щелочного металла и полученный сложный эфир фосфоновой кислоты подвергают взаимодействию с кислотой.
| J | |||
| Med | |||
| Chem | |||
| Способ сопряжения брусьев в срубах | 1921 |
|
SU33A1 |
| Солесос | 1922 |
|
SU29A1 |
Авторы
Даты
1998-07-10—Публикация
1993-04-19—Подача