Данное изобретение относится к ряду новых производных нейраминовой кислоты, которые обладают превосходной ингибирующей активностью по отношению к сиалидазе и которые, поэтому, полезны для лечения и предотвращения гриппа и других вирусных заболеваний, где репликация вируса чувствительна к ингибиторам сиалидазы. Изобретение также обеспечивает способы и композиции с использованием этих соединений для лечения или предотвращения гриппа и сходных вирусных инфекций, а также способы получения этих композиций.
Соединения данного изобретения имеют структуру 2-дезокси-2,3-дидегидро 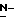 -ацилнейраминовой кислоты. Сиалиловая кислота представляет
-ацилнейраминовой кислоты. Сиалиловая кислота представляет 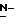 -ацетилнейраминовую кислоту.
-ацетилнейраминовую кислоту.
Вирус гриппа, а также ряд других типов вируса, имеет сиалидазу на поверхности вирусных частиц. Во время репликации таких вирусов, вирус потомства (прогонный вирус) развивается на поверхности инфицированной клетки и затем отделяется от клетки. Вирус потомства связывается с сиаловой кислотой на поверхности клеток посредством гемагглютинина на поверхности вируса потомства. Вирус потомства отделяется от клеток путем разложения сиаловой кислоты сиалидазой на поверхности вируса потомства, после чего он затем заражает другие клетки.
В соответствии с этим, удаление вируса потомства с поверхности инфицированных клеток можно блокировать путем ингибирования активности сиалидазы и, тем самым, можно предотвратить вторичное заражение. Поэтому полагают, что вещества, имеющие способность ингибировать действие сиалидазы, могут быть полезны для лечения или предотвращения гриппа.
Ряд соединений, имеющих ингибирующую сиалидазу активность и главную цепь 2-дезокси-2,3-дидегидро 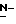 -ацилнейраминовой кислоты, известны из WO 91/16320 [эквивалент публикации патента Японии (Kokoku) N. Hei 5-507068]. Другие такие соединения известны из WO 92/26933.
-ацилнейраминовой кислоты, известны из WO 91/16320 [эквивалент публикации патента Японии (Kokoku) N. Hei 5-507068]. Другие такие соединения известны из WO 92/26933.
Нами обнаружен ряд новых соединений, имеющих главную цепь 2-дезокси-2,3-дидегидро 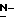 -ацилнейраминовой кислоты, которые имеют превосходную ингибирующую сиалидазу активность, которая существенно больше, чем активность известных до настоящего времени соединений, на которые ссылаются выше и которые, поэтому, могут быть использованы для лечения и предотвращения гриппа и других заболеваний, вызываемых сиалидазунесущими вирусами.
-ацилнейраминовой кислоты, которые имеют превосходную ингибирующую сиалидазу активность, которая существенно больше, чем активность известных до настоящего времени соединений, на которые ссылаются выше и которые, поэтому, могут быть использованы для лечения и предотвращения гриппа и других заболеваний, вызываемых сиалидазунесущими вирусами.
Сущность изобретения
В соответствии с этим, целью данного изобретения является разработка ряда новых соединений, имеющих ингибирующую сиалидазу активность.
Другие цели и преимущества данного изобретения становятся очевидными из следующего ниже описания.
Соединения данного изобретения представляют собой соединения формулы (1):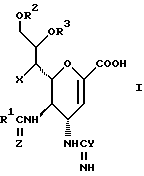
где R1 представляет алкильную группу, имеющую от 1 до 4 углеродных атомов, или галоалкильную группу, имеющую от 1 до 4 углеродных атомов;
R2 и R3 являются одинаковыми или отличными друг от друга, и, каждый, представляет атом водорода или алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов;
X представляет гидрокси группу, атом галоида, алкокси группу, имеющую от 1 до 4 углеродных атомов, или группу формулы RaO-, где Ra представляет алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов;
Y представляет группу формулы RbRcN- или RbRcN-O-, где Rb и Rc являются одинаковыми или отличными друг от друга, и, каждый, представляет атом водорода или алкильную группу, имеющую от 1 до 4 углеродных атомов;
Z представляет атом кислорода или атом серы;
При условии, что когда Y представляет амино группу и Z представляет атом кислорода, то X представляет атом галоида или алкокси группу;
и фармацевтически приемлемые их соли и сложные эфиры.
Данное изобретение также обеспечивает фармацевтическую композицию для лечения или предотвращения инфекций у млекопитающего, которым может быть человек, вызванных сиалидазунесущими вирусами, такими как вирусы семейства гриппа, и эта композиция включает ингибирующее сиалидазу соединение в смеси с фармацевтически приемлемым носителем или разбавителем, где ингибирующее сиалидазу соединение представляет собой по крайней мере одно соединение, выбранное из группы, состоящей из соединений формулы I и фармацевтически приемлемых их солей и сложных эфиров.
Кроме того, данное изобретение обеспечивает способ лечения или предотвращения инфекции у млекопитающего, которым может быть человек, вызванной сиалидазунесущим вирусом, таким как вирус семейства гриппа, и этот способ включает введение указанному млекопитающему эффективного количества ингибирующего сиалидазу соединения, причем ингибирующим сиалидазу соединением является по крайней мере одно соединение, выбранное из группы, состоящей из соединений формулы I и фармацевтически приемлемых их солей или сложных эфиров.
Данное изобретение обеспечивает также способы получения соединений данного изобретения, и эти способы описываются детально ниже.
Детальное описание изобретения
Соединения данного изобретения называют, исходя из терминологии сахаридов, в которых основные положения нумеруются, как указано в следующей формуле: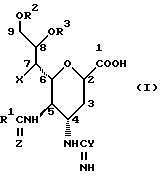
Соединения называют как производные ненасыщенный сахар нон-2- енопиранозоевой (enopyranosoic) кислоты: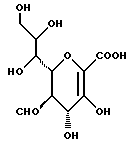
Конфигурации углеродных атомов в положениях 4-7 являются  галакто, в то время как конфигурация углеродного атома в 8-положении является
галакто, в то время как конфигурация углеродного атома в 8-положении является 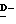 -глицеро, как следует из следующей частной формулы:
-глицеро, как следует из следующей частной формулы: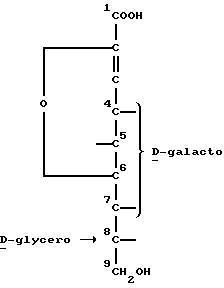
В соединениях данного изобретения, где R1 представляет алкильную группу, эта группа может быть группой с прямой или разветвленной цепью, имеющей от 1 до 4 углеродных атомов, и примеры таких групп включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную и т-бутильную группы, из которых метильная группа предпочтительна.
В том случае когда R1 представляет галоалкильную группу, атомом галоида может быть атом фтора, хлора, брома или иода, предпочтительно атом фтора, хлора или брома, и более предпочтительно атом фтора. Алкильная часть этой галоалкильной группы может представлять любую из перечисленных выше алкильных групп, имеющих от 1 до 4 углеродных атомов. Конкретные примеры таких галоалкильных групп включают фторметильную, дифторметильную, трифторметильную, 1-фторэтильную, 2-фторэтильную, 1-фторпропильную, 2-фторпропильную, 3-фторпропильную, 4-фторбутильную, хлорметильную, 1-хлорэтильную, 2-хлорэтильную, 1-хлорпропильную, 2-хлорпропильную, 3-хлорпропильную, бромметильную, 1-бромэтильную, 2-бромэтильную, 1-бромпропильную, 2-бромпропильную и 3-бромпропильную группы, из которых предпочтительна метильная группа, замещенная по крайней мере одним атомом фтора, особенно фторметильная или дифторметильная группы.
Более предпочтительно, когда R1 представляет метильную группу или галометильную группу, особенно метильную, фторметильную или дифторметильную группу, более предпочтительно метильную группу.
В том случае когда R2, R3 или Ra представляет алифатическую карбоновую ацильную группу (ацильную группу алифатической карбоновой кислоты), имеющую от 2 до 25 углеродных атомов, она может быть группой с прямой или разветвленной цепью, и предпочтительно является алканоильной (алкилкарбонильной) группой, имеющей от 2 до 25 углеродных атомов. Конкретные примеры таких групп включают ацетильную, пропионильную, бутирильную, изобутирильную, пивалоильную, валерильную, изовалерильную, октаноильную, нонилкарбонильную, децилкарбонильную, 3-метилнонилкарбонильную, 8-метилнонилкарбонильную, 3-этилоктилкарбонильную, 3,7-диметилоктилкарбонильную, ундецилкарбонильную, додецилкарбонильную, тридецилкарбонильную, тетрадецилкарбонильную, пентадецилкарбонильную, гексадецилкарбонильную, 1-метилпентадецилкарбонильную, 14- метилпентадецилкарбонильную, 13,13-диметилтетрадецилкарбонильную, гептадецилкарбонильную, 15-метилгексадецилкарбонильную, октадецилкарбонильную, 1-метилгептадецилкарбонильную, нонадецилкарбонильную, икосилкарбонильную и трикосилкарбонильную группы. Среди них, предпочтительны алкилкарбонильные группы, имеющие от 6 до 25 углеродных атомов, более предпочтительны алкилкарбонильные группы, имеющие от 8 до 16 углеродных атомов [и особенно октаноильная, нонилкарбонильная, ундецилкарбонильная (например, додеканоильная), тридецилкарбонильная (например, миристоильная) и пентадецилкарбонильная (например, пальмитоильная) группы].
R2 предпочтительно представляет атом водорода или алифатическую карбоновую ацильную группу, имеющую от 6 до 25 углеродных атомов, более предпочтительно алифатическую карбоновую ацильную группу, имеющую от 8 до 16 углеродных атомов, особенно октаноильную, нонилкарбонильную, ундецилкарбонильную, тридецилкарбонильную или пентадецилкарбонильную группу.
R3 предпочтительно представляет атом водорода или алифатическую карбоновую ацильную группу, имеющую от 6 до 25 углеродных атомов, более предпочтительно атом водорода или алифатическую карбоновую ацильную группу, имеющую от 8 до 16 углеродных атомов, особенно октаноильную, нонилкарбонильную, ундецилкарбонильную, тридецилкарбонильную или пентадецилкарбонильную группу.
Еще более предпочтительно, когда R2 представляет алифатическую ацильную группу, имеющую от 8 до 16 углеродных атомов (особенно октаноильную, нонилкарбонильную, ундецилкарбонильную, тридецилкарбонильную или пентадецилкарбонильную группу), и R3 представляет атом водорода.
В том случае, когда X представляет атом галоида, он может быть атомом фтора, хлора, брома или иода, предпочтительно атомом фтора, хлора или брома, и более предпочтительно атомом фтора;
В том случае когда X представляет алкокси группу, имеющую от 1 до 4 углеродных атомов, то она может быть группой с прямой или разветвленной цепью, и примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси или т-бутоксигруппы, из которых предпочтительны метокси и этокси группы.
X предпочтительно представляет атом фтора или метокси или этокси группу.
В том случае когда Y представляет группу формулы 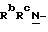 или
или 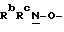 и Rb и/или Rc представляет алкильную группу, имеющую от 1 до 4 углеродных атомов, то она может быть группой с прямой или разветвленной цепью, и примеры включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную и т-бутильную группы, из которых метильная группа предпочтительна. Однако, наиболее предпочтительно, чтобы по крайней мере одна и предпочтительно обе из Rb и Rc представляли бы атом водорода. Таким образом, предпочтительной группой, представляемой RbRcN-O-, является группа формулы NH2-O-, и предпочтительной группой, представляемой RbRcN-, является NH2-, т. е. амино группа.
и Rb и/или Rc представляет алкильную группу, имеющую от 1 до 4 углеродных атомов, то она может быть группой с прямой или разветвленной цепью, и примеры включают метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную и т-бутильную группы, из которых метильная группа предпочтительна. Однако, наиболее предпочтительно, чтобы по крайней мере одна и предпочтительно обе из Rb и Rc представляли бы атом водорода. Таким образом, предпочтительной группой, представляемой RbRcN-O-, является группа формулы NH2-O-, и предпочтительной группой, представляемой RbRcN-, является NH2-, т. е. амино группа.
Y предпочтительно представляет группу формулы NH2 или NH2-O-, более предпочтительно амино группу формулы NH2.
Z предпочтительно представляет атом кислорода.
Соединения данного изобретения содержат карбокси группу и могут, поэтому, образовывать соли с катионами. Не существует особого ограничения на природу этих солей при условии, что когда эти соединения должны использоваться в медицине, эти соли должны быть фармацевтически приемлемыми, т.е. они не должны быть ни более токсичными (или неприемлемо более токсичными), чем свободная кислота, и не должны быть менее активными (или неприемлемо менее активными), чем свободная кислота. Когда соединение подлежит использованию для других целей, например в качестве интермедиатов для получения других и возможно более активных соединений, это ограничение не применяется. Примеры таких солей включают: соли щелочных металлов, такие как соль натрия, соли калия и лития; соли щелочноземельных металлов, такие как соли кальция и магния; соли других металлов, такие как соли алюминия, железа, цинка, меди, никеля и кобальта; другие неорганические соли, такие как соль аммония; аминовые соли, такие как т-октиламин, дибензиламин, морфолин, глюкозамин, алкиловый эфир фенилглицина, этилендиамин, метилглюкамин, гуанидин, диэтиламин, триэтиламин, дициклогексиламин, 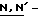 дибензилэтилендиамин, хлорпрокаин, прокаин, диэтаноламин, бензил-фенэтиламин, пиперазин, соли тетраметиламмония и трис(гидроксиметил) аминометана.
дибензилэтилендиамин, хлорпрокаин, прокаин, диэтаноламин, бензил-фенэтиламин, пиперазин, соли тетраметиламмония и трис(гидроксиметил) аминометана.
Кроме того, когда соединение данного изобретения содержит гуанидино группу, его также можно превратить в соль. Такие соли, аналогично, особенно не ограничиваются, за исключением того, что в случае их медицинского использования, они должны быть фармацевтически приемлемыми. Примеры таких солей включают гидрогалогениды, такие как гидрофторид, гидрохлорид, гидробромид или гидроиодид; другие соли неорганических кислот, такие как нитрат, перхлорат, сульфат или фосфат; низшие алкансульфонаты, такие как метансульфонат, трифторметансульфонат или этансульфонат; арилсульфонаты, такие как бензолсульфонат или п-толуолсульфонат; соли органических кислот, особенно соли карбоновых кислот, такие как ацетат, трифторацетат, малат, фумарат, сукцинат, цитрат, тартрат, оксалат или малеат; и соли аминокислот, такие как соли глицина, лизина, аргинина, орнитина, глутаминовой кислоты или аспарагиновой кислоты. Среди них предпочтительны соли щелочных металлов, такие как соли натрия, калия и лития; соли органических кислот, такие как ацетат и трифторацетат, и соли неорганических кислот, такие как гидрохлорид и сульфат.
Поскольку соединения данного изобретения содержат карбокси группу, они могут образовывать сложные эфиры. Особого ограничения на природу этих сложных эфиров нет, при условии, что в случае использования соединений в медицине, сложные эфиры должны быть фармацевтически приемлемыми, т.е. они не должны быть более токсичными (или неприемлемо более токсичными), чем свободная кислота, и не должны быть менее активными (или неприемлемо менее активными), чем свободная кислота. В случае использования данного соединения в других целях, например в качестве интермедиатов для получения других и возможно более активных соединений, такого ограничения не требуется. Примеры групп, которые могут образовывать такие сложные эфиры, включают:
алкильные группы, предпочтительно имеющие от 1 до 30, более предпочтительно от 1 до 25, углеродных атомов, такие как метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, втор-бутильная, т-бутильная, пентильная, изопентильная, 2-метилбутильная, неопентильная, 1-этилпропильная, гексильная, изогексильная, 4-метилпентильная, 3-метилпентильная, 2-метилпентильная, 1-метилпентильная, 3,3-диметилбутильная, 2,2-диметилбутильная, 1,1-диметилбутильная, 1,2-диметилбутильная, 1,3-диметилбутильная, 2,3-диметилбутильная, 2-этилбутилгептильная, 1-метилгексильная, 2-метилгексильная, 3-метилгексильная, 4-метилгексильная, 5-метилгексильная, 1-пропилбутильная, 4,4-диметилпентильная, октильная, 1-метилгептильная, 2-метилгептильная, 3-метилгептильная, 4-метилгептильная, 5- метилгептильная, 6-метилгептильная, 1-пропилпентильная, 2- этилгексильная, 5,5-диметилгексильная, нонильная, 3-метилоктильная, 4- метилоктильная, 5-метилоктильная, 6-метилоктильная, 1-пропилгексильная, 2-этилгептильная, 6,6-диметилгептильная, децильная, 1- метилнонильная, 3-метилнонильная, 8-метилнонильная, 3-этилоктильная, 3,7-диметилоктильная, 7,7-диметилоктильная, ундецильная, 4,8- диметилнонильная, додецильная, тридецильная, тетрадецильная, пентадецильная, 3,7,11-триметилдодецильная, гексадецильная, 4,8,12- триметилтридецильная, 1-метилпентадецильная, 14-метилпентадецильная, 13,13-диметилтетрадецильная, гептадецильная, 15- метилгексадецильная, октадецильная, 1-метилгептадецильная, нонадецильная, икосильная, 3,7,11,15-тетраметилгексадецильная, геникосильная и докосильная группы;
алкенильные группы, предпочтительно имеющие от 2 до 10, и более предпочтительно от 2 до 8 углеродных атомов, такие как этенил, 1-пропенил, 2-пропенил, 1-метил-2-пропенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 2-этил-2-пропенил, 1-бутенил, 2-бутенил, 1-метил-2-бутенил, 1-метил-1-бутенил, 3-метил-2-бутенил, 1-этил-2-бутенил, 3-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 1-этил-3-бутенил, 1-пентенил, 2-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-пентенил, 1-метил-3-пентенил, 2-метил-3- пентенил, 4-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил и 5-гексенил группы;
алкинильные группы, предпочтительно имеющие от 2 до 10, и более предпочтительно от 2 до 8 углеродных атомов, такие как этинил, 2-пропинил, 1-метил-2-пропинил, 2-метил-2-пропинил, 2-этил-2-пропинил, 2-бутинил, 1-метил-2-бутинил, 2-метил-2-бутинил, 1-этил-2-бутинил, 3-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1-этил-3-бутинил, 2- пентинил, 1-метил-2-пентинил, 2-метил-2-пентинил, 3-пентинил, 1-метил-3-пентинил, 2-метил-3-пентинил, 4-пентинил, 1-метил-4-пентинил, 2-метил-4-пентинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил группы;
галоалкильные группы, предпочтительно имеющие от 1 до 6, более предпочтительно от 1 до 4, углеродных атомов, такие как трифторметильная, трихлорметильная, дифторметильная, дихлорметильная, дибромметильная, фторметильная, 2,2,2-трифторэтильная, 2,2,2- трихлорэтильная, 2-бромэтильная, 2-хлорэтильная, 2-фторэтильная, 2-иодоэтильная, 3-хлорпропильная, 4-фторбутильная, 6-иодогексильная и 2,2-дибромэтильная группы;
гидроксиалкильные группы, предпочтительно имеющие от 1 до 6, более предпочтительно от 1 до 4, углеродных атомов, такие как 2-гидроксиэтильная, 2,3-дигидроксипропильная, 3-гидроксипропильная, 3,4-дигидроксибутильная и 4-гидроксибутильная группы;
алифатические ацилзамещенные алкильные группы, в которых алкильная часть предпочтительно имеет от 1 до 6 углеродных атомов, и может представлять собой любую такую группу из перечисленных выше групп, и алифатическая ацильная группа, такая как группы, проиллюстрированные выше в отношении R2, и особенно группы, имеющие от 2 до 5 углеродных атомов, такая как ацетилметильная группа;
аралкильные группы, в которых алкильная группа, имеющая от 1 до 6 углеродных атомов, замещена от 1 до 3 незамещенными карбоциклическими арильными группами, такие как бензильная, фенэтильная, 3-фенилпропильная, α -нафтилметильная. β- нафтилметильная, дифенилметильная, трифенилметильная, 6-фенилгексильная, α -нафтилдифенилметильная и 9-антрилметильная группы;
аралкильные группы, в которых алкильная группа, имеющая от 1 до 6 углеродных атомов, замещена от 1 до 3 замещенными карбоциклическими арильными группами, причем заместителями являются, например, алкил, алкокси, нитро, галоген, циано оралкоксикарбонильная группы, такие как 4-метилбензильная, 2,4,6-триметилбензильная, 3,4,5-триметилбензильная, 4-метоксибензильная, 4-метокси-фенилдифенилметильная, 2-нитробензильная, 4-нитробензильная, 4-хлорбензильная, 4-бромбензильная, 4-циано-бензильная, 4- цианобензилдифенилметильная, бис(2-нитрофенил)метильная, пиперонильная и 4-метоксикарбонилбензильная группы;
силильные группы, включая триалкилсилильную, диалкиларилсилильную и алкилдиарилсилильную группы (алкильные группы, предпочтительно имеющие от 1 до 6 углеродных атомов), такие как триметилсилильная, триэтилсилильная, изопропилдиметилсилильная, т-бутилдиметилсилильная, метилдиизопропилсилильная, метилди-т-бутилсилильная, триизопропилсилильная, метилдифенилсилильная, изопропилдифенилсилильная, бутилдифенилсилильная и фенилдиизопропилсилильная группы;
алкоксиалкильные группы, в которых алкокси и алкильная части, обе, имеют от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие как метоксиметильная, 1-этоксиэтильная, 1-метил-1-метоксиэтильная, 1-(изопропокси)-этильная, 2-метоксиэтильная, 2-этоксиэтильная, 1,1-диметил-1-метоксиметильная, этоксиметильная, пропоксиметильная, изопропоксиметильная, бутоксиметильная и т-бутоксиметильная группы;
алкоксиалкоксиалкильные группы, в которых каждая из алкокси частей и алкильная часть, все, имеют от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие как 2-метоксиэтоксиметильная группа;
арилоксиалкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие как феноксиметильная группа;
галогенированные алкоксиалкильные группы, в которых алкокси и алкильная части, обе, имеют от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие как 2,2,2-трихлорэтоксиметильная и бис(2-хлорэтокси)метильная группы;
алкоксикарбонилалкильные группы, в которых алкокси и алкильная части, обе, имеют от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие как метоксикарбонилметильная группа;
цианоалкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие цианометильная и 2-цианоэтильная группы;
алкилтиометильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие как метилтиометильная и этилтиометильная группы; арилтиометильные группы, такие как фенилтиометильная и нафтилтиометильная группы;
алкилсульфонилалкильные группы, в которых каждая из алкильных частей имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, и которые могут быть замещены одним или более атомами галогена, такие как 2-метансульфонилэтильная и 2-трифторметансульфонилэтильная группы;
арилсульфонилалкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такие как 2-бензолсульфонилэтильная и 2-толуолсульфонилэтильная группы;
ацилоксиалкильные группы, включая алифатические карбоновые ацилоксиалкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, и алифатическая ацильная часть имеет от 1 до 8, предпочтительно от 2 до 5, углеродных атомов, такие как формилоксиметильная, ацетоксиметильная, пропионилоксиметильная, бутирилоксиметильная, пивалоилоксиметильная, валерилоксиметильная, изовалерилоксиметильная, гексаноилоксиметильная, 1-формилоксиэтильная, 1-ацетокси-этильная, 1-пропионилоксиэтильная, 1-бутирилоксиэтильная, 1-пивалоилоксиэтильная, 1-валерилоксиэтильная, 1-изовалерилоксиэтильная, 1-гексаноилоксиэтильная, 2-формилоксиэтильная, 2-ацетоксиэтильная, 2-пропионилоксиэтильная, 2-бутирилоксиэтильная, 2-пивалоилоксиэтильная, 2-валерилоксиэтильная, 2-изовалерилоксиэтильная, 2-гексаноилоксиэтильная, 1-формилоксипропильная, 1-ацетоксипропильная, 1-пропионилоксипропильная, 1-бутирилоксипропильная, 1-пивалоилоксипропильная, 1-валерилоксипропильная, 1-изовалерилоксипропильная, 1-гексаноилоксипропильная, 1-ацетоксибутильная, 1-пропионилоксибутильная, 1-бутирилоксибутильная, 1-пивалоилоксибутильная, 1-ацетоксипентильная, 1-пропионилоксипентильная, 1-бутирилоксипентильная, 1-пивалоилоксипентильная и 1-пивалоилоксигексильная группы;
циклоалкилкарбонилоксиалкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, и циклоалкильная часть имеет от 3 до 8, предпочтительно 5 или 6, углеродных атомов, такие как циклопентанкарбонилоксиметильная, циклогексанкарбонилоксиметильная, 1-циклопентанкарбонилоксиэтильная, 1-циклогексанкарбонилоксиэтильная, 1-циклопентанкарбонилоксипропильная, 1-циклогексанкарбонилоксипропильная, 1-циклопентанкарбонилоксибутильная и 1-циклогексанкарбонилоксибутильная группы;
ароматические ацилоксиалкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, атомов углерода, такие как бензоилоксиметильная группа;
(алкоксикарбонилокси)алкильные группы, в которых алкокси и алкильные части, обе, имеют от 1 до 6, предпочтительно от 1 до 4, атомов углерода, такие как метоксикарбонилоксиметильная, этоксикарбонилоксиметильная, пропоксикарбонилоксиметильная, изопропоксикарбонилоксиметильная, бутоксикарбонилоксиметильная, изобутоксикарбонилоксиметильная, пентилоксикарбонилоксиметильная, гексилоксикарбонилоксиметильная, 1-(метоксикарбонилокси)этильная, 1-(этоксикарбонилокси)этильная, 1-пропоксикарбонилоксиэтильная, 1-(изопропоксикарбонилокси) этильная, 1-бутоксикарбонилоксиэтильная, 1-изобутоксикарбонилоксиэтильная, 1-(трет-бутоксикарбонилокси) этильная, 1-пентилоксикарбонилоксиэтильная, 1-гексилоксикарбонилоксиэтильная, 1-(этоксикарбонилокси) пропильная, 2-метоксикарбонилоксиэтильная, 2-этоксикарбонилоксиэтильная, 2-пропоксикарбонилоксиэтильная, 2-изопропоксикарбонилоксиэтильная, 2-бутоксикарбонилоксиэтильная, 2-изобутоксикарбонилоксиэтильная, 2-пентилоксикарбонилоксиэтильная, 2-гексилоксикарбонилоксиэтильная, 1-метоксикарбонилоксипропильная, 1-этоксикарбонилоксипропильная, 1-пропоксикарбонилоксипропильная, 1-изопропоксикарбонилоксипропильная, 1-бутоксикарбонилоксипропильная, 1-изобутоксикарбонилоксипропильная, 1-пентилоксикарбонилоксипропильная, 1-гексилоксикарбонилоксипропильная, 1-метоксикарбонил-оксибутильная, 1-этоксикарбонилоксибутильная, 1-пропоксикарбонилоксибутильная, 1-изопропоксикарбонилоксибутильная, 1-бутоксикарбонилоксибутильная, 1-изобутокси-карбонилоксибутильная, 1-метоксикарбонилоксипентильная, 1-этоксикарбонилоксипентильная, 1-метоксикарбонилоксигексильная и 1-этоксикарбонилоксигексильная группы;
(циклоалкилоксикарбонилокси) алкильные и (циклоалкилоксикарбонилокси) (циклоалкил) алкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, и циклоалкильная часть имеет от 3 до 8, предпочтительно 5 или 6, углеродных атомов, такие как циклогексилоксикарбонилоксиметильная, циклогексилоксикарбонилокси (циклогексил) метильная, 1-циклопентилоксикарбонилоксиэтильная, 1-циклопентилоксикарбонилоксипропильная, 1-циклогексилоксикарбонилоксипропильная, 1-циклопентилоксикарбонилоксибутильная, 1-циклогексилоксикарбонилоксибутильная и 1-(циклогексилоксикарбонилокси)этильная группы;
карбонилоксиалкильные группы, в которых алкильная часть имеет от 1 до б, предпочтительно от 1 до 4, углеродных атомов, включая оксодиоксоленилметильные группы, такие как (5-фенил-2-оксо-1,3-диоксолен-4-ил)метильная, [5-(4-метилфенил)-2-оксо-1,3-диоксолен-4-ил] метильная, [5-(4-метоксифенил)-2-оксо-1,3-диоксолен-4-ил] метильная, [5-(4-фторфенил) -2-оксо-1,3-диоксолен-4-ил] метильная, [5-(4-хлорфенил) -2-оксо-1,3-диоксолен-4-ил]метильная, (2-оксо-1,3-диоксолен-4-ил) метильная, (5-метил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-этил-2- оксо-1,3-диоксолен-4-ил)метильная, (5-пропил-2-оксо-1,3-диоксолен-4-ил)метильная, (5-изопропил-2-оксо-1,3-диоксолен-4-ил)метильная и (5-бутил-2-оксо-1,3-диоксолен-4-ил)метильная группы;
фталидильная и замещенная фталидильная группы, такие как фталидильная, диметилфталидильная и диметоксифталидильная группы;
арильные группы, предпочтительно имеющие от 6 до 14 углеродных атомов в одном или более карбоциклических кольцах, такие как фенильная и инданильная группы;
карбоксиалкильные группы, в которых алкильная часть имеет от 1 до 6, предпочтительно от 1 до 4, углеродных атомов, такая как карбокси метильная группа; и
амид образующие остатки аминокислот.
Из перечисленных выше сложноэфирных групп, следующие расщепляются биологическим способом, таким как гидролиз в живом организме; т.е. сложные эфиры продуцируют свободные кислоты или соли путем гидролиза или сходной реакции в организме человека, в частности:
алкильные группы, алкоксиалкильные группы, алкоксиалкоксиалкильные группы, арилоксиалкильные группы, галогенированные алкоксиалкильные группы, алкоксикарбонилалкильные группы, цианоалкильные группы, алкилтиометильные группы, алкилсульфонилалкильные группы, арилсульфонилалкильные группы, ацилоксиалкильные группы, (алкоксикарбонилокси)алкильные группы, (циклоалкилоксикарбонилокси)алкильные группы, (циклоалкилоксикарбонилокси) (циклоалкил)алкильные группы, карбонилоксиалкильные группы, фталидильные и замещенные фталидильные группы, арильные группы, карбоксиалкильные группы, и амид образующие остатки аминокислоты.
Из них предпочтительны прямые и разветвленные алкильные группы, имеющие от 6 до 25 углеродных атомов, более предпочтительна алкильная группа, имеющая от 16 до 25 углеродных атомов.
Соединение данного изобретения, когда его выдерживают в атмосферных условиях, может абсорбировать некоторое количество влаги, и оно может, в результате этого, связаться с адсорбированной водой или оно может превратиться в гидрат. Такие гидраты также составляют часть данного изобретения.
Предпочтительными классами соединений данного изобретения являются классы соединений формулы I и фармацевтически приемлемые их соли и сложные эфиры, в которых:
(A) R1 представляет метильную или галометильную группу.
(B) R2 представляет атом водорода или алифатическую карбоновую ацильную группу, имеющую от 6 до 25 углеродных атомов .
(C) R3 представляет атом водорода или алифатическую карбоновую ацильную группу, имеющую от 6 до 25 углеродных атомов .
(D) X представляет атом галогена или алкокси группу, имеющую от 1 до 4 углеродных атомов.
(E) Y представляет амино группу или группу формулы RbRcN-O-, где Rb и Rc являются такими, как определено выше.
Из вышеупомянутых соединений предпочтительны те соединения формулы I и их фармацевтически приемлемые соли и сложные эфиры, в которых R1 такой, как определено в (A) выше, R2 - такой, как определено в (B) выше, R3 такой, как определено в (C) выше, X такой, как определено в (D) выше, и Y такой, как определено в (E) выше, особенно соединения, в которых R1 такой, как определено в (A) выше, R2 такой, как определено в (B) выше, R3 такой, как определено в (C) выше, X такой, как определено в (D) выше, Y такой, как определено в (E) выше, и Z представляет атом кислорода.
Более предпочтительными классами соединений данного изобретения являются классы соединений формулы I и их фармацевтически приемлемые соли и сложные эфиры, где:
(F) R1 представляет метильную группу или метильную группу, имеющую по крайней мере один фтор-заместитель.
(G) R2 представляет атом водорода или алифатическую карбоновую ацильную группу, имеющую от 8 до 16 углеродных атомов.
(Н) R3 представляет атом водорода или алифатическую карбоновую ацильную группу, имеющую от 8 до 16 углеродных атомов.
(I) X представляет атом фтора, метокси группу или этокси группу.
(J) Y представляет амино группу или аминоокси группу.
(К) Z представляет атом кислорода.
Из вышеупомянутых соединений предпочтительны те соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры, где R1 такой, как определено в (F) выше, R2 такой, как определено в (G) выше, R3 такой, как определено в (Н) выше, X такой, как определено в (I) выше, Y такой, как определено в (J) выше, и Z такой, как определено в (К) выше.
Еще более предпочтительным классом соединений данного изобретения являются соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры, где:
(L) R2 представляет атом водорода или алифатическую карбоновую ацильную группу, имеющую от 8 до 16 углеродных атомов и R3 представляет атом водорода.
Из вышеупомянутых соединений предпочтительны соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры, где R1 такой, как определено в (F) выше, R2 и R3 такие, как определено в (L) выше, X такой, как определено в (I) выше, Y такой, как определено в (J) выше, и Z такой, как определено в (К) выше.
Другими более предпочтительными классами соединений данного изобретения являются соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры, где:
(М) R1 представляет метильную, фторметильную или дифторметильную группу.
(N) R2 представляет октаноильную, деканоильную, додеканоильную, миристоильную или пальмитоильную группу.
(О) R3 представляет атом водорода или октаноильную, деканоильную, додеканоильную, миристоильную или пальмитоильную группу.
(Р) Y представляет аминогруппу.
Из вышеупомянутых соединений предпочтительны те соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры, где R1 такой, как определено в (М) выше, R2 такой, как определено в (N) выше, R3 такой, как определено в (О) выше, X такой, как определено в (I) выше, Y такой, как определено в (Р) выше, и Z такой, как определено в (К) выше.
Следующим более предпочтительным классом соединений данного изобретения являются соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры, где:
(Q) R1 представляет метильную группу.
(R) R2 представляет октаноильную, деканоильную, додеканоильную, миристоильную или пальмитоильную группу и R3 представляет атом водорода.
Из вышеупомянутых соединений предпочтительны соединения формулы (I) и их фармацевтически приемлемые соли и сложные эфиры, где R1 такой, как определено в (Q) выше, R2 и R3 такие, как определено в (R) выше, X такой, как определено в (I) выше, Y такой, как определено в (Р) выше, и Z такой, как определено в (K) выше.
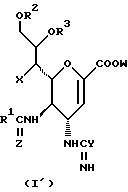
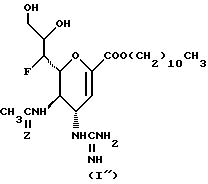
Конкретные соединения данного изобретения иллюстрируются ниже с помощью формулы (I'), где группы-заместители являются такими, как определено в следующих Таблицах 1 и 2. Любое индивидуальное соединение может быть определено путем взятия комбинации определений R1, X, Y и Z в любом ряду Таблицы 1 и комбинирования их с комбинацией определений R2, R3 и W в любом ряду Таблицы 2. Затем, соединение может быть идентифицировано числом в виде α-β, где α - число соответствующего ряда Таблицы 1 и β - число соответствующего ряда Таблицы 2. Таким образом, например, соединение формулы (I"), данное ниже, которое представляет соединение формулы (I'), где R1 представляет метильную группу, X представляет атом фтора, Y представляет амино группу, Z представляет атом водорода (ряд 1 Таблицы 1), R2 представляет атом водорода, R3 представляет атом водорода и W представляет ундецильную группу (ряд 4 Таблицы 2) является Соединением N 1 - 4.
В Таблицах используют следующие аббревиатуры:
Bu - бутил
iBu - изобутил
Et - этил
Me - метил
Pr - пропил
iPr - изопропил
Таким образом, раскрываются следующие соединения N 1-1, 1-2, 1-3 (см. в конце описания)
Среди комбинаций групп, представленных в Таблице 1 выше, предпочтительными являются комбинации групп, идентифицируемые N 1, 2, 3, 4, 5, 6, 7, 8, 9, 31, 34, 35, 36, 76, 77, 78, 106, 107, 108, 136, 137, 138, 163 и 199, и более предпочтительны комбинации групп, идентифицируемые N 1, 163 и 199.
Среди комбинаций групп, представленных в Таблице 2 выше, предпочтительными являются комбинации групп, идентифицируемые N 1 - 8, 32 - 53 и 87 - 97, и более предпочтительны комбинации групп, идентифицируемые N 1, 38, 40, 41 и 42.
Среди соединений, представленных комбинациями групп, выбранными из Таблицы 1 и Таблицы 2, предпочтительными являются соединения N 1 - 1, 1 - 2, 1 - 3, 1 - 4, 1 - 5, 1 - 6, 1 - 7, 1 - 8, 1 - 32, 1 - 33, 1 - 34, 1 - 35, 1 - 36, 1 - 37, 1 - 38, 1 - 39, 1 - 40, 1 - 41, 1 - 42, 1 - 43, 1 - 44, 1 - 45, 1 - 48, 1 - 49, 1 - 50, 1 - 51, 1 - 52, 1 - 53, 7 - 1, 7 - 2, 7 - 3, 7 - 4, 7 - 5, 7 - 6, 7 - 7, 7 - 8, 7 - 32, 7 - 33, 7 - 34, 7 - 35, 7 - 36, 7 - 37, 7 - 38, 7 - 39, 7 - 40, 7 - 41, 7 - 42, 7 - 43, 7 - 44, 7 - 45, 7 - 48, 7 - 49, 7 - 50, 7 - 51, 7 - 52, 7 - 53, 163 - 1, 163 - 38, 163 - 39, 163 - 40, 163 - 41, 163 - 42, 199 - 1, 199 - 38, 199 - 39, 199 - 40, 199 - 41 и 199 - 42.
Наиболее предпочтительными соединениями являются Соединения под следующими номерами:
1 - 1. 5-ацетамидо-4-гуанидино-2,3,4,5,7- пентадезокси-7-фторо  глицеро
глицеро 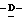 галакто-нон-2-енопиранозоевая кислота;
галакто-нон-2-енопиранозоевая кислота;
IUPAC название: 5-ацетамидо-6-(1-фторо-2,3-дигидроксипропил)-4 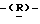 -гуанидино-2
-гуанидино-2 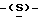 3
3 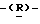 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
1 - 40. 5-ацетамидо-4-гуанидино-9  додеканоил-2,3,4,5,7 -пентадезокси-7-фторо
додеканоил-2,3,4,5,7 -пентадезокси-7-фторо  глицеро
глицеро галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-фторо-2-гидрокси-3-додеканоилоксипропил)-4
галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-фторо-2-гидрокси-3-додеканоилоксипропил)-4  гуанидино-2
гуанидино-2 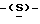 3-
3-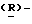 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
1 - 41. 5-ацетамидо-4-гуанидино-9 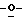 миристоил-2,3,4,5,7- пентадезокси-7-фторо
миристоил-2,3,4,5,7- пентадезокси-7-фторо 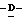 глицеро
глицеро 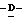 галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-фторо-2- гидрокси-3-миристоилоксипропил)-4
галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-фторо-2- гидрокси-3-миристоилоксипропил)-4 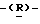 гуанидино-2
гуанидино-2 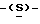 3-
3-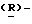 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
1 - 42. 5-aцeтaмидo-4-гуaнидинo-9  пaльмитoил-2,3,4,5,7- пентадезокси-7-фторо
пaльмитoил-2,3,4,5,7- пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2- енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1- фторо-2-гидрокси-3-пальмитоилоксипропил)-4
галакто-нон-2- енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1- фторо-2-гидрокси-3-пальмитоилоксипропил)-4  гуанидино-2-
гуанидино-2- 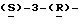 -дигидропиран-2-карбоновая кислота;
-дигидропиран-2-карбоновая кислота;
163 - 1. 5-ацетамидо-4-гуанидино-2,3,4,5,7- пентадезокси-7-метокси 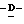 глицеро
глицеро 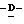 галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(2,3-дигидрокси-1-метоксипропил)-4
галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(2,3-дигидрокси-1-метоксипропил)-4 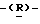 гуaнидинo-2
гуaнидинo-2 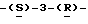 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
163 - 41. 5-ацетамидо-4-гуанидино-9 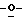 миристоил-2,3,4,5,7-пентадезокси-7-метокси
миристоил-2,3,4,5,7-пентадезокси-7-метокси 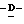 глицеро
глицеро  галакто-нон-2-енопиранозоевая кислота: 5-ацетамидо-6-(2-гидрокси-1-метокси-3-миристоилоксипропил)-4
галакто-нон-2-енопиранозоевая кислота: 5-ацетамидо-6-(2-гидрокси-1-метокси-3-миристоилоксипропил)-4 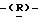 гуанидино-2
гуанидино-2 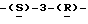 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
199 - 1. 5-ацетамидо-4-гуанидино-2,3,4,5, 7-пентадезокси-7- этокси  глицеро
глицеро  галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2,3-дигидроксипропил)-4
галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2,3-дигидроксипропил)-4  гуанидино-2
гуанидино-2 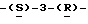 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
199 - 38. 5-ацетамидо-4-гуанидино-9 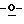 октаноил-2,3,4,5,7-пентадезокси-7-этокси
октаноил-2,3,4,5,7-пентадезокси-7-этокси 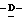 глицеро
глицеро 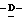 галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2-гидрокси-3-октаноилоксипропил)-4
галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2-гидрокси-3-октаноилоксипропил)-4 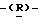 гуанидино-2
гуанидино-2 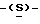 3
3 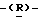 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
199 - 40. 5-aцетaмидo-4-гуaнидинo-9 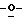 дoдекaнoил-2,3,4,5,7- пентадезокси-7-этокси
дoдекaнoил-2,3,4,5,7- пентадезокси-7-этокси 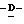 глицеро
глицеро 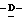 галакто-нон-2- енопиранозоевая кислота; IUPAC название: 5- ацетамидо-6-(1-этокси-2-гидрокси-3-додеканоилоксипропил)-4
галакто-нон-2- енопиранозоевая кислота; IUPAC название: 5- ацетамидо-6-(1-этокси-2-гидрокси-3-додеканоилоксипропил)-4 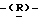 гуанидино-2
гуанидино-2 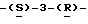 дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
199 - 41. 5-ацетамидо-4-гуанидино-9  миристоил-2,3,4,5,7- пентадезокси-7-этокси
миристоил-2,3,4,5,7- пентадезокси-7-этокси  глицеро
глицеро  галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2-гидрокси-3-миристоилоксипропил)-4
галакто-нон-2-енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2-гидрокси-3-миристоилоксипропил)-4  гуанидино-2
гуанидино-2  дигидропиран-2-карбоновая кислота;
дигидропиран-2-карбоновая кислота;
199 - 42. 5-ацетамидо-4-гуанидино-9  пальмитоил-2,3,4,5,7- пентадезокси-7-этокси
пальмитоил-2,3,4,5,7- пентадезокси-7-этокси  глицеро
глицеро  галакто-нон-2- енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2- гидрокси-3-пальмитоилоксипропил)-4
галакто-нон-2- енопиранозоевая кислота; IUPAC название: 5-ацетамидо-6-(1-этокси-2- гидрокси-3-пальмитоилоксипропил)-4  гуанидино-2
гуанидино-2 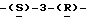 дигидропиран-2-карбоновая кислота.
дигидропиран-2-карбоновая кислота.
Соединения данного изобретения можно получить рядом способов, хорошо известных в данной области для получения соединений этого типа, например, иллюстрируемых следующими Способами D, E, F или G.
Соединение формулы (5), которое используют в качестве исходного вещества в Способе C, можно получить с помощью следующего Способа Н.
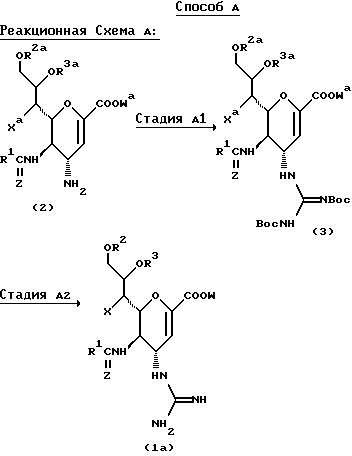
В вышеупомянутых формулах:
R1, R2, R3, X и Z такие, как определено выше;
R2a представляет любую из групп или атомов, представленных R2, или гидроксизащищающую группу, предпочтительно т-бутилдиметилсилильную группу;
R3a представляет любую из групп или атомов, представленных R3, или гидроксизащищающую группу, предпочтительно т-бутилдиметилсилильную группу;
Xa представляет любую из групп или атомов, представленных X, или защищенную гидроксигруппу, предпочтительно т-бутилдиметилсилилокси группу;
W представляет атом водорода или сложно-эфирный остаток;
Wa представляет любую из групп или атомов, представленных W, или карбокси-защищающую группу, предпочтительно аллильную группу, метоксиметильную группу, метилтиометильную группу, [2-(триметилсилил)этокси]метокси группу или дифенилметильную группу, более предпочтительно дифенилметильную группу; и
Boc представляет т-бутоксикарбонильную группу.
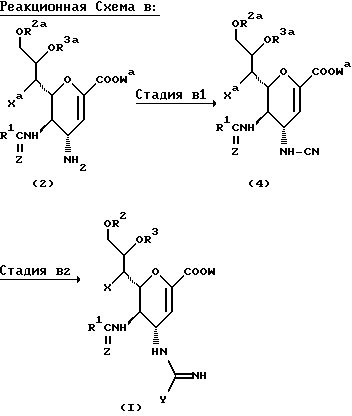
В этом Способе соединение формулы (1a) получают путем взаимодействия соединения формулы (2) с 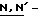 ди-т-бутоксикарбонилтиомочевиной с получением соединения формулы (3), с которого затем снимают защиту.
ди-т-бутоксикарбонилтиомочевиной с получением соединения формулы (3), с которого затем снимают защиту.
СТАДИЯ A1
В этой стадии соединение формулы (3) получают взаимодействием соединения формулы (2) с 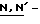 ди-т-бутоксикарбонилтиомочевиной в присутствии основания и хлорида ртути и в инертном растворителе.
ди-т-бутоксикарбонилтиомочевиной в присутствии основания и хлорида ртути и в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Особого ограничения на природу подлежащего использованию растворителя не существует, при условии, что он не оказывает вредного влияния на реакцию или на вовлеченные в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диэтилен гликоль диметиловый эфир; и амиды, такие как  диметилацетамид, и диметилформамид. Среди них предпочтительны амиды, особенно
диметилацетамид, и диметилформамид. Среди них предпочтительны амиды, особенно  диметилацетамид или диметилформамид.
диметилацетамид или диметилформамид.
Особого ограничения на природу используемого основания также не существует, и может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают: органические основания, такие как триэтиламин или диметиламинопиридин.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 1 часа до 24 часов, более предпочтительно от 5 часов до 10 часов.
После завершения реакции требуемое соединение можно получить обычным способом. Например, одна подходящая методика выделения включает в себя: фильтрование реакционного раствора в условиях пониженного давления для удаления нерастворимых веществ; добавление в него несмешиваемого с водой органического растворителя, такого как этилацетат, отделение органического слоя, содержащего требуемое соединение, после промывания водой; и дистилляцию растворителя после сушки органического слоя, например над безводным сульфатом магния.
Требуемое соединение, при необходимости, может быть в дальнейшем подвергнуто очистке путем перекристаллизации или при помощи различных видов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
СТАДИЯ A2
В этой стадии соединение формулы (1a), которое представляет собой соединение данного изобретения, получают путем обработки соединения формулы (3) реагентом, который может удалить т-бутоксикарбонильную группу, в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Особого ограничения на природу растворителя, подлежащего использованию, не существует, при условии, что он не оказывает вредного влияния на реакцию или на вовлеченные в реакцию реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол или этанол; вода; или смесь любых двух или более из них.
Аналогично, не существует особого ограничения на природу реагентов, используемых для удаления т-бутоксикарбонильной группы, и здесь в равной степени может быть использован любой реагент, обычно применяемый в реакциях этого типа. Примеры таких реагентов включают кислоты, и любая кислота, обычно используемая в качестве кислотного катализатора, может быть использована, например кислота Бренстеда, такая как неорганическая кислота (например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота) или органическая кислота (например, уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуол-сульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота), предпочтительно органическая кислота (в частности, уксусная кислота или трифторуксусная кислота).
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно выделять из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает в себя: нейтрализацию реакционного раствора и очистку остатка, полученного путем дистилляции растворителя при пониженном давлении, с помощью хроматографии на силикагеле.
В том случае, когда R2a или R3a представляет гидроксизащищающую группу, Xa представляет защищенную гидрокси группу или Wa представляет карбоксизащищающую группу, соединение данного изобретения далее можно получить путем удаления этих защищающих групп.
Реакция, используемая для удаления защищающих групп, может варьироваться, в зависимости от природы защищающей группы. Однако, она может быть осуществлена стандартным способом, например, по способу, описанному в "Protective Groups in Organic Synthesis", Second Edition (written by Greene and Wuts, John Wiley & Sons, Inc., опубликованной в 1991), на который здесь ссылаются.
Когда гидрокси-защищающей группой является триалкилсилильная группа, такая как т-бутилдиметилсилильная группа, предпочтительно можно использовать уксусную кислоту в смеси воды и тетрагидрофурана или фторид тетрабутиламмония в тетрагидрофуране. Когда карбокси-защищающей группой является дифенилметильная группа, можно использовать каталитическое восстановление с использованием газа-водорода и катализатора, такого как палладиевая чернь в смеси метанола и тетрагидрофурана, трифторуксусную кислоту в феноле, уксусную кислоту в качестве кислоты и растворителя, или комплекс трифторборан-диэтиловый эфир в уксусной кислоте.
СПОСОБ B
В этом Способе соединение формулы (1) получают взаимодействием соединения формулы (2) с аммиаком или гидроксиламином, который может быть замещен алкильной группой, имеющей от 1 до 4 углеродных атомов в амино-части, при необходимости, с последующим снятием защиты.
В вышеуказанных формулах, R1, R2, R3, R2a, R3a, X, Y, W, Z, Xa и Wa являются такими, как определено выше.
Стадия B1
В этой стадии соединение формулы (4) получают взаимодействием соединения формулы (2) с цианирующим реагентом в инертном растворителе. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Особого ограничения на природу растворителя, подлежащего использованию, не существует, при условии, что он не оказывает вредного влияния на реакцию или на вовлеченные в реакцию реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, т-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и монометиловый эфир этиленгликоля (метил Целлосольв - "Целлосольв" - торговая марка); амиды, такие как формамид, диметилформамид,  диметил-ацетамид,
диметил-ацетамид, 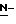 метил-2-пиppoлидoн,
метил-2-пиppoлидoн, 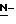 метилпирролидинон и триамид гексаметилфосфорной кислоты, и сульфоксиды, такие как диметилсульфоксид и сульфолан. Среди них предпочтительны спирты (особенно метанол).
метилпирролидинон и триамид гексаметилфосфорной кислоты, и сульфоксиды, такие как диметилсульфоксид и сульфолан. Среди них предпочтительны спирты (особенно метанол).
Также нет особого ограничения на природу используемых цианирующих агентов, и любой цианирующий агент, обычно используемый в реакциях этого типа, может быть здесь использован в равной степени. Примеры таких цианирующих агентов включают бромистый циан, в случае которого, одновременно, в качестве основания используют ацетат натрия.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 40oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно, например, выделить при помощи хроматографии на силикагеле, чтобы очистить остаток, полученный дистилляцией растворителя.
СТАДИЯ B2
В этой Стадии соединение формулы (1), которое представляет собой соединение данного изобретения, получают взаимодействием соединения формулы (4) с аммиаком или гидроксиламином, который может быть замещен алкильной группой, имеющей от 1 до 4 углеродных атомов в амино-части, при необходимости, с последующим снятием защиты,
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на вовлеченные в реакцию реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают спирты (в частности, метанол).
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 40oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает использование хроматографии на силикагеле, чтобы очистить остаток, полученный путем дистилляции растворителя.
В том случае когда R2a или R3a представляет гидрокси-защищающую группу, Xa представляет защищенную гидрокси группу или Wa представляет карбокси-зашищающую группу, соединение данного изобретения можно получить путем последующего удаления этих защищающих групп, как описано в Способе A.
СПОСОБ C
В этом Способе соединение формулы (1c) получают взаимодействием соединения формулы (5) с ацилирующим агентом, с последующим снятием защиты.
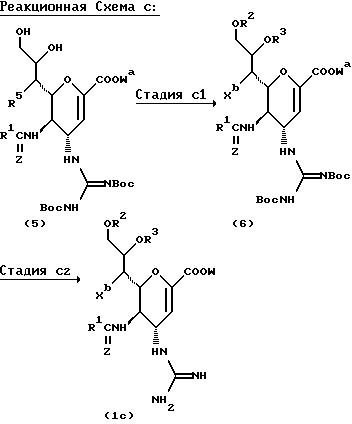
В вышеуказанных формулах:
R1, R2, R3, W, Z и Wa такие, как определено выше;
R5 представляет атом галогена, алифатическую ацилокси группу, имеющую от 2 до 25 углеродных атомов, или алкокси группу, имеющую от 1 до 4 углеродных атомов.
СТАДИЯ C1
В этой Стадии соединение формулы (6) получают путем введения требуемой ацильной группы в соединение формулы (5) в инертном растворителе.
Способ ацилирования может быть осуществлен по любому из нижеследующих Способов 1, 2 и 3.
Способ 1
В этом Способе соединение формулы (5) подвергают взаимодействию с соединением формулы RCO-L или соединением формулы RCO-O-COR, где R представляет алкильную группу, имеющую от 1 до 24 углеродных атомов; и L представляет отщепляемую группу. Особого ограничения на природу используемых отщепляемых групп не существует, и здесь может быть использована в равной степени любая нуклеофильная отщепляемая группа, обычно используемая в реакциях этого типа. Примеры таких отщепляемых групп включают: атомы галогена, такие как атомы хлора, брома и иода; алкоксикарбонилокси группы, имеющие от 1 до 6 углеродных атомов в алкокси части, такие как метоксикарбонилокси и этоксикарбонилокси группы; галогенированные алканоилокси группы, такие как хлорацетокси, дихлорацетокси, трихлорацетокси и трифторацетокси группы; алкансульфонилокси группы, имеющие от 1 до 6 углеродных атомов в алкильной части, такие как метансульфонилокси и этансульфонилокси группы; галогенированные алкансульфонилокси группы, имеющие от 1 до 6 углеродных атомов в алкильной части, такие как трифторметансульфонилокси и пентафторэтансульфонилокси группы; и арилсульфонилокси группы, такие как бензолсульфонилокси, п-толуолсульфонилокси и п-нитробензолсульфонилокси группы. Среди них предпочтительны атомы галогена, галогенированные алкансульфонилокси группы и арилсульфонилокси группы.
Реакция может протекать в присутствии или отсутствии основания и в растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на вовлеченные в реакцию реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтил карбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; и амиды, такие как формамид, диметилформамид, 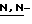 диметилацетамид,
диметилацетамид,  метил-2-пирролидон,
метил-2-пирролидон,  метилпирролидинон и триамид гексаметилфосфорной кислоты.
метилпирролидинон и триамид гексаметилфосфорной кислоты.
Особого ограничения на природу используемого основания также не существует, и здесь может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают: органические основания, такие как  метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин,
метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин,  метил-пиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(
метил-пиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(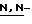 диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин, хинолин,
диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин, хинолин, 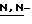 диметиланилин и
диметиланилин и 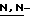 диэтиланилин.
диэтиланилин.
4-(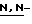 Диметиламино)пиридин и 4-пирролидинопиридин могут использоваться в каталитическом количестве в комбинации с одним или более другими основаниями. Кроме того, реакцию можно облегчить, проводя ее в присутствии одного или более из соединений: солей четвертичного аммония, таких как хлорид бензилтриэтиламмония и хлорид тетрабутиламмония; и краун эфиров, такого как дибензо-18-краун-6.
Диметиламино)пиридин и 4-пирролидинопиридин могут использоваться в каталитическом количестве в комбинации с одним или более другими основаниями. Кроме того, реакцию можно облегчить, проводя ее в присутствии одного или более из соединений: солей четвертичного аммония, таких как хлорид бензилтриэтиламмония и хлорид тетрабутиламмония; и краун эфиров, такого как дибензо-18-краун-6.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -20oC до температуры кипения используемого растворителя, более предпочтительно от 0oC до температуры кипения используемого растворителя. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 10 минут до 3 дней, более предпочтительно от 1 часа до 6 часов.
Способ 2
В этом Способе соединение формулы: RCOOH [где R такой, как определено выше] подвергают взаимодействию с соединением формулы (5) в присутствии эстерифицирующего агента и в присутствии или отсутствии каталитического количества основания в растворителе. Реакцию можно также проводить в присутствии конденсирующего агента.
Особого ограничения на природу используемых эстерифицирующих агентов не существует, и здесь в равной степени может быть использован любой эстерифицирующий агент, обычно используемый в реакциях этого типа. Примеры таких эстерифицирующих агентов включают активные сложные эфиры, особенно: алкил галоформиаты, такие как метил хлорформиат и этил хлорформиат; и диэфиры цианофосфорной кислоты, такой как диэтил цианофосфат. Эстерификация с такими активными сложными эфирами протекает в присутствии, по крайней мере, одного конденсирующего агента. Конкретные примеры таких конденсирующих агентов включают: 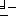 гидрокси производные, такие как
гидрокси производные, такие как 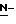 гидроксисукцинимид, 1-гидроксибензотриазол и
гидроксисукцинимид, 1-гидроксибензотриазол и 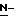 гидрокси-5-норборнен-2,3-дикарбоксимид; дисульфидные соединения, такие как 2,2'-дипиридил дисульфид; соединения янтарной кислоты, такое как
гидрокси-5-норборнен-2,3-дикарбоксимид; дисульфидные соединения, такие как 2,2'-дипиридил дисульфид; соединения янтарной кислоты, такое как 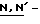 дисукцинимидил карбонат; соединения хлорангидрида фосфиновой кислоты, такое как хлорангидрид
дисукцинимидил карбонат; соединения хлорангидрида фосфиновой кислоты, такое как хлорангидрид 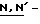 бис(2-оксо-3-окса-эолидинил)фосфиновой кислоты; оксалатные производные, такие как
бис(2-оксо-3-окса-эолидинил)фосфиновой кислоты; оксалатные производные, такие как 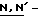 дисукцинимидил оксалат (ДСО, DSO),
дисукцинимидил оксалат (ДСО, DSO), 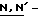 дифталимид-оксалат (ДФО, DPO),
дифталимид-оксалат (ДФО, DPO), 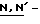 бис(норборненилсукцинимидил) -оксалат (БНО, BNO), 1,1'-бис(бензотриазолил) оксалат (ББТО, BВTO), 1,1'-бис(6-хлоробензотриазолил) оксалат (БТБО, BСТO) и 1,1'- бис(6-трифторметилбензотриазолил) оксалат (ВТВО); триарилфосфины, включая триарилфосфины, такие как трифенилфосфин, диалкил азодикарбоксилат-триарилфосфины, в которых алкильная часть имеет от 1 до 6 углеродных атомов, такой как диэтил азодикарбоксилат-трифенилфосфин;
бис(норборненилсукцинимидил) -оксалат (БНО, BNO), 1,1'-бис(бензотриазолил) оксалат (ББТО, BВTO), 1,1'-бис(6-хлоробензотриазолил) оксалат (БТБО, BСТO) и 1,1'- бис(6-трифторметилбензотриазолил) оксалат (ВТВО); триарилфосфины, включая триарилфосфины, такие как трифенилфосфин, диалкил азодикарбоксилат-триарилфосфины, в которых алкильная часть имеет от 1 до 6 углеродных атомов, такой как диэтил азодикарбоксилат-трифенилфосфин;  алкил- 5-арилизоксазолий (isoxazolium)-3'-сульфонаты, в которых алкильная часть имеет от 1 до 6 углеродных атомов, такой как
алкил- 5-арилизоксазолий (isoxazolium)-3'-сульфонаты, в которых алкильная часть имеет от 1 до 6 углеродных атомов, такой как  этил- 5-фенилизоксазолий-3'-сульфонат; производные карбодиимида, включая
этил- 5-фенилизоксазолий-3'-сульфонат; производные карбодиимида, включая  дициклоалкилкарбодиимиды, такие как
дициклоалкилкарбодиимиды, такие как  дициклогексилкарбодиимид (ДЦК, DCC) и 1-этил-3- (3-диметиламинопропил)карбодиимид (ЭДАПК, EDAPC); дигетероарилдиселениды, такой как ди-2-пиридилдиселенид; арилсульфонилтриазолиды, такой как п-нитробензолсульфонилтриазолид; галогениды 2-гало-1-алкилпиридиния, в которых алкильная часть имеет от 1 до 6 углеродных атомов, такой как иодид 2-хлоро-1-метилпиридиния; диарилфосфорилазиды, такой как дифенилфосфорилазид (ДФФА, DPPA); производные имидазола, такие как 1,1'-оксалилдиимидазол и
дициклогексилкарбодиимид (ДЦК, DCC) и 1-этил-3- (3-диметиламинопропил)карбодиимид (ЭДАПК, EDAPC); дигетероарилдиселениды, такой как ди-2-пиридилдиселенид; арилсульфонилтриазолиды, такой как п-нитробензолсульфонилтриазолид; галогениды 2-гало-1-алкилпиридиния, в которых алкильная часть имеет от 1 до 6 углеродных атомов, такой как иодид 2-хлоро-1-метилпиридиния; диарилфосфорилазиды, такой как дифенилфосфорилазид (ДФФА, DPPA); производные имидазола, такие как 1,1'-оксалилдиимидазол и  карбонилдиимидазол; производные бензотриазола, такой как 1-гидроксибензотриазол (ГОБТ, HOBT); и производные дикарбоксимида, такое как
карбонилдиимидазол; производные бензотриазола, такой как 1-гидроксибензотриазол (ГОБТ, HOBT); и производные дикарбоксимида, такое как 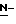 гидрокси-5-норборнен-2,3-дикарбоксимид (HONB), предпочтительно диарилфосфорилазиды.
гидрокси-5-норборнен-2,3-дикарбоксимид (HONB), предпочтительно диарилфосфорилазиды.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на вовлеченные в реакцию реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтил карбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, 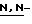 диметилацетамид,
диметилацетамид, 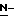 метил-2-пирролидон,
метил-2-пирролидон, 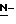 метилпирролидинон и триамид гексаметилфосфорной кислоты.
метилпирролидинон и триамид гексаметилфосфорной кислоты.
Особого ограничения на природу используемого основания также не существует, и может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают основания, описанные в отношении Способа 1, выше.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -20 до 80oC, более предпочтительно от 0oC до комнатной температуры. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 10 минут до 3 дней, более предпочтительно от 30 минут до 1 дня.
Способ 3
В этом Способе соединение формулы: RCOOH [где R такой, как определено выше] подвергают взаимодействию с соединением формулы (5) в присутствии диалкилового эфира галогенированной фосфорной кислоты, такого как диэтил хлорофосфат, и основания в растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтил карбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид,  диметилацетамид,
диметилацетамид,  метил-2-пирролидон,
метил-2-пирролидон,  метилпирролидинон и триамид гексаметилфосфорной кислоты.
метилпирролидинон и триамид гексаметилфосфорной кислоты.
Особого ограничения на природу используемого основания также не существует, и может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают основания, описанные в отношении Способа 1, выше.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 0oC до температуры кипения используемого растворителя, более предпочтительно от комнатной температуры до 50oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 10 минут до 3 дней, более предпочтительно от 30 минут до 1 дня.
Число вводимых ацильных групп варьируется в зависимости от количества используемого ацилирующего агента.
После завершения реакции по любому из вышеупомянутых Способов требуемое соединение формулы (6) может быть выделено из реакционной смеси стандартным способом. Например, требуемое соединение можно получить по следующей методике: соответствующая нейтрализация реакционной смеси; добавление несмешиваемого с водой органического растворителя, такого как этилацетат, туда после удаления нерастворимых веществ, при необходимости, путем фильтрации; промывание водой; отделение органического слоя, содержащего требуемое соединение; сушка органического слоя над безводным сульфатом магния; отгонка растворителя.
Соединение, полученное таким образом, может быть отделено и очищено, при необходимости, при помощи подходящей комбинации обычных методов, например, перекристаллизации, переосаждения или других методов, обычно используемых для выделения и очистки органических соединений, например: адсорбционная колоночная хроматография, в которой используют носитель, такой как силикагель, оксид алюминия или гель силиката магния (такой как поставляемый под торговой маркой "Florisil"); способ, в котором используют синтетический (synthesis) адсорбирующий агент, такой как распределительная хроматография, использующая носитель, такой как Sephadex LH-20 (торговая марка вещества, производимого Pharmacia Co., Ltd.), Amberlite XAD-11 (торговая марка вещества, производимого Rohm & Haas Co., Ltd.) или Diaion HP-20 (торговая марка вещества, производимого Mitsubishi Kasei Co., Ltd.); или колоночная хроматография с нормальной или обращенной фазой (предпочтительно жидкостная хроматография высокого разрешения), использующая силикагель или алкилированный силикагель и элюирование подходящим элюентом.
Стадия C2
В этой Стадии соединение формулы (1c), которое представляет собой соединение данного изобретения, получают путем обработки соединения формулы (6) реагентом, который можно удалить т-бутоксикарбонильную группу. Реакцию обычно и предпочтительно проводят в присутствии инертного растворителя.
Эта реакция, в основном, такая же, как и может проводиться тем же самым способом и используя те же самые реагенты и условия реакции, как в Стадии A2 Способа A.
Когда Wa представляет карбокси-защищающую группу, соединение данного изобретения можно получить путем последующего удаления этих защищающих групп, как указано в Стадии A2.
Способ D
Этот Способ иллюстрирует получение соединения формулы (2a), которое является одним из исходных веществ, используемых в Способах A и B.
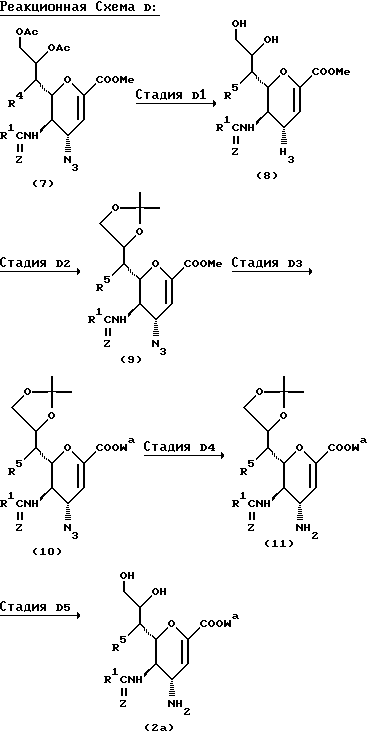
В вышеупомянутых формулах:
R1, R5, Z и Wa такие, как определено выше;
R4 представляет атом водорода, ацетокси группу или алкокси группу, имеющую от 1 до 4 углеродных атомов;
Ac представляет ацетильную группу;
Boc представляет т-бутоксикарбонильную группу; и
Me представляет метильную группу.
Стадия D1
В этой Стадии соединение формулы (8) получают взаимодействием соединения формулы (7) с основанием в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; и спирты, такой как метанол. Среди них предпочтительны галогенированные углеводороды и метанол.
Особого ограничения на природу используемого основания также не существует, при условии, что оно не воздействует на другие функциональные группы (например, метиловые группы сложного эфира), и любое основание, обычно используемое в реакции этого типа, в равной степени может быть использовано здесь. Примеры таких оснований включают метоксиды щелочных металлов, такие как метоксид натрия и метоксид калия.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает в себя: нейтрализацию реакционного раствора раствором хлористого водорода в диоксане; отгонку растворителя при пониженном давлении и очистку остатка, полученного таким образом, с помощью хроматографии на силикагеле.
Стадия D2
В этой Стадии соединение формулы (9) получают взаимодействием соединения формулы (8) с реагентом для введения изопропилиденовой группы.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; и кетоны, такие как ацетон, метилэтилкетон, метил изобутил кетон, изофорон и циклогексанон. Среди них предпочтительны кетоны (особенно ацетон).
Реагентом, используемым для введения изопропилиденовой группы, является предпочтительно 2,2-диметоксипропан. Реакцию обычно проводят в присутствии кислоты, такой как п-толуолсульфоновая кислота, в качестве катализатора.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: добавление несмешивающегося с водой растворителя, такого как этилацетат, и водного раствора кислого карбоната натрия к реакционному раствору; экстракцию требуемого соединения растворителем, таким как этилацетат; и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия D3
Эту стадию можно проводить, при необходимости, путем:
1) превращения метильной группы эфира карбоновой кислоты в другой заместитель;
2) гидролиза эфира карбоновой кислоты; или
3) выполнения вышеупомянутой 2) и затем защиты полученной свободной карбоновой кислоты.
1. Превращение сложного эфира
В этой Стадии соединение формулы (10) получают взаимодействием соединения формулы (9) со спиртом, который способен давать требуемую сложноэфирную группу, в присутствии основания и в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, т-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и монометиловый эфир этиленгликоля (такой как поставляемый под торговой маркой "Метил Целлосольв"). Среди них предпочтительны спирты, которые образуют требуемую сложноэфирную группу.
Особого ограничения на природу используемого основания также не существует, и может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают органические основания, такие как пиридин, триэтиламин, диэтиламин и 4-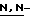 диметиламинопиридин.
диметиламинопиридин.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: нейтрализацию реакционной смеси кислотой; добавление несмешивающегося с водой растворителя, такого как этилацетат; экстракцию требуемого соединения растворителем, таким как этилацетат; промывание экстракта и отгонку растворителя. В дальнейшем, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография, при необходимости.
То же самое соединение формулы (10) можно также получить взаимодействием карбоновой кислоты [полученной путем удаления метильной группы соединения формулы (9)] со спиртом формулы Wd-OH или алкилгалогенидом формулы Wd-Hal (где Wd представляет алкильную группу и Hal представляет атом галогена).
2. Гидролиз
В этой стадии соединение формулы (10) получают взаимодействием соединения формулы (9) с основанием в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают воду или смесь воды и одного или более органических растворителей. Такими подходящими органическими растворителями являются: спирты, такие как метанол и этанол; и простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан. Среди этих растворителей предпочтительны вода или смесь воды и одного или более спиртов.
Особого ограничения на природу используемого основания также не существует, и может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия. Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно выделять из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: добавление Dowex-50x8 (H+ тип) (Dowex является торговой маркой) к реакционному раствору для его нейтрализации; отгонку растворителя при пониженном давлении и очистку полученного таким образом остатка с помощью хроматографии на силикагеле.
3. Дифенилметилирование
В этой Стадии соединение формулы (10) получают взаимодействием дифенилдиазометана с соединением формулы (9) в присутствии кислоты Льюиса и в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, т-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и монометиловый эфир этиленгликоля (такой как поставляемый под торговой маркой "Метил Целлосольв"). Среди них предпочтительны спирты (особенно метанол), галогенированные углеводороды (особенно дихлорметан) и их смеси.
Кислота Льюиса, которая обычно используется в этой реакции, предпочтительно представляет собой комплекс трифторид бора - диэтиловый эфир.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно при комнатной температуре. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя.
Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 10 минут до 5 часов, более предпочтительно от 1 до 3 часов.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: добавление кислоты, такой как уксусная кислота, к реакционной смеси; отгонку растворителя и очистку остатка с помощью перекристаллизации или хроматографии.
Стадия D4
В этой Стадии соединение формулы (11) получают из соединения формулы (10), используя восстанавливающий агент, в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, т-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и монометиловый эфир этиленгликоля (такой как поставляемый под торговой маркой "Метил Целлосольв"); кетоны, такие как ацетон, метилэтилкетон, метил изобутил кетон, изофорон и циклогексанон; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, диметилформамид, 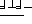 диметилацетамид,
диметилацетамид, 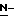 метил-2-пирролидон,
метил-2-пирролидон, 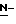 метилпирролидинон и триамид гексаметилфосфорной кислоты; сульфоксиды, такие как диметилсульфоксид и сульфолан; жирные кислоты, такие как уксусная кислота; и смеси воды и любого одного или более из этих органических растворителей. Среди них предпочтительны спирты (особенно метанол), эфиры, такие как тетрагидрофуран и диоксан, и жирные кислоты, такие как уксусная кислота, и смеси одного или более из этих органических растворителей и воды.
метилпирролидинон и триамид гексаметилфосфорной кислоты; сульфоксиды, такие как диметилсульфоксид и сульфолан; жирные кислоты, такие как уксусная кислота; и смеси воды и любого одного или более из этих органических растворителей. Среди них предпочтительны спирты (особенно метанол), эфиры, такие как тетрагидрофуран и диоксан, и жирные кислоты, такие как уксусная кислота, и смеси одного или более из этих органических растворителей и воды.
Нет особого ограничения на природу используемых восстанавливающих агентов, и здесь в равной степени может быть использован любой восстанавливающий агент, обычно используемый в реакциях этого типа. Примеры таких восстанавливающих агентов включают катализатор гидрирования, такой как палладий-на-углероде, платину или никель Ренея, в присутствии газа - водорода. Особенно предпочтительно использование Lindlar катализатора (Pd-BaSO4 или Pd-CaCO3 и хинолин или ацетат свинца в комбинации).
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно получить, например, путем фильтрации реакционного раствора при пониженном давлении, чтобы удалить катализатор, и отгонки растворителя при пониженном давлении. В дальнейшем, при необходимости, требуемое соединение можно очистить путем перекристаллизации или с помощью различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия D5
В этой Стадии соединение формулы (2a) получают путем удаления защиты изопропилиденовой группы соединения формулы (11) в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: галогенированные углеводороды, такие как метиленхлорид или хлороформ.
Реагентом, используемым для удаления защиты изопропилиденовой группы, предпочтительно является кислота. Нет особого ограничения на природу используемых кислот, и здесь в равной степени может быть использована любая кислота, обычно используемая в качестве кислотного катализатора в реакциях этого типа. Примеры таких кислот включают: кислоты Бренстеда, такие как неорганические кислоты (например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота) или органические кислоты (например, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота); кислоты Льюиса, такие как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора или трибромид бора; и кислотные ионообменные смолы. Из них предпочтительны органические кислоты (в частности, трифторуксусная кислота).
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, обычно достаточен период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: нейтрализацию реакционного раствора и отгонку растворителя при пониженном давлении. В дальнейшем, при необходимости, требуемое соединение можно очистить путем перекристаллизации или с помощью различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Способ E
В способе E получают соединение формулы (2b) или соединение формулы (2c), которые находятся среди исходных веществ, которые могут быть использованы в Способе A или B.
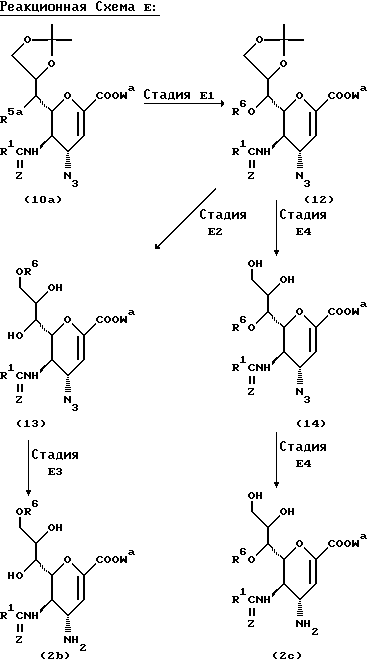
В вышеупомянутых формулах:
R1, Z и Wa такие, как определено выше;
R5a представляет гидрокси группу; и
R6 представляет алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов.
Стадия E1
В этой Стадии получают соединение формулы (12) путем введения требуемой ацильной группы в соединение формулы (10a) в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии C1 Способа C.
Стадия E2
В этой Стадии получают соединение формулы (13) путем удаления защиты изопропилиденовой группы соединения формулы (12) в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D5 Способа D.
Стадия E3
В этой Стадии получают соединение формулы (2b) из соединения формулы (13), используя восстанавливающий агент, в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D4 Способа D.
Стадия E4
В этой Стадии получают соединение формулы (14) путем обработки соединения формулы (12) реагентом, который удаляет изопропилиденовую группу в присутствии кислотного катализатора и в подходящем растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Используемым растворителем, предпочтительно, является смесь воды и уксусной кислоты (которая одновременно функционирует в качестве кислотного катализатора).
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 10 до 70oC, более предпочтительно от 30 до 60oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 24 часов, более предпочтительно от 10 до 20 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: отгонку растворителя при пониженном давлении; добавление несмешивающегося с водой растворителя, такого как этилацетат, и водного раствора кислого карбоната натрия к реакционному раствору; экстракцию требуемого соединения подходящим растворителем, таким как этилацетат, и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение можно очистить путем перекристаллизации или с помощью различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия E5
В этой Стадии получают соединение формулы (2c) из соединения формулы (14), используя восстанавливающий агент, в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D4 Способа D.
Способ F
В Способе F получают соединение формулы (2d) или соединение формулы (2e), которые находятся среди исходных веществ, используемых в Способах A и B.
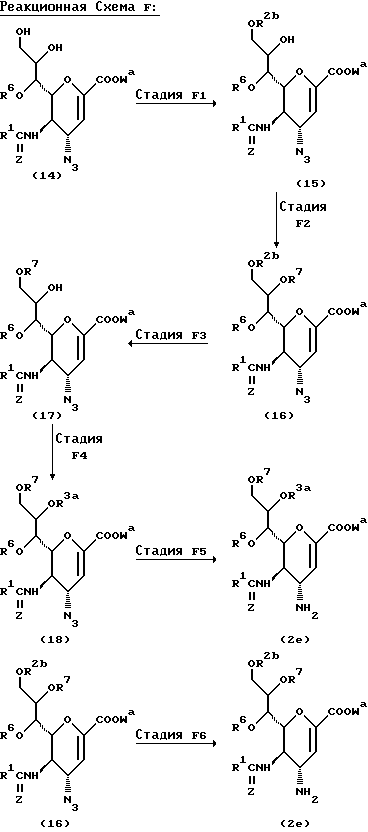
В вышеупомянутых формулах:
R1, R3a, R6, Z и Wa такие, как определено выше;
R2b представляет гидроксизащищающую группу, предпочтительно т-бутилдиметилсилильную группу; и
R7 представляет алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов.
Стадия F1
В этой Стадии получают соединение формулы (15) путем взаимодействия с соединением формулы (14) с реагентом, который защищает первичную гидрокси группу в инертном растворителе.
Нет особого ограничения на природу защищающей группы, при условии, что она может селективно защищать первичную гидрокси группу, и здесь в равной степени может быть использована любая гидроксизащищающая группа, обычно используемая в органическом синтезе. Примеры таких групп включают триалкилсилильные, диалкиларилсилильные и алкилдиарилсилильные группы, такие как т-бутил-диметилсилильная группа и т-бутилдифенилсилильная группа.
Силилирование может быть выполнено любым стандартным способом. Например, силилирование может осуществляться путем взаимодействия соединения формулы (14) с т-бутилдиметилсилил галогенидом (в частности, хлоридом) в присутствии основания, такого как триэтиламин или 4-( диметиламино)пиридин, в растворителе, таком как диметилформамид.
диметиламино)пиридин, в растворителе, таком как диметилформамид.
Реакция может протекать в широком диапазоне температур, и точная температура не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 40oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 24 часов, более предпочтительно от 10 до 20 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: добавление несмешивающегося с водой растворителя, такого как этилацетат, и водного раствора кислого карбоната натрия к реакционному раствору; экстракцию требуемого соединения подходящим растворителем, таким как этилацетат, и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение можно очистить путем перекристаллизации или с помощью различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия F2
В этой Стадии получают соединение формулы (16) путем введения требуемой ацильной группы в соединение формулы (15) в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии C1 Способа C.
Стадия F3
В этой Стадии получают соединение формулы (17) взаимодействием соединения формулы (16) с реагентом, который удаляет защищающую группу для первичной гидрокси группы.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол и этанол; воду или смесь любых двух или более из этих растворителей.
Нет особого ограничения на природу используемых агентов, удаляющих защиту, и здесь в равной степени может быть использован любой удаляющий защиту агент, обычно используемый в реакциях этого типа. Примеры таких удаляющих защиту агентов включают кислоты. Природа такой кислоты не существенна, и здесь может быть использована любая кислота, обычно используемая в стандартных реакциях в качестве кислотного катализатора. Примерами их являются: кислоты Бренстеда, такие как неорганические кислоты (например, хлористоводородна кислота, бромистоводородная кислота, серная кислота, перхлорная кислота и фосфорная кислота) и органические кислоты, такие как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота и трифторметансульфоновая кислота; кислоты Льюиса, такие как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора и трибромид бора; и кислотные ионообменные смолы. Из них предпочтительны органические кислоты (в частности, уксусная кислота и трифторуксусная кислота).
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: нейтрализацию реакционного раствора; отгонку растворителя при пониженном давлении и очистку полученного таким образом остатка с помощью хроматографии на силикагеле.
В этой Стадии ацильная группа (R7) в 8-положении сдвигается в 9-положение.
При необходимости, реагент для образования фториданиона, такой как тетрабутиламмоний фторид, может быть использован в качестве снимающего защиту агента.
Стадия F4
Эту Стадию можно осуществить путем:
1) ацилирования гидрокси группы в 8-положении; или
2) защиты гидрокси группы.
Реакция стадии 1), в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии C1 Способа C.
Реакция стадии 2) может быть осуществлена, используя т-бутилдиметилсилил трифлат в качестве реагента для введения защищающей группы и используя лутидин в качестве основания, в метиленхлориде в качестве растворителя.
Стадия F5
В этой Стадии получают соединение формулы (2d) из соединения формулы (18), используя восстанавливающий агент, в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D4 Способа D.
Стадия F6
В этой Стадии получают соединение формулы (2e) из соединения формулы (16), используя восстанавливающий агент, в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D4 Способа D.
Способ G.
В Способе G получают соединение формулы (2f) или соединение формулы (2g), которые находятся среди исходных веществ, используемых в Способах A и B.
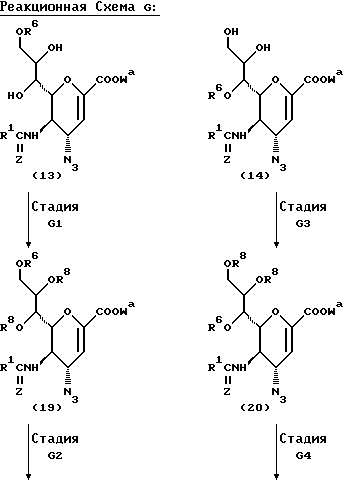

В вышеупомянутых формулах:
R1, R6, Z и Wa такие, как определено выше; и
R8 представляет алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов.
Стадия G1
В этой Стадии получают соединение формулы (19) путем введения требуемой ацильной группы в соединение формулы (13) в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии C1 Способа C.
Стадия G2
В этой Стадии получают соединение формулы (2f) из соединения формулы (19), используя восстанавливающий агент, в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D4 Способа D.
Стадия G3
В этой Стадии получают соединение формулы (20) путем введения требуемой ацильной группы в соединение формулы (14) в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии C1 Способа C.
Стадия G4
В этой Стадии получают соединение формулы (2g) из соединения формулы (20), используя восстанавливающий агент, в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D4 Способа D.
Способ H
В Способе H получают соединение формулы (5), которое находится среди исходных веществ, используемых в Способе C.
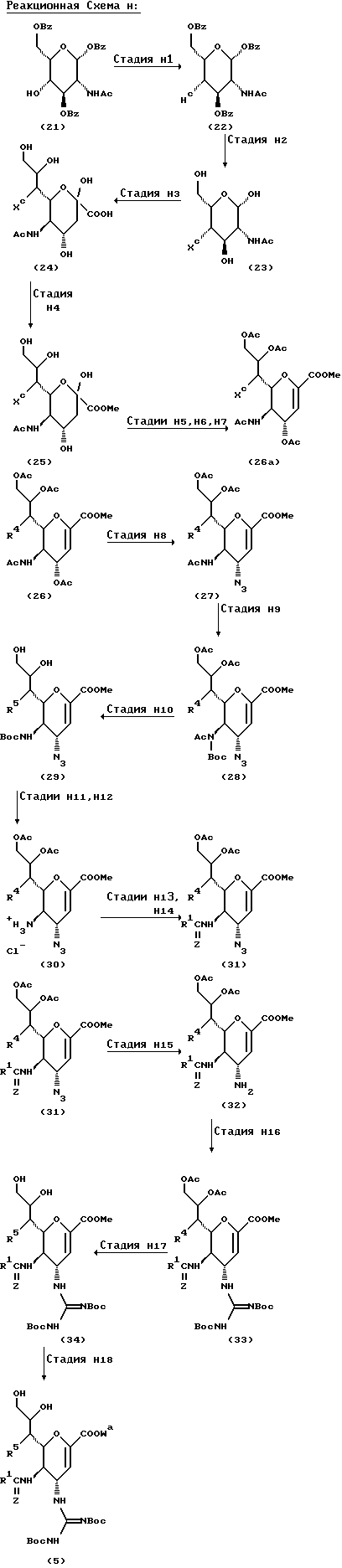
В вышеупомянутых формулах:
R1, R4, R5, Z, Wa, Ac, Boc и Me такие, как определено выше;
Xc представляет алкокси группу, имеющую от 1 до 4 углеродных атомов; и
Bz представляет бензильную группу.
Стадия H1
В этой Стадии получают соединение формулы (22) взаимодействием алкилгалогенида с соединением формулы (21) [описанным в Carbohydrate Research 83, 163 - 169 (1980)] в присутствии основания в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; амиды, такие как формамид, диметилформамид,  диметилацетамид,
диметилацетамид,  метил-2-пирролидон,
метил-2-пирролидон,  метилпиppoлидинoн и триамид гексаметилфосфорной кислоты; сульфоксиды, такие как диметилсульфоксид и сульфолан. Из них предпочтительны амиды (в частности, диметилформамид).
метилпиppoлидинoн и триамид гексаметилфосфорной кислоты; сульфоксиды, такие как диметилсульфоксид и сульфолан. Из них предпочтительны амиды (в частности, диметилформамид).
Особого ограничения на природу используемого основания также не существует, и может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают: гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, т-бутоксид калия и метоксид лития; меркаптаны щелочных металлов, такие как метилмеркаптан натрия и этилмеркаптан натрия; органические основания, такие как 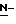 метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин,
метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, 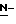 метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(
метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-( 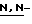 диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин, хинолин,
диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин, хинолин, 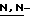 диметиланилин,
диметиланилин, 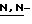 диэтиланилин, 1,5-диазабицикло[4.3.0] нон-5-ен (ДБН, DBN), 1,4-диазабицикло- [2.2.2] октан (DABCO) и 1,8-диазабицикло[5.4.0]ундек-7-ен (DBU) и органические основания металлов, такие как бутиллитий, литий диизопропиламид и литий бис (триметилсилил)амид. Из них предпочтительны гидриды щелочных металлов (особенно гидрид натрия).
диэтиланилин, 1,5-диазабицикло[4.3.0] нон-5-ен (ДБН, DBN), 1,4-диазабицикло- [2.2.2] октан (DABCO) и 1,8-диазабицикло[5.4.0]ундек-7-ен (DBU) и органические основания металлов, такие как бутиллитий, литий диизопропиламид и литий бис (триметилсилил)амид. Из них предпочтительны гидриды щелочных металлов (особенно гидрид натрия).
Особого ограничения на природу используемых алкилгалогенидов также не существует, и здесь в равной степени может быть использован любой алкилгалогенид, обычно применяемый в реакциях этого типа. Предпочтительными такими алкилгалогенидами являются алкилбромиды и алкилиодиды.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя и природа используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 0oC до 50oC, более предпочтительно при приблизительно комнатной температуре. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов, основания и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 24 часов, более предпочтительно от 2 до 10 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: добавление несмешивающегося с водой растворителя, такого как этилацетат, и водного раствора кислого карбоната натрия к реакционному раствору; экстракцию требуемого соединения подходящим растворителем, таким как этилацетат; и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия H2
В этой Стадии соединение формулы (23) получают путем взаимодействия восстанавливающего агента с соединением формулы (22) в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: спирты, такие как метанол, этанол; простые эфиры, такие как тетрагидрофуран и диоксан; жирные кислоты, такие как уксусная кислота; или смесь любого одного или более из этих органических растворителей и воды. Из них уксусная кислота предпочтительна.
Восстановление предпочтительно осуществляют при помощи водорода в присутствии катализатора гидрирования. Не существует особого ограничения на природу используемых катализаторов гидрирования, и здесь в равной степени может быть использован любой катализатор гидрирования, обычно используемый в реакциях этого типа. Примеры таких катализаторов гидрирования включают: палладий-на-углероде, платину и никель Ренея, предпочтительно палладий-на-углероде.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 0oC до 50oC, более предпочтительно при приблизительно комнатной температуре. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 24 часов, более предпочтительно от 2 до 10 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: удаление катализатора гидрирования фильтрацией; отгонку растворителя и очистку полученного таким путем остатка перекристаллизацией или при помощи различных видов хроматографии.
Стадия H3
В этой Стадии получают соединение формулы (24) путем взаимодействия пирувата натрия с соединением формулы (23) в присутствии альдолазы 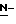 ацетилнейраминовой кислоты и азида натрия в инертном растворителе.
ацетилнейраминовой кислоты и азида натрия в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Предпочтительным растворителем является вода.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 0oC до 50oC, более предпочтительно при приблизительно комнатной температуре. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 5 часов до 5 дней, более предпочтительно от 1 до 3 дней, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: обессоливание соединения при помощи катионообменной смолы и очистку соединения при помощи хроматографии, используя анионообменную смолу.
Стадия H4
В этой Стадии получают соединение формулы (25) эстерификацией соединения формулы (24) в присутствии кислоты в метанольном растворителе.
Нет особого ограничения на природу используемых кислот, и здесь в равной степени может быть использована любая кислота, обычно используемая в качестве кислотного катализатора в реакциях этого типа. Примеры таких кислот включают: кислоты Бренстеда, такие как неорганические кислоты (например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота) или органические кислоты (например, уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота); кислоты Льюиса, такие как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора или трибромид бора; и катионообменные смолы. Из них предпочтительны катионообменные смолы.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 0oC до 50oC, более предпочтительно при приблизительно комнатной температуре. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 1 до 48 часов, более предпочтительно от 5 до 24 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси обычным способом. Например, одна подходящая методика выделения включает: удаление катионообменной смолы фильтрацией; отгонку растворителя и очистку полученного таким образом остатка путем перекристаллизации или при помощи различных типов хроматографии.
Стадия H5
В этой Стадии соединение формулы (25) ацилируют в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии C1 Способа C.
Стадия H6
В этой Стадии соединение, полученное в Стадии H5, хлорируют путем взаимодействия соединения, полученного в Стадии H5, хлористым водородом в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля. Из них предпочтительны эфиры (в частности, диоксан).
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 0oC до 50oC, более предпочтительно при приблизительно комнатной температуре. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 5 часов до 2 дней, более предпочтительно от 10 до 24 часов, обычно достаточен.
После завершения реакции растворитель и хлористый водород отгоняют при пониженном давлении и продукт используют, как таковой, для следующей реакции.
Стадия H7
В этой Стадии соединение формулы (26a) получают путем взаимодействия основания с соединением, полученным в Стадии H6, чтобы осуществить дегидрохлорирование.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля. Из них предпочтительны ароматические углеводороды (в частности, бензол).
Особого ограничения на природу используемого основания также не существует, и может быть использовано в равной степени любое основание, обычно применяемое в реакциях этого типа. Примеры таких оснований включают: алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, т-бутоксид калия и метоксид лития; меркаптаны щелочных металлов, такие как метилмеркаптан натрия и этилмеркаптан натрия; органические основания, такие как 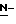 метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин,
метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, 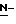 метил-пиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(
метил-пиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(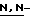 диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин, хинолин,
диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин, хинолин, 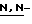 -диметиланилин,
-диметиланилин, 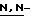 -диэтиланилин, 1,5-диазабицикло-[ 4.3.0]нон-5-ен (ДБН, DBN), 1,4-диазабицикло[2.2.2] октан (DABCO) и 1,8-диазабицикло[5.4.0]-ундек-7-ен (DBU), более предпочтительно DBU.
-диэтиланилин, 1,5-диазабицикло-[ 4.3.0]нон-5-ен (ДБН, DBN), 1,4-диазабицикло[2.2.2] октан (DABCO) и 1,8-диазабицикло[5.4.0]-ундек-7-ен (DBU), более предпочтительно DBU.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 0oC до 50oC, более предпочтительно при приблизительно комнатной температуре.
Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 5 часов до 2 дней, более предпочтительно от 10 до 24 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: добавление несмешивающегося с водой растворителя, такого как метиленхлорид, и водного раствора хлорида аммония к реакционному раствору; экстракцию требуемого соединения и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия H8
В этой Стадии соединение формулы (27) получают путем взаимодействия соединения формулы (26a), полученного, как описано в Стадии H7, или другого соединения формулы (26), которое может быть получено, как описано в W0 95/32955, с азидирующим (azidating) агентом в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид и хлороформ; простые эфиры, такие как эфир, тетрагидрофуран, диоксан и диметоксиэтан, и нитрилы, такие как ацетонитрил.
Особого ограничения на природу используемых азидирующих агентов также не существует, и здесь может быть использован в равной степени любой азидирующий агент, обычно применяемый в реакциях этого типа. Примеры таких азидирующих агентов включают: производные азида диарилфосфорной кислоты, такие как азид дифенилфосфорной кислоты; триарилсилил азиды, такие как триметилсилил азид и триэтилсилил азид; и азиды щелочных металлов, такие как азид натрия и азид калия. Из них предпочтителен азид натрия.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10oC до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: нейтрализацию реакционного раствора раствором хлористого водорода в диоксане; отгонку растворителя при пониженном давлении и очистку полученного таким образом остатка при помощи хроматографии на силикагеле.
Стадия H9
В этой Стадии соединение формулы (28) получают путем взаимодействия соединения формулы (27) с т-бутоксикарбонилирующим агентом в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид и хлороформ; простые эфиры, такие как эфир, тетрагидрофуран, диоксан и диметоксиэтан, и амиды, такие как диметилформамид.
т-Бутоксикарбонилирование может осуществляться путем взаимодействия ди-т-бутил дикарбоната или 2-(т-бутоксикарбонилоксиимино) -2-фенилацетонитрила в присутствии основания, например 4-(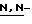 диметиламино)пиридина.
диметиламино)пиридина.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: нейтрализацию реакционного раствора; отгонку растворителя при пониженном давлении; добавление несмешивающегося с водой растворителя, такого как этилацетат, и воды к остатку; экстракцию требуемого соединения подходящим растворителем, таким как этилацетат; и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия H10
В этой Стадии соединение формулы (29) получают путем взаимодействия соединения формулы (28) с основанием в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D1 Способа D.
Стадия H11
В этой Стадии соединение формулы (29) ацетилируют в инертном растворителе.
Ацетилирование может проводиться стандартным способом, обычно используемым для защиты гидрокси группы. Например, ацетилирование может быть осуществлено 1) путем взаимодействия соединения формулы (29) с уксусным ангидридом в пиридине или 2) путем взаимодействия соединения формулы (29) с ацетил галогенидом (особенно хлоридом) в присутствии основного катализатора (например, триэтиламин, 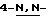 диметиламинопиридин) в метиленхлориде.
диметиламинопиридин) в метиленхлориде.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: нейтрализацию реакционного раствора; отгонку растворителя при пониженном давлении; добавление несмешивающегося с водой растворителя, такого как этилацетат, и водного раствора кислого карбоната натрия к остатку; экстракцию требуемого соединения подходящим растворителем, таким как этилацетат; и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия H12
В этой Стадии соединение формулы (30) получают путем обработки соединения, полученного в Стадии H11, с реагентом, который элиминирует т-бутоксикарбонильную группу, в инертном растворителе.
Элиминирование т-бутоксикарбонильной группы можно осуществлять обычными способами.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтил карбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; амиды, такие как формамид, диметилформамид,  диметилацетамид,
диметилацетамид,  метил-2-пирролидон,
метил-2-пирролидон,  метилпирроли-динон и триамид гексаметилфосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из них предпочтительны галогенированные углеводороды (особенно метиленхлорид).
метилпирроли-динон и триамид гексаметилфосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из них предпочтительны галогенированные углеводороды (особенно метиленхлорид).
Особого ограничения на природу реагента, используемого для элиминирования т-бутоксикарбонильной группы, не существует, и здесь в равной степени может быть использован любой реагент, обычно применяемый в реакциях этого типа. Примером такого реагента является хлористоводородная кислота.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от -10 до 50oC, более предпочтительно от 10 до 30oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 24 часов, более предпочтительно от 1 до 10 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: отгонку растворителя при пониженном давлении; добавление несмешивающегося с водой растворителя, такого как этилацетат, и водного раствора кислого карбоната натрия к реакционному раствору; экстракцию требуемого соединения подходящим растворителем, таким как этилацетат; и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия H13
В этой Стадии ацильную группу вводят в соединение формулы (30) посредством реакции с ацилирующим агентом в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии C1 Способа C.
Стадия H14
В этой Стадии соединение формулы (31) получают путем взаимодействия соединения, полученного в Стадии H13, с реагентом, который превращает карбонильную группу в тиокарбонильную группу в инертном растворителе.
Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особого ограничения на природу используемого растворителя, при условии, что он не оказывает вредного влияния на реакцию или на участвующие в реакции реагенты и что он может растворять реагенты, по крайней мере, до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля. Из них предпочтительны простые эфиры (особенно тетрагидрофуран).
Нет особого ограничения на природу реагента, используемого для превращения карбонильной группы в тиокарбонильную группу, и им предпочтительно является Lawesson's реагент.
Реакция может протекать в широком диапазоне температур, и точная температура реакции не является существенной для изобретения. Предпочтительная температура реакции обычно зависит от таких факторов, как природа растворителя, и используемого исходного вещества или реагента. Однако, в общем, нами установлено, что реакцию удобно проводить при температуре от 10 до 100oC, более предпочтительно от 40 до 70oC. Время, требуемое для реакции, также может широко варьироваться, в зависимости от многих факторов, особенно температуры реакции и природы используемых реагентов и растворителя. Однако, при условии, что реакцию осуществляют в предпочтительных условиях, описанных в общих чертах выше, период времени от 15 минут до 10 часов, более предпочтительно от 1 до 5 часов, обычно достаточен.
После завершения реакции требуемое соединение можно выделить из реакционной смеси стандартным способом. Например, одна подходящая методика выделения включает в себя: добавление несмешивающегося с водой растворителя, такого как этилацетат, и водного раствора кислого карбоната натрия к реакционному раствору; экстракцию требуемого соединения подходящим растворителем, таким как этилацетат; и отгонку растворителя. В дальнейшем, при необходимости, требуемое соединение может быть очищено перекристаллизацией или при помощи различных типов хроматографии, таких как колоночная хроматография или препаративная тонкослойная хроматография.
Стадия H15
В этой Стадии соединение формулы (32) получают из соединения формулы (31) путем использования восстанавливающего агента в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D1 Способа D.
Стадия H16
В этой Стадии соединение формулы (33) получают путем взаимодействия соединения формулы (32) с 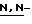 ди-т-бутоксикарбонилтиомочевиной в присутствии основания и хлорида двухвалентной ртути в инертном растворителе.
ди-т-бутоксикарбонилтиомочевиной в присутствии основания и хлорида двухвалентной ртути в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии A1 Способа A.
Стадия H17
В этой Стадии соединение формулы (34) получают путем взаимодействия соединения формулы (33), описываемым позже, с основанием в инертном растворителе.
Эта реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D1 Способа D.
Стадия H18
При необходимости данная Стадия может быть осуществлена путем 1) превращения метильной группы сложного эфира карбоновой кислоты в другой заместитель, 2) гидролиза сложного эфира карбоновой кислоты или 3) защиты карбоновой кислоты после вышеупомянутой стадии 2).
Реакция, в основном, такая же, как и может осуществляться тем же самым способом, как и используя те же самые реагенты и условия реакции, как в Стадии D3 Способа D.
В некоторых случаях соединения данного изобретения можно эффективно получить путем осуществления вышеупомянутых стадий в различном порядке, что очевидно квалифицированному читателю.
Соединения данного изобретения могут применяться, как таковые, или в смеси с обычными фармацевтически приемлемыми носителями, разбавителями или адъювантами и в различных составах, как это хорошо известно в данной области. Например, соединения данного изобретения могут применяться перорально или путем интраназального введения в виде жидкого препарата, такого как раствор или суспензия (произвольно в водной среде или в смеси или такой среде и водном сорастворителе), или в виде аэрозоля или препарата в виде порошка. Жидкие препараты, такие как растворы, необязательно включающие водный сорастворитель, могут быть приготовлены стандартным способом, например, используя очищенную воду, фармацевтически приемлемый органический растворитель (например, этанол, пропиленгликоль или ПЭГ400), стабилизирующий агент (параоксибензоат, такой как метилпарабен или пропилпарабен; спирт, такой как хлорбутанол, бензиловый спирт или фенилэтиловый спирт; бензалкониум хлорид; фенол, такой как фенол или крезол; тимеросал; или дегидроуксусная кислота). Аэрозоли можно получить стандартным способом, используя пропеллант, такой как различные газы - Фреоны (Freon) (торговая марка) и газ - азот и поверхностно-активное вещество, такое как лецитин. Препараты в виде порошка можно получить стандартным способом, используя любой один или более из наполнителя, смазки, стабилизирующего агента, корригента и разбавителя. Примеры таких наполнителей включают органические наполнители, включая: производные сахара, такие как лактоза, сахароза, глюкоза, маннит и сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α-крахмал, декстрин и карбоксиметил крахмал; производные целлюлозы, такие как кристаллическая целлюлоза, гидроксипропил целлюлоза низкого замещения, гидроксипропилметил целлюлоза, карбоксиметил целлюлоза, кальций карбоксиметил целлюлоза и межмолекулярно-сшитая натрий карбоксиметил целлюлоза; гуммиарабик; декстран и пуллулан. К другим наполнителям относятся неорганические наполнители, включая: силикатные производные, такие как мягкая двуокись кремния, синтетический силикат алюминия и алюминат метасиликат магния; фосфаты, такие как фосфат кальция; карбонаты, такие как карбонат кальция; и сульфаты, такие как сульфат кальция. Примеры смазок включают: стеариновую кислоту; соли металлов стеариновой кислоты, такие как стеарат кальция и стеарат магния; тальк; коллоидальный диоксид кремния; воски, такие как пчелиный воск и воск кашалота (sperm whale); борная кислота; адипиновая кислота; сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; 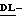 лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как кремневый ангидрид и кремневый гидрат; и вышеупомянутые производные крахмала. Примеры стабилизирующих агентов включают: параоксибензоаты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; бензалкониум хлориды; фенолы, такие как фенол и крезол; тиимеросал; дегидроуксусная кислота и сорбиновая кислота.
лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как кремневый ангидрид и кремневый гидрат; и вышеупомянутые производные крахмала. Примеры стабилизирующих агентов включают: параоксибензоаты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; бензалкониум хлориды; фенолы, такие как фенол и крезол; тиимеросал; дегидроуксусная кислота и сорбиновая кислота.
Примеры корригентов включают сластители, подкисляющие агенты и ароматизаторы.
Количество активного компонента, подлежащего использованию, обычно варьируется в зависимости от симптомов, возраста и веса тела пациента, а также от способа применения и тяжести заболевания. Однако, в общем, желательно применять активный компонент в количестве от 0,1 мг в день (предпочтительно 1 мг) до 1000 мг (предпочтительно 500 мг) в случае жидких препаратов; в случае сухих порошкообразных препаратов, активный компонент предпочтительно применяют в количестве от 0,1 мг в день (предпочтительно 1 мг) до 1000 мг (предпочтительно 500 мг); в случае аэрозолей, активный компонент предпочтительно применяют в количестве от 0,1 мг в день (предпочтительно 1 мг) до 1000 мг (предпочтительно 500 мг). Его можно применять в виде однократной дозы или в виде разделенных доз, в зависимости от состояния.
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Производные 2-дезокси-2,3-дидегидро  ацилнейраминовой кислоты данного изобретения имеют превосходную сиалидазу-ингибирующую активность и, в соответствии с этим, являются полезными для профилактики и лечения гриппа. Активность соединений данного изобретения иллюстрируется далее следующими экспериментами.
ацилнейраминовой кислоты данного изобретения имеют превосходную сиалидазу-ингибирующую активность и, в соответствии с этим, являются полезными для профилактики и лечения гриппа. Активность соединений данного изобретения иллюстрируется далее следующими экспериментами.
Эксперимент 1
Ингибирующая репликацию вируса гриппа активность
Штамм A/Yamagata/32/89 (HINI) вируса гриппа быстро размножается в живых куриных (птичьих) яйцах, и вирус, полученный этим способом, затем наносят на пластины с MDCK клетками (полученными из почки собаки), чтобы получить тромбоциты. MDCK клетки инфицируют вирусом в присутствии или отсутствии различных концентраций испытываемого соединения. Ингибирующая репликацию вируса гриппа активность испытываемых соединений может быть затем рассчитана путем сравнения количеств тромбоцитов в контрольном и испытываемом образцах.
Методология данного эксперимента находится, в общем, в соответствии с Antimicrobial Agents And Chemotherapy, 17, pp.865 - 870 (1980).
В частности, MDCK клетки культивируют в один сливающийся слой на поверхности чашек Петри, имеющих диаметр 35 мм. Условия культивирования MDCK клеток на этих пластинах представляют собой 37oC в стерильной атмосфере, содержащей 5% об/об газа-диоксида углерода. После слияния клеток культуральная жидкость поглощается. Затем на пластины добавляют количество забуференного фосфатом физиологического соляного раствора, содержащего 50-100 тое (pfu) (тромбоцит (бляшка) - образующие единицы) вируса.
Полученные пластины затем оставляют стоять в течение 1 часа при 37oC для того, чтобы допустить адсорбцию вируса, и по истечении этого времени оставшийся забуференный фосфатом физиологический соляной раствор поглощается и его заменяют MEM средой (Gibco BRL), содержащей 1 мкг/мл трипсина (Cooper Biomedical), 0,01% вес/вес DEAE декстрана Pharmacia LKB), 0,6% вес/вес агара (Sigma) вместе с испытываемым соединением в количестве от 0,00056 до 5,6 мкг/мл.
Культивирование пластин продолжают при 37oC в течение 40 часов в стерильной атмосфере, содержащей 5% газа-диоксида углерода, и по истечении этого времени отвержденную агаровую среду выделяют. Краситель кристаллический-фиолетовый (Merck) растворяют в 19% метаноле, получая конечную концентрацию 0,01%, и добавляют к выделенному агару, чтобы фиксировать и прокрасить клетки, тем самым давая возможность определить число тромбоцитов.
Число тромбоцитов, образованных в отсутствие испытываемого соединения, берется за 100% (контроль). Тогда возможно рассчитать 1C50 (концентрация в нМ/мл, при которой испытываемое соединение уменьшает число тромбоцитов на 50%), в качестве величины, определяющей ингибирующую репликацию вируса гриппа активность.
Установлено, что соединения данного изобретения демонстрируют высокую ингибирующую репликацию вируса гриппа активность, что представлено в Таблицах 3 и 4.
Соединение A в вышеуказанных Таблицах 3 и 4, a также в Таблицах 5 и 6 ниже, представляет собой соединение, полученное в Примере 3 Toku-Hyo-Hei 5-507068. Его структура представлена ниже: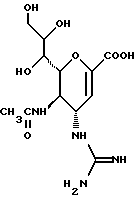
Эксперимент 2
Ингибирующая сиалидазу вируса гриппа активность
В этом эксперименте образец штамма A/PR/8/34 (HINI) вируса гриппа растворяют с помощью поверхностно-активного вещества, после чего фракцию вирусной мембраны очищают центрифугированием. Очищенную таким образом фракцию используют в качестве неочищенной сиалидазы вируса гриппа, и в качестве субстрата используют п-нитрофенил-N-ацетилнейраминовую кислоту (Wako Pure Chemical), чтобы провести испытания, аналогичные описанным в Analytical Biochemistry, 94, 287- 296 (1979).
Сначала получают раствор фермента, такой чтобы конечная активность фермента составляла 0,0011 единиц/мл (1 единица соответствует такому количеству фермента, которое гидролизует 1 мкмоль субстрата в 1 минуту). Кроме того, заранее получают водные растворы испытываемого соединения при различных концентрациях; водный раствор субстрата с концентрацией 33 мкг/мл, и 20 мМ буферный раствор 2-(  - морфолино)этансульфоновой кислоты (pH 6,5), содержащий 50 мМ хлорида кальция. Эти растворы объединяют, получая смесь, имеющую конечный объем 150 мкл, и который затем оставляют стоять при 37oC в течение 20 минут. Поглощение п-нитрофенола, образующегося в смеси, измеряют при 415 нм. Поглощение, измеренное при 415 нм, когда смесь получают путем добавления воды вместо водного раствора испытываемого соединения, берут за 100%. Таким образом, для того чтобы измерить ингибирующую сиалидазу вируса гриппа активность, IC50 (мМ) определяют как концентрацию образца, при которой поглощение уменьшается на 50%.
- морфолино)этансульфоновой кислоты (pH 6,5), содержащий 50 мМ хлорида кальция. Эти растворы объединяют, получая смесь, имеющую конечный объем 150 мкл, и который затем оставляют стоять при 37oC в течение 20 минут. Поглощение п-нитрофенола, образующегося в смеси, измеряют при 415 нм. Поглощение, измеренное при 415 нм, когда смесь получают путем добавления воды вместо водного раствора испытываемого соединения, берут за 100%. Таким образом, для того чтобы измерить ингибирующую сиалидазу вируса гриппа активность, IC50 (мМ) определяют как концентрацию образца, при которой поглощение уменьшается на 50%.
Эти результаты представлены ниже в Таблице 5.
ЭКСПЕРИМЕНТ 3
Тест на заражение мышей
Предварительно получают раствор 1500 pfu адаптированного к мышам штамма A/PR/8/34 вируса гриппа, в 50 мкл 0,42% об/об фосфатного буфера, содержащего альбумин бычьей сыворотки, и мышей (линии BALB/C, самки, возраст: 5-6 недель, 20 г) инфицируют по каплям, интраназально, полученным раствором. Испытываемое соединение суспендируют в физиологическом растворе, получая дозу 0,9 мкмоль/кг/50 мкл. Полученную суспензию вводят, по каплям, интраназально, в сумме 3 раза, один раз за 4 часа до заражения вирусом, один раз через 4 часа после заражения и один раз через 17 часов после заражения. Результат представлен в терминах числа мышей, выживших через 6 дней, 8 дней, 10 дней и 15 дней после заражения. Испытания проводят на группах мышей, причем каждая группа состоит из 12 животных. Результаты представлены в Таблице 6 ниже.
Таким образом можно видеть, что соединения данного изобретения сильно увеличивают степень выживаемости животных, подвергнутых заражению вирусом гриппа.
ПРИМЕР 1
5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-7-O-гексаноил- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
Соединение N, 76-1)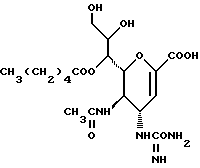
1 (i) Метил 5-ацетамидо-4-азидо-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоат
7 г (15,3 ммоль) метил 5-ацетамидо-7,8,9-три  -ацетил-4- азидо-2,3,4,5-тетрадезокси
-ацетил-4- азидо-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2- енопиранозоата растворяют в 20 мл метанола, и к полученному раствору по каплям добавляют 0,2 мл 4,9 М метанольного раствора метоксида натрия (0,98 ммоль), при перемешивании при комнатной температуре. Затем реакционную смесь перемешивают при комнатной температуре в течение 2 часов, после чего в нее по каплям добавляют 4 М раствор хлористого водорода в диоксане, pH смеси доводят до значения 6-7, и затем смесь испаряют досуха в вакууме. Полученный остаток подвергают обработке с помощью ' колоночной хроматографии на силикагеле, используя 10:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 3,56 g (выход 69%) названного соединения в виде бесцветного твердого вещества,
галакто-нон-2- енопиранозоата растворяют в 20 мл метанола, и к полученному раствору по каплям добавляют 0,2 мл 4,9 М метанольного раствора метоксида натрия (0,98 ммоль), при перемешивании при комнатной температуре. Затем реакционную смесь перемешивают при комнатной температуре в течение 2 часов, после чего в нее по каплям добавляют 4 М раствор хлористого водорода в диоксане, pH смеси доводят до значения 6-7, и затем смесь испаряют досуха в вакууме. Полученный остаток подвергают обработке с помощью ' колоночной хроматографии на силикагеле, используя 10:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 3,56 g (выход 69%) названного соединения в виде бесцветного твердого вещества,
Rf = 0,63 (5:1 = метиленхлорид:метанол)
Масс-спектр (ББА, FAB) м/е 331 (М++Н),
("FAB" - "Бомбардировка быстрыми атомами")
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 2100, 1731, 1657.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,92 (1H, дублет, J = 2,3 Гц);
4,34 (1H, дублет дублетов, J = 9,3 и 2,5 Гц);
4,27 (1H, дублет дублетов, J = 10,7 и 1,2 Гц);
4,13 (1H, дублет дублетов, J = 10,8 и 9,4 Гц);
3,82 - 3,92 (2H, мультиплет);
3,79 (3H, синглет);
3,66 (1H, дублет дублетов, J = 11,4 и 5,0 Гц);
3,60 (1H, широкий дублет, J = 9,3 Гц);
2,03 (3H, синглет).
1(ii) Метил 5-ацетамидо-4-азидо-8,9-O-изопропилиден-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоат
3,33 г (10,1 ммоль) метил 5-ацетамидо-4-азидо- 2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон- 2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 10 мл ацетона, и добавляют к полученному раствору 3,7 мл 2,2-диметоксипропана (30,2 ммоль) и 100 мг п-толуолсульфоновой кислоты 1 гидрата (0,52 ммоль) при перемешивании при комнатной температуре. Затем смесь перемешивают в течение 30 минут. По окончании этого времени к реакционной смеси добавляют 200 мл этилацетата и 60 мл насыщенного водного раствора кислого карбоната натрия, и смесь разделяют, чтобы отделить органический слой. Органический слой промывают три раза, каждый раз 50 мл насыщенного водного раствора кислого карбоната натрия и затем один раз 50 мл насыщенного водного раствора хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Этот остаток подвергают очистке с помощью колоночной хроматографии на силикагеле, используя 2:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 3,24 г (выход 87%) названного соединения в виде бесцветного твердого вещества.
галакто-нон- 2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 10 мл ацетона, и добавляют к полученному раствору 3,7 мл 2,2-диметоксипропана (30,2 ммоль) и 100 мг п-толуолсульфоновой кислоты 1 гидрата (0,52 ммоль) при перемешивании при комнатной температуре. Затем смесь перемешивают в течение 30 минут. По окончании этого времени к реакционной смеси добавляют 200 мл этилацетата и 60 мл насыщенного водного раствора кислого карбоната натрия, и смесь разделяют, чтобы отделить органический слой. Органический слой промывают три раза, каждый раз 50 мл насыщенного водного раствора кислого карбоната натрия и затем один раз 50 мл насыщенного водного раствора хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Этот остаток подвергают очистке с помощью колоночной хроматографии на силикагеле, используя 2:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 3,24 г (выход 87%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,38 (20:1 = метиленхлорид: метанол).
Масс-спектр (ББА, FAB) м/з 371 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 2094, 1734, 1656.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,98 (1H, дублет, J-2,5 Гц);
5,66 (1H, широкий дублет, J = 6,9 Гц);
4,32 - 4,41 (1H, мультиплет);
4,03 - 4,28 (6H, мультиплет);
3,81 (3H, синглет);
3,57 (1H, дублет дублетов, J = 7,9 и 5,2 Гц);
2,12 (3H, синглет);
1,66 (1H, синглет);
1,39 (3H, синглет);
1,36 (3H, синглет).
1 (iii) Метил 5-ацетамидо-4-азидо-7-O-гексаноил-8,9-O- изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоат
1,35 г (3,65 ммоль) метил 5-ацетамидо-4-азидо-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 30 мл метиленхлорида, и к полученному раствору добавляют 490 мг (4,01 ммоль) диметиламинопиридина и 0,61 мл (4,37 ммоль) гексаноил хлорида при перемешивании и охлаждении льдом. Затем реакционную смесь перемешивают при комнатной температуре в течение 30 минут, после чего по каплям при охлаждении льдом добавляют 0,56 мл триэтиламина. Смесь затем перемешивают при комнатной температуре в течение еще 2 дней. К полученному раствору добавляют 200 мл этилацетата и 100 мл насыщенного водного раствора кислого карбоната натрия, и смесь разделяют, чтобы отделить органический слой. Органический слой промывают три раза, каждый раз 50 мл насыщенного водного раствора хлорида натрия, и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Остаток подвергают очистке с помощью колоночной хроматографии на силикагеле, используя 100:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 0,69 г (выход 34%) названного соединения в виде желтого масла.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 30 мл метиленхлорида, и к полученному раствору добавляют 490 мг (4,01 ммоль) диметиламинопиридина и 0,61 мл (4,37 ммоль) гексаноил хлорида при перемешивании и охлаждении льдом. Затем реакционную смесь перемешивают при комнатной температуре в течение 30 минут, после чего по каплям при охлаждении льдом добавляют 0,56 мл триэтиламина. Смесь затем перемешивают при комнатной температуре в течение еще 2 дней. К полученному раствору добавляют 200 мл этилацетата и 100 мл насыщенного водного раствора кислого карбоната натрия, и смесь разделяют, чтобы отделить органический слой. Органический слой промывают три раза, каждый раз 50 мл насыщенного водного раствора хлорида натрия, и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Остаток подвергают очистке с помощью колоночной хроматографии на силикагеле, используя 100:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 0,69 г (выход 34%) названного соединения в виде желтого масла.
Rf = 0,46 (20:1 = метиленхлоридхлорид:метанол).
Масс-спектр (ББА, FAB) м/з 469 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 2099, 1745, 1660.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,95 (1H, дублет, J = 2,6 Гц);
5,76 (1H, широкий дублет, J = 7,8 Гц);
5,34 (1H, дублет дублетов, J = 5,3 и 1,8 Гц);
4,85 (1H, дублет дублетов, J = 9,0 и 2,7 Гц);
4,73 (1H, дублет дублетов, J = 10,4 и 1,7 Гц);
4,39 (1H, дублет дублетов, J = 11,4 и 6,1 Гц);
4,14 (1H, дублет дублетов, J = 12,3 и 6,3 Гц);
3,95 (1H, дублет дублетов, J = 8,8 и 6,2 Гц);
3,81 (3H, синглет);
3,40 (1H, дублет дублетов, J = 18,7 и 8,6 Гц);
2,28 - 2,52 (2H, мультиплет);
2,02 (3H, синглет);
1,53 - 1,72 (2H, мультиплет);
1,37 (3H, синглет);
1,35 (3H, синглет);
1,25 - 1,43 (4H, мультиплет);
0,86 - 0,94 (3H, мультиплет).
1 (iv) Метил 5-ацетамидо-4-амино-7-O-гексаноил-8,9-O- изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоат
650 мг (1,38 ммоль) метил 5-ацетамидо-4-азидо-7  гексаноил-8,9
гексаноил-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоат [полученного, как описано в стадии (iii) выше] растворяют в 20 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 400 мг Lindlar катализатора. Затем реакционную систему деаэрируют и воздух замещают водородом. Затем реакционную смесь перемешивают при комнатной температуре в течение 2 часов, после чего ее фильтруют при пониженном давлении, и растворитель удаляют из фильтрата с помощью дистилляции при пониженном давлении, получая остаток. Полученный остаток подвергают очистке с помощью колоночной хроматографии на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола, а затем смесь 10:1, по объему, метиленхлорида и метанола, в качестве элюента, получая 0,63 г (выход 100%) названного соединения в виде желтого аморфного вещества.
галакто-нон-2-енопиранозоат [полученного, как описано в стадии (iii) выше] растворяют в 20 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 400 мг Lindlar катализатора. Затем реакционную систему деаэрируют и воздух замещают водородом. Затем реакционную смесь перемешивают при комнатной температуре в течение 2 часов, после чего ее фильтруют при пониженном давлении, и растворитель удаляют из фильтрата с помощью дистилляции при пониженном давлении, получая остаток. Полученный остаток подвергают очистке с помощью колоночной хроматографии на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола, а затем смесь 10:1, по объему, метиленхлорида и метанола, в качестве элюента, получая 0,63 г (выход 100%) названного соединения в виде желтого аморфного вещества.
Rf = 0,17 (10:1 = метиленхлорид:метанол).
Масс-спектр (ББА, FAB) м/з 443 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1743, 1660.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,97 (1H, дублет, J = 2,3 Гц);
5,51 (1H, широкий дублет, J = 9,0 Гц);
5,43 (1H, дублет дублетов, J = 5,0 и 1,9 Гц);
4,40 (1H, дублет дублетов, J = 17,2 и 6,5 Гц);
4,37 (1H, дублет дублетов, J = 9,9 и 1,4 Гц);
4,15 (1H, дублет дублетов, J = 8,9 и 6,3 Гц);
3,95 (1H, дублет дублетов, J = 8,7 и 6,8 Гц);
3,80 (3H, синглет);
3,73 - 3,80 (1H, мультиплет);
3,60 (1H, дублет дублетов, J = 19,0 и 9,3 Гц);
2,24 - 2,49 (2H, мультиплет);
2,02 (3H, синглет);
1,53 - 1,70 (2H, мультиплет);
1,37 (3H, синглет);
1,35 (3H, синглет);
1,25 - 1,43 (4H, мультиплет);
0,86 - 0,94 (3H, мультиплет).
1 (v) 5-Ацетамидо-4-амино-7-O-гексаноил-8,9-O-изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоевая кислота
470 мг (1,06 ммоль) метил 5-ацетамидо-4-амино-7  гексаноил-8, 9
гексаноил-8, 9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (iv) выше] растворяют в смеси 4 мл метанола и 4 мл воды, и к полученному раствору добавляют при перемешивании при комнатной температуре 47 мг (1,12 ммоль) гидроксида лития 1 гидрат. Затем смесь перемешивают в течение дополнительных 30 минут. По окончании этого времени к смеси постепенно добавляют Dowex-50Wx8 (H+) смолу (Dowex - торговая марка), pH смеси доводят до значения приблизительно 7,5. Сразу после доведения pH полученную суспензию быстро фильтруют при пониженном давлении. Остаток, полученный путем дистилляции фильтрата при пониженном давлении, подвергают очистке при помощи колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 375 мг (выход 82%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (iv) выше] растворяют в смеси 4 мл метанола и 4 мл воды, и к полученному раствору добавляют при перемешивании при комнатной температуре 47 мг (1,12 ммоль) гидроксида лития 1 гидрат. Затем смесь перемешивают в течение дополнительных 30 минут. По окончании этого времени к смеси постепенно добавляют Dowex-50Wx8 (H+) смолу (Dowex - торговая марка), pH смеси доводят до значения приблизительно 7,5. Сразу после доведения pH полученную суспензию быстро фильтруют при пониженном давлении. Остаток, полученный путем дистилляции фильтрата при пониженном давлении, подвергают очистке при помощи колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 375 мг (выход 82%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,26 (2:5:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/з 429 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1750, 1666.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,60 (1H, дублет, J = 2,1 Гц);
5,41 (1H, дублет дублетов, J = 5,4 и 1,9 Гц);
4,58 (1H, триплет, J = 6,0 Гц);
4,15 - 4,28 (3H, мультиплет);
3,92 (1H, дублет дублетов, J = 10,8 и 6,1 Гц);
3,79 - 3,87 (1H, мультиплет);
2,30 - 2,40 (2H, мультиплет);
1,96 (3H, синглет);
1,53 - 1,70 (2H, мультиплет);
2,35 (3H, синглет);
1,32 (3H, синглет);
1,25 - 1,43 (4H, мультиплет);
0,87 - 0,96 (3H, мультиплет).
1 (vi) 5-Ацетамидо-4-амино-7-O-гексаноил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
270 мг (0,63 ммоль) 5-ацетамидо-4-амино-7  -гексаноил-8,9
-гексаноил-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (v) выше] растворяют в смеси 12 мл уксусной кислоты и 3 мл воды при комнатой температуре, и затем смесь перемешивают при 60oC в течение 2,5 часов. По окончании этого времени остаток, полученный путем дистилляции растворителя при пониженном давлении, подвергают азеотропной дистилляции бензолом, а затем концентрируют досуха в вакууме. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 174 мг (выход 71%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (v) выше] растворяют в смеси 12 мл уксусной кислоты и 3 мл воды при комнатой температуре, и затем смесь перемешивают при 60oC в течение 2,5 часов. По окончании этого времени остаток, полученный путем дистилляции растворителя при пониженном давлении, подвергают азеотропной дистилляции бензолом, а затем концентрируют досуха в вакууме. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 174 мг (выход 71%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,32 (5:1:1 = изопропанол : этилацетат : метанол).
Масс-спектр (ББА, FAB) м/з 389 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1745, 1662.
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
5,66 (1H, дублет, J = 2,2 Гц);
5,13 (1H, дублет дублетов, J = 9,3 и 1,7 Гц);
4,47 (1H, дублет дублетов, J = 10,5 и 1,3 Гц);
4,17 (1H, триплет, J = 10,0 Гц);
4,00 - 4,10 (2H, мультиплет);
3,59 (1H, дублет дублетов, J = 12,0 и 3,1 Гц);
3,39 (1H, дублет дублетов, J = 12,0 и 6,1 Гц);
2,32 - 2,39 (2H, мультиплет);
1,91 (3H, синглет);
1,45 - 1,63 (2H, мультиплет);
1,20 - 1,28 (4H, мультиплет);
0,78 - 0,86 (3H, мультиплет).
1 (vii) 5-Ацетамидо-4-цианамидо-7-O-гексаноил-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
155 мг (0,40 ммоль) 5-ацетамидо-4-амино-7  гексаноил- 2,3,4,5-тетрадезокси- D -глицеро
гексаноил- 2,3,4,5-тетрадезокси- D -глицеро  галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (vi) выше] растворяют в 4 мл метанола, и к полученному раствору, при перемешивании и при комнатной температуре, добавляют 65 мг (0,80 ммоль) ацетата натрия и 53 мг (0,50 ммоль) бромциана. Затем реакционную смесь перемешивают при комнатной температуре в течение дополнительных 40 минут, после чего удаляют растворитель путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 144 мг (выход 85%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (vi) выше] растворяют в 4 мл метанола, и к полученному раствору, при перемешивании и при комнатной температуре, добавляют 65 мг (0,80 ммоль) ацетата натрия и 53 мг (0,50 ммоль) бромциана. Затем реакционную смесь перемешивают при комнатной температуре в течение дополнительных 40 минут, после чего удаляют растворитель путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 144 мг (выход 85%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,21 (2:5:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/з 436 (M++Na), 452 (М++К).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,73 (1H, дублет, J = 1,0 Гц);
5,07 (1H, дублет дублетов, J = 7,8 и 1,2 Гц);
4,49 (1H, дублет, J = 10,6 Гц);
4,47 (1H, дублет дублетов, J = 10,5 и 1,3 Гц);
4,05 - 4,18 (2H, мультиплет);
3,85 (1H, дублет дублетов, J = 9,8 и 1,8 Гц);
3,63 - 3,73 (1H, мультиплет);
3,48 - 3,58 (1H, мультиплет);
2,28 - 2,48 (2H, мультиплет);
1,95 (3H, синглет);
1,54 - 1,68 (2H, мультиплет);
1,28 - 1,40 (4H, мультиплет);
0,87 - 0,96 (3H, мультиплет).
1 (viii) 5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-7-O- гeкcaнoил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоевая кислота
88 мг (0,21 ммоль) 5-aцетaмидo-4-циaнaмидo-7  гексаноил-2,3,4,5-тетрадезокси -O- глицеро
гексаноил-2,3,4,5-тетрадезокси -O- глицеро  галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (vii) выше] растворяют в 4 мл метанола, и к полученному раствору, при перемешивании и комнатной температуре, добавляют 15 мг (0,21 ммоль) гидрохлорида гидроксиламина. Затем реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов, после чего удаляют растворитель путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:12, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 43 мг (выход 45%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (vii) выше] растворяют в 4 мл метанола, и к полученному раствору, при перемешивании и комнатной температуре, добавляют 15 мг (0,21 ммоль) гидрохлорида гидроксиламина. Затем реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов, после чего удаляют растворитель путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:12, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 43 мг (выход 45%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,50 (5:1:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/з 447 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1727, 1661, 1631.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,57 (1H, дублет, J = 1,9 Гц);
5,13 (1H, дублет дублетов, J = 8,7 и 1,9 Гц);
4,47 (1H, широкий дублет, J = 10,2 Гц);
4,29 (1H, широкий дублет, J = 9,3 Гц);
4,21 (1H, триплет, J = 9,9 Гц);
4,00 - 4,09 (1H, мультиплет);
3,58 (1H, дублет дублетов, J = 8,7 и 3,4 Гц);
3,43 (1H, дублет дублетов, J = 11,5 и 5,7 Гц);
2,30 - 2,40 (2H, мультиплет);
1,91 (3H, синглет);
1,52 - 1,68 (2H, мультиплет);
1,28 - 1,40 (4H, мультиплет);
0,88 - 0,96 (3H, мультиплет).
ПРИМЕР 2
5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота (Соединение N 34-1)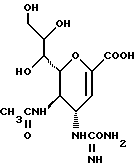
2 (i) 5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
20 мг (0,05 ммоль) 5-ацетамидо-4 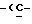 аминоокси
аминоокси 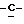 иминометиламино)-7
иминометиламино)-7  гексаноил-2,3,4,5-тетрадезокси
гексаноил-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоевой кислоты (полученной, как описано в Примере 1) растворяют в 20 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 2,1 мл 4,9 М метанольного раствора метоксида натрия (0,01 ммоль). Затем раствор перемешивают при комнатной температуре в течение еще 2 часов, после чего добавляют 4 М раствор хлористого водорода в диоксане, чтобы довести pH до значения 6 - 7. Затем смесь испаряют досуха в вакууме. Полученный остаток очищают при помощи колоночной хроматографии на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды, получая 7,3 мг (выход 50%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты (полученной, как описано в Примере 1) растворяют в 20 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 2,1 мл 4,9 М метанольного раствора метоксида натрия (0,01 ммоль). Затем раствор перемешивают при комнатной температуре в течение еще 2 часов, после чего добавляют 4 М раствор хлористого водорода в диоксане, чтобы довести pH до значения 6 - 7. Затем смесь испаряют досуха в вакууме. Полученный остаток очищают при помощи колоночной хроматографии на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды, получая 7,3 мг (выход 50%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 (4:1:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 325 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 МГц) δ (ппм):
5,58 (1H, дублет, J = 2,0 Гц);
4,42 (1H, дублет дублетов, J = 10,0 и 2,0 Гц);
4,30 (1H, дублет, J = 10,0 Гц);
4,20 (1H, дублет дублетов, J = 10,0 и 10,0 Гц);
3,90 (1H, мультиплет);
3,85 (1H, дублет дублетов, J = 12,0 и 2,2 Гц);
3,55 - 3,65 (2H, мультиплет);
1,99 (3H, синглет).
ПРИМЕР 3
5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-9-O-гексаноил-2,3,4, 5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота (Соединение N 34-36)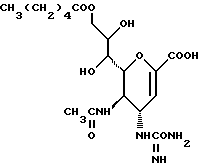
3 (i) 5-Ацетамидо-4-амино-9-O-гексаноил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
80 мг (0,21 ммоль) 5-ацетамидо-4-амино-7  гексаноил- 2,3,4,5-тетрадезокси
гексаноил- 2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в Примере 1 (vi)] растворяют в смеси 3 мл трифторуксусной кислоты и 6 мл метиленхлорида при комнатной температуре, и затем смесь перемешивают при комнатной температуре в течение еще 6 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Этот остаток подвергают азеотропной дистилляции с бензолом, после чего его испаряют досуха под вакуумом. Затем полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 55 мг (выход 68%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в Примере 1 (vi)] растворяют в смеси 3 мл трифторуксусной кислоты и 6 мл метиленхлорида при комнатной температуре, и затем смесь перемешивают при комнатной температуре в течение еще 6 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Этот остаток подвергают азеотропной дистилляции с бензолом, после чего его испаряют досуха под вакуумом. Затем полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 55 мг (выход 68%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,39 (5:1:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 389 (М++H).
[α]
Спектр инфракрасного поглощения νмакс макс (см-1): 1724, 1664.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,56 (1H, дублет, J = 2,1 Гц);
4,38 (1H, дублет дублетов, J = 11,1 и 1,9 Гц);
4,30 (1H, синглет);
4,28 (1H, дублет, J = 1,9 Гц);
4,07 - 4,25 (2H, мультиплет);
3,93 - 4,02 (1H, мультиплет);
3,58 (1H, дублет, J = 9,3 Гц);
2,37 (2H, триплет, J = 7,4 Гц);
2,04 (3H, синглет);
1,57 - 1,71 (2H, мультиплет);
1,27 - 1,40 (4H, мультиплет);
0,88 - 0,96 (3H, мультиплет).
3 (ii) 5-Ацетамидо-4-цианамидо-9-O-гексаноил-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
46 мг (0,12 ммоль) 5-ацетамидо-4-амино-9  гексаноил- 2,3,4,5-тетрадезокси
гексаноил- 2,3,4,5-тетрадезокси  глицеро
глицеро 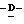 галакто-нон-енопиранозоевой кислоты [полученной, как описано в стадии (i) выше] растворяют в 10 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 29 мг (0,35 ммоль) ацетата натрия и 17 мг (0,16 ммоль) цианбромида. Реакционную смесь перемешивают при комнатной температуре в течение еще 40 минут, и затем растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Этот остаток подвергают колоночной хроматографии на силикагеле, используя 2: 5: 12, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 29 мг (выход 60%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-енопиранозоевой кислоты [полученной, как описано в стадии (i) выше] растворяют в 10 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 29 мг (0,35 ммоль) ацетата натрия и 17 мг (0,16 ммоль) цианбромида. Реакционную смесь перемешивают при комнатной температуре в течение еще 40 минут, и затем растворитель удаляют дистилляцией при пониженном давлении, получая остаток. Этот остаток подвергают колоночной хроматографии на силикагеле, используя 2: 5: 12, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 29 мг (выход 60%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,43 (2:5:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 436 (M++Na), 458 (M++2Na-H).
[α]
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,66 (1H, дублет, J = 2,0 Гц);
3,95 - 4,36 (6H, мультиплет);
3,67 (1H, дублет, J = 7,4 Гц);
2,36 (2H, триплет, J = 7,5 Гц);
2,05 (3H, синглет);
1,55 - 1,71 (2H, мультиплет);
1,27 - 1,40 (4H, мультиплет);
0,88 - 0,96 (3H, мультиплет).
3 (iii) 5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-9-O-гексаноил- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
24 мг (0,06 ммоль) 5-ацетамидо-4-цианамидо 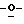 гексаноил-2,3,4,5-тетрадезокси
гексаноил-2,3,4,5-тетрадезокси 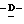 глицеро
глицеро 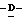 галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 4 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 4,5 мг (0,06 ммоль) гидрохлорида гидроксиламина. Реакционную смесь перемешивают при комнатной температуре в течение дополнительных 4 часов, после чего удаляют растворитель путем дистилляции при пониженном давлении, получая остаток. Этот остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 18 мг (выход 70%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 4 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 4,5 мг (0,06 ммоль) гидрохлорида гидроксиламина. Реакционную смесь перемешивают при комнатной температуре в течение дополнительных 4 часов, после чего удаляют растворитель путем дистилляции при пониженном давлении, получая остаток. Этот остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 18 мг (выход 70%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,58 (5:1:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 447 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1723, 1656.
1H-Спектр ядерного магнитного резонанса (D2O, 270 МГц) δ (ппм):
5,57 (1H, дублет, J = 2,0 Гц);
4,30 - 4,46 (3H, мультиплет);
4,08 - 4,25 (3H, мультиплет);
3,68 (1H, дублет, J = 9,4 Гц);
2,37 (2H, триплет, J = 7,3 Гц);
1,98 (3H, синглет);
1,50 - 1,64 (2H, мультиплет);
1,18 - 1,32 (4H, мультиплет);
0,77 - 0,86 (3H, мультиплет).
ПРИМЕР 4
5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-7-O- тетрадеканоил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоевая кислота (Соединение N 106-1)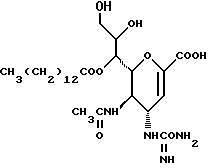
4 (i) Метил 5-ацетамидо-4-азидо-7-O-тетрадеканоил-8,9-O- изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоат
1,50 г (4,05 ммоль) метил 5-ацетамидо-4-азидо-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 1 (ii)] растворяют в 30 мл метиленхлорида, и к полученному раствору при перемешивании на бане со льдом добавляют 545 мг (4,45 ммоль) диметиламинопиридина и 1,32 мл (4,86 ммоль) тетрадеканоил хлорида. Затем реакционную смесь перемешивают при комнатной температуре в течение 40 минут, после чего 0,62 мл (4,45 ммоль) триэтиламина добавляют по каплям к смеси на бане со льдом. Затем смесь перемешивают при комнатной температуре в течение 20 часов. По окончании этого времени к реакционной смеси добавляют 200 мл этилацетата и 100 мл насыщенного водного раствора кислого карбоната натрия, и смесь разделяют, чтобы отделить органический слой. Органический слой промывают три раза, каждый раз 50 мл насыщенного водного раствора хлорида натрия. Затем его сушат над безводным сульфатом натрия, после чего удаляют растворитель путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 100: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 1,57 г (выход 67%) названного соединения в виде желтого масла.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 1 (ii)] растворяют в 30 мл метиленхлорида, и к полученному раствору при перемешивании на бане со льдом добавляют 545 мг (4,45 ммоль) диметиламинопиридина и 1,32 мл (4,86 ммоль) тетрадеканоил хлорида. Затем реакционную смесь перемешивают при комнатной температуре в течение 40 минут, после чего 0,62 мл (4,45 ммоль) триэтиламина добавляют по каплям к смеси на бане со льдом. Затем смесь перемешивают при комнатной температуре в течение 20 часов. По окончании этого времени к реакционной смеси добавляют 200 мл этилацетата и 100 мл насыщенного водного раствора кислого карбоната натрия, и смесь разделяют, чтобы отделить органический слой. Органический слой промывают три раза, каждый раз 50 мл насыщенного водного раствора хлорида натрия. Затем его сушат над безводным сульфатом натрия, после чего удаляют растворитель путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 100: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 1,57 г (выход 67%) названного соединения в виде желтого масла.
Rf = 0,49 (20:1 = метиленхлорид:метанол).
Масс-спектр (ББА, FAB) м/е 603 (M++Na).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 2100, 1745, 1661.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
6,14 (1H, дублет, J = 5,8 Гц);
5,77 (1H, широкий дублет, J = 9,8 Гц);
5,42 (1H, дублет дублетов, J = 5,2 и 2,1 Гц);
4,37 - 4,53 (2H, мультиплет);
4,10 - 4,27 (3H, мультиплет);
3,94 (1H, дублет дублетов, J = 8,7 и 6,7 Гц);
3,83 (3H, синглет);
2,21 - 2,47 (2H, мультиплет);
1,99 (3H, синглет);
1,52 - 1,68 (2H, мультиплет);
1,37 (3H, синглет);
1,35 (3H, синглет);
1,20 - 1,48 (20H, мультиплет);
0,85 - 0,92 (3H, мультиплет).
4 (ii) Метил 5-ацетамидо-4-амино-7-O-тетрадеканоил-8,9-O- изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоат
1,50 г (2,65 ммоль) метил 5-ацетамидо-4-азидо-7 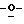 тетрадеканоил-8,9
тетрадеканоил-8,9 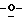 изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси 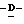 глицеро
глицеро 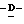 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 20 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 600 мг Lindlar катализатора. Затем атмосферу в реакционной системе замещают водородом, и смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени реакционную систему фильтруют при пониженном давлении, используя Celite (торговая марка) вспомогательный фильтрующий материал, и растворитель удаляют из фильтрата путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола и затем 10:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 710 мг (выход 50%) названного соединения в виде желтого аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 20 мл метанола, и к полученному раствору при перемешивании при комнатной температуре добавляют 600 мг Lindlar катализатора. Затем атмосферу в реакционной системе замещают водородом, и смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени реакционную систему фильтруют при пониженном давлении, используя Celite (торговая марка) вспомогательный фильтрующий материал, и растворитель удаляют из фильтрата путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола и затем 10:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 710 мг (выход 50%) названного соединения в виде желтого аморфного вещества.
Rf = 0, 29 ( 10:1 = метиленхлорид:метанол).
Масс-спектр (ББА, FAB) м/е 555 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1753, 1738, 1660.
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
5,98 (1H, дублет, J = 2,01 Гц);
5,61 (1H, широкий синглет);
5,43 (1H, дублет дублетов, J = 5,1 и 1,9 Гц);
4,35 - 4,45 (2H, мультиплет);
4,15 (1H, дублет дублетов, J = 8,9 и 6,3 Гц);
3,9.5 (1H, дублет дублетов, J = 8,9 и 6,8 Гц);
3,83 (1H, широкий синглет);
3,80 (3H, синглет);
3,64 (1H, широкий дублет, J = 8,4 Гц);
2,25 - 2,50 (2H, мультиплет);
2,01 (3H, синглет);
1,77 (1H, широкий синглет);
1,53 - 1,69 (2H, мультиплет);
1,37 (3H, синглет);
1,35 (3H, синглет);
1,22 - 1,35 (20H, мультиплет);
0,85 - 0,92 (3H, мультиплет).
4 (iii) 5-Ацетамидо-4-амино-7-O-тетрадеканоил-8,9-O- изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто- нон-2-енопиранозоевая кислота
710 мг (1,28 ммоль) метил 5-ацетамидо-4-амино-7  тетрадеканоил-8,9
тетрадеканоил-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в смеси 4 мл метанола и 4 мл воды, и к полученному раствору добавляют 59 мг (1,41 ммоль) гидроксида лития 1 гидрата, при перемешивании при комнатной температуре. Затем смесь перемешивают в течение дополнительных 30 минут при комнатной температуре. Затем к смеси постепенно добавляют Dowex-50Wx8 (H+) смолу (Dowex - торговая марка), pH смеси доводят до значения приблизительно 7,5. Сразу после доведения pH полученную суспензию быстро фильтруют при пониженном давлении. Остаток, полученный путем дистилляции растворителя из фильтрата при пониженном давлении, подвергают очистке при помощи колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 490 мг (выход 71%) названного соединения в виде бесцветного твердого вещества
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в смеси 4 мл метанола и 4 мл воды, и к полученному раствору добавляют 59 мг (1,41 ммоль) гидроксида лития 1 гидрата, при перемешивании при комнатной температуре. Затем смесь перемешивают в течение дополнительных 30 минут при комнатной температуре. Затем к смеси постепенно добавляют Dowex-50Wx8 (H+) смолу (Dowex - торговая марка), pH смеси доводят до значения приблизительно 7,5. Сразу после доведения pH полученную суспензию быстро фильтруют при пониженном давлении. Остаток, полученный путем дистилляции растворителя из фильтрата при пониженном давлении, подвергают очистке при помощи колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 490 мг (выход 71%) названного соединения в виде бесцветного твердого вещества
Rf = 0,29 (2:5:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 541 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1750, 1666.
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
5,61 (1H, дублет, J = l,9 Гц);
5,41 (1H, дублет дублетов, J = 6,0 и 1,4 Гц);
4,59 (1H, дублет дублетов, J = 12,0 и 6,2 Гц);
4,13 - 4,28 (3H, мультиплет);
3,93 (1H, дублет дублетов, J = 9,0 и 6,4 Гц);
3,79 - 3,86 (1H, мультиплет);
2,28 - 2,42 (2H, мультиплет);
1,96 (3H, синглет);
1,52 - 1,70 (2H, мультиплет);
1,35 (3H, синглет);
1,33 (3H, синглет);
1,26 - 1,43 (20H, мультиплет);
0,87 - 0,95 (3H, мультиплет).
4 (iv) 5-Ацетамидо-4-амино-7-O-тетрадеканоил-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
480 мг (0,89, ммоль) 5-ацетамидо-4- амино-7  тетрадеканоил-8,9
тетрадеканоил-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (iii) выше] растворяют в смеси 10 мл уксусной кислоты и 10 мл воды при комнатной температуре, и смесь перемешивают в течение 5 часов при комнатной температуре. Затем растворитель удаляют путем дистилляции при пониженном давлении и полученный остаток подвергают азеотропной дистилляции с бензолом, после чего испаряют досуха в вакууме. Полученный остаток подвергают очистке при помощи колоночной хроматографии на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 110 мг (выход 25%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (iii) выше] растворяют в смеси 10 мл уксусной кислоты и 10 мл воды при комнатной температуре, и смесь перемешивают в течение 5 часов при комнатной температуре. Затем растворитель удаляют путем дистилляции при пониженном давлении и полученный остаток подвергают азеотропной дистилляции с бензолом, после чего испаряют досуха в вакууме. Полученный остаток подвергают очистке при помощи колоночной хроматографии на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 110 мг (выход 25%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,37 (5:1:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 501 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1740, 1661.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,59 (1H, дублет, J = 2,2 Гц);
5,14 (1H, дублет дублетов, J = 9,4 и 1,8 Гц);
4,42 (1H, дублет дублетов, J = 10,7 и 1,7 Гц);
4,23 (1H, триплет, J = 10,1 Гц);
4,01 - 4,09 (1H, мультиплет);
3,83 (1H, дублет дублетов, J = 9,4 и 2,1 Гц);
3,56 (1H, дублет дублетов, J = 11,8 и 3,2 Гц);
3,40 (1H, дублет дублетов, J = 11,7 и 6,3 Гц);
2,28 - 2,38 (2H, мультиплет);
1,95 (3H, синглет);
1,52 - 1,68 (2H, мультиплет);
1,26 - 1,38 (20H, мультиплет);
0,87 - 0,95 (3H, мультиплет).
4 (v) 5-Ацетамидо-4-цианамидо-7-O-тетрадеканоил-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
108 мг (0,22 ммоль) 5-ацетамидо-4-амино-7  тетрадеканоил-2,3,4,5-тетрадезокси
тетрадеканоил-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-енопиранозоевой кислоты [полученной, как описано в стадии (iv) выше] растворяют в 4 мл метанола, и 46 мг (0,56 ммоль) ацетата натрия и 31 мг (0,29 ммоль) цианбромида добавляют к полученному раствору, при перемешивании при комнатной температуре. Реакционный раствор перемешивают при комнатной температуре в течение 150 минут и затем растворитель удаляют путем дистилляции при пониженном давлении, получая остаток. Этот остаток затем подвергают азеотропной дистилляции с бензолом. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 66 мг (выход 58%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-енопиранозоевой кислоты [полученной, как описано в стадии (iv) выше] растворяют в 4 мл метанола, и 46 мг (0,56 ммоль) ацетата натрия и 31 мг (0,29 ммоль) цианбромида добавляют к полученному раствору, при перемешивании при комнатной температуре. Реакционный раствор перемешивают при комнатной температуре в течение 150 минут и затем растворитель удаляют путем дистилляции при пониженном давлении, получая остаток. Этот остаток затем подвергают азеотропной дистилляции с бензолом. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 66 мг (выход 58%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 (2:5:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 526 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 2223, 1746, 1662.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,71 (1H, дублет, J = 2,1 Гц);
5,08 (1H, дублет дублетов, J = 8,2 и 1,8 Гц);
4,46 (1H, дублет дублетов, J = 10,6 и 1,7 Гц);
4,04 - 4,20 (2H, мультиплет);
3,85 (1H, дублет дублетов, J = 9,5 и 2,2 Гц);
3,66 (1H, дублет дублетов, J = 11,5 и 3,5 Гц);
3,45 - 3,54 (1H, мультиплет);
2,25 - 2,50 (2H, мультиплет);
1,96 (3H, синглет);
1,53 - 1,68 (2H, мультиплет);
1,26 - 1,40 (20H, мультиплет);
0,87 - 0,96 (3H, мультиплет).
4 (vi) 5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-7-O- тетрадеканоил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоевая кислота
51 мг (0,1 ммоль) 5-aцетaмидo-4-циaнaмидo-7  тетpaдеканоил-2,3,4,5-тетpaдезoкси
тетpaдеканоил-2,3,4,5-тетpaдезoкси  глицеpo
глицеpo  гaлaктo-нoн-2-енопиранозоевой кислоты [полученной, как описано в стадии (v) выше] растворяют в 4 мл метанола, и 7,6 мг (0,1 ммоль) гидрохлорида гидроксиламина добавляют к полученному раствору, при перемешивании при комнатной температуре. Реакционный раствор перемешивают при комнатной температуре в течение дополнительных 3 часов, после чего растворитель удаляют путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 34 мг (выход 63%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енопиранозоевой кислоты [полученной, как описано в стадии (v) выше] растворяют в 4 мл метанола, и 7,6 мг (0,1 ммоль) гидрохлорида гидроксиламина добавляют к полученному раствору, при перемешивании при комнатной температуре. Реакционный раствор перемешивают при комнатной температуре в течение дополнительных 3 часов, после чего растворитель удаляют путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 34 мг (выход 63%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,37 (5:1:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 559 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1743, 1726, 1664, 1633.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,55 (1H, дублет, J = 1,9 Гц);
5,12 (1H, дублет дублетов, J = 9,2 и 2,0 Гц);
4,44 (1H, дублет дублетов, J = 10,2 и 1,5 Гц);
4,17 - 4,33 (2H, мультиплет);
3,98 - 4,08 (1H, мультиплет);
3,56 (1H, дублет дублетов, J = 11,8 и 3,2 Гц);
3,40 (1H, дублет дублетов, J = 11,7 и 6,1 Гц);
2,28 - 2,42 (2H, мультиплет);
1,91 (3H, синглет);
1,53 - 1,70 (2H, мультиплет);
1,26 - 1,39 (20H, мультиплет);
0,87 - 0,94 (3H, мультиплет).
ПРИМЕР 5
5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-9-O- тетрадеканоил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоевая кислота (Соединение N 34-41)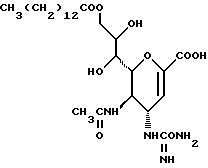
5 (i) 5-Ацетамидо-4-амино-9-O-тетрадеканоил-2,3,4,5- тeтpaдезокси-D-глицерo-D-гaлaктo-нoн-2-енoпиpaнoзoевaя кислота
55 мг (1,01 ммоль) 5-ацетамидо-4-амино-7  тетрадеканоил-8,9
тетрадеканоил-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в Примере 4 (iii)] растворяют в смеси 2 мл трифторуксусной кислоты и 4 мл метиленхлорида при комнатной температуре, и смесь затем перемешивают при комнатной температуре в течение еще 3 дней. По окончании этого времени растворитель удаляют путем дистилляции при пониженном давлении, получая остаток. Этот остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 51 мг (выход 100%) названного соединения в виде бесцветного твердого вещества
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в Примере 4 (iii)] растворяют в смеси 2 мл трифторуксусной кислоты и 4 мл метиленхлорида при комнатной температуре, и смесь затем перемешивают при комнатной температуре в течение еще 3 дней. По окончании этого времени растворитель удаляют путем дистилляции при пониженном давлении, получая остаток. Этот остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 51 мг (выход 100%) названного соединения в виде бесцветного твердого вещества
Rf = 0,49 (5:1:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 501 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1734, 1628.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,68 (1H, дублет, J = 1,9 Гц);
4,01 - 4,38 (3H, мультиплет);
3,84 - 4,00 (4H, мультиплет);
3,71 (1H, дублет, J = 7,7 Гц);
2,30 - 2,42 (2H, мультиплет);
2,06 (3H, синглет);
1,53 - 1,71 (2H, мультиплет);
1,26 - 1,40 (20H, мультиплет);
0,87 - 0,93 (3H, мультиплет).
5 (ii) 5-Ацетамидо-4 -цианамидо-9-O-тетрадеканоил-2,3,4,5-тетрадезокси-D-глицеро- D-галакто-нон-2-енопиранозоевая кислота
90 мг (0,18 ммоль) 5-ацетамидо-4-амино-9  тетрадеканоил-2,3,4,5-тетрадезокси
тетрадеканоил-2,3,4,5-тетрадезокси  глицеро
глицеро 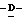 галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (i) выше] растворяют в 10 мл метанола, и 44 мг (0,54 ммоль) ацетата натрия и 19 мг (0,18 ммоль) цианбромида добавляют к полученному раствору, при перемешивании при комнатной температуре. Затем реакционную смесь перемешивают при комнатной температуре в течение 10 часов, после чего растворитель удаляют путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 75 мг (выход 79%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (i) выше] растворяют в 10 мл метанола, и 44 мг (0,54 ммоль) ацетата натрия и 19 мг (0,18 ммоль) цианбромида добавляют к полученному раствору, при перемешивании при комнатной температуре. Затем реакционную смесь перемешивают при комнатной температуре в течение 10 часов, после чего растворитель удаляют путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 75 мг (выход 79%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,52 (2:5:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 526 (М++H).
[α]
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,70 (1H, дублет, J = 1,9 Гц);
4,05 - 4,32 (3H, мультиплет);
3,78 - 4,02 (4H, мультиплет);
2,32 - 2,38 (2H, мультиплет);
2,06 (3H, синглет);
1,55 - 1,68 (2H, мультиплет);
1,26 - 1,40 (20H, мультиплет);
0,87 - 0,93 (3H, мультиплет).
5 (iii) 5-Ацетамидо-4-(C-аминоокси-C-иминометиламино)-9-O-тетрадеканоил- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
55 мг (0,11 ммоль) 5-ацетамидо-4-цианамидо-9 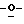 тетрадеканоил-2,3,4,5-тетрадезокси
тетрадеканоил-2,3,4,5-тетрадезокси 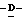 глицеро
глицеро 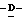 галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 4 мл метанола, и 27 мг (0,39 ммоль) гидрохлорида гидроксиламина добавляют к полученному раствору, при перемешивании при комнатной температуре. Затем реакционную смесь перемешивают при комнатной температуре в течение еще 2 часов, после чего растворитель удаляют путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 11 мг (выход 19%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 4 мл метанола, и 27 мг (0,39 ммоль) гидрохлорида гидроксиламина добавляют к полученному раствору, при перемешивании при комнатной температуре. Затем реакционную смесь перемешивают при комнатной температуре в течение еще 2 часов, после чего растворитель удаляют путем дистилляции при пониженном давлении. Полученный остаток подвергают колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 11 мг (выход 19%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,28 (2:5:1 = изопропанол:этилацетат:метанол).
Масс-спектр (ББА, FAB) м/е 559 (М++H).
[α]
Спектр инфракрасного поглощения, νмакс макс (см-1): 1679.
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
5,53 (1H, дублет, J = 1,9 Гц);
4,30 - 4,43 (2H, мультиплет);
4,03 - 4,28 (3H, мультиплет);
3,55 - 3,65 (2H, мультиплет);
2,32 - 2,40 (2H, мультиплет);
2,00 (3H, синглет);
1,55 - 1,68 (2H, мультиплет);
1,26 - 1,37 (20H, мультиплет);
0,85 - 0,93 (3H, мультиплет).
ПРИМЕР 6
Соль трифторуксусной кислоты 5-Ацетамидо-4-гуанидино-2,3,4,5,7- пентaдезoкси-7-фтopo-D-глицepo-D-гaлaктo-нoн-2-енопиранозоевой кислоты (Соединение N 1-1)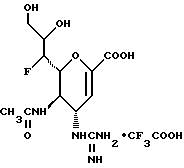
6 (i) Метил 5-ацетамидо-4-азидо-8,9-ди-O-ацетил-2,3,4,5,7- пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
300 мг (0,70 ммоль) метил 5-ацетамидо-4,8,9-три  ацетил-2,6-ангидро-3,5,7-тpидезoкси-7- фтopo
ацетил-2,6-ангидро-3,5,7-тpидезoкси-7- фтopo  глицеpo
глицеpo  галакто-нон-2-енопиранозоата [полученного согласно способу, описанному в WO 95/32955] растворяют в 10 мл безводного метиленхлорида, и к полученному раствору добавляют 25 мг (0,78 ммоль) метанола. Атмосферу в реакционной системе заменяют азотом, и затем в реакционную систему добавляют 1,0 г (7,0 ммоль) комплексной соли трифторид бора-диэтиловый эфир, и смесь перемешивают при комнатной температуре в течение 24 часов. По окончании этого времени реакционную смесь выливают в смесь 50 мл воды, 10 г льда, 10 г твердого кислого карбоната натрия и 50 мл этилацетата, и смесь энергично перемешивают в течение 10 минут. Органический слой отделяют, промывают 10 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (210 мг) растворяют в 4 мл диметилформамида, и к полученному раствору добавляют 400 г катионообменной смолы, Dowex-50x8 (H+) (Dowex - торговая марка) и 100 мг (1,53 ммоль) азида натрия. Смесь затем перемешивают при 80oC в течение 4 часов. По окончании этого времени Dowex-50x8 (H+) отделяют фильтрацией и растворитель удаляют дистилляцией при пониженном давлении. Затем, чтобы растворить остаток, добавляют 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 170 мг (выход 59%) названного соединения в виде бесцветного вязкого вещества.
галакто-нон-2-енопиранозоата [полученного согласно способу, описанному в WO 95/32955] растворяют в 10 мл безводного метиленхлорида, и к полученному раствору добавляют 25 мг (0,78 ммоль) метанола. Атмосферу в реакционной системе заменяют азотом, и затем в реакционную систему добавляют 1,0 г (7,0 ммоль) комплексной соли трифторид бора-диэтиловый эфир, и смесь перемешивают при комнатной температуре в течение 24 часов. По окончании этого времени реакционную смесь выливают в смесь 50 мл воды, 10 г льда, 10 г твердого кислого карбоната натрия и 50 мл этилацетата, и смесь энергично перемешивают в течение 10 минут. Органический слой отделяют, промывают 10 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (210 мг) растворяют в 4 мл диметилформамида, и к полученному раствору добавляют 400 г катионообменной смолы, Dowex-50x8 (H+) (Dowex - торговая марка) и 100 мг (1,53 ммоль) азида натрия. Смесь затем перемешивают при 80oC в течение 4 часов. По окончании этого времени Dowex-50x8 (H+) отделяют фильтрацией и растворитель удаляют дистилляцией при пониженном давлении. Затем, чтобы растворить остаток, добавляют 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 170 мг (выход 59%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,31 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/е 417(М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
2,07 (9H, синглет);
3,58 (1H, двойной дублет дублетов, J = 9,0, 9,0 и 9,0 Гц);
3,80 (3H, синглет);
4,22 (1H, двойной дублет дублетов, J = 1,8, 5,2 и 13,0 Гц);
4,65 - 5,00 (4H, мультиплет);
5,45 (1H, мультиплет);
5,98 (1H, дублет, J = 2,8 Гц);
6,00 (1H, дублет, J = 8,5 Гц).
6 (ii) Метил 5-ацетамидо-4-(N,N'-бис-т-бутоксикарбонилгуанидино)-8,9-ди-O-ацетил-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоат
36 мг (0,08 ммоль) метил 5-ацетамидо-4-азидо- 8,9-ди  ацетил-2,3,4,5,7-пентадезокси-7-фторо
ацетил-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии i) выше] растворяют в 3 мл метанола, и к полученному раствору добавляют 10 мг Lindlar катализатора. Атмосферу в реакционной системе заменяют на водород, и затем смесь перемешивают в течение 2 часов. Затем катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2 мл диметилформамида, и к полученному раствору добавляют 26 мг (0,093 ммоль) N, N'-ди-т-бутоксикарбонилтиомочевины, 19 мг (0,186 ммоль) триэтиламина и 25 мг (0,093 ммоль) хлорида ртути (II). Затем смесь перемешивают при комнатной температуре в течение 1 часа. Твердое вещество отделяют фильтрацией и фильтрат выливают в 2-слойную смесь 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2: 1, по объему, смесь этилацетата и гексана в качестве элюента, получая 32 мг (выход 59%) названного соединения в виде бесцветного аморфного вещества
галакто-нон-2-енопиранозоата [полученного, как описано в стадии i) выше] растворяют в 3 мл метанола, и к полученному раствору добавляют 10 мг Lindlar катализатора. Атмосферу в реакционной системе заменяют на водород, и затем смесь перемешивают в течение 2 часов. Затем катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2 мл диметилформамида, и к полученному раствору добавляют 26 мг (0,093 ммоль) N, N'-ди-т-бутоксикарбонилтиомочевины, 19 мг (0,186 ммоль) триэтиламина и 25 мг (0,093 ммоль) хлорида ртути (II). Затем смесь перемешивают при комнатной температуре в течение 1 часа. Твердое вещество отделяют фильтрацией и фильтрат выливают в 2-слойную смесь 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2: 1, по объему, смесь этилацетата и гексана в качестве элюента, получая 32 мг (выход 59%) названного соединения в виде бесцветного аморфного вещества
Rf = 0,35 (2:1 = этилацетат:гексан).
[α]
Масс-спектр (ББА, FAB) м/е 633 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,49 (9H, синглет);
1,52 (9H, синглет);
1,98 (3H, синглет);
2,05 (3H, синглет);
2,07 (3H, синглет);
3,80 (3H, синглет);
4,00 - 4,30 (3H, мультиплет);
4,75 (1H, дублет дублетов, J = 9,2, 50 Гц);
4,78 (1H, дублет, J = 18 Гц);
5,23 (1H, дублет дублетов, J = 9,0, 9,0 Гц);
5,43 (1H, мультиплет);
5,88 (1H, дублет, J = 2,8 Гц);
6,80 (1H, дублет, J = 8,2 Гц);
8,60 (1H, дублет, J = 8,5 Гц).
6 (iii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо-D -глицеро-D-галакто-нон-2-енопиранозоевой кислоты
32 мг (0,05 ммоль) метил 5-ацетамидо-4- 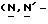 бис-т- бутоксикарбонилгуанидино)-8,9-ди
бис-т- бутоксикарбонилгуанидино)-8,9-ди  ацетил-2,3,4,5,7-пентадезокси- 7-фторо
ацетил-2,3,4,5,7-пентадезокси- 7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 2 мл метанола, и к полученному раствору добавляют 0,5 мл О,1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Затем остаток растворяют в 3:1, по объему, смеси метиленхлорид-трифторуксусная кислота, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и полученный остаток растворяют в 1 мл дистиллированной воды, и затем к полученному раствору добавляют 70 мл 1 N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. Dowex- 50x8(H+) (Dowex -торговая марка) добавляют к полученной смеси для ее нейтрализации, и затем воду удаляют дистилляцией. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 16 мг (выход 71%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 2 мл метанола, и к полученному раствору добавляют 0,5 мл О,1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Затем остаток растворяют в 3:1, по объему, смеси метиленхлорид-трифторуксусная кислота, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и полученный остаток растворяют в 1 мл дистиллированной воды, и затем к полученному раствору добавляют 70 мл 1 N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. Dowex- 50x8(H+) (Dowex -торговая марка) добавляют к полученной смеси для ее нейтрализации, и затем воду удаляют дистилляцией. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 16 мг (выход 71%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 (4:1:1 = изопропанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/е 335 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
2,00 (3H, синглет);
3,65 (1H, двойной дублет дублетов, J = 2,4, 5,5 и 12,0 Гц);
3,85 (1H, двойной дублет дублетов, J = 2,5, 2,5 и 12 Гц);
4,15 (1H, мультиплет);
4,23 (1H, дублет, J = 9,0 Гц);
4,30 - 4,60 (3H, мультиплет);
5,63 (1H, синглет).
ПРИМЕР 7
Соль трифторуксусной кислоты тетрадецил 5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-гaлaктo-нoн-2- енoпиpaнoзoaтa (Соединение N 1-5)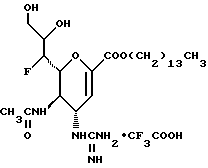
7 (i) Метил 5-ацетамидо-4-азидо-8,9-O-изопропилиден-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2- енопиранозоат
300 мг (0,72 ммоль) метил 5-ацетамидо-4-азидо-8,9-ди  ацетил-2,3,4,5,7-пентадезокси-7-фторо
ацетил-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро  галакто-нон- 2-енопиранозоата [полученного как описано в Примере 6 (i)] растворяют в 5 мл метанола, и к полученному раствору добавляют 0,2 мл 1М метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и затем растворитель удаляют дистилляцией при пониженном давлении. Остаток растворяют в 5 мл ацетона, и к полученному раствору добавляют 400 мг (3,85 ммоль) 2,2- диметоксипропана и 20 мг (0,11 ммоль) п-толуолсульфоновой кислоты. Затем смесь перемешивают при комнатной температуре в течение 3 часов. Твердое вещество отделяют фильтрацией и растворитель удаляют из фильтрата дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 140 мг (выход 52%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон- 2-енопиранозоата [полученного как описано в Примере 6 (i)] растворяют в 5 мл метанола, и к полученному раствору добавляют 0,2 мл 1М метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и затем растворитель удаляют дистилляцией при пониженном давлении. Остаток растворяют в 5 мл ацетона, и к полученному раствору добавляют 400 мг (3,85 ммоль) 2,2- диметоксипропана и 20 мг (0,11 ммоль) п-толуолсульфоновой кислоты. Затем смесь перемешивают при комнатной температуре в течение 3 часов. Твердое вещество отделяют фильтрацией и растворитель удаляют из фильтрата дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 140 мг (выход 52%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,33 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/е 373 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,37 (3H, синглет);
1,42 (3H, синглет);
2,05 (3H, синглет);
3,50 (1H, двойной дублет дублетов, J = 7,5, 7,5 и 9,5 Гц);
3,80 (3H, синглет);
4,13 (1H, двойной дублет дублетов, J = 1,2, 6,0 и 9,0 Гц);
4,20 (1H, двойной дублет дублетов, J = 1,2, 6,0 и 9,0 Гц);
4,45 (1H, мультиплет);
4,70 (1H, двойной дублет дублетов, J = 1,5, 5,7 и 47,0 Гц);
4,90 (1H, дублет дублетов, J = 2,8 и 9,5 Гц);
4,92 (1H, двойной дублет дублетов, J = 1,0, 11,0 и 28,0 Гц);
5,90 (1H, дублет, J = 7,3 Гц);
5,96 (1H, дублет, J = 2,8 Гц).
7 (ii) Тетрадецил 5-ацетамидо-4-азидо-8,9-O-изопропилиден- 2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
113 мг (0,31 ммоль) метил 5-ацетамидо-4-азидо-8,9  изопропилиден-2,3,4,5,7-пентадезокси-7- фторо
изопропилиден-2,3,4,5,7-пентадезокси-7- фторо  глицеро
глицеро 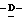 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 4 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,33 мл 1 М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток сушат над безводным сульфатом натрия при комнатной температуре и при пониженном давлении в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила, и к полученному раствору добавляют 80 мг (0,3 ммоль) 18-краун-6 и 415 мг (1,5 ммоль) тетрадецил бромида. Затем смесь перемешивают при 80oC в течение 2 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 110 мг (выход 64%) названного соединения в виде бесцветного вязкого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 4 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,33 мл 1 М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток сушат над безводным сульфатом натрия при комнатной температуре и при пониженном давлении в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила, и к полученному раствору добавляют 80 мг (0,3 ммоль) 18-краун-6 и 415 мг (1,5 ммоль) тетрадецил бромида. Затем смесь перемешивают при 80oC в течение 2 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 110 мг (выход 64%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,47 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/е 555 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,95 (3H, синглет);
1,20 - 1,50 (24H, мультиплет);
1,37 (3H, синглет);
1,42 (3H, синглет);
1,60 - 1,80 (2H, мультиплет);
2,05 (3H, синглет);
4,10 - 4,30 (2H, мультиплет);
4,45 (1H, мультиплет);
4,72 (1H, двойной дублет дублетов, J = 1,5, 5,3 и 38,0 Гц);
4,90 (1H, дублет дублетов, J = 2,4 и 9,3 Гц);
4,92 (1H, двойной дублет дублетов, J = 1,0, 10,0 и 28,0 Гц);
5,97 (1H, дублет, J = 6,5 Гц);
5,95 (1H, дублет, J = 2,4 Гц).
7 (iii) Тетрадецил 5-ацетамидо-4-(N, N'-бис-т-бутоксикарбонилгуанидино)-8,9-O-изопропилиден-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоат
110 мг (0,20 ммоль) тетрадецил 5-ацетамидо-4-азидо-8,9 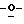 изопропилиден-2,3,4,5,7-пентадезокси-7-фторо
изопропилиден-2,3,4,5,7-пентадезокси-7-фторо 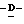 глицеро
глицеро 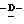 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 5 мл метанола, и к полученному раствору добавляют 30 мг Lindlar катализатора. Атмосферу в реакционной системе заменяют на водород. Смесь затем перемешивают в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией и растворитель удаляют дистилляцией при пониженном давлении. Остаток растворяют в 4 мл диметилформамида, и к полученному раствору добавляют 47 мг (0,17 ммоль)
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 5 мл метанола, и к полученному раствору добавляют 30 мг Lindlar катализатора. Атмосферу в реакционной системе заменяют на водород. Смесь затем перемешивают в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией и растворитель удаляют дистилляцией при пониженном давлении. Остаток растворяют в 4 мл диметилформамида, и к полученному раствору добавляют 47 мг (0,17 ммоль) 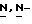 -ди-т-бутоксикарбонилтиомочевины, 35 мг (0,342 ммоль) триэтиламина и 47 мг (0,17 ммоль) хлорида ртути (II). Затем смесь перемешивают при комнатной температуре в течение 1 часа. Твердое вещество отделяют фильтрацией и фильтрат выливают в 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 98 мг (выход 63%) названного соединения в виде бесцветного вязкого вещества.
-ди-т-бутоксикарбонилтиомочевины, 35 мг (0,342 ммоль) триэтиламина и 47 мг (0,17 ммоль) хлорида ртути (II). Затем смесь перемешивают при комнатной температуре в течение 1 часа. Твердое вещество отделяют фильтрацией и фильтрат выливают в 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 98 мг (выход 63%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,30 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/е 771, (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,95 (3H, синглет);
1,20 - 1,40 (24H, мультиплет);
1,36 (3H, синглет);
1,41 (3H, синглет);
1,49 (9H, синглет);
1,50 (9H, синглет);
1,60 - 1,80 (2H, мультиплет);
2,05 (3H, синглет);
4,10 - 4,70 (6H, мультиплет);
5,20 (1H, двойной дублет дублетов, J = 2,4, 7,5 и 7,5 Гц);
5,83 (1H, дублет, J = 2,4 Гц);
5,65 (1H, дублет, J=7,0 Гц);
8,60 (1H, дублет, J = 8,5 Гц).
7 (iv) Соль трифторуксусной кислоты тетрадецил 5-ацетамидо-4- гуанидино-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2- енопиранозоата
80 мг (0,11 ммоль) тетрадецил 5-ацетамидо-4 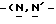 бис- т-бутоксикарбонилгуанидино)-8,9
бис- т-бутоксикарбонилгуанидино)-8,9  изопропилиден-2,3,4,5,7-пентадезокси-7-фторо
изопропилиден-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро 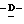 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (iii) выше] растворяют в 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают в течение 4 часов при комнатной температуре. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2: 8:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 40 мг (выход 56%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (iii) выше] растворяют в 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают в течение 4 часов при комнатной температуре. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2: 8:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 40 мг (выход 56%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,35 (5:1:1 = т-бутанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/е 531 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
0,70 - 0,85 (3H, синглет);
1,10 - 1,30 (24H, мультиплет);
1,50 - 1,80 (2H, мультиплет);
2,00 (3H, синглет);
3,60 - 3,80 (2H, мультиплет);
4,10 - 4,30 (3H, мультиплет);
4,40 - 4,60 (2H, мультиплет);
5,88 (1H, синглет).
ПРИМЕР 8
Соль трифторуксусной кислоты 4-гуанидино-5-тиоацетамидо- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 31-1)
8 (i) Метил 5-ацетамидо-4-(N, N'-бис-т- бутоксикарбонилгуанидино)-7,8,9-три-O-ацетил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоат
2,0 г (4,63 ммоль) 5-ацетамидо-4-амино-7,8,9-три  ацетил-2,3,4,5-тетрадезокси
ацетил-2,3,4,5-тетрадезокси  глицеро
глицеро 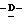 галакто-нон-2- енопиранозоата растворяют в 40 мл диметилформамида, и к полученному раствору добавляют 1,54 г (5,58 ммоль)
галакто-нон-2- енопиранозоата растворяют в 40 мл диметилформамида, и к полученному раствору добавляют 1,54 г (5,58 ммоль) 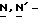 бис-т- бутоксикарбонилтиомочевины, 1,1 г (11,2 ммоль) триэтиламина и 1,54 г (5,58 ммоль) хлорида ртути (II). Затем смесь перемешивают при комнатной температуре в течение 2 часов. Нерастворимое вещество отделяют фильтрацией и фильтрат выливают в 2-слойный раствор 50 мл этилацетата и 25 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 3,0 г (выход 96%) названного соединения в виде бесцветного аморфного вещества.
бис-т- бутоксикарбонилтиомочевины, 1,1 г (11,2 ммоль) триэтиламина и 1,54 г (5,58 ммоль) хлорида ртути (II). Затем смесь перемешивают при комнатной температуре в течение 2 часов. Нерастворимое вещество отделяют фильтрацией и фильтрат выливают в 2-слойный раствор 50 мл этилацетата и 25 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 3,0 г (выход 96%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,20 (1:1 = этилацетат:гексан).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,49 (18H, синглет);
1,88 (3H, синглет);
2,07 (3H, синглет);
2,09 (3H, синглет);
2,13 (3H, синглет);
3,80 (3H, синглет);
4,15 (1H, дублет дублетов, J = 8,0 и 13,0 Гц);
4,20 - 4,30 (2H, мультиплет);
4,67 (1H, дублет дублетов, J = 3,0 и 13,0 Гц);
5,15 (1H, двойной дублет дублетов, J = 2,5, 8,5 и 8,5 Гц);
5,30 (1H, мультиплет);
5,43 (1H, дублет дублетов, J = 2,5 и 5,3 Гц);
5,90 (1H, дублет, J = 2,5 Гц);
6,20 (1H, дублет, J = 8,2 Гц);
8,50 (1H, дублет, J = 8,5 Гц).
8 (ii) Метил 4-(N,N'-бис-т-бутоксикарбонилгуанидино)-5- тиоацетамидо-7,8,9-три-O-ацетил-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоат
1,95 г (2,89 ммоль) метил 5-aцетaмидo-4- 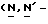 бис-т- бутоксикарбонилгуанидино)-7,8,9-три
бис-т- бутоксикарбонилгуанидино)-7,8,9-три 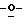 ацетил-2,3,4,5- тетрадезокси
ацетил-2,3,4,5- тетрадезокси 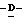 глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 40 мл тетрагидрофурана, и к полученному раствору добавляют 2,15 г (5,32 ммоль) Lawesson's реагента. Затем смесь перемешивают при 60oC в течение 2 часов. Затем реакционную смесь выливают в 2-слойный раствор 50 мл этилацетата и 30 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 1,0 г (выход 50%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 40 мл тетрагидрофурана, и к полученному раствору добавляют 2,15 г (5,32 ммоль) Lawesson's реагента. Затем смесь перемешивают при 60oC в течение 2 часов. Затем реакционную смесь выливают в 2-слойный раствор 50 мл этилацетата и 30 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 1,0 г (выход 50%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,40 (1:1 = этилацетат:гексан).
[α]
Масс-спектр (ББА, FAB) м/е 689 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,46 (9H, синглет);
1,49 (9H, синглет);
1,95 (3H, синглет);
1,97 (3H, синглет);
1,99 (3H, синглет);
2,42 (3H, синглет);
3,80 (3H, синглет);
4,15 (1H, дублет дублетов, J = 8,0 и 13,0 Гц);
4,45 (1H, дублет дублетов, J = 3,0 и 8,5 Гц);
4,70 (1H, дублет дублетов, J = 3,0 и 13,0 Гц);
5,20 - 5,35 (3H, мультиплет);
5,40 (1H, дублет дублетов, J = 2,5 и 4,5 Гц);
5,92 (1H, дублет, J = 2,5 Гц);
7,95 (1H, дублет, J = 8,2 Гц);
8,55 (1H, дублет, J = 8,5 Гц);
8 (iii) Соль трифторуксусной кислоты 4-гуанидино-5-тиоацетамидо- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
800 мг (1,16 ммоль) метил 4- 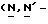 бис-т- бутоксикарбонилгуанидино)-5-тиоацетамидо-7,8,9-три
бис-т- бутоксикарбонилгуанидино)-5-тиоацетамидо-7,8,9-три 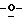 ацетил-2,3,4,5- тeтpaдезoкси
ацетил-2,3,4,5- тeтpaдезoкси 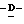 глицеpо
глицеpо 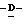 гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в стадии (ii) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 1,5 мл 0,1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 2 часов, после чего ее нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 20 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и полученный раствор перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и полученный остаток растворяют в 10 мл дистиллированной воды, и затем к полученному раствору добавляют 2,0 мл IN водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. Dowex-50х8 (H+) (Dowex - торговая марка) затем добавляют для того, чтобы нейтрализовать реакционную смесь, и воду удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 215 мг (выход 40%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в стадии (ii) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 1,5 мл 0,1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 2 часов, после чего ее нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 20 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и полученный раствор перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и полученный остаток растворяют в 10 мл дистиллированной воды, и затем к полученному раствору добавляют 2,0 мл IN водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. Dowex-50х8 (H+) (Dowex - торговая марка) затем добавляют для того, чтобы нейтрализовать реакционную смесь, и воду удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 215 мг (выход 40%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 (4:1:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/е 349 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
2,51 (3H, синглет);
3,55 (1H, дублет, J = 10 Гц);
3,62 (1H, дублет дублетов, J = 7,0 и 14,0 Гц);
3,85 (1H, дублет дублетов, J = 3,5 и 14,0 Гц);
3,92 (1H, мультиплет);
4,40 - 4,60 (2H, мультиплет);
4,50 (1H, мультиплет);
5,63 (1H, дублет, J = 2,5 Гц).
ПРИМЕР 9
Соль трифторуксусной кислоты гексил 5-тиоацетамидо-4-гуанидино- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоата (Соединение N 31-3)
9 (i) Метил 5-тиоацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-8,9-O-изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоат.
700 мг (1,01 ммоль) метил 4  бис-т-бутоксикарбонилгуанидино)-5-тиоацетамидо-7,8,9-три
бис-т-бутоксикарбонилгуанидино)-5-тиоацетамидо-7,8,9-три  ацетил-2,3,4,5- тетрадезокси
ацетил-2,3,4,5- тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного как описано в Примере 8 (ii)] растворяют в 20 мл метанола, и к полученному раствору добавляют 0,2 мл 1М метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 30 мл ацетона, и к полученному раствору добавляют 1,0 г (9,71 ммоль) 2,2- диметоксипропана и 40 мг (0,22 ммоль) п-толуолсульфоновой кислоты. Затем смесь перемешивают при комнатной температуре в течение 3 часов. Затем к смеси добавляют 100 мг твердого кислого карбоната натрия, и смесь перемешивают в течение 30 минут. Затем твердое вещество отделяют фильтрацией и растворитель удаляют из фильтрата дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь мети- ленхлорида и метанола в качестве элюента, получая 450 мг (выход 74%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного как описано в Примере 8 (ii)] растворяют в 20 мл метанола, и к полученному раствору добавляют 0,2 мл 1М метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 30 мл ацетона, и к полученному раствору добавляют 1,0 г (9,71 ммоль) 2,2- диметоксипропана и 40 мг (0,22 ммоль) п-толуолсульфоновой кислоты. Затем смесь перемешивают при комнатной температуре в течение 3 часов. Затем к смеси добавляют 100 мг твердого кислого карбоната натрия, и смесь перемешивают в течение 30 минут. Затем твердое вещество отделяют фильтрацией и растворитель удаляют из фильтрата дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь мети- ленхлорида и метанола в качестве элюента, получая 450 мг (выход 74%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,33 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/е 603 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,37 (3H, синглет);
1,41 (3H, синглет);
1,48 (9H, синглет);
1,51 (9H, синглет);
2,55 (3H, синглет);
3,50 (1H, дублет дублетов, J = 4,8 и 8,5 Гц);
3,80 (3H, синглет);
4,05 (1H, дублет дублетов, J = 5,0 и 9,0 Гц); 4,13 (1H, дублет дублетов, J = 7,3 и 9,2 Гц); 4,20 (1H, дублет, J = 10,0 Гц);
4,40 (1H, мультиплет);
4,55 (1H, двойной дублет дублетов, J = 7,4, 10,0 и 10,0 Гц);
5,30 (1H, двойной дублет дублетов, J = 2,4, 8,0 и 10,0 Гц);
5,84 (1H, дублет, J = 2,8 Гц);
8,68 (1H, J = 8,0 Гц);
9,04 (1H, J = 7,2 Гц).
9 (ii) Гексил 5-тиоацетамидо-4-(N,N'-бис-т-бутоксикарбонилгуанидино)-8,9-O-изопропилиден-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоат
190 мг (0,31 ммоль) метил 5-тиоацетамидо-4  бис-т- бутоксикарбонилгуанидино)-8,9
бис-т- бутоксикарбонилгуанидино)-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро 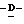 галакто-нон- 2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 12 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,32 мл 1М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила, и к полученному раствору добавляют 76 мг (0,29 ммоль) 18-краун-6 и 236 мг (1,43 ммоль) гексил бромида. Затем смесь перемешивают при 80oC в течение 2 часов, после чего ее выливают в 2-слойный раствор 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 3:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 73 мг (выход 35%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон- 2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 12 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,32 мл 1М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила, и к полученному раствору добавляют 76 мг (0,29 ммоль) 18-краун-6 и 236 мг (1,43 ммоль) гексил бромида. Затем смесь перемешивают при 80oC в течение 2 часов, после чего ее выливают в 2-слойный раствор 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 3:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 73 мг (выход 35%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,57 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/е 673 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, синглет);
1,20 - 1,50 (8H, мультиплет);
1,36 (3H, синглет);
1,41 (3H, синглет);
1,48 (9H, синглет);
1,51 (9H, синглет);
1,60 - 1,80 (2H, мультиплет);
2,56 (3H, синглет);
3,52 (1H, дублет дублетов, J = 4,8 и 8,5 мГц);
4,00 - 4,30 (3H, мультиплет);
4,40 (1H, мультиплет);
4,55 (1H, двойной дублет дублетов, J = 7,4, 10,0 и 10,0 Гц);
5,30 (1H, двойной дублет дублетов, J = 2,2, 8,0 и 10,0 Гц);
5,82 (1H, дублет, J = 2,2 Гц);
8,68 (1H, J = 8,0 Гц);
9,02 (1H, J = 7,2 Гц).
9 (iii) Соль трифторуксусной кислоты гексил 5-тиоацетамидо-4- гуaнидинo-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоата
100 мг (0,15 ммоль) гексил 5-тиоацетамидо-4- 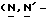 бис- т-бутоксикарбонилгуанидино)-8,9
бис- т-бутоксикарбонилгуанидино)-8,9 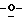 изопропилиден-2,3,4,5- тетpaдезoкси
изопропилиден-2,3,4,5- тетpaдезoкси 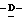 глицеpo
глицеpo 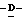 гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в стадии (ii) выше] растворяют в 12 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 4 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают с помощью колоночной хроматографии на силикагеле, используя 15: 1:1, по объему, смесь т-бутанола, этилацетата и воды в качестве элюента, получая 65 мг (выход 79%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в стадии (ii) выше] растворяют в 12 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 4 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают с помощью колоночной хроматографии на силикагеле, используя 15: 1:1, по объему, смесь т-бутанола, этилацетата и воды в качестве элюента, получая 65 мг (выход 79%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,75 (5:1:1 = т-бутанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/е 433 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
0,70 - 0,85 (3H, синглет);
1,10 - 1,40 (8H, мультиплет);
1,60 - 1,70 (2H, мультиплет);
2,50 (3H, синглет);
3,51 (1H, дублет, J = 8,5 Гц);
3,80 (1H, дублет, J = 10,0 Гц);
4,20 (2H, мультиплет);
4,40 - 4,70 (2H, мультиплет);
5,10 (1H, мультиплет);
5,98 (1H, широкий синглет).
ПРИМЕР 10
Соль трифторуксусной кислоты тетрадецил 5-тиоацетамидо-4-гуанидино-2,3,4,5-тетрадезокси- D-глицеро-D-галакто-нон-2-енопиранозоата (Соединение N 31-5)
10 (i) Тетрадецил 5-тиoaцетaмидo-4-(N,N'-бис-т- бутoксикapбoнилгуанидино)-8,9-O-изопропилиден-2,3,4,5-тетрадезокси-D- глицеро-D-галакто-нон-2-енопиранозоат
234 мг (0,39 ммоль) метил 5-тиоацетамидо-4-  бис- т-бутоксикарбонилгуанидино)-8,9
бис- т-бутоксикарбонилгуанидино)-8,9  изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси 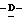 глицеро
глицеро 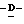 галакто-нон-2- енопиранозоата [полученного, как описано в Примере 9 (i)] растворяют в 12 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,43 мл 1 М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении и остаток сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила и к полученному раствору добавляют 103 мг (0,39 ммоль) 18-краун-6 и 593 мг (1,94 ммоль) тетрадецил бромида. Затем смесь перемешивают при 80oC в течение 2 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 3:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 100 мг (выход 33%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в Примере 9 (i)] растворяют в 12 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,43 мл 1 М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении и остаток сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила и к полученному раствору добавляют 103 мг (0,39 ммоль) 18-краун-6 и 593 мг (1,94 ммоль) тетрадецил бромида. Затем смесь перемешивают при 80oC в течение 2 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 3:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 100 мг (выход 33%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,45 (2:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/е 785 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, синглет);
1,20 - 1,50 (24H, мультиплет);
1,36 (3H, синглет);
1,40 (3H, синглет);
1,48 (9H, синглет);
1,51 (9H, синглет);
1,60 - 1,80 (2H, мультиплет);
2,54 (3H, синглет);
3,51 (1H, дублет дублетов, J = 4,8 и 8,5 Гц);
4,00 - 4,30 (3H, мультиплет);
4,40 (1H, мультиплет);
4,55 (1H, двойной дублет дублетов, J = 7,4, 10,0 и 10,0 Гц);
5,30 (1H, двойной дублет дублетов, J = 2,2, 8,0 и 10,0 Гц);
5,82 (1H, дублет, J = 2,2 Гц);
8,66 (1H, J = 8,0 Гц);
9,00 (1H, J = 7,2 Гц).
10 (ii) Соль трифторуксусной кислоты тетрадецил 5-тиоацетамидо-4-гуанидино-2,3,4,5-тетрадезокси-D-глицеро-D- галакто-нон-2-енопиранозоата
90 мг (0,11 ммоль) тетрадецил 5-тиоацетамидо-4 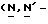 бис-т-бутоксикарбонилгуанидино)-8,9
бис-т-бутоксикарбонилгуанидино)-8,9 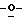 изопропилиден-2,3,4,5-тетрадезокси
изопропилиден-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют 12 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 4 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 15:1:1, по объему, смесь т-бутанола, этилацетата и воды в качестве элюента, получая 40 мг (выход 47%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют 12 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 4 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении и полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 15:1:1, по объему, смесь т-бутанола, этилацетата и воды в качестве элюента, получая 40 мг (выход 47%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,80 (5:1:1 = т-бутанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/е 545 (М++H).
1H-Спектр ядерного магнитного резонанса (D2, 270 мГц) δ (ппм):
0,70 - 0,85 (3H, синглет);
1,10 - 1,40 (24H, мультиплет);
1,60 - 1,70 (2H, мультиплет);
2,50 (3H, синглет);
3,60 - 3,90 (2H, мультиплет);
4,15 (2H, мультиплет);
4,40 - 4,70 (2H, мультиплет);
5,10 (1H, мультиплет);
5,90 (1H, широкий синглет).
ПРИМЕР 11
Соль трифторуксусной кислоты 4-гуанидино-9-O-гексаноил-5- тиоацетамидо-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2- енопиранозоата (Соединение N 31-36)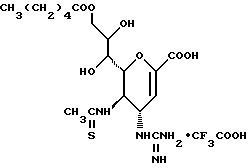
11 (i) Метил 5-тиоацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-7-O-гексаноил-8,9-O-изопропилиден-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоат
500 мг (0,83 ммоль) метил 5-тиоацетамидо-4-  бис- т-бутоксикарбонилгуанидино)-8,9
бис- т-бутоксикарбонилгуанидино)-8,9  изопропилиден-2,3,4,5- тетpaдезoкси
изопропилиден-2,3,4,5- тетpaдезoкси  глицеро
глицеро  гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного как описано в Примере 9 (i)] растворяют в 15 мл метиленхлорида, и к полученному раствору добавляют 110 мг (0,91 ммоль) диметиламинопиридина и 122 мг (0,91 ммоль) гексаноил хлорида. Затем смесь перемешивают при комнатной температуре в течение 30 минут. Затем к полученной смеси добавляют 92 мг (0,91 ммоль) триэтиламина и смесь перемешивают в течение 15 минут. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 30 мл этилацетата и 15 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 432 мг (выход 74%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного как описано в Примере 9 (i)] растворяют в 15 мл метиленхлорида, и к полученному раствору добавляют 110 мг (0,91 ммоль) диметиламинопиридина и 122 мг (0,91 ммоль) гексаноил хлорида. Затем смесь перемешивают при комнатной температуре в течение 30 минут. Затем к полученной смеси добавляют 92 мг (0,91 ммоль) триэтиламина и смесь перемешивают в течение 15 минут. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 30 мл этилацетата и 15 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 432 мг (выход 74%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 701 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, синглет);
1,20 - 1,70 (6H, мультиплет);
1,35 (3H, синглет);
1,38 (3H, синглет);
1,47 (9H, синглет);
1,48 (9H, синглет);
2,20 - 2,50 (2H, мультиплет);
2,42 (3H, синглет);
3,80 (3H, синглет);
3,92 (1H, дублет дублетов, J = 6,6 и 8,5 Гц);
4,10 (1H, дублет дублетов, J = 6,2 и 8,5 Гц);
4,35 - 4,45 (2H, мультиплет);
5,15 - 5,35 (2H, мультиплет);
5,90 (1H, дублет, J = 2,0 Гц);
7,55 (1H, J = 10,0 Гц);
8,55 (1H, J = 9,5 Гц).
11 (ii) 4-(N,N'-Бис-т-бутоксикарбонилгуанидино)-7-O-гексаноил-8,9-O-изопропидиден-5-тиоацетамидо-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
89 мг (0,13 ммоль) метил 5-тиоацетамидо-4- 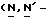 бис-т- бутоксикарбонилгуанидино)-7
бис-т- бутоксикарбонилгуанидино)-7 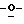 гексаноил-8,9
гексаноил-8,9 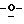 -изопропилиден-2,3,4,5-тетрадезокси
-изопропилиден-2,3,4,5-тетрадезокси 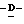 глицеро
глицеро 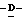 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 5,5 мг (0,13 ммоль) гидроксида лития 1 гидрата. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь нейтрализуют 4N раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 48 мг (выход 64%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 5,5 мг (0,13 ммоль) гидроксида лития 1 гидрата. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь нейтрализуют 4N раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 48 мг (выход 64%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,67 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 687 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, синглет);
1,20 - 1,70 (6H, мультиплет);
1,32 (3H, синглет);
1,35 (3H, синглет);
1,45 (9H, синглет);
1,51 (9H, синглет);
2,20 - 2,50 (2H, мультиплет);
2,35 (3H, синглет);
3,40 (1H, мультиплет);
4,20 (1H, дублет дублетов, J = 6,2 и 8,5 Гц);
4,40 (1H, дублет дублетов, J = 1,5 и 10,0 Гц);
4,55 (1H, мультиплет);
5,00 (1H, дублет дублетов, J = 10,0 и 10,0 Гц);
5,10 (1H, дублет дублетов, J = 2,1 и 10,0 Гц);
5,30 (1H, дублет дублетов, J = 2,0 и 5,5 Гц);
5,73 (1H, дублет, J = 2,1 Гц).
11 (iii) Соль трифторуксусной кислоты 4-гуанидино-9-O-гексaнoил-5-тиoaцетaмидo-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
100 мг (0,15 ммоль) 4- 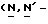 бис-т-бутоксикарбонилгуанидино)-7
бис-т-бутоксикарбонилгуанидино)-7  гексаноил-8,9
гексаноил-8,9  изопропилиден-5-тиоацетамидо-2,3,4,5-тетрадезокси
изопропилиден-5-тиоацетамидо-2,3,4,5-тетрадезокси  глицеро
глицеро 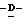 гaлaктo-нoн-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 12 мл 2:6:1, по объему, смеси метиленхлорида, трифторуксусной кислоты и тиофенола, и смесь перемешивают при комнатной температуре в течение 8 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 54 мг (выход 53%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 12 мл 2:6:1, по объему, смеси метиленхлорида, трифторуксусной кислоты и тиофенола, и смесь перемешивают при комнатной температуре в течение 8 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 54 мг (выход 53%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,55 (5:1:1 = т-бутанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 447 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
0,70 - 0,85 (3H, синглет);
1,20 - 1,70 (6H, мультиплет);
2,30 - 2,50 (2H, мультиплет);
2,52 (3H, синглет);
3,51 (1H, дублет, J = 8,5 Гц);
4,15 (1H, мультиплет);
4,23 (1H, дублет дублетов, J = 5,5 и 12,0 Гц);
4,35 (1H, дублет дублетов, J = 2,5 и 12,0 Гц);
4,40 - 4,60 (2H, мультиплет);
5,10 (1H, мультиплет);
5,63 (1H, дублет, J = 2,4 Гц).
ПРИМЕР 12
Соль трифторуксусной кислоты 4-гуанидино-9-O-тетрадеканоил-5-тиоацетамидо- 2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 31-41)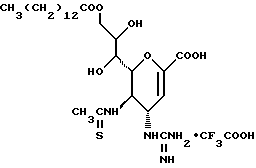
12 (i) Метил 4- (N,N'-бис-т-бутоксикарбонилгуанидино)-7-O-тетрадеканоил-8,9-O-изопропилиден-5-тиоацетамидо-2,3,4,5- тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоат
440 мг (0,73 ммоль) метил 5-тиоацетамидо-4 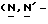 бис- т-бутоксикарбонилгуанидино)-8,9
бис- т-бутоксикарбонилгуанидино)-8,9  изопропилиден-2,3,4,5- тетрадезокси
изопропилиден-2,3,4,5- тетрадезокси 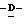 глицеро
глицеро 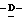 галакто-нон-енопиранозоата [полученного, как описано в Примере 9 (i)] растворяют в 15 мл метиленхлорида, и к полученному раствору добавляют 132 мг (1,08 ммоль) диметиламинопиридина и 247 мг (1,0 ммоль) тетрадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 30 минут, после чего добавляют 109 мг (1,08 ммоль) триэтиламина, и смесь перемешивают в течение 15 минут. Затем реакционную смесь выливают в 2-слойный раствор 30 мл этилацетата и 15 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 350 мг (выход 59%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-енопиранозоата [полученного, как описано в Примере 9 (i)] растворяют в 15 мл метиленхлорида, и к полученному раствору добавляют 132 мг (1,08 ммоль) диметиламинопиридина и 247 мг (1,0 ммоль) тетрадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 30 минут, после чего добавляют 109 мг (1,08 ммоль) триэтиламина, и смесь перемешивают в течение 15 минут. Затем реакционную смесь выливают в 2-слойный раствор 30 мл этилацетата и 15 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 350 мг (выход 59%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,35 (1:1 = этилацетат:гексан).
[α]
Масс-спектр (ББА, FAB) м/з 813 (M++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, синглет);
1,20 - 1,70 (22H, мультиплет);
1,35 (3H, синглет);
1,38 (3H, синглет);
1,47 (9H, синглет);
1,49 (9H, синглет);
2,20 - 2,50 (2H, мультиплет);
2,42 (3H, синглет);
3,80 (3H, синглет);
3,92 (1H, дублет дублетов, J = 6,6 и 8,5 Гц);
4,10 (1H, дублет дублетов, J = 6,2 и 8,5 Гц);
4,35 - 4,45 (2H, мультиплет);
5,15 - 5,35 (2H, мультиплет);
5,90 (1H, дублет, J = 2,0 Гц);
7,55 (1H, J = 10,0 Гц);
8,55 (1H, J = 9,5 Гц).
12 (ii) 4-(N, N'-Бис-т-бутоксикарбонилгуанидино)-7-O- тетрадеканоил-8,9-O-изопропилиден-5-тиоацетамидо-2,3,4,5-тетрадезокси-D-глицеро-D-галакто-нон-2-енопиранозоевая кислота
320 мг (0,39 ммоль) метил 4- 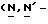 бис-т-бутоксикарбонилгуанидино)- 7
бис-т-бутоксикарбонилгуанидино)- 7 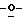 тетрадеканоил-8,9
тетрадеканоил-8,9  изопропилиден-5- тиоацетамидо-2,3,4,5-тетрадезокси
изопропилиден-5- тиоацетамидо-2,3,4,5-тетрадезокси  глицеро
глицеро  галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 7 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 18 мг (0,41 ммоль) гидроксида лития 1 гидрата. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь нейтрализуют 4 N раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 240 мг (выход 77%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 7 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 18 мг (0,41 ммоль) гидроксида лития 1 гидрата. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь нейтрализуют 4 N раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле, используя 5:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 240 мг (выход 77%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 (10:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 799 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, синглет);
1,20 - 1,70 (22H, мультиплет);
1,32 (3H, синглет);
1,35 (3H, синглет);
1,45 (9H, синглет);
1,50 (9H, синглет);
2,20 - 2,50 (2H, мультиплет);
2,35 (3H, синглет),
3,95 (1H, дублет дублетов, J = 6,2 и 8,5 Гц);
4,20 (1H, дублет дублетов, J = 6,2 и 8,5 Гц);
4,40 (1H, дублет дублетов, J = 1,5 и 10,0 Гц);
4,55 (1H, мультиплет);
5,00 (1H, дублет дублетов, J = 10,0 и 10,0 Гц);
5,10 (1H, дублет дублетов, J = 2,1 и 10,0 Гц);
5,30 (1H, дублет дублетов, J = 2,0 и 5,5 Гц);
5,73 (1H, дублет, J = 2,1 Гц).
12 (iii) Соль трифторуксусной кислоты 4-гуанидино-9-O-тетрадеканоил-5-тиоацетамидо-2,3,4,5-тетрадезокси-D-глицеpo-D-гaлaктo-нoн-2-енoпиpaнoзoевoй кислоты
220 мг (0,27 ммоль) 4-  бис-т-бутоксикарбонилгуанидино)- 7
бис-т-бутоксикарбонилгуанидино)- 7 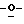 тетрадеканоил-8,9
тетрадеканоил-8,9 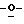 изопропилиден-5-тиоацетамидо-2,3,4,5- тетрадезокси
изопропилиден-5-тиоацетамидо-2,3,4,5- тетрадезокси 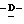 глицеро
глицеро 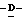 галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 12 мл 2:6:1, по объему, смеси метиленхлорида, трифторуксусной кислоты и тиофенола, и смесь перемешивают при комнатной температуре в течение 8 часов. По окончании этого времени, растворитель удаляют дистилляцией при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 120 мг (выход 56%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоевой кислоты [полученной, как описано в стадии (ii) выше] растворяют в 12 мл 2:6:1, по объему, смеси метиленхлорида, трифторуксусной кислоты и тиофенола, и смесь перемешивают при комнатной температуре в течение 8 часов. По окончании этого времени, растворитель удаляют дистилляцией при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 120 мг (выход 56%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,60 (5:1:1 = т-бутанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 559 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
0,70 - 0,85 (3H, синглет);
1,20 - 1,70 (22H, мультиплет);
2,30 - 2,50 (2H, мультиплет);
2,54 (3H, синглет);
3,61 (1H, дублет, J = 8,5 Гц);
4,15 (1H, мультиплет);
4,20 (1H, дублет дублетов, J = 5,5 и 12,0 Гц);
4,30 (1H, дублет дублетов, J = 2,5 и 12,0 Гц);
4,40 - 4,60 (2H, мультиплет);
5,10 (1H, мультиплет);
5,60 (1H, широкий синглет).
ПРИМЕР 13
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O- гексаноил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-гaлaктo-нoн-2- енoпиpaнoзoевoй кислоты (Соединение N 1-36)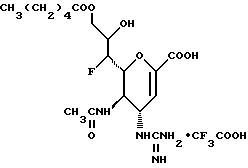
13 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро- D-галакто-нон-2-енопиранозоат
100 мг (0,24 ммоль) метил 5-ацетамидо-4  бис-т- бутоксикарбонилгуанидино)-8,9-ди
бис-т- бутоксикарбонилгуанидино)-8,9-ди  ацетил- 2,3,4,5,7-пентадезoкси-7-фтopo
ацетил- 2,3,4,5,7-пентадезoкси-7-фтopo  глицеро
глицеро  гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 6 (ii)] растворяют в 3 мл метанола, и к полученному раствору добавляют 0,5 мл 0,1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа, после чего реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 1 мл дистиллированной воды и к полученному раствору добавляют 280 мл 1 N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа, после чего реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане и затем воду удаляют дистилляцией. Полученный остаток растворяют в 3 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 100 мг (0,52 ммоль) дифенилдиазометана и 8 мг (0,06 ммоль) комплекса трифторид бора-диэтиловый эфир. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени к реакционной смеси добавляют уксусную кислоту, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 82 мг (выход 50%) названного соединения в виде бесцветного аморфного вещества.
гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 6 (ii)] растворяют в 3 мл метанола, и к полученному раствору добавляют 0,5 мл 0,1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа, после чего реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 1 мл дистиллированной воды и к полученному раствору добавляют 280 мл 1 N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа, после чего реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане и затем воду удаляют дистилляцией. Полученный остаток растворяют в 3 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 100 мг (0,52 ммоль) дифенилдиазометана и 8 мг (0,06 ммоль) комплекса трифторид бора-диэтиловый эфир. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени к реакционной смеси добавляют уксусную кислоту, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 82 мг (выход 50%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,45 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 701 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,50 (9H, синглет);
1,51 (9H, синглет);
1,95 (3H, синглет);
3,25 (2H, мультиплет);
3,90 (2H, мультиплет);
4,20 - 4,70 (3H, мультиплет);
5,25 (1H, мультиплет);
5,95 (1H, дублет, J = 2,5 Гц);
6,93 (1H, синглет);
7,10 (1H, дублет, J = 8,5 Гц);
7,20 - 7,40 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
13 (ii) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-гексаноил-2,3,4,5,7-пентадезокси-7-фтopo-D-глицеpo-D-гaлaктo-нoн-2-енoпиpaнoзoaт
50 мг (0,072 ммоль) дифенилметил 5-ацетамидо-4 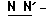 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо  глицеро
глицеро  галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 11 мг (0,11 ммоль) триэтиламина и 11 мг (0,086 ммоль) гексаноил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 47 мг (выход 83%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 11 мг (0,11 ммоль) триэтиламина и 11 мг (0,086 ммоль) гексаноил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 47 мг (выход 83%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,6 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 786 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,20 - 1,40 (6H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,97 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
2,95 (1H, дублет, J = 5,0 Гц);
4,20 - 4,60 (6H, мультиплет);
5,25 (1H, мультиплет);
5,97 (1H, дублет, J = 2,6 Гц);
6,65 (1H, дублет, J = 8,5 Гц);
6,93 (1H, синглет);
7,20 - 7,40 (10H, мультиплет);
8,60 (1H, дублет, J - 8,5 Гц).
13 (iii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-гексаноил-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоевой кислоты
40 мг (0,05 ммоль) дифенилметил 5-ацетамидо-4- 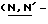 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9  гексаноил-2,3,4,5,7-пентадезокси-7-фторо
гексаноил-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 18 мг (выход 65%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (ii) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 18 мг (выход 65%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 433 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, мультиплет);
1,25 - 1,40 (4H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 4,5 Гц);
4,10 - 4,40 (5H, мультиплет);
4,45 - 4,70 (2H, мультиплет);
5,60 (1H, дублет, J = 2,4 Гц).
ПРИМЕР 14
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O- октаноил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-гaлaктo-нoн-2- енoпиpaнoзoевoй кислоты (Соединение N 1-38)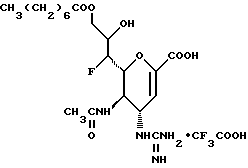
14 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-октаноил-2,3,4,5,7-пентадезокси-7-фтopo-D-глицеpo-D-гaлaктo-нoн-2-енoпиpaнoзoaт
50 мг (0,072 ммоль) дифенилметил 5-ацетамидо-4- 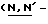 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фтopo
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фтopo  глицеро
глицеро  гaлaктo-нoн-2- енoпиpaнoзoaтa [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 1 мг (0,11 ммоль) триэтиламина и 16 мг (0,086 ммоль) октаноил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 45 мг (выход 77%) названного соединения в виде бесцветного аморфного вещества.
гaлaктo-нoн-2- енoпиpaнoзoaтa [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 1 мг (0,11 ммоль) триэтиламина и 16 мг (0,086 ммоль) октаноил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 45 мг (выход 77%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,5 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 814 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,48 (9H, синглет);
1,50 (9H, синглет);
1,95 (3H, синглет);
3,65 (1H, дублет дублетов, J = 5,0 и 18 Гц);
3,80 (1H, дублет дублетов, J = 1,8 и 18 Гц);
4,15 (1H, мультиплет);
4,23 (1H, дублет, J = 8,5 Гц);
4,30 - 4,60 (3H, мультиплет);
5,95 (1H, дублет, J = 2,3 Гц).
14 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-октаноил-2,3,4,5,7-пентадезокси-D-фторо-D-глицеpo-D-гaлaктo-нoн-2 -енопиранозоевой кислоты
40 мг (0,05 ммоль) дифенилметил 5-ацетамидо-4- 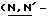 бис-т- бутоксикарбонилгуанидино)-9
бис-т- бутоксикарбонилгуанидино)-9  октаноил-2,3,4,5,7- пентадезокси-7-фторо
октаноил-2,3,4,5,7- пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 18 мг (выход 64%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 18 мг (выход 64%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 461 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, мультиплет);
1,25 - 1,40 (8H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 4,5 Гц);
4,10 - 4,40 (5H, мультиплет);
4,45 - 4,70 (2H, мультиплет);
5,60 (1H, дублет, J = 2,4 Гц).
ПРИМЕР 15
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-додеканоил-2,3,4,5,7-пентадезокси-D-фторо-D-глицеро-D-галакто-нон-2- енопиранозоевой кислоты (Соединение N 1-40)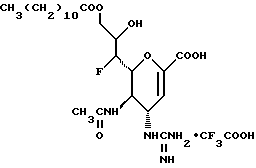
15 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-додеканоил-2,3,4,5,7-пентадезокси-7- фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
55 мг (0,078 ммоль) дифенилметил 5-ацетамидо- 4- 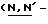 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 10 мг (0,10 ммоль) триэтиламина и 21 мг (0,094 ммоль) додеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 48 мг (выход 69%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 10 мг (0,10 ммоль) триэтиламина и 21 мг (0,094 ммоль) додеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 48 мг (выход 69%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,4 (1:1 = этилацетат:гексан).
[α]
Масс-спектр (ББА, FAB) м/з 883 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,20 - 1,40 (18H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,97 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
2,95 (1H, дублет, J = 5,0 Гц);
4,20 - 4,60 (6H, мультиплет);
5,25 (1H, мультиплет);
5,97 (1H, дублет, J = 2,6 Гц);
6,65 (1H, дублет, J = 8,5 Гц);
6,93 (1H, синглет);
7,20 - 7,40 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
15 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-0 -додеканоил-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоевой кислоты
43 мг (0,05 ммоль) дифенилметил 5-ацетамидо-4- 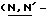 биc-т-бутoкcикapбoнилгуaнидинo)-9
биc-т-бутoкcикapбoнилгуaнидинo)-9  дoдекaнoил-2,3,4,5,7- пентадезокси-7-фторо
дoдекaнoил-2,3,4,5,7- пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 33 мг (выход 91%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 33 мг (выход 91%) названного соединения в виде бесцветного твердого вещества.
Rf=0,4 (2:5:1=изопропанол: этилацетат: вода).
[α]
Масс-спектр (ББА, FAB) м/з 517 (М++Н).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, мультиплет);
1,25 - 1,40 (16H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3Н, синглет);
2,35 (2H, триплет, J = 7,0 Гц);
4,10 - 4,40 (5H, мультиплет);
4,45 - 4,70 (2H, мультиплет);
5,60 (1H, дублет, J = 2,4 Гц).
ПРИМЕР 16
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D- галакто-нон-2-енопиранозоевой кислоты (Соединение N 1-41)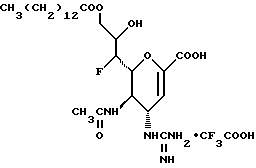
16 (i) Дифенилметил 5-ацетaмидo-4-(N,N'-бис-т- бутoксикapбoнилгуанидино)-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
50 мг (0,072 ммоль) дифенилметил 5-ацетамидо-4- 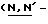 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо-
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо-  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 11 мг (0,11 ммоль) триэтиламина и 21 мг (0,086 ммоль) тетрадеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 50 мг (выход 77%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 11 мг (0,11 ммоль) триэтиламина и 21 мг (0,086 ммоль) тетрадеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 50 мг (выход 77%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,4 (1:1 = этилацетат:гексан).
[α]
Масс-спектр (ББА, FAB) м/з 898 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,20 - 1,40 (22H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,97 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
2,95 (1H, дублет, J = 5,0 Гц);
4,20 - 4,60 (6H, мультиплет);
5,25 (1H, мультиплет);
5,97 (1H, дублет, J = 2,6 Гц);
6,65 (1H, дублет, J = 8,5 Гц);
6,93 (1H, синглет);
7,20 - 7,40 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
16 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7-фторо- D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
40 мг (0,05 ммоль) дифенилметил 5-aцетaмидo-4- 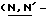 бис-т- бутоксикарбонилгуанидино)-9
бис-т- бутоксикарбонилгуанидино)-9  тетрадеканоил-2,3,4,5,7-пентадезокси-7-фторо
тетрадеканоил-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 218 мг (выход 64%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 218 мг (выход 64%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,4 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 545 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, мультиплет);
1,25 - 1,70 (20H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 4,5 Гц);
4,10 - 4,40 (5H, мультиплет);
4,45 - 4,70 (1H, мультиплет);
5,60 (1H, дублет, J = 2,4 Гц).
ПРИМЕР 17
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O- гексадеканоил- 2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон- 2-енопиранозоевой кислоты (Соединение N 1-42)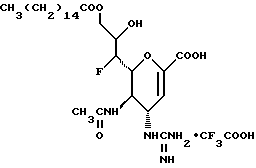
17 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-гексадеканоил-2,3,4,5,7- пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
58 мг (0,08 ммоль) дифенилметил 5-ацетамидо-4- 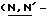 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо 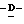 глицеро
глицеро 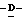 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 10 мг (0,10 ммоль) триэтиламина и 26 мг (0,0946 ммоль) гексадеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 50 мг (выход 67%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 10 мг (0,10 ммоль) триэтиламина и 26 мг (0,0946 ммоль) гексадеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 50 мг (выход 67%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,4 (1:1 = этилацетат:гексан).
[α]
Масс-спектр (ББА, FAB) м/з 939 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,20 - 1,40 (22H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,97 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
2,95 (1H, дублет, J = 5,0 Гц);
4,20 - 4,60 (6H, мультиплет);
5,25 (1H, мультиплет);
5,97 (1H, дублет, J = 2,6 Гц);
6,65 (1H, дублет, J = 8,5 Гц);
6,93 (1H, синглет);
7,20 - 7,40 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
17 (ii) Соль трифторуксусной кислоты 5-ацетамидo-4-гуанидино-9-O-гексаноил-2,3,4,5,7-пентадезокси-7-фторо-D- глицеpo-D-гaлaктo-нoн-2-енoпиpaнoзoевoй кислоты
45 мг (0,05 ммоль) дифенилметил 5- aцетaмидo-4- 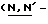 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9  гексадеканоил-2,3,4,5,7-пентадезокси-7- фторо
гексадеканоил-2,3,4,5,7-пентадезокси-7- фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 28 мг (выход 73%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 28 мг (выход 73%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,4 ( 2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 573 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, мультиплет);
1,25 - 1,40 (16H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 7,0 Гц);
4,10 - 4,40 (5H, мультиплет);
4,45 - 4,70 (2H, мультиплет);
5,60 (1H, дублет, J = 2,4 Гц).
ПРИМЕР 18
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O- октадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2- енопиранозоевой кислоты (Соединение N 1-43)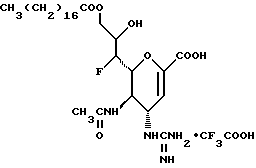
18 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-октадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоат
55 мг (0,08 ммоль) дифенилметил 5-ацетамидо-4- 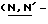 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7- пентадезокси-7-фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7- пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 10 мг (0,10 ммоль) триэтиламина и 29 мг (0,094 ммоль) октадеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 51 мг (выход 67%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору добавляют 10 мг (0,10 ммоль) триэтиламина и 29 мг (0,094 ммоль) октадеканоил хлорида, при охлаждении льдом. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:1, по объему, смесь этилацетата и гексана в качестве элюента, получая 51 мг (выход 67%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,5 (1:1 = этилацетат:гексан).
[α]
Масс-спектр (ББА, FAB) м/з 967 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,20 - 1,40 (30H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,97 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
2,95 (1H, дублет, J = 5,0 Гц);
4,20 - 4,60 (6H, мультиплет);
5,25 (1H, мультиплет);
5,97 (1H, дублет, J = 2,6 Гц);
6,65 (1H, дублет, J = 8,5 Гц);
6,93 (1H, синглет);
7,20 - 7,40 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
18 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-октадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеpo-D- гaлaктo-нoн-2-енoпиpaнoзoевoй кислоты
45 мг (0,047 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9  октадеканоил-2,3,4,5,7-пентадезокси-7-фторо
октадеканоил-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 24 мг (выход 62%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 24 мг (выход 62%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,4 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 601 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, мультиплет);
1,25 - 1,40 (28H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 7,0 Гц);
4,10 - 4,40 (5H, мультиплет);
4,45 - 4,70 (2H, мультиплет);
5,60 (1H, дублет, J = 2,4 Гц).
ПРИМЕР 19
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-ацетил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 1-54)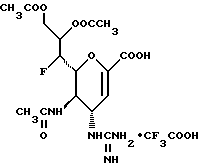
19 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-8,9-ди-O-ацетил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
58 мг (0,083 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо 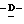 глицеро
глицеро 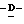 галакто-нон-2- енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл пиридина, и к полученному раствору, при охлаждении льдом, добавляют 0,5 мл уксусного ангидрида. Смесь затем перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл 1 N водного раствора хлористоводородной кислоты, и органический слой отделяют и промывают насыщенным водным раствором кислого карбоната натрия и затем насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1: 1, по объему, смесь гексана и этилацетата в качестве элюента, получая 59 мг (выход 91%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл пиридина, и к полученному раствору, при охлаждении льдом, добавляют 0,5 мл уксусного ангидрида. Смесь затем перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл 1 N водного раствора хлористоводородной кислоты, и органический слой отделяют и промывают насыщенным водным раствором кислого карбоната натрия и затем насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1: 1, по объему, смесь гексана и этилацетата в качестве элюента, получая 59 мг (выход 91%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,47 (1:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/з 785 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,48 (9H, синглет);
1,49 (9H, синглет);
1,99 (3H, синглет);
2,04 (3H, синглет);
2,07 (3H, синглет);
4,00 - 4,30 (3H, мультиплет);
4,75 (1H, дублет, J = 13 Гц);
4,80 (1H, дублет дублетов, J = 7,5 и 45 Гц);
5,20 (1H, двойной дублет дублетов, J = 1,0, 9,0 и 9,0 Гц);
5,50 (1H, мультиплет);
5,92 (1H, дублет, J = 2,4 Гц);
6,72 (1H, дублет, J = 7,5 Гц);
6,94 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
19 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-ацетил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
50 мг (0,064 ммоль) дифенилметил 5-ацетамидо-4- 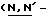 бис-т-бутоксикарбонилгуанидино)-8,9-ди
бис-т-бутоксикарбонилгуанидино)-8,9-ди  ацетил-2,3,4,5,7- пентадезокси-7-фторо
ацетил-2,3,4,5,7- пентадезокси-7-фторо 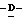 глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 23 мг (выход 56%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 23 мг (выход 56%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,16 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 419 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
2,00 (3H, синглет);
2,03 (3H, синглет);
2,05 (3H, синглет);
4,10 - 4,40 (4H, мультиплет);
4,70 - 5,00 (2H, мультиплет);
5,50 (1H, мультиплет);
5,70 (1H, дублет, J = 3,0 Гц).
ПРИМЕР 20
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-пропионил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2- енопиранозоевой кислоты (Соединение N 1-55)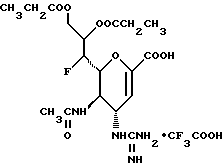
20 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т-бутоксикарбонилгуанидино)-8,9-ди-O-пропионил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
52 мг (0,074 ммоль) дифенилметил 5-ацетамидо-4- 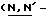 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо 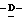 глицеро
глицеро 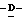 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл пиридина, и к полученному раствору, при охлаждении льдом, добавляют 0,5 мл пропионового ангидрида. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл 1N водного раствора хлористоводородной кислоты, и органический слой отделяют и промывают насыщенным водным раствором кислого карбоната натрия и затем насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1: 1, по объему, смесь гексана и этилацетата в качестве элюента, получая 54 мг (выход 90%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл пиридина, и к полученному раствору, при охлаждении льдом, добавляют 0,5 мл пропионового ангидрида. Затем смесь перемешивают при комнатной температуре в течение 3 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл 1N водного раствора хлористоводородной кислоты, и органический слой отделяют и промывают насыщенным водным раствором кислого карбоната натрия и затем насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1: 1, по объему, смесь гексана и этилацетата в качестве элюента, получая 54 мг (выход 90%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,54 (1:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/з 813 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,11 (9H, триплет, 7,5 Гц);
1,48 (9H, синглет);
1,49 (9H, синглет);
2,04 (3H, синглет);
2,20 - 2,35 (4H, мультиплет);
4,00 - 4,30 (3H, мультиплет);
4,75 (1H, дублет, J = 13 Гц);
4,80 (1H, дублет дублетов, J = 7,5 и 45 Гц);
5,20 (1H, двойной дублет дублетов, J = 1,0, 9,0 и 9,0 Гц);
5,50 (1H, мультиплет);
5,92 (1H, дублет, J = 2,4 Гц);
6,72 (1H, дублет, J = 7,5 Гц);
6,94 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
20 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-пропионил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон- 2-енопиранозоевой кислоты
46 мг (0,057 ммоль) дифенилметил 5-ацетамидо-4- 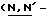 бис-т-бутоксикарбонилгуанидино)-8,9-ди
бис-т-бутоксикарбонилгуанидино)-8,9-ди 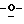 пропионил- 2,3,4,5,7-пентaдезoкси-7-фтopo
пропионил- 2,3,4,5,7-пентaдезoкси-7-фтopo  глицеро
глицеро  гaлaктo-нoн-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и гексана в качестве элюента, получая 24 мг (выход 63%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и гексана в качестве элюента, получая 24 мг (выход 63%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,25 ( 2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 447 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
1,10 (6H, триплет, J = 7,5 Гц);
2,00 (3H, синглет);
2,35 (4H, квартет, J = 7,5 Гц);
4,10 - 4,40 (4H, мультиплет);
4,70 - 5,00 (2H, мультиплет);
5,50 (1H, мультиплет);
5,60 (1H, дублет, J = 3,0 Гц).
ПРИМЕР 21
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-гексаноил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 1-58)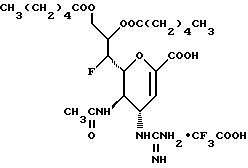
21 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т-бутоксикарбонилгуанидино)-8,9-ди-O-гексаноил-2,3,4,5,7-пентадезокси-7- фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
44 мг (0,063 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси 7 фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси 7 фторо 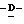 глицеро
глицеро 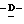 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 19 мг (0,17 ммоль) 4-диметиламинопиридина и 19 мг (0,14 ммоль) гексаноил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 49 мг (выход 87%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 19 мг (0,17 ммоль) 4-диметиламинопиридина и 19 мг (0,14 ммоль) гексаноил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 49 мг (выход 87%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,28 (3:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/з 897 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 1,00 (6H, мультиплет);
1,20 - 1,40 (8H, мультиплет);
1,48 (9H, синглет);
1,49 (9H, синглет);
1,50 - 1,70 (4H, мультиплет);
1,98 (3H, синглет);
2,20 - 2,30 (4H, мультиплет);
4,00 - 4,30 (3H, мультиплет);
4,75 (1H, дублет, J = 13 Гц);
4,80 (1H, дублет дублетов, J = 7,4 и 45 Гц);
5,18 (1H, двойной дублет дублетов, J = 1,0, 9,0 и 9,0 Гц);
5,50 (1H, мультиплет);
5,93 (1H, дублет, J = 2,4 Гц);
6,70 (1H, дублет, J = 7,5 Гц);
6,93 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
21 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-гексаноил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
42 мг (0,047 ммоль) дифенилметил 5-ацетамидо-4- 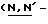 бис-т-бутоксикарбонилгуанидино)-8,9-ди
бис-т-бутоксикарбонилгуанидино)-8,9-ди 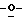 гексаноил-2,3,4,5,7-пентадезокси-7-фторо
гексаноил-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 21 мг (выход 59%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 21 мг (выход 59%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,34 ( 2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 531 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (6H, мультиплет);
1,20 - 1,40 (8H, мультиплет);
1,55 - 1,70 (4H, мультиплет);
2,00 (3H, синглет);
2,30 (2H, триплет, J = 7,5 Гц);
4,10 - 4,40 (4H, мультиплет);
4,70 - 5,00 (2H, мультиплет);
5,55 (1H, мультиплет);
5,65 (1H, дублет, J = 3,0 Гц).
ПРИМЕР 22
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-O-деканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 1-61)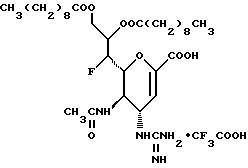
22 (i) Дифенилметил 5-aцетaмидo-4-(N,N'-бис-т- бутoксикарбонилгуанидино)-8,9-ди-O-деканоил-2,3,4,5,7-пентадезокси-7- фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
42 мг (0,06 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо 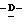 глицеро
глицеро 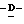 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 18 мг (0,15 ммоль) 4-диметиламинопиридина и 26 мг (0,14 ммоль) деканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 52 мг (выход 86%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 18 мг (0,15 ммоль) 4-диметиламинопиридина и 26 мг (0,14 ммоль) деканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 52 мг (выход 86%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,28 (3:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/з 1009 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,90 (6H, мультиплет);
1,20 - 1,40 (24H, мультиплет);
1,48 (9H, синглет);
1,49 (9H, синглет);
1,50 - 1,65 (4H, мультиплет);
1,98 (3H, синглет);
2,20 - 2,30 (4H, мультиплет);
4,75 (1H, дублет, J = 13 Гц);
4,80 (1H, дублет дублетов, J = 7,5 и 45 Гц);
5,20 (1H, двойной дублет дублетов, J = 1,0, 9,0 и 9,0 Гц);
5,50 (1H, мультиплет);
5,92 (1H, дублет, J = 2,4 Гц);
6,65 (1H, дублет, J = 7,5 Гц);
6,93 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
22 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4- гуанидино-8,9-ди-O-деканоил-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоевой кислоты
45 мг (0,045 ммоль) дифенилметил 5-ацетамидо-4- 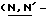 бис-т-бутоксикарбонилгуанидино)-8,9
бис-т-бутоксикарбонилгуанидино)-8,9 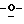 деканоил-2,3,4,5,7- пентадезокси-7-фторо
деканоил-2,3,4,5,7- пентадезокси-7-фторо  глицеро
глицеро 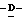 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 29 мг (выход 75%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 29 мг (выход 75%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 643 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (6H, мультиплет);
1,20 - 1,40 (24H, мультиплет);
1,55 - 1,70 (4H, мультиплет);
2,00 (3H, синглет);
2,30 (2H, триплет, J = 7,0 Гц);
4,10 - 4,40 (4H, мультиплет);
4,70 - 5,00 (2H, мультиплет);
5,55 (1H, мультиплет);
5,70 (1H, дублет, J = 3,0 Гц).
ПРИМЕР 23
Соль трифторуксусной кислоты ацетамидо-4-гуанидино-8,9-ди-O-деканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 1-63)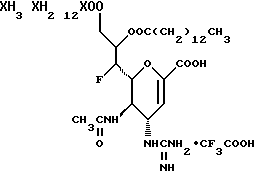
23(i) Дифенилметил 5-aцетaмидо-4-(N, N'-биc-т-бутоксикарбонилгуанидино)-8,9-ди-O-тетрадеканоил- 2,3,4,5,7-пентадезoкcи-7-фтopo-D-глицерo-D-гaлaктo-нoн-2-енoпиpaнoзoaт
43 мг (0,06 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фтopo
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фтopo  глицеpo
глицеpo 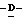 гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 19 мг (0,15 ммоль) 4-диметиламинопиридина и 26 мг (0,14 ммоль) тетрадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 60 мг (выход 87%) названного соединения в виде бесцветного аморфного вещества.
гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 19 мг (0,15 ммоль) 4-диметиламинопиридина и 26 мг (0,14 ммоль) тетрадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 60 мг (выход 87%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,28 (3:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/з 1121 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,90 (6H, мультиплет);
1,20 - 1,40 (40H, мультиплет);
1,48 (9H, синглет);
1,49 (9H, синглет);
1,50 - 1,65 (4H, мультиплет);
1,98 (3H, синглет);
2,20 - 2,30 (4H, мультиплет);
4,00 - 4,30 (3H, мультиплет);
4,75 (1H, дублет, J = 13 Гц);
4,80 (1H, дублет дублетов, J = 7,5 и 45 Гц);
5,18 (1H, двойной дублет дублетов, J = 1,0, 9,0 и 9,0 Гц);
5,50 (1H, мультиплет);
5,93 (1H, дублет, J = 2,4 Гц);
6,66 (1H, дублет, J = 7,5 Гц);
6,93 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
23 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7- фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
52 мг (0,046 ммоль) дифенилметил 5-ацетамидо-4- 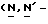 бис-т-бутоксикарбонилгуанидино)-8,9-ди
бис-т-бутоксикарбонилгуанидино)-8,9-ди 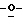 тетрадеканоил- 2,3,4,5,7-пентадезокси-7-фторо
тетрадеканоил- 2,3,4,5,7-пентадезокси-7-фторо 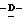 глицеро
глицеро 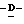 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл, 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 38 мг (выход 83%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл, 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 38 мг (выход 83%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 ( 2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр 755 (ББА, FAB) м/з 545 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (6H, мультиплет);
1,20 - 1,40 (40H, мультиплет);
1,55 - 1,70 (4H, мультиплет);
2,00 (3H, синглет);
2,30 (2H, триплет, J = 7,0 Гц);
4,10 - 4,40 (4H, мультиплет);
4,70 - 5,00 (2H, мультиплет);
5,55 (1H, мультиплет);
5,70 (1H, дублет, J = 3,0 Гц).
ПРИМЕР 24
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-гексадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 1-64)
24 (i) Дифенилметил 5-ацетамидo-4-(N,N'-биc-т- бутoкcикapбoнилгуанидино)-8,9-ди-O-гексадеканоил-2,3,4,5,7-пентадезокси- 7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
37 мг (0,053 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7- пентадезокси-7- фтopo
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7- пентадезокси-7- фтopo  глицеpo
глицеpo 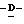 гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 16 мг (0,13 ммоль) 4-диметиламинопиридина и 34 мг (0,12 ммоль) гексадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени, реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 52 мг (выход 84%) названного соединения в виде бесцветного аморфного вещества.
гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 16 мг (0,13 ммоль) 4-диметиламинопиридина и 34 мг (0,12 ммоль) гексадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени, реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 52 мг (выход 84%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,3 (3:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/з 1177 (+М+H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,90 (6H, мультиплет);
1,20 - 1,40 (48H, мультиплет);
1,48 (9H, синглет);
1,49 (9H, синглет);
1,50 - 1,65 (4H, мультиплет);
1,98 (3H, синглет);
2,20 - 2,30 (4H, мультиплет);
4,00 - 4,30 (3H, мультиплет);
4,75 (1H, дублет, J=13 Гц);
4,80 (1H, дублет дублетов, J = 7,5 и 45 Гц);
5,20 (1H, двойной дублет дублетов, J = 1,0, 9,0 и 9,0 Гц);
5,50 (1H, мультиплет);
5,92 (1H, дублет, J = 2,4 Гц);
6,65 (1H, дублет, J = 7,5 Гц);
6,93 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
24 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4- гуанидино-8,9-ди-O-гексадеканоил-2,3,4,5,7-пентадезокси-7- фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
42 мг (0,036 ммоль) дифенилметил 5-ацетамидо-4- 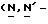 бис-т-бутоксикарбонилгуанидино)-8,9-ди
бис-т-бутоксикарбонилгуанидино)-8,9-ди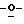 -гексадеканоил- 2,3,4,5,7-пентадезокси-7-фторо
-гексадеканоил- 2,3,4,5,7-пентадезокси-7-фторо 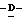 глицеро
глицеро 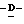 галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 22 мг (выход 59%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 22 мг (выход 59%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,4 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 811 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (6H, мультиплет);
1,20 - 1,40 (48H, мультиплет);
1,55 - 1,70 (4H, мультиплет);
2,00 (3H, синглет);
2,30 (2H, триплет, J = 7,0 Гц);
4,10 - 4,40 (4H, мультиплет);
4,70 - 5,00 (2H, мультиплет);
5,55 (1H, мультиплет);
5,70 (1H, дублет, J = 3,0 Гц).
ПРИМЕР 25
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-октадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 65-1)
25(i) Дифенилметил 5-ацетамидо-4-(N, N'-бис-т- бутоксикарбонилгуанидино)-8,9-ди-O-октадеканоил-2,3,4,5,7 -пентадезокси-7-фтopo-D-глицеpo-D-гaлaктo-нoн-2-енoпиpaнoзoaт
35 мг (0,05 ммоль) дифенилметил 5-ацетамидо-4- 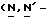 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- фторо  глицеро
глицеро 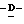 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 15 мг (0,13 ммоль) триэтиламина и 35 мг (0,115 ммоль) октадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 57 мг (выход 93%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 13 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 15 мг (0,13 ммоль) триэтиламина и 35 мг (0,115 ммоль) октадеканоил хлорида. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 3:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 57 мг (выход 93%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,3 (3:1 = гексан:этилацетат).
[α]
Масс-спектр (ББА, FAB) м/з 1233 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,90 (6H, мультиплет);
1,20 - 1,40 (56H, мультиплет);
1,48 (9H, синглет);
1,49 (9H, синглет);
1,50 - 1,65 (4H, мультиплет);
1,98 (3H, синглет);
2,20 - 2,30 (4H, мультиплет);
4,00 - 4,30 (3H, мультиплет);
4,75 (1H, дублет, J = 13 Гц);
4,80 (1H, дублет дублетов, J = 7,5 и 45 Гц);
5,20 (1H, двойной дублет дублетов, J = 1,0, 9,0 и 9,0 Гц);
5,50 (1H, мультиплет);
5,92 (1H, дублет, J = 2,4 Гц);
6,65 (1H, дублет, J = 7,5 Гц);
6,93 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,60 (1H, дублет, J = 8,5 Гц).
25 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-8,9-ди-O-октадеканоил-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
47 мг (0,04 ммоль) дифенилметил 5-ацетамидо-4- 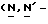 бис-т-бутоксикарбонилгуанидино)-8,9-ди
бис-т-бутоксикарбонилгуанидино)-8,9-ди 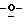 октадеканоил- 2,3,4,5,7-пентадезокси-7-фторо
октадеканоил- 2,3,4,5,7-пентадезокси-7-фторо 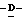 глицеро
глицеро 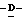 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 28 мг (выход 67%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 28 мг (выход 67%) названного соединения в виде бесцветного твердого вещества.
Rf = 0, 4 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 867 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,85 - 0,95 (6H, мультиплет);
1,20 - 1,40 (56H, мультиплет);
1,55 - 1,70 (4H, мультиплет);
2,00 (3H, синглет);
2,30 (2H, триплет, J = 7,0 Гц);
4,10 - 4,40 (4H, мультиплет);
4,70 - 5,00 (2H, мультиплет);
5,55 (1H, мультиплет);
5,70 (1H, дублет, J = 3,0 Гц).
ПРИМЕР 26
Соль трифторуксусной кислоты гексадецил 5- ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D- галакто-нон-2-енопиранозоата (Соединение N 1-6)
26 (i) Гексадецил 5-ацетамидо-4-азидо-8,9-O-изопропилиден-2,3,4,5,7-пентaдезoкcи-7-фтopo-D-глицеpo-D-гaлaктo-нoн-2-енопиранозоат
275 мг (0,74 ммоль) метил 5-ацетамидо-4-азидо-8,9  изопропилиден-2,3,4,5,7-пентадезокси-7-фторо
изопропилиден-2,3,4,5,7-пентадезокси-7-фторо 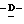 глицеро
глицеро 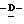 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 7 (i)] растворяют в 7 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,82 мл 1М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении и сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила, и к полученному раствору добавляют 195 мг (0,74 ммоль) 18-краун-6 и 677 мг (2,2 ммоль) гексадецил бромида. Смесь затем перемешивают при 80oC в течение 30 минут. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении. 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия выливают на полученный остаток, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 240 мг (выход 56%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 7 (i)] растворяют в 7 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,82 мл 1М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении и сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Твердое вещество растворяют в 8 мл ацетонитрила, и к полученному раствору добавляют 195 мг (0,74 ммоль) 18-краун-6 и 677 мг (2,2 ммоль) гексадецил бромида. Смесь затем перемешивают при 80oC в течение 30 минут. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении. 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия выливают на полученный остаток, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 240 мг (выход 56%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,50 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 583 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,95 (3H, мультиплет);
1,20 - 1,40 (28H, мультиплет);
1,37 (3H, синглет);
1,42 (3H, синглет);
1,60 - 1,80 (2H, мультиплет);
2,05 (3H, синглет);
4,10 - 4,30 (3H, мультиплет);
4,40 (1H, мультиплет);
4,72 (1H, двойной дублет дублетов, J = 1,3, 5,3 и 47,0 Гц);
4,90 (1H, дублет дублетов, J=2,4 и 9,3 Гц);
4,92 (1H, двойной дублет дублетов, J = 1,4, 10,0 и 28,0 Гц) ;
5,92 (1H, дублет, J = 7,2 Гц);
5,94 (1H, дублет, J = 2,6 Гц).
26 (ii) Гексадецил 5-aцетaмидo-4-(N,N'-биc-т- бутoкcикapбoнилгуанидино)-8,9-O-изопропилиден-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
240 мг (0,41 ммоль) гексадецил 5-ацетамидо-4-азидо-8,9 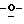 изопропилиден-2,3,4,5,7-пентадезокси-7-фторо
изопропилиден-2,3,4,5,7-пентадезокси-7-фторо 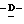 глицеро
глицеро 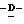 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 60 мг lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 4 мл диметилформамида, и к полученному раствору добавляют 145 мг (0,53 ммоль)
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 60 мг lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 4 мл диметилформамида, и к полученному раствору добавляют 145 мг (0,53 ммоль) 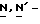 ди-т-бутоксикарбонилтиомочевины, 106 мг (1,05 ммоль) триэтиламина и 142 мг (0,53 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией, и фильтрат выливают в 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:2, по объему, смесь этилацетата и гексана в качестве элюента, получая 220 мг (выход 67%) названного соединения в виде бесцветного вязкого вещества.
ди-т-бутоксикарбонилтиомочевины, 106 мг (1,05 ммоль) триэтиламина и 142 мг (0,53 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией, и фильтрат выливают в 2-слойный раствор 15 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1:2, по объему, смесь этилацетата и гексана в качестве элюента, получая 220 мг (выход 67%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,40 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 799 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,95 (3H, мультиплет);
1,20 - 1,40 (28H, мультиплет);
1,37 (3H, синглет);
1,41 (3H, синглет);
1,49 (9H, синглет);
1,50 (9H, синглет);
1,60 - 1,80 (2H, мультиплет);
1,97 (3H, синглет);
4,10 - 4,30 (4H, мультиплет);
4,40 - 4,65 (2H, мультиплет);
5,20 (1H, двойной дублет дублетов, J = 2,4, 7,5 и 7,5 Гц);
5,83 (1H, дублет, J = 2,4 Гц);
5,65 (1H, дублет, J = 7,0 Гц);
8,60 (1H, дублет, J = 8,5 Гц).
26 (iii) Соль трифторуксусной кислоты гексадецил 5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоата
200 мг (0,25 ммоль) гексадецил 5-ацетамидо-4- 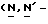 бис- т-бутоксикарбонилгуанидино)-8,9
бис- т-бутоксикарбонилгуанидино)-8,9  изопропилиден-2,3,4,5,7- пентадезокси-7-фторо
изопропилиден-2,3,4,5,7- пентадезокси-7-фторо  глицеро
глицеро 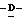 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 10 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 8:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 130 мг (выход 77%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 10 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 8:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 130 мг (выход 77%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,55 (5:1:1 = т-бутанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 559 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
0,70 - 0,85 (3H, мультиплет);
1,10 - 1,30 (28H, мультиплет);
1,60 - 1,80 (2H, мультиплет);
2,00 (3H, синглет);
3,60 - 3,85 (2H, мультиплет);
4,00 - 4,30 (3H, мультиплет);
4,50 - 4,80 (2H, мультиплет);
5,88 (1H, синглет).
ПРИМЕР 27
Соль трифторуксусной кислоты октадецил 5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоата (Соединение N 1-7)
27 (i) Октадецил 5-ацетамидо-4-азидо-8,9-O-изопропилиден- 2,3,4,5,7-пентaдезoкcи-7-фтopo-D-глицеpo-D-гaлaктo-нoн-2-енопиранозоат
45 мг (0,12 ммоль) метил 5-ацетамидо-4-азидо-8,9  изопропилиден-2,3,4,5,7-пентадезокси-7-фторо
изопропилиден-2,3,4,5,7-пентадезокси-7-фторо  глицеро
глицеро 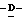 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 7 (i)] растворяют в 4 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,13 мг 1М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Это твердое вещество растворяют в 2 мл ацетонитрила, и к полученному раствору добавляют 322 мг (0,12 ммоль) 18-краун-6 и 121 мг (0,36 ммоль) октадецил бромида. Затем смесь перемешивают при 80oC в течение 30 минут. Полученный остаток выливают в 2-слойный раствор 7 мл этилацетата и 5 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 42 мг (выход 58%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 7 (i)] растворяют в 4 мл 6:1, по объему, смеси метанола и воды, и к полученному раствору добавляют 0,13 мг 1М водного раствора гидроксида калия. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток сушат при пониженном давлении при комнатной температуре в течение 2 часов, получая бледно-желтое твердое вещество. Это твердое вещество растворяют в 2 мл ацетонитрила, и к полученному раствору добавляют 322 мг (0,12 ммоль) 18-краун-6 и 121 мг (0,36 ммоль) октадецил бромида. Затем смесь перемешивают при 80oC в течение 30 минут. Полученный остаток выливают в 2-слойный раствор 7 мл этилацетата и 5 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 42 мг (выход 58%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,50 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 611 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 - 0,95 (3H, мультиплет);
1,20 - 1,40 (32H, мультиплет);
1,37 (3H, синглет);
1,42 (3H, синглет);
1,60 - 1,80 (2H, мультиплет);
2,05 (3H, синглет);
4,10 - 4,30 (3H, мультиплет);
4,40 (1H, мультиплет);
4,72 (1H, двойной дублет дублетов, J = 1,3, 5,3 и 47,0 Гц);
4,90 (1H, дублет дублетов, J = 2,6 и 9,5 Гц);
4,92 (1H, двойной дублет дублетов, J = 1,4, 10,0 и 28,0 Гц);
5,94 (1H, дублет, J = 7,2 Гц);
5,91 (1H, дублет, J = 2,6 Гц).
27 (ii) Октадецил 5-ацетамидо-4-(N,N'-бис-т-бутоксикарбонилгуанидино) -8,9-O-изопропилиден-2,3,4,5,7-пентадезокси-7-фторо-D-глицеро-D-галакто-нон-2-енопиранозоат
40 мг (0,066 ммоль) октадецил 5-ацетамидо-4-азидо-8,9 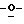 изопропилиден-2,3,4,5,7-пентадезокси-7-фторо
изопропилиден-2,3,4,5,7-пентадезокси-7-фторо 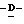 глицеро
глицеро 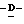 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл метанола и туда добавляют 10 мг Lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2 мл диметилформамида, и затем к полученному раствору добавляют 25 мг (0,09 ммоль)
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл метанола и туда добавляют 10 мг Lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2 мл диметилформамида, и затем к полученному раствору добавляют 25 мг (0,09 ммоль) 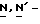 ди-т-бутоксикарбонилтиомочевины, 18 мг (0,18 ммоль) триэтиламина и 25 мг (0,09 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией. Фильтрат выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1: 1, по объему, смесь гексана и этилацетата в качестве элюента, получая 39 мг (выход 71%) названного соединения в виде бесцветного вязкого вещества.
ди-т-бутоксикарбонилтиомочевины, 18 мг (0,18 ммоль) триэтиламина и 25 мг (0,09 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией. Фильтрат выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 1: 1, по объему, смесь гексана и этилацетата в качестве элюента, получая 39 мг (выход 71%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,40 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 827(М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,80 - 0,95 (3H, мультиплет);
1,20 - 1,40 (32H, мультиплет);
1,37 (3H, синглет);
1,41 (3H, синглет);
1,49 (9H, синглет);
1,50 (9H, синглет);
1,60 - 1,80 (2H, мультиплет);
1,97 (3H, синглет);
4,10 - 4,30 (4H, мультиплет);
4,40 - 4,65 (2H, мультиплет);
5,20 (1H, двойной дублет дублетов, J = 2,4, 7,5 и 7,5 Гц);
5,83 (1H, дублет, J = 2,3 Гц);
5,65 (1H, дублет, J = 7,0 Гц);
8,60 (1H, дублет, J = 8,5 Гц).
27 (iii) Соль трифторуксусной кислоты октадецил 5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо-D- глицеро-D-галакто-нон-2-енопиранозоата
30 мг (0,04 ммоль) октадецил 5-ацетамидо-4- 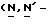 бис- т-бутоксикарбонилгуанидино)-8,9
бис- т-бутоксикарбонилгуанидино)-8,9  изопропилиден-2,3,4,5,7- пентaдезoкcи-7-фтopо
изопропилиден-2,3,4,5,7- пентaдезoкcи-7-фтopо  глицеpo
глицеpo 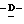 гaлaктo-нoн-2-енoпиpaнoзоата [полученного, как описано в стадии (ii) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 8:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 20 мг (выход 79%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енoпиpaнoзоата [полученного, как описано в стадии (ii) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2: 8:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 20 мг (выход 79%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,55 (5:1:1 = т-бутанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 587 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц), δ (ппм):
0,70 - 0,85 (3H, мультиплет);
1,10 - 1,30 (32H, мультиплет);
1,60 - 1,80 (2H, мультиплет);
2,00 (3H, синглет);
3,60 - 3,85 (2H, мультиплет);
4,00 - 4,30 (3H, мультиплет);
4,50 - 4,80 (2H, мультиплет);
5,88 (1H, синглет).
ПРИМЕР 28
Соль трифторуксусной кислоты 5-ацетамидо-4- гуанидино-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон- 2-енопиранозоевой кислоты (Соединение N 163-1)
28 (i) Бензил N-ацетил-3,6-ди-O-бензил-4-O-метил -α- D-глюкозамин.
4,48 г (9,12 ммоль) бензил  ацетил-3,6-ди
ацетил-3,6-ди  бензил -α-
бензил -α-  глюкозамина [полученного по способу, описанному в Carbohydrate Res. 83, 163-169 (1980)] растворяют в 50 мл диметилформамида, и к полученному раствору добавляют 1,0 г (22,5 ммоль) гидрида натрия. Затем смесь перемешивают при комнатной температуре в течение 30 минут, после чего добавляют при 0oC 1,42 г (10,0 ммоль) метилиодида, и смесь перемешивают при комнатной температуре в течение еще 5 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 100 мл этилацетата и 50 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 4: 1, по объему, смесь метиленхлорида и этилацетата в качестве элюента, получая 3,6 г (выход 78%) названного соединения в виде бесцветного твердого вещества.
глюкозамина [полученного по способу, описанному в Carbohydrate Res. 83, 163-169 (1980)] растворяют в 50 мл диметилформамида, и к полученному раствору добавляют 1,0 г (22,5 ммоль) гидрида натрия. Затем смесь перемешивают при комнатной температуре в течение 30 минут, после чего добавляют при 0oC 1,42 г (10,0 ммоль) метилиодида, и смесь перемешивают при комнатной температуре в течение еще 5 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 100 мл этилацетата и 50 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 4: 1, по объему, смесь метиленхлорида и этилацетата в качестве элюента, получая 3,6 г (выход 78%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,55 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 506(М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,80 (3H, синглет);
3,48 (3H, синглет);
3,40 - 3,80 (5H, мультиплет);
4,23 (1H, двойной дублет дублетов, J = 3,5, 10,0 и 10,0 Гц);
4,40 - 4,90 (7H, мультиплет);
5,25 (1H, дублет, J = 10,0 Гц);
7,20 - 7,40 (15H, мультиплет).
28 (ii) N-Ацетил-4-O-метил -α- D-глюкозамин
3,6 мг (7,12 ммоль) бензил 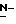 ацетил-3,6-ди
ацетил-3,6-ди 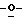 бензил-4-
бензил-4- 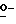 метил
метил 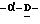 глюкозамина [полученного, как описано в стадии (i) выше] растворяют в 40 мл уксусной кислоты, и к полученному раствору добавляют 5,0 г палладий-на-углероде. Затем смесь перемешивают в атмосфере водорода при 3 атм в течение 30 минут. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя способ градиентного элюирования, смесями метиленхлорида и метанола в диапазоне от 10:1 до 5: 1, по объему, в качестве элюента, получая 1,42 г (выход 83%) названного соединения в виде бесцветного твердого вещества.
глюкозамина [полученного, как описано в стадии (i) выше] растворяют в 40 мл уксусной кислоты, и к полученному раствору добавляют 5,0 г палладий-на-углероде. Затем смесь перемешивают в атмосфере водорода при 3 атм в течение 30 минут. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя способ градиентного элюирования, смесями метиленхлорида и метанола в диапазоне от 10:1 до 5: 1, по объему, в качестве элюента, получая 1,42 г (выход 83%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,35 (5:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 236 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
1,98 (3H, синглет);
3,57 (3H, синглет);
3,60 - 3,80 (6H, мультиплет);
5,05 (1H, дублет, J = 3,2 Гц).
28 (iii) 5-ацетамидо-3,5-дидезокси-7-O-метил-D-глицеро-D-галакто-2-нонуропиранозоевая (nonuropyranosoic) кислота
5,0 г (21,3 ммоль) 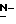 ацетил-4
ацетил-4 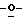 метил
метил 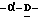 глюкозамина [полученного, как описано в стадии (ii) выше] растворяют в дистиллированной воде, и к полученному раствору добавляют 100 мг азида натрия и 5,0 г (45,5 ммоль) пирувата натрия. Затем pH реакционной смеси доводят до значения 10-11 путем добавления 1 N водного раствора гидроксида натрия, после чего к смеси добавляют 25 мг (660 Е) альдолазы
глюкозамина [полученного, как описано в стадии (ii) выше] растворяют в дистиллированной воде, и к полученному раствору добавляют 100 мг азида натрия и 5,0 г (45,5 ммоль) пирувата натрия. Затем pH реакционной смеси доводят до значения 10-11 путем добавления 1 N водного раствора гидроксида натрия, после чего к смеси добавляют 25 мг (660 Е) альдолазы 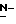 ацетилнейраминовой кислоты (производимой TOYOBO К. К. ), и смесь перемешивают при 20oC в течение 3 дней. По окончании этого времени реакционную смесь обессоливают, используя Dowex 50х8 (H+) смолу (Dowex - торговая марка), и очищают колоночной хроматографией с помощью Dowex 1 (HCOOH), элюируют 1,0 М водным раствором муравьиной кислоты, получая 1,8 г (выход 26%) названного соединения в виде бесцветного вязкого вещества.
ацетилнейраминовой кислоты (производимой TOYOBO К. К. ), и смесь перемешивают при 20oC в течение 3 дней. По окончании этого времени реакционную смесь обессоливают, используя Dowex 50х8 (H+) смолу (Dowex - торговая марка), и очищают колоночной хроматографией с помощью Dowex 1 (HCOOH), элюируют 1,0 М водным раствором муравьиной кислоты, получая 1,8 г (выход 26%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,30 ( 4:1:1 = изопропанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 324 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
1,80 (1H, дублет дублетов, J = 12,0 и 12,0 Гц);
2,00 (3H, синглет);
2,10 (1H, дублет дублетов, J = 4,5 и 12,0 Гц);
3,48 (3H, синглет);
3,50 - 3,80 (7H, мультиплет).
28 (iv) Метил 5-ацетамидо-3,5-дидезокси-7-O-метил-D-глицеро-D-галакто-2-нонуропиранозоат (nonuropyranosoate)
680 мг (2,10 ммоль) 5-aцетaмидo-3,5-дидезoкcи-7 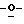 метил
метил 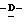 глицеро
глицеро 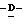 галакто-2-нонуропиранозоевой кислоты [полученной, как описано в стадии (iii) выше] растворяют в 20 мл метанола, и к полученному раствору добавляют 500 мг Dowex 50х8 (H+) катионообменной смолы (Dowex - торговая марка). Затем смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени катионообменную смолу отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 340 мг (выход 48%) названного соединения в виде бесцветного аморфного вещества.
галакто-2-нонуропиранозоевой кислоты [полученной, как описано в стадии (iii) выше] растворяют в 20 мл метанола, и к полученному раствору добавляют 500 мг Dowex 50х8 (H+) катионообменной смолы (Dowex - торговая марка). Затем смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени катионообменную смолу отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 340 мг (выход 48%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,15 (5:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 338 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
1,90 (1H, дублет дублетов, J = 12,0 и 14,0 Гц);
2,00 (3H, синглет);
2,16 (1H, дублет дублетов, J = 4,5 и 12,0 Гц);
3,40 (1H, мультиплет);
3,45 (3H, синглет);
3,50 - 3,80 (3H, мультиплет);
3,77 (3H, синглет);
3,80 - 4,00 (2H, мультиплет);
4,20 (1H, дублет дублетов, J = 1,5 и 9,5 Гц).
28 (v) Метил 5-ацетамидо-4,8,9-три-O-ацетил-2,3,5-тридезокси-7-O-метил-D-глицеро-D-галакто-2-енопиранозоат
686 мг (2,03 ммоль) метил 5-ацетамидо-3,5-дидезокси-7- 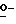 метил
метил  глицеро
глицеро  галакто-2-нонуропиранозоата [полученного, как описано в стадии (iv) выше] растворяют в смеси 10 мл пиридина и 10 мл уксусного ангидрида, и смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 20 мл 4М раствора хлористого водорода в диоксане, после чего раствор перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени полученную смесь растворяют в бензоле, и к полученному раствору добавляют 182 мг (1,20 ммоль) 1,8-диазабицикло[5.4.0]-7-ундецена, и смесь перемешивают при комнатной температуре в течение 2 часов. Затем реакционную смесь выливают в 2-слойный раствор 30 мл метиленхлорида и 15 мл насыщенного водного раствора хлорида аммония, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 310 мг (выход 34%) названного соединения в виде бесцветного аморфного вещества.
галакто-2-нонуропиранозоата [полученного, как описано в стадии (iv) выше] растворяют в смеси 10 мл пиридина и 10 мл уксусного ангидрида, и смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 20 мл 4М раствора хлористого водорода в диоксане, после чего раствор перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени полученную смесь растворяют в бензоле, и к полученному раствору добавляют 182 мг (1,20 ммоль) 1,8-диазабицикло[5.4.0]-7-ундецена, и смесь перемешивают при комнатной температуре в течение 2 часов. Затем реакционную смесь выливают в 2-слойный раствор 30 мл метиленхлорида и 15 мл насыщенного водного раствора хлорида аммония, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 310 мг (выход 34%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,30 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 446 (M++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
2,00 (3H, синглет);
2,06 (3H, синглет);
2,08 (3H, синглет);
2,10 (3H, синглет);
3,50 (3H, синглет);
3,65 (1H, дублет дублетов, J = 3,0 и 3,0 Гц);
3,80 (3H, синглет);
4,20 - 4,35 (2H, мультиплет);
4,45 (1H, мультиплет);
4,70 (1H, дублет дублетов, J = 3,0 и 12,0 Гц);
5,35 (1H, мультиплет);
5,50 (1H, дублет дублетов, J = 3,0 и 7,0 Гц);
5,55 (1H, дублет, J = 8,0 Гц);
6,00 (1H, дублет, J = 2,8 Гц).
28 (vi) Метил 5-ацетамидо-4-азидо-8,9-ди-O-ацетил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоат
303 мг (0,67 ммоль) метил 5-ацетамидо-4,8,9-три  ацетил-2,3,5-тридезокси-7
ацетил-2,3,5-тридезокси-7  метил
метил  глицеро
глицеро  галакто-нон-2- енопиранозоата [полученного, как описано в стадии (v) выше] растворяют в 10 мл безводного метиленхлорида, и к полученному раствору добавляют 22 мг (0,67 ммоль) метанола. 956 мг (6,74 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученной смеси в атмосфере азота, и смесь перемешивают при комнатной температуре в течение 24 часов. По окончании этого времени реакционную смесь выливают в смесь 20 мл воды, 10 г льда, 5 г твердого кислого карбоната натрия и 20 мл этилацетата, и смесь энергично перемешивают в течение 10 минут. Органический слой затем отделяют, промывают 10 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (270 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 270 мг катионообменной смолы [Dowex 50х8 (H+) - Dowex - торговая марка] и 90 мг (1,37 ммоль) азида натрия. Затем смесь перемешивают при 90oC в течение 4 часов. По окончании этого времени Dowex 50х8 (H+) смолу отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2-слойном растворе 20 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 250 мг (выход 70%) названного соединения в виде бесцветного вязкого вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в стадии (v) выше] растворяют в 10 мл безводного метиленхлорида, и к полученному раствору добавляют 22 мг (0,67 ммоль) метанола. 956 мг (6,74 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученной смеси в атмосфере азота, и смесь перемешивают при комнатной температуре в течение 24 часов. По окончании этого времени реакционную смесь выливают в смесь 20 мл воды, 10 г льда, 5 г твердого кислого карбоната натрия и 20 мл этилацетата, и смесь энергично перемешивают в течение 10 минут. Органический слой затем отделяют, промывают 10 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (270 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 270 мг катионообменной смолы [Dowex 50х8 (H+) - Dowex - торговая марка] и 90 мг (1,37 ммоль) азида натрия. Затем смесь перемешивают при 90oC в течение 4 часов. По окончании этого времени Dowex 50х8 (H+) смолу отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2-слойном растворе 20 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 250 мг (выход 70%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,30 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 429 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
2,06 (6H, синглет);
2,10 (3H, синглет);
3,50 (3H, синглет);
3,65 (1H, дублет дублетов, J = 1,8 и 4,0 Гц);
3,80 (3H, синглет);
4,25 (1H, дублет дублетов, J = 5,0 и 12,0 Гц);
4,45 - 4,55 (2H, мультиплет);
4,75 (1H, дублет дублетов, J = 3,2 и 12,0 Гц);
5,35 (1H, мультиплет);
5,52 (1H, дублет, J = 8,2 Гц);
5,98 (1H, дублет, J = 2,7 Гц).
28 (vii) Метил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-8,9-ди-O-ацетил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоат
80 мг (0,42 ммоль) метил 5-ацетамидо-4-азидо-8,9-ди  ацетил-2,3,4,5,7-пентадезокси-7-метокси
ацетил-2,3,4,5,7-пентадезокси-7-метокси  глицеро
глицеро 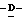 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vi) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 130 мг Lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (120 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 100 мг (0,37 ммоль)
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vi) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 130 мг Lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (120 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 100 мг (0,37 ммоль) 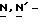 ди-т-бутоксикарбонилтиомочевины, 75 мг (0,74 ммоль) триэтиламина и 100 мг (0,37 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией, и фильтрат выливают в 2-слойный раствор 10 мл этилацетата и 50 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 180 мг (выход 64%) названного соединения в виде бесцветного аморфного вещества.
ди-т-бутоксикарбонилтиомочевины, 75 мг (0,74 ммоль) триэтиламина и 100 мг (0,37 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией, и фильтрат выливают в 2-слойный раствор 10 мл этилацетата и 50 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 180 мг (выход 64%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,50 (20:1 = метиленхлорид:метанол) .
[α]
Масс-спектр (ББА, FAB) м/з 645 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,49 (9H, синглет);
1,50 (9H, синглет);
1,97 (3H, синглет);
2,05 (3H, синглет);
2,07 (3H, синглет);
3,52 (3H, синглет);
3,55 (1H, мультиплет);
3,78 (3H, синглет);
4,10 (1H, дублет дублетов, J = 1,0 и 10,5 Гц);
4,25 - 4,40 (2H, мультиплет);
4,82 (1H, дублет дублетов, J = 3,2 и 12,0 Гц);
5,12 (1H, двойной дублет дублетов, J = 2,5 и 11,0 и 11,0 Гц);
5,30 (1H, мультиплет);
5,85 (1H, дублет, J = 2,3 Гц);
6,35 (1H, дублет, J = 8,8 Гц).
28 (viii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
53 мг (0,083 ммоль) метил 5-ацетамидо-4- 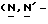 бис-т- бутоксикарбонилгуанидино)-8,9-ди
бис-т- бутоксикарбонилгуанидино)-8,9-ди 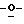 ацетил-2,3,4,5,7- пентадезокси-7-метокси
ацетил-2,3,4,5,7- пентадезокси-7-метокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vii) выше] растворяют в 2 мл метанола, и к полученному раствору добавляют 0,2 мл О, 1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 1 мл дистиллированной воды. 72 мкл 1N водного раствора гидроксида натрия затем добавляют к реакционной смеси, которую затем перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют Dowex 50х8 (H+) смолой (Dowex - торговая марка) и затем воду удаляют дистилляцией. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 24 мг (выход 85%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vii) выше] растворяют в 2 мл метанола, и к полученному раствору добавляют 0,2 мл О, 1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 1 мл дистиллированной воды. 72 мкл 1N водного раствора гидроксида натрия затем добавляют к реакционной смеси, которую затем перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют Dowex 50х8 (H+) смолой (Dowex - торговая марка) и затем воду удаляют дистилляцией. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 24 мг (выход 85%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 ( 4:1:1 = изопропанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 347 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
2,00 (3H, синглет);
3,37 (3H, синглет);
3,55 (1H, дублет, J = 8,5 Гц);
3,65 (1H, дублет дублетов, J = 5,0 и 12 Гц);
3,90 (3H, мультиплет);
4,20 (1H, дублет дублетов, J = 10 и 10 Гц);
4,40 - 4,50 (2H, мультиплет);
5,85 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 29
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 163-41)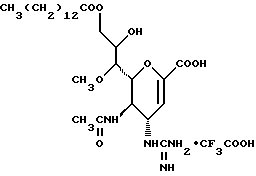
29 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро- D-галакто-нон-2-енопиранозоат
87 мг (0,14 ммоль) метил 5-ацетамидо-4-  бис-т- бутоксикарбонилгуанидино)-8,9-ди
бис-т- бутоксикарбонилгуанидино)-8,9-ди  ацетил-2,3,4,5,7- пентадезокси-7-метокси
ацетил-2,3,4,5,7- пентадезокси-7-метокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 28 (vii)] растворяют в 5 мл метанола, и к полученному раствору добавляют 2 мл 0,4 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 4 мл дистиллированной воды и к полученному раствору добавляют 0,2 мл 1 N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и затем воду удаляют дистилляцией, после чего остаток растворяют в 1:1, по объему, смеси метанола и метиленхлорида, и 47 мг (0,24 ммоль) дифенилдиазометана и 50 мг (0,38 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученному раствору. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени добавляют уксусную кислоту, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 29 мг (выход 30%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 28 (vii)] растворяют в 5 мл метанола, и к полученному раствору добавляют 2 мл 0,4 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 4 мл дистиллированной воды и к полученному раствору добавляют 0,2 мл 1 N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4 М раствором хлористого водорода в диоксане, и затем воду удаляют дистилляцией, после чего остаток растворяют в 1:1, по объему, смеси метанола и метиленхлорида, и 47 мг (0,24 ммоль) дифенилдиазометана и 50 мг (0,38 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученному раствору. Затем смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени добавляют уксусную кислоту, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 29 мг (выход 30%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,3 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 713 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
1,46 (9H, синглет);
1,52 (9H, синглет);
1,95 (3H, синглет);
3,48 (1H, дублет, J = 9,0 Гц);
3,68 (1H, дублет дублетов, J = 4,0 и 12 Гц);
3,85 (1H, дублет дублетов, J = 2,5 и 12 Гц);
3,95 (1H, мультиплет);
4,32 (1H, дублет дублетов, J = 10 и 10 Гц);
4,43 (1H, дублет, J = 10 Гц);
5,05 (1H, дублет дублетов, J = 2,2 и 10 Гц);
6,02 (1H, дублет, J = 2,2 Гц);
6,90 (1H, синглет);
7,20 - 7,50 (10H, мультиплет).
29 (ii) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-тетрадеканоил-2,3,4,5,7- пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоат
28 мг (0,039 ммоль) дифенилметил 5-ацетамидо-4- 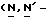 бис-т- бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- метокси
бис-т- бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- метокси 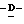 глицеро
глицеро 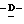 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 8 мг (0,05 ммоль) тетрадеканоил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 22 мг (выход 61%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 8 мг (0,05 ммоль) тетрадеканоил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 22 мг (выход 61%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,45 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 923 (М++H).
1H-Спектр ядерного магнитного резонанса (CHCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 - 1,30 (20H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,98 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,40 (1H, мультиплет);
3,48 (3H, синглет);
4,10 - 4,50 (5H, мультиплет);
5,18 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,18 (1H, дублет, J = 8,7 Гц);
6,92 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
29 (iii) Соль трифторуксусной кислоты 5-ацетамидо-гуанидино-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7-метoкcи-D-глицеpo-D-гaлaктo-нoн-2-енопиранозоевой кислоты
22 мг (0,024 ммоль) дифенилметил 5-ацетамидо-4- 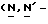 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9 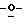 тетрадеканоил- 2,3,4,5,7-пентaдезoкcи-7-метoкcи
тетрадеканоил- 2,3,4,5,7-пентaдезoкcи-7-метoкcи 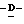 глицеро
глицеро  гaлaктo-нoн-2- енопиранозоата [полученного, как описано в стадии (ii)] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 10 мг (выход 74%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2- енопиранозоата [полученного, как описано в стадии (ii)] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 10 мг (выход 74%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,4 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 557 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,25 - 1,40 (20H, мультиплет);
1,60 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,37 (2H, триплет, J = 7,5 Гц);
3,38 (3H, синглет);
3,45 (1H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 30
Соль трифторуксусной кислоты 5-ацетамидо-4- гуанидино-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2- еноевой (enoic) кислоты (Соединение N 199-1)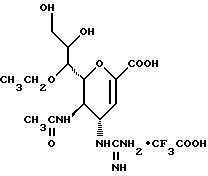
30 (i) Бензил N-ацетил-3,6-ди-O-бензил-4-O-этил -α- D-глюкoзамин
8,35 г (16,8 ммоль) бензил  ацетил-3,6-ди
ацетил-3,6-ди 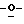 бензил -α-
бензил -α- 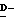 глюкозамина [полученного согласно способу, описанному в Carbohydrate Res. 83, 163-169 (1980)] растворяют в 80 мл диметилформамида, и к полученному раствору добавляют 1,84 г (42,2 ммоль) гидрида натрия. Затем смесь перемешивают при комнатной температуре в течение 30 минут, после чего к смеси при 0oC добавляют 2,86 г (18,5 ммоль) этилиодида, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 200 мл этилацетата и 100 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем ее сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 4: 1, по объему, смесь метиленхлорида и этилацетата в качестве элюента, получая 7,0 г (выход 80%) названного соединения в виде бесцветного твердого вещества.
глюкозамина [полученного согласно способу, описанному в Carbohydrate Res. 83, 163-169 (1980)] растворяют в 80 мл диметилформамида, и к полученному раствору добавляют 1,84 г (42,2 ммоль) гидрида натрия. Затем смесь перемешивают при комнатной температуре в течение 30 минут, после чего к смеси при 0oC добавляют 2,86 г (18,5 ммоль) этилиодида, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 200 мл этилацетата и 100 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем ее сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 4: 1, по объему, смесь метиленхлорида и этилацетата в качестве элюента, получая 7,0 г (выход 80%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,55 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 520 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,10 (3H, триплет, J = 7,0 Гц);
1,80 (3H, синглет);
3,40 - 3,90 (7H, мультиплет);
4,21 (1H, двойной дублет дублетов, J = 3,5, 10,0 и 10,0 Гц);
4,40 - 4,90 (7H, мультиплет);
5,22 (1H, дублет, J = 10,0 Гц);
7,20 - 7,40 (15H, мультиплет).
30 (ii) N-Ацетил-4-O-этил -α- D-глюкозамин
7,0 г (13,4 ммоль) бензил  ацетил-3,6-ди
ацетил-3,6-ди 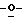 бензил-4-
бензил-4- 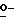 этил
этил 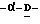 глюкозамина [полученного, как описано в стадии (i) выше] растворяют в 60 мл уксусной кислоты, и к полученному раствору добавляют 10 г палладий-на-углероде. Затем смесь перемешивают в атмосфере водорода при давлении 3 атм в течение 3 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя способ градиентного элюирования, смесями метиленхлорида и метанола в диапазоне от 10:1 до 5:1, по объему, в качестве элюента, получая 2,4 г (выход 81%) названного соединения в виде бесцветного твердого вещества.
глюкозамина [полученного, как описано в стадии (i) выше] растворяют в 60 мл уксусной кислоты, и к полученному раствору добавляют 10 г палладий-на-углероде. Затем смесь перемешивают в атмосфере водорода при давлении 3 атм в течение 3 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя способ градиентного элюирования, смесями метиленхлорида и метанола в диапазоне от 10:1 до 5:1, по объему, в качестве элюента, получая 2,4 г (выход 81%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,35 (5:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 250 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц), δ (ппм):
1,15 (3H, триплет, J = 7,0 Гц);
2,00 (3H, синглет);
3,33 (2H, квартет, J = 7,0 Гц);
3,60 - 3,90 (6H, мультиплет);
5,15 (1H, синглет).
30 (iii) 5-Ацетамидо-3,5-дидезокси-7-O-этил-D-глицеро-D- галакто-2-нонуропиранозоевая кислота
5,0 г (20,1 ммоль) 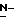 ацетил-4
ацетил-4 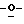 этил
этил 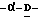 глюкозамина [полученного, как описано в стадии (iii) выше] растворяют в дистиллированной воде, и к полученному раствору добавляют 100 мг азида натрия и 5,0 г (45,5 ммоль) пирувата натрия. pH реакционной смеси доводят до значения 10-11, используя 1N водный раствор гидроксида натрия, после чего добавляют 25 мг (660 Е) альдолазы
глюкозамина [полученного, как описано в стадии (iii) выше] растворяют в дистиллированной воде, и к полученному раствору добавляют 100 мг азида натрия и 5,0 г (45,5 ммоль) пирувата натрия. pH реакционной смеси доводят до значения 10-11, используя 1N водный раствор гидроксида натрия, после чего добавляют 25 мг (660 Е) альдолазы 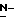 ацетил-нейраминовой кислоты (производимой TOYOBO К. К.), и смесь перемешивают при 20oC в течение 3 дней. По окончании этого времени реакционную смесь обессоливают, используя Dowex 50х8 (H+) смолу (Dowex -торговая марка) и очищают с помощью хроматографии, используя Dowex 50х8 (H+) смолу (Dowex - торговая марка) с 1,0М водным раствором муравьиной кислоты в качестве элюента, получая 500 мг (выход 7,4%) названного соединения в виде бесцветного вязкого вещества.
ацетил-нейраминовой кислоты (производимой TOYOBO К. К.), и смесь перемешивают при 20oC в течение 3 дней. По окончании этого времени реакционную смесь обессоливают, используя Dowex 50х8 (H+) смолу (Dowex -торговая марка) и очищают с помощью хроматографии, используя Dowex 50х8 (H+) смолу (Dowex - торговая марка) с 1,0М водным раствором муравьиной кислоты в качестве элюента, получая 500 мг (выход 7,4%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,20 ( 4:1:1 = изопропанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 338 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
1,05 (3H, триплет, J = 7,0 Гц);
1,80 (1H, дублет дублетов, J = 12,0 и 12,0 Гц);
2,00 (3H, синглет);
2,20 (1H, дублет дублетов, J = 4,5 и 12,0 Гц);
3,50 - 3,80 (7H, мультиплет).
30 (iv) Метил 3- ацетамидо-3,5-дидезокси-7-O-этил-D-глицеро-D-галакто-2-нонуропиранозоат
1,9 г (5,64 ммоль) 5-ацетамидо-3,5-дидезокси-7 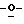 этил
этил 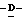 глицеро
глицеро 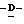 галакто-2-нонуропиранозоевой кислоты [полученной, как описано в стадии (iii) выше] растворяют в 60 мл метанола, и к полученному раствору добавляют 600 мг катионообменной смолы [Dowex 50х8 (H+) - Dowex - торговая марка]. Затем смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени Dowex 50х8 (H+) отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 1,4 г (выход 71%) названного соединения в виде бесцветного аморфного вещества.
галакто-2-нонуропиранозоевой кислоты [полученной, как описано в стадии (iii) выше] растворяют в 60 мл метанола, и к полученному раствору добавляют 600 мг катионообменной смолы [Dowex 50х8 (H+) - Dowex - торговая марка]. Затем смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени Dowex 50х8 (H+) отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 1,4 г (выход 71%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,3 (5:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 352 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
1,17 (3H, триплет, J = 7,0 Гц);
1,95 (1H, дублет дублетов, J = 12,0 и 14,0 Гц);
2,00 (3H, синглет);
2,16 (1H, дублет дублетов, J = 4,5 и 12,0 Гц);
3,42 (1H, дублет дублетов, J = 1,5 и 8,0 Гц);
3,60 (2H, квартет, J = 7,0 Гц);
3,77 (3H, синглет);
3,70 - 4,00 (4H, мультиплет);
4,15 (1H, дублет дублетов, J = 1,5 и 9,5 Гц).
30 (v) Метил 5-ацетамидо-4,8,9-три-O-ацетил-2,3,5,7- тетрадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоат
1,4 г (3,99 ммоль) метил 5-ацетамидо-3,5-дидезокси-7-  этил
этил  глицеро
глицеро  гaлaктo-2-нoнуpoпиpaнoзoaтa [полученного, как описано в стадии (iv) выше] растворяют в смеси 20 мл пиридина и 10 мл уксусного ангидрида, и смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 50 мл 4М раствора хлористого водорода в диоксане. Затем смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в бензоле. Затем к реакционной смеси добавляют 952 мг (6,30 ммоль) 1,8-диазабицикло [5.4.0]-7-ундецена, и смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 30 мл метиленхлорида и 15 мл насыщенного водного раствора хлорида аммония, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 1,1 г (выход 60%) названного соединения в виде бесцветного аморфного вещества.
гaлaктo-2-нoнуpoпиpaнoзoaтa [полученного, как описано в стадии (iv) выше] растворяют в смеси 20 мл пиридина и 10 мл уксусного ангидрида, и смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 50 мл 4М раствора хлористого водорода в диоксане. Затем смесь перемешивают при комнатной температуре в течение 15 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в бензоле. Затем к реакционной смеси добавляют 952 мг (6,30 ммоль) 1,8-диазабицикло [5.4.0]-7-ундецена, и смесь перемешивают при комнатной температуре в течение 2 часов. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 30 мл метиленхлорида и 15 мл насыщенного водного раствора хлорида аммония, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 1,1 г (выход 60%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,30 ( 20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 460 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,20 (3H, триплет, J = 7,0 Гц);
1,98 (3H, синглет);
2,05 (3H, синглет);
2,08 (3H, синглет);
3,50 - 3,80 (3H, мультиплет);
3,80 (3H, синглет);
4,20 - 4,35 (2H, мультиплет);
4,45 (1H, мультиплет);
4,70 (1H, дублет дублетов, J = 3,2 и 12,0 Гц);
5,33 (1H, мультиплет);
5,47 (1H, дублет дублетов, J = 3,3 и 7,0 Гц);
5,51 (1H, дублет, J = 7,0 Гц);
6,00 (1H, дублет, J = 3,3 Гц).
30 (vi) Метил 5-Ацетамидо-4-азидо-8,9-ди-O-ацетил-2,3,4,5,7- пентадезокси-7-этокси-D-глицеро-D-галакто-нон-енопиранозоат
1000 мг (2,18 ммоль) метил 5-ацетамидо-4,8,9- три  ацетил-2,3,5,7-тетрадезокси-7- этокси
ацетил-2,3,5,7-тетрадезокси-7- этокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (v) выше] растворяют в 20 мл безводного метиленхлорида, и к полученному раствору добавляют 25 мг (0,78 ммоль) метанола, после чего 3,1 г (21,8 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученной смеси в атмосфере азота, и смесь перемешивают при комнатной температуре в течение 24 часов. По окончании этого времени реакционную смесь выливают в смесь 50 мл воды, 10 г льда, 10 г твердого кислого карбоната натрия и 50 мл этилацетата, и смесь энергично перемешивают в течение 10 минут. Органический слой затем промывают 10 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (800 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 800 мг катионообменной смолы [Dowex 50х8 (H+) - Dowex - торговая марка] и 400 мг (0,15 ммоль) азида натрия. Затем смесь перемешивают при 90oC в течение 4 часов. По окончании этого времени Dowex 50х8 (H+) смолу отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2-слойном растворе 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 600 мг (выход 63%) названного соединения в виде бесцветного вязкого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (v) выше] растворяют в 20 мл безводного метиленхлорида, и к полученному раствору добавляют 25 мг (0,78 ммоль) метанола, после чего 3,1 г (21,8 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученной смеси в атмосфере азота, и смесь перемешивают при комнатной температуре в течение 24 часов. По окончании этого времени реакционную смесь выливают в смесь 50 мл воды, 10 г льда, 10 г твердого кислого карбоната натрия и 50 мл этилацетата, и смесь энергично перемешивают в течение 10 минут. Органический слой затем промывают 10 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (800 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 800 мг катионообменной смолы [Dowex 50х8 (H+) - Dowex - торговая марка] и 400 мг (0,15 ммоль) азида натрия. Затем смесь перемешивают при 90oC в течение 4 часов. По окончании этого времени Dowex 50х8 (H+) смолу отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 2-слойном растворе 30 мл этилацетата и 20 мл насыщенного водного раствора кислого карбоната натрия, и органический слой отделяют и промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 600 мг (выход 63%) названного соединения в виде бесцветного вязкого вещества.
Rf = 0,30 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 443 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,25 (3H, триплет, J = 7,0 Гц);
2,09 (3H, синглет);
2,10 (3H, синглет);
2,13 (3H, синглет);
3,50 - 3,80 (3H, мультиплет);
3,80 (3H, синглет);
4,05 (1H, мультиплет);
4,25 (1H, дублет дублетов, J = 5,0 и 12,0 Гц);
4,45 - 4,55 (2H, мультиплет);
4,80 (1H, дублет дублетов, J = 3,2 и 12,0 Гц);
5,35 (1H, мультиплет);
5,51 (1H, дублет, J = 8,2 Гц);
6,00 (1H, дублет, J = 2,7 Гц).
30 (vii) Метил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-8,9-ди-O-ацетил- 2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоат
580 мг (1,31 ммоль) метил 5-ацетамидо-4-азидо-8,9-ди-  ацетил-2,3,4,5,7-пентадезокси-7-этокси
ацетил-2,3,4,5,7-пентадезокси-7-этокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vi) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 270 мг Lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (400 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 408 мг (1,48 ммоль)
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vi) выше] растворяют в 10 мл метанола, и к полученному раствору добавляют 270 мг Lindlar катализатора. Затем смесь перемешивают в атмосфере водорода в течение 2 часов. По окончании этого времени катализатор отделяют фильтрацией, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток (400 мг) растворяют в 10 мл диметилформамида, и к полученному раствору добавляют 408 мг (1,48 ммоль) 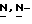 ди-т-бутоксикарбонилтиомочевины, 300 мг (2,95 ммоль) триэтиламина и 402 мг (1,48 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией, и фильтрат выливают в 2-слойный раствор 20 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 530 мг (выход 61%) названного соединения в виде бесцветного аморфного вещества.
ди-т-бутоксикарбонилтиомочевины, 300 мг (2,95 ммоль) триэтиламина и 402 мг (1,48 ммоль) хлорида ртути. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени твердое вещество отделяют фильтрацией, и фильтрат выливают в 2-слойный раствор 20 мл этилацетата и 10 мл насыщенного водного раствора кислого карбоната натрия. Органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 2:1, по объему, смесь гексана и этилацетата в качестве элюента, получая 530 мг (выход 61%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,40 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 659 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,20 (3H, триплет, J = 7,0 Гц);
1,49 (9H, синглет);
1,50 (9H, синглет);
1,95 (3H, синглет);
2,06 (3H, синглет);
2,09 (3H, синглет);
3,50 - 3,80 (3H, мультиплет);
3,80 (3H, синглет);
4,10 (1H, дублет дублетов, J = 1,0 и 10,5 Гц);
4,25 - 4,40 (2H, мультиплет);
4,80 (1H, дублет дублетов, J = 3,2 и 12,0 Гц);
5,10 (1H, двойной дублет дублетов, J = 2,5, 11,0 и 11,0 Гц);
5,30 (1H, мультиплет);
5,83 (1H, дублет, J = 2,3 Гц);
6,20 (1H, дублет, J = 8,8 Гц).
30 (viii) Соль трифторуксусной кислоты 5-ацетамидо-4- гуанидино-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон- 2-енопиранозоевой кислоты
50 мг (0,076 ммоль) метил 5-ацетамидо-4-( 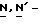 бис-т- бутоксикарбонилгуанидино)-8,9-ди
бис-т- бутоксикарбонилгуанидино)-8,9-ди  ацетил-2,3,4,5,7-пентадезокси- 7-этокси
ацетил-2,3,4,5,7-пентадезокси- 7-этокси  глицеро
глицеро 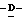 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vii) выше] растворяют в 2 мл метанола, и к полученному раствору добавляют 0,2 мл О, 1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 1 мл дистиллированной воды. Затем 110 мкл 1N водного раствора гидроксида натрия добавляют к реакционной смеси, которую затем перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют Dowex 50х8 (H+) смолой (Dowex - торговая марка), и затем воду удаляют дистилляцией. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 27 мг (выход 75%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (vii) выше] растворяют в 2 мл метанола, и к полученному раствору добавляют 0,2 мл О, 1 N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток растворяют в 1 мл дистиллированной воды. Затем 110 мкл 1N водного раствора гидроксида натрия добавляют к реакционной смеси, которую затем перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют Dowex 50х8 (H+) смолой (Dowex - торговая марка), и затем воду удаляют дистилляцией. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 5:1:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 27 мг (выход 75%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,30 (4:1:1 = изопропанол:уксусная кислота:вода).
[α]
Масс-спектр (ББА, FAB) м/з 361 (М++H).
1H-Спектр ядерного магнитного резонанса (D2O, 270 мГц) δ (ппм):
1,05 (3H, триплет, J = 7,0 Гц);
1,97 (3H, синглет);
3,40 (1H, мультиплет);
3,50-3,65 (3H, мультиплет);
3,80 (1H, дублет дублетов, J = 5,0 и 12 Гц);
3,90 (1H, мультиплет);
4,15 (1H, дублет дублетов, J = 10 и 10 Гц);
4,40 - 4,50 (2H, мультиплет);
5,55 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 31
Соль трифторуксусной кислоты 5-aцетaмидo-4-гуaнидинo-9-O-октаноил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 199-38)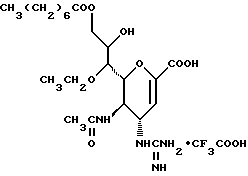
31 (i) Дифенилметил 5-ацетамидо-4-(N,N'- бис-т- бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D- галакто-нон-2-енопиранозоат
495 мг (0,75 ммоль) метил 5-ацетамидо-4- 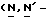 бис-т-бутоксикарбонилгуанидино)-8,9-ди
бис-т-бутоксикарбонилгуанидино)-8,9-ди 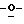 ацетил-2,3,4,5,7- пентадезокси-7-этокси
ацетил-2,3,4,5,7- пентадезокси-7-этокси 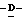 глицеро
глицеро 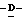 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 30 (vii)] растворяют в 10 мл метанола, и к полученному раствору добавляют 2 мл 0,1N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 10 мл дистиллированной воды и туда добавляют 1,0 мл 1N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и затем воду удаляют дистилляцией. Полученный остаток растворяют в 6:1, по объему, смеси метанола и метиленхлорида, и 500 мг (2,60 ммоль) дифенилдиазометана и 50 мг (0,38 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученному раствору. Затем смесь перемешивают при комнатной температуре в течение 2 часов, после чего туда добавляют уксусную кислоту, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 450 мг (выход 82%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 30 (vii)] растворяют в 10 мл метанола, и к полученному раствору добавляют 2 мл 0,1N метанольного раствора метоксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток растворяют в 10 мл дистиллированной воды и туда добавляют 1,0 мл 1N водного раствора гидроксида натрия. Затем смесь перемешивают при комнатной температуре в течение 1 часа. По окончании этого времени реакционную смесь нейтрализуют 4М раствором хлористого водорода в диоксане, и затем воду удаляют дистилляцией. Полученный остаток растворяют в 6:1, по объему, смеси метанола и метиленхлорида, и 500 мг (2,60 ммоль) дифенилдиазометана и 50 мг (0,38 ммоль) комплекса трифторид бора-диэтиловый эфир добавляют к полученному раствору. Затем смесь перемешивают при комнатной температуре в течение 2 часов, после чего туда добавляют уксусную кислоту, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 20:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 450 мг (выход 82%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,25 (10:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 727 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
1,20 (3H, триплет, J = 7,0 Гц);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,95 (3H, синглет);
3,60 - 4,10 (6H, мультиплет);
4,30 - 4,50 (2H, мультиплет);
5,10 (1H, мультиплет);
5,95 (1H, дублет, J = 2,7 Гц);
6,55 (1H, дублет, J = 8,0 Гц);
6,95 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,50 (1H, дублет, J = 8,5 Гц).
31 (ii) Дифенилметил 5- aцетaмидo-4-(N,N'-биc-т-бутoкcикapбoнилгуанидино)-9-O-октаноил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2- енопиранозоат
30 мг (0,041 ммоль) дифенилметил 5-aцетaмидo-4- 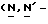 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- этокси
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- этокси 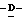 глицеро
глицеро 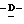 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 8 мг (0,05 ммоль) октаноил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 24 мг (выход 69%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 8 мг (0,05 ммоль) октаноил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50: 1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 24 мг (выход 69%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,30 ( 20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 854 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 (3H, триплет, J = 7,0 Гц);
1,20 - 1,30 (8H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,95 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,50 (1H, триплет, J = 5,5 Гц);
3,59 (2H, квартет, J = 7,0 Гц);
4,10 - 4,50 (5H, мультиплет);
5,10 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,10 (1H, дублет, J = 8,7 Гц);
6,94 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
31 (iii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-октаноил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
20 мг (0,023 ммоль) дифенилметил 5-ацетамидо-4- 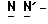 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9 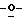 октаноил-2,3,4,5,7-пентaдезoкcи-7-этoкcи
октаноил-2,3,4,5,7-пентaдезoкcи-7-этoкcи 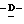 глицеро
глицеро 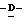 гaлaктo-нoн-2-енoпиpaнoзоата [полученного, как описано в стадии (ii) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 10 мг (выход 73%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енoпиpaнoзоата [полученного, как описано в стадии (ii) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 10 мг (выход 73%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 (2:5:1 = изопропанол:этилацетат-вода).
[α]
Масс-спектр (ББА, FAB) м/з 487 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,15 (3H, триплет, J = 7,0 Гц);
1,20 - 1,40 (8H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
3,45 - 3,60 (3H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 32
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-додеканоил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 199-40)
32 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-додеканоил-2,3,4,5,7-пентадезокси-7- этокси-D-глицеро-D-галакто-нон-2-енопиранозоат
30 мг (0,041 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-этокси
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-этокси  глицеро
глицеро 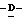 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 31 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 11 мг (0,05 ммоль) додеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 29 мг (выход 78%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 31 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 11 мг (0,05 ммоль) додеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 29 мг (выход 78%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,35 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 910 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 (3H, триплет, J = 7,0 Гц);
1,20 - 1,30 (16H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,95 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,50 (1H, триплет, J = 5,5 Гц);
3,59 (2H, квартет, J = 7,0 Гц);
4,10 - 4,50 (5H, мультиплет);
5,10 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,10 (1H, дублет, J = 8,7 Гц);
6,94 (1H, синглет);
7,20-7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
32 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-додеканоил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
28 мг (0,03 ммоль) дифенилметил 5-ацетамидо-4- 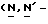 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9 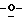 додеканоил- 2,3,4,5,7-пентадезокси-7-этокси
додеканоил- 2,3,4,5,7-пентадезокси-7-этокси 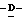 глицеро
глицеро 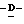 галакто- нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 12 мг (выход 61%) названного соединения в виде бесцветного твердого вещества.
галакто- нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 12 мг (выход 61%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 543 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,15 (3H, триплет, J = 7,0 Гц);
1,20 - 1,40 (16H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
3,45 - 3,60 (3H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 33
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 199-41)
33(i) Дифенилметил 5-aцетaмидo-4-(N, N'-биc-т- бутoкcикapбoнилгуанидино)-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7- этокси-D-глицеро-D-галакто-нон-2-енопиранозоат
30 мг (0,041 ммоль) дифенилметил 5-aцетaмидo-4- 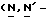 бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- этокси
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- этокси  глицеро
глицеро 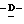 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 31 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 12 мг (0,05 ммоль) додеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 30 мг (выход 78%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 31 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 12 мг (0,05 ммоль) додеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 30 мг (выход 78%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,35 ( 20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 938 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 (3H, триплет, J = 7,0 Гц);
1,20 - 1,30 (20H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,95 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,50 (1H, триплет, J = 5,5 Гц);
3,59 (2H, квартет, J = 7,0 Гц);
4,10 - 4,50 (5H, мультиплет);
5,10 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,10 (1H, дублет, J = 8,7 Гц);
6,94 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
33 (ii) Соль трифторуксусной кислоты 5-aцетaмидo-4-гуанидино-9-O-тетрадеканоил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
28 мг (0,03 ммоль) дифенилметил 5-ацетамидо-4- 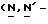 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9 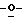 тетрадеканоил-2,3,4,5,7-пентадезокси-7-этокси
тетрадеканоил-2,3,4,5,7-пентадезокси-7-этокси 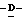 глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 13 мг (выход 74%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 13 мг (выход 74%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 571 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,15 (3H, триплет, J = 7,0 Гц);
1,20 - 1,40 (20H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
3,45 - 3,60 (3H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = l,8 Гц).
ПРИМЕР 34
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-гексадеканоил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 199-42)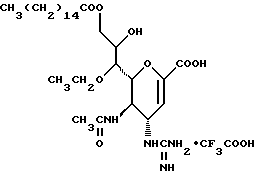
34 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бyтоксикapбонилгуанидино)-9-O-гексадеканоил-2,3,4,5,7-пентадезокси-7-этокси-D-глицеро-D-галакто-нон-2-енопиранозоат
30 мг (0,041 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- этокси
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- этокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 31 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 14 мг (0,05 ммоль) гексадеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 31 мг (выход 78%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 31 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 6 мг (0,06 ммоль) триэтиламина и 14 мг (0,05 ммоль) гексадеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 31 мг (выход 78%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,35 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 966 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 (3H, триплет, J = 7,0 Гц);
1,20 - 1,30 (24H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,95 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,50 (1H, триплет, J = 5,5 Гц);
3,59 (2H, квартет, J = 7,0 Гц);
4,10 - 4,50 (5H, мультиплет);
5,10 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,10 (1H, дублет, J = 8,7 Гц);
6,94 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
34 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4- гуанидино-9-O-гексадеканоил-2,3,4,5,7-пентадезокси-7-этокси-D- глицеро-D-галакто-нон-2-енопиранозоевой кислоты
28 мг (0,029 ммоль) дифенилметил 5-aцетaмидo-4- 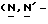 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9  гексадеканоил-2,3,4,5,7-пентaдезoкcи-7-этoкcи
гексадеканоил-2,3,4,5,7-пентaдезoкcи-7-этoкcи  глицеро
глицеро  гaлaктo-нoн-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 12 мг (выход 58%) названного соединения в виде бесцветного твердого вещества.
гaлaктo-нoн-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 12 мг (выход 58%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,3 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 599 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,15 (3H, триплет, J = 7,0 Гц);
1,20 - 1,40 (24H, мультиплет);
1,55 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,35 (2H, триплет, J = 7,5 Гц);
3,45 - 3,60 (3H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 35
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-октаноил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-гaлaктo-нoн-2-енoпиpaнoзoевoй кислоты (Соединение N 163-38)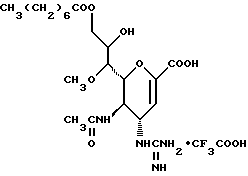
35 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-октаноил-2,3,4,5,7-пентадезокси-7-метoкcи-D- глицеpo-D-гaлaктo-нoн-2-енoпиpaнoзoaт
57 мг (0,08 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- метокси
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- метокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 11 мг (0,10 ммоль) триэтиламина и 16 мг (0,09 ммоль) октаноил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 38 мг (выход 58%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 11 мг (0,10 ммоль) триэтиламина и 16 мг (0,09 ммоль) октаноил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 38 мг (выход 58%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,5 (10:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 839 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 - 1,30 (8H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,98 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,40 (1H, мультиплет);
3,48 (3H, синглет);
4,10 - 4,50 (5H, мультиплет);
5,18 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,18 (1H, дублет, J = 8,7 Гц);
6,92 (1H, синглет);
7,20-7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
35 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-октаноил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
31 мг (0,037 ммоль) дифенилметил 5-ацетамидо-4- 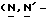 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9 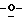 октаноил- 2,3,4,5,7-пентадезокси-7-метокси
октаноил- 2,3,4,5,7-пентадезокси-7-метокси 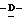 глицеро
глицеро 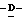 галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 15 мг (выход 69%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 15 мг (выход 69%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,34 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 473 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,25 - 1,40 (8H, мультиплет);
1,60 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,37 (2H, триплет, J = 7,5 Гц);
3,38 (3H, синглет);
3,45 (1H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 36
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-деканоил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 163-39)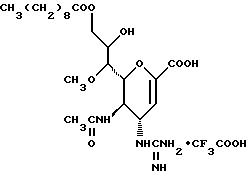
36 (i) Дифенилметил 5-ацетамидо-4- (N,N'-биc-т-бутoкcикарбонилгуанидино)-9-O-деканоил-2,3,4,5,7- пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоат
56 мг (0,08 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-метокси
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-метокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 11 мг (0,10 ммоль) триэтиламина и 18 мг (0,09 ммоль) деканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 40 мг (выход 50%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 11 мг (0,10 ммоль) триэтиламина и 18 мг (0,09 ммоль) деканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 40 мг (выход 50%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,5 (10:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 867 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 - 1,30 (12H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,98 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,40 (1H, мультиплет);
3,48 (3H, синглет);
4,10 - 4,50 (5H, мультиплет);
5,18 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,18 (1H, дублет, J = 8,7 Гц);
6,92 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
36 (ii) Соль трифторуксусной кислоты 5-aцетaмидo-4-гуанидино-9-O-деканоил-2,3,4,5,7-пентадезокси-7-метокси-D- глицеро-D-галакто-нон-2-енопиранозоевой кислоты
33 мг (0,04 ммоль) дифенилметил 5-ацетамидо-4- 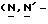 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9 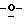 деканоил-2,3,4,5,7- пентадезокси-7-метокси
деканоил-2,3,4,5,7- пентадезокси-7-метокси 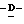 глицеро
глицеро 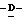 галакто-нон-2-енопиранозоата [полученного, как описано в Примере 36 (i)] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 20 мг (выход 85%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 36 (i)] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 20 мг (выход 85%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,34 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 501 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,25 - 1,40 (12H, мультиплет);
1,60 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,37 (2H, триплет, J = 7,5 Гц);
3,38 (3H, синглет;
3,45 (1H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = l,8 Гц).
ПРИМЕР 37
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-додеканоил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 163-40)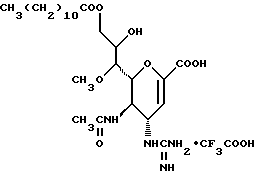
37 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-додеканоил-2,3,4,5,7-пентадезокси-7-метoкcи-D-глицеpo-D-гaлaктo-нoн-2-енoпиpaнoзoaт
51 мг (0,07 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-метокси
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7-метокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 9 мг (0,09 ммоль) триэтиламина и 19 мг (0,09 ммоль) додеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 39 мг (выход 61%) названного соединения в виде бесцветного аморфного вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 9 мг (0,09 ммоль) триэтиламина и 19 мг (0,09 ммоль) додеканоил хлорида. Смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 39 мг (выход 61%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,6 (20:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 895 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 - 1,30 (16H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,98 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,40 (1H, мультиплет);
3,48 (3H, синглет);
4,10 - 4,50 (5H, мультиплет);
5,18 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,18 (1H, дублет, J = 8,7 Гц);
6,92 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
37 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-додеканоил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты
31 мг (0,035 ммоль) дифенилметил 5-ацетамидо-4- 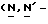 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9  додеканоил-2,3,4,5,7- пентадезокси-7-метокси
додеканоил-2,3,4,5,7- пентадезокси-7-метокси  глицеро
глицеро  галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 22 мг (выход 98%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2-енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 22 мг (выход 98%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,31 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 529 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,25 - 1,40 (16H, мультиплет);
1,60 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,37 (2H, триплет, J = 7,5 Гц);
3,38 (3H, синглет;
3,45 (1H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = 1,8 Гц).
ПРИМЕР 38
Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-гексадеканоил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоевой кислоты (Соединение N 163-42)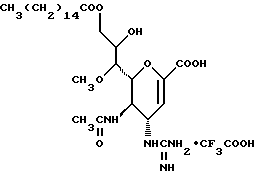
37 (i) Дифенилметил 5-ацетамидо-4-(N,N'-бис-т- бутоксикарбонилгуанидино)-9-O-гексадеканоил-2,3,4,5,7-пентадезокси-7-метокси-D-глицеро-D-галакто-нон-2-енопиранозоат
50 мг (0,07 ммоль) дифенилметил 5-ацетамидо-4-  бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- метoкcи
бис-т-бутоксикарбонилгуанидино)-2,3,4,5,7-пентадезокси-7- метoкcи  глицеро
глицеро  гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 9 мг (0,09 ммоль) триэтиламина и 23 мг (0,084 ммоль) гексадеканоил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 40 мг (выход 60%) названного соединения в виде бесцветного аморфного вещества.
гaлaктo-нoн-2-енoпиpaнoзoaтa [полученного, как описано в Примере 29 (i)] растворяют в 2 мл метиленхлорида, и к полученному раствору, при охлаждении льдом, добавляют 9 мг (0,09 ммоль) триэтиламина и 23 мг (0,084 ммоль) гексадеканоил хлорида. Затем смесь перемешивают при 0oC в течение 1 часа. По окончании этого времени реакционную смесь выливают в 2-слойный раствор 5 мл этилацетата и 3 мл насыщенного водного раствора кислого карбоната натрия, и органический слой промывают насыщенным водным раствором хлорида натрия. Затем сушат над безводным сульфатом натрия, и растворитель удаляют дистилляцией при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя 50:1, по объему, смесь метиленхлорида и метанола в качестве элюента, получая 40 мг (выход 60%) названного соединения в виде бесцветного аморфного вещества.
Rf = 0,6 (10:1 = метиленхлорид:метанол).
[α]
Масс-спектр (ББА, FAB) м/з 951 (М++H).
1H-Спектр ядерного магнитного резонанса (CDCl3, 270 мГц) δ (ппм):
0,85 (3H, мультиплет);
1,20 - 1,30 (24H, мультиплет);
1,48 (9H, синглет);
1,50 (9H, синглет);
1,55 - 1,70 (2H, мультиплет);
1,98 (3H, синглет);
2,33 (2H, триплет, J = 7,5 Гц);
3,40 (1H, мультиплет);
3,48 (3H, синглет);
4,10 - 4,50 (5H, мультиплет);
5,18 (1H, двойной дублет дублетов, J = 2,4, 9,0 и 9,0 Гц);
5,95 (1H, дублет, J = 2,3 Гц);
6,18 (1H, дублет, J = 8,7 Гц);
6,92 (1H, синглет);
7,20 - 7,50 (10H, мультиплет);
8,55 (1H, дублет, J = 8,7 Гц).
38 (ii) Соль трифторуксусной кислоты 5-ацетамидо-4-гуанидино-9-O-гексадеканоил-2,3,4,5,7-пентадезокси-7-метoкcи-D-глицеpo-D-гaлaктo-нoн-2-енопиранозоевой кислоты
34 мг (0,036 ммоль) дифенилметил 5-ацетамидо-4- 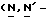 бис-т-бутоксикарбонилгуанидино)-9
бис-т-бутоксикарбонилгуанидино)-9  гексадеканоил-2,3,4,5,7- пентадезокси-7-метокси
гексадеканоил-2,3,4,5,7- пентадезокси-7-метокси  глицеро
глицеро  галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 23 мг (выход 92%) названного соединения в виде бесцветного твердого вещества.
галакто-нон-2- енопиранозоата [полученного, как описано в стадии (i) выше] растворяют в 3 мл 3:1, по объему, смеси метиленхлорида и трифторуксусной кислоты, и смесь перемешивают при комнатной температуре в течение 5 часов. По окончании этого времени растворитель удаляют дистилляцией при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле, используя 2:5:1, по объему, смесь изопропанола, этилацетата и воды в качестве элюента, получая 23 мг (выход 92%) названного соединения в виде бесцветного твердого вещества.
Rf = 0,47 (2:5:1 = изопропанол:этилацетат:вода).
[α]
Масс-спектр (ББА, FAB) м/з 585 (М++H).
1H-Спектр ядерного магнитного резонанса (CD3OD, 270 мГц) δ (ппм):
0,90 (3H, мультиплет);
1,25 - 1,40 (24H, мультиплет);
1,60 - 1,70 (2H, мультиплет);
2,00 (3H, синглет);
2,37 (2H, триплет, J = 7,5 Гц);
3,38 (3H, синглет;
3,45 (1H, мультиплет);
4,10 - 4,40 (6H, мультиплет);
5,53 (1H, дублет, J = 1,8 Гц).
Препаративный пример 1
Получают водный раствор, содержащий 10% (вес) соединения по примеру 1, 0,04% (вес) бензалконийхлорида, 0,40% (вес) фенилэтилового спирта и 89,56% (вес) очищенной воды.
Препаративный пример 2
Получают водный раствор с сорастворителем, содержащий 10% (вес) соединения по примеру 1, 0,04% (вес) бензалконийхлорида, 10,0% (вес) полиэтиленгликоля 400, 30% (вес) пропиленгликоля и 39,96% (вес) очищенной воды.
Препаративный пример 3
Получают сухой порошок, содержащий 40% (вес) соединения по примеру 1 и 60% (вес) лактозы.
Препаративный пример 4
Получают аэрозоль, содержащий 10% (вес) соединения по примеру 1, 0,5% (вес) лецитина, 34,5% флона 11 и 55% флона 12.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ НЕЙРАМИНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА | 1997 |
|
RU2169145C2 |
| 3-ЦИАНОАНДРОСТА-3,5-ДИЕН-1717β-КАРБОНОВАЯ КИСЛОТА В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО ПРОДУКТА, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ | 1993 |
|
RU2114861C1 |
| ПРОИЗВОДНЫЕ 1,2-ДИФЕНИЛПИРРОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2125044C1 |
| ПРОИЗВОДНЫЕ ОКТАГИДРОНАФТАЛИНОКСИМА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2125043C1 |
| 13-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 5-ОКСИМА МИЛБЕМИЦИНА, СОДЕРЖАЩАЯ ИХ АНТИГЕЛЬМИНТНАЯ, АКАРИЦИДНАЯ И ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2128181C1 |
| ПРОИЗВОДНЫЕ НУКЛЕОЗИДОВ ПИРИМИДИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2085557C1 |
| ЛЕЙСТРОДУКСИН, СПОСОБ ПОЛУЧЕНИЯ ЛЕЙСТРОДУКСИНА ШТАММ STREPTOMYCES PLATENSIS - ПРОДУЦЕНТ ЛЕЙСТРОДУКСИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КРОВЕТВОРНОЙ И ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ, ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО | 1992 |
|
RU2082760C1 |
| АНАЛОГИ ЛИПИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2076107C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СЛОЖНЫЕ ЭФИРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2086541C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ПРИМЕНИМЫЕ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ ЭФФЕКТОРОВ ПРИ МУСКАРИНОВЫХ РЕЦЕПТОРАХ | 1995 |
|
RU2152385C1 |
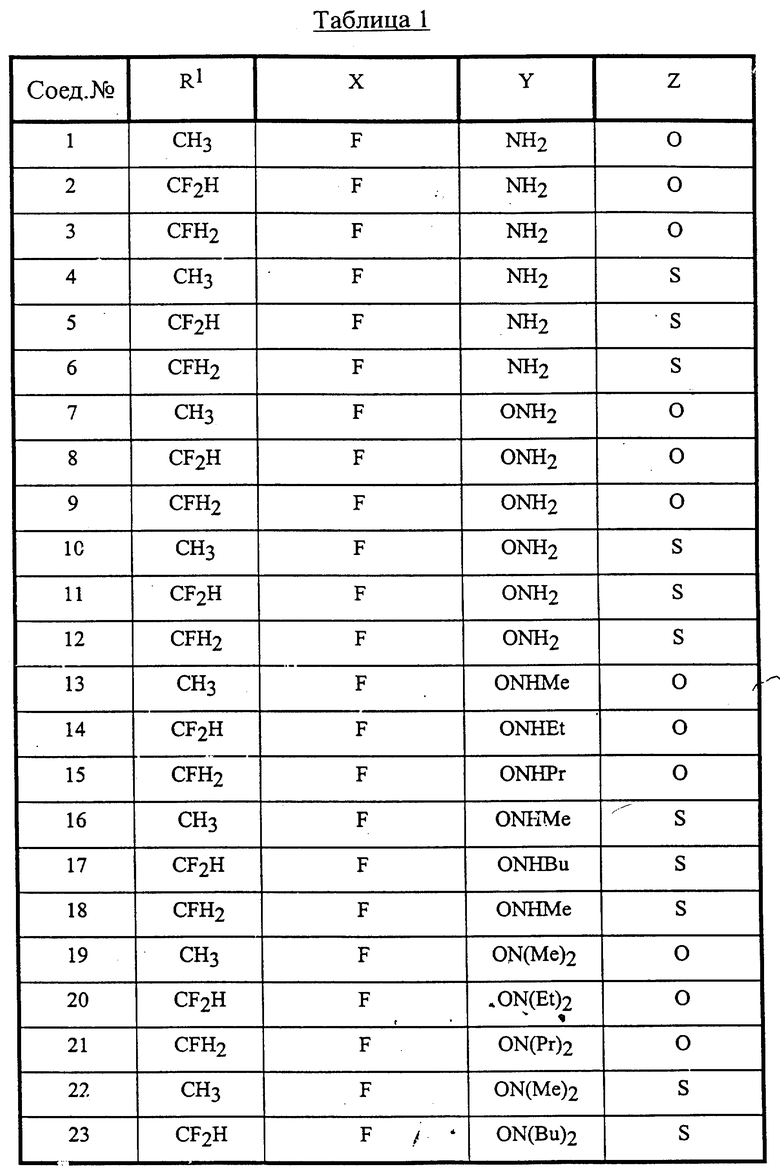
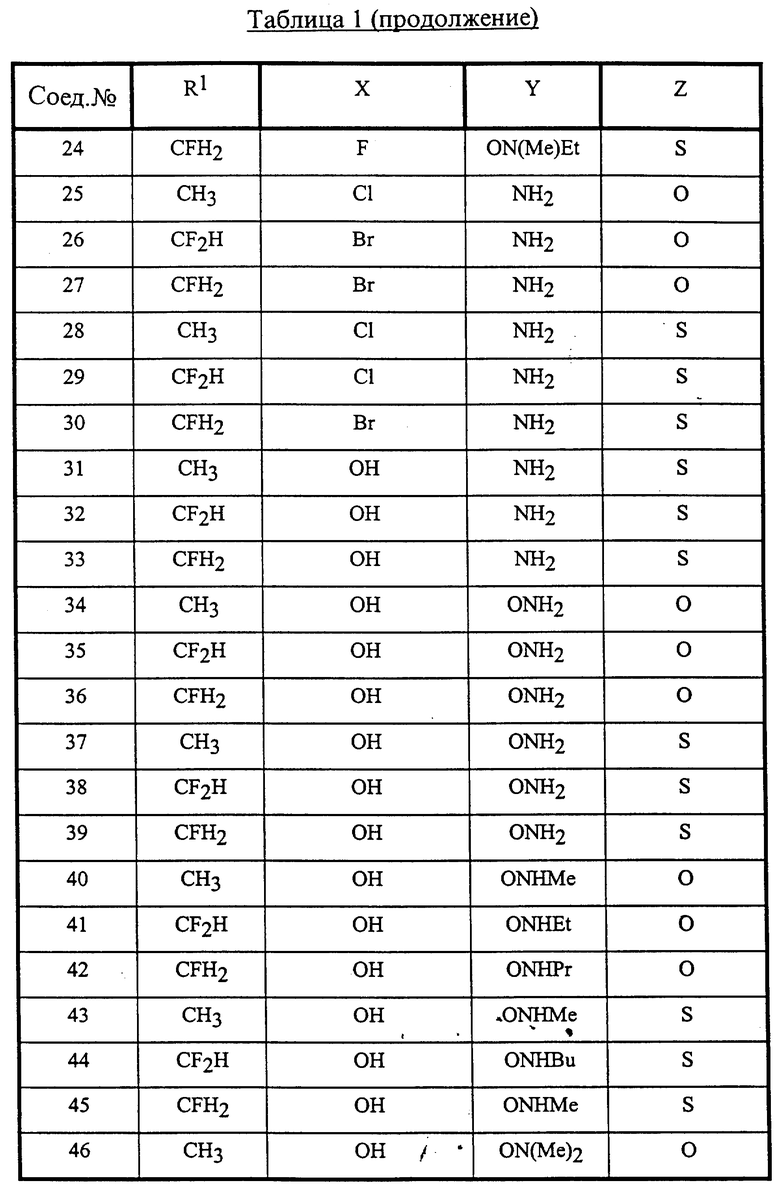
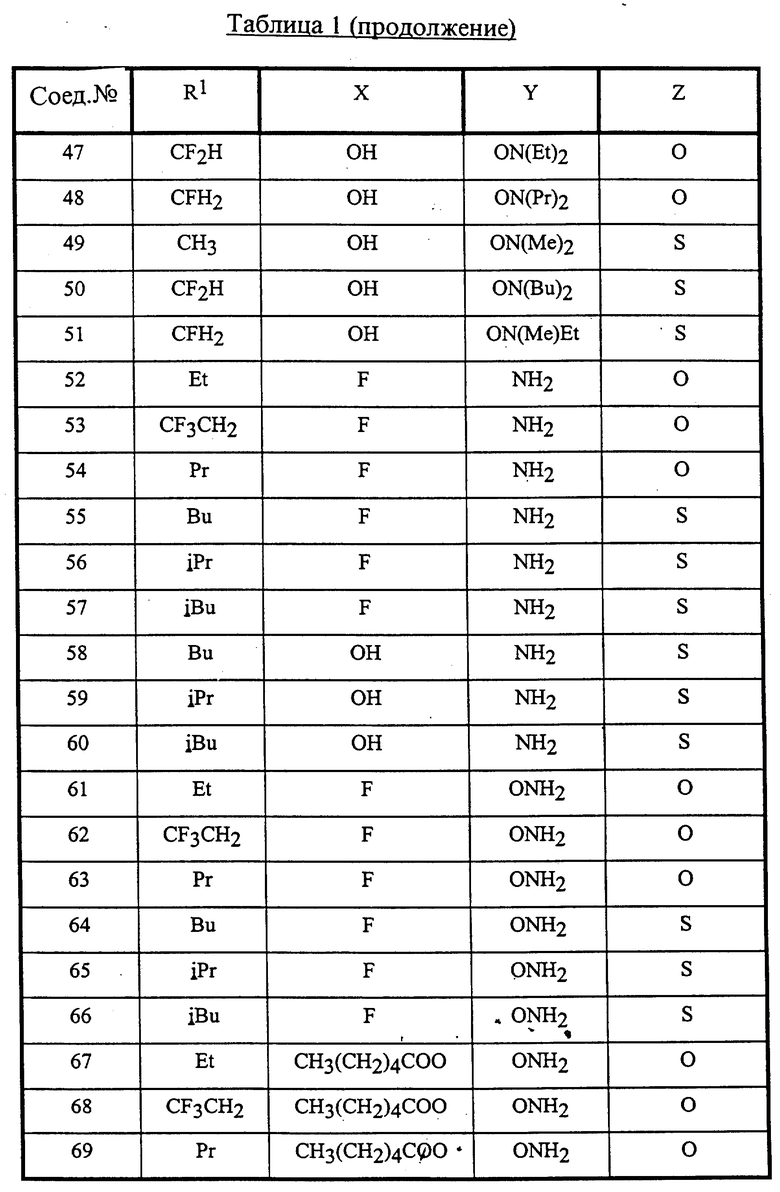
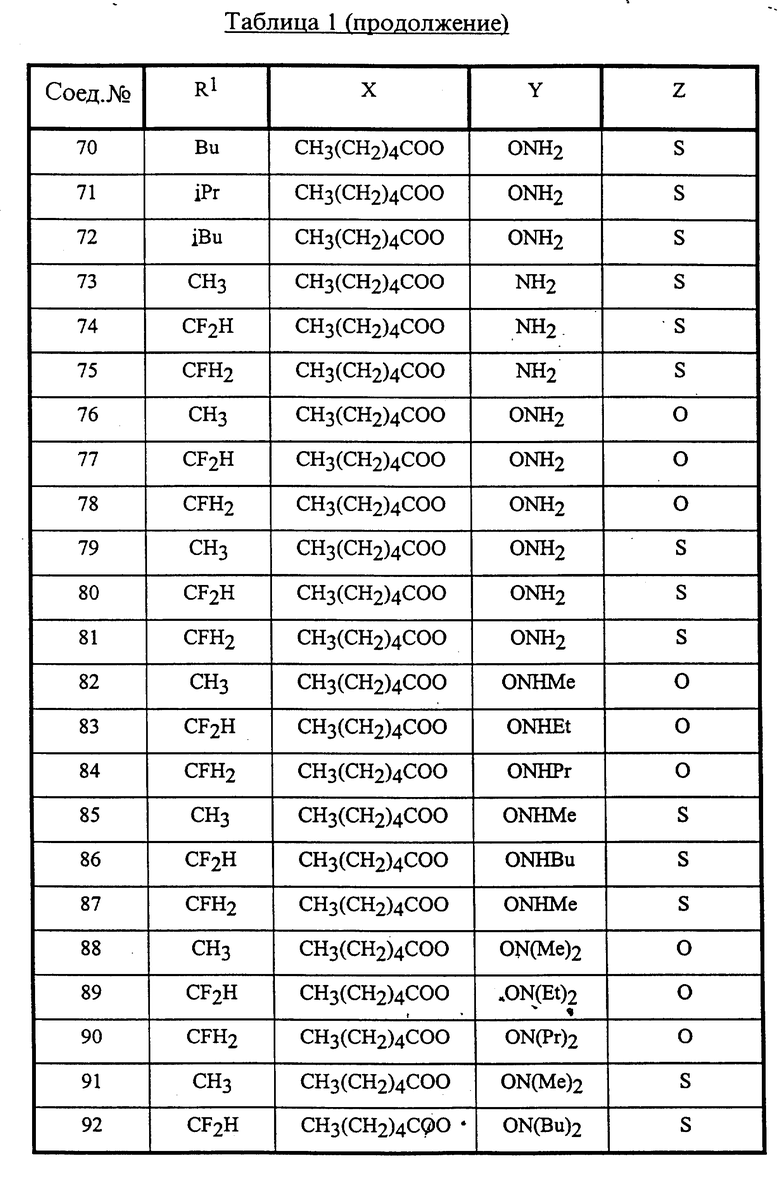
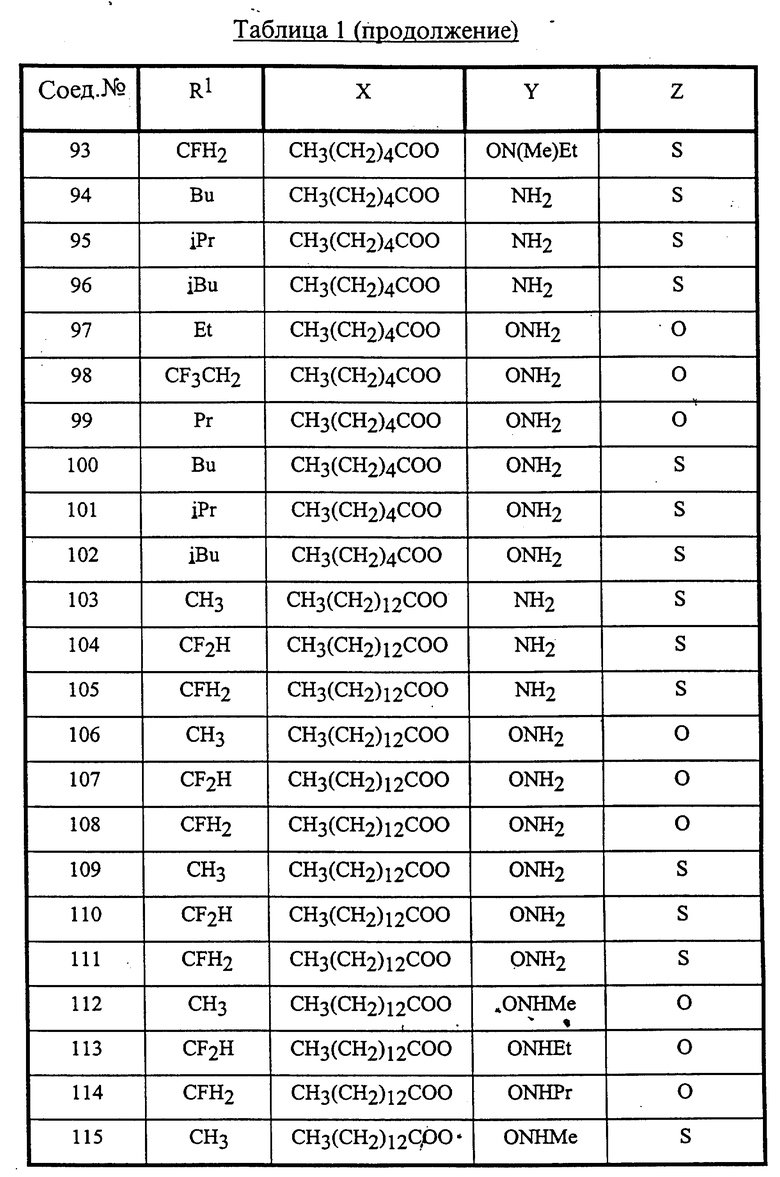
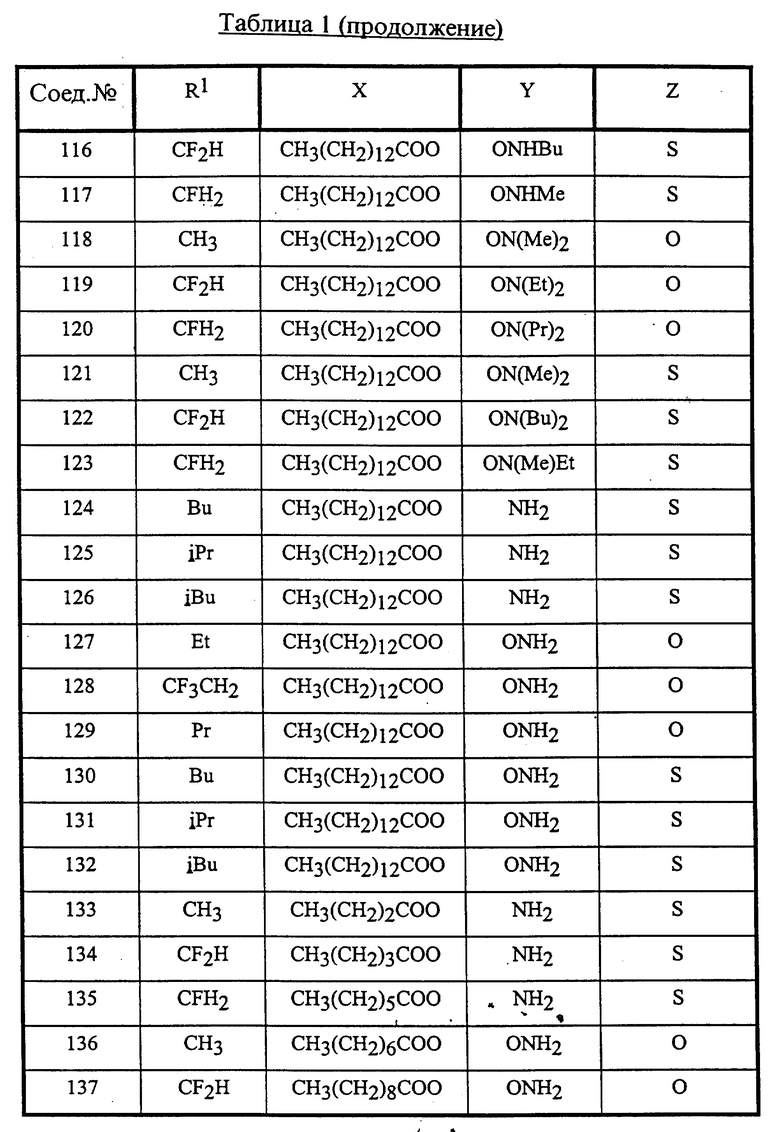
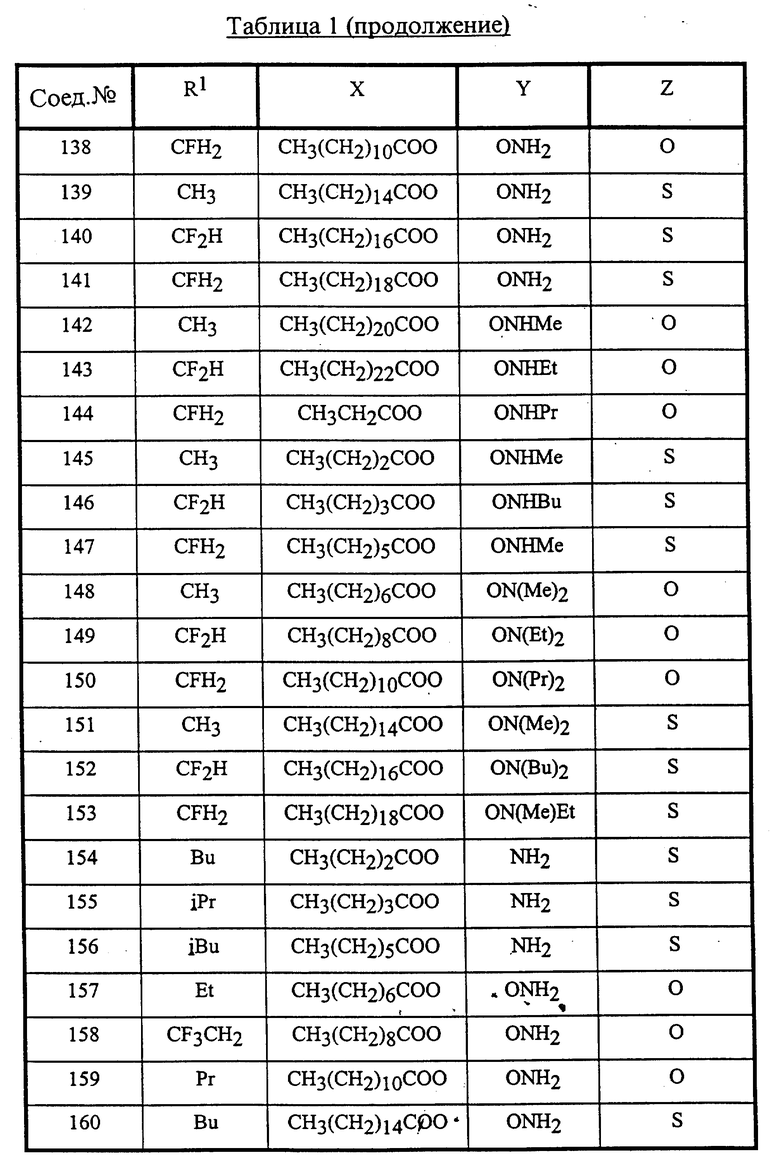
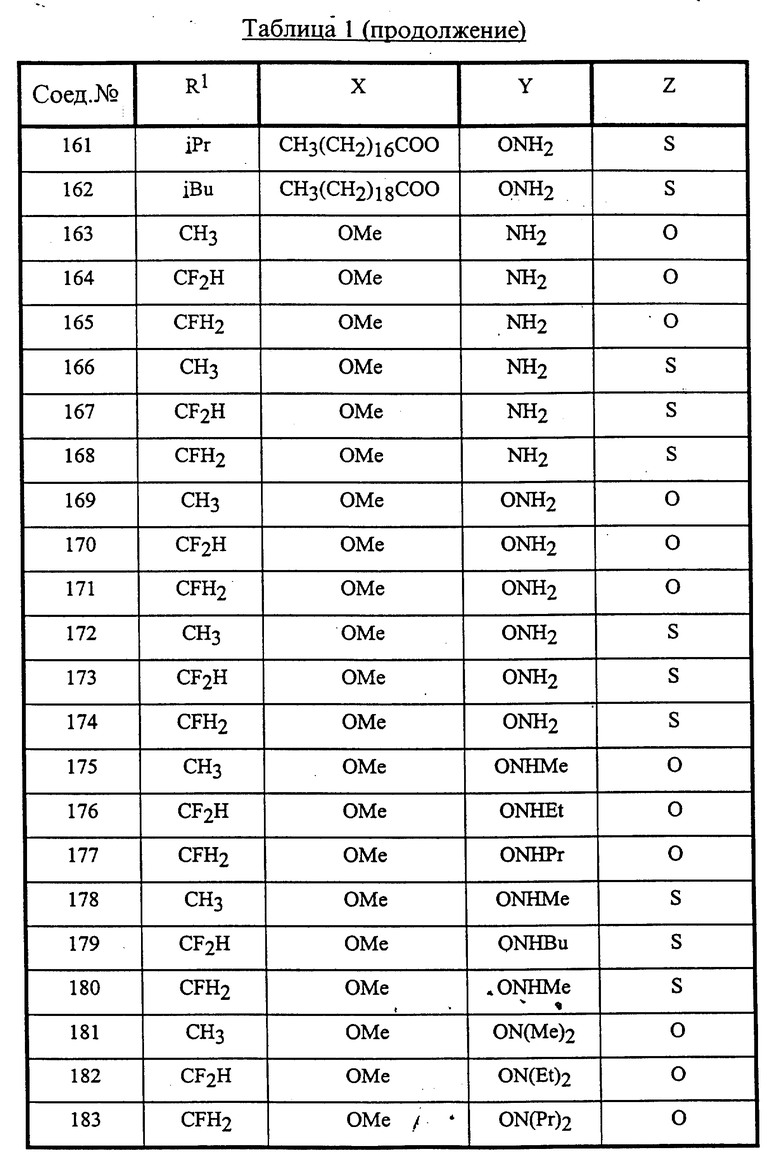
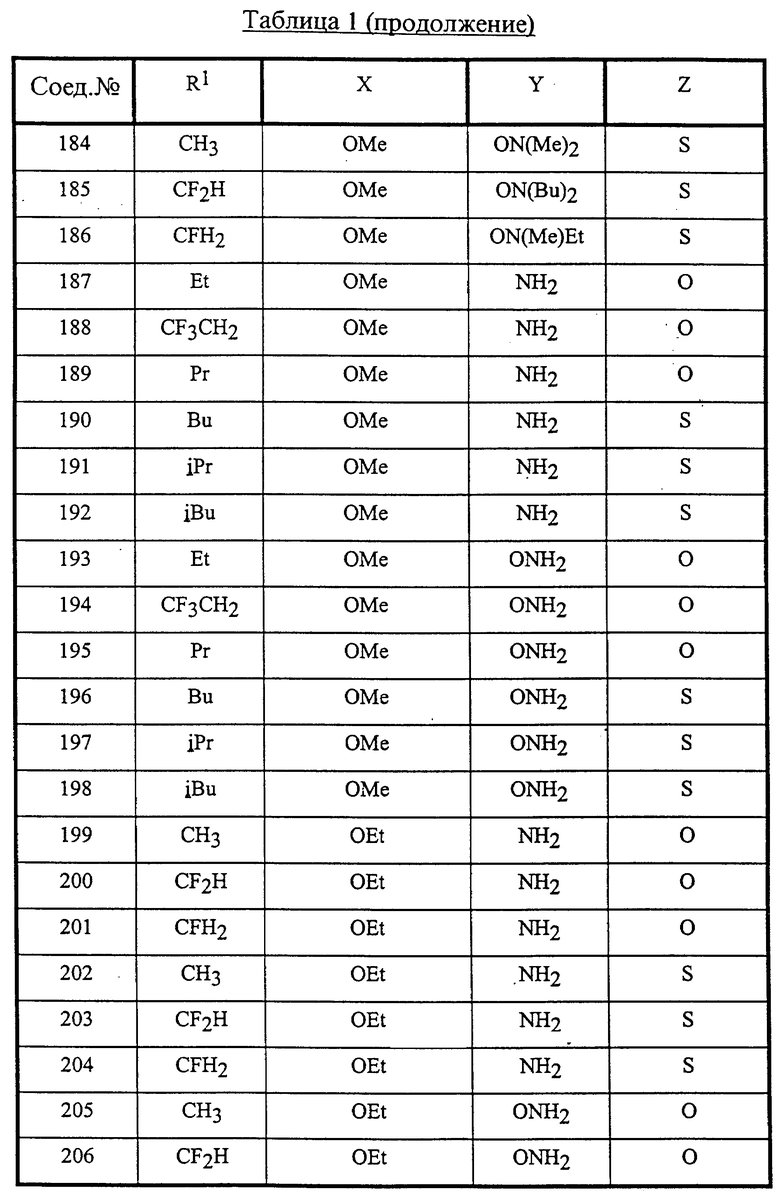
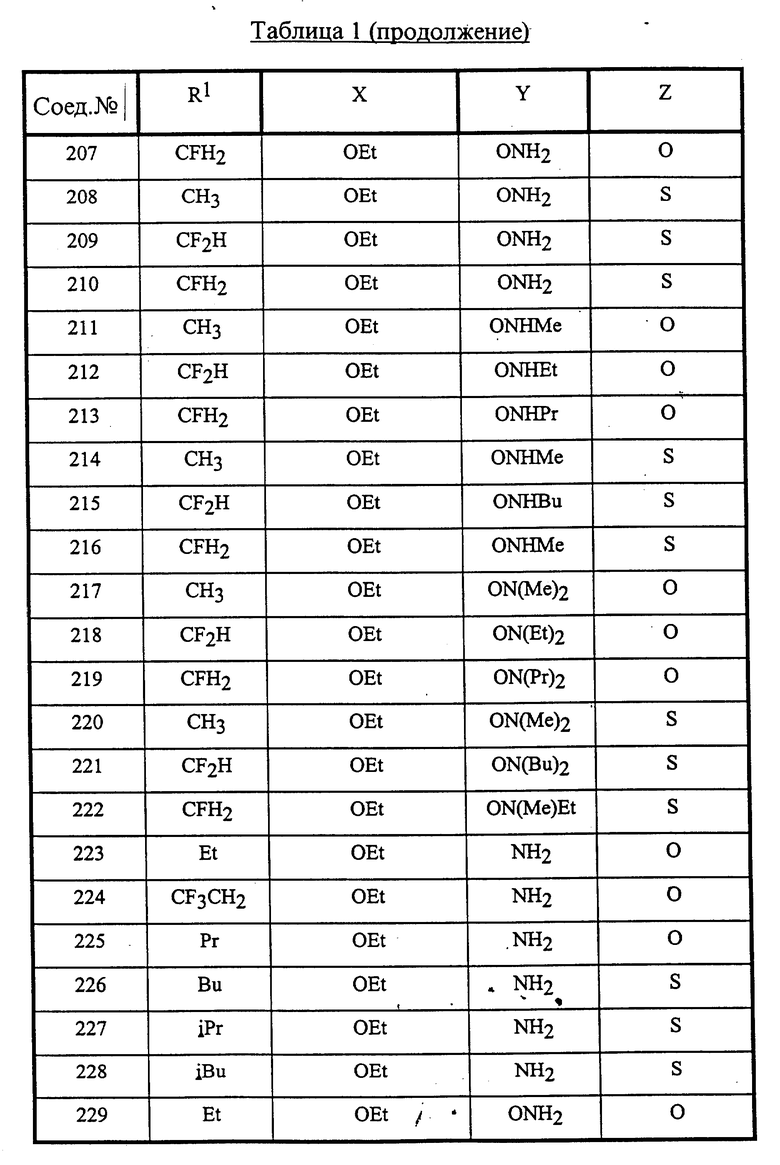
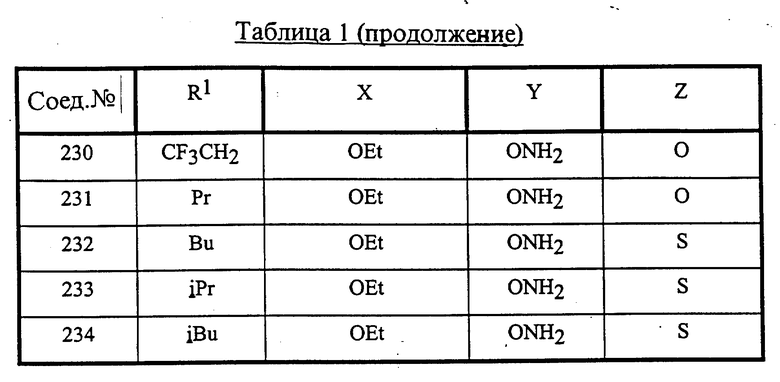
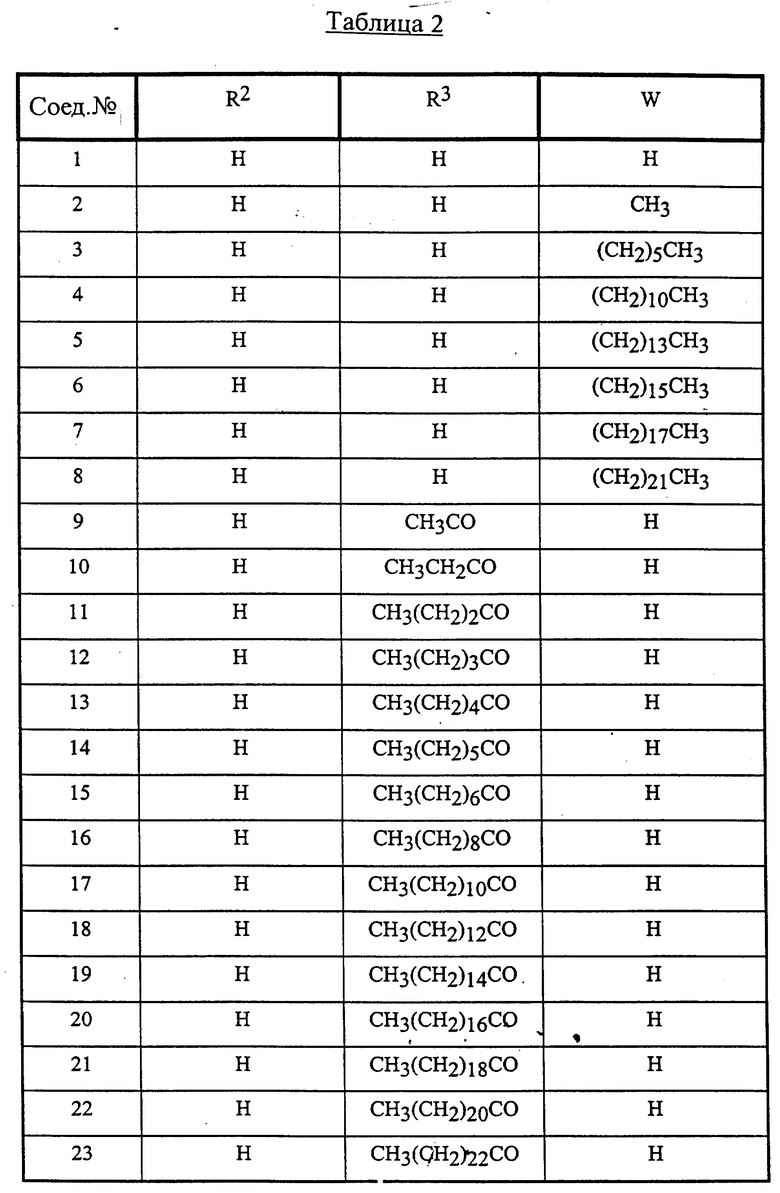
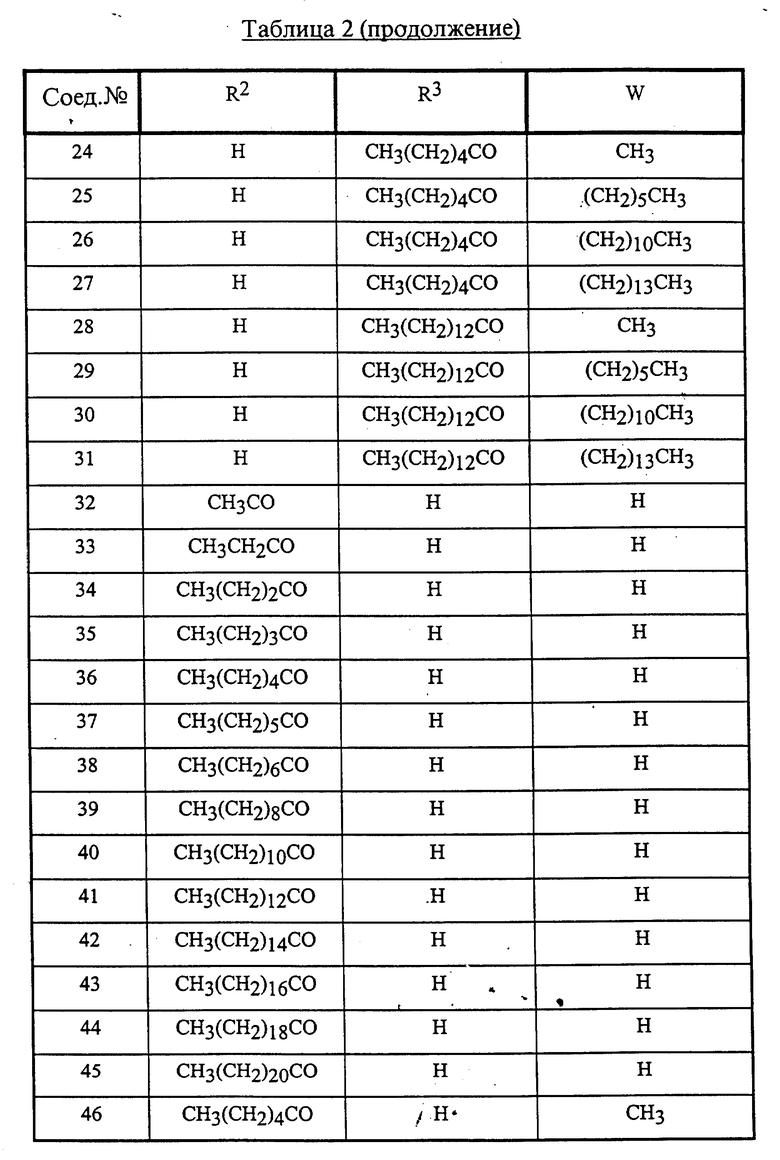
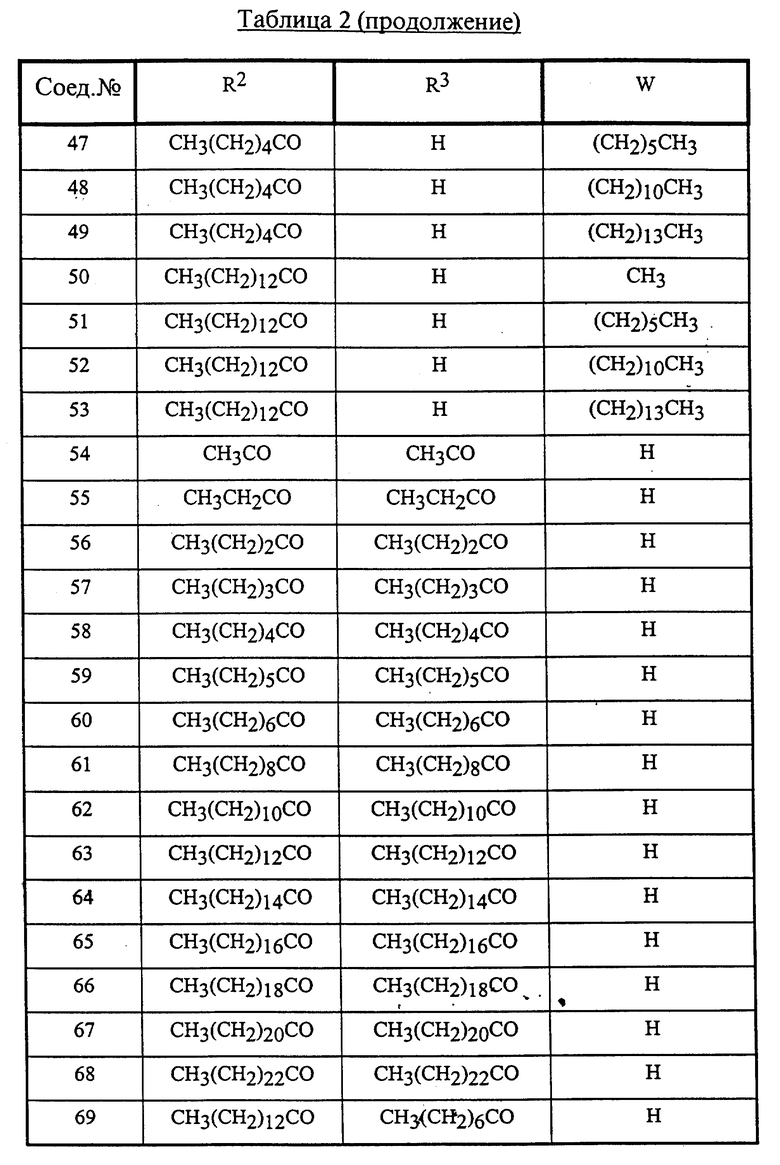
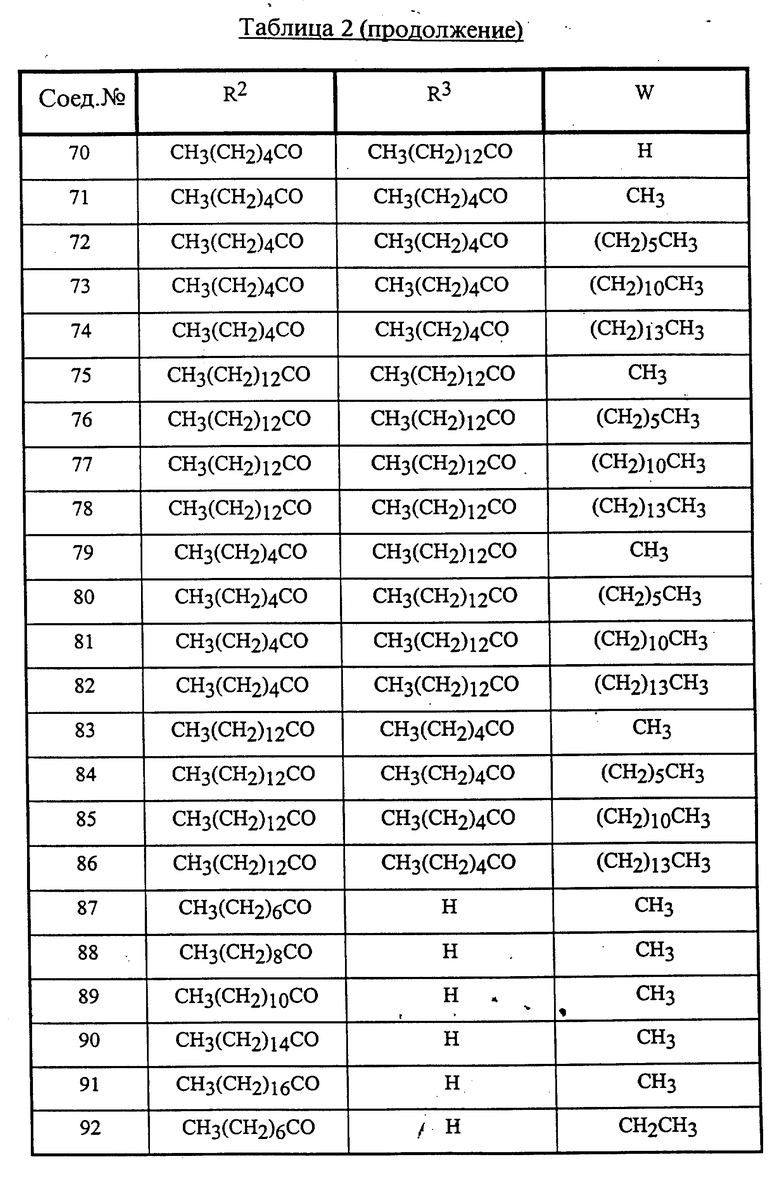
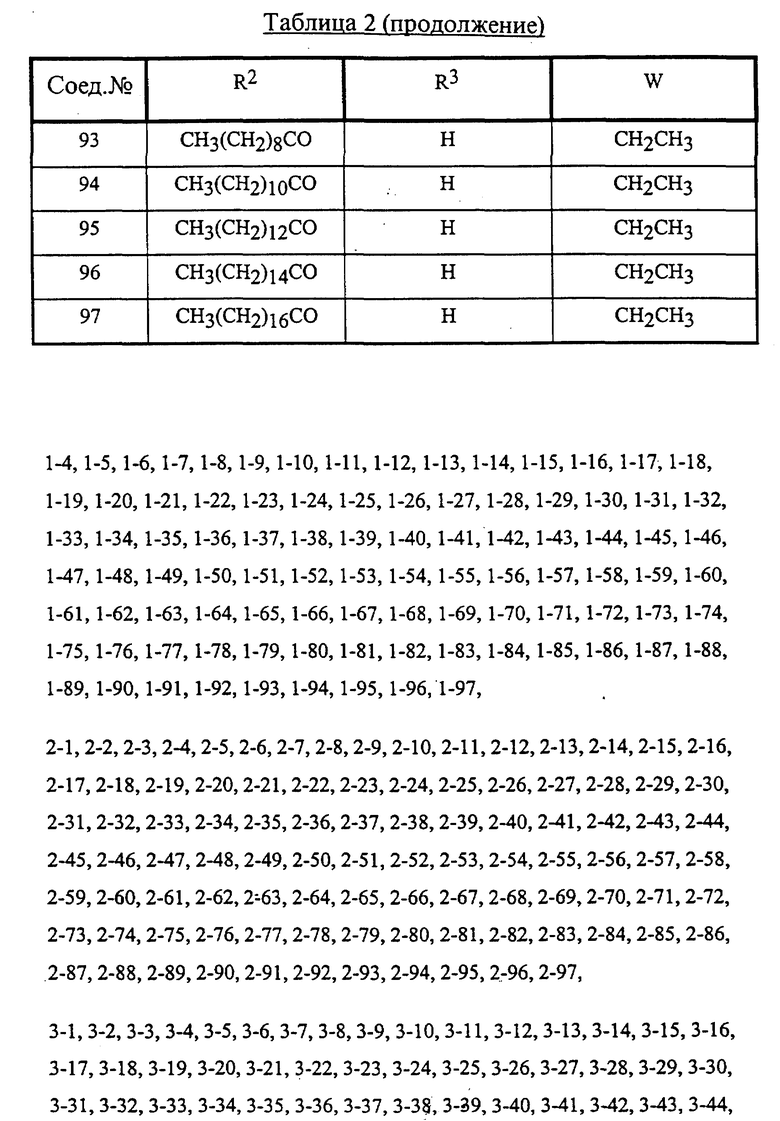













































































Производные нейраминовой кислоты формулы I, где R1 - C1-C4-алкил или C1-C4-галоалкил; R2 и R3 - атом водорода или C2-C25-алифатическая ацильная группа; Х - гидрокси, галоген, алкокси или группа формулы RaO-, где Ra - C2-C25-алифатическая ацильная группа; Y представляет группу формулы RbRcN- или RbRcN-O-, где Rb и Rc - атом водорода или C1-C4-алкил; Z - атом кислорода или атом серы; или их фармацевтически приемлемые соли обладают превосходной ингибирующей активностью по отношению к сиалидазе и которые в связи с этим полезны для лечения и предотвращения гриппа и других вирусных заболеваний, где репликация вируса чувствительна к ингибиторам сиалидазы. 3 с. и 25 з.п. ф-лы, 6 табл. 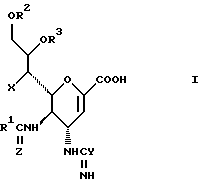
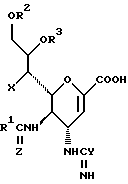
где R1 представляет алкильную группу, имеющую от 1 до 4 углеродных атомов, или галоалкильную группу, имеющую от 1 до 4 углеродных атомов;
R2 и R3 являются одинаковыми или отличными друг от друга и каждый представляет атом водорода или алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов;
X представляет гидроксигруппу, атом галогена, алкоксигруппу, имеющую от 1 до 4 углеродных атомов, или группу формулы RaO-, где Ra представляет алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов;
Y представляет группу формулы RbRcN- или RbRcN-O-, где Rb и Rc являются одинаковыми или отличными друг от друга и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 4 углеродных атомов;
Z представляет атом кислорода или атом серы; при условии, что когда Y представляет аминогруппу и Z представляет атом кислорода, тогда X представляет атом галогена или алкоксигруппу;
или их фармацевтически приемлемые соли, или их сложные эфиры.
RbRcN-O-,
где Rb и Rc такие, как определены по п.1.
5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-додеканоил-2,3,4,5,7-пентадезокси-7-фторо глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-миристоил-2,3,4,5,7-пентадезокси-7-фторо глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-пальмитоил-2,3,4,5,7-пентадезокси-7-фторо глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси метокси
метокси глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-миристоил-2,3,4,5,7-пентадезокси-7-метокси глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-этокси глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-октаноил-2,3,4,5,7-пентадезокси-7-этокси глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-додеканоил-2,3,4,5,7-пентадезокси-7-этокси глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-миристоил-2,3,4,5,7-пентадезокси-7-этокси глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-пальмитоил-2,3,4,5,7-пентадезокси-7-этокси глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-октаноил-2,3,4,5,7-пентадеокси-7-метокси глицеро
глицеро галактонон-2-енопиранозоевую кислоту;
галактонон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-деканоил-2,3,4,5,7-пентадеокси-7-метокси-D-глицеро-D-галактонон-2-енопиранозоевую кислоту;
5-ацетамидо-4-гуанидино-9-0-додеканоил-2,3,4,5,7-пентадеокси-7-метокси-D-глицеро-D-галактонон-2-енопиранозоевую кислоту и
5-ацетамидо-4-гуанидино-9-0-гексадеканоил-2,3,4,5,7-пентадеокси-7-метокси-D-глицеро-D-галактонон-2-енопиранозоевую кислоту,
или их фармацевтически приемлемые соли, или их сложные эфиры.
Приоритет по признакам:
22.07.96 по соединениям формулы I, где R1 представляет алкильную группу, имеющую от 1 до 4 углеродных атомов, или галоалкильную группу, имеющую от 1 до 4 углеродных атомов; R2 и R3 являются одинаковыми или разными и представляют каждый атом водорода или алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов, X представляет гидроксигруппу, атом галогена или группу формулы Ra0-, где Ra представляет алифатическую ацильную группу, имеющую от 2 до 25 углеродных атомов, Y представляет группу формулы RbRcN- или RbRcN-O-, где Rb и Rc являются одинаковыми или отличными друг от друга и каждый представляет атом водорода, а для группы формулы RbRcN-O- они могут быть алкильной группой, имеющей от 1 до 4 углеродных атомов, Z представляет атом кислорода или атом серы, при условии, что когда Y представляет амино группу и Z представляет атом кислорода, тогда X представляет атом галогена, или фармацевтически приемлемые соли, или сложные эфиры, соединение по п.25, представляющее собой 5-ацетамидо-4-гуанидино-2,3,4,5,7-пентадезокси-7-фторо глицеро
глицеро галакто-нон-2-енопиранозоевую кислоту;
галакто-нон-2-енопиранозоевую кислоту;
04.04.97 - при X, представляющем алкоксигруппу, имеющую от 1 до 4 атомов углерода, все соединения по п.25, за исключением первого и четырех последних;
21.07.97 - при Y, представляющем группу формулы NRbRс, где Rb и/или Rс представляют алкильную группу, имеющую от 1 до 4 углеродных атомов, последние четыре соединения по п.25.
Авторы
Даты
1999-01-10—Публикация
1997-07-21—Подача