Изобретение относится к новому способу получения производных таксана общей формулы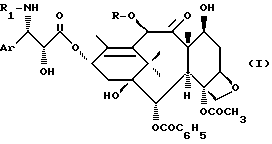
которые обладают ценными противолейкемическими и противоопухолевыми свойствами.
В общей формуле (I) R является атомом водорода или ацетильным радикалом, а R1 является бензоильным радикалом или R2 - O-CO-радикалом, в котором R2 является прямым или разветвленным алкильным радикалом, содержащим 1-8 атомов углерода. Ar является фенилом.
Особый интерес представляют продукты общей формулы (I), в которой R является атомом водорода или ацетильным радикалом, R1 является бензоильным радикалом или трет. -бутоксикарбонильным радикалом, Ar является фенильным радикалом.
Продукты общей формулы (I), в которой R1 является бензоильным радикалом, соответствуют таксолу и 10-дезацетил-таксолу, а продукты общей формулы (I), в которой R1 является трет-бутоксикарбонильным радикалом, соответствуют тем продуктам, которые являются объектом европейского патента ЕР 0253738.
Согласно способу, который описан в международной заявке на патент PCTWO 92/09589, производные общей формулы (I) могут быть получены:
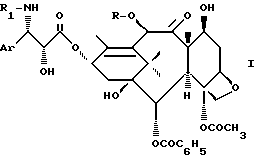
- конденсацией производного оксазолидина общей формулы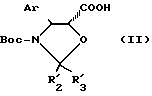
в которой Ar имеет указанные ранее значения, Boc является трет-бутоксикарбонильным радикалом и R'2 и R'3, одинаковые или различные, являются алкильным радикалом, содержащим 1-4 атома углерода, возможно замещенным одним или несколькими арильными радикалами, или арильным радикалом, или же R'2 и R'3, вместе с атомом углерода, к которому они присоединены, образуют цикл, имеющий 4-7 звеньев, с защищенным баккатином III или защищенным 10-дезацитилбаккатином III общей формулы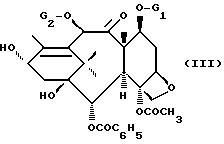
в которой G1 является группировкой, защищающей гидроксильную функцию, а G2 является ацетильным радикалом или группировкой, защищающей гидроксильную функцию, чтобы получить продукт общей формулы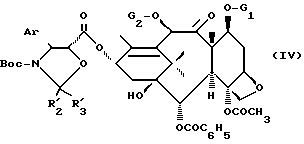
в которой Ar, R'2, R'3, G1, G2 и Boc имеют указанные ранее значения,
- обработкой в кислой среде продукта общей формулы (IV) в таких условиях, которые не оказывают воздействия на G1 и G2, чтобы получить продукт общей формулы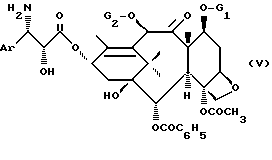
в которой Ar, G1 и G2 имеют указанные ранее значения,
- обработкой продукта общей формулы (V) реагентом, пригодным для введения бензольного радикала или радикала R2-OCO-, чтобы получить продукт общей формулы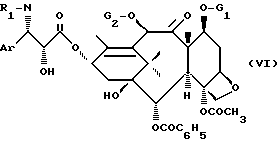
в которой Ar, R1, G1 и G2 имеют указанные ранее значения, и
- заменой защищающих группировок G1 и G2 в продукте общей формулы (VI) на атомы водорода, чтобы получить продукт общей формулы (I).
Теперь обнаружено и это является объектом настоящего изобретения, что продукты общей формулы (I) могут быть получены:
1) этерификацией баккатина III или 10 - дезацетилбаккатина III общей формулы (III), в которой G1 и при необходимости G2 являются группировкой, защищающей гидроксильную функцию, предпочтительно, триалкилсилильной, диалкиларилсилильной, алкилдиарилсилильной или триарилсилильной группой, и, более конкретно, еще радикалом R5-O-CO-, в котором R5 определен ниже, с помощью кислоты общей формулы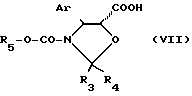
в которой Ar имеет указанные ранее значения, R3 и R4, одинаковые или различные, являются атомом водорода или алкильным радикалом, содержащим 1-4 атома углерода, или алкенильным радикалом, содержащим 2-4 атома углерода, или аралкильным радикалом, алкильная часть которого содержит 1-4 атома углерода, а арильная часть предпочтительно является фенильным радикалом, возможно замещенным одним или несколькими алкоксирадикалами, содержащими 1-4 атома углерода, или арильным радикалом, предпочтительно являющимся фенильным радикалом, возможно замещенным одним или несколькими алкоксирадикалами, содержащими 1-4 атома углерода, или же R3 и R4 образуют вместе с атомом углерода, к которому они присоединены, цикл, имеющий 4-7 звеньев, и R5 является алкильным радикалом, содержащим 1-4 атома углерода, замещенным одним или несколькими атомами хлора, чтобы получить продукт общей формулы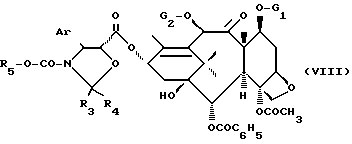
в которой A, R3, R4, R5, G1 и G2 имеют указанные ранее значения:
2) заменой группировок, защищающих гидроксильную и аминную функции полученного продукта общей формулы (VIII), на атомы водорода, чтобы получить продукт общей формулы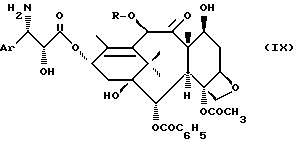
в которой A и R имеют указанные ранее значения:
3) обработкой полученного продукта общей формулы (IX) реагентом, который позволяет ввести заместитель R1 в аминную функцию, чтобы получить продукт общей формулы (I).
Продукты общей формулы (IX) также могут быть получены по способу осуществления реакции вицинального оксиаминирования по Шарплессу, как описано в J. Med. Chem., 24/3/, 992/ 1991/.
Согласно настоящему изобретению этерификацию защищенного баккатина III или защищенного 10-дезацетилбаккатина III общей формулы (III) с помощью кислоты общей формулы (VII), в которой R5 предпочтительно является 2,2,2-трихлорэтильным радикалом или 2-трехлорметилизопропильным радикалом, можно провести в присутствии конденсирующего агента, такого как диимид, например, дициклогексилкабодиимид, или реакционноспособный карбонат, например 2-дипиридилкарбонат, и активирующего агента, такого как аминопиридин, например 4-диметиламинопиридин или 4-пирролидинпиридин, работая в органическом растворителе, выбранном среди простых эфиров, таких как тетрагидрофуран, диизопропиловый эфир, метил-трет-бутиловый эфир или диоксан, кетонов, таких как метилизобутилкетон, сложных эфиров, таких как этилацетат, изопропилацетат, н-бутилацетат, нитрилов, таких как ацетонитрил, алифатических углеводородов, таких как пентан, гексан или гептан, галоидированных алифатических углеводородов, таких как дихлорметан или 1,2-дихлорэтан, и ароматических углеводородов, таких как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре между -10 и 90oC. Особенно целесообразно проводить этерификацию, работая в ароматическом углеводороде при температуре около 20oC.
Этерификация также может быть проведена с использованием кислоты общей формулы (VII) в виде ангидрида общей формулы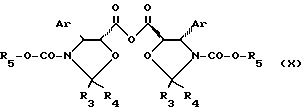
в которой Ar, R3, R4 и R5 имеют указанные ранее значения, R5 предпочтительно является 2,2,2-трихлоэтильным радикалом или 2-трихлометилизопропильным радикалом, в присутствии активирующего агента, такого как аминопиридин, например 4-диметиламинопиридин или 4-пирролидинопиридин, при работе в органическом растворителе, выбранном среди простых эфиров, таких как тетрагидрофуран, диизопропиловый эфир, метил- трет-бутиловый эфир или диоксан, кетонов, таких как метилизобутилкетон, сложных эфиров, таких как этилацетат, изопропилацетат или н-бутилацетат, нитрилов, таких как ацетонитрил, алифатических углеводородов, таких как пентан, гексан или гептан, галоидированных углеводородов, таких как дихлорметан или 1,2-дихлорэтан, и ароматических углеводородов, таких как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре между 0 и 90oC.
Этерификация также может быть проведена с использованием кислоты общей формулы (VII) в виде галоидангидрида или смешанного ангидрида общей формулы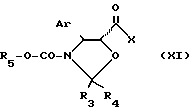
в которой Ar, R3, R4 и R5 имеют указанные ранее значения, R5 предпочтительно является 2,2,2-трихлорэтильным или 2-трихлорметилизопропильным радикалом и X является атомом галоида или ацилокси- или ароилоксирадикалом причем соединение формулы VII может быть получено in situ, в присутствии основания, которое предпочтительно является азотистым органическим основанием, таким как третичный алифатический амин, например триэтиламин, пиридин или аминопиридин, например 4-диметиламинопиридин или 4-пирролидинопиридин, работая в инертном органическом растворителе, выбранном среди простых эфиров, таких как тетрагидрофуран, диизопропиловый эфир, метил- трет-бутиловый эфир или диоксан, кетонов, сложных эфиров, таких как этилацетат, изопропилацетат или н-бутилацетат, нитрилов, таких как ацетонитрил, алифатических углеводородов, таких как пентан, гексан или гептан, галоидированных алифатических углеводородов, таких как дихлорметан или 1,2-дихлорэтан, и ароматических углеводородов, таких как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре между 0 и 80oC, предпочтительно около 20oC.
Предпочтительно используют активное производное общей формулы (XI), в которой X является атомом галоида или алкокси-радикалом, содержащим 1-5 атомов углерода, ароилоксирадикалом, в котором арильная часть является фенилом, необязательно замещенным 1-5 атомами или радикалами, одинаковыми или различными, выбранными среди атомов галоида (хлора, брома), и нитро, метильных или метоксирадикалов.
Замена атомов водорода на группировки, защищающие гидроксильную или аминную функции, в продукте общей формулы (VIII), в которой R5 является предпочтительно 2,2,2-трихлорэтильным или 2-трихлорметилпропильным радикалом, G1 при необходимости G2 являются группировками, защищающими гидроксильную функцию, предпочтительно 2,2,2-трихлорэтоксикарбонильным радикалом или 2-(2-трихлорметилпропокси)-карбонильным радикалом осуществляется обычно при обработке цинком, при необходимости ассоциированным с медью, в присутствии уксусной кислоты при температуре между 30 и 60oC или с помощью минеральной или органической кислоты, такой как соляная кислота или уксусная кислота, в растворе в алифатическом спирте, содержащем 1-3 атома углерода, или в алифатическом сложно эфире, таком как этилацетат, изопропилацетат или н-бутилацетат, в присутствии цинка, при необходимости ассоциированного с медью.
Замену атомами водорода группировок, защищающих гидроксильную и аминную функции в продукте общей формулы (VIII), в которой R5 является предпочтительно 2,2,2-трихлорэтильным радикалом или 2-(трихлометилпропильным) радикалом, G1 и при необходимости G2 являются группировками, защищающими гидроксильную функцию, предпочтительно триалкилсилильным, диалкиларилсилильным, алкилдиарилсилильным или триарилсилильным радикалом, обычно проводят при обработке в кислой среде, такой как, например, соляная кислота в растворе алифатического спирта, содержащего 1-3 атома углерода (метанол, этанол, пропанол, изопропанол) или водная фтористоводородная кислота, при температуре между 0 и 40oC, чтобы заменить защищающие группировки G1 и при необходимости G2, и при обработке цинком, при желании ассоциированным с медью, в присутствии уксусной кислоты при температуре между 30 и 60oC или с помощью минеральной, или органической кислоты, такой как соляная кислота или уксусная кислота в алифатическом спирте, содержащем 1-3 атома углерода, или алифатическом сложном эфире, таком как этилацетат, изопропилацетат или н-бутилацетат, в присутствии цинка, который может быть ассоциирован с медью, для замены R5.
Замена защищающих группировок в продукте общей формулы (VIII) на атомы водорода также может быть проведена с помощью электролитического восстановления.
Введение заместителя R1 в аминную функцию продукта общей формулы (IX) осуществляют при действии бензоилхлорида или реактивности производного общей формулы:
R2-O-CO-Y, (XII)
в которой R2 имеет указанные ранее значения и Y является атомом галоида (фтор, хлор) или остатком -O-R2 или -O-CО-OR2, при работе в таком органическом растворителе, как спирт, например метанол, алифатический сложный эфир, например этилацетат, или галоидированный алифатический углеводород, например дихлорметан, в присутствии минерального или органического основания, такого как бикарбонат натрия. Обычно реакцию проводят при температуре между 0 и 50oC, предпочтительно около 20oC.
Кислота общей формулы (VII) может быть получена путем омыления в щелочной среде сложного эфира общей формулы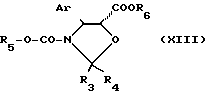
в которой Ar, R3, R4 и R5 имеют указанные ранее значения, а R6 является алкильным радикалом, содержащим 1-4 атома углерода, необязательно замещенным фенильным радикалом.
Обычно омыление проводят с помощью минерального основания, такого как гидроксид щелочного металла (лития, калия, натрия), карбоната или бикарбоната щелочного металла (бикарбоната натрия, карбоната или бикарбоната калия) в водно-спиртовой среде, такой как смесь метанол-вода, при температуре между 10 и 40oC. предпочтительно около 20oC.
Сложный эфир общей формулы (XIII) может быть получен при действии продукта общей формулы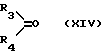
в которой R3 и R4 имеют указанные ранее значения, возможно в виде диалкилацеталя или фенола простого алкилового эфира, на производное фенилизосерина общей формулы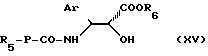
в которой Ar, R5 и R6 имеют указанные ранее значения, в рацемической форме или предпочтительно в 2R, 3S форме, работая в инертном органическом растворителе в присутствии сильной минеральной кислоты, такой как серная кислота, или органической кислоты, такой как п-олуолсульфоновая кислота, возможно в форме пиридиниевой соли, при температуре между 0oC и температурой кипения реакционной среды. Особенно удобными растворителями являются ароматические углеводороды.
Продукты общей формулы (XV) могут быть получены в условиях, описанных в международной заявке PCT WO 92/09589.
Ангидрид общей формулы (X) может быть получен при взаимодействии дегидратирующего агента, такого как дициклогексилкарбодиимид, на кислоту общей формулы (VII), работают в органическом растворителе, выбранном среди галоидированных алифатических углеводородов и ароматических углеводородов, при температуре между 0 и 30oC.
Активированная кислота общей формулы (XI) может быть получена при действии сульфурилгалоида, предпочтительно хлорида, или продукта общей формулы:
R7 - CO - Z, (XVI)
в которой R7 является алкильным радикалом, содержащим 1-4 атома углерода, или фенильным радикалом, возможно замещенным 1-5 атомами или радикалами, одинаковыми или различными, выбранными среди атомов галоида и нитро, метильных или метоксирадикалов, и Z является атомом галоида, предпочтительно атомом хлора, на кислоту общей формулы (VII), работая в подходящем органическом растворителе, таком как тетрагидрофуран, в присутствии органического основания, такого как третичный амин, например триэтиламин, при температуре между 0 и 30o.
Пример 1. К раствору 11,7 г (60 ммоль) (2R, 3S)-метилфенилизосерината и 5,22 г пиридина в 180 см3 метиленхлорида прибавляют в течение 50 минут при 0oC 9,48 см3 2,2,2-трихлорэтоксикарбонилхлорида. Реакционную смесь оставляют на 3 часа, чтобы она нагрелась до комнатной температуры (около 20oC) при перемешивании. Раствор промывают 100 см3 0,1 н. водного раствора соляной кислоты, потом 2 раза 50 см3 воды. После сушки и концентрирования органической фазы при пониженном давлении остаток обрабатывают 300 см3 циклогексана. Затем растворитель частично отгоняют при пониженном давлении (60 кПа) при 40oC до появления первых кристаллов. Полученный таким образом остаток отделяют фильтрованием, потом промывают циклогексаном и сушат. Таким образом получают с выходом 86% 19,1 г метил-2-окси-3-фенил-3-(2,2,2-трихлорэтоксикарбониламино)-(2R, 3S)-пропионата, который имеет следующие характеристики:
- протонный ЯМР - спектр (360 МГц, DMCO-d6, химические сдвига в ппм, константы сочетания J в Гц): 8,12 (д, J=9,2, 1H), 7,20 (м, 5H), 5,63 (м, 1H), 4,89 (дд, J = 5,1 и 9,2, 1H), 4,77 и 4,67 (сист AB, J=-12,3, 1H), 4,29 (м, 1H, 3,46), c, 3H).
К раствору 11,1 г (30 ммоль) метил-2-окси-3-фенил-3- (2,2,2-трихлоэтоксикарбониламино) - (2R, 3S)-пропионата и 3,24 г 2 - метоксипропена в 100 см3 толуола прибавляют 151 мг паратолуолсульфоната пиридиния. Реакционную смесь нагревают до кипения. Прибавляют в течение 2 часов 50 см3 толуольного раствора, содержащего 19,5 г 2-метоксипропена. Проводят отгонку до тех пор, пока не получают 80 см3 дистиллата. Реакционную смесь охлаждают до температуры около 20oC, обрабатывают бикарбонатом натрия, потом промывают водой. Органический раствор сушат, потом концентрируют при пониженном давлении. Таким образом получают 14,5 г сырого продукта в виде масла, которое хроматографируют на колонке с окисью кремни, элюируя смесью циклогексан/этилацетат (90-10 по объему). Выделяют 5,68 г чистого 5-метоксикарбонил-2,2-диметил-4-фенил-3-(2,2,2-трихлорэтоксикарбонил) - (4S, 5R) - оксазолидина - 1,3 (выход 46%) и 4,95 г чистого 5-метоксикарбонил-2-метил-2-изобутенил-4-фенил-3-(2,2,2- трихлоэтоксикарбонил) - (4S, 5R)-оксазолидина-1,3 - (выход 36,7%).
Пример 2. Прибавляют 6% (мас./объем) метанольный раствор карбоната калия к раствору 1,24 г (3 ммоль) 5-метоксикарбонил-2,2-диметил-4-фенил-3-(2,2,2-трихлорэтоксикарбонил)- (4S, 5R) оксазолидина-1,3. Реакционную смесь перемешивают 4 часа при температуре около 20oC. После добавления 5 см3 воды и перемешивания в течение 30 минут при температуре около 20oC реакционную смесь концентрируют досуха. Маслянистый остаток обрабатывают 20 см3 воды и экстрагируют 2 раза 20 см3 диизопропилового эфира. Водную фазу подкисляют добавлением 1 н. соляной кислоты до pH 2, потом экстрагируют 20 см3 метиленхлорида. Органическую фазу сушат, потом концентрируют при пониженном давлении. Таким образом получают с выходом 96% 1,15 г 5-карбокси-2,2-диметил-4-фенил-3-(2,2,2-трихлорэтоксикарбонил)-(4S, 5R)-оксазолидина - 1,3.
Аналогичные результаты получают при использовании 5-метоксикарбонил-2-метил-2-изобутенил-4-фенил-3-(2,2,2- трихлорэтоксикарбонил) - (4S, 5R)-оксазолидина - 1,3.
Пример 3. К раствору 0,95 г 5-карбокси-2,2-диметил-4-фенил-3-(2,2,2-трихлорэтоксикарбонил)-(4S, 5R)-оксазолидина - 1,3 и 1,43 г 4-ацетокси- 2α-бензоилокси-5β , 20-эпокси-1β,13α-диокси-9-оксо-7β , 10β -бис-(2,2,2-трихлорэтоксикарбонилокси)-таксена-11 и 0,039 г 4-диметиламинопиридина в 20 см3 безводного толуола прибавляют при перемешивании при температуре около 20oC 0,495 г дициклогексилкарбодиимида. Реакционную смесь перемешивают 2 часа. Отфильтровывают дициклогексилмочевину, потом промывают толуолом. Объединяют толуольные фазы, промывают их последовательно 0,1 н. водным раствором соляной кислоты, насыщенным водным раствором бикарбоната натрия, сушат над сульфатом натрия, фильтруют, потом концентрируют досуха при пониженном давлении. Таким образом получают с выходом около 78% 2,15 г 3-(2,2,2-трихлорэтоксикарбонил)-2,2-диметил-4-фенил-5-(4S, 5R)-оксазолидинкарбоксилат-4-ацетокси-2α-бензоилокси-5β, 20-эпокси-1-окси-9-оксо-7β,10β-бис-(2,2,2-трихлорэтоксикарбонил)-таксен-11-ила-13α.
Пример 4. К раствору 1,28 г продукта, полученного в примере 3, в 5 см3 этилацетата при перемешивании прибавляют 0,65 г цинкового порошка, потом в течение 5 минут по каплям 1,8 см3 ледяной уксусной кислоты. Отмечается незначительное выделение тепла и выделение газов. Реакционную смесь затем выдерживают при 45oC в течение 90 минут, потом охлаждают до температуры около 20oC. Цинк отфильтровывают, потом промывают этилацетатом. Объединенные органические фазы концентрируют досуха при пониженном давлении. Остаток обрабатывают толуолом. Полученный раствор снова концентрируют досуха при пониженном давлении. Эту операцию повторяют первый раз с гептаном, потом с этилацетатом. Остаток обрабатывают этилацетатом. Этот раствор затем экстрагируют 10 см3 0,1 н. водного раствора соляной кислоты. Водную фазу нейтрализуют добавлением 1 н раствора гидроксида натрия. Прибавляют 10 см3 этилацетата, потом устанавливают pH 8 при добавлении насыщенного водного раствора бикарбоната натрия. После разделения водную фазу экстрагируют 2 раза 25 см3 этилацетата. Объединяют органические фазы, сушат над сульфатом натрия, фильтруют, потом концентрируют досуха при пониженном давлении. Таким образом получают с выходом 49% 0,355 г 3-амино-2-окси-3-фенил-(2R, 3S)-ацетоксипропионат-2α-бензоилокси- 5β, 20-эпокси-1β, 7α,10α-триокси-9-оксотаксен-11-ил-13α.
Пример 5. К раствору 0,3 продукта, полученного в примере 4, в 5 см3 метанола прибавляют 0,108 г ди-трет-бутилдикарбоната. Реакционную смесь перемешивают 15 часов при температуре около 20oC. После добавления 20 см3 воды реакционную смесь экстрагируют 3 раза 15 см3 метиленхлорида. Объединяют водные фазы, сушат над сульфатом натрия, потом концентрируют досуха при пониженном давлении. Таким образом получают с выходом 70% 0,395 г 3-трет-бутоксикарбониламино-2-окси-3-фенил-4-(2R, 3S)-ацетоксипропионат-2α-бензоилокси-5β. 20-эпокси-1,7β,10β-триокси-9-оксо-таксен-11-ила-13α.
Пример 6. Смешивают 0,46 г 7-триэтилсилилбаккатина III и 0,3 г 4-фенил-2,2-диметил-3-трихлорэтоксикарбокси-1,3-оксазолидина, 10 мл толуола и 0,013 г 4-диметиламинопиридина, добавляют при температуре около 20oC 0,21 г дициклогексилкарбодиимида. Перемешивают в течение 2 часов. Отделяют дициклогексилмочевину фильтрацией.
Толуоловую фазу промывают 0,1 н. HCl, затем насыщенным раствором бикарбоната натрия.
Раскрытие оксазолидинового цикла осуществляют в эфирном растворе с помощью ледяной уксусной кислоты и 10%-ного водного раствора HCl (50-50) при комнатной температуре.
Азот затем ацилируют раствором бензоилхлорида.
Получают 3-бензоиламино-2-гидрокси-3-фенилпропионат (2R, 3S)-4-ацетокси-2α-бензоилокси- 5β, 20-эпокси-1β,7α,10α-тригидрокси-9-оксо-11-таксен- 13α-ил с выходом 41% по таксолу. Этот продукт является коммерческим.
Получение таксола подтверждается ВЭЖХ.
Усовершенствованный способ получения производных таксана общей формулы (I) путем этерификации баккатина III или защищенного 10-дезацетилбаккатина III с помощью кислоты общей формулы (VII), удаления защищающих группировок из полученного сложного эфира с последующим ацилированием аминной функции боковой цепи. В формулах (I) и (VII) Ar является фенилом, R является водородом или ацетилом, R1 является бензоилом или R2-O-CO-, в которой R является алкилом, R3 и R4 одинаковые или различные, являются водородом, алкилом, R5 является алкильным радикалом, замещенным одним или несколькими атомами хлора, 2,2,2 - трихлорэтилом, 2-трихлорметилизопропилом. 3 с. и 21 з.п.ф-лы.
где R - атом водорода или ацетильный радикал;
R1 - бензоильный радикал или радикал R2-O-CO-, где R2 - прямой или разветвленный C1 - C8-алкил;
Ar - фенил,
отличающийся тем, что этерифицируют защищенное производное баккатина III или защищенного 10-дезацетилбаккатина III общей формулы III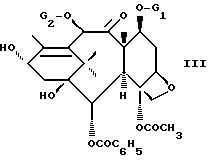
где G1 и, при необходимости, G2 - группировка, защищающая гидроксильную функцию,
с действием кислоты общей формулы II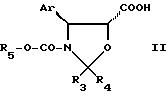
где Ar имеет указанные значения;
R3 и R4 - одинаковые или различные, атом водорода или C1 - C4-алкил;
R5 - C1 - C4-алкил, замещенный одним или несколькими атомами хлора,
или активного производного этой кислоты для получением соединения формулы IV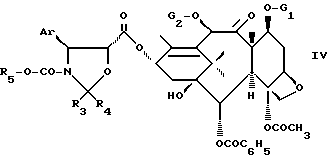
где Ar, R3, R4, R5, G1 и G2 имеют указанные значения,
в котором заменяют группировки, защищающие гидроксильную и аминную функции, на атомы водорода и получают соединение формулы V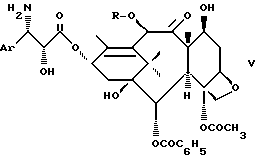
где Ar и R1 имеют указанные значения,
с последующей обработкой его реаген-реактивным производным формулы VI
R2 - O - CO - Y,
где Y - атом галогена;
R2 имеет указанные значения,
для введения заместителя R1 в аминную функцию и выделением целевого продукта.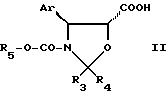
где Ar, R3, R4 и R5 имеют значения, указанные в п.1,
в присутствии конденсирующего агента и активирующего агента в органическом растворителе при температуре -10 - 90oC.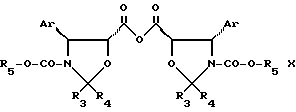
где Ar, R3, R4 и R5 имеют значения, указанные в п.1,
в присутствии активирующего агента в органическом растворителе при температуре 0 - 90oC.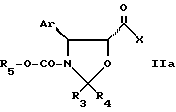
где Ar, R3, R4 и R5 имеют указанные значения;
X - атом галогена или ацилокси- или ароилоксирадикал,
возможно полученной in situ, в присутствии основания, в среде органического растворителя при температуре 10 - 80oC.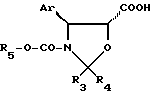
где Ar, R3, R4 и R5 имеют значения, указанные в п.1,
необязательно в виде соли, сложного эфира, ангидрида, смешанного ангидрида или галоидангидрида.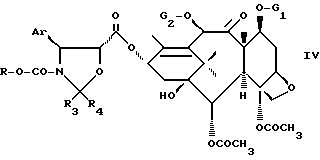
где Ar, R3, R4, R5, G1 и G2 имеют значения, указанные в п.1.
| WO, 9209589, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-07-27—Публикация
1993-10-04—Подача