Изобретение относится к производным азола, используемый в качестве противогрибковых терапевтических агентов и к их применению.
Различные производные уже были заявлены в качестве противогрибковых агентов (например, ЕРА- 122693, ЕРА-122056 и ЕРА-332387). Эти соединения, однако, не удовлетворительны по своему терапевтическому эффекту с точки зрения противогрибковой активности, спектру противогрибкового действия, побочных эффектов и фармакокинетики.
Традиционные противогрибковые препараты не обладают достаточным терапевтическим эффектом и к тому же существует много проблем с побочными эффектами, фармакокинетиками, суперинфекцией и приобретаемой устойчивостью к лекарствам.
Для разрешения этих проблем ясно, что в качестве терапевтических препаратов желательны соединения, обладающие высокой степенью безопасности, лучшей абсорбцией in vivo и более сильной противогрибковой активностью.
Изобретение относится к производному азола формулы (I)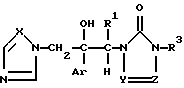
где
Ar является дизамещенной галоидом фенильной группой;
R1 является водородным атомом или низшей алкильной группой;
R3 представляет низший алкил, возможно замешенный галоидом, фенил, незамещенный или замешенный низшим алкилом, галоидом, трифторметилом, низшим алкокси, галоид (низшим) алкокси, пиперазинилом, бензилпиперазинилом, низшим ацилпиперазинилом, низшим алкоксифенилпиперазином, алкильная часть которого может быть заменена галоидом, пиридил или пиримидинилрадикал;
X является атомом азота или метиновой группой; и
Y и Z независимо являются атомом азота или метиновой группой, которая необязательно может быть дополнительно замещена низшей алкильной группой,
или его кислотноаддитивным солям.
Далее изобретение предусматривает противогрибковый препарат, который включает производное азола, представленное формулой (I), или его соль.
Соединение формулы I или его соль согласно изобретению имеет один или более асимметричных атомов углерода в молекуле, таким образом имеет два или более стереоизомеров. Некоторые из этих стереоизомеров так же, как и их смесь, входят в сферу изобретения. Что касается оптических изомеров предпочтительным является, когда углерод, к которому присоединен замененный фенил, обозначенный Ar, и углерод, к которому присоединен R1, имеют R-конфигурацию.
Соединение формулы I или его соль согласно изобретению, может быть получено, например, реакцией соединения формулы (II)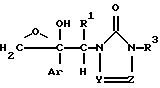
где значения радикалов определены, как указано выше, с соединением формулы (III)
где значения радикалов определены, как указано выше, или его солью.
Указанная реакция обычно может быть осуществлена в растворителе, который не препятствует реакции. Примерами такого растворителя могут быть: вода; кетоны, такие, как ацетон; сульфоксиды, такие, как диметилсульфоксид; эфиры, такие, как диэтиловый эфир, тетрагидрофуран или диоксан; нитрилы, такие, как ацетонитрил; ароматические углеводороды, такие, как бензол, толуол или ксилол; галогенированные углеводороды, такие, как дихлорметан, хлороформ или 1,2-дихлорэтан; эфиры, такие, как этилацетат; амиды, такие, как диметилформамид, ацетамид или диметилацетамид; производные мочевины, такие, как 1,3-диметил-2-имидазолидинон; и т.п. Растворитель может использоваться как индивидуально, так и в виде смеси растворителей, взятых в подходящем соотношении.
Предпочтительно, чтобы указанная реакция протекала в присутствии основания, такого, как гидроксид щелочного металла (например, гидроксида лития, гидроксида калия или гидроксида натрия), гидрида щелочного металла (например, гидрида калия или гидрида натрия), карбоната щелочного металла (например, карбоната лития, бикарбоната натрия, карбоната цезия, карбоната калия или карбоната натрия), соли органической кислоты (например, ацетата натрия), алкоголята щелочного металла (например, метилата натрия или трет-бутилата калия), фторида тетрабутиламмония, бис(три-н-бутилстаннил)оксида, и т.п.
Вместо соединения формулы III может быть использована его соль с металлом (например, щелочным металлом, таким, как натрий или калий) и реакцию проводят в указанном растворителе с получением желаемого соединения.
Количество используемого основания обычно составляет 0,001-100 экв., предпочтительно около 0,01-50 экв. относительно соединения формулы (II).
Количество соединения формулы (III) или его соли составляет 1-100 экв., предпочтительно около 1-50 экв. относительно соединения формулы (II).
Температура реакции не ограничена особым образом, но может быть обычно приблизительно 0-150oC, предпочтительно около 10-120oC.
Время реакции обычно составляет от нескольких минут до нескольких десятков часов (например, от 5 мин до 50 ч).
Соединение формулы I согласно изобретению также может быть получено, например, реакцией соединения формулы (IV)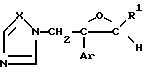
где значения радикалов определены, как указано выше, или его соли с соединением формулы (V)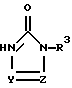
где значения радикалов определены, как указано выше, или его соли.
Указанная реакция обычно может быть проведена в растворителе, который не влияет на реакцию. Примерами таких растворителей являются: вода; кетон, такой, как ацетон; сульфоксид, такой, как диметилсульфоксид; эфиры, такие, как диэтиловый эфир, тетрагидрофуран или диоксан; нитрил, такой, как ацетонитрил; ароматические углеводороды, такие, как бензол, толуол или ксилол; галогенированные углеводороды, такие, как дихлорметан, хлороформ или 1,2-дихлорэтан; эфиры, такие, как этилацетат; амиды, такие, как диметилформамид, ацетамид или диметилацетамид; производное мочевины, такое, как 1,3-диметил-2-имидазолидинон; и т.п. Они могут использоваться как индивидуально, так и в виде смеси, взятые в подходящем соотношении.
Предпочтительно, чтобы реакция проводилась в присутствии основания, такого, как гидроксиды щелочного металла (например, гидроксида лития, гидроксида калия или гидроксида натрия), гидридов щелочного металла (например, гидрид калия или гидрид натрия), карбоната щелочного металла (например, карбоната лития, бикарбоната натрия, карбоната цезия, карбоната калия или карбоната натрия), соли органической кислоты (например, ацетата натрия), алкоголята щелочного металла (например, метилата натрия или тетрабутилата калия), тетрабутиламмонийфторида и т.п.
Количество основания обычно составляет около 0,01-100 экв., предпочтительно около 0,01-50 экв. по отношению к соединению формулы (IV).
Количество соединения формулы (V) или его соли по отношению к соединению формулы (IV) или его соли составляет 1-100 экв., предпочтительно около 1-50 экв.
Температура реакции не ограничивается специально, но может быть порядка обычно 0-150oC, предпочтительно около 10-120oC.
Время реакции обычно составляет от нескольких минут до нескольких десятков часов (например, от 5 мин до 50 ч).
Соединение формулы I может быть также использовано в виде соли и примерами таких солей являются фармакологически приемлемые соли, такие, как неорганические соли (например, гидрохлориды, гидробромиды, сульфаты, нитраты или фосфаты) и органические соли (например, ацетататы, тартраты, цитраты, фумараты, малеаты, толуолсульфонаты или метансульфонаты).
Примерами солей исходного материала, включая упомянутые соединения формул III и IV, являются те же соли, что и для соединения формулы I.
Соединение формулы I или его соль может быть выделена из реакционной смеси известными методами выделения и очистки, такими, как экстракция, фильтрация, перекристаллизация, колончатая хроматография и тонкослойная хроматография.
Соединение формулы I или его соль может иметь по крайней мере два стереоизомера. Каждый из этих изомеров или каждая их смесь входит в объем изобретения, но, если желательно, каждый из изомеров может быть синтезирован отдельно. Например, отдельный изомер соединения формулы I может быть получен из каждого отдельного изомера исходного соединения формулы II или IV. Когда продуктом является смесь одного или более изомеров, они могут быть разделены на отдельные изомеры обычными методами, такими, как метод получения солей оптически активных кислот (например, камфорсульфоновой кислоты или винной кислоты) или путем различного типа хроматографий, фракционированной перекристаллизацией и т.п.
Соли соединения формулы I могут быть также получены таким методом, как обработка указанными неорганическими или органическими кислотами соединения формулы I.
Соединение формулы I или его соль, имеющие низкую токсичность и значительную противогрибковую активность широкого противогрибкового спектра действия (например, эффективны против Candida, Aspergillus или Cryptococcus) могут быть использованы для профилактики и лечения грибковых инфекций (например, кандидозов, аспергиллозов или криптококкозов) у млекопитающих (например, человека, домашних животных или птиц). Соединение формулы I или его соль могут использоваться также в качестве противогрибкового препарата в сельском хозяйстве.
Соединение формулы I или его соль могут безопасно назначаться как орально, так и парентерально человеку в виде фармацевтических композиций (например, порошок, гранулы, таблетки или капсулы), парентеральных препаратов (например инъекции, наружные препараты, например для носа или кожные, суппозитории, например ректальные или вагинальные, и так далее) per se или в смеси с соответствующими фармакологически приемлемыми носителями, наполнителями или разбавителями.
Эти препараты могут быть получены по методам, которые известны per se и широко используемы при производстве фармакологических препаратов.
Например, соединение формулы I или его соль согласно изобретению может быть в виде инъекции, такой, как водная инъекция, включающая диспергирующий агент (например, Tween 60 [Atlas Power, USA], MCO 60 [Nikko Chemicals, Japan], карбоксиметилцеллюлоза и альгинат натрия), стабилизатор (например, метилпарабен, пропилпарабен, бензиловый спирт или хлорбутанол), изотонический агент (например, хлорид натрия, глицерин, сорбитол или глюкоза) и тому подобное, или такой, как инъекция, полученная растворением, суспендированием или эмульгированием в растительном масле (например, в оливковом масле, сезамовом (кунжутном) масле, арахисовом масле, хлопковом масле или кукурузном масле), в пропиленгликоле и тому подобное.
При получении препаратов для орального применения соединение I или его соль согласно изобретению прессуют под давлением вместе, например, с волокнами (например, лактоза, сахар или крахмал), разрыхляющими агентами (например, крахмал или карбонат кальция), связующего (например, крахмал, arable резина, карбоксиметилцеллюлоза, поливинилпирролидинон или гидроксипропилцеллюлоза), смазкой (например, тальк, стеарат магния или полиэтиленгликоль 6000) и тому подобное или, если необходимо, под слоем (в соответствии с известными методами per se) веществ для придания вкуса или для придания препарату свойств, определяющих его высвобождение в кишечнике. Примерами являются, например, гидроксипропилметилцеллюлоза, этилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, полиоксиэтиленгликоль, Tween 80, Pluronic F80, ацетат фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат сукцинат гидроксиметилцеллюлозы, Eudoragit (Rohm, West Germany; сополимер метакриловой кислоты с акриловой кислотой) и красители, такие, как оксид титана и красный оксид железа.
В случае препарата для наружного применения соединение формулы I или его соль согласно изобретению может быть, например, в виде твердого, полутвердого или жидкого препарата, изготовленного по известному per se методу. Например, в случае твердого препарата, соединение формулы I или его соль используют непосредственно или в виде смеси с наполнителями (например, глюкозой, маннитолом, крахмалом или микрокристаллической целлюлозой), загустителем (например, натуральные каучуки, производные целлюлозы или полимеры акриловой кислоты) и т.д. с получением порошковой композиции. В случае жидкого препарата процедура почти такая же, как в случае инъекций с получением масляной или водной суспензии. В случае полутвердого препарата предпочтительны водный или масляный гель или мазь. Все это может быть дополнено pH-регулирующим агентом (например, угольная кислота, фосфорная кислота, лимонная кислота, соляная кислота или гидроксид натрия), антисептиками (например, п-гидроксибензоаты, хлорбутанол или хлорид бензалкония) и тому подобное. Например, для стерилизации или дезинфекции кожи или слизистой оболочки можно использовать мазь, приготовленную на основе 0,1-100 мг препарата на 1 г используемого вазелина или ланолина в качестве основного материала.
В случае суппозиториев соединения согласно изобретению I или его соль могут быть изготовлены известным методом per se в виде масляных или водных суппозиториев в твердом, полутвердом или жидком виде. Примерами используемых материалов для масляного основания являются глицериды высокожирных кислот (например, масло какао, Witepsols (Dinamite-Nobell), средне-жирные кислоты (например, Migriol (Dynamite-Nobell), растительное масло (например, кунжутное масло, масло сои или масло хлопка) и тому подобное. Примерами используемых материалов для водных оснований являются полиэтиленгликоль и пропиленгликоль, а примерами материалов для водных гелей являются натуральные резины, производные целлюлозы, виниловые полимеры и полимеры акриловой кислоты.
Дозы могут варьироваться в зависимости от степени инфекции и пути назначения, в случае взрослых пациентов (вес тела 50 кг) для терапии кандидозов оральным путем около 0,01-100 мг/кг/день, предпочтительно 0,1-50 мг/кг/день и более предпочтительно 0,1-20 мг/кг/день.
В случае использования в качестве противогрибкового агента для сельскохозяйственных культур соединение формулы I или его соль растворяют или диспергируют в подходящем жидком носителе (например, растворителе) или смешивают или адсорбируют с соответствующим твердым носителем (например, разбавитель или наполнитель) с последующим, если необходимо, добавлением эмульгатора, суспендирующего агента, смазки, стабилизатора и т.д., с получением препарата, такого, как эмульсия, гидратированный агент, порошки, гранулы. Такие препараты могут быть получены известным методом per se. Количество используемого соединения формулы I или его соли, например в случае болезни рисовым вредителем, 25-150 г, предпочтительно 40-80 г на ар зараженного рисового поля.
Примерами используемого жидкого носителя является вода, спирты (например, метиловый спирт, этиловый спирт, н-пропиловый спирт, изопропиловый спирт или этиленгликоль), эфиры (например, диоксан или тетрагидрофуран), алифатические углеводороды (например, керосин, ламповое масло или мазутное масло), ароматические углеводороды (например, бензол или толуол), галогенированные углеводороды (например, метиленхлорид или хлороформ), амиды кислот (например, диметилформамид или диметилацетамид), эфиры (например, этилацетат или бутилацетат), нитрилы (например, ацетонитрил или пропионитрил) и тому подобное. Они могут быть использованы как индивидуально, так и в виде их смеси в подходящем соотношении.
Примерами твердого носителя являются растительный порошок (например, порошок сои, порошок табака или пшеничная мука), минеральный порошок (например, каолин или бентонит), алюминий, порошок серы, активированный уголь и т. д. Они могут быть использованы как индивидуально, так и в виде смеси в подходящем соотношении.
Изобретение иллюстрируется далее путем следующих ссылочных примеров и рабочих примеров.
1H-ЯМР спектры измерялись на спектрометре типа Varian Gemini 200 (200 МГц) с использованием тетраметилсилана в качестве внутреннего стандарта. Все значения δ даны в ppm. Для смешанных растворителей цифры, приведенные в скобках, показывают объемную долю каждого растворителя в смеси. Обозначение "%" означает % по массе, если не дано другого разъяснения.
Обозначения в примерах имеют следующие значения: s: синглет, d: дублет; t: триплет; k: квадруплет; dd: двойной дублет; m: мультиплет; br: уширенный; j: константа сигнала; 1H-NMR: 1H-ЯМР; IRmax: ИКмакс; cm-1: см-1; neat: чистый.
Ссылочный пример 1. 2-[(1R)-1-(3,4,5,6-Тетрагидро-2H-пиран- 2-ил)оксиэтил] -2-(2,4-дифторфенил)оксиран (82 г, полученный по методу, описанному в Japanese Laid Open Application Hei 04/074168-A) и 6,3 г п-толуолсульфоната пиридиния растворяют в 600 мл этанола и раствор перемешивают при 55oC в течение 1 ч. Реакционный раствор концентрируют при пониженном давлении. Остаток растворяют в 1 л этилацетата и полученный раствор промывают водой (2•200 мл). Водный слой экстрагируют этилацетатом (2•100 мл). Органические слои объединяют, промывают насыщенным водным раствором хлористого натрия, высушивают над сульфатом магния и упаривают при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - гексан: этилацетат = 10: 1 к 8:1 к 3:1) с получением 31,5 г (1R)-1-[2-(2,4-дифторфенил)-2-оксиранил]этанол в виде бледно-желтого масла.
1H-NMR (CDCl3) δ: 1,14-1,23 (3H, m), 1,77, 2,22 (1H), 2,80, 2,92 (1H), 3,27-3,32 (1H), 4,00-4,20 (1H, m), 6,75-6,94 (2H, m), 7,36-7,48 (1H, m).
Ссылочный пример 2. (1R)-1-[2-(2,4-Дифторфенил)-2-оксиранил]этанол (31,5 г) и 40 г 3,5-динитробензоилхлорида растворяют в 500 мл метиленхлорида и при охлаждении льдом добавляют по каплям 24,1 мл триметиламина. Реакционный раствор перемешивают при комнатной температуре 3,5 ч, промывают 150 мл воды и затем 150 мл 5%-ным водным раствором бикарбоната, высушивают над сульфатом магния и концентрируют при пониженном давлении. Кристаллы отделяют фильтрацией и промывают метиленхлоридом. Маточный раствор и промывочную воду объединяют и упаривают при пониженном давлении, затем добавляют 25 мл этилацетата и 300 мл метанола к остатку, и смесь охлаждают на льду, кристаллы отделяют фильтрацией и перекристаллизовывают из смеси 25 мл этилацетата и 250 мл метанола с получением 28,7 г [(1R)-1-[(2R)-2-(2,4-дифторфенил)- 2-оксиранил]этил]-3,5-динитробензоата в виде бесцветных игл.
T.пл. 104-107oC (перекристаллизация из этилацетат-гексана).
1H-NMR (CDCl3) δ : 1,46 (3H, dd, J = 6,6 Hz, J = 1,2 Hz), 3,01 (1H, d, J = 4,6 Hz), 3,23 (1H, d, J = 4,6 Hz), 5,33(1H, q, J = 6,6 Hz), 6,85-7,07 (2H, m), 7,54 (1H, m), 9,13 (2H, d, J = 2,2 Hz), 9,25 (1H, t, J = 2,2 Hz).
Ссылочный пример 3. [(1R)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этил]- 3,5-динитробензоат (50 г) растворяют в 2 л метанола и при комнатной температуре по каплям добавляют 255 мл 1н. раствора гидроксида натрия. Реакционный раствор перемешивают 1 ч при комнатной температуре и нейтрализуют 127 мл 1н. соляной кислоты. Метанол удаляют при пониженном давлении, затем к остатку добавляют 1 л этилацетата и 200 мл воды, и смесь экстрагируют этилацетатом. Органический экстракт промывают 200 мл насыщенного водного раствора хлорида натрия, высушивают над сульфатом магния и упаривают при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - гексан:этилацетат = 3:1) с получением 25 г (1R)-1-[(2R)-2-(2,4-дифторфенил)- 2-оксиранил]этанола в виде бледно-желтого масла.
1H-NMR (CDCl3) δ : 1,17 (3H, dd, J = 6,6 Hz, l,2H), 2,05 (1H, br), 2,80 (1H, d, J = 5,2 Hz), 3,30 (1H, d, J = 5,2 Hz), 4,01-4,17 (1H, m), 6,75-6,93 (2H, m), 7,36-7,48 (1H, m).
Ссылочный пример 4. K раствору 16,1 г (1R)-1-[(2R)-2-(2,4-Дифторфенил)- 2-оксиранил] этанола в 320 мл тетрагидрофурана добавляют при ледяном охлаждении 63,3 г трифенилфосфина, 29,5 г бензойной кислоты и 42,0 г диэтилазодикарбоксилата и смесь перемешивают 6 ч в атмосфере аргона при комнатной температуре. К реакционному раствору добавляют 800 мл этилацетата и 500 мл воды для фракционирования, и водный слой экстрагируют 200 мл этилацетата. Органические слои объединяют и промывают водой и насыщенным водным раствором хлорида натрия, высушивают над сульфатом магния и концентрируют. Остаток очищают при помощи хроматографии на силикагеле (элюент - гексан:этилацетат = 15: 1 к 7:1) с получением 19,2 г [1S)-1-[(2R)-2-(2,4-дифторфенил)-2- оксиранил]этил]бензоат в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,37 (3H, d, J = 6,6 Hz), 2,90 (1H, d, J = 5,2 Hz), 3,28 (1H, d, J = 5,2 Hz), 5,36 (1H, q, J = 6,6 Hz), 6,74-6,94 (2H, m), 7,38-7,60 (4H, m), 7,94-8,01 (2H, m).
IRυ
[1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этил]бензоат (15,9 г) растворяют в 800 мл метанола. При ледяном охлаждении добавляют 28%-ный метанольный раствор метилата натрия (12,9 мл), и реакционный раствор перемешивают при комнатной температуре 6 ч. К реакционному раствору прибавляют 63,2 мл 1н. соляной кислоты и растворитель удаляют упариванием при пониженном давлении.
Остаток очищают при помощи хроматографии на силикагеле (элюент - гексан: этилацетат = 6: 1 к 2:1) с получением 9,7 г (1S)-1[(2R)-2-(2,4-дифторфенил)-2-оксиранил}этанола в виде бесцветного масла.
1H-NMR (CDCl3) δ: 1,20 (3H, dd, J = 6,4 Hz, 2,2 Hz), 2,24 (1H, d, J = 1H), 2,92 (1H, d, J = 5 Hz), 3,28 (1H, d, J = 5 Hz), 4,12 (1H, q, J = 6,4 Hz), 6,77-6,95 (2H, m), 7,34 (1H, m).
IRυ
Ссылочный пример 5. К раствору (1S)-1-[(2R)-2-(2,4-Дифторфенил)- 2-оксиранил]этанола в 15 мл дихлорметана добавляют в атмосфере азота 0,51 мл диизопропилэтиламина при -78oC и затем 0,49 мл ангидрида трифторметансульфоновой кислоты по каплям в течение 3 мин. Смесь перемешивают при -78oC 20 мин, затем при -20oC 20 мин и концентрируют до 9 мл при -10oC. Концентрат подвергают флэш-хроматографии на колонке с использованием силикагеля (3,2 х 4 см), элюируя с дихлорметаном-гексаном (1:1). Нужную фракцию концентрируют до 3 мл, остаток добавляют к раствору натриевой соли 1-(4-трифторметилфенил)-2(1H, 3H)-имидазолона, полученного из 606 мг 1-(4-трифторметилфенил)-2(1H, 3H)-имидазолона, 3 мл диметилформамида и 85 мг 60%-ного гидрида натрия в масле, при -10oC и перемешивании в течение 10 мин. Реакционный раствор далее перемешивают при 0oC в течение 20 мин. Добавляют к реакционному раствору воду (30 мл) и смесь экстрагируют до 30 мл этилацетата четыре раза. Этилацетатные вытяжки промывают дважды по 20 мл водой и затем один раз насыщенным водным раствором хлорида натрия, высушивают над обезвоженным сульфатом магния и удаляют растворитель при пониженном давлении с получением бесцветного масла. Его очищают при помощи хроматографии на силикагеле (элюент - гексан: этилацетат = 3:1 к 2:1 к 1:1) с получением 362 г 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3-(4-трифторметилфенил)-2(1H, 3H)- имидазолона и 209 мг (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1-(4-трифторметилфенил)- 2-имидазолилокси]этил]оксирана.
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил]- 3-(4-трифторметилфенил)-2(1H,3H)имидазолон, бесцветные призмы. Т.пл. 135-136oC.
1H-NMR (CDCl3) δ : 1,37 (3H, d, J = 7,2 Hz), 2,72 (1H, d, J = 4,4 Hz), 2,82 (1H, d, J = 4,4 Hz), 5,09 (1H, q, J = 7,2 Hz), 6,50 (1H, d, J = 3,2 Hz), 6,64 (1H, d, J = 3,2 Hz), 6,80-6,97 (2H, m), 7,35-7,50 (1H, m), 7,69 (2H, d, J = 8,4 Hz), 7,82 (2H, d, J = 8,4 Hz).
IRυ
Вычислено, %: C 58,54; H 3,68; N 6,83.
C20H15F5N5O2.
Найдено, %: C 58,80; H 3,90; N 6,81.
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-трифторметилфенил)- 2-имидaзoлилoкcи]этил]оксиран, бесцветное масло.
1H-NMR (CDCl3) δ : 1,46 (3H, dd, J = 6,6, 1,6 Hz), 2,89 (1H, d, J = 4,8 Hz), 3,16 (1H, d, J = 4,8 Hz), 5,24 (1H, q, J = 6,6 Hz), 6,70-6,91 (4H, m), 7,22-7,40 (1H, m), 7,50 (2H, d, J = 8,4 Hz), 7,70 (2H, d, J = 8,4 Hz).
IRυ
SIMS (m/z): 411 (M+H)+.
Ссылочный пример 6. Таким же путем, как и в ссылочном примере 5 исходя из 423 мг (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 207 мг 1-метил-2(1H, 3H)-имидазолона получают по методу, описанному в Journal of American Chemical Society, Vol. 98, p. 8218 (1976), 102 мг 1-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -3-метил- 2(1H,3H)-имидазолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,40 (3H, dd, J = 6,4, 1,4 Hz), 2,90 (1H, d, J = 5,4 Hz), 3,23 (1H, d, J = 5,4 Hz), 3,37 (3H, s), 5,18 (1H, d, J = 6,4 Hz), 6,48 (1H, d, J = 1,6 Hz), 6,59 (1H, J = 1,6 Hz), 6,75-6,98 (2H, m), 7,41-7,59 (1H, m).
IRυ
SIMS (m/z): 281 (M+H)+.
Ссылочный пример 7. Тем же методом, что и в ссылочном примере 5, исходя из 1,95 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,39 г 1-(4-фторфенил)-2(1H, 3H)-имидазолона было получено 1,10 г 1-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]-3-(4-фторфенил)- 2(1H,3H)-имидазолона и 0,88 г (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1- 4-фторфенил)-2-имидазолилокси]этил оксирана.
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 3-(4-фторфенил)-2(1H,3H)-имидазолон, бесцветное масло.
1H-NMR (CDCl3) δ : 1,37 (3H, d, J = 7,2 Hz), 2,70 (1H, d, J = 4,8 Hz), 2,81 (1H, d, J = 4,8 Hz), 5,07 (1H, d, J = 7,2 Hz), 6,44 (1H, d, J = 3,2 Hz), 6,52 (1H, d, J = 3,2 Hz), 6,79-6,98 (2H, m), 7,02-7,20 (2H, m), 7,35-7,50 (1H, m), 7,50-7,68 (2H, m).
IRυ
SIMS (M/z): 361 (M+H)+.
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-фторфенил)- 2-имидазолилокси] этил]оксирана, бесцветное масло.
1H-NMR (CDCl3) δ : 1,44 (3H, dd, J = 6,4, 1,6 Hz), 2,88 (1H, d, J = 4,8 Hz), 3,14 (1H, d, J = 4,8 Hz), 5,16 (1H, q, J = 6,4 Hz), 6,65-6,80 (4H, m), 7,01-7,19 (2H, m), 7,20-7,38 (3H, m).
IRυ
SIMS (m/z): 361 (M+H)+.
Ссылочный пример 8. Тем же методом, что и в ссылочном примере 5 исходя из 1,36 г (1S)-1-[(2R)-2-(2,4-Дифтopфeнил)-2-oкcиpaнил]этанола и 1,06 г 1-(2,4-дифторфенил)-2-(1H, 3H)-имидазолона получают 0,53 г 1-[(1R,2S)-2-(2,4-дифтopфeнил)-2,3-эпoкcи-1-метилпропил] -3-(2,4-дифторфенил)- 2(1H, 3H)-имидазолона и 0,56 г (2R)-2-(2,4-дифторфенил)-2-[(1R)- 1-[1-(2,4-дифторфенил)-2-имидазолилокси]этил]оксирана.
1-[1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил]- 3-(2,4-дифторфенил)-2(1H,3H)-имидазолон, бледно-желтое масло.
1H-NHR (CDCl3) δ : 1,38 (3H, d, J = 7,2 Hz), 2,72 (1H, d, J = 4,6 Hz), 2,83 (1H, d, J = 4,6 Hz), 5,06 (1H, q, J=7,2 Hz), 6,44 (2H, s), 6,78-7,03 (4H, m), 7,42 (1H, m), 7,60 (1H, m).
IRυ
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(2,4-дифторфенил)- 2-имидазолилокси]этил]оксиран, бледно-желтое масло.
1H-NMR (CDCl3) δ : 1,39 (3H, d, J= 6,5 Hz), 2,87 (1H, d, J = 5 Hz), 3,13 (1H, d, J = 5 Hz), 5,4(1H, q, J = 6,5 Hz), 6,62-7,05 (6H, m), 7,15-7,45 (2H, m).
IRυ
Ссылочный пример 9. Тем же методом, что и в ссылочном примере 5 исходя из 1,35 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 963 мг 4-(4-фторфенил)-3(2H,4H)-1,2,4-триазолона получают 583 г 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метил-пропил] -4-(4-фторфенил)- 3(2H,4H)-1,2,4-триазолона в виде бесцветных игл.
Т.пл. 100-101oC.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7,2 Hz), 2,88 (1H, d, J = 4,6 Hz), 3,16 (1H, d, J = 4,6 Hz), 4,94 (1H, q, J = 7,2 Hz), 6,70-6,91 (2H, m), 7,08-7,22 (2H, m), 7,25-7,51 (3H, m), 7,63 (1H, s).
IRυ
Вычислено, %: C 59,84; H 3,91; N 11,63.
C18H14F3N3O2.
Найдено, %: C 59,85; H 3,93; N 11,74.
Ссылочный пример 10. Тем же методом, что и в ссылочном примере 5 исходя из 1,66 г (1S)-1-(2R)-2-(2,4-Дифторфенил)-2-оксиранил-этанола и 1,26 г 1-(метоксифенил)-2(1H, 3H)-имидазолона получают 1-(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил-3-(4-метоксифенил)- 2(1H,3H)-имидазолон 617 мг в виде бесцветных призм.
Т.пл. 150-151oC.
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7,2 Hz), 2,70 (1H, d, J = 4,8 Hz), 2,81 (1H, d, J = 4,8 Hz), 3,82 (3H, s), 5,07 (1H, q, J = 7,2 Hz), 6,41 (1H, d, J= 3 Hz), 6,49 (1H, d, J = 3Hz), 6,78-6,95 (2H, m), 6,94 (2H, d, J = 9 Hz), 7,35-7,50 (1H, m), 7,49 (2H, d, J = 9 Hz).
Вычислено, %: C 64,51; H 4,87; N 7,52.
C20H18F2N2O3.
Найдено, %: C 64,26; H 4,97; N 7,46.
IRυ
Ссылочный пример 11.
Тем же методом, что и в ссылочном примере 5 исходя из 1,73 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил] этанола и 1,32 г 4-(4-метоксифенил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метил-пропил] -4-(4-метоксифенил)- 3(2H,4H)-1,2,4-триазолон 869 мг в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 4,6 Hz), 3,16 (1H,d, J = 4,6 Hz), 3,83 (3H, s), 4,95 (1H, q, J = 7 H), 6,74-6,90 (2H, m), 6,96 (2H, d, J = 9,2 Hz), 7,28-7,42 (1H, m), 7,36 (2H, d, J = 9,2 Hz), 7,59 (1H, s).
IRυ
SIMS (m/z): 374 (M+H)+.
Ссылочный пример 12. Тем же методом, что и в ссылочном примере 5 исходя из 1,36 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,32 г 1-(4-трифторметоксифенил)-2(1H,3H)-имидазолона получают 1-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метил-пропил] - 3-(4-трифторметоксифенил)-2(1H,3H)-имидазолон (0,60 г) и 0,46 г (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1-(4-трифторметоксифенил)- 2-имидазолилокси]этил]оксирана.
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил]- 3-(4-трифторметоксифенил)-2(1H,3H)-имидазолон - бесцветные кристаллы.
Т.пл. 99-100oC.
1H-NMR (CDCl3) δ : 1,37 (3H, d, J = 7,2 Hz), 2,71 (1H, d, J = 4,8 Hz), 2,80 (1H, d, J = 4,8 Hz), 5,07 (1H, q, J = 7,2 Hz), 6,46 (1H, d, J = 3,2 Hz), 6,56 (1H, d, J = 3,2 Hz), 6,80-6,96 (2H, m), 7,28 (2H, d, J = 9 Hz), 7,40 (1H, m), 7,67 (2H, d, J = 9 Hz).
IRυ
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-трифторметоксифенил)- 2-имидазолилокси]этил]оксиран - бледно-желтое масло.
IRυ
1H-NMR (CDCl3) δ : 1,45 (3H, dd, J = 6,6 Hz, J = 1,6 Hz), 2,90 (1H, d, J = 5 Hz), 3,14 (1H, d, J = 5 Hz), 5,19 (1H, q, J = 6,6 Hz), 6,70-6,90 (4H, m), 7,18-7,50 (5H, m).
Ссылочный пример 13. Тем же методом, что и в ссылочном примере 5 исходя из 1,64 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,87 г 4-(трифторметилфенил)-3(2H,4H)-1,2,4-триазолона получают 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-(4-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолон (1,26 г) в виде бесцветных кристаллов.
1H-NMR (CDCl3) δ : 1,48 (3H, d, J = 7,4 Hz), 2,89 (1H, d, J = 4,6 Hz), 3,16 (1H, d, J = 4,6 Hz), 4,95 (1H, q, J = 7,2 Hz), 6,74-6,90 (2H, m), 7,28-7,42 (1H, m), 7,64-7,86 (5H, m).
IRυ
Вычислено, %: C 55,48; H 3,43; N 10,22.
C19H14F5N3O2.
Найдено, %: C 55,56; H 3,43; N 10,15.
Ссылочный пример 14. Тем же методом, что и в ссылочном примере 5 исходя из 2,49 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 2,52 г 2-(4-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолона получают 4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 2-(4-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолон (1,13 г) и 618 мг (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1-(4-трифторметилфенил)-1H- 1,2,4-триазол-5-илокси]этил]оксирана.
4-[1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 2-(4-трифторметилфенил)-3(2H,4H)-1,2,4-триазолон, бесцветные призмы.
Т.пл. 164-165oC.
1H-NMR (CDCl3) δ : 1,44 (3H, d, J = 7,2 Hz), 2,74 (1H, d, J = 4,2 Hz), 2,78 (1H, d, J = 4,2 Hz), 5,02 (1H, q, J = 7,2 Hz), 6,80-7,01 (2H, m), 7,35-7,51 (1H, m), 7,64 (1H, s), 7,70 (2H, d, J = 8,8 Hz), 8,18 (2H, d, J = 8,8 Hz).
IRυ
Вычислено, %: C 55,48; H 3,43; N 10,22.
C19H14F5N3O2.
Найдено, %: C 55,17; H 3,39; N 10,19.
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-трифторметилфенил)-1H- 1,2,4-триазол-5-илокси]этил]оксиран, бесцветное масло.
1H-NMR (CDCl3) δ : 1,53 (3H, dd, J = 6,6, 1,6 Hz), 2,94 (1H, d, J = 4,8 Hz), 3,22 (1H, d, J = 4,8 Hz), 5,37 (1H, q, J = 6,6 Hz), 6,75-6,98 (2H, m), 7,38-7,52 (1H, m), 7,69 (1H, s), 7,70 (2H, d, J = 8,4 Hz), 7,85 (2H, d, J = 8,4 Hz).
IRυ
Ссылочный пример 15. Тем же методом, что и в ссылочном примере 5 исходя из 1,36 г (1S)-1-[(2R)-2-(2,4-Дифтopфeнил)-2-oкcиpaнил]этанола и 1,33 г 4-(4-трифторметоксифенил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]- 4-(4-трифторметоксифенил)-3(2H, 4H)-1,2,4-триазолон (1,45 г) в виде бесцветных призм. Т.пл. 103-106oC.
1H-NMR (CDCl3) δ : 1,48 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 4,8 Hz), 3,16 (1H, d, J = 4,8 Hz), 4,94 (1H, q, J = 7 Hz), 6,72-6,92 (2H, m), 7,25-7,45 (3H, m), 7,56 (2H, d, J = 9,2 Hz), 7,66 (1H, s).
IRυ
Ссылочный пример 16. Тем же методом, что и в ссылочном примере 5 исходя из 0,83 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 0,83 г 1-(4-изопропилфенил)-2(1H, 3H)-имидазолона получают 1-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3-(4-изопропилфенил)-2(1H,3H)-имидазолон (0,25 г) и 0,22 г (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1-(4-изопропилфенил)- 2-имидазолилокси]этил]оксирана.
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 3-(4-изопропилфенил)-2(1H,3H)-имидазолон, бесцветные кристаллы. Т.пл. 119-120oC.
1H-NMR (CDCl3) δ : 1,25 (6H, d, J = 7,0 Hz), 1,36 (3H, d, J = 7,4 Hz), 2,70 (1H, d, J = 5 Hz), 2,81 (1H, d, J = 5 Hz), 2,92 (1H, quintet, J = 7,0 Hz), 5,08 (1H, q, J = 7,4 Hz), 6,42 (1H, d, J = 3,2 Hz), 6,54 (1H, d, J = 3,2 Hz), 6,80-6,93 (2H, m), 7,27 (2H, d, J = 8,6 Hz), 7,35-7,48 (1H, m), 7,52 (2H, d, J = 8,6 Hz).
IRυ
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-изопропилфенил)- 2-имидaзoлилoкcи]этил]оксиран, бесцветное масло.
1H-NMR (CDCl3) δ : 1,30 (6H, d, J = 7 Hz), 1,43 (3H, d, J = 6,6 Hz), 2,88 (1H, d, J = 5,0 Hz), 2,97 (1H, q, J = 7,0 Hz), 3,15 (1H, d, J = 5,0 Hz), 5,14 (1H, d, J = 6,6 Hz), 6,67-6,82 (4H, m), 7,26 (4H, s), 7,22-7,35 (1H, m).
Ссылочный пример 17. Тем же методом, что и в ссылочном примере 5 исходя из 1,36 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,07 г 4-(2,4-дифторфенил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -4-(2,4-дифторфенил)- 3(2H, 4H)-1,2,4-триазолон (1,20 г) в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,48 (3H, d, J = 7,2 Hz), 2,89 (1H, d, J = 4,6 Hz), 3,18 (1H, d, J = 4,6 Hz), 4,94 (1H, q, J = 7,2 Hz), 6,76-6,94 (2H, m), 6,95-7,10 (2H, m), 7,28-7,42 (1H, m), 7,50-7,65 (1H, m), 7,58 (1H, d, J = 2,2 Hz).
IRυ
Ссылочный пример 18. Тем же методом, что и в ссылочном примере 5 исходя из 2,27 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,80 г 2-(4-фторфенил)-3(2H, 4H)-1,2,4-триазолона получают 4-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -2-(4-фторфенил)- 3(2H,4H)-1,2,4-триазолон (848 мг) и 446 мг (2R)-2-(2,4-дифторфенил)-2- [1R)-1-[1-(4-фторфенил)-1H-1,2,4-триазол-5-илокси]этил]оксирана.
4-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 2-(4-фторфенил)-3(2H,4H)-1,2,4-триазолон, бесцветные призмы. Т.пл. 163-164oC.
1H-NMR (CDCl3) δ : 1,43 (3H, d, J = 7,2 Hz), 2,73 (1H, d, J = 4,2 Hz), 2,77 (1H, d, J = 4,2 Hz), 5,01 (1H, q, J = 7,2 Hz), 6,82-7,01 (2H, m), 7,12 (2H, t, J = 8,8 Hz), 7,35-7,50 (1H, m), 7,60 (1H, s), 7,96 (2H, dd, J = 8,8, 4,6 Hz).
IRυ
Вычислено, %: C 59,84; H 3,91; N 11,63.
C18H14F3N3O2.
Найдено, %: C 59,51; H 3,83; N 11,83.
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-фторфенил)-1H-1,2,4-триазол- 5-илокси]этил]оксиран, бесцветное масло.
1H-NMR (CDCl3) δ : 1,50 (3H, dd, J = 6,6, 1,6 Hz), 2,93 (1H, d, J = 4,8 Hz), 3,20 (1H, d, J = 4,8 Hz), 5,27 (1H, q, J = 6,6 Hz), 6,76-6,98 (2H, m), 7,13 (2H, t, J = 8,2 Hz), 7,30-7,49 (1H, m), 7,63 (2H, dd, J = 4,6, 8,2 Hz), 7,64 (1H, s).
IRυ
Ссылочный пример 19. Тем же методом, что и в ссылочном примере 5 исходя из 681 мг (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,0 г 4-[4-(4-бензил-1-пиперазинил)фенил]-3(2H,4H)-1,2,4-триазолона получают 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(4-бензил-1-пиперазинил)фенил]-3(2H,4H)-1,2,4-триазолон (293 мг) в виде бесцветного порошка.
1H-NMR (CDCl3) δ : 1,45 (3H, d, J = 7 Hz), 2,61 (4H, t, J = 4,8 Hz), 2,87 (1H, d, J = 4,8 Hz), 3,16 (1H, d, J = 4,8 Hz), 3,22 (4H, t, J = 4,8 Hz), 3,57 (2H, s), 4,96 (1H, q, J = 7 Hz), 6,72-6,91 (2H, m), 6,94 (2H, d, J = 9 Hz), 7,21-7,45 (8H, m), 7,57 (1H, s).
Ссылочный пример 20. Тем же методом, что и в ссылочном примере 5 исходя из 1,72 г (1S)-1-1(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,68 г 4-(4-изопропилфенил)-3(2H, 4H)-1,2,4-триазолона получают смесь порядка 1:1 (0,89 г) 2-[(1R,2S)-2-(2,4-дифторфeнил)-2,3-эпокси- 1-метилпропил]-4-(4-изопропилфенил)-3(2H, 4H)-1,2,4-триазолона и (1R)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола.
1H-NMR (CDCl3) δ : 1,16 (dd, J = 6,6, 1,0 Hz), 1,25 (d, J = 6,8 Hz), 1,46 (d, J = 7 Hz), 1,78 (d, J = 8 Hz), 2,79 (d, J = 5 Hz), 2,88 (d, J = 5 Hz), 2,94 (q, J = 6,8 Hz), 3,16 (d, J = 5 Hz), 3,30 (d, J = 5 Hz), 4,02-4,17 (m), 4,96 (q, J = 7 Hz), 6,73-6,92 (m), 7,27-7,45 (m), 7,62 (s).
Ссылочный пример 21. Тем же методом, что и в ссылочном примере 5 исходя из 1,41 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,30 г 1-(4-трифторметилфенил)-5(1H, 4H)-тетразолона получают 1-[1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-(4-трифторметилфенил)-5(1H,4H)-тетразолон (1,38 г) и 0,168 г (2R)-2-(2,4-дифторфенил)-2-[(1R)- 1-[1-(4-трифторметилфенил)-1H-тетразол-5-илокси]этил]оксирана.
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил]- 4-(4-трифторметилфенил)-5(1H,4H)-тетразолон, бесцветное масло.
1H-NMR (CDCl3) δ : 1,61 (3H, d, J = 7,2 Hz), 2,93 (1H, d, J = 4,6 Hz), 3,16 (1H, d, J = 4,6 Hz), 4,97 (1H, q, J = 7,2 Hz), 6,72-6,94 (2H, m), 7,23-7,40 (1H, m), 7,75 (2H, d, J = 8,4 Hz), 8,13 (2H, d, J = 8,4 Hz).
IRυ
SIMS (m/z): 413 (М+Н)+.
(2R)-2-(2,4-Дифтopфeнил)-2-[(1R)-1-[1-(4-тpифтopмeтилфeнил)- 1H-тетразол-5-илокси]этил]оксиран, бесцветное масло.
1H-NMR (CDCl3) δ : 1,59 (3H, dd, J = 6,6, 1,6 Hz), 2,98 (1H, d, J = 4,6 Hz), 3,23 (1H, d, J = 4,6 Hz), 5,39 (1H, q, J = 6,6 Hz), 6,75-6,98 (2H, m), 7,32-7,49 (1H, m), 7,80 (2H, d, J = 9 Hz), 7,82 (2H, d, J = 9 Hz).
SIMS (m/z): 413 (M+H)+.
Ссылочный пример 22. Тем же методом, что и в ссылочном примере 5 исходя из 0,50 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 0,72 г 1-[4-(2,2,3,3-тетрафторпропокси)фенил] -2(1H, 3H)-имидазолона получают 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3-[4-(2,2,3,3-тетрафторпропокси)фенил] -2-(1H, 3H)-имидазолон (0,21 г) и 0,14 г (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-1-[4-(2,2,3,3- тетрафторпропокси)фенил]-2-имидазолилокси]этил]оксирана.
1-[(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 3-[4-(2,2,3,3-тетрафторпропокси)фенил]-2(1H,3H)-имидазолон.
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7,2 Hz), 2,70 (1H,d, J = 4,7 Hz), 2,81 (1H, d, J = 4,7 Hz), 4,36 (2H, t, J = 12 Hz), 5,07 (1H, q, J = 7,2 Hz), 6,06 (1H, tt, J = 4,8, 53 Hz), 6,43 (1H, d, J = 3 Hz), 6,51 (1H, d, J = 3 Hz), 6,79-7,02 (4H, m), 7,26-7,47 (1H, m), 7,52-7,60 (2H, m).
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-4-(2,2,3,3- тетрафторпропокси)фенил]-2-имидазолилокси]этил оксиран.
1H-NMR (CDCl3) δ : 1,43 (3H, d, J = 6,6 Hz), 2,86 (1H, d, J = 5,2 Hz), 3,14 (1H, d, J = 5,2 Hz), 4,32-4,47 (2H, m), 5,19 (1H, q, J = 6,6 Hz), 6,09 (1H, tt, J = 4,8, 53 Hz), 6,72-6,83 (4H, m), 6,90-7,02 (2H, m), 7,24- 7,47 (3H, m).
Ссылочный пример 23. Тем же методом, что и в ссылочном примере 5 исходя из 543 мг (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 809 мг 4-[4-[4-(4-метоксифенил)-1-пиперазинил]фенил]-3(2H,4H)-1,2,4-триазолона, полученного по методу, описанному в Journal Medicinal Chemistry, vol.27, p. 894 (1984), получают 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил] -4-[4-[4-(4-метоксифенил)-1-пиперазинил] фенил] -3(2H, 4H)- 1,2,4-триазолон (373 мг) в виде бесцветных призм. Т.пл. 175-176oC.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7,2 Hz), 2,88 (1H, d, J = 4,8 Hz), 3,16 (1H, d, J = 4,8 Hz), 3,17-3,30 (8H, m), 3,79 (3H, s), 4,96 (1H, q, J = 7,2 Hz), 6,73-6,96 (2H, m), 6,87 (2H, d, J = 9,2 Hz), 6,96 (2H, d, J = 9,2 Hz), 7,01 (2H, d, J = 8,8 Hz), 7,34 (2H, d, J = 8,8 Hz), 7,24-7,41 (1H, m), 7,58 (1H, s).
Вычислено, %: C 65,28; H 5,48; N 13,13.
C29H29F2N5O3.
Найдено, %: C 65,30; H 5,50; N 13,03.
Ссылочный пример 24. Тем же методом, что и в ссылочном примере 5 исходя из 1,2 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,1 г 4-(3-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-(3-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолон (0,85 г) в виде бесцветного порошка.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7 Hz), 2,89 (1H, d, J = 4,6 Hz), 3,16 (1H, d, J = 4,6 Hz), 4,95 (1H, q, J = 7Hz), 6,75-6,90 (3H, m), 7,28-7,45 (2H, m), 7,73 (1H, s), 7,71-7,82 (2H, m).
Ссылочный пример 25. Тем же методом, что и в ссылочном примере 5 исходя из 1,43 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,03 г 1-(4-фторфенил)-5(1H, 4H)-тетразолона получают 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]-4-(4-фторфенил)- 5(1H,4H)-тетразолон (1,22 г) и 205 г (2R)-2-(2,4-дифторфенил)-2-[(1R)- 1-[1-(4-фторфенил)-1H-тетразол-5-илокси]этил]оксирана.
1-(1R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил- 4-(4-фторфенил)-5(1H,4H)-тетразолон, бесцветное масло.
1H-NMR (CDCl3) δ : 1,60 (3H, d, J = 7,2 Hz), 2,93 (1H, d, J = 4,4 Hz), 3,17 (1H, d, J = 4,4 Hz), 4,93 (1H, q, J = 7,2 Hz), 6,75-6,92 (2H, m), 7,10-7,40 (3H, m), 7,82-7,99 (2H, m).
SIMS (m/z): 363 (M+H)+.
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-фторфенил)-1H-тетразол- 5-илокси]этил]оксиран, бесцветное масло.
1H-NMR (CDCl3) δ : 1,56 (3H, dd, J = 6,6, 1,6 Hz), 2,96 (1H, d, J = 4,6 Hz), 3,20 (1H, d, J = 4,6 Hz), 5,31 (1H, q, J = 6,6 Hz), 6,74-6,96 (2H, m), 7,23 (2H, t, J = 9 Hz), 7,30-7,49 (1H, m), 7,65 (2H, dd, J = 4,6 Hz).
SIMS (m/z): 363 (M+H)+.
Ссылочный пример 26. Тем же методом, что и в ссылочном примере 5 исходя из 1,42 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,92 г 4-(4-пиридил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]-4-(4-пиридил)- 3(2H,4H)-1,2,4-триазолон (0,66 г) в виде бесцветных призм. T. пл. 96-97oC.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 4,6 Hz), 3,15 (1H, d, J = 4,6 Hz), 4,93 (1H, q, J = 7 Hz), 6,72-6,91 (2H, m), 7,26-7,40 (1H, m), 7,62 (2H, dd, J = 4,8, 1,6 Hz), 7,83 (1H, s), 8,70 (2H, dd, J = 4,8, 1,6 Hz).
Вычислено, %: C 59,30; H 4,10; N 16,27.
C17H14F2N4O2.
Найдено, %: C 59,23; H 4,12; N 16,36.
Ссылочный пример 27. Тем же методом, что и в ссылочном примере 5 исходя из 536 мг (1S)-1-(2R)-2-(2,4-Дифторфенил)-2-оксиранил этанола и 305 мг 4-(4-пиримидинил)-3(2H, 4H)-1,2,4-триазолона получают 2-(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил-4-(4-пиримидинил)- 3(2H, 4H)-1,2,4-триазолон (199 мг) в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7,2 Hz), 2,90 (1H, d, J = 4,6 Hz), 3,16 (1H, d, J = 4,6 Hz), 4,90 (1H, q, J = 7,2 Hz), 6,72-6,90 (2H, m), 7,25-7,40 (1H, m), 8,34 (1H, dd, J = 5,6, 1,2 Hz), 8,46 (1H, s), 8,80 (1H, d, J = 5,6 Hz), 9,03 (1H, d, J = 1,2 Hz).
SIMS (m/z): 346 (M+H)+.
Ссылочный пример 28. Тем же методом, что и в основном примере 5 исходя из 1,36 г (1S)-1-(2R)-2-(2,4-Дифторфенил)-2-оксиранил этанола и 0,91 г 4-(2,2,2-трифторэтил)-3(2H,4H)-1,2,4-триазолона получают 2-(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил- 4-(2,2,2-трифторэтил)-3(2H, 4H)-1,2,4-триазолон (1,25 г) в виде бесцветного масла.
IRυ cm-1 (film): 1716, 1704, 1652, 1616, 1558, 1508.
1H-NMR (CDCl3) δ : 1,43 (3H, d, J = 7 Hz), 2,86 (1H, d, J = 4,6 Hz), 3,11 (1H, d, J = 4,6 Hz), 4,05-4,35 (2H, m), 4,87 (1H, q, J = 7 Hz), 6,70-6,90 (2H, m), 7,20-7,25 (1H, m), 7,46 (1H, s).
Ссылочный пример 29. Тем же методом, что и в ссылочном примере 5 исходя из 1,0 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,16 г 4-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H,4H)-1,2,4-триазолона получают 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H, 4H)-1,2,4-триазолон (1,34 г) в виде бесцветного масла.
IRυ cm-1 (film): 1716, 1705, 1616, 1558, 1516, 1257, 1108.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 4,8 Hz), 3,16 (1H, d, J = 4,8 Hz), 4,38 (2H, t, J = 11,8 Hz), 4,94 (1H, q, J = 7 Hz), 6,07 (1H, tt, J = 53 Hz, J = 4,8 Hz), 6,75-6,90 (2H, m), 6,95-7,12 (2H, m), 7,28-7,55 (3H, m), 7,63 (1H, s).
Ссылочный пример 30. Тем же методом, что и в ссылочном примере 5 исходя из 1,0 г (1S)-1-[(2R)-2-(2,4-дифтopфeнил)-2-oкcиpaнил]этанола и 1,1 г 4-(2-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-(2-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолон (0,4 г) в виде бесцветного порошка.
1H-NMR (CDCl3) δ : 1,48 (3H, d, J = 7,2 Hz), 2,91 (1H, d, J = 4,4 Hz), 3,19 (1H, d, J = 4,4 Hz), 4,97 (1H, q, J= 7,2 Hz), 6,75-6,90 (2H, m), 7,29-7,45 (3H, m), 7,56-7,84 (3H, m).
Ссылочный пример 31. Тем же методом, что и в ссылочном примере 5 исходя из 1,43 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,94 г 4-(4-изопропоксифенил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-(4-изопропоксифенил)-3(2H, 4H)-1,2,4-триазолон (0,84 г) в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,34 (6H, d, J = 6,2 Hz), 1,46 (3H, d, J = 7,2 Hz), 2,88 (1H, d, J = 4,6 Hz), 3,17 (1H, d, J = 4,6 Hz), 4,56 (1H, septet, J = 6,2 Hz), 4,96 (1H, q, J = 7,2 Hz), 6,72-6,91 (2H, m), 6,94 (2H, d, J = 8,4 Hz), 7,28-7,40 (1H, m), 7,34 (2H, d, J = 8,4 Hz), 7,58 (1H, s).
SIMS (m/z): 402 (M+H)+.
Ссылочный пример 32. Тем же методом, что и в ссылочном примере 5 исходя из 1,38 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,21 г 4-(3-метилбутил)-3(2H, 4H)-1,2,4-триазолона получают 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -4-(3-метилбутил)- 3(2H,4H)-1,2,4-триазолон (1,15 г) в виде бесцветного масла.
1H-NMR (CDCl3) δ : 0,94 (6H, dd, J = 6,2, 1,8 Hz), 1,41 (3H, d, J = 7,2 Hz), 1,40-1,70 (3H, m), 2,85 (1H, d, J = 4,6 Hz), 3,10 (1H, d, J = 4,6 Hz), 3,59 (2H, t, J = 6,2 Hz), 4,91 (1H, q, J = 7,2 Hz), 6,67-6,79 (2H, m), 7,33 (1H, s), 7,72-7,39 (1H, m).
SIMS (m/z): 338 (M+H)+.
Ссылочный пример 33. Тем же методом, что и в ссылочном примере 5 исходя из 1,0 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,11 г 4-[4-(1,1,2,2-тетрафторэтокси] -3(2H, 4H)-1,2,4-триазолона получают 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(1,1,2,2-тетрафторэтокси)фенил]-3(2H,4H)-1,2,4-триазолон (0,99 г) в виде бесцветного масла.
IRυ cm-1 (film): 1699, 1619, 1600, 1554, 1510, 1400.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7,2 Hz), 2,89 (1H, d, J = 4,6 Hz), 3,16 (1H, d, J = 4,6 Hz), 4,95 (1H, q, J = 7,2 Hz), 5,93 (1H, tt, J = 53 Hz, J = 2,8 Hz), 6,74-6,90 (2H, m), 7,25-7,45 (3H, m), 7,55 (2H, dt, J = 9 Hz, J = 2,2 Hz), 7,67 (1H, s).
Ссылочный пример 34. Тем же методом, что и в ссылочном примере 5 исходя из 1,34 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,15 г 2-(4-хлорфенил)-3(2H, 4H)-1,2,4-триазолона получают 2-(4-хлорфенил)-4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3(2H,4H)-1,2,4-триазолон (519 мг) и 424 мг (2R)-2-[(1R)-1-[1-(4-хлорфенил)- 1H-1,2,4-триазол-5-илокси]этил]-2-(2,4-дифторфенил)оксирана.
2-(4-Хлорфенил)-4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил]-3(2H,4H)-1,2,4-триазолон, бесцветные призмы. Т.пл. 172-173oC.
1H-NMR (CDCl3) δ : 1,42 (3H, d, J = 7,4 Hz), 2,73 (1H, d, J = 4,4 Hz), 2,77 (1H, d, J = 4,4 Hz), 5,00 (1H, q, J = 7,4 Hz), 6,81-6,99 (2H, m), 7,32-7,48 (1H, m), 7,39 (2H, d, J = 9 Hz), 7,60 (1H, s), 7,96 (2H, d, J = 9 Hz).
Вычислено, %: C 55,90; H 3,91; N 10,86.
C18H14ClF2N3O2•0,5H2O.
Найдено, %: C 56,20; H 3,69; N 10,93.
(2R)-2-[(1R)-1-[1-(4-Хлорфенил)-1H-1,2,4-триазол-5-илокси] этил] - 2-(2,4-дифторфенил)оксиран, в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,51 (3H, dd, J = 6,6, 1,6 Hz), 2,93 (1H, d, J = 4,6 Hz), 3,20 (1H, d, J = 4,6 Hz), 5,30 (1H, q, J = 6,6 Hz), 6,78-6,96 (2H, m), 7,31-7,46 (1H, m), 7,40 (2H, d, J = 9 Hz), 7,62 (2H, d, J = 9 Hz), 7,64 (1H, s).
SIMS (m/z): 378 (M+H)+.
Ссылочный пример 35. Таким же методом, что и в ссылочном примере 5 исходя из 1,53 г (1S)-1-[(2R)-2-(2,4-дифтopфeнил)-2-oкcиpaнил]этанола и 1,50 г 2-(4-трифторметоксифенил)-3(2H, 4H)-1,2,4-триазолона получают 4-[(1R,2S)-2-(2,4-дифтopфeнил)-2,3-эпoкcи-1-метилпропил]- 2-(4-трифторметоксифенил)-3(2H, 4H)-1,2,4-триазолон (829 мг) и 778 мг (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1-(4-трифторметоксифенил)-1H- 1,2,4-триазол-5-илокси]этил]оксирана.
4-[(R, 2S)-2-(2,4-Дифторфенил)-2,3-эпокси-1-метилпропил] - 2-(4-трифторметоксифенил)-3(2H,4 Н)-1,2,4-триазолон, бесцветные призмы. Т.пл. 116-117oC.
1H-NMR (CDCl3) δ : 1,43 (3H, d, J = 7,2 Hz), 2,74 (1H, d, J = 4 Hz), 2,77 (1H, d, J = 4 Hz), 5,01 (1H, q, J = 7,2 Hz), 6,80-7,00 (2H, m), 7,28 (2H, d, J = 9,2 Hz), 7,33-7,50 (1H, m), 7,61 (1H, s), 8,05 (2H, d, J = 9,2 Hz).
Вычислено, %: C 53,40; H 3,30; N 9,83.
C19H14F5N3O3.
Найдено, %: C 53,09; H 3,23; N 9,83.
(2R)-2-(2,4-Дифторфенил)-2-[(1R)-1-[1-(4-трифторметоксифенил)-1H- 1,2,4-триазол-5-илокси]этил]оксиран, бесцветное масло.
1H-NMR (CDCl3) δ : 1,51 (3H, d, J = 6,6 Hz), 2,94 (1H, d, J = 4,8 Hz), 3,20 (1H, d, J = 4,8 Hz), 5,31 (1H, q, J = 6,6 Hz), 6,78-6,98 (2H, m), 7,29 (2H, d, J = 9 Hz), 7,35-7,50 (1H, m), 7,65 (1H, s), 7,71 (2H, d, 9 Hz).
SIMS (m/z): 428 (M+H)+.
Ссылочный пример 36. Тем же методом, что и в ссылочном примере 5 исходя из 1,54 г (1S)-1-[(2R)-(2,4-дифторфенил)-2-оксиранил]этанола и 1,52 г 1-(4-трифторметоксифенил)-5(1H, 4H)-тетразолона получают 1,76 г 1-[(1R,2S)-2-(2,4-дифтopфeнил)-2,3-эпoкcи-1-мeтилпропил]- 4-(4-трифторметоксифенил)-5(1H, 4H)-тетразолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,60 (3H, d, J = 7,4 Hz), 2,93 (1H, d, J = 4,4 Hz), 3,17 (1H, d, J = 4,4 Hz), 4,93 (1H, q, J = 7,4 Hz) 6,75-6,96 (2H, m), 7,24-7,43 (1H, m), 7,35 (2H, d, J = 9,2 Hz), 8,00 (2H, d, J = 9,2 Hz).
IRυ
SIMS (m/z): 429 (M+H)+.
Ссылочный пример 37. Тем же методом, что и в ссылочном примере 5 исходя из 1,39 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,63 г 1-[4-(2,2,3,3-тетрафторпропокси)фенил] -5(1H, 4H)-тетразолона получают 1,27 г 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(2,2,3,3-тетрафторпропокси)фенил]-5(1H,4H)-тетразолона в виде бесцветного масла.
1H-MMR (CDCl3) δ : 1,60 (3H, d, J = 7,2 Hz), 2,93 (1H, d, J = 4,4 Hz), 3,17 (1H, d, J = 4,4 Hz), 4,40 (2H, t, J = 11,8 Hz), 4,93 (1H, q, J = 7,2 Hz), 6,08 (1H, tt, J = 53,2, 4,6 Hz), 6,73-6,94 (2H, m), 7,05 (2H, d, J = 9 Hz), 7,23-7,41 (1H, m), 7,86 (2H, d, J = 9 Hz).
IRυ
SIMS (m/z): 475 (M+H)+.
Ссылочный пример 38. Тем же методом, что и в ссылочном примере 5 исходя из 1,38 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,09 г 1-(4-хлорфенил)-5(1H, 4H)-тетразолона получают 1,27 г 1-(4-xлopфeнил)-4-[(1R, 2S)-2-(2,4-дифтopфeнил)-2,3-эпокси-1-метилпропил] - 5(1H, 4H)-тетразолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,60 (3H, d, J = 7,2 Hz), 2,92 (1H,d, J = 4,4 Hz), 3,16 (1H, d, J = 4,4 Hz), 4,92 (1H, q, J = 7,2 Hz), 6,75-6,96 (2H, m), 7,25-7,41 (1H, m), 7,45 (2H, d, J = 9 Hz), 7,90 (2H, d, J = 9 Hz).
IRυ
SIMS (m/z): 379 (M+H)+.
Ссылочный пример 39. Тем же методом, что и в ссылочном примере 5 исходя из 1,01 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,15 г 1-[4-(1,1,2,2-тетрафторэтокси)фенил] -2(1H, 3H)-имидазола получают 0,36 г 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3-[4-(1,1,2,2-тетрафторэтокси)фенил] -2(1H,3H)-имидазолона в виде бесцветных игл. Т.пл. 117-118oC.
1H-NMR (CDCl3) δ : 1,37 (3H, d, J = 7,2 Hz), 2,71 (1H, d, J = 5 Hz), 2,81 (1H, d, J = 5 Hz), 5,08 (1H, q, 7,2 Hz), 5,93 (1H, tt, J = 53, 2,8 Hz), 6,46 (1H, d, J = 3 Hz), 6,57 (1H, d, J=3 Hz), 6,80-6,95 (2H, m), 7,28 (2H, d, J = 9Hz), 7,36-7,48 (1H, m), 7,67 (2H, d, J = 9 Hz).
Ссылочный пример 40. Тем же методом, что и в ссылочном примере 5 исходя из 0,80 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,78 г 1-(4-хлорфенил)-2(1H, 3H)-имидазолона получают 0,18 г 1-(4-хлорфенил)-3-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпoкcи-1-мeтилпpoпил] - 2(1H, 3H)-имидaзoлoнa в виде бесцветного вязкого масла.
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7 Hz), 2,70 (1H, d, J = 5 Hz), 2,80 (1H, d, J = 5 Hz), 5,07 (1H, q, J = 7 Hz), 6,45 (1H, d, J = 3,2 Hz), 6,55 (1H, d, J = 3,2 Hz), 6,79-6,94 (2H, m), 7,34-7,46 (1H, m), 7,38 (2H, d, J = 9 Hz), 7,59 (2H, d, J = 9 Hz).
Ссылочный пример 41. Тем же методом, что и в ссылочном примере 5 исходя из 0,66 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 0,65 г 4-(4-хлорфенил)-3-(2H, 4H)-1,2,4-триазолона получают 0,23 г 4-(4-хлорфенил)-2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3(2H,4H)-1,2,4-триазолона в виде бесцветного вязкого масла.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 5 Hz), 3,15 (1H, d, J = 5 Hz), 4,94 (1H, q, J = 7 Hz), 6,76-6,88 (2H, m), 7,26-7,50 (1H, m), 7,46 (4H, s), 7,66 (1H, s).
Ссылочный пример 42. Тем же методом, что и в ссылочном примере 5 исходя из 0,83 г (1S)-1-1(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,56 г 1-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] -2-(1H, 3H)-имидазолона получают 0,30 г 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] -2(1H, 3H)-имидазолона в виде бесцветного вязкого масла.
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7,2 Hz), 2,70 (1H, d, J = 4,8 Hz), 2,80 (1H, d, J = 4,8 Hz), 4,48 (2H, t, J = 13 Hz), 5,07 (1H, q, J = 7,2 Hz), 6,09 (1H, tt, J = 52, 5,6 Hz), 6,43 (1H, d, J = 3,2 Hz), 6,51 (1H, d, J = 3,2 Hz), 6,79-6,96 (2H, m), 7,00 (2H, d, J = 9 Hz), 7,34-7,47 (1H, m), 7,57 (2H, d, J = 9 Hz).
Ссылочный пример 43. Тем же методом, что и в ссылочном примере 5 исходя из 0,68 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 0,70 г 1-[4-(2,2,2-трифторэтокси)фенил] -2(1H,3H)-имидазолона получают 0,30 г 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 3-[4-(2,2,2-трифторэтокси)фенил]-2(1H,3H)-имидазолона в виде бесцветных призм.
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7,2 Hz), 2,71 (1H, d, J = 4,8 Hz), 2,81 (1H, d, J = 4,8 Hz), 4,37 (2H, q, J = 8 Hz), *) 6,52 (1H, d, J = 3,2 Hz), 6,43 (1H, q, J = 3,2 Hz), 6,80-6,95 (2H, m), 7,00 (2H, d, J = 9,2 Hz), 7,35-7,48 (1H, m), 7,57 (2H, d, J = 9,2 Hz). *) 5,07 (1H, q, J = 7,2 Hz).
Ссылочный пример 44. Тем же методом, что и в ссылочном примере 5 исходя из 1,0 г (1S)-1-[(2R)-2-(2,4-Дифторфенил)-2-оксиранил]этанола и 1,23 г 1-[4-(2,2,3,3,3-пентафторпропокси)фенил] -2(1H,3H)-имидазолона получают 0,43 г 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]- 3-[4-(2,2,3,3,3-пентафторпропокси)фенил]-2(1H,3H)-имидазолона в виде бесцветных пластинок.
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7,2 Hz), 2,71 (1H, d, J = 4,8 Hz), 2,81 (1H, d, J = 4,8 Hz), 4,44 (2H, t, J = 12 Hz), 5,08 (1H, q, J = 7,2 Hz), 6,44 (1H, d, J = 3,2 Hz), 6,52 (1H, d, J = 3,2 Hz), 6,78-6,95 (2H, m), 7,00 (2H, d, J = 9,2 Hz), 7,35-7,48 (1H, m), 7,57 (2H, d, J = 9,2 Hz).
Ссылочный пример 45. Тем же методом, что и в ссылочном примере 5 исходя из 0,73 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,73 г 4-[4-(2,2,2-трифторэтокси)фенил] -3(2H, 4H)-1,2,4-триазолона получают 0,74 г 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(2,2,2-трифторэтокси)фенил]-3(2H,4H)-1,2,4-триазолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 4,6 Hz), 3,15 (1H, d, J = 4,6 Hz), 4,38 (2H, q, J = 8 Hz), 4,94 (1H, q, J = 7 Hz), 6,74-6,90 (2H, m), 7,02 (2H, d, J = 9,2 Hz), 7,36-7,50 (1H, m), 7,44 (2H, d, J = 9,2 Hz), 7,62 (1H, s).
Ссылочный пример 46. Тем же методом, что и в ссылочном примере 5 исходя из 0,94 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,16 г 4-[4-(2,2,3,3,3-пентафторпропокси)фенил] -3(2H, 4H)-1,2,4-триазолона получают 0,68 г 2-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 4-[4-(2,2,3,3,3-пентафторпропокси)фенил] -3(2H, 4H)-1,2,4-триазолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 4,6 Hz), 3,15 (1H, d, J = 4,6 Hz), 4,44 (2H, t, J = 12 Hz), 4,94 (1H, q, J = 7 Hz), 6,72-6,92 (2H, m), 7,02 (2H, dt, J = 9,2 Hz, J = 2,2 Hz), 7,30-7,50 (1H, m), 7,44 (2H, dt, J = 9,2 Hz, J = 2,2 Hz), 7,62 (1H, s).
Ссылочный пример 47. Тем же методом, что и в ссылочном примере 5 исходя из 0,70 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,17 г 4-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил]-3(2H,4H)- 1,2,4-триазолона получают 0,18 г 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил]-4-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] -3(2H, 4H)- 1,2,4-триазолона в виде бесцветного вязкого масла.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7 Hz), 2,88 (1H, d, J = 5 Hz), 3,16 (1H, d, J = 5 Hz), 4,49 (2H, t, J = 13 Hz), 4,95 (1H, q, J = 7 Hz), 6,10 (1H, tt, J = 52, 5,4 Hz), 6,75-6,90 (2H, m), 7,04 (2H, d, J = 9,0 Hz), 7,25-7,42 (1H, m), 7,45 (2H, d, J = 9,0 Hz), 7,62 (1H, s).
Ссылочный пример 48. Тем же методом, что и в ссылочном примере 5 исходя из 0,971 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,0 г 2-[4-(2,2,2-трифторэтокси)фенил] -3(2H, 4H)-1,2,4-триазолона получают 0,825 г 4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 2-[4-(2,2,2-тpифтopэтoкcи)фeнил] -3-(2H,4H)-1,2,4-триазолона в виде бесцветных призм. T. пл. 118-119oC.
1H-NMR (CDCl3) δ : 1,42 (3H, d, J = 7,2 Hz), 2,73 (1H,d, J = 4,2 Hz), 2,77 (1H, d, J = 4,2 Hz), 4,37 (2H, q, J = 8,2 Hz), 5,00 (1H, q, J = 7,2 Hz), 6,81-7,02 (2H, m), 7,00 (2H, d, J = 9,2 Hz), 7,31-7,50 (1H, m), 7,59 (1H, s), 7,93 (2H, d, J = 9,2 Hz).
Ссылочный пример 49. Тем же методом, что и в ссылочном примере 5 исходя из 0,98 г (1S)-1-[(2R)-2-(2,4-дифтopфeнил)-2-oкcиpaнил]этанола и 1,04 г 2-[4-(2,2,3,3,3-пентафторпропокси)фенил] -3(2H, 4H)- 1,2,4-триазолона получают 0,882 г 4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил]-2-[4-(2,2,3,3,3-пентафторпропокси)фенил] -3(2H, 4H)- 1,2,4-триазолона в виде бесцветных призм. Т.пл. 128-129oC.
1H-NMR (CDCl3) δ : 1,43 (3H, d, J = 7,2 Hz), 2,73 (1H, d, J = 4,2 Hz), 2,77 (1H, d, J = 4,2 Hz), 4,44 (2H, t, J = 12,2 Hz), 5,01 (1H, q, J = 7,2 Hz), 6,80-7,01 (2H, m), 7,01 (2H, d, J = 9,2 Hz), 7,32-7,49 (1H, m), 7,59 (1H, s), 7,94 (2H, d, J = 9,2 Hz).
Ссылочный пример 50. Тем же методом, что и в ссылочном примере 5 исходя из 345 мг (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 410 мг 2-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] -3-(2H, 4H)- 1,2,4-триазолона получают 371 мг 4-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил]-2-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] -3(2H, 4H)- 1,2,4-триазолона в виде бесцветных призм.
1H-NMR (CDCl3) δ : 1,42 (3H, d, J = 7 Hz), 2,73 (1H, d, J = 4,2 Hz), 2,77 (1H, d, J = 4,2 Hz), 4,49 (2H, t, J = 13 Hz), 5,00 (1H, d, J = 7 Hz), 6,12 (1H, tt, J = 52, 5,4 Hz), 6,80-7,01 (2H, m), 7,01 (2H, d, J = 9,2 Hz), 7,30-7,50 (1H, m), 7,59 (1H, s), 7,94 (2H, d, J = 9,2 Hz).
Ссылочный пример 51. Тем же методом, что и в ссылочном примере 5 исходя из 0,975 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил] этанола и 1,13 г 2-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H, 4H)-1,2,4-триазолона получают 0,847 г 4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 2-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H, 4H)-триазолона в виде бесцветных призм. Т.пл. 116-117oC.
1H-NMR (CDCl3) δ : 1,42 (3H, d, J = 7,2 Hz), 2,73 (1H,d, J = 4,2 Hz), 2,77 (1H, d, J = 4,2 Hz), 4,37 (2H, tt, J = 11,8, 1,6 Hz), 5,00 (1H, q, J = 7,2 Hz), 6,08 (1H, tt, J = 53, 5Hz), 6,79-7,04 (2H, m), 6,99 (2H, d, J = 9,4 Hz), 7,32-7,49 (1H,m), 7,59 (1H, s), 7,93 (2H, d, J = 9,4 Hz).
Ссылочный пример 52. Тем же методом, что и в ссылочном примере 5 исходя из 1,15 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 1,27 г 2-[4-(1,1,2,2-тетрафторэтокси)фенил]-3(2H,4H)-1,2,4-триазолона получают 1,20 г 4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпoкcи-1-мeтилпpoпил] - 2-[4-1,1,2,2-тeтpaфтopэтoкcи)фенил] -3(2H, 4H)-1,2,4-триазолона в виде бесцветных игл. Т. пл. 105-106oC.
1H-NMR (CDCl3) δ : 1,43 (3H, d, J = 7,2 Hz), 2,74 (1H, d, J = 4,4 Hz), 2,77 (1H, d, J = 4,4 Hz), 5,01 (1H, q, J = 7,2 Hz), 5,92 (1H, tt, J = 53, 2,8 Hz), 6,81-7,01 (2H, m), 7,28 (2H, d, J = 9,2 Hz), 7,30-7,49 (1H, m), 7,61 (1H, s), 8,04 (2H, d, J = 9,2 Hz).
Ссылочный пример 53. 2,4-Дифторанилин (25 г) и 25,2 г пиридина растворяют в 200 мл дихлорметана, к которому добавляют по каплям при охлаждении льдом 33,3 г фенил хлорформиата. После перемешивания при ледяном охлаждении в течение 30 мин реакционный раствор промывают водой и далее высушивают упариванием растворителя с получением смеси фенил 2,4-дифторфенилкарбамата и пиридина. К смеси добавляют 30,7 г 2-(диэтокси)этиламина и смесь перемешивают при комнатной температуре. Кристаллы отделяют фильтрацией и промывают петролейным эфиром с получением 37,8 г N-(2,2-диэтоксиэтил)-N'-(2,4-дифторфенил)мочевины в виде бесцветных кристаллов.
Эту мочевину (37,5 г) растворяют в смеси 560 мл метанола и 280 мл воды, затем добавляют 0,48 M соляную кислоту и полученную смесь перемешивают три дня при комнатной температуре. Реакционный раствор концентрируют при пониженном давлении. Отделенные кристаллы промывают смесью воды и метанола (5:1) с получением 22,8 г 1-(2,4-дифторфенил)-2(1H,3H)-имидазолона в виде бесцветного порошка. Т.пл. 192-194oC.
Вычислено, %: C 55,11; H 3,08; N 14,28.
C9H6F2N2O.
Найдено, %: C 55,14; H 3,29; N 14,18.
Ссылочные примеры 54-63. Производные имидазолона, представленные в табл. 1 и 2, были получены тем же способом, что и по ссылочному примеру 53.
Ссылочный пример 64
К диэтилацеталю аминоацетальдегида (7,8 мл, 53,6 ммоль) прибавляют по каплям 10 г (53,4 ммоль) 4-трифторметилфенилизоцианата при 0oC в течение 5 мин. Реакционный раствор перемешивают 1 ч при комнатной температуре. Кристаллы, полученные при этом, собирают фильтрованием и промывают гексаном с получением 16,2 г 1-(2,2-диэтоксиэтил)-3-(4- трифторметилфенил)мочевины (95%) в виде бесцветного порошка.
1-(2,2-Диэтоксиэтил)-3-(4-трифторметилфенил)мочевину (9,2 г, 28,7 ммоль) растворяют в смеси 113 мл метанола и 57 мл воды. К реакционному раствору добавляют 67,5 мл 0,48 н. соляной кислоты и смесь перемешивают 48 ч при комнатной температуре. К реакционному раствору добавляют гидроксид натрия до достижения pH 7 с последующим концентрированием при пониженном давлении. Остаток экстрагируют этилацетатом (100 мл х 4). Экстракты объединяют, промывают водой и насыщенным водным раствором хлорида натрия, высушивают над сульфатом магния и отгоняют растворитель. Полученные кристаллы перекристаллизовывают из этилацетата-диизопропилэтилового эфира с получением 4,87 г 1-(4-трифторметилфенил)-2(1H, 3H)-имидазолона (74%) в виде бесцветных призм. Т.пл. 170-171oC.
Ссылочный пример 65.
4-Трифторметоксианилин (20 г) и 9,8 г пиридина растворяют в 150 мл этилацетата и при охлаждении льдом добавляют 19,5 г фенил хлорформиата. После перемешивания в течение 15 мин с ледяным охлаждением реакционный раствор промывают водой, высушивают и отгоняют растворитель при пониженном давлении. Отделенные кристаллы промывают гексаном с получением 34,1 г фенил 4-трифторметоксикарбамата в виде бесцветных кристаллов.
Этот карбамат (15 г) и 6 мл гидразингидрата перемешивают в 50 мл этанола в течение 2 ч. Реакционный раствор концентрируют при пониженном давлении и остаток промывают холодным этилацетатом с получением 11,7 г 4-(4-трифторметоксифенил) семикарбазида в виде бесцветных кристаллов.
После перемешивания 7,0 г этого семикарбазида и 15,5 г формамидинацетата в 150 мл диметилформамида при комнатной температуре в течение 30 мин, прибавляют 8,9 г уксусной кислоты, и смесь нагревают при 80oC в течение 6 ч. Растворитель удаляют отгонкой при пониженном давлении. К остатку добавляют этилацетат и насыщенный водный раствор хлорида натрия. Органический слой высушивают и концентрируют, и остаток перекристаллизовывают из этилацетата-гексана с получением 4-(4-трифторметоксифенил)-3(2H,4H)-1,2,4-триазолона в виде бесцветных кристаллов (3,44 г). Т.пл. 193-195oC.
1H-NMR (CDCl3) δ : 7,37 (2H, d, J = 9 Hz), 7,63 (2H, dt, J = 9 Hz, J = 2 Hz), 7,73 (1H, d, J = 1,4 Hz), 10,23 (1H,br).
Ссылочные примеры 66-84. Тем же способом, что и в ссылочном примере 65 были получены производные триазолона, представленные в табл. 3-5.
Ссылочный пример 85. K раствору 3-метилбутиламина (20 г, 229 моль) в 840 мл дихлорметана при 0oC добавляют 35,6 мл триэтиламина (255 моль) и 28,8 мл фенилхлорформиата (230 ммоль). Смесь перемешивают 3 ч при комнатной температуре. После отгонки растворителя при пониженном давлении к остатку прибавляют 200 мл этилацетата и 200 мл воды. Органические слои отделяют, а водный слой экстрагируют с этилацетатом (100 мл x 3). Органические слои объединяют, промывают водой и насыщенным раствором хлорида натрия и высушивают над сульфатом магния. Растворитель упаривают, кристаллы отделяют фильтрацией и промывают петролейным эфиром с получением 39,5 г фенил 3-метилбутилкарбамата (83%) в виде бесцветных кристаллов.
К раствору 3-метилбутилкарбамата (18,5 г, 8,9 ммоль) в 210 мл диоксана добавляют 22 мл гидразингидрата и смесь кипятят с обратным холодильником в течение 3 ч. После охлаждения растворитель упаривают при пониженном давлении. Остаток растворяют в 200 мл этилацетата. К раствору добавляют раствор 4 н. соляная кислота - этилацетат (22 мл) и смесь перемешивают в течение 1 ч при комнатной температуре. Осадок собирают фильтрацией, промывают этилацетатом (50 мл x 2) и сушат с получением 14,8 г 4-(3-метилбутил)семикарбазид гидрохлорид (91%) в виде белого порошка.
Смесь 13,0 г 4-(3-метилбутил)семикарбазида гидрохлорида (71,6 ммоль) и 60 мл этилформиата перемешивают в течение 2 ч при 110oC. После охлаждения смесь подвергают хроматографии на колонке с силикагелем (элюент - этилацетат: гексан = 1: 2 - 2:1 - этилацетат δ этилацетат:метанол = 10:1). Нужные фракции концентрируют. Полученные таким образом кристаллы перекристаллизовывают из этилацетата - петролейного эфира с получением 7,0 г 4-(3-метилбутил)-3(2H,4H)-1,2,4-триазолона (63%) в виде бесцветных игл. Т.пл. 78-79oC.
1H-NMR (CDCl3) _→: 0,96 (6H, d, J = 6,4 Hz), 1,53-1,72 (3Н, m), 3,66 (2H, t, J = 7,4 Hz), 7,39 (1H, s).
Вычислено, %: C 54,17; H 8,44; N 27,07.
C7H13N3O.
Найдено, %: C 54,14; H 8,47; N 27,14.
Ссылочный пример 86. К смеси 5,0 г 4-(трифторметил)фенилгидразина (28,4 ммоль), 31 мл воды и 3,1 мл концентрированной соляной кислоты добавляют 2,9 г гидрата глиоциловой кислоты (31,4 ммоль), и смесь перемешивают в течение 1 ч при комнатной температуре. Полученный таким образом осадок отделяют и собирают фильтрованием, промывают водой и высушивают над пятиокисью фосфора с получением 6,26 г 4-(трифторметил)фенилгидразонуксусной кислоты (95%) в виде бледно-желтого порошка.
4-(трифторметил)фенилгидразонуксусную кислоту (6,26 г, 27 ммоль) суспендируют в 176 мл толуола и добавляют 4,0 мл триэтиламина (28,7 ммоль) и 6,1 мл дифенилфосфорилазида (28,3 ммоль), и полученную смесь перемешивают в течение 1 ч при 120oC. После охлаждения реакционный раствор экстрагируют 200 мл водного раствора гидроксида калия (10%). Водный экстракт подкисляют концентрированной соляной кислотой до pH 1, полученные таким образом кристаллы отделяют, промывают водой и гексаном и высушивают над пятиокисью фосфора с получением 4,48 г 2-(4-трифторметилфенил)-3(2H,4H)-1,2,4-триазолона в виде бесцветного порошка. Т.пл. 221oC.
Ссылочные примеры 87-94.
Тем же способом, что и в ссылочном примере 86, были получены производные триазолона, представленные в табл. 6.
Ссылочный пример 95.
Тем же способом, что и в ссылочном примере 64, был получен 1-(4-фторфенил)-2(1H,3H)-имидазолон. Т.пл. 166-167oC.
Ссылочный пример 96. К 4-трифторметилфенил изоцианату (2,89 мл, 20,2 ммоль) добавляют 5,36 мл азидотриметилсилан (39,9 ммоль) и смесь перемешивают при 110oC в течение 24 ч. После охлаждения смесь подвергают хроматографии на колонке с силикагелем (элюент - этилацетат:гексан = 1:1 - 2:1 δ этилацетат) с отбором нужной фракции, которую концентрируют. Полученные кристаллы перекристаллизовывают из этилацетата - гексана с получением 3,64 г 1-(4-трифторметилфенил)-5(1H, 4H)-тетразолона (78%) в виде бесцветных игл. Т.пл. 191-192oC.
Ссылочные примеры 97-104. Тем же способом, что и в ссылочном примере 96 были получены производные триазолона, представленные в табл. 7.
Ссылочный пример 105. 1-[4-(1,1,2,2-Тетрафторэтокси)фенил]семикарбазид (6,0 г) и 10,6 г гидрохлоридацетамидина растворяют в 100 мл диметилформамида. Раствор перемешивают 1 ч при комнатной температуре. После добавления 6,6 г уксусной кислоты реакционный раствор нагревают при 80oC в течение 7 ч и концентрируют при пониженном давлении. Остаток растворяют в смеси 200 мл этилацетата и 40 мл воды. Отделенный органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат и отгоняют растворитель. Остаток перекристаллизовывают из этилацетата с получением 3,6 г 5-метил-4-[4- (1,1,2,2-тетрафторэтокси)фенил] -3(2H,4H)-1,2,4-триазолона в виде бесцветных игл. T.пл. 204-205oC.
1H-NMR (DMSO-d6) _→: 2,08 (3H, s), 6,84 (1H, tt, J = 51,8 Hz, J = 3,2 Hz), 7,43 (2H, d, J = 8,8 Hz), 7,55 (2H, d, J = 8,8 Hz), 11,57 (1H, s).
Ссылочный пример 106. Тем же методом, что и в ссылочном примере 105, получают 5-метил-4-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H, 4H)- 1,2,4-триазолона. Т.пл. 206-207oC.
Ссылочный пример 107. 4-Хлорфенилгидразин гидрохлорид (5,0 г) и 3,4 г ацетата натрия растворяют в смеси 50 мл воды и 25 мл этанола, к которой по каплям прибавляют 1,69 г 80%-ного водного раствора ацетальдегида, полученную смесь перемешивают при комнатной температуре 30 мин. После добавления 50 мл воды реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором хлорида натрия, высушивают и отгоняют растворитель с получением ацетальдегида 4-хлорфенилгидразона в виде масла.
Гидразон растворяют в 15 мл уксусной кислоты, добавляют 1,82 г водной суспензии цианата натрия, смесь перемешивают 1 ч при комнатной температуре. Выпавшие кристаллы собирают фильтрованием и промывают водой с получением 4,8 г 2-(4-хлорфенил)-5-метил-1,2,4-триазолизин-3-она в виде красно-коричневого порошка.
Смесь 1,0 г 2-(4-хлорфенил)-5-метил-1,2,4-триазолизин-3-она, 50%-ного водного раствора 2,28 г гидроксида натрия и 0,11 г трибутиламмонийбромида в 25 мл толуола перемешивают 4 ч при 60oC. После охлаждения реакционную смесь разбавляют 25 мл воды. Водный слой отделяют подкислением концентрированной HCl. Выпавшие кристаллы собирают фильтрацией и перекристаллизовывают из этилацетата-диизопропилового эфира с получением 0,56 г 2-(4-хлорфенил)-5-метил-3(2H,-4H)-1,2,4-триазолона в виде бесцветных игл. Т.пл. 218-219oC.
1H-NMR (CDCl3) δ : 2,34 (3H, s), 7,40 (2H, tt, J = 9,2 Hz, J = 2,2 Hz), 7,91 (2H, tt, J = 9,2 Hz, J = 2,2 Hz), 11,65 (1H, br).
Ссылочный пример 108. Тем же методом, что и в ссылочном примере 107 получают 5-метил-2-(4-трифторметоксифeнил)-3(2H, 4H)-1,2,4-триазолон. Т.пл. 213-214oC.
Ссылочный пример 109. Тем же методом, что и в ссылочном примере 5 исходя из 0,44 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,48 г 1-[4-[4-[4-(2,2,3,3-тетрафторпропокси)фенил] -1-пиперазинил]фенил]- 2(1H,3H)-имидазолона получают 0,11 г 1-[(1R,2S)-2-(2,4-дифторфенил)- 2,3-эпокси-1-метилпропил] -3-[4-[4-[4-(2,2,3,3-тетрафторпропокси)фенил] - 1-пипepaзинил] фенил]-2(1H,3H)-имидaзoлoнa в виде бесцветного порошка,
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7,2 Hz), 2,70 (1H, d, J = 4,8 Hz), 2,81 (1H, d, J = 4,8 Hz), 3,22-3,40 (8H, m), 4,31 (2H, t, J = 12 Hz), 5,07 (1H, q, J = 7,2 Hz), 6,07 (1H, tt, J = 53, 5,2 Hz), 6,40 (1H, d, J = 3,2 Hz), 6,50 (1H, d, J = 3,2 Hz), 6,70-7,03 (8H, m), 7,22-7,51 (3H, m).
Ссылочный пример 110. Тем же методом, что и в ссылочном примере 5 исходя из 0,31 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,50 г 4-[4-[4-[4-(2,2,3,3-тетрафторпропокси)фенил] -1-пиперазинил]фенил]- 3(2H,4H)-1,2,4-триазолон получают 0,15 г 2-[(1R,2S)-2-(2,4-дифторфенил)- 2,3-эпокси-1-метилпропил] -4-[4-[4-[4-(2,2,3,3-тетрафторпропокси)фенил] - 1-пиперазинил]фенил]-3(2H,4H)-триазолона в виде бесцветного порошка.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7,0 Hz), 2,88 (1H, d, J = 5 Hz), 3,16 (1H, d, J = 5 Hz), 3,22-3,39 (8H, m), 4,31 (2H, t, J = 12,2 Hz), 4,96 (1H, q, J = 7,0 Hz), 6,07 (1H, tt, J = 53, 5,0 Hz), 6,75-7,03 (8Н, m), 7,23-7,40 (3H, m), 7,59 (1H, s).
Ссылочный пример 111. Тем же методом, что и в ссылочном примере 5 исходя из 0,35 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,31 г 1-[4-(2,2,2-трифторэтокси)фенил]-5(1H,4H)-1,2,4-тетразолона получают смесь (3: 2, 0,22 г) 1-[(1R,2S)-2- (2,4-дифторфенил)-2, 3-эпокси-1-метилпропил]-4-[4-(2,2,2-трифторэтокси)фенил] -5(1H, 4H)- 1,2,4-тетразолона и (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1-[4-(2,2,2- трифторэтокси)фенил] -1H-тетразол-5-илокси]этил]оксирана в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,55 (d, J = 7 Hz), 1,60 (d, J = 8Hz), 2,93 (d, J = 4,5 Hz), 2,96 (d, J = 4,8 Hz), 3,17 (d, J = 4,5 Hz), 3,20 (d, J = 4,8 Hz), 4,40 (q, J = 8 Hz), 4,44 (q, J = 8 Hz), 4,93 (q, J = 8 Hz), 5,31 (q, J = 7 Hz), 6,77-6,95 (m), 7,06 (d, J = 9,2 Hz), 7,09 (d, J = 9,2 Hz), 7,27-7,45 (m), 7,61 (d, J = 9,2 Hz), 7,86 (d, J = 9,2 Hz).
Ссылочный пример 112. Тем же методом, что и в ссылочном примере 5 исходя из 1,049 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил] этанола и 1,17 г 1-[4-(1,1,2,2-тетрафторэтокси)фенил] -5(1H, 4H)-тетразолона получают 1,28 г 1-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]- 4-[4-(1,1,2,2-тетрафторэтокси)фенил]-5(1H,4H)тетразолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,61 (3H, d, J = 7 Hz), 2,93 (1H, d, J = 4,4 Hz), 3,17 (1H, d, J = 4,4 Hz), 4,93 (1H, q, J = 7 Hz), 5,94 (1H, tt, J = 52,8, 2,6 Hz), 6,75-6,94 (2H, m), 7,24-7,40 (1H, m), 7,34 (2H, d, J = 9 Hz), 7,98 (2H, d, J = 9 Hz).
IRυ
Ссылочный пример 113. Тем же методом, что и в ссылочном примере 5 исходя из 0,962 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил] этанола и 1,19 г 1-[4-(2,2,3,3,3-пентафторпропокси)фенил] -5(1H,4H)-тетразолона получают 1,31 г 1-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил]- 4-[4-(2,2,3,3,3-пентафторпропокси)фенил] -5(1H,4H)-тетразолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,60 (3H, d, J = 7 Hz), 2,92 (1H, d, J = 4,4 Hz), 3,16 (1H, d, J = 4,4 Hz), 4,46 (2H, dt, J = 12, 1 Hz), 4,92 (1H, q, J = 7 Hz), 6,75-6,93 (2H, m), 7,05 (2H, d, J = 9,2 Hz), 7,20-7,38 (1H, m), 7,86 (2H, d, J = 7 Hz).
IRυ
Ссылочный пример 114. Тем же методом, что и в ссылочном примере 5 исходя из 0,988 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил] этанола и 1,55 г 1-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] -5(1H, 4H)тетразолона получили смесь (7: 3, 1,72 г) 1-[(1R,2S)-2-(2,4-дифторфeнил)-2,3-эпокси- 1-метилпропил] -4-[4-(2,2,3,3,-4,4,5,5-октафторпентокси)фенил]-5(1H,4H)- тетразолина и (2R)-2-(2,4-дифторфенил)-2-[(1R)-1-[1-[4-(2,2,3,3,4,4,5,5- октафтopпeнтoкcи)фенил]-1H-тeтpaэoл-5-илoкcи]этил]оксирана в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,55 (dd, J = 6,6, 1,5 Hz), 1,60 (d, J = 7,2 Hz), 2,93 (d, J = 4,5 Hz), 2,95 (d, J = 4,8 Hz), 3,17 (d, J = 4,5 Hz), 3,20 (d, J = 4,8 Hz), 4,51 (t, J = 12,9 Hz), 4,55 (t, J = 12,8 Hz), 4,93 (q, J = 7,2 Hz), 5,31 (q, J = 7,2 Hz), 6,10 (tt, J = 52, 5,5 Hz), 6,11 (tt, J = 52, 5,3 Hz), 6,74-6,94 (m), 7,06 (d, J = 9 Hz), 7,09 (d, J = 9 Hz), 7,28-7,45 (m), 7,61 (d, J = 9 Hz), 7,86 (d, J = 9 Hz).
Ссылочный пример 115. Тем же методом, что и в ссылочном примере 5 исходя из 0,50 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,61 г 5-метил-4-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H,4H)-1,2,4- триазолона получают 0,45 г 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил]-5-метил-4-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H, 4H)- 1,2,4-триазолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,44 (3H, d, J = 7,2 Hz), 2,11 (3H, s), 2,87 (1H, d, J = 4,8 Hz), 3,17 (1H, d, J = 4,8 Hz), 4,38 (2H, t, J = 11,8 Hz), 4,94 (1H, q, J = 7,2 Hz), 6,06 (1H, tt, J = 53 Hz, J = 4,7 Hz), 6,74-6,90 (2H, m), 7,02 (2H, dt, J = 9,2 Hz, J = 2,6 Hz), 7,18 (2H, dt, J = 9,2 Hz, J = 2,6 Hz), 7,28-7,43 (1H, m).
Ссылочный пример 116. Тем же методом, что и в ссылочном примере 5 исходя из 0,50 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,58 г 5-метил-4-[4-(1,1,2,2-тетрафторэтокси)фенил] -3(2H, 4H)- 1,2,4-триазолона получают 0,46 г 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси- 1-метилпропил]-5-метил-4-[4-(1,1,2,2-тетрафторэтокси)фенил]-3(2H,4H)- 1,2,4-триазолона в виде бесцветного масла.
1H-NMR (CDCl3) δ: 1,45 (3H, d, J = 7 Hz), 2,15 (3H, s), 2,87 (1H, d, J = 4,6 Hz), 3,18 (1H, d, J = 4,6 Hz), 4,94 (1H, q, J = 7 Hz), 5,94 (1H, tt, J = 2,6 Hz), 6,74-6,90 (2H, m), 7,25-7,42 (5H, m).
Ссылочный пример 117. Тем же методом, что и в ссылочном примере 5 исходя из 0,70 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,62 г 2-(4-хлорфенил)-5-метил-3(2H, 4H)-1,2,4-триазолона получают 0,28 г 2-(4-хлорфенил)-4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпoкcи- 1-мeтилпpoпил]-5-мeтил-3(2H,4 Н)-1,2,4-триазолона в виде бесцветного масла.
1H-NMR (CDCl3) δ : 1,55 (3H, d, J = 7,2 Hz), 2,24 (3H, s), 2,94 (1H, d, J = 4,2 Hz), 3,16 (1H, d, J = 4,2 Hz), 4,81 (1H, q, J = 7,2 Hz), 6,78-6,93 (2H, m), 7,30-7,46 (1H, m), 7,36 (2H, d, J = 9 Hz), 7,90 (2H, d, J = 9Hz).
Ссылочный пример 118. Тем же методом, что и в ссылочном примере 5 исходя из 0,50 г (1S)-1-[(2R)-2-(2,4-дифторфенил)-2-оксиранил]этанола и 0,52 г 5-метил-2-(4-трифторметоксифенил)-3(2H, 4H)-1,2,4-триазолона получают 0,13 г 4-[(1R, 2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] - 5-метил-2-(4-трифторметоксифенил)-3(2H, 4H)-1,2,4-триазолона в виде бесцветного вязкого масла.
1H-NMR (CDCl3) δ : 1,55 (3H, d, J = 7 Hz), 2,24 (3H, s), 2,92 (1H, d, J = 4 Hz), 3,16 (1H, d, J = 4 Hz), 4,81 (1H, q, J = 7 Hz), 6,78-6,91 (2H, m), 7,25 (2H, d, J = 9 Hz), 7,33-7,44 (1H, m), 7,97 (2H, d, J =9 Hz).
Рабочий пример 1. Смесь 300 мг (2R,3S)-2-(2,4-дифторфенил)-3-метил- 2-[(1H-1,2,4-тpиaзoл-1-ил)мeтил] oкcиpaнa и 2,77 г 1-фенил-2- триметилсилилоксиимидазола перемешивают в атмосфере аргона при 180oC в течение 4 ч. После охлаждения к реакционному раствору добавляют 50 мл хлороформа и 50 мл воды. Отделенный водный слой далее экстрагируют 10 мл хлороформа. Органические экстракты объединяют, промывают водой и насыщенным водным раствором хлорида натрия и сушат над сульфатом магния. Растворитель упаривают при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - этилацетат-гексан = от 1:2 до 1:1) с получением 16 г 1-[(1R,2S)-2-(2,4-дифторфенил)-1-метил-3-(1H-1,2,4-триазол-1-ил)- 2-триметилсилил-оксипропил]-3- фенил-2(1H,3H)- имидазолона.
1H-NMR (CDCl3) δ: 0,28 (9H, s), 1,09 (3H, d, J = 7 Hz), 4,35 (1H, d, J = 15 Hz), 5,06 (1H, q, J = 7 Hz), 5,28 (1H, dd, J = 15, 2 Hz), 6,62 (1H, d, J = 3,2 Hz), 6,71 (1H, d, J = 3,2 Hz), 6,75-6,91 (2H, m), 7,25-7,65 (6H, m), 7,67 (1H, s), 7,89 (1H, s).
К раствору 118 мг указанного соединения в 6 мл тетрагидрофурана добавляют 77 мг тригидратфторида тетрабутиламмония и смесь перемешивают при комнатной температуре 30 мин. Реакционный раствор концентрируют при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - этилацетат:гексан = от 1:1 до 21:1) с получением 83 г [1-[(1R,2S)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-тpиaзoл- 1-ил)пропил] -3-фенил-2(1H,3H)-имидазолона (Соединение 1) в виде желтого порошка.
1H-NMR (CDCl3) δ ; 1,21 (3H, d, J = 7 Hz), 4,20 (1H, d, J = 14,4 Hz), 4,95 (1H, q, J = 7 Hz), 5,11 (1H, d, J = 14,4 Hz), 5,64 (1H, s), 6,66 (1H, s, J = 3,2 Hz), 6,73 (1H, d, J = 3,2 Hz), 6,75-6,87 (2H, m), 7,40-7,69 (6H, m), 7,72 (1H, s), 7,86 (1H, s).
IRυ
SIMS (m/z): 412 (M+H)+.
Рабочий пример 2. 1-[(1R, 2S)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-3-(4-трифторметилфенил)-2(1H,3H)-имидазолон (соединение 2).
60%-ный гидрид натрия в масле (65 мг) диспергируют в 4 мл диметилформамида, к которому при охлаждении льдом добавляют 118 мг 1,2,4-триазола.
Смесь перемешивают при комнатной температуре в течение 10 мин. Добавляют раствор 1-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1- метилпропил]-3-(4-трифторметилфенил)-2(1H, 3H)-имидазолина, полученного, как указано в ссылочном примере 5, в 2 мл диметилформамида, и конечную смесь нагревают при 50oC в течение 5 ч.
После охлаждения реакционный раствор фракционируют путем добавления 8 мл холодной воды и 40 мл этилацетата, и отделенный водный слой дважды экстрагируют этилацетатом.
Этилацетатные экстракты объединяют, промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - этилацетат:гексан = от 1:1 до 2:1 до этилацетата) с получением 350 мг соединения 2 в виде белого порошка.
1H-NMR (CDCl3) δ : 1,21 (3H, d, J = 7,2 Hz), 4,19 (1H, d, J = 14,2 Hz), 5,00 (1H, q, J = 7,2 Hz), 5,11 (1H, d, J = 14,2 Hz), 5,46 (1H, s), 6,71 (1H, d, J = 3,2 Hz), 6,83 (1H, d, J = 3,2 Hz), 6,72-6,90 (2H, m), 7,40-7,56 (1H, m), 7,72 (2H, d, J = 8,4 Hz), 7,75 (1H, s), 7,83 (2H, d, J = 8,4 Hz), 7,84 (1H, s).
IRυ
Вычислено, %: C 55,12; H 3,78; N 14,61.
C22H18F5N5O2.
Найдено, %: C 54,81; H 3,97; N 14,39.
Рабочие примеры 3-19. Следующие соединения получают тем же способом, что и в рабочем примере 2.
Рабочий пример 3. 1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-3-метил-2(1H,3H)-имидазолон (соединение 3), бесцветное масло. Выход 88 мг (68%).
1H-NMR (CDCl3) δ : 1,19 (3H, d, J = 6,8 Hz), 3,45 (3H, s), 4,69 (1H, d, J = 14,4 Hz), 5,05 (1H, dd, J = 14,4, 1,4 Hz), 5,34 (1H, q, J = 6,8 Hz), 5,60 (1H, s), 6,55 (1H, d, J = 1,6 Hz), 6,64 (1H, d, J = 1,6 Hz), 6,70-6,88 (2H, m), 7,45-7,62 (1H, m), 7,70 (1H, s), 8,06 (1H, s).
IRυ
SIMS (m/z): 350 (M+H)+.
Рабочий пример 4. 1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-(4-фторфенил)-2(1H, 3H)-имидазолон (Соединение 4), бесцветный порошок. Выход 971 мг (74%).
1H-NMR (CDCl3) δ : 1,20 (3H, d, J = 7 Hz), 4,20 (1H, d, J = 14,2 Hz), 4,95 (1H, q, J = 7 Hz), 5,10 (1H, d, J = 14,2 Hz); 5,58 (1H, br), 6,60 (1H, d, J = 3,2 Hz), 6,74 (1H, d, J= 3,2 Hz), 6,70-6,88 (2H, m), 7,05-7,20 (2H, m), 7,40-7,65 (3H, m), 7,73 (1H, s), 7,85 (1H, s).
IRυ
SIMS (m/z): 430 (М+Н)+.
[α]
Рабочий пример 5. 1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-(2,4-дифторфенил)-2(1H, 3H)-имидазолон (соединение 5), бесцветный кристаллический порошок. Выход 416 мг (66%). Т. пл. 134-136oC.
1H-NMR (CDCl3) δ : 1,21 (3H, d, J = 7 Hz), 4,19 (1H, d, J = 14,4 Hz), 4,95 (1H, q, J = 7 Hz), 5,11 (1H, d, J = 14,4 Hz), 5,52 (1H, br), 6,52 (1H, t, J = 2,6 Hz), 6,70-6,86 (3H, m), 6,92-7,06 (2H, m), 7,40-7,68 (2H, m), 7,74 (1H,s), 7,85 (1H, s).
IRυ
Рабочий пример 6. 2-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-фторфенил)-3(2H, 4H)-1,2,4-триазолон (соединение 6), бесцветный порошок. Выход 532 мг (53%).
1H-NMR (CDCl3) δ : 1,30 (3H, d, J = 7 Hz), 4,36 (1H, d, J = 14,2 Hz), 5,01 (1H, d, J = 14,2 Hz), 5,08 (1H, q, J = 7 Hz), 5,44 (1H, s), 6,72-6,90 (2H, m), 7,12-7,31 (2H, m), 7,48-7,65 (3H, m), 7,69 (1H, s), 7,76 (1H, s), 7,94 (1H, s).
IRυ
SIMS (m/z): 431 (М+Н)+.
Вычислено, %: C 53,57; H 4,27; N 18,74.
C20H17F3N6O2•H2O.
Найдено, %: C 53,95; H 4,14; N 18,45.
Рабочий пример 7. 1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-(4-метоксифенил)-2(1H, 3H)-имидазолон (соединение 7), бесцветный порошок. Выход 663 мг (90%).
1H-NMR (CDCl3) δ : 1,21 (3H, d, J = 7,2 Hz), 3,83 (3H, s), 4,21 (1H, d, J = 14,2 Hz), 4,92 (1H, q, J = 7,2 Hz), 5,09 (1H, d, J = 14,2 Hz), 5,71 (1H, br), 6,58 (1H, d, J = 3,2 Hz), 6,68 (1H, d, J = 3,2 Hz), 6,70-6,88 (2H, m), 6,97 (2H, d, J = 9 Hz), 7,40-7,60 (1H, m), 7,50 (2H, d, J = 9 Hz), 7,72 (1H, s), 7,88 (1H, s).
IRυ
SIMS (m/z): 442 (M+H)+.
Рабочий пример 8. 1-[(1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-4-(4-метоксифенил)-3(2H,4H)-1,2,4-триазолон (соединение 8), бесцветный порошок. Выход 672 мг (65%).
1H-NMR (CDCl3) δ : 1,29 (3H, d, J = 7 Hz), 3,85 (3H, s), 4,35 (1H, d, J = 14,4 Hz), 5,02 (1H, d, J = 14,4 Hz), 5,08 (1H, q, J = 7 Hz), 5,56 (1H, s), 6,71-6,89 (2H, m), 7,01 (2H, d, J = 9 Hz), 7,45 (2H, d, J = 9 Hz), 7,50-7,64 (1H, m), 7,67 (1H, s), 7,73 (1H, s), 7,96 (1H, s).
IRυ
SIMS (m/z): 443 (M+H)+:
Вычислено, %: C 54,78; H 4,82; N 18,25.
C21H20F2N6O3•H2O.
Найдено, %: C 54,86; H 4,64; N 18,06.
Рабочий пример 9. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1- метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3-(4-трифторметоксифенил)- 2(1H, 3H)-имидазолон (соединение 9), бесцветный порошок. Выход 500 мг (71%).
1H-NMR (CDCl3) δ : 1,20 (3H, d, J = 7 Hz), 4,19 (1H, d, J = 14,4 Hz), 4,97 (1H, q, J = 7 Hz), 5,10 (1H, d, J = 14,4 Hz), 5,51 (1H, br), 6,39 (1H, d, J = 3,2 Hz), 6,64 (1H, d, J = 3,2 Hz), 6,70-6,86 (2H, m), 7,31 (2H, d, J = 9 Hz), 7,38-7,54 (1H, m), 7,69 (2H, d, J = 9 Hz), 7,74 (1H, s), 7,84 (1H, s).
IRυ
Рабочий пример 10. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-трифторметилфенил)-3(2H, 4H)- 1,2,4-триазолон (соединение 10), бесцветный порошок. Выход 420 мг (42%).
1H-NMR (CDCl3) δ : 1,31 (3H, d, J = 7,0 Hz), 4,38 (1H, d, J = 15 Hz), 5,03 (1H, d, J = 15 Hz), 5,09 (1H, q, J = 7,0 Hz), 5,35 (1H, br), 6,76-6,86 (2H, m), 7,50-7,62 (1H, m), 7,66-7,84 (5H, m), 7,87 (1H, s), 7,94 (1H, s).
Рабочий пример 11. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триaзол-1-ил)пропил] -2-(4-трифторметилфенил)-3(2H, 4H)- 1,2,4-триазолон (соединение 11), бесцветный порошок. Выход 304 мг (24%).
1H-NMR (CDCl3) δ : 1,24 (3H, d, J = 7,2 Hz), 4,15 (1H, d, J = 14 Hz), 4,97 (1H, dq, J = 7,2, 1,4Hz), 5,08 (1H, q, J = 14 Hz), 5,56 (1H, d, J = 1,4 Hz), 6,76-6,91 (2H, m), 7,38-7,59 (1H, m), 7,72 (2H, d, J = 8,6 Hz), 7,77 (1H, s), 7,80 (1H, s), 8,00 (1H, s), 8,20 (2H, d, J = 8,6 Hz).
IRυ
Рабочий пример 12. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-трифторметоксифенил)-3(2H, 4H)- 1,2,4-триазолон (соединение 12), бесцветный порошок. Выход: 790 мг (47%).
1H-NMR (CDCl3) δ : 1,31 (3H, d, J = 7 Hz), 4,37 (1H, d, J = 14,2 Hz), 5,03 (1H, d, J = 14,2 Hz), 5,09 (1H, q, J = 7 Hz), 5,41 (1H, s), 6,76-6,90 (2H, m), 7,38 (2H, d, J = 9 Hz), 7,51-7,64 (1H, m), 7,65 (2H, d, J = 9 Hz), 7,70 (1H, s), 7,81 (1H, s), 7,94 (1H, s).
IRυ
Рабочий пример 13. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-тpиaзoл-1-ил)пропил] 3-(4-изoпpoпилфeнил)-2(1H, 3H)-имидазолон (соединение 13), бесцветный порошок. Выход 200 мг (84%).
1H-NMR (CDCl3) δ : 1,21 (3H, d, J = 7 Hz), 1,26 (6H, d, J = 6,8 Hz), 2,94 (1H, q, J = 6,8 Hz), 4,19 (1H, d, J = 14 Hz), 4,92 (1H, m), 5,09 (1H, d, J = 14 Hz), 5,6-5,8 (1H, br), 6,62 (1H, d, J = 3,2 Hz), 6,69 (1H, d, J = 3,2 Hz), 6,7-6,9 (2H, m), 7,30 (2H, d, J = 8,6 Hz), 7,4-7,5 (1H, m), 7,52 (2H, d, J = 8,4 Hz), 7,71 (1H, s), 7,87 (1H, s).
Рабочий пример 14. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(2,4-дифторфенил)-3(2H, 4H)-1,2,4-триазолон (соединение 14), бесцветный порошок. T.пл. 111-113oC. Выход 660 мг (47%).
1H-NMR (CDCl3) δ : 1,32 (3H, d, J = 7 Hz), 4,36 (1H, d, J = 14,4 Hz), 5,04 (1H, d, J = 14,4 Hz), 5,07 (1H, q, J = 7 Hz), 5,73 (1H, s), 6,74-6,88 (2H, m), 7,00-7,14 (2H, m), 7,50-7,75 (2H, m), 7,71 (1H, s), 7,73 (1H, d, J = 2,4 Hz), 7,95 (1H, s).
IRυ
Рабочий пример 15. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -2-(4-фторфенил)-3(2H, 4H)-1,2,4-триазолон (соединение 15), бесцветный порошок. Выход 545 мг (55%).
1H-NMR (CDCl3) δ : 1,23 (3H, d, J = 7,2 Hz), 4,15 (1H, d, J = 14,2 Hz), 4,95 (1H, dq, J = 7,2, 1,6 Hz), 5,08 (1H, d, J = 14,2 Hz), 5,56 (1H, d, J = 1,6 Hz), 6,78-6,91 (2H, m), 7,14 (2H, t, J = 9,4 Hz), 7,39-7,62 (1H, m), 7,77 (1H, s), 7,80 (1H, s), 7,95 (1H, s), 7,99 (2H, dd, J = 9,4, 4,8 Hz).
IRυ
Рабочий пример 16. Тем же методом, что и в рабочем примере 2, осуществляли реакцию с использованием смеси порядка 1:1 2-[(1R,2S)-2-(2,4-дифторфенил)-2,3-эпокси-1-метилпропил] -4-(4-изопропилфенил)- 3(2H,4H)-1,2,4-триазолона и (1R)-1-[(2R)-2-(2,4-дифторфенил)- 2-оксиранил]этанола, полученного по ссылочному примеру 20, с получением 2-((1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол- 1-ил)пропил] -4-(4-изопропилфенил)-3(2H,4H)-1,2,4-триазолона (соединение 17) в виде бесцветного порошка.
1H-NMR (CDCl3) δ : 1,28 (6H, d, J = 6,8 Hz), (3H, d, J = 7 Hz), 2,97 (1H, q, J = 6,8 Hz), 4,35 (1H, d, J = 14 Hz), 5,03 (1H, d, J = 14 Hz), 5,10 (1H, q, J = 7 Hz), 5,55 (1H, s), 6,76-6,87 (2H, m), 7,37 (2H, d, J = 8,8 Hz), 7,47 (2H, d, J = 8,8 Hz), 7,50-7,62 (1H, m), 7,68 (1H, s), 7,77 (1H, s), 7,96 (1H, s).
Вычислено, %: C 60,79; H 5,32; N 18,49.
C23H24F2N6O2.
Найдено, %: C 60,48; H 5,49; N 18,32.
Рабочий пример 17. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-4-(4-трифторметилфенил)-5(1H,4H)-тетразолон (соединение 18), бесцветный порошок. Выход 21%.
1H-NMR (CDCl3) δ : 1,47 (3H, d, J = 7,2 Hz), 4,36 (1H, d, J = 14,2 Hz), 5,08 (1H, d, J = 14,2 Hz), 5,10 (1H, q, J = 7,2 Hz), 5,47 (1H, s), 6,74-6,91 (2H, m), 7,50-7,68 (1H, m), 7,73 (1H, s), 7,80 (2H, d, J = 8,8 Hz), 7,91 (1H, s), 8,18 (2H, d, J = 8,8 Hz).
Вычислено, %: C 49,90; H 3,35; N 20,37.
C20H16F5N7O2.
Найдено, %: C 49,64; H 3,35; N 20,22.
Рабочий пример 18. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(2,2,3,3-тетрафторпропокси)фенил] - 2(1H,3H)-имидазолон (соединение 19), бесцветный порошок. Выход 79%.
1H-NMR (CDCl3) δ : 1,20 (3H, d, J = 7 Hz), 4,20 (1H, d, J = 14 Hz), 4,37 (2H, t, J = 12 Hz), 4,94 (1H, q, J = 7 Hz), 5,09 (1H, d, J = 14 Hz), 5,55-5,74 (1H, br), 6,06 (1H, tt, J = 5, 53 Hz), 6,59 (1H, d, J = 3 Hz), 6,72 (1H, d, J = 3 Hz), 6,74-6,85 (2H, m), 7,01 (2H, d, J = 9 Hz), 7,42-7,55 (1H, m), 7,58 (2H, d, J = 9 Hz), 7,73 (1H, s), 7,86 (1H, s). Т.пл. 124,6-125,5oC.
Вычислено, %: C 53,24; H 3,91; N 12,93.
C24H21F6N5O3.
Найдено, %: C 53,12; H 4,19; N 12,76.
[α]
Рабочий пример 19. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(4-бензил-1-пиперазинил)фенил]- 3(2H, 4H)-1,2,4-триазолон (соединение 21), бесцветный порошок. Выход 59%.
1H-NMR (CDCl3) δ : 1,28 (3H, d, J = 7 Hz), 2,62 (4H, t, J = 4,8 Hz), 3,25 (4H, t, J = 4,8 Hz), 3,59 (2H, s), 4,33 (1H, d, J = 14,2 Hz), 5,01 (1H, d, J = 14,2 Hz), 5,08 (1H, q, J = 7 Hz), 5,60 (1H, s), 6,72-6,91 (2H, m), 6,98 (2H, d, J = 9 Hz), 7,23-7,45 (7H, m), 7,45-7,62 (1H, m), 7,66 (1H, s), 7,71 (1H, s), 7,96 (1H, s).
Вычислено, %: C 62,51; H 5,58; N 18,81.
C31H32F2N8O2•0,5H2O.
Найдено, %: C 62,28; H 5,44; N 18,56.
Рабочий пример 20. 4-[4-(4-Ацетил-1-пиперазинил)фенил]-2-[(1R,2R)- 2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил]- 3(2H, 4H)-1,2,4-триазолон (соединение 23).
К раствору 170 мг соединения 21 в 20 мл этанола добавили 20 мг 10% Pd-C и смесь перемешивали при комнатной температуре в токе водорода 9 ч. Катализатор отфильтровывали и промывали 5 мл этанола. Фильтрат и промывную жидкость объединяли и концентрировали при пониженном давлении с получением 144 мг 2-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-4-[4-(1-пипepaзинил)фенил]-3(2H,4H)- 1,2,4-триазолона (соединение 22) в виде бледно-желтого масла.
К раствору 144 мг соединения 22 в 20 мл метиленхлорида было добавлено 0,044 мл триэтиламина при 0oC, затем еще 0,030 мл уксусного ангидрида и полученную смесь перемешивали 1 ч. Реакционный раствор промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Концентрат очищали при помощи хроматографии на силикагеле (элюент - этилацетат:метанол = 10:1) с получением 80 мг соединения 23 в виде бледно-желтого порошка.
1H-NMR (CDCl3) δ : 1,29 (3H, d, J = 7 Hz), 2,16 (3H, s), 3,15-3,35 (4H, m), 3,59-3,88 (4H, m), 4,35 (1H, d, J = 14,4 Hz), 5,01 (1H, d, J = 14,4 Hz), 5,08 (1H, q, J = 7 Hz), 5,57 (1H, s)), 6,75-6,90 (2H, m), 7,01 (2H, d, J = 9 Hz), 7,44 (2H, d, J = 9 Hz), 7,49-7,67 (1H, m), 7,68 (1H, s), 7,73 (1H, s), 7,98 (1H, s).
Вычислено, %: C 55,20; H 5,52; N 19,81.
C26H28F2N8O3•1,5H2O.
Найдено, %: C 55,55; H 5,22; N 19,77.
Рабочие примеры 21-50. Следующие соединения получают тем же способом, что и в рабочем примере 2.
Рабочий пример 21. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-[4-(4-метоксифенил)- 1-пиперазинил] фенил]-3(2H,4H)-1,2,4-триазолон (соединение 24). Т.пл. 204-205oC. Выход 97%.
1H-NMR (CDCl3) δ: 1,29 (3H, d, J = 7 Hz), 3,18-3,30 (4H, m), 3,30-3,46 (4H, m), 3,79 (3H, s), 4,35 (1H, d, J = 14,4 Hz), 5,01 (1H, d, J = 14,4 Hz), 5,09 (1H, q, J = 7 Hz), 5,59 (1H, s), 6,72-6,90 (2H, m), 6,87 (2H, d, J = 9,2 Hz), 6,97 (2H, d, J = 9,2 Hz), 7,06 (2H, d, J = 9,2 Hz), 7,43 (2H, d, J = 9,2 Hz), 7,50-7,66 (1H, m), 7,68 (1H, s), 7,73 (1H, s), 7,97 (1H, s).
Вычислено, %: C 61,78; H 5,35; N 18,59.
C31H32F2N8O3.
Найдено, %: C 61,45; H 5,37; N 18,29.
Рабочий пример 22. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол- 1-ил)пропил] -4-(3-трифторметилфенил)-3(2H,4H)-1,2,4-триазолон (соединение 25), бесцветный порошок. Выход 30%.
1H-NMR (CDCl3) δ : 1,32 (3H, d, J = 7,0 Hz), 4,36 (1H, d, J = 14,6 Hz), 5,04 (1H, d, J = 14,6 Hz), 5,09 (1H, q, J = 7,0 Hz), 5,36 (1H, s), 6,76-6,86 (2H, m), 7,5-7,7 (4H, m), 7,78-7,90 (2H, m), 7,86 (1H, s), 7,93 (1H, s).
Вычислено, %: C 52,50; H 3,57; N 17,49.
C21H17F5N6O2.
Найдено, %: C 52,64; H 3,72; N 17,15.
Рабочий пример 23. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-фторфенил)-5(1H, 4H)-тетразолон (соединение 26), бесцветный порошок. Выход 51%.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7,2 Hz), 4,35 (1H, d, J = 14,4 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,10 (1H, q, J = 7,2 Hz), 5,50 (1H, s), 6,72-6,90 (2H, m), 7,15-7,30 (2H, m), 7,50-7,68 (1H, m), 7,72 (1H, s), 7,91 (1H, s), 7,89-8,01 (2H, m).
Вычислено, %: C 50,78; H 4,04; N 21,82.
C19H16F3N7O2•H2O.
Найдено, %: C 50,83; H 3,71; N 21,68.
Рабочий пример 24. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси 1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-пиридил)-3(2H, 4H)- 1,2,4-триазолон (соединение 27), бесцветный порошок. Выход 41%.
1H-NMR (CDCl3) δ : 1,36 (3H, d, J = 7,2 Hz), 4,37 (1H, d, J = 14,2 Hz), 5,01 (1H, d, J = 14,2 Hz), 5,07 (1H, q, J =7,2 Hz), 5,31 (1H, s), 6,74-6,90 (2H, m), 7,50-7,65 (1H, m), 7,67 (1H, s), 7,69 (1H, s), 7,70 (1H, s), 7,93 (2H, d, J = 5,8 Hz), 8,75 (2H, d, J = 5,8 Hz).
Вычислено, %: C 51,82; H 4,58; N 22,26.
C19H17F2N7O2•1,5H2O.
Найдено, %: C 51,47; H 4,24; N 22,48.
Рабочий пример 25. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-пиримидинил)-3(2H,4H)-1,2,4-триазолон (соединение 28), бесцветный порошок. Выход 10%.
1H-NMR (CDCl3) δ : 1,41 (3H, d, J = 6,6 Hz), 4,32 (1H, d, J = 11,6 Hz), 4,78 (1H, q, J = 6,6 Hz), 4,90 (1H, d, J= 11,6 Hz), 5,41 (1H, s), 6,70-6,92 (2H, m), 7,44 (1H, s), 7,89 (1H, dd, J = 5,6 Hz, 1,2 Hz), 7,85-8,06 (1H, m), 8,15 (1H, s), 8,90 (1H, d, J = 5,6 Hz), 9,10 (1H, d, J = 1,2 Hz), 9,26 (1H, s).
Вычислено, %: C 51,06; H 4,05; N 26,47.
C18H16F2N8O2•0,5H2O.
Найдено, %: C 50,70; H 3,71; N 26,62.
Рабочий пример 26. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(2,2,2-трифторэтил)-3(2H, 4H)- 1,2,4-триазолон (соединение 29), бесцветный порошок. Выход 53%.
1H-NMR (CDCl3) δ : 1,28 (3H, d, J = 7,2 Hz), 4,25 (14, d, J = 14,5 Hz), 4,32 (2H, dq, J = 1,6 Hz, J = 8,6 Hz), 5,00 (1H, q, J = 7,2 Hz), 5,02 (1H, d, J = 14,5 Hz), 5,29 (1H, s), 6,72-6,88 (2H, m), 7,48-7,0 (1H, m), 7,63 (1H, s), 7,70 (1H, s), 7,93 (1H, s).
Указанное соединение обрабатывают раствором 4н. соляная кислота-этилацетат с получением гидрохлорида в виде бесцветного порошка.
IRυ(KBr) cm-1: 1716, 1700, 1689, 1652, 1618, 1560, 1506.
Рабочий пример 27. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3-тетрафторпропокси)-фенил] - 3(2H,4H)-1,2,4-триазолон (соединение 30), бесцветный порошок. Выход 63%.
Т.пл. 150-151oC (изопропиловый эфир).
IRυ
1H-NMR (CDCl3) δ : 1,30 (3H, d, J = 7 Hz), 4,37 (1H, d, J = 15 Hz), 4,40 (2H, tt, J = 11,8, 1,4 Hz) 5,02 (1H, d, J = 15 Hz), 5,47 (1H, s), 5,09 (1H, q, J = 7 Hz), 6,07 (1H, tt, J = 53 Hz, 4,8 Hz), 6,75-6,88 (2H, m), 7,07 (2H, dt, J = 9 Hz, 2,2 Hz), 7,53 (2H, dt, J = 9 Hz, 2,2 Hz), 7,50-7,64 (1H, m), 7,69 (1H, s), 7,75 (1H, s), 7,95 (1H, s).
Вычислено, %: C 50,93; H 3,72; N 15,49.
C23H20F6N6O3.
Найдено, %: C 50,91; H 3,84; N 15,47.
Рабочий пример 28. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(2-трифторметилфенил)-3(2H, 4H)- 1,2,4-триазолон (соединение 31), бесцветный порошок. Выход 28%.
1H-NMR (CDCl3) δ : 1,32 (3H, d, J = 7 Hz), 4,29 (1H, d, J = 14,2 Hz), 5,06 (1H, d, J = 14,2 Hz), 5,07 (1H, q, J = 7 Hz), 5,41 (1H, s), 6,74-6,86 (2H, m), 7,48-7,60 (3H, m), 7,63-7,90 (3H, m), 7,70 (1H, s), 7,97 (1H, s).
Вычислено, %: C 52,50; H 3,57; N 17,49.
C21H17F5N6O2.
Найдено, %: C 52,32; H 3,76; N 17,35.
Рабочий пример 29. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-изопропоксифенил)-3(2H, 4H)-триазолон (соединение 32), бесцветный порошок. Выход 80%.
1H-NMR (CDCl3) δ : 1,29 (3H, d, J = 7,0 Hz), 1,36 (6H, d, J = 6 Hz), 4,35 (1H, d, J = 14,2 Hz), 4,58 (1H, septet, J =6 Hz), 5,02 (1H, d, J = 14,2 Hz), 5,08 (1H, q, J = 7 Hz), 5,57 (1H, s), 6,72-6,89 (2H, m), 6,99 (2H, d, J = 9 Hz), 7,42 (2H, d, J = 9 Hz), 7,47-7,63 (1H, m), 7,67 (1H, s), 7,72 (1H, s), 7,96 (1H, s).
Вычислено, %: C 56,55; H 5,36; N 17,20.
C23H24F2N6O3•H2O.
Найдено, %: C 56,36; H 5,15; N 17,26.
Рабочий пример 30. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(3-метилбутил)-3(2H, 4H)-1,2,4-триазолон (соединение 33), бесцветный порошок. Выход 53%.
1H-NMR (CDCl3) δ : 0,99 (6H, d, J = 6,2 Hz), 1,23 (3H, d, J = 6,8 Hz), 1,56-1,80 (3H, m), 3,72 (2H, t, J = 7,2 Hz), 4,20 (1H, d, J = 14,2 Hz), 4,97 (1H, d, J = 14,2 Hz), 5,02 (1H, q, J = 6,8 Hz), 5,63 (1H, s), 6,72-6,90 (2H, m), 7,45-7,62 (1H, m), 7,50 (1H, s), 7,67 (1H, s), 7,96 (1H, s).
SIMS (m/z): 407 (M+H)+.
Рабочий пример 31. 2-[1R, 2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-4-[4-(1,1,2,2-тетрафторэтокси)фенил]- 3(2H, 4H)-1,2,4-триазолон (соединение 34), бесцветный порошок. Выход 65%.
IRυ cm-1 (KBr): 1710, 1691, 1620, 1564, 1511, 1276.
1H-NMR (CDCl3) δ : 1,31 (3H, d, J = 7 Hz), 4,37 (1H, d, J = 14,2 Hz), 5,02 (1H, d, J = 14,2 Hz), 5,09 (1H, q, J = 7 Hz), 5,41 (1H, s), 5,94 (1H, tt, J = 53 Hz, J = 2,8 Hz), 6,75-6,90 (2H, m), 7,38 (2H, d, J = 9 Hz), 7,50-7,70 (1H, m), 7,63 (3H, d, J = 9 Hz), 7,70 (1H, s), 7,80 (1H, s), 7,94 (1H, s).
Рабочий пример 32. 2-(4-Хлорфенил)-4-1(1R,2R)-2-(2,4-дифторфенил)- 2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3(2H, 4H)-1,2,4-триазолон (соединение 36), бесцветные призмы. Выход 66%.
1H-NMR (CDCl3) δ : 1,23 (3H, d, J = 7,2 Hz), 4,14 (1H, d, J = 14,2 Hz), 4,95 (1H, dq, J = 7,2 Hz, 1,6 Hz), 5,07 (1H, d, J = 14,2 Hz), 5,54 (1H, d, J = 1,6 Hz), 6,73-6,89 (2H, m), 7,37-7,50 (1H, m), 7,41 (2H, d, J = 9 Hz), 7,77 (1H, s), 7,93 (1H, s), 7,96 (1H, s), 7,98 (2H, d, J = 9 Hz).
Вычислено, %: C 53,76; H 3,83; N 18,81.
C20H17ClF2N6O2.
Найдено, %: C 53,93; H 4,00; N 18,44.
Рабочий пример 33. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -2-(4-трифторметоксифенил)-3(2H, 4H)- 1,2,4-триазолон (соединение 36), бесцветный порошок. Выход 68%.
1H-NMR (CDCl3) δ : 1,24 (3H, d, J = 7,2 Hz), 4,14 (1H, d, J = 14,4 Hz), 4,96 (1H, dq, J = 7,2, 1,6 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,56 (1H, d, J = 1,6 Hz), 6,75-6,90 (2H, m), 7,31 (2H, d, J = 9,2 Hz), 7,48-7,52 (1H, m), 7,77 (1H, s), 7,80 (1H, s), 7,97 (1H, s), 8,08 (2H, d, J = 9,2 Hz).
Рабочий пример 34. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-(4-трифторметоксифенил)-5(1H, 4H)-тетразолон (соединение 37), бесцветный порошок. Выход: 43%.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7,2 Hz), 4,35 (1H, d, J = 13,8 Hz), 5,08 (1H, d, J = 13,8 Hz), 5,10 (1H, q, J =7,2 Hz), 5,51 (1H, s), 6,71-6,90 (2H, m), 7,38 (2H, d, J = 9,2 Hz), 7,48-7,63 (1H, m), 7,72 (1H, s), 7,91 (1H, s), 8,04 (2H, d, J = 9,2 Hz).
IRυ
[α]
Рабочий пример 35. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3-тетрафторпропокси)-фенил] - 5(1H,4H)-тетразолона (соединение 38), бесцветный порошок. Выход 57%.
1H-NMR (CDCl3) δ : 1,45 (3H, d, J = 7,2 Hz), 4,35 (1H, d, J = 14,2 Hz), 4,41 (2H, t, J = 11,8 Hz), 5,08 (1H, d, J = 14,2 Hz), 5,11 (1H, q, J = 7,2 Hz), 5,53 (1H, s), 6,09 (1H, tt, J = 53,2, 4,8 Hz), 6,75-6,90 (2H, m), 7,08 (2H, d, J = 9 Hz), 7,50-7,68 (1H, m), 7,72 (1H, s), 7,90 (2H, d, J = 9 Hz), 7,92 (1H, s).
IRυ
[α]
Рабочий пример 36. 1-(4-Хлорфенил)-4-[(1R,2R)-2-(2,4-дифторфенил)- 2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -5 (1H, 4H)-тетразолон (соединение 39), бесцветный порошок. Выход 46%.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7 Hz), 4,35 (1H, d, J = 14,4 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,10 (1H, q, J = 7 Hz), 5,49 (1H, s), 6,72-6,91 (2H, m), 7,42-7,61 (1H, m), 7,50 (2H, d, J = 9 Hz), 7,72 (1H, s), 7,92 (1H, s), 7,94 (2H, d, J = 9 Hz).
IRυ
Вычислено, %: C 49,95; H 3,75; N 21,46.
C19H16ClF2N7O2•0,5H2O.
Найдено, %: C 50,08; H 3,74; N 21,52.
[α]
Рабочий пример 37. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-3-[4-(1,1,2,2-тетрафторэтокси)фенил]- 2(1H, 3H)-имидазолон (соединение 40), бесцветный порошок. Выход 66%.
1H-NMR (CDCl3) δ : 1,21 (3H, d, J = 7 Hz), 4,18 (1H, d, J = 14 Hz), 4,97 (1H, q, J = 7 Hz), 5,10 (1H, d, J = 14 Hz), 5,4-5,6 (1H, br), 5,93 (1H, tt, J = 53, 2,8 Hz), 6,64 (1H, d, J = 3 Hz), 6,77 (1H, d, J = 3 Hz), 6,74-6,84 (2H, m), 7,30 (2H, d, J = 9 Hz), 7,40-7,55 (1H, m), 7,67 (2H, d, J = 9 Hz), 7,74 (1H, s), 7,84 (1H, s).
Вычислено, %: C 52,38; H 3,63; N, 13,28.
C23H19F6N5O3.
Найдено, %: C 52,22; H 3,83; N 13,08.
[α]
Рабочий пример 38. 1-(4-Хлорфенил)-3-[(1R,2R)-2-(2,4-дифторфенил)- 2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -2(1H, 3H)-имидазолон (соединение 41), бесцветный порошок. Выход 54%.
1H-NMR (CDCl3) δ : 1,20 (3H, d, J = 7 Hz), 4,19 (1H, d, J = 14 Hz), 4,97 (1H, q, J = 7 Hz), 5,10 (1H, d, J = 14 Hz), 5,42-5,65 (1H, br), 6,63 (1H, d, J = 3,2 Hz), 6,75 (1H, d, J = 3,2 Hz), 6,78-6,85 (2H, m), 7,42 (2H, d, J = 9 Hz), 7,40-7,55 (1H, m), 7,61 (2H, d, J = 9 Hz), 7,74 (1H, s), 7,85 (1H, s).
Рабочий пример 39. 4-(4-Хлорфенил)-2-[(1R,2R)-2-(2,4-дифторфенил)- 2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3(2H, 4H)-1,2,4-триазолон (соединение 42), бесцветный порошок. Выход 42%.
1H-NMR (CDCl3) δ : 1,30 (3H, d, J = 7,0 Hz), 4,36 (1H, d, J = 14 Hz), 5,02 (1H, d, J = 14 Hz), 5,08 (1H, q, J = 7,0 Hz), 5,41 (1H, s), 6,75-6,86 (2H, m), 7,47-7,63 (5H, m), 7,70 (1H, s), 7,79 (1H, s), 7,94 (1H).
Рабочий пример 40. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] - 2-(1H,3H)-имидазолон (соединение 43), бесцветный порошок. Выход 74%.
1H-NMR (CDCl3) δ ; 1,20 (3H, d, J = 7,0 Hz), 4,20 (1H, d, J = 14,3 Hz), 4,49 (2H, t, J = 13 Hz), 4,94 (1H, q, J = 7,0 Hz), 5,09 (1H, d, J = 14,3 Hz), 5,5-5,7 (1H, br), 6,09 (1H, tt, J = 52, 5,4 Hz), 6,59 (1H, d, J = 3,2 Hz), 6,72 (1H, d, J = 3,2 Hz), 6,75-6,85 (2H, m), 7,03 (2H, d, J = 9,0 Hz), 7,42-7,54 (1H, m), 7,58 (2H, d, J = 9,0 Hz), 7,73 (1H, s), 7,85 (1H, s).
Рабочий пример 41. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(2,2,2-трифторэтокси)фенил]-2(1H,3H)- имидазолон (соединение 44), бесцветный кристаллический порошок. Выход 70%.
1H-NMR (CDCl3) δ : 1,21 (3H, d, J = 6,8 Hz), 4,20 (1H, d, J = 14,2 Hz), 4,38 (2H, q, J = 8 Hz), 4,95 (1H, q, J = 6,8Hz), 5,10 (1H, d, J = 14,2 Hz), 5,60 (1H, br), 6,60 (1H, d, J = 3 Hz), 6,73 (1H, d, J = 3 Hz), 6,70-6,88 (2H, m), 7,03 (2H, d, J = 9 Hz), 7,40-7,55 (1H, m), 7,58 (2H, d, J = 9 Hz), 7,73 (1H, s), 7,86 (1H, s).
Рабочий пример 42. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(2,2,3,3,3-пентафторпропокси)фенил] - 2(1H, 3H)-имидазолон (соединение 45), бесцветный кристаллический порошок. Выход 79%.
1H-NMR (CDCl3) δ : 1,21 (3H, d, J = 7 Hz), 4,20 (1H, d, J = 14,2 Hz), 4,45 (2H, t, J = 12 Hz), 4,95 (1H, q, J = 7 Hz), 5,10 (1H, d, J = 14,2 Hz), 5,60 (1H, br), 6,60 (1H, d, J = 3 Hz), 6,74 (1H, d, J = 3 Hz), 6,65-6,85 (2H, m), 7,03 (2H, d, J = 8,8 Hz), 7,40-7,55 (1H, m), 7,59 (2H, d, J = 8,8 Hz), 7,74 (1H, s), 7,86 (1H, s).
Рабочий пример 43. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,2-трифторэтокси)фенил]-3(2H,4H)- 1,2,4-триазолон (соединение 46), бесцветные иглы. Выход 59%.
1H-NMR (CDCl3) δ : 1,30 (3H, d, J = 7 Hz), 4,36 (1H, d, J = 14,8 Hz), 4,41 (2H, q, J = 8 Hz), 5,02 (1H, d, J = 14,8 Hz), 5,09 (1H, q, J = 7 Hz), 5,48 (1H, s), 6,74-6,90 (2H, m), 7,09 (2H, d, J = 9 Hz), 7,48-7,65 (1H, m), 7,53 (2H, d, J = 9 Hz), 7,69 (1H, s), 7,76 (1H, s), 7,95 (1H, s).
Рабочий пример 44. 2- [(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3,3-пентафторпропокси)фенил] - 3(2H,4H)-1,2,4-триазолон (соединение 47), бесцветные иглы. Выход 46%.
1H-NMR (CDCl3) δ : 1,30 (3H, d, J = 7 Hz), 4,36 (1H, d, J = 14,8 Hz), 4,48 (2H, t, J = 12 Hz), 5,02 (1H, d, J = 14,8 Hz), 5,09 (1H, q, J = 7 Hz), 5,48 (1H, s), 6,75-6,90 (2H, m), 7,09 (1H, d, J = 9 Hz), 7,48-7,64 (1H, m), 7,54 (2H, d, J = 9 Hz), 7,70 (1H, s), 7,76 (1H, s), 7,95 (1H, s).
Рабочий пример 45. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3,4,4,5,5-октафторпентокси)фенил] - 3(2H, 4H)-1,2,4-триазолон (соединение 48), бесцветный порошок. Выход 54%.
1H-NMR (CDCl3) δ : 1,30 (3H, d, J = 7,0 Hz), 4,36 (1H, d, J = 14 Hz), 4,52 (2H, t, J = 13 Hz), 5,01 (1H, t, J = 14 Hz), 5,09 (1H, q, J = 7,0 Hz), 5,48 (1H, s), 6,10 (1H, tt, J = 52, 5,4 Hz), 6,77-6,87 (2H, m), 7,09 (2H, d, J = 9,0 Hz), 7,51-7,62 (1H, m), 7,54 (2H, d, J = 9,0 Hz), 7,70 (1H, s), 7,76 (1H, s), 7,95 (1H, s).
Рабочий пример 46. (4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -2-[4-(2,2,2-трифторэтокси)фенил]-3(2H,4H)- 1,2,4-триазолон (соединение 49), бесцветный порошок. Выход 68%.
1H-NMR δ : 1,24 (3H, d, J = 7,2 Hz), 4,15 (1H, d, J = 14,2 Hz), 4,39 (2H, q, J = 8,2 Hz), 4,95 (1H, dq, J = 7,2, 1,6 Hz), 5,09 (1H, d, J = 14,2 Hz), 5,56 (1H, d, J = 1,6 Hz), 6,70-6,90 (2H, m), 7,03 (2H, d, J = 9,2 Hz), 7,34-7,53 (1H, m), 7,77 (1H, s), 7,81 (1H, s), 7,94 (1H, s), 7,96 (2H, d, J = 9,2 Hz).
Рабочий пример 47. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -2-[4-(2,2,3,3,3-пентафторпропокси)фенил] - 3(2H,4H)-1,2,4-триазолон (соединение 50), бесцветный порошок. Выход 53%.
1H-NMR (CDCl3) δ : 1,24 (3H, d, J = 7,2 Hz), 4,14 (1H, d, J = 14,4 Hz), 4,45 (2H, t, J = 12,2 Hz), 4,95 (1H, dq, J = 7,2, 1,6 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,54 (1H, d, J = 1,6 Hz), 6,71-6,89 (2H, m), 7,03 (2H, d, J = 9 Hz), 7,34-7,52 (1H, m), 7,77 (1H, s), 7,80 (1H, s), 7,93 (1H, s), 7,96 (2H, d, J = 9 Hz).
Рабочий пример 48. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -2-[4-(2,2,3,3,4,4,5,5- октафторпентокси)фенил] -3(2H,4H)-1,2,4-триазолон (соединение 51), бесцветный порошок. Выход 37%.
1H-NMR (CDCl3) δ : 1,24 (3H, d, J = 7 Hz), 4,14 (1H, d, J = 14,4 Hz), 4,49 (2H, t, J = 13 Hz), 4,94 (1H, dq, J = 1,6 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,54 (1H, d, J = 1,6 Hz), 6,10 (1H, tt, J = 52 Hz, 5,4 Hz), 6,71-6,89 (2H, m), 7,03 (2H, d, J = 9,2 Hz), 7,34-7,51 (1H, m), 7,77 (1H, s), 7,80 (1H, s), 7,93 (1H, s), 7,95 (2H, d, J = 9,2 Hz).
Рабочий пример 49. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-трназол-1-ил)пропил] -2-[4-(2,2,3,3-тетрафторпропокси)фенил] - 3(2H,4H)-1,2,4-триазолон (соединение 52), бесцветный порошок. Выход 81%.
1H-NMR (CDCl3) δ : 1,23 (3H, d, J = 7 Hz), 4,14 (1H, d, J = 14,4 Hz), 4,49 (2H, t, J = 13 Hz), 4,94 (1H, dq, J = 7, 1,6 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,54 (1H, d, J = 1,6 Hz), 6,10 (1H, tt, J = 52, 5,4 Hz), 6,71-6,89 (2H, m), 7,03 (2H, d, J = 9,2 Hz), 7,34-7,51 (1H, m), 7,77 (1H, s), 7,80 (1H, s), 7,93 (1H, s), 7,95 (2H, d, J = 9,2 Hz).
Рабочий пример 50. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-2-[4-(1,1,2,2-тетрафторэтокси)фенил]- 3(2H, 4H)-1,2,4-триазолон (соединение 53), бесцветный порошок. Выход 57%.
1H-NMR (CDCl3) δ : 1,24 (3H, d, J = 7,2 Hz), 4,14 (1H, d, J = 14,2 Hz), 4,95 (1H, dq, J = 7,2, 1,6 Hz), 5,08 (1H, d, J = 14,2 Hz), 5,55 (1H, d, J = 1,6 Hz), 5,93 (1H, tt, J = 53, 2,8 Hz), 6,71-6,90 (2H, m), 7,30 (2H, d, J = 9,2 Hz), 7,34-7,51 (1H, m), 7,77 (1H, s), 7,80 (1H, s), 7,96 (1H, s), 8,06 (2H, d, J = 9,2 Hz).
Рабочий пример 51. 60%-ный гидрид натрия в масле (80 мг) диспергируют в 5 мл диметилформамида и 582 мг 4-[4-(2,2,3,3-тетрафторпропокси)фенил]-3(2H, 4H)-1,2,4-триазолона добавляют при ледяном охлаждении. Смесь перемешивают при комнатной температуре 10 мин. К смеси добавляют 474 мг (2RS)-2-(2,4-дифторфенил)-2-(1H-1,2,4- триазол-1-ил)метилоксирана (синтезированного по методу патента Японии Laid-Open Sho 58-32868) и полученную смесь нагревают при 60oC в течение 15 мин. После охлаждения реакционный раствор фракционируют, добавляя 20 мл холодной воды и 40 мл этилацетата, и охлажденный водный слой дважды экстрагируют этилацетатом. Этилацетатные слои объединяют, промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и отгоняют при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - дихлорметан:ацетон = 2:1) с получением 510 мг 2-[(2RS)-2-(2,4-дифторфенил)-2-гидрокси-3-(1H-1,2,4-триазол- 1-ил)пропил] -4-[4-(2,2,3,3-тетрафторпропокси)фенил]-3(2H,4H)-1,2,4-триазолона (соединение 54) в виде белого порошка.
1H-NMR (CDCl3) δ : 4,18 (1H, d, J = 15 Hz), 4,40 (2H, t, J = 12 Hz), 4,61 (1H, d, J = 15 Hz), 4,71 (2H, s), 5,80 (1H, s), 6,05 (1H, tt, J = 5,2, 54 Hz), 6,77-6,87 (2H, m), 7,01 (2H, d, J = 8,6 Hz), 7,37 (2H, d, J = 8,6 Hz), 7,53 (1H, s), 7,56-7,64 (1H, m), 7,84 (1H, s), 8,15 (1H, s). Т.пл. 79-80oC.
Рабочий пример 52. 60%-ный гидрид натрия в масле (40 мг) диспергируют в 4 мл диметилформамида и 250 мг 2-(4-трифторметоксифенил)-3(2H,4H)-1,2,4-триазолона добавляют при ледяном охлаждении. Смесь перемешивают при комнатной температуре 10 мин.
К смеси добавляют 237 мг (2RS)-2-(2,4-дифторфенил)-2-(1H-1,2,4-триазол- 1-ил)метилоксирана и полученную смесь перемешивают при комнатной температуре в течение 22 ч. После охлаждения реакционный раствор фракционируют, добавляя 15 мл холодной воды и 30 мл этилацетата, и отделенный водный слой дважды экстрагируют этилацетатом. Этилацетатные слои объединяют, промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и отгоняют при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - этилацетат:гексан = от 3:1 до этилацетата) с получением 92 мг 4-[(2RS)-2-(2,4-дифторфенил)-2-гидрокси-3-(1H-1,2,4-триазол-1-ил)пропил]- 2-(4-трифторметоксифенил)-3(2H,4H)-1,2,4-триазолона (соединение 55) в виде белого порошка.
1H-NMR (CDCl3) δ : 4,20 (2H, s), 4,51 (1H, d, J = 14,4 Hz), 4,80 (1H, d, J = 14,4 Hz), 5,93 (1H, s), 6,80-6,89 (2H, m), 7,31 (2H, d, J = 9,2 Hz), 7,51-7,59 (1H, m), 7,61 (1H, s), 7,87 (1H, s), 7,92 (2H, d, J = 9,2 Hz), 8,05 (1H, s).
Т.пл. 128-130oC.
Рабочий пример 53. Тем же методом, как в рабочем примере 51 исходя из 0,19 г (2RS)-2-(2,4-Дифторфенил)-2-(1-инидазолил)метилоксирана и 0,23 г 4-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H,4H)-1,2,4-триазолона получают 2-[(2RS)-2-(2,4-дифторфенил)-2-гидрокси-3-(1-имидазолил)пропил] - 4-[4-(2,2,3,3-тетрафторпропокси)фенил] -3(2H,4H)-1,2,4-триазолона (соединение 56: 0,23 г) в виде бесцветного порошка. Выход 55%.
1H-NMR (CDCl3) δ : 4,20 (1H, d, J = 15 Hz), 4,37 (2H, s), 4,37 (2H, t, J = 12 Hz), 4,57 (1H, d, J = 15 Hz), 5,76 (1H, s), 6,04 (1H, tt, J = 5,2 Hz, 54 Hz), 6,75-6,98 (2H, m), 6,92 (1H, s), 7,00 (2H, d, J = 9,2 Hz), 7,26 (1H, s), 7,35 (2H, d, J = 9,2 Hz), 7,43-7,60 (1H, m), 7,45 (1H, s), 7,51 (1H, s).
Рабочий пример 54. Тем же методом, как в рабочем примере 51 исходя из 0,24 г (2RS)-2-(2,4-Дифторфенил)-2-(1H-1,2,4-тетразолил-1-ил)метилоксирана и 0,28 г 4-[4-(1,1,2,2-тетрафторэтокси)фенил] -3(2H,4H)-1,2,4-триазолона получают 2-[(2R)-2-(2,4-дифторфенил)-2-гидрокси-3-(1H-1,2,4-триазол- 1-ил)пропил] -4-[4-(1,1,2,2-тетрафторэтокси)фенил] -3(2H, 4H)-1,2,4-триазолона (соединение 78: 0,22 г) в виде бесцветного порошка. Выход 43%.
1H-NMR (CDCl3) δ : 4,19 (1H, d, J = 15 Hz), 4,61 (1H, q, J = 15 Hz), 4,72 (2H, s), 5,71 (1H, s), 5,92 (1H, tt, J = 2,8 Hz, 53 Hz), 6,76-6,88 (2H, m), 7,31 (2H, d, J = 10 Hz), 7,46-7,64 (1H, m), 7,49 (2H, d, J = 10 Hz), 7,59 (1H, s), 7,84 (1H, s), 8,14 (1H, s).
Рабочие примеры 55-61. Следующие соединения были получены в соответствии с тем методом, который описан в рабочем примере 54.
Рабочий пример 55. 2-[(2R)-2-(2,4-Дифторфенил)-2-гидрокси-3-(1H- 1,2,4-тpиaэoл-1-ил)пропил] -4-[4-(2,2,2-трифторэтокси)фенил] -3(2H, 4H)- 1,2,4-триазолон (соединение 90), бесцветный порошок. Выход 30%.
1H-NMR (CDCl3) δ : 4,18 (1H, d, J = 15 Hz), 4,37 (2H, q, J = 8 Hz), 4,60 (1H, d, J = 15 Hz), 4,71 (2H, s), 5,79 (1H, s), 6,77-6,98 (2H, m), 7,02 (2H, d, J = 10 Hz), 7,37 (2H, d, J = 10 Hz), 7,46-7,64 (1H, m), 7,53 (1H, s), 7,84 (1H, s), 8,15 (1H, s).
Рабочий пример 56. 2-[(2R)-2-(2,4-Дифторфенил)-2-гидрокси-3-(1H- 1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3,3-пентафторпропокси)фенил] - 3(2H, 4H)-1,2,4-триазолон (соединение 94), бесцветный порошок. Выход 31%.
1H-NMR (CDCl3) δ : 4,18 (1H, d, J = 15 Hz), 4,44 (2H, t, J = 12 Hz), 4,60 (1H, d, J = 15 Hz), 4,71 (2H, s), 5,79 (1H, s), 6,77-6,86 (2H, m), 7,02 (2H, d, J = 8,8 Hz), 7,38 (2H, d, J = 8,8 Hz), 7,53 (1H, s), 7,56-7,64 (1H, m), 7,84 (1H, s), 8,15 (1H, s).
[α]
Рабочий пример 57. 4-[(2S)-2-(2,4-Дифторфенил)-2-гидрокси-3-(1H- 1,2,4-триазол-1-ил)пропил] -2-[4-(2,2,3,3-тетрафторпропокси)фенил]-3(2H,4H)- 1,2,4-триазолон (соединение 75), бесцветный порошок. Выход 20%.
1H-NMR (CDCl3) δ : 4,14 (1H, d, J = 15 Hz), 4,24 (1H, d, J = 15 Hz), 4,32 (2H, t, J = 12 Hz), 4,51 (1H, d, J = 15 Hz), 4,77 (1H, d, J = 15 Hz), 6,02 (1H, s), 6,06 (1H, tt, J = 4,8 Hz, 54 Hz), 6,71-6,98 (2H, d, J = 9,2 Hz), 7,03 (2H, d, J = 9,2Hz), 7,51-7,63 (1H, m), 7,55 (1H, s), 7,79 (2H, d, J = 9,2 Hz), 7,86 (1H, s), 8,06 (1H, s).
Рабочий пример 58. 4-[(2S)-2-(2,4-Дифторфенил)-2-гидрокси-3-(1H- 1,2,4-триазол-1-ил)пропил] -2-[4-(1,1,2,2-тетрафторэтокси)фенил] -3-(2H,4H)- 1,2,4-триазолон (соединение 79), бесцветный порошок. Выход 23%.
1H-NMR (CDCl3) δ : 4,15 (1H, d, J = 14 Hz), 4,24 (1H, d, J = 14 Hz), 4,50 (1H, d, J = 14 Hz), 4,79 (1H, d, J = 14 Hz), 5,92 (1H, tt, J = 2,8 Hz, 53 Hz), 5,94 (1H, s), 6,79-6,88 (2H, m), 7,25 (2H, d, J = 10 Hz), 7,50-7,62 (1H, m), 7,59 (1H, s), 7,87 (1H, s), 7,91 (2H, d, J = 10 Hz), 8,05 (1H, s).
[α]
Рабочий пример 59. 4-[(2S)-2-(2,4-Дифторфенил)-2-гидрокси-3-(1H- 1,2,4-триазол-1-ил)пропил] -2-[4-(2,2,2-трифторэтокси)фенил] -3(2H, 4H)- 1,2,4-триазол (соединение 91), бесцветный порошок. Выход 22%.
1H-NMR (CDCl3) δ : 4,14 (1H, d, J = 14 Hz), 4,24 (1H, d, J = 14 Hz), 4,35 (2H, q, J = 8 Hz), 4,51 (1H, d, J = 14 Hz), 4,76 (1H, d, J = 14 Hz), 6,02 (1H, s), 6,72-6,89 (2H, m), 6,97 (2H, d, J = 9,2 Hz), 7,51-7,63 (1H, m), 7,55 (1H, s), 7,79 (2H, d, J = 9,2 Hz), 7,86 (1H, s), 8,06 (1H, s).
Рабочий пример 60. 2-[(2R)-2-(2,4-Дифторфенил)-2-гидрокси-3-(1H- 1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3-тетрафторпропокси)фенил]-3(2H,4H)- 1,2,4-триазолон (соединение 74), бесцветный порошок. Выход 46%.
1H-NMR (CDCl3) δ : 4,18 (1H, d, J = 15 Hz), 4,40 (2H, t, J = 12 Hz), 4,61 (1H, d, J = 15 Hz), 4,71 (2H, s), 5,80(1H, s), 6,05 (1H, tt, J = 5,2 z, 54 Hz), 6,77-6,87 (2H, m), 7,01 (2H, d, J = 8,6 Hz), 7,37 (2H, d, J = 8,6 Hz), 7,53 (1H, s), 7,56-7,64 (1H, m), 7,84 (1H, s), 8,15 (1H, s).
Рабочий пример 61. 2-[(2R)-2-(2,4-Дифторфенил)-2-гидрокси-3-(1H- 1,2,4-триазол-1-ил)пропил] -4-(4-трифторметоксифенил)-3(2H, 4H)-1,2,4-триазолон (соединение 70), бесцветный порошок. Выход 41%.
1H-NMR (CDCl3) δ : 4,19 (1H, d, J = 15 Hz), 4,60 (1H, d, J = 15 Hz), 4,72 (2H, s), 5,69 (1H, s), 6,76-6,88 (2H, m), 7,32 (2H, d, J = 9 Hz), 7,46-7,64 (1H, m), 7,50 (2H, d, J = 9 Hz), 7,59 (1H, s), 7,84 (1H, s), 8,14 (1H, s).
Рабочие примеры 62-71. Следующие соединения были получены в соответствии с тем методом, который описан в рабочем примере 2.
Рабочий пример 62. 1-1[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-[4-[4-(2,2,3,3-тетрафторпропокси)фенил] - 1-пиперизинил] фенил] -2(1H, 3H)-имидазолон (соединение 104), бесцветный порошок. Выход 62%.
1H-NMR (CDCl3) δ : 1,22 (3H, d, J = 7 Hz), 3,23-3,38 (8H, m), 4,22 (1H, d, J = 15 Hz), 4,31 (2H, t, J = 12 Hz), 4,92 (1H, q, J = 7 Hz), 5,10 (1H, d, J = 15 Hz), 6,08 (1H, tt, J = 53, 5 Hz), 6,59 (1H, d, J = 3,0 Hz), 6,68 (1H, d, J = 3,0 Hz), 6,73-7,06 (8H, m), 7,43-7,54 (3H, m), 7,72 (1H, s), 7,89 (1H, s).
Рабочий пример 63. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-[4-[4-(2,2,3,3-тетрафторпропокси)фенил] - 1-пипeразинил]фенил]-3(2H,4H)-1,2,4-триазолон (соединение 105), бесцветный порошок. Выход 54%.
1H-NMR (CDCl3) δ : 1,29 (3H, d, J = 7,0 Hz), 3,23-3,42 (8H, m), 4,31 (2H, t, J = 12 Hz), 4,35 (1H, d, J = 15 Hz), 5,02 (1H, d, J = 15 Hz), 5,09 (1H, q, J = 7,0 Hz), 5,58 (1H, s), 6,07 (1H, tt, J = 53, 5,0 Hz), 6,76-7,00 (6H, m), 7,06 (2H, d, J = 9 Hz), 7,43 (2H, d, J = 9 Hz), 7,50-7,62 (1H, m), 7,68 (1H, s), 7,73 (1H, s), 7,96 (1H, s).
Рабочий пример 64. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,2-трифторэтокси)фенил]-5(1H,4H)- 1,2,4-триазолон (соединение 106), бесцветный порошок. Выход 27%.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7 Hz), 4,35 (1H, d, J = 16 Hz), 4,41 (2H, q, J = 8 Hz), 5,08 (1H, d, J = 16 Hz), 5,10 (1H, q, J = 7 Hz), 5,51 (1H, s), 6,75-6,88 (2H, m), 7,09 (2H, d, J = 9 Hz), 7,51-7,63 (1H, m), 7,72 (1H, s), 7,90 (2H, d, J = 9 Hz), 7,91 (1H, s).
Рабочий пример 65. 1-[1(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил]-4-[4-(1,1,2,2-тетрафторэтокси)фeнил]- 5(1H, 4H)-1,2,4-тpиaзoлoн (соединение 107), бесцветный порошок. Выход 48%.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7,2 Hz), 4,34 (1H, d, J = 14,4 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,10 (1H, q, J = 7,2 Hz), 5,50 (1H, s), 5,95 (1H, tt, J = 52,8, 2,8 Hz), 6,73-6,91 (2H, m), 7,38 (2H, d, J = 9 Hz), 7,49-7,64 (1H, m), 7,72 (1H, s), 7,91 (1H, s), 8,01 (2H, d, J = 9 Hz).
IRυ
Рабочий пример 66. 1-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3,3-пентафторпропокси)фенил] - 5(1H,4H)-1,2,4-триазолон (соединение 108), бесцветный порошок. Выход 53%.
1H-NMR (CDCl3) δ : 1,45 (3H, d, J = 7,2 Hz), 4,35 (1H, d, J = 14,2 Hz), 4,47 (2H, dt, J = 12,2, 1 Hz), 5,08 (1H, d,J = 14,2 Hz), 5,10 (1H, q, J = 7,2 Hz), 5,50 (1H, s), 6,74-6,90 (2H, m), 7,09 (2H, d, J = 9,2 Hz), 7,49-7,65 (1H, m), 7,72 (1H, s), 7,90 (2H, d, J = 9,2 Hz), 7,91 (1H, s).
IRυ
Рабочий пример 67. 1-[(1R,2R)-2-(2,4-Дифторфeнил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3,4,4,5,5- октафторпентокси)фенил]-5(1H,4H)-1,2,4-триазолон (соединение 109), бесцветный порошок. Выход 42%.
1H-NMR (CDCl3) δ : 1,46 (3H, d, J = 7,2 Hz), 4,35 (1H, d, J = 14,4 Hz), 4,53 (2H, t, J = 13 Hz), 5,08 (1H, d, J = 14,4 Hz), 5,10 (1H, q, J = 7,2 Hz), 5,52 (1H, s), 6,11 (1H, tt, J = 52, 5,4 Hz), 6,74-6,91 (2H, m), 7,10 (2H, d, J = 9,2 Hz), 7,50-7,66 (1H, m), 7,73 (1H, s), 7,91 (2H, d, J = 9,2 Hz), 7,92 (1H, s).
IRυ
Рабочий пример 68. 2-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -5-метил-4-[4-(2,2,3,3- тетрафторпpoпoкcи)фенил] -3(2H, 4H)-l, 2,4-тpиaзoлoн (соединение 110), бесцветный порошок. Выход 44%.
1H-NMR (CDCl3) δ : 1,25 (3H, d, J = 7 Hz), 2,19 (3H, s), 4,40 (1H, d, J = 14,8 Hz), 4,42 (2H, t, J = 11,8 Hz), 4,97 (1H, d, J = 14,8 Hz), 5,06 (1H, q, J = 7 Hz), 5,62 (1H,s), 6,08 (1H, tt, J = 53,2 Hz, J = 4,6 Hz), 6,84-6,90 (2H, m), 7,09 (2H, dt, J = 9 Hz, 2,6 Hz), 7,33 (2H, dt, J = 9 Hz, 2,6 Hz), 7,50-7,65 (1H, m), 7,70 (1H, s), 7,98 (1H, s).
Рабочий пример 69. 2- [(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3(1H-1,2,4-триазол-1-ил)пропил]-5-метил-4-[4-(1,1,2,2-тетрафторэтокси)фенил] - 3(2H,4H)-1,2,4-триазолон (соединение 111), бесцветный порошок. Выход 46%.
1H-NMR (CDCl3) δ : 1,26 (3H, d, J = 7 Hz), 2,24 (3H, s), 4,42 (1H, d, J = 14,6 Hz), 4,98 (1H, d, J = 14,6 Hz), 5,07 (1H, q, J = 7 Hz), 5,55 (1H, s), 5 96 (1H, tt, J = 53,2 Hz, 2,8 Hz), 6,75-6,90 (2H, m), 7,41 (4H, s), 7,50-7,65 (1H, m), 7,71 (1H, s), 7,97 (1H, s).
Рабочий пример 70. 2-(4-Хлорфенил)-4-[(1R,3R)-2-(2,4-дифторфенил)- 2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -5-метил-3(2H,4H)- 1,2,4-триазолон (соединение 112), бесцветный порошок. Выход 77%.
1H-NMR (400 MHz, DMSO-d6, 138oC) δ : 1,33 (3H, d, J = 7 Hz), 2,38 (3H, s), 4,49 (1H, d, J = 14,2 Hz), 4,76-4,90 (1H, m), 4,89 (1H, d, J = 14,2 Hz), 6,23 (1H, br), 6,88-6,95 (1H, m), 6,99-7,07 (1H, m), 7,46-7,54 (1H, m), 7,46 (2H, d, J = 9 Hz), 7,55 (1H, s), 7,90 (2H, d, J = 9 Hz), 8,14 (1H, s).
IRυ
Рабочий пример 71. 4-[(1R,2R)-2-(2,4-Дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -5-метил-2-(4-трифторметоксифенил)- 3(2H, 4H)-тетразолон (соединение 113), бесцветный порошок. Выход 72%.
IRυ
Рабочий пример 72. K смеси 60%-ного (w/w) гидрида натрия в масле (10 мг) и диметилформамида (2 мл) добавляют 4-(4-трифторметилфенил)-3(2H, 4H)-1,2,4-триазолон (59 мг) при 0oC. Полученную смесь перемешивают при комнатной температуре 10 мин. К смеси добавляют (2R,2S)-2-(2,4-дифторфенил)-3-метил-2-[(1H-1,2,4-триазол- 1-ил)метил] оксиран (63 мг). После перемешивания в течение 19 ч при 70oC смесь разбавляют водой (4 мл) и экстрагируют этилацетатом (4 мл х 2). Экстракт промывают водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле (элюент - этилацетат: гексан = от 3:1 до этилацетата) с получением 1-[(1R, 2R)-2-(2,4-дифторфеннил)-2-гидрокси-1-метил-3-(1H- 1,2,4-триазол-1-ил)пропил]-4-(4-трифторметилфенил)-3(2H,4H)-1,2,4-триазолона (соединение 10) в виде бесцветного порошка (10 мг).
Рабочий пример 73. Тем же методом, как в рабочем примере 72, (2R,2S)-2-(2,4-дифторфенил)-3-метил-2-[(1H-1,2,4-триазол-1-ил)метил-оксиран (63 мг) подвергают реакции с 2-(4-трифторметилфенил)-3(2H,4H)- 1,2,4-триазолоном (59 мг) с получением 4-[(1R,2R)-2-(2,4-дифторфенил)- 2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -2-(4-трифторметилфенил)- 3(2H,4H)-1,2,4-триазолона (соединение 11) в виде белого порошка (12 мг).
Рабочий пример 74. Тем же методом, как в рабочем примере 72, (2R,3S)-2-(2,4-дифторфенил)-3-метокси-2-[(1H-1,2,4-триазол-1-ил)метил] -оксиран (251 мг) подвергают реакции с 2-(4-фторфенил)-3(2H,4H)-1,2,4-триазолоном (358 мг) с получением 4-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил- 3-(1H-1,2,4-триазол-1-ил)пропил] -2-(4-фторфенил)-3(2H, 4H)-1,2,4-триазолона (соединение 15) в виде белого порошка (76 мг).
Рабочий пример 75. Тем же методом, как в рабочем примере 72, (2R,3S)-2-(2,4-дифторфенил)-3-метил-2-[(1H-1,2,4-триазол-1-ил)метил] -оксиран (251 мг) подвергают реакции с 2-(4-хлорфенил)-3(2H,4H)-1,2,4-триазолоном (392 мг) с получением 2-(4-хлорфенил)-4-[(1R,2R)-2-(2,4-дифторфенил)- 2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил]-3(2H,4H)-1,2,4-триазолона (соединение 35) в виде бесцветных призм (48 мг).
Предпочтительная группа соединений, выраженная соединением общей формулы I согласно изобретению, проиллюстрирована в табл. 8-27, что, однако, не ограничивает изобретение соединениями, там представленными.
Приготовление 1.
Используя соединение 30, полученное в рабочем примере 27, смешивают следующие компоненты. Смесь упаковывают в желатиновые капсулы с получением капсул, каждая из которых содержит соединение 30 в количестве 50 мг.
Соединение 30 (полученное в рабочем примере 27) - 50 мг
Лактоза - 100 мг
Кукурузный крахмал - 40 мг
Стеарат магния - 10 мг
Всего - 200 мг
Приготовление 2.
Соединение 35, полученное в рабочем примере 32, и стеарат магния гранулируют в растворе растворимого крахмала. Полученный продукт высушивают и затем смешивают с лактозой и кукурузным крахмалом. Смесь подвергают прессованию с получением таблетки, содержащей указанные компоненты.
Соединение 35 (полученное в рабочем примере 32 - 50 мг
Лактоза - 65 мг
Кукурузный крахмал - 30 мг
Растворимый крахмал - 35 мг
Стеарат магния - 20 мг
Всего - 200 мг
Оценка противогрибковой активности соединения формулы I проводилась по следующей методике: лист фильтровальной бумаги (изготовленной Toyo Seisakusho, 8 мм в диаметре), пропитанный 1000 мг/мл раствором соединения формулы I в метаноле, помещался на агаровую пластинку, содержащую различные грибки, инкубировался при 28oC в течение двух дней и затем измерялся диаметр роста ингибированной зоны вокруг фильтровальной бумаги. Были использованы следующие культуральные среды:
A: азотно-основная дрожжевая агаровая среда (pH 7,0)
B: пептон-дрожжевая экстракт-глюкозная агаровая среда (pH 7,0).
Противогрибковая активность соединений формулы I показана в табл. 28.
Антифунгицидная активность соединения формулы I против Candida albicans показана в табл. 29-32.
Защитные свойства соединения формулы I против Candida albicans инфекции показаны на мышах и приведены в табл. 33 и 34.
Метод исследования: пятинедельные мыши Crj: CDF1 были привиты минимумом летальной дозы Candida albicans внутривенно. Исследуемое соединение вводилось орально одноразово, сразу после инфицирования. Активность выражена в единицах ED50, рассчитанных по методу Reed и Muench для степени выживания после 7 дней после инфицирования.
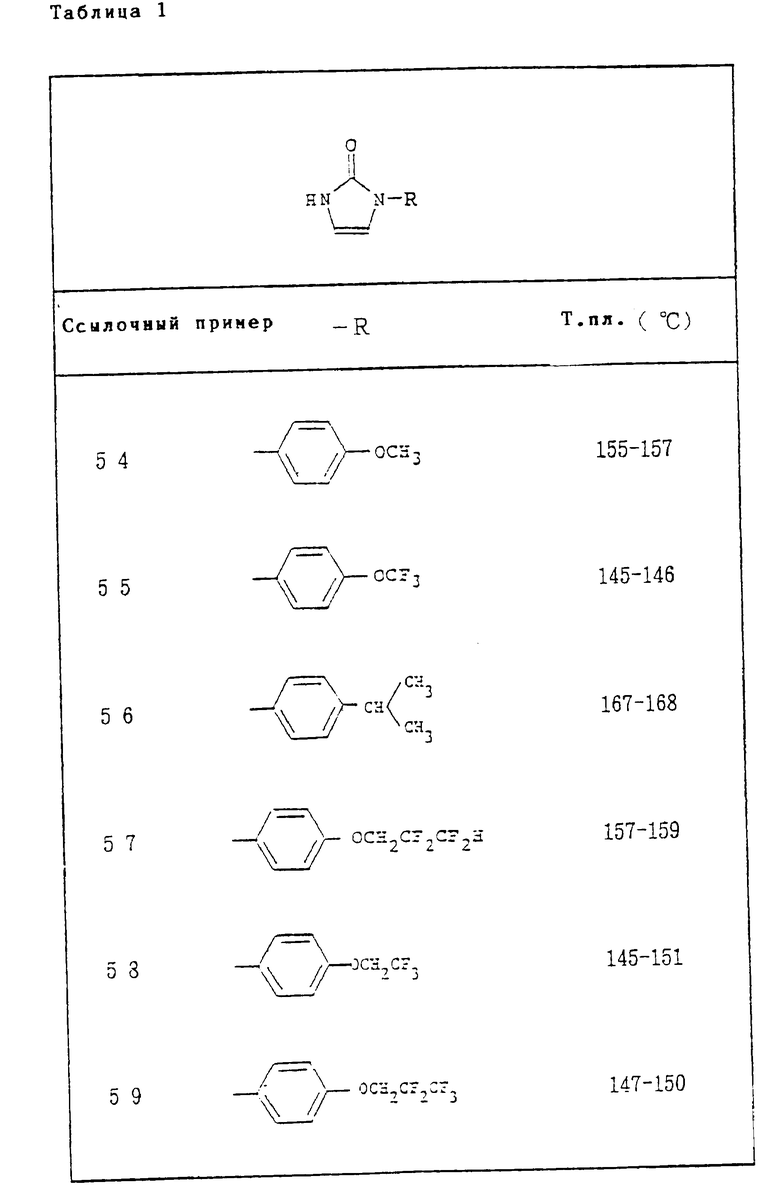
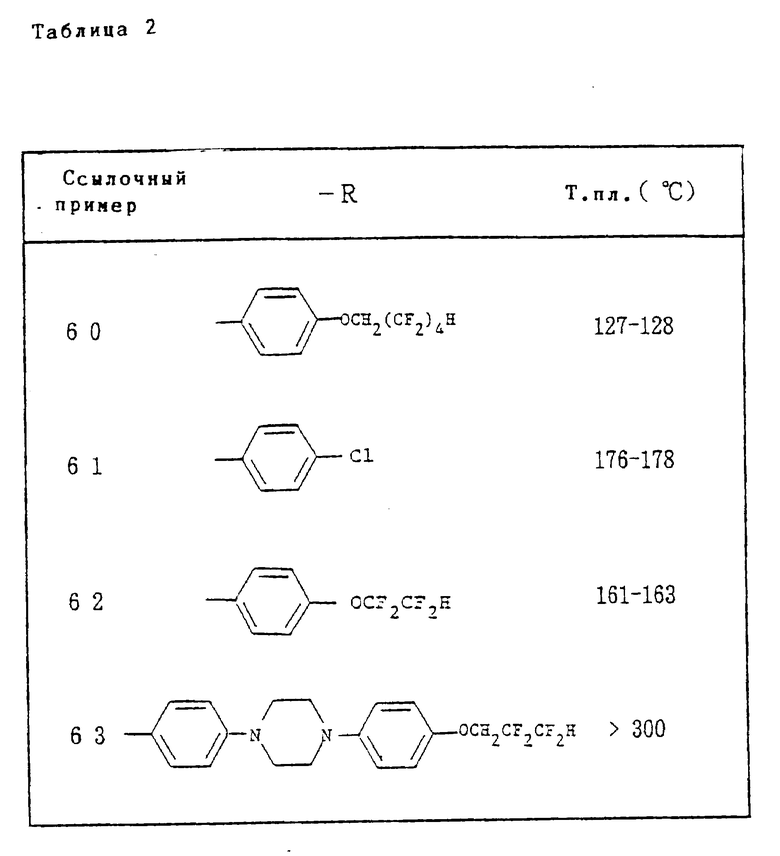
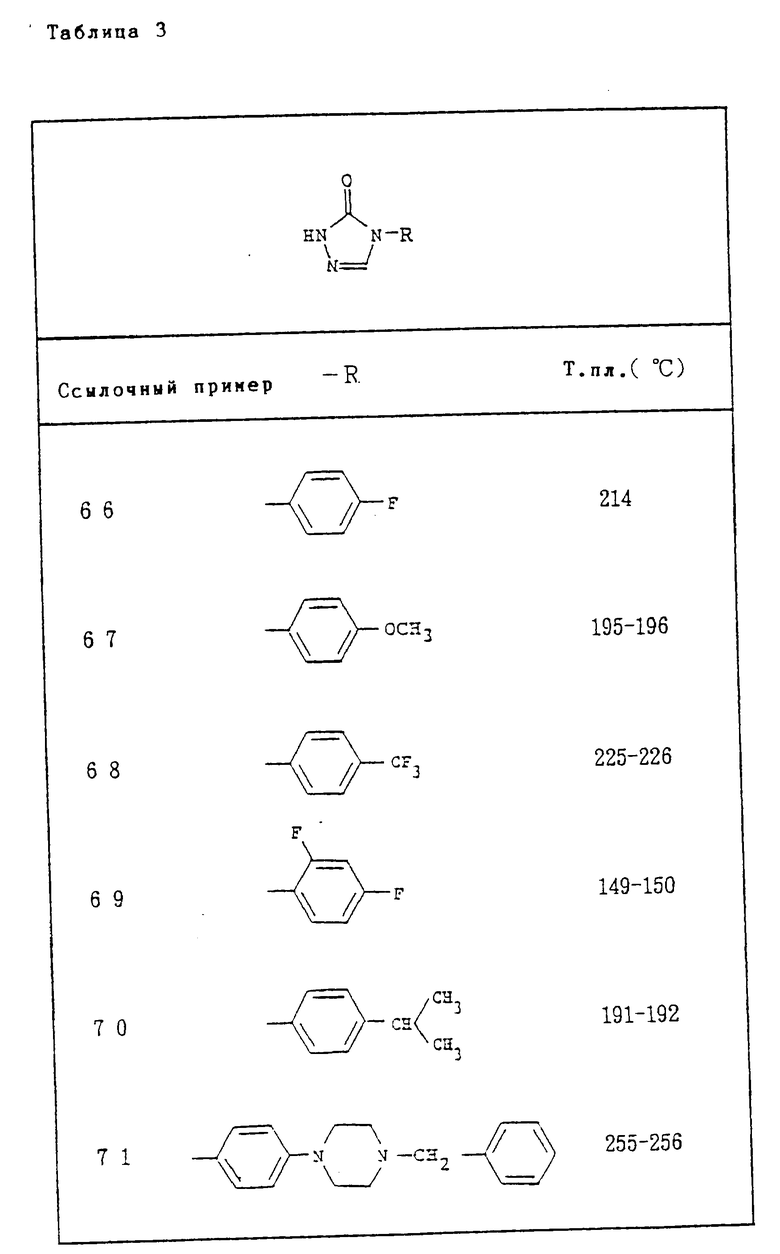
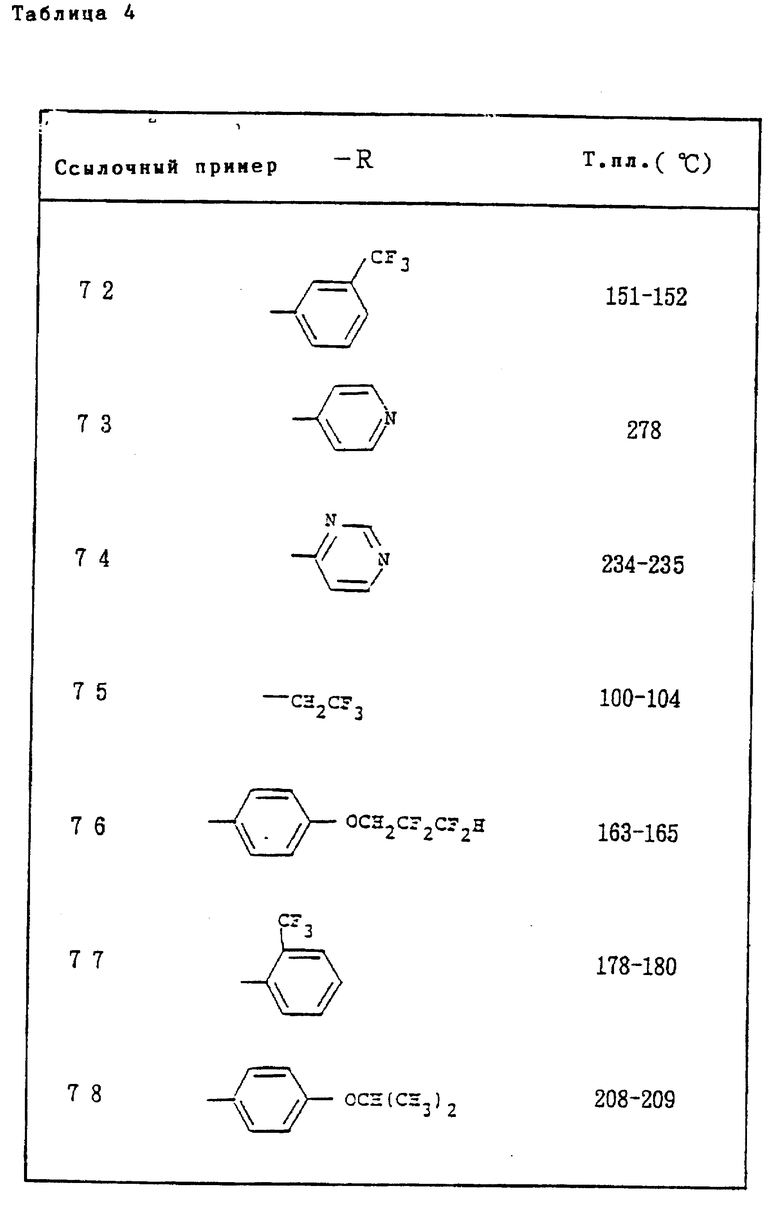
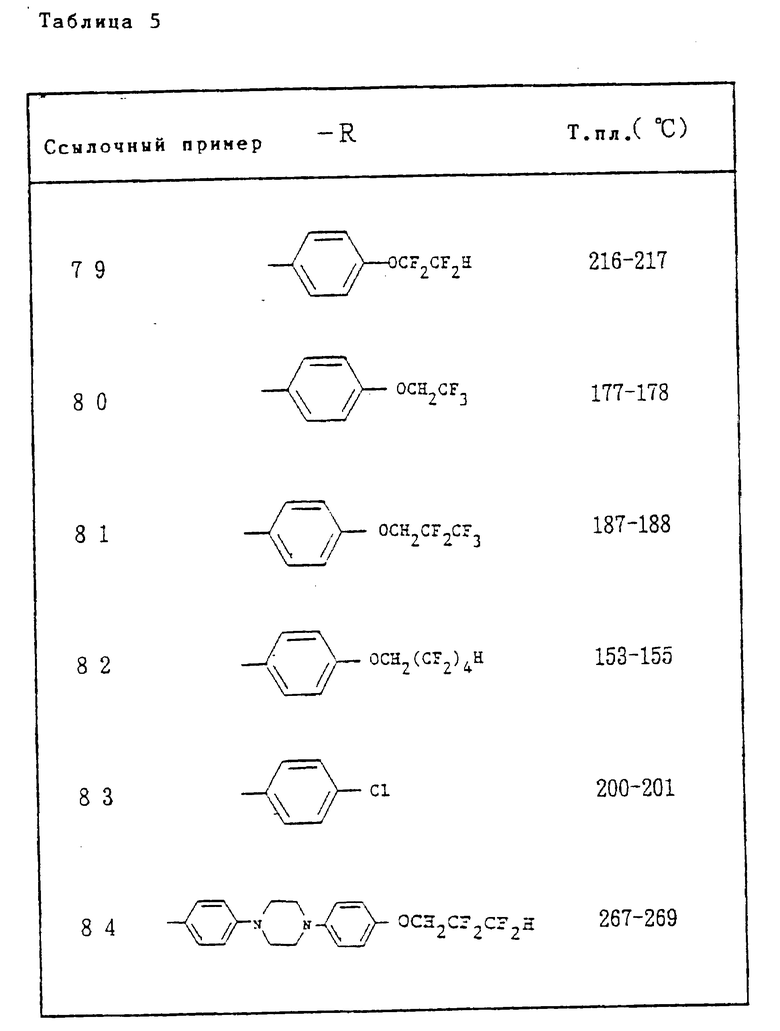
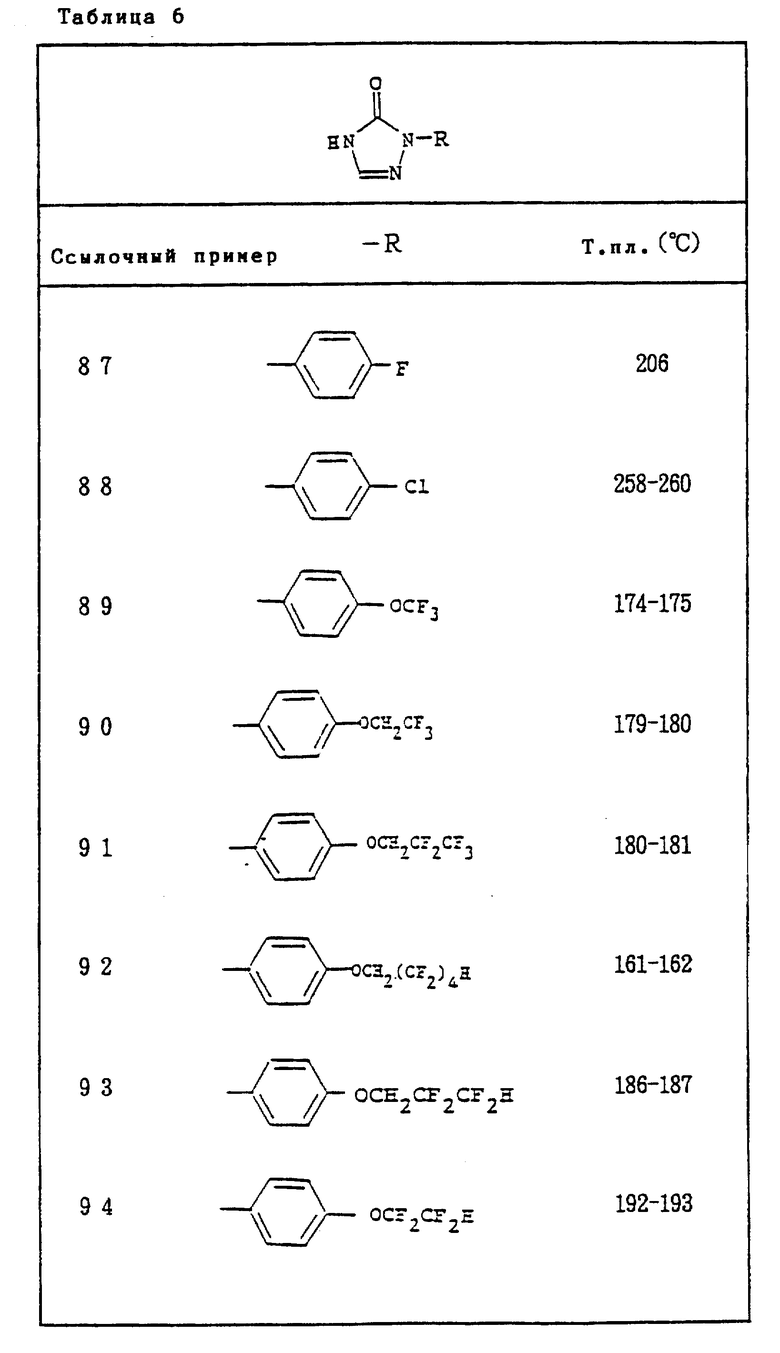
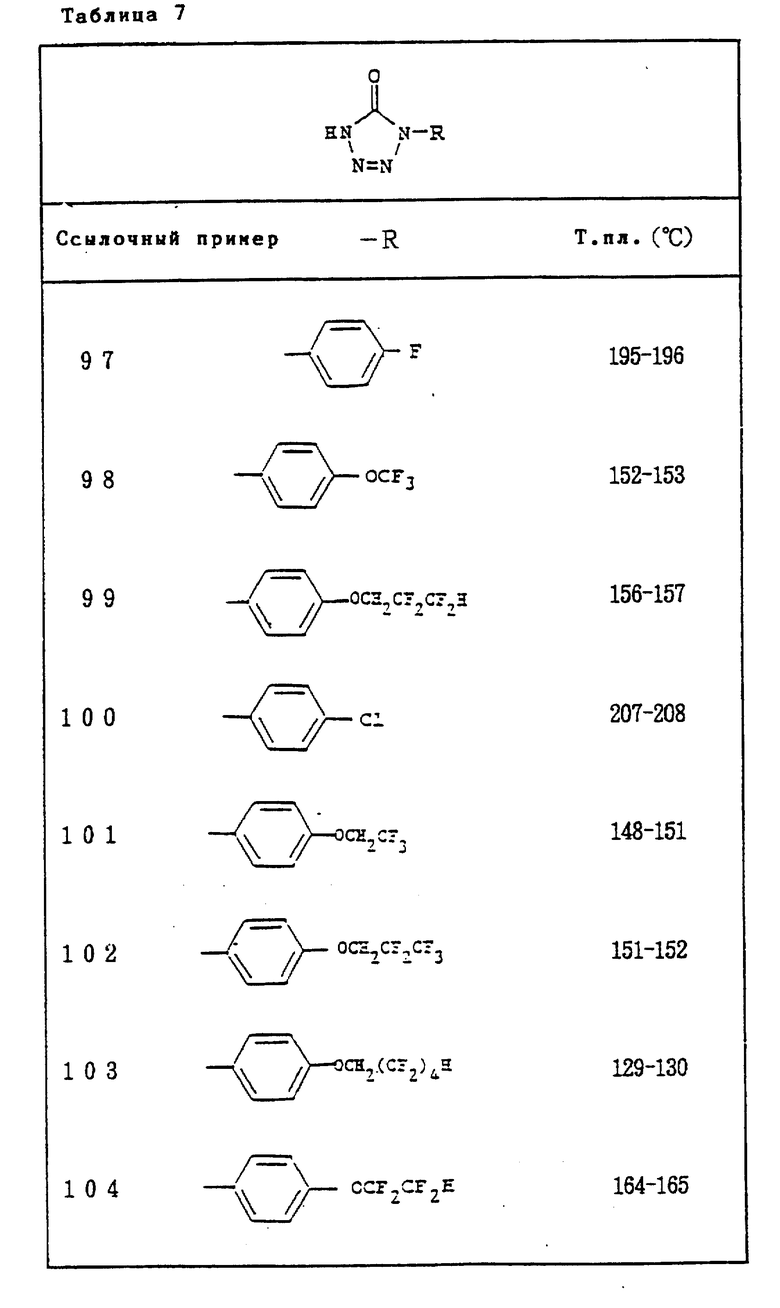
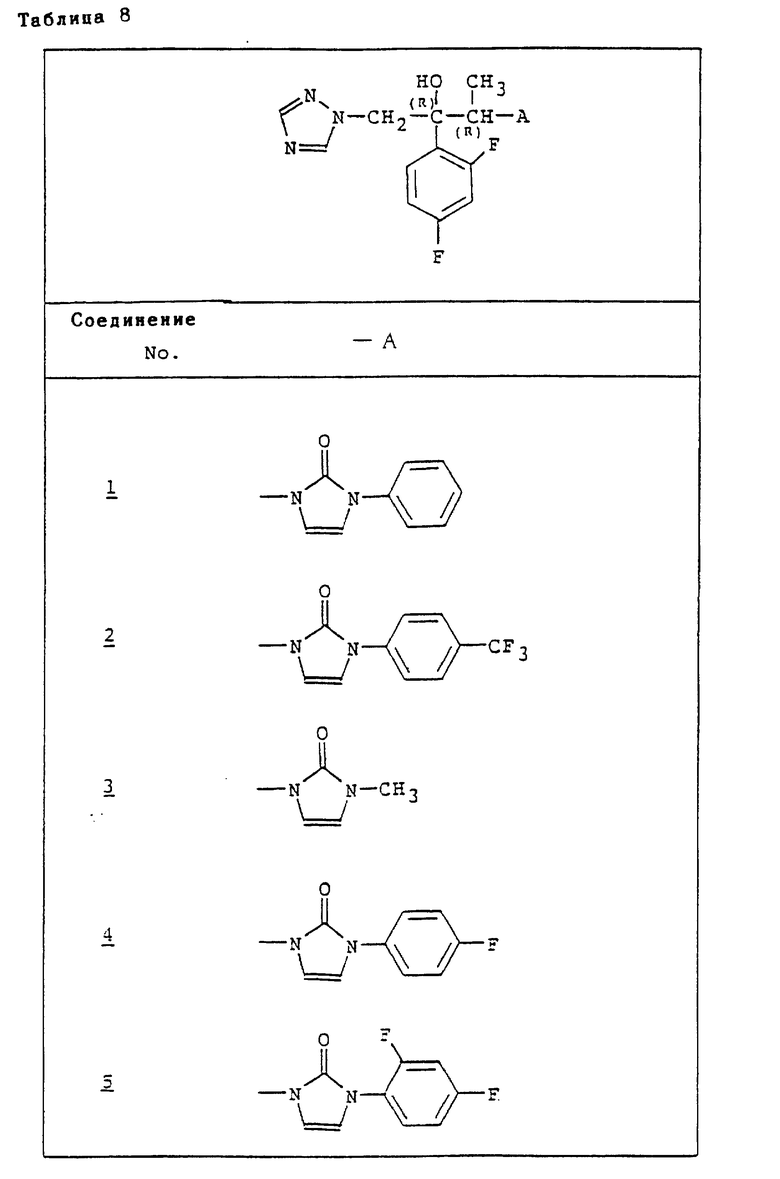
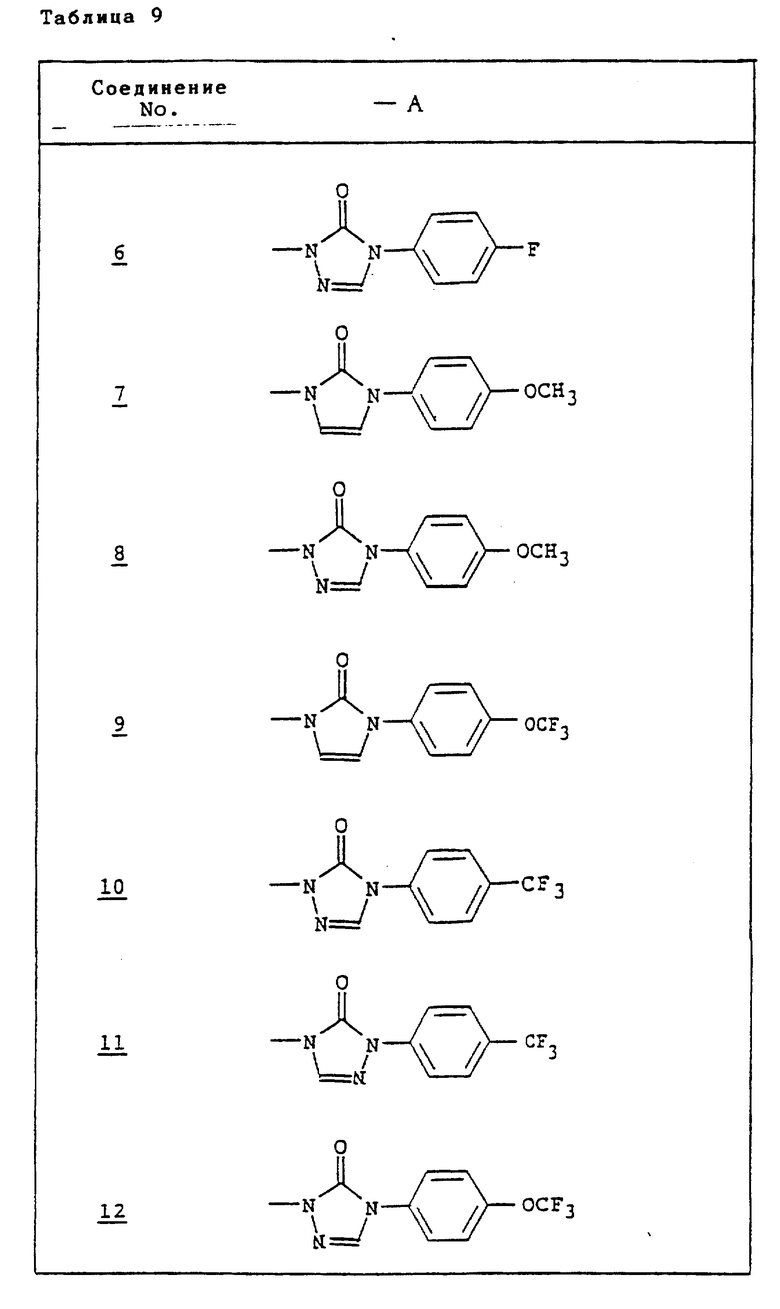
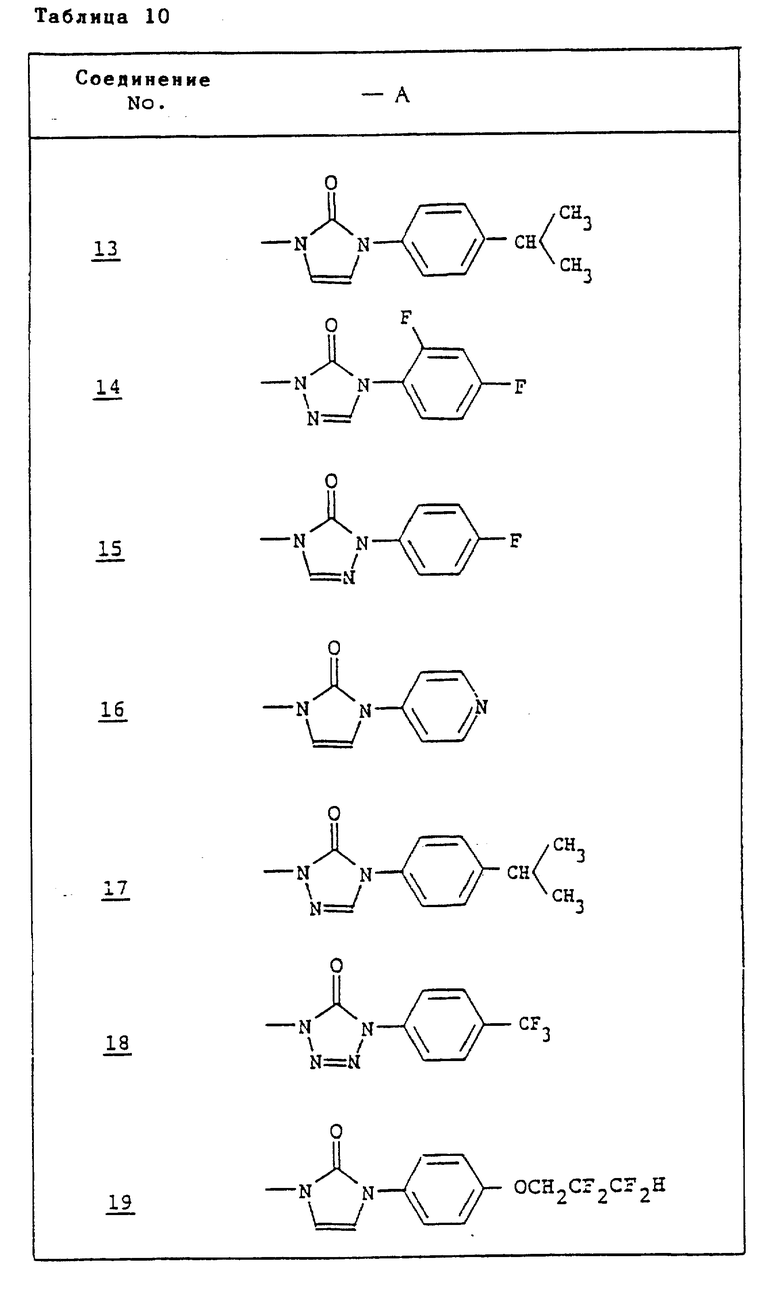
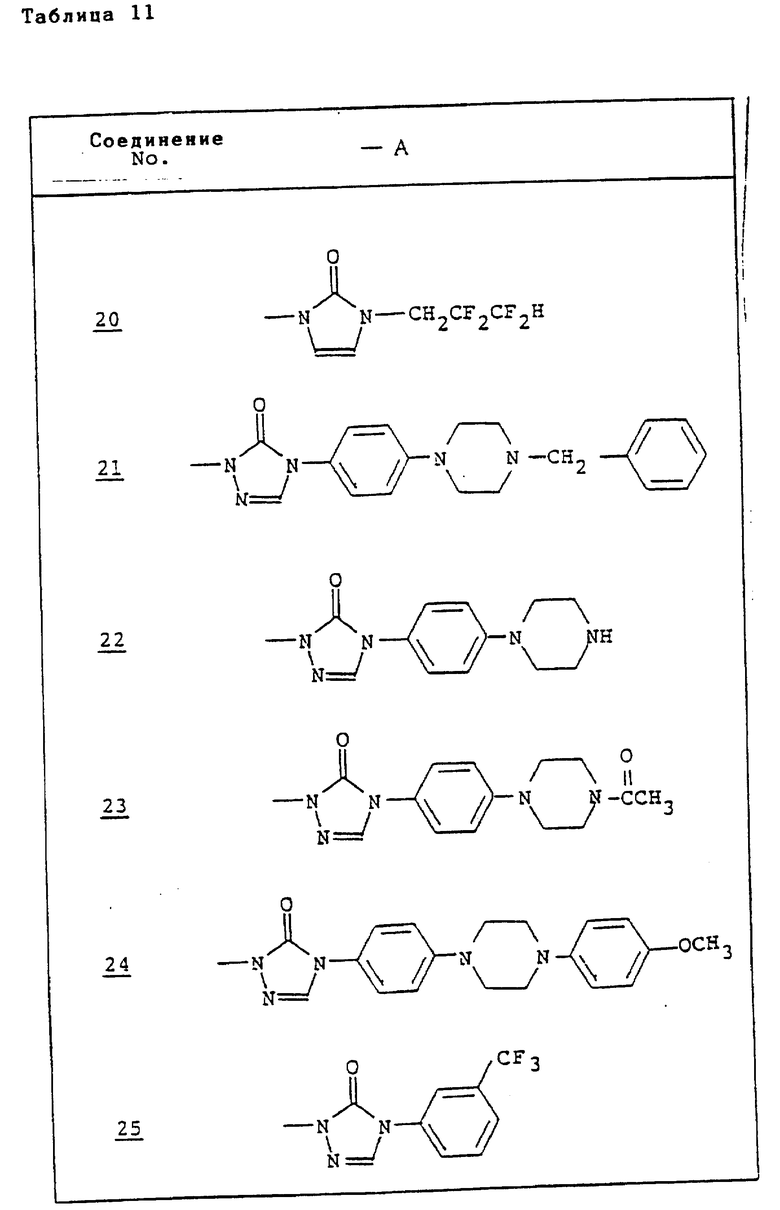
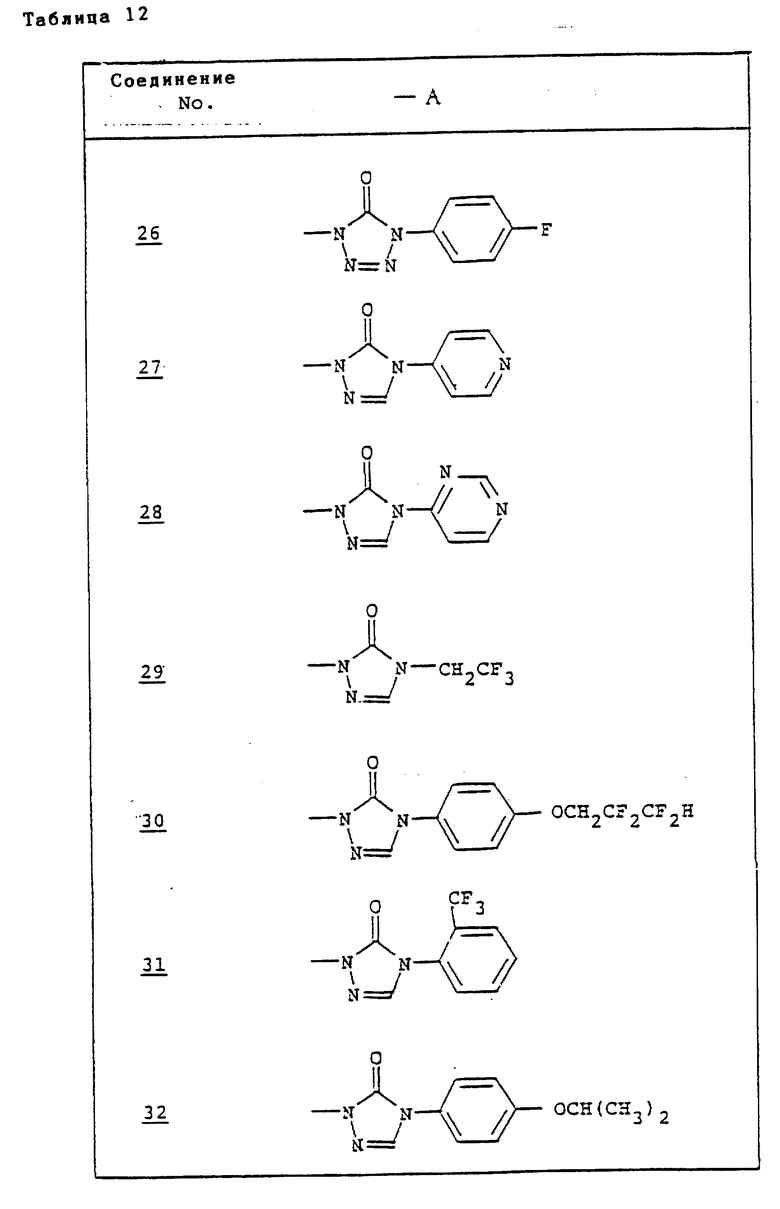
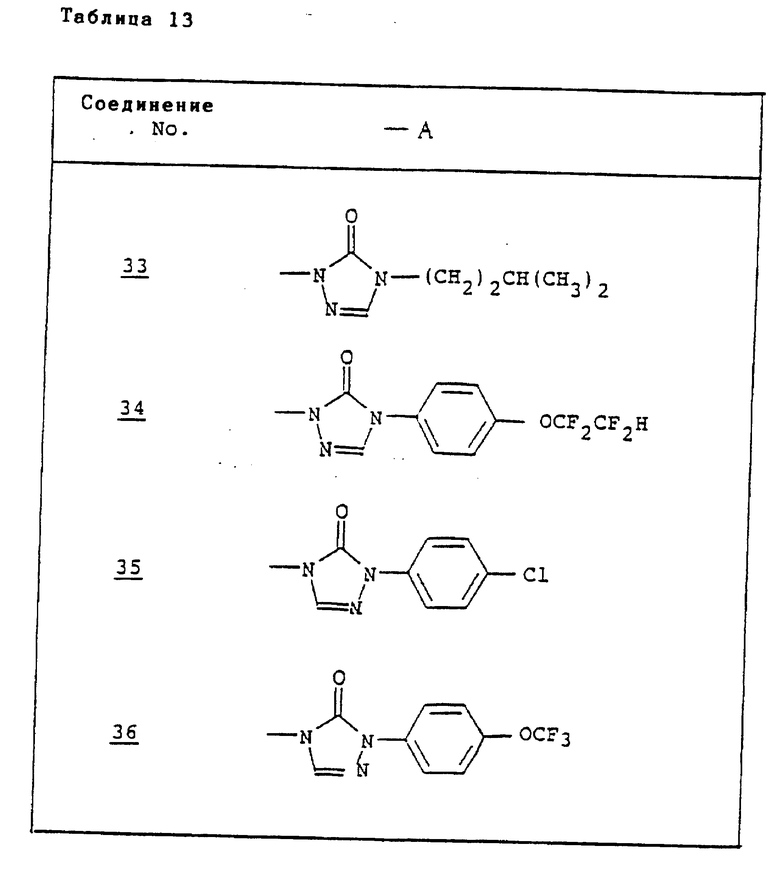
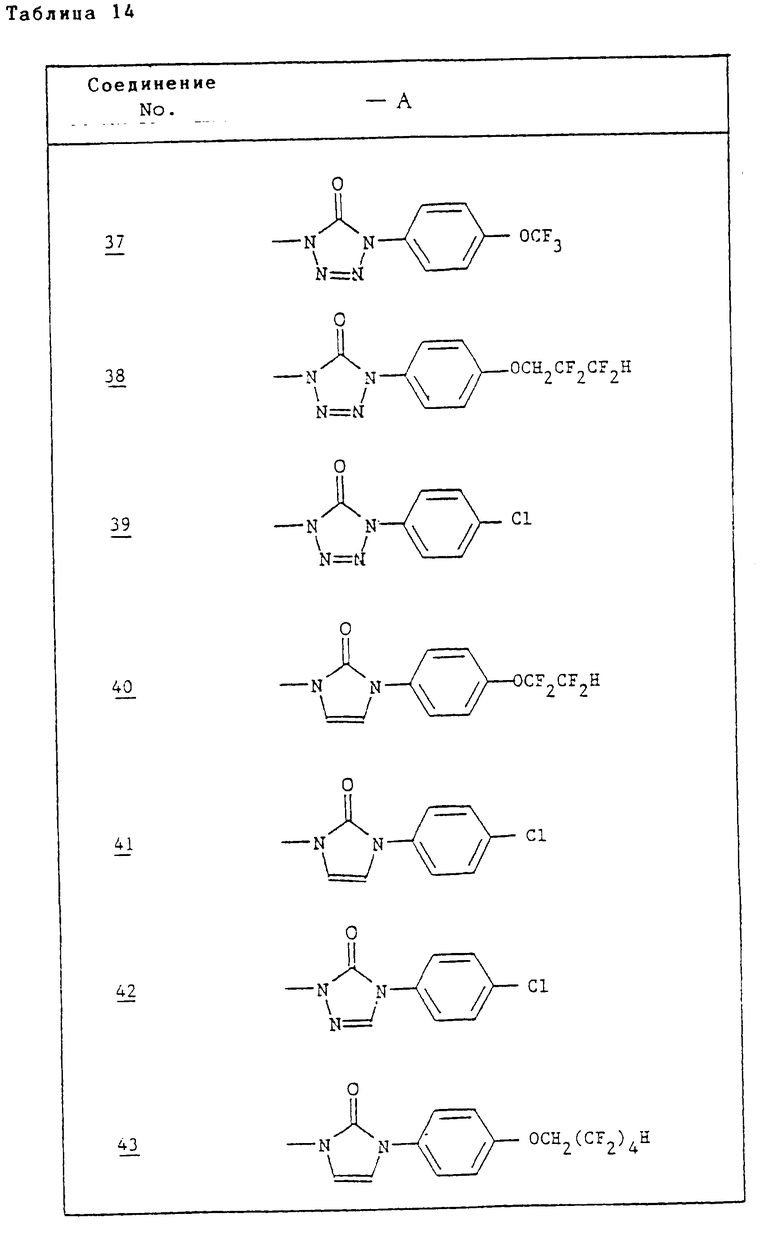
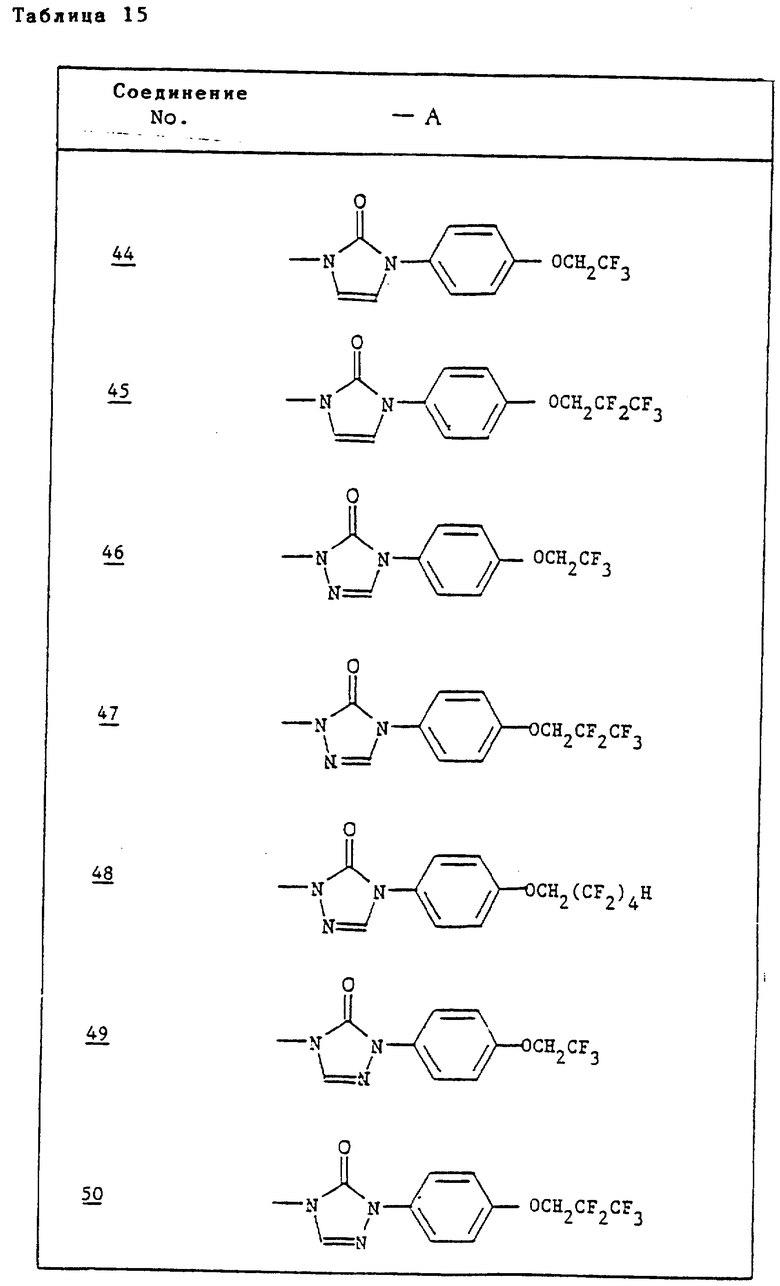
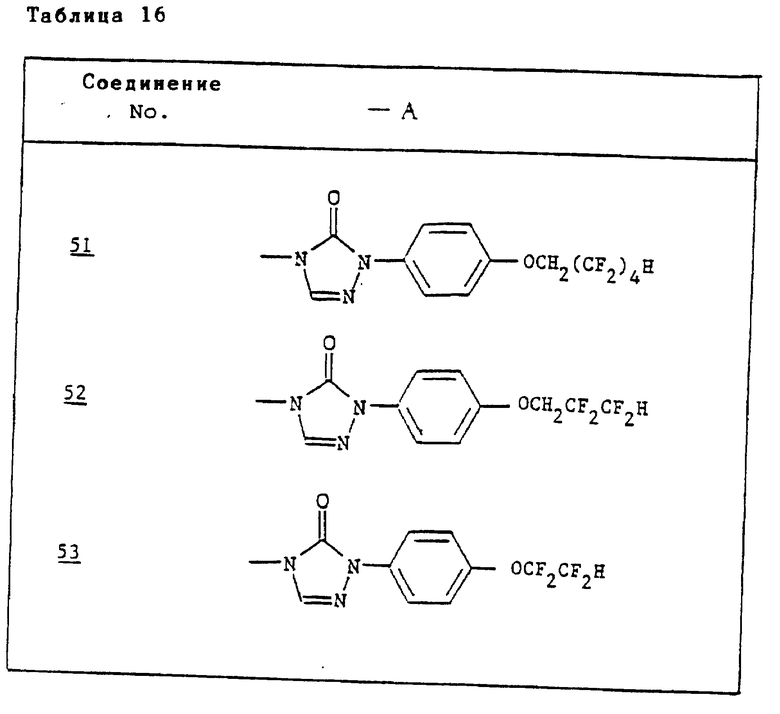
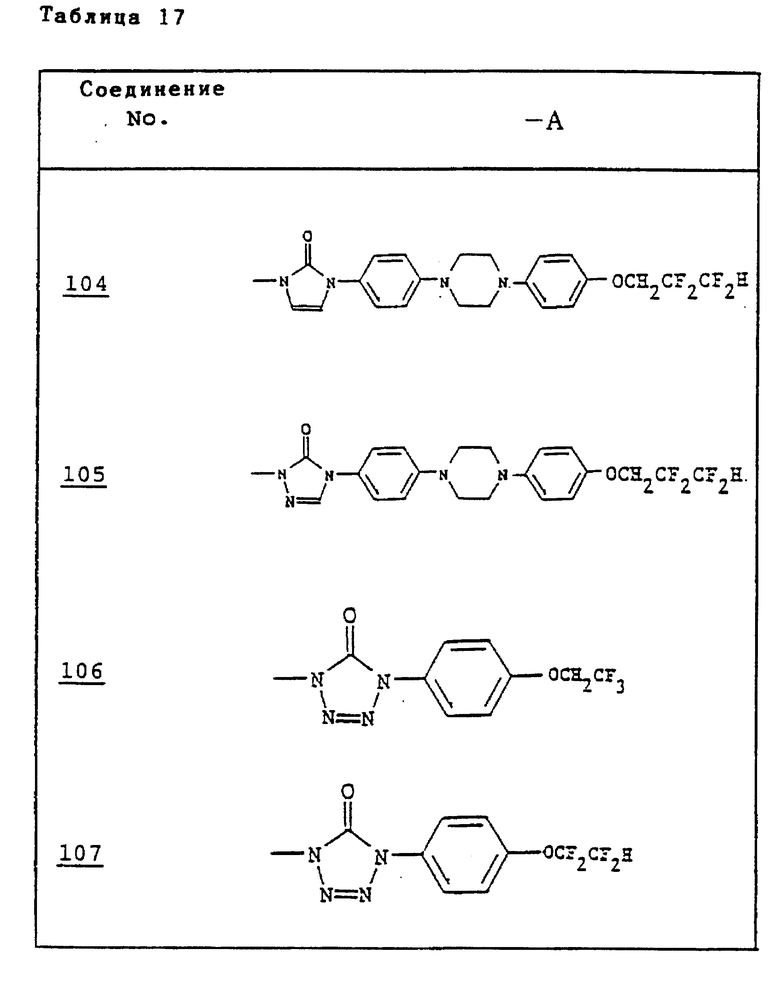
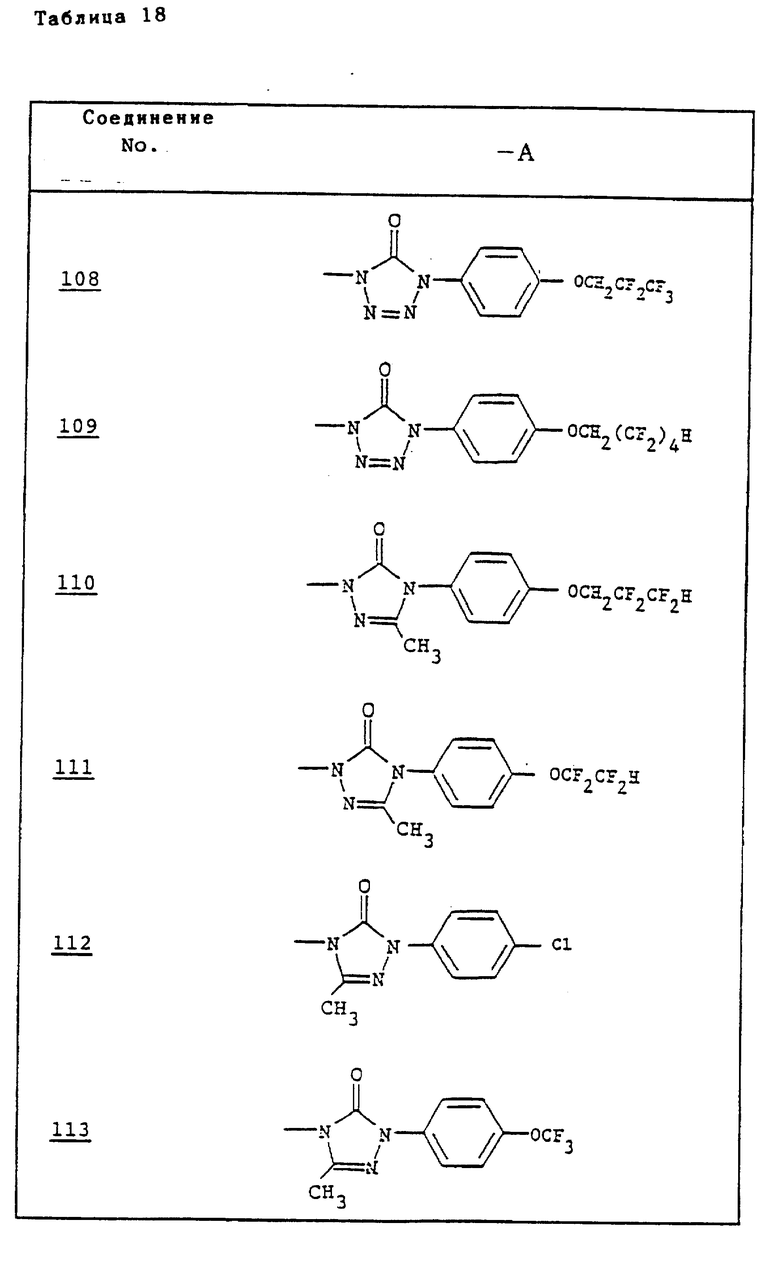
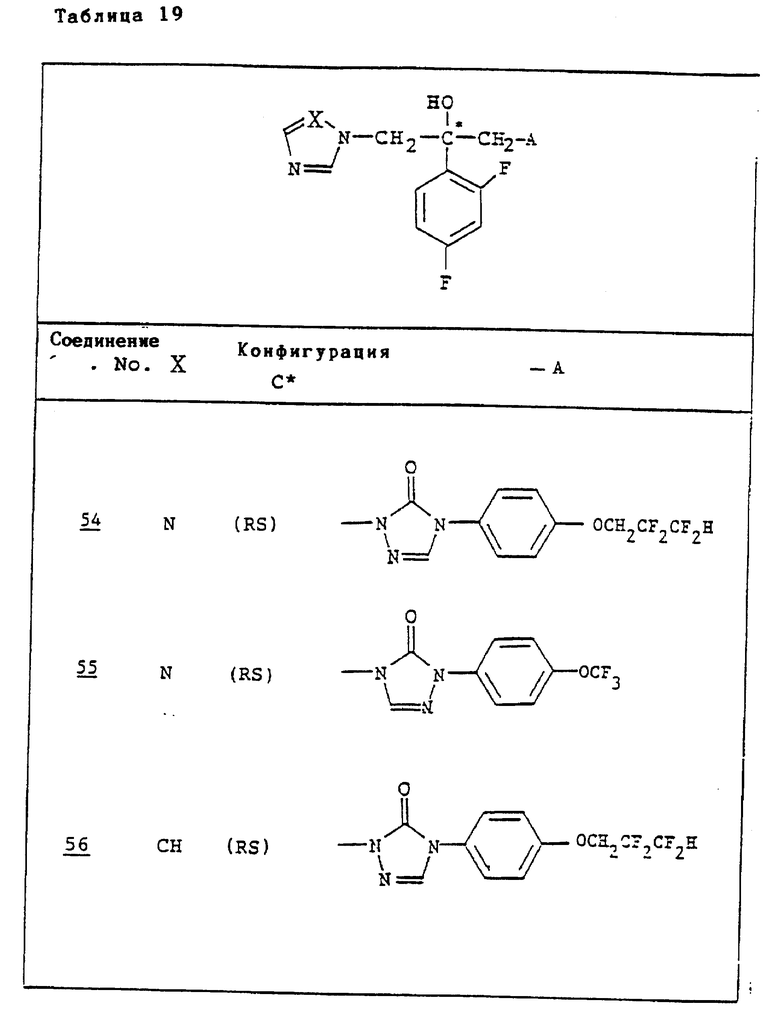
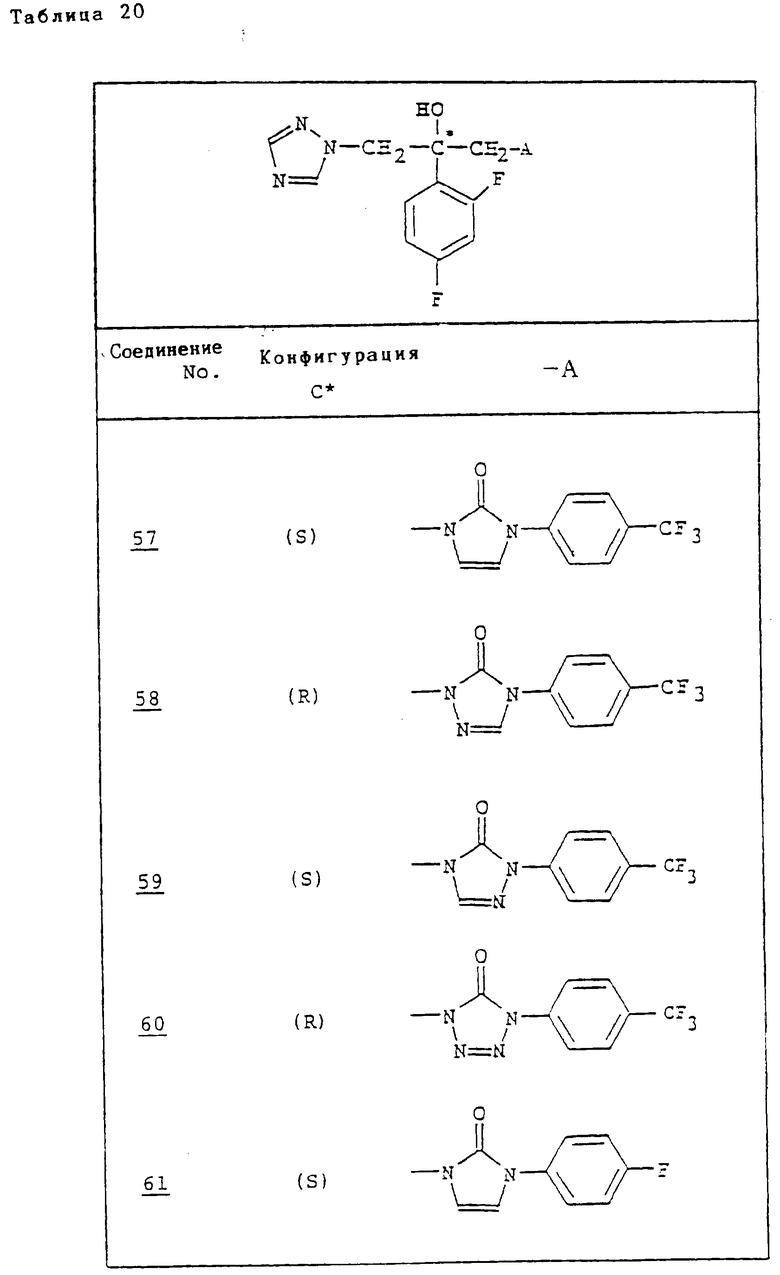
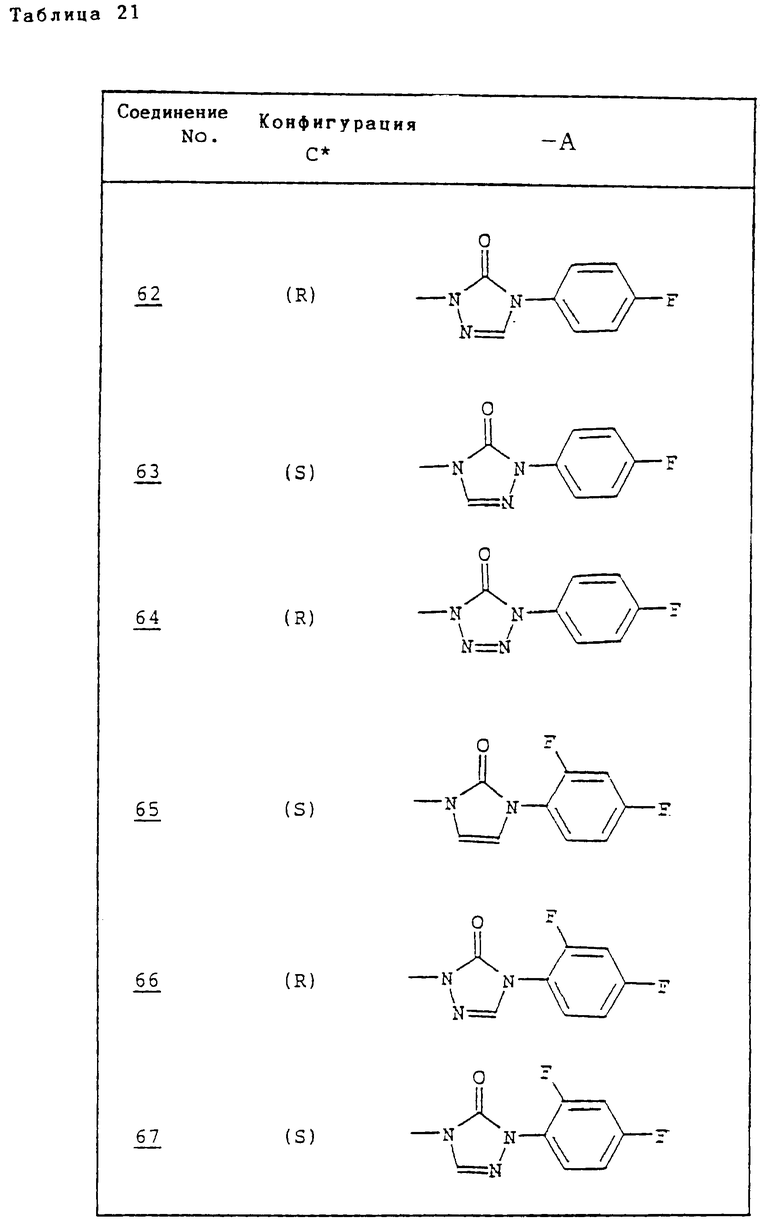
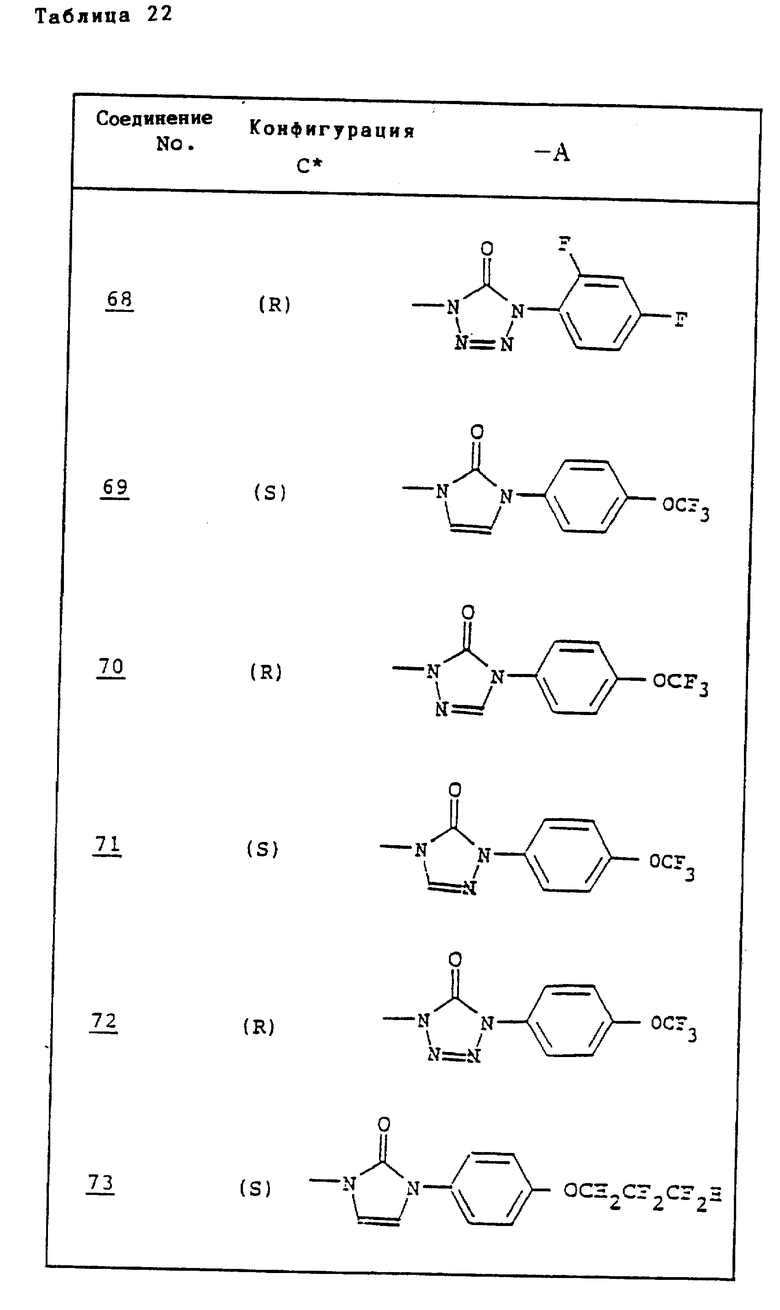
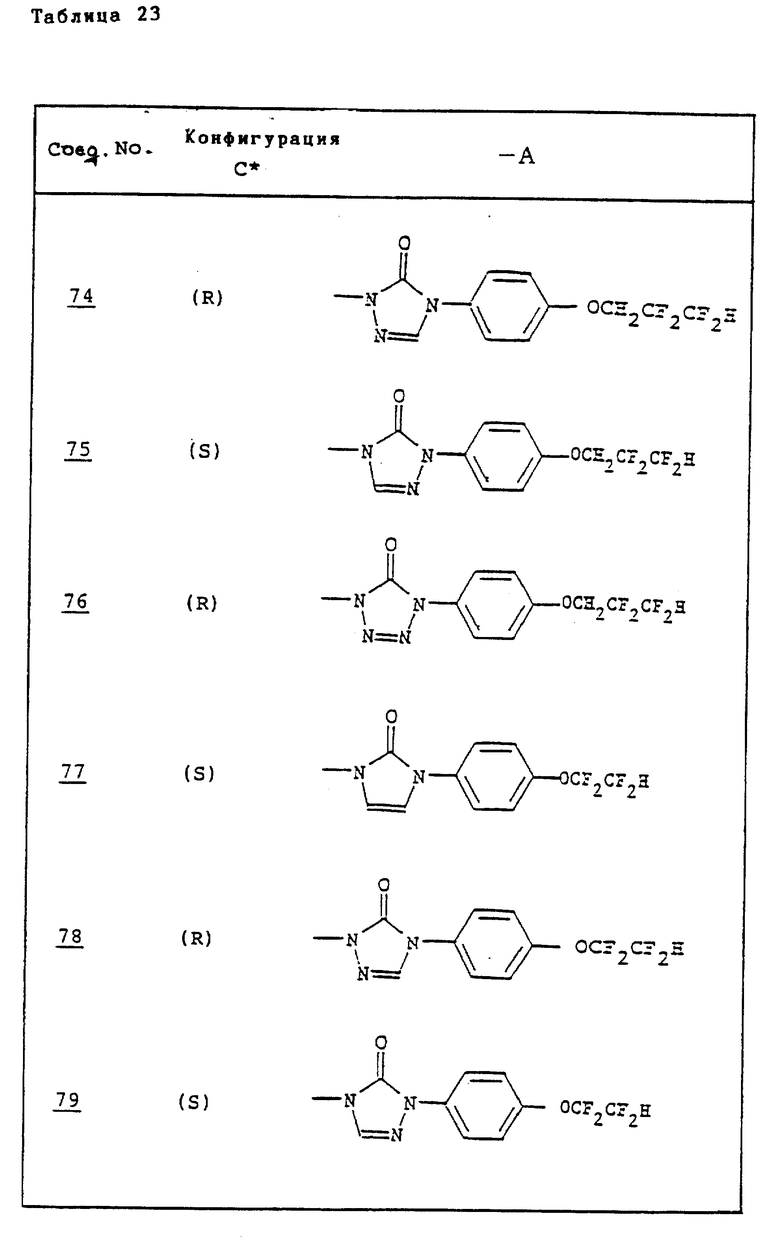
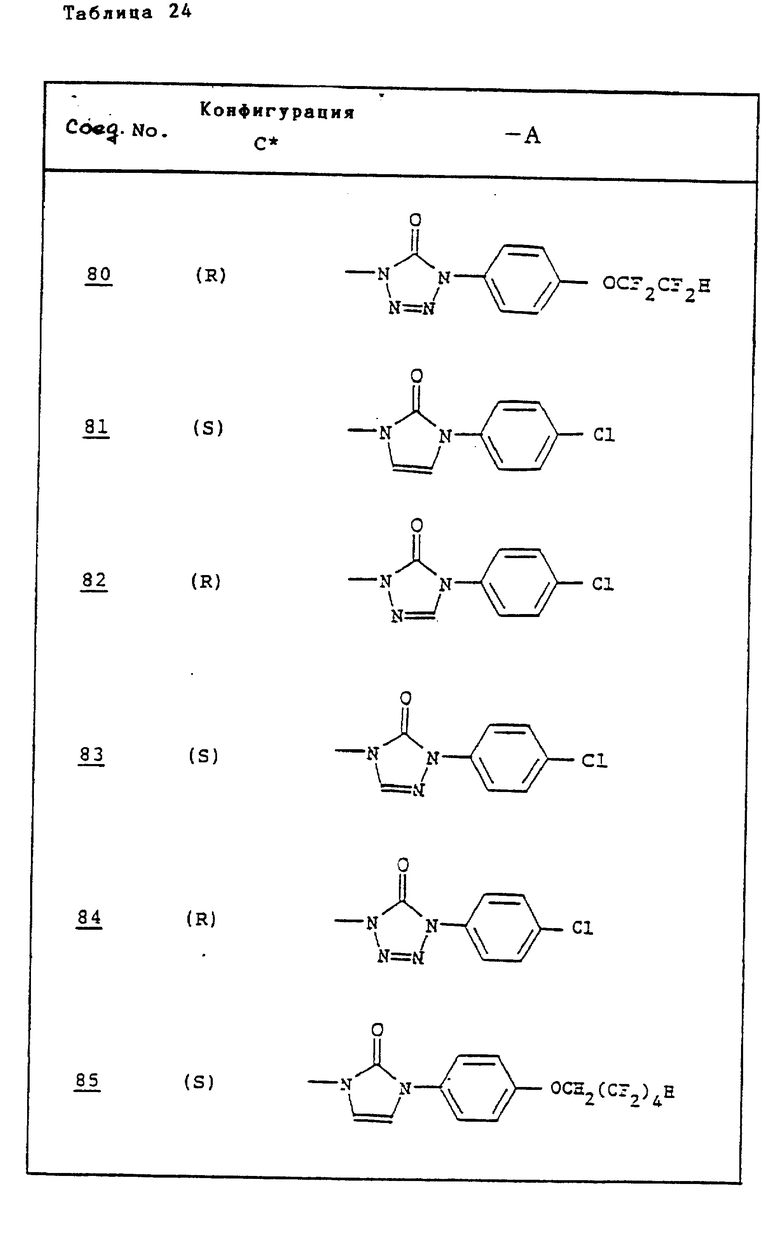
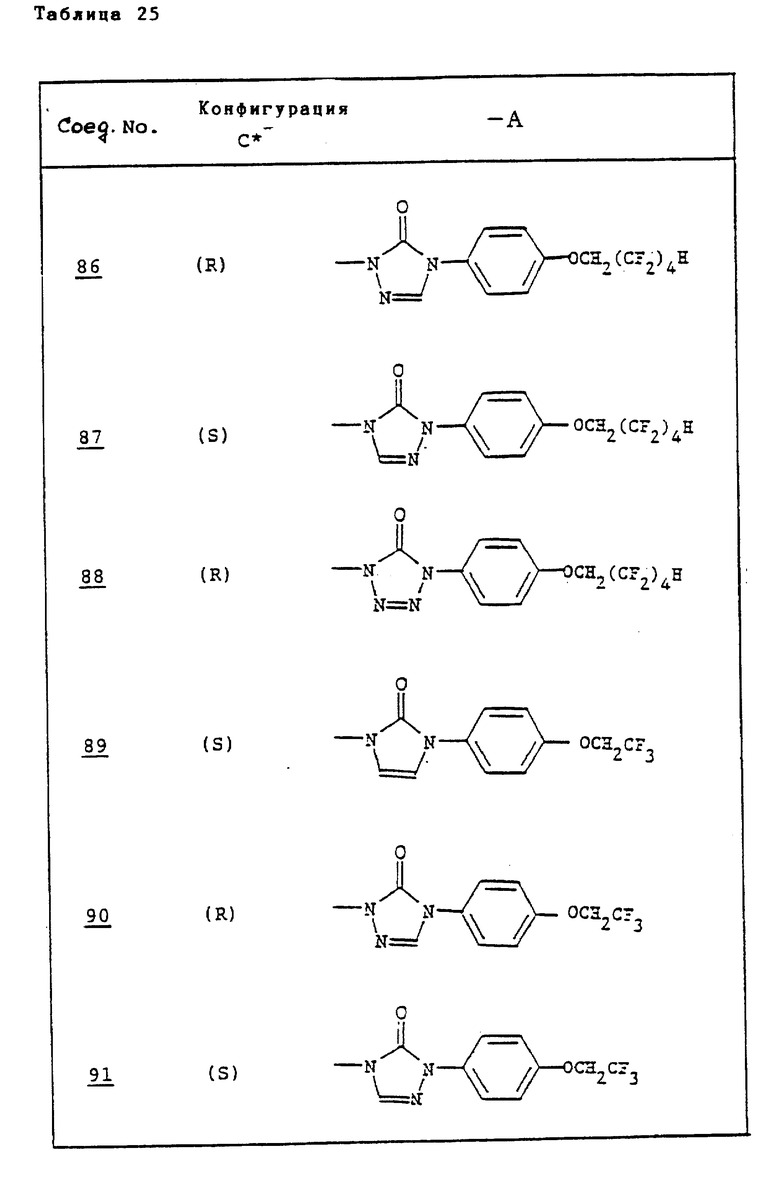
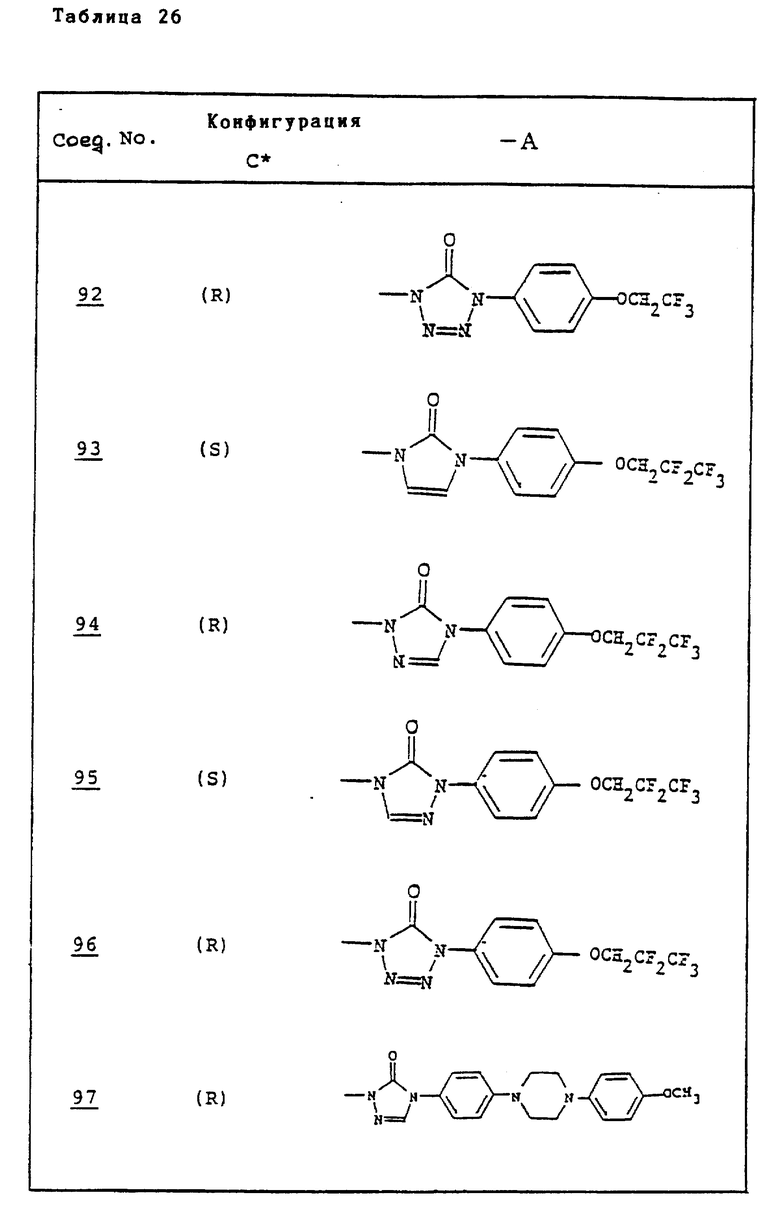
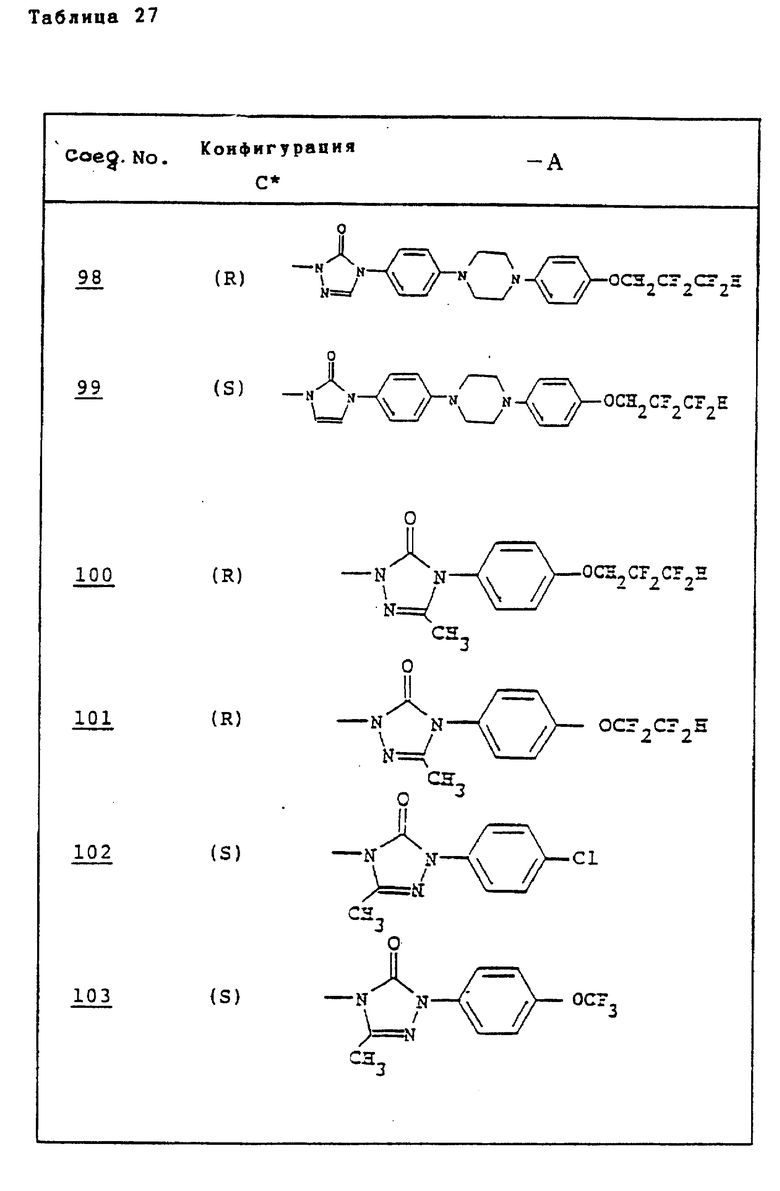
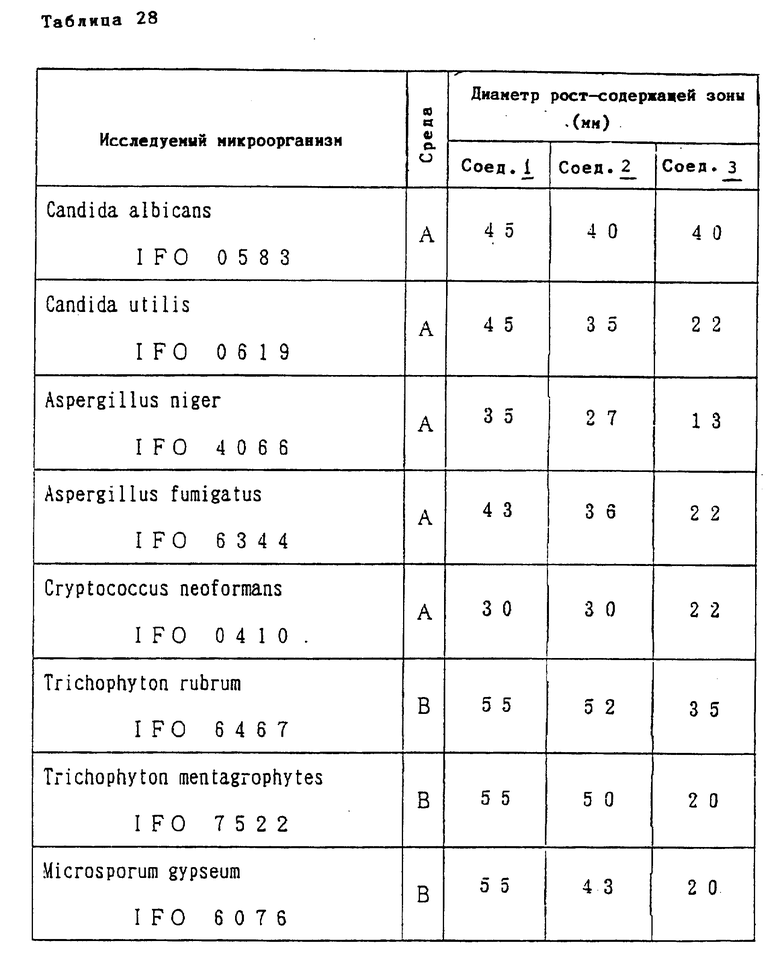
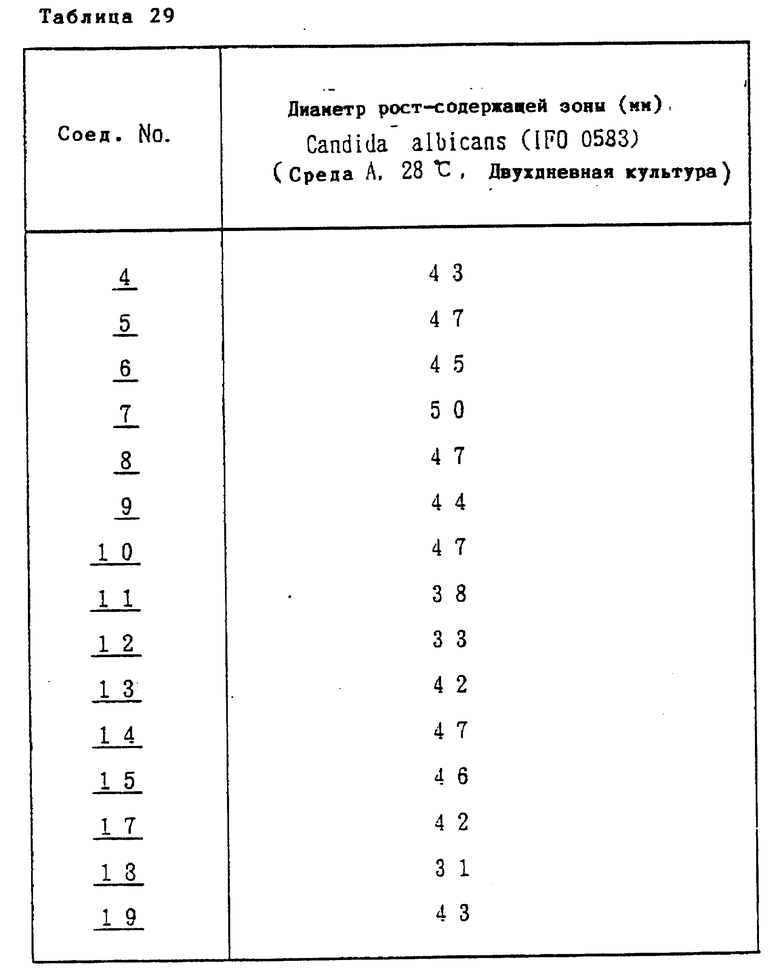
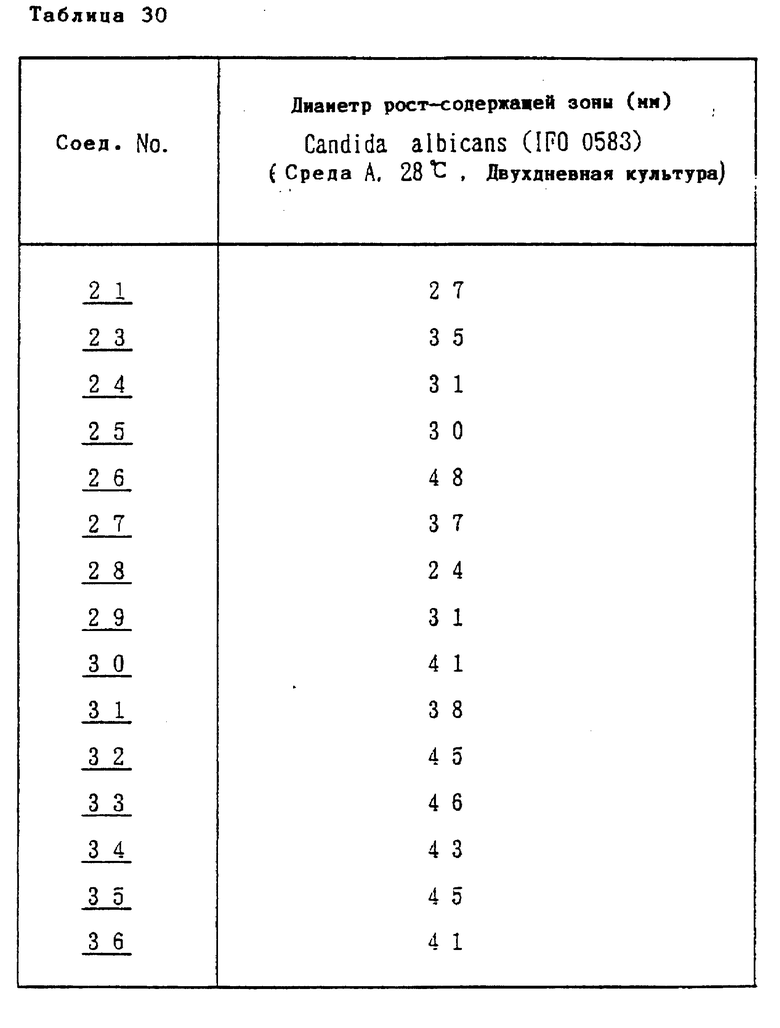




Изобретение может быть использовано в химии гетероциклических соединений и медицине. Описываются новые производные азола общей формулы I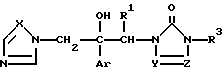
где Ar - галоид; R1 - водород или низший алкил; R3 - низший алкил, возможно замещенный галоидом, фенил, незамещенный или замещенный низшим алкилом, галоидом, трифторметилом, низшим алкокси, галоид (низшим) алкокси, пиперазинилом, бензилпиперазинилом, низшим ацилпиперазинилом, низшим алкоксифенилпиперазинилом, алкильная часть которого может быть замещена галоидом, пиридил или пиримидинилрадикал; X - атом азота или метиновая группа; и Y и Z - независимо являются атомом азота или метиновой группой, которая необязательно может быть дополнительно замещена низшей алкильной группой, или его кислотно-аддитивные соли, обладающие противогрибковой активностью, и фармацевтическая композиция на их основе. Указанные соединения получают путем взаимодействия соединений II и III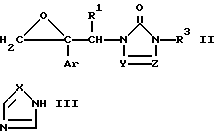
4 c. и 25 з.п.ф-лы, 34 табл.
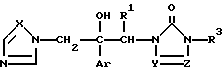
где Ar - дизамещенная галоидом фенильная группа;
R1 - водородный атом или низшая алкильная группа;
R3 - низший алкил, возможно замещенный галоидом, фенил, незамещенный или замещенный низшим алкилом, галоидом, трифторметилом, низшим алкокси, галоид (низшим) алкокси, пиперазинилом, бензилпиперазинилом, низшим ацилпиперазинилом, низшим алкоксифенилпиперазином, алкильная часть которого может быть замещена галоидом, пиридил или пиримидинилрадикал;
X - атом азота или метиновая группа;
Y и Z, независимо, - атом азота или метиновая группа, которая необязательно может быть дополнительно замещена низшей алкильной группой,
или его кислотноаддитивные соли.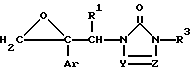
где значения радикалов те же, что указаны для формулы I,
с соединением, представленным формулой III
где значения радикалов те же, что указаны для формулы I,
или его солью.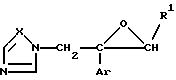
где значения радикалов те же, что указаны для формулы I,
или его соли с соединением, представленным формулой V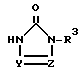
где значения радикалов те же, что указаны для формулы I,
или с его солью.
| EP, 332387, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, 136063, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, 122056, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, 1220693, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-07-27—Публикация
1993-04-27—Подача