Изобретение относится к производным триазолопиридазина и их солям, способу их получения, полупродуктам и фармацевтическим препаратам. Производные триазолопиридазина и их соли настоящего изобретения обладают антиаллергической, противовоспалительной и антиФАТ-активностью (ФАТ - фактор активации тромбоцитов) и вследствие свойства ингибировать бронхоспазм и бронхостеноз могут использоваться в качестве антиспазматических средств.
В то время как большое число триазолопиридазиновых соединений синтезируют в последнее время для использования в качестве лекарственных средств, эффективных против различных заболеваний, патент США 3915968 предлагает соединения формулы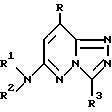
в которой R и R3 - водород или низший алкил (по меньшей мере один из R и R3 - низший алкил);
R1 и R2 вместе с атомом азота - гетероциклическая группа, выбранная из пирролидина, пиперидина, пиперазина и морфолина,
или их соли;
патент США 4136182 предлагает соединения формулы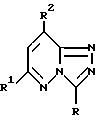
в которой R - водород, фенил или низшая алкилкарбониламиногруппа;
R1 - морфолино- или пиперидиногруппа;
R2 - водород или низший алкил при условии, что по меньшей мере один из R и R2 отличен от водорода и что если R - фенил, то R1 - морфолиногруппа и R2 - низший алкил,
или их соли.
Европейский патент A 0248413 предлагает соединения формулы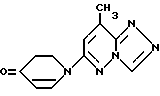
или их соли. Все соединения применимы в качестве бронхолитических средств, эффективно ослабляющих бронхоспазм.
Хотя множество антиастматических лекарственных средств уже имеются в продаже, но ни одно из них не является удовлетворительным с точки зрения длительности действия, безопасности и других свойств. Таким образом, необходим поиск новых соединений, обладающих большей антиаллергической, противовоспалительной и антиФАТ-активностью и удовлетворяющих требованиям длительности действия, безопасности и другим свойствам.
Авторы изобретения изучили химические модификации 1,2,4-триазоло[1,5-b] пиридазинов в положении 6 и нашли, что новый ряд производных, структурно отличный от вышеупомянутых известных соединений, неожиданно показывает высокую антиаллергическую, противовоспалительную и антиФАТ-активности при превосходной длительности действия и безопасности. Авторы также нашли, что эти соединения ингибируют бронхоспазм и бронхостеноз и, следовательно, могут быть использованы в качестве эффективных антиастматических средств. Эти находки и легли в основу выполнения настоящего изобретения.
Настоящее изобретение предлагает
1) соединение формулы I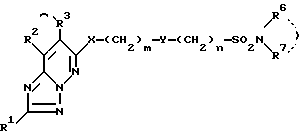
в которой R1 - водород, возможно замещенный низший алкил или галоген;
R2 и R3 - водород или возможно замещенный низший алкил, или R2 и R3 вместе с соседней группой -C=C- образуют 5-7-членное кольцо;
X - кислород или S(O)p (p = 0-2);
Y-группа -CR4R5- (R4 и R5 - водород или возможно замещенный низший алкил) или двухвалентная группа, производная возможно замещенного 3-7-членного (гомо- или гетероциклического кольца;
R6 и R7 - водород, возможно замещенный низший алкил, возможно замещенный циклоалкил или возможно замещенный арил, или R6 и R7 вместе с соседним атомом азота образуют возможно замещенный азотсодержащий гетероциклический радикал;
m = 0-4,
n = 0-4,
и их соли,
2) способ получения соединений, описанных в п. 1), который заключается в реакции соединений формулы II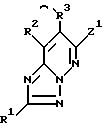
в которой Z1 - реакционноспособная группа;
R1, R2 и R3 определены выше,
или их солей с соединениями формулы III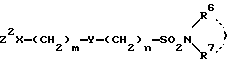
в которой Z2 - группа, уходящая при реакции с Z1;
X, Y, R6, R7, m и n определены выше,
или их солями,
3) способ получения соединений, описанных в п. 1), который заключается в реакции соединений формулы IV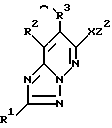
в которой Z2, R1, R2, R3 и X определены выше,
или их солей с соединениями формулы V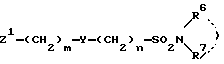
где Z1, Y, R6, R7, m и n определены выше,
или их солями,
4) способ получения соединений, описанных в п. 1, который заключается в реакции соединений формулы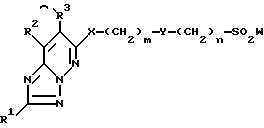
в которой W - уходящая группа;
R1, R2, R3, X, Y, m и n определены выше,
или их солей с соединениями формулы VII
где R6 и R7 определены выше, или их солями,
5) антиастматические препараты, характеризующиеся содержанием соединений формулы I или их солей,
6) антиФАТ-препараты, характеризующиеся содержанием соединений формулы I или их солей,
7) соединения формулы VI или их соли.
Следует понимать, что если соединения формулы I или их соли содержат асимметрический атом углерода в своей структуре, то они присутствуют в форме оптически активных изомеров или рацемических смесей и что эти изомеры и смеси попадают в рамки изобретения.
На всем описании термин "низший алкил" обозначает нормальный или разветвленный C1-C6-алкил, включая метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, н-гексил и т.д.
Термин "циклоалкил" обозначает C3-C6-циклоалкил, включая циклопропил, циклобутил, циклопентил и циклогексил.
Термин "арил" обозначает C6-C14-арил, включая фенил, нафтил и т.д.
Заместители, которыми 1-4-кратно может быть замещен "низший алкил" и "циклоалкил", выбирают из гидрокси-, амино-, карбокси-, нитро-, моно- или ди(низший)алкиламино- (например, моно- или ди-C1-C6-алкиламиногруппы, такой как метиламино-, этиламино-, пропиламино-, диметиламино- или диэтиламиногруппа и т. д. ), низшей алкокси- (например, C1-C6-алкоксигруппы, такой как метокси-, этокси-, пропокси- или гексилоксигруппа и т.д.) или низшей алкилкарбонилоксигруппы (например, C1-C6-алкилкарбонилоксигруппы, такая как ацетокси- или этилкарбонилоксигруппа и т.д.), или галогена (например, фтор, хлор, бром и йод) и т.д.
Заместители, которыми может быть замещен "арил" 1-5-кратно, выбирают из возможно замещенного низшего алкила, возможно замещенной аминогруппы, ацетамидо-, гидрокси-, карбокси-, нитро- или низшей алкоксигруппы (например, C1-C6-алкоксигруппы, такой как метокси-, этокси- или пропоксигруппа и т.д.), низшей алкилкарбонилоксигруппы (например C1-C6-алкилкарбонилоксигруппы, такой как ацетокси- или этилкарбонилоксигруппа и т. д. ) или галогена (например фтора, хлора, брома и иода) и т.д. В этой связи заместители, которыми низший алкил (например C1-C6-алкил, такой как метил, этил, пропил и т. д. ) может быть замещен 1-4-кратно, выбирают из гидрокси-, амино-, моно- или ди(низший)алкиламиногруппы (например моно- или ди-C1-C6-алкиламиногруппы, такой как метиламино-, этиламино-, пропиламино-, диметиламино- или диэтиламиногруппа и т. д.), низшей алкоксигруппы (например C1-C6-алкоксигруппы, такой как метокси-, этокси-, пропокси- или гексилоксигруппа и т.д.) или галогена (например фтора, хлора, брома и иода) и т.д. Заместители, которыми 1-2-кратно может быть замещена аминогруппа, выбирают из C1-C6-алкила (например метила, этила, пропила и т.д.) или аминогруппа является 5-7-членной циклической аминогруппой (например пирролидино-, мофолино-, пиперидино- или пиперазиногруппа и т.д.) и т.д.
Термин "галоген" обозначает фтор, хлор, бром или иод, например.
5-7-членное кольцо, образуемое вместе с группой -C=C-, обозначает 5-7-членное кольцо, например кольцо с 1-4 гетероатомами, выбранными из азота, кислорода, серы и т. д., в добавление к атомам углерода. Таким образом, в частности, 5-7-членное углеводородное кольцо, например C5-C7-циклоалкены, такие как циклопентен, циклогексен, циклогептен и т.д., бензол и т.д., и 5-6-членные азотсодержащие гетероциклические группы, состоящие из атомов углерода и азота, такие как пиррол, пиридин, пиперидин и т.д., могут быть упомянуты в качестве обычных примеров.
Термин "3-7-членное гомоциклическое кольцо" обозначает 3-7-членное кольцо, состоящее исключительно из атомов углерода. Таким образом, например, C3-C7-циклоалкены, такие как циклопропан, циклобутан, циклопентан, циклогексан, циклогептан и т.д., C3-C7-циклоалкены, такие как циклопропен, циклобутен, циклопентен, циклогесен, циклогептен и т.д., и бензол, могут быть упомянуты в качестве обычных примеров.
Двухвалентную группу, произведенную из "3-7-членного гомоциклического кольца", получают удалением двух атомов водорода от одного атома углерода или удалением одного атома водорода от каждого из двух атомов углерода. Примеры включают следующие группы
В частности, следующие группы можно привести в качестве обычных примеров
Наиболее предпочтительные примеры включают группы
Термин "3-7-членное гетероциклическое кольцо", содержащее 1-4 гетероатома, выбранных из азота, кислорода, серы и других атомов, в дополнение к атомам углерода. Можно использовать оксетан, тетрагидрофуран, тетрагидропиран, пиррол, азетидин, пирролидин, пиперидин, пиперазин, тетрагидротиофен, гомопиперидин, морфолин и т.д.
Двухвалентную группу, произведенную из "3-7-членного гетероциклического кольца", получают удалением двух атомов водорода от одного атома углерода или одного атома водорода от каждого из двух различных атомов. Примеры включают следующие группы
Термин "азотсодержащая гетероциклическая группа" обозначает группу, образующуюся при удалении одного атома водорода от атома азота в 3-13-членном азотсодержащем гетероциклическом кольце, содержащем один атом азота в дополнение к атомам углерода и, возможно, содержащем 1-4 гетероатома, например, выбранных из азота, кислорода, серы и других атомов. Обычно используют следующие 3-9-членные азотсодержащие гетероциклические группы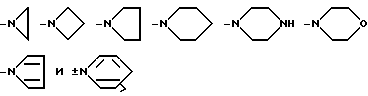
Заместители, которыми 1-5-кратно могут быть замещены "3-7-членное гомоциклическое кольцо", "3-7-членное гетероциклическое кольцо" и "азотсодержащая гетероциклическая группа", выбирают из возможно замещенного низшего алкила, возможно замещенной амино-, гидрокси-, карбокси-, нитро или низшей алкоксигруппы (например C1-C6-алкоксигруппы, такой как метокси-, этокси- или пропоксигруппа и т.д.), галогена (например фтора, хлора, брома и иода) и т.д. В этой связи 1-4 заместителя, которыми может быть замещен вышеупомянутый низший алкил (например C1-C6-алкил, такой как метил, этил, н-пропил и т.д.), выбирают из гидрокси-, амино-, моно- или ди(низший)алкиламиногруппы (например моно- или ди-C1-C6-алкиламиногруппы, такой как метиламино-, этиламино-, пропиламино-, диметиламино- или диэтиламиногруппа и т. д.), низшей алкоксигруппы (например C1-C6-алкоксигруппы, такой как метокси-, этокси-, пропокси- или гексилоксигруппа и т.д.), низшей алкилкарбонилоксигруппы (например C1-C6-алкилкарбонилоксигруппы, такой как ацетокси- или этилкарбонилоксигруппа и т. д.), галогена (например фтора, хлора, брома и иода) и т.д. Заместители (один или два), которыми может быть замещена вышеупомянутая аминогруппа выбирают из C1-C6-алкила (например метила, этила, пропила и т.д.), ацила (например C1-C6-ацила, такого как формил, ацетил, пропионил, бутирил и т.д.) или аминогруппа является 5-7-членной циклической аминогруппой (например пирролидино-, морфолино-, пиперидино- или пиперазиногруппой и т.д.) и т.д.
В формуле, представленной выше, R1 - водород, возможно замещенный низший алкил или галоген. Предпочтительно R1 может быть водородом или C1-C3-алкилом (например метилом, этилом, н-пропилом и т.д.) и наиболее предпочтительно - водородом.
R2 и R3 - водород или возможно замещенный низший алкил, или R2 и R3 вместе с соседней группой -C=C- образуют 5-7-членное кольцо. Предпочтительно R2 - водород или C1-C3-алкил (например метил, этил, н-пропил и т.д.), наиболее предпочтительно R2 - водород. R3 - предпочтительно водород или C1-C3-алкил (например метил, этил, н-пропил и т. д.), наиболее предпочтительно R3 - C1-C3-алкил (например метил, этил, н-пропил и т.д.). Также предпочтительным является случай, в котором R2 и R3 в комбинации с соседней группой -C=C- образуют 5-7-членное гомоциклическое кольцо, наиболее предпочтительно - циклогексен, бензол или близкая им группа.
X - кислород или группа S(O)p (p = 0-2), предпочтительно X - кислород или сера, и наиболее предпочтительно X - кислород.
Y - группа формулы -CR4R5 (в которой R4 и R5 - водород или возможно замещенный низший алкил) или двухвалентная группа, произведенная из возможно замещенного 3-7-членного гомо- или гетероциклического кольца. Предпочтительно Y - группа -CR4', R5'-, в которой R4' и R5' - водород или возможно замещенный C1-C3-алкил. "C1-C3-алкил" "возможно замещенного C1-C3-алкила" может быть, например, метилом, этилом, н-пропилом или изопропилом, и заместители, которыми такие C1-C3-алкилы могут быть замещены, представляют собой те же группы, что и для вышеупомянутого "низшего алкила". Наиболее предпочтителен случай, в котором R4' и R5' - водород или C1-C3-алкил (например метил, этил, н-пропил и т.д.). Наиболее предпочтительно R4' и R5' - C1-C3-алкил (например метил, этил, н-пропил и т.д.).
Такие предпочтительны случаи, в которых Y - двухвалентная группа, произведенная из возможно замещенного - 3-7-членного гомо- или гетероциклического кольца.
Предпочтительно Y - группа формулы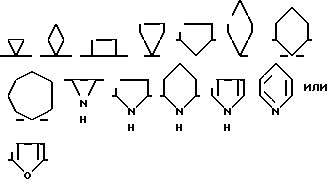
Обычными примерами Y являются следующие группы: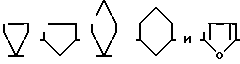
Наиболее предпочительными группами Y являются следующие:
R6 и R7 - водород, возможно замещенный низший алкил, возможно замещенный циклоалкил или возможно замещенный арил, и R6 и R7 вместе с соседним атомом азота образует возможно замещенную азотсодержащую гетероциклическую группу. Предпочтительно R6 и R7 - водород, C1-C3-алкил (например метил, этил, н-пропил и т.д.) или близкая группа, наиболее предпочтительно - водород.
m = 0-4, предпочтительно 1-4, предпочтительнее 1-3 и наиболее предпочтительно 1. n = 0-4, предпочтительно 1-4, наиболее предпочтительно 1. Наиболее предпочтителен случай, в котором m и n = 1.
Соли соединения формулы I являются предпочтительно физиологически приемлемыми солями с кислотами. Такие соли включают соли с неорганическими кислотами (например хлористо-водородной, фосфорной, бромисто-водородной или серной кислотой) и соли с органическими кислотами (например уксусной, муравьиной, пропионовой, фумаровой, малеиновой, янтарной, винной, лимонной, яблочной, щавелевой, бензойной, метансульфоновой и бензолсульфоновой кислот).
Если соединения формулы I содержат кислотную группу, например карбоксигруппу, то они могут образовывать соли с неорганическими основаниями (например щелочным или щелочно-земельным металлом, таким как натрий, калий, кальций или магний, или аммиаком) или с органическим основанием (например три-C1-C3-алкиламином, таким как триэтиламин).
Способ получения соединений формулы I или их солей описан ниже.
Способ A)
Соединения формулы I или их соли можно синтезировать реакцией соединений формулы II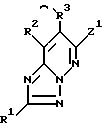
где Z1, R1, R2 и R3 определены выше,
или их солей с соединениями формулы III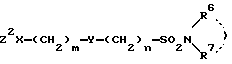
где Z2, X, Y, R6, R7, m и n определены выше,
или их солями.
Уходящая при реакции с Z1 группа Z2 может быть, например, водородом или щелочным металлом, например натрием или калием, если X - кислород или сера, или щелочным металлом, если X - группа SO или SO2.
В этой реакции применяют обычно 1-5 молей, предпочтительно 1-2 моля, соединений формулы III или их солей на моль соединений формулы II или их солей.
Обычно эту реакцию конденсации проводят в присутствии основания, которым может быть гидрид щелочного металла, такой как гидрид натрия, гидрид калия и т. д., алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия и т. д., гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия и т.д. и карбонаты, такие как карбонат натрия, карбонат калия и т.д.
Реакцию можно проводить в инертном растворителе, например спирте, таком как метанол, этанол и т.д., простом эфире, таком как диоксан, тетрагидрофуран и т.д., ароматическом углеводороде, таком как бензол, толуол, ксилол и т.д., нитриле, таком как ацетонитрил, амиде, таком как диметилформамид, диметилацетамид и т.д., и сульфоксиде, таком как диметилсульфоксид.
Температура реакции 10-200oC, предпочтительно 50-100oC. Время реакции 0,5-24 ч, предпочтительно 1-6 ч.
Способ B)
Соединения формулы I или их соли можно также получать реакцией соединений формулы IV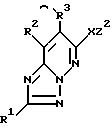
где Z2, R1, R2, R3 и X определены выше,
или их солей с соединениями формулы V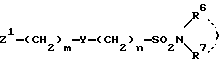
где Z1, Y, R6, R7, m и n определены выше,
или их солями.
В этой реакции используют обычно 1-5 молей соединений формулы V или их солей, предпочтительно 1-2 моля, на моль соединений формулы IV или их солей.
Обычно реакцию конденсации проводят в присутствии основания, которым может быть гидрид щелочного металла, такой как гидрид натрия, гидрид калия и т. д., алкоксид щелочного металла, такой как метоксид натрия, этоксид натрия и т. д., гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия и т.д., и карбонаты, такие как карбонат натрия, карбонат калия и т.д.
Эту реакцию можно проводить в инертном растворителе, например спирте, таком как метанол, этанол и т.д., простом эфире, таком как диоксан, тетрагидрофуран и т. д. , ароматическом углеводороде, таком как бензол, толуол, ксилол и т. д. , нитриле, таком как ацетонитрил, амиде, таком как диметилформамид, диметилацетамид и т.д., и сульфоксиде, таком как диметилсульфоксид.
Температура реакции 10-200oC, предпочтительно 50-150oC. Время реакции 0,5-24 ч, предпочтительно 1-10 ч.
Способ C)
Соединения формулы I или их соли можно синтезировать реакцией соединений формулы VI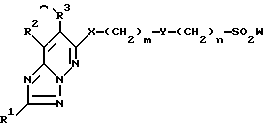
в которой W, R1, R2, R3, X, Y, m и n определены выше,
или их солей с соединениями формулы VII
в которой R6 и R7 определены выше,
или их солями.
Уходящая группа W может быть галогеном (например хлором, бромом, иодом и т. д. ), C6-C10-арилсульфонилоксигруппой (например бензолсульфонилокси- или п-толуолсульфонилоксигруппой и т. д. ) или C1-C4-алкилсульфонилоксигруппой (например метансульфонилоксигруппой и т. д. ). Предпочтительно используют галоген (например хлор, бром, иод и т.д.).
В этой реакции обычно применяют 1-5 молей, предпочтительно 1-2 моля, соединений формулы VII или их солей на моль соединений формулы VI или их солей.
Эту реакцию можно проводить в инертном растворителе, например спирте, таком как метанол, этанол и т.д., простом эфире, таком как диоксан, тетрагидрофуран и т. д. , ароматическом углеводороде, таком как бензол, толуол, ксилол и т.д., нитриле, таком как ацетонитрил и т.д., амиде, таком как диметилформамид, диметилацетамид и т. д., и сульфоксиде, таком как диметилсульфоксид.
Реакцию проводят при температуре от -20 до 100oC, предпочтительно от -10 до 50oC. Время реакции 0,5-5 ч, предпочтительно 1-3 ч.
Соединения формулы I или их соли можно превратить известными способами в соли, если соединения находятся в форме свободных оснований, или в свободные формы или другие соли, если соединения находятся в форме солей. Соединения формулы I и их соли можно выделять из реакционной смеси и очищать известными методами: экстракцией растворителем, регулированием pH, перераспределением, осаждением, кристаллизацией, перекристаллизацией, хроматографией и т.д. Если соединения формулы I или их соли являются оптически активными соединениями, то они могут быть разделены на d- и l-формы обычными методами оптического расщепления.
Способ получения исходных соединений формул II-VII и их солей, применяемых в синтезе соединений формулы I и их солей описан ниже.
В качестве солей этих соединений используют соли с неорганическими кислотами (например хлористо-водородной, фосфорной бромисто-водородной и серной кислотой и т.д.) и соли с органическими кислотами (например уксусной, муравьиной, пропионовой, фумаровой, малеиновой, янтарной, винной, лимонной, яблочной, щавелевой, бензойной, метансульфоновой и бензолсульфоновой кислотами и т. д. ). Если соединения содержат кислотную группу, такую как карбоксигруппа, то они могут образовывать соли с неорганическими основаниями (например щелочными и щелочно-земельными металлами, такими как натрий, калий, магний, кальций и т.д., или аммиаком и т.д.) или органическими основаниями (например три-C1-C3-алкиламинами, такими как триэтиламин и т.д.).
Исходные соединения формулы II или их соли получают способом, описанным в J. Org. Chem. 39, 2143 (1987) или аналогичным способом.
Исходные соединения формулы III или их соли и исходные соединения формулы V или их соли получают способами, описанными в Chem. Ber. 91, 2130 (1958), J. Org. Chem. 52, 2162 (1987) и патенте Японии A-223287/1991 или аналогичными способами.
Исходные соединения формулы IV или их соли получают способом, описанным в патенте EP-A-381132 или аналогичным способом.
Исходные соединения формулы VI или их соли можно получать 1) реакцией соединений формулы II или их солей с соединениями формулы VIII
Z2X - (CH2)m - Y - (CH2)n - SO2W,
где X, Y, Z2, W, m и n определены выше,
или 2) реакцией соединений формулы IV или их солей с соединениями формулы IX
Z1 - (CH2)m - Y - (CH2)n - SO2W,
где Y, Z1, W, m и n определены выше.
В реакции 1) применяют обычно 1-5 молей, предпочтительно 1-2 моля, соединений формулы VIII или их солей на моль соединения формулы II или соли и реакцию проводят так же, как реакцию соединений формулы II или их солей с соединениями формулы III или их солями.
В реакции 2) соединения формулы IX или их соли применяют в количестве 1-5 молей, предпочтительно 1-2 моля, на моль соединений формулы IV или их солей и реакцию проводят так же, как реакцию соединений формулы IV или их солей с соединениями формулы V или их солями.
Исходные соединения формул VII-IX и их соли можно получать известными способами.
Полученные исходные соединения и их соли можно выделять и очищать известными способами, такими как экстракция растворителя, регулирование pH, перераспределение, осаждение, кристаллизация, перекристаллизация, хроматография и т.д., однако реакционные смеси также могут быть непосредственно использованы в качестве исходных материалов для следующих стадий без выделения.
В реакциях получения соединений формулы I и исходных соединений с участием соединений, содержащих амино-, карбокси- и(или) гидроксигруппы, такие группы могут быть предварительно защищены защитными радикалами, обычно используемыми в пептидной химии. В таких случаях целевые соединения получают удалением защитных радикалов после реакции.
В качестве защитных радикалов для аминогрупп можно применять формил, возможно замещенный C1-C6-алкилкарбонил (например ацетил, этилкарбонил и т.д. ), фенилкарбонил, C1-C6-алкоксикарбонил (например метоксикарбонил, этоксикарбонил и т.д.), феноксикарбонил, C7-C10-аралкилкарбонил (например бензилкарбонил и т.д.), тритил, фталоил, N,N-диметиламинометилен и т.д. Защитные группы могут нести 1-3 заместителя, выбранные из галогенов (например фтора, хлора, брома и иода), C1-C6-алкилкарбонила (например метилкарбонила, этилкарбонила, бутилкарбонила и т.д.), нитрогруппы и т.д.
В качестве защитных радикалов для карбоксигрупп применяют возможно замещенный C1-C6-алкил (например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и т.д.), фенил, тритил, силил и другие группы. Эти защитные радикалы могут нести 1-3 заместителя, выбранных из галогена (например фтора, хлора, брома и иода), формила, C1-C6-алкилкарбонила (например ацетила, этилкарбонила, бутилкарбонила и т.д.) и нитрогруппы.
Защитные радикалы для гидроксигрупп включают возможно замещенный C1-C6-алкил (например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и т.д.), фенил, C7-C10-аралкил (например бензил и т.д.), формил, C1-C6-алкилкарбонил (например ацетил, этилкарбонил и т.д.), феноксикарбонил, C7-C10-аралкилкарбонил (например бензилкарбонил и т.д.), пиранил, фуранил, силил и другие группы. Эти защитные радикалы могут нести 1-4 заместителя, выбранных из галогена (например фтора, хлора, брома и иода), C1-C6-алкила (например метила, этила, пропила и т.д.), фенила, C7-C10-алкила (например бензила), нитрогруппы и т.д.
Для удаления защитных радикалов применяют известные способы или аналогичные им способы. Такие способы включают применение кислот и оснований, восстановление, УФ-облучение, обработку гидразином, фенилгидразином, N-метилдитиокарбаматом натрия, тетрабутиламмонийфторидом или ацетатом палладия и т.д.
Соединения формулы I или их соли обладают антиаллергической, противовоспалительной и антиФАТ-активностью (ФАТ - фактор активации тромбоцитов) и могут использоваться безопасно (острая токсичность: LDSO > 2 г/кг) в качестве антиастматических средств для млекопитающих (например людей, мышей, собак, крыс, быков). Хотя соединения формулы I или их соли можно применять в форме нерасфасованного порошка, но существует обычная практика назначать его в форме препарата вместе с носителем. В качестве препаратов применяют таблетки, капсулы, гранулы, тонкие гранулы, порошки, сиропы, инъекции и ингаляции. Препараты приготавливают обычными методиками. В качестве носителей пероральных препаратов применяют обычные носители, используемые в фармацевтической промышленности, такие как крахмал, маннит, кристаллическая целлюлоза и натрийкарбоксиметилцеллюлоза. В качестве носителей для инъекций применяют дистиллированную воду, физиологический солевой раствор, растворы глюкозы. В фармацевтические препараты можно добавлять и другие обычно используемые подходящие добавки. Хотя доза препарата изменяется в зависимости от возраста, массы тела, симптомов, способа и частоты приема и других факторов, их рекомендуется принимать в количестве 0,1-100 мг/кг, предпочтительно 1-50 мг/кг, наиболее предпочтительно 1-10 мг/кг, за 1-2 раза в день для взрослых. Способ приема - перорально или парентерально.
Последующие примеры, контрольные примеры, препаратные примеры и опыты имеют единственной целью описать изобретение более детально и не должны толковаться как определение границ изобретения.
Обнаружение фракций, содержащих каждое целевое соединение в примерах, осуществляют с применением контроля ТСХ (тонкослойной хроматографии) на пластинках Мерк 60 F254 и ультрафиолетового детектора. Комнатная температура - это 15-20oC.
Сокращения в дальнейшем описании имеют следующие значения:
J - константа взаимодействия,
с - синглет,
шс - широкий синглет,
т - триплет,
м - мультиплет,
Гц - герц,
д - дублет,
кв - квадруплет (квартет),
ЯМР - ядерный магнитный резонанс,
ДМСО - диметилсульфоксид,
CDCl3 - дейтерохлороформ,
об./об. - объем/объем,
% - массовый %,
т.пл. - точка плавления,
в.в. - внутривенная инъекция,
δ(ppm)/ - химический сдвиг (млн-1).
Пример 1
Получение 6-(2,2-диметил-3-сульфамоил-1-пропокси)-1,2,4- триазоло[1,5-b] пиридазина.
В 15 мл диметилформамида суспендируют 0,42 г 60% гидрида натрия в масле, добавляют 0,878 г 3-гидрокси-2,2-диметил-1-пропансульфонамида и смесь перемешивают при пониженном давлении и комнатной температуре 30 мин. Затем добавляют 0.773 г 6-хлор-1,2,4-триазоло[1,5-b]пиридазина и смесь дополнительно перемешивают при комнатной температуре 1 ч. Добавляют 40 мл ледяной воды, устанавливают pH 6 добавлением 1н. хлористо-водородной кислоты, образующиеся кристаллы собирают фильтрованием и промывают 20 мл воды и 20 мл диэтилового эфира. Промытые кристаллы перекристаллизовывают из горячего этанола с получением 1,16 г целевого соединения. Т.пл. 180-184oC.
Элементный анализ для C10H15N5O3S.
Рассчитано, %: C 42,10; H 5,30; N 24,55.
Найдено, %: C 41,87; H 5,28; N 24,59.
Пример 2
Получение 6-(2,2-диэтил-3-сульфамоил-1-пропокси)-1,2,4- тиазоло[1,5-b] пиридазина.
В 20 мл диметилформамида суспендируют 0,64 г 60% гидрида натрия в масле, добавляют 1,56 г 3-гидрокси-2,2-диэтил-1-пропансульфонамида и смесь перемешивают при пониженном давлении и комнатной температуре 30 мин. Затем добавляют 1,24 г 6-хлор-1,2,4-триазоло[1,5-b]пиридазина и смесь дополнительно перемешивают при комнатной температуре 1,5 ч. Добавляют 100 мл ледяной воды, устанавливают в реакционной смеси pH 6 добавлением 1н. хлористо-водородной кислоты, образующиеся кристаллы собирают и промывают 20 мл воды и 20 мл диэтилового эфира. Промытые кристаллы перекристаллизовывают из горячего этанола с получением 1,57 г целевого соединения. Т.пл. 194-197oC.
Элементный анализ для C12H19N5O3S • 0,5 EtOH.
Рассчитано, %: C 46,41; H 6,59; N 20,82.
Найдено, %: C 46,33; H 6,68; N 20,99.
Пример 3
Получение 6-(2,2-диметил-3-сульфамоил-1-пропокси)-7-метил 1,2,4-триазоло[1,5-b]пиридазина.
В 5 мл тетрагидроуфрана растворяют 0,44 г 3-гидрокси-2,2-диметил-1-пропансульфонамида, добавляют 0,5 мл диметилацеталя N,N-диметилформамида. Смесь оставляют стоять при комнатной температуре 10 ч, затем концентрируют при пониженном давлении. Остаток растворяют в 4 мл диметилформамида, добавляют 0,2 г 60% гидрида натрия в масле, раствор перемешивают при пониженном давлении и комнатной температуре 1 ч. Добавляют 50 мл ледяной воды и 30 мл 1н. HCl, реакционную смесь кипятят с обратным холодильником 1 ч и устанавливают pH 6 добавлением бикарбоната натрия. Образующиеся кристаллы собирают фильтрованием и перекристаллизовывают из водного метанола с получением 0,12 г целевого соединения. Т.пл. 216-218oC.
Элементный анализ для C11H17N5O3S.
Рассчитано, %: C 44,14; H 5,72; N 23,39.
Найдено, %: C 44,13; H 5,74; N 23,19.
Пример 4
Получение 7,8-диметил-6-(2,2-диметил-3-сульфамоил-1-пропокси)- 1,2,4-тиазоло[1,5-b]пиридазина.
В 30 мл диметилформамида суспендировали 1,38 г 60% гидрида натрия в масле, добавляют 2,51 г 3-гидрокси-2,2-диметил-1-пропансульфонамида и смесь перемешивают при пониженном давлении и комнатной температуре 1 ч. Затем добавляют 2,56 г 6-хлор-7,8-диметил-1,2,4-триазоло[1,5-b]пиридазина и смесь перемешивают при комнатной температуре 3 ч. Добавляют 100 мл ледяной воды, устанавливают в реакционной смеси pH 6 добавлением 5н. HCl и экстрагируют 3 порциями смеси этилацетаттетрагидрофуран (2: 1). Экстракт промывают 20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Растворитель отгоняют при пониженном давлении, остаток пропускают через хроматографическую колонку с силикагелем, элюируют смесью дихлорметан-метанол (30:1). Фракции, содержащие желаемый продукт, объединяют и концентрируют с получением 0,63 г целевого соединения. Т.пл. 175-177oC.
Элементный анализ для C12H19N5O3S.
Рассчитано, %: C 45,99; H 6,11; N 22,35.
Найдено, %: C 46,27; H 6,14; N 22,16.
Пример 5
Получение 6-(2,2-диэтил-3-сульфамоил-1-пропокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
В 20 мл диметилформамида суспендируют 0,672 г 60% гидрида натрия в масле, добавляют 1,72 г 3-гидрокси-2,2-диэтил-1-пропансульфонамида и смесь перемешивают при пониженном давлении и комнатной температуре 1 ч. Затем добавляют 1,35 г 6-хлор-7-метил-1,2,4-триазоло[1,5-b] пиридазина и смесь перемешивают в атмосфере азота при комнатной температуре 2 ч. Затем добавляют 70 мл ледяной воды, приводят реакционную смесь к pH 6 добавлением 5н. HCl и экстрагируют 3 порциями смеси этилацетат-тетрагидрофуран (2:1). Экстракт промывают насыщенным водным раствором NaCl и сушат безводным MgSO4. Растворитель отгоняют при пониженном давлении, остаток пропускают через хроматографическую колонку с силикагелем, элюируют смесью дихлорметан-этилацетат-метанол (10:10:1). Фракции, содержащие целевой продукт, объединяют и концентрируют, к остатку добавляют 50 мл 5н. HCl. Смесь кипятят с обратным холодильником 30 мин. После охлаждения смесь концентрируют при пониженном давлении, остаток разбавляют водой и водным раствором бикарбоната натрия, экстрагируют 3 порциями смеси этилацетат-тетрагидрофуран (1:1). Экстракт промывают насыщенным водным раствором NaCl, сушат безводным MgSO4 и концентрируют при пониженном давлении. Остаток перекристаллизовывают из горячего этанола с получением 0,79 г целевого соединения. Т.пл. 189-192oC.
Элементный анализ для C13H21N5O3S • 0,5 EtOH.
Рассчитано, %: C 47,98; H 6,90; N 19,90.
Найдено, %: C 47,44; H 6,84; N 19,93.
Пример 6
Получение 6-(2,2-диэтил-3-сульфамоил-1-пропокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
К раствору 1,38 г 3-(N,N-диметиламинометиленаминосульфонил)-2,2-диэтил-1-пропанола в 30 мл тетрагидрофурана добавляют 0,23 г 60% гидрида натрия в масле и смесь перемешивают при комнатной температуре 1 ч. Затем добавляют 0,74 г 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина и смесь кипятят с обратным холодильником при перемешивании 1 ч. После охлаждения реакционную смесь приводят к pH 6 добавлением 1н. HCl и экстрагируют смесью этилацетат-тетрагидрофуран (1: 1). Экстракт промывают водой, сушат и растворитель отгоняют. К остатку добавляют 14 мл 6н. HCl и смесь перемешивают при 110oC 30 мин. После охлаждения добавляют к реакционной смеси 100 мл воды и образующиеся кристаллы отделяют фильтрованием и перекристаллизовывают из метанола с получением 1,16 г целевого соединения. Т.пл. 208-209oC.
Элементный анализ для C13H21N5O3S.
Рассчитано, %: C 47,69; H 6,46; N 21,39.
Найдено, %: C 47,46; H 6,44; N 21,59.
Перекристаллизация этого продукта из этанола дает кристаллы, содержащие этанол как в примере 5.
Пример 7
Получение 6-(2,2-диметил-4-сульфамоил-1-бутокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 4-гидрокси-3,3-диметил-1-бутансульфонамида и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 5. Т.пл. 214-215oC.
Элементный анализ для C12H19N5O3S.
Рассчитано, %: C 45,99; H 6,11; N 22,35.
Найдено, %: C 45,80; H 5,91; N 22,56.
ЯМР (d6-ДМСО) δ: 1,06 (6H, с), 1,80 - 1,95 (2H, м), 2,33 (3H, с), 2,97 - 3,09 (2H, м), 4,09 (2H, с), 6,75 (2H, с), 8,16 (1H, с), 8,38 (1H, с).
Пример 8
Получение 6-(2,2-диметил-5-сульфамоил-1-пентилокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 5-гидрокси-4,4-диметил-1-пентансульфонамида и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 5. Т.пл. 171-172oC.
Элементный анализ для C13H21N5O3S.
Рассчитано, %: C 47,69; H 6,46; N 21,39.
Найдено, %: C 47,45; H 6,39; N 21,18.
ЯМР (CDCl3) δ: 1,05 (6H, с), 1,45 - 1,59 (2H, м), 1,66 - 1,82 (2H, м), 2,33 (3H, с), 2,96 (2H, т, J = 7,8 Гц), 4,08 (2H, с), 6,72 (2H, шс), 8,15 (1H, с), 8,37 (1H, с).
Пример 9
Получение 6-(2,2-диметил-6-сульфамоил-1-гексилокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 6-гидрокси-5,5-диметил-1-гексансульфонамида и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 5. Т.пл. 161-163oC.
Элементный анализ для C14H23N5O3S.
Рассчитано, %: C 49,25; H 6,79; N 20,51.
Найдено, %: C 48,99; H 6,68; N 20,74.
ЯМР (d6-ДМСО) δ: 1,05 (6H, с), 1,38 - 1,60 (4H, м), 1,67 - 1,98 (4H, м), 2,37 (3H, с), 3,15 (2H, т, J = 7,8 Гц), 4,14 (2H, с), 4,77 (2H, шс), 7,78 (1H, с), 8,25 (1H, с).
Пример 10
Получение 6-(2,2-диэтил-6-сульфамоил-1-гексилокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 6-гидрокси-5,5-диэтил-1-гексансульфонамида и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 5. Т.пл. 132-133oC.
Элементный анализ для C16H27N5O3S.
Рассчитано, %: C 52,01; H 7,37; N 18,95.
Найдено, %: C 51,89; H 7,10; N 19,08.
ЯМР (CDCl3) δ: 0,85 (6H, т. J = 7,4 Гц), 1,35 - 1,55 (8H, м), 1,78 - 1,98 (2H, м), 3,13 (2H, т, J = 8,0 Гц), 4,18 (2H, с), 4,76 (2H, шс), 7,77 (1H, с), 8,25 (1H, с).
Пример 11
Получение 6-(2,2-диэтил-5-сульфамоил-1-пентилокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 5-гидрокси-4,4-диэтил-1-пентансульфонамида и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 5. Т.пл. 157-158oC.
ЯМР (CDCl3) δ: 0,86 (6H, т. J = 7,4 Гц), 1,46 (4H, кв, J = 7,4 Гц), 1,48 (2H, т, J = 7,6 Гц), 1,79 - 1,98 (2H, м), 2,36 (3H с), 3,07 (2H, т, J = 7,6 Гц), 4,21 (2H, с), 5,54 (2H, шс), 7,76 (1H, с), 8,24 (1H, с).
Пример 12
Получение 6-(2,2-диэтил-6-сульфамоил-1-бутокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 4-(N,N-диметиламинометиленаминосульфонил)-2,2-диэтил-1-бутанола и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 148-149oC.
Элементный анализ для C14H23N5O3S.
Рассчитано, %: C 49,25; H 6,79; N 20,51.
Найдено, %: C 48,99; H 6,68; N 20,24.
ЯМР (d6-ДМСО) δ: 0,84 (6H, т, J = 7,0 Гц), 1,42 (4H, кв, J = 7,0 Гц), 1,76 - 1,91 (2H, м), 2,31 (3H, с), 2,89 - 3,03 (2H, м), 4,11 (2H, с), 6,77 (2H, шс), 8,15 (1H, с), 8,39 (1H, с).
Пример 13
Получение 6-(2,2-пентаметилен-3-сульфамоил-1-пропокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 3-(N,N-диметиламинометиленаминосульфонил)-2,2-пентаметилен-1- пропанола и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 268-270oC.
Элементный анализ для C14H21N5O3S.
Рассчитано, %: C 49,54; H 6,24; N 20,63.
Найдено, %: C 49,19; H 6,22; N 20,40.
ЯМР (d6-ДМСО) δ: 1,28 - 1,89 (10H, м), 2,34 (3H, с), 3,34 (2H, с), 4,43 (2H, с), 6,94 (2H, шс), 8,16 (1H, с), 8,39 (1H, с).
Пример 14
Получение 6-(3,3-диметил-6-сульфамоил-1-пентилокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 5-(N,N-диметиламинометиленаминосульфонил)-3,3-диметил-1-пентанола и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 143-144oC.
Элементный анализ для C13H21N5O3S.
Рассчитано, %: C 47,69; H 6,46; N 21,39.
Найдено, %: C 47,50; H 6,53; N 21,13.
ЯМР (d6-ДМСО) δ: 1,00 (6H, с), 1,66 - 1,89 (4H, м), 2,30 (3H, с), 2,94 - 3,10 (2H, м), 4,43 (2H, т, J = 6,8 Гц), 6,77 (2H, шс), 8,16 (1H, с), 8,39 (1H, с).
Пример 15
Получение 6-(4,4-диметил-6-сульфамоил-1-гексилокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 6-(N,N-диметиламинометиленаминосульфонил)-4,4-диметил-1-гексанола и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 154-155oC.
Элементный анализ для C14H23N5O3S.
Рассчитано, %: C 49,25; H 6,79; N 20,51.
Найдено, %: C 48,98; H 7,02; N 20,86.
ЯМР (d6-ДМСО) δ: 0,91 (6H, с), 1,29 - 1,46 (2H, м), 1,57 - 1,88 (4H, м), 2,30 (3H, с), 2,85 - 3,04 (2H, м), 4,35 (2H, т, J = 6,3 Гц), 6,75 (2H, шс), 8,15 (1H, с), 8,37 (1H, с).
Пример 16
Получение 6-(2,2-пентаметилен-4-сульфамоил-1-бутокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 4-(N,N-диметиламинометиленаминосульфонил)-2,2-пентаметилен-1-бутанола и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 208-209oC.
Элементный анализ для C15H23N5O3S.
Рассчитано, %: C 50,97; H 6,56; N 19,81.
Найдено, %: C 51,24; H 6,55; N 19,58.
ЯМР (d6-ДМСО) δ: 1,32 - 1,65 (10H, м), 1,86 - 2,03 (2H, м), 2,32 (3H, с), 2,90 - 3,04 (2H, м), 4,16 (2H, с), 6,75 (2H, шс), 8,14 (1H, с), 8,38 (1H, с).
Пример 17
Получение 6-(2-изопропил-3-сульфамоил-1-пропоксии)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 3-(N,N-диметиламинометиленаминосульфонил)-2-изопропил-1-пропанола и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 196-197oC.
Элементный анализ для C12H19N5O3S.
Рассчитано, %: C 45,99; H 6,11; N 22,35.
Найдено, %: C 45,85; H 6,18; N 22,00.
ЯМР (d6-ДМСО) δ: 0,97 (3H, д, J = 6,8 Гц), 0,98 (3H, д, J = 6,8 Гц), 1,98 - 2,19 (1H, м), 2,25 - 2,43 (1H, м), 2,31 (2H, м), (3H, с), 3,03 - 3,27 (2H, м), 4,40 - 4,59 (2H, м), 6,93 (2H, шс), 8,16 (1H, с), 8,39 (1H, с).
Пример 18
Получение 6-(2-этил-2-метил-3-сульфамоил-1-пропокси)-7-метил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 3-(N,N-диметиламинометиленаминосульфонил)-2-этил-2-метил-1-пропанола и 6-хлор-7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 189-190oC.
Элементный анализ для C12H19N5O3S.
Рассчитано, %: C 45,99; H 6,11; N 22,35.
Найдено, %: C 46,17; H 6,18; N 22,19.
ЯМР (d6-ДМСО) δ: 0,90 (3H, д, J = 7,4 Гц), 1,20 (3H, с), 1,66 (2H, кв, J = 7,4 Гц), 2,34 (3H, с), 3,22 (2H, д, J = 3,6 Гц), 4,31 (2H, с), 6,93 (2H, шс), 8,16 (1H, с), 8,39 (1H, с).
Пример 19
Получение 6-(2,2-диэтил-3-сульфамоил-1-пропокси)-2,7-диметил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 3-(N,N-диметиламинометиленаминосульфонил)-2,2-диэтил-1-пропанола и 6-хлор-2,7-метил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 221-222oC.
Элементный анализ для C14H23N5O3S.
Рассчитано, %: C 49,25; H 6,79; N 20,51.
Найдено, %: C 49,36; H 6,56; N 20,71.
ЯМР (d6-ДМСО) δ: 0,88 (6H, д, J = 7,2 Гц), 1,62 (4H, кв, J = 7,2 Гц), 2,31 (3H, с), 2,49 (3H, с), 3,21 (2H, с), 4,31 (2H, с), 6,93 (2H, шс), 8,02 (1H, с).
Пример 20
Получение 2,7-диметил-6-(2,2-диметил-3-сульфамоил-1-пропокси)-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 3-(N,N-диметиламинометиленаминосульфонил)-2,2-диметил-1-пропанола и 6-хлор-2,7-диметил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 217-218oC.
Элементный анализ для C12H19N5O3S.
Рассчитано, %: C 45,99; H 6,11; N 22,35.
Найдено, %: C 46,02; H 5,99; N 22,36.
Пример 21
Получение 6-(2-этил-2-метил-3-сульфамоил-1-пропокси)-2,7-диметил-1,2,4- триазоло[1,5-b]пиридазина.
Целевое соединение получают из 3-(N,N-диметиламинометиленаминосульфонил)-2-этил-2-метил-1-пропанола и 6-хлор-2,7-диметил-1,2,4-триазоло[1,5-b] пиридазина по реакции примера 6. Т.пл. 194-195oC.
Элементный анализ для C13H21N5O3S.
Рассчитано, %: C 47,69; H 6,46; N 21,39.
Найдено, %: C 47,63; H 6,32; N 21,57.
Пример 22
Получение 6-(2,2-диэтил-3-сульфамоил-1-пропокси)-2,8-диметил- 1,2,4-триазоло[1,5-b]пиридазина.
Целевое соединение получают из 3-(N,N-диметиламинометиленаминосульфонил)-2,2-диэтил-1-пропанола и 6-хлор-2,8-диметил-1,2,4-триазоло[1,5-b]пиридазина по реакции примера 6. Т.пл. 159-160oC.
Элементный анализ для C14H23N5O3S.
Рассчитано, %: C 49,25; H 6,79; N 20,51.
Найдено, %: C 49,04; H 6,65; N 20,36.
Пример 23
Получение 2,7-диметил-6-(2,2-пентаметилен-4-сульфамоил-1- бутокси)-1,2,4-триазоло[1,5-b]пиридазина.
Целевое соединение получают из 4-(N,N-диметиламинометиленаминосульфонил)-2,2-пентаметилен-1-бутанола и 6-хлор-2,7-диметил-1,2,4-триазоло[1,5-b] пиридазина по реакции примера 6. Т.пл. 204-205oC.
Элементный анализ для C16H25N5O3S.
Рассчитано, %: C 52,30; H 6,86; N 19,06.
Найдено, %: C 52,45; H 6,90; N 18,78.
Пример 24
Получение 6-(3-сульфамоил-1-пропокси)- 1,2,4-триазоло[1,5-b]пиридазина.
В 12 мл диметилформамида суспендируют 0,48 г 60% гидрида натрия в масле, добавляют 0,835 г 3-гидрокси-1-пропансульфонамида и смесь перемешивают при пониженном давлении и комнатной температуре 30 мин. Затем добавляют 0,928 г 6-хлор-1,2,4-триазоло[1,5-b] пиридазина и смесь дополнительно перемешивают при комнатной температуре 18 ч. Добавляют 40 мл ледяной воды, устанавливают в реакционной смеси pH 6 добавлением 1н. HCl и насыщают NaCl. Водный слой экстрагируют тетрагидрофураном и экстракт сушат над MgSO4. Растворитель отгоняют при пониженном давлении, образующийся остаток кристаллизуют из диэтилового эфира. Получают 0,811 г целевого соединения.
Элементный анализ для C8H11N5O3S.
Рассчитано, %: C 37,35; H 4,31; N 27,22.
Найдено, %: C 37,48; H 4,33; N 26,95.
Пример 25
Получение 6-[3-(N, N-диметилсульфамоил)-1-пропокси] - 1,2,4-триазоло[1,5-b]пиридазина.
В 10 мл диметилформамида суспендируют 0,252 г 60% гидрида натрия в масле, добавляют 1,0 г N,N-диметил-3-гидрокси-1-пропансульфонамида и смесь перемешивают при пониженном давлении и комнатной температуре 30 мин. Затем добавляют 0,928 г 6-хлор-1,2,4-триазоло[1,5-b]пиридазина и смесь дополнительно перемешивают при комнатной температуре 1,5 ч. Добавляют 30 мл ледяной воды, устанавливают в реакционной смеси pH 4,0 добавлением 1н. HCl, образующиеся кристаллы собирают фильтрованием и перекристаллизовывают из горячего метанола с получением 1,255 г целевого соединения. Т.пл. 151-153oC.
Элементный анализ для C10H15N5O3S.
Рассчитано, %: C 42,10; H 5,30; N 24,55.
Найдено, %: C 42,17; H 5,21; N 24,69.
Пример 26
Получение 6-[3-(1-метил-4-пиперазинилсульфонил)-1-пропокси]- 1,2,4-триазоло[1,5-b]пиридазина.
В 10 мл диметилформамида суспендируют 0,21 г 60% гидрида натрия в масле, добавляют 1,12 г 3-(1-метил-4-пиперазинилсульфонил)-1-пропанола и смесь перемешивают при пониженном давлении и комнатной температуре 75 мин. Затем добавляют 0,773 г 6-хлор-1,2,4-триазоло[1,5-b]пиридазина и смесь дополнительно перемешивают при комнатной температуре 1,5 ч. Добавляют 40 мл ледяной воды и реакционную смесь насыщают NaCl. Водный слой экстрагируют тетрагидофураном, экстракт сушат над MgSO4. Растворитель отгоняют при пониженном давлении, остаток вводят в хроматографическую колонну с силикагелем и элюируют смесью дихлорметан-метанол (10: 1). Фракции, содержащие целевой продукт, объединяют и концентрируют с получением 1,032 г целевого соединения. Т.пл. 140-141oC.
Элементный анализ для C13H20N6O3S.
Рассчитано, %: C 45,87; H 5,92; N 24,69.
Найдено, %: C 45,67; H 5,94; N 24,90.
Пример 27
Получение 6-(3-сульфамоил-1-пропилтио)-1,2,4-триазоло-[1,5-b] пиридазина.
В 20 мл метанола растворяют 1,94 мл метил-3-меркаптопропионата, добавляют 7,5 мл 2н. метоксида натрия в метаноле и 0,773 г 6-хлор-1,2,4-триазоло-(1,5-b)пиридазина и раствор кипятят с обратным холодильником 30 мин. После охлаждения смесь концентрируют при пониженном давлении. К остатку добавляют этилацетат и образующие кристаллы собирают фильтрованием. Кристаллы суспендируют в тетрагидрофуране и добавляют 0,997 г 3-иод-1-пропансульфонамида и смесь кипятят с обратным холодильником 2,5 ч. После охлаждения растворитель отгоняют при пониженном давлении, остаток обрабатывают 20 мл ледяной воды и устанавливают в реакционной смеси pH 4 добавлением 1н. HCl. Образующиеся кристаллы собирают фильтрованием и перекристаллизовывают из метанола с получением 0,856 г целевого соединения. Т.пл. 130-131oC.
Элементный анализ для C8H11N5O2S2.
Рассчитано, %: C 35,15; H 4,06; N 25,62.
Найдено, %: C 35,17; H 4,06; N 25,55.
Справочный пример 1
Получение этил-4-хлор-2,2-диметилбутирата.
К раствору 22,2 мл диизопропиламина в 150 мл тетрагидрофурана добавляют 93,6 мл 1,6 М раствора н-бутиллития в гексане при перемешивании и температуре от -5 до 0oC. После перемешивания в течение 30 мин реакционную смесь охлаждают до -78oC и добавляют по каплям 19,0 мл этилизобутирата. После перемешивания в течение 45 мин добавляют по каплям раствор 11,9 мл 1-бром-2-хлорэтана в 10 мл тетрагидрофурана. Реакционную смесь перемешивают при -78oC 1 ч, затем при комнатной температуре 2 ч. Добавляют избыток водного раствора NH4Cl и смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат над MgSO4. Растворитель отгоняют, остаток перегоняют в вакууме с получением 24,7 г целевого соединения в форме бесцветного масла. Т.кип. 54-56oC/0,25 мм рт.ст.
ЯМР (CDCl3) δ: 1,22 (6H, с), 1,26 (3H, т, J = 7,0 Гц), 2,06 (2H, т, J = 8,1 Гц), 3,51 (2H, т, J = 8,1 Гц), 4,14 (2H, кв, J = 7,0 Гц).
Справочный пример 2
Получение этил-2,2-диметил-4-тиоцианобутирата.
В 100 мл диметилформамида растворяют 22,1 г этил-4-хлор-2,2-диметилбутирата и 14,5 г тиоцианата калия и раствор перемешивают при 100oC 7 ч. Реакционную смесь выливают в 500 мл воды и экстрагируют диэтиловым эфиром. Экстракт промывают водой и сушат над MgSO4. Растворитель отгоняют, остаток перегоняют в вакууме с получением 16,4 г целевого соединения в форме бесцветного масла. Т.кип. 109-111oC/0,3 мм рт.ст.
ЯМР (CDCl3) δ: 1,24 (6H, с), 1,27 (3H, т, J = 7,2 Гц), 2,00 - 2,12 (2H, м), 2,86 - 2,97 (2H, м), 2,86 - 2,97 (2H, м), 4,15 (2H, кв, J = 7,2 Гц).
Справочный пример 3
Получение этил-4-аминосульфонил-2,2-диметилбутирата.
В смеси 200 мл уксусной кислоты и 200 мл воды растворяют 42,5 г этил-2,2-диметил-4-тиоцианобутирата и при сильном перемешивании и охлаждении до 10-15oC в течение 3 ч в раствор пропускают газообразный хлор. Реакционную смесь перемешивают при комнатной температуре 30 мин, разбавляют 500 мл воды и экстрагируют дихлорметаном. Экстракт промывают водой, сушат над MgSO4 и растворитель отгоняют. Остаток растворяют в дихлорметане (250 мл) и через раствор пропускают газообразный аммиак в течение 2 ч при 10-15oC. Смесь фильтруют, фильтрат промывают водой и сушат MgSO4. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем и элюируют смесью гексан-этилацетат (3: 1) с получением 40,7 г целевого соединения в виде бесцветного масла.
ЯМР (CDCl3) δ: 1,23 (6H, с), 1,26 (3H, т, J = 7,2 Гц), 2,00 - 2,13 (2H, м), 3,06 - 3,19 (2H, м), 4,14 (2H, кв, J = 7,2 Гц), 4,86 (2H, шс).
Справочный пример 4
Получение 4-гидрокси-3,3-диметил-1-бутансульфонамида.
К суспензии 0,35 г литийалюминийгидрида в 30 мл тетрагидрофурана при перемешивании и охлаждении льдом по каплям добавляют раствор 1,5 г этил-4-аминосульфонил-2,2-диметилбутирата в 8 мл тетрагидрофурана. После завершения прибавления смесь перемешивают при 0oC 30 мин, затем при комнатной температуре 30 мин. К реакционной смеси добавляют водный тетрагирофуран для разложения избытка литийалюминийгидрида и смесь нейтрализуют 2н. HCl, экстрагируют этилацетатом, экстракт промывают водой и сушат MgSO4. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем и элюируют смесью гексан-этилацетат (1:1) с получением 0,94 г целевого соединения. Т.пл. 75-76oC.
Элементный анализ для C6H15NO3S.
Рассчитано, %: C 39,75; H 8,34; N 7,73.
Найдено, %: C 39,80; H 8,10; N 7,92.
Справочный пример 5
Получение 4-(N,N-диметиламинометиленаминосульфонил)-2,2-диметил- 1-бутанола.
К суспензии 2,3 г 4-гидрокси-3,3-диметил-1-бутансульфонамида в 40 мл толуола добавляют 1,59 г диметилацеталя N,N-диметилформамида и смесь перемешивают при 70oC 40 мин. Растворитель отгоняют, а остаток перекристаллизовывают из диэтилового эфира с получением 2,86 г целевого соединения.
ЯМР (CDCl3) δ: 0,91 (6H, с), 1,69 - 1,84 (2H, м), 1,94 (1H, т, J = 4,8 Гц), 2,98 - 3,11 (2H, м), 3,05 (3H, с), 3,14 (3H, с), 3,34 (2H, д, J = 4,8 Гц), 8,05 (1H, с).
Справочный пример 5
Получение 3-(N, N-диметиламинометиленаминосульфонил)-2,2-диэтил-1-пропанола.
Смесь 6,0 г 3-гидрокси-2,2-диэтил-1-пропансульфонамида, 4,0 г диметилацеталя N, N-диметилформамида и 60 мл толуола перемешивают при 100oC 30 мин. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем и элюируют смесью этилацетат-хлороформ-метанол (20:20:1) с получением 6,4 г целевого соединения в виде бесцветного масла.
ЯМР (CDCl3) δ: 0,84 (6H, т, J = 7,4 Гц), 1,49 (4H, кв, J = 7,4 Гц), 3,05 (4H, с), 3,15 (3H, с), 3,64 (2H, с), 8,05 (1H, с).
Справочный пример 7
Получение 3-(N,N-диметиламинометиленаминосульфонил)-2,2-пентаметилен-1- пропанола.
Целевое соединение получают из 3-гидрокси-2,2-пентаметилен-1-пропансульфонамида и диметилацеталя N,N-диметилформамида по реакции справочного примера 5.
ЯМР (CDCl3) δ: 1,36 - 1,73 (10H, м), 2,72 (1H, шс), 3,05 (3H, с), 3,14 (2H, с), 3,15 (3H, с), 3,72 (3H, с), 8,05 (1H, с).
Справочный пример 8
Получение 4-(N, N-диметиламинометиленаминосульфонил)-1-иод- 2,2-диметилбутана.
Смесь 5,5 г 4-гидрокси-3,3-диметил-1-бутансульфонамида, 3,98 г диметилацеталя N,N-диметилформамида и 50 мл бензола перемешивают при 80oC 1 ч. Растворитель отгоняют и остаток растворяют в 50 мл дихлорметана. К перемешиваемому раствору при охлаждении льдом добавляют по каплям 6,6 мл безводной трифторметансульфокислоты. После завершения добавления смесь перемешивают 20 мин, добавляют 4,7 мл лутидина и реакционную смесь выдерживают при 0oC 20 мин, разбавляют 100 мл воды и экстрагируют этилацетатом. Экстракт промывают последовательно водным раствором гидросульфата калия и водой, высушивают. Растворитель отгоняют, образующееся масло растворяют в 100 мл ацетона, добавляют 13,5 г NaI и смесь кипятят с обратным холодильником при перемешивании 2 ч. После охлаждения реакционную смесь разбавляют водой и экстрагируют этилацетатом. Экстракт промывают водой и высушивают. Растворитель отгоняют, остаток вносят в хроматографическую колонну и элюируют смесью этилацетат-гексан (3:1). Фракции, содержащие целевой продукт, объединяют и концентрируют, остаток перекристаллизовывают из изопропилового эфира с получением 8,44 г целевого соединения. Т.пл. 81-82oC.
Элементный анализ для C9H19IN2O2S.
Рассчитано, %: C 31,22; H 5,53; N 8,09.
Найдено, %: C 31,67; H 5,68; N 8,18.
ЯМР (CDCl3) δ: 1,07 (6H, с), 1,78 - 1,91 (2H, м), 2,92 - 3,04 (2H, м), 3,06 (3H, с), 3,12 (2H, с), 3,16 (3H, с), 8,05 (1H, с).
Справочный пример 9
Получение 1-циано-4-(N, N-диметиламинометиленаминосульфонил)-2,2- диметилбутана.
Смесь 1,85 г 4-(N,N-диметиламинометиленаминосульфонил)-1-иод-2,2-диметилбутана, 0,49 г KCN, 0,06 г 18-краун-6 и 30 мл диметилсульфоксида перемешивают при 100oC 14 ч. После охлаждения реакционную смесь разбавляют 100 мл воды и экстрагируют этилацетатом. Экстракт промывают водой и сушат над MgSO4. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем (70 г) и элюируют смесью этилацетат-гексан (9:1). Фракции, содержащие целевой продукт, объединяют и концентрируют, остаток перекристаллизовывают из диэтилового эфира с получением 1,11 г целевого соединения. Т.пл. 53-54oC.
Элементный анализ для C10H19N3O2S.
Рассчитано, %: C 48,96; H 7,81; N 17,13.
Найдено, %: C 48,88; H 7,82; N 16,77.
ЯМР (CDCl3) δ: 1,10 (6H, с), 1,82 - 1,94 (2H, м), 2,27 (2H, с), 2,96 - 3,07 (2H, м), 3,05 (3H, с), 3,15 (3H, с), 8,04 (1H, с).
Справочный пример 10
Получение метил-5-аминосульфонил-3,3-диметилвалерата.
Смесь 0,49 г цианосоединения, полученного в справочном примере 9, и 10 мл HCl конц. перемешивают при 120-130oC 16 ч и упаривают до сухого состояния при пониженном давлении. Остаток растворяют в 12 мл метанола, добавляют 4 капли H2SO4 конц. и кипятят с обратным холодильником 14 ч. Метанол отгоняют, остаток разбавляют водой и экстрагируют этилацетатом. Экстракт промывают водой и сушат MgSO4. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем (60 г) и элюируют смесью этилацетат-гексан (4:1) с получением 0,35 г целевого соединения в виде масла.
ЯМР (CDCl3) δ: 1,05 (6H, с), 1,84 - 1,98 (2H, м), 2,25 (2H, с), 3,10 - 3,23 (2H, м), 3,68 (3H, с), 5,01 (2H, шс).
Справочный пример 11
Получение 5-(N, N-диметиламинометиленаминосульфонил)-3,3- диметил-1-пентанола.
В 10 мл тетрагидрофурана растворяют 0,352 г метилового эфира, полученного в справочном примере 10, и при перемешивании и охлаждении льдом к нему добавляют по каплям суспензию 0,101 г литийалюминийгидрида в 20 мл тетрагидрофурана. Смесь перемешивают при этой температуре 40 мин, после чего добавляют водный тетрагидрофуран. Смесь нейтрализуют 2н. HCl и экстрагируют этилацетатом. Экстракт промывают водой и сушат MgSO4. Растворитель отгоняют, остаток растворяют в 8 мл толуола, добавляют 0,24 г диметилацеталя N,N-диметилформамида. Смесь перемешивают при 80oC 45 мин, после чего растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем (60 г) и элюируют смесью хлороформ-метанол (20:1) с получением 0,286 г целевого соединения в виде масла.
Элементный анализ для C10H22N2O3S.
Рассчитано, %: C 47,97; H 8,86; N 11,19.
Найдено, %: C 47,71; H 8,62; N 11,44.
ЯМР (CDCl3) δ: 0,94 (6H, с), 1,52 (2H, т, J = 7,2 Гц), 1,67 - 1,81 (3H, м), 2,94 - 3,06 (2H, м), 3,04 (3H, с), 3,14 (3H, с), 3,70 (2H, т, J = 7,2 Гц), 8,03 (1H, с).
Справочный пример 12
Получение 5-(N, N-диметиламинометиленаминосульфонил)-1-иод- 3,3-диметилпентана.
В 10 мл дихлорметана растворяют 0,25 г соединения, полученного в справочном примере 11, и к раствору при перемешивании и охлаждении по каплям добавляют 0,24 мл безводной тифторметансульфокислоты. Смесь перемешивают при той же температуре 20 мин, затем добавляют 0,18 мл 2,6-лутидина и смесь перемешивают еще 20 мин. Реакционную смесь разбавляют водой и экстрагируют дихлорметаном. Экстракт промывают последовательно водным раствором KHSO4, водой и сушат MgSO4. Растворитель отгоняют, остаток растворяют в 15 мл ацетона, добавляют 0,5 г NaI и смесь кипятят с обратным холодильником 2 ч. После охлаждения реакционную смесь разбавляют водой и экстрагируют этилацетатом. Экстракт промывают водой и сушат MgSO4. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем (50 г) и элюируют смесью этилацетат-гексан (4:1) с получением 0,267 г целевого соединения.
Элементный анализ для C10H21IN2O2S.
Рассчитано, %: C 33,34; H 5,88; N 7,78.
Найдено, %: C 33,57; H 5,97; N 8,09.
Справочный пример 13
Получение 1-циано- 5-(N,N-диметиламинометиленаминосульфонил)-3,3-диметилпентана.
Смесь 7,2 г иодпроизводного, полученного в справочном примере 12, 1,95 г KCN, 0,26 г 18-краун-6 и 100 мл диметилсульфоксида перемешивают при 90oC 5 ч. После охлаждения реакционную смесь разбавляют 300 мл воды и экстрагируют этилацетатом. Экстракт промывают водой, сушат и растворитель отгоняют при пониженном давлении. Остаток вносят в хроматографическую колонну с силикагелем (100 г) и элюируют смесью этилацетат-хлороформ (5:1). Фракции, содержащие целевой продукт, объединяют и концентрируют с получением 4,23 г целевого соединения в виде бесцветного масла.
ЯМР (CDCl3) δ: 0,94 (6H, с), 1,57 - 1,80 (4H, м), 2,32 (2H, т, J = 7,6 Гц), 2,91 - 3,04 (2H, м), 3,05 (3H, с), 3,15 (3H, с), 8,05 (1H, с).
Справочный пример 14
Получение метил-6-аминосульфонил-4,4-диметилгексаноата.
Смесь 3,6 г цианопроизводного, полученного в справочном примере 13, и 30 мл HCl конц. перемешивают при 120-130oC 10 ч и упаривают до сухого состояния при пониженном давлении. Остаток растворяют в 50 мл метанола, добавляют 0,3 мл H2SO4 конц. и смесь кипятят с обратным холодильником 6 ч. Метанол отгоняют, остаток разбавляют водой и экстрагируют этилацетатом. Экстракт промывают водой, сушат и растворитель отгоняют. Остаток вносят в хроматографическую колонну с силикагелем (100 г) и элюируют смесью этилацетат-гексан (2:1) с получением 2,95 г целевого соединения в виде масла.
ЯМР (CDCl3) δ: 0,93 (6H, с), 1,54 - 1,85 (4H, м), 2,30 (2H, т, J = 8,0 Гц), 3,10 (2H, д, J = 8,0 Гц), 3,68 (3H, с), 4,89 (2H, шс).
Справочный пример 15
Получение 6-(N, N-диметиламинометиленаминосульфонил)4,4-диметил-1-гексанола.
В 20 мл тетрагидрофурана растворяют 3,3 г метил-6-аминосульфонил-4,4-диметилгексаноата и к раствору при перемешивании и охлаждении льдом по каплям добавляют суспензию 0,79 г литийалюминийгидрида в 100 мл тетрагидрофурана. Смесь перемешивают при той же температуре 40 мин, затем добавляют водный тетрагидрофуран. Смесь нейтрализуют 2н. HCl и экстрагируют этилацетатом. Экстракт промывают водой, высушивают и растворитель отгоняют. Остаток растворяют в 50 мл толуола, добавляют 1,85 мл диметилацеталя N,N-диметилформамида и смесь перемешивают при 80oC 1 ч. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем (80 г) и элюируют смесью хлороформ-метанол (20:1) с получением 3,15 г целевого соединения в виде масла.
ЯМР (CDCl3) δ: 0,90 (6H, с), 1,20 - 1,33 (2H, м), 1,46 - 1,78 (4H, м), 1,61 (1H, с), 2,98 (2H, т, J = 6,4 Гц), 3,05 (3H, с), 3,14 (3H, с), 3,62 (2H, т, J = 6,4 Гц), 8,04 (1H, с).
Справочный пример 16
Получение этил-5-бром-2,2-диметилвалерата.
К раствору 28,7 мл диизопропиламина в 150 мл тетрагидрофурана добавляют 126 мл 1,6 М раствора н-бутиллития в гексане при температуре от -5 до 0oC и перемешивании и смесь выдерживают 30 мин, затем реакционную смесь охлаждают до -78oC и по каплям добавляют 26,7 мл этилизобутирата. Смесь перемешивают 1 ч, затем по каплям добавляют 41,8 г 1,3-дибромпропана. Реакционную смесь перемешивают 1 ч при -78oC, затем 2 ч при комнатной температуре. Смесь выливают в водный раствор хлорида аммония и экстрагируют этилацетатом. Экстракт промывают водой и сушат. Растворитель отгоняют и остаток перегоняют в вакууме с получением 40,3 г целевого соединения в виде бесцветного масла. Т. кип. 76-78oC/0,27 мм рт.ст.
ЯМР (CDCl3) δ: 1,19 (6H, с), 1,25 (3H, т, J = 7,2 Гц), 1,31 - 1,60 (4H, м), 3,30 - 3,50 (2H, м), 4,12 (2H, кв, J = 7,2 Гц).
Справочный пример 17
Получение этил-6-бром-2,2-диметилгексаноата.
Целевое соединение получают из этилизобутирата и 1,4-дибромбутана по реакции справочного примера 16. Т.кип. 62-64oC/0,4 мм рт.ст.
ЯМР (CDCl3) δ: 1,17 (6H, с), 1,25 (3H, т, J = 7,2 Гц), 1,33 - 1,63 (4H, м), 3,33 - 3,50 (4H, м), 4,12 (2H, кв, J = 7,2 Гц).
Справочный пример 18
Получение этил-4-хлор-2,2-диэтилбутирата.
Целевое соединение получают из этил-2-этилбутирата и 1-бром-2-хлорэтана по реакции справочного примера 16. Т.кип. 69-72oC/0,3 мм рт.ст.
ЯМР (CDCl3) δ: 0,81 (6H, т, J = 7,1 Гц), 1,26 (3H, т, J = 7,2 Гц), 1,61 (4H, кв, J = 7,2 Гц), 2,07 (2H, т, J = 8,6 Гц), 3,45 (2H, т, J = 8,6 Гц), 4,15 (2H, кв, J = 7,1 Гц).
Справочный пример 19
Получение этил-5-бром-2,2-диметилвалерата.
Целевое соединение получают из этил-2-этилбутирата и 1,3-дибромпропана по реакции справочного примера 16. Т.кип. 98-102oC/0,3 мм рт.ст.
ЯМР (CDCl3) δ: 0,79 (6H, т, J = 7,4 Гц), 1,25 (3H, т, J = 7,0 Гц), 1,51 - 1,86 (8H, м), 3,39 (3H, т, J = 6,2 Гц), 4,14 (2H, кв, J = 7,0 Гц).
Справочный пример 20
Получение этил-6-бром-2,2-диэтилгексаната.
Целевое соединение получают из этил-2-этилбутирата и 1,4-дибромбутана по реакции справочного примера 16. Т.кип. 125-130oC/0,3 мм рт.ст.
ЯМР (CDCl3) δ: 0,80 (6H, т, J = 7,6 Гц), 1,27 (3H, т, J = 7,0 Гц), 1,49 - 1,78 (4H, м), 1,61 (4H, кв, J = 7,6 Гц), 2,90 - 3,02 (2H, м), 4,15 (2H, кв, J = 7,0 Гц).
Справочный пример 21
Получение этил-2,2-диметил-5-тиоциановалерата.
В 120 мл диметилформамида растворяют 40,3 г этил-5-бром-2,2-диметилвалерата и 18,2 г тиоцианата калия и смесь перемешивают 5 ч при 85oC. Реакционную смесь выливают в 500 мл воды, экстрагируют этилацетатом, экстракт промывают водой и сушат. Растворитель отгоняют и остаток перегоняют в вакууме с получением 35,7 целевого соединения в виде масла. Т.кип. 116-118oC/0,3 мм рт.ст.
Справочный пример 22
Получение этил-2,2-диметил-6-тиоцианогексаноата.
Целевое соединение получают из этил-6-бром-2,2-диметилгексаноата и тиоцианата калия по реакции справочного примера 21. Т.кип. 123-125oC/0,4 мм рт.ст.
ЯМР (CDCl3) δ: 1,17 (6H, с), 1,25 (3H, т, J = 7,2 Гц), 1,33 - 1,65 (4H, м), 1,73 - 2,08 (2H, м), 2,94 (2H, т, J = 7,2 Гц), 4,12 (2H, кв, J = 7,2 Гц).
Справочный пример 23
Получение этил-2,2-диэтил-4-тиоцианобутирата.
Целевое соединение получают из этил-4-хлор-2,2-диэтилбутирата и тиоцианата калия по реакции справочного примера 21. Т.кип. 105-108oC/0,3 мм рт. ст.
ЯМР (CDCl3) δ: 0,81 (3H, т, J = 7,4 Гц), 0,83 (3H, т, J = 7,4 Гц), 1,27 (3H, т, J = 7,0 Гц), 1,54 - 1,72 (4H, м), 2,00 - 2,13 (2H, м), 2,80 - 2,92 (2H, м), 4,17 (2H, кв, J = 7,0 Гц).
Справочный пример 24
Получение этил-2,2-диэтил-5-тиоциановалерата.
Целевое соединение получают из этил-5-бром-2,2-диэтилвалерата, синтезированного в справочном примере 19, и тиоцианата калия по реакции справочного примера 21. Т.кип. 125-130oC/0,3 мм рт.ст.
ЯМР (CDCl3) δ: 0,80 (6H, т, J = 7,6 Гц), 1,27 (3H, т, J = 7,0 Гц), 1,49 - 1,78 (4H, м), 1,61 (4H, кв, J = 7,6 Гц), 2,90 - 3,02 (2H, м), 4,15 (2H, кв, J = 7,0 Гц).
Справочный пример 25
Получение этил-2,2-диэтил-6-тиоцианогексаноата.
Целевое соединение получают из этил-6-бром-2,2-диэтилгексаноата, синтезированного в справочном примере 20, и тиоцианата калия по реакции справочного примера 21. Т.кип. 145-148oC/0,3 мм рт.ст.
ЯМР (CDCl3) δ: 0,78 (6H, т, J = 7,6 Гц), 1,25 (3H, т, J = 7,0 Гц), 1,21 - 1,68 (8H, м), 1,82 (2H, м), 2,95 (2H, т, J = 7,4 Гц), 4,14 (2H, кв, J = 7,0 Гц).
Справочный пример 26
Получение этил-5-аминосульфонил-2,2-диметилвалерата.
В смеси 150 мл уксусной кислоты и 150 мл воды растворяют 35,68 г этил-2,2-диметил-5-тиоциановалерата, полученного в справочном примере 21, и в раствор при сильном перемешивании и 10-15oC в течение 1,2 ч пропускают газообразный хлор. Смесь дополнительно перемешивают 1 ч при 0oC, затем экстрагируют дихлорметаном. Экстракт промывают водой, сушат и растворитель отгоняют. Остаток растворяют в 200 мл дихлорметана и в раствор при 0oC в течение 40 мин пропускают газообразный аммиак. Смесь фильтруют, фильтрат промывают водой и сушат. Растворитель отгоняют, остаток вносят в хроматографическую колонну с силикагелем (150 г) и элюируют смесью этилацетат-гексан (1:1) с получением 30 г целевого соединения.
ЯМР (CDCl3) δ: 1,20 (6H, с), 1,26 (3H, т, J = 7,4 Гц), 1,61 - 1,93 (4H, м), 3,11 (2H, т, J = 7,0 Гц), 4,14 (2H, кв, J = 7,4 Гц), 4,88 (2H, шс).
Справочный пример 27
Получение этил-6-аминосульфонил-2,2-диметилгексаноата.
Целевое соединение получают из этил-2,2-диметил-6-тиоцианогексаноата, синтезированного в справочном примере 22, по реакции справочного примера 26.
ЯМР (CDCl3) δ: 1,17 (6H, с), 1,25 (3H, т, J = 7,2 Гц), 1,32 - 1,64 (4H, м), 1,85 (2H, т, J = 7,6 Гц), 3,12 (2H, т, J = 7,6 Гц), 4,12 (2H, кв, J = 7,2 Гц), 4,84 (2H, шс).
Справочный пример 28
Получение этил-4-аминосульфонил-2,2-диэтилбутирата.
Целевое соединение получают из этил-2,2-диэтил-4-тиоцианобутирата, синтезированного в справочном примере 23, по реакции справочного примера 26. Т. пл. 93-94oC.
Элементный анализ для C10H21NO4S.
Рассчитано, %: C 47,79; H 8,42; N 5,57.
Найдено, %: C 47,73; H 8,44; N 5,70.
ЯМР (CDCl3) δ: 0,83 (6H, т, J = 7,4 Гц), 1,27 (3H, т, J = 7,0 Гц), 1,61 (4H, т, J = 7,4 Гц), 2,03 - 2,16 (2H, м), 2,99 - 3,13 (2H, м), 4,17 (2H, кв, J = 7,0 Гц), 4,84 (2H, шс).
Справочный пример 29
Получение этил-5-аминосульфонил-2,2-диэтилвалерата.
Целевое соединение получают из этил-2,2-диэтил-5-тиоциановалерата, синтезированного в справочном примере 24, по реакции справочного примера 26. Т. пл. 66-67oC.
Элементный анализ для C11H23NO4S.
Рассчитано, %: C 49,79; H 8,74; N 5,28.
Найдено, %: C 49,43; H 8,81; N 5,18.
ЯМР (CDCl3) δ: 0,79 (6H, т, J = 7,4 Гц), 1,26 (3H, т, J = 7,2 Гц), 1,61 (4H, т, J = 7,4 Гц), 1,66 - 1,85 (4H, м), 3,11 (2H, т, J = 6,6 Гц), 4,15 (2H, кв, J = 7,2 Гц), 4,84 (2H, шс).
Справочный пример 30
Получение этил-6-аминосульфонил-2,2-диэтилгексаноата.
Целевое соединение получают из этил-6-тиоциано-2,2-диэтилгексаноата, синтезированного в справочном примере 25, по реакции справочного примера 26.
ЯМР (CDCl3) δ: 0,77 (6H, т, J = 7,4 Гц), 1,25 (3H, т, J = 7,2 Гц), 1,19 - 1,40 (2H, м), 1,58 (4H, кв, J = 7,4 Гц), 1,49 - 1,69 (2H, м), 1,85 (2H, м), 3,12 (2H, м), 4,13 (2H, кв, J = 7,2 Гц), 4,71 (2H, шс).
Справочный пример 31
Получение 5-гидрокси-4,4-диметил-1-пентансульфонамида.
Раствор 7,1 г этил-5-аминосульфонил-2,2-диметилвалерата, синтезированного в справочном примере 26, в 20 мл тетрагидрофурана добавляют по каплям к суспензии литийалюминийгидрида в 100 мл тетрагидрофурана при перемешивании и охлаждении льдом. Смесь перемешивают при 0oC 40 мин, добавляют водный тетрагидрофуран для разложения избытка литийалюминийгидрида, раствор нейтрализуют 2н. HCl и экстрагируют этилацетатом. Экстракт промывают водой, сушат MgSO4 и растворитель отгоняют. Остаток вносят в хроматографическую колонну с силикагелем (100 г) и элюируют смесью гексан-этилацетат (4:1) с получением 3,39 г целевого соединения в виде масла.
ЯМР (CDCl3) δ: 0,90 (6H, с), 1,35 - 1,50 (2H, м), 1,75 - 1,97 (2H, м), 3,12 (2H, т, J = 7,8 Гц), 3,35 (2H, с), 5,04 (2H, шс).
Справочный пример 32
Получение 6-гидрокси-5,5-диметил-1-гексансульфонамида.
Целевое соединение получают из этил-6-аминосульфонил-2,2-диметилгексаноата, синтезированного в справочном примере 27, по реакции справочного примера 31.
ЯМР (CDCl3) δ: 0,87 (6H, с), 1,21 - 1,54 (4H, м), 1,76 - 1,94 (2H, м), 2,05 (1H, с), 3,16 (2H, т, J = 8 Гц), 3,31 (2H, с), 5,13 (2H, шс).
Справочный пример 33
Получение 4-гидрокси-3,3-диэтил-1-бутансульфонамида.
Целевое соединение получают из этил-4-аминосульфонил-2,2-диэтилбутирата, синтезированного в справочном примере 28, по реакции справочного примера 31. Т.пл. 79-80oC.
Элементный анализ для C8H19NO3S.
Рассчитано, %: C 45,91; H 9,15; N 6,69.
Найдено, %: C 46,90; H 9,20; N 6,69.
ЯМР (CDCl3) δ: 0,74 (6H, т, J = 7,4 Гц), 1,58 (4H, кв, J = 7,4 Гц), 1,50 - 1,66 (2H, м), 2,83 - 2,97 (2H, м), 3,11 (2H, c), 6,71 (2H, шс).
Справочный пример 34
Получение 5-гидрокси-4,4-диэтил-1-пентансульфонамида.
Целевое соединение получают из этил-5-аминосульфонил-2,2-диэтилвалерата, синтезированного в справочном примере 29, по реакции справочного примера 31.
ЯМР (CDCl3) δ: 0,79 (6H, т, J = 7,6 Гц), 1,14 - 1,45 (6H, м), 1,70 - 1,89 (2H, м), 2,05 (1H, с), 3,12 (2H, т, J = 7,6 Гц), 3,39 (2H, с), 5,18 (2H, шс).
Справочный пример 35
Получение 6-гидрокси-5,5-диэтил-1-гексансульфонамида.
Целевое соединение получают из этил-6-аминосульфонил-2,2-диэтилгексаноата, синтезированного в справочном примере 30, по реакции справочного примера 31. Т.пл. 64-65oC.
Элементный анализ для C10H23NO3S.
Рассчитано, %: C 50,60; H 9,77; N 5,90.
Найдено, %: C 50,90; H 9,58; N 6,15.
ЯМР (CDCl3) δ: 0,78 (6H, т, J = 7,2 Гц), 1,15 - 1,49 (4H, м), 1,23 (4H, кв, J = 7,2 Гц), 1,67 (1H, с), 1,85 (2H, м), 3,15 (2H, т, J = 4,6 Гц), 3,35 (2H, с), 4,90 (2H, шс).
Справочный пример 36
Получение 4-(N, N-диметиламинометиленаминосульфонил)-2,2- диэтил-1-бутанола.
К раствору 2,0 г 4-гидрокси-3,3-диэтил-1-бутансульфонамида, синтезированному в справочном примере 33, в 30 мл толуола добавляют 1,2 г диметилацеталя N,N-диметилформамида и смесь перемешивают при 90oC 1 ч. Растворитель отгоняют при пониженном давлении, остаток вносят в хроматографическую колонну с силикагелем (70 г) и элюируют смесью этилацетат-хлороформ-метанол (20:20: 1) с получением 2,43 г целевого соединения в виде масла.
ЯМР (CDCl3) δ: 0,81 (6H, т, J = 7,4 Гц), 1,15 - 1,38 (4H, м), 1,68 - 1,80 (2H, м), 1,96 (1H, шс), 2,96 - 3,07 (2H, м), 3,04 (3H, с), 3,14 (3H, с), 3,36 (2H, с), 8,05 (1H, с).
Справочный пример 37
Получение 5-(N,N-диметиламинометиленаминосульфононил)-2,2- диэтил-1-пентанола.
Целевое соединение получают из 5-гидрокси-4,4-диэтил-1-пентансульфонамида, синтезированного в справочном примере 34, по реакции справочного примера 36; т.пл. 87-88oC.
Элементный анализ для C12H26N2O3S.
Рассчитано, %: C 51,77; H 9,41; N 10,06.
Найдено, %: C 51,75; H 9,47; N 10,09.
ЯМР (CDCl3) δ: 0,78 (6H, т, J = 7,4 Гц), 1,18 - 1,41 (6H, м), 1,64 (1H, с), 1,70 - 1,85 (2H, м), 2,99 (2H, т, J = 7,6 Гц), 3,04 (3H, с), 3,14 (3H, с), 3,37 (2H с), 8,04 (1H, с).
Справочный пример 38
Получение 2-изопропил-1,3-пропандиола.
К суспензии 4,17 г литийалюминийгидрида в тетрагидрофуране добавляют по каплям при перемешивании и охлаждении льдом 15 г диэтилизопропилмалоната. После окончания прибавления реакционную смесь перемешивают при 0oC 30 мин, затем при комнатной температуре 1 ч. К смеси добавляют водный тетрагидрофуран для разложения избытка литийалюминийгидрида, нейтрализуют 6н. HCl. Раствор фильтруют, фильтрат экстрагируют этилацетатом. Экстракт промывают водой и сушат MgSO4. Растворитель отгоняют при пониженном давлении и получают 7,47 г целевого соединения.
ЯМР (CDCl3) δ: 0,92 (3H, с), 0,95 (3H, с), 1,49 - 1,65 (1H, м), 1,66 - 1,86 (1H, м), 2,32 (2H, шс), 3,72 - 3,93 (4H, м).
Справочный пример 39
Получение 2-этил-2-метил-1,3-пропандиола.
Целевое соединение получают из диэтил-2-этил-2-метилмалоната по реакции справочного примера 38. Т.пл. 78-81oC/0,3 мм рт.ст.
ЯМР (CDCl3) δ: 0,81 (3H, с), 0,87 (3H, т, J = 7,2 Гц), 1,38 (2H, кв, J = 7,2 Гц), 2,48 (2H, шс), 3,54 (4H, с).
Справочный пример 40
Получение 3-бром-2-изопропил-1-пропанола.
В 150 мл дихлорметана растворяют 11,8 г 2-изопропил-1,3-пропандиола, синтезированного в справочном примере 38, и 26 г трифенилфосфина. Затем маленькими порциями при охлаждении льдом добавляют 17,8 г N-бромсукцинимида. Реакционную смесь перемешивают при этой температуре 30 мин, затем при комнатной температуре 1 ч реакционную смесь концентрируют при пониженном давлении. Остаток пропускают через хроматографическую колонну с силикагелем (100 г) и элюируют смесью этилацетат-гексан (3:7) с получением 11,87 г целевого соединения в виде бесцветного масла.
ЯМР (CDCl3) δ: 0,94 (3H, с), 0,98 (3H, с), 1,40 - 1,69 (2H, м), 1,71 - 1,93 (1H, м), 3,61 - 3,92 (4H, м).
Справочный пример 41
Получение 3-бром-2-этил-2-метил-1-пропанола.
Целевое соединение получают из 2-этил-2-метил-1,3-пропандиола, синтезированного в справочном примере 39, по реакции справочного примера 40.
ЯМР (CDCl3) δ: 0,87 (3H, т, J = 7,4 Гц), 0,96 (3H, с), 1,40 (2H, кв, J = 7,4 Гц), 1,53 (1H, шс), 3,40 (2H, с), 3,48 (2H, с).
Справочный пример 42
Получение 3-ацетокси-2-изопропил-1-пропантиоцианата.
Смесь 22 г 3-бром-2-изопропил-1-пропанола, 16,5 г тиоцианата калия и 100 мл диметилформамида перемешивают 15 ч при 100oC. После охлаждения к реакционной смеси добавляют 200 мл диэтилового эфира и 200 мл воды и органический слой отделяют. Водный слой экстрагируют 150 мл этилацетата и органические слои объединяют, промывают насыщенным водным раствором NaCl и сушат. Растворитель отгоняют при пониженном давлении. К остатку добавляют 17,4 г уксусного ангидрида и 18,3 г пиридина и смесь перемешивают при комнатной температуре 3 ч. Растворитель отгоняют при пониженном давлении. Остаток вводят в хроматографическую колонну с силикагелем (200 г) и элюируют смесью этилацетат-гексан (1:5) с получением целевого соединения в виде бесцветного масла.
ЯМР (CDCl3) δ: 0,97 (3H, т, J = 7,3 Гц), 1,01 (3H, д, J = 7,3 Гц), 1,84 - 2,05 (2H, м), 2,08 (3H, с), 2,97 - 3,24 (2H, м), 4,03 - 4,35 (2H, м).
Справочный пример 43
Получение 3-ацетокси-2-этил-2-метил-1-пропантиоцианата.
Целевое соединение получают из 3-бром-2-этил-2-метил-1-пропанола по реакции справочного примера 42.
ЯМР (CDCl3) δ: 0,90 (3H, т, J = 7,4 Гц), 1,03 (3H, с), 1,46 (2H, кв, J = 7,4 Гц), 2,09 (3H, с), 3,07 (2H, с), 3,94 (2H, с).
Справочный пример 44
Получение 3-ацетокси-2-изопропил-1-пропансульфонамида.
В смеси 50 мл уксусной кислоты и 50 мл воды растворяют 10 г 3-ацетокси-2-изопропил-1-пропантиоцианата и при сильном перемешивании в раствор пропускают газообразный хлор в течение 2 ч при комнатной температуре. Реакционную смесь экстрагируют дихлорметаном, экстракт промывают насыщенным водным раствором NaCl и высушивают. Растворитель отгоняют при пониженном давлении. Остаток растворяют в 100 мл дихлорметана и при охлаждении через раствор пропускают газообразный аммиак в течение 30 мин при температуре < 15oC. Осадок отфильтровывают, фильтрат концентрируют. Остаток вводят в хроматографическую колонну с силикагелем (100 г) и элюируют смесью метанол-хлороформ (1:20) с получением 7,9 г целевого соединения в виде масла.
ЯМР (CDCl3) δ: 0,96 (3H, т, J = 6,8 Гц), 0,98 (3H, д, J = 6,8 Гц), 1,89 - 2,07 (1H, м), 2,08 (3H, с), 2,17 - 2,32 (1H, м), 3,11 - 3,19 (2H, м), 4,21 - 4,29 (2H, м), 4,87 (2H, шс).
Справочный пример 45
Получение 3-ацетокси-2-этил-2-метил-1-пропансульфонамида.
Целевое соединение получают из 3-ацетокси-2-этил-2-метил-1-пропантиоцианата по реакции справочного примера 44.
ЯМР (CDCl3) δ: 0,90 (3H, т, J = 7,4 Гц), 1,16 (3H, с), 1,57 (2H, кв, J = 7,4 Гц), 2,09 (3H, с), 3,24 (2H, дд, J = 2,5 Гц и 4,9 Гц), 4,08 (2H, с), 4,86 (2H, шс).
Справочный пример 46
Получение 3-гидрокси-2-изопропил-1-пропансульфонамида.
В 50 мл метанола растворяют 7,0 г 3-ацетокси-2-изопропил-1-пропансульфонамида и при перемешивании к раствору добавляют при комнатной температуре 6,5 г 28% метоксида натрия. Через 30 мин реакционную смесь концентрируют до сухого состояния. Остаток вносят в хроматографическую колонну с силикагелем (100 г) и элюируют смесью хлороформ-метанол (9:1) с получением 4,4 г целевого соединения. Т.пл. 83-84oC.
Элементный анализ для C6H15NO3S.
Рассчитано, %: C 39,67; H 8,34; N 7,73.
Найдено, %: C 39,72; H 8,36; N 7,78.
ЯМР (d6-ДМСО) δ: 0,87 (3H, т, J = 7,0 Гц), 0,87 (3H, д, J = 7,0 Гц), 1,79 - 2,09 (2H, м), 2,85 - 2,95 (2H, м), 3,43 - 3,59 (2H, м), 4,55 12H, шс), 6,77 (2H, шс).
Справочный пример 47
Получение 3-гидрокси-2-этил-2-метил-1-пропансульфонамида.
Целевое соединение получают из 3-ацетокси-2-этил-2-метил-1-пропансульфонамида по реакции справочного примера 46.
ЯМР (CDCl3) δ/ : 0,90 (3H, т, J = 7,4 Гц), 1,07 (3H, с), 1,33 - 1,68 (2H, м), 2,71 (2H, шс), 3,22 (2H, кв, J = 7,4 Гц), 3,61 (2H, с), 5,13 (2H, шс).
Справочный пример 48
Получение этил-1-(2-хлорэтил)циклогексаноата.
Целевое соединение получают из этилциклогексаноата по реакции справочного примера 1. Т.кип. 83-86oC/0,25 мм рт.ст.
ЯМР (CDCl3) δ: 1,11 - 1,68 (8H, м), 1,27 (3H, т, J = 7,2 Гц), 2,01 (2H, т, J = 6,7 Гц), 1,91 - 2,16 (2H, м), 3,45 (2H, т, J = 6,7 Гц), 4,16 (2H, кв, J = 7,2 Гц).
Справочный пример 49
Получение этил-1-(2-тиоцианоэтил)циклогексаноата.
Целевое соединение получают из этил-1-(2-хлорэтил)циклогексаноата по реакции справочного примера 2. Т.кип. 118-122oC/0,25 мм рт.ст.
ЯМР (CDCl3) δ: 1,29 (3H, т, J = 7,2 Гц), 1,14 - 1,66 (8H, м), 1,92 - 2,14 (4H, м), 2,80 - 2,90 (2H, м), 4,19 (2H, кв, J = 7,2 Гц).
Справочный пример 50
Получение этил-1-(2-аминосульфонилэтил)циклогексаноата.
Целевое соединение получают из этил-1-(2-тиоцианоэтил)циклогексаноата по реакции справочного примера 3.
ЯМР (CDCl3) δ: 1,27 (3H, т, J = 7,0 Гц), 1,16 - 1,71 (10H, м), 1,94 - 2,14 (2H, м), 2,98 - 3,13 (2H, м), 4,17 (2H, кв, J = 7,0 Гц), 4,69 (2H, шс).
Справочный пример 51
Получение 4-гидрокси-3,3-пентаметилен-1-бутансульфонамида.
Целевое соединение получают из этил-1-(2-аминосульфонилэтил)циклогексаноата по реакции справочного примера 4.
ЯМР (CDCl3) δ: 1,19 - 1,56 (10H, м), 1,82 - 1,97 (2H, м), 2,05 (1H, с), 3,06 - 3,22 (2H, м), 3,43 (2H, с), 5,27 (2H, шс).
Справочный пример 52
Получение 3-(N, N-диметиламинометиленаминосульфонил)-2-изопропил- 1-пропанола.
Целевое соединение получают из 3-гидрокси-2-изопропил-1-пропансульфонамида по реакции справочного примера 5.
ЯМР (CDCl3) δ: 0,91 (3H, т, J = 6,6 Гц), 0,94 (3H, д, J = 6,6 Гц), 1,66 (1H, шс), 1,82 - 2,11 (2H, м), 3,04 (3H, с), 3,11 (2H, д, J = 6,6 Гц), 3,15 (3H, с), 3,63 - 3,93 (2H, м), 8,06 (1H, с).
Справочный пример 53
Получение 3-(N,N-диметиламинометиленаминосульфонил)-2-этил-2- метил-1-пропанола.
Целевое соединение получают из 3-гидрокси-2-этил-2-метил-1-пропансульфонамида по реакции справочного примера 5.
ЯМР (CDCl3) δ: 0,88 (3H, т, J = 7,4 Гц), 1,05 (3H, с), 1,32 - 1,73 (2H, м), 3,04 (2H, кв, J = 7,4 Гц), 3,05 (2H, с), 3,15 (3H, с), 3,56 - 3,69 (2H, м), 8,05 (1H, с).
Справочный пример 54
Получение 4-(N,N-диметиламинометиленаминосульфонил)-2,2- пентаметилен-1-бутанола.
Целевое соединение получают из 4-гидрокси-3,3-пентаметилен-1-бутансульфонамида по реакции справочного примера 5.
ЯМР (CDCl3) δ: 1,22 - 1,54 (10H, м), 1,80 - 1,94 (4H, м), 3,05 (3H, с), 3,14 (3H, с), 3,41 (2H, с), 8,05 (1H, с).
Справочный пример 55
Получение N,N-диметил-3-гидрокси-1-пропансульфонамида.
Целевое соединение получают из 3-ацетокси-1-пропансульфонилхлорида и хлоргидрата диметиламина по реакции справочных примеров 44 и 46.
ЯМР (CDCl3) δ: 1,91 (1H, шс), 2,0 - 2,2 (2H, м), 2,89 (6H, с), 3,0 - 3,2 (2H, м), 3,7 - 3,9 (2H, м).
Справочный пример 56
Получение 3-(1-метил-4-пиперазинилсульфонил)-1-пропанола.
Целевое соединение получают из 3-ацетокси-1-пропансульфонилхлорида и 1-метилпиперазина по реакции справочного примера 44 и 46. Т.пл. 90-93oC.
Элементный анализ для C8H18N2O3S.
Рассчитано, %: C 43,22; H 8,16; N 12,60.
Найдено, %: C 43,01; H 8,20; N 12,53.
Препаративный пример 1
1) Соединение примера 1 - 10,0 мг
2) Лактоза - 60,0 мг
3) Зерновой крахмал - 35,0 мг
4) Желатин - 3,0 мг
5) Стеарат магния - 2,0 мг
С применением 0,03 мл 10% водного раствора желатина (3,0 мг желатина) смесь 10,0 мг соединения примера 1, 60,0 мг лактозы и 35,0 мг зернового крахмала гранулируют пропусканием через сито с ячейками 1 мм, сушат при 40oC и пересеивают. Образующиеся гранулы смешивают с 2,0 мг стеарата магния и смесь подвергают прессованию. Образующееся ядро таблетки покрывают водной суспензией, содержащей сахарозу, диоксид титана, тальк и гуммиарабик. Покрытую таблетку полируют пчелиным воском.
Препаративный пример 2
1) Соединение примера 1 - 10,0 мг
2) Лактоза - 70,0 мг
3) Зерновой крахмал - 50,0 мг
4) Растворимый крахмал - 7,0 мг
5) Стеарат магния - 3,0 мг
С применением 0,07 мл водного раствора растворимого крахмала (7,0 мг растворимого крахмала) смесь соединения примера 1 и 3,0 мг стеарата магния гранулируют, сушат и смешивают с 70,0 мг лактозы и 50,0 мг зернового крахмала. Смесь прессуют в таблетку.
Препаративный пример 3
1) Соединение примера 1 - 5,0 мг
2) Хлорид натрия - 20,0 мг
3) Дистиллированная вода - 2 мл
5,0 мг соединения, полученного в примере 1, и 20,0 мг хлорида натрия растворяют в дистиллированной воде и раствор разбавляют водой по 2 мл. Раствор фильтруют и асептически наливают в 2 мл ампулу. Ампулу стерилизуют и запаивают с получением инъекционного раствора.
Эксперимент
Результаты фармакологических испытаний соединений формулы I или их солей показан ниже.
Влияние на бронхостеноз у гвинейских свиней, вызываемый фактором активации тромбоцитов (ФАТ).
Для опытов используют самцов гвинейской свиньи Хартли (масса тела около 500 г). Бронхостеноз, вызываемый ФАТ, 1 мкг/кг внутривенно, у гвинейской свинью измеряют по методу Концетта-Ресслера. Гвинейскую свинью иммобилизуют в положении на спине, под уретановой анестезией (1,5 г/кг внутривенно) выполняют трахеотомию и трахею соединяют через трубку с респиратором. Боковой отвод трахеотомической трубки соединяют с датчиком дыхания (модель 7020, Ugobasite). При объеме воздуха на порцию 3-7 мл, частоте вентиляции 70/мин и давлении в легочной артерии 10 см вод.ст. объем избытка воздуха регистрируется на ректиграфе (Recte-Hori-8S, San-ei Sokki) через датчик воздуха. После введения галламина (1 мг/кг внутривенно), ФАТ, 1 мкг/кг, растворенный в физиологическом солевом растворе, вводят через трубку в яремную вену и вызванный бронхостеноз регистрируют в течение 15 мин. Лекарство, суспендированное в 5% растворе гуммиарабика, вводят перорально в количестве 30 мг/кг или 10 мг/кг за час до введения ФАТ. Результаты представлены в табл. 1.
Из табл. 1 ясно, что соединения формулы I или их соли обладают превосходной антиФАТ-активностью.
Влияние на бронхостеноз у гвинейских свиней, вызываемый лейкотриеном C4 (ЛТС4).
Для опытов используют самцов гвинейнской свиньи Хартли (масса тела около 500 г). Бронзостеноз, вызываемый ЛТС4, 20 мкг/кг внутривенно, у гвинейской свиньи измеряют по методу Концетта-Ресслера. Гвинейскую свинью иммобилизуют в положении на спине, под уретановой анестезией (1,5 г/кг внутривенно) выполняют трахеотомию и трахею соединяют через трубку с респиратором. Боковой отвод трахеотомической трубки соединяют с датчиком дыхания (Модель 7020, Ugobasite). При объеме воздуха на порцию 3-7 мл, частоте вентиляции 70/мин и давлении в легочной артерии 10 см вод.ст. объем избытка воздуха регистрируется на ректиграфе (Recte-Hori-8S, San-ei Sokki) через датчик воздуха. После введения галламина (1 мг/кг внутривенно), ЛТС4, 20 мкг/кг, растворенный в физиологическом солевом растворе, вводят через трубку в яремную вену и вызванный бронхостеноз регистрируют в течение 15 мин. Лекарство, растворенное в 5%-ном растворе гуммиарабика, вводят перорально за час до введения ЛТС4. Результаты представлены в табл. 2.
Из табл. 2 ясно, что соединения формулы I и их соли обладают превосходной анти-ЛТС4 активностью.
Влияние на бронхостеноз у гвинейских свиней, вызываемый эндотелином-1 (ET-1).
Для опытов используют самцов гвинейской свинью Хартли (масса тела около 500 г). Бронхостеноз, вызываемый ET-1, 5 мкг/кг внутривенно, у гвинейской свиньи измеряют по методу Концетта-Ресслера. Гвинейскую свинью иммобилизуют в положении на спине, под уретановой анестезией (1,5 г/кг внутривенно) выполняют трахеотомию и трахею соединяют через трубку с респиратором. Боковой отвод трахеотомической трубки соединяют с датчиком дыхания (Модель 7020, Ugobasite). При объеме воздуха на порцию 3-7 мл, частоте вентиляции 70/мин и давлении в легочной артерии 10 см вод.ст. объем избытка воздуха регистрируется на ректиграфе (Recte-Hori-8S, San-ei Sokki) через датчик воздуха. После введения галламина (1 мг/кг внутривенно), ET-1, 5 мкг/кг, растворенный в физиологическом солевом растворе, вводят через трубку в яремную вену и вызванный бронхостеноз регистрируют в течение 15 мин. Лекарство, суспендированное в 5%-ном растворе гуммиарабика, вводят перорально за час до введения ET-1. Результаты представлены в табл. 3.
Из табл. 3 ясно, что соединения формулы I и их соли обладают превосходной анти-ET-1 активностью.
Ингибирование сужения просвета бронхов, вызванного ФАТ, %:
Пример 19. 30% ингибирования (10 мг/кг, перорально)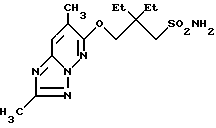
Пример 27. 33% ингибирования (30 мг/кг, перорально)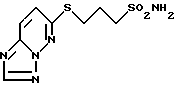
Пример 13. 54% ингибирования (1 мг/кг, внутривенно)
Пример 25. 55% ингибирования (10 мг/кг, внутривенно)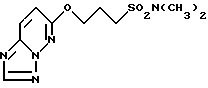
Пример 26. 33% ингибирования (10 мг/кг, внутривенно)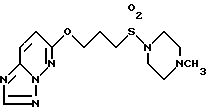
Пример 24. 43% ингибирования (10 мг/кг, внутривенно)
Методика испытания
Морских свинок Хартли, весящих примерно 350-450 г, сенсибилизировали интраперитониальной инъекцией 1 мл физиологического раствора, содержащего овальбумин (10 мкг) и гелем гидроксида алюминия (5 мг) 4 раза с интервалом в две недели по способу Левина (J. Immunol., 106, 29 (1971)). Через неделю после последней сенсибилизации морских свинок анестезировали уретаном (1,5 г/кг, интраперитониально). Трахею и яремную вену каждого животного канюлировали и животных механически вентилировали респиратором постоянного объема (модель 683, Харвард Аппаратус, Южный Нэйтик, Манитоба или Миннесота), отрегулированным на приливно-отливный объем 3-5 мл при частоте 70 дыханий в минуту. Сужение просвета бронхов измеряли по способу Концетта-Росслера (Naunyn-Schmiedeberger's Arch. Exp. Path. Pharmak., 195, 71 (1940)). Применяли начальное давление 10 см H2O и животных обрабатывали триэтиодидом галламина (1 мг/кг, внутривенно), а затем мепирамином (1 мг/кг, внутривенно) и пропранолом (1 мг/кг, внутривенно). Через две минуты после обработки сужение бронхов вызывали внутривенным введением овальбумина (1 мг/кг). Соединение в примере 6 давали перорально за 1 час до инъекции антигена.
Результаты.
Соединение в примере 6 настоящей заявки (1, 3, 10 мг/кг, перорально) в зависимости от дозы ингибировало сужение просвета бронхов, вызываемое антигеном (табл. 4 - представлены средние данные по 7-8 животным).
Выводы. Пероральное введение соединения в примере 6 ингибирует сужение просвета бронхов, вызванное антигеном у морских свинок.
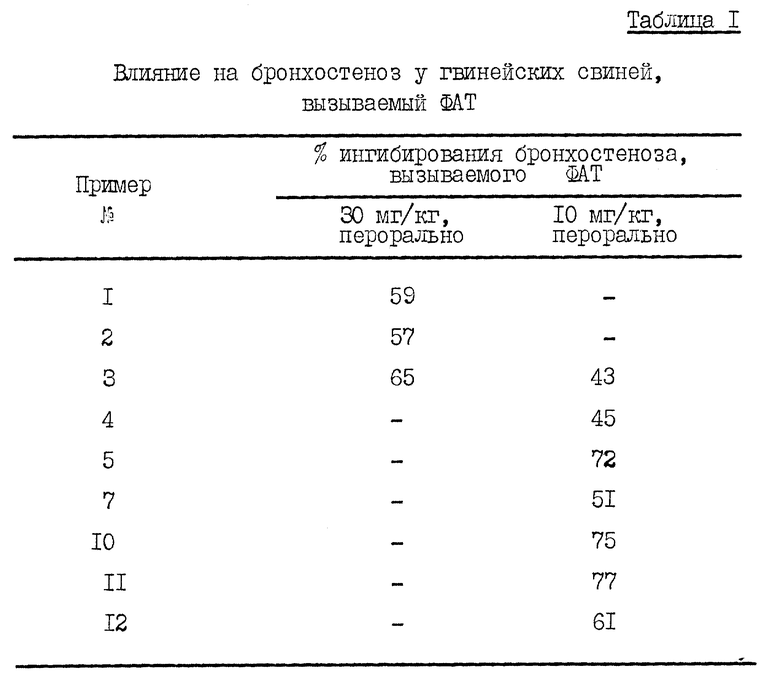

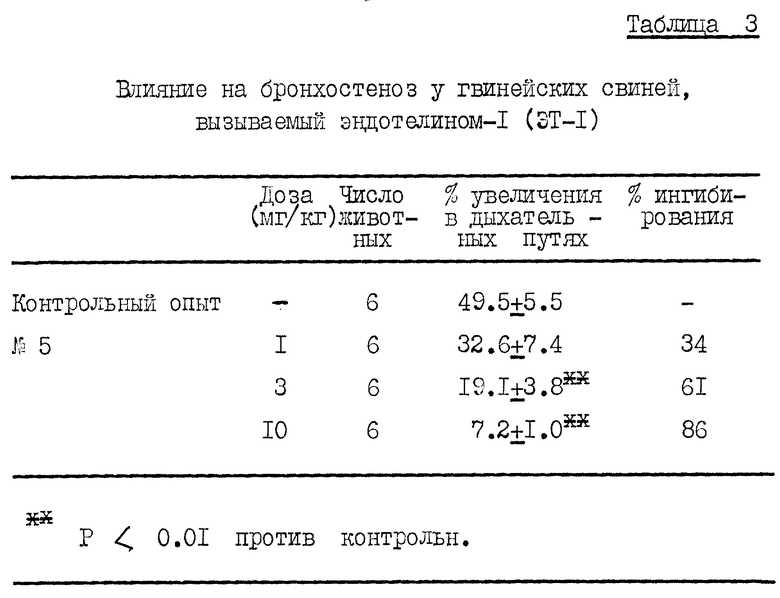

Производные 1,2,4-триазоло(1,5-b)пиридазина общей формулы I, где R1, R2, R3 - Н или низший алкил, Х - кислород или сера, Y - группа -CR4R5, R4, R5 - Н, низший алкил или группа формулы (a), R6, R7 - Н или низший алкил или вместе с соседним атомом азота образуют пиперазиногруппу, возможно N-замещенную низшей алкильной группой; m, n - целое число, равное 0-4, или их соли обладают антиаллергической, противовоспалительной и антиФАТ-активностью. 5 с. и 14 з.п. ф-лы, 4 табл.
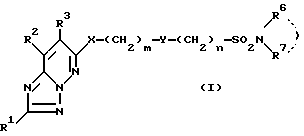

в которой R1 - водород или низший алкил;
R2 и R3 - водород или низший алкил;
Х - кислород или сера;
Y - группа - CR4R5, где R4 и R5 - водород или низший алкил или группа формулы
R6 и R7 - водород, низший алкил или R6 и R7 вместе с соседним атомом азота образуют пиперазиногруппу, возможно N-замещенную низшей алкильной группой;
m и n - целое число, равное 0 - 4,
или их соли.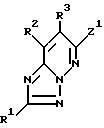
где Z1 -реакционноспособная группа;
R1, R2, R3 определены в п.1,
или его соли с соединением формулы III
где Z2 - группа, уходящая при реакции с Z1;
X, Y, R6 и R7, m и n определены в п.1,
или его солью.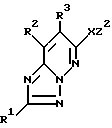
где Z2 - группа, уходящая при реакции с Z1;
R1, R2, R3 и X определены в п.1,
или его соли с соединением формулы V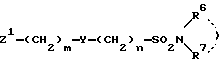
где Z1 -реакционноспособная группа;
Y, R6 и R7, m и n определены в п.1,
или его солью.
Приоритет по пунктам и признакам:
18.03.92 по пп.1 - 19 и примерам 1 - 4;
18.08.92 по примеру 5;
01.02.93 по примерам 6 - 19;
12.03.93 по примерам 20 - 27.
| Способ получения производных -триазоло (4,3-в) пиридазинов или их солей | 1975 |
|
SU545261A3 |
| Способ получения замещенного 6-фенил-1,2,4-триазол-/4,3-в/-пиридазина | 1977 |
|
SU793399A3 |
| ЭЛЕКТРОЛИТ ВЫРАВНИВАЮЩЕГО НИКЕЛИРОВАНИЯ | 0 |
|
SU248413A1 |
| СТАТОР ЭЛЕКТРИЧЕСКОЙ МАШИНЫ | 0 |
|
SU381132A1 |
| Способ получения катализатора окисления в | 1972 |
|
SU444549A1 |
| Справочник практикующего врача /Под ред.акад.А.И.Воробьева | |||
| - М.: Медицина, 1990, т.1, с.139-145 | |||
| Малая медицинская энциклопедия | |||
| - М: Советская энциклопедия, 1991, т.1, с.268 | |||
| СЧЕТНЫЙ ДИСК ДЛЯ РАСЧЕТА СОСТАВНЫХ ЧАСТЕЙ ПИЩИ | 1919 |
|
SU284A1 |
Авторы
Даты
1999-05-20—Публикация
1993-03-12—Подача