Изобретение относится к новым циклическим эфирам, обладающим очень хорошей модулирующей активностью в отношении натриевых каналов, к их получению и применению.
Предпосылки создания изобретения
Вещества, которые модулируют натриевый канал, управляемый импульсами разности потенциалов, известны как местные анестетики, противоаритмические средства или противосудорожные средства. Последние исследования показали, что модуляторы натриевых каналов эффективны также в качестве терапевтических лекарственных средств для лечения заболеваний и расстройств центральной нервной системы, таких, как ишемическое нарушение центральной нервной системы, травма головного мозга, повреждение спинного мозга и т.д. (Trends in Pharmacological Science, 16, 309-316, 1995). Ишемическое или травматическое повреждение нерва влечет за собой удерживание ионов натрия в местных нейронах или нервных волокнах (Stroke, 20, 1377-1382, 1989), а это удерживание натрия вызывает развитие отека, анормальное выделение различных нейротрансмиттеров, таких, как допамин и глутаматы (Trends in Neuroscience, 16, 415-419, 1993), и стимулирование притока ионов кальция под воздействием Na+/Ca2+-ионообменника (Neuron, 12, 295-300, 1994), что приводит к повреждению клеток.
Известны как модуляторы натриевых каналов BW619C89, лифаризин, рилузол и некоторые другие соединения (Trends in Pharmacological Science, 16, 309-316, 1995), но циклические простые эфиры, имеющие аминогруппы на конденсированных кольцевых системах, не известны.
В качестве циклических простых эфиров, имеющих аминогруппы на конденсированных кольцевых системах, известны, кроме прочих других, следующие соединения:
1) Аминокумараны следующей формулы, обладающие ингибирующей активностью в отношении перокисления липидов (EP-A-483772 и его двойник JP-A-5-140142):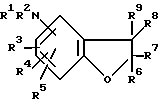
где каждый из R1 и R2 представляет водород, ацил, алкоксикарбонил или алифатическую или ароматическую группу, которая может быть замещенной; каждый из R3, R4 и R5 представляет гидрокси, который может быть ацилирован, или амино-, алкокси- или алифатическую группу, которая может быть замещенной, или два из радикалов R3, R4 и R5 могут образовывать карбоцикл; каждый из R6 и R7 представляет алифатическую группу, которая может быть замещенной, и, по крайней мере один из радикалов R6 и R7, имеет метилен в α-положении; каждый из R8 и R9 представляют водород или алифатическую или ароматическую группу, которая может быть замещенной.
2) Аминокумараны следующей формулы, обладающие ингибирующей активностью в отношении перокисления липидов (JP-A-641123).
где R1, R2, R3 и R4 могут быть одинаковыми или разными и представляют каждый низший алкил; кольцо A представляет бензольное кольцо, замещенное по крайней мере одним заместителем, выбранным из низшего алкила, низшего алкокси и галогена.
3) Кристаллическая соль энантиомера 5-амино-2,4,6,7-тетраметил-2-(4-фенилпиперидинометил)-2,3-дигидробензо[b] -фурана, обладающая ингибирующей активностью в отношении перокисления липидов (USP 5552552).
Однако нет никакого сообщения о том, что эти соединения обладают модулирующей активностью в отношении натриевых каналов.
Ожидается, что всякое модулирующее натриевые каналы вещество, обладающее удовлетворительной, модулирующей активностью в отношении натриевых каналов, связанной с подходящими кинетикой внутричерепного переноса и метаболической устойчивостью, проявят хорошую эффективность в лечении заболеваний и расстройств центральной нервной системы (ЦИС), таких, как ишемия центральной нервной системы, травма центральной нервной системы (например, травма головного мозга, повреждение спинного мозга, травма от резкого движения конечности и т.д.), эпилепсия, нейродегенеративные заболевания (например, боковой амиотрофический склероз (ALS), болезнь Альцгеймера, хорея Хантингтона, болезнь Паркинсона, диабетическая невропатия и т.д.), сосудистая деменция (например, многоинфарктная деменция, болезнь Бинсвангера и т.д.), маниакальнодепрессивный психоз, депрессия, шизофрения, хроническая боль, невралгия тройничного нерва, мигрень и отек мозга. Однако в настоящее время нет вполне удовлетворительного модулятора и существует потребность в создании соединения, обладающего удовлетворительной модулирующей активностью в отношении натриевых каналов и пригодного для применения в качестве лекарственного средства.
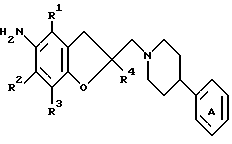
Создатели настоящего изобретения провели широкие исследования соединений, обладающих модулирующей активностью в отношении натриевых каналов, и преуспели в создании нового соединения, которое структурно отличается тем, что углеродный атом в положении 2 конденсированного циклического простого эфира был замещен одновременно низшей алкильной группой и группой формулы: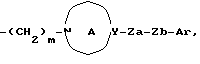
где каждый из символов имеет значение, такое же, как определенное ниже, и имеет формулу: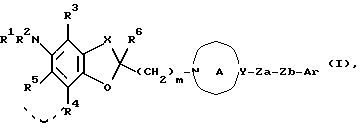
где каждый из R1 и R2 представляет атом водорода, низшую алкильную группу, которая может быть замещенной, или ацил; каждый из R3, R4 и R5 представляет низший алкил, который может быть замещенным, или низший алкокси, который может быть замещенным, или R4 и R5, взятые вместе, представляют 5- или 6-членную карбоциклическую группу;
R6 представляет низший алкил;
Ar представляет ароматическую группу, которая может быть замещенной;
кольцо A представляет 5-8-членное азотсодержащее гетероциклическое кольцо, которое может быть замещенным;
X представляет низший алкилен, который может быть замещенным;
Y представляет атом углерода или азота;
Za представляет группу формулы: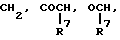

где R7 представляет атом водорода или ароматическую группу, которая может быть замещенной; R10 представляет атом водорода, углеводородную группу, которая может быть замещенной, или ацил;
Zb представляет связь или двухвалентную алифатическую углеводородную группу, которая может быть замещенной и может содержать кислород, азот или серу; и
m представляет целое число от 1 до 3, или его соли [называемые далее коротко как соединение (I)]. Они неожиданно открыли, что соединение следующей формулы или его соль [называемые далее коротко как соединение (Ia)], как и соединение (I), обладает весьма подходящими свойствами, необходимыми модулятору натриевых каналов, например хорошим сродством к натриевому каналу и высокой устойчивостью, и как таковое вполне подходит для применения в качестве лекарственного средства. Настоящее изобретение было создано на основе вышеописанных находок.
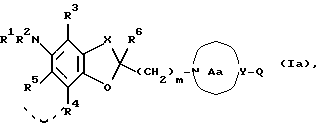
где Q представляет атом водорода, ароматическую группу, которая может быть замещенной, или группу формулы: -Zc-Ar, где Zc представляет двухвалентную алифатическую углеводородную группу, которая может быть замещенной и может содержать кислород, азот или серу; и Ar имеет такое же значение, как определенное выше; кольцо Aa представляет 5-8-членное азотсодержащее гетероциклическое кольцо, которое может быть замещенным, или соответствующую бензольную систему; другие соответственные символы имеют такие же значения, как определенные выше.
Раскрытие изобретения
Настоящее изобретение направлено на
(1) соединение (I),
(2) соединение по пункту (1), в котором каждый из R1 и R2 представляет
i) атом водорода,
(ii) C1-6 алкил, который может быть замещен 1-5 заместителями, выбранными из группы, состоящей из галогена, C3-6 циклоалкила, C2-6 алкинила, C2-6 алкенила, C6-10 арила, C7-11 аралкила, C1-6 алкокси, C6-10 арилокси, C1-6 алкилкарбонила, C6-10 арилкарбонила, C1-6 алкилкарбонилокси, C6-10 арилкарбонилокси, карбокси, C1-6 алкоксикарбонила, карбамоила, амидино, имино, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, 3-6-членного циклического амино, C1-3 алкилендиокси, гидрокси, нитро, циано, меркапто, сульфо, сульфино, фосфино, сульфамоила, моно-C1-6 алкилсульфамоила, ди-C1-6алкилсульфамоила, C1-6 алкилтио, C6-10 арилтио, C1-6 алкилсульфинила, C6-10 арилсульфинила, C1-6 алкилсульфонила и C6-10 арилсульфонила, или
iii) ацил, выбранный из группы, состоящей из формила, C1-6 алкилкарбонила, C6-10 арилкарбонила, C6-10 арил-C1-6 алкилкарбонила, C1-6 алкоксикарбонила, C6-10 apил-C1-6 алкоксикарбонила, C1-6 алкилсульфонила, C6-10 арилсульфонила, который может быть замещен 1-3 C1-6 алкилами, и C6-10 apил-C1-6 алкилсульфонила;
каждый из символов R3, R4 и R5 представляет
(i) C1-6 алкил, который может быть замещен 1-5 заместителями, выбранными из группы, состоящей из галогена, C3-6 циклоалкила, C2-6 алкинила, C2-6 алкенила, C6-10 арила, C7-11 аралкила, C1-6 алкокси, C6-10 арилокси, C1-6 алкилкарбонила, C6-10 арилкарбонила, C1-6 алкилкарбонилокси, C6-10 арилкарбонилокси, карбокси, C1-6 алкоксикарбонила, карбамоила, амидино, имино, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, 3-6-членного циклического амино, C1-3 алкилендиокси, гидрокси, нитро, циано, меркапто, сульфо, сульфино, фосфоно, сульфамоила, моно-C1-6 алкилсульфамоила, ди-C1-6 алкилсульфамоила, C1-6 алкилтио, C6-10 арилтио, C1-6 алкилсульфинила, C6-10 арилсульфинила, C1-6 алкилсульфонила и C6-10 арилсульфонила, или
ii) C1-6 алкокси, который может быть замещен 1-5 заместителями, выбранными из группы, состоящей из галогена, C3-6 циклоалкила, C2-6 алкинила, C2-6 алкенила, C6-10 арила, C7-11 аралкила, C1-6 алкокси, C6-10 арилокси, C1-6 алкилкарбонила, C6-10 арилкарбонила, C1-6 алкилкарбонилокси, C6-10 арилкарбонилокси, карбокси, C1-6 алкоксикарбонила, карбамоила, амидино, имино, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, 3-6-членного циклического амино, C1-3 алкилендиокси, гидрокси, нитро, циано, меркапто, сульфо, сульфино, фосфоно, сульфамоила, моно-C1-6 алкилсульфамоила, ди-C1-6 алкилсульфамоила, C1-6 алкилтио, C6-10 арилтио, C1-6 алкилсульфинила, C6-10 арилсульфинила, C1-6 алкилсульфонила и C6-10 арилсульфонила, или
R4 и R5, взятые вместе с соответственными смежными углеродными атомами, образуют 5- или 6-членную карбоциклическую группу, выбранную из группы, состоящей из 6-членного ароматического углеводородного кольца и 5- или 6-членного циклоалкена;
R6 представляет C1-6 алкил;
Ar представляет i) C6-14 арил или ii) 5-10-членную ароматическую гетероциклическую группу, содержащую, кроме углерода, 1-4 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-5 заместителями, выбранными из группы, состоящей из галогена, C1-3 алкилендиокси, нитро, циано, C1-6 алкила, который может быть галогенированным, C3-6 циклоалкила, C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, C1-6 алкилкарбонила, карбокси, C1-6 алкоксикарбонила, карбамоила, моно-C1-6 алкилкарбамоила, ди-C1-6 алкилкарбамоила, C6-10 арилкарбамоила, сульфо, C1-6 алкилсульфонила, C6-10 арила и C6-10 арилокси;
кольцо A представляет 5-8-членное азотсодержащее гетероциклическое кольцо, необязательно содержащее, кроме азота и углерода, 1-4 гетероатома, выбранных из азота, серы и кислорода, которые могут быть замещены 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-3 алкилендиокси, нитро, циано, C1-6 алкила, который может быть галогенированным, C3-6 циклоалкила, C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, C1-6 алкилкарбонила, карбокси, C1-6 алкоксикарбонила, карбамоила, моно-C1-6 алкилкарбамоила, ди-C1-6 алкилкарбамоила, C6-10 арилкарбамоила, сульфо, C1-6 алкилсульфонила, C6-10 арила и C6-10 арилокси;
X представляет C1-6 алкилен, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-6 алкила, C3-6 циклоалкила, C2-6 алкенила, C2-6 алкинила, C6-14 арила, нитро, циано, гидрокси, C1-6 алкокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, C1-6 алкилкарбонила, C6-10 арилокси и оксо;
Y представляет i) атом азота или ii) группу формулы:
> C(R8)-,
где R8 представляет атом водорода, галоген, нитро, циано, C1-6 алкил, который может быть галогенированным, C3-6 циклоалкил, C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, C1-6 алкилкарбонил, карбокси, C1-6 алкоксикарбонил, карбамоил, моно-C1-6 алкилкарбамоил, ди-C1-6 алкилкарбамоил, C6-10 арилкарбамоил, сульфо, C1-6 алкилсульфонил, C6-10 арил или C6-10 арилокси;
R7 представляет атом водорода или i) C6-14 арил или ii) 5-10-членную ароматическую гетероциклическую группу, содержащую, кроме углерода, 1-4 гетероатома, выбранных из азота, серы и кислорода, каждый из которых может быть замещен 1-5 заместителями, выбранными из группы, состоящей из галогена, C1-3 алкилендиокси, нитро, циано, C1-6 алкила, который может быть галогенированным, C3-6 циклоалкила, C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, C1-6 алкилкарбонила, карбокси, C1-6 алкоксикарбонила, карбамоила, моно-C1-6 алкилкарбамоила, ди-C1-6 алкилкарбамоила, C6-10 арилкарбамоила, сульфо, C1-6 алкилсульфонила, C6-10 арила и C6-10 арилокси;
R10 представляет i) атом водорода,
(ii) C1-6 алкильную, C2-6 алкенильную, C2-6 алкинильную, C3-6 циклоалкильную, C6-14 арильную или C7-16 аралкильную группу, которая может быть замещена 1-5 заместителями, выбранными из группы, состоящей из галогена, C3-6 циклоалкила, C2-6 алкинила, C2-6 алкенила, C6-10 арила, C7-11 аралкила, C1-6 алкокси, C6-10 арилокси, C1-6 алкилкарбонила, C6-10 арилкарбонила, C1-6 алкилкарбонилокси, C6-10 арилкарбонилокси, карбокси, C1-6 алкоксикарбонила, карбамоила, амидино, имино, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, 3-6-членного циклического амино, C1-3 алкилендиокси, гидрокси, нитро, циано, меркапто, сульфо, сульфино, фосфоно, сульфамоила, моно-C1-6 алкилсульфамоила, ди-C1-6 алкилсульфамоила, C1-6 алкилтио, C6-10 арилтио, C1-6 алкилсульфинила, C6-10 арилсульфинила, C1-6 алкилсульфонила и C6-10 арилсульфонила, или
iii) ацил, выбранный из группы, состоящей из формила, C1-6 алкилкарбонила, C6-10 арилкарбонила, C6-10 арил-C1-6 алкилкарбонила, C1-6 алкоксикарбонила, C6-10 арил-C1-6алкоксикарбонила, C1-6 алкилсульфонила, C6-10 арилсульфонила, который может быть замещен 1-3 C1-6 алкилами, и C6-10 apил-C1-6 алкилсульфонила; и
Zb представляет двухвалентную алифатическую углеводородную группу, выбранную из группы, состоящей из (i) C1-8 алкилена, (ii) C2-8 алкенилена, (iii) C2-8 алкинилена или (iv) группы формулы:
(CH2)p-M-(CH2)q-,
где каждый из символов p и q представляет целое число от 0 до 8 и p + q равно целому числу от 1 до 8; М представляет O, NR9, S, SO или SO2,
где R9 представляет атом водорода, C1-6 алкил, C3-6 циклоалкил, C6-14 арил, C7-11 аралкил или ацил, выбранный из группы, состоящей из формила, C1-6 алкилкарбонила, C6-10 арилкарбонила, C6-10 арил-C1-6 алкилкарбонила, C1-6 алкоксикарбонила, C6-10 арил-C1-6 алкоксикарбонила, C1-6 алкилсульфонила, C6-10 арилсульфонила, который может быть замещен 1-3 C1-6 алкилами, и C6-10 арил-C1-6 алкилсульфонила, причем каждая двухвалентная группа может быть замещена 1-5 заместителями, выбранными из группы, состоящей из галогена, нитро, циано, C1-6 алкила, который может быть галогенированным, C3-6 циклоалкила, C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, C6-14 арила, C7-11 аралкила, C6-10 арилокси, оксо, формила, C1-6 алкилкарбонила, C6-10 арилкарбонила, C6-10 арил-C1-6 алкилкарбонила, C1-6 алкоксикарбонила, C6-10 арил-C1-6 алкоксикарбонила, C1-6 алкилсульфонила, C6-10 арилсульфонила, который может быть замещен 1-3 C1-6 алкилами, и C6-10 apил-C1-6 алкилсульфонила,
(3) соединение по пункту (1), в котором Za представляет группу формулы:
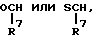
где R7 имеет такое же значение, как определенное выше,
(4) соединение по пункту (1), в котором каждый из символов R1 и R2 представляет атом водорода,
(5) соединение по пункту (1), в котором каждый из символов R3, R4 и R5 представляет C1-6 алкил,
(6) соединение по пункту (1), в котором R6 представляет C1-6 алкил,
(7) соединение по пункту (1), в котором Ar представляет C6-14 арил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-6 алкила и C1-6 алкокси,
(8) соединение по пункту (1), в котором кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо, которое может быть замещенным,
(9) соединение по пункту (1), в котором X представляет метилен,
(10) соединение по пункту (1), в котором Y представляет CH,
(11) соединение по пункту (1), в котором Za представляет группу формулы: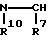
где соответственные символы имеют такие же значения, как определенные выше,
(12) соединение по пункту (1), в котором R7 представляет C6-10 арил, который может быть замещенным,
(13) соединение по пункту (1), в котором R10 представляет атом водорода,
(14) соединение по пункту (1), в котором Zb представляет связь,
(15) соединение по пункту (1), в котором m = 1,
(16) соединение по пункту (1), в котором каждый из R1 и R2 представляет атом водорода;
каждый из R3, R4, R5 и R6 представляет C1-6 алкил;
Ar представляет фенил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-6 алкила и C1-6 алкокси;
кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо;
X представляет метилен;
Y представляет CH или N;
Za представляет группу формулы: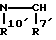
где R7′ представляет фенил, может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-6 алкила и C1-6алкокси; и R10′ представляет атом водорода;
Zb представляет связь или C1-6 алкилен, который может быть замещен C6-10 арилом; и
m = 1 или 2,
(17) соединение по пункту (1), в котором, каждый из R1 и R2 представляет атом водорода;
каждый из R3, R4, R5 и R6 представляет C1-6 алкил;
Ar представляет C6-10 арил, который может быть замещен метилендиокси;
кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо;
X представляет метилен;
Y представляет CH или N;
Za представляет группу формулы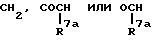
где R7a представляет атом водорода или C6-10 арил;
Zb представляет связь или (i) C1-6 алкиленовую или (ii) C2-6 алкениленовую группу, которая может быть замещена C6-10 арилом; и
m = 1,
(18) соединение по пункту (1), в котором каждый из R1 и
R2 представляет водород;
каждый из R3, R4, R5 и R6 представляет C1-6 алкил;
Ar представляет C6-10 арил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, метилендиокси, C1-6 алкила и C1-6 алкокси;
кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо;
X представляет метилен;
Y представляет CH или N;
Za представляет группу формулы: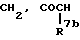

где R7b представляет атом водорода или C6-10 арил, который может быть замещен галогеном, и R10a представляет атом водорода или C7-11 аралкил;
Zb представляет связь или двухвалентную группу, выбранную из группы, состоящей из (i) C1-6 алкилена, (ii) C2-6 алкенилена и (iii) группы формулы:
-(CH2)p′-M′-(CH2)q′-
где каждый из символов p' и q' представляет целое число от 0 до 5, p' + q' равно целому числу от 1 до 6 и М' представляет O или NH, причем каждая двухвалентная группа может быть замещена C6-10 арилом; и
m = 1 или 2,
(19) соединение по пункту (1), которое представляет собой
1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)- метил] -N-(дифенилметил)-4-пиперидинамин,
(-)-1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
(+)-1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N- (дифенилметил)-4-пиперидинамин,
1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил) метил]-N-(дифенилметил)-4-пиперидинамин,
(-)-1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил) метил]-N-(дифенилметил)-4-пиперидинамин,
(+)-1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил) метил]-N-(дифенилметил)-4-пиперидинамин или их соль,
(20) способ получения соединения по пункту (1), которой включает
(i) взаимодействие соединения формулы: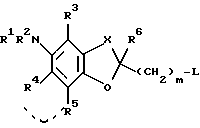
где L представляет уходящую группу, а другие символы имеют такие же значения, как определенные выше, или его соли с соединением формулы: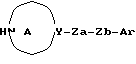
где соответственные символы имеют такие же значения, как определенные выше, или его солью;
(ii) подвергание соединения формулы: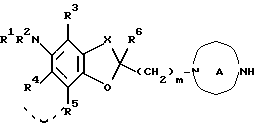
где соответствующие символы имеют такие же значения, как определенные выше, или его соли (а) алкилированию, (b) ацилированию или (с) ацилированию с последующим восстановлением;
(iii) взаимодействие соединения формулы: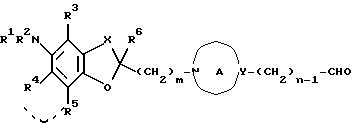
где n представляет целое число от 1 до 4, а другие символы имеют такие же значения, как определенные выше, или его соли с соединением формулы: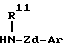
где R11 представляет атом водорода или углеводородную группу, которая может быть замещенной;
Zd представляет двухвалентную алифатическую углеводородную группу, которая может быть замещенной и может содержать кислород, азот или серу;
Ar имеет такие же значения, как определенные выше, или его солью;
(iv) осуществление взаимодействия соединения формулы: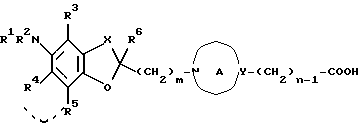
где соответствующие символы имеют такие же значения, как определенные выше, или его соли с соединением формулы: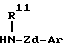
где соответствующие символы имеют такие же значения, как определенные выше, или его солью, необязательно с последующим восстановлением; или
(v) подвергание соединения формулы: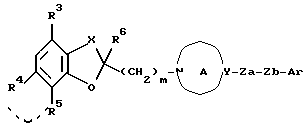
где соответствующие символы имеют такие же значения, как определенные выше, или его соли (а) нитрованию с последующим восстановлением или (b) реакции диазосочетания с последующим восстановлением,
(21) фармацевтическую композицию, которая содержит соединение по пункту (1), если необходимо вместе с фармацевтически приемлемым носителем,
(22) композицию по пункту (21), которая предназначена для модулирования натриевого канала,
(23) композицию по пункту (22), которая предназначена для профилактики или лечения ишемии центральной нервной системы, травмы центральной нервной системы, нейродегенеративного заболевания или отека головного мозга,
(24) способ модулирования натриевого канала у млекопитающего, нуждающегося в этом, который включает введение такому млекопитающему эффективного количества соединения по пункту (1) или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым наполнителем, носителем или разбавителем,
(25) применение соединения по пункту (1) или его соли для изготовления фармацевтической композиции для модулирования натриевого канала,
(26) фармацевтическую композицию для модулирования натриевого канала, которая содержит соединение (1a), и
(27) композицию по пункту (26), которая содержит (S)-2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1-пиперидинил)метил]-5-бензофуранамин,
2,3-дигидро-7-изопропил-2,4,6-триметил-2-[(4-фенил-1-пиперидинил)метил]- 5-бензофуранамин,
(-)-2,3-дигидро-7-изопропил-2,4,6-триметил-2-[(4-фенил-1-пиперидинил)метил]-5-бензофуранамин,
(+)-2,3-дигидро-7-изопропил-2,4,6-триметил-2-[(4-фенил-1-пиперидинил)метил]-5-бензофуранамин,
7-трет-бутил-2,3-дигидро-2,4,6-триметил-2-[(4-фенил-1-пиперидинил)метил] -5-бензофуранамин,
(-)-7-трет-бутил-2,3-дигидро-2,4,6-триметил-2-[(4-фенил-1-пиперидинил)метил]-5-бензофуранамин,
(+)-7-трет-бутил-2,3-дигидро-2,4,6-триметил-2-[(4-фенил-1-пиперидинил)метил]-5-бензофуранамин или их соль.
В приведенных выше формулах "низший алкил" "низшего алкила, который может быть замещенным", для R1, R2, R3, R4 или R5 включает, например, C1-6 алкил, такой, как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил и гексил.
"Заместитель", которым может быть замещен "низший алкил", включает, например, галоген (например, фтор, хлор, бром, йод и т.д.), циклоалкил (например, C3-6 циклоалкил, такой, как циклопропил, циклобутил, циклопентил, циклогексил и т. д. ), низший алкинил (например, C2-6 алкинил, такой, как этинил, 1-пропинил, пропаргил и т.д.), низший алкенил (например, C2-6 алкенил, такой, как винил, аллил, изопропенил, бутенил, изобутенил и т.д.), арил (например, C6-10 арил, такой, как фенил, нафтил и т.д.), аралкил (например, C7-11 аралкил, такой, как бензил, α-метилбензил, фенетил и т.д.), низший алкокси (например, C1-6 алкокси, такой, как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.д.), арилокси (например, C6-10 арилокси, такой, как фенокси и т.д.), низший алканоил (например, C1-6 алкилкарбонил, такой, как ацетил, пропионил, бутирил, изобутирил и т.д.), арилкарбонил (например, C6-10 арилкарбонил, такой, как бензоил, нафтоил и т. д.), низший алканоилокси (например, C1-6 алкилкарбонилокси, такой, как ацетилокси, пропионилокси, бутирилокси, изобутирилокси и т.д.), арилкарбонилокси (например, C6-10 арилкарбонилокси, такой, как бензоилокси, нафтоилокси и т. д.), карбокси, низший алкоксикарбонил (например, C1-6 алкоксикарбонил, такой, как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил и т.д.), карбамоил, амидино, имино, амино, моно-низший алкиламино (например, моно-C1-6 алкиламино, такой, как метиламино, этиламино, пропиламино, изопропиламино, бутиламино и т. д. ), ди-низший алкиламино (например, ди-C1-6 алкиламино, такой, как диметиламино, диэтиламино, метилэтиламино, дипропиламино, диизопропиламино, дибутиламино и т.д.), 3-6-членный циклический амино, необязательно содержащий в дополнение к углероду и одному атому азота 1-3 гетероатома, выбранных из кислорода, серы и азота (например, 3-6-членный циклический амино, такой, как азиридинил, азетидинил, пирролидинил, пирролинил, пирролил, имидазолил, пиразолил, имидазолидинил, пиперидино, морфолино, тиоморфолино, дигидропиридил, пиридил, N-метилпиперазинил, N-этилпиперазинил и т.д.), алкилендиокси (например, C1-3 алкилендиокси, такой, как метилендиокси, этилендиокси и т.д.), гидрокси, нитро, циано, меркапто, сульфо, сульфино, фосфоно, сульфамоил, моноалкилсульфамоил (например, моно-C1-6 алкилсульфамоил, такой, как метилсульфамоил, этилсульфамоил, пропилсульфамоил, изопропилсульфамоил, бутилсульфамоил и т.д.), диалкилсульфамоил (например, ди-C1-6 алкилсульфамоил, такой, как ди-метилсульфамоил, диэтилсульфамоил, дипропилсульфамоил, дибутилсульфамоил и т.д.), низший алкилтио (например, C1-6 алкилтио, такой, как метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио и т.д.), арилтио (например, C6-10 арилтио, такой, как фенилтио, нафтилтио и т.д.), низший алкилсульфинил (например, C1-6 алкилсульфинил, такой, как метилсульфинил, этилсульфинил, пропилсульфинил, бутилсульфинил и т. д. ), арилсульфинил (например, C6-10 арилсульфинил, такой, как фенилсульфинил, нафтилсульфинил и т. д. ), низший алкилсульфонил (например, C1-6 алкинсульфонил, такой, как метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил и т.д.) и арилсульфонил (например, C6-10 арилсульфонил, такой, как фенилсульфонил, нафтилсульфонил и т.д.).
"Низший алкил" "низшего алкила, который может быть замещенным", может иметь любой из вышеуказанных заместителей в замещаемых положениях 1-5, предпочтительно 1-3, причем, когда число заместителей составляет не менее 2, то заместители могут быть одинаковыми или разными.
"Ацил" для R1 или R2 включает, например, ацил, полученный из карбоновой кислоты или сульфоновых кислот. Предпочтительный ацил включает формил, низший алкилкарбонил (например, C1-6 алкилкарбонил, такой, как ацетил, пропионил, бутирил, изобутирил и т.д.), арилкарбонил (например, C6-10 арилкарбонил, такой, как бензоил, нафтоил и т.д.), аралкилкарбонил (например, C6-10 apил-C1-6 алкилкарбонил, такой, как бензилкарбонил, фенетилкарбонил, нафтилметилкарбонил и т.д.), низший алкоксикарбонил (например, C1-6 алкоксикарбонил, такой, как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил и т.д.), аралкилоксикарбонил (например, C6-10 арил-C1-6 алкоксикарбонил, такой, как бензилоксикарбонил и т.д.), низший алкилсульфонил (например, C1-6 алкилсульфонил, такой, как мезил, этилсульфонил, пропилсульфонил и т.д. ), C6-10 арилсульфонил, необязательно имеющий C1-6 алкил (например, фенилсульфонил, нафтилсульфонил, тозил и т.д.) и аралкилсульфонил (например, C6-10 apил-C1-6 алкилсульфонил, такой, как бензилсульфонил, фенетилсульфонил, нафтилметилсульфонил и т.д.).
Предпочтительно каждый из R1 и R2 представляет атом водорода, C1-6 алкил или C1-6 алкилкарбонил. Более предпочтительным является атом водорода или C1-6 алкил. Особенно предпочтительным является атом водорода.
"Низший алкокси" "низшего алкокси, который может быть замещенным", для R3, R4 или R5 включает, например, C1-6 алкокси, такой, как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, пентилокси и гексилокси. "Заместитель", которым может быть замещен "низший алкокси", включает такие же заместители, как указанные выше для "низшего алкила" и число заместителей также может быть аналогичным указанному для "низшего алкила".
"5- или 6-членная карбоциклическая группа", которая может быть образована радикалами R4 и R5, взятыми вместе с соответственными смежными углеродными атомами, включает, например, 6-членные ароматические углеводородные кольца (например, бензольные кольца и т.д.) и 5- или 6-членные циклоалкены (например, циклопентен, циклопентадиен, циклогексен и т.д.).
Предпочтительно каждый из R3, R4 и R5 представляет C1-6 алкил. Более предпочтительно каждый из R3 и R4 представляет метил.
"Низший алкил" для R6 может быть аналогичным "низшему алкилу" "низшего алкила, который может быть замещенным", для R1, R2, R3, R4 или R5.
Предпочтительно R6 представляет C1-6 алкил. Более предпочтительным является метил.
"Ароматическая группа" "ароматической группы, которая может быть замещенной", для Ar включает, например, ароматические углеводородные группы и ароматические гетероциклические группы.
"Ароматическая углеводородная группа" включает, например, C6-14 моноциклические или конденсированные полициклические ароматические углеводородные группы. Так, например, можно назвать C6-14 арил, такой, как фенил, 1-нафтил, 2-нафтил, антрил и т.д. Предпочтительным является C6-10 арил, такой, как фенил, 1-нафтил, 2-нафтил и т.д. Особенно предпочтительным является фенил.
Упомянутая выше "ароматическая гетероциклическая группа" включает, например, 5-10-членные моноциклические или их конденсированные гетероароматические группы, содержащие, кроме углерода, один или больше, например 1-4, гетероатомов, выбранных из азота, серы и кислорода. В частности, она включает одновалентные группы, образующиеся при отщеплении любого одного атома водорода соответственно от ароматических гетероциклических колец или конденсированных кольцевых систем, состоящих из любого такого гетероциклического кольца (предпочтительно 5- или 6-членного моноциклического кольца) и одного или нескольких (предпочтительно 1 или 2, более предпочтительно 1) ароматических колец (например, бензольного или пиридинового кольца и т.д.), такие, как тиофен, бензотиофен, бензофуран, бензимидазол, бензоксазол, бензотиазол, бензизотиазол, нафто [2,3-b] тиофен, фуран, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, индол, изоиндол, 1H-индазол, изохинолин, хинолин, карбазол, изотиазол, изоксазол и т. д. Предпочтительная "ароматическая гетероциклическая группа" включает 2-пиридил, 3-пиридил, 4-пиридил, 2-хинолил, 3-хинолил, 4-хинолил, 2-хинолил, 8-хинолил, 1-изохинолил, 3-изохинолил, 4-изохинолил, 5-изохинолил, 1-индолил, 2-индолил, 3-индолил, 2-бензотиазолил, 2-бензотиенил, бензофуранил, 2-тиенил, 3-тиенил, 2-бензоксазолил, 2-бензимидазолил и 2-пиридотиазолил. Особенно предпочтительными являются 2-пиридил, 3-пиридил, 4-пиридил, 2-хинолил, 3-хинолил, 4-хинолил, 2-индолил и 3-индолил.
"Заместитель" "ароматической группы, которая может быть замещенной", для Ar включает, например, галоген (например, фтор, хлор, бром, йод и т.д.), C1-3 алкилендиокси (например, метилендиокси, этилендиокси и т.д.), нитро, циано, C1-6 алкил, который может быть галогенированным, C3-6 циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил и т.д.), C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино (например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино и т.д.), ди-C1-6 алкиламино (например, диметиламино, диэтиламино, метилэтиламино, дипропиламино, дибутиламино и т.д.), C1-6 алкилкарбонил (например, ацетил, пропионил и т.д.), карбокси, C1-6 алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил и т.д.), карбамоил, моно-C1-6 алкилкарбамоил (например, метилкарбамоил, этилкарбамоил и т.д.), ди-C1-6 алкилкарбамоил (например, диметилкарбамоил, ди-этилкарбамоил и т.д. ), C6-10 арилкарбамоил (например, фенилкарбамоил, нафтилкарбамоил и т.д.), сульфо, C1-6 алкилсульфонил (например, метилсульфонил, этилсульфонил и т.д. ), C6-10 арил (например, фенил, нафтил и т.д.) и C6-10 арилокси (например, фенилокси, нафтилокси и т.д.). Когда заместитель представляет собой C1-3 алкилендиокси, он предпочтительно образует кольцо с двумя смежными атомами углерода.
"C1-6 алкил, который может быть галогенированным", включает, например, C1-6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.д.), необязательно имеющий 1-3 атома галогена (например, фтор, хлор, бром, йод и т.д.). Так, например, можно назвать метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, 3,3,3-трифторпропил, изопропил, бутил, 4,4,4-трифторбутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, 5,5,5-трифторпентил, гексил, 6,6,6-трифторгексил и т.д.
"C1-6 алкокси, который может быть галогенированным", включает, например, C1-6 алкокси, необязательно имеющий 1-3 атома галогена (например, фтор, хлор, бром, йод и т.д.). Так, например, можно назвать метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4-трифторбутокси, изобутокси, втор-бутокси, пентилокси, гексилокси и т.д.
"C1-6 алкилтио, который может быть галогенированным", включает, например, C1-6 алкилтио (например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио и т.д.), необязательно имеющий 1-3 атома галогена (например, фтор, хлор, бром, йод и т.д.). Так, например, можно назвать метилтио, дифторметилтио, трифторметилтио, этилтио, пропилтио, изопропилтио, бутилтио, 4,4,4-трифторбутилтио, пентилтио, гексилтио и т.д.
"Ароматическая группа" "ароматической группы, которая может быть замещенной", может иметь 1-5, предпочтительно 1-3, заместителей в замещаемых положениях ядра, причем конкретные заместители, которые могут присутствовать, включают те, которые указаны выше. При введении двух или более заместителей они могут быть одинаковыми или разными.
Предпочтительно Ar представляет C6-14 арильную (предпочтительно фенил), 2-пиридильную, 3-пиридильную, 4-пиридильную, 2-индолильную или 3-индолильную группу, которая может быть замещенной. Более предпочтительно Ar представляет C6-10 арил, который может быть замещенным. Предпочтительный "заместитель" в этом случае включает галоген, C1-6 алкокси и C1-6 алкил. Более предпочтительно Ar представляет C6-14 арил (предпочтительно фенил), который может быть замещен 1-3 заместителями, выбранными из галогена, C1-6 алкокси и C1-6 алкила.
"5-8-членное азотсодержащее гетероциклическое кольцо" "5-8-членного азотсодержащего гетероциклического кольца, которое может быть замещенным", для кольца A включает, например, 5-8-членные насыщенные или ненасыщенные гетероциклические кольца, каждое из которых содержит, кроме углерода, по крайней мере один атом азота. Конкретный перечень таких гетероциклических колец включает пиперидин, пиперазин, 1,2,5,6-тетрагидропиридин, пирролидин, 1H-азепин, 1H-2,3-дигидроазепин, 1H-2,3,4,5-тетрагидроазепин, 1H-2,3,6,7- тетрагидроазепин, 1H-2,3,4,5,6,7-гексагидроазепин, 1H-1,4-диазепин, 1H-2,3-дигидро-1,4-диазепин, 1H-2,3,4,5-тетрагидро-1,4-диазепин, 1H-2,3,6,7-тетрагидро-1,4-диазепин, 1H-2,3,4,5,6,7-гексагидро-1,4-диазепин, 1,2-дигидроазоцин, 2,3,4,5-тетрагидроазоцин, 1,2,3,4,5,6-гексагидроазоцин, 1,2,3,4,5,6,7,8-октагидроазоцин, 1,2-дигидро-1,5-диазоцин, 1,2,3,4,5,6-гексагидро-1,5-диазоцин, 1,2,3,4,5,6,7,8-октагидро-1,5-диазоцин и т. д. Предпочтительным является 6-членное азотсодержащее гетероциклическое кольцо. Более предпочтительными являются пиперидин и пиперазин.
"Заместитель", который может, необязательно, находиться на "5-8-членном азотсодержащем гетероциклическом кольце", включает те же самые группы, которые указаны выше для "ароматической группы, которая может быть замещенной", в связи с Ar. Число заместителей может находиться в пределах от 1 до 3, причем при введении двух или более заместителей они могут быть, одинаковыми или разными.
Предпочтительно кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо, которое может быть замещенным. Более предпочтительно кольцо А представляет пиперидин или пиперазин.
"Низший алкилен" "низшего алкилена, который может быть замещенным", для X включает, например, двухвалентные группы, образующиеся при отщеплении двух атомов водорода соответственно от C1-6 алканов. "Низший алкилен" включает, например, неразветвленный C1-6 алкилен, такой, как метилен, этилен, триметилен, тетраметилен, пентаметилен, бутилен, пентилен и т.д., предпочтительными являются метилен и этилен. Особенно предпочтительным является метилен.
"Заместитель", необязательно присутствующий в упомянутом выше "низшем алкилене, который может быть замещенным", включает, например, галоген (например, фтор, хлор, бром, йод и т.д.), C1-6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, пентил, гексил и т.д.), C3-6 циклоалкил (например, циклопропил, циклобутил, циклопентил и т. д. ), C2-6 алкенил (например, винил, аллил, 1-пропенил, 2-бутенил и т. д. ), C2-6 алкинил (например, этинил, 2-пропинил, 2-бутинил и т.д.), C6-14 арил (например, фенил, 1-нафтил, 2-нафтил, дифенилил и т.д.), нитро, циано, гидрокси, C1-6 алкокси (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, пентилокси, гексилокси и т.д.), амино, моно-C1-6 алкиламино (например, метиламино, этиламино и т.д.), ди-C1-6 алкиламино (например, диметиламино, диэтиламино, метилэтиламино и т.д.), C1-6 алкилкарбонил, (например, ацетил, пропионил и т.д.), C6-10 арилокси (например, фенилокси, нафтилокси и т.д.) и оксо.
"Низший алкилен" "низшего алкилена, который может быть замещенным", может иметь 1-3, предпочтительно 1 или 2, таких заместителей в замещаемых положениях низшего алкилена, причем при введении двух или более заместителей они могут быть одинаковыми или разными.
Предпочтительным примером X является метилен.
Когда Y представляет углерод, можно обычно назвать группу формулы: > C(R8)-.
В приведенной выше формуле R8 представляет, например, атом водорода, галоген (например, фтор, хлор, бром, йод и т.д.), нитро, циано, C1-6 алкил, который может быть галогенированным, C3-6 циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил и т.д.), C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино (например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино и т.д.), ди-C1-6алкиламино (например, димемиламино, диэтиламино, метилэтиламино, дипропиламино, дибутиламино и т. д.), C1-6 алкилкарбонил, (например, ацетил, пропионил и т.д.), карбокси, C1-6 алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил и т.д.), карбамоил, моно-C1-6 алкилкарбамоил (например, метилкарбамоил, этилкарбамоил и т.д.), ди-C1-6 алкилкарбамоил (например, диметилкарбамоил, диэтилкарбамоил и т.д.), C6-10 арилкарбамоил (например, фенилкарбамоил, нафтилкарбамоил и т.д.), сульфо, C1-6 алкилсульфонил (например, метилсульфонил, этилсульфонил и т.д.), C6-10 арил (например, фенил, нафтил и т.д.) и C6-10 арилокси (например, фенилокси, нафтилокси и т.д.). Предпочтительно R8 представляет водород, циано, C1-6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, пентил, гексил и т.д.), C1-6 алкокси (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, пентилокси, гексилокси и т.д.), гидрокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино или C1-6 алкилкарбонил.
Когда Y представляет азот, Za предпочтительно представляет группу формулы
где R7 - такой, как определенный выше.
Предпочтительно Y представляет CH или N. Более предпочтительно Y представляет CH.
"Ароматическая группа, которая может быть замещенной", для R7 включает группы, аналогичные тем, что указаны для "ароматической группы, которая может быть замещенной", когда говорилось об Ar.
Предпочтительно R7 представляет водород или C6-10 арил, который может быть замещенным. Более предпочтительным является C6-10 арил (например, фенил, 1-нафтил, 2-нафтил и т.д., предпочтительно фенил), который может быть замещен галогеном.
"Углеводородная группа" "углеводородной группы, которая может быть замещенной", для R10 представляет группу, образующуюся при отщеплении одного атома водорода от углеводородного соединения, и включает как ациклические, так и циклические углеводородные группы (например, алкил, алкенил, алкинил, циклоалкил, арил, аралкил и т. д. ). Предпочтительной является следующая ациклическая или циклическая C1-16 углеводородная группа:
(i) C1-6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.д.),
(ii) C2-6 алкенил (например, винил, аллил, изопропенил, бутенил, изобутенил, втор-бутенил и т.д.),
(iii) C2-6 алкинил (например, этинил, пропаргил, бутинил, 1-гексинил и т.д.),
(iv) C3-6 циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил и т.д.),
(v) C6-14 арил (например, фенил, 1-нафтил, 2-нафтил, дифенил, 2-антрил и т.д., предпочтительно фенил),
(vi) C7-16 аралкил (например, бензил, фенетил, дифенилметил, 1-нафтилметил, 2-нафтилметил, 2,2-дифенилэтил, 3-фенилпропил, 4-фенилбутил, 5-фенилпентил и т.д., предпочтительно бензил).
"Заместитель", необязательно присутствующий в "углеводородной группе, которая может быть замещенной", включает 1-5, предпочтительно 1-3, заместителей, аналогичных "заместителю" "низшего алкила, который может быть замещенным", для R1, R2, R3, R4 или R5.
"Ацил" для R10 является таким же, как "ацил", определенный для R1 или R2.
Предпочтительно R10 представляет водород или C7-11 аралкил. Особенно предпочтительным является водород.
Za предпочтительно представляет группу формулы: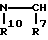
где соответствующие символы имеют такие же значения, как определенный выше. Более предпочтительной является группа формулы: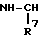
где R7 имеет такое же значение, как определенное выше.
"Двухвалентная алифатическая углеводородная группа, которая может содержать кислород, азот или серу", "двухвалентной углеводородной группы, которая может быть замещенной и может содержать кислород, азот или серу", для Zb включает, например, (i) метилен или (ii) двухвалентную группу, образующуюся при отщеплении одного атома водорода от каждого из двух атомов углерода насыщенного или ненасыщенного алифатического углеводорода и необязательно имеющую 1 или 2 (предпочтительно 1) гетероатома, выбранных из кислорода, азота и серы, между углеродными атомами или в концевом(ых) положении(ях). Предпочтительной является группа, имеющая 1-8 углеродных атомов. Примеры группы включают:
(i) C1-8 алкилен (например, -CH2-, -(CH2)2-, -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -(CH2)7-, -(CH2)8- и т.д.),
(ii) C2-8 алкенилен (например, -CH=CH-, -CH2-CH=CH-, -CH2-CH=CH-CH2-, -CH2-CH2-CH=CH-, -CH=CH-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH=CH- и т.д.),
(iii) C2-8 алкинилен (например, -C≡C-, -CH2-C≡C-, -CH2-C≡C-CH2-CH2- и т. д.),
(iv) группу формулы: -(CH2)p-M-(CH2)q-, где М представляет O, NR9, S, SO или SO2; каждый из p и q представляют целое число от 0 до 8 и p+q представляет целое число от 1 до 8. В приведенной выше формуле R9 представляет атом водорода, C1-6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, пентил, гексил и т.д.), C3-6 циклоалкил (например циклопропил, циклобутил, циклопентил и т.д.), C6-14 арил (например, фенил, 1-нафтил, 2-нафтил, дифенилил и т.д.), C7-11 аралкил (например, бензил, фенетил и т.д.) или ацил. Только что указанный "ацил" включает такие же группы, как указанные для "ацила", представленного символом R1 или R2.
М предпочтительно представляет O или NR9, где R9 предпочтительно представляет водород.
Каждый из p и q предпочтительно представляет целое число от 0 до 5, более предпочтительно целое число от 0 до 4.
"Заместитель", необязательно присутствующий в "двухвалентной алифатической углеводородной группе, которая может содержать кислород, азот или серу", включает, например, галоген (например, фтор, хлор, бром, йод и т.д.), нитро, циано, C1-6 алкил, который может быть галогенированным, C3-6 циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил и т.д.), C1-6 алкокоси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино (например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино и т. д. ), ди-C1-6 алкиламино (например, диметиламино, диэтиламино, метилэтиламино, дипропиламино, дибутиламино и т.д.), C6-14 арил (например, фенил, 1-нафтил, 2-нафтил, дифенилил и т.д.), C7-11 аралкил (например, бензил, фенетил и т.д.), C6-10 арилокси (например, фенилокси, нафтилокси и т.д.), оксо и ацил. Упомянутые выше "C1-6 алкил, который может быть галогенированным", "C1-6 алкокси, который может быть галогенированным", и "C1-6 алкилтио, который может быть галогенированным", могут быть такими же, как указанные ранее в качестве заместителей в ароматической группе для Ar. Упомянутый чуть выше "ацил" включает такие же группы, как указанные для "ацила", представляемого символом R1 или R2.
Указанные заместители могут находиться в замещаемых положениях 1-5, причем, когда число заместителей равно 2 или более, то заместители могут быть одинаковыми или разными.
Zb предпочтительно представляет связь или C1-8 алкилен. Более предпочтительно Zb представляет связь.
"Ароматическая группа, которая может быть замещенной", для Q может быть такой же, как "ароматическая группа, которая может быть замещенной", для Ar.
"Двухвалентная алифатическая углеводородная группа, которая может быть замещенной и может содержать кислород, азот или серу", для Zc может быть такой же, как "двухвалентная алифатическая углеводородная группа, которая может быть замещенной и может содержать кислород, азот или серу", для Zb.
Q предпочтительно представляет ароматическую группу, которая может быть замещенной.
"5-8-членное азотсодержащее гетероциклическое кольцо, которое может быть замещенным", "5-8-членное азотсодержащего гетероциклического кольца, которое может быть замещенным, или соответствующей конденсированной бензольной системы" для кольца Aa может быть таким же, как "5-8-членное азотсодержащее гетероциклическое кольцо, которое может быть замещенным", для кольца А. "Конденсированная бензольная система, соответствующая 5-8-членному азотсодержащему гетероциклическому кольцу, которое может быть замещенным", может представлять собой конденсированную кольцевую систему, образующуюся при конденсации "5-8-членного азотсодержащего гетероциклического кольца, которое может быть замещенным" для кольца А "бензольным кольцом, которое может быть замещенным" в плоскости конденсации.
"Заместитель", необязательно присутствующий в "бензольном кольце, которое может быть замещенным", может быть сходным с заместителем, необязательно присутствующим в "ароматической группе, которая может быть замещенной", для Ar. Число заместителей может находиться в пределах от 1 до 4.
Предпочтительно кольцо Aa представляет 6-членное азотсодержащее гетероциклическое кольцо. Более предпочтительно кольцо Aa представляет пиперидин.
Предпочтительным соединением (I является соединение, в котором каждый из R1 и R2 представляет атом водорода;
каждый из R3, R4, R5 и R6 представляет C1-6 алкил;
Ar представляет фенил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-6 алкила и C1-6 алкокси;
кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо;
X представляет метилен;
Y представляет CH или N;
Za представляет группу формулы: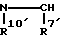
где R7' представляет фенил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-6 алкила и C1-6 алкокси; и R10' представляет атом водорода;
Zb представляет связь или C1-6 алкилен, который может быть замещен C6-10 арилом; и
m = 1 или 2.
Предпочтительными являются соединения (включая их соли) формулы (I), где
каждый из R1 и R2 представляет водород;
каждый из R3, R4, R5 и R6 представляет C1-6 алкил;
Ar представляет (i) C6-10 арил, (ii) 2-пиридил, (iii) 3-пиридил, (iv) 4-пиридил, (v) 2-индолил или (vi) 3-индолил, каждый из которых может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, C1-3 алкилендиокси, нитро, циано, C1-6 алкила, который может быть галогенированным, C3-6 циклоалкила, C1-6 алкокси, который может быть галогенированным, C1-6 алкилтио, который может быть галогенированным, гидрокси, амино, моно-C1-6 алкиламино, ди-C1-6 алкиламино, C1-6 алкилкарбонила, карбокси, C1-6 алкоксикарбонила, карбамоила, моно-C1-6 алкилкарбамоила, ди-C1-6 алкилкарбамоила, C6-10 арилкарбамоила, сульфо, C1-6 алкилсульфонила, C6-10 арила и C6-10 арилокси;
кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо;
X представляет метилен;
Y представляет CH или N;
Za представляет группу формулы
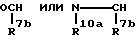
R7b представляет атом водорода или C6-10 арил, который может быть замещен галогеном;
R10a представляет атом водорода или C7-11 аралкил;
Zb представляет связь или (i) C1-6 алкилен, (ii) C2-6 алкенилен или (iii) группы формулы
-(CH2)p′-M′-(CH2)q′-,
где каждый из p' и q' представляет целое число от 0 до 5, p' + q' представляет целое число от 1 до 6 и М' представляет O или NH, причем каждая группа может быть замещена C6-10 арилом; и
m = 1 или 2.
Особенно предпочтительными являются соединения, в которых R10a представляет атом водорода, Zb представляет связь и m = 1, и их соли.
Также предпочтительными являются соединения, (включая их соли) формулы (I), где
каждый из R1 и R2 представляет атом водорода;
каждый из R3, R4, R5 и R6 представляет C1-7 алкил;
Ar представляет C6-10 арил, который может быть замещен на метилендиокси;
кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо;
X представляет метилен;
Y представляет CH или N;
Za представляет группу формулы: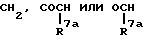
R7a представляет атом водорода или C6-10 арил;
Zb представляет (i) связь или (ii) C1-6 алкиленовую или C2-6 алкениленовую группу, которая может быть замещена C6-10 арилом; и
m = 1.
Предпочтительными являются также соединения (включая их соли) формулы (I), где
каждый из R1 и R2 представляет атом водорода;
каждый из R3, R4, R5 и R6 представляет C1-6 алкил;
Ar представляет C6-10 арил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, метилендиокси, C1-6 алкила и C1-6 алкокси;
кольцо A представляет 6-членное азотсодержащее гетероциклическое кольцо;
X представляет метилен;
Y представляет CH или N;
Za представляет группу формулы: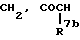
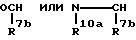
R7b представляет атом водорода или C6-10 арил, который может быть замещен галогеном;
R10a представляет атом водорода или C7-11 аралкил;
Zb представляет связь или (i) C1-6 алкилен, (ii) C2-6алкенилен или (iii) группу формулы
-(CH2)p′-M′-(CH2)q′-,
где каждый из p' и q' представляет каждый целое число от 0 до 5, p' + q' представляет целое число от 1 до 6 и М' представляет O или NH, причем каждая группа может быть замещена C6-10 арилом; и
m = 1 или 2.
Предпочтительные виды соединения (I) по настоящему изобретению включают:
2-[(4-бензил-1-пиперидинил)метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин,
1-((5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
(-)-1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
(+)-1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
(-)-1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил)метил]-N-(дифенилметил)-4- пиперидинамин,
(+)-1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил)метил]-N-(дифенилметил)-4-пиперидинамин,
2-[[4-(дифенилметокси)-1-пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин,
1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(3,3-дифенилпропил)-4-пиперидинэтиламин,
2,3-дигидро-2,4,6,7-тетраметил-2-[[4-(2-фенилэтил)-1-пиперазинил] метил] -5-бензофуранамин и их соли.
Более предпочтительным является
1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
(-)-1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
(+)-1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран--ил)метил] - N-(дифенилметил)-4-пиперидинамин,
1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин,
(-)-1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил)метил]-N-(дифенилметил)-4-пиперидинамин,
(+)-1-[(5-амино-2,3-дигидро-7-изопропил-2,4,6-риметилбензофуран-2-ил) метил]-N-(дифенилметил)-4-пиперидинамин или их соль.
Предпочтительными соединениями формулы (Ia), включая их соли, являются соединения в которых каждый из R1 и R2 представляет атом водорода, C1-6 алкил или C1-6 алкилкарбонил;
каждый из R3, R4, R5 и R6 представляет C1-6 алкил;
кольцо A представляет 6- или 7-членное азотсодержащее гетероциклическое кольцо, которое может быть сконденсировано с бензольным кольцом;
X представляет метилен;
Y представляет (i) группу формулы >C(R8a) - (где R8a представляет атом водорода или гидрокси) или (ii) N;
Q представляет (i) атом водорода, (ii) C6-10 арил или 6-членную азотсодержащую ароматическую группу, которая может быть замещена галогеном или C1-6 алкокси, или (iii) группу формулы -Zc'-Ar' (где Zc' представляет C1-6 алкиленовую или C2-6 алкениленовую группу, которая может быть замещена C6-10 арилом или оксо и может содержать кислород; и Ar' представляет C6-10 арил); и
m = 1.
Предпочтительные виды соединения (Ia) включают
(S)-2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1-пиперидинил) метил] -5-бензофуранамин,
2,3-дигидро-7-изопропил-2,4,6-триметил-2-[(4-фенил-1-пиперидинил)метил] -5-бензофуранамин,
(-)-2,3-дигидро-7-изопропил-2,4,6-триметил-2-[(4-фенил-1-пиперидинил) метил]-5-бензофуранамин,
(+)-2,3-дигидро-7-изопропил-2,4,6-триметил-2-[(4-фенил-1-пиперидинил) метил]-5-бензофуранамин,
7-трет-бутил-2,3-дигидро-2,4,6-триметил-2-[(4-фенил-1-пиперидинил) метил]-5-бензофуранамин,
(-)-7-трет-бутил-2,3-дигидро-2,4,6-триметил-2-[(4-фенил-1-пиперидинил) метил]-5-бензофуранамин,
(+)-7-трет-бутил-2,3-дигидро-2,4,6-триметил-2-[(4-фенил-1-пиперидинил) метил]-5-бензофуранамин или их соль.
Более предпочтительными являются (S)-2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1-пиперидинил)метил] -5-бензофуранамин и его соль.
Соединение (I) и соединение (Ia) включают стереоизомеры, но в объем настоящего изобретения входят также соответствующие изомеры и их смеси.
Соль соединения (I) по настоящему изобретению или соединения (Ia) обычно является фармакологически приемлемой солью, такой, как соли с неорганическими основаниями, соли аммония, соли с органическими основаниями, соли с неорганическими кислотами, соли с органическими кислотами и соли с основными и кислыми аминокислотами. Предпочтительными солями с неорганическими основаниями являются соли с щелочными металлами, такими, как натрий, калий и т.д., соли со щелочноземельными металлами, такими, как кальций магний и т.д., соли алюминия и т.д. Предпочтительными солями с органическими основаниями являются соли с триметиламином, триэтиламином, пиридином, пиколином, 2,6-лутидином, этаноламином, диэтаноламином, триэтаноламином, циклогексиламином, дициклогексиламином, и N,N'-дибензилэтилендиамином и т.д. Предпочтительными солями с неорганическими кислотами являются соли с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой и т.д. Предпочтительными солями с органическими кислотами являются соли с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фталевой кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и т.д. Предпочтительными солями с основными аминокислотами являются соли с аргинином, лизином, орнитином и т.д. Предпочтительными солями с кислыми аминокислотами являются соли с аспарагиновой кислотой, глутаминовой кислотой и т.д.
Особенно предпочтительными солями являются фармакологически приемлемые соли. Когда соединение (I) или соединение (Ia) содержит основную функциональную группу, предпочтительная соль включает соответствующие соли с неорганическими кислотами, такими, как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота и т.д., и соли с органическими кислотами, такими, как уксусная кислота, фталевая кислота, фумаровая кислота, щавелевая кислота, винная кислота, малеиновая кислота, лимонная кислота, янтарная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.д. Когда присутствует кислотная функциональная группа, предпочтительная соль включает соответствующие соли со щелочными металлами, такими, как натрий, калий и т.д., соли со щелочноземельными металлами, такими, как кальций, магний и т.д., и соли аммония.
Далее описан способ получения соединения (I) по настоящему изобретению.
Соединение (I) по настоящему изобретению может быть получено известными как таковыми способами или их аналогами или способами, показанными на представленных далее схемах реакций. Соединение (Ia) может быть получено известными как таковыми способами (например, способами, раскрытыми в ЕР-А-483772, JP-A-5140142, JP-A-641123, USP 5552552 и т.д.) или их аналогами или способами, показанными на представленных далее схемах реакций.
На схемах реакций 1-6 (см в конце описания) соответствующие символы имеют такие же значения, как определенные ранее. Соединения (II)-(XXVIII) на схемах включают их соли, которые могут быть такого же типа, как указанные для соединения (I).
Соединение (II) может быть получено известным самим по себе способом, например любым из способов, раскрытых в JP-A-6287585, JP-A-5140142, J. Am. Oil Chem. Soc., 51, 200-203, 1974, и т.д., или любым способом, аналогичным указанным известным способам.
Соединение (V) может быть получено известным самим по себе способом, например способом, раскрытым в JP-A-5140142, или любым аналогичным ему способом.
Соединение (VII) может быть куплено на рынке, если оно там есть, или может быть получено известным способом, например способом, раскрытым в Eur. J. Med. Chem. 15, 363-370, 1980, JP-A-249726 и т.д., или любым аналогичным ему способом.
Соединение (III) (где L представляет уходящую группу) может быть получено способом, который включает восстановление карбоксильной группы соединения (II) либо непосредственно, либо после этерификации с получением соответствующего спирта, который подвергают сульфоновой этерификации или галогенированию.
"Уходящая группа" для L включает, например галоген (например, фтор, хлор, бром, йод и т.д.), C1-5 алкилсульфонилокси, который может быть галогенированным (например, метансульфонилокси, этансульфонилокси, трихлорметансульфонилокси и т.д.), и арилсульфонилокси (например, бензолсульфонилокси, который может быть замещенным, обычно п-толуолсульфонилокси и бензолсульфонилокси, и т.д.).
Восстановитель для применения в восстановлении карбоксила включает, например, гидриды металлов, такие, как гидрид алюминия, гидрид диизобутилалюминия и т.д., водородно-металлические комплексы, такие, как литийалюминийгидрид, борогидрид натрия и т.д., борановые комплексы, такие, как борантетрагидрофурановый комплекс, борандиметилсульфидный комплекс и т.д., алкилбораны, такие как тексилборан, дисиамилборан и т.д., и диборан. Относительное содержание восстановителя, если взять в качестве примера гидрид металла, составляет примерно 0,5-10 моль, предпочтительно примерно 0,5-3,0 моль, на моль соединения (II), а в случае водородно-металлического комплекса - примерно 0,5-10 моль, предпочтительно примерно 0,5-5,0 моль, на моль соединения (II). Доля боранового комплекса, алкилборана или диборана составляет примерно 1,0-10,0 моль, предпочтительно 1,0-5,0 моль, на моль соединения (II). Эту реакцию целесообразно осуществлять в присутствии инертного растворителя. Нет в других отношениях особого ограничения на тип растворителя, лишь бы только он не мешал ходу реакции. Является предпочтительным использовать спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N, N-диметилформамид, N,N-диметилацетамид и т.д., органические кислоты, такие, как муравьиная кислота, уксусная кислота и т.д., и смеси таких растворителей. Время реакции составляет обычно 1-100 часов, предпочтительно примерно 1-50 часов. Температура реакции составляет обычно 0-120oC, предпочтительно 20-80oC. По окончании реакции реакционная смесь может быть подвергнута следующей реакции либо в том виде, как она есть, либо после частичной очистки, а полученное соединение может быть легко выделено известным самим по себе способом и очищено обычным методом, таким, как перекристаллизация, перегонка, хроматография и т.д.
Восстановитель для применения в процессе, содержащем этерифицирование соединения (II) обычным методом органической химии и восстановление полученного сложного эфира, включает, например, гидриды металлов, такие как гидрид алюминия, гидрид диизобутилалюминия и т.д., водородно-металлические комплексы, такие, как литийалюминийгидрид, борогидрид натрия и т.д., борановые комплексы, такие, как борантетрагидрофурановый комплекс, борандиметилсульфидный комплекс и т.д., алкилбораны, такие, как тексилборан, дисиамилборан и т. д., диборан и катализаторы гидрирования, такие, как никель Ренея, кобальт Ренея и т.д. Относительное содержание восстановителя, если взять в качестве примера гидрид металла, составляет примерно 1,0-10 моль, предпочтительно примерно 1,0-3,0 моль, на моль сложного эфира соединения (II), а в случае водородно-металлического комплекса - примерно 1,0-10 моль, предпочтительно примерно 1,0-3,0 моль, на моль сложного эфира соединения (II). В случае боранового комплекса, алкилборана или диборана их относительное содержание на моль сложного эфира соединения (II) составляет примерно 1,0-5,0 моль. В случае гидрирования катализатор гидрирования используют в пропорции примерно 10-1000 мас.%, предпочтительно примерно 80-300 мас.%, от массы сложного эфира соединения (II). Эту реакцию целесообразно осуществлять в присутствии инертного растворителя. Нет в других отношениях особого ограничения на тип растворителя, лишь бы только он не мешал ходу реакции. Примеры растворителя включают спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т. д. , углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N, N-диметилформамид, N, N-диметилацетамид и т.д., органические кислоты, такие, как муравьиная кислота, уксусная кислота и т.д., и смеси таких растворителей. В зависимости от активности и количества используемого катализатора время реакции составляет обычно 1-100 часов, предпочтительно примерно 1-50 часов. Температура реакции составляет обычно 0-120oC, предпочтительно 20-80oC. При использовании катализатора гидрирования давление водорода устанавливают обычно в интервале 1-100 атмосфер. По окончании реакции реакционная смесь может быть подвергнута следующей реакции либо в том виде, как она есть, либо после частичной очистки, а полученное соединение может быть легко выделено известным самим по себе способом и очищено обычным методом, таким, как перекристаллизация, перегонка, хроматография и т.д.
Для превращения полученного описанным образом спирта в сложный эфир сульфоновой кислоты, используют сульфонирующий агент, такой, как метансульфонилхлорид или п-толуолсульфонилхлорид, необязательно в сочетании с основанием, если это необходимо. Сульфонирующий агент используют с относительным содержанием примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль спирта. Эту реакцию предпочтительно проводят в инертном растворителе. Нет особого ограничения на тип растворителя, который может быть использован, но является целесообразным использовать простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N, N-диметилформамид, N, N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., азотсодержащие ароматические углеводородные соединения, такие, как пиридин, лутидин, хинолин и т. д., и смеси таких растворителей. Основание, которое может быть, необязательно, использовано, включает, например, триэтиламин и пиридин. Температура реакции находится в интервале -20-150oC, предпочтительно 0-100oC. Время реакции находится в интервале обычно от 5 минут до 24 часов, предпочтительно от 10 минут до 5 часов.
Галогенирующий агент включает например, тионилгалогениды, такие, как тионилхлорид, тионилбромид и т.д., фосфорилгалогениды, такие, как фосфорилхлорид, фосфорилбромид и т. д., галогениды фосфора, такие, как пентахлорид фосфора, трихлорид фосфора, пентабромид фосфора, трибромид фосфора и т.д., оксалилгалогениды, такие, как оксалилхлорид и т.д., и фосген. Галогенирующий агент используют в пропорции примерно 1,0-30 моль, предпочтительно примерно 1,0-10 моль, на моль спирта. Эту реакцию предпочтительно осуществляют в отсутствие растворителя или в инертном растворителе. Тип растворителя не столь важен, но является целесообразным использовать ароматические углеводороды, такие, как бензол, толуол и т.д., насыщенные углеводороды, такие, как циклогексан, гексан и т.д., простые эфиры, такие, как тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., и смеси таких растворителей. Время реакции находится в интервале обычно от 10 минут до 12 часов, предпочтительно от 10 минут до 5 часов. Температура реакции находится в интервале обычно -10-200oC, предпочтительно -10-120oC. Полученное описанным образом соединение (III) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (IV) может быть получено путем нитрования соединения (III). Нитрующий агент, который может быть использован, включает, например, смешанную кислоту, ацетилнитрат, дымящую азотную кислоту, тетрафторборат нитрония (NO2 +BF4 -) и трифторметансульфонат нитрония (NO2 +CF3SO3 -). Нитрующий агент используют в пропорции примерно 1,0-50 моль, предпочтительно примерно 1,0-10 моль, на моль соединения (III). Эту реакцию целесообразно проводить в отсутствие растворителя или в инертном растворителе. Тип используемого растворителя не столь важен, но предпочтительными являются органические кислоты, такие, как уксусная кислота, ангидриды кислоты, такие, как уксусный ангидрид, минеральные кислоты, такие, как серная кислота, азотная кислота и т. д. , насыщенные углеводороды, такие, как циклогексан и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., и смеси таких растворителей. Время реакции находится в интервале обычно от 10 минут до 12 часов, предпочтительно от 10 минут до 5 часов. Температура реакции находится в интервале обычно -10-200oC, предпочтительно - 10-120oC. Полученное описанным образом соединение (IV) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (VI) может быть получено путем восстановления соединения (IV) и необязательного подвергания его алкилированию и/или ацилированию. Восстановитель, который может быть использован для этого восстановления, включает, например, гидриды металлов, такие, как гидрид алюминия, гидрид диизобутилалюминия и т. д., водородно-металлические комплексы, такие, как литийалюминийгидрид, борогидрид натрия и т.д., борановые комплексы, такие, как борантетрагидрофурановый комплекс, борандиметилсульфидный комплекс и т.д., алкилбораны, такие, как тексилборан, дисиамилборан и т.д., диборан, некоторые металлы, такие, как цинк, алюминий, олово, железо и т.д., и щелочной металл (например, натрий, литий и т. д.) в жидком аммиаке (восстановление по Берчу). Кроме указанных восстановителей могут быть использованы различные катализаторы, такие, как, палладий на углероде, оксид платины, никель Ренея, кобальт Ренея и т.д., в качестве катализаторов гидрирования. Относительное содержание восстановителя, если взять в качестве примера гидрид металла составляет примерно 1,0-10 моль, предпочтительно примерно 1,0-3,0 моль, на моль соединения (IV), а в случае водородно-металлического комплекса - примерно 1,0-10 моль, предпочтительно примерно 1,0-3,0 моль, на моль соединения (IV). В случае боранового комплекса, алкилборана или диборана их относительное содержание на моль соединения (IV) составляет примерно 1,0-5,0 моль. В случае металла его используют в пропорции примерно 1,0-20 эквивалентов, предпочтительно примерно 1-5 эквивалентов. В случае использования щелочного металла его доля составляет примерно 1-20 эквивалентов, предпочтительно примерно 1-5 эквивалентов. В случае гидрирования катализатор, такой, как палладий на углероде, оксид платины, никель Ренея и кобальт Ренея, используют в пропорции примерно 5-1000 мас. %, предпочтительно примерно 10-300 мас.% от массы соединения (IV). Эту реакцию целесообразно осуществлять в инертном растворителе. Тип растворителя не столь важен, лишь бы только он не мешал ходу реакции. Предпочтительными являются спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т. д. , органические кислоты, такие, как муравьиная кислота, уксусная кислота и т.д., и смеси таких растворителей. При использовании никеля Ренея или кобальта Ренея может быть добавлен амин, такой, как аммиак, для подавления побочных реакций. В зависимости от типа и количества используемого катализатора время реакции составляет обычно 1-100 часов, предпочтительно примерно 1-50 часов. Температура реакции составляет обычно 0-120oC, предпочтительно 20-80oC. При использовании катализатора гидрирования давление водорода устанавливают обычно в интервале 1-100 атмосфер. По окончании реакции реакционная смесь может быть подвергнута следующей реакции либо в том виде, как она есть, либо после частичной очистки, а полученное соединение может быть легко выделено известным самим по себе способом и очищено обычным методом, таким как перекристаллизация, перегонка, хроматография и т.д.
Полученный амин при необходимости алкилируют.
Так, соединение (VI) (в котором, по крайней мере один из R1 и R2 представляет атом водорода) подвергают взаимодействию с соответствующим алкилирующим агентом (например, соответствующим алкилгалогенидом или соответствующим алкилсульфонатом и т.д.), необязательно в присутствии основания. Алкилирующий агент используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на каждый моль соединения (VI). Основание, которое может быть использовано, включает, например, неорганические основания, такие, как карбонат натрия, карбонит калия, карбонат цезия, гидрокарбонат натрия и т.д., ароматические амины, такие, как пиридин, лутидин и т.д. , третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфилин и т.д., гидриды щелочных металлов, такие, как гидрид натрия, гидрид калия и т.д., амиды металлов, такие, как амид натрия, диизопропиламид лития, гексаметилдисилазид лития и т. д. , и алкоксиды металлов, такие, как метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д. Основание используют в пропорции примерно 1,0-5,0 моль, предпочтительно 1,0-2,0 моль, на моль соединения (VI). Эту реакцию целесообразно проводить в инертном растворителе. Нет особого ограничения на тип растворителя. Предпочтительными являются спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т. д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., и смеси таких растворителей. Время реакции находится в интервале обычно от 30 минут до 48 часов, предпочтительно 1-24 часа. Температура реакции находится в интервале обычно -20-200oC, предпочтительно 0-150oC.
Полученный амин при необходимости ацилируют.
Так, соединение (VI) (в котором, по крайней мере один из R1 и R2 представляет атом водорода) подвергают взаимодействию с ацилирующим агентом, необязательно в присутствии основания или кислоты. Ацилирующим агентом может быть, например, соответствующая карбоновая кислота или ее реакционноспособное производное, (например, галогенангидрид, ангидрид кислоты, сложный эфир и т. д. ). Ацилирующий агент используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (VI). Эту реакцию целесообразно проводить в отсутствие растворителя или в инертном растворителе. Нет особого ограничения на тип растворителя, который может быть использован. Предпочтительными являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., азотсодержащие ароматические углеводородные соединения, такие, как пиридин, лутидин, хинолин и т.д., и смеси таких растворителей. Основание, которое может быть, хотя и не обязательно, использовано, включает, например, триэтиламин и пиридин. Кислота, которая может быть, хотя и не обязательно, использована, включает, например, метансульфоновую кислоту, п-толуолсульфоновую кислоту и камфорсульфоновую кислоту. Температура реакции находится в интервале обычно примерно -20-150oC, предпочтительно 0-100oC. Время реакции находится в интервале обычно от 5 минут до 24 часов, предпочтительно от 10 минут до 5 часов. Полученное описанным образом соединение (VI) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Если требуется, описанные выше реакции алкилирования и ацилирования могут быть осуществлены в сочетании или несколько раз.
Соединение (VI) может быть также получено путем обработки соединения (V) галогенирующим реагентом. Эта реакция может быть проведена, когда необходимо, с использованием оснований, основных солей или радикального инициатора или под воздействием света. Галогенирующий реагент включает, например, галоген, такой, как бром, хлор или йод, имид, такой,
как N-бромсукцинимид, аддукт галогена, такой, как бензилтриметиламмонийдихлориодат, бензилтриметиламмонийтрибромид, тетраметиламмонийбромид, аддукт брома, пербромид пиридинийбромида, дибромид диоксана. Галогенирующий агент используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (V). Эту реакцию предпочтительно осуществляют в отсутствие растворителя или в инертном растворителе. Нет особого ограничения на тип растворителя, если он не мешает ходу реакции. Предпочтительными являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., спирты, такие, как метанол, этанол, пропанол и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., органические кислоты, такие, как уксусная кислота, пропионовая кислота и т.д., нитроалканы, такие, как нитрометан и т.д., ароматические амины, такие, как пиридин, лутидин, хинолин и т. д., и смеси таких растворителей. Основание, которое может быть, хотя и не обязательно, использовано, включает, например, неорганические основания, такие, как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.д., ароматические амины, такие, как пиридин, лутидин и т. д., и третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.д. Основная соль, которая может быть, хотя и не обязательно, использована, включает, например, ацетат натрия, ацетат калия и т.д. Радикальный инициатор, который может быть, хотя и не обязательно, использован, включает, например, бензоилпероксид, азобисизобутиронитрил и т. д. В случае подвергания воздействию света может быть использована галогенная лампа. Температура реакции находится в интервале обычно примерно - 50-150oC, предпочтительно 0-100oC. Время реакции находится в интервале обычно от 5 минут до 24 часов, предпочтительно от 10 минут до 5 часов.
Соединение (VI) может быть также получено способом, включающим циклизацию соединения (V) органической перкислотой, необязательно в присутствии основания, и подвергание полученного спирта сульфоновой этерификации. Органическая перкислота, которая может быть использована, включает, например, м-хлорпербензойную кислоту и перуксусную кислоту. Органическую перкислоту используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (V). Эту реакцию предпочтительно осуществляют в инертном растворителе. Нет особого ограничения на тип растворителя, если он не мешает ходу реакции. Предпочтительными являются вода, простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д.; углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., органические кислоты, такие, как уксусная кислота, пропионовая кислота и т.д., азотсодержащие ароматические углеводородные соединения, такие, как пиридин, лутидин, хинолин и т. д., и смеси таких растворителей. Основание, которое может быть, хотя и не обязательно, использовано, включает, например, неорганические основания, такие, как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.д., ароматические амины, такие, как пиридин, лутидин и т. д. , и третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламино-пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.д. Температура реакции находится в интервале обычно примерно -20-150oC, предпочтительно 0-100oC. Время реакции находится в интервале обычно от 5 минут до 24 часов и предпочтительно от 10 минут до 5 часов. Последующая реакция сульфоновой этерификации может быть осуществлена при тех же условиях, что описаны для получения соединения (III) из соединения (II). Полученное описанным образом соединение (VI) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (I) может быть получено путем подвергания соединения (VI) конденсации с соединением (VII).
Эта конденсация соединения (VI) с соединением (VII) может быть осуществлена, необязательно, в присутствии основания. Основание включает, например, неорганические основания, такие, как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.д., ароматические амины, такие, как пиридин, лутидин и т.д., третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.д., гидриды щелочных металлов, такие, как гидрид натрия, гидрид калия и т.д., амиды металлов, такие, как амид натрия, диизопропиламид лития, гексаметилдисилазид лития и т.д., и алкоксиды металлов, такие, как метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д. Основание используют в пропорции примерно 1,0-30 моль, предпочтительно примерно 1,0-10 моль, на моль соединения (VI). Эту реакцию целесообразно проводить в отсутствие растворителя или в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции. Предпочтительными являются галогенированные углеводороды, такие, как дихлорэтан, хлороформ и т.д., алифатические углеводороды, такие, как гексан, циклогексан и т.д., ароматические углеводороды, такие, как толуол, ксилол и т.д., простые эфиры, такие, как диэтиловый эфир, диизопропиловый эфир и т.д., амиды, такие, как диметилформамид, диметилацетамид и т.д., спирты, такие, как метанол, этанол, и т.д., и смеси таких растворителей. Доля растворителя составляет обычно 0,2-50 мл, предпочтительно 2-20 мл, на грамм соединения (VI). Эту реакцию проводят обычно при -5-200oC, предпочтительно 5-180oC. Время реакции находится в интервале обычно примерно от 5 до 72 часов, предпочтительно примерно 0,5-30 часов. При использовании высокой температуры реакцию обычно осуществляют в автоклаве или тому подобном.
Что касается соединения (IX) (где L имеет такое же значение, как определенное выше, r представляет 1 или 2), соединение (IX), в котором r = 1, может быть получено путем осуществления взаимодействия соединения (VI), в котором m = 1, то есть соединения (VIII) (где r имеет значение, указанное выше), в котором r = 1, с цианосоединением. Цианосоединение включает, например, цианид натрия, цианид калия и их смесь. Можно также использовать цианосоединение, полученное путем осуществления in situ (на месте) взаимодействия циановодорода с солью щелочного металла, такой, как гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия или тому подобное. Цианосоединение используют в пропорции примерно 0,8-10 моль, предпочтительно примерно 1,0-5,0 моль, на моль соединения (VIII). Эту реакцию целесообразно проводить в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции. Предпочтительный растворитель включает спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т. д. , амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан, хлорбензол, о-дихлорбензол и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., вода и смеси таких растворителей. Реакция может быть осуществлена с использованием воды и нерастворимого или плохо растворимого в воде растворителя, выбранного из вышеуказанных растворителей, в присутствии межфазного катализатора. Межфазный катализатор, который может быть использован, включает, например, соли четвертичного аммония, такие, как тетрабутиламмонийбромид, бензилтриэтиламмонийхлорид и т.д., и соли четвертичного фософния. Межфазный катализатор используют в пропорции примерно 0,001-10 моль, предпочтительно примерно 0,005-0,5 моль, на моль соединения (VIII). Время реакции находится в интервале обычно от 10 минут до 50 часов, предпочтительно от 30 минут до 20 часов. Температура реакции находится в интервале обычно 0-200oC, предпочтительно 20-150oC. Полученное описанным образом соединение (IX) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Что касается соединения (X) (где r имеет такое же значение, как определенное выше), соединение (X), в котором r = 1, может быть получено путем гидролиза соединения (IX), в котором r = 1, с кислотой или основанием. Кислотный гидролиз может быть осуществлен с минеральной кислотой, такой, как хлороводородная кислота, бромоводородная кислота, серная кислота и т.д., кислотой Льюиса, такой, как трихлорид бора, трибромид бора и т.д., в отдельности или в сочетании с тиолом или сульфидом, или органической кислотой, такой, как трифторуксусная кислота, п-толуолсульфоновая кислота и т.д. Основный гидролиз может быть осуществлен с использованием гидроксида металла, такого, как гидроксид натрия, гидроксид калия, гидроксид бария и т.д., карбоната металла, такого, как карбонат натрия, карбонат калия и т.д., алкоксида металла, такого, как метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д., или органического основания, такого, как триэтиламин, имидазол, формамидин и т.д. Кислоту или основание используют в пропорции примерно 0,1-20 моль, предпочтительно 0,5-12 моль, на моль соединения (IX). Эту реакцию целесообразно проводить в отсутствие растворителя или в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции. Предпочтительный растворитель включает спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан, хлорбензол, о-дихлорбензол и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., вода и смеси таких растворителей. Время реакции находится в интервале обычно от 10 минут до 50 часов, предпочтительно от 30 минут до 40 часов. Температура реакции находится в интервале обычно 0-200oC, предпочтительно 20-150oC. Полученное описанным образом соединение (X) может быть использовано либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (VIII), в котором r = 2, может быть получено из соединения (X), в котором r = 1, так же, как описано выше в отношении получения соединения (III) из соединения (II).
Соединение (IX), в котором r = 2, может быть получено из соединения (VIII), в котором r = 1, так же, как описано выше в отношении получения соединения (IX), в котором r = 1, из соединения (VIII), в котором r = 2.
Соединение (X), в котором r = 2, может быть получено из соединения (IX), в котором r = 2, так же, как описано выше в отношении получения соединения (X), в котором r = 1, из соединения (IX), в котором r = 1.
Соединение (XI) (в котором r имеет такое же значение, как определенное выше) может быть получено путем конденсации соединения (VII) с соединением (X), реакционноспособным производным соединения (X) или солью соединения (X). Реакционноспособное производное соединения (X) включает соответствующие галогенангидриды, (например, хлорангидрид, бромангидрид и т.д.), амиды кислот (например, соответствующие амиды кислот с пиразолом, имидазолом, бензотриазолом и т. д. ), смешанные ангидриды кислот (например, смешанные ангидриды кислот с моно-C1-4 алкилугольными кислотами, такими, как монометилугольная кислота, моноэтилугольная кислота, моноизопропилугольная кислота, моно-трет-бутилугольная кислота и т.д.; смешанные ангидриды кислот с моно-C7-10 аралкилугольными кислотами, такими, как монобензилугольная кислота, моно(п-нитробензил)угольная кислота и т. д.; смешанные ангидриды кислот с C1-6 алифатическими карбоновыми кислотами, такими, как уксусная кислота, цианоуксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, пиваловая кислота, трифторуксусная кислота, трихлоруксусная кислота, ацетоуксусная кислота и т.д.; смешанные ангидриды кислот с C7-11 ароматическими карбоновыми кислотами, такими, как бензойная кислота п-толуиловая кислота, п-хлорбензойная кислота и т.д.; смешанные ангидриды кислот с органическими сульфоновыми кислотами, такими, как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и т.д.; и смешанные ангидриды кислот с моноаллилугольной кислотой и т. д. ), азиды кислот, активные сложные эфиры (например, эфир диэтоксифосфорной кислоты, эфир дифеноксифосфорной кислоты, п-нитрофениловый эфир, 2,4-динитрофениловый эфир, цианметиловый эфир, пентахлорфениловый эфир, эфир с N-гидроксисукцинимидом, эфир с N-гидроксифталимидом, эфир с 1-гидроксибензотриазолом, эфир с 6-хлор-1-гидроксибензотриазолом, эфир с 1-гидрокси-1H-2- пиридоном и т.д.), и активные сложные тиоэфиры (например, 2-пиридилтиоэфир, 2-бензотиазолилтиоэфир и т.д.).
В качестве альтернативы использованию реакционноспособного производного соединения (X), как описано выше, соединение (X) или соль соединения (X) можно непосредственно подвергнуть взаимодействию с соединением (VII) в присутствии подходящего конденсирующего агента. Используемый конденсирующий агент включает, например, N,N,-дизамещенные карбодиимиды, такие, как N,N'-дициклогексилкарбодиимид, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSC) и т.д., азолиды, такие, как N,N'-карбонилдиимидазол и т.д., дегидратирующие агенты, такие, как N-этоксикарбонил-2-этокси-1,2-дигидрохинолин, оксихлорид фосфора, алкоксиацетилены и т.д., и соли 2-галогенпиридиния, такие, как 2-хлорметил-пиридиниййодид, 2-фтор-1-метилпиридиниййодид и т.д. Соединение (VII) используют в пропорции обычно примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (X), реакционноспособного производного соединения (X) или соли соединения (X). Эту реакцию целесообразно проводить в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции. Предпочтительными являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т. д. , вода и смеси таких растворителей. Когда в качестве реакционноспособного производного соединения (X) используют галогенангидрид, сметанный ангидрид кислоты или реакционноспособный сложный эфир, реакция может быть осуществлена в присутствии акцептора кислоты для удаления высвободившейся из реакционной системы кислоты. Акцептор кислоты, который может быть использован для этой цели, включает неорганические основания, такие, как карбонат натрия, карбонат калия, гидрокарбонат натрия и т.д., ароматические амины, такие, как пиридин, лутидин и т.д., и третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т. д. В зависимости от типов реагента и используемого растворителя время реакции находится в интервале обычно от 30 минут до 48 часов, предпочтительно от 30 минут до 24 часов. Температура реакции находится в интервале обычно 0-100oC, предпочтительно 0-70oC.
Полученное описанным образом соединение (XI) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (I) может быть также получено путем восстановления соединения (XI). Восстановитель, который может быть использован для этого восстановления, включает, например, гидриды металлов, такие, как гидрид алюминия, гидрид диизобутилаллюминия и т. д., водородно-металлические комплексы, такие, как литийалюминийгидрид, борогидрид натрия и т.д., борановые комплексы, такие, как борантетрагидрофурановый комплекс, борандиметилсульфидный комплекс и т. д., алкилбораны, такие, как тексилборан, дисиамилборан и т.д., и диборан. На каждый моль соединения (XI) восстановитель используют в пропорции примерно 1,0-10 моль, предпочтительно примерно 1,0-3,0 моль, в случае гидрида металла, примерно 1,0-10 моль, предпочтительно примерно 1,0-5,0 моль, в случае водородно-металлического комплекса и примерно 1,0-10,0 моль, предпочтительно примерно 1,0-7,0 моль, в случае боранового комплекса, алкилборана или диборана. Эту реакцию целесообразно проводить в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции. Предпочтительными являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., и смеси таких растворителей. Время реакции находится в интервале обычно от 15 минут до 100 часов, предпочтительно от 20 минут до 50 часов. Температура реакции находится в интервале обычно 0-120oC, предпочтительно 10-80oC. По окончании реакции реакционная смесь может быть подвергнута следующей реакции либо в том виде, как она есть, либо после частичной очистки, а полученное соединение в реакционной смеси может быть легко выделено известным самим по себе способом и очищено обычным методом разделения, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (XII) может быть получено путем удаления группы формулы: -Za-Zb-Ar (где соответственные символы имеют значения, определенные выше) из соединения (I) где Y = N. Это снятие защиты может быть осуществлено путем обработки вышеуказанного соединения (I) подходящим реагентом, таким, как кислота, основание, ультрафиолетовый свет, гидразин, фенилгидразин, N-метилдитиокарбамат натрия, тетрабутиламмонийфторид и ацетат палладия, или путем осуществления реакции восстановления. Эти реакции могут быть осуществлены в соответствии с известными как таковыми способами, например способами, описанными в Protective Groups in Organic Synthesis, второе издание, John Wiley & Sons, Inc. , 1991. Полученное описанным образом соединение (XII) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (I), в котором Y = N, может быть получено из соединения (XII), в котором Y = N, путем подвергания последнего (i) алкилированию, (ii) ацилированию или (iii) ацилированию с последующим восстановлением полученного амида.
Ацилирование может быть осуществлено так же, как описано выше, в отношении получения соединения (I) из соединения (VI).
Ацилирование может быть осуществлено так же, как описано выше в отношении получения соединения (XI) из соединения (X). Стадия, на которой восстанавливают амид, полученный путем ацилирования, может быть осуществлена так же, как описано выше в отношении получения соединения (I) из соединения (XI).
Соединение (XIV) (где n представляет целое число от 1 до 4) можно получить, подвергнув соединение (VI) и соединение (XIII) (где n имеет такое же значение, как определенное выше) конденсации, подобной вышеописанной конденсации соединения (VI) и соединения (VII).
Соединение (XIII) можно купить на рынке, когда оно там есть, или можно получить известным как таковым способом, например, описанным в J. Med. Chem. , 34, 1073, 1991, и т.д.
Соединение (XV) (где n имеет такое же значение, как определенное выше) можно получить, подвергнув соединение (XIV) известной самой по себе реакции окисления. Окислитель, который можно использовать для этой реакции, включает соединения хромовой кислоты, такие, как хромовый ангидрид, дихромат натрия, дихромат калия и т. д., соединения периодной кислоты, такие, как п-периодная кислота, м-периодная кислота, м-периодат натрия и т.д., оксиды металлов, такие, как диоксид марганца, оксид серебра, оксид свинца и т.д., комбинация сульфоксида, такого, как диметилсульфоксид, с дегидратирующим агентом, таким, как оксалилхлорид или N,N'-дициклогексилкарбодиимид. Окислитель используют в пропорции примерно 1-30 моль, предпочтительно примерно 1-10 моль, на моль соединения (XIV). Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции. Предпочтительными являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., кетоны, такие, как ацетон, метилэтилкетон и т. д. , нитрилы, такие, как ацетонитрид, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., вода и смеси таких растворителей. Время реакции находится в интервале обычно от 5 минут до 48 часов, предпочтительно от 5 минут до 16 часов. Температура реакции находится в интервале обычно -90-200oC, предпочтительно -80-150oC. По окончании реакции реакционная смесь может быть подвергнута следующей реакции либо в том виде, как она есть, либо после частичной очистки, а целевое соединение, полученное в реакционной системе, может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (I) может быть также получено путем восстановительной конденсации соединения (XV) и соединения (XVI) (где R11 представляет атом водорода или углеводородную группу, которая может быть замещенной; Zd представляет двухвалентную алифатическую углеводородную группу, которая может быть замещенной и может содержать кислород, азот или серу).
"Углеводородная группа, которая может быть замещенной", для R11 может быть такой же, как "углеводородная группа, которая может быть замещенной", для R10, определенного выше.
"Двухвалентная алифатическая углеводородная группа, которая может быть замещенной и может содержать кислород, азот или серу", для Zd может быть такой же, как "двухвалентная алифатическая углеводородная группа, которая может быть замещенной и может содержать кислород, азот или серу", указанная для Zb. Когда указанная выше двухвалентная алифатическая "углеводородная группа, которая может быть замещенной", содержит кислород или серу, гетероатом находится между углеродными атомами.
Соединение (XVI) может быть куплено, когда оно коммерчески доступно, или может быть получено известным самим по себе способом.
Соединение (XVI) используют в пропорции примерно 0,5-2 моль, предпочтительно 0,8-1,5 моль, на моль соединения (XV). Используемый восстановитель включает, например, гидриды металлов, такие, как гидрид алюминия, гидрид диизобутилалюминия и т.д., водородно-металлические комплексы, такие, как литийалюминийгидрид, борогидрид натрия, цианборогидрид натрия и т.д., борановые комплексы, такие, как борантетрагидрофурановый комплекс, борандиметилсульфидный комплекс и т.д., алкилбораны, такие, как тексилборан, дисиамилборан и т. д. , и диборан. При проведении этой реакции можно, хотя и не обязательно, использовать кислоту (например, хлороводород, серную кислоту, уксусную кислоту, трифторуксусную кислоту и т.д.). На каждый моль соединения (XV) восстановитель используют в пропорции примерно 0,3-10 моль, предпочтительно примерно 0,3-3,0 моль, в случае гидрида металла, примерно 0,3-10 моль, предпочтительно примерно 0,5-5,0 моль, в случае водородно-металлического комплекса и примерно 1,0-10,0 моль, предпочтительно примерно 1,0-3,0 моль, в случае боранового комплекса, алкилборана или диборана. Эту реакцию целесообразно осуществлять в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции, но предпочтительными растворителями являются спирты, такие, как метанол, этанол, пропанол и т. д. , простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т. д., вода и смеси таких растворителей.
Время реакции находится в интервале обычно от 10 минут до 10 часов, предпочтительно от 10 минут до 2 часов. Температура реакции составляет обычно -20-120oC, предпочтительно -10-80oC. По окончании реакции реакционная смесь может быть подвергнута следующей реакции либо в том виде, как она есть, либо после частичной очистки, а целевое соединение может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (I) можно также получить, подвергнув соединение (XV) и соединение (XVI) восстановительной конденсации с использованием водорода и катализатора гидрирования, такого как оксид платины, палладий на углероде, никель Ренея, кобальт Ренея или тому подобное. Содержание катализатора гидрирования относительно соединения (XV) находится в интервале примерно 0,1-1000 мас.%, предпочтительно примерно 1-300 мас.%. Эту реакцию целесообразно осуществлять в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции, но предпочтительными растворителями являются спирты, такие, как метанол, этанол, пропанол и т. д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., органические кислоты, такие, как муравьиная кислота, уксусная кислота и т.д., и смеси таких растворителей. В зависимости от активности и количества используемого катализатора время реакции находится в интервале обычно от 10 минут до 100 часов, предпочтительно от 10 минут до 10 часов. Температура реакции составляет обычно 0-120oC, предпочтительно 20-80oC. Когда используют катализатор гидрирования, давление водорода обычно составляет 1-100 атмосфер. По окончании реакции реакционная смесь может быть подвергнута следующей реакции либо в том виде, как она есть, либо после частичной очистки, а целевое соединение, полученное в реакционной смеси, может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (XVIII) (где R12 представляет атом водорода или углеводородную группу; n имеет такое же значение, как определенное выше) можно получить, подвергнув соединение (VI) и соединение (XVII) (где соответственные символы имеют такие же значения, как определенные выше) конденсации, подобной той, что используют для получения соединения (I) из соединения (VI).
"Углеводородная группа" для R12 может быть такой же, как "углеводородная группа" "углеводородной группы, которая может быть замещенной" определенной для R10.
Соединение (XVII) может быть куплено, когда оно коммерчески доступно, или может быть получено известным самим по себе способом, например способом, описанным в Am. Chem. Soc., 75, 6249, 1953, и т.д.
Соединение (XIX) (где n имеет такое же значение, как определенное выше) может быть получено путем подвергания соединения (XVIII), кислотному или щелочному гидролизу. Кислотный гидролиз может быть осуществлен с использованием, например, минеральной кислоты, такой, как хлороводородная кислота, серная кислота и т.д., кислоты Льюиса, такой, как трихлорид бора, трибромид бора и т.д., комбинации кислоты Льюиса с тиолом или сульфидом, или органической кислоты, такой, как трифторуксусная кислота, п-толуолсульфоновая кислота и т.д. Щелочной гидролиз может быть осуществлен с использованием гидроксида металла, такого, как гидроксид натрия, гидроксид калия, гидроксид бария и т.д., карбоната металла, такого, как карбонат натрия, карбонат калия и т. д. , алкоксида металла, такого, как метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д., или органического основания, такого, как триэтиламин, имидазол, формамидин и т.д.. Кислоту или основание используют в пропорции примерно 0,5-20 моль, предпочтительно примерно 0,5-10 моль, на моль соединения (XVIII). Эту реакцию целесообразно проводить в отсутствие растворителя или в инертном растворителе. Нет особого ограничения на тип используемого растворителя, если он не мешает ходу реакции. Предпочтительными растворителями являются спирты, такие, как метанол, этанол, пропанол и т.д., ароматические углеводороды, такие, как бензол, толуол и т.д., насыщенные углеводороды, такие, как циклогексан, гексан и т.д., органические кислоты, такие, как муравьиная кислота, уксусная кислота и т. д., простые эфиры, такие, как тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как, дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т. д. , нитрилы, такие, как ацетонитрил, пропионитрил и т.д., кетоны, такие, как ацетон, метилэтилкетон и т.д., сульфоксиды, такие, как диметилсудьфоксид и т. д., вода и смеси таких растворителей. Время реакции находится в интервале обычно от 10 минут до 60 часов, предпочтительно от 10 минут до 12 часов. Температура реакции находится в интервале обычно -10-200oC, предпочтительно 0-120oC. Полученное описанным образом соединение (XIX) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (XX) (где n и Zd имеют такие же значения, как соответственно определенные выше) можно получить, подвергнув соединение (XVI) конденсации с соединением (XIX), реакционноспособным производным соединения (XIX) или солью соединения (XIX) так же, как описано в отношении получения соединения (XI) из соединения (X). Соединение (I) можно также получить, подвергнув соединение (XX) восстановлению так же, как описано в отношении получения соединения (I) из соединения (XI).
Соединение (XXI) (где М представляет металл и R13 представляет углеводородную группу, которая может быть замещенной, или силил) может быть получено известным самим по себе способом, например способом, описанным в JP-A-5-140142, или любым аналогичным ему способом.
"Металл" для М включает, например, щелочные металлы, такие, как литий, натрий и т. д. , щелочноземельные металлы, такие, как магний и т.д., медь, цинк, бор, алюминий, церий и титан.
"Углеводородная группа, которая может быть замещенной", для R13 включает "углеводородную группу, которая может быть замещенной", определенную для R10.
"Силил" для R13 включает, например, три-C1-6-алкилсилил (например, триметилсилил, трет-бутилдиметилсилил).
Соединение (XXII) (где соответствующие символы имеют значения, определенные выше) может быть получено известным самим по себе способом, например способами, описанными в Journal of The American Chemical Society, 109, 5765-5780, 1987, или любым аналогичным им способом.
Соединение (XXV) может быть получено известным самим по себе способом, например способами, описанными в JP-A-5140142 или другой литературе, или любым аналогичным им способом.
Из соединении (XXIII) (где соответственные символы имеют значения, определенные выше) соединение, в котором m = 1 и X представляет метилен, может быть получено путем подвергания соединения (XXI) и соединения (XXII), в котором m = 1 и X представляет метилен, конденсации. Соединение (XXI) используют в пропорции примерно 0,8-10 моль, предпочтительно примерно 1,0-5,0 моль, на моль соединения (XXII). Эту реакцию целесообразно осуществлять в инертном растворителе (т.е. растворителе, индиферентном к реакции; это относится и к дальнейшему описанию). Нет особого ограничения на тип используемого растворителя. Но предпочтительными растворителями являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т. д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., и смеси таких растворителей. Время реакции находится в интервале обычно от 10 минут до 100 часов, предпочтительно от 10 минут до 10 часов. Температура реакции составляет обычно -100-30oC, предпочтительно -80-20oC. Эта реакция может быть, хотя и не обязательно, осуществлена в присутствии добавки. Указанная добавка включает комплексы трифторида бора, такие, как трифторид бора-диэтиловый эфир, трифторид бора-диметилсульфид и т.д., и соли меди, такие, как йодид меди (I). Добавку используют в пропорции примерно 0,1-3,0 моль, предпочтительно примерно 0,5-1,5 моль, на моль соединения (XXII). Полученная описанным образом реакционная смесь может быть использована для следующей реакции либо в том виде, как она есть, либо в частично очищенном виде, а целевое соединение может быть легко выделено из реакционной смеси и дополнительно очищено такими методами разделения, как перекристаллизация, перегонка, хроматография и т.д.
Из соединений (XXIV) (где соответственные символы имеют значения, определенные выше) соединение, в котором m = 1 и X представляет метилен, может быть получено путем подвергания соединения (XXIII), в котором m = 1 и X представляет метилен, циклизации с помощью основания. Основание, которое может быть использовано для этой цели, включает, например, неорганические основания, такие, как гидроксид натрия, гидроксид калия и т.д., основные соли, такие, как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.д., ароматические амины, такие, как пиридин, лутидин и т.д., третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.д., гидриды щелочных металлов, такие, как гидрид натрия, гидрид калия и т.д., амиды металлов, такие, как амид натрия, диизопропиламид лития, гексаметилдисилазид лития и т.д., и алкоксиды металлов, такие, как метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д. Основание используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (XXIII). Эту реакцию целесообразно проводить в инертном растворителе. Нет особого ограничения на тип используемого растворителя. Предпочтительными являются спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-ди-метоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т. д., вода и смеси таких растворителей. Время реакции находится в интервале обычно от 5 минут до 3 часов, предпочтительно от 5 минут до 2 часов. Температура реакции находится в интервале обычно -20-200oC, предпочтительно -10-120oC.
Из соединений (III) (где соответственные символы имеют значения, определенные выше) соединение, в котором m = 1 и X представляет метилен, может быть получено также путем подвергания соединения (XXIV), в котором m = 1 и X представляет метилен, реакции снятия защиты с R13 с использованием кислоты или основания в качестве катализатора и последующей циклизации. Катализатор, который может быть использован для этой цели, включает минеральную кислоту, такую, как хлороводородная кислота, серная кислота, бромоводородная кислота и т. д., органическую кислоту, такую, как уксусная кислота, трифторуксусная кислота и т.д., трифторид бора-диэтиловый эфир, кислоту Льюиса, такую, как хлорид цинка, хлорид олова и т.д., сульфоновую кислоту, такую, как п-толуолсульфоновая кислота, метансульфоновая кислота и т.д., неорганическое основание, такое, как гидроксид натрия, гидроксид калия и т.д., основную соль, такую, как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.д., ароматический амин, такой, как пиридин, лутидин и т.д., третичный амин, такой, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.д., гидрид щелочного металла, такой, как гидрид натрия, гидрид калия и т.д., амид металла, такой, как амид натрия, диизопропиламид лития, гексаметилдисилазид лития и т.д., или алкоксид металла, такой, как метоксид натрия, этоксид натрия, трет-бутоксид калия и т.д. Кислоту или основание используют в пропорции примерно 0,1-30 моль, предпочтительно примерно 0,5-10 моль, на моль соединения (XXIV). Эту реакцию целесообразно проводить в инертном растворителе. Нет особого ограничения на тип используемого растворителя. Предпочтительными являются спирты, такие, как метанол, этанол, пропанол и т.д., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-ди-метилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., кетоны, такие, как ацетон, метилэтилкетон и т.д., вода и смеси таких растворителей. Время реакции находится в интервале обычно от 5 минут до 100 часов, предпочтительно
от 5 минут до 3 часов. Температура реакции находится в интервале обычно -20-120oC, предпочтительно 0-80oC. Полученная описанным образом реакционная смесь может быть использована для следующей реакции либо в том виде, как она есть, либо в частично очищенном виде, а целевое соединение может быть легко выделено из реакционной смеси и дополнительно очищено такими методами разделения, как перекристаллизация, перегонка, хроматография и т.д.
Из соединений (III) (где соответственные символы имеют значения, определенные выше) соединение, в котором m = 1 и X представляет метилен, может быть также получено из соединения (XXV), в котором X представляет метилен, так же, как соединение (VI) из соединения (V).
Соединение (XXVI) может быть получено путем подвергания соединения (III) и соединения (VII) конденсации так же, как в случае получения соединения (I) из соединения (VI).
Соединение (I) может быть получено также путем нитрования соединения (XXVI) так же, как в процессе получения соединения (IV) из соединения (III), с последующим восстановлением нитрогруппы так же, как в процессе получения соединения (VI) из соединения (IV). Кроме того, могут быть осуществлены необязательные реакции алкилирования и ацилирования соединения (VI) совместно или раздельно. Полученная описанным образом реакционная смесь может быть использована для следующей реакции либо в том виде, как она есть, либо в частично очищенном виде, а целевое соединение может быть легко выделено из реакционной смеси известными способами и дополнительно очищено, такими методами разделения, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (I) можно получить, подвергнув соединение (XXVI) реакции азосочетания с солью диазония с последующим восстановлением полученного азосоединения. Соль диазония, которая может быть использована, включает соли арилдиазония, такие, как бензолдиазонийхлорид, 4-нитробензолдиазонийхлорид, 2,4-динитробензолдиазонийхлорид, 4-сульфобензолдиазонийхлорид и т.д. Соль диазония может быть получена известным самим по себе методом, например способами, описанными в JP-A-5140142 и другой литературе, или любыми аналогичными им способами. Это соединение диазония используют в пропорции примерно 0,8-3 моль на моль соединения (XXVI). Эту реакцию азосочетания целесообразно осуществлять в инертном растворителе. Нет особого ограничения на тип используемого инертного растворителя, лишь бы в нем могла протекать реакция. Но предпочтительными являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т.д., углеводороды, такие, как бензол, толуол, циклогексан и т.д., амиды, такие, как N,N-диметилформамид, N, N-диметилацетамид и т. д. , галогенированные углеводороды, такие, как дихлорметан, хлороформ, 1,2-дихлорэтан, тетрахлорид углерода и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., кетоны, такие, как ацетон, метилэтилкетон и т.д., органические кислоты, такие, как уксусная кислота, пропионовая кислота и т. д., вода и смеси таких растворителей. Время реакции находится в интервале обычно от 10 минут до 100 часов, предпочтительно от 20 минут до 30 часов. Температура реакции находится в интервале обычно -20-80oC, предпочтительно 0-50oC. Полученная описанным образом реакционная смесь может быть использована для следующей реакции либо в том виде, как она есть, либо в частично очищенном виде, а целевое соединение может быть легко выделено из реакционной смеси известными способами и дополнительно очищено такими методами разделения, как перекристаллизация, перегонка, хроматография и т. д. Последующее восстановление этого азосоединения может быть осуществлено при таких же условиях, как те, что описаны для получения соединения (VI) из соединения (IV). Реакции алкилирования и ацилирования, которым необязательно подвергают соединение (VI), необязательно применимы также к соединению (I) в подходящем сочетании или одна за другой. Полученная описанным образом реакционная смесь может быть использована для следующей реакции либо в том виде, как она есть, либо в частично очищенном виде, а целевое соединение может быть легко выделено из реакционной смеси известными способами и дополнительно очищено такими методами разделения, как перекристаллизация, перегонка, хроматография и т.д.
Кроме того, используя в качестве исходного материала оптически активные разновидности соединения (XXII), можно легко синтезировать оптически активные разновидности соединения (I).
Соединение (XXVII) может быть получено известным самим по себе методом, например способами, раскрытыми в JP-A-5140142, или любым аналогичным им способом.
Соединение (XXVIII) (где L имеет такое же значение, как определенное выше; m представляет 1) может быть также получено путем обработки соединения (V) галогенирующим реагентом. Эта реакция может быть проведена с использованием оснований, основных солей или радикального инициатора или под воздействием света, когда это необходимо. Галогенирующий реагент включает, например, галоген, такой, как бром, хлор или йод, имид, такой, как N-бромсукцинимид, аддукт галогена, такой, как бензилтриметиламмонийдихлориодат, бензилтриметиламмонийтрибромид, аддукт брома, тетраметиламмонийбромид, пербромид пиридинийбромида, дибромид диоксана. Галогенирующий агент используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (V). Эту реакцию предпочтительно осуществляют в отсутствие растворителя или в инертном растворителе. Нет особого ограничения на тип растворителя, если он не мешает ходу реакции. Предпочтительными являются простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т. д. , спирты, такие, как метанол, этанол, пропанол и т.д., углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., органические кислоты, такие, как уксусная кислота, пропионовая кислота и т.д., нитроалканы, такие, как нитрометан и т. д., ароматические амины, такие, как пиридин, лутидин, хинолин и т.д., и смеси таких растворителей. Основание, которое может быть, хотя и не обязательно, использовано, включает, например, неорганические основания, такие, как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.д., ароматические амины, такие, как пиридин, лутидин и т. д. , и третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.д. Основная соль, которая может быть, хотя и не обязательно, использована, включает, например, ацетат натрия, ацетат калия и т.д. Радикальный инициатор, который может быть, хотя и не обязательно, использован, включает, например, бензоилпероксид, азобисизобутиронитрил и т. д. В случае подвергания воздействию света может быть использована галогенная лампа. Температура реакции находится в интервале обычно примерно -50-150oC, предпочтительно 0-100oC. Время реакции находится в интервале обычно от 5 минут до 24 часов, предпочтительно от 10 минут до 5 часов.
Соединение (XXVIII) может быть также получено способом, включающим циклизацию соединения (XXVII) органической перкислотой, необязательно в присутствии основания, и подвергание полученного спирта сульфоновой этерификации. Органическая перкислота, которая может быть использована, включает, например, м-хлорпербензойную кислоту и перуксусную кислоту. Органическую перкислоту используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (XXVII). Эту реакцию предпочтительно осуществляют в инертном растворителе. Нет особого ограничения на тип растворителя, если он не мешает ходу реакции. Предпочтительными являются вода, простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан и т. д. , углеводороды, такие, как бензол, толуол, циклогексан, гексан и т.д., амиды, такие, как N,N-диметилформамид, N,N-диметилацетамид и т. д. , галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.д., нитрилы, такие, как ацетонитрил, пропионитрил и т.д., сульфоксиды, такие, как диметилсульфоксид и т.д., органические кислоты, такие, как уксусная кислота, пропионовая кислота и т. д., ароматические амины, такие, как пиридин, лутидин, хинолин и т.д., и смеси таких растворителей. Основание, которое может быть, хотя и не обязательно, использовано, включает, например, неорганические основания, такие, как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.д. , ароматические амины, такие, как пиридин, лутидин и т.д., и третичные амины, такие, как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.д. Температура реакции находится в интервале обычно примерно -20-150oC, предпочтительно 0-100oC. Время реакции находится в интервале обычно от 5 минут до 24 часов, предпочтительно от 10 минут до 5 часов. Последующая реакция сульфоновой этерификации может быть осуществлена при тех же условиях, что описаны для получения соединения (III) из соединения (II). Полученное описанным образом соединение (XXVII) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычным методом очистки, таким, как перекристаллизация, перегонка, хроматография и т.д.
Соединение (VI) можно получить, подвергнув соединение (XXVIII) алкилированию в присутствии протонной кислоты или кислоты Льюиса. Алкилирующий агент включает, например, спирты, такие, как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д., галогенированные углеводороды, такие, как изопропилхлорид, трет-бутилхлорид и т.д., алкены, такие, как изобутен и т.д., сложные эфиры, такие, как изо-пропилацетат, трет-бутилацетат, диизопропилсульфат, п-толуолсульфонат, изопропилфосфит и т.д., простые эфиры, такие, как трет-бутилметиловый эфир и т.д. Алкилирующий агент используют в пропорции примерно 1,0-30 моль, предпочтительно примерно 1,0-15 моль, на моль соединения (XXVIII). Протонная кислота, которая может быть использована, включает, например, концентрированную серную кислоту, трифторуксусную кислоту и т.д. Используемая кислота Льюиса включает, например, такую, как хлорид алюминия, бромид алюминия, хлорид железа (III), хлорид олова (IV), хлорид титана, хлорид цинка и т.д. Протонная кислота и кислота Льюиса могут быть использованы отдельно или в сочетании друг с другом. Протонную кислоту используют в пропорции примерно 1,0-200 моль, предпочтительно примерно 1,0-100 моль, на моль соединения (XXVIII). Кислоту Льюиса используют в пропорции примерно 1,0-5,0 моль, предпочтительно примерно 1,0-2,0 моль, на моль соединения (XXVIII). Эту реакцию целесообразно осуществлять в инертном растворителе. Нет особого ограничения на тип используемого растворителя. Предпочтительными являются углеводороды, такие, как бензол, толуол, ксилол, циклогексан, гексан и т.д., галогенированные углеводороды, такие, как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан, тетрахлорэтан и т. д. , нитрилы, такие, как ацетонитрил, пропионитрил и т.д., нитроалканы, такие, как нитрометан и т.д., и смеси таких растворителей. Температура реакции находится в интервале обычно -20-200oC, предпочтительно 0-150oC. Время реакции находится в интервале обычно от 5 минут до 24 часов, предпочтительно от 10 минут до 5 часов. Полученное описанным образом соединение (VI) может быть подвергнуто следующей реакции либо в виде реакционной смеси, либо после частичной очистки, а может быть легко выделено известным самим по себе способом и очищено обычными методами очистки, такими, как перекристаллизация, перегонка, хроматография и т.д.
Когда в вышеописанных реакциях исходные соединения имеют амино, карбоксил или/и гидрокси в качестве заместителя (ей), в эти функциональные группы соединений могут быть введены защитные группы, обычно используемые в химии пептидов, и целевые соединения могут быть получены путем удаления защитных групп, когда это необходимо.
Защитная группа для функциональной аминогруппы включает, например, формильную и C1-6 алкилкарбонильную (например, ацетил, пропионил и т.д.), фенилкарбонильную, C1-6 алкоксикарбонильную (например, метоксикарбонил, этоксикарбонил и т. д. ), фенилоксикарбонильную, С7-10 аралкилоксикарбонильную (например, бензилоксикарбонил и т. д. ), тритильную и фталоильную группы, каждая из которых может быть замещенной. Заместителем здесь может быть, например, галоген (например, фтор, хлор, бром, йод и т.д.), C1-6 алкилкарбонил (например, ацетил, пропионил, валерил и т.д.), нитро и т.д. Число возможных заместителей составляет 1-3.
Защитная группа для функциональной карбоксильной группы включает, например, C1-6 алкильную (например, метил, этил, пропил, изопропил, бутил, трет-бутил и т. д. ), фенильную, тритильную и силильную группы, каждая из которых может быть замещенной. Заместителем здесь может быть, например, галоген (например, фтор, хлор, бром, йод и т.д.), формил, C1-6 алкилкарбонил (например, ацетил, пропионил, бутилкарбонил и т. д.), нитро, C1-6 алкил (например, метил, этил, трет-бутил и т.д.) и C6-10 арил (например, фенил, нафтил и т.д.) и т.д. Число возможных заместителей составляет 1-3.
Защитная группа для функциональной гидроксигруппы включает, например, C1-6 алкильную (например, метил, этил, пропил, изопропил, бутил, трет-бутил и т.д.), фенильную, C7-11 аралкильную (например, бензильную и т.д.), формильную, C1-6 алкилкарбонильную (например, ацетил, пропионил и т.д.), фенилоксикарбонильную, C7-11 аралкилоксикарбонильную (например, бензилоксикарбонил и т. д. ), тетрагидропиранильную, тетрагидрофуранильную и силильную группы, каждая из которых может быть замещенной. Заместителем может быть, например, галоген (например, фтор, хлор, бром, йод и т.д.), C1-6алкил (например, метил, этил, трет-бутил и т.д.), C7-11аралкил (например, бензил и т. д. ), C6-10 арил (например, фенил, нафтил и т.д.), нитро и т.д. Число возможных заместителей составляет 1-4.
Защитные группы могут быть удалены известными методами или аналогичными им методами. Можно, например, назвать обработку кислотой, основанием, ультрафиолетовым светом, гидразином, фенилгидразином, N-метилдитиокарбаматом натрия, тетрабутиламмонийфторидом, ацетатом палладия или тому подобным или восстановление.
Во всяком случае, при синтезировании соединения (I) можно при необходимости использовать независимо или в сочетании любые известные реакции удаления защитных групп, ацилирования, алкилирования, гидрирования, окисления, восстановления, удлинения углеродной цепи и обмена заместителями. Указанные реакции могут быть осуществлены, методами, например, описанными в Shin Jikken Kagaku Koza (New Series in Experimental Chemistry) 14 и 15, 1977 (Maruzen Publishing Co.), и т.д.
Когда целевое соединение получают в свободной форме, его можно преобразовать в соль традиционными методами. Когда целевое соединение получают в виде соли, его можно преобразовать в свободное соединение или другой вид соли. Полученное таким образом соединение (I) может быть выделено из реакционной смеси и очищено известными как таковыми методами, такими, как диспропорционирование, концентрирование, экстракция растворителем, дробная перегонка, кристаллизация, перекристаллизация и хроматография.
В случае, когда соединение (I) существует в виде конфигурационных изомеров (изомеров положения), диастереомеров, конформеров, соответственные изомеры могут быть выделены вышеописанными методами фракционирования и очистки. Когда соединение (I) представляет собой рацемическое соединение, его можно разделить на (S) и (R) формы любым традиционным методом оптического разделения. Соединение (I) может быть в форме гидрата или безводного соединения.
Соединение (I) по настоящему изобретению и соединение (Ia) обладают высоким аффинитетом к натриевому каналу, особенно к участку 2, при низкой токсичности и низком риске оказания вредных эффектов, благодаря чему они полезны в качестве безопасных лекарственных средств.
Соединения (I) и (Ia) действуют как модуляторы натриевых каналов у млекопитающих (например, мышь, крыса, хомяк, кролик, кошка, собака, свинья, крупный рогатый скот, овца, обезьяна, человек и т.д.) и могут быть использованы в качестве профилактических и/или лечебных средств для различных заболеваний и расстройств центральной нервной системы, таких, как ишемия центральной нервной системы, травма центральной нервной системы (например, травма головного мозга, повреждение спинного мозга, травма от резкого движения конечности и т. д. ), эпилепсия, нейродегенеративные заболевания (например, боковой амиотрофический склероз (ALS), болезнь Альцгеймера, хорея Хантингтона, болезнь Паркинсона, диабетическая невропатия и т.д.), сосудистая деменция (например, многоинфарктная деменция, болезнь Бинсвангера и т. д. ), маниакально-депрессивный психоз, депрессия, шизофрения, хроническая боль, невралгия тройничного нерва, мигрень, отек мозга и так далее. Кроме того, соединения (I) и (Ia) обладают высокой противоокислительной активностью и модулирующей активностью в отношении транспорта допамина и потому полезны в качестве профилактических и лечебных средств для вышеуказанных заболеваний и ишемических сердечно-сосудистых заболеваний (например, инфаркта миокарда, стенокардии и т.д.), атеросклероза и других заболеваний. В том числе в качестве профилактического и/или лечебного средства для ишемии центральной нервной системы, травмы центральной нервной системы, нейродегенеративных заболеваний и отека головного мозга.
Каждое из соединений (I) и (Ia) лишь незначительно токсично и может быть безопасно введено в отдельности или в виде фармацевтической композиции, приготовленной путем смешивания его с фармакологически приемлемым носителем в соответствии с существующей фармацевтической практикой в таких лекарственных формах, как таблетки (включая драже и таблетки, покрытые пленкой), порошки, гранулы, капсулы (включая мягкие капсулы), растворы, инъекционные растворы, суппозитории и лекарственные формы с управляемым высвобождением, перорально или другими способами введения (например, местно, ректально, внутривенно и т. д. ). Относительное содержание соединения (I) или (Ia) в фармацевтической композиции по настоящему изобретению может находиться в интервале от примерно 0,01% до примерно 100% по массе. Доза зависит от особенностей пациента или реципиента, способа введения, заболевания, которое нужно лечить, и других факторов. Вообще говоря, при введении взрослому пациенту инъецируемой лекарственной формы для лечения травмы головного мозга рекомендуемая доза по активному компоненту [соединение (I) или соединение (Ia)] составляет примерно 0,05-30 мг/кг массы тела, предпочтительно примерно 0,1-20 мг/кг массы тела, более предпочтительно примерно 0,1-5 мг/кг массы тела и еще более предпочтительно примерно 0,1-2 мг/кг массы тела, в сутки в виде разовой дозы или нескольких раздельных доз. Соединение (I) или (Ia) может быть использовано в сочетании с другими активными веществами (например, антитромботическим средством, таким, как аргатробан и т.д., тромболитическим средством, таким, как урокиназа, тканевый активатор плазминогена и т.д., ингибитором агрегации тромбоцитов, таким, как озагрел и т.д., антикоагулянтом, таким, как гепарин и т.д., антагонистом гистаминовых рецепторов, таким, как циметидин, фамотидин и т. д., лекарственным средством против болезни Паркинсона, таким, как допамин, леводопа и т.д., антиконвульсивным средством группы гидантоина, таким, как фенитоин, мефенитоин, этотоин и т.д., антиконвульсивными или аналгезирующими средствами группы барбитала, такими, как фенобарбитал, мефобарбитал, метарбитал и т.д., блокатором кальциевых каналов, таким, как дилтиазем и т.д., имипенем-циластатин-натрием, глицерином и т.д.). Так, любое из этих других активных веществ может быть традиционным образом приготовлено в сочетании с соединением (I) или (Ia) с получением фармацевтической композиции (например, таблеток, порошков, гранул, капсул (включая мягкие капсулы), растворов, инъекционных растворов, суппозиториев, лекарственных форм с управляемым высвобождением и т.д.).
Фармакологически приемлемый носитель, который может быть использован для изготовления фармацевтической композиции по настоящему изобретению, включает различные виды органических или неорганических носителей, которые обычно используют в фармацевтической практике, такие, как наполнитель, смазывающее вещество, связывающее вещество и разрыхляющее вещество для твердых препаратов или растворитель, солюбилизатор, суспендирующее вещество, изотонизирующее вещество, буфер и местное анестезирующее или успокаивающее вещество для жидких препаратов. При необходимости могут быть также включены такие распространенные добавки, как антисептик, антиоксидант, краситель, подслащиватель, адсорбент, смачивающее вещество и т.д.
Наполнитель включает лактозу, сахарозу, D-маннит, крахмал, кукурузный крахмал, кристаллическую целлюлозу, светлый кремневый ангидрид и т.д.
Смазывающее вещество включает стеарат магния, стеарат кальция, тальк, коллоидальный диоксид кремния и т.д.
Связывающее вещество включает, например, кристаллическую целлюлозу, сахарозу, D-маннит, декстрин, гидроксипропилцеллюлозу, поливинилпирролидон, крахмал, тростниковый сахар, желатин, метилцеллюлозу, натрий-карбоксиметилцеллюлозу и т.д.
Разрыхляющее вещество включает, крахмал, карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, натрий-кроскармелозу, натрий-карбоксиметилкрахмал, L-гидроксипропилцеллюлозу и т.д.
Растворитель включает воду для инъекции, спирт, пропиленгликоль, макроголы, сезамовое масло, кукурузное масло, оливковое масло и т.д.
Солюбилизатор включает полиэтиленгликоль, пропилен-гликоль, D-маннит, бензилбензоат, этанол, трисаминометан, холестерин, триэтаноламин, карбонат натрия, цитрат натрия и т.д.
Суспендирующее вещество включает самые разнообразные поверхностно-активные вещества, такие, как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовая кислота, лецитин, бензалконийхлорид, бензэтонийхлорид, глицерилмоно-стеарат и т.д., и гидрофильные макромолекулярные вещества, такие, как поливиниловый спирт, поливинилпирролидон, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и т.д.
Изотонизирующее вещество включает глюкозу, D-сорбит, хлорид натрия, глицерин, D-маннит и т.д.
Буфер включает фосфат, ацетат, карбонат, цитрат и т.д.
Местное анестезирующее вещество включает бензиловый спирт и т.д.
Антисептик включает сложные эфиры п-гидробензойной кислоты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и т.д.
Антиоксидант включает сульфиты, аскорбиновую кислоту, α-токоферол и т.д.
Наилучший способ осуществления изобретения
Следующие далее ссылочные примеры, примеры, примеры изготовления лекарственных средств и экспериментальные примеры предназначены для более подробного описания настоящего изобретения и ни в коей мере не должны рассматриваться как ограничивающие объем изобретения.
При использовании в следующих ссылочных и рабочих примерах термин "комнатная температура" обычно означает примерно 10-35oC. Символ % означает процент по массе, если не указано иное, но все значения выхода представлены в моль/моль%.
Используемым силикагелем в основном был NH-DM1020 производства Fuji Silysia Chemical Ltd.
Другие сокращения, использованные в тексте, имеют следующие значения:
s (с): синглет
d (д): дублет
t (т): триплет
q (кв): квартет
m (м): мультиплет
dd (дд): двойной дублет
dt (дт): двойной триплет
quintet: квинтет
br (ш): широкий
J: константа взаимодействия
Hz (Гц): Герц
CDCl3 : дейтерированный хлороформ
DMSO-d6 (ДМСО-d6): дейтерированный диметилсульфоксид
CO3OD: дейтерированный метанол
1H-NMR (1H-ЯМР): протонный ядерный магнитный резонанс
Примеры
Ссылочный пример 1
2,3-Дигидро-2-[[4-(4-метоксифенил)-1-пиперазинил]метил]-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
В автоклаве перемешивали под газообразным аргоном при 180oC в течение 15 часов смесь 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,5 г), 1-(4-метоксифенил)пиперазина (2,0 г) и триэтиламина (1,6 г). После охлаждения реакционную смесь обрабатывали насыщенным раствором гидрокарбоната натрия (NaHCO3) в воде и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния (MgSO4), после чего отгоняли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат: гексан = 9:1) и обрабатывали 4 Н раствором хлороводорода в этаноле с получением тригидрохлорида. Этот продукт перекристаллизовывали из этанола с получением 0,53 г указанного в заголовке соединения. Выход 20%.
Т. пл. 194-196oC.
1H-NMR (DMSO-d6) δ: 1,62 (3H, s), 2,08 (3H, s), 2,25 (6H, s), 3,05 (1H, d, J = 16,2 Hz), 3,34-3,63 (11H, m), 3,71 (3H, s), 6,88 (2H, d, J = 9,0 Hz), 7,05 (2H, d, J = 9,0 Hz), 9,92 (2H, br, s).
Ссылочный пример 2
2-[[4-(2-Хлорфенил)-1-пиперазинил] метил]-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминдигидрохлорид
Суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,4 г), 1-(2-хлорфенил)пиперазингидрохлорида (1,4 г) и карбоната калия (2,1 г) в N,N-диметилформамиде (15 мл) перемешивали под газообразным азотом при 145oC в течение 20 часов. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия (Na2SO4) и силикагелем (элюированным этилацетатом) и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 5:1-2:1). Полученный в результате этого 2-[[4-(2-хлорфенил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамин растворяли в метаноле и прибавляли стехиометрический избыток 10%-ного раствора хлороводорода в метаноле. Смесь концентрировали при пониженном давлении и перекристаллизовывали из смеси этанол-диэтиловый эфир с получением 1,0 г указанного в заголовке соединения. Выход 44%.
Т. пл. 167-171oC.
1H-NMR (DMSO-d6) δ: 1,61 (3H, s), 2,07 (3H, s), 2,23 (3H, s), 3 2,25 (3H, s), 3,06 (1H, d, J = 16,6 Hz), 3,1-3,9 (11H, m), 7,0-7,25 (2H, m), 7,3-7,5 (2H, m).
Ссылочный пример 3
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4- (4-пиридил)-1-пиперидинил] метил] -5-бензофуранамин
Смесь 2- бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (0,85 г), 4-(4-пиперидинил) пиридина (0,97 г) и триэтиламина (1,3 мл) перемешивали под газообразным азотом при 180oC в течение 15 часов. К этой реакционной смеси прибавляли насыщенный водный раствор NaHCO3 и этилацетат. Органический слой отделяли и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4 фильтровали и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метанол = 20:1) и кристаллизовали из смеси этилацетат-гексан с получением 0,77 г указанного в заголовке соединения. Выход 70%.
Т. пл. 126-128oC.
1H-NMR (CDCl3) δ: 1,45 (3H, s), 1,5-1,9 (4H, m), 2,0-2,5 (3H, m), 2,08 (6H, s), 2,11 (3H, s), 2,52 (1H, d, J = 13,9 Hz), 2,61 (1H, d, J = 13,9 Hz), 2,83 (1H, d, J = 15,4 Hz), 2,95-3,3 (2H, m), 3,13 (1H, d, J = 15,4 Hz), 7,1-7,2 (2H, m), 8,45-8,55 (2H, m).
Ссылочный пример 4
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - N-фенил-4-пиперидинамин
Использовав N-фенил-4-пиперидинамин и в других отношениях действуя так, как в ссылочном примере 3, получили указанное в заголовке соединение. Выход 69%.
Т. пл. 116-118oC (кристаллизованное из смеси этилацетат-гексан).
1H-NMR (CDCl3) δ: 1,2-1,6 (2H, m), 1,43 (3H, s), 1,9-2,2 (2H, m), 2,07 (6H, s), 2,09 (3H, s), 2,2-2,45 (2H, m), 2,50 (1H, d, J = 13,8 Hz), 2,58 (1H, d, J = 13,8 Hz), 2,8-2,95 (1H, m), 2,81 (1H, d, J = 15,0 Hz), 3,0-3,35 (2H, m), 3,11 (1H, d, J = 15,0 Hz), 6,5-6,7 (3H, m), 7,1-7,2 (2H, m).
Ссылочный пример 5
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -4-(4-хлорфенил)-4-пиперидинол
Суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,4 г) и 4-(4-хлорфенил)-4-гидроксипиперидина (1,3 г) в ксилоле (10 мл) перемешивали под газообразным азотом при 120oC в течение 1,5 часов и затем нагревали с обратным холодильником в течение 16 часов. После этого прибавляли 0,85 г 4-(4-хлорфенил)-4-гидроксипиперидина и смесь нагревали с обратным холодильником в течение 24 часов. После охлаждения реакционную смесь фильтровали и промывали диэтиловым эфиром. Фильтрат экстрагировали 1 Н хлороводородной кислотой и водный слой делали слабо кислым насыщенным водным раствором гидрокарбоната натрия (NaHCO3). Этот водный слой промывали диэтиловым эфиром и делали слабо основным насыщенным водным раствором NaHCO3. Этот раствор экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток кристаллизовали из смеси диэтиловый эфир-гексан с получением 0,58 г указанного в заголовке соединения. Выход 28%.
Т. пл. 118-120oC.
1H-NMR (CDCl3) δ : 1,45 (3H, s), 1,5-1,8 (2H, m), 1,9-2,2 (2H, m), 2,07 (6H, s), 2,10 (3H, s), 2,5-2,7 (4H, m), 2,7-2,9 (1H, m), 2,83 (1H, d, J = 15,4 Hz), 2,9-3,05 (1H, m), 3,13 (1H, d, J = 15,4 Hz), 7,29 (2H, d, J = 8,8 Hz), 7,42 (2H, d, J = 8,8 Hz).
Ссылочный пример 6
N-[2,3-Дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперидинил)метил]бензофуран-5-ил]ацетамид
К суспензии 2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперидинил)метил]-5-бензофуранаминдигидрохлорида (1,3 г) в тетрагидрофуране (10 мл) прибавляли раствор карбоната натрия (0,95 г) в воде (5 мл) при охлаждении льдом и смесь перемешивали 5 минут. Затем прибавляли по каплям 0,26 мл ацетилхлорида и смесь перемешивали при комнатной температуре в течение 15 минут. Эту реакционную смесь разбавляли водой и экстрагировали 2 порциями этилацетата. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением 1,1 г указанного в заголовке соединения. Выход 90%.
Т. пл. 94-96oC.
1H-NMR (CDCl3) δ : 1,4-1,5 (3H, m), 1,6-1,9 (4H, m), 2,0-2,7 (17H, m), 2,81 (1H, d, J = 15,4 Hz), 2,9-3,3 (3H, m), 6,5-6,7 (1H, m), 7,1-7,4 (5H, m).
Ссылочный пример 7
N-[2,3-Дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперазинил)метил]бензофуран-5-ил]ацетамид
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперазинил)метил]-5-бензофуранамин, повторяли в других отношениях процедуру ссылочного примера 6 с получением N-[2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперазинил)метил] бензофуран-5-ил]ацетамид. Выход 94%. Этот продукт растворяли в тетрагидрофуране и, разбавив раствор метанолом, прибавляли стехиометрический избыток 10% раствора HCl в метаноле. Смесь концентрировали при пониженном давлении и кристаллизовали из смеси этанол-диэтиловый эфир с получением указанного в заголовке соединения.
Т. пл. 195-199oC.
1H-NMR (CDCl3) δ : 1,62 (3H, s), 1,97 (3H, s), 1,99 (3H, s), 2,02 (3H, s), 2,05 (3H, s), 3,01 (1H, d, J = 15,8 Hz), 3,1-4,2 (11H, m), 6,85 (1H, t, J = 7,1 Hz), 6,99 (2H, d, J = 8,2 Hz), 7,26 (2H, t, J = 7,7 Hz), 9,11 (0,5H, s), 10,5-10,9 (0,5H, br).
Ссылочный пример 8
N-Этил-2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперидинил)метил] -5-бензофуранамин
К раствору N-[2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1-пиперидинил)метил] бензофуран-5-ил] ацетамида (0,56 г) в тетрагидрофуране (8 мл) прибавляли 0,11 г литийалюминийгидрида небольшими порциями при охлаждении льдом. Затем смесь нагревали с обратным холодильником в течение 30 часов. После этого реакционную смесь охлаждали льдом, прибавляли 0,42 г Hyflo-Super-Cel (торговый знак) и этилацетат, после чего прибавляли воду (0,2 мл). Смесь энергично перемешивали, затем фильтровали и фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (гексан: этилацетат = 5:1) с получением указанного в заголовке соединения. Выход 63%.
Т. пл. 84-86oC.
1H-NMR (CDCl3) δ : 1,20 (3H, t, J = 7,1 Hz), 1,46 (3H, s), 1,6-1,9 (4H, m), 2,08 (3H, s), 2,15 (3H, s), 2,18 (3H, s), 2,2-2,6 (3H, m), 2,52 (1H, d, J = 14,0 Hz), 2,61 (1H, d, J = 14,0 Hz), 2,75-3,1 (4H, m), 3,09 (1H, d, J = 15,4 Hz), 3,15-3,3 (1H, m), 7,1-7,4 (5H, m).
Ссылочный пример 9
N-Этил-2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперазинил)метил] -5-бензофуранаминтригидрохлорид
Использовав N-[2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперазинил)метил] бензофуран-5-ил]ацетамид, повторяли в других отношениях процедуру ссылочного примера 8 с получением N-этил-2,3-дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперазинил)метил]-5-бензофуранамин. Этот продукт растворяли в метаноле и прибавляли избыток 10%-ного раствора HCl в метаноле. Эту смесь концентрировали при пониженном давлении и остаток кристаллизовали из смеси этанол-диэтиловый эфир с получением указанного в заголовке соединения. Выход 64%.
Т. пл. 210-216oC.
1H-NMR (DMSO-d6) δ : 1,33 (3H, t, J = 7,1 Hz), 1,64 (3H, s), 2,08 (3H, s), 2,32 (3H, s), 2,35 (3H, s), 3,0-3,9 (13H, m), 3,07 (1H, d, J = 16,0 Hz), 6,86 (1H, t, J = 7,2 Hz), 7,00 (2H, d, J = 8,0 Hz), 7,26 (2H, t, J = 7,7 Hz).
Ссылочный пример 10
2,3-Дигидро-2,4,6,7-тетраметил-2-[(2,3,4,5-тетрагидро-1H-3-бензазепин-3-ил)метил]-5-бензофуранаминдигидрохлорид
Использовав 2,3,4,5-тетрагидро-1H-3-бензазепин) повторяли в других отношениях процедуру ссылочного примера 3 с получением 2,3-дигидро-2,4,6,7-тетраметил-2-[(3H-1,2,4,5-тетрагидро-3-бензазепин-3-ил)метил] -5- бензофуранамина. Этот продукт растворяли в метаноле и прибавляли избыток 10%-ного раствора HCl в метаноле. Эту смесь концентрировали при пониженном давлении и остаток кристаллизовали из смеси метанол-диэтиловый эфир с получением указанного в заголовке соединения. Выход 71%.
Т. пл. 180-183oC.
1H-NMR (DMSO-d6) δ : 1,64 (3H, s), 2,09 (3H, s), 2,24 (6H, s), 3,0-3,9 (11H, m), 3,08 (1H, d, J = 16,6 Hz), 7,19 (4H, s).
Ссылочный пример 11
4-Бензилоксипиперидингидрохлорид
К раствору трет-бутил-4-гидрокси-1-пиперидинкарбоксилата (5,0 г) в тетрагидрофуране (50 мл) прибавляли гидрид натрия (1,0 г, 66%-ная дисперсия в жидком парафине) и смесь перемешивали при комнатной температуре в течение 10 минут. Затем прибавляли 3,6 мл бензилбромида и смесь нагревали с обратным холодильником в течение 1 часа. Реакционную смесь вливали в водный раствор хлорида аммония и экстрагировали 2 порциями этилацетата. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в 20 мл этилацетата с последующим добавлением 15 мл 4 Н раствора HCl в этилацетате и смесь перемешивали при комнатной температуре в течение 2 часов. Собрав осадок, получили 4,4 г указанного в заголовке соединения. Выход 77%.
Т. пл. 134-139oC.
1H-NMR (CDCl3) δ : 1.9-2,3 (4H, m), 3,1-3,5 (4H, m), 3,7-3,8 (1H, m), 4,52 (2H, s), 7,2-7,45 (5H, m), 9,2-9,7 (2H, br).
Ссылочный пример 12
4-[(3-Фенил-2-пропенил)окси]пиперидингидрохлорид
Использовав 3-бром-1-фенил-1-пропен и выполнив процедуру, описанную в ссылочном примере 11, получили указанное в заголовке соединение. Выход 42%.
Т. пл. 211-213oC.
1H-NMR (CDCl3) δ : 1,9-2,3 (4H, m), 3,1-3,5 (4H, m), 3,7-3,8 (1H, m), 4,15 (2H, dd, J = 5,8, 1,3 Hz), 6,24 (1H, dt, J = 16,2, 5,8 Hz), 6,60 (1H, d, J = 16,2 Hz), 7,2-7,5 (5H, m), 9,2-9,8 (2H, br).
Ссылочный пример 13
2,3-Дигидро-2,4,6,7-тетраметил-2-[(1-пиперазинил)метил] -5- бензофуранаминтригидрохлорид
Смесь 2,3-дигидро-2,4,6,7-тетраметил-2-[(4-бензил-1- пиперазинил)метил] -5-бензофуранамина (12 г) 10%-ного палладия на углероде (1,0 г, 50%-ный водный) и 150 мл этанола перемешивали в газообразном водороде при давлении 5 атмосфер и 50oC в течение 15 часов. После охлаждения реакционной смеси отфильтровывали катализатор и фильтрат концентрировали. Остаток перекристаллизовывали из смеси этилацетат-диизопропиловый эфир с получением 7,1 г свободного основания указанного в заголовке соединения. Выход 80%. Это свободное основание обрабатывали 4,8 Н раствором HCl в этаноле, получив в результате соответствующий гидрохлорид, который перекристаллизовывали из смеси метанол-этилацетат с получением указанного в заголовке соединения.
Т. пл. 228-231oC.
1H-NMR (DMSO-d6) δ : 1,53 (3H, s), 2,05 (3H, s), 2,24 (6H, s), 2,8-4,5 (12H, m), 9,2-10,0 (3H, br, s).
Ссылочный пример 14
1-[2-(Дифенилметокси)этил]пиперазин
В реакторе, снабженном водоотделителем (ловушка Дина-Старка), нагревали с обратным холодильником в течение 6 часов смесь бензгидрола (5,0 г), 1-(2-гидроксиэтил)пиперазина (3,5 г), камфор-10-сульфоновой кислоты (14 г) и толуола (80 мл). Затем прибавляли 1 Н хлороводородную кислоту и смесь разделяли на две фазы. Водный слой подщелачивали 5 Н водным раствором гидроксида натрия, насыщенным хлоридом натрия, и экстрагировали хлороформом. Экстракт промывали небольшим количеством насыщенного водного раствора NaCl, сушили над MgSO4 и концентрировали при пониженном давлении с получением 1,9 г указанного в заголовке соединения. Выход 24%. Это соединение дополнительно не очищали, а непосредственно подвергали следующей реакции.
Масло.
1H-NMR (CDCl3) δ : 2,42-2,54 (4H, m), 2,60 (2H, t, J = 6,0 Hz), 2,89 (4H, t, J = 5,0 Hz), 3,60 (2H, t, J = 6,0 Hz), 5,37 (1H, s), 7,20-7,38 (10H, m).
Ссылочный пример 15
3-(Дифенилметокси)пропилбромид
В реакторе, снабженном водоотделителем, нагревали с обратным холодильником в течение 2 часов смесь бензгидрола (5,0 г), 3-бром-1-пропанола (3,8 г), камфор-10-сульфоновой кислоты (1,0 г) и толуола (80 мл). Эту реакционную смесь концентрировали и остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 95:5) с получение 7,0 г указанного в заголовке соединения. Выход 85%.
Масло.
1H-NMR (CDCl3) δ : 2,16 (2H, quintet, J = 6,0 Hz), 3,58 (4H, t, J = 6,0 Hz), 5,36 (1H, s), 7,20-7,38 (10H, m).
Ссылочный пример 16
1-[3-(Дифенилметокси)пропил]пиперазин
В 20 мл этанола растворяли 20 г пиперазина при нагревании. Затем прибавляли по каплям раствор 3-(дифенилметокси)пропилбромида (7,0 г) в этаноле (20 мл) и смесь перемешивали при 70oC в течение 1 часа. Эту реакционную смесь разбавляли насыщенным водным раствором NaCl и экстрагировали хлороформом. Экстракт промывали насыщенным водным раствором NaCl для удаления исходного пиперазина, сушили над MgSO4, и концентрировали при пониженном давлении, получив в результате 7,1 г указанного в заголовке соединения. Выход 99%). Этот продукт дополнительно не очищали, а непосредственно подвергали следующей реакции.
Масло.
1H-NMR (CDCl3) δ : 1,75-1,92 (2H, m), 2,38-2,50 (6H, m), 2,88 (4H, t, J = 5,0 Hz), 3,50 (2H, t, J = 6,2 Hz), 5,33 (1H, s), 7,18-7,41 (10H, m).
Ссылочный пример 17
4-(Дифенилметокси)бутилхлорид
Использовав в качестве исходных материалов бензгидрол и 4-хлор-1-бутанол, в других отношениях повторяли процедуру ссылочного примера 15 с получением указанного в заголовке соединения. Выход 90%.
Масло.
1H-NMR (CDCl3) δ : 1,52-1,84 (4H, m), 3,45 (2H, t, J = 6,0
Hz), 3,53 (2H, t, J = 6,6 Hz), 5,32 (1H, s), 7,15-7,44 (10H, m).
Ссылочный пример 18
1-[4-(Дифенилметокси)бутил]пиперазин
Использовав 4-(дифенилметокси)бутилхлорид и пиперазин, в других отношениях повторяли процедуру ссылочного примера 16 с получением указанного в заголовке соединения. Выход 54%.
Масло.
1H-NMR (CDCl3) δ : 1,36-1,52 (2H, m), 1,60-1,73 (2H, m), 2,28-2,42 (6H, m), 2,88 (4H, t, J = 4,8 Hz), 3,45 (2H, t, J = 6,6 Hz), 5,33 (1H, s), 7,20-7,40 (10H, m).
Ссылочный пример 19
5-(Дифенилметокси)пентилхлорид
Использовав бензгидрол и 5-хлор-1-бутанол, в других отношениях повторяли процедуру ссылочного примера 15 с получением указанного в заголовке соединения. Выход 96%.
Масло.
1H-NMR (CDCl3) δ : 1,45-1,85 (6H, m), 3,46 (2H, t, J = 6,2 Hz), 3,53 (2H, t, J = 6,6 Hz), 5,33 (1H, s), 7,18-7,42 (10H, m).
Ссылочный пример 20
1-[5-(Дифенилметокси)пентил]пиперазин
Использовав 5-(дифенилметокси)пентилхлорид и пиперазин, в других отношениях повторяли процедуру ссылочного примера 16 с получением указанного в заголовке соединения. Выход 93%.
Масло.
1H-NMR (CDCl3) δ : 1,34-1,55 (4H, m), 1,58-1,74 (2H, m), 2,26-2,42 (6H, m), 2,89 (4H, t, J = 5,0 Hz), 3,44 (2H, t, J = 6,4 Hz), 5,32 (1H, s), 7,18-7,42 (10H, m).
Ссылочный пример 21
6-(Дифенилметокси)гексилхлорид
Использовав бензгидрол и 6-хлор-1-гексанол, в других отношениях повторяли процедуру ссылочного примера 15 с получением указанного в заголовке соединения. Выход 88%.
Масло.
1H-NMR (CDCl3) δ : 1,40-1,51 (4H, m), 1,60-1,85 (4H, m), 3,45 (2H, t, J = 6,4 Hz), 3,52 (2H, t, J = 6,8 Hz), 5,33 (1H, s), 7,20-7,36 (10H, m).
Ссылочный пример 22
1-[6-(Дифенилметокси)гексил]пиперазин
Использовав 6-(дифенилметокси)гексилхлорид и пиперазин, в других отношениях повторяли процедуру ссылочного примера 16 с получением указанного в заголовке соединения. Выход 94%.
Масло.
1H-NMR (CDCl3) δ : 1,22-1,54 (6H, m), 1,58-1,71 (2H, m), 2,25-2,42 (6H, m), 2,89 (4H, t, J = 4,8 Hz), 3,41-3,49 (2H, m), 5,32 (1H, s), 7,19-7,39 (10H, m).
Ссылочный пример 23
4-[(Дифенилметокси)метил]пиперидин
В реакторе, снабженном водоотделителем, нагревали с обратным холодильником в течение 2 часов смесь бензгидрола (3,7 г), 4-пиперидинметанола (2,3 г), камфор-10-сульфоновой кислоты (7,0 г) и толуола (30 мл). После охлаждения прибавляли 35 мл 1 Н водного раствора гидроксида натрия и реакционную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении с получением 5,3 г указанного в заголовке соединения. Выход 94%. Этот продукт далее не очищали, а непосредственно подвергали следующей реакции.
Масло.
1H-NMR (CDCl3 δ : 1,08-1,32 (2H, m), 1,72-1,88 (3H, m), 2,61 (2H, dt, J = 2,2, 12,0 Hz), 3,04-3,15 (2H, m), 3,29, (2H, d, J = 6,0 Hz), 5,31 (1H, s), 7,15-7,40 (10H, m).
Ссылочный пример 24
4-[2-(Дифенилметокси)этил]пиперидин
Использовав бензгидрол и 4-пиперидинэтанол, в других отношениях повторяли процедуру ссылочного примера 23 с получением указанного в заголовке соединения. Выход 94%.
Масло.
1H-NMR (CDCl3) δ : 1,06-1,28 (2H, m), 1,54-1,71 (3H, m), 2,52-2,63 (4H, m), 3,02-3,14 (2H, m), 3,48 (2H, t, J = 6,2 Hz), 5,31 (1H, s), 7,20-7,40 (10H, s).
Ссылочный пример 25
4-[3-(Дифенилметокси)пропил]пиперидин
Использовав бензгидрол и 1-(трет-бутоксикарбонил)-4-пиперидинпропанол, в других отношениях повторяли процедуру ссылочного примера 23 с получением указанного в заголовке соединения. Выход 90%.
Масло.
1H-NMR (CDCl3) δ : 0,99-1,19 (2H, m), 1,21-1,38 (2H, m), 1,60-1,75 (3H, m), 1,97 (2H, s), 2,55 (2H, dt, J = 2,0, 12,0 Hz), 3,03-3,10 (2H, m), 3,43 (2H, t, J = 6,4 Hz), 5,33 (1H, s), 7,17-7,37 (10H, m).
Ссылочный пример 26
1-(2-Фенилэтил)пиперазин
Использовав β-фенетилбромид и пиперазин, в других отношениях повторяли процедуру ссылочного примера 16 с получением указанного в заголовке соединения. Выход 92%.
Масло.
1H-NMR (CDCl3) δ : 2,47-2,63 (6H, m), 2,76-2,91 (2H, m), 2,93 (4H, t, J = 4,8 Hz), 7,18-7,35 (5H, m).
Ссылочный пример 27
4-[Бис (4-фторфенил)метокси]пиперидин
В реакторе, снабженном водоотделителем, нагревали с обратным холодильником в течение 1 часа суспензию 4-гидроксипиперидина (3,0 г), 4,4'-дифторбензгидрола (6,2 г) и моногидрата п-толуолсульфоновой кислоты (6,3 г) в толуоле (30 мл). Эту реакционную смесь промывали 1 Н водным раствором гидроксида натрия и насыщенным водным раствором NaCl и сушили над MgSO4. После фильтрования фильтрат концентрировали при пониженном давлении с получением 9,8 г смеси, содержавшей указанное в заголовке соединение в виде масла. Этот продукт далее не очищали, а непосредственно подвергали следующей реакции.
Ссылочный пример 28
2,3-Дигидро-2-[[4-(4-метоксибензоил)-1-пиперазинил] метил]-2,4,6,7- тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1- пиперазинил)метил]-5-бензофуранамин и п-анисовую кислоту, в других отношениях следовали процедуре примера 10, представленного далее, с получением указанного в заголовке соединения. Выход 67%.
Т. пл. 120-123oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ : 1,43 (3H, s), 2,06 (9H, s), 2,30-2,70 (6H, m), 2,82 (1H, d, J = 15,6 Hz), 3,11 (1H, d, J = 15,6 Hz), 3,20-3,80 (6H, m), 3,83 (3H, s), 6,90 (2H, d, J = 8,8 Hz), 7,36 (2H, d, J = 8,8 Hz).
Ссылочный пример 29
2,3-Дигидро-2-[[4-(3-метоксибензоил)-1-пиперазинил] метил]- 2,4,6,7-тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1- пиперазинил)метил]-5-бензофуранамин и м-анисовую кислоту, в других отношениях следовали процедуре примера 10; представленного далее, с получением указанного в заголовке соединения. Выход 73%.
Т. пл. 95-98oC (перекристаллизованное из смеси этилацетат-гексан).
1H-NMR (CDCl3) δ : 1,43 (3H, s), 2,06 (9H, s), 2,30-2,70 (6H, m), 2,82 (1H, d, J = 15,0 Hz), 3,11 (1H, d, J = 15,0 Hz), 3,20-3,80 (6H, m), 3,82 (3H, s), 6,91-6,97 (3H, m), 7,28-7,40 (1H, m).
Ссылочный пример 30
2,3-Дигидро-2-[[4-(2-метоксибензоил)-1-пиперазинил] метил]- 2,4,6,7-тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1- пиперазинил)метил]-5-бензофуранамин и о-анисовую кислоту, в других отношениях следовали процедуре примера 10, представленного далее, с получением указанного в заголовке соединения. Выход 42%.
Т. пл. 128-131oC (перекристаллизованное из смеси этилацетат-гексан).
1H-NMR (CDCl3) δ : 1,43 (3H, s), 2,06 (9H, s), 2,30-2,70 (5H, m), 2,82 (1H, d, J = 15,0 Hz), 3,00-3,80 (8H, m), 3,81 (3H, s), 6,85-7,01 (2H,m), 7,20-7,40 (2H, m).
Ссылочный пример 31
2-[[4-(3,4-Диметоксибензоил)-1-пиперазинил]метил]-2,3-дигидро- 2,4,6,7-тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1- пиперазинил)метил]-5-бензофуранамин и 3,4-диметоксибензойную кислоту, в других отношениях следовали процедуре примера 10, представленного далее, с получением указанного в заголовке соединения. Выход 74%.
Т. пл. 113-116oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ : 1,43 (3H, s), 2,07 (9H, s), 2,40-2,80 (6H, m), 2,83 (1H, d, J = 14,8 Hz), 3,11 (1H, d, J = 14,8 Hz), 3,20-3,80 (6H, m), 3,89 (3H, s), 3,90 (3H, s), 6,84 (1H, d, J = 9,2 Hz), 6,90-7,00 (2H, m).
Ссылочный пример 32
2-[[4-(4-Хлорбензоил)-1-пиперазинил]метил]-2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1- пиперазинил)метил]-5-бензофуранамин и 4-хлорбензойную кислоту, в других отношениях следовали процедуре примера 10, представленного далее, с получением указанного в заголовке соединения. Выход 64%.
Т. пл. 136-138oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ : 1,43 (3H, s), 2,06 (9H, s), 2,30-2,70 (6H, m), 2,86 (1H, d, J = 14,3 Hz), 3,11 (1H, d, J = 14,3 Hz), 3,30-3,80 (6H, m), 7,30-7,40 (4H, m).
Ссылочный пример 33
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(4-метилбензоил)-1- пиперазинил] метил]-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1- пиперазинил)метил]-5-бензофуранамин и 4-метилбензойную кислоту, в других отношениях следовали процедуре примера 10, представленного далее, с получением указанного в заголовке соединения. Выход 53%.
Т. пл. 131-133oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ : 1,43 (3H, s), 2,07 (9H, s), 2,38 (3H, s), 2,40-2,80 (6H, m), 2,84 (1H, d, J = 14,6 Hz), 3,12 (1H, d, J = 14,6 Hz), 3,20-3,90 (6H, m), 7,10-7,40 (4H, m).
Ссылочный пример 34
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(4-нитробензоил)-1- пиперазинил] метил]-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1- пиперазинил)метил]-5-бензофуранамин и 4-нитробензойную кислоту, в других отношениях следовали процедуре примера 10, представленного далее, с получением указанного в заголовке соединения. Выход 51%.
Т. пл. 154-158oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ : 1,43 (3H, s), 2,06 (9H, s), 2,40-2,80 (6H, m), 2,84 (1H, d, J = 15,2 Hz), 3,12 (1H, d, J = 15,2 Hz), 3,30-3,85 (6H, m), 7,55 (3H, d, J = 8,8 Hz), 8,27 (2H, d, J = 8,8 Hz).
Ссылочный пример 35
4,4-Дифенил-1-бутанол
В 70 мл охлажденного льдом диэтилового эфира суспендировали 1,9 г литийалюминийгидрида, после чего прибавляли по каплям раствор 4,4-дифенилмасляной кислоты (6,0 г) в диэтиловом эфире (50 мл). По окончании капельного прибавления смесь нагревали с обратным холодильником в течение 2 часов и затем давали ей остыть. К этой реакционной смеси прибавляли 1,9 мл воды, 1,9 мл 15%-ного водного раствора гидроксида натрия и 5,7 мл воды в указанном порядке и смесь перемешивали при комнатной температуре в течение 30 минут. Отфильтровывали осадок и фильтрат концентрировали с получением 5,6 г указанного в заголовке соединения. Выход 99%.
Масло.
1H-NMR (CDCl3) δ : 1,20 (1H, br s), 1,40-1,70 (2H, m), 2,10-2,19 (2H, m), 3,65 (2H, t, J = 6,6 Hz), 3,91 (1H, t, J = 7,8 Hz), 7,10-7,40 (10H, m).
Ссылочный пример 36
4,4-Дифенилбутилметансульфонат
К охлажденному льдом раствору 4,4-дифенил-1-бутанола (5,6 г) в дихлорэтане (100 мл) прибавляли по каплям 11 мл триэтиламина и 2,9 мл метансульфонилхлорида в указанном порядке. После 30 минут перемешивания реакционную смесь вливали в воду и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали с получением 7,5 г указанного в заголовке соединения. Выход 99%.
Масло.
1H-NMR (CDCl3) δ : 1,73 (2H, m), 2,18 (2H, dt, J = 7,9, 7,8 Hz), 2,95 (3H, s), 3,91 (1H, t, J = 7,9 Hz), 4,22 (2H, t, J = 6,3 Hz), 7,10-7,40 (10H, m).
Ссылочный пример 37
5,5-Дифенилвалеронитрил
Раствор 4,4-дифенилбутилметансульфоната (7,5 г) и цианида натрия (2,5 г) в диметилсульфоксиде (70 мл) перемешивали при 60oC в течение 15 часов. Дав реакционной смеси остыть, экстрагировали ее диэтиловым эфиром. Экстракт сушили над MgSO4 и концентрировали, в результате чего количественно получили 5,8 г указанного в заголовке соединения.
Масло.
1H-NMR (CDCl3) δ : 1,50-1,72 (2H, m), 2,19 (2H, dt, J = 7,9, 7,8 Hz), 2,34 (2H, t, J = 7,1 Hz), 3,91 (1H, t, J = 7,9 Hz), 7,10-7,40 (10H, m).
Ссылочный пример 38
5,5-Дифенилвалериановая кислота
К раствору 5,5-дифенилвалеронитрила (6,5 г) в метаноле (30 мл) прибавляли 80 мл воды и 10 г гидроксида натрия и смесь нагревали с обратным холодильником в течение 72 часов. Дав реакционной смеси остыть, промывали ее диэтиловым эфиром и доводили до pH 1 концентрированной хлороводородной кислотой. Этот кислый раствор экстрагировали диэтиловым эфиром и экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали. Остаток перекристаллизовывали с получением 5,5 г указанного в заголовке соединения. Выход 86%.
Т. пл. 87-90oC (перекристаллизованное из диэтилового эфира).
1H-NMR (DMSO-d6) δ : 1,30-1,50 (2H, m), 1,95-2,09 (2H, m), 2,23 (2H, t, J = 7,6 Hz), 3,92 (1H, t, J = 7,6 Hz), 7,12-7,35 (10H, m).
Ссылочный пример 39
Этил 4-[(Дифенилметил)амино]-1-пиперидинкарбоксилат
В реакторе, снабженном водоотделителем, нагревали с обратным холодильником в течение 4 часов раствор 1,1-дифенилметиламина (5,0 г) и 1-этоксикарбонил-4-пиперидона (4,7 г) в толуоле (70 мл). Эту реакционную смесь концентрировали при пониженном давлении и остаток растворяли в 50 мл этанола. После охлаждения раствора льдом прибавляли 2,1 г цианборогидрида натрия и небольшое количество бромкрезоловой зелени. Затем прибавляли по каплям 4 Н раствор HCl в метаноле, до тех пор пока реакционная смесь не становилась желтой, после чего смесь перемешивали 20 минут. Эту реакционную смесь вливали в избыточное количество водного раствора гидрокарбоната натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 5:1-65:35) с получением 8,4 г указанного в заголовке соединения. Выход 91%. Аморфное твердое вещество.
1H-NMR (CDCl3) δ : 1,20-1,38 (2H, m), 1,24 (3H, t, J = 7,0 Hz), 1,87-1,96 (2H, m), 2,54-2,66 (1H, m), 2,70-2,84 (2H, m), 3,99-4,17 (2H, m), 4,10 (1H, q, J = 7,0 Hz), 5,02 (1H, s), 7,19-7,41 (10H, m).
Ссылочный пример 40
N-(Дифенилметил)-4-пиперидинаминдигидрохлорид
Раствор этил 4-[(дифенилметил)амино] -1-пиперидинкарбоксилата (42 г) и гидроксида натрия (50 г) в метаноле (300 мл) нагревали с обратным холодильником в течение 24 часов. Эту реакционную смесь разбавляли водой и экстрагировали хлороформом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении с получением N-(дифенилметил)пиперидинамина. Этот продукт преобразовывали в дигидрохлорид, использовав 4 Н раствор HCl в этаноле, и осадок собирали путем фильтрования и высушивали, получив в результате 31 г указанного в заголовке соединения. Выход 73%.
Т. пл. 228-234oC.
1H-NMR (DMSO-d6) δ : 1,91-2,08 (2H, m), 2,40-2,50 (2H, m), 2,78-2,90 (2H, m), 3,07-3,41 (3H, m), 5,75 (1H, br s), 7,34-7,47 (6H, m), 7,87 (4H, d, J = 6,6 Hz), 9,16 (2H, br, s), 10,44 (2H, br, s).
Ссылочный пример 41
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - 4-пиперидинэтанол
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 4-пиперидинэтанол, в других отношениях повторяли процедуру примера 1, представленного далее, с получением указанного в заголовке соединения. Выход 88%.
Т. пл. 94-95oC (перекристаллизованное из смеси этилацетат-гексан).
1H-NMR (CDCl3) δ : 1,20-1,63 (7H, m), 1,42 (3H, s), 1,98-2,18 (2H, m), 2,07 (6H, s), 2,09 (3H, s), 2,46 (1H, d, J = 13,8 Hz), 2,54 (1H, d, J = 13,8 Hz), 2,76-2,88 (2H, m), 2,06-3,14 (2H, m), 3,67 (2H, t, J = 6,6 Hz).
Ссылочный пример 42
Трет-бутил [(2,3-дигидро-2-[[4-(2-гидроксиэтил)-1- пиперидинил]метил]-2,4,6,7-тетраметилбензофуран-5-ил]карбамат
К раствору 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -4-пиперидинэтанола (3,1 г) и ди-трет-бутилдикарбоната (2,1 г) в тетрагидрофуране (20 мл) прибавляли 10 мл 1 Н водного раствора гидроксида натрия и смесь перемешивали при комнатной температуре в течение 2 часов. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат:метанол = 95:5) с получением 3,9 г указанного в заголовке соединения. Выход 98%.
Масло.
1H-NMR (CDCl3) δ : 1,20-1,65 (7H, m), 1,41 (3H, s), 1,50 (9H, s), 2,05-2,21 (2H, m), 2,06 (3H, s), 2,10 (3H, s), 2,12 (3H, s), 2,43-2,58 (2H, m), 2,73-2,90 (2H, m), 3,01-3,13 (2H, m), 3,68 (2H, t, J = 6,6 Hz), 5,78 (1H, br, s).
Ссылочный пример 43
Трет-бутил [2-[[4-(формилметил)-1-пиперидинил] метил] -2,3- дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамат
К раствору диметилсульфоксида (2,6 мл) в дихлорметане (40 мл) при -78oC прибавляли по каплям под газообразным аргоном 2,4 мл оксалилхлорида и смесь перемешивали 20 минут. Затем прибавляли по каплям раствор трет-бутил [(2,3-дигидро-2-[[4-(2-гидроксиэтил)-1-пиперидинил] метил] -2,4,6,7- тетраметилбензофуран-5-ил]карбамата (3,6 г) в дихлорметане (10 мл) и смесь перемешивали еще 1 час. К этой реакционной смеси прибавляли 8,0 мл триэтиламина. Затем смесь при комнатной температуре подщелачивали водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором NaCl и сушили над MgSO4, после чего отгоняли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 1:1 до этилацетата) с получением 3,0 г указанного в заголовке соединения. Выход 85%.
Масло.
1H-NMR (CDCl3) δ : 1,20-2,25 (7H, m), 1,41 (3H, s), 1,50 (9H, s), 2,05 (3H, s), 2,09 (3H, s), 2,12 (3H, s), 2,30-2,36 (2H, m), 2,51 (2H, s), 2,72-2,88 (2H, m), 3,02-3,13 (2H, m), 5,77 (1H, br, s), 9,76 (1H, s).
Ссылочный пример 44
Трет-бутил [2-[[4-[2-(дифенилметил)амино] этил]-1- пиперидинил]метил]-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил]-карбамат
Раствор трет-бутил [2-[[4-(формилметил)-1-пиперидинил]метил]-2,3- дигидро-2,4,6,7-тетраметилбензофуран-5-ил] карбамата (1,5 г) и 1,1-дифенилметиламина (0,60 мл) в этаноле (20 мл) перемешивали на ледяной бане в течение 30 минут. Затем прибавляли 0,26 г цианборогидрида натрия и небольшое количество бромкрезоловой зелени. После этого прибавляли 4 Н раствор HCl в этаноле, до тех пор пока реакционная смесь не становилась желтой. Смесь перемешивали 1 час, после чего ее вливали в избыточное количество водного раствора гидрокарбоната натрия. Смесь экстрагировали этилацетатом и экстракт промывали насыщенным водным раствором NaCl и сушили над MgSO4. Отгоняли при пониженном давлении растворитель и остаток очищали путем колоночной хроматографии на силикагеле (этилацетат:гексан = 4:1 до этилацетата) с получением 1,6 г указанного в заголовке соединения. Выход 77%.
Масло.
1H-NMR (CDCl3) δ : 1,20-1,78 (7H, m), 1,40 (3H, s), 1,50 (9H, s), 2,00-2,21 (2H, m), 2,04 (3H, s), 2,09 (3H, s), 2,12 (3H, s), 2,41-2,60 (4H, m), 2,72-2,84 (2H, m), 2,98-3,12 (2H, m), 4,79 (1H, s), 5,77 (1H, br, s), 7,18-7,40 (10H, m).
Ссылочный пример 45
Трет-бутил [2-[[4-[2-[(3,3-дифенилпропил)амино] этил] -1- пиперидинил] метил]-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамат
Использовав трет-бутил [2-[[4-(формилметил)-1-пиперидинил]метил]- 2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил] карбамат и (3,3-дифенилпропил)амин, в других отношениях повторяли процедуру ссылочного примера 44 с получением указанного в заголовке соединения. Выход 97%.
Аморфное твердое вещество.
1H-NMR (CDCl3) δ : 1,20-1,60 (9H, m), 1,40 (3H, s), 1,50 (9H, s), 2,04 (3H, s), 2,08 (3H, s), 2,11 (3H, s), 2,23-2,70 (8H, m), 2,72-2,86 (2H, m), 2,98-3,11 (2H, m), 3,97 (1H, t, J = 7,8 Hz), 5,79 (1H, br, s), 7,13-7,30 (10H, m).
Ссылочный пример 46
Этил 1-[(5-амино-2,4,6,7-тетраметил-2,3-дигидробензофуран-2- ил)метил] -4-пиперидинкарбоксилат
В автоклаве перемешивали под газообразным азотом при 180oC в течение 15 часов смесь 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (8,4 г), этилизонипекотата (14 г) и ксилола (20 мл). С реакционной смеси брали супернатант и промывали его водой насыщенным водным раствором NaHCO3 и насыщенным водным раствором NaCl, сушили над MgSO4, обрабатывали активированным углем, фильтровали и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 5: 1-2: 1) и кристаллизовали из гексана с получением 2,9 г указанного в заголовке соединения. Выход 27%.
Т. пл. 74-76oC.
1H-NMR (CDCl3) δ : 1,24 (3H, t, J = 7,1 Hz), 1,41 (3H, s), 1,6-1,9 (4H, m), 1,9-2,3 (3H, m), 2,07 (6H, s), 2,09 (3H, s), 2,46 (1H, d, J = 13,7 Hz), 2,54 (1H, d, J = 13,7 Hz), 2,79 (1H, d, J = 15,4 Hz), 2,8-2,95 (1H, m), 3,0-3,2 (1H, m), 3,10 (1H, d, J = 15,4 Hz), 4,12 (2H, q, J = 7,1 Hz).
Ссылочный пример 47
1-[(5-Амино-2,4,6,7-тетраметил-2,3-дигидробензофуран-2- ил)метил]-4-пиперидинкарбоксилат натрия
К раствору этил 1-[(5-амино-2,4,6,7-тетраметил-2,3- дигидробензофуран-2-ил)метил] -4-пиперидинкарбоксилата (10 г) в этаноле (40 мл) прибавляли 5,7 мл 5 Н водного раствора гидроксида натрия и смесь перемешивали под газообразным азотом при комнатной температуре в течение 2 часов. Осадок собирали путем фильтрования и промывали диэтиловым эфиром, получив в результате 7,5 г указанного в заголовке соединения. Выход 75%. Фильтрат концентрировали при пониженном давлении и твердый остаток тщательно промывали диэтиловым эфиром с получением еще 1,4 г указанного в заголовке соединения. Выход 14%. Эти продукты далее не очищали, а непосредственно подвергали следующей реакции.
Т. пл. 237-241oC.
1H-NMR (CD3OD) δ : 1,35 (3H, s) 1,5-1,9 (4H, m), 1,9-2,2 (3H, m), 2,02 (3H, s), 2,05 (6H, s), 2,49 (2H, s), 2,76 (1H, d, J = 15,3 Hz), 2,8-3,0 (1H, m), 3,0-3,2 (1H, m), 3,12 (1H, d, J = 15,3 Hz).
Ссылочный пример 48
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(дифенилметил)-4-пиперидинкарбоксамид
К суспензии 1-[(5-амино-2,4,6,7-тетраметил-2,3-дигидробензофуран- 2-ил)метил]-4-пиперидинкарбоксилата натрия (0,89 г) в N,N-диметилформамиде (10 мл) прибавляли 0,35 г триэтиламингидрохлорида и смесь перемешивали при комнатной температуре в течение 5 минут. К этой смеси прибавляли 0,34 г 1-гидроксибензотриазола и 0,46 г 1,1-дифенилметиламина. Затем прибавляли при охлаждении льдом 0,48 г 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида. Эту смесь перемешивали под газообразным азотом при комнатной температуре в течение 23 часов. Эту реакционную смесь разбавляли водой и экстрагировали 2 порциями этилацетата. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси метанол-диизопропиловый эфир с получением 0,71 г указанного в заголовке соединения. Выход 57%.
Т. пл. 175-177oC.
1H-NMR (CDCl3) δ : 1,40 (3H, s), 1,4-2,3 (7H, m), 2,06 (6H, s), 2,08 (3H, s), 2,46 (1H, d, J = 13,9 Hz), 2,55 (1H, d, J = 13,9 Hz), 2,79 (1H, d, J = 14,8 Hz), 2,9-3,4 (4H, m), 3,10 (1H, d, J = 14,8 Hz), 6,01 (1H, d, J = 7,9 Hz), 6,24 (1H, d, J = 7,9 Hz), 7,1-7,4 (10H, m).
Ссылочный пример 49
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(2,2-дифенилэтил)-4-пиперидинкарбоксамид
Использовав 2,2-дифенилэтиламин, в других отношениях повторяли процедуру ссылочного примера 48 с получением указанного в заголовке соединения. Выход 62%.
Т. пл. 168-170oC (перекристаллизованное из смеси тетрагидрофуран-метанол).
1H-NMR (CDCl3) δ : 1,39 (3H, s), 1,4-2,2 (7H, m), 2,06 (3H, s), 2,07 (3H, s), 2,08 (3H, s), 2,43 (1H, d, J = 14,1 Hz), 2,52 (1H, d, J = 14,1 Hz), 2,78 (1H, d, J = 15,0 Hz), 2,8-3,5 (4H, m), 3,08 (1H, d, J = 15,0 Hz), 3,88 (2H, dd, J = 8,0, 5,5 Hz), 4,18 (1H, t, J = 8,0 Hz), 5,38 (1H, br, t, J = 5,5 Hz), 7,1-7,4 (10H, m).
Ссылочный пример 50
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(3,3-дифенилпропил)-4-пиперидинкарбоксамиддигидрохлорид
Использовав 3,3-дифенилпропиламин, в других отношениях повторяли процедуру ссылочного примера 48 с получением 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - N-(3,3-дифенилпропил)-4-пиперидинкарбоксамида. Этот продукт растворяли в метаноле, прибавляли к нему по каплям стехиометрический избыток 10%-ного раствора хлороводорода в метаноле и смесь концентрировали при пониженном давлении. Остаток кристаллизовали из смеси этанол-диэтиловый эфир с получением указанного в заголовке соединения. Выход 52%.
Т. пл. 166-171oC.
1H-NMR (DMSO-d6) δ : 1,57 (3H, s), 1,7-2,6 (7H, m), 2,05 (3H, s), 2,23 (6H, s), 2,8-3,8 (10H, s), 3,98 (1H, t, J = 7,7 Hz), 7,1-7,4 (10H, m), 8,05 (1H, br, s), 9,4-10,6 (4H, m).
Ссылочный пример 51
Этил 4-[N-бензил-N-(3,3-дифенилпропил)амино]-1-пиперидинкарбоксилат
В реакторе, снабженном водоотделителем, нагревали с обратным холодильником в течение 2 часов раствор 3,3-дифенилпропиламина (4,9 г) и 1-этоксикарбонил-4-пиперидона (4,0 г) в толуоле (100 мл). Эту реакционную смесь концентрировали при пониженном давлении и остаток растворяли в 80 мл этанола. После охлаждения этого раствора льдом прибавляли 1,8 г цианборогидрида натрия и небольшое количество бромкрезоловой зелени. Затем прибавляли по каплям 4 Н раствор хлороводорода в этаноле, до тех пор, пока реакционная смесь не становилась желтой, и после окончания капельного прибавления смесь перемешивали еще 30 минут. Эту реакционную смесь вливали в избыточное количество водного раствора гидрокарбоната натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении с получением этил 4-[(3,3-дифенилпропил)амино] -1-пиперидинкарбоксилата. Этот продукт растворяли в 80 мл N,N-диметилформамида с последующим прибавлением 2,8 мл бензилбромида и 3,2 г карбоната калия и смесь перемешивали при комнатной температуре в течение 2 часов. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4, и концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 9: 1-7: 3) с получением 7,8 г указанного в заголовке соединения. Выход на основе 3,3-дифенилпропиламина составлял 73%.
Масло.
1H-NMR (CDCl3) δ : 1,18-1,40 (5H, m), 1,59-1,68 (2H, m), 2,10-2,20 (2H, m), 2,40-2,62 (5H, m), 3,60 (2H, s), 3,90-4,17 (5H, m), 7,10-7,35 (15H, m).
Ссылочный пример 52
N-Бензил-N-(3,3-дифенилпропил)-4-пиперидинамин
Использовав этил 4-[N-бензил-N-(3,3-дифенилпропил)амино] -1-пиперидинкарбоксилат, в других отношениях повторяли процедуру ссылочного примера 40 с получением указанного в заголовке соединения. Выход 99%.
Масло.
1H-NMR (CDCl3) δ : 1,22-1,43 (2H, m), 1,63-1,75 (2H, m), 2,08-2,19 (2H, m), 2,40-2,61 (5H, m), 3,02-3,08 (2H, m), 3,62 (2H, s), 3,97 (1H, t, J = 7,4 Hz), 7,10-7,36 (15H, m).
Ссылочный пример 53
N-(2-Цианметил-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил)формамид
Раствор N-(2-бромметил-2,3-дигидро-2,4,6,7-тетраметилбензофуран- 5-ил)формамида (20 г) и цианида натрия (17 г) в диметилсульфоксиде (100 мл) перемешивали под газообразным аргоном при 100oC в течение 13 часов. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси этилацетат-диизопропиловый эфир с получением 14 г указанного в заголовке соединения. Выход 86%.
Т. пл. 183-185oC.
1H-NMR (CDCl3) δ : 1,66 (3H, s), 2,08-2,17 (9H, m), 2,73-2,75 (2H, m), 3,03-3,22 (2H, m), 6,65-6,76 (1H, m), 7,96 (0,4H, d, J = 12,2 Hz), 8,41 (0,6H, d, J = 1,4 Hz).
Ссылочный пример 54
5-Амино-2,3-дигидро-2,4,6,7-тетраметил-2-бензофурануксусная кислота
К раствору N-(2-Цианметил-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил)формамида (14 г) в метаноле (50 мл) прибавляли 120 мл 4,6 Н водного раствора гидроксида натрия и смесь нагревали с обратным холодильником под газообразным аргоном в течение 40 часов. Эту реакционную смесь нейтрализовали концентрированной хлороводородной кислотой и экстрагировали хлороформом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4, и концентрировали при пониженном давлении. Остаток кристаллизовали из смеси хлороформ-диизопропиловый эфир с получением 11 г указанного в заголовке соединения. Выход 82%.
Т. пл. 186-188oC.
1H-NMR (DMSO-d6) δ : 1,43 (3H, s), 1,95 (9H, s), 2,60 (2H, s), 2,84 (1H, d, J = 15,6 Hz), 3,18 (1H, d, J = 15,6 Hz).
Ссылочный пример 55
5-[(Трет-бутоксикарбонил)амино] -2,3-дигидро-2,4,6,7- тетраметил-2-бензофурануксусная кислота
К суспензии 5-амино-2,3-дигидро-2,4,6,7-тетраметил-2-бензофурануксусной кислоты (8,3 г) в тетрагидрофуране (50 мл) прибавляли раствор ди-трет-бутилдикарбоната (7,6 г) в тетрагидрофуране (5 мл) и 34 мл 1 Н водного раствора гидроксида натрия и полученную смесь перемешивали при комнатной температуре в течение 30 минут. После охлаждения льдом реакционную смесь подкисляли 0,5 М водным раствором лимонной кислоты и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4, и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 2:3) с получением 11 г указанного в заголовке соединения. Выход 92%.
Масло.
1H-NMR (CDCl3) δ : 1,50-1,53 (9H, m), 1,58 (3H, s), 2,08-2,09 (6H, m), 2,13 (3H, s), 2,78 (2H, br, s), 2,98 (1H, d, J = 15,4 Hz), 3,25 (1H, d, J = 15,4 Hz), 5,80 (1H, s).
Ссылочный пример 56
Трет-бутил [2,3-дигидро-2-(2-гидроксиэтил)-2,4,6,7- тетраметилбензофуран-5-ил]карбамат
К раствору 5-[(трет-бутоксикарбонил)амино]-2,3-дигидро-2,4,6,7- тетраметил-2-бензофурануксусной кислоты (11 г) в 50 мл тетрагидрофурана прибавляли по каплям при охлаждении льдом 64 мл 1 М раствора боран-тетрагидрофуруанового комплекса в тетрагидрофуране и смесь перемешивали при комнатной температуре в течение 12 часов. Эту реакционную смесь вливали в воду и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 2:1) с получением 7,8 г указанного в заголовке соединения. Выход 76%.
Масло.
1H-NMR (CDCl3) δ : 1,47 (3H, s), 1,50 (9H, s), 1,89-2,16 (2H, m), 2,07 (3H, s), 2,10 (3H, s), 2,13 (3H, s), 2,35 (1H, br, s), 2,91 (1H, d, J = 15,4 Hz), 3,06 (1H, d, J = 15,6 Hz), 3,71-3,97 (2H, m), 5,79 (1H, br, s).
Ссылочный пример 57
Трет-бутил [2-(2-бромэтил)-2,3-дигидро-2,4,6,7- тетраметилбензофуран-5-ил]карбамат
К раствору трет-бутил [2,3-дигидро-2-(2-гидроксиэтил)-2,4,6,7- тетраметилбензофуран-5-ил] карбамата (7,7 г) и тетрабромида углерода (8,0 г) в тетрагидрофуране (80 мл) прибавляли при охлаждении льдом 6,3 г трифенилфосфина и смесь перемешивали 30 минут. Эту реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 97:3-4:1) с получением 7,5 г указанного в заголовке соединения. Выход 82%.
Аморфное твердое вещество.
1H-NMR (CDCl3) δ : 1,44 (3H, s), 1,50 (9H, s), 2,07 (3H, s), 2,08 (3H, s), 2,13 (3H, s), 2,26-2,35 (2H, m), 2,88 (1H, d, J = 15,8 Hz), 3,01 (1H, d, J = 15,8 Hz), 3,40-3,49 (2H, m), 5,77 (1H, br, s).
Ссылочный пример 58
Трет-бутил [2-[2-[4-(дифенилметокси)-1-пиперидинил]этил]-2,3- дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамат
Суспензию трет-бутил [2-(2-бромэтил)-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил] карбамата (1,2 г), 4-(дифенилметокси)пиперидина (0,85 г) и карбоната калия (0,44 г) в N,N-диметилформамиде (20 мл) перемешивали при 60oC в течение 15 часов. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат:метанол = 98:2-95: 5) с получением 1,6 г указанного в заголовке соединения. Выход 92%.
Масло.
1H-NMR (CDCl3) δ : 1,39 (3H, s), 1,50 (9H, s), 1,66-1,96 (6H, m), 2,03-2,20 (2H, m), 2,06 (3H, s), 2,07 (3H, s), 2,12 (3H, s), 2,40-2,48 (2H, m), 2,70-2,80 (2H, m), 2,82 (1H, d, J = 15,4 Hz), 3,01 (1H, d, J = 15,4 Hz), 3,35-3,50 (1H, m), 5,51 (1H, s), 5,76 (1H, br, s), 7,20-7,36 (10H, m).
Ссылочный пример 59
Трет-бутил [2-[2-[4-[(дифенилметокси)метил] -1-пиперидинил] этил]-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамат
Использовав трет-бутил [2-(2-бромэтил)-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил] карбамат и 4-[(дифенилметокси)метил] пиперидин, в других отношениях повторяли процедуру ссылочного примера 58 с получением указанного в заголовке соединения. Выход 82%.
Масло.
1H-NMR (CDCl3) δ : 1,18-1,50 (2H, m), 1,40 (3H, s), 1,50 (9H, s), 1,60-1,97 (7H, m), 2,07 (6H, s), 2,12 (3H, s), 2,41-2,50 (2H, m), 2,78-3,04 (4H, m), 3,29 (2H, d, J = 6,4 Hz), 5,30 (1H, s), 5,76 (1H, br, s), 7,20-7,37 (10H, m).
Ссылочный пример 60
Трет-бутил [2-[2-[4-[2-(дифенилметокси)этил]-1-пиперидинил]этил]- 2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамат
Использовав трет-бутил [2-(2-бромэтил)-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил] карбамат и 4-[2-(дифенилметокси)этил] пиперидин, в других отношениях повторяли процедуру ссылочного примера 58 с получением указанного в заголовке соединения. Выход 83%.
Масло.
1H-NMR (CDCl3) δ : 1,18-1,70 (4H, m), 1,39 (3H, s), 1,49 (9H, s), 1,80-2,00 (7H, m), 2,07 (6H, s), 2,11 (3H, s), 2,35-2,50 (2H, m), 2,78-3,05 (4H, m), 3,40-3,52 (2H, m), 5,30 (1H, s), 5,77 (1H, br, s), 7,19-7,38 (10H, m).
Ссылочный пример 61
2-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - 2H-изоиндол-1,3-дион
Суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (2,0 г) и фталимида калия (2,2 г) в N,N-диметилацетамиде (20 мл) нагревали с обратным холодильником под газообразным азотом в течение 3 часов. Эту реакционную смесь разбавляли водой и экстрагировали 2 порциями этилацетата. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением 1,4 г указанного в заголовке соединения. Выход 56%.
Т. пл. 147-150oC.
1H-NMR (CDCl3) δ : 1,52 (3H, s), 1,98 (3H, s), 2,03 (3H, s), 2,08 (3H, s), 2,93 (1H, d, J = 15,8 Hz), 3,0-3,4 (2H, br), 3,26 (1H, d, J = 15,8 Hz), 3,86 (1H, d, J = 13,9 Hz), 3,95 (1H, d, J = 13,9 Hz), 7,6-7,9 (4H, m).
Ссылочный пример 62
2,3-Дигидро-2,4,6,7-тетраметил-2-[(1,2,3,4-тетрагидроизохинолин-2-ил)метил]-5-бензофуранаминоксалат
Суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,4 г), 1,2,3,4-тетрагидроизохинолина (1,3 г) и карбоната калия (1,4 г) в N, N-диметилацетамиде (10 мл) нагревали с обратным холодильником под газообразным азотом в течение 15 часов. Эту реакционную смесь разбавляли водой и экстрагировали 2 порциями этилацетата. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 3:1) с получением 2,3-дигидро-2,4,6,7-тетраметил-2-[(1,2,3,4-тетрагидроизохинолин-2- ил)метил]-5-бензофуранамина. Этот продукт растворяли в этаноле с последующим прибавлением 1 эквивалента раствора щавелевой кислоты в этаноле. Эту смесь нагревали и полученный раствор концентрировали при пониженном давлении. Собирали выпавшие кристаллы, получив в результате 1,5 г указанного в заголовке соединения. Выход 68%.
Т. пл. 153-156oC.
1H-NMR (DMSO-d6) δ : 1,41 (3H, s), 1,99 (6H, s), 2,02 (3H, s), 2,7-3,2 (6H, m), 2,84 (1H, d, J = 15,8 Hz), 3,11 (1H, d, J = 15,8 Hz), 3,89 (1H, d, J = 15,4 Hz), 4,00 (1H, d, J = 15,4 Hz), 6,95-7,2 (4H, m).
Ссылочный пример 63
2-[[4-(2,3-Дигидро-2-оксо-1H-бензимидазол-1-ил)-1- пиперидинил]метил]-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин дигидрохлорид
В автоклаве перемешивали под газообразным азотом при 180oC в течение 15 часов суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,4 г) и 4-(2-кето-1-бензимидазолинил)пиперидина (2,3 г) в ксилоле (20 мл). Затем реакционную смесь охлаждали, фильтровали и промывали диэтиловым эфиром. Фильтрат промывали водой и экстрагировали 1 Н хлороводородной кислотой. Водный слой нейтрализовали насыщенным водным раствором NaHCO3 и экстрагировали 2 порциями этилацетата.
Объединенный органический слой промывали насыщенным водным раствором NaCl, сушили над безводным сульфатом натрия (Na2SO4) и силикагелем (элюирован этилацетатом) и концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением 1,2 г 2-[[4-(2,3-дигидро-2-оксо-1H-бензимидазол-1-ил)-1- пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина. Выход 55%. Этот продукт растворяли в тетрагидрофуране при нагревании и после разбавления раствора метанолом прибавляли стехиометрический избыток 10%-ного раствора HCl в метаноле. Полученный раствор концентрировали при пониженном давлении и кристаллизовали из смеси метанол-диэтиловый эфир с получением указанного в заголовке соединения.
Т. пл. 202-208oC.
1H-NMR (DMSO-d6) δ : 1,5-2,3 (3H, m), 1,65 (3H, m), 2,07 (3H, s), 2,22 (3H, s), 2,25 (3H, s), 2,8-3,2 (3H, m), 3,07 (1H, d, J = 16,4 Hz), 3,2-3,7 (4H, m), 3,8-4,0 (1H, m), 4,4-4,7 (1H, m), 6,9-7,1 (3H, m), 7,6-7,8 (1H, m), 9,5-10,1 (2H, br), 10,7-11,0 (1H, m).
Ссылочный пример 64
2-[[4-[(9-Фторенил)окси] -1-пиперидинил]метил]-2,3-дигидро- 2,4,6,7-тетраметил-5-бензофуранаминоксалат
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 4-[(9-фторфенил)окси] пиперидин, в других отношениях следовали процедуре примера 1, представленного далее, с получением 2-[[4-[(9-фторенил)окси]-1-пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина. Выход 63%. Часть продукта преобразовывали в оксалат и перекристаллизовывали из этанола с получением указанного в заголовке соединения.
Т. пл. 121-123oC.
1H-NMR (DMSO-d6) δ : 1,36 (3H, s), 1,63 (2H, br, s), 1,86-2,06 (2H, m), 1,96 (9H, s), 2,50-3,12 (8H, m), 3,72 (1H, br, s), 5,62 (1H, s), 7,27-7,45 (4H, m), 7,59 (2H, d, J = 6,8 Hz), 7,79 (2H, d, J = 7,4 Hz).
Ссылочный пример 65
4-[(9-Фторенил)окси]пиперидин
Использовав 9-флуоренол и 4-пиперидинол, в других отношениях повторяли процедуру ссылочного примера 23 с получением указанного в заголовке соединения. Выход 38%.
Аморфное твердое вещество.
1H-NMR (CDCl3) δ : 1,45-1,68 (2H, m), 1,75-1,90 (2H, m), 2,50-2,62 (2H, m), 3,04-3,18 (2H, m), 3,45-3,58 (1H, m), 5,62 (1H, s), 7,22-7,40 (4H, m), 7,56-7,67 (4H, m).
Ссылочный пример 66
2-Бром-3-(метоксиметокси)-1,4,5-триметилбензол
Под газообразным азотом раствор 2-бром-3,5,6-триметилфенола (10 г) в N, N-диметилформамиде (50 мл) прибавляли по каплям к суспензии 60%-ного гидрида натрия (2,1 г) в N,N-диметилформамиде (20 мл) при охлаждении льдом и смесь перемешивали в течение 10 минут. К этой смеси дополнительно прибавляли по каплям раствор хлорметилметилового эфира (3,9 мл) в N,N-диметилформамиде (5 мл) и смесь перемешивали еще 30 минут. Эту реакционную смесь разбавляли ледяной водой и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 97:3) с получением указанного в заголовке соединения (12 г). Выход 99%.
Масло.
1H-NMR (CDCl3) δ : 2,20 (3H, s), 2,24 (3H, s), 2,34 (3H, s), 3,66 (3H, s), 5,04 (2H, s), 6,85 (1H, s).
Ссылочный пример 67
(R)-1-[[2-(Метоксиметокси)-3,4,6-триметилфенил]метил]-1-метилоксиран
К раствору 2-бром-3-(метоксиметокси)-1,4,5-триметилбензола (3,0 г) в тетрагидрофуране (30 мл) прибавляли по каплям при -78oC 1,6 М раствор н-бутиллития в гексане (7,0 мл) и смесь перемешивали в течение 15 минут. К этой смеси прибавляли (R)-метилглицидилтозилат (2,8 г) и трифторид бора-диэтиловый эфир (1,5 мл) и полученную смесь перемешивали еще 15 минут. Реакционную смесь подогревали до комнатной температуры, затем разбавляли водой и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (гексан:этилацетат = 3: 1) с получением (R)-2-гидрокси-3-[2-(метоксиметокси)-3,4,6-триметилфенил] -2- метилпропил-4-метилбензолсульфоната. Это соединение растворяли в метаноле (20 мл) с последующим прибавлением карбоната калия (1,6 г) при охлаждении льдом и смесь перемешивали 30 минут. К этой реакционной смеси прибавляли этилацетат и воду и полученные два слоя разделяли. Водный слой экстрагировали этилацетатом и экстракт объединяли с отделенным, как указано выше, органическим слоем. Объединенный органический раствор промывали насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 9:1) с получением указанного в заголовке соединения (0,73 г). Выход по 2-бром-3-(метоксиметокси)-1,4,5-триметилбензолу составлял 25%.
Масло.
1H-NMR (CDCl3) δ : 1,35 (3H, s), 2,15 (3H, s), 2,20 (3H, s), 2,26 (3H, s), 2,44 (1H, d, J = 5,2 Hz), 2,50 (1H, d, J = 5,2 Hz), 3,00-3,15 (2H, m), 3,61 (3H, s), 4,88-4,95 (2H, m), 6,78 (1H, s).
Ссылочный пример 68
(S)-2,3-Дигидро-2,4,6,7-тетраметил-2-бензофуранметанол
К раствору (R)-1-[[2-(метоксиметокси)-3,4,6- триметилфенил]метил]-1-метилоксирана (0,60 г) в тетрагидрофуране (5 мл) прибавляли смесь трифторуксусной кислоты (1 мл) и воды (1 мл) по каплям при охлаждении льдом и смесь перемешивали 30 минут. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 8:2) с получением указанного в заголовке соединения в виде твердого вещества (0,41 г). Выход 83%.
1H-NMR (CDCl3) δ : 1,44 (3H, s), 2,08 (3H, s), 2,15 (3H, s), 2,20 (3H, s), 2,80 (1H, d, J = 15,4 Hz), 3,13 (1H, d, J = 15,4 Hz), 3,55-3,73 (2H, m), 6,51 (1H, s).
Этот продукт дополнительно не очищали, а непосредственно подвергали следующей реакции.
Ссылочный пример 69
(S)-(2,3-Дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метилметансульфонат
К раствору (S)-2,3-дигидро-2,4,6,7-тетраметил-2-бензофуранметанола (0,40 г) и триэтиламина (0,41 мл) в тетрагидрофуране (5 мл) прибавляли по каплям при охлаждении льдом метансульфонилхлорид (0,17 мл) и смесь перемешивали в течение 10 минут. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали последовательно 1 Н хлороводородной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (0,43 г). Выход 78%.
[α]D= +1,4° (c = 0,41, этанол).
Т. пл. 70-71oC.
1H-NMR (CDCl3) δ : 1,52 (3H, s), 2,05 (3H, s), 2,15 (3H, s), 2,19 (3H, s), 2,88 (1H, d, J = 15,6 Hz), 3,02 (3H, s), 3,13 (1H, d, J = 15,6 Hz), 4,26 (2H, s), 6,52 (1H, s).
Ссылочный пример 70
(S)-1-[(2,3-Дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - N-(дифенилметил)-4-пиперидинамин
Суспензию (S)-(2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метилметансульфоната (0,34 г), N-(дифенилметил)-4-пиперидинамина (0,73 г) и карбоната калия (0,38 г) в N,N-диметилацетамиде (2 мл) перемешивали под газообразным аргоном при 177oC в течение 6 часов. Эту реакционную смесь разбавляли водой и экстрагировали диизопропиловым эфиром. Органический слой промывали водой и экстрагировали 1 Н хлороводородной кислотой. Водный слой подщелачивали 2 Н раствором гидроксида натрия в воде и экстрагировали диизопропиловым эфиром. Экстракт промывали водой и насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 7:3) с получением указанного в заголовке соединения (0,49 г). Выход 79%.
[α]D= +3,0° (c = 0,20, этанол).
Масло.
1H-NMR (CDCl3) δ : 1,25-1,52 (2H, m), 1,41 (3H, s), 1,80-1,96 (2H, m), 2,00-2,23 (2H, m), 2,03 (3H, s), 2,13 (3H, s), 2,18 (3H, s), 2,31-2,56 (3H, m), 2,71-2,87 (2H, m), 2,95-3,08 (2H, m), 5,00 (1H, s), 6,46 (1H), 7,16-7,39 (10H, m).
Ссылочный пример 71
1-[(2,3-Дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил]- N-(дифенилметил)-4-пиперидинамин
Суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметилбензофурана (1,0 г), N-(дифенилметил)-4-пиперидинамина (1,5 г) и карбоната калия (0,77 г) в N, N-диметилацетамиде (4 мл) перемешивали под газообразным аргоном при 177oC в течение 4 часов. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 7: 3) с получением указанного в заголовке соединения (1,5 г). Выход 97%.
Масло.
1H-NMR (CDCl3) δ : 1,25-1,50 (2H, m), 1,41 (3H, s), 1,78-1,96 (2H, m), 2,01-2,22 (2H, m), 2,03 (3H, s), 2,13 (3H, s), 2,18 (3H, s), 2,31-2,57 (3H, m), 2,71-2,86 (2H, m), 2,96-3,07 (2H, m), 5,01 (1H, s), 6,46 (1H, s), 7,16-7,39 (10H, m).
Ссылочный пример 72
2,3-Дигидро-2,4,6,7-тетраметил-2-[[1,2,3,6-тетрагидро-4-(3- индолил)-1-пиридил]метил]-5-бензофуранамин
Суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (0,85 г), 3-(1,2,3,6-тетрагидро-4-пиридил)-1H-индола (1,1 г) и бикарбоната калия (0,83 г) в N, N-диметилацетамиде (6 мл) нагревали с обратным холодильником под средой азота в течение 7,5 часов. К смеси прибавляли воду и продукт экстрагировали два раза этилацетатом. Объединенный экстракт промывали водой, а затем насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и выпаривали. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 1:1) и перекристаллизовывали из смеси ацетон-диизопропиловый эфир с получением 0,99 г указанного в заголовке соединения. Выход 82%.
Т. пл. 169-173oC.
1H-NMR (CDCl3) δ : 1,49 (3H, s), 2,08 (3H, s), 2,09 (3H, s), 2,14 (3H, s), 2,50-2,65 (2H, m), 2,66 (1H, d, J = 13,9 Hz), 2,75 (1H, d, J = 13,9 Hz), 2,75-3,06 (3H, m), 3,21 (1H, d, J = 15,4 Hz), 3,23-3,51 (2H, m), 6,15-6,24 (1H, m), 7,06-7,29 (3H, m), 7,35-7,40 (1H, m), 7,86-7,94 (1H, m), 8,08 (1H, br, s).
Ссылочный пример 73
1-Фенил-1H-индол
Суспензию индола (8,2 г), бикарбоната натрия (12 г) и йодида меди (I) (2,7 г) в бромбензоле (70 мл) нагревали с обратным холодильником в течение 3 часов под средой азота. К смеси прибавляли йодид меди (I) (11 г) и смесь нагревали с обратным холодильником еще 6 часов. Удаляли путем фильтрования нерастворимый материал и фильтрат концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 50:1) с получением указанного в заголовке соединения (8,4 г). Выход 62%.
Масло.
1H-NMR (CDCl3) δ : 6,68 (1H, dd, J = 3,2, 0,8 Hz), 7,11-7,27 (2H, m), 7,29-7,43 (2H, m), 7,44-7,63 (5H, m), 7,65-7,22 (1H, m).
Ссылочный пример 74
1-Фенил-3-(1,2,3,6-тетрагидро-4-пиридил)-1H-индол
К нагретой (110oC) смеси 4-пиперидонмоногидратгидрохлорида (8,2 г), уксусной кислоты (15 мл) и трифторуксусной кислоты (30 мл) прибавляли под средой азота в течение 25 минут 1-фенил-1H-индол (3,1 г). Смесь перемешивали 30 минут при 120oC, затем охлаждали и выливали на лед. Нейтрализовали ее концентрированной аммиачной водой при охлаждении и продукт экстрагировали три раза этилацетатом. Объединенный экстракт промывали водой и затем насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и выпаривали. Остаток использовали для следующей реакции без дополнительной очистки. Выход 63%.
Аморфное твердое вещество.
1H-NMR (CDCl3) δ : 2,48-2,66 (2H, m), 3,21 (2H, t, J = 5,7 Hz), 3,53-3,94 (3H, m), 6,23-6,34 (1H, m), 7,00-7,70 (9H, m), 7,80-8,04 (1H, m).
Ссылочный пример 75
Бис [2,3-дигидро-2,4,6,7-тетраметил-2-[[1,2,3,6-тетрагидро-4-(1- фенил-3-индолил)-1-пиридил]метил]-5-бензофуранамин]триоксалат
Использовав 1-фенил-3-(1,2,3,6-тетрагидро-4-пиридил)-1H-индол, в других отношениях повторяли процедуру ссылочного примера 72 с получением 2,3-дигидро-2,4,6,7-тетраметил-2-[[1,2,3,6-тетрагидро-4-(1-фенил-3-индолил)-1-пиридил] метил] -5-бензофуранамина. Выход 61%. Часть этого продукта преобразовывали в оксалат с получением указанного в заголовке соединения.
Аморфное твердое вещество.
1H-NMR (DMSO-d6) δ : 1,48 (3H, s), 1,99 (6H, s), 2,05 (3H, s), 2,64-2,90 (2H, m), 2,89 (1H, d, J = 15,4 Hz), 3,05-3,48 (5H, m), 3,62-3,95 (2H, m), 6,27 (1H, br, s), 7,14-7,30 (2H, m), 7,37-7,67 (6H, m), 7,79 (1H, s), 7,93-8,02 (1H, m).
Ссылочный пример 76
2,3-Дигидро-2-[[4-(3-индолил)-1-пиперидинил] метил] -2,4,6,7- тетраметил-5-бензофуранамингидрохлорид
Смесь 2,3-дигидро-2,4,6,7-тетраметил-2-[[1,2,3,6-тетрагидро-4-(3-индолил)-1-пиридил] метил] -5-бензофуранамина (0,40 г), оксида платины (80 мг), тетрагидрофурана (2 мл) и метанола (4 мл) перемешивали 2 часа при 60oC под средой водорода. Смесь охлаждали, удаляли путем фильтрования катализатор и фильтрат концентрировали в вакууме. Остаток растворяли в метаноле и к полученному раствору прибавляли избыток 10%-ного хлороводорода в метаноле. Смесь концентрировали и полученный кристаллический продукт собирали с получением 0,20 г указанного в заголовке соединения. Выход 44%.
Т. пл. 236-242oC.
1H-NMR (DMSO-d6) δ : 1,54 (3H, br, s), 1,86-2,40 (5H, m), 1,99 (3H, s), 2,01 (6H, s), 2,70-3,90 (7H, m), 2,94 (1H, d, J = 16,0 Hz), 4,50-5,50 (2H, br), 6,92-7,19 (3H, m), 7,35 (1H, d, J = 8,0 Hz), 7,50-7,76 (1H, m), 9,40-10,20 (1H, br), 10,89 (1H, br, s).
Ссылочный пример 77
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(1-фенил-3-индолил)-1- пиперидинил] метил]-5-бензофуранаминоксалат
Смесь 2,3-дигидро-2,4,6,7-тетраметил-2-[[1,2,3,6-тетрагидро-4-(1- фенил-3-индолил)-1-пиридил] метил] -5-бензофуранамина (0,36 г), оксида платины (72 мг), тетрагидрофурана (2 мл) и метанола (4 мл) перемешивали 3,5 часа при 60oC под средой водорода. Смесь охлаждали, удаляли путем фильтрования катализатор и фильтрат концентрировали в вакууме. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 5:1) с получением 2,3-дигидро-2,4,6,7-тетраметил-2-[[4-(1-фенил-3-индолил)-1- пиперидинил]метил] -5-бензофуранамина. Полученный продукт растворяли в метаноле и к раствору прибавляли 1 эквивалент раствора щавелевой кислоты в метаноле. Смесь концентрировали и к остатку прибавляли этанол и диэтиловый эфир. Полученный порошкообразный продукт собирали, получив в результате 0,10 г указанного в заголовке соединения. Выход 24%.
Аморфное твердое вещество.
1H-NMR (DMSO-d6) δ : 1,49 (3H, s), 1,84-2,36 (5H, m), 1,97 (3H, s), 1,99 (3H, s), 2,01 (3H, s), 2,90-3,70 (6H, m), 2,91 (1H, d, J = 16,0 Hz), 3,12 (1H, d, J = 16,0 Hz), 7,08-7,26 (2H, m), 7,32-7,69 (6H, m), 7,48 (1H, s), 7,76 (1H, d, J = 7,8 Hz).
Ссылочный пример 78
N-[2,3-Дигидро-2-(йодметил)-2,4,6-триметилбензофуран-5-ил]формамид
К суспензии N-[4-гидрокси-2,6-диметил-3-(2-метил-2- пропенил)фенил]формамида (16 г) и карбоната кальция (9,3 г) в тетрагидрофуране (60 мл) и метаноле (60 мл) медленно прибавляли бензилтриметиламмонийдихлорйодат (27 г). Смесь перемешивали в течение 10 минут. Удаляли путем фильтрования нерастворимый материал и фильтрат концентрировали в вакууме. К остатку прибавляли этилацетат и воду. Отделяли органический слой и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали 10%-ным водным раствором гидросульфита натрия, водой, насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия. Органический слой сушили над сульфатом магния, фильтровали и фильтрат концентрировали в вакууме. Остаток кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением 23 г указанного в заголовке соединения. Выход 93%.
Т. пл. 135-138oC.
1H-NMR (CDCl3) δ : 1,66, 1,67 (3H, s), 2,13, 2,17 (3H, s), 2,21, 2,24 (3H, s), 2,97 (1H, d, J = 15,7 Hz), 3,24 (1H, d, J = 15,7 Hz), 3,43, 3,44 (2H, s), 6,53, 6,54 (1H, s), 6,58-6,87 (1H, m), 8,00 (0,45H, d, J = 12,2 Hz), 8,41 (0,55H, J = 1,4 Hz).
Ссылочный пример 79
N-[2,3-Дигидро-2-(йодметил)-7-изопропил-2,4,6- триметилбензофуран-5-ил] формамид
К смеси N-[2,3-дигидро-2-(йодметил)-2,4,6-триметилбензофуран-5- ил] формамида (6,9 г) и 2-пропанола (10 мл) прибавляли концентрированную серную кислоту (20 мл) по каплям при охлаждении водой. Смесь перемешивали при комнатной температуре в течение 1,5 часов и выливали на лед. Продукт экстрагировали два раза смесью тетрагидрофурана и диизопропилового эфира (1:2). Объединенный органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и фильтрат выпаривали в вакууме. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 1:1) с получением 7,3 г указанного в заголовке соединения. Выход 94%.
Аморфное твердое вещество.
1H-NMR (CDCl3) δ : 1,27, 1,28 (3H, d, J = 6,6 Hz), 1,30, 1,32 (3H, d, J = 6,8 Hz), 1,64, 1,67 (3H, s), 2,09, 2,13 (3H, s), 2,19, 2,23 (3H, s), 2,93 (1H, d, J = 15,8 Hz), 3,04-3,27 (2H, m), 3,44, 3,45 (2H, s), 6,72 (0,5H, br, s), 6,81 (0,5H, br, d, J = 12,2 Hz), 7,97 (0,5H, d, J = 12,2 Hz), 8,41 (0,5H, d, J = 1,6 Hz).
Ссылочный пример 80
2,3-Дигидро-2-(йодметил)-7-изопропил-2,4,6-триметил-5-бензофуранамин
К раствору N-[2,3-дигидро-2-(йодметил)-7-изопропил-2,4,6- триметилбензофуран-5-ил] формамида (7,3 г) в метаноле (40 мл) прибавляли концентрированную хлороводородную кислоту (10 мл). Смесь нагревали с обратным холодильником в течение 1,5 часов под средой азота и вливали в суспензию бикарбоната натрия (20 г) в воде и этилацетате. Отделяли органический слой и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, обрабатывали активированным углем, фильтровали и фильтрат выпаривали в вакууме. Остаток кристаллизовали из гексана с получением 5,7 г указанного в заголовке соединения. Выход 84%.
Т. пл. 84-86oC.
1H-NMR (CDCl3) δ : 1,29 (3H, d, J = 7,0 Hz), 1,31 (3H, d, J = 7,0 Hz), 1,62 (3H, s), 2,06 (3H, s), 2,13 (3H, s), 2,92 (1H, d, J = 15,8 Hz), 3,11-3,27 (2H, m), 3,42 (2H, s).
Ссылочный пример 81
2,3-Дигидро-7-изопропил-2,4,6-триметил-2-[(4-фенил-1- пиперидинил)метил] -5-бензофуранамин
Суспензию 2,3-дигидро-2-(йодметил)-7-изопропил-2,4,6-триметил-5-бензофуранамина (1,1 г), 4-фенилпиперидина (0,87 г) и карбоната калия (0,83 г) в N,N-диметилацетамиде (6 мл) нагревали с обратным холодильником в течение 4,5 часов. Смесь разбавляли водой и продукт экстрагировали два раза этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и фильтрат выпаривали в вакууме. Остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 30:1-10:1) и перекристаллизовывали из смеси гексан-этилацетат с получением 0,55 г указанного в заголовке соединения. Выход 47%.
Т. пл. 128-131oC.
1H-NMR (CDCl3) δ : 1,27 (3H, d, J = 6,8 Hz), 1,28 (3H, d, J = 6,8 Hz), 1,39 (3H, s), 1,66-1,87 (4H, m), 2,07 (3H, s), 2,10-2,55 (3H, m), 2,13 (3H, s), 2,60 (2H, s), 2,72 (1H, d, J = 15,0 Hz), 3,00-3,28 (4H, m), 7,12-7,37 (5H, m).
Ссылочный пример 82
N-[2,3-Дигидро-2-(йодметил)-7-изопропил-2,4,6,7- тетраметилбензофуран-5-ил]формамид
К суспензии N-[4-гидрокси-2,3,6-триметил-5-(2-метил-2-пропенил)фенил] формамида (187 г) и карбоната кальция (104 г) в тетрагидрофуране (600 мл) и метаноле (600 мл) медленно прибавляли бензилтриметиламмонийдихлорйодат (307 г). Смесь перемешивали в течение 10 минут. Удаляли путем фильтрования нерастворимый материал и фильтрат концентрировали в вакууме. К остатку прибавляли этилацетат (800 мл) и воду (400 мл). Отделяли органический слой и водный слой экстрагировали этилацетатом (400 мл). Объединенный органический слой промывали 10%-ным водным раствором гидросульфита натрия (400 г), водой (300 мл), насыщенным водным раствором бикарбоната натрия (300 мл) и водным раствором хлорида натрия (300 мл). Органический слой сушили над сульфатом магния, обрабатывали активированным углем, фильтровали и фильтрат концентрировали в вакууме. Остаток кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением 271 г указанного в заголовке соединения. Выход 94%.
Т. пл. 145-147oC.
1H-NMR (CDCl3) δ : 1,66, 1,67 (3H, s), 2,05-2,20 (9H, m), 2,98 (1H, d, J = 15,9 Hz), 3,24 (1H, d, J = 15,9 Hz), 3,42, 3,43 (2H, s), 6,63-8,82 (1H, m), 7,96 (0,45H, d, J = 12,0 Hz), 8,41 (0,55H, d, J = 1,2 Hz).
Ссылочный пример 83
2,3-Дигидро-2-(йодметил)-2,4,6,7-тетраметил-5-бензофуранамин
К раствору N-[2,3-дигидро-2-(йодметил)-2,4,6,7-тетраметилбензофуран-5-ил] формамида (6,5 г) в метаноле (40 мл) прибавляли концентрированную хлороводородную кислоту (10 мл). Смесь нагревали с обратным холодильником в течение 1,5 часов под средой азота и вливали в суспензию бикарбонат натрия (12 г) в воде и этилацетате. Отделяли органический слой и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, обрабатывали активированным углем, фильтровали и фильтрат выпаривали в вакууме. Остаток кристаллизовали из гексана с получением 5,5 г указанного в заголовке соединения. Выход 91%.
Т. пл. 105-107oC.
1H-NMR (CDCl3) δ : 1,64 (3H, s), 2,07 (6H, s), 2,12 (3H, s), 2,98 (1H, d, J = 15,6 Hz), 3,25 (1H, d, J = 15,6 Hz), 3,41 (2H, s).
Пример 1
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(2-фенилэтил)-1- пиперидинил]метил] -5-бензофуранамин
В автоклаве перемешивали под газообразным аргоном при 180oC в течение 15 часов смесь 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,5 г), 4-(2-фенилэтил)пиперидина (2,0 г) и триэтиламина (5,3 г). После охлаждения реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl и сушили над MgSO4, после чего отгоняли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 1:1) и перекристаллизовывали из диизопропилового эфира с получением 0,88 г указанного в заголовке соединения. Выход 42%.
Т. пл. 91-92oC.
1H-NMR (CDCl3) δ : 1,17-1,35 (3H, m), 1,42 (3H, s), 1,48-1,70 (4H, m), 1,99-2,17 (2H, m), 2,07 (6H, s), 2,10 (3H, s), 2,45 (1H, d, J = 13,8 Hz), 2,53 (1H, d, J = 13,8 Hz), 2,55-2,65 (2H, m), 2,79 (1H, d, J = 15,2 Hz), 2,82-2,92 (1H, m), 3,06-3,14 (1H, m), 3,10 (1H, d, J = 15,2 Hz), 7,13-7,20 (3H, m), 7,22-7,31 (2H, m).
Пример 2
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(3-фенилпропил)-1- пиперидинил] метил]-5-бензофуранамин
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 4-(3-фенилпропил)пиперидин, в других отношениях повторяли процедуру примера 1 с получением указанного в заголовке соединения. Выход 42%.
Т. пл. 79-80oC (перекристаллизованное из смеси диизопропиловый эфир-гексан).
1H-NMR (CDCl3) δ : 1,15-1,30 (5H, m), 1,41 (3H, s), 1,52-1,67 (4H, m), 1,98-2,17 (2H, m), 2,06 (3H, s), 2,07 (3H, s), 2,09 (3H, s), 2,44 (1H, d, J = 13,6 Hz), 2,53 (1H, d, J = 13,6 Hz), 2,57, t, J = 7,6 Hz), 2,78 (1H, d, J = 15,0 Hz), 2,81-2,88 (1H, m), 3,00-3,10 (1H, m), 3,09 (1H, d, J = 15,0 Hz), 7,13-7,21 (3H, m), 7,22-7,30 (2H, m).
Пример 3
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(4-фенилбутил)-1- пиперидинил] метил]-5-бензофуранамин
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 4-(4-фенилбутил)пиперидин, в других отношениях повторяли процедуру примера 1 с получением указанного в заголовке соединения. Выход 62%.
Т. пл. 70-71oC (перекристаллизованное из пентана).
1H-NMR (CDCl3) δ : 1,10-1,39 (7H, m), 1,41 (3H, s), 1,51-1,65 (4H, m), 1,98-2,18 (2H, m), 2,06 (3H, s), 2,07 (3H, s), 2,09 (3H, s), 2,44 (1H, d, J = 13,8 Hz), 2,52 (1H, d, J = 13,8 Hz), 2,59 (2H, t, J = 7,4 Hz), 2,79 (1H, d, J = 15,2 Hz), 2,83-2,88 (1H, m), 3,00-3,10 (1H, m), 3,10 (1H, d, J = 15,2 Hz), 7,12-7,20 (3H, m), 7,23-7,30 (2H, m).
Пример 4
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-[(3,4-метилендиоксифенил)метил] -1- пиперазинил]метил]-5-бензофуранаминтригидрохлорид
В автоклаве перемешивали под газообразным аргоном при 180oC в течение 15 часов смесь 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,5 г), 1-[(3,4-метилендиоксифенил)метил]пиперазина (2,5 г) и триэтиламина (1,6 г). После охлаждения реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl и сушили над MgSO4, после чего отгоняли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат:метанол = 100:0-95:5) и обрабатывали 4 Н раствором HCl в этаноле для преобразования в тригидрохлорид. Этот продукт перекристаллизовывали из этанола с получением 1,2 г указанного в заголовке соединения. Выход 41%.
Т. пл. 216-218oC.
1H-NMR (DMSO-d6) δ : 1,51 (3H, s), 2,03 (3H, s), 2,22 (3H, s), 2,23 (3H, s), 2,96 (1H, d, J = 16,8 Hz), 3,25 (1H, d, J = 16,8 Hz), 3,40 (10H, br, s), 4,25 (2H, s), 6,06 (2H, s), 6,97 (1H, d, J = 8,9 Hz), 7,08 (1H, d, J = 8,0 Hz), 7,29 (1H, s), 9,85 (2H, br, s).
Пример 5
2-[(4-Бензил-1-пиперидинил)метил] -2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамин
В автоклаве перемешивали под газообразным азотом при 180oC в течение 15 часов смесь 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (0,85 г), 4-бензилпиперидина (1,1 г) и триэтиламина (1,3 мл). Эту реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали 2 порциями этилацетатом. Объединенный органический слой промывали насыщенным водным раствором NaCl и сушили над MgSO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (гексан:этанол = 10:1) и кристаллизовали из гексана с получением 0,86 г указанного в заголовке соединения. Выход 78%.
Т. пл. 71-73oC.
1H-NMR (CDCl3) δ : 1,1-1,7 (5H, m), 1,41 (3H, s), 1,9-2,2 (2H, m), 2,06 (9H, s), 2,3-2,6 (4H, m), 2,7-2,9 (1H, m), 2,79 (1H, d, J = 15,4 Hz), 3,0-3,2 (1H, m), 3,10 (1H, d, J = 15,4 Hz), 7,1-7,3 (5H, m).
Пример 6
2-[(4-Бензил-1-пиперазинил)метил] -2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранаминтригидрохлорид
Использовав 1-бензилпиперазин, в других отношениях повторяли процедуру примера 5 с получением 2-[(4-бензил-1-пиперазинил)метил] -2,3-дигидро-2,4,6,7-тетраметил-5- бензофуранамина. Этот продукт растворяли в метаноле с последующим прибавлением стехиометрического избытка 10%-ного раствора HCl в метаноле и смешиванием. Собирали выпавшие кристаллы, получив в результате указанное в заголовке соединение. Выход 78%.
Т. пл. 210-215oC.
1H-NMR (DMSO-d6) δ : 1,50 (3H, s), 2,02 (3H, s), 2,22 (3H, s), 2,23 (3H, s), 2,97 (1H, d, J = 16,1 Hz), 3,0-4,2 (10H, m), 3,25 (1H, d, J = 16,1 Hz), 4,35 (2H, s), 7,4-7,5 (3H, m), 7,55-7,7 (2H, m), 9,6-10,2 (2H, br).
Пример 7
2-[(4-Бензилокси-1-пиперидинил)метил] -2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамин
В этилацетате суспендировали 2,0 г 4-бензилоксипиперидингидрохлорида и суспензию нейтрализовали 1 Н водным раствором гидроксида натрия. Отделяли органический слой и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и фильтрат концентрировали при пониженном давлении. К раствору, приготовленному путем растворения полученного 4-бензилоксипиперидина в 0,5 мл толуола, прибавляли 1,1 г 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина и 2,8 мл триэтиламина и смесь перемешивали в автоклаве под газообразным азотом при 180oC в течение 15 часов. Эту реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали 3 порциями этилацетата. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (гексан:этилацетат = 1:1) и перекристаллизовывали из смеси этилацетат-гексан с получением 1,1 г указанного в заголовке соединения. Выход 67%.
Т. пл. 85-86oC.
1H-NMR (CDCl3) δ : 1,42 (3H, s), 1,5-2,1 (4H, m), 2,07 (6H, s), 2,09 (3H, s) 2,1-2,45 (2H, m), 2,47 (1H, d, J = 13,8 Hz), 2,56 (1H, d, J = 13,8 Hz), 2,7-3,1 (2H, m), 2,80 (1H, d, J = 15,4 Hz), 3,10 (1H, d, J = 15,4 Hz), 3,3-3,45 (1H, m), 4,53 (2H, s), 7,2-7,4 (5H, m).
Пример 8
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-[(3-фенил-2- пропенил)окси] -1-пиперидинил]метил]-5-бензофуранамин
Использовав 4-[(3-фенил-2-пропенил)окси] пиперидингидрохлорид, в других отношениях повторяли процедуру примера 7 с получением указанного в заголовке соединения. Выход 71%.
Т. пл. 77-79oC (кристаллизованное из смеси диэтиловый эфир-гексан).
1H-NMR (CDCl3) δ : 1,4-2,0 (4H, m), 1,42 (3H, s), 2,07 (6H, s), 2,10 (3H, s), 2,1-2,4 (2H, m), 2,48 (1H, d, J = 13,8 Hz), 2,56 (1H, d, J = 13,8 Hz), 2,7-3,1 (2H, m), 2,80 (1H, d, J = 15,4 Hz), 3,10 (1H, d, J = 15,4 Hz), 3,25-3,45 (1H, m), 4,16 (2H, dd, J = 5,9, 1,1 Hz), 6,29 (1H, dt, J = 15,8, 5,9 Hz), 6,60 (1H, d, J = 15,8 Hz), 7,15-7,45 (5H, m).
Пример 9
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-[(3-фенилпропил)окси] -1- пиперидинил]метил]-5-бензофуранамин
Суспензию 2,3-дигидро-2,4,6,7-тетраметил-2-[[4-[(3-фенил-2- пропенил)окси] -1-пиперидинил]метил]-5-бензофуранамина (1,2 г) и 5%-ного палладия на углероде (0,23 г) в тетрагидрофуране (10 мл) перемешивали под средой водорода при комнатной температуре в течение 1 часа. Затем отфильтровывали катализатор и фильтрат концентрировали при пониженном давлении. Остаток кристаллизовали из гексана с получением 0,36 г указанного в заголовке соединения. Выход 31%.
Т. пл. 53-54oC (кристаллизованное из гексана).
1H-NMR (CDCl3) δ : 1,4-1,7 (2H, m), 1,42 (3H, з), 1,7-2,0 (4H, m), 2,07 (6H, s), 2,10 (3H, s) 2,1-2,4 (2H, m), 2,47 (1H, d, J = 14,0 Hz), 2,56 (1H, d, J = 14,0 Hz), 2,69 (2H, t, J = 7,5 Hz), 2,7-3,1 (2H, m), 2,80 (1H, d, J = 15,4 Hz), 3,10 (1H, d, J = 15,4 Hz), 3,1-3,3 (1H, m), 3,42 (2H, t, J = 6,4 Hz), 7,1-7,35 (5H, m).
Пример 10
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(4-фенилбутирил)-1- пиперазинил]метил]-5-бензофуранамин
К раствору 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (0,22 г) и 1-гидроксибензотриазола (0,13 г) в N,N-диметилформамиде (5 мл) прибавляли 0,12 г 4-фенилмасляной кислоты при 0oC и смесь перемешивали при этой температуре в течение 5 минут и затем при комнатной температуре в течение 2 часов. Эту реакционную смесь прибавляли к раствору 2,3-дигидро-2,4,6,7-тетраметил-2-[(1-пиперазинил)метил] -5-бензофуранамина (0,20 г) в N,N-диметилформамиде (2 мл) при 0oC и смесь перемешивали еще 30 минут. Эту реакционную смесь вливали в воду и экстрагировали этилацетатом. Экстракт сушили на MgSO4 и отгоняли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 1:2) с получением 0,22 г указанного в заголовке соединения. Выход 74%.
Масло.
1H-NMR (CDCl3) δ : 1,42 (3H, s), 1,97 (2H, m), 2,05 (3H, s), 2,07 (6H, s), 2,30 (2H, t, J = 8,0 Hz), 2,4-2,8 (10H, m), 2,80 (1H, d, J = 15,1 Hz), 3,10 (1H, d, J = 15,1 Hz), 3,32 (2H, t, J = 4,8 Hz), 3,57 (2H, t, J = 5,0 Hz), 7,1-7,3 (5H, m).
Пример 11
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(4-фенилбутил)-1- пиперазинил] метил]-5-бензофуранаминтригидрохлорид
Смесь 2,3-дигидро-2,4,6,7-тетраметил-2-[[4-(4-фенилбутирил)-1- пиперазинил)метил] -5-бензофуранамина (0,47 г), литийалюминийгидрида (83 мг) и тетрагидрофурана (7 мл) нагревали с обратным холодильником под газообразным аргоном в течение 1 часа. После охлаждения реакционную смесь выливали на дробленый лед и экстрагировали этилацетатом. Экстракт сушили на MgSO4 и отгоняли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат) и перекристаллизовывали из смеси гексан-диизопропиловый эфир с получением 0,35 г свободного основания указанного в заголовке соединения. Выход 76%. Это свободное основание обрабатывали 4,8 Н раствором HCl в этаноле для преобразования в тригидрохлорид и затем перекристаллизовывали из смеси метанол-диизопропиловый эфир с получением 0,12 г указанного в заголовке соединения. Выход 21%.
Т. пл. 190-193oC.
1H-NMR (DMSO-d6) δ : 1,49 (3H, s), 1,5-1,8 (4H, m), 2,05 (3H, s), 2,22 (6H, s), 2,59 (2H, m), 2,8-3,7 (14H, m), 7,1-7,3 (5H, m), 9,7-9,9 (1H, br, s).
Пример 12
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(3-фенилпропионил)-1- пиперазинил] метил]-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1-пиперазинил]метил]-5-бензофуранамин и 3-фенилпропионовую кислоту, в других отношениях повторяли процедуру примера 10 с получением указанного в заголовке соединения. Выход 73%.
Масло.
1H-NMR (CDCl3) δ : 1,41 (3H, s), 2,07 (9H, s), 2,4-3,1 (12H, m), 3,33 (2H, t, J = 5,1 Hz), 3,58 (2H, t, J = 5,1 Hz), 7,1-7,3 (5H, m).
Пример 13
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(3-фенилпропил)-1- пиперазинил] метил]-5-бензофуранаминтригидрохлорид
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[[4-(3- фенилпропионил)-1-пиперазинил]метил]-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 19%.
Т. пл. 200-202oC (перекристаллизованное из смеси метанол-диэтиловый эфир).
1H-NMR (DMSO-d6) δ : 1,49 (3H, s), 2,03 (5H, m), 2,22 (6H, s), 2,64 (2H, t, J = 7,7 Hz), 2,8-3,7 (14H, m), 7,1-7,4 (5H, m), 9,7-9,9 (2H, br, s).
Пример 14
2-[[4-(2,2-Дифенилэтил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин
Использовав 2-[[4-(2,2-дифенилацетил)-1-пиперазинил]метил]-2,3- дигидро-2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 79%.
Т. пл. 130-132oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ : 1,39 (3H, s), 2,06 (3H, s), 2,07 (6H, s), 2,10-2,70 (10H, m), 2,78 (1H, d, J = 15,4 Hz), 2,96 (2H, s, J = 7,4 Hz), 3,10 (1H, d, J = 15,4 Hz), 4,20 (1H, t, J = 7,4 Hz), 7,00-7,40 (10H, m).
Пример 15
2-[[4-(3,3-Дифенилпропионил)-1-пиперазинил] метил] -2,3- дигидро-2,4,6,7-тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1-пиперазинил)метил]-5-бензофуранамин и 3,3-дифенилпропионовую кислоту, в других отношениях повторяли процедуру примера 10 с получением указанного в заголовке соединения. Выход 72%.
Т. пл. 77-78oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ : 1,40 (3H, s), 2,07 (3H, s), 2,09 (6H, s), 2,00-2,60 (6H, m), 2,81 (1H, d, J = 15,0 Hz), 3,03 (2H, d, J = 7,4 Hz), 3,06 (1H, d, J = 15,0 Hz), 3,31 (2H, t, J = 4,6 Hz), 3,52 (2H, t, J = 4,6 Hz), 4,66 (1H, t, J = 7,4 Hz), 7,10-7,40 (10H, m).
Пример 16
2-[[4-(3,3-Дифенилпропил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав в качестве исходного материала 2-[[4-(3,3-дифенилпропионил)-1-пиперазинил] метил]-2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамин, получили свободное основание так, как в примере 11. Выход 78%.
Масло.
1H-NMR (CDCl3) δ : 1,41 (3H, s), 2,07 (6H, s), 2,09 (3H, s), 2,30-2,80 (14H, m), 2,79 (1H, d, J = 15,4 Hz), 3,11 (1H, d, J = 15,4 Hz), 3,97 (1H, m), 7,10-7,40 (10H, m).
Указанное свободное основание обрабатывали 4,8 Н раствором HCl в этаноле и полученный тригидрохлорид перекристаллизовывали из смеси метанол-диизопропиловый эфир с получением указанного в заголовке соединения.
Т. пл. 200-203oC.
Пример 17
2-[[4-(Дифенилметокси)-1-пиперидинил] метил] -2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранаминоксалат
Использовав 4-(дифенилметокси)пиперидин, в других отношениях повторяли процедуру ссылочного примера 3 с получением 2-[(4-дифенилметокси-1-пиперидинил)метил]-2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамина. Этот продукт растворяли в этаноле с последующим прибавлением одного эквивалента раствора щавелевой кислоты в этаноле. Эту смесь нагревали и полученный раствор охлаждали. Затем к раствору прибавляли диэтиловый эфир для кристаллизации и в результате получили указанное в заголовке соединение. Выход 26%.
Т. пл. 173-175oC.
1H-NMR (DMSO-d6) δ : 1,41 (3H, s), 1,6-2,1 (4H, m), 1,96 (9H, s), 2,7-3,4 (8H, m), 3,4-3,6 (1H, m), 5,64 (1H, s), 7,15-7,3 (10H, m).
Пример 18
2-[[4-(2,2-Дифенилацетил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1-пиперазинил)метил]-5-бензофуранамин и 2,2-дифенилацетат, в других отношениях повторяли процедуру примера 10 с получением указанного в заголовке соединения. Выход 67%.
Т. пл. 113-115oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ: 1,38 (3H, s), 2,05 (3H, s), 2,06 (6H, s), 2,10-2,70 (6H, m), 2,79 (1H, d, J = 15,4 Hz), 3,08 (1H, d, J = 15,4 Hz), 3,00-3,80 (2H, br, s), 3,39 (2H, t, J = 4,8 Hz), 3,65 (2H, t, J = 4,8 Hz), 5,19 (1H, s), 7,10-7,40 (10H, m).
Пример 19
2-[14-[2-(Дифенилметокси)этил] -1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 1-[2-(дифенилметокси)этил]пиперазин, в других отношениях повторяли процедуру примера 4 с получением указанного в заголовке соединения. Выход 33%.
Т. пл. 173-176oC (перекристаллизованное из смеси этанол-диэтиловый эфир).
1H-NMR (DMSO-d6) δ: 1,54 (3H, s), 2,03 (3H, s), 2,24 (6H, s), 2,95-3,78 (16H, m), 5,57 (1H, s), 7,25-7,44 (10H, m).
Пример 20
2-[[4-[3-(Дифенилметокси)пропил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 1-[3-(дифенилметокси)пропил] пиперазин, в других отношениях повторяли процедуру примера 4 с получением указанного в заголовке соединения. Выход 54%.
Т. пл. 193-196oC (перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ: 1,54 (3H, s), 2,05 (5H, br, s), 2,24 (6H, s), 2,95-3,63 (16H, m), 5,48 (1H, s), 7,34-7,36 (10H, m).
Пример 21
2-[[4-[4-(Дифенилметокси)бутил] -1-пиперазинил)метил] -2,3- дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 1-[4-(дифенилметокси)бутил]пиперазин, в других отношениях повторяли процедуру примера 4 с получением указанного в заголовке соединения. Выход 43%.
Т. пл. 203-205oC (перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ: 1,54 (3H, s), 1,62 (2H, br, s), 1,80 (2H, br s), 2,05 (3H, s), 2,23 (3H, s), 2,24 (3H, s), 2,94-3,58 (16H, m), 5,44 (1H, s), 7,20-7,38 (10H, m).
Пример 22
2-[[4-[5-(Дифенилметокси)пентил] -1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 1-[5-(дифенилметокси)пентил] пиперазин, в других отношениях повторяли процедуру примера 4 с получением указанного в заголовке соединения. Выход 45%.
Т. пл. 186-189oC (разлож., перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ: 1,31-1,70 (6H, m), 1,53 (3H, s), 2,05 (3H, s), 2,24 (6H, s), 2,94-3,58 (16H, m), 5,42 (1H, s), 7,20-7,39 (10H, m).
Пример 23
2-[[4-[6-(Дифенилметокси)гексил] -1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 1-[6-(дифенилметокси)гексил] пиперазин, в других отношениях повторяли процедуру примера 4 с получением указанного в заголовке соединения. Выход 60%.
Т. пл. 183-186oC (разлож., перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ: 1,35-1,71 (8H, m), 1,53 (3H, s), 2,05 (3H, s), 2,23 (6H, s), 2,96-3,60 (16H, m), 5,41 (1H, s), 7,20-7,39 (10H, m).
Пример 24
2-[[4-[(Дифенилметокси)метил] -1-пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминоксалат
В автоклаве перемешивали под газообразным аргоном при 180oC в течение 15 часов смесь 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,5 г), 4-[(дифенилметокси)метил)пиперидина (3,0 г) и триэтиламина (7,4 мл). Эту реакционную смесь разбавляли водой и эксрагировали этилацетатом. Экстракт промывали насыщенных водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан: этилацетат = 1:1) с получением 2,4 г 2-[[4-[(дифенилметокси)метил] -1-пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина. Выход 95%. Этот продукт обрабатывали 0,45 г щавелевой кислоты и затем перекристаллизовывали из этанола с получением 1,8 г указанного в заголовке соединения. Выход 58%.
Т. пл. 125-127oC.
1H-NMR (DMSO-d6) δ: 1,36-1,79 (5H, m), 1,39 (3H, s), 1,96 (9H, s), 2,60-3,34 (10H, m), 5,40 (1H, s), 7,21-7,34 (10H, m).
Пример 25
2-[[4-[2-(Дифенилметокси)этил] -1-пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминоксалат
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 4-[2-(дифенилметокси)этил]пиперидин, в других отношениях повторяли процедуру примера 24 с получением указанного в заголовке соединения. Выход 32%.
Т. пл. 107-110oC (перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ: 1,36-1,72 (7H, m), 1,43 (3H, s), 1,96 (9H, s), 2,70-2,88 (3H, m), 3,00-3,25 (4H, m), 3,38-3,45 (3H, m), 5,40 (1H, s), 7,20-7,39 (10H, m).
Пример 26
2-[[4-[3-(Дифенилметокси)пропил] -1-пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминоксалат
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 4-[3-(дифенилметокси)пропил] пиперидин, в других отношениях повторяли процедуру примера 24 с получением указанного в заголовке соединения. Выход 40%.
Т. пл. 109-111oC (перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ: 1,22-1,80 (9H, m), 1,40 (3H, s), 1,98 (9H, s), 2,65-3,40 (10H, m), 5,40 (1H, s), 7,20-7,38 (10H, m).
Пример 27
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(2-фенилэтил)-1-пиперазинил] метил] -5-бензофуранамин
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и 1-(2-фенилэтил)пиперазин, в других отношениях повторяли процедуру примера 1 с получением указанного в заголовке соединения. Выход 50%.
Т. пл. 99-100oC (перекристаллизованное из смеси диизопропиловый эфир-пентан).
1H-NMR (CDCl3) δ: 1,33 (3H, s), 1,98 (6H, s), 2,00 (3H, s), 2,38-2,75 (15H, m), 3,04 (1H, d, J = 15,0 Hz), 7,08-7,19 (5H, m).
Пример 28
2-[[4-[Бис(4-фторфенил)метокси] -1-пиперидинил] метил] -2,3- дигидро-2,4,6,7-тетраметил-5-бензофуранаминоксалат
Суспензию 4-[бис(4-фторфенил)метокси]пиперидина (3,8 г), полученную так, как в ссылочном примере 27, 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,4 г) и карбоната калия (1,4 г) в N,N-диметилацетамиде (10 мл) нагревали с обратным холодильником под газообразным азотом в течение 15 часов. Эту реакционную смесь разбавляли водой и экстрагировали 2 порциями этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (гексан: этилацетат = 2: 1-1: 1) с получением 2-[[4-[бис(4-фторфенил)метокси] -1- пиперидинил)метил]-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина. Этот продукт растворяли в этаноле с последующим прибавлением 1 эквивалента раствора щавелевой кислоты в этаноле. Эту смесь нагревали и полученный раствор концентрировали при пониженном давлении и перекристаллизовывали из метанола с получением 1,5 г указанного в заголовке соединения. Выход 52%.
Т. пл. 181-185oC.
1H-NMR (DMSO-d6) δ: 1,40 (3H, s), 1,6-2,1 (4H, m), 1,96 (9H, s), 2,6-3,3 (8H, m), 3,3-3,6 (1H, m), 5,68 (1H, s), 7,15 (4H, t, J = 9,0 Hz), 7,39 (4H, dd, J = 8,6, 5,6 Hz).
Пример 29
2,3-Дигидро-2-[[4-(4-метоксибензил)-1-пиперазинил] метил)-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2,3-дигидро-2-[[4-(4-метоксибензоил)-1- пиперазинил]метил] -2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 85%.
Т. пл. 197-202oC (перекристаллизованное из смеси вода-этанол).
1H-NMR (DMSO-d6) δ: 1,48 (3H, s), 2,03 (3H, s), 2,23 (6H, s), 2,70-4,40 (17H, m), 6,99 (2H, d, J = 8,8 Hz), 7,53 (2H, d, J = 8,8 Hz), 9,80 (2H, br, s).
Пример 30
2,3-дигидро-2-[[4-(3-метоксибензил)-1-пиперазинил]метил]-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2,3-дигидро-2-[[4-(3-метоксибензоил)-1-пиперазинил]метил]-2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 74%.
Т. пл. 196-199oC (перекристаллизованное из смеси вода-этанол).
1H-NMR (DMSO-d6) δ: 1,54 (3H, s), 2,04 (3H, s), 2,24 (6H, s), 2,97 (1H, d, J = 16,2 Hz), 3,20-4,50 (16H, m), 7,01 (1H, d, J = 8,0 Hz), 7,18 (1H, d, J = 7,0 Hz), 7,30-7,46 (2H, m), 9,90 (2H, br, s).
Пример 31
2,3-Дигидро-2-[[4-(2-метоксибензил)-1-пиперазинил]метил]-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2,3-дигидро-2-[[4-(2-метоксибензоил)-1-пиперазинил]метил]-2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 67%.
Т. пл. 202-204oC (перекристаллизованное из смеси метанол-этанол).
1H-NMR (DMSO-d6) δ: 1,54 (3H, s), 2,03 (3H, s), 2,24 (6H, s), 2,70-3,80 (10H, m), 3,86 (3H, s), 4,10-4,70 (4H, m), 7,00-7,20 (2H, m), 7,40-7,70 (2H, m), 9,83 (2H, br, s).
Пример 32
2-[[4-(3,4-Диметоксибензил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2,3-дигидро-2-[[4-(3,4-диметоксибензоил)-1-пиперазинил] метил] -2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 77%.
Т. пл. 176-179oC (перекристаллизованное из смеси вода-этанол).
1H-NMR (DMSO-d6) δ: 1,49 (3H, s), 2,03 (3H, s), 2,22 (6H, s), 2,70-4,40 (20H, m), 6,98 (1H, d, J = 7,6 Hz), 7,08 (1H, d, J = 7,6 Hz), 7,39 (1H, s), 9,80 (2H, br, s).
Пример 33
2-[[4-(4-Хлорбензил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-[[4-(4-хлорбензоил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 91%.
Т. пл. 198-200oC (перекристаллизованное из смеси вода-этанол).
1H-NMR (DMSO-d6) δ: 1,43 (3H, s), 2,02 (3H, s), 2,20 (3H, s), 2,22 (3H, s), 2,70-4,40 (14H, m), 7,54 (2H, d, J = 7,6 Hz), 7,63 (2H, d, J = 7,6 Hz), 9,75 (2H, br, s).
Пример 34
2,3-Дигидро-2,4,6,7-тетраметил-2-[[4-(4-метилбензил)-1-пиперазинил] метил]-5-бензофуранаминтригидрохлорид
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[[4-(4-метилбензоил)-1-пиперазинил]метил]-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 36%.
Т. пл. 183-186oC (перекристаллизованное из смеси вода-этанол).
1H-NMR (DMSO-d6) δ: 1,50 (3H, s), 2,00 (3H, s), 2,20 (6H, s), 2,34 (3H, s), 2,80-4,20 (12H, m), 4,28 (2H, s), 7,25 (2H, d, J = 7,6 Hz), 7,49 (2H, d, J = 7,6 Hz), 9,78 (2H, br, s).
Пример 35
2-[[4-(4,4-Дифенилбутирил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1-пиперазинил]метил]-5-бензофуранамин и 4,4-дифенилмасляную кислоту, в других отношениях повторяли процедуру примера 10 с получением указанного в заголовке соединения. Выход 29%.
Т. пл. 135-138oC (перекристаллизованное из смеси этилацетат-диизопропиловый эфир).
1H-NMR (CDCl3) δ: 1,41 (3H, s), 2,07 (9H, s), 2,10-2,70 (10H, m), 2,80 (1H, d, J = 14,7 Hz), 3,09 (1H, d, J = 14,7 Hz), 3,10-3,40 (4H, m), 3,55 (2H, t, J = 5,2 Hz), 3,95 (1H, t, J = 7,7 Hz), 7,10-7,70 (10H, m).
Пример 36
2-[[4-(4,4-Дифенилбутил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-[[4-(4,4-дифенилбутирил)-1-пиперазинил] метил]-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 54%.
Т. пл. 190-192oC (перекристаллизованное из смеси метанол-диэтиловый эфир).
1H-NMR (DMSO-d6) δ: 1,50 (3H, s), 1,55-1,65 (2H, m), 2,03 (5H, br, s), 2,23 (6H, s), 2,60-4,30 (15H, m), 7,10-7,40 (10H, m), 9,70-10,00 (2H, br, s).
Пример 37
2-[[4-(5,5-Дифенилвалерил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин
Использовав 2,3-дигидро-2,4,6,7-тетраметил-2-[(1-пиперазинил]метил]-5-бензофуранамин и 5,5-дифенилвалериановую кислоту, в других отношениях повторяли процедуру примера 10 с получением указанного в заголовке соединения. Выход 86%.
Масло.
1H-NMR (CDCl3) δ: 1,41 (3H, s), 1,50-1,70 (2H, m), 2,20-2,70 (21H, m), 2,81 (1H, d, J = 15,4 Hz), 3,09 (1H, d, J = 15,4 Hz), 3,28 (2H, t, J = 4,8 Hz), 3,53 (2H, t, J = 4,8 Hz), 3,90 (1H, t, J = 8,2 Hz), 7,20-7,40 (10H, m).
Пример 38
2-[[4-(5,5-Дифенилпентил)-1-пиперазинил] метил] -2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
Использовав 2-[[4-(5,5-дифенилвалерил)-1-пиперазинил] метил]-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин, в других отношениях повторяли процедуру примера 11 с получением указанного в заголовке соединения. Выход 86%.
Т. пл. 177-181oC (перекристаллизованное из смеси метанол-диэтиловый эфир).
1H-NMR (DMSO-d6) δ: 1,05-1,25 (2H, m), 1,44 (3H, s), 1,60-1,80 (2H, m), 1,90-2,10 (5H, m), 2,21 (6H, s), 2,40-4,00 (15H, m), 7,10-7,40 (10H, m), 9,75 (2H, br, s).
Пример 39
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и N-(дифенилметил)-4-пиперидинамин, в других отношениях повторяли процедуру примера 1 с получением указанного в заголовке соединения. Выход 38%.
Т. пл. 128-129oC (перекристаллизованное из смеси этилацетат-гексан).
1H-NMR (CDCl3) δ: 1,25-1,49 (2H, m), 1,39 (3H, s), 1,79-1,92 (2H, m), 2,00-2,19 (2H, m), 2,05 (3H, s), 2,06 (3H, s), 2,08 (3H, z), 2,30-2,54 (3H, m), 2,73-2,84 (2H, m), 2,96-3,11 (2H, m), 5,00 (2H, s), 7,17-7,39 (10H, m).
Пример 40
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинаминтригидрохлорид
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин (2,2 г) обрабатывали 4 Н раствором HCl в этаноле и полученный тригидрохлорид перекристаллизовывали из смеси этанол-диэтиловый эфир с получением 2,5 г указанного в заголовке соединения. Выход 87%.
Т. пл. 200-203oC (разлож.).
1H-NMR (DMSO-d6) δ: 1,57 (3H, s), 2,04 (3H, s), 2,18-2,59 (4H, m), 2,23 (6H, s), 2,98-3,76 (9H, m), 5,74 (1H, s), 7,30-7,44 (6H, m), 7,86-7,90 (4H, m).
Пример 41
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(дифенилметил)-4-пиперидинэтиламинтригидрохлорид
К раствору трет-бутил [2-[[4-[2-[(дифенилметил)амино]этил]-1-пиперидинил]метил]-2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамата (1,6 г) в этаноле (3 мл) прибавляли 10 мл 4 Н раствора HCl в этаноле и смесь перемешивали при комнатной температуре в течение 15 часов. Эту реакционную смесь подщелачивали водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl и сушили над MgSO4. Отгоняли при пониженном давлении растворитель с получением 1,3 г 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил]-N-(дифенилметил)-4-пиперидинэтиламина. Выход 97%. Этот продукт обрабатывали 4 Н раствором HCl в этаноле и полученный тригидрохлорид перекристаллизовывали из смеси этанол-диэтиловый эфир с получением 1,3 г указанного в заголовке соединения. Выход 76%.
Т. пл. 197-199oC (разлож.).
1H-NMR (DMSO-d6) δ: 1,50-1,80 (7H, m), 1,57 (3H, s), 2,04 (3H, s), 2,24 (6H, s), 2,80-3,75 (10H, m), 5,60 (1H, br, s), 7,38-7,58 (6H, m), 7,78 (4H, d, J = 7,8 Hz).
Пример 42
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(3,3-дифенилпропил)-4-пиперидинэтиламинтригидрохлорид
Использовав трет-бутил [2-[[4-[2-[(3,3-дифенилпропил)амино]этил]-1-пиперидинил] метил] -2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамат, в других отношениях повторяли процедуру примера 41 с получением указанного в заголовке соединения. Выход 23%.
Т. пл. 180-181oC (перекристаллизованное из смеси этанол-диэтиловый эфир).
1H-NMR (DMSO-d6) δ : 1,58 (3H, s), 1,77 (9H, br, s), 2,05 (3H, s), 2,23 (6H, s), 2,73-3,69 (12H, m), 4,10-4,14 (1H, m), 7,18-7,32 (10H, m).
Пример 43
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(дифенилметил)-4-пиперидинметиламиндигидрохлорид
К раствору 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(дифенилметил)-4-пиперидинкарбоксамида (1,3 г) в тетрагидрофуране (20 мл) прибавляли 17 мл 1 М раствора боран тетрагидрофуранового комплекса в тетрагидрофуране при охлаждении льдом и смесь нагревали с обратным холодильником под газообразным азотом в течение 23 часов. После охлаждения реакционной смеси льдом, прибавляли по каплям 12 мл 5 Н хлороводородной кислоты и смесь концентрировали при пониженном давлении. Остаток нейтрализовали гидрокарбонатом натрия и экстрагировали 2 порциями этилацетата. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgS04, фильтровали и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (гексан: этанол = 10: 1) с получением 0,89 г 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - N-(дифенилметил)-4-пиперидинметиламина. Выход 68%. Этот продукт растворяли в метаноле и прибавляли по каплям стехиометрический избыток 10%-ного раствора HCl в метаноле. Смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения.
Аморфное твердое вещество.
1H-NMR (DMSO-d6) δ : 1,3-2,2 (5H, m), 1,48 (3H, s), 1,98 (3H, s), 2,00 (6H, s), 2,3-3,7 (10H, m), 4,0-4,3 (1H, br), 5,48 (1H, br, s), 7,2-7,6 (6H, m), 7,6-7,9 (4H, m).
Пример 44
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(2,2-дифенилэтил)-4-пиперидинметиламинтригидрохлорид
К раствору 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(2,2-дифенилэтил)-4-пиперидинкарбоксамида (1,0 г) в тетрагидрофуране (20 мл) прибавляли 12 мл 1 М раствора боран тетрагидрофуранового комплекса в тетрагидрофуране по каплям при охлаждении льдом и смесь нагревали с обратным холодильником под газообразным азотом в течение 6 часов. После охлаждения реакционной смеси льдом прибавляли по каплям 8 мл 5 Н хлороводородной кислоты с последующим перемешиванием. Смесь прибавляли по каплям к суспензии гидрокарбоната натрия (4 г) в смеси вода-диизопропиловый эфир для ее нейтрализации и экстрагировали 2 порциями этилацетата. Объединенный органический слой промывали насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали. После растворения остатка в метаноле прибавляли 10 мл 5 Н хлороводородной кислоты и смесь нагревали с обратным холодильником в течение 1 часа. После охлаждения льдом смесь разбавляли 20 мл 5 Н водного раствора гидроксида натрия и экстрагировали 3 порциями диэтилового эфира. Объединенный органический слой промывали водой и насыщенным водным раствором NaCl, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (гексан: этилацетат: триэтиламин = 30:10:1-20:10:1) с получением 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N-(2,2-дифенилэтил)-4-пиперидинметиламина. Растворив этот продукт в метаноле прибавляли по каплям стехиометрический избыток 10%-ного раствора HCl в метаноле и полученную смесь концентрировали при пониженном давлении с получением 0,74 г указанного в заголовке соединения. Выход 61%.
Аморфное твердое вещество.
1H-NMR (DMSO-d6) δ : 1,4-2,3 (5H, m), 1,57 (3H, s), 2,04 (3H, s), 2,23 (6H, s), 2,6-3,8 (12H, m), 4,6-4,8 (1H, m), 7,1-7,5 (10H, m), 8,9-9,2 (2H, br), 9,5-10,1 (3H, br), 10,3-10,6 (1H, br).
Пример 45
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(3,3-дифенилпропил)-4-пиперидинметиламиндигидрохлорид
Использовав 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил]-N-(3,3-дифенилпропил)-4-пиперидинкарбоксамид (свободное основание, полученное в ссылочном примере 50), в других отношениях повторяли процедуру примера 44 с получением указанного в заголовке соединения. Выход 46%.
Т. пл. 168-172oC (кристаллизованное из смеси метанол-диэтиловый эфир).
1H-NMR (DMSO-d6) δ : 1,3-2,2 (5H, m), 1,46 (3H, br, s), 1,98 (9H, s), 2,3-3,5 (14H, m), 4,09 (1H, t, J = 7,5 Hz), 7,1-7,4 (10H, m).
Пример 46
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-бензил-N-(3,3-дифенилпропил)-4-пиперидинаминтригидрохлорид
Использовав 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и N-бензил-N-(3,3-дифенилпропил)-4-пиперидинамин, в других отношениях повторяли процедуру примера 1 с получением 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-бензил-N-(3,3-дифенилпропил)-4-пиперидинамина. Выход 60%.
Масло.
1H-NMR (CDCl3) δ : 1,39 (3H, s), 1,45-1,61 (4H, m), 1,97-2,18 (4H, m), 2,05 (3H, s), 2,07 (3H, s), 2,08 (3H, s), 2,37-2,54 (5H, m), 2,72-2,89 (2H, m), 3,02-3,10 (2H, m), 3,58 (2H, s), 3,94 (1H, t, J = 7,6 Hz), 7,11-7,30 (15H, m).
Полученный описанным выше образом 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] -N- бензил-N-(3,3-дифенилпропил)-4-пиперидинамин (1,0 г) обрабатывали 4 Н раствором HCl в этаноле и полученный тригидрохлорид перекристаллизовывали из смеси этанол-диэтиловый эфир с получением 0,65 г указанного в заголовке соединения. Выход 53%.
Т. пл. 185-187oC.
1H-NMR (DMSO-d6) δ : 1,59 (3H, s), 1,93-2,55 (6H, m), 2,06 (3H, s), 2,24 (6H, s), 2,76-3,60 (9H, m), 3,79-3,94 (3H, m), 4,23-4,49 (2H, m), 7,16-7,23 (10H, m), 7,38-7,42 (3H, m), 7,66-7,71 (2H, m).
Пример 47
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(3,3-дифенилпропил)-4-пиперидинаминтригидрохлорид
К раствору 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-бензил-N-(3,3-дифенилпропил)-4-пиперидинамина (1,5 г) в этаноле (50 мл) прибавляли 0,30 г 5%-ного палладия на углероде (50%-ный водный раствор) и смесь перемешивали в среде водорода при давлении 5 атмосфер и при 40oC в течение 6 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением 1,2 г 1-[(5-амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - N-(3,3-дифенилпропил)-4-пиперидинамина. Выход 94%. Этот продукт обрабатывали 4 Н раствором HCl в этаноле и полученный тригидрохлорид перекристаллизовывали из смеси этанол-диэтиловый эфир с получением 1,3 г указанного в заголовке соединения. Выход 82%.
Т. пл. 187-189oC (разлож.).
1H-NMR (DMSO-d6) δ : 1,58 (3H, s), 2,02-2,26 (4H, m), 2,05 (3H, s), 2,23 (6H, s), 2,78 (2H, br, s), 3,00-3,55 (10H, m), 3,77-3,91 (1H, m), 4,14 (1H, t, J = 7,6 Hz), 7,20-7,33 (10H, m).
Пример 48
2-[2-[4-(Дифенилметокси)-1-пиперидинил] этил] -2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранаминоксалат
Использовав в качестве исходного материала трет-бутил [2-[2-[4-(дифенилметокси)-1-пиперидинил] этил] -2,3-дигидро-2,4,6,7- тетраметилбензофуран-5-ил] карбамат, в других отношениях повторяли процедуру примера 41 с получением 2-[2-[4-(дифенилметокси)-1-пиперидинил]этил]-2,3-дигидро-2,4,6,7- тетраметил-5-бензофуранамина. Выход 84%. Это соединение преобразовывали в оксалат и перекристаллизовывали из этанола с получением указанного в заголовке соединения. Выход 45%.
Т. пл. 137-139oC.
1H-NMR (DMSO-d6) δ : 1,31 (3H, s), 1,62-2,01 (6H, m), 1,94 (6H, s), 1,96 (3H, s), 2,77-3,20 (8H, m), 3,53 (1H, br, s), 5,65 (1H, s), 7,20-7,38 (10H, m).
Пример 49
2-[2-[4-[(Дифенилметокси)метил] -1-пиперидинил] этил] -2,3- дигидро-2,4,6,7-тетраметил-5-бензофуранаминдиоксалат
Использовав трет-бутил [2-[2-[4-[(дифенилметокси)метил]-1- пиперидинил] этил] -2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил] карбамат, в других отношениях повторяли процедуру примера 48 с получением указанного в заголовке соединения. Выход 20%.
Т. пл. 160-162oC (перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ : 1,28-1,66 (2H, m), 1,36 (3H, s), 1,84-2,10 (5H, m), 1,99 (9H, s), 2,81-3,16 (6H, m), 3,25-3,30 (2H, m), 3,41-3,56 (2H, m), 5,43 (1H, s) 7,20-7,37 (10H, m).
Пример 50
2-[2-[4-[2-(Дифенилметокси)этил] -1-пиперидинил] этил] -2,3- дигидро-2,4,6,7-тетраметил-5-бензофуранаминоксалат
Использовав трет-бутил [2-[2-[4-[2-(дифенилметокси)-этил]-1- пиперидинил] этил] -2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил]карбамат, в других отношениях повторяли процедуру примера 48 с получением указанного в заголовке соединения. Выход 54%.
Т. пл. 119-121oC (перекристаллизованное из этанола).
1H-NMR (DMSO-d6) δ : 1,24-2,10 (9H, m), 1,34 (3H, s), 1,96 (6H, s), 1,98 (3H, s), 2,79-3,14 (6H, m), 3,36-3,43 (4H, m), 5,41 (1H, s), 7,20-7,38 (10H, m).
Пример 51
N-2-[[4-[4-(Дифенилметокси)бутил] -1-пиперазинил] метил] -2,3- дигидро-2,4,6,7-тетраметилбензофуран-5-ил]ацетамид
К суспензии 2-[[4-[4-(дифенилметокси)бутил] -1-пиперазинил]метил]-2,3- дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорида (0,60 г) в тетрагидрофуране (10 мл) прибавляли 8 мл 1 Н водного раствора гидроксида натрия и 0,10 мл уксусного ангидрида при охлаждении льдом и смесь перемешивали в течение 1 часа. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат: метанол = 9:1) с получением 0,48 г указанного в заголовке соединения. Выход 93%.
Масло.
1H-NMR (CDCl3) δ : 1,42 (3H, s), 1,62 (4H, br, s), 2,05-2,82 (25H, m), 3,08-3,17 (1H, m), 3,41-3,47 (2H, m), 5,32 (1H, s), 6,58-6,62 (1H, m), 7,20-7,33 (10H, m).
Пример 52
2-[[4-[4-(Дифенилметокси)бутил] -1-пиперазинил] метил] -N- этил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранаминтригидрохлорид
К раствору N-2-[[4-[4-(Дифенилметокси)бутил] -1-пиперазинил] метил] - 2,3-дигидро-2,4,6,7-тетраметилбензофуран-5-ил] ацетамида (0,48 г) в тетрагидрофуране (20 мл) прибавляли 64 мг литийалюминийгидрида и смесь нагревали с обратным холодильником под газообразным аргоном в течение 15 часов. Эту реакционную смесь разбавляли небольшим количеством воды и прибавляли этилацетат, MgSO4 и Hyflo Super-Cel (торговый знак). Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат:метанол = 95:5) с получением 0,32 г 2-[[4-[4-(дифенилметокси)бутил] -1-пиперазинил] метил]-N- этил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина. Выход 68%. Этот продукт обрабатывали 4 Н раствором HCl в этаноле и полученный тригидрохлорид перекристаллизовывали из смеси этанол-диэтиловый эфир с получением 0,32 г указанного в заголовке соединения. Выход 55%.
Т. пл. 156-158oC.
1H-NMR (DMSO-d6) δ : 1,33 (3H, t, J = 7,2 Hz), 1,57-1,63 (5H, m), 1,73-1,85 (2H, m), 2,05 (3H, s), 2,30 (3H, s), 2,33 (3H, s), 2,98-3,60 (18H, m), 5,44 (1H, s), 7,22-7,40 (10H, m).
Пример 53
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-[бис(4-фторфенил)метил]-4-пиперидинамин
Суспензию 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамина (1,4 г), N-[бис(4-фторфенил)метил] -4-пиперидинамина (4,5 г) и карбоната калия (1,4 г) в N,N-диметилацетамиде с (20 мл) перемешивали под газообразным аргоном при 172oC в течение 4,5 часов. Эту реакционную смесь разбавляли водой и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии (силикагель/этилацетат и основный силикагель/гексан:этилацетат = 9:1-85:15) и перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (0,97 г, выход 39%).
Т. пл. 133-134oC.
1H-NMR (CDCl3) δ : 1,24-1,47 (2H, m), 1,40 (3H, s), 1,78-1,91 (2H, m), 1,96-2,18 (2H, m), 2,05 (3H, s), 2,07 (3H, s), 2,08 (3H, s), 2,23-2,55 (3H, m), 2,74-2,96 (2H, m), 2,95-3,12 (2H, m), 4,97 (1H, s), 6,97 (4H, t, J = 8,8 Hz), 7,20-7,40 (4H, m).
Пример 54
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-[бис(4-метоксифенил)метил]-4-пиперидинамин
Использовав в качестве исходных материалов 2-бромметил-2,3-дигидро-2,4,6,7-тетраметил-5-бензофуранамин и N-[бис(4-метоксифенил)метил]-4-пиперидинамин, в других отношениях повторяли процедуру примера 53 с получением указанного в заголовке соединения. Выход 43%.
Т. пл. 109-111oC.
1H-NMR (CDCl3) δ : 1,25-1,46 (2H, m), 1,40 (3H, s), 1,76-2,55 (9H, m), 2,05 (3H, s), 2,07 (3H, s), 2,08 (3H, s), 2,72-2,86 (2H, m), 2,96-3,12 (2H, m), 3,77 (6H, s), 4,92 (1H, s), 6,82 (4H, d, J = 8,8 Hz), 7,26 (4H, d), J = 8,8 Hz).
Пример 55
(R)-1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил]-N-(дифенилметил)-4-пиперидинамин
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(дифенилметил)-4-пиперидинамин подвергали препаративной высокоэффективной жидкостной хроматографии (колонка: CHIRALCEL OD (20 х 250 мм, Daicel Chemical Industry, Ltd.), подвижная фаза: гексан-2-пропанол = 95:5); расход: 80 мл/мин, температура колонки: 30oC) с получением указанного в заголовке соединения.
[α]D= -21,4° (c = 0,496, этанол)
Пример 56
(S)-1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил]-N-(дифенилметил)-4-пиперидинамин
1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил] -N-(дифенилметил)-4-пиперидинамин подвергали препаративной высокоэффективной жидкостной хроматографии (колонка: CHIRALCEL OD (20 х 250 мм, Daicel Chemical Industry, Ltd.), подвижная фаза: гексан-2-пропанол = 95:5); расход: 80 мл/мин, температура колонки: 30oC) с получением указанного в заголовке соединения.
[α]D= +21,5° (c = 0,549, этанол)
Пример 57
(R)-1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил]-N-(дифенилметил)-4-пиперидинаминсульфат
К раствору (R)-1-[(5-амино-2,3-дигидро-2,4,6,7- тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамина (3,5 г) в смеси метанола (15 мл) и этилацетата (5 мл) прибавляли 2 Н серную кислоту (7,5 мл) и смесь концентрировали при пониженном давлении. К остатку прибавляли метанол (15 мл) и смесь стояла в течение 18 часов. Образовавшееся твердое вещество собирали, высушивали и перекристаллизовывали из смеси метанол-вода с получением 3,5 г указанного в заголовке соединения. Выход 76%.
[α]D= -8,0° (c = 0,51, этанол)
Т. пл. 154-156oC.
1H-NMR (DMSO-d6) δ : 1,33 (3H, s), 1,52-2,20 (4H, m), 1,95 (9H, s), 2,15-2,30 (1H, s), 2,58-2,82 (4H, m), 2,97-3,25 (4H, m), 5,52 (1H, br, s), 7,28-7,42 (6H, m), 7,52-7,58 (4H, m).
Пример 58
(S)-1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил]-N-(дифенилметил)-4-пиперидинаминсульфат
Использовав (S)-1-[(5-амино-2,3-дигидро-2,4,6,7- тетраметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин и 2 Н серной кислоты, в других отношениях повторяли процедуру примера 57 с получением указанного в заголовке соединения. Выход 68%.
[α]D= +8,5° (c = 0,52, этанол)
Т. пл. 155-157oC (перекристаллизованное из смеси метанол-вода).
1H-NMR (DMSO-d6) δ : 1,34 (3H, s), 1,53-2,07 (4H, m), 1,95 (9H, s), 2,23 (1H, br, s), 2,59-2,81 (4H, m), 2,99-3,28 (4H, m), 5,52 (1H, br, s), 7,28-7,43 (6H, m), 7,52-7,57 (4H, m).
Пример 59
(S)-1-[(5-Амино-2,3-дигидро-2,4,6,7-тетраметилбензофуран-2- ил)метил]-N-(дифенилметил)-4-пиперидинамин
4-Нитроанилин (0,14 г) растворяли в 2 Н хлороводородной кислоте (3 мл) при нагревании и раствор охлаждали льдом. К этому раствору прибавляли по каплям раствор нитрита натрия (72 мг) в воде (0,5 мл) и смесь перемешивали 15 минут. Водный раствор полученного при этом 4-нитробензолдиазонийхлорида прибавляли к раствору (S)-1-[(2,3-дигидро-2,4,6,7-тетраметилбензофуран-2-ил)метил] - N-(дифенилметил)-4-пиперидинамина (0,43 г) в уксусной кислоте (3 мл) при охлаждении и смесь перемешивали при комнатной температуре в течение 12 часов. Эту реакционную смесь вливали в насыщенный водный раствор карбоната натрия и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия, сушили над MgSO4, и концентрировали при пониженном давлении. К полученному при этом (S)-1-[[2,3-дигидро-2,4,6,7-тетраметил-5-(4- нитрофенилазо)бензофуран-2-ил]метил]-N-(дифенилметил)-4-пиперидинамину прибавляли этанол (30 мл) и никель Ренея (Kawaken Fine Chemical NDHT-90) (0,6 г) и смесь перемешивали в среде водорода при 5 атм и комнатной температуре в течение 1 часа. Эту реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан:этилацетат = 1: 1) с получением 0,32 г указанного в заголовке соединения. Выход 71%.
1H-NMR (CDCl3) δ : 1,25-1,52 (2H, m), 1,40 (3H, s), 1,78-2,20 (4H, m), 2,05 (3H, s), 2,06 (3H, s), 2,08 (3H, s), 2,30-2,54 (3H, m), 2,72-2,83 (2H, m), 2,95-3,11 (2H, m), 5,01 (1H, s), 7,15-7,40 (10H, m).
Пример 60
1-[(5-Амино-2,3-дигидро-7-изопропил-2,4,6-триметилбензофуран-2-ил)метил] -N-(дифенилметил)-4-пиперидинамин
Суспензию 2,3-дигидро-2-(йодметил)-7-изопропил-2,4,6-триметил-5-бензофуранамина (1,1 г), N-(дифенилметил)-4-пиперидинамина (1,4 г) и карбоната калия (0,83 г) в N,N-диметилацетамиде (6 мл) нагревали с обратным холодильником в течение 4,5 часов. Смесь разбавляли водой и продукт экстрагировали два раза этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и выпаривали в вакууме. Остаток очищали путем колоночной хроматографии на основном силикагеле (гексан: этилацетат = 20:1-5:1) и перекристаллизовывали из смеси гексан-этилацетат с получением 1,4 г указанного в заголовке соединения. Выход 91%.
Аморфное твердое вещество.
1H-NMR (CDCl3) δ : 1,20-1,50 (2H, m), 1,25 (3H, d, J = 7,4 Hz), 1,26 (3H, d, J = 6,8 Hz), 1,33 (3H, s), 1,70-2,55 (5H, m), 2,04 (3H, s), 2,12 (3H, s), 2,51 (2H, s), 2,67 (1H, d, J = 15,0 Hz), 2,78-3,29 (3H, m), 3,12 (1H, d, J = 15,0 Hz), 5,01 (1H, s), 7,12-7,47 (10H, m).
Химические формулы соединений, полученных в примерах 1-60, показаны в таблицах 1-5.
Пример 1 изготовления лекарственного средства
Соединение, полученное в примере 5, растворяли в 30%-ном (масса/объем) растворе полиэтиленгликоля 400 в физиологическом растворе с получением 0,01%-ного раствора соединения. Этот раствор фильтровали через бактериальный фильтр и разливали по флаконам (10 мл на флакон), получив в результате инъекционный раствор для внутривенного введения, содержавший 1 мг соединения в каждом флаконе.
Пример 2 изготовления лекарственного средства
(S)-2,3-Дигидро-2,4,6,7-тетраметил-2-[(4-фенил-1- пиперидинил)метил] -5-бензофуранаминдигидрохлорид растворяли в 30%-ном (масса/объем) растворе полиэтиленгликоля 400 в физиологическом растворе с получением 0,01%-ного раствора соединения. Раствор фильтровали через бактериальный фильтр и разливали по флаконам (10 мл на флакон), получив в результате инъекционный раствор для внутривенного введения, содержавший 1 мг соединения в каждом флаконе.
Пример 3 изготовления лекарственного средства
(1) Соединение примера 5 - 1,0 г
(2) Лактоза - 60,0 г
(3) Кукурузный крахмал - 35,0 г
(4) Желатин - 3,0 г
(5) Стеарат магния - 2,0 г
Использовав 30 мл 10%-ного по массе водного раствора желатина (3,0 г в виде желатина), смесь 1,0 г соединения, полученного в примере 5, 60,0 г лактозы и 35,0 г кукурузного крахмала гранулировали через сито с диаметром отверстий 1 мм, высушивали при 40oC и вновь пропускали через сито. Полученные гранулы смешивали с 2,0 г стеарата магния и смесь прессовали. Полученные таблетки ядра покрывали суспензией сахарозы, диоксида титана, талька и аравийской камеди в воде. Покрытые таблетки глазуровали пчелиным воском и в результате получили 1000 таблеток с покрытием.
Пример 4 изготовления лекарственного средства
Соединение, полученное в примере 40, растворяли в 30%-ном (масса/объем) растворе полиэтиленгликоля 400 в физиологическом растворе с получением 0,01%-ного раствора соединения. Этот раствор фильтровали через бактериальный фильтр и разливали по флаконам (10 мл на флакон), получив в результате инъекционный раствор для внутривенного введения, содержавший 1 мг соединения в каждом флаконе.
Экспериментальный пример 1
Испытание на связывание с натриевым каналом с использованием фракции коры головного мозга крыс
Для испытания использовали крыс Wistar (возраст 10-15 недель). Крысу умерщвляли путем обезглавливания и сразу же извлекали кору головного мозга. Затем с помощью гомогенизатора извлеченное корковое вещество гомогенизировали в примерно 10 объемах охлажденного льдом 0,32 М раствора сахарозы в 5 мМ гидрофосфата калия (pH 7,4, 4oC). Полученный гомогенат центрифугировали при 1000•g в течение 10 минут и затем супернатант центрифугировали при 20000•g в течение 15 минут. Осадок в пробирке после центрифугирования суспендировали и промывали в 0,32 М буферном растворе сахарозы и вновь центрифугировали при 20000•g в течение 15 минут. Извлекали остаток. Полученный описанным образом мембранный образец суспендировали в безнатриевом буфере для испытания (50 мМ HEPES, 5,4 мМ KCl, 0,8 мМ MgSO4, 5,5 мМ глюкозы, 130 мМ хлорида холина (pH 7,4)) и испытание на связывание проводили следующим образом. К 0,2 мл буфера для испытания, содержавшего испытуемое соединение, 1 мкМ тетродотоксина, 100 мкг/мл токсина скорпиона и 5 нМ [3H]-батракотоксинин A-20-α-бензоата (34,0 Ки/ммоль), добавляли 0,2 мл вышеупомянутой суспензии мембранного образца с получением конечного объема 0,4 мл и реакцию осуществляли в инкубаторе при 37oC в течение 1 часа. Эту реакционную смесь сразу же фильтровали путем отсасывания на фильтре CF/B и фильтр промывали 2 мл промывочного буфера (5 мМ HEPES, 1,8 мМ CaCl2, 0,8 мМ MgSO4, 130 мМ хлорида холина и 0,01% БСА (BSA) (pH 7,4, 4oC)) суммарно 3 раза. К фильтру добавляли 4 мл сцинтиллятора и измеряли радиоактивность с помощью жидкостного сцинтилляционного счетчика. Для определения неспецифического связывания добавляли 0,3 мМ вератридина.
Испытуемое соединение добавляли при конечных концентрациях 0,03, 0,1, 0,3, 1, 3, 10 и 30 мкМ и по ингибируемости вычисляли значение IC50.
Результаты показаны ниже.
Соединение - IC50 (мкМ)
Пример 1 - 0,22
Пример 2 - 0,28
Пример 3 - 0,26
Пример 4 - 0,28
Пример 5 - 0,52
Пример 6 - 0,79
Пример 17 - 0,32
Пример 24 - 0,41
Пример 25 - 0,34
Пример 26 - 0,22
Пример 27 - 0,20
Пример 28 - 0,22
Пример 29 - 0,21
Пример 30 - 0,39
Пример 31 - 0,49
Пример 32 - 0,25
Пример 33 - 0,31
Пример 34 - 0,42
Пример 40 - 0,16
Пример 41 - 0,14
Пример 42 - 0,16
Ссылочный пример 8 - 0,64
Ссылочный пример 10 - 0,47
Приведенные выше данные показывают, что соединения (I) и (Ia) имеют аффинитет к натриевому каналу.
Промышленное применение
Соединение (I) по настоящему изобретению и соединение (Ia) проявляют высокий аффинитет к натриевому каналу, в частности на участке 2, при низкой токсичности и малой опасности побочных эффектов. Поэтому они могут действовать как модуляторы натриевых каналов и, следовательно, полезны в качестве профилактических и лечебных средств для заболеваний и расстройств центральной нервной системы, таких, как ишемия центральной нервной системы, травма центральной нервной системы (например, травма головного мозга, повреждение спинного мозга, травма от резкого движения конечности и т.д.), эпилепсия, нейродегенеративные заболевания (например, боковой амиотрофический склероз (ALS), болезнь Альцгеймера, хорея Хантингтона, болезнь Паркинсона, диабетическая невропатия и т.д.), сосудистая деменция (например, многоинфарктная деменция, болезнь Бинсвангера и т.д.), маниакально-депрессивный психоз, депрессия, шизофрения, хроническая боль, невралгия тройничного нерва, мигрень и отек мозга. Кроме того, соединения (I) и (Ia) обладают высокой противоокислительной активностью и модулирующей активностью в отношении транспорта допамина и потому полезны в качестве профилактических и лечебных средств для других ишемических сердечно-сосудистых заболеваний (например, инфаркта миокарда, стенокардии и т.д.), атеросклероза и других заболеваний.
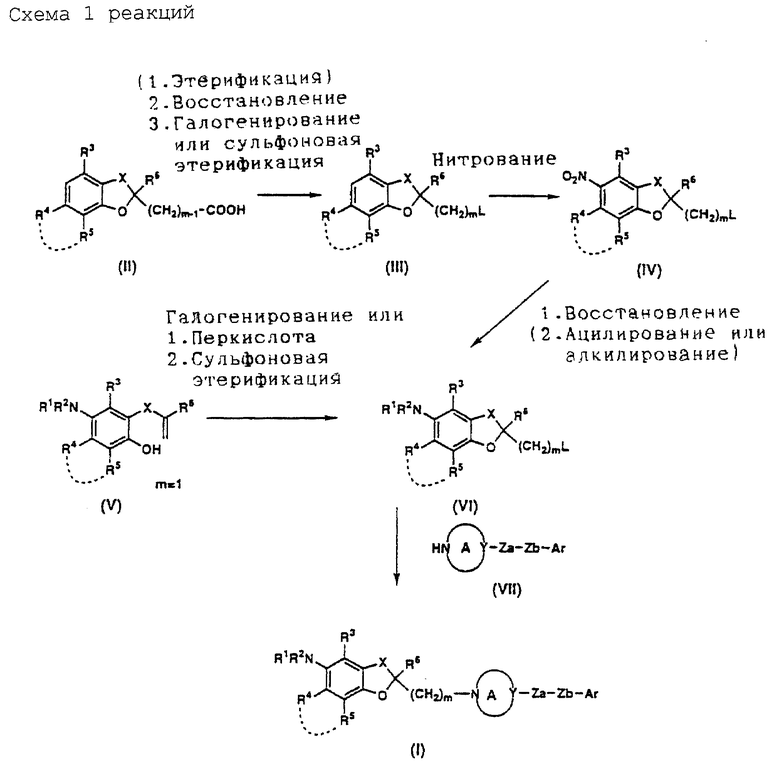
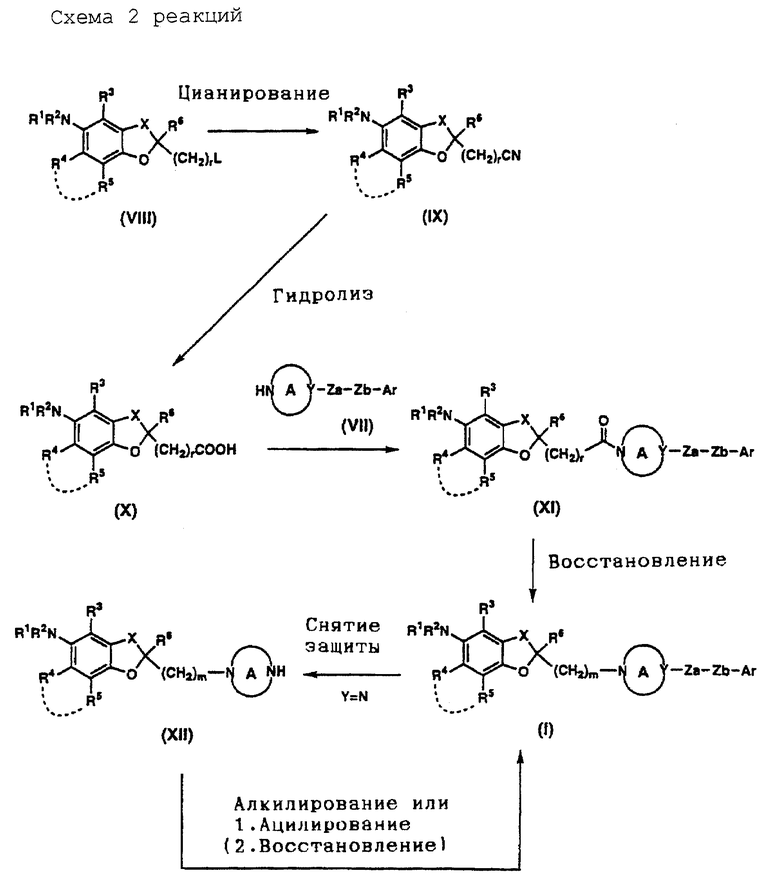
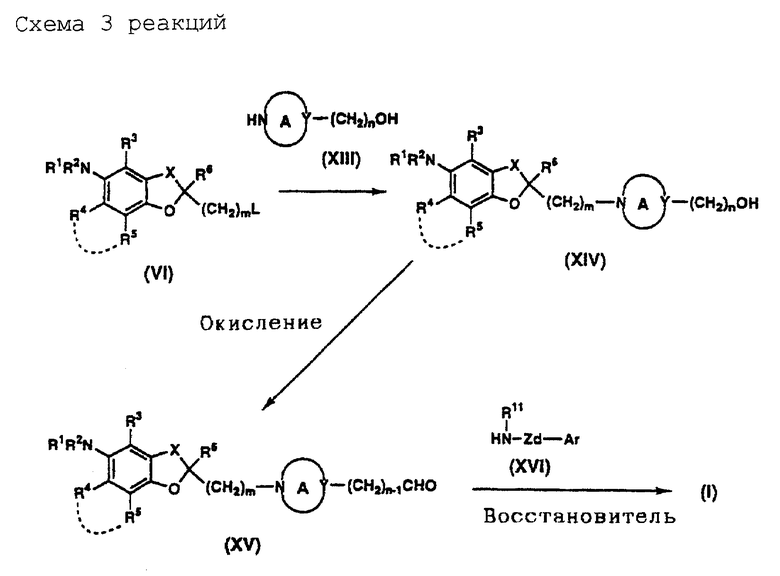
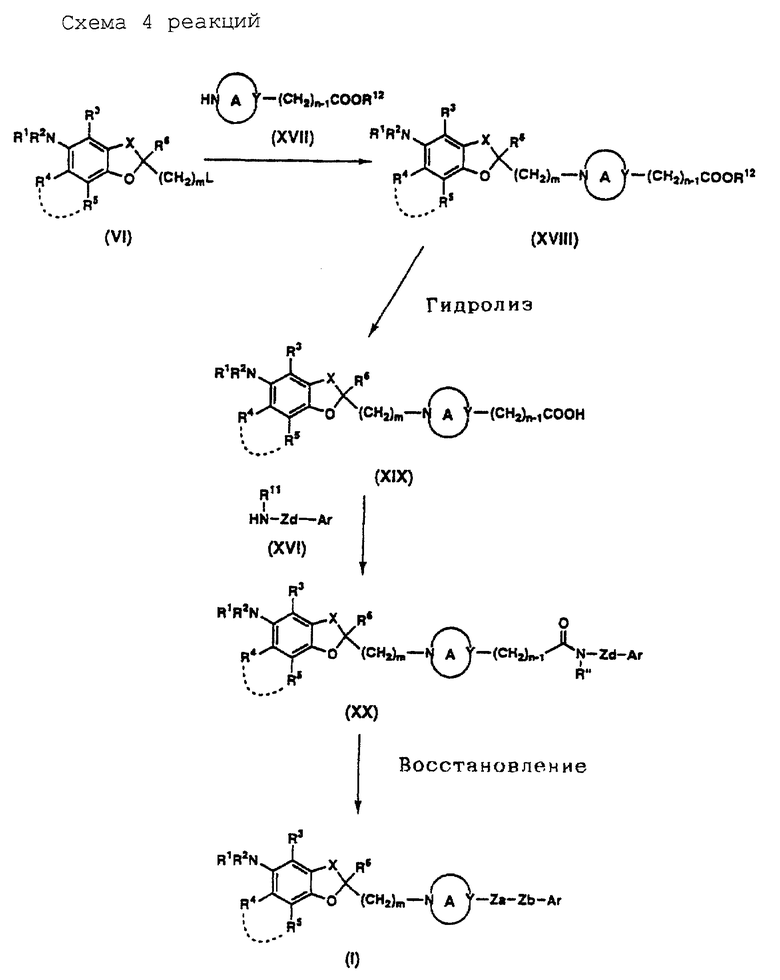
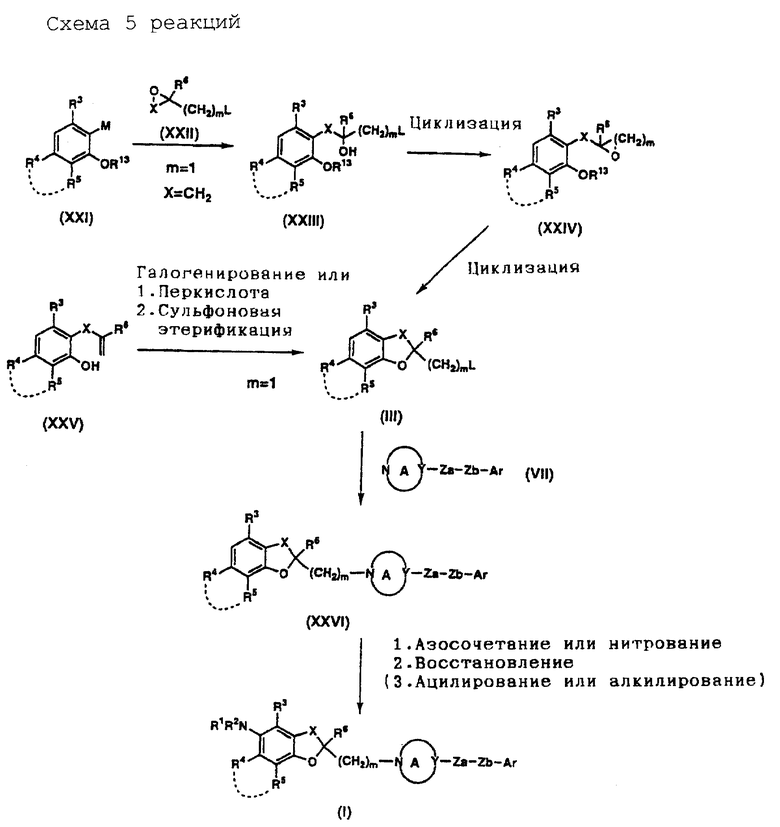
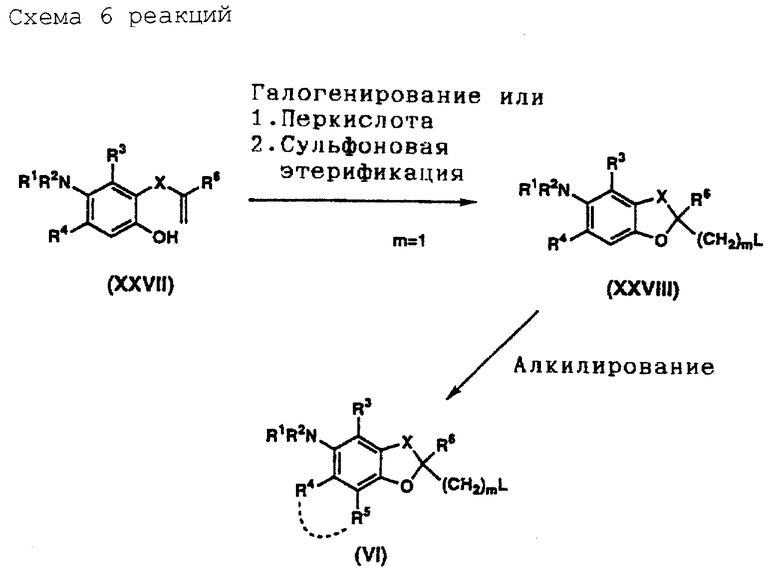
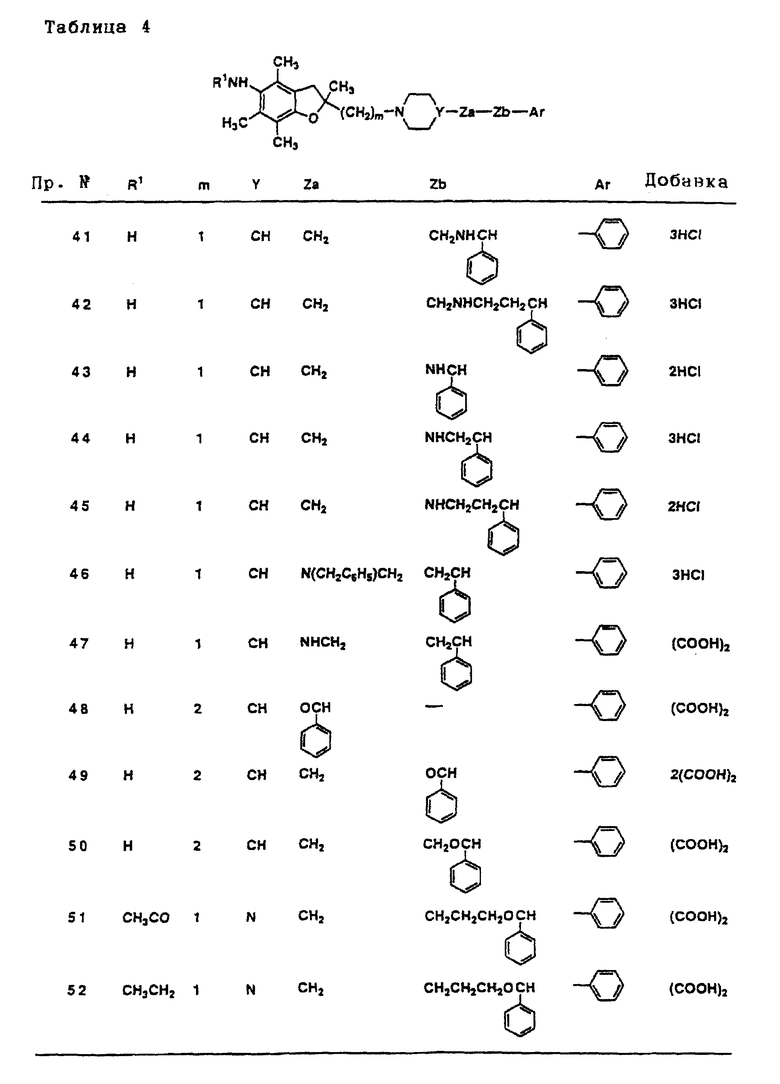
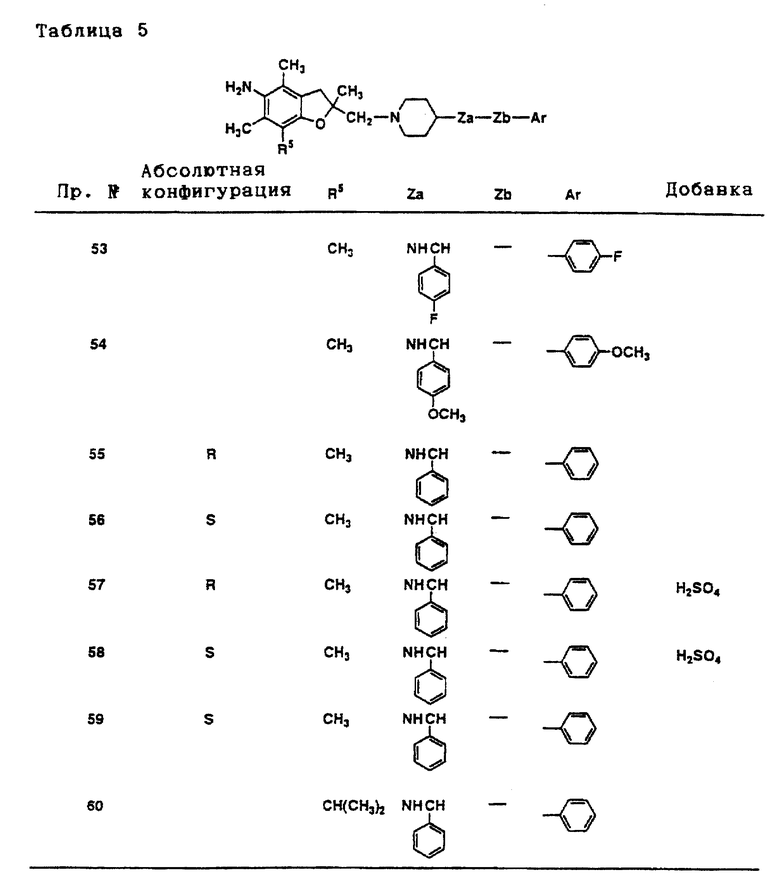
Описывается новый циклический простой эфир формулы (I), где каждый R1 и R2 представляет атом водорода, низший алкил или С1-6 алкилкарбонил; R3, R4 и R5 каждый представляет низший алкил; R6 представляет низший алкил; Ar представляет С6-14 арил, который может быть замещен галогеном, С1-6 алкилом, С1-6 алкокси или С1-3 алкилендиокси; кольцо А представляет 5 - 8-членное насыщенное азотсодержащее гетероциклическое кольцо; Х представляет низший алкилен; Y представляет атом углерода или азота; Zа представляет группу формулы (а), (в), (с) или (d), где R7 представляет атом водорода или С6-14 арил, который может быть замещен галогеном или С1-6 алкокси; R10 представляет атом водорода или С7-16 аралкил; Zb представляет связь или двухвалентную углеводородную группу, выбранную из группы, включающей С1-8 алкилен, С2-8 алкенилен или группу формулы: -(СН2)р-М-(СН2)q-, где р и q каждый представляет целое число от 0 до 8 и р + q представляет целое число от 1 до 8; М представляет О или NR9, где R9 представляет атом водорода, при этом каждая двухвалентная группа может быть замещена С6-14 арилом; и m представляет целое число от 1 до 3, или его соль, который годится для изготовления фармацевтической композиции для модулирования натриевого канала. Описывается способ получения эфира, фармацевтическая композиция и способ модулирования натриевого канала. 7 с. и 19 з.п. ф-лы, 5 табл. 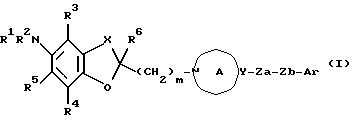
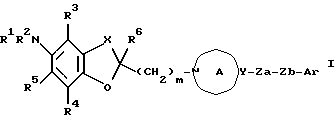
где каждый R1 и R2 представляет атом водорода, низший алкил или C1-6 алкилкарбонил;
R3, R4 иR5 каждый представляет низший алкил;
R6 представляет низший алкил;
Ar представляет C6-14 арил, который может быть замещен галогеном, C1-6 алкилом, C1-6 алкокси или C1-3 алкилендиокси;
кольцо А представляет 5-8-членное насыщенное азотсодержащее гетероциклическое кольцо;
Х представляет низший алкилен;
Y представляет атом углерода или азота;
Za представляет группу формулы
где R7 представляет атом водорода или C6-14 арил, который может быть замещен галогеном или C1-6 алкокси;
R10 представляет атом водорода или C7-16 аралкил;
Zb представляет связь или двухвалентную углеводородную группу, выбранную из группы, включающей C1-8 алкилен, C2-8 алкенилен или группу формулы - (CH2)p-M-(CH2)q-, где p и q каждый представляет целое число от 0 до 8 и p + q представляет целое число от 1 до 8; М представляет O или NR9, где R9 представляет атом водорода, при этом каждая двухвалентная группа может быть замещена C6-14 арилом;
m = 1 - 3,
или его соль.
где R7 имеет значения, определенные в п.1.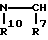
в которой соответствующие символы имеют значения, определенные в п.1.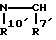
где R7′ представляет фенил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена и C1-6 алкокси;
R10′ представляет атом водорода;
Zb представляет связь или C1-6 алкилен, который может быть замещен C6-10 арилом; и m = 1 или 2.
где R7а представляет атом водорода или C6-10 арил;
Zb представляет связь или (i) C1-6 алкилен или (ii) C2-6 алкенилен, который может быть замещен C6-10 арилом; и m = 1.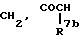
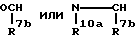
где R7b представляет атом водорода или C6-10 арил, который может быть замещен галогеном;
R10а представляет атом водорода или C7-11 аралкил;
Zb представляет связь или двухвалентную группу, выбранную из группы, включающей (i) C1-6 алкилен, (ii) C2-6 алкенилен, и (iii) группу формулы -(CH2)p′-M′-(CH2)q′, где p' и q' каждый представляет целое число от 0 до 5 и p' + q' представляет целое число от 1 до 6 и M' представляет O или NH, при этом каждая двухвалентная группа может быть замещена C6-10 арилом; и m = 1 или 2.
где L представляет уходящую группу;
каждый R1 и R2 представляет атом водорода, низший алкил или C1-6 алкилкарбонил;
R3, R4, R5 и R6 каждый представляет низший алкил; Х представляет низший алкилен;
m представляет целое число от 1 до 3,
или его соли с соединением формулы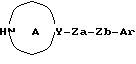
где кольцо А представляет 5-8-членное насыщенное содержащее азот гетероциклическое кольцо;
Y представляет атом углерода или азота;
Za представляет группу формулы
где R7 представляет атом водорода или C6-14 арил, который может быть замещен галогеном или C1-6 алкокси;
R10 представляет атом водорода или C7-16 аралкил;
Zb представляет связь или двухвалентную углеродную группу, выбранную из группы, включающей C1-8 алкилен, C2-8 алкенилен или группу формулы -(CH2)p-M-(CH2)q-, где p и q каждый представляет целое число от 0 до 8 и p + q представляет целое число от 1 до 8; М представляет O или NR9, где R9 представляет атом водорода, при этом каждая двухвалентная группа может быть замещена C6-14 арилом;
Ar представляет C6-14 арил, который может быть замещен галогеном, C1-6 алкилом, C1-6 алкокси или C1-3 алкилендиокси,
или его соль.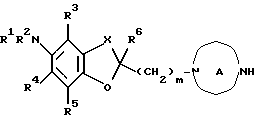
где каждый R1 и R2 представляет атом водорода, низший алкил или C1-6 алкилкарбонил;
R3, R4, R5 и R6 каждый представляет низший алкил;
Х представляет низший алкилен;
m представляет целое число от 1 до 3;
кольцо А представляет 5-8-членное насыщенное азотсодержащее гетероциклическое кольцо;
или его соли подвергают (a) алкилированию, (b) ацилированию или (с) ацилированию с последующим восстановлением.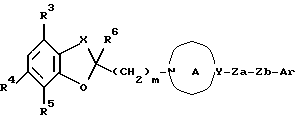
где R3, R4, R5 и R6 каждый представляет низший алкил;
Х представляет низший алкилен;
кольцо А представляет 5-8-членное насыщенное азотсодержащее гетероциклическое кольцо;
Y представляет атом углерода или азота;
Za представляет группу формулы
где R7 представляет атом водорода или C6-14 арил; который может быть замещен галогеном или C1-6 алкокси;
R10 представляет атом водорода или C7-16 аралкил;
Zb представляет связь или двухвалентную углеводородную группу, выбранную из группы, включающей C1-8 алкилен, C2-8 алкенилен или группу формулы -(CH2)p-M-(CH2)q-, где p и q каждый представляет целое число от 0 до 8 и p + q представляет целое число от 1 до 8; М представляет O или NR9, где R9 представляет атом водорода, при этом каждая двухвалентная группа может быть замещена C6-14 арилом; и m представляет целое число 1 или 3;
Ar представляет C6-14 арил, который может быть замещен галогеном, C1-6 алкилом или C1-3 алкилендиокси,
или его соли подвергают (а) нитрованию с последующим восстановлением или (b) реакции диазосочетания с последующим восстановлением.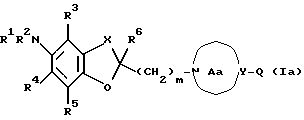
где Q представляет группу формулы -Zc-Ar, где Zc представляет двухвалентную алифатическую углеводородную группу, выбранную из C1-8 алкилена или группы формулы -(CH2)p-M-(CH2)q-, где каждый из символов p и q представляет целое число от 0 до 8 и p + q равно целому числу от 1 до 8; М представляет O или NR9, где R9 представляет атом водорода; причем каждая двухвалентная группа может замещена C6-14 арилом; и Ar имеет такое же значение, как определено в п.1;
кольцо Аа представляет 5-8 членное насыщенное азотсодержащее гетероциклическое кольцо; и другие соответствующие символы имеют такие же значения, как определено в п.1,
или его соль.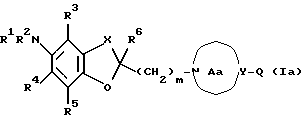
где Q представляет группу формулы -Zc-Ar, где Zc представляет двухвалентную алифатическую углеводородную группу, выбранную из C1-8 алкилена или группу формулы (CH2)p-M-(CH2)q-, где каждый из символов p и q представляет целое число от 0 до 8 и p + q равно целому числу от 1 до 8; М представляет O или NR9, где R9 представляет атом водорода; причем каждая двухвалентная группа может замещена C6-14 арилом; и Ar имеет такое же значение, как определено в п.1;
кольцо Аа представляет 5-8 членное насыщенное азотсодержащее гетероциклическое кольцо; и другие соответствующие символы имеют такие же значения, как определено в п.1,
или его фармацевтически приемлемую соль с фармацевтически приемлемым наполнителем, носителем или разбавителем.
Приоритет по пунктам:
29.08.1996 по пп.3,7,21,26,28;
04.04.1997 по пп.1,2,4 - 16,18,20,24;
28.08.1997 по пп.19,22.
| Устройство для получения высоковольтных импульсов | 1973 |
|
SU483772A2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-ОКСИ-3-[МЕТИЛЕН-(8'-ОКСИХИНОЛИНИЛ-5')]-КУМАРИНОВ | 1967 |
|
SU224520A1 |
Авторы
Даты
2001-09-20—Публикация
1997-08-28—Подача