Предметом данного изобретения являются новые производные 17,20-эпоксидов прегнана, их получение, их применение для получения кортизонных производных и промежуточные соединения.
Более конкретно, изобретение относится к соединениям формулы (I)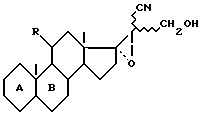
где
R - радикал оксо или β- гидрокси и циклы A и B - остаток

где
K - радикал оксо или группировка, защищающая радикал оксо формулы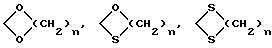
где
n равна 2 или 3;
R1 - остаток эфира или сложного эфира;
K' - радикал оксо или защищающая группировка, типа оксим, гидразон или семикарбазон,
волнистые линии символизируют смесь изомеров.
Когда R1 - остаток эфира, то это может быть любой остаток, известный специалистам, способным блокировать положение 3 в этом виде, в частности это может быть радикал алкил, с 1 - 6 атомами углерода, радикал алкоксиалоксиалкила с 3 - 8 атомами углерода, радикал арил с 6-10 атомами углерода или радикал аралкил с 7 - 12 атомами углерода.
Когда R1 - радикал алкил, то это, например, радикал метил, этил, пропил, изопропил, н-бутил, вторичный бутил, третичный бутил, пентил или гексил.
Когда R1 - радикал алкоксиалкоксиалкил, то это, например, радикал метоксиэтоксиметила.
Когда R1 - радикал аралкил, то это, например, радикал бензил или фенетил.
Когда R1 - радикал арил, то это, например, радикал фенил или радикал фенил, замещенный, в частности, одним или несколькими радикалами алкил.
Когда R1 - остаток эфира, то это может быть силилированная группировка, например, группировка триалкилсилил, такая как триметилсилил, третичный бутил, диметилсилил или, например, группировка триарилсилил, такая как трифенилсилил или диарилалкилсилил, такой как дифенилтрет.бутилсилил.
Когда R1 - остаток сложного эфира, то это может быть любой остаток, известный специалистам, могущий блокировать положение 3 в этом виде, причем R1 - радикал алкил, арил или аралкил, такой как он определен выше.
Когда K' - защищающая группировка, типа оксим или семикарбазон, то это, например, остаток формулы = N-OX, где X - атом водорода, радикал алкил с 1 - 6 атомами углерода, предпочтительно метил, радикал ацил с 1 - 10 атомами углерода, предпочтительно ацетил или бензоил или радикал арил с 6 - 12 атомами углерода, или остаток =N-NH-CO-Y, где Y - радикал амино или группировка
Z1, Z2, Z3 - радикалы алкил с 1 - 6 атомами углерода или образуют вместе с атомом радикал пиридил и Hal - атом галогена, предпочтительно хлора или брома.
В частности, изобретение касается соединений, таких как они определены выше, отвечающих формуле I1
где
R имеет значение, уже определенное выше, и циклы A1 и B1 - остаток
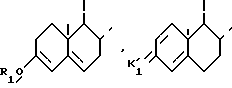
где
n и R1 имеют уже указанное значение и K1 и K'1 - группировки, защищающие радикал оксо, такие как они уже определены, и в особенности соединения, отвечающие формуле I'1
где
R и n имеют уже указанные значения.
Изобретение особенно относится к соединениям, таким как они определены выше, отвечающим формуле I2
где
R имеет уже указанное значение.
Предметом изобретения является также способ получения соединений формулы (I), отличающийся тем, что защищают функцию кетона в положении 3, соединения формулы II:
где линия пунктиром указывает на возможное присутствие второй связи,
чтобы получить соединение формулы III
где
A1 и B1 имеют уже определенное значение,
которое обрабатывают алкиловым эфиром цианоуксусной кислоты формулы IV:
N ≡ C-CH2-CO2R2
где
R2 - радикал алкил с 1 - 6 атомами углерода,
чтобы получить соединение формулы V
где
R2, A1, B1 и волнистые линии определены выше,
которое обрабатывают средством эпоксидации, для получения соединения формулы VI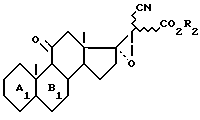
Функцию сложного эфира восстанавливают для получения соединения формулы I1а
Функцию кетона в положении II которого, по желанию, восстанавливают, чтобы получить соединение формулы I1б
в соединениях формул (I1а) и (I1б) освобождают функцию кетона в положении 3, по желанию, чтобы получить соединение формулы (I2), такое как оно определено выше.
Защита функции кетона в положении 3 ведется способами, известными специалистам. Таким образом можно употреблять, в частности, диол, дтилиол или смешанный тиол формулы HO-(CH2)n-OH, HS-(CH2)n-SH, HO-(CH2)n-SH, в кислой среде, например в присутствии концентрированной соляной кислоты и концентрированного бромистого водорода, в каталитических количествах, пара-толуолсульфокислоты, или в присутствии кислоты Льюис, такой как хлористый цинк, тетрахлорид титана или трифторида бора, предпочтительно в виде эфирной вытяжки. Можно употреблять метилэтилдиоксолан в присутствии кислоты, например одной из тех, которые упомянуты выше.
Можно также употреблять галогенид алкила, алкоксиалкоксиалкила аралкила или арила, в присутствии основания, образующего промежуточно энолат, например, гидрид, алкоголят или щелочной гидроксил.
Можно употреблять галогенид триалкила, триарила или диарилалкилсилила в щелочной среде, как это указано выше.
Можно еще употреблять подходящий хлорид кислоты, действуя в присутствии основания, которым может быть азотное основание, например, триэтиламин, пиридин, диметиламинопиридин или минеральное основание, в частности гидрид, алкоголят или щелочной гидроксид.
Можно еще употреблять подходящий гидроксиламин, могущий быть в виде хлоргидрата или другой соли, или семикарбазид или подходящее производное, также в виде хлоргидрата или другой соли.
Действие алкилового эфира циануксусной кислоты предпочтительно ведется в безводной среде, в присутствии первичного амина, например, гексиламина или низшего гомолога и слабого кислого катализатора, например кислоты Льюиса, кислой смолы, бензойной кислоты или паратолуолсульфокислоты.
Действуют в среде органического растворителя, такой как растворитель ароматического соединения, например, бензол, толуол или ксилол, или циклогексан.
Средством эпоксидации является средство, которое не затрагивает группировку нитрила. Предпочитают перекись водорода, употребляемую одну или в присутствии переходного металла, такого как титан, вольфрам или молибден, например в виде гидратированной соли.
Действуют предпочтительно в щелочной среде, в частности в присутствии карбоната, бикарбоната или щелочной гидроокиси или щелочно-земельной гидроокиси, в среде растворителя, которым может быть алканол, предпочтительно в смеси с сорастворителем, в частности растворитель галогенированный.
Можно употреблять щелочный гипохлорид, с нейтральным pH или с pH, близким к нейтральности.
Эта реакция эпоксидации α,β- этиленового нитрила проявляет оригинальный и неожиданный характер, тем, что нитрил сохранен, что, априорно, не очевидно.
Восстановление функции сложного эфира ведется действием щелочного борогидрида в спирте, в среде органического растворителя, например, борогидрида натрия или лития, в смеси этанола и толуола. Можно еще употреблять гидрид, например двойной гидрид лития и алюминия, гидрид диэтилнатрияалюминия, гидрид диизобутилалюминия или еще дигидробис(2-метокси этокси) алюмината натрия. Тогда действуют, например, в толуоле или тетрагидрофуроне.
Восстановление функции кетона ведется по одной или другой вышеупомянутой реакции, в условиях указанных растворителей.
Надо заметить, что оба восстановления ведутся в обратном порядке, по сравнению с тем, который встречается обычно, т.е. восстановление сложного эфира в 21 происходит до восстановления кетона в 11. Это также является неожиданностью способа.
Ясно, что не выходя из рамок изобретения, можно вести оба восстановления одновременно, без выделения промежуточного соединения 11-оксо. Такой пример находится в опытной части.
Освобождение функции кетона в положении 3 ведется средствами, соответствующими природе защитной группировки. Употребляют кислотное средство в присутствии воды или смеси вода-спирт, в случае кеталя. Например, используют минеральную или органическую кислоту, такую как соляная кислота, бромистый водород, серная кислота, хлорная кислота, азотная, паратолуолсульфокислота, уксусная кислота, щавелевая кислота или смесь кислот, или кислую смолу, например сульфоновую смолу. В случае тиокеталя или смешанного кеталя, снятие защиты функции 3-оксо ведется действием йода в присутствии основания, например, щелочного бикарбоната, или действием иода в каталитическом количестве, в присутствии окислителя, в частности перекиси водорода, действием иодида метила, глиоксиловой кислоты или солями металлов, таких как ртуть или кадмий. Обычно можно действовать в растворителе, таком как низший алканол, например метанол или этанол, в смеси с галогенированным растворителем, например, хлористым метиленом, в присутствии воды. В случае смешанного кеталя, снятия защиты ведется, например, ртутной солью, такой как хлорная ртуть в присутствии буфера уксусная кислота/ацетат калия при около 100oC, никелем Ранея в тех же условиях, которые указаны выше, или смесью соляная кислота - уксусная кислота в горячем виде.
В случае, когда R1 - остаток эфира или сложного эфира, то тоже употребляют обработку кислотой, в частности, в условиях, описанных выше для кеталя. То же касается освобождения функции кетона, защищенной в виде оксима или семикарбазона.
Данное изобретение имеет также целью применение соединений формулы (I), такой как она определена выше, для получения соединений формулы A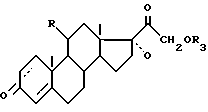
где
R - имеет определенное выше значение;
R3 - группировка, защищающая радикал гидрокси, и линия пунктиром - возможная вторая связь углерод-углерод, заключающееся в том, что защищают функцию гидрокси в положении 21 соединения формулы (I), чтобы получить соединение формулы VII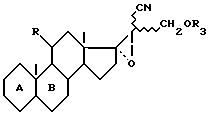
где
R, R3, A и B имеют уже указанное значение,
функцию нитрила которого гидратируют для получения соединения формулы VIII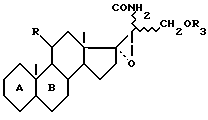
которое подвергают реакции разложения Гофманна для получения соединения формулы IX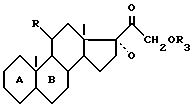
функцию кетона которого, при желании, освобождают /в положении 3/, для получения целевого соединения формулы /A/.
Под группировкой, защищающей радикал гидрокси, подразумевают группировку, устойчивую в условиях способа и особенно в условиях разложения Гофманна, т. е. остаток эфира и прежде всего радикал алкил с 1 - 6 атомами углерода, в частности радикал метил, этил, пропил.
Такие эфиры получаются, в частности, действием соответствующего галогенида, в присутствии щелочи, например действием подходящего иодида или бромида, в присутствии сильного основания, такого как гидрид, амид щелочного металла или щелочной алкоголят, действуют в среде растворителя, которым может быть, в частности, эфир, такой как тетрагидрофуран или диоксан, диметилформамид, диметилсульфоксид.
Гидратация функции нитрила ведется действием водного минерального основания и, в частности, действием щелочной гидроокиси, такой как гидроокись натрия, калия или лития. Действуют в присутствии органического растворителя, предпочтительно полярного, как то тетрагидрофуран, диоксан, диметилформамид, диэтилсульфоксид или ацетонитрил.
Разложение амида ведется действием щелочного или щелочно-земельного гипогалогенита, в частности гипохлорита или гипобромита натрия, при необходимости образованного "на месте". Действуют в среде растворителя, которым может быть предпочтительно один из тех, которые указаны выше, и в присутствии воды.
Изобретение распространяется на применение, такое как оно определено выше, отличающееся тем, что разложение ведется без промежуточного выделения амида формулы /VIII/.
Возможное освобождение функции кетона производится в условиях, указанных выше.
Наконец, изобретение имеет целью в качестве промышленных новых продуктов:
соединения формулы
где
A1, B1, R2 и волнистые линии определены выше;
R4 и R5 образуют вместе связь углерод-углерод или эпокси в положении α,
соединения формулы
где
A, B, R, R3 и волнистые линии определены выше,
R6 - радикал циано или радикал карбамоил,
соединения формулы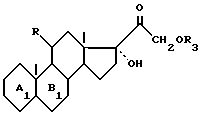
где
A1, B1, R и R3 определены выше.
Соединения формулы /A/ являются обычно известными соединениями, например американским патентом US 2648688 или ссылками J. Org. Chem. 26, 4153-5 /1961/ и 26, 5046-52 /1961/ или как промежуточные соединения синтеза, или как биологически активные соединения.
Соединение формулы /II/ описано, например, в патенте US 2844600.
Следующие примеры иллюстрируют изобретение, но не ограничивают его.
Пример 1: Циклический 3,3-/1,2-этандиил/-ацеталь 17,20-эпокси-20-циано-21-гидроксипрегна-5-ен-3,11-диона.
Стадия A: Циклический 3,3-/1,2-этандиил/-ацеталь андрост-5-ен-3,11,17-триона.
В инертном газе смешивают 10 г адреностерона и 150 см3 метилэтилдиоксолана, нагревают с рефлюксом 30 минут, прибавляют 0,033 г п-толуолсульфокислоты и продолжают нагревание с рефлюксом 6 часов 30 минут. Охлаждают до около 50oC, прибавляют 0,5 см3 триэтиламина и концентрируют досуха под уменьшенным давлением. Полученный продукт перекристаллизуют в этаноле, отсасывают и промывают холодным этанолом, а затем смесью этанол-вода и сушат. Получают 6,35 г целевого продукта.
Т. пл. = 196-198oC.
Спектр ИК /CHCl3/.
Поглощение при 1740 см-1 /17 C=O/ и 1706 см-1 /11-O/.
ЯМР спектр /CDCl3, 250 МГц, ч.н.м./ 0,86: 18-CH3; 3,95: CH2 кеталя; 5,38: H в 6.
Стадия Б: Этиловый эфир 20-циано-3,3-(1,2-этандиилбисокси) 11-оксопрегн-5,17(20)-диен-21-кислоты.
В инертном газе смешивают 6,25 г полученного в стадии А продукта, 100 см3 ксилола, 6,2 см3 этилового эфира циануксусной кислоты, 3,1 см3 гексиламина и 0,31 г бензойной кислоты.
Нагревают с рефлюксом 24 часа, удаляя воду, образованную во время реакции, а затем охлаждают до около 15oC и прибавляют 5 см3 10%-ного водного раствора бикарбоната натрия. Перемешивают 1 час, а затем декантируют, промывают водой органический слой и концентрируют под уменьшенным давлением. Получают кристаллический продукт, который перекристаллизуют в этиловом эфире уксусной кислоты. После промывания кристаллов в гексане и сушки получают 3,42 г целевого продукта. Хроматографией маточных растворов на двуокиси кремния, и элюируя смесью циклогексан-толуол-этиловый эфир уксусной кислоты (2-2-1), получают 2,75 г дополнительного целевого продукта.
ИК спектр (CHCl3)
поглощения при 2226 см-1 (-C≡N), 1725-1707 см-1 (C=O и сопряженный сложный эфир), 1611 см-1 (C=C).
ЯМР спектр (CdCl3, 300 МГц, чнм)
1,01: CH3 в 18; 1,23: CH3 в 19; 1,34 (т); CH3 сложного эфира; 3,94: CH2 ацеталя, 4,27 (d); CH2 сложного эфира; 5,36: H в 6.
Стадия B: Этиловый эфир 20-циано-3,3-(1-,2-этандиилбисокси) 11-оксо-17,20-эпоксипрегн-5-ен-21-кислоты.
В инертной атмосфере смешивают 0,255 г полученного в стадии Б продукта, 1 см3 хлористого метилена и 4 см3 этанола. При 20oC прибавляют к раствору 0,2 см3 50%-ной перекиси водорода. Затем прибавляют насыщенный раствор бикарбоната калия в 50%-ный этанол до pH 9, а затем выдерживают при перемешивании при постоянном pH 3 часа минут. Затем прибавляют 0,5 см3 10%-ной уксусной кислоты, а затем концентрируют досуха под уменьшенным давлением при 25oC. Остаток поглощают в смесь воды и хлористого метилена, декантируют и концентрируют досуха органический слой. Остаток хроматографируют на двуокиси кремния, элюируя смесью хлористый метилен-этиловый эфир уксусной кислоты /95-5/ и получают 0,236 г целевого продукта.
ИК спектр /CHCl3/.
Поглощение при 1764 см-1 и 1740 см-1: карбонил; 1707 см-1: 11-кето; 2243-2235 см-1: C≡N несопряженный; 1672 см-1: C=C.
ЯМР спектр /CDCl3, 300 МГц, чнм/
1,05 /s/ /3H/; 18-CH3; 1,22 /s/ /3H/: 19-CH3; 3,95 /м/ /4H/: кеталь; 5,30 /м/ /1H/: H в 6; 1,37 /3H/; 4,35 /2H/: -CH2-CH3-.
Стадия Г: Циклический 3,3-/1,2-этандиил/-ацеталь 17,20-эпокси-20-циано-21-гидроксипрегн-5-ен-3,11-диона.
В инертном газе смешивают 4,36 г продукта, полученного, как это описано, в стадии В, 44 см3 толуола и 44 см3 этанола. К раствору прибавляют 0,195 г борогидрида натрия. Выдерживают перемешивание 2 часа при 20o, а затем охлаждают до 0oC, прибавляют 0,097 г борогидрида натрия и продолжают перемешивание 2 ч при 0oC. Потом прибавляют 5 см3 20%-ного хлористого аммония, перемешивают 30 минут при 10oC, а затем концентрируют до полуобъема. Прибавляют 50 см3 воды и 50 см3 этилового эфира уксусной кислоты, перемешивают смесь и декантируют. Сушат органический слой и концентрируют досуха. Остаток хроматографируют на двуокиси кремния, элюируя смесью хлористый метилен - этиловый эфир уксусной кислоты /8-2/, получают 3,17 г целевого продукта.
ИК спектр: /CHCl3/.
Поглощения при 3605 см-1 /-OH/, 2242 см-1 (-C≡N), 1705 см-1 /C=O/, 1670 см-1 /C=C/.
ЯМР спектр /CDCl3, 200 МГц, чнм/
1,01: CH3 в 18; 1,22: CH3 в 19; 3,18: CH2 в 21; 3,95: CH2 ацеталя; 5,35: H в 6.
Пример 2: Циклический 3,3-/1,2-этандиил/ацеталь 11-β, 21-дигидрокси-17,20-эпокси-20-цианопрегн-5-ен-3-он.
В инертном газе смешивают 5,9 г продукта, полученного в стадии В примера 1, 120 см3 этанола и 1,2 г борогидрида натрия, а затем перемешивают 45 минут при комнатной температуре. Затем смесь нагревают до 45oC и прибавляют 0,6 г борогидрида натрия, спустя 1 час 30 минут, а затем заново после 3 часов. По истечении 4 часов 30 минут охлаждают до 0-5oC, медленно прибавляют 200 см3 насыщенного раствора хлористого аммония, выдерживая реакционную температуру ниже 15oC. Перемешивают, а затем прибавляют смесь вода-этиловый эфир уксусной кислоты, сушат органический слой и концентрируют его досуха. Остаточный продукт очищают хроматографией на двуокиси кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты /1-1/, и получают 3 г целевого продукта.
ИК спектр /CHCl3/.
Поглощения при 3614 см-1 /OH/, 2240 см-1 /-C=/, отсутствие C=O.
ЯМР спектр /CDCl3, 200 МГц, чнм/
1,28 /s/: CH3 в 18; 1,32 /s/: CH3 в 19; 3,76 и 3,87 /d - J = 12/: CH2 в 21; 3,95: CH2 кеталя; 4,5: H в 11; 5,25: H в 6.
Пример 3: 17 α- гидрокси-21-метоксипрегн-4-ен-3,11,20-трион.
Стадия А: Циклический 3,3-/1,2-этандиил/-ацеталь 17,20-эпокси-20-циано-21-метоксипрегн-5-ен-3,11-диона.
В инертном газе смешивают 20 см3 безводного тетрагидрофурана и 0,668 г 50%-ного гидрида натрия в масле. Прибавляют в течение 5 мин при перемешивании и 20-22oC раствор 4,21 г продукта, полученного в примере 1 в 30 см3 тетрагидрофурана. Перемешивают 40 мин. при 20-22oC, а затем прибавляют 3 см3 иодистого метила и продолжают перемешивание 1 час. Таким образом полученный раствор выливают в смесь 50 см3 20%-ного водного раствора хлористого аммония и 50 г льда. Экстрагируют этиловым эфиром уксусной кислоты, сушат органический слой и концентрируют досуха. Получают 4,61 г сырого продукта, который очищают сгущением в смеси изопропиловый эфир - этиловый эфир уксусной кислоты. После сушки получают 4,03 г целевого продукта. Т.пл. # 256°C.
ИК спектр /CHCl3/.
Поглощение при 2248 см-1 (-C≡N) ; 1706 см-1 /C=O/, 1670-1637 см-1 /C=C/, отсутствие OH.
ЯМР спектр /CDCl3, 300 МГц, чнм/
1,00 /s/: CH3 в 18; 1,22 /s/: CH3 в 19; 3,47 /s/: O-CH3; 3,57: -CH2 в 21; 3,95: CH2 кеталя; 5,35: H в 6.
Стадия Б : Циклический 3,3-/1,2-этандиил/ацеталь 17,20-эпокси-20-карбамоил-21-метоксипрегн-5-ен-3,11-диона.
0,36 г продукта, полученного в стадии A, и 0,049 г гидроокиси лития растворяют в 7,5 см3 диоксана и 2,5 см3 воды. Нагревают с рефлюксом 2 часа. Охлаждают до комнатной температуры, а затем разбавляют 0,2 н.-ой соляной кислотой. Экстрагируют хлористым метиленом, сушат органический слой и концентрируют досуха. Получают 0,378 г целевого продукта, который, употребляемый в данном виде, может быть обработан по способу разложения Гофманна, как это указано в следующей стадии.
ЯМР спектр /CDCl3, 200 МГц, чн.м./
0,88 /s/: CH3 в 18; 1,17 /s/: CH3 в 19; 3,24 /1H, d, J = 11 Гц/ и 4,18 /1H, d, J = 11 Гц/: CH2 в 21; 3,39 /3H, s/: O-CH3; 5,37 /1H, dd, J = 2,5 Гц и J = 7,5 Гц/: H в 6; 5,67 /1H, d, J = 4 Гц/ и 6,19 /1H, d, J = 4 Гц/: -NH2-.
Стадия В: Циклический 3,3-/1,2-этандиил/-ацеталь 17α- гидрокси-21-метоксипрегн-5-ен-3,11,20-триона.
В инертном газе смешивают 0,36 г полученного в стадии А продукта и 0,049 г гидроокиси лития. Прибавляют 5 см3 диоксана и 1 см3 воды, а затем нагревают до рефлюкса 3 часа. Раствор охлаждают ледяной баней и прибавляют 0,5 см3 15%-ного гипохлорита натрия и перемешивают 3 часа при 0 - 20oC, прибавляя два раза 1 см3 гипохлорита натрия /15%-ного/. Разбавляют водой, экстрагируют эфиром, сушат и концентрируют досуха органический слой. Остаток хроматографируют на двуокиси кремния, элюируя смесью этиловый эфир уксусной кислоты - циклогексан /15-85, а затем 50-50/ и получают 0,073 г целевого продукта, который перекристаллизуют по желанию в смеси хлористый метилен-гексан.
Т.пл. = 236oC.
ИК спектр /CHCl3/.
Поглощения при 3610 см-1: OH, 1703 cм-1 и 1670 см-1: CO= и C=C.
ЯМР спектр: /CDCl3, 200 МГц, чнм/
0,63 /s, 3H/: CH3 в 18; 1,21 /s, 3H/: CH3 в 19; 3,45 /s, 3H/: O-CH3; 3,95 /4H/: -CH2 ацеталя, 4,17 /d, J = 18 Гц, 1H/ и 4,36 /d, J = 18 Гц, 1H/: CH2 в 21, 5,36 /м, 1H/: H в 6.
Стадия Г: 17α-гидрокси-21-метоксипрегн-4-ен-3,11,20-трион.
В инертном газе смешивают 0,036 г продукта, полученного в стадии В, с 1 см3 метанола и 0,2 см3 2 н. соляной кислоты. Выдерживают перемешиванием 4 часа, отсасывают осадок и сушат его. Получают 0,012 г целевого продукта. Концентрацией маточных растворов получают снова целевой продукт.
ИК спектр /CHCl3/.
Поглощения при 3610-3480 см-1: 17-OH, 1706 см-1 11 C=0 и 20 C=0; 1667 см-1: 3-C-O сопряженные; 1617 см-1 4,5.
ЯМР спектр /CDCl3, 200 МГц, чнм/
0,67 /s/: CH3 в 18; 1,41 /s/: CH3 в 19; 3,44 /s/: O-CH3; 3,47 /s/: OH в 17; 4,19 /d/ и 4,31 /d/: CH2 в 21, 5,74: H в 4.
Пример 4: 17α- гидрокси-21-метоксипрегн-4-ен-3,11,20-трион.
Стадия А: 17,20-эпокси-20-циано-21-гидроксипрегн-4-ен-3,11-дион.
В инертном газе 4,1 г продукта, полученного как это описано в примере 1, смешивают с 80 см3 метанола и 7 см3 хлористого метилена. Прибавляют 20 см3 2н. соляной кислоты и перемешивают при комнатной температуре 4 часа. Отсасывают образованные кристаллы, промывают их смесью метанол-вода /8-2/, а затем водой. Концентрацией маточных растворов выделяют добавочный продукт. После сушки очищают продукт хроматографией на двуокиси кремния, элюируя смесью хлороформ - изопропанол /95-5/, и получают 3,3 г целевого продукта. Т.пл. = 256oC.
ИК спектр: /CHCl3/.
Поглощения при 3310 см-1: OH, 1703 и 1654 см-1: С=O; 1612 см-1: C=C.
ЯМР спектр /CDCl3, 300 МГц, чнм/
1,04 /s/: CH3 в 18; 1,42 /s/: CH3 в 19; 3,84 /сист AB/: -CH2OH; 5,74 /s/: H в 4.
Анализ: C22H27O4N /369,52/.
Вычислено: C% 71,4; H% 7,3; N% 3,8.
Найдено: C% 71,3; H% 7,3; N% 3,5.
Стадия Б: 17,20-эпокси-20-циано-21-метоксипрегн-4-ен-3,11-дион.
Эфир в 21 приготовляют по способу, описанному в стадии А примера 5, исходя из продукта, полученного выше в стадии А.
Стадия В: 17α- гидрокси-21-метоксипрегн-4-ен-3,11,20-трион.
На исходе употребляют соединение, полученное выше в стадии Б, либо, как это указано на стадии Б примера 3, выделяя промежуточный продукт 17,20-эпокси-20-карбамоил-21-метоксипрегн-4-3,11-диона, а затем обрабатывая это соединение раствором гипохлорита натрия по принципу разложения Гофманна, либо, как это указано в стадии В примера 3, т.е. производя это разложение без промежуточного выделения соединения 20-карбамоила. Получают целевой продукт, такой же как полученный в стадии Г примера 3.
Пример 5: 11β,17α- дигидрокси-21-метоксипрегн-4-он-3,20-дион.
Стадия А: Циклический 3,3-/1,2-этандиил/ацеталь 11β- гидрокси-17,20-эпокси-20-циано-21-метоксипрегн-5-ен-3-она.
Действуют как в стадии А примера 3, исходя из продукта, полученного в примере 2, и получают целевой продукт.
Стадия Б: Циклический 3,3-/1,2-этандиил/-ацеталь 11β,17α- дигидрокси-21-метоксипрегн-5-ен-3,20-диона.
Действуют, исходя из продукта, полученного выше на стадии А, либо как указано на стадии Б примера 3, выделяя промежуточно циклический 3,3-/1,2-этандиил/-ацеталь 11β- гидрокси-17,20-эпокси-20- карбамоил-21-метоксипрегн-5-ен-3-она, а затем обрабатывая это соединение раствором гипохлорита натрия, по принципу разложения Гофманна, либо, как это указано в стадии В примера 3, т.е. проделывая это разложение без выделения соединения 20-карбамоила.
Стадия В: 11β-,17α- дигидрокси-21-метоксипрегн-4-ен-3,20-дион.
Действуют как это указано на стадии Г примера 3, исходя из соединения, полученного выше на стадии Б. Получают целевой продукт.
Пример 6: 11β,17α- дигидрокси-21-метоксипрегн-4-ен-3,20-дион.
Стадия А: 11β,21- дигидрокси-17,20-эпокси-20-цианопрегн-4-ен-3-он.
В инертном газе смешивают 3 г продукта, полученного в примере 2, 66 см3 метанола и 10 см3 хлористого метилена. Прибавляют 15 см3 2н. соляной кислоты и перемешивают при комнатной температуре 2 часа. Отсасывают кристаллы, промывают их смесью метанол - вода /75-25/, а затем водой, отсасывают осадившиеся кристаллы, промывают их водой и, наконец, концентрируют маточные растворы, отсасывают заново образовавшиеся кристаллы и промывают их водой. Сушат все кристаллы и перекристаллизуют их в метаноле. Получают 1 г целевого продукта.
ИК спектр: /CHCl3/.
Поглощения при 3485 см-1: область OH/NH, 2240 см-1: C≡N, 1628 и 1616 см-1: C=O сопряженный.
ЯМР спектр /CDCl3, 300 МГц, чнм/
1,34 /s/: CH3 в 18; 1,50 /s/: CH3 в 19; 3,81 /d/: OH в 11; 3,76 и 3,88 /-сист АВ/: CH2 в 21; 4,45: H в 11; 5,69 /s/: H в 4; 7,18: подвижный H.
Анализ: C22H29O4N /371,52/.
Вычислено: C% 71,12; H% 7,86; N% 3,77.
Найдено: C% 71,00; H% 7,90; N% 3,70.
Стадия Б: 11β- гидрокси-17,20-эпокси-20-циано-21-метоксипрегн-4-ен-3-он.
Приготовляют эфир в 21 по способу, описанному в стадии А примера 3, исходя из продукта, полученного в предыдущей стадии А.
Стадия В: 11β,17α- дигидрокси-21-метоксипрегн-4-ен-3,20-дион.
Исходят из продукта, полученного в предыдущей стадии Б, либо, как это указано в стадии Б примера 3, выделяя промежуточно 11β- гидрокси-17,20-эпокси-20-карбамоил-21-метоксипрегн-4-ен-3-он, а затем обрабатывая это соединение раствором гипохлорита натрия по принципу разложения Гофманна, либо, как это указано в стадии В примера 3, т.е. проделывая это разложение без выделения промежуточного соединения 20-карбамоила. Получают целевой продукт, такой же как и тот, который получен в стадии В примера 5.
Изобретение относится к новым производным 17,20-эпоксидов прегнана, к способу их получения и к их применению в качестве полупродуктов в синтезе биологически активных продуктов, конкретно к производным 17,20-эпоксидов общей формулы I
где R-=0, β-OH, А и В остатки
а К=О, или группа
или
где n=2,3;
R1-остаток эфира или сложного эфира,
волнистые линии означают смесь изомеров. Новые соединения могут найти применение в медицине. 6 с. и 5 з. п. ф-лы.

где R - оксо или β-гидроксигруппа, а циклы А и В - остаток
где К - оксогруппа или группа, ее защищающая, формулы
где n = 2 или 3;
R1 - остаток эфира или сложного эфира,
волнистые линии означают смесь изомеров.
где R имеет вышеуказанные значения, а R - оксо защищена, а АI и BI имеют значения, указанные в п.1 для А и В.
где R и n имеют вышеуказанные значения.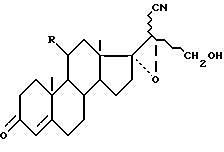
где R имеет вышеуказанные значения.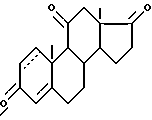
где - - - означает возможную вторую связь углерод-углерод,
защищают функцию кетона в положении 3, чтобы получить соединение общей формулы III
где AI и BI имеют вышеуказанные значения,
которое далее обрабатывают алкиловым эфиром циануксусной кислоты общей формулы IV
N≡C-CH2-CO2R2
где R2 - C1-C6 алкил,
чтобы получить соединение общей формулы V
где R2, AI, BI и волнистые линии определены выше,
которое обрабатывают перекисью водорода, возможно в присутствии переходного металла для получения соединения общей формулы VI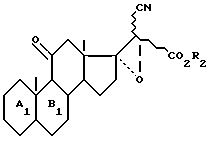
функцию сложного эфира которого восстанавливают при желании для получения соединения общей формулы IIa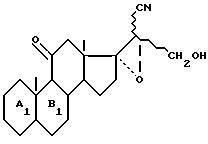
функцию кетона которого в II-положении восстанавливают для получения соединения общей формулы IIб
и в соединениях формулы IIa и IIб функцию кетона в положении 3 по желанию освобождают, чтобы получить соединение формулы I2.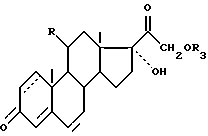
где R имеет вышеуказанные значения;
R3 - C1-C6 алкил;
пунктирная линия - возможная вторая связь углерод-углерод,
отличающийся тем, что в соединении формулы I защищают гидроксигруппу в положении 21 для получения соединения общей формулы VII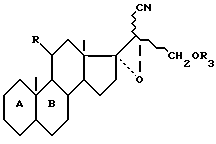
где R, R3, А и В имеют вышеуказанные значения,
функцию нитрила которого гидратируют, чтобы получить соединение общей формулы VIII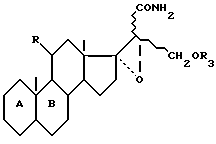
которое подвергают реакции разложения Гофмана, чтобы получить соединение общей формулы IX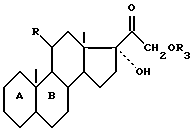
в котором при желании освобождают функцию кетона в 3 положении для получения целевого соединения формулы А.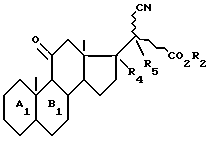
где AI, BI, R2 и волнистые линии имеют указанные в п.5 значения;
R4 и R5 образуют вместе эпоксигруппу в положении α, или вместе образуют вторую связь углерод-углерод в качестве промежуточных продуктов в синтезе соединений формулы I.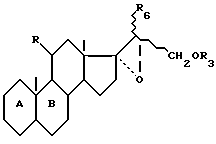
где А, В, R и волнистые линии определены в п.1;
R3 - определен в п.6;
R6 - циано или карбамоил,
в качестве промежуточных соединений в синтезе соединений формулы А.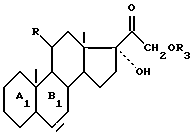
где AI, BI и R определены как в п.2;
R3 определен как в п.6 за исключением соединений, в которых AI, BI означают остаток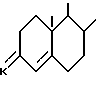
где К означает защитную группу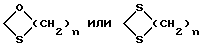
где n = 2 или 3, а R - оксорадикал, в качестве промежуточных соединений в синтезе продуктов формулы I.
| СПОСОБ ОПРЕДЕЛЕНИЯ МОРОЗОСТОЙКОСТИ ОБРАЗЦОВ СТРОИТЕЛЬНОГО МАТЕРИАЛА | 0 |
|
SU308345A1 |
| Хим.Фарм | |||
| Жур | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
Авторы
Даты
1999-01-20—Публикация
1994-01-13—Подача