Изобретение относится к новому методу получения 16-α-метилированных стероидов.
Таким образом, предметом настоящего изобретения является метод получения соединений формулы I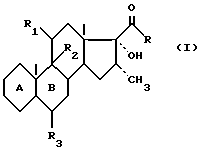
в которой циклы A и B представляют собой остаток
в котором кетоновая функциональная группа в положении 3 может быть защищена в форме кеталя, тиокеталя, гемитиокеталя или енолового эфира, или же остаток
R представляет собой метильный радикал или радикал -CH2-OR', в котором R' представляет собой атом водорода или эфирный или сложноэфирный остаток, R1 и R2 вместе образуют вторую связь или R1 и R2 вместе образуют эпоксид в положении β, или R1 представляет собой атом водорода, кетоновую функциональную группу или гидроксильную функциональную группу в положении α или β, свободную или защищенную в форме эфира или сложного эфира, а R2 представляет собой атом водорода, или R1 представляет собой атом водорода, а R2 представляет собой гидроксильную функциональную группу в положении α, или R1 представляет собой гидроксильную функциональную группу в положении β, свободную или защищенную в форме эфира или сложного эфира, а R2 представляет собой атом фтора или брома в положении α, а R3 представляет собой атом водорода или атом фтора или метильный радикал в положении α или β, отличающийся тем, что соединение формулы II
в которой A, B, R, R1, R2 и R3 имеют вышеуказанные значения, подвергают обработке метилирующим средством в присутствии катализатора на основе меди с последующим гидролизом 16-α-метилированного енолата для получения соответствующего енола с последующим воздействием на полученный енол окислителем для получения искомого соединения.
Когда кетоновая функциональная группа в положении 3 защищена в форме кеталя, тиокеталя или гемитиокеталя, речь идет предпочтительно о функциональной группе с формулой
в которой n имеет значение 2 или 3, или в первую очередь о этилендиоксильной или этилендитионильной функциональной группе.
В тех случаях, когда кетоновая функциональная группа в положении 3 защищена в форме енолового эфира, речь идет, предпочтительно, об алкоксильной или алкоксиалкоксильной функциональной группе, включающей от 1 до 8 атомов углерода, и, в первую очередь, о метоксильной, этоксильной, этоксиэтоксильной или 1-этоксиэтоксильной функциональной группе, причем в этом случае циклы A и B содержат систему двойных связей Δ3,5.
В тех случаях, когда R' представляет собой эфирный остаток, речь может идти о любом остатке, известном специалистам, и, в частности, об алкильном радикале, включающем от 1 до 6 атомов углерода, например, о метильном, этильном или пропильном радикале, о тетрагидропиранильном радикале, или о силилированном эфирном остатке, например, о триалкилсилильном остатке, таком как триметильный или диметил-трет-бутилсилильный, триарилсилильном, таком как трифенилсилильный, или диарилалкилсилильном, таком как дифенил-трет-бутилсилильный остаток.
В тех случаях, когда R' представляет собой сложноэфирный остаток, речь может идти о любом остатке, известном специалистам, и, в частности, об ацильном радикале, включающем от 1 до 8 атомов углерода, например о таком радикале, как формильный, ацетильный, пропионильный, бутирильный, валерильный или бензильный.
В тех случаях, когда R1 представляет собой защищенную гидроксильную функциональную группу в форме эфира или сложного эфира, речь может идти об одном из эфирных или сложноэфирных остатков, указанных выше для R', причем следует иметь в виду, что указанные остатки не обязательно одинаковы.
Предметом настоящего изобретения, в частности, является вышеописанный метод, отличающийся тем, что на исходном этапе используют соединение формулы II, в которой циклы A и B представляют собой остаток
в котором R3 определен, как указано выше, а кетоновая функция в положении 3 свободна, причем предпочтение отдается последнему из представленных остатков.
Предметом настоящего изобретения также является вышеописанный метод, отличающийся тем, что на исходном этапе используют соединение формулы II, в которой R1 и R2 вместе образуют вторую связь, или R1 и R2 образуют вместе эпоксид в положении β, или R1 представляет собой гидроксильную функциональную группу в положении β, свободную или защищенную в форме эфира или сложного эфира, а R2 представляет собой атом фтора в положении α, а R3 представляет собой атом водорода, атом фтора или метильный радикал и, в первую очередь, атом водорода.
В качестве метилирующего средства может использоваться метилированное производное меди, например CH3Cu, (CH3)2CuMg, (CH3)2CuLi или, в первую очередь, хлорид, бромид или иодид метилмагния, используемый в присутствии катализатора на основе меди. Катализатором может быть соль, такая как диацетат, дипропинат или дихлорид меди, монохлорид, монобромид, моноиодид или цианид (I) меди, или же комплексное соединение, такое как, например, ацетилацетонат меди, диметилсернистокислый монобромид меди или же три-н-бутилфосфинмонохлорид меди или любое другое комплексное соединение того же типа, известное специалистам. Предпочтение отдается, главным образом, диацетату или дипропионату меди.
Операции выполняются в среде растворителя, который является, в первую очередь, эфиром, таким как тетрагидрофуран, диоксан, трет-бутилметилэфир, диметоксиэтан, этиловый эфир, t-бутилметиловый эфир, ди-н-бутиловый эфир. Предпочтение отдается тетрагидрофурану.
Операции желательно выполнять при температуре от 0 до -30oC, предпочтительно при -20oC.
Гидролиз 16-α-метилированного енолата выполняется, преимущественно, в среде инертного газа путем вливания реакционного раствора в водный раствор монощелочного фосфата, например, натрия или калия, или в слабокислом pH буферном растворе, в частности в фосфатном буферном растворе, или, в большинстве случаев, в слабом окислителе, таком как уксусная, пропионовая или бутановая кислота, или же в водном растворе хлорида или ацетата аммония. Предпочтение отдается фосфатному буферному раствору.
После гидролиза желательно выполнить оксидирующую обработку, которая должна позволить превратить одновалентные медные ионы, присутствующие в смеси, в двухвалентные и, соответственно, упростить осаждение. Для этого превращения могут использоваться обычные окислители, известные специалистам. В качестве примера можно назвать перекись водорода, которая исключительно хорошо подходит для этой цели. Для насыщения среды осаждение может быть улучшено при добавлении щелочной соли, например сульфата или хлорида натрия.
Окисление енола может выполняться с помощью обычного окислителя, такого как перекись водорода, используемая самостоятельно или в сочетании либо с переходным металлом, в частности с титаном, марганцем или вольфрамом, либо с ацетоном или производным, в частности с гексахлорацетоном или гексафторацетоном, или такого как перманганат калия, активированный или неактивированный металлами, такими как медь, или каким-нибудь агентом, в частности эпоксидирующим веществом, таким как диоксиран, в частности диметилдиоксиран, гидроперекись, например гидроперекись трет-бутила, или надкислота, например надбензолдикарбоновая, надбензойная, n-хлорнадбензойная, надуксусная, трифторнадуксусная или надмалеиновая кислота. Предпочтение отдается окислению с использованием надкислоты.
Операции выполняются преимущественно в среде инертного газа, в среде галогенсодержащего растворителя, такого как метиленхлорид, трихлорметан, дихлорэтан, эфира, такого как простой этиловый эфир, тетрагидрофуран или диоксан, ароматического растворителя, такого как толуол, или же сложного эфира, такого как этилацетат или ацетонитрил, возможно в присутствии сорастворителя, например, алканола, такого как метанол, этанол, изопропанол или, в первую очередь, трет-бутанол, желательно при температуре от -10 до +10oC.
Предметом настоящего изобретения является, в первую очередь и предпочтительно, вышеописанный метод, отличающийся тем, что окисление выполняется с помощью надбензолдикарбоновой кислоты, желательно в среде тетрагидрофурана.
Методы получения соединений формулы I уже описаны ранее, например в патентной заявке WO 87/07612. Метод указанной патентной заявки заключается в метилировании ненасыщенного 16-производного с помощью метилирующего средства в присутствии катализатора на основе меди и силилирующего средства с целью промежуточного выделения енолового эфира, отвечающего следующей формуле:
который впоследствии подвергается обработке надкислотой для образования 17-α-20-эпоксида формулы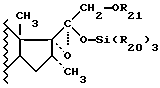
который затем подвергается гидролизу с помощью кислоты или основания.
Таким образом, указанный метод требует прохождения через эпоксид, полученный из стабилизированного енола, в форме силилированного эфира, который затем должен быть подвергнут гидролизу.
Метод, являющийся предметом настоящего изобретения не требует выделения какого бы то ни было промежуточного продукта, поскольку продукт, полученный в результате реакции метилирования, непосредственно гидролизуется, а затем окисляется в условиях, которые до настоящего времени никогда не предусматривались и которые представляют исключительный интерес с промышленной точки зрения. Таким образом, указанный метод не требует ни какого бы то ни было прохождения через промежуточную стабилизированную форму енола, ни конечного гидролиза для выделения продукта. Впрочем, насколько это известно фирме-заявительнице, непосредственное окисление подобного енола выполняется впервые.
Можно еще назвать патент Великобритании 2 001 990, который также описывает метод получения соединений формулы I и заключается, как описано выше, в метилировании 16-ненасыщенного производного и затем в получении и выделении гидроперекиси формулы
которая затем восстанавливается цинком в уксусной кислоте или же щелочным иодидом в алифатическом кетоне.
Таким образом, речь идет о методе, который как с точки зрения своего принципа, так и с точки зрения используемых промежуточных продуктов, отличается от метода, являющегося предметом настоящего изобретения.
Соединения формулы II известны и описаны, например, в патентах США US 2 345 711, 2 883 400, 2 963 496, 2 966 504, 2 975 197, 3 029 233, 3 210 341, 3 377 343, 3 839 369, 3 976 638, 4 031 080, 4 277 409, 4 929 395, в патенте ФРГ 2 207 420, нидерландском патенте 69 02 507 или в бельгийских патентах 539 498, 540 478, 711 016, или же могут быть легко получены на основе соединений, описанных в перечисленных патентах с применением обычных методов, хорошо известных специалистам.
16-α-метильные соединения формулы I известны тем, что они обладают противовоспалительными свойствами, причем указанная формула распространяется, в частности, на дексаметазон, его производные, такие как фторметазон (6-α-фтор), параметазон (6-α-фтор 9H), а также на возможные предшественники (Δ 9,11,9-α-OH или 9,11-эпокси).
Приводимые далее примеры иллюстрируют изобретение, вместе с тем не ограничивая его.
Пример 1. 9-β,11β-эпокси-16-α-метил-17-α-гидрокси- 21-ацетилокси- прегна- 1,4-диен- 3,20-дион.
В среде инертного газа смешивают 0,2 г моногидратного диацетата меди, 7,66 г 9-β,11-β-эпокси-21-ацетилокси- прегна- 1,4,16(17)- триен- 3,20-диона и 100 см3 безводного тетрагидрофурана. После 10-минутной выдержки при температуре +20oC смесь охлаждают до -20oC и добавляют за 2 ч 8,8 см3 3 М раствора хлорида метилмагния в тетрагидрофуране. Взбалтывание продолжают еще в течение 15 мин, а затем охлаждают до -30oC. Затем смесь медленно вливают в среде инертного газа в 80 см3 смеси 1 М фосфорной кислоты и 1,35 М едкого натра при температуре 0oC. Смеси дают нагреться при взбалтывании, а затем, через 40 мин, при температуре +15oC добавляют 1 см3 1 М перекиси водорода. После 1-часового взбалтывания при температуре от +15oC до +20oC добавляют 8 г хлорида натрия и продолжают взбалтывание еще в течение 10 мин. Затем отстаивают в среде инертного газа, экстрагируют водную фазу с использованием тетрагидрофурана, а затем промывают органическую фазу 10 см3 вышеуказанной смеси фосфорной кислоты и едкого натра. После этого добавляют 2 г хлорида натрия, взбалтывают смесь в течение нескольких минут и отстаивают. Затем в органическую фазу добавляют 2 г хлорида натрия, взбалтывают и вновь отстаивают.
Кроме этого, смешивают 8 г фталевого ангидрида и 5 см3 1 М перекиси водорода. Затем взбалтывают в течение 1 ч при комнатной температуре и добавляют 5 см3 тетрагидрофурана. Затем взбалтывают еще в течение 1 ч 15 мин и добавляют 3 см3 тетрагидрофурана. После этого взбалтывают в течение 1 ч и вновь добавляют 5 см3 тетрагидрофурана. Взбалтывание продолжают еще в течение 1 ч.
Затем при температуре 0 - +3oC в среде инертного газа в приготовленный выше еноловый раствор добавляют 8 г безводного сульфата натрия. После этого добавляют приготовленную выше суспензию надкислоты. После 2-часового взбалтывания при температуре около +5oC раствор нейтрализуют путем добавления 9 г бикарбоната натрия в 90 см3 воды. Затем добавляют 8 г хлорида натрия, взбалтывают в течение 15 мин, отстаивают и повторно экстрагируют водную фазу с использованием этилацетата. После этого соединенные органические фазы промывают соленой водой, высушивают и концентрируют при пониженном давлении при температуре около +30oC. Таким образом получают 6,6 г сырого продукта, 1/5 часть которого подвергают хроматографии на двуокиси кремния (элюант: метиленхлорид - этиловый эфир (7:3)). В результате получают 1,321 г целевого продукта, то есть выход составляет 80%.
Инфракрасный спектр: (CHCl3).
Поглощение 3610 см-1 (OH); 1747-1728 см-1 (C=O); 1663-1625-1607 см-1 ( Δ 1,4 3-он).
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
0,88 (d): CH3 - 16; 0,93: CH3 - 18; 1,44: CH3 - 19; 2,16: CH3-OAc; 2,94: -OH; 3,21: H - 11; 4,69 (d) и 5,04 (d): 2H - 21; 6,14: H - 4; 6,20: H - 2; 6,62: H - 1.
Пример 2. 16-α-метил- 17-α-гидрокси- 21-ацетилокси- прегна- 1,4,9(11)-триен- 3,20-дион.
Операции выполняются, как описано в примере 1, с использованием 0,02 г моногидратного диацетата меди и 0,733 г 16-α-метил- 21-ацетилокси-прегна- 1,4,9(11)-16(17)-тетраен- 3,20-диона в 10 см3 тетрагидрофурана, а затем 1 см3 3 М раствора хлорида метилмагния в тетрагидрофуране, 8 см3 смеси фосфорной кислоты и едкого натра и 0,1 см3 перекиси водорода.
Надкислоту получают, как описано в примере 1, на основе 0,59 г фталевого ангидрида.
После очистки методом хроматографии на двуокиси кремния (элюант: метиленхлорид - этиловый эфир (7:3)) получают 0,4 г целевого продукта.
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
0,75: CH3 - 18; 0,94 (d): CH3 - 16; 1,40: CH3 - 19; 2,17: CH3-OAc; 4,82 (d) - 4,99 (d): 2H - 21; 5,57: H - 11; 6,05: H - 4; 6,28: H - 2; 7,19: H - 1.
Пример 3. 9-α-фтор- 11-β-гидрокси- 16-α-метил- 17-α-гидрокси- 21-ацетилокси- прегна-1,4-диен- 3,20-дион.
Операции выполняются, как описано в примере 1, с использованием 0,02 г моногидратного диацетата меди и 0,805 г 9-α-фтор- 11-β-гидрокси-21-ацетилокси-прегна- 1,4,9(11)-триен- 3,20-диона в 15 см3 тетрагидрофурана, а затем 2 см3 3 М раствора хлорида метилмагния в тетрагидрофуране, 12 см3 смеси фосфорной кислоты и едкого натра и 0,1 см3 перекиси водорода.
Надкислоту получают, как описано в примере 1, на основе 0,59 г фталевого ангидрида.
После очистки методом хроматографии на двуокиси кремния (элюант: метиленхлорид - этилацетат (7:3)) получают 0,25 г целевого продукта.
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
0,93 (d): CH3 - 16; 1,07: CH3 - 18; 1,57: CH3 - 19; 2,17: CH3-OAc; 3,39 OH - 11 β и 17 α; 4,38: H - 11; 4,92: 2H - 21; 6,11: H - 4; 6,33: H - 2; 7,25: H - 1.
Пример 4. 9-α-фтор- 11-β,21-диацетилокси- 16-α-метил- 17-α-гидрокси- прегна- 1,4-диен-3,20-дион.
Операции выполняются, как описано в примере 1, с использованием 0,02 г моногидратного диацетата меди и 0,889 г 9-α-фтор- 11-β,21-диацетилокси- прегна- 1,4,9(11)-триен-3,20-диона в 10 см3 тетрагидрофурана, а затем 1 см3 3 М раствора хлорида метилмагния в тетрагидрофуране, 8 см3 смеси фосфорной кислоты и едкого натра и 0,1 см3 перекиси водорода.
Надкислоту получают, как описано в примере 1, на основе 0,59 г фталевого ангидрида.
После очистки методом хроматографии на двуокиси кремния (элюант: метиленхлорид - этиловый эфир (7:3)) получают 0,634 г целевого продукта.
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
0,93 (d): CH3 - 16; 0,93: CH3 - 18; 1,58: CH3 - 19; 2,13-2,15: CH3-OAc - 21 и 11 β; 2,74: OH; 4,71(d) - 4,99 (d): 2H - 21; 5,42 (m): H - 11 α; 6,11: H - 4; 6,33: H - 2; 6,82: H - 1.
Пример 5. 9-β,11-β-эпокси -16α-метил- 17-α-гидрокси-прегна- 1,4-диен-3,20-дион.
Операции выполняются, как описано в примере 1, с использованием 0,02 г моногидратного диацетата меди и 0,649 г 9β, 11β-эпокси-прегна- 1,4,16(17)-триен- 3,20-диона в 10 см3 тетрагидрофурана, а затем 0,9 см3 3 М раствора хлорида метилмагния в тетрагидрофуране, 8 см3 смеси фосфорной кислоты и едкого натра и 0,1 см3 перекиси водорода.
Надкислоту получают, как описано в примере 1, на основе 0,59 г фталевого ангидрида.
После очистки методом хроматографии на двуокиси кремния (элюант: метиленхлорид - этиловый эфир (7:3)) получают 0,234 г целевого продукта.
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
0,88 (d): CH3 - 16; 1,01: CH3 - 18; 1,44: CH3 - 19; 2,24: CH3 - 21; 3,05: OH - 17; 3,21: H - 11 α; 6,15: H - 4; 6,18: H - 2; 6,60: H -1.
Пример 6. 9-β,11-β-эпокси- 16-α-метил- 17-α-гидрокси- 21- ацетилокси-прегна- 1,4-диен-3,20-дион.
В среде инертного газа смешивают 3,06 г 9-β, 11-β- эпокси- 21-ацетилокси-прегна- 1,4,16(17)- триен-3,20-диона и 0,08 г моногидратного диацетата меди в 33 см3 тетрагидрофурана. Затем охлаждают и при температуре -20oC за 1 ч вводят 4 см3 3 М раствора хлорида метилмагния в тетрагидрофуране. Взбалтывание продолжают еще в течение 1 ч, а затем охлаждают до температуры -30oC. После этого смесь медленно вливают в 30 см3 смеси фосфорной кислоты (1 М) и едкого натра (1,35 М), охлажденной до 0oC. Затем смеси дают нагреться при взбалтывании, после чего при температуре +15oC добавляют 0,4 см3 1 М перекиси водорода. По истечении 1 ч при температуре от +15oC до +20oC добавляют 4 г хлорида натрия. Затем взбалтывают в течение 10 мин и отстаивают в среде инертного газа. Водную фазу экстрагируют с использованием тетрагидрофурана, а затем промывают органическую фазу 5 см3 вышеуказанной смеси фосфорной кислоты и едкого натра, добавляют 1 г хлорида натрия, после чего отстаивают воду и дополняют до 50 см3. После этого отбирают в среде инертного газа 10 см3 раствора, концентрируют досуха и забирают метиленхлоридом. Затем охлаждают до 0oC и добавляют 0,1 см3 гексахлорацетона и 0,6 см3 1 М перекиси водорода. После этого взбалтывают при температуре от 0 до +5oC в течение 15 ч, добавляют небольшое количество воды, насыщенной хлоридом натрия, отстаивают органическую фазу, высушивают и концентрируют ее досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант: метиленхлорид - этиловый эфир (7:3)) и получают 0,047 г целевого продукта.
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
0,88 (d): CH3 - 16; 0,93: CH3 - 18; 1,44: CH3 - 19; 2,16: CH3-OAc; 2,94: OH; 3,21: H - 11 α; 4,69 (d): - 5,04 (d): 2H - 21; 6,14: H - 4; 6,20: H -2; 6,62: H - 1.
Пример 7. 9-β,11-β-эпокси-16-α-метил- 17-α-гидрокси-21-ацетилокси- прегна-1,4-диен- 3,20-дион.
Операции выполняются, как описано в примере 6, вплоть до отбора в среде инертного газа 10 см3 раствора, полученного в результате гидролиза. После этого концентрируют досуха и забирают метиленхлоридом. Затем добавляют смесь 4 г перманганата калия, 2 г сульфата меди (5H2O) и 0,2 см3 воды, а затем 1 см3 трет-бутилового спирта. После этого взбалтывают в течение 3 ч при температуре +20oC, фильтруют, высушивают и концентрируют досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант: циклогексан - этилацетат (1: 1), а затем метиленхлорид - этиловый эфир (7:3)). В результате получают 0,072 г целевого продукта.
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
0,88 (d): CH3 - 16; 0,93: CH3 - 18; 1,44: CH3 - 19; 2,16: CH3-OAc; 2,94: OH; 3,21: H - 11 α; 4,69 (d): - 5,04 (d): 2H - 21; 6,14: H - 4; 6,20: H -2; 6,62: H - 1.
Пример 8. 6-альфа-фтор-9-бета,11-бета-эпокси-16-альфа-метил-17- альфа-гидрокси-21-ацетилоксипрегна-1,4-диен-3,20-дион.
Стадия A: 6-альфа-фтор-9-бета, 11-бета-эпокси-16-альфа-метил -20-ол -21-ацетоксипрегна-1,4-17(20) триен-3-он
0,06 г моногидрата ацетата меди (2), 2,40 г 6-альфа-фтор-9-бета, 11-бета-эпокси-21-ацетоксипрегна-1,4,16(17) триен-3,20-диона и 30 см3 безводного тетрагидрофурана смешивают вместе в атмосфере инертного газа. Через 10 мин перемешивания при 20oC смесь охлаждают до -30oC и в течение 2 часов добавляют 2,4 см3 3 М раствора метилмагнийхлорида в тетрагидрофуране и 1,6 см3 тетрагидрофурана. Перемешивание продолжают в течение 2 ч при -30oC. Медленно добавляют 1,2 см3 7N раствора уксусной кислоты. Смесь доводят при перемешивании до 5oC, после чего добавляют 10 см3 воды и 10 см3 толуола. Затем добавляют 0,3 см3 перекиси водорода (1 М) при +15oC и после декантации в атмосфере инертного газа удаляют водную фазу.
Последующее окисление осуществляют с помощью раствора, содержащего 5 см3 воды, 5 см3 толуола и 0,15 см3 перекиси водорода (1 М). После 20 мин перемешивания в инертном газе смесь декантируют. Водную фазу удаляют и органическую фазу промывают 10 см3 воды и сушат. Органический растворитель удаляют в вакууме и получают 2 г целевого енола.
Спектр ЯМР: (CDCl3, 300 МГц, млн-1).
1,04 (d): CH3-CH; 1,10 - 1,12: 18- CH3; 1,45-1,47: 19-CH3; 2,15: OAc; 3,26: H11; 4,52 (d) - 4,70 (d): =C-CH2-OAc; 5,31 - 5,22: OH; 5,50: H6; 6,28 (dd): H2; 6,48 (d): H4; 6,59 (d): H1.
Стадия B: 6-альфа-фтор-9-бета,11-бета-эпокси-16-альфа-метил -17-альфа-гидрокси-21-ацетилоксипрегна-1,4-диен-3,20-дион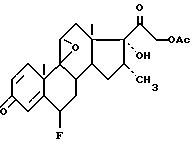
Работают так же, как описано в примере 1, начиная с вышеуказанного енола. Перкислоту получают так, как описано в примере 1, но исходя из 1,8 г фталевого ангидрида. После очистки в тех же условиях, что в примере 1, получают 0,9 г целевого продукта. Этот продут описан в патенте США 3,105,083.
Пример 9. 16-альфа-метил-17- альфа-гидрокси-21-ацетоксипрегна-4-ен-3,11,20-трион.
Стадия A: 16-альфа-метил-20-ол-21-ацетоксипрегна-4,17(20) диен-3,11-дион
0,06 г моногидрата ацетата меди (2), 1,153 г 21-ацетилоксипрегна-1,4,16(17) триен-3,11,20-триона и 12 см3 безводного тетрагидрофурана смешивают вместе в атмосфере инертного газа. Через 10 мин перемешивания при 20oC смесь охлаждают до -30oC и в течение 2 часов добавляют 1,4 см3 3 М раствора метилмагнийхлорида в тетрагидрофуране и 1,4 см3 тетрагидрофурана. Перемешивание продолжают в течение 1 ч при -30oC и медленно добавляют 1 см3 7N раствора уксусной кислоты. Смесь доводят при перемешивании до 0oC, после чего добавляют 7 см3 воды и 7 см3 толуола. Затем добавляют 0,3 см3 перекиси водорода (1 М) при +15oC и после декантации в атмосфере инертного газа удаляют водную фазу. Последующее окисление осуществляют путем добавления 7 см3 воды и 0,3 см3 перекиси водорода (1 М). После 20 минут перемешивания в инертном газе добавляют 2 см3 хлористого метилена, смесь оставляют перемешиваться несколько секунд и декантируют. Водную фазу удаляют и органическую фазу промывают 10 см3 воды и сушат. Органический растворитель удаляют в вакууме и остаток смешивают со смесью изопропиловый эфир/циклогексан/изопропанол и затем концентрируют досуха. Получают 1,1 г целевого енола.
Спектр ЯМР: (CDCl3, 300 МГц, м.д.).
0,87 13-CH3; 1,02 - 1,11: 16-CH3; 1,39: 10-CH3; 2,12: -CH2-OAc; 3,20: H12; 4,52: -CH2 группы -CH2-OAc; 5,72: H4.
ИК-спектр (KBr).
Поглощение при 1614 см-1: C=C; 1668 - 1710 - 1725 см-1: C=O; 1746 см-1: ацетат; 3335 см-1: OH.
Стадия B: 16-альфа-метил -17-альфа-гидрокси-21-ацетоксипрегн-4-ен-3,11,20-трион
Работают так же, как описано в примере 1, но исходят из вышеуказанного енола. Перкислоту получают так, как в примере 1, из 10 г фталевого ангидрида. Используют 1,5 см3 раствора перкислоты. После очистки в тех же условиях, что в примере 1, получают 0,96 г целевого продукта. Этот продукт описан в патенте США 3,030,389.
Спектр ЯМР: (CDCl3, 300 МГц, м.д.).
0,74 13-CH3; 0,98: 16-CH3; 1,40: 10-CH3; 2,16: -CH2-OAc; 2,83: H или 17 α OH; 3,11: H16; 4,59-5,05: CH2 из -CH2-OAc; 5,73: H4.
Способ получения 16α-метилированных стероидов формулы I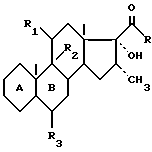
в которой циклы А и В представляют остаток формулы (a)
или (б)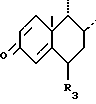
R - метил или радикал -CH2-OR', в котором R'- атом водорода или ацил; R1 и R2 - вместе образуют вторую связь, или R1 и R2 вместе образуют эпоксид в положении β, или R1 - Н, кетоновая группа, бета-гидроксил, a R2 - атом водорода, или R1 - бета-гидроксил, возможно замещенный в форме эфира или сложного эфира, a R2 - фтор или бром в положении альфа; R3 - водород, фтор или метил, заключается в обработке соединения формулы II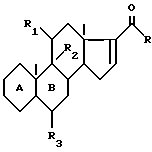
где A, R, R1, R2 и R3 имеют вышеуказанные значения, галогенидом магния в присутcтвии диацетата или дипропионата меди с последующим гидролизом полученного 16 α-метилированного енолата слабой кислотой или буферным раствором со слабокислым рН. Полученный енол далее окисляют надкислотой. Представленный способ не требует выделения никакого промежуточного продукта. 4 з.п. ф-лы.

в которой циклы A и B представляют остаток формулы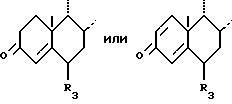
а R - метил, или радикал - CH2 - OR1, в котором R1 - атом водорода или ацил;
R1 и R2 - вместе образуют вторую связь или R1 и R2 вместе образуют эпоксид в положении β, или R1 - атом водорода, кетоновая группа, β - гидроксильная группа, а
R2 - атом водорода, или R1-β - гидроксильная группа, возможно защищенная в форме эфира или сложного эфира, а
R2 - атом фтора или брома в положении α, R3 - атом водорода, фтора или метил, отличающийся тем, что соединение общей формулы Il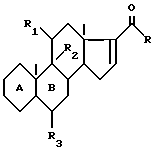
где A, B, R, R1, R2 и R3 имеют вышеуказанные значения, подвергают обработке галогенидом магния в присутствии катализатора на основе меди, предпочтительно диацетата или дипропионата меди с последующим гидролизом полученного 16α-метилированного енолата с помощью слабой кислоты или буферного раствора со слабокислым pH с получением соответствующего енола, с последующим его окислением с помощью надкислоты.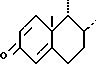
3. Способ по пп. 1 и 2, отличающийся тем, что за гидролизом следует окисляющая обработка одновалентных медных ионов, присутствующих в смеси.
| US 4277409, 1985 | |||
| Способ получения 11 @ -гидроксистероидов прегнанового ряда | 1983 |
|
SU1447826A1 |
Авторы
Даты
1999-03-10—Публикация
1994-01-19—Подача