Изобретение относится к новым карбоксамидам формулы I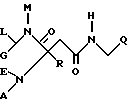
где E обозначает водород,
G обозначает H, низший алкил или при определенных условиях связанный через низший алкилен COOH, COO-низший алкил, низший алканоил, OH, низший алканоилокси, низший алкокси, арил-низший алкокси, CONH2, CONHCH2CH2OH, CONHOH, CONHOCH3, CONHO-бензил, CONHSO2-низший алкил, CONHCH2CH2-арил, CONH-циклоалкил, CONHCH2-гетероарил, NH2, NHCOO-низший алкил, NHCOO-низший аралкил, NHSO3H, (NHSO2 либо NHSO3)-низший алкил, NH-низший алканоил, NHCOCOOH, NHCOCOO-низший алкил, NH-циклоалкил, NH-(3,4-диоксо-2-гидроксициклобут-1-енил), NH-[2-низший (алкокси либо -алкенилокси)-3,4-диоксоциклобут-1-енил], NHCH2-гетероарил, NHCOCO-(арил либо низший алкил), NHCOCH2Cl, NHCO-низший алкилен-O-(низший алкил либо арил), NHCOCH2[арил, гетероарил либо -N(гет)], NHCOC(NOH)-низший алкилен-COOH, NHSO2-N(гет),
R10 и R20 обозначают H, низший алкил или фенил и
M обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил,
L обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил или
M и L вместе с атомами, с которыми они связаны, образуют группу -N(гет) или
E и G вместе образуют метиленовую либо карбонильную группу и
M обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил или карбокси-низший алкил и
L обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил,
A обозначает H, алкил, низший аралкил или группу формулы
-C(O)R2 (A1),
-S(O)2N(R3,R4) (A2)
или если группа Q содержит гидроксильную группу и/или если E и G вместе представляют собой CH2 либо CO, то
A может представлять собой также группу формулы
-S(O))2R5 (A3),
R2 обозначает низший алкил, при определенных условиях связанный через низший алкилен арил, гетероарил либо циклоалкил, или связанный через низший алкилен карбо-низший алкокси или связанный через низший алкилен - (O либо S)-(арил, гетероарил либо циклоалкил), причем содержащаяся в R2 группа низшего алкилена в α- положении относительно карбонильной группы, с которой связан R2, может быть замещена гидроксильной группой, аминогруппой либо низшим алканоиламино, или
R2 обозначает связанный через низший алкилен галоген, карбоксильную группу, низший алкокси, амино, моно- либо ди-низший алкиламино или связанную через низший алкилен группу -N(гет), или
R2 представляет собой группу -OR22 либо -NHR22,
R22 обозначает низший алкил или при определенных условиях связанный через низший алкилен арил, гетероарил либо циклоалкил, или замещенный во фрагменте низшего алкила арилом, карбо-низшим алкокси либо COOH низший аралкил,
R3 и R4 независимо друг от друга обозначают водород, алкил либо арил-низший алкил, или вместе с N-атомом, по которому они связаны, образуют группу -N(гет),
R5 обозначает арил, гетероарил, гетероциклил, алкил либо циклоалкил,
-N(гет) обозначает N-связанный, при определенных условиях разорванный O, S, NH либо N-низшим алкилом и при определенных условиях замещенный в количестве до двух заместителями из группы: низший алкил, OH, оксо, COOH, COO-низший алкил, CH2OH и CH2O-бензил -N(CH2)4-9,
Q представляет собой группу формулы Q1 или Q2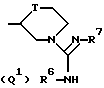
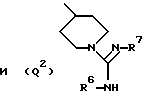
T представляет собой CH2 либо O,
один из R6 и R7 обозначает водород либо карбо-низший алкокси, а другой обозначает водород, карбо-низший алкокси либо гидроксильную группу, и
R представляет собой водород либо низший алкил,
а также к гидратам или сольватам и к физиологически совместимым солям названных соединений.
Изобретение относится далее к способу получения вышеназванных соединений, фармацевтическим препаратам, содержащим такие соединения, а также к применению этих соединений для изготовления фармацевтических препаратов.
Примерами применяемых в физиологии солей соединений формулы I являются соли с физиологически совместимыми минеральными кислотами, как соляная кислота, серная кислота, сернистая кислота либо фосфорная кислота; или с органическими кислотами, как метансульфоновая кислота, p-толуолсульфоновая кислота, уксусная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота либо салициловая кислота. Соединения формулы I с кислыми группами, как карбоксильная группа, могут образовывать также соли с физиологически совместимыми основаниями. Примерами таких солей являются соли щелочных и щелочноземельных металлов, соли аммония и алкиламмония, как соли натрия, калия, кальция или тетраметиламмония. Соединения формулы 1 могут быть представлены также в виде амфотерных ионов.
Соединения формулы I могут подвергаться сольватации, прежде всего гидратации. Гидратация может проводиться во время осуществления способа получения по изобретению, или же она может проявляться постепенно в форме последовательного ряда гигроскопических свойств первоначально безводного соединения формулы I.
Соединения формулы I содержат по крайней мере два асимметричных C-атома и поэтому могут быть представлены в виде смеси диастереомеров либо в виде оптически чистого соединения.
В рамках настоящего изобретения определение "низший" обозначает группы, содержащие 1-6, предпочтительно 1-4 C-атома. Так, понятие "низший алкил", употребленное само по себе или в каком-либо сочетании, обозначает линейные либо разветвленные, содержащие 1-6, предпочтительно 1-4 C-атома группы, как метил, этил, пропил, изопропил, бутил, изобутил, трет.-бутил, 2-бутил и пентил. В качестве алкильных групп предпочтительны группы низшего алкила. Одним из примеров низшего алкилена является метилен.
Арил обозначает группы, как фенил и 1- либо 2-нафтил, при определенных условиях с одним или несколькими заместителями, как галоген, например хлор, или низший алкил либо алкокси, например CH3, трет.-бутил, OH, OCH3, фенил, CF3, OCF3, циклопентил, CN, COOH, COOCH3, COOC2H5, CONH2 либо тетразолил.
Гетероарильные группы представляют собой 5-10-звенные ароматические группы, состоящие из одного либо двух колец и содержащие один либо несколько N- и/или O-атомов. Примерами таких групп являются 2-, 3- либо 4-пиридил также в виде их N-оксидов, фурил, пиримидил, индолил, пиразинил, пиридазинил, тетразолил, оксадиазолил, хинолил или имидазолил. Они могут быть замещены, например, оксо, низшим-алкилом, как CH3, галогеном, как хлор, или амино.
Циклоалкильные группы содержат 3-8 C-атомов. Примерами таких групп являются циклопропил, циклопентил и циклогексил.
Гетероциклил обозначает 5-10-звенные неароматические, частично либо полностью насыщенные группы, как тетрагидрохинолил или тетрагидропиридазинил, содержащие одно либо два кольца и по крайней мере один гетероатом, например один либо два N-атома, и при определенных условиях замещенные одним либо несколькими заместителями, как низший алкил, например метил.
Примерами при определенных условиях разорванных гетероатомом и при определенных условиях замещенных от тетра- до нонаметилениминогрупп N(гет) являются гексагидроазепин, морфолино и метилпиперазинил.
Примерами соединений по изобретению являются соединения формулы Ia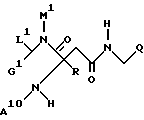
где G1 обозначает H, низший алкил или при определенных условиях связанный через низший алкилен COOH, COO-низший алкил, низший алканоил, OH, низший алканоилокси, низший алкокси, арил-низший алкокси, CONH2, CONHCH2CH2OH, CONHOH, CONHOCH3, CONHO-бензил, CONHSO2-низший алкил, CONHCH2CH2-арил, CONH-циклоалкил, CONHCH2-гетероарил, NH2, NHCOO-низший алкил, NHCOO-низший аралкил, NHSO3H, (NHSO2 либо NHSO3)-низший алкил, NH-низший алканоил, NHCOCOOH, NHCOCOO-низший алкил, NH-циклоалкил, NH-(3,4-диоксо-2-гидроксициклобут-1-енил), NH-[2-низший (алкокси либо -алкенилокси)-3,4-диоксоциклобут-1-енил] , NHCH2-гетероарил, NHCOCO-(арил либо низший алкил), NHCOCH2Cl, NHCO-низший алкилен-O-(низший алкил либо арил), NHCOCH2[арил, гетероарил либо -N(гет)] , NHCOC(NOH)-низший алкилен-COOH, NHSO2-N(гет), NHCO-(арил, гетероарил либо гетероциклил), NHPO3(R10,R20), гетероарил либо группу CO-N(гет),
R10 и R20 обозначают H, низший алкил или фенил, и
M1 обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил,
L1 обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил, или
M1 и L1 вместе с атомами, с которыми они связаны, образуют группу -N(гет),
A10 обозначает H, алкил, низший аралкил или группу формулы
-C(O)R2 (A1),
-S(O)2N(R3,R4) (A2)
или, если группа Q содержит гидроксильную группу,
A10 может представлять собой также группу формулы
-S(O))2R5 (A3),
R, R2-R5, -N(гет) и Q имеют указанное выше значение.
Другими примерами соединений по изобретению являются соединения формулы Ib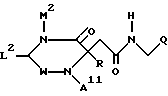
где W обозначает метилен либо карбонил,
M2 обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил, или карбокси-низший алкил, и
L2 обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил, и
A11 представляет собой H, алкил, низший аралкил либо группу формулы
-C(O)R2 (A1),
-S(O)2N(R3,R4) (A2) или
-S(O))2R5 (A3), и
R, R2-R5, и Q имеют указанное выше значение.
Среди соединений Ia предпочтительными являются те из них, где L1 представляет собой водород, а G1 - при определенных условиях связанный через низший алкилен COOH, COO-низший алкил, NHCOO-низший аралкил или NHCO (арил либо гетероарил),
далее те их них, где M1 представляет собой низший алкил либо циклоалкил и/или где A10 представляет собой группу формулы
-C(O)R2 (A1),
в которой R2 представляет собой группу R22, -OR22 либо -NHR22, и R22 представляет собой низший алкил либо при определенных условиях связанный через низший алкилен арил, гетероарил либо циклоалкил или в которой R2 представляет собой связанный через низший алкилен карбо-низший алкокси или связанный через низший алкилен -(O либо S)-(арил, гетероарил либо гетероарил), причем содержащаяся в R2 группа низшего алкилена в α- положении относительно карбонильной группы, по которой связан R2, может быть замещена OH либо низшим алканоиламино.
Среди других предпочтительных соединений Ia следует выделить те из них, где A10 содержит группу -S(O)2 арил, а Q содержит группу OH, или где A10 представляет собой морфолиносульфонил.
Среди соединений Ia предпочтительными являются далее те, где L1 представляет собой водород, а G1 - при определенных условиях связанный через низший алкилен NHCO-низший алкилен-O-(низший алкил либо арил), NHCOCH2[арил, гетероарил либо -N(гет)], NHCOC(NOH)-низший алкилен-COOH, NHSO2-N(гет), NHCO-гетероциклил или при определенных условиях разорванный O либо S и при определенных условиях замещенный в количестве до двух заместителями из группы: низший алкил, COOH, COO-низший алкил, CH2OH и CH2O-бензил CON(CH2)4-9,
и далее те из них, где A10 представляет собой низший алкил, низший аралкил либо группу формулы
-C(O)R2 (A1),
в которой R2 представляет собой связанный через низший алкилен галоген, карбоксильную группу, низший алкокси, амино, моно- либо ди-низший алкиламино или связанную через низший алкилен группу -N(гет) или R2 представляет собой -NHR22, где R22 представляет собой замещенную во фрагменте низшего алкила арилом, карбо-низшим алкокси либо COOH группу низшего аралкила.
К соединениям формулы Ia относятся, например, следующие:
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-бензилоксикарбониламинопропионил] -циклопропиламино]- уксусной кислоты,
этиловый эфир 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-бензилоксикарбониламинопропионил] -циклопропиламино] - пропионовой кислоты,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-бензилоксикарбониламинопропионил] -бутиламино] - уксусной кислоты,
этиловый эфир 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-бензилоксикарбониламинопропионил]-бутиламино]- пропионовой кислоты,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- бензилоксикарбониламинопропионил]-циклопропиламино]-уксусная кислота,
3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- бензилоксикарбониламинопропионил]-циклопропиламино]-пропионовая кислота,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- бензилоксикарбониламинопропионил]-бутиламино]-уксусная кислота,
3-[[(S)-3-[(S)-1-аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- бензилоксикарбониламинопропионил]-бутиламино]-пропионовая кислота,
этиловый эфир [[(S)-3-[4-(аминоиминометил)-морфолин-2- илметилкарбамоил] -2-бензилоксикарбониламинопропионил]-циклопропиламино]- уксусной кислоты,
этиловый эфир [[(S)-3-[4-(аминоиминометил)-морфолин-2- илметилкарбамоил] -2-бензилоксикарбониламинопропионил]-бутиламино]- уксусной кислоты,
этиловый эфир 3-[[(S)-3-[4-(аминоиминометил)-морфолин-2- илметилкарбамоил]-2-бензилоксикарбониламинопропионил]-циклопропиламино]- пропионовой кислоты,
этиловый эфир 3-[[(S)-3-[4-(аминоиминометил)-морфолин-2- илметилкарбамоил]-2-бензилоксикарбониламинопропионил]-бутиламино]- пропионовой кислоты,
[[(S)-3-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил]-2- бензилоксикарбониламинопропионил]-циклопропиламино]-уксусная кислота,
3-[[(S)-3-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил]-2- бензилоксикарбониламинопропионил]-циклопропиламино]-пропионовая кислота,
3-[[(S)-3-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил]-2- бензилоксикарбониламинопропионил]-бутиламино]-пропионовая кислота,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-циклогексилметоксикарбониламинопропионил]- циклопропиламино]-уксусной кислоты,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- циклогексилметоксикарбониламинопропионил]-циклопропиламино]-уксусная кислота,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-(3-бензилуреидо)-пропионил]-циклопропиламино]- уксусной кислоты,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-(3-фуран-2-илметилуреидо)-пропионил] -циклопропиламино]- уксусной кислоты,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-(3-бутилуреидо)-пропионил]-циклопропиламино]- уксусной кислоты,
этиловый эфир 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-(3-фуран-2-илметилуреидо)-пропионил] -бутиламино]- пропионовой кислоты,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- (3-бензил-уреидо)-пропионил]-циклопропиламино]-уксусная кислота,
[[(S)-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- (3-фуран-2-илметилуреидо)-пропионил]-циклопропиламино]-уксусная кислота,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- (3-n-бутилуреидо)-пропионил]-циклопропиламино]-уксусная кислота,
[[(S)-[(S)-1-аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- (3-фуран-2-илметил)-уреидо)-пропионил]-n-бутиламино]-пропионовая кислота,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-пентаноиламинопропионил]-циклопропиламино]-уксусной кислоты,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-гексаноиламинопропионил]-циклопропиламино]-уксусной кислоты,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-(4-хлорпиридин-2-илкарбониламино)-пропионил]- циклопропиламино]-уксусной кислоты,
этиловый эфир [[(S)-3-[(S)-1-аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-бензоиламинопропионил]-циклопропиламино]-уксусной кислоты,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-бензилоксикарбониламинопропионил]-циклопропиламино]- уксусной кислоты,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- гексаноиламинопропионил]-циклопропиламино]-уксусной кислоты,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- (4-хлоро-пиридин-2-илкарбониламино)-пропионил]-циклопропиламино]-уксусная кислота,
[[(S)-3-[(S)-1-аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- бензоиламинопропионил]-циклопропиламино]-уксусная кислота,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- бензилкарбониламинопропионил]-циклопропиламино]-уксусная кислота,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-трет. - бутоксикарбониламино-N1-циклопропил-N1-(2-пиразин-2-илкарбониламино)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-(3-индол-3-ил-пропиониламино)-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
метиловый эфир (S)-4-[(S)-2-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбонил] -1-[циклопропил-(2-пиразин-2-илкарбониламиноэтил)- карбамоил]-этилкарбамоил]-4-гидрокси-масляной кислоты,
(S)-2-[(S)-2-ацетиламино-3-индол-3-илпропиониламино] -N4-[(S)- 1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-N1-(2- пиразин-2-илкарбониламиноэтил)-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-2- феноксиацетиламино-N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамид,
бензиловый эфир 2-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-морфолин-4-илсульфониламинопропионил]-циклопропиламино]- этилкарбаминовой кислоты и
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-2- морфолин-4-илсульфониламино-N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамид.
Другими примерами соединений Ia являются
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-2- морфолин-4-илсульфониламино-N1-[2-(6-оксо-1,4,5,6-тетрагидропиридазин-3- илкарбониламино)-этил]-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-[2-(3- аминопиразин-2-илкарбониламино)-этил] -N1-циклопропил-2-морфолин-4- илсульфониламино-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-(2-метоксиацетиламиноэтил)-2-морфолин-4-илсульфониламино-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-(2-морфолин-4-илацетиламиноэтил)-2-морфолин-4-илсульфониламино-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-[2-(4-метилпиперазин-1-илацетиламино)-этил] -2-морфолин-4- илсульфониламино-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-[2-(3-метоксипропиониламино)-этил]-2-морфолин-4-илсульфониламино- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-(2-имидазол-1-илацетиламиноэтил)-2-морфолин-4-илсульфониламино- сукцинамид,
(E)- и (Z)-4-[2-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-морфолин-4-илсульфониламинопропионил] - циклопропиламино] -этилкарбамоил]-4-гидроксиминомасляная кислота,
(S)-N1-(2-аминоэтил)-N4-[(S)-1-(аминоиминометил)-пиперидин-3- илметил] -N1-циклопропил-2-морфолин-4-илсульфониламино-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-[2-(4-метилпиперазин-1-илсульфониламино)-этил] -2-морфолин-4- илсульфониламино-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-морфолин-4-илсульфониламино-N1-(2-морфолин-4-илсульфониламиноэтил)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-(3-метоксипропиониламино)-N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-метоксиацетиламино-N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-(4-метилпиперазин-1-илацетиламино)-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-2-амино- 3-фенилпропиониламино] -N1-циклопропил-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(R)-2-амино- 3-фенил-пропиониламино]-N1-циклопропил-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-[2-(4-гидроксипиперидин-1-ил)-ацетиламино] -N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-(2-имидазол-1-илацетиламино)-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-[2-(2-оксопиперидин-1-ил)-ацетиламино] -N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-(3-диметимламинопропиониламино)-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-(2-диметиламиноацетиламино)-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-(2,6-диметилморфолин-4-илацетиламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамид,
этиловый эфир 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-бутиламинопропионил]-циклопропиламино]-пропионовой кислоты,
3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- бутиламинопропионил]-циклопропиламино]-пропионовая кислота,
[[(S)-2-амино-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -пропионил]-циклопропиламино]-уксусная кислота,
(S)-3-амино-N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -4- азепан-1-ил-4-оксо-бутирамид,
(S)-N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]-4-азепан-1-ил- 3-бензилоксикарбониламино-4-оксо-бутирамид,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-(3-дифенилметилуреидо)-пропионил]-циклопропиламино]- уксусной кислоты,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-(3-циклогексилметилуреидо)-пропионил] -циклопропиламино]- уксусной кислоты,
(S)-N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -4-азепан-1-ил- 3-(3-бензилуреидо)-4-оксо-бутирамид,
метиловый эфир (S)-2-[3-[(S)-1-[(S)-(аминоиминометил)-пиперидин-3- илметилкарбамоилметил] -2-азепан-1-ил-2-оксоэтил]-уреидо]-3-фенилпропионовой кислоты,
метиловый эфир (R)-2-[3-[(S)-1-[(S)-(аминоиминометил)-пиперидин-3- илметилкарбамоилметил] -2-азепан-1-ил-2-оксоэтил]-уреидо]-3-фенилпропионовой кислоты,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- (3-дифенилметилуреидо)-пропионил]-циклопропиламино]-уксусная кислота,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- (3-циклогексилметилуреидо)-пропионил]-циклопропиламино]-уксусная кислота,
(S)-2-[3-[(S)-1-[(S)-(аминоиминометил)-пиперидин-3- илметилкарбамоилметил]-2-азепан-1-ил-2-оксоэтил]-уреидо]-3-фенилпропионовая кислота,
(R)-2-[3-[(S)-1-[(S)-(аминоиминометил)-пиперидин-3- илметилкарбамоилметил]-2-азепан-1-ил-2-оксоэтил]-уреидо]-3-фенилпропионовая кислота,
[[(S)-2-бензилоксикарбониламино-3-[(S)-1-(этоксикарбониламиноиминометил)- пиперидин-3-илметилкарбамоил]-пропионил]-циклопропиламино]-уксусная кислота,
[[(S)-2-бензилоксикарбониламино-3-[4-(этоксикарбониламиноиминометил)- морфолин-2-илметилкарбамоил]-пропионил]-циклопропиламино]-уксусная кислота,
этиловый эфир [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-(2-хлорацетиламино)-пропионил]-циклопропиламино]- уксусной кислоты,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-(2-хлорацетиламино)-пропионил]-циклопропиламино]-уксусная кислота,
Примерами соединений Ib являются
N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-4-циклопентил- 1-нафтален-2-илсульфонил-3,6-диоксопиперазин-2-ил]-ацетамид,
[3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоилметил] -4- бутилсульфонил-2-оксопиперазин-1-ил]-уксусная кислота и
N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-2,6-диоксо- 4-бутилпиперазин-2-ил]-ацетамид.
Другими примерами соединений Ib являются
N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-4-циклопропил- 3,6-диоксо-1-(3-фенилпропил)-пиперазин-2-ил]-ацетамид,
N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-1-нафтален- 2-илсульфонил-3,6-диоксопиперазин-2-ил]-ацетамид,
N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(2S, 5S)-5- гидроксиметил-1-нафтален-2-илсульфонил-3,6-диоксопиперазин-2-ил]-ацетамид,
(S)-1-(аминоиминометил)-пиперидин-3-илметиламид(2S, 5R)- и (2S,5S)-(5-бензил-3,6-диоксо-4-пропилпиперазин-2-ил)-уксусной кислоты,
этиловый эфир (S)-[2-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоилметил]-4-циклопропил-3,6-диоксопиперазин-1-ил]-уксусной кислоты,
[(S)-2-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоилметил] - 4-циклопропил-3,6-диоксопиперазин-1-ил]-уксусная кислота,
(S)-1-(аминоиминометил)-пиперидин-3-илметиламид(R)- и (S)-(2,4-диметил-1-нафтален-2-илсульфонил-3-оксопиперазин-2-ил)-уксусной кислоты.
К предпочтительным соединениям формулы I относятся следующие:
[[(S)-3-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил] -2- бензилоксикарбониламинопропионил]-бутиламино]-уксусная кислота,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]-2- пентаноиламинопропионил]-циклопропиламино]-уксусная кислота,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-(2-пиразин-2-илкарбониламиноэтил)-2-пиримидин-2-илсульфанилацетиламино- сукцинамид,
(S)-N4-[(S)-1-(аминогидроксииминометил)-пиперидин-3-илметил] -N1- циклопропил-2-(нафтален-2-илсульфониламино)-N1-[2-(пиразин-2-илкарбониламино)- этил]-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-морфолин-4-илсульфониламино-N1-[2-(6-оксо-1,6-дигидропиридазин-3- илкарбониламиноэтил]-сукцинамид и
N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-4-циклопропил- 1-нафтален-2-илсульфонил-3,6-диоксопиперазин-2-ил]-ацетамид.
Другими предпочтительными соединениями являются следующие:
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1- циклопропил-2-морфолин-4-илацетиламино-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамид,
этиловый эфир 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-(3-фенилпропиламино)-пропионил] -циклопропиламино] - пропионовой кислоты,
3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-(3-фенилпропиламино)-пропионил]-циклопропиламино]-пропионовая кислота,
3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-морфолин-4-илсульфониламинопропионил]-циклопропиламино]-пропионовая кислота.
Предлагаемые согласно изобретению соединения получают по известной методике следующим образом:
а) кислоту формулы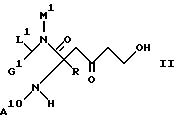
подвергают обменной реакции с амином формулы
H2NCH2Q III
либо с солью этого амина при определенных условиях с промежуточной защитой функциональных групп, содержащихся в группах G1, M1 и A10 (в II) и Q (в III), или
б) амин формулы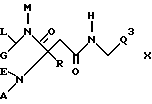
где Q3 представляет собой группу формулы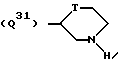
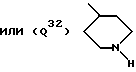
подвергают обменной реакции со средством, вводящим при определенных условиях гидроксилированную амидиногруппу -C(NR7)NHR6, или
в) амин формулы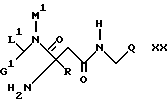
подвергают обменной реакции со средством, вводящим группу A10, или
г) аминокислоту формулы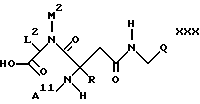
либо формулы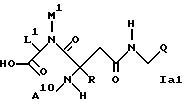
циклизуют до соединения формулы Ib или
д) для получения карбоновой кислоты формулы Ib, где M2 представляет собой карбокси-низший алкил, расщепляют соответствующий сложный низший алкиловый эфир и
е) в случае необходимости содержащуюся в соединении формулы I реакционноспособную группу функционально модифицируют и
ж) в случае необходимости соединение формулы I переводят в физиологически совместимую соль либо соль соединения формулы I переводят в свободную кислоту или основание.
Предпочтительно кислоту II подвергают в растворителе, как диметилформамид (ДМФ) либо метиленхлорид, в присутствии основания, как 4-этилморфолин, триэтиламин, этилдиизопропиламин (основание Хюнига) либо 1,8-диазабицикло(5.4.0)ундец-7-ен (ДБУ), при комнатной температуре обменной реакции с солью соединения формулы III, например, с трифторацетатом, бисульфитом, нитратом, гидрохлоридом или гидройодидом, и с гексафторфосфатом бензотриазол-1-илокси- трис(диметиламино)фосфония (БОФ). Содержащиеся в соединениях II и III, промежуточно защищаемые функциональные группы, как COOH, NH2 и OH, могут защищаться в виде низший алкил OCO-групп, бензил OCO-групп либо азидогрупп, соответственно бензилоксигрупп. Расщепление защищенной карбоксильной группы, как COOCH3 или COOC2H5, до COOH может осуществляться с помощью натрового щелока в этаноле. Перевод бензилOCONH- или N3-группы в свободную аминогруппу может проводиться путем каталитического (Pt/C) гидрирования в этаноле.
Согласно варианту б) способа для получения соединения формулы I, где R6 и R7 (в группе Q) являются водородом, соответствующее соединение формулы X можно подвергать в растворителе, как ДМФ либо метанол, в присутствии основания, как триэтиламин, обменной реакции с формамидинсульфокислотой либо с нитратом 3,5-диметил-1-пиразолил-формамидиния, предпочтительно при температуре до 50oC.
Для получения соединения формулы I, где R6 и R7 (в группе Q) представляют собой OH, соединение формулы X может подвергаться в растворителе, как метиленхлорид, при охлаждении обменной реакции сначала с бромистым цианом, а затем с гидрохлоридом гидроксиламина в присутствии амина, как триэтиламин.
Для осуществления варианта в) способа амин XX может подвергаться в растворителе, как ДМФ, в присутствии основания, как этилморфолин, обменной реакции с соединением формулы ClC(O)OR2 либо ClC(O)R2, например, с циклогексилметиловым эфиром хлормуравьиной кислоты. Если амин XX подвергать в растворителе, как ацетонитрил, взаимодействию с бикарбонатом натрия и активированным карбаматом, например, 2,5-диоксопирролидин-1-иловым эфиром бензилкарбаминовой кислоты, то получают уретан формулы Ia, где A10 представляет собой группу -C(O)NHR22. Если амин XX подвергать в растворителе, как метиленхлорид, взаимодействию с карбоновой кислотой, например, пиримидин-2-тиоуксусной кислотой, в присутствии основания, как основание Хюнига, и БОФ, то получают соединение формулы Ia, в котором A10 представляет собой группу -C(O)R2, где R2 представляет собой, например, связанный через низший алкилен -(O либо S)-(арил, гетероарил либо циклоалкил).
Циклизацию г) можно проводить в растворителе, как ДМФ, в присутствии основания, как 4-этил-морфолин, и БОФ.
Расщепление д) эфира низший алкил-карбоновой кислоты до соответствующей карбоновой кислоты формулы Ib, где M2 представляет собой карбокси-низший алкил, может проводиться в растворителе, как водный этанол, с помощью ионита в виде Cl.
В качестве функциональных модификаций в варианте е) способа можно назвать следующие:
1. омыление сложноэфирной группы, как этоксикарбонил, например, в ТГФ, с помощью основания, как водный LiOH;
2. отщепление Z-группы (бензилоксикарбонил) в Z-защищенной аминогруппе, содержащейся, например, в группе G;
3. преобразование получаемой по п.2 свободной аминогруппы G в группу NHC(O)-(арил либо гетероарил), соответственно в группу NHSO2-N(гет), например, посредством реакции с карбоновой кислотой формулы G-COOH, соответственно с ClSO2-N(гет).
Применяемые в качестве исходных указанные выше вещества могут быть получены по известной методике, например, согласно следующим схемам: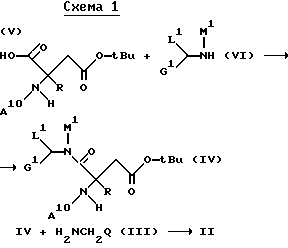
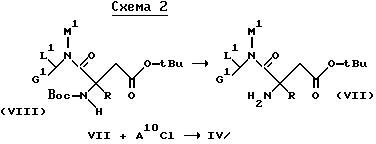
Амин XX можно получать, например, путем отщепления Z-группыв в соединении формулы Ia, в которой группа A10 представляет собой бензилоксикарбонильную группу.
Соединения XXX описываются в европейской заявке EP-A-468231. Их можно получать так же, как и соединения формулы Ia.
Применяемые в качестве исходных веществ сложные эфиры в варианте д) способа можно получать следующим путем: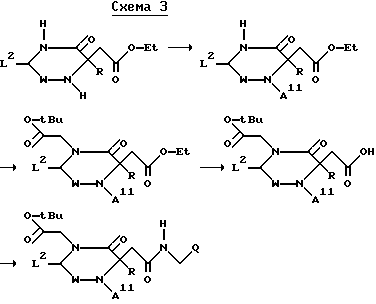
В дополнение к приведенным пояснениям в некоторых из нижеследующих примеров содержатся более подробные данные касательно получения определенных исходных материалов и промежуточных продуктов.
Соединения формулы I, их сольваты и их соли обладают способностью ингибировать как накопление тромбоцитов, индуцированное тромбином, так и индуцированное тромбином свертывание фибриногена в плазме крови. Названные соединения влияют как на индуцированное тромбоцитами, так и на плазменное свертывание крови. Тем самым они препятствуют прежде всего образованию обтурирующих тромбов, равно как и богатых тромбоцитами тромбов и могут применяться для лечения, соответственно предупреждения таких болезней, как тромбоз, апоплексия, инфаркт миокарда, воспаление и атеросклероз. Кроме того, эти соединения эффективны против опухолевых клеток и препятствуют образованию метастаз. Благодаря этому они могут использоваться в качестве противоопухолевых средств.
Способность названных выше соединений к разностороннему ингибированию тромбина и других серин-протеаз делает эти соединения объектом для получения средств, отличающихся максимально высокой специфичностью их действия и позволяющих тем самым избежать возможных побочных эффектов. В ходе проводившихся с серин-протеазами экспериментов наряду с другими факторами было выявлено соотношение между ингибированием трипсина и ингибированием тромбина, принятое за основную величину измерения специфического действия того или иного соединения (обозначение через q в нижеследующей таблице), поскольку трипсин как наиболее неспецифическая серин-протеаза легко может ингибироваться самыми разными ингибиторами. Чтобы получить возможность, несмотря на использование различных субстратов, для непосредственного сравнения ингибирования тромбина и трипсина, в качестве величины измерения ингибирования была определена константа Ki, независимая от концентрации субстрата и фермента.
Для подтверждения ингибирующего действия по отношению к каталитической активности вышеназванных протеаз могут использоваться соответствующие хромогенные пептидные субстраты. Ингибирование амидолитической активности тромбина и трипсина вышеназванными соединениями было выявлено по описанной ниже методике.
Измерения проводили на планшетах для микротитрования при комнатной температуре. С этой целью из расчета на каждую перфорацию в планшете приготавливали смеси из 150 мкл буфера (50 мМ трис, 100 мМ NaCl, 0,1% полиэтиленгликоля; pH 7,8) и 50 мкл растворенной в ДМСО и разбавленной в буфере ингибирующей субстанции и в смесь добавляли 25 мкл тромбина человека (конечная концентрация 0,5 нМ). Через 10 мин инкубирования реакцию возбуждали добавкой хромогенного субстрата S-2238 (H-D-Phe-Pip-Arg-паранитроанилин фирмы Kabivitrum; конечная концентрация 10 или 50 мкМ) и процесс гидролиза субстрата контролировали спектрофотометрическим путем с помощью кинетического считывающего устройства в течение 5 мин. На основании графического изображения кривых ингибирования по методу, описанному в Biochem. Journ. 55, 1955, 170-171, определяли значения Ki. Ингибирование трипсина осуществляли аналогичным образом, однако при этом применяли субстрат S-2251 (H-D-Val-Leu-Lys-паранитроанилин) в конечной концентрации 200 и 750 мкМ.
Полученные результаты представлены в таблице.
Соединения формулы I имеют малую токсичность. Так, продукты из приведенных в таблице примеров при внутривенном введении мышам имеют LD50 125-500 мг/кг.
Как упоминалось выше, лекарственные средства, содержащие соединение формулы I, сольват или соль этого соединения, также являются предметом настоящего изобретения, предмет изобретения составляет далее способ получения таких лекарственных средств, отличающийся тем, что из одного либо нескольких других ценных в терапевтическом отношении веществ изготавливают препараты в галогеновой форме. Лекарственные средства могут вводиться энтерально, например орально, в виде драже, мягкожелатиновых и твердожелатиновых капсул, растворов, эмульсий или суспензий или же, будучи изготовленными, например, в виде суппозиториев либо аэрозолей, могут назначаться для ректального введения. Введение препаратов, например, в виде растворов для инъекций может проводиться также парэнтерально.
Для изготовления таблеток, лаковых таблеток, драже и твердожелатиновых капсул в активное вещество могут добавляться фармацевтически инертные, неорганические либо органические эксципиенты. В качестве таковых для таблеток, лаковых таблеток, драже и твердожелатиновых капсул могут использоваться, например, лактоза, кукурузный крахмал либо его производные, тальк, стеариновая кислота либо ее соли. В качестве эксципиентов для мягкожелатиновых капсул пригодны, например, растительные масла, воск, жиры, полутвердые и жидкие полиолы; однако в зависимости от свойств активного вещества для мягкожелатиновых капсул вообще не потребуется никаких эксципиентов. Для приготовления растворов и сиропов в качестве эксципиентов пригодны, например, вода, полиолы, сахароза, инвертный сахар и глюкоза, для инъекционных растворов пригодны, например, вода, спирты, полиолы, глицерин и растительные масла, а для суппозиториев пригодны природные либо отвержденные масла, воск, жиры, полужидкие либо жидкие полиолы. Фармацевтические препараты могут содержать, кроме того, еще и консерванты, вещества, способствующие растворению, стабилизаторы, смачивающие агенты, эмульгаторы, сладкие вещества, красители, ароматизирующие вещества, соли для изменения осмотического давления, буферы, покрытия или антиокислители.
При лечении, соответственно предупреждении названных выше болезней дозировку активного вещества можно варьировать в широких пределах с учетом, естественно, в каждом отдельном случае индивидуальных особенностей пациента. В принципе при назначении для орального или парэнтерального введения, например внутривенно или подкожно, суточная доза для взрослого должна составлять от приблизительно 0,1 до приблизительно 20 мг/кг, предпочтительно от приблизительно 0,5 до приблизительно 4 мг/кг веса тела, однако, если это окажется целесообразным, дозу можно выбирать также выше либо ниже указанного верхнего предела.
Пример 1. 1.А) 3,6 г трет.-бутилового эфира (S)-3-бензилоксикарбониламино-N-циклопропил-N-этоксикарбонилметилсукцинамовой кислоты растворяют в 36 мл метиленхлорида, обрабатывают при 0oC 40 мл 4М соляной кислоты в уксусной эфире и перемешивают в течение 5 ч. Раствор упаривают и бесцветный остаток растворяют в 36 мл ДМФ, обрабатывают 5,1 мл 4-этилморфолина, 3,55 г гексафторофосфата бензотриазол-1-илокситрис(диметиламино)фосфония (БОФ) и 2,02 г дигидрохлорида (S)-1-амидино-3-(аминометил)пиперидина (см. европейскую заявку EP-A-468231; пример 60Ас) и перемешивают в течение ночи при комнатной температуре. Реакционную смесь упаривают и остаток хроматографируют с помощью градиента вода/ацетонитрил на RP-18. Фракции, содержащие продукт, упаривают и фильтруют с помощью воды/этанола через ионит (в виде Cl). После упаривания выделяют 2,9 г бесцветного гидрохлорида этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-бензилоксикарбониламинопропионил] -циклопропиламино]- уксусной кислоты, МС (бомбардировка ионами): 531,4 (M+H)+.
1.Б) Получение исходных веществ
В раствор из 8,0 г β- трет.-бутилового эфира N-Z-L-аспарагиновой кислоты в 80 мл метиленхлорида последовательно добавляют 5,0 г гидрохлорида N-(диметиламинопропил)-N'-этилкарбодиимида, 0,3 г 4-диметиламинопиридина и 3,7 г этилового эфира N-циклопропилглицина и перемешивают в течение 17 ч при комнатной температуре. Затем реакционную смесь сливают в ледяной раствор, состоящий из 5%-ного раствора гидросульфата калия и 10%-ного раствора сульфата калия, и экстрагируют с помощью уксусного эфира. Органические фазы промывают водой, сушат, упаривают и остаток хроматографируют с помощью гексана/уксусного эфира (3: 1) на силикагеле. В результате получают 8,4 г бесцветного, маслянистого трет. -бутилового эфира (S)-3-бензилоксикарбониламино-N-циклопропил-N- этоксикарбонилметилсукцинамовой кислоты, МС (БТЯ): 449,2 (M+).
Пример 2. 2.А) Аналогично примеру 1 получают следующие соединения:
а) гидрохлорид этилового эфира 3-[[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-бензилоксикарбониламинопропионил] - циклопропиламино]-пропионовой кислоты, МС (бомбардировка ионами): 545,4 (M+H)+,
б) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-бензилоксикарбониламинопропионил]- бутиламино]-уксусной кислоты, МС (бомбардировка ионами): 547,5 (M+H)+,
в) гидрохлорид этилового эфира 3-[[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-бензилоксикарбониламинопропионил] - бутиламино] -пропионовой кислоты, МС (бомбардировка ионами): 561,4 (M+H)+.
2.Б) Получение исходных веществ
Аналогично примеру 1.Б), с той однако разницей, что вместо этилового эфира N-циклопропилглицина используют этиловый эфир N-циклопил -β- аланина, этиловый эфир N-бутилглицина, соответственно этиловый эфир N-бутил -β- аланина, получают следующие промежуточные продукты:
а) трет.-бутиловый эфир (S)-3-бензинкарбониламино-N-циклопропил- N-(2-этоксикарбонилэтил)-сукцинамовой кислоты, МС (БТЯ): 463,3 (M+H)+,
б) трет. -бутиловый эфир (S)-3-бензилкарбониламино-N-бутил-N- этоксикарбонилметилсукцинамовой кислоты, МС (бомбардировка ионами): 465,4 (M+H)+,
в) трет. -бутиловый эфир (S)-3-бензилкарбониламино-N-бутил-N- (2-этоксикарбонилэтил)-сукцинамовой кислоты, МС (БТЯ): 479,3 (M+H)+.
Пример 3. 1,5 г гидрохлорида этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- бензилоксикарбониламинопропионил] -циклопропиламино] -уксусной кислоты (пример 1) растворяют в 15 мл ТГФ, обрабатывают 7,9 мл 1н. раствора гидроокиси лития и перемешивают в течение 90 мин при комнатной температуре. Затем раствор обрабатывают 7,9 мл 1н. соляной кислоты и упаривают. Остаток хроматографируют с помощью градиента вода/ацетонитрил на RP-18. В результате получают 0,63 г бесцветной [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- бензилоксикарбониламинопропионил]-циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 503,5 (M+H)+.
Пример 4. Аналогично примеру 3, исходя однако из сложноэфирных продуктов из примера 2, получают следующие кислоты:
а) 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-бензилоксикарбониламинопропионил] -циклопропиламино] -пропионовую кислоту, МС (бомбардировка ионами): 517,4 (M+H)+,
б) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-бензилоксикарбониламинопропионил]-бутиламино]-уксусную кислоту, МС (бомбардировка ионами): 519,4 (M+H)+,
в) 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-бензилоксикарбониламинопропионил] -бутиламино] -пропионовую кислоту, МС (бомбардировка ионами): 533,5 (M+H)+.
Пример 5. Аналогично примеру 1, применяя однако вместо дигидрохлорида (S)-1-амидино-3-(аминометил)пиперидина дигидрохлорид рац-2-аминометил-4-морфолинокарбоксамидина получают следующие соединения:
а) из трет.-бутилового эфира (S)-3-бензилоксикарбониламино-N- циклопропил-N-этоксикарбонилметилсукцинамовой кислоты получают гидрохлорид этилового эфира [[(S)-3-[4-аминоиминометил)-морфолин-2- илметилкарбамоил]-2-бензилоксикарбониламинопропионил] -циклопропиламино] - уксусной кислоты (1:1), МС (бомбардировка ионами): 533,4 (M+H)+,
б) из трет. -бутилового эфира (S)-3-бензилоксикарбониламино-N-бутил-N- этоксикарбонилметилсукцинамовой кислоты получают гидрохлорид этилового эфира [[(S)-3-[4-(аминоиминометил)-морфолин-2- илметилкарбамоил] -2-бензилоксикарбониламинопропионил]-бутиламино]- уксусной кислоты (1:1), МС (бомбардировка ионами): 549,4 (M+H)+,
в) из трет. -бутилового эфира (S)-3-бензилкарбониламино-N-циклопропил- N-(2-этоксикарбонилэтил)-сукцинамовой кислоты получают гидрохлорид этилового эфира 3-[[(S)-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил] - 2-бензилоксикарбониламинопропионил]-циклопропиламино]-пропионовой кислоты (1:1), МС (бомбардировка ионами): 547,5 (M+H)+,
г) из трет.-бутилового эфира (S)-3-бензилоксикарбониламино-N-бутил- N-(2-этоксикарбонилэтил)-сукцинамовой кислоты получают гидрохлорид этилового эфира 3-[[(S)-3-[4-(аминоиминометил)-морфолин-2- илметилкарбамоил] -2-бензилоксикарбониламинопропионил] -бутиламино] - пропионовой кислоты (1:1), МС (бомбардировка ионами): 563,5 (M+H)+.
Пример 6. Аналогично примеру 3, исходя однако из сложных эфиров из примера 5, получают следующие кислоты:
а) [[(S)-3-[4-аминоиминометил)-морфолин-2-илметилкарбамоил] -2- бензилоксикарбониламинопропионил] -циклопропиламино] -уксусную кислоту (1:1), МС (бомбардировка ионами): 505,0 (M+H)+,
б) [[(S)-3-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил] -2- бензилоксикарбониламинопропионил] -бутиламино] -уксусную кислоту (1: 1), МС (бомбардировка ионами): 521,1 (M+H)+,
в) 3-[[(S)-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил] -2- бензилоксикарбониламинопропионил]-циклопропиламино]-пропионовую кислоту (1:1), МС (бомбардировка ионами): 519,4 (M+H)+,
г) 3-[[(S)-3-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил]-2- бензилоксикарбониламинопропионил] -бутиламино] -пропионовую кислоту (1: 1), МС (бомбардировка ионами): 535,4 (M+H)+.
Пример 7.
7. А) 4,4 г продукта из примера 1.А) растворяют в 44 мл этанола, обрабатывают 7,7 мл 1н. соляной кислоты и 0,44 г Pd/C и гидрируют в течение 1 ч при комнатной температуре. После фильтрации и упаривания раствора получают 3,4 г бесцветного дигидрохлорида этилового эфира [[(S)-2-амино-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - пропионил] -циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 397,4 (M+H)+,
7. Б) Аналогично примеру 7.А), исходя однако из продуктов из примера 2. А), получают следующие амины:
7. Б)а) дигидрохлорид этилового эфира 3-[[(S)-2-амино-3-[(S)- 1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -пропионил] - циклопропиламино]-пропионовой кислоты,
7. Б)б) дигидрохлорид этилового эфира 3-[[(S)-2-амино-3-[(S)- 1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -пропионил]-бутиламино]- уксусной кислоты,
7. Б)в) дигидрохлорид этилового эфира 3-[[(S)-2-амино-3-[(S)- 1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -пропионил] -бутиламино] - пропионовой кислоты, МС (бомбардировка ионами): 427,4 (M+H)+.
7. В) Аналогично примеру 7.А), исходя однако из продукта из примера 3, соответственно 4в), получают следующие амины:
7. В)а) гидрохлорид [[(S)-2-амино-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -пропионил] -циклопропиламино] -уксусной кислоты, МС (бомбардировка ионами): 369,4 (M+H)+,
7. В)б) гидрохлорид 3-[[(S)-2-амино-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -пропионил] -бутиламино] -пропионовой кислоты, МС (бомбардировка ионами): 399,4 (M+H)+.
7. Г) В раствор из 1,7 г аминопродукта из примера 7.А) в 18 мл ДМФ добавляют 2,4 мл 4-этилморфолина и 0,73 г циклогексилметилового эфира хлормуравьиной кислоты и перемешивают в течение ночи при комнатной температуре. Реакционную смесь упаривают, обрабатывают 1н. соляной кислотой, после чего повторно упаривают и остаток хроматографируют с помощью градиента ацетонитрил/вода на RP-18. После упаривания содержащих продукт фракций получают 1,6 г гидрохлорида этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-циклогексилметоксикарбониламинопропионил] - циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 537,6 (M+H)+.
Пример 8.
Аналогично примеру 3, исходя однако из сложного эфира из примера 7.Г), получают следующую кислоту:
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- циклогексилметоксикарбониламинопропионил] -циклопропиламино] -уксусную кислоту, МС (бомбардировка ионами): 509,5 (M+H)+.
Пример 9.
9.А) Получение продуктов:
9. А)а) 1,7 г аминопродукта из примера 7.А) растворяют в 17 мл ацетонитрила и 17 мл воды. Затем добавляют последовательно 0,6 г бикарбоната натрия и 1,35 г 2,5-диоксопирролидин-1-илового эфира бензилкарбаминовой кислоты и перемешивают в течение 17 ч при комнатной температуре. Реакционную смесь упаривают и остаток очищают на колонке RP-18 с помощью градиента ацетонитрил/вода. В результате выделения получают 0,6 г бесцветного гидрохлорида этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-(3-бензилуреидо)-пропионил] -циклопропиламино]- уксусной кислоты, МС (бомбардировка ионами): 530,5 (M+H)+.
9. А)б) Аналогичным путем, используя однако соответствующие активированные карбаматы, получают следующие соединения:
9. А)б)1) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-(3-фуран-2-илметилуреидо)-пропионил] - циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 520,5 (M+H)+,
9. А)б)2) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-(3-бутилуреидо)-пропионил] - циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 496,6 (M+H)+.
9.Б) Получение исходных материалов:
9. Б)а) В раствор из 6,4 г бензиламина в 150 мл ацетонитрила при 5oC в течение 5 мин небольшими порциями добавляют 18,4 г N,N'-дисукцинимидилкарбоната. Реакционную смесь перемешивают при комнатной температуре и затем упаривают. Остаток растворяют в уксусном эфире и промывают водой. Органическую фазу сушат, концентрируют, после чего остаток перекристаллизовывают из метиленхлорида/гексана. В результате выделения получают 11,3 г бесцветного 2,5-диоксо-пирролидин-1-илового эфира бензилкарбаминовой кислоты, МС (БТЯ): 133 (M-HO-сукц.).
9. Б)б) Аналогичным путем, используя однако вместо бензиламина соответствующие амины, получают следующие активированные карбаматы:
9. Б)б)1) 2,5-диоксотетрагидропиррол-1-иловый эфир фуран-2-илметилкарбаминовой кислоты, МС (БТЯ): 123 (M-HO-сукц.),
9. Б)б)2) 2,5-диоксопирролидин-1-иловый эфир пиридин-3-илметилкарбаминовой кислоты, МС (БТЯ): 151 (M-сукц.),
9. Б)б)3) 2,5-диоксопирролидин-1-иловый эфир бутилкарбаминовой кислоты, МС (БТЯ): 214 (M).
Пример 10.
Аналогично примеру 9, исходя однако из амина из пункта 7.Б.в) и используя сложный активированный эфир из пункта 9.Б)б)1), получают следующий сложный эфир:
гидрохлорид этилового эфира 3-[[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-(3-фуран-2-илметилуреидо)-пропионил] - бутиламино]-пропионовой кислоты, МС (бомбардировка ионами): 550,4 (M+H)+.
Пример 11.
2,5 г продукта из примера 7.В)а) растворяют в 25 мл ацетонитрила и 25 мл воды. Затем добавляют последовательно 1,0 г бикарбоната натрия и 2,3 г 2,5-диоксо-пирролидин-1-илового эфира бензилкарбаминовой кислоты и перемешивают в течение 5 ч при комнатной температуре. Реакционную смесь упаривают и остаток очищают на колонке RP-18 с помощью градиента ацетонитрил/вода. В результате выделения получают 0,8 г бесцветной [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-(3-бензилуреидо)-пропионил] - циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 502,4 (M+H)+.
Пример 12.
Аналогично примеру 3, исходя однако из сложных эфиров из примеров 9. А)б)1), 9.А)б)2) и 10, получают следующие кислоты:
а) [[(S)-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-(3-фуран-2-илметилуреидо)-пропионил] -циклопропиламино] -уксусную кислоту, МС (бомбардировка ионами): 492,5 (M+H)+,
б) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-(3-n-бутилуреидо)-пропионил] -циклопропиламино] -уксусную кислоту, МС (бомбардировка ионами): 468,4 (M+H)+,
в) [[(S)-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-(3-фуран-2-илметилуреидо)-пропионил] -n-бутиламино] -пропионовую кислоту, МС (бомбардировка ионами): 522,4 (M+H)+.
Пример 13.
А) Аналогично примеру 1 получают следующие соединения:
а) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил]-2-пентаноиламинопропионил]- циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 481,5 (M+H)+,
б) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил]-2-гексаноиламинопропионил]- циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 495,6 (M+H)+,
в) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-(4-хлоропиридин-2-илкарбониламино)- пропионил] -циклопропиламино] -уксусной кислоты, МС (бомбардировка ионами): 536,5 (M+H)+,
г) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-бензоиламинопропионил] - циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 501,6 (M+H)+,
д) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-бензилоксикарбониламинопропионил] - циклопропиламино]-уксусной кислоты, МС (бомбардировка ионами): 515,5 (M+H)+.
Б) Получение исходных материалов:
а) Раствор из 16,6 г трет.-бутил (S)-2-(2-трет.-бутоксиформамидо)-N- циклопропил-N-[(этоксикарбонил]метил]сукцинамата (получение аналогично получению продукта из примера 1.Б) в 170 мл диоксана обрабатывают 19,0 г моногидрата p-толуолсульфокислоты и перемешивают в течение 30 ч при комнатной температуре. Затем раствор при охлаждении обрабатывают сначала 17,8 мл пиридина, а затем 9,6 мл хлорида валероила и перемешивают в течение ночи при комнатной температуре. Для дальнейшей переработки реакционную смесь сливают в ледяной раствор, состоящий из 5%-ного раствора гидросульфата калия и 10%-ного раствора сульфата калия, после чего экстрагируют с помощью уксусного эфира. Органические фазы промывают разбавленным раствором поваренной соли, сушат и упаривают. После хроматографии остатка на силикагеле с помощью гексана/уксусного эфира (2:1) выделяют 4,8 г бесцветного трет.-бутилового эфира (S)-N-циклопропил-N-этоксикарбонилметил-3-пентаноиламиносукцинамовой кислоты, МС (бомбардировка ионами): 399,4 (M+H)+.
б) Аналогичным путем, но с использованием вместо хлорида валероила соответствующих хлоридов кислот получают следующие трет.-бутиловые эфиры:
б)1) трет. -бутиловый эфир (S)-N-циклопропил-N-этоксикарбонилметил-3- гексаноиламиносукцинамовой кислоты, МС (БТЯ): 413 (M+H)+,
б)2) этиловый эфир [[(S)-3-трет.-бутоксикарбонил-2-(4-хлоропиридин- 2-илкарбониламино)-пропионил]-циклопропиламино]-уксусной кислоты, МС (БТЯ): 213 (M+H)+,
б)3) трет.-бутиловый эфир (S)-3-бензоиламино-N-циклопропил-N- этоксикарбонилметилсукцинамовой кислоты, МС (БТЯ): 419 (M+H)+,
б)4) трет. -бутиловый эфир (S)-2-бензилкарбониламино-N-циклопропил-N- этоксикарбонилметилсукцинамовой кислоты, МС (бомбардировка ионами): 433,1 (M+H)+.
Пример 14.
Аналогично примеру 3, исходя однако из сложных эфиров из примера 13А), получают следующие кислоты:
а) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-пентаноиламинопропионил]-циклопропиламино]-уксусную кислоту, МС (бомбардировка ионами): 453,4 (M+H)+,
б) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-гексаноиламинопропионил]-циклопропиламино]-уксусную кислоту, МС (бомбардировка ионами): 467,4 (M+H)+,
в) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-(4-хлоропиридин-2-илкарбониламино)-пропионил] -циклопропиламино] -уксусную кислоту, МС (бомбардировка ионами): 508,5 (M+H)+,
г) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-бензоиламинопропионил] -циклопропиламино] -уксусную кислоту, МС (бомбардировка ионами): 473,6 (M+H)+,
д) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-бензилкарбониламинопропионил]-циклопропиламино]-уксусную кислоту, МС (бомбардировка ионами): 487,4 (M+H)+.
Пример 15.
Раствор из N-[N4-[[(S)-1-амидино-3-пиперидинил]метил]-N2-(нафтален- 2-илсульфонил)-L-аспарагинил]-N-циклопропилглицина
- (получение из β- трет.-бутилового эфира N-Boc-L-аспарагиновой кислоты и этилового эфира N-циклопропилглициновой кислоты, через трет.-бутил (S)-3-(1-t-бутоксиформамида)-N-циклопропил- N-[(этилоксикарбонил)метил]сукцинамат и через трет. -бутил-(S)-N-циклопропил- N-[(этоксикарбонил)метил]-3-(нафтален-2-илсульфонамидо)-сукцинамат) -
в 30 мл ДМФ обрабатывают 1,7 мл 4-этилморфолина и 1,2 г БОФ и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь упаривают, обрабатывают 1н. соляной кислотой и повторно упаривают. Остаток хроматографируют с помощью градиента ацетонитрил/вода на колонке RP-18. Содержащие продукт фракции концентрируют, после чего выделяют 0,7 г гидрохлорида N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-4-циклопропил- 1-нафтален-2-илсульфонил-3,6-диоксопиперазин-2-ил]-ацетамида, МС (бомбардировка ионами): 541,5 (M+H)+.
Пример 16.
Аналогично тому, как это описано в примере 15, получают из (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-карбоксиметил- N1-циклопентил-2-(нафталин-2-сульфониламино)-сукцинамида
- (получение из β- трет.-бутилового эфира N-Boc-L-аспарагиновой кислоты и этилового эфира N-циклопентилглицина, через трет.-бутил-(S)-3- (1-t-бутоксиформамидо)-N-циклопентил-N-[(этилоксикарбонил)метил] сукцинамат и через трет. -бутил-(S)-N-циклопентил-N-[(этокстикарбонил)метил] - 3-(нафтален-2-илсульфонамидо)сукцинамат) -
гидрохлорид N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]-2-[(S)- 4-циклопентил-1-нафтален-2-илсульфонил-3,6-диоксопиперазин-2-ил]-ацетамида, МС (бомбардировка ионами): 569,4 (M+H)+.
Пример 17.
А) Получение продукта:
0,8 г (RS)-(4-трет.-бутоксикарбонилметил-1-бутилсульфонил-3- оксопиперазин-2-ил)-уксусной кислоты растворяют в 15 мл ДМФ и затем обрабатывают последовательно 1,3 мл 4-этилморфолина, 0,92 г БОФ и 0,72 г дигидрохлорида (S)-1-амидино-3-(аминометил)пиперидина. Реакционную смесь перемешивают в течение ночи при комнатной температуре, после чего упаривают и остаток хроматографируют с помощью градиента вода/ацетонитрил на колонке RP-18. Содержащие продукт фракции упаривают и фильтруют водой/этанолом через ионит (в виде Cl). После упаривания выделяют бесцветную [3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоилметил]-4-бутилсульфонил-2-оксопиперазин-1-ил]- уксусную кислоту, МС (бомбардировка ионами): 475,6 (M+H)+.
Б) Получение исходного материала:
а) 15,0 г этил-2-пиперазин-3-он-ацетата растворяют в 150 мл пиридина и обрабатывают при комнатной температуре 12,5 мл 1-бутансульфохлорида. В течение ночи перемешивают при комнатной температуре и затем реакционную смесь упаривают. После хроматографии остатка на силикагеле с помощью уксусного эфира/гексана получают 23,1 г бесцветного этилового эфира (RS)-(1-бутилсульфонил-3-оксопиперазин- 2-ил)-уксусной кислоты, МС (БТЯ): 261 (M-OEt).
б) В раствор из 2,0 г полученного в п. а) вещества в 20 мл ДМФ при -15oC добавляют последовательно 520 мг 60%-ной дисперсии гидрида натрия и раствор из 1,9 мл трет.-бутилового эфира бромуксусной кислоты в 30 мл ДМФ. Реакционную смесь перемешивают при комнатной температуре, затем обрабатывают ее водой и экстрагируют с помощью уксусного эфира. Органические фазы промывают водой, сушат и упаривают. Остаток хроматографируют с помощью уксусного эфира/гексана на силикагеле и выделяют 1,8 г бесцветного трет.-бутилового эфира (RS)-3-этоксикарбонил-2-оксо-4-бутилсульфонилпиперазин-1-илуксусной кислоты, МС (БТЯ): 375 (M-OEt).
в) 1,7 г полученного в п. а) вещества растворяют в 17 мл ТГФ, обрабатывают 12 мл 1н. раствора гидроокиси лития и перемешивают в течение 2 ч при комнатной температуре. Затем добавляют 10 мл уксусной кислоты, после чего реакционную смесь упаривают. Остаток растворяют в уксусном эфире и промывают ледяным раствором, состоящим из 5%-ного раствора гидросульфата калия и 10%-ного раствора сульфата калия, и водой. Органические фазы сушат и упаривают. В результате получают 0,8 (RS)-(4-трет.-бутоксикарбонилметил-1-бутилсульфонил-3-оксопиперазин- 2-ил)-уксусной кислоты, МС (бомбардировка ионами): 391,3 (M-H)-.
Пример 18.
Раствор из 1,3 г гидрохлорида этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-бензилоксикарбониламинопропионил]-бутиламино]-уксусной кислоты (пример 2.А)б)) растворяют в 13 мл этанола и 13 мл 1н. соляной кислоты, обрабатывают 0,13 г Pd/C и гидрируют в течение 90 мин при комнатной температуре. После фильтрации реакционной смеси, упаривания фильтрата и хроматографии остатка с помощью градиента ацетонитрил/вода на колонке RP-18 выделяют 0,4 г гидрохлорида N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2-[(S)-2,6-диоксо- 4-бутил-пиперазин-2-ил]-ацетамида, МС (бомбардировка ионами): 367,4 (M+H)+.
Пример 19.
4,1 г гидрохлорида циклопропил-2-(пиразин-2-илкарбонмиламино)этиламина (1:2), 4,98 г Z-Asp(OtBu)-OH и 7,37 г БОФ растворяют в 100 мл метиленхлорида и при перемешивании обрабатывают 10,06 мл основания Хюнига. После перемешивания в течение 2 ч при комнатной температуре смесь растворяют в простом эфире и промывают водой. После упаривания уксусноэфирной фазы и хроматографии остатка на силикагеле получают 7,06 г трет.-бутилового эфира (S)-2-бензилоксикарбониламино-N1-циклопропил- N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамовой кислоты, МС (бомбардировка ионами): 512 (M+H).
Из 7,06 г трет.-бутилового эфира (S)-2-бензилоксикарбониламино- N1-циклопропил-N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамовой кислоты 5,92 г раствора в 100 мл соляной кислоты (в уксусном эфире) и реакционную смесь перемешивают при комнатной температуре. После выпаривания уксусного эфира растворяют в 70 мл метиленхлорида и добавляют 3,96 мл основания Хюнига и 2,52 г ди-трет.-бутилдикарбоната, после чего смесь перемешивают при комнатной температуре. Затем смесь концентрируют, остаток растворяют в 70 мл метиленхлорида и при перемешивании добавляют последовательно 2,75 г дигидрохлорида (S)-амидино-3-(аминометил)пиперидина, 10,27 мл основания Хюнига и 5,31 г БОФ и перемешивают при комнатной температуре. После упаривания остаток хроматографируют над силикагелем с помощью уксусного эфира/ацетона/воды/ледяной уксусной кислоты (соотношение 6:2:1:1). В результате получают 3,17 г чистого ацетата (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - 2-трет. -бутоксикарбониламино-N1-циклопропил-N1-(2-пиразин-2- илкарбониламино)-сукцинамида (1:2), МС (бомбардировка ионами): 560,5 (M+H).
Получение исходного материала:
5 г гидрохлорида бензилового эфира 2-циклопропиламиноэтилкарбаминовой кислоты (1: 1) (получение из Z-глицина и циклопропиламина через циклопропиламид бензилоксикарбониламиноуксусной кислоты) при комнатной температуре обрабатывают при перемешивании 4,36 г ди-трет.-бутилдикарбоната, 3,08 мл триэтиламина и 100 мг диметиламинопиридина. После перемешивания в течение 20 ч при комнатной температуре смесь растворяют в простом эфире и эфирную фазу промывают 1н. соляной кислотой и водой. Эфирную фазу концентрируют. Полученное масло растворяют в 100 мл метанола, обрабатывают 200 мг Pd/C (10%) и гидрируют. После отфильтровывания катализатора метаноловый раствор концентрируют. Раствор из остатка в 100 мл метиленхлорида обрабатывают 2,34 г пиразинкарбоновой кислоты, 9,5 мл основания Хюнига и 8,44 г БОФ. После перемешивания при комнатной температуре смесь растворяют в простом эфире и эфирные фазы промывают водой. Остаток хроматографируют над силикагелем с помощью уксусного эфира/гексана (1: 1). Полученное масло растворяют в 40 мл простого эфира и обрабатывают 30 мл 5н. соляной кислоты (в диоксане). После перемешивания добавляют простой эфир и отфильтровывают выпавшие кристаллы. В результате получают 4,1 г белого кристаллического гидрохлорида циклопропил-2-(пиразин-2-илкарбониламино)этиламина (1:2), МС (бомбардировка потоком электронов): 207 (M+H).
Пример 20.
300 мг ацетата (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - 2-трет. -бутоксикарбониламино-N1-циклопропил-N1-(2-пиразин-2- илкарбониламино)-сукцинамида (1: 2) растворяют в 2 мл диоксана и обрабатывают этот раствор 5 мл 4н. соляной кислоты (в диоксане). Затем перемешивают в течение 2 ч, после чего диоксан выпаривают. Остаток помещают в 12 мл метиленхлорида и обрабатывают при перемешивании 76 мг пиримидин-2-тиоуксусной кислоты, 0,46 мл основания Хюнига и 206 мг БОФ. Смесь перемешивают при комнатной температуре и затем концентрируют. Остаток хроматографируют над силикагелем с помощью уксусного эфира/ацетона/воды/ледяной уксусной кислоты в соотношении 4: 2:1:1. В результате получают 167 мг ацетата (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-(2-пиразин-2-илкарбониламиноэтил)-2-пиримидин-2- илсульфонилацетиламиносукцинамида (1:2), МС (бомбардировка ионами): 612,5 (M+H).
Пример 21.
Аналогично примеру 20 получают следующие соединения:
а) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-2-(3-индол-3-илпропиониламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:2), МС (бомбардировка ионами): 631,5 (M+H),
б) ацетат метилового эфира (S)-4-[(S)-2-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбонил] -1-[циклопропил-(2-пиразин-2- илкарбониламиноэтил)-карбамоил]-этилкарбамоил]-4-гидроксимасляной кислоты (1:2), МС (бомбардировка ионами): 604,5 (M+H),
в) ацетат (S)-2-[(S)-2-ацетиламино-3-индол-3-илпропиониламино] - N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]-N1-циклопропил- N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамида (1:2), МС (бомбардировка ионами): 688,6 (M+H),
г) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1- циклопропил-2-феноксиацетиламино-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамида (1: 2), МС (бомбардировка ионами): 594,5 (M+H), причем вместо пиримидинтиоуксусной кислоты используют соответствующую карбоновую кислоту.
Пример 22.
354 мг трет.-бутилового эфира (S)-3-[(S)-3-[циклопропил-(2-пиразин- 2-илкарбониламиноэтил)-карбамоил]-3-(нафтален-2-илсульфониламино)- пропиониламинометил]-пиперидин-1-карбоновой кислоты
- (получение из гидрохлорида бензилового эфира 2-циклопропиламинэтилкарбаминовой кислоты через гидрохлорид трет.-бутилового эфира (S)-3-[(S)-3-[(2-аминоэтил)-циклопропилкарбамоил] - 3-(нафтален-2-илсульфониламино)-пропиониламинометил]-пиперидин-1- карбоновой кислоты) -
растворяют в 3 мл метиленхлорида и обрабатывают этот раствор 5 мл 5н. соляной кислоты (в диоксане). После перемешивания в течение 1 ч этот раствор концентрируют и остаток азеотропируют сначала водой, а затем уксусным эфиром. Остаток перемешивают в 3 мл метиленхлорида и при охлаждении льдом добавляют 53 мг бромциана, после чего по каплям добавляют 0,14 мл триэтиламина в 1 мл метиленхлорида. После перемешивания при комнатной температуре добавляют 70 мг гидрохлорида гидроксиламина и повторно 0,14 мл триэтиламина. Смесь перемешивают в течение 20 ч, затем концентрируют и хроматографируют на колонке над силикагелем с помощью уксусного эфира/ацетона/воды/ледяной уксусной кислоты в соотношении 6:2:1:1. В результате получают 60 мг ацетата (S)-N4-[(S)-1-(аминогидроксииминометил)-пиперидин-3-илметил] -N1- циклопропил-2-(нафтален-2-илсульфониламино)-N1-[2-(пиразин-2- илкарбониламино)-этил] -сукцинамида (1:1), МС (бомбардировка ионами): 666,3 (M+H).
Пример 23.
1,0 г бензилового эфира (S)-N1-[3-(бензилоксикарбониламино)-этил]- N1-циклопропил-2-(морфолиносульфонил)-аминосукцинамовой кислоты растворяют в 10 мл ТГФ и добавляют 3,4 мл 1н. раствора LiOH. После перемешивания в течение 1 ч раствор обрабатывают 3,4 мл 1н. соляной кислоты. Затем раствор разбавляют уксусным эфиром и промывают водой. После выпаривания уксусного эфира получают 997 мг свободной кислоты, которую затем после растворения в 10 мл метиленхлорида обрабатывают 1 мл N-этилморфолина, 360 мг дигидрохлорида (S)-1-амидино-3-(аминометил)пиперидина и 715 мг БОФ. Смесь перемешивают при комнатной температуре и затем концентрируют. Остаток хроматографируют над силикагелем с помощью уксусного эфира/ацетона/воды/ледяной уксусной кислоты в соотношении 6: 2: 1: 1 и в результате получают 740 мг бензилового эфира 2-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- морфолин-4-илсульфониламинопропионил]-циклопропиламино]-этилкарбаминовой кислоты, МС (бомбардировка ионами): 637,5 (M+H).
Получение исходного материала:
5,0 г гидрохлорида бензилового эфира 2-циклопропиламино-этилкарбаминовой кислоты (1:1), 5,97 г Boc-Asp(OBzl)-OH и 7,16 г основания Хюнига помещают в 120 мл метиленхлорида и обрабатывают этот раствор 8,57 г БОФ. После перемешивания в течение 2 ч при комнатной температуре раствор разбавляют в простом эфире и эфирные фазы промывают 1н. соляной кислотой, водой, раствором бикарбоната и повторно водой. Образовавшийся после упаривания остаток хроматографируют над силикагелем с помощью уксусного эфира/гексана в соотношении 1: 2. Из 9,6 г промежуточного продукта, полученных после хроматографии, 1,76 г растворяют в 19 мл ТГФ и обрабатывают этот раствор 6 мл 4н. соляной кислоты (в диоксане). После перемешивания при комнатной температуре смесь упаривают. Из 2,29 г полученного масла 1,54 г растворяют в 18 мл метиленхлорида, после чего добавляют 1,2 г морфолин-N-сульфохлорида и 2,2 мл основания Хюнига. Смесь перемешивают в течение 20 ч, растворяют в уксусном эфире и промывают 1н. соляной кислотой и водой. После сушки и упаривания остаток хроматографируют на колонке над силикагелем с помощью уксусного эфира/гексана в соотношении 1:1. В результате получают 920 мг бензилового эфира (S)-N1-[3-(бензилоксикарбониламино)-этил]-N1- циклопропил-2-(морфолиносульфонил)-аминосукцинамовой кислоты, МС (БТЯ): 589,1 (M+H).
Пример 24.
325 мг бензилового эфира 2-[[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-морфолин-4-илсульфониламинопропионил] - циклопропиламино] -этилкарбаминовой кислоты растворяют в 10 мл метанола. После добавки 35 мг Pd/C (10%) проводят гидрирование при комнатной температуре, после чего катализатор отфильтровывают. После упаривания остаток растворяют в 4 мл метиленхлорида и при перемешивании добавляют 48 мг пиразинкарбоновой кислоты, 0,24 мл N-этилморфолина и 178 мг БОФ. После перемешивания при комнатной температуре смесь концентрируют и остаток хроматографируют над силикагелем с помощью уксусного эфира/ацетона/воды/ледяной уксусной кислоты в соотношении 6:2:1:1. В результате получают 181 мг ацетата (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- 2-морфолин-4-илсульфониламино-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамида (1:1), МС (бомбардировка ионами): 609,5 (M+H).
Пример 25.
Если вместо используемой в примере 24 пиразинкарбоновой кислоты применять 2,3-дигидро-3-оксопиридазин-6-карбоновую кислоту, то получают ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-2-морфолин-4-илсульфониламино-N1-[2-(6-оксо-1,6- дигидропиридазин-3-илкарбониламиноэтил]-сукцинамида (1:1), МС (бомбардировка ионами): 625,4 (M+H).
Пример 26.
Если вместо используемой в примере 24 пиразинкарбоновой кислоты применять следующие кислоты:
а) 6-оксо-1,4,5,6-тетрагидропиридазинкарбоновую кислоту,
б) 3-аминопиразин-2-карбоновую кислоту,
в) метоксиуксусную кислоту,
г) морфолиноуксусную кислоту,
д) 4-метилпиперазин-1-уксусную кислоту,
е) 3-метоксипропионовую кислоту,
ж) 1-имидазолилуксусную кислоту соответственно
з) 2-гидроксиаминоглутаровую кислоту,
то получают следующие продукты:
а) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-2-морфолин-4-илсульфониламино-N1-[2-(6-оксо-1,4,5,6- тетрагидропиридазин-3-илкарбониламино)-этил]-сукцинамида (1:1), МС (бомбардировка ионами): 627,6 (M+H),
б) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-[2-(3-аминопиразин-2-илкарбониламино)-этил] -N1-циклопропил-2- морфолин-4-илсульфониламиносукцинамида (1:1), МС (бомбардировка ионами): 624,6 (M+H),
в) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-N1-(2-метоксиацетиламиноэтил)-2-морфолин-4- илсульфониламиносукцинамида (1:1), МС (бомбардировка ионами): 575,5 (M+H),
г) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-N1-(2-морфолин-4-илацетиламиноэтил)-2-морфолин-4- илсульфониламиносукцинамида (1:1), МС (бомбардировка ионами): 630,6 (M+H) и 316,2 (M+2H),
д) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-N1-[2-(4-метилпиперазин-1-илацетиламино)-этил]-2- морфолин-4-илсульфониламиносукцинамида (1:1), МС (бомбардировка ионами): 643,6 (M+H),
е) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-N1-[2-(3-метоксипропиониламино)-этил] -2-морфолин-4- илсульфониламиносукцинамида (1:1), МС (бомбардировка ионами): 589,6 (M+H),
ж) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-N1-(2-имидазол-1-илацетиламиноэтил)-2-морфолин-4- илсульфониламиносукцинамида (1:1), МС (бомбардировка ионами): 611,6 (M+H),
з) ацетат (E)- и (Z)-4-[2-[[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил]-2-морфолин-4-илсульфониламинопропионил]- циклопропиламино] -этилкарбамоил]-4-гидроксииминомасляной кислоты (1:1), МС (бомбардировка ионами): 646,5 (M+H).
Пример 27.
2,77 г бензилового эфира 2-[[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил]-2-морфолин-4-илсульфониламинопропионил]- циклопропиламино] -этилкарбаминовой кислоты (пример 23) растворяют в 90 мл метанола. После добавки 2,14 мл 2н. соляной кислоты и 300 мг Pd/C (10%) проводят гидрирование в течение 1,5 ч при комнатной температуре, затем отфильтровывают катализатор и фильтрат концентрируют. Остаток диспергируют с помощью простого эфира, после чего отфильтровывают белые кристаллы. В результате получают 2,44 г кристаллического гидрохлорида (S)-N1-(2-аминоэтил)-N4-[(S)-1- (аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-2-морфолин-4- илсульфониламиносукцинамида (1:2), МС (бомбардировка ионами): 503,4 (M+H).
Пример 28.
330 мг гидрохлорида (S)-N1-(2-аминоэтил)-N4-[(S)-1- (аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-2-морфолин-4- илсульфониламиносукцинамида перемешивают в течение 20 ч при комнатной температуре вместе с 162 мг 4-метилпиперазин-1-илсульфонилхлорида и 0,49 мл основания Хюнига в 8 мл метиленхлорида. Реакционную смесь хроматографируют над силикагелем с помощью уксусного эфира/ацетона/ледяной уксусной кислоты/воды в соотношении 2:2:2:1. В результате получают 149,1 мг чистого кристаллического ацетата (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил- N1-[2-(4-метилпиперазин-1-илсульфониламино)-этил] -2-морфолин-4- илсульфониламиносукцинамида (1:2), МС (бомбардировка ионами): 665,6 (M+H) и 333,7 (M+2H).
Пример 29.
Аналогично примеру 28, применяя вместо 4-метилпиперазин-1- илсульфонилхлорида морфолиносульфонилхлорид, получают ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1- циклопропил-2-морфолин-4-илсульфониламино-N1-(2-морфолин-4- илсульфониламиноэтил)-сукцинамида (1:1), МС (бомбардировка ионами): 652,5 (M+H).
Пример 30.
Аналогично примеру 20, применяя однако вместо пиримидинтиоуксусной кислоты соответственно одну из карбоновых кислот:
а) 3-метоксипропионовую кислоту,
б) морфолиноуксусную кислоту,
в) метоксиуксусную кислоту,
г) 4-метилпиперазин-1-уксусную кислоту,
д) (L)-фенилаланин,
е) (D)-фенилаланин,
ж) 4-гидроксипиперидин-1-уксуную кислоту,
з) 1-имидазолилуксусную кислоту,
и) 2-пиперидон-1-уксусную кислоту,
к) 3-диметиланинопропановую кислоту,
л) диметиламиноуксусную кислоту соответственно
м) 2,6-диметилморфолин-4-уксусную кислоту,
получают следующие соединения:
а) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-2-(3-метоксипропиониламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:2), МС (бомбардировка ионами): 546,5 (M+H),
б) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-2-морфолин-4-илацетиламино-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:3), МС (бомбардировка потоком электронов): 587,3 (M+H),
в) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-2-метоксиацетиламино-N1-(2-пиразин-2-илкарбониламиноэтил)- сукцинамида (1:2), МС (бомбардировка ионами): 532,6 (M+H),
г) ацетат (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- N1-циклопропил-2-(4-метилпиперазин-1-илацетиламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:3), МС (бомбардировка ионами): 600,6 (M+H),
д) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - 2-[(S)-2-амино-3-фенилпропиониламино]-N1-циклопропил-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:2), МС (бомбардировка ионами): 607,5 (M+H),
е) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - 2-[(R)-2-амино-3-фенилпропиониламино]-N1-циклопропил-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:2), МС (бомбардировка ионами): 607,5 (M+H) и 304,6 (M+2H),
ж) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-2-[2-(4-гидроксипиперидин-1-ил)-ацетиламино] -N1-(2- пиразин-2-илкарбониламиноэтил)-сукцинамида (1: 2), МС (бомбардировка ионами): 601,6 (M+H),
з) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-2-(2-имидазол-1-илацетиламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:2), МС (бомбардировка ионами): 568,5 (M+H),
и) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-2-[2-(2-оксопиперидин-1-ил)-ацетиламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1: 2), МС (бомбардировка ионами): 599,5 (M+H),
к) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-2-(3-диметиламинопропиониламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:3), МС (бомбардировка ионами): 559,6 (M+H),
л) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-2-(2-диметиламиноацетиламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:3), МС (бомбардировка ионами): 545,6 (M+H),
м) гидрохлорид (S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - N1-циклопропил-2-(2,6-диметилморфолин-4-илацетиламино)-N1-(2-пиразин-2- илкарбониламиноэтил)-сукцинамида (1:2) (R:S=1:1 для C2 и C6 в морфолиновом кольце), МС: 615,4 (M+H).
Пример 31.
Раствор из 3,0 г продукта из примера 7.Б)а) в 63 мл этанола и 7 мл воды обрабатывают 0,95 мл коричного альдегида и 1,6 мл 4-этилморфолина и перемешивают в течение 20 мин при комнатной температуре. В этот раствор добавляют 0,3 г катализатора Pd/C и реакционную смесь гидрируют в течение 6 ч в обычных условиях. Затем катализатор отфильтровывают, фильтрат упаривают и остаток хроматографируют с помощью градиента вода/ацетонитрил на колонке RP-18. Содержащие продукт фракции упаривают и фильтруют с помощью воды/этанола через ионит (в виде Cl). После упаривания выделяют бесцветный гидрохлорид этилового эфира 3-[[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-(3-фенилпропиламино)-пропионил]- циклопропиламино]-пропионовой кислоты (1:2), МС (бомбардировка ионами): 529,6 (M+H)+.
Пример 32.
Аналогично примеру 31 получают следующий продукт: гидрохлорид этилового эфира 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил]-2-бутиламинопропионил] -циклопропиламино] -пропионовой кислоты (1: 2), МС (бомбардировка ионами): 467,6 (M+H)+.
Пример 33.
Аналогично примеру 3, но с дополнительной фильтрацией конечного продукта с помощью воды/этанола через ионит (в виде Cl) получают следующие продукты:
а) гидрохлорид 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-(3-фенилпропиламино)-пропионил] -циклопропиламино]- пропионовой кислоты (1:1), МС (бомбардировка ионами): 501,7 (M+H)+,
б) гидрохлорид 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-бутиламинопропионил] -циклопропиламино]-пропионовой кислоты (1:1), МС (бомбардировка ионами): 439,6 (M+H)+.
Пример 34.
В раствор из 3,4 г продукта из примера 3 в 34 мл этанола и 6,8 мл 1Н соляной кислоты добавляют 0,34 г катализатора палладий на угле и гидрируют реакционную смесь в течение 2 ч. Затем катализатор отфильтровывают и фильтрат упаривают. Таким путем выделяют бесцветный гидрохлорид [[(S)-2-амино-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- пропионил]-циклопропиламино]-уксусной кислоты (1:1), МС (бомбардировка ионами): 369,4 (M+H)+.
Пример 35.
Аналогично примеру 34 из продукта из примера 37 получают следующее соединение:
гидрохлорид (S)-3-амино-N-[(S)-1-(аминоиминометил)-пиперидин-3- илметил] -4-азепан-1-ил-4-оксобутирамида (1: 2), МС (бомбардировка ионами): 353,4 (M+H)+.
Пример 36.
2,1 г продукта из примера 7.А) растворяют в 45 мл этанола и 5 мл воды, после чего обрабатывают 0,7 г коричного альдегида и 1,1 мл 4-этилморфолина и перемешивают в течение 15 мин при комнатной температуре. Затем добавляют 0,2 г катализатора Pd/C и гидрируют в течение 6 ч в обычных условиях. Катализатор отфильтровывают, фильтрат упаривают и остаток хроматографируют с помощью градиента вода/ацетонитрил на колонке RP-18. Содержащие продукт фракции упаривают и остаток фильтруют с помощью ионита (Dowex, в виде Cl). После упаривания выделяют 0,5 г гидрохлорида N-[(S)-1-(аминоиминометил)- пиперидин-3-илметил]-2-[(S)-4-циклопропил-3,6-диоксо-1-(3-фенилпропил)- пиперазин-2-ил]-ацетамида (1:1), МС (бомбардировка ионами): 469,5 (M+H)+.
Пример 37.
Аналогично примеру 1 получают следующее соединение:
гидрохлорид (S)-N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- 4-азепан-1-ил-3-бензилоксикарбониламино-4-оксобутирамида (1:1), МС (бомбардировка ионами): 487,5 (M+H)+.
Получение исходного материала:
Аналогично примеру 1.Б), используя однако вместо этилового эфира N-циклопропилглицина гексаметиленимин, получают следующий промежуточный продукт: трет. -бутиловый эфир (S)-4-азепан-1-ил-3-бензилоксикарбониламино-4- оксомасляной кислоты, МС (бомбардировка ионами): 405,2 (M+H)+.
Пример 38.
Аналогично примеру 9, используя однако соответствующие активированные карбаматы, получают следующие соединения:
а) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-(3-дифенилметилуреидо)-пропионил] - циклопропиламино]-уксусной кислоты (1:1), МС (бомбардировка ионами): 606,6 (M+H)+,
б) гидрохлорид этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил]-2-(3-циклогексилметилуреидо)-пропионил]- циклопропиламино]-уксусной кислоты (1:1), МС (бомбардировка ионами): 536,5 (M+H)+.
Получение исходных материалов:
Аналогично примеру 9.Б)б) получают следующие активированные карбаматы:
2,5-диоксопирролидин-1-иловый эфир дифенилметилкарбаминовой кислоты, МС (БТЯ): 309 (M-гидроксисукцинимид),
2,5-диоксопирролидин-1-иловый эфир циклогексилметилкарбаминовой кислоты, МС (БТЯ): 115 (M-гидроксисукцинимид).
Пример 39.
Аналогично примеру 9, исходя однако из амина из примера 35 и используя соответствующие активированные карбаматы, получают следующие соединения:
а) гидрохлорид (S)-N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- 4-азепан-1-ил-3-(3-бензилуреидо)-4-оксобутирамида (1:1), МС (бомбардировка ионами): 486,4 (M+H)+,
б) гидрохлорид метилового эфира (S)-2-[3-[(S)-1-[(S)-(аминоиминометил)- пиперидин-3-илметилкарбамоилметил]-2-азепан-1-ил-2-оксоэтил]-уреидо]-3- фенилпропионовой кислоты (1:1), МС (бомбардировка ионами): 558,5 (M+H)+,
в) гидрохлорид метилового эфира (R)-2-[3-[(S)-1-[(S)-(аминоиминометил)- пиперидин-3-илметилкарбамоилметил]-2-азепан-1-ил-2-оксоэтил]-уреидо]-3- фенилпропионовой кислоты (1:1), МС (бомбардировка ионами): 558,5 (M+H)+.
Получение исходных материалов:
Аналогично примеру 9.Б)б) получают следующие активированные карбаматы:
а) 2,5-диоксопирролидин-1-иловый эфир бензилкарбаминовой кислоты, МС (БТЯ): 133 (M-гидроксисукцинимид),
б) метиловый эфир (R)-2-(2,5-диоксопирролидин-1-илоксикарбониламино)- 3-фенилпропионовой кислоты, МС (БТЯ): 133 (M-гидроксисукцинимид),
в) метиловый эфир (S)-2-(2,5-диоксопирролидин-1-илоксикарбониламино)- 3-фенилпропионовой кислоты, МС (БТЯ): 162 (M-H2-NCOO-сукцинимид).
Пример 40.
Аналогично примеру 3, используя однако продукты из примеров 38 и 39б) и в), получают следующие продукты:
а) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-(3-дифенилметилуреидо)-пропионил] -циклопропиламино] -уксусную кислоту, МС (бомбардировка ионами): 578,3 (M+H)+,
б) [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-(3-циклогексилметилуреидо)-пропионил]-циклопропиламино]-уксусную кислоту, МС (бомбардировка ионами): 508,5 (M+H)+,
в) (S)-2-[3-[(S)-1-[(S))-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-азепан-1-ил-2-оксоэтил] -уреидо] -3-фенилпропионовую кислоту, МС (бомбардировка ионами): 544,5 (M+H)+,
г) (R)-2-[3-[(S)-1-[(S))-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-азепан-1-ил-2-оксоэтил] -уреидо] -3-фенилпропионовую кислоту, МС (бомбардировка ионами): 544,6 (M+H)+.
Пример 41.
Аналогично примеру 1, используя однако вместо дигидрохлорида (S)-1-амидино-3-(аминометил)пиперидина гидрохлорид этилового эфира (S)-(3-аминометилпиперидин-1-ил)-иминометилкарбаминовой кислоты, получают [[(S)-2-бензилоксикарбониламино-3-[(S)-1- (этоксикарбониламиноиминометил)-пиперидин-3-илметилкарбамоил]-пропионил]- циклопропиламино]-уксусную кислоту, МС (бомбардировка ионами): 575,5 (M+H)+.
Пример 42.
Аналогично примеру 41, используя однако вместо гидрохлорида этилового эфира (S)-(3-аминометилпиперидин-1-ил)-аминометилкарбаминовой кислоты гидрохлорид этилового эфира (RS)-(2-аминометилморфолин-4-ил)- иминометилкарбаминовой кислоты, получают [[(S)-2-бензилоксикарбониламино- 3-[4-(этоксикарбониламиноиминометил)морфолин-2-илметилкарбамоил] -пропионил] -циклопропиламино] -уксусную кислоту (R: S= 1: 1 в морфолиновом кольце), МС (бомбардировка ионами): 577,5 (M+H)+.
Пример 43.
Аналогично примеру 15, но исходя из
а) [(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] - 2-нафтален-2-илсульфониламинопропиониламино]-уксусной кислоты соответственно,
б) (S)-2-[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-нафтален-2-илсульфониламинопропиониламино]-3-гидроксипропионовой кислоты,
получают следующие продукты:
а) гидрохлорид N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] - 2-[(S)-1-нафтален-2-илсульфонил-3,6-диоксопиперазин-2-ил] -ацетамида (1:1), МС (бомбардировка ионами): 501,4 (M+H)+,
б) гидрохлорид N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил]- 2-[(2S, 5S)-5-гидроксиметил-1-нафтален-2-илсульфонил-3,6-диоксопиперазин- 2-ил] -ацетамида (1:1), МС (бомбардировка ионами): 531,4 (M+H)+.
Получение исходных материалов:
1. Исходя из β- трет.-бутилового эфира N-Бок-L-аспарагиновой кислоты и этилового эфира глицина, соответственно метилового эфира серина, получают через
1.а) трет.-бутил-(S)-3-(1-трет.-бутоксиформамидо)-N- [(этоксикарбонил)метил]-сукцинамат, соответственно
1. б) трет.-бутил-(S)-3-(1-трет.-бутоксиформамидо)-N-[1-(2-гидрокси- 1-метоксикарбонил)-этил]сукцинамат, через
2. а) трет.-бутил-(S)-N-[(этоксикарбонил)метил]-3-(нафтален-2- илсульфонамидо)сукцинамат, соответственно
2. б) трет. -бутил-(S)-N-[1-(2-гидрокси-1-метоксикарбонил)-этил] - 3-(нафтален-2-илсульфонамидо)сукцинамат и через
3. а) гидрохлорид этилового эфира [(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-нафтален-2- илсульфониламинопропиониламиноуксусной кислоты (1:1), МС (бомбардировка ионами): 547,4 (M+H)+,
3.б) гидрохлорид этилового эфира [(S)-2-[(S)-3-[(S)-1-(аминоиминометил)- пиперидин-3-илметилкарбамоил] -2-нафтален-2-илсульфониламинопропиониламино]- 3-гидроксипропионовой кислоты (1:1), МС (бомбардировка ионами): 563,4 (M+H)+ через
4. а) [(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил]- 2-нафтален-2-илсульфониламинопропиониламино]-уксусную кислоту, МС (бомбардировка ионами): 519,4 (M+H)+, соответственно
4.б) [(S)-2-[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-нафтален-2-илсульфониламинопропиониламино]-3- гидроксипропионовую кислоту, МС (бомбардировка ионами): 549,3 (M+H)+.
Пример 44.
Аналогично примеру 1.А) из смеси (1:1), содержащей трет.-бутиловый эфир (2S, 5R)- и (2S,5S)-(5-бензил-3,6-диоксо-4- пропилпиперазин-2-ил)-уксусной кислоты, получают смесь из гидрохлорида (S)-1-(аминоиминометил)-пиперидин-3-илметиламида (2S, 5R)- и (2S,5S)-(5-бензил-3,6-диоксо-4-пропилпиперазин-2-ил)-уксусной кислоты (1:1), МС (бомбардировка ионами): 443,6 (M+H)+.
Получение исходного материала:
Исходя их β- трет. -бутилового эфира N-Бок-L-аспарагиновой кислоты и метилового эфира рац-N-пропилфенилаланина, через трет.-бутиловый эфир (S)-2-трет. -бутоксикарбониламино-N-[(R)- и [(S)-1-метоксикарбонил-2-фенилэтил] -N-пропилсукцинамовой кислоты, МС бомбардировка ионами): 493,5 (M+H)+ получают трет. -бутиловый эфир (2S,5R)- и (2S,5S)-(5-бензил-3,6-диоксо-4-пропилпиперазин-2-ил)-уксусной кислоты, МС (БТЯ): 360 (M+).
Пример 45.
Аналогично примеру 1.А) из трет.-бутилового эфира (S)-(4-циклопропил-1-этоксикарбонилметил-3,6-диоксопиперазин-2-ил)- уксусной кислоты получают гидрохлорид этилового эфира (S)-[2-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоилметил] -4- циклопропил-3,6-диоксопиперазин-1-ил] -уксусной кислоты (1:1), МС (бомбардировка ионами): 437,5 (M+H)+.
Получение исходного материала:
а) 0,67 г продукта из примера 7.А) растворяют в 7 мл ДМФ, обрабатывают 0,5 мл 4-этилморфолина и перемешивают в течение ночи при 80oC. Реакционную смесь упаривают и остаток хроматографируют с помощью уксусного эфира/метанола (99: 1) на силикагеле. Таким путем получают 0,43 г бесцветного трет.-бутилового эфира (S)-(4-циклопропил-3,6-диоксопиперазин-2-ил)-уксусной кислоты, МС (бомбардировка ионами): 269,3 (M+H)+.
б) В раствор из 3,45 г полученного в п.а) продукта в 50 мл ДМФ добавляют 1,9 г 80%-ной дисперсии гидрида натрия, после чего при 3-10oC по каплям добавляют 7,1 мл этилового эфира бромуксусной кислоты. Затем перемешивают в течение 4 ч при комнатной температуре, реакционную смесь сливают на воду и экстрагируют с помощью уксусного эфира. Органическую фазу промывают раствором поваренной соли, сушат и концентрируют. После хроматографии остатка с помощью уксусного эфира/гексана (1:1) на силикагеле получают 1,6 г трет.-бутилового эфира (S)-(4-циклопропил-1-этоксикарбонилметил-3,6-диоксопиперазин- 2-ил)-уксусной кислоты в виде желто смолы, МС (бомбардировка ионами): 355,4 (M+H)+.
Пример 46.
Аналогично примеру 3 из продукта из примера 45 получают [(S)-2-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоилметил] -4- циклопропил-3,6-диоксопиперазин-1-ил] -уксусную кислоту, МС (бомбардировка ионами): 409,5 (M+H)+.
Пример 47.
Раствор из 6,5 г (RS)-(2,4-диметил-1-нафтален-2-илсульфонил-3- оксопиперазин-2-ил)-уксусной кислоты в 65 мл ДМФ обрабатывают последовательно 7,64 г БОФ, 6,5 мл 4-этилморфолина и 4,35 г дигидрохлорида (S)-1-амидино-3-(аминометил)-пиперидина и перемешивают в течение ночи при комнатной температуре. После выпаривания растворителя остаток хроматографируют с помощью градиента вода/ацетонитрил на колонке RP-18. Содержащие продукт фракции упаривают и остаток фильтруют через ионит (Dowex, в виде Cl). После упаривания выделяют 0,8 г смеси (1:1) из гидрохлорида (S)-1-(аминоиминометил)-пиперидин-3-илметиламида (R)- и (S)-(2,4-диметил-1-нафтален-2-илсульфонил-3-оксо-пиперазин-2-ил)-уксусной кислоты, МС (бомбардировка ионами): 515,6 (M+H)+.
Получение исходного материала:
а) Раствор из 10 г этил-2-пиразин-3-онацетата в 100 мл диоксана обрабатывают 6,8 мл 4-этилморфолина и раствором из 12,9 г ди-трет.-бутилкарбоната в 50 мл диоксана и перемешивают в течение 6 ч при комнатной температуре. Затем растворитель выпаривают и остаток очищают уксусным эфиром/гексаном (1: 1) на силикагеле. В результате получают 15,4 г трет.-бутилового эфира (RS)-2-этоксикарбонилметил-3-оксо- пиперазин-1-карбоновой кислоты, МС (бомбардировка ионами): 287,3 (M+H)+.
б) Раствор из 15,0 г полученного в п.а) соединения в 200 мл ДМФ обрабатывают 7,9 г 80%-ной дисперсии гидрида натрия. Затем при 3-10oC добавляют по каплям 16,3 мл метилйодида, перемешивают в течение 4 ч при комнатной температуре, после чего реакционную смесь сливают на воду и экстрагируют с помощью уксусного эфира. Органическую фазу промывают водой, сушат и упаривают. Остаток хроматографируют с помощью уксусного эфира/гексана (1:1) на силикагеле. В результате получают 11,4 г трет.-бутилового эфира (RS)-2-этоксикарбонилметил-2,4-диметил-3-оксопиперазин-1-карбоновой кислоты, МС (БТЯ): 314 (M+).
в) Раствор продукта из п.б) в ацетонитриле обрабатывают моногидратом p-толуолсульфокислоты. После упаривания раствор из полученного остатка в диоксане обрабатывают β- нафтилсульфохлоридом. Таким путем получают этиловый эфир (RS)-(2,4-диметил-1-нафтален-2-илсульфонил-3-оксопиперазин- 2-ил)-уксусной кислоты, МС (БТЯ): 405 (M+H)+.
г) Аналогично примеру 3 из продукта из п.в) получают (RS)-(2,4-диметил-1-нафтален-2-илсульфонил-3-оксопиперазин-2-ил)-уксусную кислоту, МС (бомбардировка ионами): 375,4 (M-H)-.
Пример 48.
2,35 г аминопродукта из примера 7.А) обрабатывают в 25 мл ДМФ 3,2 мл 4-этилморфолина и 0,5 мл хлорида хлоруксусной кислоты и перемешивают в течение ночи при комнатной температуре. Реакционную смесь упаривают и остаток хроматографируют на колонке RP-18 с помощью градиента вода/ацетонитрил. Из содержащих продукт фракций после упаривания получают 0,5 г гидрохлорида этилового эфира [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2-(2- хлорацетиламино)-пропионил]-циклопропиламино]-уксусной кислоты (1:1), МС (бомбардировка ионами): 473,4 (M+H)+.
Пример 49.
Аналогично примеру 3 из продукта в примере 48 получают [[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2-(2- хлорацетиламино)-пропионил] -циклопропиламино] -уксусную кислоту, МС (бомбардировка ионами): 445,4 (M+H)+.
Пример 50.
0,9 г аминопродукта из примера 7.А) вместе с 0,5 г гидрокарбонита натрия растворяют в 9 мл ТГФ и 9 мл воды, затем обрабатывают 0,82 г морфолин-N-сульфохлорида в 8 мл ТГФ и 1,9 мл 1н. натрового щелока и перемешивают в течение 48 ч при комнатной температуре. Реакционной смеси с помощью 1н. соляной кислоты придают кислый характер, упаривают и остаток хроматографируют на колонке RP-18 с помощью градиента вода/ацетонитрил. Из содержащих продукт фракций после упаривания получают 0,2 г бесцветного гидрохлорида этилового эфира 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3- илметилкарбамоил] -2-морфолин-4-илсульфониламинопропионил]- циклопропиламино]-пропионовой кислоты (1:1), МС (бомбардировка ионами): 560,5 (M+H)+.
Пример 51.
Аналогично примеру 3 из продукта из примера 50 получают 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2- морфолин-4-илсульфониламинопропионил]-циклопропиламино]-пропионовую кислоту, МС (бомбардировка ионами): 532,5 (M+H)+.
Соединение формулы I, сольват или соль этого соединения можно применять по известной методике в качестве активного вещества для изготовления фармацевтических препаратов, например таблеток и капсул следующего состава:
Пример А
На одну таблетку
Активное вещество - 200 мг
Микрокристаллическая целлюлоза - 155 мг
Кукурузный крахмал - 25 мг
Тальк - 25 мг
Гидроксипропилметилцеллюлоза - 20 мг - --- - 425 мг
Пример Б
На одну капсулу
Активное вещество - 100,0 мг
Кукурузный крахмал - 20,0 мг
Молочный сахар - 95,0 мг
Тальк - 4,5 мг
Стеарат магния - 0,5 мг - --- - 220,0 мги
| название | год | авторы | номер документа |
|---|---|---|---|
| СУЛЬФОНАМИДОКАРБОКСАМИДЫ, ИХ ГИДРАТЫ И ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1993 |
|
RU2133739C1 |
| ПРОИЗВОДНЫЕ УКСУСНОЙ КИСЛОТЫ | 1994 |
|
RU2151768C1 |
| ПРОИЗВОДНЫЕ 2-ПИПЕРИДОНА В КАЧЕСТВЕ АГОНИСТОВ ПРОСТАГЛАНДИНА | 2004 |
|
RU2311409C2 |
| ПРОИЗВОДНЫЕ ТИАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 1999 |
|
RU2166503C2 |
| ПРОИЗВОДНЫЕ НИТРИЛОВ β-АМИНОКИСЛОТ | 2001 |
|
RU2245871C2 |
| НОВЫЕ АЗАИНДОЛТИАЗОЛИНОНЫ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2005 |
|
RU2391342C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1997 |
|
RU2184112C2 |
| β-ЛАКТАМЫ | 1995 |
|
RU2143435C1 |
| ПРОИЗВОДНЫЕ ЦЕФАЛОСПОРИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1994 |
|
RU2130939C1 |
| ПРОИЗВОДНЫЕ 4-ПИПЕРИДИНИЛАЛКИЛАМИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТАГОНИСТИЧЕСКИМ ДЕЙСТВИЕМ В ОТНОШЕНИИ МУСКАРИНОВЫХ РЕЦЕПТОРОВ | 2002 |
|
RU2300524C2 |
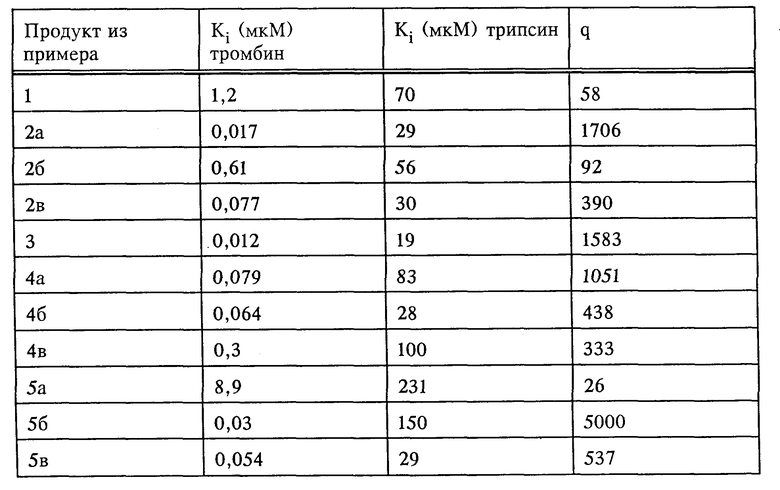
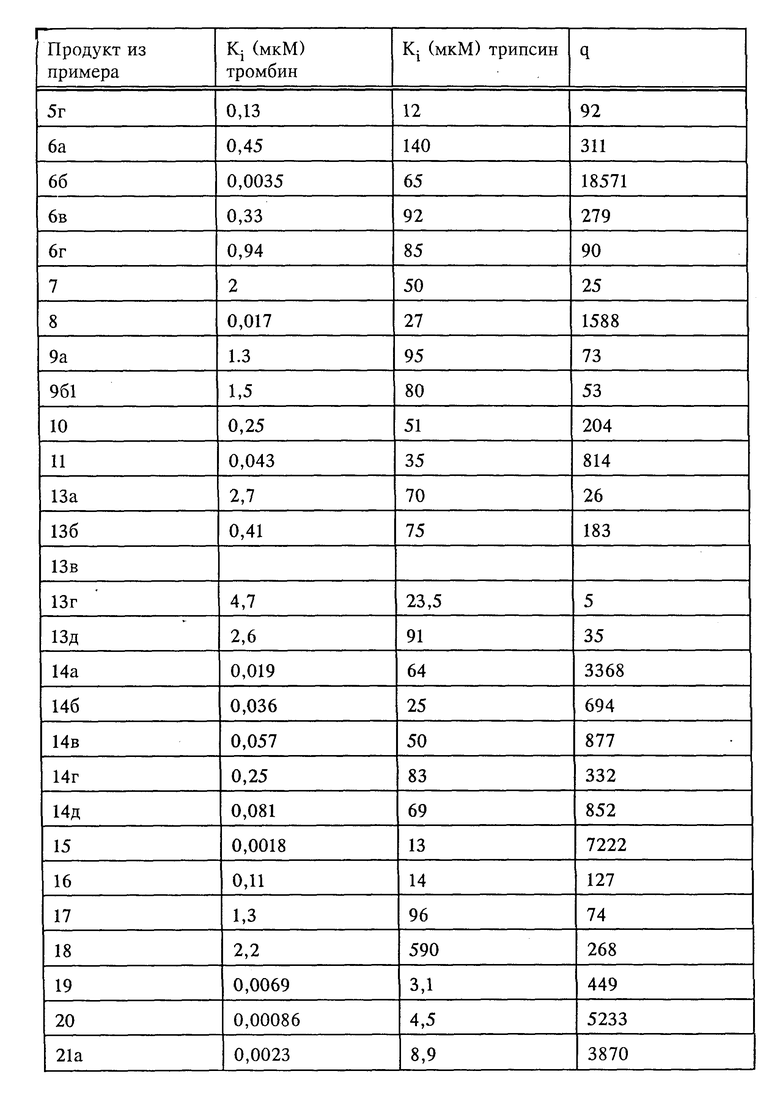
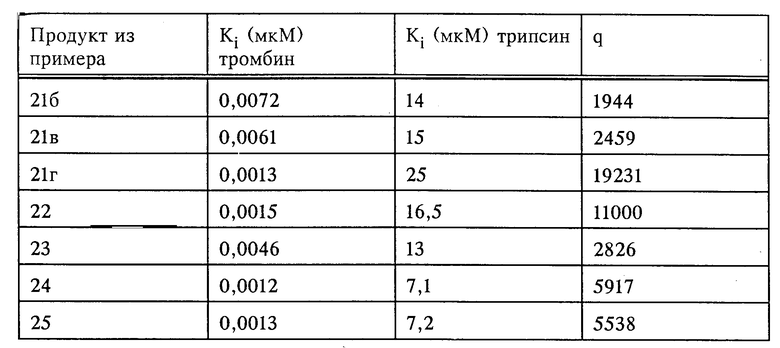
Изобретение относится к новым карбоксамидам ф-лы 1, где Е-Н, G-H, низший алкил, низший алкилен СООН, СОО-низший алкил, низший алканоил, низший алканоилокси, низший алкокси, арил-низший алкокси, СОNH2 и др., М-Н, низший алкил, низший алкенил, арил, гетероарил, циклоалкил, L-H, низший алкил, арил, циклоалкил, или М и L вместе с атомами, с которыми они связаны, образуют группу - N (гет), или Е и G месте образуют метиленовую, либо карбонильную группу и М обозначает Н, низший алкил, низший алкенил, арил, гетероарил, циклоалкил, L-H, низший алкил, арил , циклоалкил, А-Н, алкил, аралкил, Q представляет группу формулы Q1 или Q2, T-CH2 или О, R6 и R7 - H, карбонизший алкокси, ОН. Соединения ф-лы 1 обладают способностью ингибировать накопление тромбоцитов, индуцированное тромбином, а также свертывание фибриногена в плазме крови.
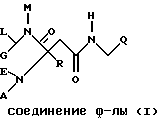
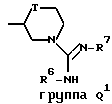
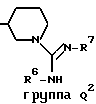
17 з.п.ф-лы, 1 табл.
где E обозначает водород;
G обозначает H, низший алкил или при определенных условиях связанный через низший алкилен COOH, COO-низший алкил, низший алканоил, OH, низший алканоилокси, низший алкокси, арил-низший алкокси, CONH2, CONHCH2CH2OH, CONHOH, CONHOCH3, CONHO-бензил, CONHSO2-низший алкил, CONHCH2CH2-арил, CONH-циклоалкил, CОNHCH2-гетероарил, NH2, NHCOO-низший алкил, NHCOO-низший аралкил, NHSO3H, (NHSO2 либо NHSO3)-низший алкил, NH-низший алканоил, NHCOCOOH, NHCOCOO-низший алкил, NH-циклоалкил, NH - (3,4-диоксо-2-гидроксициклобут-1-енил), NH-[2-низший (алкокси либо -алкенилокси)-3,4-диоксоциклобут-1-енил] , NHCH2-гетероарил, NHCOCO-(арил либо низший алкил), NHCOCH2Cl, NHCO-низший алкилен-O-(низший алкил либо арил), NHCOCH2[арил, гетероарил либо -N(гет)], NHCOC(NOH)-низший алкилен-COOH, NHSO2-N(гет), NHCO-(арил, гетероарил либо гетероциклил), NHPO3, (R10, R20), гетероарил либо группу CO-N(гет), R10 и R20 обозначают H, низший алкил или фенил и M обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил,
L обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил или M и L вместе с атомами, с которыми они связаны, образуют группу -N(гет) или E и G вместе образуют метиленовую либо карбонильную группу и
M обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил или карбокси-низший алкил и
L обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил,
A обозначает H, алкил, низший аралкил или группу формулы
-C(O)R2 (A1),
-S(O)2N(R3,R4) (A2)
или, если группа Q содержит гидроксильную группу и/или если E и G вместе представляют собой CH2 либо CO, то
A может представлять собой также группу формулы
-S(O)2R5 (A3),
R2 обозначает низший алкил, при определенных условиях связанный через низший алкилен арил, гетероарил либо циклоалкил, или связанный через низший алкилен карбо-низший алкокси или связанный через низший алкилен - (O либо S)-(арил, гетероарил либо циклоалкил), причем содержащаяся в R2 группа низшего алкилена в α-положении относительно карбонильной группы, с которой связан R2, может замещена гидроксильной группой, аминогруппой либо низшим алканоиламино, или
R2 обозначает связанный через низший алкилен галоген, карбоксильную группу, низший алкокси, амино, моно- либо ди-низший алкиламино или связанную через низший алкилен группу -N(гет) или
R2 представляют собой группу -OR22 либо -NHR22,
R22 обозначает низший алкил или при определенных условиях связанный через низший алкилен арил, гетероарил либо циклоалкил, или замещенный во фрагменте низшего алкила арилом, карбо-низшим алкокси либо COOH низший аралкил,
R3 и R4 независимо друг от друга обозначают водород, алкил либо арил-низший алкил, или вместе с N-атомом, по которому они связаны, образуют группу -N(гет),
R5 обозначает арил, гетероарил, гетероциклил, алкил либо циклоалкил, -N(гет) обозначает N-связанный, при определенных условиях разорванный O, S, NH либо N-низшим алкилом и при определенных условиях замещенный в количестве до двух заместителей из группы: низший алкил, OH, оксо, COOH, COO-низший алкил, CH2OH и CH2O-бензил -N(CH2)4-9,
Q представляет собой группу формулы Q1 или Q2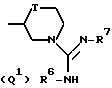
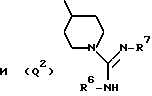
T представляет собой CH2 либо O,
один из R6 и R7 обозначает водород либо карбо-низший алкокси, а другой обозначает водород, карбо-низший алкокси либо гидроксильную группу, и
R представляет собой водород либо низший алкил,
а также гидраты или сольваты и физиологически совместимые соли названных соединений.
E обозначает водород,
G обозначает H, низший алкил либо при определенных условиях связанный через низший алкилен COOH, COO-низший алкил, низший алканоил, OH, низший алканоилокси, низший алкокси, арил-низший алкокси, CONH2, CONHCH2CH2OH, CONHOH, CONHOCH3, CONHO-бензил, CONHSO2-низший алкил, CONHCH2CH2-арил, CONH-циклоалкил, CОNHCH2-гетероарил, NH2, NHCOO-низший алкил, NHCOO-низший аралкил, NHSO3H, (NHSO2 либо NHSO3)-низший алкил, NH-низший алканоил, NHCOCOOH, NHCOCOO-низший алкил, NH-циклоалкил, NH-(3,4-диоксо-2-гидрокси-циклобут-1-енил), NH-[2-низший (алкокси либо -алкенилокси)-3,4-диоксоциклобут-1-енил], NHCH2-гетероарил, NHCOCO-(арил либо низший алкил), NHCOCH2Cl, NHCOCH2O-арил, NHCOCH2-арил, NHCO-(арил либо гетероарил), NHPO3(R10, R20), гетероарил, или при определенных условиях разорванный O либо S и при определенных условиях замещенный заместителями числом до двух из группы низший алкил, COOH, COO-низший алкил, CH2OH и CH2O-бензил CON(CH2)4-9, и
R10 и R20 обозначают H, низший алкил либо фенил,
M обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил,
L обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил, или
M и L вместе с атомами, по которым они связаны, образуют при определенных условиях разорванный O либо S и при определенных условиях замещенный заместителями числом до 2-х из группы низший алкил, COOH, COO-низший алкил, CH2OH, CH2O-бензил N(CH2)4-9, или
E и G образуют вместе метиленовую либо карбонильную группу, и
M обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил либо (арил, герероарил либо циклоалкил)-низший алкил, или карбоки-низший алкил, и
L обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил,
A может представлять собой группу формулы:
-C(O)R2 (A1),
-S(O)2N(R3, R4) (A2)
или, если группа Q содержит гидроксильную группу, A может представлять собой также группу формулы
-S(O)2R5 (A3)
или, если E и G вместе представляют собой CH2 либо CO, A может представлять собой также H, алкил или группу формулы:
-S(O)2R5 (A3),
R2 представляет собой группу R22, -OR22 либо -NHR22, и
R22 обозначает низший алкил либо при определенных условиях связанный через низший алкилен арил, гетероарил либо циклоалкил, или
R2 обозначает связанный через низший алкилен карбо-низший алкокси либо связанный через низший алкилен - (O либо S)-(арил, гетероарил либо циклоалкил), причем содержащаяся в R2 группа низшего алкилена в α-положении относительно карбонильной группы, с которой связан R2, может быть замещена гидроксильной группой, амино либо низшим алканоиламино,
R3 и R4 независимо друг от друга обозначают водород, алкил либо арил-низший алкил, или вместе с N-атомом, по которому они связаны, представляют собой при определенных условиях разорванный O либо S -N(CH2)4-9, R5 обозначает арил, гетероарил, гетероциклил, алкил или циклоалкил,
Q представляет собой группу формулы Q1 либо Q2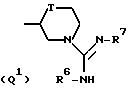
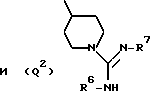
где T обозначает CH2 либо O;
один из R6 и R7 обозначает водород либо карбо-низший алкокси, а другой обозначает водород, карбо-низший алкокси либо гидроксильную группу, и
R обозначает водород,
а также гидраты или сольваты и физиологически совместимые соли названных соединений.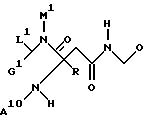
где G1 обозначает H, низший алкил или при определенных условиях связанный через низший алкилен COOH, COO-низший алкил, низший алканоил, OH, низший алканоилокси, низший алкокси, арил-низший алкокси, CONH2, CONHCH2CH2OH, CONHOH, CONHOCH3, CONHO-бензил, CONHSO2-низший алкил, CONHCH2CH2-арил, CONH-циклоалкил, CONHCH2-гетероарил, NH2, NHCOO-низший-алкил, NHCOO-низший-аралкил, NHSO3H, (NHSO2 либо NHSO3)-низший алкил, NH-низший алканоил, NHCOCOOH, NHCOCOO-низший алкил, NH-циклоалкил, NH-(3,4-диоксо-2-гидрокси-циклобут-1-енил), NH-[2-низший (алкокси либо -алкенилокси)-3,4-диоксоциклобут-1-енил] , NHCH2-гетероарил, NHCOCO-(арил либо низший алкил), NHCOCH2Cl, NHCO-низший алкилен-O-(низший алкил либо арил), NHCOCH2[арил, гетероарил либо -N(гет)] , NHCOC(NOH)-низший алкилен-COOH, NHSO2-N(гет), NHCO-(арил, гетероарил либо гетероцикл), NHPO3(R10, R20), гетероарил либо группу CO-N(гет),
R10 и R20 обозначают H, низший алкил или фенил и
M1 обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил,
L1 обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил или M1 и L1 вместе с атомами, с которыми они связаны, образуют группу -N(гет),
A10 обозначает H, алкил, низший аралкил или группу формулы
-C(O)R2 (A1),
-S(O)2N(R3, R4) (A2)
или, если группа Q содержит гидроксильную группу,
A10 может представлять собой также группу формулы
-S(O)2R5 (A3), и R, R2 - R5, -N(гет) и Q имеют то же значение, что и в п.1,
а также гидраты или сольваты и физиологически совместимые соли названных соединений.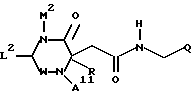
где W обозначает метилен либо карбонил,
M2 обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил, или карбокси-низший алкил, и
L2 обозначает H, низший алкил, арил, циклоалкил, или (арил либо циклоалкил)-низший алкил, и
A11 представляет собой H, алкил, низший аралкил либо группу формулы
-C(O)R2 (A1),
-S(O)2N(R3, R4) (A2) или
-S(O)2R5 (A3), и
R, R2 - R5, и Q имеют то же значение, что и в п.1,
а также гидраты или сольваты и физиологически совместимые соли названных соединений.
G1 обозначает H, низший алкил либо при определенных условиях связанный через низший алкилен COOH, COO-низший алкил, низший алканоил, OH, низший алканоилокси, низший алкокси, арил-низший алкокси, CONH2, CONHCH2CH2OH, CONHOH, CONHOCH3, CONHO-бензил, CONHSO2-низший алкил, CONHCH2CH2-арил, CONH-циклоалкил, CONHCH2-гетероарил, NH2, NHCOO-низший алкил, NHCOO-низший аралкил, NHSO3H, (NHSO2 либо NHSO3)-низший алкил, NH-низший алканоил, NHCOCOOH, NHCOCOO-низший алкил, NH-циклоалкил, NH-(3,4-диоксо-2-гидрокси-циклобут-1-енил), NH-[2-низший (алкокси либо -алкенилокси)-3,4-диоксоциклобут-1-енил], NHCH2-гетероарил, NHCOCO-(арил либо низший алкил), NHCOCH2Cl, NHCOCH2O-арил, NHCOCH2-арил, NHCO-(арил либо гетероарил), NHPO3(R10, R20), гетероарил, или при определенных условиях разорванный O либо S и при определенных условиях замещенный заместителями числом до 2-х из группы низший алкил, COOH, COO-низший алкил, CH2OH и CH2O-бензил CON(CH2)4-9, и
R10 и R20 обозначают H, низший алкил либо фенил,
M1 обозначает H, низший алкил либо низший алкенил, арил, гетероарил, циклоалкил или (арил, гетероарил либо циклоалкил)-низший алкил,
L1 обозначает H, низший алкил, арил, циклоалкил или (арил либо циклоалкил)-низший алкил, или
M1 и L1 вместе с атомами, по которым они связаны, образуют при определенных условиях разорванный O либо S и при определенных условиях замещенный заместителями числом до двух из группы низший алкил, COOH, COO-низший алкил, CH2OH, CH2O-бензил N(CH2)4-9,
A10 представляет собой группу формулы:
-C(O)R2 (A1),
-S(O)2N(R3, R4) (A2)
или, если группа Q содержит гидроксильную группу,
A10 может представлять собой также группу формулы
-S(O)2R5 (A3),
R обозначает водород и
R2 - R5 и Q имеют те же значения, что и в п.3,
а также гидраты или сольваты и физиологически совместимые соли названных соединений.
R обозначает водород,
A11 представляет собой H, алкил или группу формулы:
-C(O)R2 (A1),
-S(O)2N(R3, R4) (A2)
или -S(O)2R5 (A3),
и L2, M2, W, R2 - R5 и Q имеют то же значение, что и в п.4,
а также гидраты или сольваты и физиологически совместимые соли названных соединений.
-C(O)-R2 (A1),
в которой R2 представляет собой связанный через низший алкилен галоген, карбоксильную группу, низший алкокси, амино, моно- либо ди-низший алкиламино или связанную через низший алкилен группу -N(гет) или R2 представляет собой группу -NHR22, где R22 представляет собой группу низшего аралкила, замещенную в нижнеалкиловом фрагменте арилом, карбонизшим алкокси или COOH.
-C(O)-R2 (A1),
в которой R2 представляет собой группу R22, -OR22 либо -NHR22, и R22 представляет собой низший алкил или при определенных условиях связанный через низший алкилен арил, гетероарил либо циклоалкил, или в которой R2 представляет собой связанный через низший алкилен карбо-низший алкокси или связанный через низший алкилен -(O либо S)-(арил либо гетероарил), причем содержащаяся в R2 группа низшего алкилена в α-положении относительно карбонильной группы, с которой связан R2, может быть замещена OH либо низшим алканоиламино.
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-2-морфолин-4-илацетиламино-N1-(2-пиразин-2-илкарбониламиноэтил)-сукцинамид,
этиловый эфир 3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2-(3-фенилпропиламино)пропионил] -циклопропиламино] -пропионовой кислоты,
3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2-(3-фенилпропиламино)-пропионил]-циклопропиламино]-пропионовая кислота,
3-[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2-морфолин-4-илсульфониламинопропионил]-циклопропиламино]-пропионовая кислота.
[[(S)-3-[4-(аминоиминометил)-морфолин-2-илметилкарбамоил] -2-бензилоксикарбониламинопропионил]-бутиламино]-уксусная кислота,
[[(S)-3-[(S)-1-(аминоиминометил)-пиперидин-3-илметилкарбамоил] -2-пентаноиламинопропионил]-циклопропиламино]-уксусная кислота,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-N1-(2-пиразин-2-илкарбониламиноэтил)-2-пиримидин-2-илсульфонилацетиламиносукцинамид,
(S)-N4-[(S)-1-(аминогидроксииминометил)-пиперидин-3-илметил] -N1-циклопропил-2-(нафтален-2-илсульфониламино)-N1-[2-(пиразин-2-илкарбониламино)-этил]-сукцинамид,
(S)-N4-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -N1-циклопропил-2-морфолин-4-илсульфониламино)-N1-[2-(6-оксо-1,6-дигидропиразин-3-илкарбониламиноэтил]-сукцинамид и
N-[(S)-1-(аминоиминометил)-пиперидин-3-илметил] -2[(S)-4-циклопропил-1-нафтален-2-илсульфонил-3,6-диоксопиперазин-2-ил]-ацетамид.
Приоритет по признакам:
07.09.93 по всем признакам; за исключением признаков:
05.07.94 при G обозначает NHCOC(NOH)-низший алкилен-COOH,NHSO2-N(гет), NHCO-(арил, гетероарил либо гетероциклил), R - низший алкил, M и L вместе с атомами, с которыми они связаны, образуют группу - N(гет), R3 и R4 вместе N-атомом, по которому они связаны, образуют группу -N(гет), -N(гет) обозначает N-связанный, при определенных условиях разорванный O, S, NH либо N - низшим алкилом и при определенных условиях замещенный в количестве до двух заместителей из группы: низший алкил, OH, оксо, COOH, COO - низший алкил, CH2OH и CH2O - бензил-N(CH2)4-9.
| УСТРОЙСТВО ДЛЯ ПИТАНИЯ ЭЛЕКТРИЧЕСКОГО НАГРЕВАТЕЛЯ И КОНТРОЛЯ ЕГО ТЕМПЕРАТУРЫ | 1972 |
|
SU428231A1 |
| Способ получения -арил- (1- -4-пиперидинил) ацетамидов или их солей | 1976 |
|
SU747424A3 |
| УСТРОЙСТВО ДЛЯ РАЗДЕЛЕНИЯ ФАРФОРОВЫХ БЛЮДЕЦ ПОСЛЕ ОБЖИГА | 0 |
|
SU330026A1 |
Авторы
Даты
1999-02-10—Публикация
1994-09-07—Подача