Настоящее изобретение относится к производным бензоциклоалкилениламина общей формулы
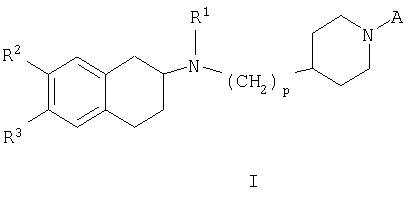
в которой
А представляет собой -C(O)R4 или -S(O)2R5;
R1 представляет собой (С1-С6)-алкил или аллил;
R2 и R3 независимо при каждом упоминании представляют собой водород, галоген, (С1-С6)-алкил, галоген(С1-С6)-алкил, -OR', -S(O)0-2R', -NR'R", -NR'COR", -NR'"CONR'R", -NR'SO2R", -NR'"SO2NR'R", -SO2NR'R", -OSO2R', нитро, циано, гетероарил или арил, указанные группы гетероарил или арил являются незамещенными или замещенными одной или более группой, выбранной из гидрокси, циано, (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, (С1-С6)-алкилтио, галогена, галоген(С1-С6)-алкила, гидрокси(С1-С6)-алкила, нитро, (С1-С6)-алкоксикарбонила, амино, моно- или ди(С1-С6)-алкиламино, (С1-С6)-алкилсульфонила, (С1-С6)-алкилкарбонила, моно- или ди-(С1-С6)-алкиламиносульфонила, (С1-С6)-алкилсульфониламино, моно- или ди-(С1-С6)-алкиламинокарбонила и (С1-С6)-алкилкарбониламино;
при этом предполагается, что R2 и R3 одновременно не представляют собой водород;
R', R" и R'" независимо при каждом упоминании представляют собой водород, (С1-С6)-алкил или (С3-С6)-циклоалкил, галоген(С1-С6)-алкил, дифенилметил, арил или арил-(С1-С6)-алкил, в которых арильная группа является незамещенной или замещенной одной или более группой, выбранными из гидрокси, циано, (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, (С1-С6)-алкилтио, галогена, галоген(С1-С6)-алкила, гидрокси(С1-С6)-алкила, нитро, (С1-С6)-алкоксикарбонила, амино, моно-или ди-(С1-С6)-алкиламино, (С1-С6)-алкилсульфонила, (С1-С6)-алкилкарбонила, моно- или ди-(С1-С6)-алкиламиносульфонила, (С1-С6)-алкилсульфониламино, моно- или ди-(С1-С6)-алкиламинокарбонила, (С1-С6)-алкилкарбониламино и фенила; гетероциклил, который является незамещенным или замещенным одной или более группами, выбранными из гидрокси, оксо, циано, (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, (С1-С6)-алкилтио, галогена и галоген(С1-С6)-алкила, гетероарил, который является незамещенным или замещенным одной или более группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси и галогена, или R' и R" вместе с атомом азота, к которому они присоединены, могут также образовывать 5-7-членное кольцо, которое может включать один дополнительный гетероатом, выбранный из О, N или S(O)0-2, указанное кольцо является незамещенным или замещенным одной или двумя группами (С1-С6)-алкил;
R4 представляет собой (С1-С6)-алкил, галоген(С1-С6)-алкил, бензилокси, дифенилметил,
-NRaRb, в котором Ra и Rb являются такими, как определено в тексте заявки,
-Y-гетероциклил, -Y-гетероарил, в которых указанные группы гетероциклил и гетероарил являются независимо друг от друга незамещенными или замещенными одной или более группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галогена, галоген(С1-С6)-алкила, (С1-С6)-алкилсульфонила, моно- или ди-(С1-С6)-алкиламиносульфонила и (С1-С6)-алкилсульфониламино, и указанный Y представляет собой связь или (С1-3)-алкилен;
Ra представляет собой водород, (С1-С6)-алкил, галоген(С1-С6)-алкил, циклоалкил или арил, указанные группы циклоалкил или арил каждая независимо друг от друга является незамещенной или замещенной одной или более группой, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галогена, галоген(С1-С6)-алкила и алкил(С1-С6)сульфонила,
или Ra и Rb вместе с атомом азота, к которому они присоединены, могут также образовывать 5-7-членное кольцо, которое может включать один дополнительный гетероатом, выбранный из О, N или S(O)0-2, указанное кольцо является незамещенным или замещенным одной или двумя группами (С1-С6)-алкил;
Rb представляет собой водород или (С1-С6)-алкил;
R5 представляет собой (С1-С6)-алкил, галоген(С1-С6)-алкил,
-NRaRb, в котором Ra и Rb являются такими, как определено выше, арил или гетероарил, указанные арил или гетероарил каждый независимо друг от друга является незамещенным или замещенным одной или двумя группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галогена и (С1-С6)-алкилсульфонила; и
р равно 1 или 2;
или отдельным изомерам, рацемическим и не рацемическим смесям изомеров, или их фармацевтически приемлемым солям или сольватам.
Неожиданно было обнаружено, что соединения формулы I являются антагонистами мускаринового рецептора.
Ацетилхолин (Ach - от англ. acetylcholine) является основным трансмиттером парасимпатической нервной системы. Физиологическое действие Ach осуществляется посредством активации либо никотиновых рецепторов, либо мускариновых рецепторов. Оба этих класса рецепторов являются гетерогенными: например, семейство мускариновых рецепторов включает пять подтипов (М1, М2, М3, М4 и М5), каждый из которых кодируется различными генами и обладает своеобразным фармакологическим действием и специфическим распределением.
Почти все мышечные ткани экспрессируют как мускариновые М2 рецепторы, так и мускариновые М3 рецепторы, оба этих подвида играют определенную функциональную роль. Количество М2 рецепторов превышает количество М3 рецепторов в соотношении приблизительно 4 к 1. Как правило, М3 рецепторы являются медиаторами прямого сократительного воздействия на подавляющее большинство тканей гладкой мускулатуры. С другой стороны, М2 рецепторы косвенно являются причиной сокращения гладкой мускулатуры, посредством ингибирования релаксации с участием симпатетически действующих медиаторов (β-адренорецептор).
Соединения, которые оказывают действие как антагонисты мускариновых рецепторов, использовали для лечения некоторых болезненных состояний, связанных с плохим функционированием гладкой мускулатуры, а также для лечения когнитивных и нейродегенеративных нарушений и расстройств, таких как болезнь Альцгеймера. До недавнего времени большинство этих соединений было неселективным в отношении различных подтипов мускариновых рецепторов, что приводило к нежелательным антихолинергетическим побочным эффектам, таким как сухость во рту, запор, нечеткое зрительное восприятия или тахикардия.
Наиболее частым из этих побочных эффектов является сухость во рту вследствие блокирования мускариновых рецепторов слюнной железы. Недавно созданные специфические антагонисты М2 и/или М3 рецепторов, как было показано, обладают меньшими побочными эффектами. Данные подтверждают, что преимущественная блокада М2 и/или М3 рецепторов по отношению к М5 рецептору могла бы быть терапевтически эффективной при лечении болезненных состояний, связанных с расстройством функционирования гладкой мускулатуры.
В дополнение антагонисты мускаринового рецептора являются самыми современными терапевтическими средствами, используемыми в качестве бронходилаторных агентов при хроническом обструктивном заболевании легких (ХОЗЛ). Полагают, что эффективность этого класса соединений осуществляется посредством антагонизма в отношении трансмиттеров природного происхождения (ацетилхолин), проявляемого М3 рецепторами гладкой мускулатуры воздушных путей, и соединения этого класса могут иметь дополнительные преимущества при ХОЗЛ посредством подавления выделения слизи, медиатором которого также могут являться М3 рецепторы. Обычное современное противомускариновое средство для лечения ХОЗЛ - это ипратропиум (атровент), который вводят в виде аэрозоля 4 раза в день. Позже фирмой «Boehringer-Ingelheim» был разработан тиотропиум (спирива), в качестве мускаринового антагониста второго поколения, и, как ожидалось, этот препарат будет выпускаться с 2002 года (в сотрудничестве с фирмой «Pfizer»). Тиотропиум также вводят в виде аэрозоля, но он долго задерживается на М3 рецепторе и в результате этого обладает пролонгированным бронходилаторным действием. Тиотропиум вводят один раз в день. Хотя тиотропиум обладает высоким сродством ко всем подтипам мускариновых рецепторов, он является четвертичным аммониевым соединением, которое плохо абсорбируется.
Разработано немного селективных антагонистов М2 и/или М3 рецепторов. Настоящее изобретение восполняет эту потребность, предоставляя возможность получения антагонистов этого типа, которые могут применяться для лечения болезненных состояний, связанных с плохим функционированием гладкой мускулатуры и респираторными расстройствами.
Объектами настоящего изобретения являются новые производные бензоциклоалкилениламина, их индивидуальные изомеры, рацемические и не рацемические смеси изомеров, фармацевтически приемлемые соли или гидраты, которые особенно полезны в качестве антагонистов мускаринового рецептора. Настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы I, или индивидуальных изомеров, рацемические и не рацемические смеси изомеров, фармацевтически приемлемые соли или сольваты этих соединений в смеси с по меньшей мере одним фармацевтически приемлемым носителем. Предпочтительно фармацевтические композиции пригодны для введения субъекту, находящемуся в болезненном состоянии, которое может быть вылечено при воздействии антагониста мускаринового рецептора.
Другой аспект настоящего изобретения относится к способу получения соединений формулы I, указанный способ включает:
взаимодействие соединения общей формулы
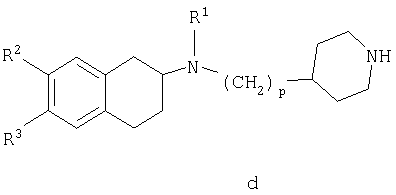
в которой р, R1, R2 и R3 являются такими, как определено выше в тексте заявки, с соединением формулы R4C(O)L или R5S(O)2L, в котором L представляет собой отщепляемую группу, и R4 и R5 являются такими, как определено выше в тексте заявки, с получением при этом соединения общей формулы

в которой R1, R2, R3, р и А являются такими, как определено выше в тексте заявки.
Другой аспект настоящего изобретения относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения общей формулы I или отдельного изомера, рацемической или не рацемической смеси изомеров и их солей или сольватов, в смеси с по меньшей мере одним подходящим носителем.
Согласно другому аспекту настоящее изобретение относится к применению соединений формулы I для лечения пациента, находящегося в таком болезненном состоянии, которое может быть облегчено при лечении соединением, обладающим селективной активностью в отношении мускариновых рецепторов. В частности, пациент может находиться в состоянии, которое включает нарушения или расстройства функционирования гладкой мускулатуры, предпочтительно нарушения или расстройства деятельности мочеполового тракта, нарушения или расстройства функционирования дыхательных путей, расстройства деятельности желудочно-кишечного тракта; более предпочтительно нарушения или расстройства деятельности мочеполового тракта, такие как повышенная деятельность мочевого пузыря или гиперактивность детрузора (сжимателя) и их симптомы, например изменения, проявляющиеся как настойчивые позывы к мочеиспусканию, частое мочеиспускание, сниженный объем мочевого пузыря, недержание мочи и подобные им, изменения, уродинамически проявляющиеся в изменении объема мочевого пузыря, неполном мочеиспускании, нестабильном сокращении мочевого пузыря, спастике сфинктера и подобных симптомах, а также симптомы, обычно проявляющиеся при гиперрефлексии детрузора (нейрогенной дисфункции мочевого пузыря), такие как затруднение мочеиспускания, недостаточность мочеиспускания, гиперчувствительность органов таза или идиопатические состояния, такие как нестабильность детрузора и подобные им. В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения заболевание включает нарушения или расстройства функционирования дыхательных путей, такие как аллергия или астма. В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения болезненное состояние включает желудочно-кишечные расстройства. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения болезненное состояние включает когнитивные и нейродегенеративные нарушения или расстройства.
Если не указано иное, то следующие термины при использовании в тексте настоящей заявки, включая описание и формулу изобретения, имеют значения, приведенные ниже. Следует отметить, что при употреблении в описании и прилагаемой формуле изобретения формы единственного числа обозначают и формы множественного числа, если из контекста с очевидностью не следует обратное.
«(С1-С6)-алкил», или «низший алкил», или «алкил» означает моновалентный линейный или разветвленный насыщенный углеводородный радикал, содержащий от одного до шести атомов углерода, если не указано иное. Примеры радикалов «низший алкил» включают, не ограничиваясь указанным, метил, этил, пропил, изопропил, 1-этилпропил, втор-бутил, трет-бутил, н-бутил, н-пентил, н-гексил и подобные им радикалы.
«Замещенный (С1-С6)-алкил» означает (С1-С6)-алкил, который определен в тексте заявки и включает от одного до трех заместителей, предпочтительно один заместитель, такой как гидроксил, алкокси, амино, амидо, карбоксил, ацил, галоген, циано, нитро или тиол. Эти группы могут присоединяться к любому атому углерода, входящему в (С1-С6)-алкильную часть. Примеры радикалов «замещенный (С1-С6)-алкил» включают, не ограничиваясь указанным, 2-метоксиэтил, 2-гидроксиэтил, диметиламинокарбонилметил, 4-гидрокси-2,2-диметил-бутил, трифторметил, трифторбутил и подобные им радикалы.
«(С1-С6)-алкокси» означает радикал -O-R, в котором R представляет собой радикал (С1-С6)-алкил, определенный в тексте заявки. Примеры радикалов «алкокси» включают, не ограничиваясь указанным, метокси, этокси, изопропокси и подобные им радикалы.
«Арил» означает моновалентный ароматический карбоциклический радикал, состоящий из одного отдельного кольца или одного или более конденсированных колец, среди которых по меньшей мере одно кольцо является ароматическим, указанный радикал может быть необязательно замещенным одним или более, предпочтительно одним или двумя, заместителями, выбранными из гидрокси, циано, низшего алкила, низшего алкокси, галогеналкокси, алкилтио, галогена, галогеналкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино и арилкарбониламино, если не указано иное. В качестве альтернативы два смежных атома в арильном кольце могут быть замещены метилендиоксигруппой или этилендиоксигруппой. Примеры радикалов «арил» включают, не ограничиваясь указанным, фенил, нафтил, бифенил, инданил, антрахинолил, трет-бутилфенил, 1,3-бензодиоксолил и подобные им радикалы.
«Арил(С1-С6)-алкил» означает радикал R'R"-, в котором R' представляет собой радикал арил, который определен в тексте заявки, и R" представляет собой радикал алкил, который определен в тексте заявки. Примеры радикалов «арилалкил» включают, не ограничиваясь указанным, бензил, фенилэтил, 3-фенилпропил и подобные им радикалы.
«(С3-С10)-Циклоалкил» означает моновалентный насыщенный карбоциклический радикал, состоящий из одного или более колец, предпочтительно из одного или двух колец, содержащих от трех до десяти атомов каждое, указанный радикал может быть необязательно замещенным одним или более, предпочтительно одним или двумя, заместителями, выбранными из гидрокси, циано, низшего алкила, низшего алкокси, галогеналкокси, алкилтио, галогена, галогеналкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино и арилкарбониламино, если не указано иное. Примеры радикалов «циклоалкил» включают, не ограничиваясь указанным, циклопропил, циклобутил, 3-этилциклобутил, циклопентил, циклогептил, адамантил и подобные им радикалы.
«Гетероарил» означает моновалентный ароматический циклический радикал, содержащий одно или более кольцо, предпочтительно от одного до трех колец, содержащих от четырех до восьми атомов каждое, такой радикал включает один или более гетероатомов в кольце, предпочтительно один или два гетероатома (выбранных из азота, кислорода или серы), указанный радикал может быть необязательно замещенным одним или более, предпочтительно одним или двумя заместителями, выбранными из гидрокси, циано, низшего алкила, низшего алкокси, галогеналкокси, алкилтио, галогена, галогеналкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино и арилкарбониламино, если не указано иное. Примеры радикалов «гетероарил» включают, не ограничиваясь указанным, имидазолил, оксазолил, тиазолил, пиразинил, тиенил, фуранил, пиридинил, хинолинил, изохинолинил, бензофурил, бензотиенил, бензотиопиранил, бензимидазолил, бензоксазолил, бензотиазолил, бензопиранил, индазолил, индолил, изоиндолил, хинолинил, изохинолинил, нафтиридинил, бензолсульфонилтиенил и подобные им радикалы.
«Гетероциклил» означает моновалентный насыщенный циклический радикал, состоящий из одного или более колец, предпочтительно от одного до двух колец, содержащих от трех до восьми атомов каждое, такой радикал включает один или более гетероатомов в кольце (выбранный из N, О или S(O)0-2), и указанный радикал может быть необязательно замещенным одним или более, предпочтительно одним или двумя, заместителями, выбранными из гидрокси, оксо, циано, низшего алкила, низшего алкокси, галогеналкокси, алкилтио, галогена, галогеналкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино и арилкарбониламино, если не указано иное. Примеры гетероциклических радикалов включают, не ограничиваясь указанным, морфолинил, пиперазинил, пиперидинил, пирролидинил, тетрагидропиранил, тиоморфолинил и подобные им радикалы.
«Галоген» означает радикал фтор, бром, хлор и/или иод.
«Галоген(С1-С6)-алкил" означает радикал низший алкил, который определен в тексте заявки, замещенный в произвольной позиции одним или более атомами галогена, которые определены в тексте заявки. Примеры радикалов «галогеналкил» включают, не ограничиваясь указанным, 1,2-дифторпропил, 1,2-дихлорпропил, трифторметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил и подобные им радикалы.
«Галоген(С1-С6)-алкокси» означает радикал -OR, в котором R означает галогеналкил, который определен выше.
«Гидрокси(С1-С6)-алкил» означает радикал низший алкил, который определен в тексте заявки, замещенный одной или более гидроксигруппами. Примеры радикалов «гидроксиалкил» включают, не ограничиваясь указанным, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 1-(гидроксиметил)-2-гидроксиэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил, 2-(гидроксиметил)-3-гидроксипропил и подобные им радикалы.
«(С1-С6)-алкоксикарбонил» или «(С1-С6)-алкильная сложноэфирная группа» означает радикал -C(O)-O-R, в котором R представляет собой радикал низший алкил, который определен в тексте заявки. Примеры радикалов «алкоксикарбонил» включают, не ограничиваясь указанным, метоксикарбонил, этоксикарбонил, втор-бутоксикарбонил, изопропилоксикарбонил и подобные им радикалы.
«Арилоксикарбонил» или «арильная сложноэфирная группа» означает радикал -C(O)-O-R, в котором R представляет собой радикал арил, который определен в тексте заявки. Примеры радикалов «арилоксикарбонил» включают, не ограничиваясь указанным, фениловую сложноэфирную группу, нафтиловую сложноэфирную группу и подобные им радикалы.
«(С1-С6)-алкилкарбонил» (или «ацил») означает радикал -C(O)-R, в котором R представляет собой радикал низший алкил, который определен в тексте заявки. Примеры радикалов «алкилкарбонил» включают, не ограничиваясь указанным, ацетил, пропионил, н-бутирил, втор-бутирил, трет-бутирил, изо-пропионил и им подобные радикалы.
«(С1-С6)-алкиламинокарбонил» означает радикал -C(O)NR'R", в котором R' представляет собой низший алкил, который определен в тексте заявки, и R" представляет собой водород или низший алкил, который определен в тексте заявки. Примеры радикалов алкиламинокарбонил включают, не ограничиваясь указанным, метиламинокарбонил, диметиламинокарбонил, трет-бутиламинокарбонил, н-бутиламинокарбонил, изо-пропиламинокарбонил и подобные им радикалы.
«(С1-С6)-алкилкарбониламино» означает радикал -NC(O)R', в котором R' представляет собой низший алкил, который определен в тексте заявки. Примеры радикалов алкилкарбониламино включают, не ограничиваясь указанным, метилкарбониламино, изо-пропилкарбониламино, трет-бутилкарбониламино и подобные им радикалы.
«(С1-С6)-алкиламиносульфонил» означает радикал -S(O)2NR'R", в котором R' представляет собой низший алкил, который определен в тексте заявки, и R" представляет собой водород или низший алкил, который определен в тексте заявки. Примеры радикалов алкиламиносульфонил включают, не ограничиваясь указанным, метиламиносульфонил, диметиламиносульфонил и подобные им радикалы.
«(С1-С6)-алкилсульфониламино» означает радикал -NS(O)2R', в котором R' представляет собой низший алкил, который определен в тексте заявки. Примеры радикалов алкилсульфониламино включают, не ограничиваясь указанным, метилсульфониламино, пропилсульфониламино и подобные им радикалы.
«(С1-С6)-алкилсульфонил» означает радикал -S(O)2R, в котором R представляет собой низший алкил или замещенный низший алкил, которые определены в тексте заявки. Примеры радикалов алкилсульфонил включают, не ограничиваясь указанным, метилсульфонил, трифторметилсульфонил, пропилсульфонил и подобные им радикалы.
«(С1-С6)-алкилсульфонилокси» означает радикал -OS(O)2R, в котором R представляет собой низший алкил или замещенный низший алкил, который определен в тексте заявки. Примеры радикалов алкилсульфонилокси включают, не ограничиваясь указанным, метилсульфонилокси, трифторметилсульфонилокси, пропилсульфонилокси и подобные им радикалы.
«Необязательный» или «необязательно» означает, что указанное после этого термина событие или обстоятельство может, но необязательно должно, происходить, и что описание включает как примеры того, когда такое событие или обстоятельство происходит, так и примеры того, когда оно не происходит. Например, термин «необязательная связь» означает, что связь может как присутствовать, так и отсутствовать, и что описание включает простые, двойные или тройные связи.
«Отщепляемая группа» имеет значение, обычно принятое в синтетической органической химии, т.е. означает атом или группу, способную замещаться в условиях реакции алкилирования. Примеры отщепляемых групп включают, не ограничиваясь указанным, галоген, алкан- или арилсульфонилокси, такие как метансульфонилокси, этансульфонилокси, тиометил, бензолсульфонилокси, тозилокси и тиенилокси, дигалогенфосфиноилокси, необязательно замещенный бензилокси, изопропилокси, ацилокси и подобные им радикалы.
«Защитная группа» означает группу, которая избирательно блокирует один реакционноспособный центр в соединении, включающем различные функциональные группы, таким образом, что химическая реакция может быть селективно проведена таким образом, что в ней будет участвовать другой, незащищенный реакционноспособный центр; термин имеет значение, обычно принятое в синтетической химии. В конкретных способах согласно настоящему изобретению предполагается, что защитные группы используются для снятия реакционной активности атомов кислорода, присутствующих в реагентах. Приемлемые защитные группы для спиртовых или фенольных гидроксильных групп, такие, что они могут быть удалены последовательно и селективно, включают группы, защищенные ацетатами, галогеналкилкарбонатами, бензиловыми сложноэфирными группами, алкилсилильными сложноэфирными группами, гетероциклильными сложноэфирными группами, и метальными или алкильными сложноэфирными группами, и подобными им группами. Защитные или блокирующие группы для карбоксильных групп аналогичны описанным защитным группам для гидроксильных групп, предпочтительно это сложноэфирные группы с трет-бутлом, бензилом или метилом. Примеры защитных групп могут быть найдены в: Т.W.Greene et al., «Protective Groups in Organic Chemistry», J.Wiley, 2nd ed. 1991, и в: Harrison et al., «Compendium of Synthetic Organic Methods», Vols.1-8 (J.Wiley и Sons 1971-1996).
«Защитная группа для аминогруппы» означает защитную группу, которая относится к органическим группам, предназначенным для защиты атома азота от участия в нежелательных реакциях при осуществлении методик синтеза, указанная группа включает бензил, бензилоксикарбонил (карбобензилокси, Cbz), пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил, трет-бутоксикарбонил (Boc), трифторацетил и подобные им группы. Предпочтительно использование в качестве защитной группы для аминогруппы либо Boc, либо Cbz вследствие относительной простоты их удаления, например, при использовании кислот в случае Boc, например, посредством трифторуксусной кислоты или хлороводородной кислоты в этилацетате; или посредством каталитического гидрирования в случае Cbz.
«Удаление защиты» означает процесс, в результате которого после завершения селективной реакции удаляется защитная группа. Некоторые защитные группы могут быть более предпочтительными, чем другие, из-за удобства использования или легкости снятия защиты. Реагенты, предназначенные для снятия защиты в случае защищенных гидроксильных или карбоксильных групп, включают карбонаты калия или натрия, спиртовые растворы гидроксида лития, цинк в метаноле, уксусную кислоту, трифторуксусную кислоту, катализаторы на основе палладия или трибромид бора и подобные им вещества.
Термин «изомеры» означает соединения, которые имеют одинаковые молекулярные формулы, но различаются способом или порядком связи входящих в них атомов или расположением входящих в них атомов в пространстве. Изомеры, которые различаются расположением входящих в них атомов в пространстве, называются «стереоизомерами». Стереоизомеры, которые не являются зеркальными отображениями друг друга, называются «диастереомерами», а стереоизомеры, которые являются несовместимыми в пространстве зеркальными отображениями друг друга, называются «энантиомерами» или иногда оптическими изомерами. Атом углерода, связанный с четырьмя различными заместителями, называется «хиральным центром».
«Хиральный изомер» означает соединение с одним хиральным центром. Такое соединение имеет две энантиомерные формы с зеркально симметричным расположением заместителей и может существовать как в виде отдельного энантиомера, так и в виде их смеси. Смесь, содержащая одинаковые количества каждой из энантиомерных форм с зеркально симметричным расположением заместителей, называется «рацемической смесью». Соединение, которое содержит более чем один хиральный центр, имеет 2n-1 пар энантиомеров, где n означает количество хиральных центров. Соединения с более чем одним хиральным центром могут существовать как в виде отдельного диастереомера, так и в виде их смеси, называемой «смесью диастереомеров». В том случае, когда присутствует один хиральный центр, стереоизомер может быть охарактеризован абсолютной конфигурацией (R или S) такого хирального центра. Абсолютная конфигурация означает расположение в пространстве заместителей, присоединенных к указанному хиральному центру. Заместители, присоединенные к рассматриваемому хиральному центру, ранжируются в соответствии с правилами упорядочения Кана-Ингольда-Прелога (Cahh et al., Angew. Chem. Inter. Edit. 1966, 5, 385; errata 511; Cahn et al., Angew. Chem. 1966, v.78, p.413; Cahn and Ingold, J.Chem. Soc. (London) 1951, 612; Cahn et al., Experientia 1956, 12, 81; Cahn, J. Chem. Educ. 1964, 41, 116).
«Геометрические изомеры» означают диастереомеры, которые своим существованием обязаны затрудненному вращению вокруг двойных связей. Такие конфигурации различаются по названиям в зависимости от наличия приставок цис- или транс-, или Z и Е, которые означают, что группы располагаются по одну или по разные стороны от двойной связи в соответствии с правилами Кана-Ингольда-Прелога.
«Атропические изомеры» означает изомеры, обязанные своим существованием затрудненному вращению объемных групп вокруг центральной связи.
Термин «по существу чистый» означает, что получено по меньшей мере приблизительно 80 молярных процентов, более предпочтительно, по меньшей мере приблизительно 90 молярных процентов и наиболее предпочтительно по меньшей мере приблизительно 95 молярных процентов целевого энантиомера или стереоизомера.
Термин «фармацевтически приемлемый» свидетельствует о возможности использования для изготовлении фармацевтической композиции, которая в целом является безопасной, нетоксичной и приемлемой как биологически, так и в каком-либо другом отношении и определяет приемлемость как для ветеринарного использования, так и для использования при лечении людей.
Термин «фармацевтически приемлемые соли» соединения означают соли, которые являются фармацевтически приемлемыми и которые сохраняют требуемую фармакологическую активность исходного соединения. Такие соли включают:
(1) соли - продукты присоединения кислоты, образованные с неорганическими кислотами, такими как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобными им кислотами; или образованные с органическими кислотами, такими как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорасульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, 2-нафталинсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, дибензоил-L-винная кислота, винная кислота, пара-толуолсульфоновая кислота, триметилуксусная кислота, трифторуксусная кислота и подобными им кислотами; или
(2) соли, образующиеся, когда протон кислоты, присутствующий в исходном соединении, либо замещается ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо образует координационное соединение с органическим или неорганическим основанием. Подходящие органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и подобные им основания. Подходящие неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия.
Предпочтительными фармацевтически приемлемыми солями являются соли, образованные с хлороводородной кислотой, трифторуксусной кислотой, дибензоил-L-винной кислотой и фосфорной кислотой.
Следует понимать, что во всех случаях упоминания фармацевтически приемлемые соли включают соли - продукты присоединения растворителя (сольваты) и кристаллические формы (полиморфные модификации), как это определено в тексте заявки, образованные той же самой солью - продуктом присоединения кислоты.
«Кристаллические формы» (или полиморфные модификации) означают кристаллические структуры, при образовании которых соединение может кристаллизоваться с образованием различных типов кристаллической упаковки, каждая из которых имеет тот же самый элементный состав. Различные кристаллические формы обычно характеризуются различными дифракционными рентгенограммами, различными инфракрасными спектрами, имеют различную температуру плавления, плотность, твердость, форму кристаллов, оптические и электрические свойства, стабильность и растворимость. Растворитель для перекристаллизации, скорость кристаллизации, температура хранения и иные факторы могут вызывать преобладание какой-либо одной кристаллической формы.
«Сольваты» означают формы - продукты присоединения растворителя, такие формы содержат либо стехиометрическое, либо нестехиометрическое количество растворителя. Некоторым соединениям присуща тенденция захватывать молекулы растворителя в фиксированном молярном соотношении, образуя таким образом в твердом кристаллическом состоянии сольваты. Если растворителем является вода, то образующийся сольват представляет собой гидрат, если растворителем является спирт, то образующийся сольват представляет собой алкоголят. Гидраты образуются при сочетании одной или более молекулы воды с одним из веществ, в котором вода остается в молекулярном состоянии в виде Н2О, при таких сочетаниях могут быть образованы один или более гидратов.
«Пролекарство» означает фармакологически неактивную форму соединения, которая должна претерпевать метаболизм in vivo, например, при воздействии биологических жидкостей или ферментов пациента, превращаясь в фармакологически активную форму соединения для того, чтобы произвести необходимый фармакологический эффект. Пролекарство может подвергнуться метаболизму до абсорбции, во время абсорбции, после абсорбции или на специфическом участке. Хотя метаболизм большинства соединений происходит первоначально в печени, почти все другие ткани и органы, в особенности легкое, способны в различной степени участвовать в метаболизме. Пролекарства как формы соединений могут быть использованы, например, для того, чтобы повысить биодоступность, сделать соединения более приемлемыми для пациента, например, посредством маскировки или уменьшения неприятных характеристик соединения, таких как горький вкус или раздражение желудочно-кишечного тракта, видоизменять растворимость, например, в случае внутривенного введения, обеспечивать возможность пролонгированного или замедленного высвобождения или доставки, облегчить приготовление композиции или сделать возможной сайт-специфическую доставку соединения. Пролекарства описаны в: The Organic Chemistry of Drug Design and Drug Action, by Richard B.Silverman, Academic Press, Design of Prodrugs San Diego, 1992. Chapter 8: «Prodrugs and Drug delivery Systems», pp.352-401, edited by H. Bundgaard, Elsevier Science, Amsterdam, 1985; Design of Biopharmaceutical Properties through Prodrugs and Analogs, Ed. by E.B.Roche, American Pharmaceutical Association, Washington, 1977; и в: Drug Delivery Systems, ed. by R.L.Juliano, Oxford Univ.Press, Oxford, 1980.
Термин «пациент» означает как млекопитающих, так и не млекопитающих. Термин «млекопитающие» относится к любому представителю класса. Млекопитающие, включая, но не ограничиваясь указанным, человека, а также не человекообразных приматов, например таких как шимпанзе, и включая других представителей человекообразных обезьян и не человекообразных приматов, таких как шимпанзе и другие виды обезьян; а также включая разводимых на фермах животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи, домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши, морские свинки и подобных животных. Примеры не млекопитающих включают, не ограничиваясь указанным, птиц и т.п.
Термин «терапевтически эффективное количество» означает количество соединения, которое при введении млекопитающему для лечения заболевания является достаточным для того, чтобы произошло указанное лечение заболевания. «Терапевтически эффективное количество» будет варьироваться в зависимости от конкретного соединения, заболевания и степени выраженности симптомов, возраста и состояния здоровья пациента, способа введения и формы, в которой вводится соединение, от решения лечащего врача или ветеринара и от других факторов.
Термин «фармакологический эффект» при использовании в тексте заявки указывает на эффект, достигаемый при воздействии на пациента в случае достижения предполагаемой цели терапии. В соответствии с одним из вариантов осуществления настоящего изобретения достижение фармакологического эффекта означает, что первичные показания, которые были у подвергавшегося лечению пациента, устранены, облегчены или уменьшены. Например, фармакологический эффект будет таким эффектом, который обеспечивает предупреждение, облегчение или уменьшение первичных показаний у подвергаемого лечению пациента. Согласно другому предпочтительному варианту осуществления настоящего изобретения достижение фармакологического эффекта означает, что нарушения, расстройства или симптомы, соответствующие первичным показаниям пациента, подвергаемого лечению, предотвращены, облегчены или уменьшены. Например, фармакологический эффект будет таким эффектом, который обеспечивает предотвращение или уменьшение первичных показаний у подвергаемого лечению пациента.
Термин «болезненное состояние» означает любое заболевание, состояние, симптом или показание.
Термин «лечение» болезненного состояния включает:
(1) предупреждение болезненного состояния, т.е. лечение приводит к тому, что у пациента не развиваются клинические симптомы заболевания, к появлению или проявлению которых предрасполагает заболевание, но которые пока еще не ощущаются или не проявляются как симптомы заболевания;
(2) подавление болезненного состояния, то есть приостановление или ослабление развития болезненного состояния или его клинических симптомов; или
(3) ослабление болезненного состояния, то есть временную или постоянную регрессию заболевания или его клинических симптомов.
Термин «антагонист» означает молекулу, например, такую как молекула соединения, лекарственного средства, ингибитора фермента или гормона, которая снижает или предотвращает действие другой молекулы или участка рецептора.
Термин «расстройства или нарушения мочевыводящих путей» или «уропатия», используемый взаимозаменяемо с термином «симптомы мочевыводящих путей», означает патологические изменения мочевыводящих путей. Симптомы мочевыводящих путей включают повышенную деятельность мочевого пузыря (также называемую гиперактивностью детрузора), затруднение мочеиспускания, недостаточность мочеиспускания, гиперчувствительность органов таза.
Термины «повышенная деятельность мочевого пузыря» и «гиперактивность детрузора» включают, но не ограничиваясь указанным, изменения, проявляющиеся как настойчивые позывы к мочеиспусканию, частое мочеиспускание, сниженный объем мочевого пузыря, недержание мочи и подобные им; а также изменения, уродинамически проявляющиеся в изменении объема мочевого пузыря, неполном мочеиспускании, нестабильном сокращении мочевого пузыря, спастике сфинктера и подобных симптомах, а также включают симптомы, обычно проявляющиеся при гиперрефлексии детрузора (нейрогенной дисфункции мочевого пузыря), такие как затруднение мочеиспускания, недостаточность мочеиспускания, гиперчувствительность органов таза или идиопатические состояния, такие как нестабильность детрузора и подобные им.
Термин «затруднение мочеиспускания » включает, но не ограничивается указанным, доброкачественную гипертрофию предстательной железы (ВРН), стриктуру уретры, опухоли и подобное. Обычно симптоматически это проявляется как затруднение мочеиспускания (низкая скорость мочеиспускания, затрудненное начало мочеиспускания и т.п.) или раздражение (настойчивые позывы к мочеиспусканию, надлобковая боль и т.п.).
Термин «недостаточность мочеиспускания» включает, но не ограничивается указанным, уретральную гипермобильность, недостаточность сфинктера или недержание мочи, обусловленные различными причинами. Симптоматически это обычно проявляется как недержание мочи при напряжении.
Термин «гиперчувствительность органов таза» включает, но не ограничивается указанным, боль в органах таза, интерстициальный (элементарный) цистит, простадинию, хроническое заболевание предстательной железы, вульвадинию, уретрит, орхиалгию и т.п. Симптоматически это обычно проявляется как боль, воспаление или дискомфорт в области тазовых органов и обычно включает симптомы, связанные с повышенной деятельностью мочевого пузыря.
В тексте заявки используются сокращения, которые имеют следующие значения:
Номенклатура
Система наименования и нумерации атомов в соединениях согласно настоящему изобретению представлена ниже:
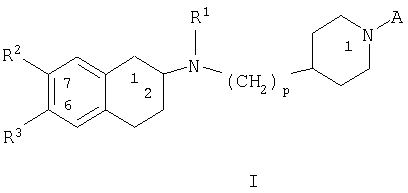
Номенклатура, используемая в данной заявке, в целом основывается на компьютерной системе «AUTONOM»™, версия 4, (разработка «Beilstein Institute») для установления названий по систематической номенклатуре ИЮПАК. Например, соединение общей формулы I, в которой R2 и R3 означают метокси, R1 означает пропил, р равно 1, А означает -C(O)R4 и R4 означает -N(СН3)2, будет названо «диметиламид 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты».
Среди соединений, являющихся предметом настоящего изобретения, некоторые соединения общей формулы I, или пролекарства, отдельные изомеры, рацемические или не рацемические смеси изомеров, или фармацевтически приемлемые соли или сольваты таких соединений являются предпочтительными.
Особенно предпочтительны соединения общей формулы I по п.1 формулы изобретения, в котором А представляет собой -C(O)R4 или -S(O)2R5;
R1 представляет собой (С1-С6)-алкил или аллил;
R2 и R3 независимо при каждом упоминании представляют собой водород, галоген, (С1-С6)-алкил, галоген(С1-С6)-алкил, -OR', -S(O)0-2R', -NR'R", -NR'COR", -NR'"CONR'R", -NR'SO2R", -NR'"SO2NR'R", -SO2NR'R", -OSO2R', нитро, циано, гетероарил или арил, указанные группы гетероарил или арил являются необязательно замещенными одной или более группами, выбранными из гидрокси, циано, (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, (С1-С6)-алкилтио, галогена, галоген(С1-С6)-алкила, гидрокси(С1-С6)-алкила, нитро, (С1-С6)-алкоксикарбонила, амино, моно- или ди(С1-С6)-алкиламино, (С1-С6)-алкилсульфонила, (С1-С6)-алкилкарбонила, моно- или ди(С1-С6)-алкиламиносульфонила, (С1-С6)-алкилсульфониламино, моно-или ди(С1-С6)-алкиламинокарбонила и (С1-С6)-алкилкарбониламино, при этом предполагается, что R2 и R3 одновременно не означают водород;
R', R" и R"' независимо при каждом упоминании представляют собой водород, (С1-С6)-алкил или (С3-С6)-циклоалкил, галогеналкил, арил или арил-(С1-С6)-алкил, указанная группа арил является необязательно замещенной одной или более группами, выбранными из гидрокси, циано, (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, (С1-С6)-алкилтио, галогена, галоген(С1-С6)-алкила, гидрокси(С1-С6)-алкила, нитро, (С1-С6)-алкоксикарбонила, амино, моно- или ди(С1-С6)-алкиламино, (С1-С6)-алкилсульфонила, (С1-С6)-алкилкарбонила, моно- или ди(С1-С6)-алкиламиносульфонила, (С1-С6)-алкилсульфониламино, моно- или ди(С1-С6)-алкил-аминокарбонила и (С1-С6)-алкилкарбониламино, гетероциклил, указанная группа гетероциклил является необязательно замещенной одной или более группами, выбранными из гидрокси, оксо, циано, (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, (С1-С6)-алкилтио, галогена и галоген(С1-С6)-алкила, гетероарил, указанная группа гетероарил является необязательно замещенной одной или более группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси и галогена,
или R' и R" вместе с атомом азота, к которому они присоединены, могут также образовывать 5-7-членное кольцо, которое может включать один дополнительный гетероатом, выбранный из О, N или S(O)0-2, указанное кольцо является незамещенным или замещенным одной или двумя группами (С1-С6)-алкил;
R4 представляет собой (С1-С6)-алкил, галоген(С1-С6)-алкил, бензилокси, дифенилметил,
-NRaRb, в котором Ra и Rb являются такими, как определено в тексте заявки,
-Y-гетероциклил, -Y-гетероарил, в которых указанные группы гетероциклил и гетероарил являются независимо друг от друга незамещенными или замещенными одной или более группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галогена, галоген(С1-С6)-алкила, (С1-С6)-алкилсульфонила, моно- или ди-(С1-С6)-алкиламиносульфонила и (С1-С6)-алкилсульфониламино, и указанный Y представляет собой связь или (С1-3)-алкилен;
Ra представляет собой водород, (С1-С6)-алкил, галоген(С1-С6)-алкил, циклоалкил или арил, указанные группы циклоалкил или арил каждая независимо друг от друга являются незамещенной или замещенной одной или более группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галогена, галоген(С1-С6)-алкила и алкил(С1-С6)-сульфонила,
или Ra и Rb вместе с атомом азота, к которому они присоединены, могут также образовывать 5-7-членное кольцо, которое может включать один дополнительный гетероатом, выбранный из О, N или S(O)0-2, указанное кольцо является незамещенным или замещенным одной или двумя группами (С1-С6)-алкил;
Rb представляет собой водород или (С1-С6)-алкил;
R5 представляет собой (С1-С6)-алкил, галоген(С1-С6)-алкил,
-NRaRb, в котором Ra и Rb являются такими, как определено выше, арил или гетероарил, указанные арил или гетероарил каждый независимо друг от друга является незамещенным или замещенным одной или двумя группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галогена и (С1-С6)-алкилсульфонила; и
р равно 1 или 2;
или отдельные изомеры, рацемические и не рацемические смеси изомеров, или фармацевтически приемлемые соли или сольватам этих соединений.
Согласно предпочтительному варианту осуществления соединения формулы I согласно настоящему изобретению представляют собой соединения, в которых А означает -C(O)R4.
В соответствии с этим предпочтительным вариантом осуществления настоящего изобретения предпочтительную группу соединений формулы I представляют соединения, в которых R4 означает -NRaRb, более предпочтительно, в которых R4 означает -NRaRb, и Ra представляет собой (С1-С6)-алкил или арил, и Rb представляет собой водород или (С1-С6)-алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, могут также образовывать 5-7-членное кольцо, которое может включать один дополнительный гетероатом, выбранный из О, N или S(O)0-2, указанное кольцо является незамещенным или замещенным одной или двумя группами (С1-С6)-алкил.
Другой предпочтительной группой соединений, входящей в объем этого предпочтительного варианта осуществления настоящего изобретения, являются соединения, в которых R4 означает -NRaRb, а Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пиперидиновую, пирролидиновую или пиперазиновую кольцевую систему, указанные пиперидиновая, пирролидиновая или пиперазиновая кольцевые системы являются незамещенными или замещенными одной или двумя группами (С1-С6)-алкил.
Другой предпочтительной группой соединений формулы I, входящей в объем этого предпочтительного варианта осуществления настоящего изобретения, являются соединения, в которых R4 означает -NRaRb, и Ra и Rb вместе с атомом азота, к которому они присоединены, образуют морфолиновую кольцевую систему, указанная морфолиновая кольцевая система является незамещенной или замещенной одной или двумя группами (С1-С6)-алкил.
Согласно другому предпочтительному варианту осуществления настоящего изобретения предпочтительны соединения формулы I, в которых фрагмент А означает -C(O)R4, и R4 означает (С1-С6)-алкил или галоген(С1-С6)-алкил.
Согласно другому предпочтительному варианту осуществления настоящего изобретения фрагмент А означает -C(O)R4, и R4 означает -Y-гетероциклил, или -Y-гетероарил, и -Y- означает связь или (С1-3)алкилен. Предпочтительной группой соединений в объеме этого варианта осуществления настоящего изобретения являются соединения, в которых гетероарильную группу выбирают из фурана, тиофена, изоксазола, оксазола или имидазола, а согласно другому варианту осуществления настоящего изобретения предпочтительной группой соединений являются такие соединения, в которых гетероциклильная группа представляет собой пиперидиновую группу, которая является незамещенной или замещенной одной или более группами (С1-С6)-алкил.
Согласно другому предпочтительному варианту осуществления соединения формулы I согласно настоящему изобретению представляют собой соединения, в которых фрагмент А означает -S(O)2R5.
В объеме этого предпочтительного варианта осуществления настоящего изобретения предпочтительной группой соединений формулы I являются соединения, в которых R5 означает (С1-С6)-алкил или галоген(С1-С6)-алкил.
В объеме этого предпочтительного варианта осуществления настоящего изобретения предпочтительной группой соединений формулы I являются соединения, в которых R5 означает -NRaRb, более предпочтительно в которых R5 означает -NRaRb, и Ra представляет собой (С1-С6)-алкил или арил, а Rb представляет собой водород или (С1-С6)-алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, могут также образовывать 5-7-членное кольцо, которое может включать один дополнительный гетероатом, выбранный из О, N или S(O)0-2, указанное кольцо является незамещенным или замещенным одной или двумя группами (С1-С6)-алкил.
Согласно другому предпочтительному варианту осуществления настоящего изобретения фрагмент А означает -S(O)2R5, и R5 представляет собой арил, более предпочтительно R5 представляет собой фенил, который является незамещенным или замещенным одной или более группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галогена и (С1-С6)-алкилсульфонила.
Согласно другому предпочтительному варианту осуществления настоящего изобретения фрагмент А означает -S(O)2R5, и R5 представляет собой гетероарил, и даже более предпочтительно, если указанный гетероарил выбирают из группы, включающей фуран, тиофен, изоксазол, оксазол и имидазол, каждый представитель группы является незамещенным или замещенным одной или двумя группами (С1-С6)-алкил.
Согласно другому предпочтительному варианту осуществления соединения формулы I согласно настоящему изобретению представляют собой соединения, в которых R2 и R3 представляют собой -OR', -NO2, -OSO2R', арил или водород, при этом предполагается, что R2 и R3 одновременно не представляют собой водород; более предпочтительно R2 и R3 представляет собой водород или -OR', где R' означает (С1-С6)-алкил или галоген(С1-С6)-алкил, при этом предполагается, что R2 и R3 одновременно не представляют собой водород.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения соединения формулы I представляют собой соединения, в которых R1 представляет собой (С1-С6)-алкил; более предпочтительно R1 представляет собой этил или пропил.
Примеры предпочтительных соединений или индивидуальных изомеров, рацемических или нерацемических смесей изомеров, фармацевтически приемлемых солей или сольватов таких соединений включают:
(7-бром-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин;
(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)пиперидин-4-илметанон;
(1-метансульфонилпиперидин-4-илметил)-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин;
диметиламид 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты;
(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон;
(1-метансульфонилпиперидин-4-илметил)-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин; и
(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон.
Соединения согласно настоящему изобретению могут быть получены способами, отраженными на схемах реакций синтеза, которые приведены для иллюстрации, указанные схемы представлены и описаны ниже.
Исходные вещества и реагенты, которые используют при получении таких соединений, являются либо коммерчески доступными от производителей, таких как «Aldrich Chemical Co.», или могут быть получены способами, известными специалисту в данной области техники. Следующие методики описаны в источниках, приведенных в качестве ссылки, таких как: Fieser and Fieser, "Reagents for Organic Synthesis"; Wiley & Sons: New York, 1991, Volumes 1-15; Rodd, "Chemistry of Carbon Compounds", Elsevier Science Publishers, 1989, Volumes 1-5 and Supplementals; а также в "Organic Reactions", Wiley & Sons: New York, 1991, Volumes 1-40. Следующие схемы реакций синтеза являются только иллюстрациями некоторых способов, которыми могут быть получены соединения согласно настоящему изобретению; при этом возможны многочисленные модификации таких схем реакций синтеза, которые будут очевидны специалисту в данной области техники, обратившемуся к описанию, которое представлено в данной заявке.
Исходные вещества и промежуточные продукты взаимодействия могут быть выделены и очищены, если возникнет такая необходимость, с использованием общеизвестных способов, включающих, но не ограничиваясь этим, фильтрацию, перегонку, кристаллизацию, хроматографию и подобные им способы. Такие вещества могут быть описаны с использованием общеизвестных характеристик, включая физические константы и данные спектрального анализа.
Если не указано иное, то реакции, описанные в тексте заявки, предпочтительно проводят при атмосферном давлении в температурном интервале от приблизительно -78°С до приблизительно 150°С, более предпочтительно от приблизительно 0°С до приблизительно 125°С и наиболее предпочтительно и удобно при приблизительно комнатной температуре (или температуре окружающей среды), например при приблизительно 20°С.
Схема А
На схеме А представлен общий случай способа получения соединений общей формулы I, в которой R1, R2, R3, А и р являются такими, как определено выше в тексте заявки.
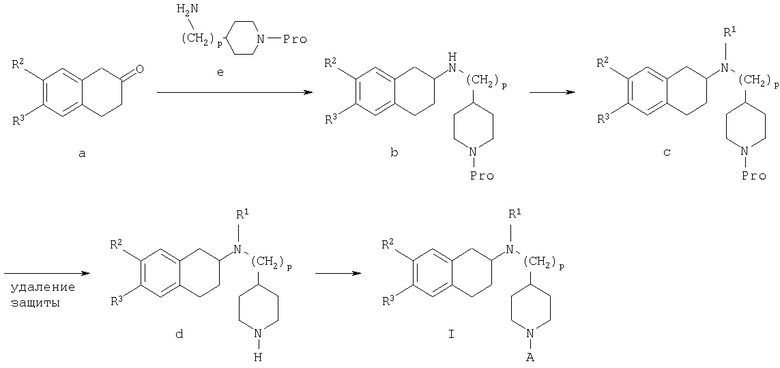
Соединение формулы (b) в общем случае может быть получено посредством взаимодействия тетралона формулы (а) с защищенным аминопиперидином общей формулы (е) в условиях реакции восстановительного аминирования. Подходящие условия реакции восстановления включают присутствие триацетоксиборгидрида натрия, цианоборгидрида натрия, изопропоксида титана и цианоборгидрида натрия, присутствие водорода и металлического катализатора, а также агентов - переносчиков водорода, таких как циклогексен, муравьиная кислота и ее соли, цинк и хлороводородная кислота или муравьиная кислота, или присутствие сульфида борана с последующей обработкой муравьиной кислотой. Подходящие органические растворители для проведения реакций включают дихлорметан, 1,2-дихлорэтан, тетрагидрофуран, спирты или этилацетат и подобные им вещества. Предпочтительно реакции проводят в основной среде в присутствии триацетоксиборгидрида натрия в 1,2-дихлорэтане. Методики восстановительного аминирования описаны в химической литературе. Например, в J. Org. Chem. 1996, 61, 3849 и в Tetrahedron Letters 1996, 37, 3977 описаны способы использования триацетоксиборгидрида натрия в качестве реагента для восстановительного аминирования альдегидов для получения широкого класса аминов.
Соединение формулы (b) далее подвергают взаимодействию в условиях реакции восстановительного аминирования, описанных в тексте заявки, с подходящим карбоксиальдегидом, с получением при этом в общем случае соединение формулы (с), которое после снятия защиты с пиперидиновой группы в условиях, хорошо известных специалисту в данной области техники, как это описано в тексте заявки, могут претерпевать ацилирование, алкилирование или сульфонирование под действием хлорангидрида R4С(O)Cl, карбамоилхлорида R4COCl, изоцианата R4СО или сульфонилхлорида R5S(O)2Cl соответственно, в указанных формулах R4 и R5 являются такими, как определено выше в тексте заявки, в условиях, хорошо известных специалисту в данной области техники, с получением в общем случае соединения формулы I согласно настоящему изобретению.
Общеизвестные исходные вещества, указанные на схеме А, являются коммерчески доступными или легко могут быть синтезированы специалистом в данной области техники.
Соединения, которые действуют как антагонисты мускариновых рецепторов, использовали для лечения некоторых болезненных состояний, связанных с недостаточной деятельностью гладкой мускулатуры. До недавнего времени большинство этих соединений было неселективным в отношении различных мускариновых рецепторов, что приводило к нежелательным антихолинергетическим побочным эффектам, таким как сухость во рту, запор, нечеткое зрительное восприятия или тахикардия. Наиболее частым из этих побочных эффектов является сухость во рту вследствие блокирования мускариновых рецепторов слюнной железы. Недавно созданные специфические антагонисты М2 и/или М3 рецепторов, как было показано, обладают меньшими побочными эффектами. Данные подтверждают, что преимущественная блокада М2 и/или М3 рецепторов по отношению к М5 рецептору могла бы быть терапевтически эффективной при лечении болезненных состояний, связанных с расстройством функционирования гладкой мускулатуры, например, таких как нарушения или расстройства функционирования мочеполового тракта, расстройства функционирования дыхательных путей, расстройства деятельности гладкой мускулатуры и когнитивные и нейродегенеративные расстройства.
Нарушения или расстройства функционирования мочеполового тракта, для лечения которых возможно использовать соединения согласно настоящему изобретению, более конкретно включают повышенную деятельность мочевого пузыря или гиперактивность детрузора (сжимателя) и их симптомы, например, такие как изменения, симптоматически проявляющиеся как настойчивые позывы к мочеиспусканию, частое мочеиспускание, сниженный объем мочевого пузыря, недержание мочи и подобные им, изменения, уродинамически проявляющиеся в изменении объема мочевого пузыря, неполном мочеиспускании, нестабильном сокращении мочевого пузыря, спастике сфинктера и подобных симптомах, а также симптомы, обычно проявляющиеся при гиперрефлексии детрузора (нейрогенной дисфункции мочевого пузыря), такие как затруднение мочеиспускания, недостаточность мочеиспускания, гиперчувствительность органов таза или идиопатические состояния, такие как нестабильность детрузора и т.п.
Нарушения или расстройства желудочно-кишечного тракта, для лечения которых возможно использовать соединения согласно настоящему изобретению, более конкретно включают синдром повышенной раздражимости толстой кишки, дивертикулез, ахалазию, гипермобильность желудочно-кишечного тракта и диарею.
Нарушения или расстройства функционирования дыхательных путей, для лечения которых возможно использовать соединения согласно настоящему изобретению, более конкретно включают хроническое обструктивное легочное заболевание, включая хронический бронхит, эмфизему, астму и фиброз легкого.
Соединения, селективные в отношении М2 мускаринового рецептора, как было показано, также могут быть использованы для лечения когнитивных и нейродегенеративных заболеваний, например, таких как болезнь Альцгеймера, что описано в статье: J. Med. Chem., 1993, v.36, р.3734-3737. В патенте US №6294554 описаны мускариновые анатагонисты, используемые для лечения когнитивных нарушений и расстройств.
Этот и другие виды терапевтического применения описаны, например, в: Goodman & Gilman, The Pharmacological Basis of Therapeutics, ninth edition, 1996, McGraw-Hill, New York, Chapter 26:601-616; и в Coleman, R.A., Pharmacological Reviews 1994, 46, 205-229.
Соединения согласно настоящему изобретению являются антагонистами мускаринового рецептора. Сродство исследуемых соединений согласно настоящему изобретению к мускариновому рецептору может быть определено при использовании методики исследования in vitro - при исследовании связывания, в котором используют препарат клеточных мембран из овариальных клеток китайских хомяков, экспрессирующих рекомбинантные мускариновые рецепторы человека (M1-M5), эта методика более подробно описана в примере 18.
Антагонистические свойства исследуемых соединений в отношении мускариновых рецепторов могут быть установлены при проведении исследования in vivo, в котором определяют ингибирующую активность в отношении мускариновых рецепторов, являющихся медиаторами выделения слюны у крыс, находящихся под анестезией, эта методика описана более подробно для оксотреморин/пилокарпин-индуцированного слюноотделения (OIS/PIS) на модели у анестезированных крыс, пример 19.
Антагонистические свойства исследуемых соединений в отношении мускариновых рецепторов могут быть установлены при проведении исследования in vivo, в котором определяют ингибирующую активность в отношении мускариновых рецепторов, которые являются медиаторами сокращения мочевого пузыря у анестезированных крыс, что описано более подробно для исследования ингибирования, индуцированного введенным объемом сокращения мочевого пузыря, пример 20.
Антагонистические свойства исследуемых соединений в отношении мускариновых рецепторов могут быть определены при проведении исследования in vivo, в котором определяют ингибирующую активность в отношении мускариновых рецепторов, которые являются медиаторами сокращения мочевого пузыря и слюноотделения у анестезированных собак, это описано более подробно в примере 21.
Антагонистические свойства исследуемых соединений в отношении мускариновых рецепторов при использовании соединений в качестве бронходилаторных агентов могут быть определены посредством проведения исследования in vivo на анестезированных крысах, как это описано более подробно в примере 22.
Настоящее изобретение относится к фармацевтическим композициям, включающим по меньшей мере одно соединение согласно настоящему изобретению, или пролекарство, или индивидуальный изомер, рацемическую и не рацемическую смесь изомеров, или их фармацевтически приемлемые соли или сольваты вместе с фармацевтически приемлемым носителем и необязательно другими терапевтическими или профилактическими ингредиентами.
Как правило, соединения согласно настоящему изобретению вводят в терапевтически эффективном количестве, используя какой-либо способ введения, принятый для введения агентов, которые используются в тех же целях. Подходящие интервалы дозировок составляют обычно 1-500 мг в день, предпочтительно 1-100 мг в день, и наиболее предпочтительно 1-30 мг в день, в зависимости от множества факторов, таких как степень выраженности симптомов заболевания, которое подлежит лечению, возраста и относительного здоровья пациента, эффективности используемого соединения, способа введения и формы, используемой для введения, а также показаний, в отношении которых осуществляется введение, и предпочтений и имеющегося опыта лечащего врача. Специалист в области лечения таких заболеваний сможет без проведения чрезмерных экспериментов, опираясь на имеющиеся у него знания и раскрытие изобретения в описании данной заявки, установить терапевтически эффективное количество соединений согласно настоящему изобретению, которое необходимо использовать при данном заболевании. Как правило, соединения согласно настоящему изобретению вводят в виде фармацевтических композиций, включающих такие подходящие для перорального (включая трансбуккальное и подъязычное), ректального, назального, местного, легочного, вагинального, трансдермального или парентерального (включая внутримышечное, внутриартериальное, интратрахеальное, подкожное и внутривенное) введения или в форме, пригодной для введения посредством ингаляции или инсуффляции. Предпочтительный способ введения, как правило, является пероральным, с использованием общепринятого режима дневных дозировок, который может быть отрегулирован в зависимости от степени выраженности заболевания.
Соединение или соединения согласно настоящему изобретению, вместе с одним или более общепринятым вспомогательным веществом, носителем или разбавителем могут быть представлены в виде фармацевтических композиций или единичных дозированных форм. Фармацевтические композиции или единичные дозированные формы могут включать обычные ингредиенты в общепринятых соотношениях, с использованием или без использования дополнительных активных соединений или составных частей, и единичные дозированные формы могут содержать любое подходящее эффективное количество активного ингредиента, соответствующее предполагаемому интервалу используемых дневных дозировок. Фармацевтические композиции могут быть использованы в виде твердых форм, таких как таблетки или наполненные капсулы, полутвердые продукты, порошки, составы с замедленным высвобождением или жидкости, такие как растворы, суспензии, эмульсии, эликсиры или наполненные капсулы для перорального использования; или в виде суппозиториев для ректального или вагинального введения; или в виде стерильных растворов для инъекций, предназначенных для парентерального введения. Композиции, содержащие приблизительно один (1) миллиграмм активного ингредиента, или более широко, от приблизительно 0,01 до приблизительно ста (100) миллиграммов активного ингредиента на таблетку, таким образом являются подходящими типичными единичными дозированными формами.
Соединения согласно настоящему изобретению могут быть введены в состав самых разнообразных дозированных форм для перорального ведения. Фармацевтические композиции и дозированные формы могут включать в качестве активного ингредиента соединение или соединения согласно настоящему изобретению или их фармацевтически приемлемые соли. Фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в твердом состоянии включают порошки, таблетки, пилюли, капсулы, драже, суппозитории и мелкие гранулы. Твердым носителем может быть одно или более веществ, которые могут выполнять функцию разбавителей, веществ, улучшающих вкус и запах, солюбилизаторов, смазывающих веществ, суспендирующих агентов, связующих, консервантов, агентов, способствующих распадаемости таблеток, или являться материалом капсул. В случае порошков носитель, как правило, представляет собой тонко измельченное твердое вещество, которое находится в смеси с тонко измельченным активным компонентом. В случае таблеток активный компонент, как правило, смешивают в подходящих соотношениях с носителем, имеющим необходимую способность к связыванию, и прессуют с получением при этом необходимой формы и размера. Порошки и таблетки предпочтительно содержат от приблизительно одного (1) до приблизительно семидесяти (70) процентов активного соединения. Подходящие носители включают, но не ограничиваются указанным, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатину, трагакантовую камедь, метилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, низкоплавкий воск, масло какао и т.п. Термин «препарат», как предполагается, включает композицию активного соединения с инкапсулирующим материалом в качестве носителя, при этом получают капсулу, в которой активный компонент, с носителем или без носителей, окружен носителем, который входит в композицию. Аналогичным образом, в объем изобретения входят драже и леденцы. Таблетки, порошки, капсулы, пилюли, драже и леденцы можно рассматривать как твердые формы, подходящие для перорального введения.
Другие формы, подходящие для перорального введения, включают препараты, находящиеся в жидком состоянии, такие как эмульсии, сиропы, эликсиры, водные растворы, водные суспензии или препараты в твердом состоянии, которые, как предполагается, перед употреблением могут быть быстро переведены в препарат, находящийся в жидком состоянии. Для получения эмульсий могут быть использованы растворы, например водный раствор пропиленгликоля, либо эмульсии могут содержать эмульгирующие агенты, например, такие как лецитин, моноолеат сорбита или акацию. Водные растворы могут быть получены растворением активного компонента в воде, с добавлением подходящего окрашивающего агента, вещества, улучшающего вкус и запах, стабилизатора и загустителя. Водные суспензии могут быть получены диспергированием тонко измельченного активного компонента в воде с добавлением вязкого вещества, например, такого как природные или синтетические смолы, полимеры, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и другие известные суспендирующие агенты. Препараты в жидкой форме включают растворы, суспензии и эмульсии и могут содержать, в дополнение к активному ингредиенту, подкрашивающие вещества, вещества, улучшающие вкус и запах, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие агенты, загустители, солюбилизирующие агенты и т.п.
Соединения согласно настоящему изобретению могут быть использованы в составе композиции для парентерального введения (например, посредством инъекции или непрерывной инфузии) и могут быть представлены как единичная дозированная форма и находиться в ампулах, предварительно наполненных шприцах, в виде небольших объемов для инфузии или могут находиться в контейнерах для многократного дозирования с добавлением консервантов. Композиции также могут находиться в виде суспензий, растворов или эмульсий на масляной или водной основе, например в виде растворов в водном полиэтиленгликоле. Примеры маслообразных или неводных носителей, разбавителей, растворителей или наполнителей включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло), пригодные для инъекций органические сложные эфиры (например, этилолеат) и могут содержать вспомогательные агенты, такие как консерванты, агенты, улучшающие смачиваемость, эмульгаторы или суспендирующие агенты, стабилизаторы и/или диспергирующие агенты. В качестве альтернативы активный ингредиент может находиться в виде порошка, полученного асептическим выделением стерильного твердого вещества или посредством лиофилизации из раствора для приготовления перед употреблением с использованием подходящего наполнителя, например стерильной апирогенной воды.
Соединения согласно настоящему изобретению могут быть использованы в составе композиции для местного введения в эпидермис в виде мазей, кремов и лосьонов или в качестве трансдермального пластыря. Мази и кремы могут быть, например, выполнены на водной или масляной основе с добавлением подходящего загустителя и/или агента гелеобразования. Лосьоны могут быть выполнены на водной или масляной основе и, как правило, также содержат один или более эмульгаторов, стабилизаторов, диспергирующих агентов, суспендирующих агентов, загустителей или подкрашивающих веществ. Композиции, подходящие для местного введения - введения через рот, включают леденцы, содержащие активные ингредиенты, введенные в основу, обладающую определенным вкусом и запахом, обычно смолу акации или трагакантовую камедь; пастилки, включающие активный ингредиент, введенный в инертную основу, например, такую как желатина и глицерин или сахароза и смола акации; а также жидкости для полоскания горла, включающие активный ингредиент в подходящем жидком носителе.
Соединения согласно настоящему изобретению могут быть использованы в составе композиции для введения в виде суппозиториев. Сначала размягчают низкоплавкую воскообразную основу, например, такую как смесь глицеридов жирных кислот или масло какао, а затем гомогенно диспергируют активный компонент, например при перемешивании. Затем размягченную гомогенную смесь выливают в формы подходящего размера и дают остыть и затвердеть.
Соединения согласно настоящему изобретению могут быть использованы в составе композиции для назального введения. Растворы и суспензии используют для введения непосредственно в носовую полость с помощью обычных средств, например, используя пипетку, капельницу или спрей. Композиции могут быть представлены в виде формы для однократного введения или для многократного дозирования. В последнем случае при использовании капельницы или пипетки это может быть осуществлено самим пациентом при введении подходящего, предварительно установленного объема раствора или суспензии. В случае спрея дозирование может быть осуществлено, например, с помощью дозирующего устройства для распыления.
Соединения согласно настоящему изобретению могут быть использованы в составе композиции для введения в виде аэрозоля, в частности для введения в дыхательные пути, включая интраназальное введение. Соединение, как правило, будет характеризоваться небольшим размером частиц, например порядка пяти (5) микрон или менее. Частицы такого размера могут быть получены при использовании средств, известных из предшествующего уровня техники, например, с использованием микроизмельчения. Активный ингредиент помещают в упаковку, находящуюся под давлением и содержащую подходящую сжатую жидкость, например, такую как хлорфторуглерод (CFC), например дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, или диоксид углерода или другой подходящий газ. Аэрозоль также вполне может содержать поверхностно-активное вещество, такое как лецитин. Доза лекарственного средства может регулироваться с помощью дозирующего клапана. В качестве альтернативы активные ингредиенты могут быть представлены в виде сухого порошка, например в виде порошкообразной смеси соединения с подходящим порошком-основой, например, таким как лактоза, крахмал, производные крахмала, такие как гидроксипропилметилцеллюлоза и поливинилпирролидин (PVP). Порошок-носитель в носовой полости будет образовывать гель. Порошкообразная композиция может быть представлена в виде единичной дозированной формы, например, в капсулах или в картриджах, например, из желатины, или в виде в виде блистерной упаковки, из которой порошок может вводиться посредством ингалятора.
Соединения согласно настоящему изобретению могут быть использованы в составе композиции для трансдермального или подкожного введения с использованием введения в виде систем доставки лекарственного средства. Такие системы доставки лекарственного средства предпочтительны в тех случаях, когда необходимо замедленное высвобождение соединения, и в том случае, когда контактность больного является критическим фактором, определяющим режим введения. Соединения в системах трансдермальной часто «прикрепляют» к приклеивающемуся к коже твердому носителю. Соединение, представляющее интерес, может быть объединено с веществом, облегчающим проникновение, например, используя азон(1-додецилазациклогептан-2-он). Системы замедленного высвобождения вводят подкожно в подкожный слой посредством хирургической операции или посредством инъекции. В случае подкожных имплантатов соединение вводят в растворимую в липидах мембрану, например в силиконовый каучук или биодеградируемый полимер, например, такой как полимерная α-оксипропионовая кислота.
Фармацевтические препараты предпочтительно находятся в виде единичных дозированных форм. При изготовлении такой формы композицию подразделяют на единичные дозы, содержащие соответствующее количество активного компонента. Единичная дозированная форма может представлять собой препарат в упаковке; упаковку, содержащую дискретные дозы препарата, такие как таблетки в упаковке, капсулы и порошки во флаконах или ампулах. Единичная дозированная форма также может непосредственно представлять собой капсулу, таблетку, драже или леденец или подходящее количество любой из этих форм в упакованном виде.
Другие фармацевтические носители и композиции и их использование описаны в: Remington, The Science and Practice of Pharmacy, edited by E.W.Martin, Mack Publishing Company, 19th edition, 1995, Easton, Pennsylvania.
Типичные фармацевтические композиции, содержащие соединение согласно настоящему изобретению, описаны в примерах 11-17.
Следующие подготовительные примеры и примеры приводятся для того, чтобы специалист в данной области техники смог лучше понять и осуществить настоящее изобретение. Эти примеры не следует рассматривать как ограничение объема изобретения, они служат лишь иллюстрацией и являются наиболее характерными.
Пример 1
Изопропиламид 4-({этил-[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты
Стадия 1: трет-бутиловый эфир 4-[(7-нитро-1,2,3,4-тетрагидронафталин-2-иламино)метил] пиперидин-1-карбоновой кислоты
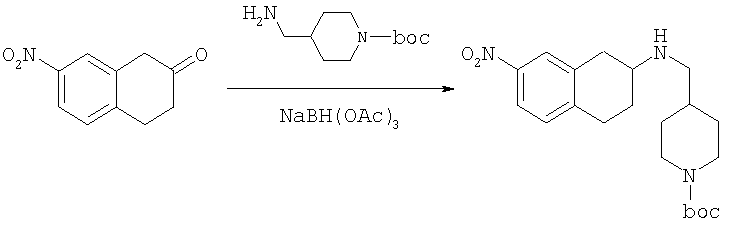
К раствору 7-нитро-3,4-дигидро-1H-нафталин-2-она (600 мг, 2,98 ммоль), получен согласно J.Med.Chem., 1989, 32(9), 2128-34, и трет-бутилового эфира 4-аминометилпиперидин-1-карбоновой кислоты (700 мг, 3,3 ммоль) в дихлорэтане (50 мл) в атмосфере азота в один прием добавляют триацетоксиборгидрид натрия (1,4 г, 6,5 ммоль, 2 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc (100 мл) и 5%-ным водным раствором КОН (50 мл). Водный слой дважды экстрагируют, используя EtOAc (2×50 мл). Объединенные органические слои промывают насыщенным раствором соли, высушивают над MgSO4, фильтруют и концентрируют, получая при этом темное маслянистое вещество. После экспресс-хроматографии на силикагеле с элюированием смесью 5% метанол/метиленхлорид получают трет-бутиловый эфир 4-[(7-нитро-1,2,3,4-тетрагидронафталин-2-иламино)метил]пиперидин-1-карбоновой кислоты в виде маслянистого вещества (790 мг).
Стадия 2: трет-бутиловый эфир 4-{[этил-(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)амино]метил}пиперидин-1-карбоновой кислоты
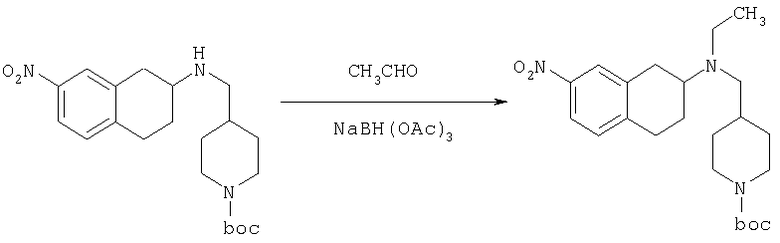
К раствору трет-бутилового эфира 4-[(7-нитро-1,2,3,4-тетрагидронафталин-2-иламино)метил]пиперидин-1-карбоновой кислоты (485 мг, 1,25 ммоль) и ацетальдегида (110 мкл, 1,49 ммоль) в дихлорэтане (20 мл) в атмосфере азота в один прием добавляют триацетоксиборгидрид натрия (530 мг, 2,49 ммоль, 2 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, затем концентрируют в вакууме. Остаток разделяют между EtOAc (75 мл) и 5%-ным водным раствором КОН (50 мл). Водную фазу дважды экстрагируют, используя EtOAc (2×30 мл). Объединенные органические слои высушивают над MgSO4, фильтруют и концентрируют на силикагеле (10 г). Полученное вещество помещают на колонку для экспресс-хроматографии и элюируют, используя 20% ацетона в гексане. Фракции, содержащие целевое вещество, объединяют и концентрируют, получая при этом трет-бутиловыи эфир 4-{[этил-(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)амино]метил}пиперидин-1-карбоновой кислоты в виде желтого маслянистого вещества (430 мг).
Стадия 3: трет-бутиловый эфир 4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)-этиламино]метил}пиперидин-1-карбоновой кислоты
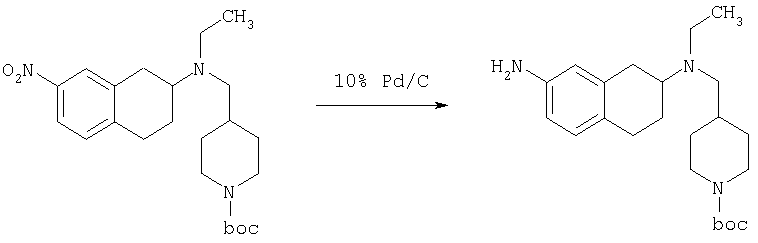
К раствору трет-бутилового эфира 4-{[этил-(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)амино]метил}пиперидин-1-карбоновой кислоты (490 мг, 1,2 ммоль) в этаноле (30 мл) добавляют 10%-ный палладий на углероде (50 мг). Раствор встряхивают, используя встряхивающее устройство Парра, в течение 24 ч при давлении водорода 55 фунт/кв. дюйм. Раствор фильтруют через целит и концентрируют, получая при этом трет-бутиловый эфир 4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)-этиламино]метил}пиперидин-1-карбоновой кислоты в виде маслянистого вещества (405 мг), которое непосредственно используют на следующей стадии.
Стадия 4: трет-бутиловый эфир 4-({этил-[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты
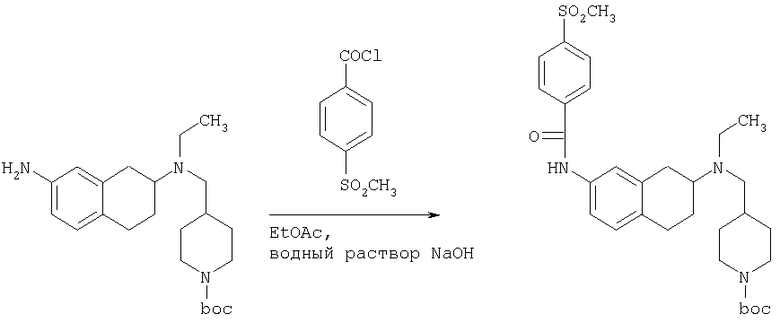
К раствору трет-бутилового эфира 4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)-этиламино]метил}пиперидин-1-карбоновой кислоты (1,5 г, 3,87 ммоль) в EtOAc (50 мл) и 20%-ному водному раствору карбоната калия (50 мл) по каплям добавляют 4-метансульфонилбензоилхлорид (760 мг, 4,1 ммоль) в EtOAc (75 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи и слои разделяют. Слой с EtOAc концентрируют на силикагеле и помещают на колонку для экспресс-хроматографии. Колонку элюируют, используя 35% ацетона в гексане. Фракции, содержащие вещество, объединяют и концентрируют, получая при этом трет-бутиловый эфир 4-({этил-[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты в виде светло-розового твердого вещества (1,33 г).
Стадия 5: N-[7-(этилпиперидин-4-илметил-амино)-5,6,7,8-тетрагидронафталин-2-ил]-4-метансульфонилбензамид
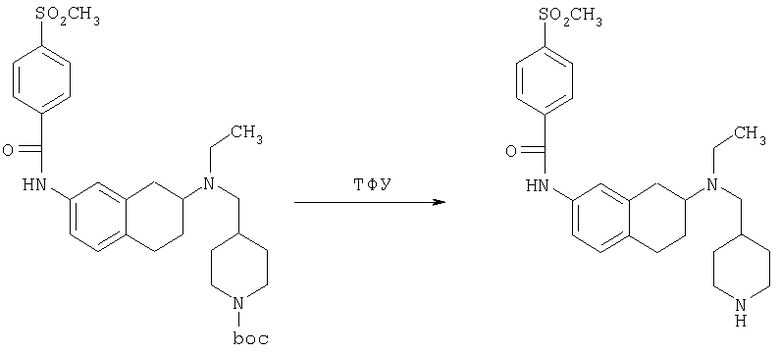
К раствору трет-бутилового эфира 4-({этил-[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты (1,33 г, 2,3 ммоль) в метиленхлориде (30 мл) в атмосфере азота добавляют трифторуксусную кислоту (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют в вакууме. Остаток разделяют между EtOAc (50 мл) и 10%-ным водным раствором КОН (50 мл), органический слой отделяют, высушивают над MgSO4, фильтруют и концентрируют, получая при этом N-[7-(этилпиперидин-4-илметил-амино)-5,6,7,8-тетрагидронафталин-2-ил]-4-метансульфонилбензамид (1,02 г). [М+Н]+=470.
Стадия 6: изопропиламид 4-({этил-[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты
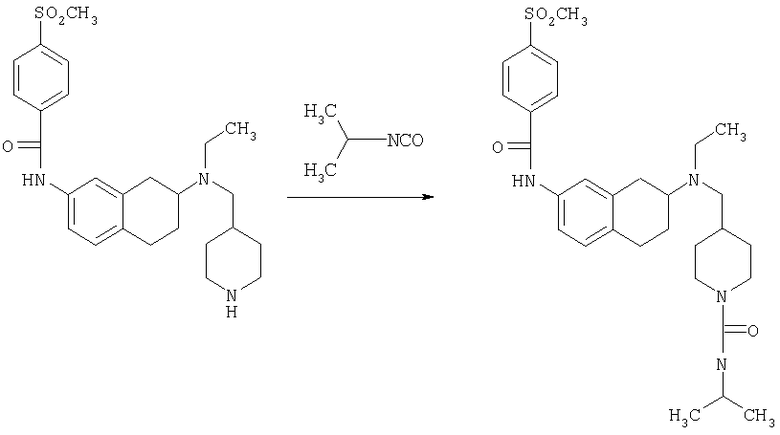
К охлаждаемому на бане со льдом раствору N-[7-(этилпиперидин-4-илметил-амино)-5,6,7,8-тетрагидронафталин-2-ил]-4-метансульфонилбензамида (1,3 г, 2,3 ммоль) в метиленхлориде (40 мл) в атмосфере азота в один прием добавляют триэтиламин (1,3 мл, 9,2 ммоль, 4 экв.), затем изопропилизоцианат (0,33 мл, 3,3 ммоль, 1,4 экв.). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 24 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc (75 мл) и 10%-ным водным раствором гидроксида натрия (40 мл). Водный слой экстрагируют, используя EtOAc (2×30 мл), и объединенные слои с EtOAc высушивают над MgSO4, фильтруют и концентрируют. После растирания с эфиром получают изопропиламид 4-({этил-[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты (1) в виде светло-розового твердого вещества (1,1 г). [М+Н]+=555.
В соответствии с методикой, описанной выше в примере 1, но заменяя на стадии 6 изопропилизоцианат на другие подходящие изоцианаты, получают следующие соединения:
N-(7-{этил[1-(морфолин-4-карбонил)пиперидин-4-илметил]амино}-5,6,7,8-тетрагидронафталин-2-ил)-4-метансульфонилбензамид, (2), [М+Н]+=583;
диэтиламид4-({этил[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (3), [М+Н]+=569;
метиламид 4-({этил[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (4), [М+Н]+=527;
фениламид 4-({этил[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (5), [М+Н]+=589 и
амид 4-({этил[7-(4-метансульфонилбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (6), [М+Н]+=513.
Пример 2
Изопропиламид 4-({этил-[7-(4-фторбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты
Стадия 1: трет-бутиловый эфир 4-({этил-[7-(2,2,2-трифторацетиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты
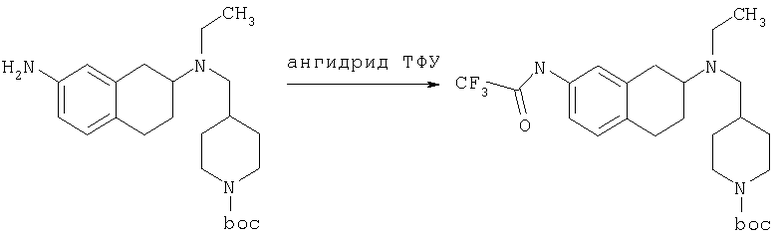
К раствору трет-бутилового эфира 4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)этиламино] метил } пиперидин-1-карбоновой кислоты (2,3 г, 5,36 ммоль) в метиленхлориде (30 мл) при перемешивании в инертной атмосфере добавляют пиридин (0,9 мл, 10,7 ммоль) и трифторуксусный ангидрид (1,0 мл, 6,96 ммоль) и раствор оставляют при перемешивании при комнатной температуре в течение 20 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc и водой. Органический слой промывают насыщенным раствором соли, высушивают (MgSO4) и концентрируют. Неочищенный продукт реакции подвергают экспресс-хроматографии на силикагеле, элюируя 20% ацетона в гексане, с получением при этом трет-бутилового эфира 4-({этил-[7-(2,2,2-трифтор-ацетиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты в виде оранжевого маслянистого вещества (1,2 г).
Стадия 2: N-[7-(этилпиперидин-4-илметиламино)-5,6,7,8-тетрагидронафталин-2-ил]-2,2,2-трифторацетамид
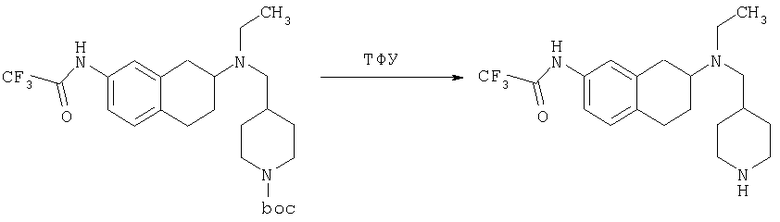
К раствору трет-бутилового эфира 4-({этил-[7-(2,2,2-трифтор-ацетиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты (800 мг, 1,7 ммоль) в метиленхлориде (20 мл) в инертной атмосфере добавляют трифторуксусную кислоту (5 мл) и оставляют раствор перемешиваться при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют в вакууме и разделяют между 10%-ным КОН и EtOAc. Органический слой промывают насыщенным раствором соли, высушивают (MgSO4) и концентрируют, получая при этом N-[7-(этилпиперидин-4-илметил-амино)-5,6,7,8-тетрагидронафталин-2-ил]-2,2,2-трифтор-ацетамид в виде маслянистого вещества, которое непосредственно используют на следующей стадии.
Стадия 3: изопропиламид 4-({этил-[7-(2,2,2-трифтор-ацетиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты
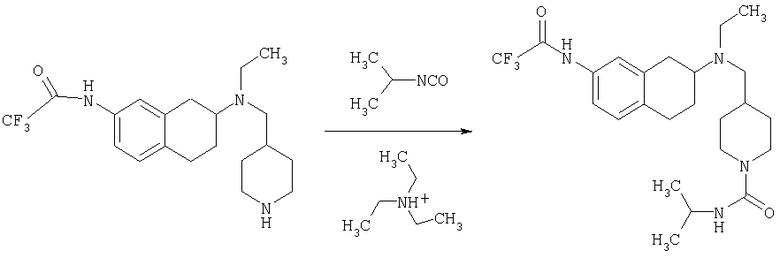
К раствору N-[7-(этилпиперидин-4-илметил-амино)-5,6,7,8-тетрагидронафталин-2-ил]-2,2,2-трифтор-ацетамида (1,7 ммоль) в метиленхлориде (20 мл) в инертной атмосфере добавляют триэтиламин (1,0 мл, 6,6 ммоль) и изопропилизоцианат (230 мкл, 2,3 ммоль). Реакционную смесь перемешивают в течение 20 ч и затем концентрируют в вакууме. Полученное вещество разделяют между 5%-ным КОН и водой. Органический слой высушивают (MgSO4) и концентрируют, получая при этом изопропиламид 4-({этил-[7-(2,2,2-трифтор-ацетил-амино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты в виде бесцветного маслянистого вещества (630 мг).
Стадия 4: изопропиламид 4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)-этиламино]метил}пиперидин-1-карбоновой кислоты
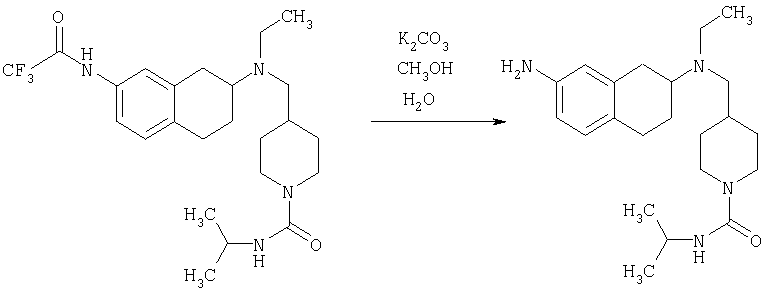
К раствору изопропиламида 4-({этил-[7-(2,2,2-трифтор-ацетиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты (630 мг, 1,3 ммоль) в метаноле (20 мл) и воде (10 мл) добавляют карбонат калия (500 мг) и реакционную смесь оставляют перемешиваться при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc и водой. Органический слой промывают насыщенным раствором соли, высушивают (MgSO4) и концентрируют, получая при этом изопропиламид 4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)-этиламино]метил}пиперидин-1-карбоновой кислоты в виде светло-коричневого маслянистого вещества (464 мг).
Стадия 5: изопропиламид 4-({этил-[7-(4-фтор-бензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты
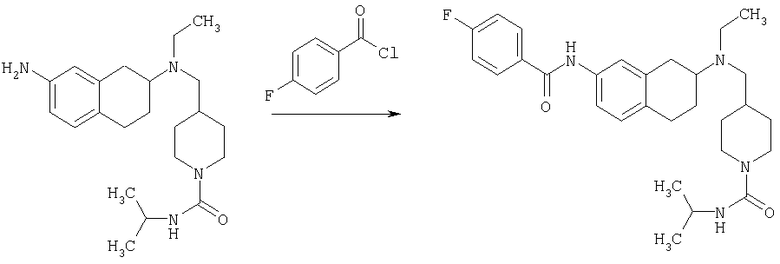
К раствору изопропиламида 4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)-этиламино]метил} пиперидин-1-карбоновой кислоты (200 мкл 0,25 М раствора в ацетонитриле, 50 мкмоль) добавляют 220 мкл 0,25 М раствора 4-фторбензоилхлорида в дихлорметане и 30 мкл ДИЭА. Раствор оставляют перемешиваться в течение 24 ч при 25°С в атмосфере N2 и концентрируют в вакууме. Конечный продукт отделяют препаративной жидкостной хроматографией высокого разрешения (ОФ ЖХВР, колонка «YMC Combiprep ODS-A», 10-90% ацетонитрил: вода (0,1% ТФУ)), получая при этом изопропиламид 4-({этил-[7-(4-фтор-бензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты (13,1 мг) 7, [М+Н]+=495.
По методике, описанной выше в примере 2, стадия 5, но заменяя 4-фторбензоилхлорид подходящим хлорангидридом или сульфонилхлоридом, получают следующие соединения:
изопропиламид 4-({этил[7-(4-трифторметилбензоиламино метил)пиперидин-1-карбоксил)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (8), [М+Н]+=545;
изопропиламид 4-[(этил{7-[(нафталин-2-карбонил)амино]-1,2,3,4-тетрагидронафталин-2-ил}амино)метил]пиперидин-1-карбоновой кислоты, (9), [M+H]+=527;
изопропиламид 4-({этил[7-(4-метокси-бензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (10), [М+Н]+=507;
изопропиламид 4-[({7-[(бифенил-4-карбонил)амино]-1,2,3,4-тетрагидронафталин-2-ил}этиламино)метил]пиперидин-1-карбоновой кислоты, (11), [М+Н]+=553;
изопропиламид 4-{[(7-дифенилацетиламино-1,2,3,4-тетрагидронафталин-2-ил)этиламино]метил}пиперидин-1-карбоновой кислоты, (12), [М+Н]+=567;
изопропиламид 4-({этил[7-(2-фенилбутириламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (13), [М+Н]+=519;
изопропиламид 4-[(этил{7-[2-(4-метоксифенил)-ацетиламино]-1,2,3,4-тетрагидронафталин-2-ил}амино)метил]пиперидин-1-карбоновой кислоты, (14), [М+Н]+=521;
изопропиламид 4-({[7-(4-диметиламинобензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]этиламино}метил)пиперидин-1-карбоновой кислоты, (15), [М+Н]+=520;
изопропиламид 4-({[7-(2,4-дифторбензоиламино)-1,2,3,4-тетрагидронафталин-2-ил]этиламино}метил)пиперидин-1-карбоновой кислоты, (16), [М+Н]+=513;
изопропиламид 4-({этил[7-(нафталин-2-сульфониламино)-1,2,3,4-тетрагидронафталин-2-ил] амино}метил)пиперидин-1-карбоновой кислоты, (17), [М+Н]+=563;
изопропиламид 4-({этил[7-(4-метокси-бензолсульфониламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (18), [М+Н]+=543;
изопропиламид 4-{[этил(7-фенилметансульфониламино-1,2,3,4-тетрагидронафталин-2-ил)амино]метил}пиперидин-1-карбоновой кислоты, (19), [М+H]+=527;
изопропиламид 4-({этил[7-(4-трифторметоксибензолсульфониламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (20), [М+Н]+=597;
изопропиламид 4-({этил[7-(4-фторбензолсульфониламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (21), [М+Н]+=531;
изопропиламид 4-({этил[7-(4-трифторметилбензолсульфониламино)-1,2,3,4-тетрагидронафталин-2-ил]амино}метил)пиперидин-1-карбоновой кислоты, (22), [М+Н]+=531;
изопропиламид 4-({[7-(бифенил-4-сульфониламино)-1,2,3,4-тетрагидронафталин-2-ил]этиламино}метил)пиперидин-1-карбоновой кислоты, (23), [M+H]+=589; и
изопропиламид 4-[(этил{7-[2-(4-изобутилфенил)пропиониламино]-1,2,3,4-тетрагидронафталин-2-ил}амино)метил]пиперидин-1-карбоновой кислоты, (24), [М+Н]+=589.
Пример 3
Метиламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты
Стадия 1: трет-бутиловый эфир 4-[(7-метокси-1,2,3,4-тетрагидронафталин-2-иламино)метил]пиперидин-1-карбоновой кислоты
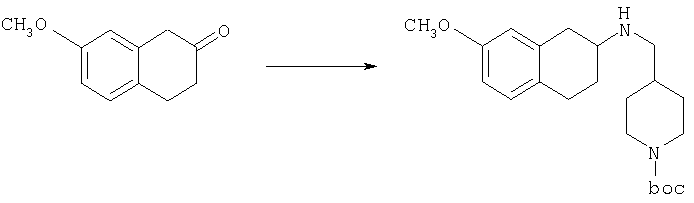
К раствору 7-метокси-3,4-дигидро-1H-нафталин-2-она (1,0 г, 5,67 ммоль) и трет-бутилового эфира 4-аминометилпиперидин-1-карбоновой кислоты (1,34 г, 6,23 ммоль) в дихлорэтане (50 мл) в атмосфере азота в один прием добавляют триацетоксиборгидрид натрия (3,0 г, 14,2 ммоль, 2,5 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc (100 мл) и 5%-ным водным раствором КОН (50 мл). Водный слой дважды экстрагируют, используя этилацетат (2×50 мл). Объединенные органические слои промывают насыщенным раствором соли, высушивают над MgSO4, фильтруют и концентрируют. После экспресс-хроматографии на силикагеле с элюированием смесью 5% метанол/метиленхлорид получают трет-бутиловый эфир 4-[(7-метокси-1,2,3,4-тетрагидронафталин-2-иламино)метил]пиперидин-1-карбоновой кислоты в виде маслянистого вещества (2,1 г).
Стадия 2: трет-бутиловый эфир 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты
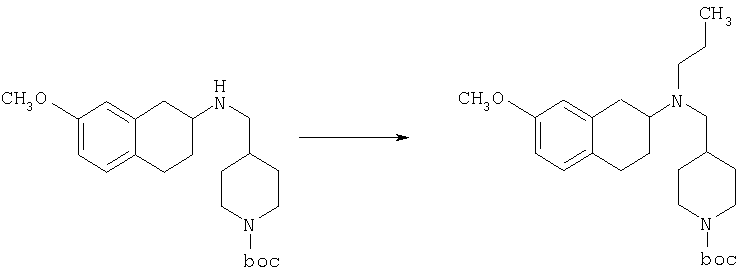
К раствору трет-бутилового эфира 4-[(7-метокси-1,2,3,4-тетрагидронафталин-2-иламино)метил]пиперидин-1-карбоновой кислоты (2,1 г, 5,6 ммоль) и пропионового альдегида (0,45 мл, 6,23 ммоль) в дихлорэтане (20 мл) в атмосфере азота в один прием добавляют триацетоксиборгидрид натрия (3,09 г, 14,15 ммоль, 2,5 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, затем концентрируют в вакууме. Остаток разделяют между EtOAc (75 мл) и 5%-ным водным раствором КОН (50 мл). Водную фазу дважды экстрагируют, используя EtOAc (2×30 мл). Объединенные органические слои высушивают над MgSO4, фильтруют и концентрируют на силикагеле (10 г). Полученное вещество помещают на колонку для экспресс-хроматографии и элюируют, используя 20% ацетона в гексане. Фракции, содержащие целевое вещество, объединяют и концентрируют, получая при этом трет-бутиловый эфир 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты (2,4 г).
Стадия 3: (7-Метокси-1,2,3,4-тетрагидронафталин-2-ил)пиперидин-4-илметилпропиламин
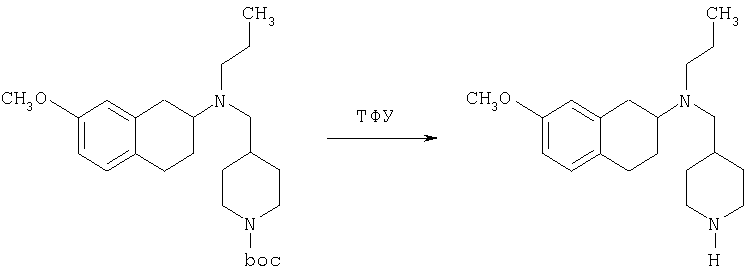
К раствору трет-бутилового эфира 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты (2,4 г, 4,56 ммоль) в метиленхлориде (30 мл) в атмосфере азота добавляют трифторуксусную кислоту (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют в вакууме. Остаток разделяют между EtOAc (50 мл) и 10%-ным водным раствором КОН (50 мл). Органический слой отделяют, высушивают над MgSO4, фильтруют и концентрируют, получая при этом (7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пиперидин-4-илметил-пропиламин (1,62 г).
Стадия 4: метиламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты
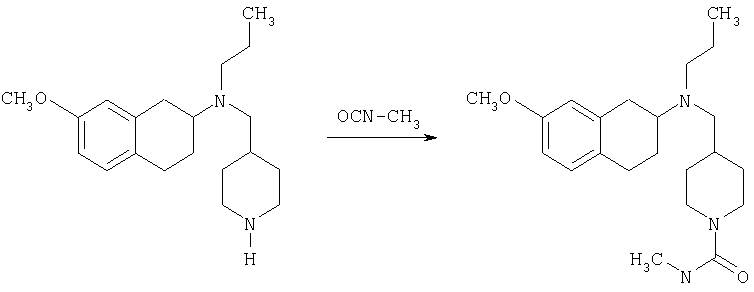
К раствору (7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пиперидин-4-илметилпропиламина (200 мкл 0,25 М раствора в дихлорметане, 50 мкмоль) добавляют 220 мкл 0,25 М раствора метилизоцианата в ацетонитриле и 30 мкл ДИЭА. Раствор оставляют перемешиваться в течение 24 ч при 25°С в атмосфере N2 и затем концентрируют в вакууме. Конечный продукт отделяют препаративной ОФ ЖХВР (колонка «YMC Combiprep ODS-A», 10-90% ацетонитрил:вода (0,1% ТФУ)), получая при этом метиламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты (17,1 мг), 25 [М+Н]+=374.
В соответствии с методикой, описанной выше в примере 3, стадия 4, но заменяя метилизоцианат подходящим изоцианатом, сульфонилхлоридом, карбамоилхлоридом или хлорангидридом, получают следующие соединения:
адамантан-1-иламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (26), [М+Н]+=494;
изопропиламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (27), [М+Н]+=402;
(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон, (28), [М+Н]+=430;
диэтиламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (29), [М+Н]+=416;
диизопропиламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (30), [М+Н]+=444;
(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)пирролидин-1-илметанон, (31), [М+Н]+=414;
диметиламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (32), [М+Н]+=388;
метилфениламид 4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (33), [М+Н]+=450;
(1-бензолсульфонилпиперидин-4-илметил)-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (34), [М+Н]+=457;
(1-метансульфонилпиперидин-4-илметил)-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (35), [М+Н]+=395;
7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-[1-(пропан-2-сульфонил)пиперидин-4-илметил]пропиламин, (36), [М+Н]+=423;
[1-(2-хлорбензолсульфонил)пиперидин-4-илметил]-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (37), [М+Н]=491;
(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-[1-(1-метил-1H-имидазол-4-сульфонил)пиперидин-4-илметил]пропиламин, (38), [М+Н]+=461;
1-(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-2,2-диметилпропан-1-он, (39), [M+H]+=401;
1-(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-3-метилбутан-1-он, (40), [М+Н]+=401;
(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)тиофен-2-илметанон, (41), [М+Н]+=427;
изоксазол-5-ил-(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)метанон, (42), [М+Н]+=412;
1-(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-2,2-дифенилэтанон, (43), [М+Н]+=511;
1-(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-этанон, (44), [М+Н]+=359; и
(1-метансульфонилпиперидин-4-ил)-(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)метанон, (45), [M+H]+=506.
В соответствии с методикой, описанной выше в примере 3, но заменяя на стадии 1 7-метокси-3,4-дигидро-1H-нафталин-2-он на 6-метокси-3,4-дигидро-1H-нафталин-2-он и используя подходящие хлорангидриды, сульфонилхлориды, карбамоилхлориды или изоцианаты на стадии 4, получают следующие соединения:
адамантан-1-иламид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (46), [М+Н]+=494;
(2-хлорфенил)амид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (47), [М+Н]+=470;
трет-бутиламид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (48), [М+Н]+=416;
изопропиламид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (49), [М+Н]+=402;
метиламид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (50), [М+Н]+=374;
(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон, (51), [M+H]+=430;
диэтиламид4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (52), [М+Н]+=416;
диизопропиламид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (53), [М+Н]+=444;
(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)пирролидин-1-илметанон, (54), [M+H]+=414;
диметиламид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (55), [М+Н]+=388;
метилфениламид 4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (56), [М+Н]+=450;
(1-бензолсульфонилпиперидин-4-илметил)-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (57), [M+H]+=457;
(1-метансульфонилпиперидин-4-илметил)-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (58), [М+Н]+=395;
(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)-[1-(пропан-2-сульфонил)пиперидин-4-илметил]пропиламин, (59), [М+Н]+=423;
[1-(2-хлор-бензолсульфонил)пиперидин-4-илметил]-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (60), [М+Н]+=491;
(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)-[1-(1-метил-1H-имидазол-4-сульфонил)пиперидин-4-илметил]пропиламин, (61), [М+Н]+=461;
1-(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-2,2-диметилпропан-1-он, (62), [M+H]+=401;
1-(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-3-метилбутан-1-он, (63), [М+Н]+=401;
(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)тиофен-2-илметанон, (64), [М+Н]+=427;
изоксазол-5-ил-(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)метанон, (65), [М+Н]+=412;
1-(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-2,2-дифенилэтанон, (66), [М+Н]+=511;
1-(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)этанон, (67), [М+Н]+=359 и
(1-метансульфонилпиперидин-4-ил)-(4-{[(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)метанон, (68), [М+Н]+=506.
В соответствии с методикой, описанной выше в примере 3, но заменяя 7-метокси-3,4-дигидро-1H-нафталин-2-он на 6,7-диметокси-3,4-дигидро-1H-нафталин-2-он на стадии 1 и используя подходящие хлорангидриды, сульфонилхлориды, карбамоилхлориды или изоцианаты на стадии 4, получают следующие соединения:
бензиловый эфир 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (69), [М+Н]+=481;
(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)фуран-2-илметанон, (70), [М+Н]+=441;
(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)тиофен-2-илметанон, (71), [М+Н]+=457;
1-(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-2-тиофен-2-илэтанон, (72), [М+Н]+=471;
1-(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-этанон, (73), [М+Н]+=389;
(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)-(3,5-диметилизоксазол-4-ил)метанон, (74), [M+H]+=470;
(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон, (75), [М+Н]+=460;
диэтиламид 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (76), [М+Н]+=446;
(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)пирролидин-1-илметанон, (77), [M+H]+=444;
диметиламид 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (78), [М+Н]+=418;
(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин, (79), [М+Н]+=425;
диметиламид 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-сульфоновой кислоты, (80), [М+Н]+=454;
(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропил-(1-трифторметансульфонилпиперидин-4-илметил)амин, (81), [М+Н]+=479;
(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропил-[1-(тиофен-2-сульфонил)пиперидин-4-илметил]амин, (82), [M+H]+=479;
метиламид 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, (83), [М+Н]+=404 и
[1-(5-хлортиофен-2-сульфонил)пиперидин-4-илметил]-(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (84), [М+Н]+=527.
Пример 4
N-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}изобутирамид
Стадия 1: (7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пиперидин-4-илметил-пропиламин
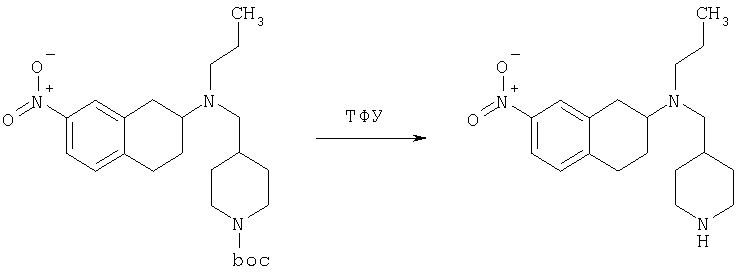
К раствору трет-бутилового эфира 4-{[(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, полученной согласно примеру 1. (1,12 г, 2,60 ммоль) в метиленхлориде (30 мл) в атмосфере азота добавляют трифторуксусную кислоту (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют в вакууме. Остаток разделяют между EtOAc (50 мл) и 10%-ным водным раствором КОН (50 мл). Органический слой отделяют, высушивают над MgSO4, фильтруют и концентрируют, получая при этом (7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пиперидин-4-илметилпропиламин (845 мг).
Стадия 2: (1-метансульфонилпиперидин-4-илметил)-(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пропиламин, (122)
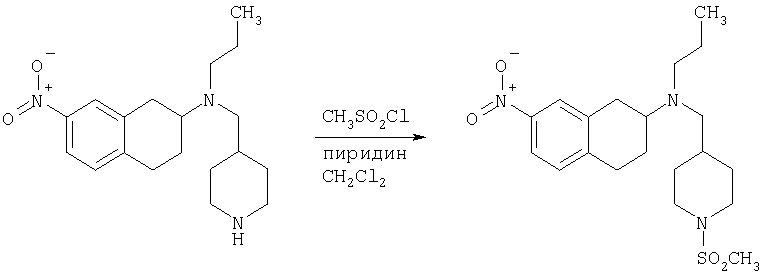
К охлаждаемому на бане со льдом раствору (7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пиперидин-4-илметилпропиламина (420 мг, 1,3 ммоль) и пиридина (154 мкл, 1,5 ммоль, 1,2 экв.) в метиленхлориде (30 мл) в инертной атмосфере по каплям добавляют метансульфонилхлорид (154 мкл, 1,9 ммоль, 1,5 экв.). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 24 ч. Реакцию останавливают добавлением воды и отделяют слой с метиленхлоридом, высушивают (MgSO4) и концентрируют, получая при этом (1-метансульфонилпиперидин-4-илметил)-(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пропиламин в виде серовато-желтого твердого вещества (454 мг).
Стадия 3: N-(1-метансульфонилпиперидин-4-илметил)-N-пропил-1,2,3,4-тетрагидронафталин-2,7-диамин
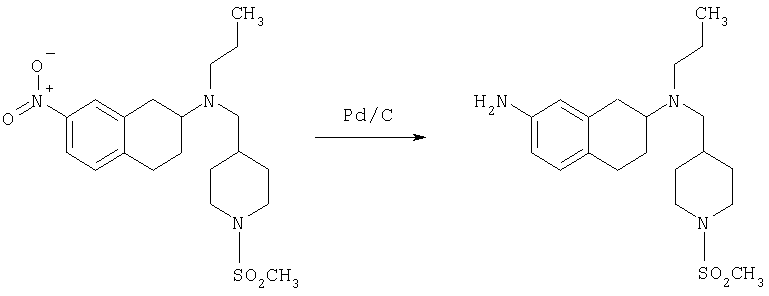
К раствору (1-метан сульфонилпиперидин-4-илметил)-(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пропиламина (490 мг, 1,20 ммоль) в этаноле (30 мл) добавляют 10%-ный палладий на углероде (50 мг). Раствор встряхивают, используя встряхивающее устройство Парра, в течение 24 ч при давлении водорода 55 фунт/кв. дюйм. Раствор фильтруют через целит и концентрируют, получая при этом N-(1-метан сульфонилпиперидин-4-илметил)-N-пропил-1,2,3,4-тетрагидронафталин-2,7-диамин (400 мг), (85), [М+Н]+=380, который непосредственно используют на следующей стадии.
Стадия 4: N-{7-(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}изобутирамид
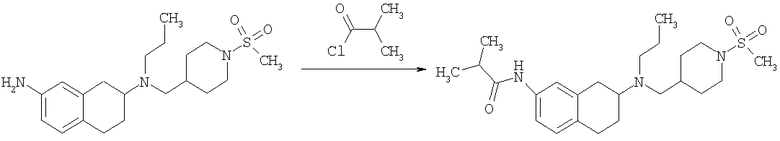
К раствору N2-(1-метансульфонилпиперидин-4-илметил)-N2-пропил-1,2,3,4-тетрагидронафталин-2,7-диамина (200 мкл 0,25 М раствора в дихлорметане, 50 мкмоль) добавляют 220 мкл 0,25 М раствора изобутирилхлорида в дихлорметане и 30 мкл ДИЭА. Раствор оставляют перемешиваться в течение 72 ч при 25°С в атмосфере N2 и затем концентрируют в вакууме. Конечный продукт отделяют препаративной ОФ ЖХВР (колонка «YMC Combiprep ODS-A»», 10-90% ацетонитрил:вода (0,1% ТФУ)), получая при этом N-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}изобутирамид (10,4 мг), (86). [М+Н]+=450.
В соответствии с методикой, описанной выше в примере 4, стадия 4, но заменяя изобутирилхлорид на подходящий хлорангидрид, сульфонилхлорид или карбоксальдегид, получают следующие соединения:
N-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}-2,2-диметилпропионамид, (87), [М+Н]+=464;
N-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}метансульфонамид, (88), [М+Н]+=458;
3-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}-N-диметиламиносульфонамид, (89), [М+Н]+=487;
{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}амид пирролидин-1-сульфоновой кислоты, (90), [M+H]+=513;
1-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}-3-метил-мочевина, (91), [М+Н]+=437;
1-изопропил-3-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}мочевина, (92), [M+H]+=465;
1-трет-бутил-3-{7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-ил}мочевина, (93), [M+H]+=479 и
N2-изо-бутил-N2-(1-метансульфонилпиперидин-4-илметил)-N2-пропил-1,2,3,4-тетрагидронафталин-2,7-диамин, (94) [М+Н]+=436.
Пример 5
N-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил] пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)изобутирамид
Стадия 1: морфолин-4-ил-(4-{[(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)метанон
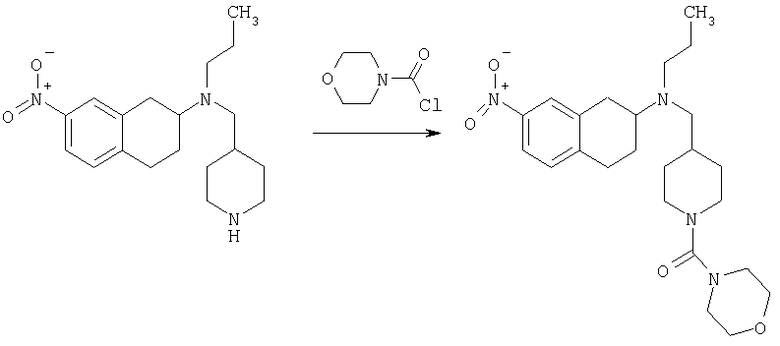
К охлажденному на бане со льдом раствору (7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пиперидин-4-илметилпропиламина, полученного согласно примеру 4 (400 мг, 1,2 ммоль), и триэтиламина (170 мкл, 1,4 ммоль, 1,2 экв.) в метиленхлориде (40 мл) в инертной атмосфере по каплям добавляют морфолин-4-карбонилхлорид (170 мкл, 1,4 ммоль). Удаляют ледяную баню и реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Смесь с метиленхлоридом дважды промывают водой (30 мл), высушивают (MgSO4), фильтруют и концентрируют, получая при этом морфолин-4-ил-(4-{[(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)метанон в виде бесцветного маслянистого вещества (540 мг).
Стадия 2: (4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон
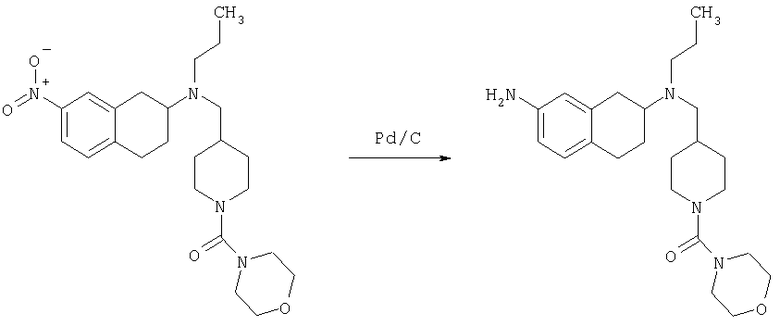
К раствору морфолин-4-ил-(4-{[(7-нитро-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)метанона (540 мг, 1,2 ммоль) в этаноле (30 мл) добавляют 10%-ный палладий на углероде (50 мг). Раствор встряхивают, используя встряхивающее устройство Парра, в течение 24 ч при давлении водорода 55 фунт/кв. дюйм. Раствор фильтруют через целит и концентрируют, получая при этом (4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон (432 мг), (95), [М+Н]+=415, который непосредственно используют на следующей стадии.
Стадия 3: N-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)изобутирамид
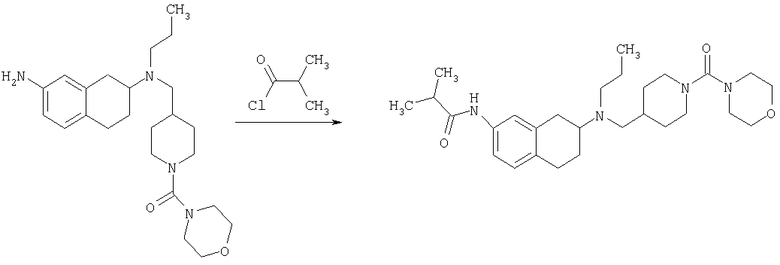
К раствору (4-{[(7-амино-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанона (200 мкл 0,25 М раствора в дихлорметане, 50 мкмоль) добавляют 220 мкл 0,25 М раствора изобутирилхлорида в дихлорметане и 30 мкл ДИЭА. Раствор оставляют перемешиваться в течение 72 ч при 25°С в атмосфере N2 и затем концентрируют в вакууме. Конечный продукт отделяют препаративной ОФ ЖХВР (колонка «YMC Combiprep ODS-A», 10-90% ацетонитрил:вода (0,1% ТФУ)), получая при этом N-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)изобутирамид (8,6 мг), (96), [M+H]+=485.
В соответствии с методикой, описанной выше в примере 5, стадия 3, но заменяя изобутирилхлорид подходящим хлорангидридом, сульфонилхлоридом, карбамоилхлоридом или карбоксальдегидом, получают следующие соединения:
2,2-диметил-N-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)-пропионамид, (97), [M+H]+=499;
N-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)метансульфонамид, (98), [М+Н]+=493;
N-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)-N,N-диметиламиносульфонамид, (99), [M+H]+=522;
(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)амид пирролидин-1-сульфоновой кислоты, (100), [M+H]+=548;
1-изопропил-3-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)мочевина, (101), [M+H]+=500;
1-трет-бутил-3-(7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-ил)мочевина, (102), [M+H]+ =514 и
(4-{[(7-изобутиламино-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон, (103), [M+H]+=471.
Пример 6
(7-Этокси-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин
Стадия 1: (7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин
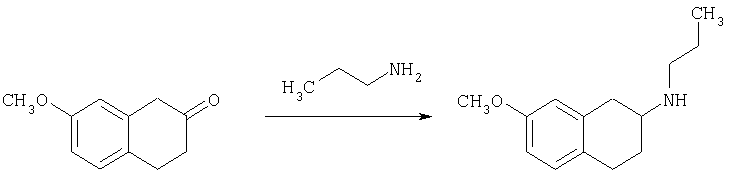
К раствору 7-метокси-3,4-дигидро-1H-нафталин-2-она (6,0 г, 39,7 ммоль) в дихлорэтане (130 мл) в инертной атмосфере в один прием добавляют пропиламин (3,4 мл, 41,7 ммоль, 1,05 экв.), а затем триацетоксиборгидрид натрия (21 г, 99,3 ммоль, 2,5 экв.). Реакционную смесь оставляют при перемешивании при комнатной температуре в течение 24 ч. Смесь концентрируют в вакууме и разделяют между EtOAc (200 мл) и 5%-ным водным раствором NaOH (100 мл). Водный слой дважды экстрагируют, используя EtOAc (2×70 мл). Объединенные органические слои промывают насыщенным раствором соли (100 мл), высушивают над MgSO4, фильтруют и концентрируют. Остаток помещают в эфир (125 мл) и обрабатывают 1Н раствором HCl в эфире. Соль отфильтровывают и высушивают, получая при этом гидрохлорид (7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин в виде желто-коричневого твердого вещества (5,0 г).
Стадия 2: 2,2,2-трифтор-N-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-N-пропилацетамид
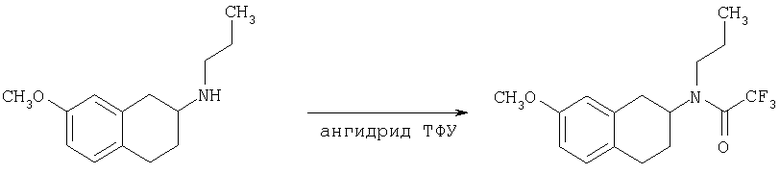
К раствору (7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламина (3,0 г, 11,7 ммоль) в дихлорметане (100 мл) в инертной атмосфере добавляют пиридин (2,4 мл, 29,3 ммоль, 2,5 экв.). К полученному раствору добавляют трифторуксусный ангидрид (1,8 мл, 12,9 ммоль, 1,1 экв.) и смесь оставляют при перемешивании при комнатной температуре в течение 24 ч. Реакционную смесь выливают в 1М раствор HCl, органический слой отделяют и концентрируют в вакууме. Полученное соединение подвергают экспресс-хроматографии на силикагеле, элюируя с использованием 30% ацетона в гексане, получая при этом 2,2,2-трифтор-N-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-N-пропилацетамид в виде маслянистого вещества (3,4 г).
Стадия 3: 2,2,2-трифтор-N-(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)-N-пропилацетамид
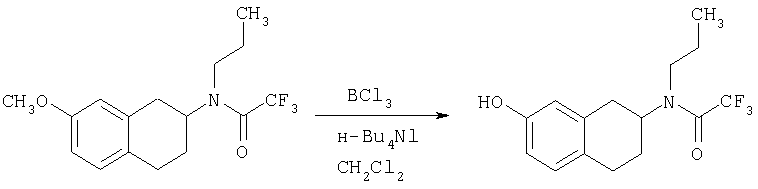
К охлажденному до -78°С раствору 2,2,2-трифтор-N-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-N-пропилацетамида (3,4 г, 10,9 ммоль) и тетрабутиламмонийиодида (4,43 г, 12,0 ммоль) в дихлорметане (200 мл) в инертной атмосфере по каплям добавляют трихлорид бора (1М, 27,2 мл). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2,5 ч. Реакцию останавливают, медленно добавляя воду. Органический слой отделяют и высушивают (MgSO4). Полученное вещество концентрируют на силикагеле (15 г) и помещают на колонку для экспресс-хроматографии. После хроматографии с использованием 30% ацетона в гексане в качестве элюента получают 2,2,2-трифтор-N-(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)-N-пропилацетамид в виде вспененного вещества (3,1 г).
Стадия 4: N-(7-этокси-1,2,3,4-тетрагидронафталин-2-ил)-2,2,2-трифтор-N-пропилацетамид
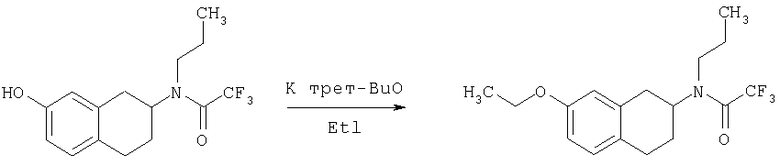
К раствору 2,2,2-трифтор-N-(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)-N-пропилацетамида (1,0 г, 3,32 ммоль) в ДМСО (30 мл) в инертной атмосфере добавляют суспензию трет-бутоксида калия (392 мг, 3,49 ммоль, 1,05 экв.) в ДМСО (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем по каплям добавляют этилиодид (0,32 мл, 3,98 ммоль, 1,2 экв.). Реакционную смесь перемешивают в течение 2 ч, реакцию останавливают водой и экстрагируют, используя EtOAc (2×50 мл). Объединенные органические слои высушивают над MgSO4, фильтруют и концентрируют на силикагеле (10 г). Полученное вещество помещают на колонку для экспресс-хроматографии и элюируют, используя 20% ацетона в гексане, с получением при этом N-(7-этокси-1,2,3,4-тетрагидронафталин-2-ил)-2,2,2-трифтор-N-пропилацетамида в виде маслянистого вещества (660 мг).
Стадия 5: (7-этокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин
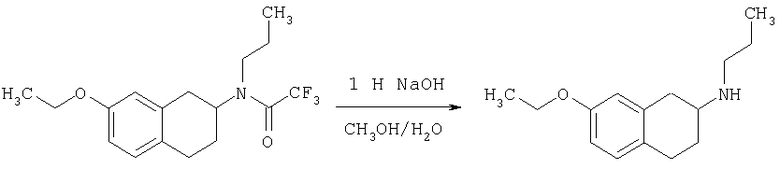
Раствор N-(7-этокси-1,2,3,4-тетрагидронафталин-2-ил)-2,2,2-трифтор-N-пропилацетамида (660 мг, 2,0 ммоль) в метаноле (30 мл) и 1Н NaOH (30 мл) перемешивают при комнатной температуре в течение 30 ч. Реакционную смесь концентрируют, остаток разделяют между EtOAc (40 мл) и водой (40 мл). Водный слой дважды экстрагируют, используя EtOAc (2×30 мл). Объединенные органические слои промывают насыщенным раствором соли (30 мл), высушивают (MgSO4) и концентрируют, получая при этом (7-этокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин.
Стадия 6: (7-этокси-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин
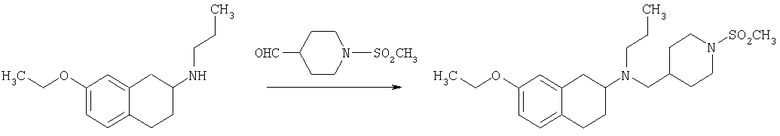
К раствору полученного (7-этокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламина (200 мкл 0,25 М раствора в 1,2-дихлорэтане, 50 мкмоль) добавляют 220 мкл раствора 1-(метилсульфонил)-4-пиперидинкарбоксальдегида (0,25 М в 1,2-дихлорэтане), затем 30 мкл ДИЭА и 300 мкл 0,25 М суспензии триацетоксиборгидрида натрия в 1,2-дихлорэтане. Раствор встряхивают при 25°С в течение 48 ч в атмосфере N2. Реакцию останавливают, добавляя 1 мл 2%-ного NaOH, и смесь переносят вместе с 0,5 мл Н2О и EtOAc в рабочую колбу. Колбу встряхивают, смеси дают отстояться и водную фазу удаляют и уничтожают. Органическую фазу промывают водой, переносят в пробирку и концентрируют в вакууме. Конечный продукт отделяют препаративной Оф ЖХВР (колонка «YMC Combiprep ODS-A», 10-90% ацетонитрил:вода (0,1% ТФУ)), получая при этом (7-этокси-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин (8 мг), 104, [М+Н]+=409.
В соответствии с методикой, описанной выше в примере 6, стадия 1, но заменяя 7-метокси-3,4-дигидро-1H-нафталин-2-он на 6-метокси-3,4-дигидро-1Н-нафталин-2-он, получают следующее соединение:
(6-этокси-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин, (105), [М+Н]+=409.
Пример 7
7-{[1-(Морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты
Стадия 1: 7-пропиламино-5,6,7,8-тетрагидронафталин-2-ол
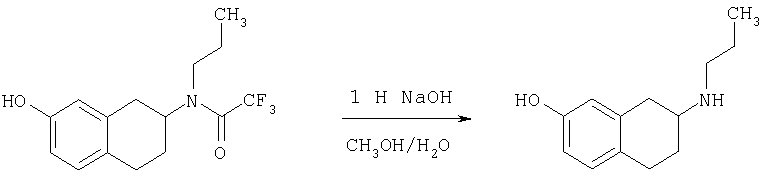
Раствор 2,2,2-трифтор-N-(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)-N-пропилацетамида (340 мг, 1,03 ммоль) в метаноле (30 мл) и 1Н NaOH (30 мл) перемешивают при комнатной температуре в течение 30 ч. Реакционную смесь концентрируют и остаток разделяют между EtOAc (40 мл) и водой (40 мл). Водный слой дважды экстрагируют, используя EtOAc (2×30 мл). Объединенные органические слои промывают насыщенным раствором соли (30 мл), высушивают (MgSO4) и концентрируют, получая при этом 7-пропиламино-5,6,7,8-тетрагидронафталин-2-ол (240 мг).
Стадия 2: трет-бутиловый эфир 4-{[(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты
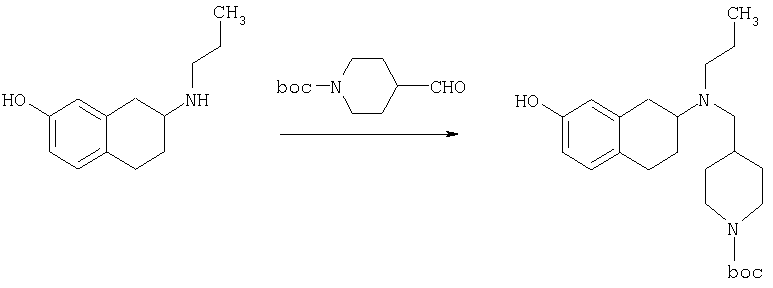
К раствору 7-пропиламино-5,6,7,8-тетрагидронафталин-2-ола (937 мг, 4,6 ммоль) и трет-бутилового эфира 4-формилпиперидин-1-карбоновой кислоты (1,46 г, 6,9 ммоль) в дихлорэтане (40 мл) в один прием добавляют триацетоксиборгидрид натрия (2,1 г, 10,12 ммоль). Реакционную смесь оставляют при перемешивании при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc (75 мл) и 5%-ным водным раствором КОН (75 мл). Органический слой высушивают (MgSO4), фильтруют и концентрируют, получая при этом трет-бутиловый эфир 4-{[(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты (1,37 г).
Стадия 3: трет-бутиловый эфир 4-{[пропил-(7-трифторметансульфонилокси-1,2,3,4-тетрагидронафталин-2-ил)амин]метил}пиперидин-1-карбоновой кислоты
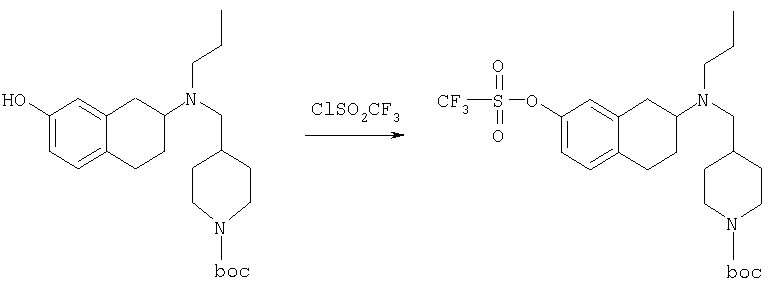
К охлажденному на бане со льдом раствору трет-бутилового эфира 4-{[(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты (300 мг, 0,75 ммоль) в метиленхлориде (30 мл) в атмосфере азота добавляют триэтиламин (0,16 мл, 1,125 ммоль), затем трифторметансульфонилхлорид (0,08 мл, 0,78 ммоль). Реакционную смесь перемешивают на ледяной бане в течение 30 мин и затем добавляют к воде (60 мл). Органический слой отделяют, высушивают над MgSO4, фильтруют и концентрируют. После хроматографии с 40% ацетона в гексане получают трет-бутиловый эфир 4-{[пропил-(7-трифторметансульфонилокси-1,2,3,4-тетрагидронафталин-2-ил)амино]метил}пиперидин-1-карбоновой кислоты (220 мг).
Стадия 4: 7-(пиперидин-4-илметил-пропиламино)-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты
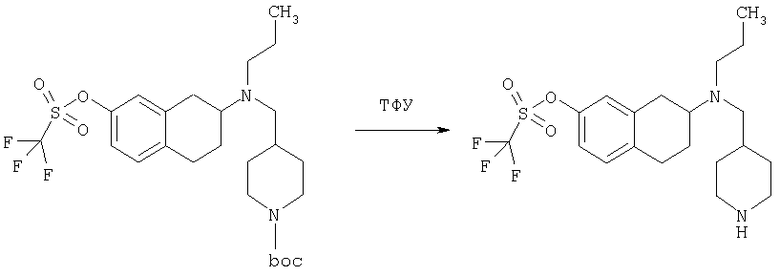
К раствору трет-бутилового эфира 4-{[пропил-(7-трифторметансульфонилокси-1,2,3,4-тетрагидронафталин-2-ил)амино]метил}пиперидин-1-карбоновой кислоты (220 мг, 0,41 ммоль) в метиленхлориде (5,0 мл) в инертной атмосфере добавляют трифторуксусную кислоту (1,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют в вакууме и разделяют между 1 Н NaOH (20 мл) и EtOAc (30 мл). Органический слой отделяют, высушивают (MgSO4) и концентрируют, получая при этом 7-(пиперидин-4-илметил-пропиламино)-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты (114 мг).
Стадия 5: 7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты
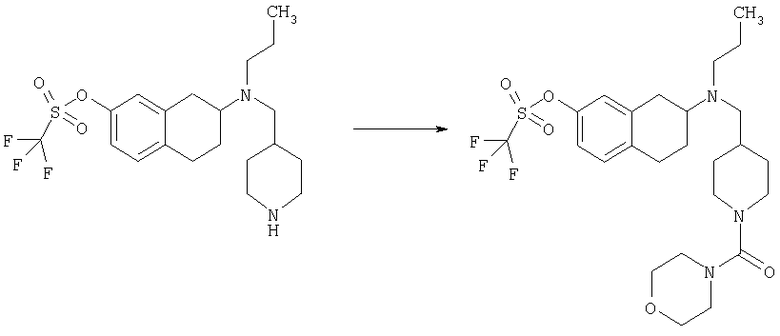
К раствору 7-(пиперидин-4-илметил-пропиламино)-5,6,7,8-тетрагидронафталин-2-илового эфира трифторметансульфоновой кислоты (200 мкл 0,19 М раствора в ацетонитриле, 36 мкмоль) добавляют 220 мкл 0,25 М раствора морфолин-4-карбонилхлорида в дихлорметане и 30 мкл ДИЭА. Раствор оставляют перемешиваться в течение 48 ч при 25°С в атмосфере N2 и затем концентрируют в вакууме. Конечный продукт отделяют препаративной ОФ ЖХВР (колонка «YMC Combiprep ODS-A», 10-90% ацетонитрил:вода (0,1% ТФУ)), получая при этом 7-{[1-(морфолин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты (12,8 мг) (106), [М+Н]+=548.
В соответствии с методикой, описанной выше в примере 7, стадия 5, но заменяя морфолин-4-карбонилхлорид подходящим хлорангидридом, карбамоилхлоридом или сульфонилхлоридом, получают следующие соединения:
7-{[1-(изоксазол-5-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты, (107), [М+Н]+=530;
7-[(1-диметилкарбамоилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты, (108), [M+H]+=506;
7-[(1-метансульфонилпиперидин-4-илметил)пропиламино]-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты, (109), [M+Н]+=513 и
7-{[1-(1-метил-1H-имидазол-4-сульфонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир трифторметансульфоновой кислоты, (110), [М+Н]+=579.
Пример 8
[7-(3-Аминофенил)-1,2,3,4-тетрагидронафталин-2-ил]-(1-метансульфонилпиперидин-4-илметил)пропиламин
Стадия 1: (7-бром-1,2,3,4-тетрагидронафталин-2-ил)пропиламин
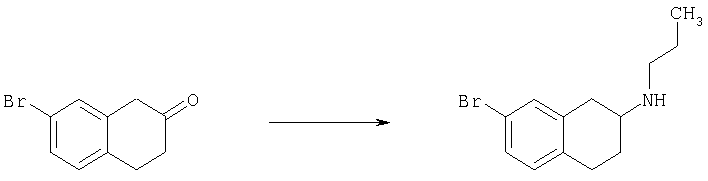
К раствору 7-бром-3,4-дигидро-1H-нафталин-2-она, полученного, как описано в J.Med.Chem. 1993, 36, 2279-2291, (5,2 г, 23 ммоль) в 1,2 дихлорэтане (30 мл) добавляют пропиламин (1,63 г, 28 ммоль), затем триацетоксиборгидрид натрия (7,3 г, 34,5 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в атмосфере азота в течение 24 ч, по истечении которых смесь концентрируют в вакууме. Полученное твердое вещество разделяют между 1 М раствором гидроксида натрия и этилацетатом. Слой с этилацетатом промывают насыщенным раствором соли, высушивают над сульфатом магния и отфильтровывают, получая при этом (7-бром-1,2,3,4-тетрагидронафталин-2-ил)пропиламин (2,75 г).
Стадия 2: (7-бром-1,2,3,4-тетрагидронафталин-2-ил)-(1-метан сульфонилпиперидин-4-илметил)пропиламин
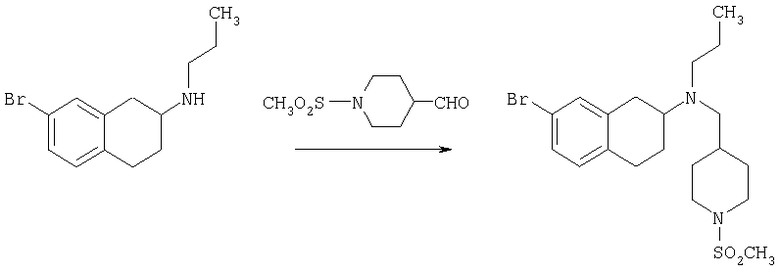
К раствору (7-бром-1,2,3,4-тетрагидронафталин-2-ил)пропиламина (536 мг, 2 ммоль) и 1-метансульфонилпиперидин-4-карбоксальдегида (458 мг, 2,47 ммоль) в дихлорэтане (10 мл) добавляют триацетоксиборгидрид натрия (551 мг, 2,6 ммоль) в один прием. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc (75 мл) и 5%-ным водным раствором КОН (75 мл). Органический слой высушивают (MgSO4), фильтруют и концентрируют, получая при этом (7-бром-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин (857 мг), (111), [M+H]+=444.
Стадия 3: [7-(3-аминофенил)-1,2,3,4-тетрагидронафталин-2-ил]-(1-метансульфонилпиперидин-4-илметил)пропиламин
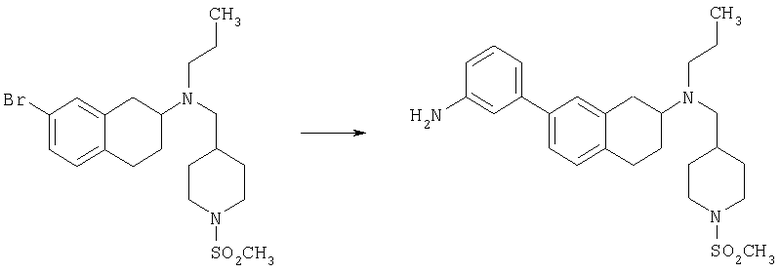
В пробирку, содержащую 2-3 мг катализатора Pd(PPh3)4, добавляют 1 мл раствора (7-бром-1,2,3,4-тетрагидронафталин-2-ил)-(1-метан сульфонилпиперидин-4-илметил)пропиламина (25 ммоль в DMA), затем 120 мкл раствора 3-аминофенилбороновой кислоты (30 ммоль в DMA) и 200 мкл 1 Н водного раствора NaOH. Раствор встряхивают при 80°С в течение 4 ч, концентрируют и очищают хроматографией, получая при этом
[7-(3-аминофенил)-1,2,3,4-тетрагидронафталин-2-ил]-(1-метансульфонилпиперидин-4-илметил)пропиламин, (112), [М+Н]+=456.
В соответствии с методикой, описанной выше в примере 8, стадия 3, но заменяя 3-аминофенилбороновую кислоту подходящим производным бороновой кислоты, получают следующие соединения:
[7-(4-метансульфонилфенил)-1,2,3,4-тетрагидронафталин-2-ил]-(1-метан сульфонилпиперидин-4-илметил)пропиламин, (113), [М+Н]+=519;
(7-фуран-2-ил-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин, (117), [М+Н]+=431;
(7-фуран-3-ил-1,2,3,4-тетрагидронафталин-2-ил)-(1-метансульфонилпиперидин-4-илметил)пропиламин, (118), [М+Н]+=431;
(1-метансульфонилпиперидин-4-илметил)пропил-(7-пиридин-3-ил-1,2,3,4-тетрагидронафталин-2-ил)амин, (119), [М+Н]+=442;
(1-метансульфонилпиперидин-4-илметил)пропил-[7-(1H-пиррол-2-ил)-1,2,3,4-тетрагидронафталин-2-ил]-амин, (120), [М+Н]+=430 и
(1-метансульфонилпиперидин-4-илметил)пропил-(7-пиридин-4-ил-1,2,3,4-тетрагидронафталин-2-ил)амин, (120), [М+Н]+=420.
Пример 9
7-{[1-(пиперидин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир 3,5-диметилизоксазол-4-сульфоновой кислоты
Стадия 1: трет-бутиловый эфир 4-({[7-(3,5-диметилизоксазол-4-сульфонилокси)-1,2,3,4-тетрагидронафталин-2-ил]пропиламино}метил)пиперидин-1-карбоновой кислоты
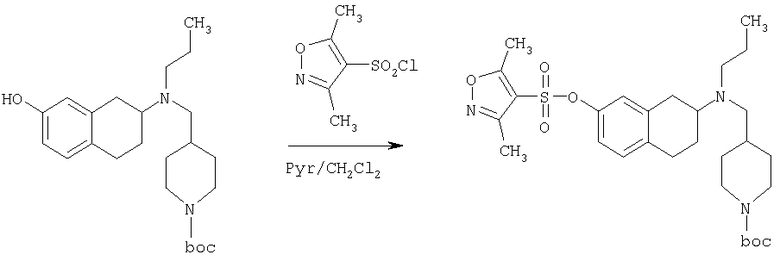
К охлаждаемому на бане со льдом раствору трет-бутлового эфира 4-{[(7-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты, полученного, как описано в примере 8 (1,0 г, 2,48 ммоль), и триэтиламина (0,52 мл, 2,73 ммоль) в метиленхлориде (75 мл) в инертной атмосфере по каплям добавляют 3,5-диметилизоксазол-4-сульфонилхлорид (535 мг, 2,73 ммоль). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 24 ч. Реакцию останавливают добавлением воды, слой, содержащий метиленхлорид, отделяют, высушивают (MgSO4) и концентрируют, получая при этом трет-бутиловый эфир 4-({[7-(3,5-диметилизоксазол-4-сульфонилокси)-1,2,3,4-тетрагидронафталин-2-ил] пропиламино}метил)пиперидин-1-карбоновой кислоты (1,16 г).
Стадия 2: 7-(пиперидин-4-илметил-пропиламино)-5,6,7,8-тетрагидронафталин-2-иловый эфир 3,5-диметил-изоксазол-4-сульфоновой кислоты
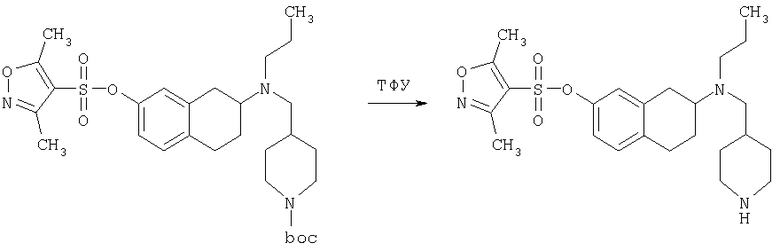
К раствору трет-бутилового эфира 4-({[7-(3,5-диметил-изоксазол-4-сульфонилокси)-1,2,3,4-тетрагидронафталин-2-ил]пропиламино}метил)пиперидин-1-карбоновой кислоты (1,16 г, 2,1 ммоль) в метиленхлориде (30 мл) в атмосфере азота добавляют трифторуксусную кислоту (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют в вакууме. Остаток разделяют между EtOAc (50 мл) и 10%-ным водным раствором КОН (50 мл). Органический слой отделяют, высушивают над MgSO4, фильтруют и концентрируют, получая при этом 7-(пиперидин-4-илметил-пропиламино)-5,6,7,8-тетрагидронафталин-2-иловый эфир 3,5-диметилизоксазол-4-сульфоновой кислоты (847 мг).
Стадия 3: 7-{[1-(пиперидин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир 3,5-диметилизоксазол-4-сульфоновой кислоты
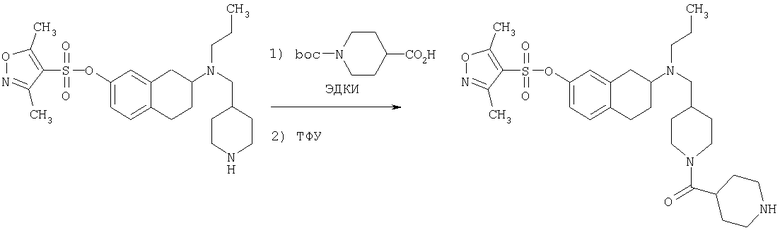
В инертной атмосфере смешивают 7-(пиперидин-4-илметилпропиламино)-5,6,7,8-тетрагидронафталин-2-иловый эфир 3,5-диметилизоксазол-4-сульфоновой кислоты (400 мг, 0,87 ммоль), моно-трет-бутиловый эфир пиперидин-1,4-дикарбоновой кислоты (199 мг, 0,87 ммоль, 1 экв.), ЭДКИ (166 мг, 0,87 ммоль, 1 экв.), триэтиламин (0,25 мл, 1,79 ммоль, 2 экв.) и дихлорметан (35 мл). Смесь перемешивают при комнатной температуре в течение 48 ч и затем концентрируют в вакууме. Остаток помещают в EtOAc (50 мл) и промывают водой (30 мл), 1 Н раствором NaOH (30 мл), насыщенным раствором соли (30 мл) и затем высушивают (MgSO4). Раствор фильтруют и концентрируют, получая при этом желтое маслянистое вещество. Полученное маслянистое вещество подвергают экспресс-хроматографии на силикагеле, элюируя, используя 20% ацетона в гексане, с получением при этом защищенного амина в виде вспененного вещества (447 мг), защиту которого снимают, используя трифторуксусную кислоту, как описано в тексте заявки, получая при этом 7- {[1-(пиперидин-4-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир 3,5-диметилизоксазол-4-сульфоновой кислоты (320 мг), 114, [М+Н]+=609.
В качестве альтернативы, посредством ацилирования 7-(пиперидин-4-илметилпропиламино)-5,6,7,8-тетрагидронафталин-2-илового эфира 3,5-диметилизоксазол-4-сульфоновой кислоты, полученного, как описано выше на стадии 2, с использованием 1 -метилпиперидин-4-карбонилхлорида в условиях, которые описаны в тексте заявки в примере 5, получают 7-{[1-(4-метилпиперазин-1-карбонил)пиперидин-4-илметил]пропиламино}-5,6,7,8-тетрагидронафталин-2-иловый эфир 3,5-диметилизоксазол-4-сульфоновой кислоты, (115), [М+Н]+=624.
Пример 10
(4-{2-[((R)-7-Метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]-этил}пиперидин-1-ил)пиперидин-4-илметанон
Стадия 1: ((R)-7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-(2-пиперидин-4-илэтил)пропиламин
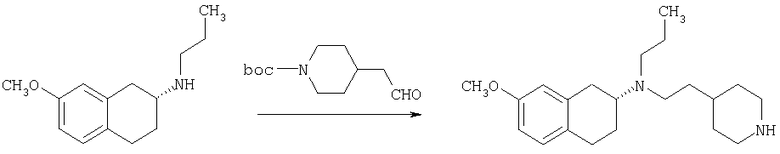
К раствору (R)-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламина (510 мг, 2,0 ммоль) и трет-бутилового эфира 4-(2-оксоэтил)пиперидин-1-карбоновой кислоты (500 мг, 2,2 ммоль) в дихлорэтане (40 мл) добавляют триэтиламин (0,3 мл, 2,2 ммоль) и триацетоксиборгидрид натрия (1,0 г, 4,75 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют в вакууме и разделяют между EtOAc (75 мл) и 5%-ным водным раствором КОН (75 мл). Органический слой высушивают (MgSO4), фильтруют и концентрируют, получая при этом маслянистое вещество (716 мг). После снятия защиты с использованием 10 мл трифторуксусной кислоты, как описано в тексте заявки, получают ((R)-7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-(2-пиперидин-4-ил-этил)пропиламин.
Стадия 2: (4-{2-[(R)-7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]этил}пиперидин-1-ил)пиперидин-4-илметанон
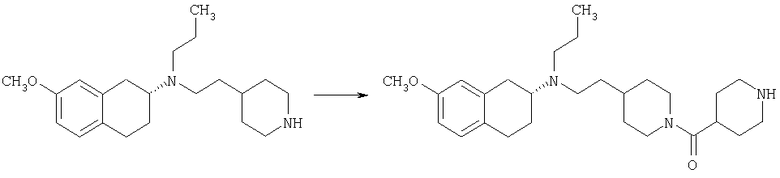
В инертной атмосфере смешивают ((R)-7-метокси-1,2,3,4-тетрагидронафталин-2-ил)-(2-пиперидин-4-ил-этил)пропиламин (200 мг, 0,61 ммоль), моно-трет-бутиловый эфир пиперидин-1,4-дикарбоновой кислоты (139 мг, 0,61 ммоль), ЭДКИ (117 мг, 0,61 ммоль), ГОБТ (82 мг, 0,61 ммоль), триэтиламин (0,17 мл, 1,2 ммоль) и дихлорметан (35 мл). Смесь перемешивают при комнатной температуре в течение 48 ч и затем концентрируют в вакууме. Остаток помещают в EtOAc (50 мл) и промывают водой (30 мл), 1 Н раствором NaOH (30 мл), насыщенным раствором соли (30 мл) и высушивают (MgSO4). Раствор фильтруют и концентрируют, получая при этом маслянистое вещество. Полученное маслянистое вещество подвергают экспресс-хроматографии на силикагеле, элюируя 20% ацетона в гексане, с получением при этом защищенного амина (260 мг), защиту которого снимают, используя 10 мл трифторуксусной кислоты, как описано в тексте заявки, с получением при этом (4-{2-[((R)-7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]-этил} пиперидин-1-ил)пиперидин-4-илметанона (200 мг), (116), [М+Н]+=478.
Пример 11
Композиция для перорального введения
Ингредиенты смешивают и наполняют полученной смесью капсулы, приблизительно по 100 мг в каждую капсулу; в одной капсуле содержится примерно суммарная дневная доза.
Пример 12
Композиция для перорального введения
Ингредиенты объединяют и гранулируют, используя растворитель, например, такой как метанол. Композицию затем высушивают и формируют таблетки (содержащие примерно 20 мг активного соединения) в подходящем устройстве для изготовления таблеток.
Пример 13
Композиция для перорального введения
Ингредиенты смешивают, получая суспензию для перорального введения.
Пример 14
Композиция для парентерального введения (IV)
Активный ингредиент растворяют в части воды для инъекций. Затем при перемешивании добавляют достаточное количество хлорида натрия для того, чтобы сделать раствор изотоническим. Раствор доводят до необходимой массы, используя оставшуюся воду для инъекций, фильтруют через мембранный фильтр (0,2 микрон) и упаковывают в стерильных условиях.
Пример 15
Композиция для изготовления суппозиториев
Ингредиенты сплавляют и перемешивают на паровой бане, затем выливают в формы, по 2,5 г.
Пример 16
Композиция для местного использования
Все ингредиенты, за исключением воды, объединяют и нагревают при перемешивании до примерно 60°С. Затем при интенсивном перемешивании добавляют достаточное количество воды при температуре приблизительно 60°С, для того чтобы эмульгировать ингредиенты, после чего добавляют воду в количестве, достаточном для того, чтобы довести массу композиции до примерно 100 г.
Пример 17
Композиция для назального спрея
В качестве композиций для назального спрея было приготовлено несколько водных суспензий, содержащих приблизительно 0,025-0,5 процента активного соединения. Составы необязательно содержат неактивные ингредиенты, например, такие как микрокристаллическая целлюлоза, натриевая соль карбоксиметилцеллюлозы, декстроза и подобные им ингредиенты. Для регулировки величины рН может быть добавлена хлороводородная кислота. Композиции для назального спрея могут быть доставлены при использовании дозирующего насоса, обычно при доставке приблизительно 50-100 микролитров композиции за один впрыск. Обычный режим дозирования включает 2-4 введения распыленного средства каждые 4-12 часов.
Пример 18
Исследование связывания радиоактивного лиганда
Ингибирующую активность соединений согласно настоящему изобретению in vitro определяют с использованием модификации методики, описанной в статье: Hegde, S.S. et al., Br.J.Pharmacol, 1997, v.120, p.1409-1418.
Используют клеточные мембраны овариальных клеток китайских хомяков, экспрессирующие рекомбинантные мускариновые рецепторы человека (m1-m5). Исследование проводят с использованием радиоактивного лиганда [3H]N-метилскополамина (0,4 нМ, специфическая активность 84 Кюри·ммоль-1) в конечном объеме, равном 0,25 мл Трис-буфера Кребса. Неспецифическое связывание определяют, используя 1 мкМ атропина. Исследование проводят, используя методику близости сцинтилляций. Кривые конкурентного вытеснения строят для 10 концентраций исследуемых соединений и анализируют с использованием итерационных аппроксимаций кривой, заданной четырехпараметрическим логистическим уравнением. Значения pIC50 (отрицательный логарифм величины IC50) переводят в значения pKi, используя уравнение Ченга-Прусоффа.
Ингибирующая активность в отношении мускариновых рецепторов (выраженная как значение pKi) для некоторых соединений приведена ниже:
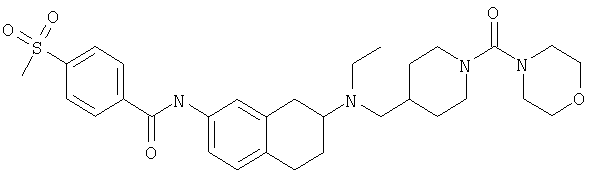
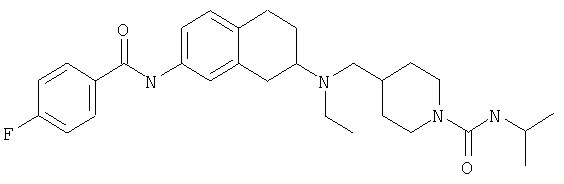
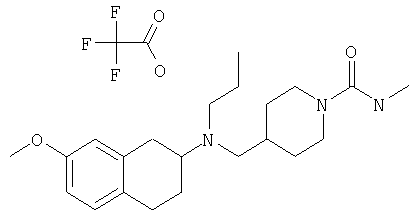
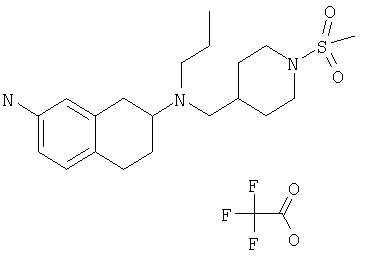
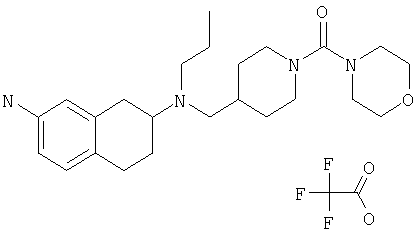
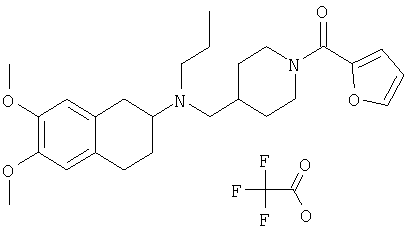
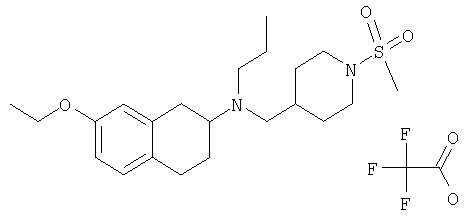
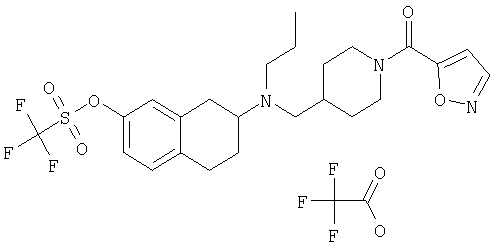
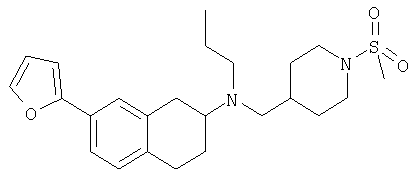
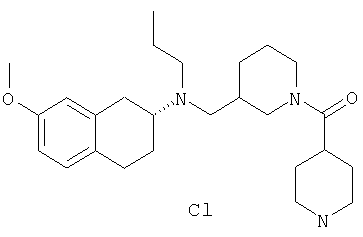
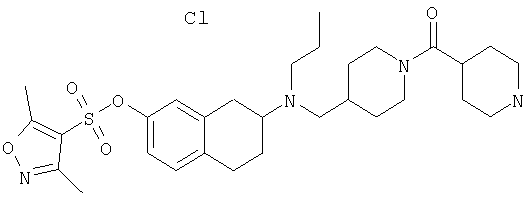
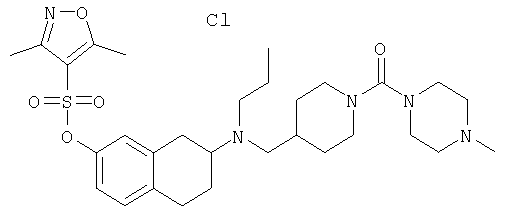
Пример 19
Модель оксотреморин/пилокарпин-индуцированного слюноотделения (OIS/PIS) у анестезированных крыс
Крыс-самок линии «Sprague-Dawley» («Charles-River», массой 200-300 г) подвергают анестезии уретаном (1,5 г/кг, подкожно) и трахеотомии. В одну бедренную вену вводят канюлю для введения лекарственного средства. После периода стабилизации продолжительностью 1 час крыс подвергают предварительной обработке метоктрамином (только для случая индуцирования оксотреморином (OIS)) для того, чтобы инициировать брадикардию, антагонистом которой является М2 рецептор. Каждому животному внутривенно вводят отмеренную разовую дозу наполнителя или указанного соединения. Через десять минут в рот животного помещают предварительно взвешенные прокладки из хлопка, после чего животному вводят дозированное количество наполнителя или оксотреморин (0,1 мг/кг, внутривенно)/пилокарпин (1 мг/кг, внутривенно). Через 5 минут после введения оксотреморина/пилокарпина помещают свежие прокладки из хлопка и собирают слюну дополнительно еще 5 минут. Прокладки из хлопка (после 5- и 10-минутного периода) после этого еще раз взвешивают, для того чтобы определить количество слюны, выделившейся за 10-минутный период.
Все получившие оксотреморин/пилокарпин группы оценивают сравнительно, используя однонаправленный анализ дисперсии. Попарные сравнения осуществляют с использованием критерия Даннетта (Dunnett). При анализе используют упорядоченные данные (непараметрическая методика) или данные в том виде, как они получены (параметрическая методика), при выборе используют критерий Бартлетта (Bartlett), который определяет однородность дисперсии. Группы наполнитель/оксотреморин и наполнитель/пилокарпин сравнивают с группой наполнитель/наполнитель, используя критерий суммы рангов Вилкокса (Wilcox). Определяют величину ID50 для каждого соединения по отношению к массе, соответствующей 10-минутной суммарной секреции для каждого животного. Сигмовидная модель имеет вид:
Resp=max+(max-min)/(1+(доза/ID50)**N),
где ID50 представляет собой дозу, необходимую для того, чтобы вызвать реакцию, величина которой соответствует половине максимальной реакции, N представляет собой параметр кривизны, а max означает максимальную реакцию на кривой зависимости величины реакции от дозы. Минимальная реакция зафиксирована на модели в момент 0.
По данным этого исследования соединения согласно настоящему изобретению обладают активностью.
Пример 20
Ингибирование индуцированного введенным объемом сокращения мочевого пузыря у крыс
Активность соединений согласно настоящему изобретению в отношении ингибирования мускаринового рецептора определяют на крысах с использованием модификации методики, описанной в: Hegde, S.S. et al., Proceedings of the 26th Annual Meeting of the International Continence Society, 1996 (August 27th - 30th), Abstract 126.
Крыс-самок линии «Sprague-Dawley» подвергают анестезии уретаном и подготавливают аппаратуру для внутривенного введения лекарственных средств и в некоторых случаях измерения артериального давления, сердечного ритма и внутрипредсердного давления. Воздействие тестируемых соединений на зависящую от введенного объема емкость мочевого пузыря определяют у отдельных групп животных. Индуцированное введенным объемом рефлекторное сокращение мочевого пузыря вызывают посредством наполнения мочевого пузыря физиологическим раствором. Исследуемые соединения вводят внутривенно кумулятивно с 10-минутными интервалами. Атропин (0,3 мг/кг, внутривенно) вводят в конце исследования в качестве положительного контроля.
По данным этого исследования соединения согласно изобретению обладают активностью.
Пример 21
Антимускариновая активность на модели у анестезированных собак
Активность соединений согласно настоящему изобретению в отношении ингибирования мускаринового рецептора определяют на собаках, используя модификацию методики, описанной в: Newgreen, D.T. et al., J.Urol, 1996, v.155 (Suppl.5), 1156.
Самок гончих (Marshall Farms, North Rose, NY) не кормят в течение 18 часов до начала эксперимента, воду предоставляют без ограничений. В день эксперимента собак подвергают анестезии и вводят пентобарбитал (36 мг/кг, внутривенно, первоначально, затем 5-10 мг/кг, внутривенно, для поддержания). До завершения эксперимента собакам также вводят внутривенно жидкости. Собак подвергают искусственной вентиляции через эндотрахеальную трубку с использованием респиратора «Harvard» (Модель 613). В обе бедренные вены и в одну бедренную артерию вводят канюлю для введения лекарственного средства и измерения давления крови соответственно. Кровяное давление измеряют, используя датчик «Gould» (модель P23XL) и записывают с использованием самописца «Gould» (модель 3400). Выполняют подъязычный надрез, для того чтобы открыть проток левой нижней челюсти, в который затем помещают канюлю для сбора слюны в предварительно взвешенные флаконы. Левую слюнную железу обнажают посредством поднижнечелюстного надреза. Хорда-лингвальный нерв изолируют и помещают на него биполярный электрод для стимуляции. Определяют исследуемую реакцию на стимуляцию хорда-лингвального нерва, для того чтобы подтвердить правильное расположение электрода.
После завершения хирургических операций инфузионно вводят физостигмин (180 мкг/кг/ч, внутривенно) (ингибитор холинэстеразы) до завершения эксперимента. После стабилизационного периода продолжительностью один час проводят две контрольных стимуляции хорда-лингвального нерва при 12 Гц, 10 В, продолжительностью 0,5 миллисекунд («Grass S48»). Хорда-лингвальный нерв стимулируют в течение 20 с и 2 мин соответственно с минимальным 10 минутным интервалом между каждым сеансом стимуляции. После того как были получены две последовательных контрольных реакции, дозированно вводят наполнитель или указанное соединение, кумулятивно, за 3 минуты перед каждым стимулированием хорда-лингвального нерва. Эксперименты, в которых не была получена постоянная реакция слюноотделения, не включают в последующий анализ. Атропин (1,0 мг/кг, внутривенно) используют в качестве внутривенного контроля в конце исследования.
Среднее значение артериального кровяного давления рассчитывают как (диастолическое артериальное давление)+(систолическое артериальное давление - диастолическое артериальное давление)/3. Сердечный ритм определяют по пульсу. Слюну собирают в предварительно взвешенные флаконы и взвешивают после каждого сбора для того, чтобы определить вес выделившейся слюны. Ингибирование реакции слюнных желез выражают как процент от эффекта атропина (1 мг/кг, внутривенно).
Оценка ED50
Для определения % максимального ингибирования слюноотделения проводят оценку параметров с использованием смешанной нелинейной модели. При реализации метода на старте используют подпрограмму PROC NLIN, а в итерациях - подпрограмму PROC MIXED. Эта методика предполагает справедливость следующей сигмовидной модели исследуемого процесса для соотношения доза - реакция:
где Реакция = % максимального ингибирования сокращения мочевого пузыря при максимальном воздействии, х=log10 дозы обработки, и 4 параметра представляют собой: log10 ED50 (μ), максимальную и минимальную реакцию (Мах и Min) и кривизну (σ). В качестве минимума берут 0%. Данный метод предполагает общую симметрию ковариационной структуры. Зависимость между результатами нескольких измерений для одного и того же животного вычисляют с использованием метода итерационных аппроксимаций кривой и этим же методом оценивают искомые параметры и границы их доверительных интервалов, таким образом, чтобы возможные ошибки находились в пределах соответствующего интервала.
Сравнение с базисными значениями
Для того чтобы сравнить реакцию на каждую дозу с базисным значением по каждой переменной, проводят двухфакторный дисперсионный анализ по главным эффектам (ANOVA), принимая во внимание пациента и лечение, с последующей проверкой для каждой дозировки парности по критерию Стьюдента. Если эффект суммарной обработки по данным дисперсионного анализа (ANOVA) не был значимым (р-значение >0,05), то для каждой дозировки используют скорректированные методом Бонферрони (Bonferroni) p-значения в качестве р-значений для проверки парности по критерию Стьюдента.
По данным этого исследования соединения согласно настоящему изобретению обладают активностью.
Пример 22
Исследование in vivo: антимускариновая активность при бронхоконстрикции
Оценивают антагонистическую активность в отношении индуцированной метахолином бронхоконстрикции и брахикардии на модели у анестезированных крыс в соответствии с методикой, описанной в статье: Hirose et al, J.Pharm. Exp.Ther., 2001, v.297, p.790-797. Соединения вводят внутривенно, перорально или посредством интратрахеального вливания до внутривенного введения метахолина. В качестве показателей бронхоконстрикции используют сопротивление легких и динамическую податливость.
Хотя в описании настоящего изобретения представлены различные конкретные варианты осуществления изобретения, специалисту в данной области техники будет понятно, что в соответствии с изобретательским замыслом и в пределах объема изобретения могут быть осуществлены различные изменения и использованы эквиваленты. В дополнение, могут быть выполнены различные модификации, для того чтобы адаптировать конкретную ситуацию, материал, композицию, способ, стадию или стадии способа в соответствии с целью, замыслом и объемом настоящего изобретения. Как предполагается, все такие модификации находятся в пределах объема изобретения, который определяется прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ 1-АМИНОАЛКИЛЛАКТАМЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2243222C2 |
| ПРОИЗВОДНЫЕ АМИНОТЕТРАЛИНА В КАЧЕСТВЕ АНТАГОНИСТОВ МУСКАРИНОВОГО РЕЦЕПТОРА | 2002 |
|
RU2311408C2 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОНАФТАЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2194696C2 |
| НОВЫЕ ФОСФАТНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2617682C2 |
| НОВЫЕ ИНДОЛИЗИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2013 |
|
RU2646223C2 |
| ПРОИЗВОДНЫЕ ИНДАЗОЛА КАК АНТАГОНИСТЫ КРФ | 2003 |
|
RU2341518C2 |
| СТИМУЛЯТОРЫ СЕКРЕЦИИ ГОРМОНА РОСТА | 1996 |
|
RU2172742C2 |
| ПРОИЗВОДНЫЕ 1-[М-КАРБОКСАМИДО(ГЕТЕРО)АРИЛ-МЕТИЛ]-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДА | 2013 |
|
RU2644761C2 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
| АМИНОПИРИДИНСОДЕРЖАЩИЕ ИНГИБИТОРЫ ТИРОЗИНКИНАЗЫ СЕЛЕЗЕНКИ (SYK) | 2012 |
|
RU2612217C2 |
Описываются новые соединения общей формулы (I), в которой р, R1, R2, R3 и А являются такими, как определено в описании, их индивидуальные изомеры и их фармацевтически приемлемые соли. Технический результат - соединения обладают антагонистическим действием в отношении мускариновых рецепторов, что позволяет их использовать при лечении и профилактике заболеваний, поддающихся лечению антагонистом мускаринового рецептора. Описываются также фармацевтическая композиция, содержащая эти соединения. 2 н. и 21 з.п. ф-лы.
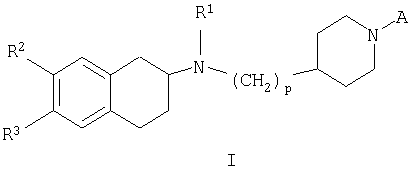
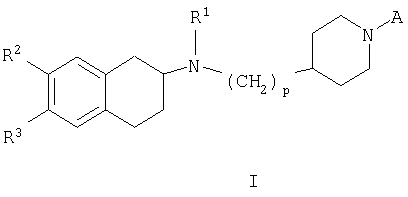
в которой
А представляет собой -C(O)R4 или -S(O)2R5;
R1 представляет собой (С1-С6)-алкил;
R2 и R3 независимо в каждом случае представляют собой водород, -OR', -NR'R", -NR'COR", -NR'"CONR'R", -NR'SO2R", -NR'"SO2NR'R", -OSO2R', гетероарил, представляющий собой пирролил, пиридинил, фуранил, где указанные группы гетероарила являются незамещенными, фенил, замещенный одной группой, выбранной из амино, (С1-С6)-алкилсульфонила;
при условии, что R2 и R3 оба не обозначают водород;
R', R" и R'" независимо в каждом случае представляют собой водород, (С1-С6)-алкил, галоген(С1-С6)-алкил, дифенилметил, нафтил, фенил, фенил-(С1-С6)-алкил, в последних двух группах фенильная группа является незамещенной или замещенной одной или двумя группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, галогена, галоген(С1-С6)-алкила, ди-(С1-С6)-алкиламино, (С1-С6)-алкилсульфонила и фенила; изоксазолил, замещенный одной или двумя группами (С1-С6)-алкила, или R' и R" вместе с атомом азота, к которому они присоединены, могут образовывать пирролидиновое кольцо;
R4 представляет собой (С1-С6)-алкил, бензилокси, дифенилметил, -NRaRb, где
Ra и Rb являются такими, как определено ниже,
-Y-гетероарил, где гетероарил представляет собой тиенил, фуранил, пиридинил, изоксазолил,
-Y-гетероциклил, где гетероциклил представляет собой морфолинил, пирролидинил, пиперазинил, пиперидинил,
где указанные группы гетероциклила или гетероарила являются независимо друг от друга незамещенными или замещенными одной или двумя группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкилсульфонила; и указанный Y представляет собой связь или (С1-С3)-алкилен;
Ra представляет собой водород, (С1-С6)-алкил, (С3-С10)-циклоалкил или фенил, незамещенный или замещенный галогеном,
Rb представляет собой водород или (С1-С6)-алкил;
R5 представляет собой (С1-С6)-алкил, галоген(С1-С6)-алкил, -NRaRb, где Ra и Rb являются такими, как определено выше, фенил, имидазолил, тиофенил, где каждый независимо друг от друга является незамещенным или замещенным одной группой, выбранной из (C1-С6)-алкила, галогена; и
р равно 1 или 2;
или их индивидуальные изомеры или их фармацевтически приемлемые соли.
А представляет собой -C(O)R4 или -S(O)2R5;
R1 представляет собой (С1-С6)-алкил;
R2 и R3 независимо в каждом случае представляют собой водород, -OR', -NR'R", -NR'COR", -NR'"CONR'R", -NR'SO2R", -NR'"SO2NR'R", -OSO2R', гетероарил, представляющий собой пирролил, пиридинил, фуранил, где указанные группы гетероарила являются незамещенными, фенил, замещенный одной группой, выбранной из амино, (С1-С6)-алкилсульфонила;
при условии, что R2 и R3 оба не обозначают водород;
R', R" и R'" независимо в каждом случае представляют собой водород,
(С1-С6)-алкил, галоген(С1-С6)-алкил, нафтил, фенил, фенил-(С1-С6)-алкил, в последних двух группах фенильная группа является незамещенной или замещенной одной или двумя группами, выбранными из (С1-С6)-алкила, (С1-С6)-алкокси, галоген(С1-С6)-алкокси, галогена, галоген(С1-С6)-алкила, ди-(С1-С6)-алкиламино, (С1-С6)-алкилсульфонила;
изоксазолил, замещенный одной или двумя группами (С1-С6)-алкила, или R' и R" вместе с атомом азота, к которому они присоединены, могут образовывать пирролидиновое кольцо;
R4 представляет собой (С1-С6)-алкил, бензилокси, дифенилметил, -NRaRb, где Ra и Rb являются такими, как определено ниже,
-Y-гетероарил, где гетероарил представляет собой тиенил, фуранил, пиридинил, изоксазолил,
-Y-гетероциклил, где гетероциклил представляет собой морфолинил, пирролидинил, пиперазинил, пиперидинил,
где указанные группы гетероциклила или гетероарила являются независимо друг от друга незамещенными или замещенными одной или двумя группами, выбранными из (С1-С6)-алкила (С1-С6)-алкилсульфонила; и
где Y представляет собой связь или (С1-С3)-алкилен;
Ra представляет собой (С1-С6)-алкил, (С3-С10)-циклоалкил или фенил, незамещенный или замещенный галогеном,
Rb представляет собой водород или (С1-С6)-алкил;
R5 представляет собой (С1-С6)-алкил, галоген(С1-С6)-алкил, -NRaRb, где Ra и Rb являются такими, как определено выше, фенил, имидазолил, тиофенил, где каждый независимо друг от друга является незамещенным или замещенным одной группой, выбранной из (C1-С6)-алкила, галогена; и
р означает целое число от 1 до 2;
или индивидуальные изомеры или их фармацевтически приемлемые соли.
(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)пиперидин-4-илметанон;
(1-метансульфонилпиперидин-4-илметил)-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин;
диметиламид 4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-,2-ил)пропиламино]метил}пиперидин-1-карбоновой кислоты;
(4-{[(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон;
(1-метансульфонилпиперидин-4-илметил)-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламин; и
(4-{[(6,7-диметокси-1,2,3,4-тетрагидронафталин-2-ил)пропиламино]метил}пиперидин-1-ил)морфолин-4-илметанон.
| WO 9943657, 02.09.1999 | |||
| 0 |
|
SU190082A1 | |
| Форматор-вулканизатор для покрышек пневматических шин | 1972 |
|
SU447292A1 |
Авторы
Даты
2007-06-10—Публикация
2002-11-25—Подача