Изобретение относится к новым вакцинам против инфекционного заболевания сумки (ИЗС) и новым ослабленным вирусным штаммам инфекционного заболевания сумки.
Инфекционное заболевание сумки у домашней птицы называется вирусом, который относится к группе вирусов BIRNA. Эти вирусы относительно устойчивы при низком pH, в эфире и хлороформе. Они содержат два фермента двуцепочечной РНК, которые кодируют свои вирусные белки.
Известны два серотипа, серотип I, который вызывает ИЗС у цыплят, и серотип II, выделенный из индейки, непатогенный для цыплят. Материнские антитела одного серотипа не защищают против другого серотипа. Гомологические антитела, одного, все же защищают цыплят от болезни.
Инфекционное заболевание сумки широко распространено и приводит к большим экономическим потерям. Пораженные болезнью цыплята страдают поносом, мышечным кровотечением, омертвлением сумки Фабрициуса и тяжелыми нарушениями иммунной системы. Смертность высока, а у выживших птенцов наблюдается замедление роста и высокая чувствительность к другим заболеваниям.
На протяжении ряда лет разработано несколько живых ослабленных вакцин. Например, пат.США N 3584055 раскрывает вакцину, эффективную против ИЗС, содержащую ослабленный ИЗС-вирус, полученный многократными пассажами. Пат. США N 3769400 раскрывает вакцину, эффективную против ИЗС у домашней птицы при однократном введении птицам в возрасте, обычном для вакцинации, которая включает ИЗС-вирус, депонированный как АТСС VR - 2041. Вакцина непатогенна и может разрушаться при обычном уровне полученных с матерью антител без повреждения сумки птиц с материнским иммунитетом, и поэтому может использоваться для придания иммунитета домашней птице. Вакцину получают путем 4-стадийной plaque очистки с последующими пассажами на двух куриных эмбрионах. Пат. США N 4824668 раскрывает вакцину, эффективную против ИЗС у домашней птицы, включающую ослабленный или инактивированный ИЗС вирусный штамм VR2161 и носитель или разбавитель, и которая может быть введена домашней птице без получения ИЗС-симптомов у вакцинированных птиц. Такие вакцины обычно вводят с питьевой водой, и до 1988 г. они обеспечивали хороший иммунитет. Заявка РСТ/WO 9001336 раскрывает вакцину для профилактики ИЗС у домашней птицы, вызываемого штаммами, нечувствительными к вакцинам, известным в настоящее время (очевидно, "неклассические" штаммы), содержащую убитый или ослабленный новый очищенный ИЗС-вирус, описанный в ней.
В 1988 г., впервые в Англии и Голландии, а впоследствии в других частях мира, появился новый штамм, который был очень патогенен и вызывал значительно более высокую смертность, чем смертность, вызываемая "старыми" штаммами. Существующие живые ослабленные вакцины больше не защищали против нового штамма. Установлено, что новый штамм, изолированный в Европе, не является антигенно отличным от старого, так называемого "классического" штамма. С другой стороны, в США изолировали "вариантные" штаммы, которые отличались от "классических" штаммов при испытании с моноклональными антителами испытываемых систем. Испытывали израильские изоляты, которые являются предметом данного изобретения, и нашли, что они подобны европейским штаммам.
Неэффективность старых вакцин для защиты против новых штаммов обусловлена, между прочим, более высокой патогенностью новых штаммов, способных проникать через материнские антитела, переходя от кур-производителей к цыплятам. После вакцинации вновь выведенных цыплят. Старые вирусы, введенные таким образом, инактивируются такими материнскими антителами. Титр материнского антитела уменьшается после выведения наполовину через примерно 5 дней. Если вакцинацию откладывают на возраст, при котором нельзя определить материнские антитела, то цыплята подвергаются очень большому риску: они могут быть заражены патогенным полевым штаммом до того, как будут иммунизированы с помощью вакцинного штамма. Поэтому полагают, что вакцинный штамм должен иметь некоторую патогенность, такую, чтобы он мог быть разрушен материнскими антителами прежде, чем начнут действовать полевые штаммы, а именно он должен иметь промежуточную вирулентность.
Недавно, Н. I. Tsai и I.M. Saif [Avian Disiases 36 : 415-422 (1992)] описали два вариантных штамма ИЗС (IN и E), которые адаптированы и перепривиты на определенную линию клеток почки зеленой обезьяны (BGM-70). Пересев на клеточную культуру приводит к потере патогенности, в то время как антигенность и иммуногенность сохраняются. Однако никакой защиты против болезни не возникает, когда пассированные вирусы дают свободным от конкретного патогена (СКП) цыплятам в качестве живых вакцин. В противоположность этому, настоящее изобретение относится к вирусам, которые, будучи пассированы, теряют некоторую часть своей патогенности, но сохраняют антигенность и все же обеспечивают иммунитет домашней птицы.
Таким образом, первый объект изобретения предлагает вакцину для профилактики инфекционного заболевания сумки у цыплят, содержащую эффективное иммунизирующее количество одного из живых аттенуированных промежуточно-вирулентных вирусов инфекционного заболевания сумки: ЕСАСС No. V92052301 (МВ), или ЕСАСС No. V92100106 (МВ-2) или ЕСАСС No.V92102209 (МВ-1).
Другой объект изобретения касается лиофилизированной вирусной композиции для тех же целей.
Еще одним объектом изобретения является способ защиты цыплят от инфекционного заболевания сумки, предусматривающий введение цыплятам эффективного иммунизирующего количества вакцины по п.1 или вирусной композиции по п.5.
И еще одним объектом изобретения является способ получения живой вакцины для защиты цыплят от инфекционного заболевания сумки, предусматривающий культивирование вируса инфекционного заболевания сумки в инкубируемых эмбрионированных куриных яйцах, или в фибробластах эмбрионов цыплят (ФЭЦ), или в клеточной линии vero, сборку вирусного материала, полученного при культивировании, стабилизацию собранного материала и его лиофилизацию, причем штамм вируса инфекционного заболевания сумки выбирают из штаммов, депонированных в ЕСАСС под NN V92052301 (МВ), V92100106 (МВ-2) и V92102209 (MB-1).
Как установлено выше, вакцинация домашней птицы должна осуществляться в раннем возрасте, до исчезновения материнских антител, чтобы не подвергать высокому риску цыплят быть зараженными патогенными полевыми штаммами. Поэтому полагают, что патентный вакцинный штамм должен сохранять некоторую патогенность, такую чтобы он мог бы проникнуть через материнские антитела. Три новых штамма изобретения, МВ, МВ-2 и МВ-1, обладают этой требуемой характеристикой, являясь промежуточно патогенными, тем самым разрушая материнский иммунитет, но не настолько вирулентными, чтобы вызвать заболевание. При испытании на СКП цыплятах, свободных от ИЗС-антител, штамм MB-1 несколько менее патогенен, чем штамм МВ, и штамм МВ-2 еще менее патогенен. Все три штамма обеспечивают хороший иммунитет при введении его с питьевой водой, даже в раннем возрасте 1 - 2 недели, и непатогенны для бройлерных цыплят с материнским иммунитетом или при замене производителя и цыплят-несушек. Однако все же имеет место некоторая степень атрофии сумки после вакцинации.
Исходные штаммы изолируют из сумок Фабрициуса бройлерных цыплят, которые умерли от ИЗС на двух фермах центральной части Израиля в течение 1989 г. Этот вирус можно вырастить в куриных яйцах с развивающимся эмбрионом, а также на культурах клеток, таких как тканевая культура фибробласта эмбриона цыпленка (ФЭЦ), культуры линии vero и другие подходящие культуры. Клетки выращивают до 80% слияния во вращающихся бутылках, сосудах, на микроносителях или другими методами выращивания тканевых культур. Через 3 - 4 дня после заражения наблюдают цитопатическое действие (ЦПД), и вирус собирают путем охлаждения и оттаивания с последующим низкоскоростным центрифугированием. К супернатанту добавляют стабилизаторы для проведения сушки замораживанием. Ослабление и размножение вируса будет детально описано в последующих примерах.
Получение вакцин и их применение также находится в поле зрения этого изобретения. Яйца с развивающимися эмбрионами инокулируют, эмбрионы и мембраны собирают, и получают живую вакцину из гомогената, содержащего их, с добавлением стабилизатора, обычно используемого в живых птичьих вакцинах, такого как пептон, лактоза, сухое порошковое молоко и т.д.
Используют дозу, как для живой вакцины, в диапазоне 102 - 104 ДИЯ50 (ДИЯ50 = доза, инфицирующая 50% яиц).
Живая вакцина согласно изобретению может содержать один из указанных вирусных штаммов, или смесь любых двух указанных штаммов, или смесь всех указанных вирусных штаммов.
Любая из живых вакцин изобретения может также содержать другие вирусы, например, Ньюкаслской болезни или болезни Марека или инфекционного бронхита.
Вакцину вводят цыплятам с помощью известных подходящих инокуляционных способов, например с питьевой водой, путем введения в глаз в виде глазных капель, путем распыления аэрозоля или других способов распыления, путем назального введения в виде капель для носа или с помощью любых других подходящих известных путей вакцинации.
Цыплята, вакцинированные живой вакциной, содержащей МВ, МВ-2 или МВ-1 вирусы, вырабатывают преципитирующие антитела и тип специфических нейтрализующих антител, и они иммунны к последующему заражению Израильским вирулентным ИЗС вирусным штаммом, а также к заражению Европейским штаммом. Таким образом, вакцины данного изобретения, по-видимому, обеспечивают универсальный иммунитет против ИЗС.
Пример 1
Ослабление штамма
Исходный штамм изолируют из сумок Фабрициуса бройлерных цыплят, которые погибли от ИЗС на двух фермах центральной части Израиля на протяжении 1989 г. Сумки измельчают, центрифугируют и фильтруют через 0,2 мкм фильтр Millipore. Фильтраты вводят в аллантоидную полость СКП куриных яиц с 11-дневными развивающимися эмбрионами. После инкубации в течение 72 - 96 часов эмбрионы и мембраны собирают, гомогенизируют и вновь вводят серийно в СКП яйца цыплят с развивающимися эмбрионами для ослабления.
Штамм МВ ( ЕСАСС N V92052301) пассируют 43 раза, штамм MB-1 (ECFCC N V92102209) пассируют 94 раза и штамм МВ-2 (ЕСАСС N V92100106, выделенный на другой ферме, пассируют 71 раз. Эти пассированные штаммы лиофилизуют и они служат в качестве рабочих пасевов.
Пример 2
Вакцинация бройлерных цыплят с материнским иммунитетом (МИ) МВ-вакциной
Бройлерных цыплят (по 15 в группе) подвергают вакцинации в различном возрасте: однократной вакцинации в возрасте 2, 7, или 14 дней, или двукратной вакцинации в возрасте 2 и 14 дней (табл. 1). Цыплята находились в изолированных помещениях на протяжении всего эксперимента. Вакцинацию проводили через питьевую воду с 103,35 ДИЯ50 МВ вируса на дозу. Материнские антитела на 2, 7 и 12 день после выведения составляли 11/11, 6/10 и 2/10 соответственно (N АГП положительный/ N испытываемой серии; АГП = агар гель преципитин). Эффективность оценивали на 28 день двумя способами:
(а) Серологический ответ: преципитирующие антитела (АГП) или ферментный иммуносорбентный тест (ELISA). Установлена хорошая корреляция между этими системами.
(в) Защита против контрольного заражения: птиц подвергают контрольному заражению в возрасте 28 дней израильским вирулентным ИЗС вирусным штаммом - 105 ДИЯ50 на цыпленка внутриглазным путем. Осуществляют также заражение Weybridge 52/70 штаммом. Через три дня птиц забивают, и их сумки Фабрициуса исследуют на присутствие ИЗС-вируса при помощи АГП. Иммунизированные птицы должны быть отрицательными, в то время как восприимчивые к болезни птицы должны быть положительными. Идентичные результаты получают для контрольных заражений вирулентным израильским штаммом ИЗС-вируса Weybridge 52/70 штаммом. Таким образом, вакцины данного изобретения обеспечивают иммунитет как против израильского, так и европейского штаммов.
Рассчитывают отношение сумка/вес тела, и сумки подвергают испытанию на гистопатологическое повреждение. Все группы подвергают также вакцинации живой коммерческой вакциной из лентогенных вирусов при Newcastll болезни (ПЭ-пневмоэнцефилит) в возрасте 14 дней.
Из результатов, представленных в табл. 1, можно видеть, что цыплята являются защищенными при вакцинации вакциной с МВ штаммом в возрасте 7 дней и старше.
В возрасте 7 дней около половины птиц отвечают серологически и все из них являются защищенными против контрольного заражения. В возрасте 14 дней все птицы являются иммунными, как видно серологически и по устойчивости к контрольному заражению. Не наблюдается защиты, когда вакцинация осуществляется в 2 дневном возрасте. Отношение сумка/вес через 3 дня после экспозиции вирулентным вирусом составляет около 0,25% для незащищенной группы (контроли и вакцинированные на 2 день) и 0,07% для защищенных групп (2 + 14, 7 и 14 дни). Эти цифры указывают на то, что вирус проникает через материнские антитела и ввызывают атрофию сумки. Гистопатологическое исследование обнаруживает умеренную лимфопению. Ответ на ПЭВ-вакцинацию в группах, вакцинированных против ИЗС, анологичен ответу контрольной группы. Вес тела у птиц, вакцинированных против ИЗС, в конце эксперимента статистически не отличался от веса контрольной группы.
Пример 3
Оральная или аэрозольная вакцинация бройлерных цыплят с МИ МВ и МВ-1 вакциной
Бройлерные цыплята, помещенные в изоляторы на 1 день, были подвержены вакцинации либо в 12-дневном возрасте (группы 1 и 2, МВ или МВ-1 вакцины), либо в 1 + 12 дневном возрасте (группы 3 и 5, МВ вакцина) дозой 103,65 ДИЯ50. Птицы были вакцинированы живой ПЭВ-вакциной (VH штамм) в возрасте 1 + 18 дней глазным путем (группы 1 - 4) или в возрасте 1 + 12 дней аэрозольным путем (группы 5 - 6). В группе 5 осуществлена комбинированная аэрозольная вакцинация ИЗСВ (МВ) и ПЭВ (VH). Птиц обескровливали, подвергали контрольному заражению в возрасте 29 дней и забивали через 3 дня. На 1 день 10/10 птиц имели ИЗС-антитела, полученные с матерью. Результаты приведены в табл. 2.
МВ и МВ-1 вакцины обеспечивают превосходную защиту против контрольного заражения и небольшой серологический ответ при введении с помощью питьевой воды или с помощью аэрозоля. Из этого и из предыдущего примера видно, что одна вакцинация в возрасте 12 - 13 дней иммунизирует так же, как две вакцинации в возрасте 1 и 12 - 14 дней.
Не наблюдалось вредного воздействия на вес тела или ПЭВ-титр, даже если наблюдалась некоторая степень атрофии сумки.
Кроме того, можно сделать вывод, что возможна одновременная вакцинация МВ штаммом Gumboro и New Castll вакциной, приводящая к аналогичным результатам в сравнении с раздельными вакцинациями. Эта комбинированная вакцинация производится с помощью распираторной системы, использующей аэрозольную технику, которая рекомендуется для ПЭВ-вакцинации. Кроме того, показано, что аэрозольная вакцинация является хорошим путем для массовой вакцинации МВ вакциной.
Пример 4
Сравнение МВ штамма с ослабленным Winterfield штаммом
Бройлерных цыплят в 14 дневном возрасте подвергают вакцинации глазным путем МВ штаммом (103,75 ДИЯ50 на птицу) или Winberfield штаммом (104,28 ДИЯ50 на птицу). Штамм представляет собой ослабленный штамм, который не защищает птиц против существующих более патогенных вирусов. Две контрольные группы не подвергались вакцинации ИБСВ. Три группы были подвергнуты вакцинации на 1 день и 17 день. В возрасте 31 день все птицы были обескровлены и подвергнуты контрольному заражению. Результаты представлены в табл. 3.
Из табл. 3 можно видеть, что: (а) Winterfield штамм не защищает против контрольного заражения, не продуцирует анти-ИЕС антитела; (в) МВ штамм обеспечивает высокую защиту и высокий уровень антител; и (с) МВ штамм не имеет вредного воздействия на титр ПЭВ-антител.
Пример 5
Вакцинация цыплят МВ и МВ-2 вакцинами, использующая различные дозы
Вакцинацию производят в изолированных помещениях (одно помещение на экспериментальную группу) при помощи глазных капель в возрасте 7 и 12 дней. Испытывают различные дозы в диапазоне от 101,0 до 103,35 ДИЯ50. В этом примере коммерческих МИ бройлерных цыплят, а также СКП цыплят подвергают вакцинации, и результаты суммируют в табл. 4 и 5 соответственно. В возрасте 21 день (9 или 14 дней после вакцинации) птиц обескровливают и подвергают контрольному заражению. Спустя 4 дня птиц забивают, их сумки испытывают, их сумки испытывают на ИБС-антиген и рассчитывают отношение сумка/вес тела.
Антиген обнаружен у 3 выживших организмов. Смерть не имела места после контрольного заражения в какой-либо из вакцинированных групп.
Можно видеть (табл. 4, 5), что МВ и МВ-2 вакцины обеспечивают превосходную защиту от контрольного заражения еще 9 дней после вакцинации и хороший серологический ответ, даже уже при дозе 101 ДИЯ50.
МВ-2 является менее патогенной, чем МВ (смотри поствакцинацию на СКП цыплятах табл. 5), и она вызывает несколько более слабый серологический ответ.
Пример 6
Вакцинация СКП-цыплят однодневного возраста МВ, МВ-1 и МВ-2 штаммами
СКП-цыплят однодневного возраста подвергают вакцинации в изолированных помещениях с помощью глазных капель, 103,35 ДИЯ50 на дозу. На 7 день после вакцинации часть каждой группы забивают, и рассчитывают отношение сумка/вес тела. В возрасте 21 день оставшихся цыплят подвергают контрольному заражению, и эта методика аналогична методике, описанной в примере 5.
Из табл. 6 можно видеть, что степень патогенности для однодневных по возрасту СКП-цыплят (измеренной посредством показателя смертности) выше для МВ, ниже для МВ-1 и ноль для МВ-2. Защита против контрольного заражения очень хорошая для всех штаммов.
Пример 7
Идентификация МВ и МВ-2 вирусных белков
А. Получение вирусных белков для анализа
Цыплят выращивают в изоляции вплоть до 4-недельного возраста, делят на группы и идентифицируют следующим образом.
Группу 1 заражают диким типом патогенного вируса, выделенного в Израиле.
Группу 2 заражают другим изолятом ИЗСВ, из которой МВ штамм данного изобретения разрабатывают путем пассирования на куриных эмбрионах.
Группу 3 заражают МВ штаммом (Депозит. N ЕСАСС V92052301).
Группу 4 заражают дополнительным изолятом ИЗСВ, из которого МВ-2 (депозит. N92100106) разрабатывают путем пассирования на куриных эмбрионах.
Группу 5 заражают МВ-2 штаммом (Депозит. NЕСАСС V102209).
Через 3 дня после заражения цыплят забирают и их сумки Фабрициуса гомогенизируют, замораживают и оттаивают. Вирусные частицы каждой группы связывают от 40 до 60% сахарозой в ультрацентрифуге.
В.Вестерн блот-анализ
После НДС-обработки белки отделяют с помощью НДС-ПАГЭ (электрофорез в полиакриламидном геле (ПАГЭ) в присутствии додецилсульфата натрия (НДС) в течение 14 часов при 9 ваттах. Половину каждого геля окрашивают синим Кумасси и половину переносят на hybond -С фильтры для реакции с СКП отрицательной сывороткой (гель А) или с сывороткой выздоравливающего цыпленка (гель В). Гели взаимодействуют с сывороткой кролик - антицыпленок и пероксидазой.
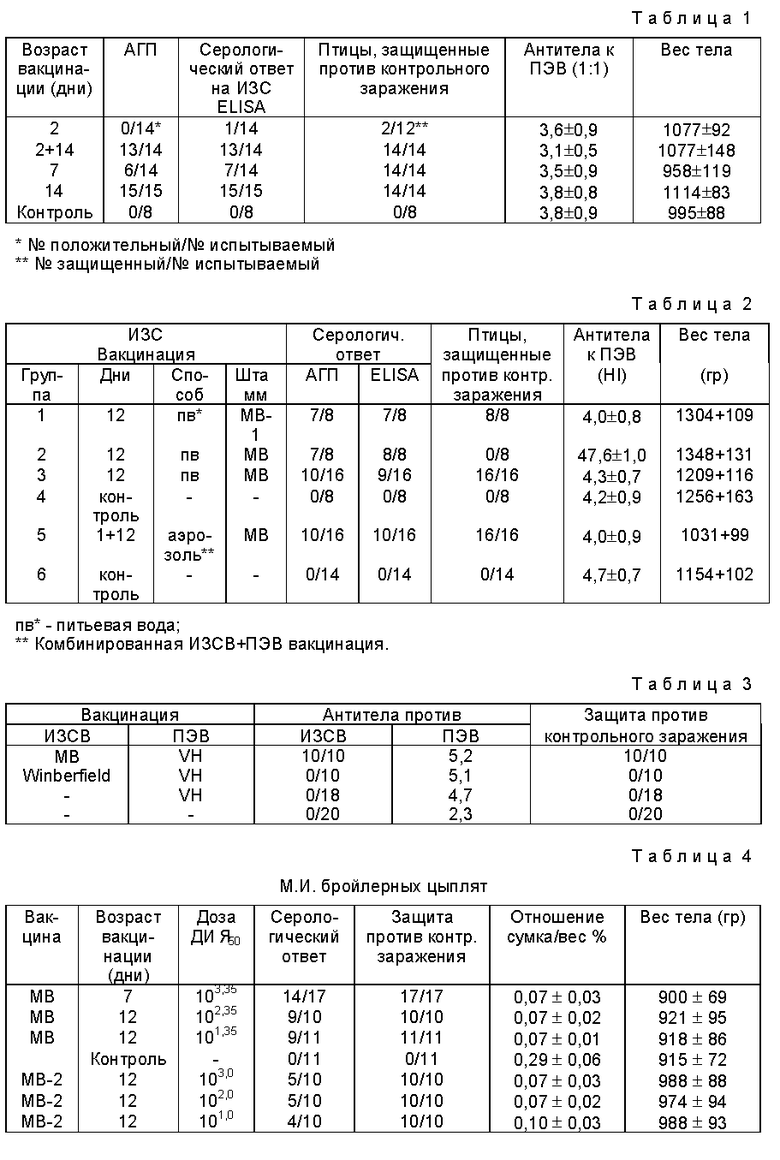
Чертеж является иллюстративным примером такого эксперимента. Полосы 1 - 5 в каждом геле соответствуют Группам 1 - 5, детализированным выше. Vp=вирусный белок.
Из чертежа можно видеть, что конвальесцентная сыворотка (гель В) взаимодействует с ВБ2 и ВБ3 вируса ИЗС, в то время как СКП отрицательная сыворотка не взаимодействует с этими вирусными белками (гель А).
Кроме того, можно видеть, что:
а) ВБ2 МВ и его штамм-оригинатор - полосы 2 и 3 - отличается размером от штамма дикого типа (полоса 1).
в) ВБ2 ослабленного МВ-2 штамма (полоса 5) взаимодействует с конвалесцентной сывороткой менее интенсивно, чем ВБ2 его штамма-оригинатора (полоса 4).
Его положение на геле сходно с ВБ2 всех других вирусов, за исключением ВБ2 МВ и МВ оригинатора.
Представляется важным выяснить, что МВ-2 четко отличается от его штамма-оригинатора и что МВ отличается от большинства других вирусов ИЗС, выделенных в Израиле.
Пример 8
Отсутствие возвращения к исходному вирулентному состоянию
Цель этого примера состоит в том, чтобы показать, что степень остаточной патогенности МВ штамма не изменяется во время пассажей вируса от птицы к птице. 15 СКП-цыплят вакцинируют в возрасте 1 день МВ вирусом (103,65 ДИЯ50 на цыпленка). Через 3 дня пять цыплят забивают и их сумки используют для заражения второй группы цыплят в возрасте 1 день. Через 7 дней после каждого заражения вирулентность вируса измеряют путем:
а) отношения сумка/вес тела; и
в) гистопатологического изучения сумки.
Проводят пять таких успешных пассажей от птицы к птице. При каждом пассаже контрольную группу заражают МВ штаммом и проводят сравнение между патогенностью вируса, перепривитого птице, и патогенностью МВ зараженных инокулятов. В табл. 7 патогенность первого МВ заражения, выраженная двумя индексами, т.е. отношением сумка/вес тела и гистопатологической бальной оценкой, произвольно обозначают 1,00 и называют "индексом патогенности".
Из табл. 7 можно заключить, что патогенность МВ штамма не увеличивается во время пяти от птицы к птице пассажей.
Изобретение касается новых вакцин против инфекционного заболевания сумки (ИЗС) цыплят, изготавливаемых на основе новых ослабленных вирусных штаммов, депонированных в ЕСАСС. Три новых штамма изобретения, МБ, МВ-2 и МВ-1 являются промежуточно-патогенными, но не настолько вирулентными, чтобы вызвать заболевание. Вакцину получают следующим образом: яйца с развивающимися эмбрионами инокулируют, эмбрионы и мембраны собирают и получают живую вакцину из гомогената, содержащего их, с добавлением стабилизатора. Используют дозу в диапазоне 102-104 ДИЯ50. Живая вакцина может содержать один из вирусных штаммов, или смесь любых двух указанных штаммов, или смесь всех указанных вирусных штаммов. Цыплята, вакцинированные живой вакциной, вырабатывают преципитирующие антитела и тип специфических нейтрализующих антител, иммунны к последующему заражению Израильским вирулентным ИЗС, а также к заражению Европейским штаммом. Вакцина обеспечивает универсальный иммунитет против ИЗС. 4 c. и 13 з.п. ф-лы, 1 ил., 7 табл.
| US 005397568 A, 25.02.93 | |||
| US 005397569 A, 25.01.93 | |||
| US 005518724 A, 15.09.92 | |||
| US 5064646, 02.08.88 | |||
| US 005192539 A, 11.05.89.EP 0352835 A1, 31.01.90. |
Авторы
Даты
1999-02-20—Публикация
1993-11-30—Подача